Note: Descriptions are shown in the official language in which they were submitted.
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
1
SOURCES D'ELECTRONEBULISATION PLANAIRES SUR LE MODELE
D'UNE PLUME DE CALLIGRAPHIE ET LEUR FABRICATION
DESCRIPTION
DOMAINE TECHNIQUE
La présente invention concerne des sources
d'électronébulisation originales, leur procédé de
fabrication et leurs applications.
ETAT DE LA TECHNIQUE ANTERIEURE
L'électronébulisation est le phénomène qui
transforme un liquide en un nébulisat sous l'action
d'une haute tension (M. CLOUPEAU "Electrohydrodynamic
spraying functioning modes: a critical review. Journal
of Aerosol Science (1994), 25(6), 1021-1036"). Pour ce
faire, le liquide est amené dans un capillaire et est
soumis à une haute tension continue ou alternative ou à
une superposition des deux (Z. HUNEITI et al., "The
study of AC coupled DC fields on conducting liquid
jets", Journal of Electrostatics (1997), 40 & 41 97-
102). En sortie de capillaire, le liquide est nébulisé
sous l'action de la tension. La surface du ménisque
formé par le liquide est allongée pour former un ou des
cônes de Taylor d'où sont éjectées des gouttelettes de
liquide chargées qui évoluent pour donner un gaz
contenant des particules chargées. La formation du
nébulisat est observée lorsque les forces électriques
dues à l'application de la tension compensent et
dépassent les forces de tension de surface du liquide
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
2
sur la section du capillaire en l'extrémité dudit
capillaire.
La taille du capillaire, et plus
précisément son orifice de sortie, est en relation
directe avec le débit de liquide sortant du capillaire
et la tension à appliquer pour observer le phénomène de
nébulisation. il existe deux régimes distincts
d'électronébulisation qui se distinguent de par leurs
caractéristiques d'établissement :
= le régime dit classique qui correspond à.
des tailles de sortie de capillaire de 100 }gym, des
débits de fluide dans la gamme de 1-20 pL/min et des
hautes tensions de 3-4 kV ;
= le régime dit de nanoélectronébulisation
où les débits de liquide sont inférieurs à 1 pL/min, la
haute tension d'environ 1 kV et les diamètre internes
des capillaires de 1-10 pm (M. WILM et al, "Analytical
Properties of the Nanoelectrospray Ion Source",
Analytical Chemistry (1996), 68(1), 1-8.).
L'application d'une tension comportant une
composante alternative permet la stabilisation du
processus d'électronébulisation par synchronisation sur
sa fréquence propre (F. CHARBONNIER et al.,
"Differentiating between Capillary and Counter
Electrode Processes during Electrospray Ionization by
Opening the Short Circuit at the Collector. Analytical
Chemistry (1999), 71(8), 1585-1591). La composition
chimique des gouttes produites par ale phénomène
d'électronébulisation peut être améliorée en vue de ses
applications par l'application de tensions multiples et
indépendantes qui permettent la modification chimique
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
3
des espèces présentes dans le liquide par électrochimie
(voir la demande de brevet US 2003/0015656; G. J. VAN
BERKEL, "Enhanced Study and Control of Analyte
Oxidation in Electrospray Using a Thin-Channel, Planar
Electrode Emitter", Analytical Chemistry (2002),
74(19), 5047-5056; G.J. VAN BERKEL et al.,
"Derivatization for electrospray ionization mass
spectrometry. 3. Electrochemically ionizable
derivatives", Analytical Chemistry (1998), 70(8), 1544-
1554; F. ZHOU et al. "Electrochemistry Combined Online
with Electrospray Mass Spectrometry", Analytical
Chemistry (1995), 67(20), 3643-3649).
Les domaines d'applications de
l'électronébulisation sont les suivants :
= En premier lieu, l'ionisation de
molécules (M. DOLE et al., "Molecular beams of
macroions", Journal of Chemical Physics (1968), 49(5),
2240-2249 ; L. L. MACK et al., "Molecular beams of
macroions. II", Journal of Chemical Physics (1970),
52(10), 4977-4986 ; le brevet US 4 209 696; M.
YAMASHITA et al., "Electrospray ion source. Another
variation on the free-jet theme", Journal of Physical
Chemistry (1984), 88(20), 4451-4459 ; M. YAMASHITA et
al., "Negative ion production with the electrospray ion
source", Journal of Physical Chemistry (1984), 88(20),
4671-4675) avant leur analyse par spectrométrie de
masse en fonction du rapport m/z où m est la masse de
l'analyte et z sa charge. Dans ce cas, le débit de
liquide est .continu.
= Une deuxième application des dispositifs
d'électronébulisation est la production de gouttes de
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
4
taille calibrée. De telles gouttes peuvent être
déposées sur un support (C. J. McNEAL et al., "Thin
film deposition by the electrospray method for
californium-252 plasma desorption studies of involatile
molecules", Analytical Chemistry (1979), 51(12), 2036-
2039 ; R. C. MURPHY et al., "Electrospray loading of
field desorption emitters and desorption chemical
ionization probes", Analytical Chemistry (1982), 54(2),
336-338) par exemple une plaque pour, soit la
production de puces d'analyse comme les puces à ADN ou
à peptides, dédiées à une analyse à haut débit (V. N.
MOROZOV et al., "Electrospray Deposition as a Method
for Mass Fabrication of Mono- and Multicomponent
Microarrays of Biological and Biologically Active
Substances", Analytical Chemistry (1999), 71(15), 3110-
3117; R. MOERMAN et al., "Miniaturized electrospraying
as a technique for the production of microarrays of
reproducible micrometer-sized protein spots",
Analytical Chemistry (2001 May 15), 73(10), 2183-2189 ;
N. V. AVSEENKO et al., "Immunoassay with Multicomponent
Protein Microarrays Fabricated by Electrospray
Deposition", Analytical Chemistry (2002), 74(5), 927-
933), soit le dépôt de solutions sur une plaque MALDI
(pour "Matrix Assisted Laser Desorption Ionization")
avant une analyse par spectrométrie de masse P.
AXELSSON et al., "Improved reproducibility and
increased signal intensity in matrix-assisted laser
desorption/ionization as a result of electrospray
sample preparation", Rapid Communications in Mass
Spectrometry (1997), 11(2), 209-213). Ces gouttes
peuvent aussi être manipulées, soit pour l'injection de
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
liquide dans une balance hydrodynamique pour la
manipulation de gouttes uniques (M. J. BOGAN et al.,
"MALDI-TOF-MS analysis of droplets prepared in an
electrodynamic balance: "wall-less" sample
5 préparation", Analytical Chemistry (2002), 74(3), 489-
496), soit pour leur collecte pour conduire à des
molécules encapsulées ou présentant un état cristallin
métastable (I. G. LOSCERTALES et al., "Micro/nano
encapsulation via electrified coaxial liquid jets",
Science (Washington, DC, United States) (2002),
295(5560), 1695-1698). Ici, l'éjection a lieu de
manière discrète les dimensions des sources dépendent
grandement de la taille des dépôts à réaliser.
= Une troisième application est le dépôt
de particules de taille contrôlée contenues au sein du
liquide (I. W. LENGGORO et al., "Sizing of Colloidal
Nanoparticles by Electrospray and Differential Mobility
Analyzer Methods", Langmuir (2002), 18(12), 4584-4591).
Les particules peuvent également être remplacées pas
des cellules pour la préparation de puces à cellules.
= Une quatrième application est
l'injection des gouttes formées par électronébulisation
dans un liquide conduisant à des émulsions de taille
bien définies (R. J. PFEIFER et al., "Charge-to-mass
relation for electrohydrodynamically sprayed liquid
droplets", Physics of Fluids (1958-1988) (1967),
10(10), 2149-54; C. TSOURIS et al., "Expérimental
Investigation of Electrostatic Dispersion of
Nonconductive Fluids into Conductive Fluids",
Industrial & Engineering Chemistry Research (1995),
34(4), 1394-1403 ; R. HENGELMOLEN et al., "Emulsions
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
6
from aérosol sprays", Journal of Colloid and Interface
Science (1997), 196(1), 12-22).
= Une cinquième application est l'écriture
moléculaire sur une plaque à l'aide de molécules ou de
solutions chimiques (S. N. JAYASINGHE et al., "A novel
process for simulataneous printing of multiple tracks
from concentrated suspensions", Materials Research
Innovations (2003), 7(2), 62-64.), en vue de la
fonctionnalisation du matériau ou d'un traitement
chimique localisé, à une échelle pouvant être
inférieure au micromètre.
Ces diverses applications peuvent être
également combinées entre elles.
Usuellement, les sources utilisées pour la
nanoélectronébulisation se présentent sous forme de
capillaires en verre ou en silice fondue. Elles sont
fabriquées par étirement à chaud ou par attaque acide
du matériau afin de donner un orifice de sortie de 1 à
10 pm (M. WILM et al., "Electrospray and Taylor-Cone
theory, Dole's beam of macromolécules at last?",
International Journal of Mass Spectrometry and Ion
Processes (1994), 136(2-3), 167-180). La tension
d'électronébulisation peut être appliquée via un
revêtement extérieur conducteur approprié un
revêtement métallique comme l'or ou un alliage Au/Pd
(G. A. VALASKOVIC et al., "Long-lived metalized tips
for nanoliter electrospray mass spectrometry", Journal
of the American Society for Mass Spectrometry (1996),
7(12), 1270-1272), l'argent (Y.-R CHEN et al., "A
simple method for fabrication of silver-coated
sheathless electrospray emitters", Rapid Communications
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
7
in Mass Spectrometry (2003), 17(5), 437-441), un
matériau à base de carbone (X. ZHU et al., "A Colloidal
Graphite-Coated Emitter for Sheathless Capillary
Electrophoresis/Nanoelectrospray Ionization Mass
Spectrometry", Analytical Chemistry (2002), 74(20),
5405-5409) ou un polymère conducteur comme le
polyaniline (P. A. BIGWARFE et al., "Polyaniline-coated
nanoelectrospray emitters: performance characteristics
in the negative ion mode", Rapid Communications in Mass
Spectrometry (2002), 16(24), 2266-2272). La tension
d'électronébulisation peut aussi être appliquée via le
liquide avec l'introduction d'un fil métallique dans la
source (K. W. Y. FONG et al., "A novel nonmetallized
tip for electrospray mass spectrometry at nanoliter
flow rate", Journal of the American Society for Mass
Spectrometry (1999), 10(1), 72-75).
Néanmoins, les dispositifs de l'art
antérieur dédiés à la nanoélectronébulisation souffrent
de plusieurs faiblesses (B. FENG et al., "A Simple
Nanoelectrospray Arrangement With Controllable Flowrate
for Mass Analysis of Submicroliter Protein Samples",
Journal of the American Society for Mass Spectrometry
(2000), 11, 94-99)
= Tout d'abord, ces capillaires sont peu
robustes. Leur procédé de fabrication est mal contrôlé
et fournit des sources de dimensions peu
reproductibles ;
= Le revêtement conducteur externe se
détériore rapidement ;
= Leur mode d'utilisation est peu
commode du fait de leur géométrie de type aiguille : le
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
8
liquide à nébuliser doit être introduit manuellement
dans l'aiguille à l'aide d'une micropipette et d'un
embout adapté de forme effilée ;
= Le chargement de la solution conduit à
l'introduction de bulles d'air dans l'aiguille qui
peuvent perturber ultérieurement la stabilité du
nébulisat, elles doivent donc être chassées ;
= Enfin, le plus souvent, l'orifice de
sortie est trop petit pour permettre le passage du
liquide ; de ce fait, les capillaires doivent d'abord
être cassés doucement le long d'une paroi, ce qui
accroît encore le caractère aléatoire de leurs
dimensions.
Ainsi, les sources standard commerciales
sont-elles peu adaptées, premièrement à une
nébulisation contrôlée, reproductible et de qualité,
deuxièmement à l'utilisation de robots du fait du
caractère entièrement manuel de leur mode
d'utilisation, et, troisièmement, à une intégration sur
un microsystème fluidique, comme discuté dans la suite.
Ces défauts entravent certains domaines
d'applications de l'éléctronébulisation qui nécessitent
à l'heure actuelle une robotisation et une
automatisation des processus. Ceci est le cas des
domaines d'applications recensés ci-dessus : l'analyse
par spectrométrie de masse, le dépôt de gouttes de
taille calibrée et l'écriture à une échelle inférieure
au micromètre à l'aide d'une pointe.
Ces deux dernières décennies ont vu
l'avènement de la microfluidique dans les domaines de
la chimie et de la biologie. Ce secteur résulte en
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
9
partie de la miniaturisation des outils de laboratoire
et donc du mariage entre microtechnologie et biologie
ou microtechnologie et analyse chimique. Ainsi, les
techniques de microtechnologie sont-elles mises à
profit pour la fabrication de microsystèmes intégrés de
taille caractéristique de l'ordre du micromètre et qui
rassemblent une série de processus réactionnels et/ou
analytiques, chimiques et/ou biochimiques/biologiques.
L'essor de la microfluidique dans les
domaines de la chimie et de la biologie, où la rapidité
et l'automatisation des processus sont aujourd'hui
requises, s'explique par :
= le gain en vitesse des processus, du
fait que la vitesse dépend principalement de la taille
des dispositifs ; ce gain en vitesse est
particulièrement important pour des champs
d'applications de type diagnostic médical ou analyse
environnementale, où une réponse instantanée est
souvent attendue,
= la possibilité de parallélisation des
processus ; la microtechnologie permet la fabrication
simultanée d'un grand nombre de dispositifs identiques,
= la compatibilité des objets
microfabriqués avec une interface robotique en vue de
l'automatisation des processus,
= l'adéquation des volumes manipulés avec
ceux dont l'expérimentateur dispose dans le cas, entre
autres, des analyses biologiques ou environnementales,
= la limitation allant jusqu'à la
suppression de l'intervention humaine, qui est souvent
source d'erreur et de contamination,
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
= un gain en sensibilité, pour certaines
techniques d'analyse, dont la spectrométrie de masse
avec une ionisation par électronébulisation,
= globalement, de nouvelles performances
5 qui ne correspondent pas seulement à une diminution
d'échelle des outils et des techniques bien établis.
Les dispositifs microfluidiques sont
fabriqués à l'aide des techniques de microtechnologie.
Une large gamme de matériaux est aujourd'hui disponible
10 pour ces microfabrications, gamme qui va du silicium et
du quartz (matériaux usuels en microtechnologie) aux
verres, céramiques et matériaux de type polymère, comme
les élastomères ou les plastiques. Ainsi, la
microfluidique bénéficie-t-elle à la fois :
= de l'héritage des matériaux et des
techniques de fabrication développés et utilisés pour
des applications microélectronique et,
= de nouveaux procédés de fabrication,
développés en parallèle et adaptés à d'autres matériaux
émergents et de grand intérêt pour des applications
microfluidiques, comme les matériaux de type plastique,
dont l'attrait principal réside dans leur faible coût.
Plus précisément, les matériaux
envisageables pour des fabrications technologiques
applicables à la chimie et à la biologie sont (T.
McCREEDY, "Fabrication techniques and materials
commonly used for the production of microreactors and
micro total analytical systems", TrAC, Trends in
Analytical Chemistry (2000), 19(6), 396-401) :
= les matériaux de type semi-conducteurs
comme le silicium, matériaux traditionnels en
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
11
microtechnologie qui bénéficient de techniques de
fabrication robustes et éprouvées ; parmi ces
techniques de fabrication, on compte la lithographie,
les gravures physiques et chimiques entre autres (P. J.
FRENCH et al., "Surface versus bulk micromachining: the
contest for suitable applications", Journal of
Micromechanics and Microengineering (1998), 8(2), 45-
53). De ce fait, le silicium notamment est le matériau
le plus intéressant en termes de fabrication de petites
structures à des échelles de la dizaine de nanomètres.
De plus, sa chimie de surface est maîtrisée, les
traitements mettant en jeu les fonctions silanols
présentes à sa surface. Mais ses propriétés semi-
conductrices ne sont pas toujours adaptées en fonction
des applications visées. Il n'est pas transparent ce
qui empêche toute technique de détection optique
(absorbance UV, fluorescence, luminescence). Le coût du
matériau lui-même le rend impropre pour certaines
fabrications de masse (objets à usage unique
notamment).
= le quartz, utilisé pour le développement
des premiers microsystèmes (J. S. DANEL et al.,
"Quartz: a material for microdevices", Journal of
Micromechanics and Microengineering (1991), 1(4), 187-
98), qui est devenu peu attrayant du fait de son coût
fortement élevé ; il est donc progressivement abandonné
en dépit de ses propriétés physico-chimiques.
= le verre, matériau moins cher que le
quartz et le silicium, qui est beaucoup utilisé du fait
de ses propriétés de surface adaptées à l'établissement
d'un flux électroosmotique (K. SATO et al.,
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
12
"Integration of chemical and biochemical analysis
systems into a glass microchip", Analytical Sciences
(2003), 19(1), 15-22). De même que pour le silicium,
des groupements silanols tapissent la surface du verre.
Ils laissent envisager une modification chimique
ultérieure des surfaces de verre. De plus, ses
propriétés de transparence en font un matériau de choix
dans le cas d'une détection optique. Cependant, les
techniques de fabrication ne sont pas aussi bien
maîtrisées que pour le silicium; les profils de gravure
sont moins propres et le rapport de forme est fort
médiocre (T. R. DIETRICH et al., "Fabrication
technologies for microsystems utilizing photoetchable
glass", Microelectronic Engineering (1996), 30(1-4),
497-504) . D'autre part, c'est un matériau fragile et
cassant.
= les matériaux de type polymère, qui
regroupent les plastiques les élastomères. Leur
avantage principal est leur faible coût qui est
compatible avec des productions de masse à bas prix de
revient. La multiplicité de ces matériaux conduit à une
large gamme de propriétés physico-chimiques. Leur
inconvénient majeur est leur faible résistance aux
hautes températures et leur sensibilité aux conditions
de solvant utilisées classiquement en chimie et en
biologie, milieu organique, acide, basique, qui peuvent
entraîner une dégradation du matériau voire même sa
dissolution. Par ailleurs, la chimie de surface de ces
matériaux est mal connue, ce qui rend difficile tout
traitement ultérieur des surfaces engendrées afin d'en
modifier les propriétés. Les techniques de fabrication
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
13
sont tout autres et sont basées sur des techniques de
moulage/injection, d'ablation laser, de LIGA (acronyme
allemand pour "Lithographie, Galvanoformung,
Abformung") (J. HRUBY, " Overview of LIGÅ
microfabrication", AIP Conférence Proceedings (2002),
625(High Energy Density and High Power RF), 55-61), de
photolithographie, de gravure plasma.
= les matériaux de types céramiques (W.
BAUER, "Ceramic materials in the microsystem
technology", Keramische Zeitschrift (2003), 55(4), 266-
270), qui sont des substrats inorganiques de faible
coût de fabrication à l'image des matériaux plastiques.
Un avantage majeur est que leur fabrication ne
nécessite pas d'équipements dédiés d'entretien onéreux
comme des salles blanches mais repose sur des processus
simples et rapides (ablation laser, laminage, moulage,
procédé sol-gel), réduisant encore le prix de revient
des structures microfabriquées. Leur état de surface
est comparable à celui du verre ou du silicium et
enfin, le capotage est plus facile que pour d'autres
matériaux, comme le verre.
En particulier, les techniques de
microfabrication ont été appliquées à la réalisation de
sources d'électronébulisation ou de pointe type
aiguille en vue :
= d'améliorer la qualité globale des
capillaires en termes de contrôle des procédés de
fabrication, de reproductibilité des sources et de
leurs dimensions,
= de produire un grand nombre de
dispositifs identiques ou différant entre eux par une
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
14
ou plusieurs dimensions, sur une même plaque de
matériau, à l'image des microcomposants en
microélectronique, afin de promouvoir l'automatisation
et la robotisation de l'électronébulisation.
Les fabrications à l'aide des techniques de
microtechnologie de pointes d'électronébulisation
obéissent à deux tendances :
= la fabrication d'une pointe
d'électronébulisation qui reproduit la géométrie
classique, c'est-à-dire un capillaire microfabriqué et,
le plus souvent, de section circulaire. Dans cette
classe peuvent être inclues également les aiguilles
microfabriquées destinées à une autre application,
comme celle d'injection de substances chimiques ou de
mesure de potentiel biologique.
= la conception d'une source
d'électronébulisation comme une sortie de microcanal ou
capillaire fabriqué à l'aide de techniques de
microtechnologie et ayant un profil effilé.
Ces dispositifs d'électronébulisation
microfabriqués reposent, à l'image des microsystèmes
fluidiques, sur l'utilisation de différents types de
matériaux et différents types de procédés.
Selon la première tendance, qui vise à
produire par voie technologique une géométrie de type
capillaire, on recense les descriptions suivantes :
= Selon cette approche, des sources
d'électronébulisation en nitrure de silicium ont été
fabriquées à l'aide de techniques classiques de
photolithographie et de gravure (A. DESAI et al., "MEMS
Electrospray Nozzle for Mass Spectrometry", Int. Conf.
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
on Solid-State Sensors and Actuators, Transducers '97,
(1997)). Les dimensions desdits dispositifs sont une
longueur de 40 }gym et un diamètre interne de l'orifice
de sortie de 1 à 3 pm. Lesdites sources ont été testées
5 en spectrométrie de masse à des tensions de
nébulisation voisines de 4 kV et un débit de liquide de
50 nL/min avec des peptides standard à une
concentration de quelques micromolaires. La tension de
nébulisation est appliquée en amont dudit dispositif,
10 au niveau de la jonction avec un capillaire
d'alimentation en liquide, et ce, sur une connexion
métallique en platine.
= Des sources d'électronébulisation
fabriquées en matériau de type polymère, le parylène,
15 matériau photolithographiable ont également été
décrites (demande interntionale WO-A-00/30167; L.
LICKLIDER et al., "A Micromachined Chip-Based
Electrospray Source for Mass Spectrometry", Analytical
Chemistry (2000), 72(2), 367-375). Ces sources ont un
orifice de sortie de 5 x 10 pm et ont été présentées
comme partie intégrante d'un microsystème fluidique en
silicium. Elles sont connectées à des microcanaux de
100 pm de largeur et de 5 pm de hauteur. La tension
requise pour la nébulisation est ici plus faible, de
l'ordre de 1,2 à 1,8 kV dans des conditions de
concentration et de débit de fluide équivalentes ; la
tension est appliquée sur un fil métallique mis en
contact avec la solution à nébuliser.
= Le silicium a aussi été utilisé pour la
microfabrication de structures de type aiguille. La
demande internationale WO-A-00/15321 décrit un
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
16
dispositif d'électronébulisation ressemblant à une
cheminée, de diamètre interne de 10 pm pour un diamètre
externe de 20 pm et une hauteur de 50 }gym. On peut se
référer également à l'article de G. A. SCHULTZ et al.,
intitulé "A Fully Integrated Monolithic Microchip
Electrospray Device for Mass Spectrometry", Analytical
Chemistry (2000), 72(17), 4058-4063. Ces sources
résultent d'une gravure physique dite profonde du
matériau. Leur fonctionnement en électronébulisation
est décrit avec des hautes tensions de 1,25 kV, qui
sont appliquées sur le capillaire d'alimentation en
fluide situé à l'arrière de la source et qui est en
matériau conducteur. Le prototype a été présenté
intégré sur une plaque comprenant 100 sources de ce
type, identiques et fonctionnant indépendamment les
unes des autres. Le silicium et un procédé de
fabrication similaire ont également été utilisés pour
former des structures de type aiguille qui sont
employées soit comme sources d'électronébulisation (P.
GRISS et al., "Development of micromachined hollow tips
for protein analysis based on nanoelectrospray
ionization mass spectrometry", Journal of
Micromechanics and Microengineering (2002), 12(5), 682-
687; J. SJODAHL et al., "Characterization of
micromachined hollow tips for two-dimensional
nanoelectrospray mass spectrometry", Rapid
Communications in Mass Spectrometry (2003), 17(4), 337-
341), soit comme aiguilles de mesure de potentiels
biologiques (demande internationale WO-A-03/15860; P.
GRISS et al., "Micromachnied electrodes for
biopotential measurements", IEEE/ASME Journal of
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
17
Microelectromechanical systems, 2001, 10, 10-16). Leur
forme varie quelques peu en fonction de leur
application; les dispositifs d'électronébulisation
ressemblent aux dispositifs en silicium décrits ci-
dessus, avec néanmoins, un profil qui se rétrécit en
leur pointe conduisant à un plus petit orifice de
sortie, alors que les aiguilles destinées à des mesures
de potentiels biologiques ont une pointe très effilée.
Le procédé de fabrication desdits dispositifs en
silicium à l'aide de techniques de gravure profonde est
fort complexe et nécessite un appareillage coûteux,
encombrant et les performances, en termes de tension de
nébulisation entre autres, des structures obtenues sont
médiocres comparées à celles de sources standard
commerciales. Par ailleurs, leur géométrie se prête mal
à une intégration sur un microsystème fluidique.
= L'article de L. LIN et al., intitulé
"Silicon processed microneedles", IEEE Journal of
Mictroelectromechanical Systems (1999), 8, 78-84)
décrit des micro-aiguilles qui sont connectées à un
réseau microfluidique. Ces aiguilles ont été
développées pour l'injection de substances chimiques in
situ et non pour de la nébulisation, mais la géométrie
de type aiguille de ces dispositifs est proche de celle
des sources de nanonébulisation. Ces aiguilles sont
fabriquées en nitrure de silicium et présentent un
orifice de sortie rectangulaire de 9 x 30-50 pm et une
hauteur de 1 à 6 mm.
= Des structures de type aiguille ont
enfin été fabriquées en un autre matériau polymère, le
polycarbonate, à l'aide d'un procédé d'ablation laser
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
18
(K. TANG et al., "Génération of multiple electrosprays
using microfabricated emitter arrays for improved mass
spectrometric sensitivity", Analytical Chemistry
(2001), 73(8), 1658-1663). Leurs dimensions sont les
suivantes : 30 pm de diamètre interne en leur orifice
de sortie et 250 im de hauteur. Pour cet exemple
encore, les dimensions desdits dispositifs sont trop
grandes pour un régime en nanoélectronébulisation
puisque la tension requise pour l'observation d'un
nébulisat est de 7 kV et le débit de fluide est estimé
à 30 pL/min. Le procédé de fabrication est par ailleurs
complexe. Ces sources se présentent sous forme d'une
série de neuf sources arrangées selon un carré 3 x 3.
Elles opèrent simultanément et nébulisent la même
solution.
La deuxième tendance est d'usiner une
pointe à la sortie d'un microcanal ou de créer une
structure en pointe qui tient lieu de source
d'électronébulisation. L'angle de la structure en
pointe ne semble pas avoir d'influence sur le phénomène
de nébulisation. Selon cette deuxième tendance:
= Les tentatives de nébulisation à la
sortie d'un microcanal, sur la tranche d'un
microsystème se sont révélées peu concluantes. La
tension à appliquer est très élevée et, dans ces
conditions, le liquide a tendance à s'étaler sur la
surface de sortie, sur la tranche du microsystème (R.
RAMSEY et al., "Generating Electrospray from Microchip
Devices Using Electroosmotic Pumping", Analytical
Chemistry (1997), 69(6), 1174-1178; Q. XUE et al.,
"Multichannel Microchip Electrospray Mass
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
19
Spectrometry", Analytical Chemistry (1997), 69(3), 426-
430; B. ZHANG et al., "Microfabricated Devices for
Capillary Electrophoresis-Electrospray Mass
Spectrometry", Analytical Chemistry (1999), 71(15),
3258-3264). Ces essais ont été améliorés par un
traitement chimique approprié de la surface de sortie
ou en assistant de façon pneumatique la formation du
nébulisat. Ceci démontre l'importance de travailler
avec une structure en pointe qui conduit à une
concentration du champ électrique et qui permet ainsi
la nébulisation.
= L'effet de pointe peut être réalisé par
insertion d'une structure plane triangulaire entre les
deux plaques de matériaux définissant un microcanal (le
support dans lequel le microcanal est usiné et le
couvercle). Cette structure plane triangulaire est
constituée d'une feuille de parylène de 5 Um
d'épaisseur (J. KAMEOKA et al., "An electrospray
ionization source for intégration with microfluidics",
Analytical Chemistry (2002), 74(22), 5897-5901). Le
système intègre quatre dispositifs
d'électronébulisation identiques placés en parallèle.
La tension de nébulisation requise est de 2,5-3 kV pour
un débit de fluide de 300 nL/min. Aucune interférence
inter-sources n'a été observée.
= Un dispositif en forme d'étoile à huit
branches a été fabriqué en polyméthylméthacrylate
(PMMA) (C.-H. YUAN et al., "Sequential Electrospray
Analysis Using Sharp-Tip Channels Fabricated on a
Plastic Chip", Analytical Chemistry (2001), 73(6),
1080-1083). Chacune des branches de l'étoile constitue
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
un système microfluidique indépendant et la pointe de
chaque branche est une source de nébulisation. Chaque
branche intègre ainsi un microcanal de section 300 x
376 pm, la structure en pointe forme un angle de 90 et
5 les huit réservoirs de liquide sont regroupés au centre
de l'étoile. La tension appliquée pour l'établissement
d'un cône de Taylor est élevée et égale à 3,8 kV, ce
qui s'explique par les dimensions fort larges de la
section du microcanal en son extrémité. Par ailleurs,
10 le procédé de fabrication décrit repose sur l'usinage
de canaux à l'aide d'un couteau, technique qui ne
permet pas de réaliser des canaux et des dispositifs de
nébulisation de petites dimensions.
= Un autre matériau de type polymère, le
15 polydiméthylsiloxane (PDMS), a servi à la réalisation
de structures en pointe destinées à
l'électronébulisation suivant trois voies de
fabrication microtechnologiques différentes, une
méthode basée sur l'ablation de matériau, un procédé
20 utilisant une double couche de résine
photolithographiable et un procédé de moulage de la
résine (demande internationale WO-A-02/55990; J. S. KIM
et al., "Microfabrication of polydimethylsiloxane
electrospray ionization emitter", Journal of
Chromatography, A (2001), 924(1-2), 137-145; J.-S. KIM
et al., "Microfabricated PDMS multichannel emitter for
electrospray ionization mass spectrometry", Journal of
the American Society for Mass Spectrometry (2001),
12(4), 463-469; J.-S. KIM et al., "Miniaturized
multichannel electrospray ionization emitters on
poly(dimethylsiloxane) microfluidic devices",
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
21
Electrophoresis (2001), 22(18), 3993-3999). L'orifice
de nébulisation est rectangulaire et de dimensions
variables allant de 30 x 100 pm à 30 x 50 pm selon le
procédé de microtechnologie utilisé pour leur
fabrication. Dans les différents cas, la tension de
nébulisation allait de 2,5 kV à 3,7 kV pour des
solutions à 1 à 10 pM et des débits élevés de quelques
100 nL/min à plusieurs pL/min.
= Enfin, le polyimide, autre matériau de
type polymère relativement hydrophobe a été utilisé
pour la fabrication de sources de nébulisation (GB-A-2
379 554; V. GOBRY et al., "Microfabricated polymer
injector for direct mass spectrometry coupling",
Proteomics (2002), 2(4), 405-412; J. S. ROSSIER et al.,
"Thin-chip microspray system for high-performance
Fourier-transform ion-cyclotron resonance mass
spectrometry of biopolymers", Angewandte Chemie,
International Edition (2003), 42(1), 54-58) intégrées
sur un microsystème, ou tout du moins, connectées à un
microcanal de section 120 x 45 pm. Le système, le
microcanal et la structure en pointe sont fabriqués par
gravure plasma du polyamide. Le couvercle du système
est en polyéthylène/polyéthylène téréphtalate. Le
fonctionnement desdites sources en électronébulisation
a été validé pour des échantillons de peptides standard
à 5 pM, s'écoulant à 140 nL/min et pour des tensions de
nébulisation de 1,6 à 1,8 W. Un autre dispositif
fabriqué dans le même matériau a été présenté,
différant du précédent de par sa topologie ouverte et
la finesse de l'épaisseur (50 pm) de matériau utilisée
pour sa fabrication. Cette structure dite mince a été
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
22
testée pour des tensions d'ionisation de 1 à 2,3 kV
appliquées ici sur une électrode de carbone intégrée
sur le dispositif.
Globalement, les dispositifs de
nébulisation recensés ci-dessus présentent des
conditions de fonctionnement non conformes pour une
nébulisation à petite échelle (dimensions trop grandes,
tensions de nébulisation trop élevées) et résultent le
plus souvent de procédés de fabrication fort complexes.
De plus, le type de structure choisi pour ces
différents dispositifs est pratiquement indissociable
du matériau utilisé pour leur réalisation.
Pour les différents dispositifs présentés
ci-dessus, la tension de nébulisation est le plus
souvent appliquée au niveau du réservoir du dispositif,
si le système inclut un réservoir, ou, dans le cas
contraire, au niveau de l'alimentation en liquide qui
est effectuée à l'aide d'un capillaire connecté au
dispositif. Dans ce cas, soit ' le capillaire est
conducteur (en acier inoxydable par exemple), soit la
connexion repose sur un raccord métallique. Cependant,
il a été proposé d'intégrer, sur le dispositif de
nébulisation, une électrode ou zone conductrice sur
laquelle est appliquée la tension de nébulisation (T.
C. ROHNER et al., "Polymer microspray with an
integrated thick-film microelectrode", Analytical
Chemistry (2001), 73(22), 5353-5357). Cette zone
conductrice est réalisée à base d'encre de carbone dans
l'exemple cité.
Enfin, l'application de ces dispositifs est
ciblée pour de l'électronébulisation précédant une
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
23
analyse par spectrométrie de masse et ne se prête pas à
un autre type d'application.
Par ailleurs, les dispositifs de dépôt de
gouttes calibrées issus de la microtechnologie ne
reposent pas sur la nébulisation de la solution mais
sur un effet mécanique avec la mise en contact de la
pointe microfabriquée sur la surface de dépôt. Ainsi :
= Une structure mimant celle d'un stylo
plume a été décrite pour l'élaboration de plaques de
type des puces à ADN avec la déposition régulière de
gouttes calibrées sur une surface lisse (voir la
demande internationale WO-A-03/53583). Le dispositif
comprend une tranchée gravée dans le matériau se
terminant sur une pointe par laquelle le liquide sort.
Cette structure est dite flexible et le liquide à
déposer sort par mise en contact de la pointe flexible
avec le substrat de dépôt, l'angle de contact étant de
20-30 par rapport à la verticale. L'application
majeure ciblée par cette invention est la préparation
de puces à ADNs ou autres composés à analyser.
= P. BELAUBRE et al. dans l'article
"Fabrication of biological microarrays using
microcantilevers", Applied Physics Letters (2003),
82(18), 3122-3124, proposent une structure de type
poutre ouverte pour le dépôt de gouttes de taille
reproductible. L'application du dispositif est la
préparation de puces à ADN ou à protéines de façon
automatisée. La structure de type poutre est tout
d'abord plongée dans la solution à déposer, puis est
mise en contact avec la surface de dépôt. L'éjection du
liquide est provoquée par la mise en contact entre la
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
24
pointe et ladite surface. Une particularité de ce
dispositif est l'intégration dans la structure de type
poutre d'électrodes en aluminium qui permettent
d'accroître le chargement en liquide de la pointe
lorsque cette dernière est trempée dans la solution à
déposer, par effet électrostatique. Ces structures de
type poutre, qui ont une largeur de 210 pm en leur
pointe, sont fabriquées en parallèle sur un même
système. Elles permettent l'éjection de gouttes ayant
un volume dans la gamme du femtolitre jusqu'au
picolitre, le volume déposé dépendant linéairement du
temps de contact entre la pointe et la surface, avec un
débit pouvant atteindre 100 dépôts par minute.
Enfin, l'écriture moléculaire à des
échelles de l'ordre du nanomètre est principalement
décrite avec une pointe de microscopie AFM (Microscopie
à Force Atomique) qui est trempée dans une solution
chimique, à l'image d'une plume de stylo (G. AGARWAL et
al., "Dip-Pen Nanolithography in Tapping Mode", Journal
of the American Chemical Society (2003), 125(2), 580-
583; les demandes internationales WO-A-03/48314 et WO-
A-03/52514; H. ZHANG et al., "Direct-write dip-pen
nanolithography of proteins on modified silicon oxide
surfaces", Angewandte Chemie, International Edition
(2003), 42(20), 2309-2312; L. FU et al.,
"Nanopatterning of "Hard" Magnetic Nanostructures via
Dip-Pen Nanolithography and a Sol-Based Ink", Nano
Letters (2003), 3(6), 757-760; H. ZHANG et al.,
"Fabrication of sub-50-nm solid-state nanostructures on
the basis of dip-pen nanolithography", Nano Letters
(2003), 3(1), 43-45). L'écriture a ensuite lieu par
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
mise en contact ou après rapprochement, suivant le mode
d'utilisation de l'AFM sélectionné, de la pointe et
d'une surface lisse. La solution chimique peut aussi
être une solution qui attaque le matériau sur lequel
5 elle est déposée et servir ainsi à la gravure de canaux
ou d'autres structures. La technique de microscopie AFM
présente l'avantage d'une forte résolution et d'une
très grande précision d'écriture. Trois modes de
fonctionnement sont possibles, et suivant le mode
10 choisi, l'état de surface peut être contrôlé avant et
après passage de la solution chimique d'écriture
moléculaire. Néanmoins, cette technique impose
l'utilisation d'un appareillage lourd, encombrant,
onéreux et complexe.
15 Deux dispositifs d'écriture moléculaire
décrits dans la littérature peuvent également être
cités. Ils dérivent de la technique utilisant une
pointe de microscopie AFM mais reposent sur
l'utilisation d'une pointe microfabriquée. Le premier
20 dispositif (A. LEWIS et al., "Fountain pen
nanochemistry: Atomic force control of chrome etching",
Applied Physics Letters (1999), 75(17), 2689-2691 ; H.
TAHA et al., "Protein printing with an atomic force
sensing nanofountainpen", Applied Physics Letters
25 (2003), 83(5), 1041-1043), se présente sous forme d'une
micropipette fabriquée à l'aide de techniques de
microtechnologie et dont la pointe peut avoir des
dimensions aussi petites que 3 et 10 nm pour ses
diamètres internes et externes respectivement. Cette
micropipette est néanmoins intégrée dans un
appareillage AFM pour son utilisation. L'éjection de la
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
26
solution est ici provoquée non pas par une mise en
contact mais en exerçant une pression sur la colonne de
liquide. Ce dispositif a été testé pour son aptitude à
délivrer des solutions de gravure d'une couche de
chrome déposée sur une plaque de verre. Le deuxième
dispositif (I. W. RANGELOW et al., ""NANOJET": Tool for
the nanofabrication".. Journal of Vacuum Science &
Technology, B: Microelectronics and Nanometer
Structures (2001), 19(6), 2723-2726; J. VOIGT et al.,
"Nanofabrication with scanning nanonozzle 'Nanojet "',
Microelectronic Engineering (2001), 57-58 1035-1042)
consiste en des pointes réalisées en silicium couvert
de Cr/Au, ayant une forme pyramidale et un orifice de
sortie de taille inférieure à ,100 nm. Ce dispositif
délivre non pas une solution chimique comme dans
l'exemple précédent, mais des radicaux libres en phase
gazeuse produits par une décharge plasma qui viennent
attaquer le matériau mis en regard de la pointe. Ainsi,
le dispositif ne consiste-t-il pas uniquement en une
pointe microfabriquée mais inclut-il également une
machinerie de production d'espèces très réactives,
comme une décharge plasma radiofréquence ou microonde,
qui peuvent attaquer le substrat.
Ces deux exemples présentent certes une
pointe microfabriquée qui remplace la pointe
conventionnelle de microscopie AFM, mais ils ne
permettent pas de s'affranchir de la machinerie
périphérique lourde et onéreuse nécessaire à leur
fonctionnement. D'autre part, cette technique repose
sur une mise en contact ou quasi-mise en contact de la
pointe et du substrat. De ce fait, les paramètres de
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
27
fonctionnement doivent être très minutieusement
contrôlés pour éviter toute détérioration de l'état de
surface due à une trop grande force exercée au niveau
de la pointe.
EXPOSÉ DE L'INVENTION
La présente invention concerne un
dispositif d'électronébulisation bidimensionnel ayant
une géométrie de type plume de calligraphie, dont la
pointe tient lieu de siège pour la nébulisation.
L'invention a donc pour objet une source
d'électronébulisation comportant une structure
comprenant au moins une pointe plate et mince en porte-
à-faux par rapport au reste de la structure, ladite
pointe étant pourvue d'une fente capillaire pratiquée
dans toute l'épaisseur de la pointe et qui aboutit à
l'extrémité de la pointe pour former l'orifice
d'éjection de la source d'électronébulisation, la
source comprenant des moyens d'approvisionnement de la
fente capillaire en liquide à nébuliser et des moyens
d'application d'une tension d'électronébulisation sur
ledit liquide.
Selon un mode avantageux, les moyens
d'approvisionnement comprennent au moins un réservoir
en communication fluidique avec la fente capillaire.
De préférence, la structure comprend un
support et une plaque solidaire du support et dont une
partie constitue ladite pointe. Les moyens
d'approvisionnement peuvent comprendre un réservoir
constitué par un évidement formé dans ladite plaque et
en communication fluidique avec la fente capillaire.
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
28
Les moyens d'application d'une tension
d'électronébulisation peuvent comprendre au moins une
électrode disposée de façon à être en contact avec
ledit liquide à nébuliser.
Dans le cas où la structure comprend un
support et une plaque solidaire du support, les moyens
d'application d'une tension d'électronébulisation
peuvent comprendre le support, au moins partiellement
électriquement conducteur, et/ou la plaque au moins
partiellement électriquement conductrice.
Avantageusement, la plaque présente une surface
hydrophobe au liquide à nébuliser.
Les moyens d'application d'une tension
d'électronébulisation peuvent comprendre un fil
électriquement conducteur disposé pour pouvoir être en
contact avec ledit liquide à nébuliser.
Les moyens d'approvisionnement peuvent
comprendre un tube capillaire. Ils peuvent comprendre
un canal réalisé dans un microsystème supportant ladite
structure et en communication fluidique avec la fente
capillaire.
Selon un mode avantageux, les moyens
d'application de la tension (électrode, support,
plaque, fil) permettent également l'application des
tensions nécessaires pour tout dispositif placé en
amont en continuité fluidique avec l'objet de la
présente invention.
L'invention a aussi pour objet un procédé
de fabrication d'une structure étant une source
d'électronébulisation, comprenant
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
29
- la réalisation d'un support à partir d'un
substrat,
- la réalisation d'une plaque comportant
une partie constituant une pointe plate et mince,
ladite pointe étant pourvue d'une fente capillaire,
pour véhiculer un liquide à nébuliser, pratiquée dans
toute l'épaisseur de la pointe et qui aboutit à
l'extrémité de la pointe,
- la solidarisatio.ii de ladite plaque sur le
support, la pointe étant en porte-à-faux par rapport au
support.
Ce procédé peut comprendre les étapes
suivantes :
- la fourniture d'un substrat pour réaliser
le support,
- la délimitation du support au moyen de
tranchées gravées dans le substrat,
- le dépôt, sur une zone du substrat
correspondant à la future pointe de la structure, de
matériau sacrificiel selon une épaisseur déterminée,
- le dépôt de la plaque sur le support
délimité dans le substrat, la pointe de la plaque étant
située sur le matériau sacrificiel,
- l'élimination du matériau sacrificiel,
- le détachement du support par rapport au
substrat par clivage au niveau desdites tranchées.
L'étape de dépôt de la plaque peut être un
dépôt d'une plaque comprenant en évidement en
communication fluidique avec la fente capillaire afin
de constituer un réservoir. Le procédé peut comprendre
en outre une étape de dépôt d'au moins une électrode
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
destinée à assurer un contact électrique avec le
liquide à nébuliser.
La source d'électronébulisation selon
l'invention peut être utilisée pour obtenir une
5 ionisation d'un liquide par électronébulisation avant
son analyse en spectrométrie de masse. Elle peut aussi
être utilisée pour obtenir une production de gouttes de
liquide de taille calibrée ou l'éjection de particules
de taille fixée. Elle peut encore s'appliquer à la
10 réalisation d'une écriture moléculaire à l'aide de
composés chimiques. Elle peut encore s'appliquer à la
définition du potentiel électrique de jonction d'un
dispositif en continuité fluidique.
15 BREVE DESCRIPTION DES DESSINS
L'invention sera mieux comprise et d'autres
avantages et particularités apparaîtront à la lecture
de la description qui va suivre, donnée à titre
d'exemple non limitatif, accompagnée des dessins
20 annexés parmi lesquels :
- les figures lA et 1B sont des vues
respectivement de dessus et de côté d'une source
d'életronébulisation selon la présente invention,
- la figure 2 est une vue en perspective de
25 l'extrémité de la pointe d'une source
d'électronébulisation selon la présente invention,
- les figures 3A à 3H sont des vues de
dessus illustrant un procédé de fabrication de la
source d'électronébulisation représentée aux figures lA
30 et 1B,
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
31
- les figures 4A et 4B illustrent une
technique de clivage utilisable pour la mise en oeuvre
du procédé de fabrication illustré par les figures 3A à
3H,
- la figure 5 représente un montage utilisé
lors d'un test au cours duquel une source
d'électronébulisation selon l'invention est associée à.
un spectromètre de masse,
- la figure 6 est un graphe représentant le
courant ionique total obtenu au cours du test utilisant
une source d'électronébulisation selon l'invention,
dans le montage de la figure 5,
- la figure 7 est un spectre de masse
obtenu au cours du test utilisant une source
d'électronébulisation selon l'invention dans le montage
de la figure 5,
- la figure 8 représente un autre montage
utilisé lors d'un test au cours duquel une source
d'életronébulisation selon l'invention est associée à
un spectromètre de masse,
- la figure 9 est un graphe représentant le
courant ionique total obtenu au cours du test utilisant
une source d'électronébulisation selon l'invention,
dans le montage de la figure 8,
- la figure 10 est un spectre de masse
obtenu cours du test utilisant une source
d'électronébulisation selon l'invention dans le montage
de la figure 8,
- la figure 11 représente un spectre de
masse de fragmentation du glu-fibrinopeptide obtenu
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
32
avec une source d'électronébulisation selon la présente
invention,
- la figure 12 représente un spectre de
masse obtenu pour un digestat de Cytochrome C par
l'intermédiaire d'une source d'électronébulisation
selon la présente invention,
- la figure 13 est un graphe représentant
le courant ionique total obtenu au cours d'un test
utilisant une source d'électronébulisation selon
l'invention,
- la figure 14 représente un spectre de
masse obtenu au cours d'un test utilisant une source
d'électronébulisation selon la présente invention,
- la figure 15 est un graphe représentant
le courant ionique total enregistré sur un spectromètre
de masse de type trappe ionique lors d'un test en
couplage utilisant une source d'électronébulisation
selon la présente invention,
- la figure 16 représente le spectre de
masse correspondant au graphe de la figure 15.
EXPOSÉ DÉTAILLÉ DE MODES DE RÉALISATION PARTICULIERS
La présente invention s'inspire de la
structure et du mode de fonctionnement d'une plume de
calligraphie. Les sources planaires qui font l'objet de
la présente invention sont constituées des mêmes
éléments qu'une plume de calligraphie : un réservoir à
liquide et une fente capillaire bidimensionnelle formée
dans une pointe. La présente invention peut comporter,
si cela est nécessaire, une zone de contact électrique
sur laquelle est appliquée la tension nécessaire à
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
33
l'établissement d'un nébulisat. Cette zone de contact
peut être structurée avec des contacts multiples et
indépendants et en particulier trois contacts
correspondant à. une électrode de travail, permettant
également d'appliquer la tension d'électronébulisation,
une électrode de référence et une électrode de mesure
pour permettre la modification chimique par
électrochimie en vue de favoriser le processus
d'électronébulisation ou de l'étudier. Ces électrodes
permettent également le contrôle du processus
d'électronébulisation par synchronisation sur sa
fréquence propre. De même que dans la plume de
calligraphie, le liquide est amené par capillarité dans
la fente vers l'extrémité de la pointe de la structure
de type plume où il est éjecté. L'éjection a lieu non
pas par action mécanique, mais sous forme de
nébulisation par application d'une haute tension sur le
liquide.
Une source d'électronébulisation selon la
présente invention est représentée aux figures lA et
1B, la figure lA étant une vue de dessus et la figure
1B une vue de côté.
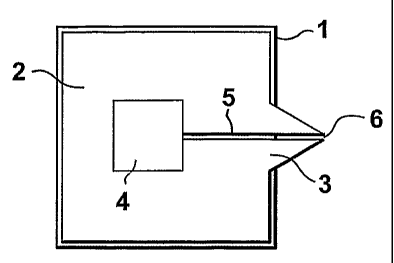
Cette source d'électronébulisation comprend
un support 1 et une plaque 2 solidaire du support 1.
Une partie de la plaque 2 forme une pointe 3 en porte-
à-faux par rapport au support 1. La plaque 2 comporte
en son centre un évidement 4 révélant la surface du
support 1 et constituant un réservoir. Une fente
capillaire 5, révélant également le support 1, relie le
réservoir 4 à l'extrémité 6 de la pointe 3 qui forme un
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
34
orifice d'éjection pour la source
d'électronébulisation.
Le fonctionnement du dispositif repose sur
les principes énoncés suivants. Le réservoir de liquide
4 contient le liquide ou sert de transit pour
l'alimentation en liquide. Le liquide est ensuite guidé
par la fente capillaire 5 en amont de laquelle est
situé le réservoir 4 de liquide. La pointe de la
structure permet l'établissement d'un électronébulisat.
Il en découle le mode de fonctionnement
suivant. Le liquide d'intérêt est déposé ou acheminé
dans le réservoir de liquide 4 par une méthode
adéquate. Il est guidé vers l'extrémité 6 de la
structure par capillarité. La source est amenée sur son
site d'utilisation (par exemple devant un spectromètre
de masse). Un potentiel est appliqué au liquide de
façon à observer le nébulisat à l'extrémité 6 de la
pointe.
La physique de la source ayant une
géométrie de type plume repose sur les propriétés des
matériaux qui la constituent et sur les dimensions de
ses différents éléments. La figure 2 représente une vue
tridimensionnelle de la fente capillaire au niveau de
l'extrémité 6 de la pointe 3.
Le rôle du réservoir 4 est de contenir le
liquide à nébuliser et d'alimenter progressivement la
fente capillaire 5. La topologie de la structure est
bidimensionnelle. La plaque 2 est en un matériau à
caractère hydrophobe, et même plus hydrophobe que celui
constituant le support 1 supportant la plaque 2,
matériau qui tapisse le fond du réservoir. Ceci permet
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
de limiter les pertes de liquide hors du réservoir. Il
est intéressant de noter à ce point que les liquides
envisagés pour la nébulisation seront a priori à
caractère plutôt hydrophile, tels que des solutions
5 purement aqueuses ou mi-aqueuses mi-alcooliques, par
exemple des mélanges méthanol/eau 50/50.
La fente capillaire 5 et l'extrémité 6 de
la pointe 3 sont constituées dans le matériau formant
la plaque 2 et leurs dimensions sont déterminées lors
10 du procédé de fabrication. Sur la figure 2 sont
indiquées des dimensions à considérer pour le
fonctionnement de la source d'électronébulisation : la
largeur w de la fente, sa hauteur h et sa longueur 1.
On suppose que du liquide est présent dans la fente
15 capillaire 5. Lorsque la source d'électronébulisation
est présenté en regard de la zone où la nébulisation
est souhaitée, l'effet de gravité sur ce liquide est
négligeable. Les facteurs qui vont intervenir pour le
remplissage de la fente capillaire par le liquide
20 sont : l'angle de contact (a) du liquide sur le
matériau constituant la plaque 2, la tension de surface
(y) du liquide et les dimensions (1 et h) de la fente
capillaire 5. D'après l'équation 1, régissant l'effet
de capillarité d'un liquide dans un tube capillaire, le
25 cosinus de l'angle de contact a doit être positif pour
observer l'effet de capillarité, et ceci,
indépendamment de l'effet de gravité.
2y cos a (Equation 1)
/gr
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
36
où (r) est le rayon interne du capillaire,
(hr) la hauteur dont monte le liquide dans le tube
capillaire, (p) la densité du liquide, (a) est l'angle
de contact du liquide sur les parois internes du tube
capillaire et (g) est l'accélération de la pesanteur.
rcosa - rsv -YSL (Equation 2)
où Ysv est la tension de surface à
l'interface solide-vapeur et YSL est la tension de
surface à l'interface solide-liquide.
Tout d'abord, dans le cas où a < 90 (cos a
> 0), l'équation de Young (équation 2') implique que
Ysv > YSL et donc que l'interaction solide-liquide soit
favorisée comparée à celle solide-vapeur. Le terme r
apparaît dans l'équation 1. De sa valeur dépend
l'observation ou non de l'effet de capillarité. Le
terme r correspond au rayon du tube capillaire et; dans
le cas du dispositif faisant l'objet de la présente
invention, à la dimension de la fente capillaire 5. Si
le liquide pénètre dans la fente capillaire, il se
forme un pont-liquide entre les deux parois de la fente
capillaire. On peut ainsi définir un rapport de forme R
pour la fente capillaire 5, correspondant au rapport
h/w. Il résulte de ce qui précède que R doit être
supérieur à une valeur critique pour observer un effet
de capillarité dans la fente capillaire 5 et pour que
la formation du pont-liquide dans la fente capillaire 5
soit favorisée du point de vue énergétique.
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
37
Le dispositif de nébulisation peut ou non
inclure des zones conductrices (voir la figure 3H). Ces
zones conductrices si elles sont situées au niveau de
réservoir de liquide 4 servent d'électrodes pour amener
la tension de nébulisation. Par contre, si elles se
situent au niveau de la fente capillaire 5, ces
électrodes serviront à modifier les espèces présentes
dans le liquide. Dans le cas d'une application de type
électronébulisation avant analyse par spectrométrie de
masse, des processus électrochimiques interviennent
lors de l'ionisation des molécules. Les zones
conductrices implantées de part et d'autre de la fente
capillaire 5 au niveau de l'extrémité 6 de la pointe 3
permettraient de les étudier. Par ailleurs, ces
phénomènes conduisent à une augmentation du rendement
d'ionisation et, de ce fait, à une amélioration des
conditions d'analyse. Dans le cas d'une application de
type écriture moléculaire, la présence d'une quantité
plus importante d'espèces radicalaires accroît la
vitesse de gravure du substrat.
Néanmoins, suivant la nature du matériau
choisi pour réaliser le support 1 de la source
d'électronébulisation, ces zones conductrices, en
particulier si leur rôle est d'amener la tension de
nébulisation, peuvent ne pas être nécessaires. En
effet, si un matériau conducteur (métal, Si..) est
utilisé pour réaliser le support 1 ou la plaque 2, la
tension sera directement appliquée sur ce matériau
conducteur. Enfin, un dispositif ne comprenant pas de
zones conductrices et pour lequel les matériaux ne sont
pas conducteurs peut- être utilisé en
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
38
électronébulisation pourvu que le contact électrique
soit réalisé via le liquide. Un fil métallique
plongeant dans la solution à nébuliser, au niveau du
réservoir 4 ou tout autre contact conducteur assurera
ainsi le rôle d'application de la tension de
nébulisation.
Le dispositif peut être également connecté
à une source d'alimentation en liquide en amont du
réservoir 4, comme un capillaire amenant une solution
provenant d'un autre appareil, d'une autre structure.
Par exemple, pour une application de type spectrométrie
de masse, le capillaire peut correspondre à une sortie
de colonne de séparation. Pour une application de type
dépôt de gouttes de taille calibrée ou écriture
moléculaire, ce capillaire amène le liquide vers le
dispositif de nébulisation depuis sa localisation
initiale. Ledit capillaire peut être un capillaire
classique commercial en silice fondue. Il peut
également être un capillaire microfabriqué, c'est-à-
dire un microcanal intégré sur le système supportant la
source. Le capillaire peut être une piste hydrophile
matérialisée sur le support 1. Dans ces deux derniers
cas, la plaque 2 est intégrée sur un microsystème
fluidique et joue le rôle d'interface entre ledit
microsystème et le monde extérieur où la solution
sortant du microsystème est utilisée. Enfin, les
propriétés conductrices du dispositif ou d'un de ses
éléments peuvent être utilisées pour alimenter
électriquement tout système en relation fluidique avec
le dispositif.
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
39
De surcroît, lesdites plaques de type plume
peuvent être utilisées de façon isolée ou être
intégrées en grand nombre sur un même support, et ce,
en vue de la parallélisation de la nébulisation. Dans
ce cas, lesdites plaques de type plumes sont
indépendantes ou non les unes des autres et les
solutions nébulisées sont, soit les mêmes afin
d'accroître la nébulisation de ladite solution, soit
différentes et, dans ce cas, les plumes fonctionnent de
façon séquentielle en nébulisation. L'intégration
desdites plaques de type plume peut être réalisée de
façon linéaire avec un alignement desdites plaques sur
un côté du support ou de façon circulaire sur un
support rond. Le passage d'une source à l'autre
s'effectue alors respectivement par translation ou par
rotation du support.
Une large gamme de matériaux est
aujourd'hui envisageable pour des fabrications
microtechnologiques et en particulier de microsystèmes
fluidiques : verre, matériaux à base de silicium (Si,
SiO2, nitrure de silicium...), quartz, céramiques ainsi
qu'un grande nombre de matériaux macromoléculaires,
plastiques ou élastomères.
La géométrie retenue pour la présente
invention est compatible avec des fabrications
utilisant tout type de matériaux, et ce, pour les
différentes parties composant la source
d'électronébulisation : le support 1, la plaque de type
plume 2 et les zones conductrices. Le procédé de
fabrication technologique fait de plus intervenir un ou
plusieurs autre (s) matériau (x) dont le choix est adapté
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
en fonction des matériaux retenus pour les éléments 1,
2 et 3.
Un procédé générique de fabrication de
sources d'électronébulisation selon l'invention est
5 représenté aux figures 3A à 3H. Ce procédé de
fabrication peut être découpé en sept étapes majeures
qui sont détaillées ci-dessous, de façon à être
applicable à n'importe quel type de matériau.
La première étape de ce procédé de
10 fabrication est le choix du substrat destiné à
constituer le support de la source
d'électronébulisation. Ce substrat 10 (voir la figure
3A) peut être en matériau macromoléculaire, en verre ou
bien en silicium ou encore en métal. Dans le cas de cet
15 exemple de réalisation, c'est un substrat de silicium
de 250 pm d'épaisseur.
Le début du procédé conditionne la fin de
la fabrication des dispositifs d'électronébulisation.
Il s'agit de la matérialisation sur le support du
20 dispositif de lignes qui aideront au clivage du
substrat afin de libérer la pointe de la source et
permettre la nébulisation.
Selon la deuxième étape, une couche 11 de
matériau dit de protection est déposée sur une partie
25 du substrat 10. Le matériau de la couche 11 est choisi
en fonction de la nature du matériau du substrat 10 de
façon qu'une attaque de la couche 11 n'affecte pas le
substrat 10. Dans cet exemple de réalisation, la couche
de matériau de protection est une couche d'oxyde de
30 silicium de 20 nm d'épaisseur. La couche 11 est
d'épaisseur variable suivant la nature des matériaux du
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
41
substrat 10 et de la couche 11. La couche 11 est
soumise à une étape de lithographie destinée à révéler
les zones du substrat à attaquer pour définir. des
lignes de clivage délimitant le support de la
structure. Les zones correspondantes de la couche 11
sont attaquées afin de fournir des fenêtres 12 révélant
le substrat 10 (voir la figure 3B). Une fois ces zones
du substrat révélées, elles sont soumises à une attaque
appropriée de façon à matérialiser les lignes de
clivage 13. Enfin, la couche 11 restante est éliminée.
La figure 3C montre le résultat obtenu : les lignes 13,
constituées de tranchées à section en V, délimitant le
support de la structure à obtenir.
Au cours d'une troisième étape, une couche
de matériau sacrificiel est déposée sur le substrat 10.
Cette couche de matériau sacrificiel 14 permettra en
fin de fabrication à la pointe de la structure de
surplomber son support avant l'opération de clivage. Le
substrat 10 est recouvert d'une fine couche de matériau
sacrificiel d'épaisseur suffisante pour que, après sa
suppression, la pointe soit suffisamment séparée du
substrat 10, mais néanmoins suffisamment fine pour
pouvoir s'affranchir de tout problème de contrainte et
de courbure de la pointe en surplomb du support. Dans
cet exemple de réalisation, la couche de matériau
sacrificiel est une couche de nickel de 150 nm
d'épaisseur.
La couche de matériau sacrificiel est
alors, soumise à une étape de lithographie et d'attaque
appropriée afin de ne garder de ce matériau qu'une zone
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
42
14 correspondant à la pointe de la structure (voir la
figure 3D).
La quatrième étape peut être mise en oeuvre.
Le substrat 10 est alors recouvert d'une couche d'un
matériau destinée à constituer la plaque de la
structure. En fonction du matériau du substrat, le
matériau de cette couche peut être du silicium ou à
base de silicium, un métal ou même un matériau de type
polymère ou céramique. Dans cet exemple de réalisation,
la couche de matériau destinée à constituer la plaque
est une couche de 35 pm d'épaisseur en polymère SU-8
2035 acheté sous forme pré-polymérisée chez Microchem
et polymérisé par un procédé photolithographique.
L'épaisseur de cette couche est choisie de façon
appropriée. De cette épaisseur dépendent en effet les
performances en ionisation du dispositif de
nébulisation, comme il a été expliqué précédemment.
L'épaisseur de cette couche influence directement la
hauteur h de la fente capillaire et, d'après ce qui
précède, plus h est grand, plus w doit être grand afin
de ne pas modifier le rapport R. Or, en fonction de
l'application finale de la source de nébulisation,
l'enjeu est de diminuer au maximum w afin d'accroître
les performances. En revanche, si l'épaisseur de la
couche destinée à constituer la plaque est trop fine,
la pointe en surplomb peut se courber une fois décollée
du support du fait des contraintes exercées sur le
matériau. L'homme de l'art est en mesure d'adapter le
présent cahier des charges en fonction de la nature du
matériau de cette couche et ainsi de définir
l'épaisseur optimale de matériau à déposer.
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
43
Cette couche subit alors une étape de
lithographie et une attaque afin de former la plaque de
type plume 2, c'est-à-dire en plus de son encombrement,
le réservoir 4, la fente capillaire 5 et la pointe 3
(voir la figure 3E). Cette attaque est adaptée en
fonction du matériau de la plaque. Il peut s'agir d'une
technique de gravure chimique, d'une attaque physique
dans le cas d'un matériau à base de silicium ou d'un
métal, d'une attaque physique ou d'une
photolithographie suivie d'une révélation dans le cas
d'un polymère photolithographiable.
La cinquième étape peut alors être
entreprise. Une fois la plaque 2 formée, la zone 14 de
matériau sacrificiel sous la pointe 3 peut être ôtée.
Le matériau sacrificiel est ôté par une attaque
chimique appropriée. La solution pour cette attaque
chimique doit être choisie judicieusement de façon à ce
que tout le matériau sacrificiel soit supprimé sans que
ni le support ni plaque ne soient affectés. Les
matériaux de ces éléments ne doivent donc pas être
sensibles à cette solution chimique. On obtient la
structure montrée à la figure 3F.
La sixième étape concerne l'implantation de
zones conductrices sur la structure. Comme mentionné
précédemment, cette étape n'est incluse dans le procédé
de fabrication que s'il est prévu de telles zones
conductrices.
Que ces zones se situent au niveau du
réservoir 4 (application de la tension de nébulisation)
ou au niveau de la pointe (électrodes d'études physico-
chimiques), le procédé le fabrication est le même. La
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
44
réalisation des zones conductrices 3 au niveau du
réservoir seule sera détaillée ici.
Ces zones conductrices peuvent être en
métal ou en carbone. La structure est d'abord soumise à
une étape de masquage afin que seules les zones
correspondant à la formation des zones conductrices
soient dégagées. Le matériau conducteur choisi est
alors déposé par une technique de PECVD (déposition en
phase vapeur par techniques de plasma chimique) sur la
structure. Dans cet exemple de réalisation, les zones
conductrices sont en palladium et ont une épaisseur de
400 nm. La figure 3G montre la structure obtenue. Deux
zones conductrices 7 et 8 encadrent le réservoir 4 et
permettent d'y appliquer un potentiel électrique.
La septième étape de ce procédé de
fabrication de la source de nébulisation est le
détachement du support 1 par rapport au substrat 10 et
notamment, la mise en surplomb de la pointe 3 par
rapport au support 1 en utilisant les lignes de clivage
13 matérialisées à la deuxième étape de ce procédé de
fabrication. La structure obtenue est représentée à la
figure 3H.
Une technique de clivage avantageuse est
illustrée par les figures 4A et 4B dans le cas de la
mise en surplomb de la pointe. Un fil métallique fixe
20 est placé sous le support 1 au niveau des tranchées
de clivage 13 réalisées de part et d'autre de la
pointe. Conjointement, deux forces sont exercées sur le
substrat aux endroits indiqués sur la figure 4A par des
flèches. La séparation préalablement effectuée de la
pointe 3 par rapport au support 1 assure ainsi de ne
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
pas endommager là pointe lors de l'étape de clivage. La
figure 4B montre le clivage en cours de réalisation.
Ce procédé de fabrication générique est
ensuite adapté en fonction des matériaux choisis pour
5 chaque élément de la source d'électronébulisation.
Le premier champ d'applications ciblé par
la présente invention est l'électronébulisation de
solutions biologiques ou chimiques à analyser par
spectrométrie de masse. La spectrométrie de masse est à
10 l'heure actuelle la technique de choix pour l'analyse,
la caractérisation et l'identification des protéines.
Or, depuis la fin du décryptage du génome, les
biologistes notamment s'intéressent de plus en plus à
la protéomique, science qui vise à étudier et à
15 caractériser l'ensemble des protéines d'un individu.
Ces protéines, chez tout être humain, sont présentes à
raison de plus de 106 molécules différentes en incluant
les modifications post-traductionnelles. Ce point
justifie le besoin à l'heure actuelle, de techniques et
20 d'outils d'analyse compatibles avec une automatisation
en vue d'une analyse à haut débit, et ce, notamment
pour la spectrométrie de masse du fait de sa pertinence
dans le cadre de l'étude des protéines. Les
échantillons (ou solutions à analyser) dont dispose le
25 biologiste sont souvent de taille restreinte
(inférieure ou égale au 1 pL) et contiennent peu de
matériel biologique, ce qui impose de travailler avec
une technique d'analyse très sensible et consommant peu
d'échantillon. Ceci fait de la spectrométrie de masse
30 avec une ionisation par nanoélectronébulisation une des
techniques d'analyse les plus utilisées pour la
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
46
caractérisation des protéines. Dans ce contexte,
l'enjeu majeur est la diminution au maximum des
dimensions de l'extrémité de la pointe de la source. En
effet, comme mentionné dans l'introduction, il existe
deux régimes d'électronébulisation pour ce type
d'application, le plus intéressant en termes
d'automatisation et de gain en sensibilité étant le
régime de nanoélectronébulisation. Cependant, à l'heure
actuelle, la vitesse d'analyse est limitée, le débit
d'échantillons restreint du fait que la nanoESl-MS
(pour "nano ElectroSpray Ionization - Mass
Spectrometry") repose entièrement sur des processus
manuels. Les outils actuels ne se prêtent pas à une
analyse robotisée et automatisée. Ce contexte explique
les motivations pour le développement de la présente
invention pour ce type d'applications.
Le deuxième type d'applications ciblé par
la présente invention est le dépôt de gouttes calibrées
sur une surface lisse ou rugueuse. Ceci est de prime
intérêt pour la préparation de puces à ADN, à peptides,
à PNA ou tout autre type de molécules. Ce type
d'applications requiert un dispositif capable de
délivrer du fluide sous forme discrète, des gouttes de
liquide de taille calibrée, la taille dépendant le plus
souvent de la résolution espérée dans la préparation
des plaques d'analyse. Plus les gouttes sont petites,
plus leur dépôt peut être rapproché sur la plaque et
plus la densité en dépôts et donc en substances à
analyser est grande. Le dispositif faisant l'objet de
la présente invention peut être utilisé à cette fin. La
largeur de la fente capillaire 5, ainsi que la valeur
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
47
de la tension appliquée pour l'éjection des gouttes
conditionne la taille des gouttes éjectées par ledit
dispositif de nébulisation. Ainsi la résolution des
plaques d'analyse peut-elle être ajustée en fonction de
la largeur de la fente du dispositif. Enfin, la tension
de nébulisation peut être alternative et ainsi donner
une vitesse de dépôt en gouttes/minute dépendant
directement de la fréquence de la tension alternative.
Le dépôt de gouttes calibrées comme présenté ci-dessus
peut être utilisé pour la préparation de plaques
d'analyse comme les puces à ADN. Il peut aussi être
appliqué à la préparation de cibles MALDI (pour
"Matrix-Assisted Laser Desorption/Ionization") sur
lesquelles les échantillons à analyser par
spectrométrie de masse avec une ionisation MALDI ici,
sont déposés de façon discrète avant leur
cristallisation et leur introduction dans le
spectromètre de masse. Ainsi, le présent dispositif de
nébulisation ayant une géométrie de type plume peut-il
être par exemple connecté en sortie de colonne de
séparation et permettre un couplage entre une technique
séparative et une analyse en ligne par spectrométrie de
masse de type MALDI. Les gouttes de liquide enfin
peuvent être remplacées par des cellules. Dans ce cas,
les cellules sont de même éjectées de façon discrète et
déposées par exemple sur une plaque en vue de
l'élaboration de puces à cellules.
La troisième application ciblée par la
présente invention est l'écriture moléculaire à des
échelles de l'ordre de la centaine de nanomètres. A
l'heure actuelle, ce type d'opérations est réalisé à
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
48
l'aide de pointes de microscopie AFM, fonctionnant à
l'aide d'un appareillage lourd et encombrant.
L'éjection du liquide repose sur une mise en contact ou
quasi-contact de la pointe et du substrat de dépôt dans
le cas de l'AFM ou sur l'application d'une pression sur
le liquide. Une adaptation de cette technique est
d'éjecter le liquide sous l'action d'une tension et non
à l'aide d'une pression ou d'une mise en contact. En
effet, dans les deux cas, l'éjection est provoquée
lorsque les forces de tension du liquide au niveau de
la pointe de la pipette sont dépassées par une
autre force appliquée à la colonne de liquide. Ceci est
envisageable avec un dispositif d'électronébulisation
où la force électrique vient surpasser celle de tension
du liquide et ainsi engendrer la formation de
gouttelettes. D'autre part, la formation d'espèces
réactives est intrinsèque au processus
d'électronébulisation. Cette technique d'éjection du
fluide supprime tout appareillage complexe de
production d'espèces réactives comme des radicaux
libres, tel qu'une décharge plasma ou micro-onde, en
amont de la structure qui délivre le liquide.
La présente invention peut donc être
utilisée à de telles fins d'écriture moléculaire sur un
substrat lisse ou rugueux, la libération de la solution
d'écriture (pseudo-encre) étant ici régie par
application d'une tension. De même que pour le premier
champ d'applications, un enjeu majeur est de minimiser
la taille de l'extrémité de la pointe, cette dimension
conditionnant la taille des éjections par nébulisation
et par conséquent la résolution espérée en écriture sur
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
49
le substrat final. La largeur de la pointe est
inférieure ou égale au micromètre. Un autre facteur
influençant la taille des éjections et le débit de
fluide est la tension de nébulisation appliquée au
liquide. Enfin, la production d'espèces réactives, si
le dispositif est utilisé pour dispenser une solution
d'attaque du substrat, peut être accrue avec
l'implantation d'électrodes au sein de la structure de
type plume qui délivre le fluide. Ces électrodes sont
alors le siège de réactions électrochimiques conduisant
à la formation d'espèces réactives.
On va maintenant s'intéresser aux exemple
suivants.
Exemple 1 : Design de sources de
nanoélectronébulisation microfabriquées selon la
présente invention.
Un premier exemple concerne les dimensions
et les formes choisies pour réaliser un dispositif de
nébulisation comme décrit dans la présente invention.
Ce premier dispositif présente de petites
dimensions en sa pointe du fait du domaine
d'applications visé, c'est-à-dire une
nanoélectronébulisation pour l'ionisation de solutions
avant leur analyse par spectrométrie de masse. Le
dispositif est réalisé conformément aux figures 1A et
1B. Le réservoir 4 du dispositif a pour dimensions
2,5 mm x 2,5 mm x e (}gym) où e est l'épaisseur de la
couche de matériau utilisée pour réaliser la plaque 2.
La valeur de e est proche de celle de h, considérée ci-
après, l'épaisseur de matériau sacrificiel étant de
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
l'ordre de la centaine de nanomètres. La largeur de la
fente capillaire 5 est de 8 pm à l'extrémité 6 de la
pointe 3. De la valeur de cette largeur de fente
découle l'épaisseur de la plaque 2 de façon à observer
5 l'effet de capillarité et la pénétration effective du
liquide dans la fente capillaire 5. Ceci est régi par
la valeur du paramètre R défini comme le rapport entre
la hauteur h et la largeur w de la fente, R = h/w. Il
apparaît que ce rapport doit être supérieur à 1 pour
10 que l'effet de capillarité soit observé. Ainsi,
l'épaisseur de la plaque doit-elle être supérieure à
une dizaine de micromètres. Par ailleurs, pour
s'affranchir des problèmes de contraintes mécaniques
qui se traduisent par un recourbement de la structure
15 en extrémité 6, cette épaisseur a été fixée à 35 }gym.
Exemple 2 : Fabrication des sources de
design décrit dans l'exemple 1 à l'aide des matériaux
silicium et SU-8.
20 Le deuxième exemple concerne la fabrication
par microtechnologie des sources de nébulisation, comme
décrit dans l'exemple 1. Les matériaux utilisés sont le
silicium pour le support 1 et la résine
photolithographiable négative SU-8 pour la plaque de
25 type plume 2. Le procédé de fabrication découle du
procédé décrit ci-dessus. Il est adapté aux matériaux
choisis.
Un substrat de silicium orienté (100) et
dopé n, de 3 pouces, est recouvert d'une couche de 200
30 nm d'oxyde de silicium (Si02), puis masqué par
lithographie. La couche de Si02 est attaquée par une
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
51
solution acide de HF:H20 sur les zones non masquées. Le
silicium exposé est ensuite attaqué par une solution de
soude (KOH) de façon à matérialiser les lignes de
clivage. Une couche de 150 nm de nickel est ensuite
déposée sur la surface de silicium par technique de
pulvérisation sous argon (Plassys MP 450S). La couche
de nickel est attaquée de façon locale par
photolithographie UV (résine positive photosensible
AZ1518 [1 , 2}im] , solution de gravure HN03/H20 (1:3)) de
façon à ce qu'il ne reste du nickel que sous la pointe
de la plume. Après suppression de toute trace de résine
photolithographiable, la plaque de silicium est
déshydratée à 170 C pendant 30 min, de façon à
optimiser l'adhésion de la résine SU-8 sur la surface
de silicium. Une couche de 35 pm de résine SU-8 est
étalée sur le substrat de silicium à l'aide d'une
tournette pour en homogénéiser l'épaisseur avant
l'étape suivante de photolithographie. La plaque de
type plume 2 est réalisée dans cette couche de résine
SU-8 à l'aide de techniques classiques de
photolithographie UV. Après développement de la résine
SU-8 avec le réactif approprié (acétate de 1-méthoxy-2-
propanol, PGMEA), la couche de nickel est attaquée avec
la solution acide (HN03/H20) décrite ci-dessus. Cette
étape d'attaque chimique du nickel n'affecte pas la
résine SU-8 même si ce procédé peut prendre plusieurs
heures. Enfin, après séchage du dispositif, le substrat
1 de silicium est scié selon la technique illustrée aux
figures 4A et 4B. La technique utilisée ici préserve la
structure de la plume, comme cette dernière a été
auparavant décollée de son support. Une photographie de
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
52
microscopie électronique à balayage (Hitachi S4700) de
la source de nébulisation de type plume fabriquée selon
ce procédé confirme le décollement correct de la pointe
par rapport àson support.
Le procédé de fabrication décrit ci-dessus
n'inclut pas la réalisation d'électrodes.
Exemple 3 : Design de dispositif d'éjection
de particules d'une centaine de micromètres.
Un troisième exemple concerne les
dimensions et les formes choisies pour réaliser un
dispositif d'éjection de particules ayant une taille
d'une centaine de micromètres, comme décrit dans la
présente invention.
Ce dispositif présente des dimensions plus
larges que celui décrit dans l'exemple 1. Ici, les
dimensions de la fente de capillaire 5 et du réservoir
4 doivent être compatibles avec la manipulation
d'objets d'une centaine de micromètres. Du fait de
cette gamme de dimensions, le dispositif décrit dans
l'exemple 3 s'applique également à la manipulation de
cellules de taille avoisinant 100 im de diamètre, pour
la préparation de puces à cellules par exemple.
Le réservoir 4 dudit dispositif a pour
dimensions 1 cm x 1 cm x e (}gym) où e est l'épaisseur de
la plaque 2. De même que dans l'exemple 1, la valeur de
e est définie en fonction de la largeur de la fente
capillaire 5 de façon à avoir un facteur de forme R en
l'extrémité 6 de la plaque qui soit supérieur à 1. Les
particules manipulées par ce dispositif ont une taille
de la centaine de micromètres, donc la fente capillaire
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
53
doit avoir une largeur supérieure à 100 pm.
Cependant, les particules pouvant avoir tendance à
s'agréger, cette largeur ne doit pas être choisie trop
grande. Elle est de préférence voisine du double de la
5 taille des particules manipulées. De ce fait, la
largeur de la fente est fixée à 150 pm, et l'épaisseur
de la plaque à 200 }gym.
Le matériau retenu pour la fabrication de
la plaque de type plume 2 est ici encore la résine
photolithographiable négative SU-8 et le matériau
choisi pour le support 1 est le verre. La résine SU-8
est intéressante ici pour la manipulation de particules
comme les cellules, car ces cellules n'adhèrent pas sur
ce matériau. De ce fait, le support 1 en verre est lui
aussi couvert d'une fine couche de résine SU-8 afin de
prévenir toute adhésion non désirée des cellules sur le
dispositif.
Exemple 4 : Test des sources de
nébulisation fabriquées selon l'exemple 2 en
spectrométrie de masse. I : Application de la tension à
l'aide d'un fil de platine.
L'exemple 4 est le test des sources de
nébulisation fabriquées comme décrit dans l'exemple 2
pour une analyse en spectrométrie de masse. Dans ce
premier exemple, la tension de nébulisation est
appliquée à du liquide à nébuliser à l'aide d'un fil de
platine plongé dans le liquide au niveau du réservoir
comme illustré sur la figure 5.
Le dispositif de nébulisation est placé sur
une pièce mobile 30 pouvant être déplacée en xyz. Cette
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
54
pièce mobile 30 comporte une partie métallique 31 sur
laquelle est appliquée la tension d'ionisation dans le
spectromètre de masse 25. Le support 1 de silicium est
précautionneusement isolé de cette partie métallique 31
lors de la fixation du dispositif sur ladite pièce
mobile 30 du fait des propriétés semi-conductrices de
ce matériau. Le contact électrique entre la partie
métallique 31 et le réservoir du dispositif est assuré
à l'aide d'un fil de platine 32 introduit dans le
réservoir et qui plonge dans la solution à analyser 33.
La solution utilisée pour les tests de nébulisation,
une solution de peptide standard (Gramicidine S), est
déposée dans le réservoir du dispositif et la pièce
mobile 30 est introduite dans l'entrée du spectromètre
de masse 25. Les tests sont effectués sur un
spectromètre de masse de type trappe ionique de chez
Thermo Finnigan (LCQ DECA XP+). La tension est alors
appliquée au liquide. Une caméra installée sur la
trappe ionique permet de visualiser la formation du
cône de Taylor, une fois la tension appliquée. La fente
capillaire à une largeur de 8 pm.
La figure. 6 est un graphe représentant le
courant ionique total enregistré par le spectromètre de
masse pour une expérience menée pendant 2 minutes avec
une solution de Gramicidine S à 5 pM et une tension
d'ionisation à 0,8 W. L'axe des ordonnées représente
l'intensité relative IR. L'axe des abscisses représente
le temps. La figure 7 correspond au spectre de masse
obtenu avec une solution de Gramicidine S à 5 pM et une
tension de 1,2 W. Le spectre de masse a été moyenne
sur 2 minutes d'acquisition du signal soit 80 scans.
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
Exemple 5 Test des sources de
nébulisation fabriquées selon l'exemple 2 en
spectrométrie de masse. II : Application de la tension
5 sur le support en silicium
L'exemple 5 est proche de l'exemple 4, mais
ici la tension n'est pas appliquée à l'aide d'un fil de
platine mais en exploitant les propriétés semi-
conductrices du silicium.
10 L'exemple 5 est donc le test en
spectrométrie de masse de sources de nébulisation
fabriquées selon l'exemple 2 avec une application de la
tension d'ionisation sur le matériau constituant le
support 1 du dispositif de nébulisation.
15 De même que précédemment, le dispositif de
nébulisation est fixé sur une pièce mobile 40 pouvant
être déplacée en xyz et comportant une partie
métallique 41. Ici, le support 1 de silicium est mis en
contact électrique avec la partie métallique 41 de la
20 pièce mobile 40 sur laquelle est appliquée la tension
d'ionisation dans le spectromètre de masse 25. Le
dispositif est fixé sur la partie mobile 40 à l'aide
d'un ruban de téflon qui entoure le dispositif en amont
du réservoir. Le test est conduit comme précédemment
25 après introduction de la pièce mobile 40 dans la trappe
ionique 25 et application de la tension. La fente
capillaire possède une largeur de 8 pm.
Les tests ont été menés avec un autre
peptide standard le Glu-Fibrinopeptide B. Les tensions
30 d'ionisation, ici, sont dans la même gamme que
précédemment, de 1 à 1,4 kV pour des concentrations en
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
56
peptide inférieures à 1 pM. La figure 9 représente le
courant ionique total mesuré pendant 3 minutes
d'acquisition du signal avec une solution à 0,1 pM et
une tension de 1,1 W. IR est l'intensité relative et t
le temps. La figure 10 est le spectre de masse obtenu
pour cette acquisition et moyenné sur la période de 3
minutes soit 120 scans. IR est l'intensité relative.
Exemple 6 : Test des sources de
nébulisation fabriquées selon l'exemple 2 en
spectrométrie de masse. III : Expérience de
fragmentation (MS/MS).
L'exemple 6 est identique à l'exemple 5 sur
la façon de conduire le test. Le montage de test est
identique à celui de l'exemple précédent, le dispositif
de nébulisation correspond à celui décrit dans
l'exemple 1 et réalisé selon le procédé de fabrication
décrit dans l'exemple 2. La tension est appliquée
directement sur le matériau du support 1, le silicium,
via la zone métallique 41 incluse sur la pièce mobile
40 introduite dans le spectromètre de masse 25 (voir la
figure 8). La fente capillaire a une largeur de 8 pm.
La solution est la même que précédemment,
une solution de peptide standard, le Glu-Fibrinopeptide
B à des concentrations inférieures ou égales à 1 pM.
Ici, le peptide est soumis à une expérience de
fragmentation. Le peptide sous forme dichargée (M+2H)2*
est spécifiquement isolé dans la trappe ionique et est
fragmenté (paramètre d'énergie de collision normalisée
de 30%, facteur d'activation de radiofréquence fixé à
0,25).
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
57
La figure 11 représente le spectre de
fragmentation obtenu lors de cette expérience avec une
solution à 0,1 pM et une tension de 1,1 kV. IR est
l'intensité relative. Le spectre a été moyenne sur 2-3
minutes d'acquisition du signal de nébulisation. Les
différents fragments de MS/MS sont annotés avec leur
séquence.
Exemple 7 : Test des sources de
nébulisation fabriquées selon l'exemple 2 en
spectrométrie de masse. IV : Application à l'analyse
d'un mélange biologique.
L'exemple 7 est identique à l'exemple 5
(même dispositif fabriqué selon le même procédé et
testé dans les même conditions avec application de la
tension sur le support 1 en silicium) sauf que
l'échantillon analysé ici n'est plus un peptide
standard mais un mélange complexe de peptides obtenu
par digestion d'une protéine, le Cytochrome C. Ce
digestat se compose de 13 peptides de longueurs et de
propriétés physico-chimiques différentes. Ce digestat
est testé à une concentration de 1 pM et avec une
tension d'ionisation de 1,1-1,2 kV. La largeur de la
fente capillaire est de 8 }gym.
La figure 12 représente le spectre de masse
obtenu pour le digestat de Cytochrome C à 1 pM avec une
tension de 1,2 kV. IR est l'intensité relative. Les
pics sont annotés avec la séquence du fragment ainsi
que son état de charge. Sur les 15 peptides, 11 sont
clairement identifiés lors de cette expérience.
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
58
Exemple 8 : Test des sources de
nébulisation fabriquées selon l'exemple 2 en
spectrométrie de masse. V : Alimentation dudit
dispositif en continu à l'aide d'un pousse-seringue ou
d'une chaîne de nanoLC placé en amont.
L'exemple 8 est identique à l'exemple 5
(même dispositif fabriqué selon le même procédé et
testé dans les même conditions avec application de la
tension sur le support 1 en silicium) sauf que
l'échantillon analysé ici est amené sur ledit
dispositif en continu par un capillaire connecté à un
pousse-seringue ou une chaîne de nanoLC en amont.
Pour le couplage à un pousse-seringue, le
débit de liquide a été fixé à 500 nL/min. La solution
pour ce test est identique à celle de l'exemple 5, sauf
que la concentration du peptide Glu-Fibrinopeptide B
est ici de 1 pM et la tension de nébulisation a été
fixée à 1,2 W. La largeur de la fente capillaire est
de 8 pm.
La figure 13 présente le courant ionique
total enregistré lors d'un test de nébulisation mené
sur une période de 6 minutes dans lesdites conditions.
ZR est l'intensité relative et t le temps. La figure 14
représente le spectre de masse correspondant et moyenne
sur cette période d'acquisition de 6 minutes soit 240
scans. ZR est l'intensité relative.
Le couplage à une chaîne de nanoLC
(chromatographie liquide à un débit de 1 à 1000 nL/min)
a été effectué avec des conditions classiques de
couplage entre une séparation sur nanoLC et une analyse
en ligne par spectrométrie de masse sur une trappe
CA 02545213 2006-05-08
WO 2005/046881 PCT/FR2004/050580
59
ionique. Le débit de fluide est de 100 nL/min, la
tension d'ionisation de 1,5 kV. L'expérience de
séparation est effectuée sur un digestat de Cytochrome
C à 800 fmol/pL et 800 fmol de ce digestat sont
injectés sur la colonne de séparation. La largeur de la
fente capillaire est de 10 pm. La figure 15 représente
le courant ionique total détecté sur le spectromètre de
masse lors de l'expérience de séparation. IR est
l'intensité relative et t le temps. La figure 16 est le
spectre de masse obtenu pour le pic indiqué sur la
figure 15 au temps de rétention de 23,8 min. Il
correspond à l'élution et à l'analyse du fragment 92-99
du Cytochrome C. IR est l'intensité relative.