Note: Descriptions are shown in the official language in which they were submitted.
CA 02546387 2006-05-12
-1-
La présente invention concerne de nouveaux dérivés de
phénylpyridinylpipérazine, leur
procédé de préparation et les compositions pharmaceutiques qui les
contiennent.
Les composés de la présente invention sont particulièrement intéressants d'un
point de vue
pharmacologique pour leur interaction spécifique avec les récepteurs
histaminergiques centraux
de type H3, trouvant leur application dans le traitement des neuropathologies
associées au
vieillissement cérébral, des troubles de l'humeur, du comportement alimentaire
et du rythme
veille-sommeil, ainsi que du syndrome d'hyperactivité avec déficits
attentionnels.
Le vieillissement de la population par augmentation de l'espérance de vie à la
naissance a
entraîné parallèlement un large accroissement de l'incidence des
neuropathologies liées à
l'âge et notamment de la maladie d'Alzheimer. Les principales manifestations
cliniques du
vieillissement cérébral et surtout des neuropathologies liées à l'âge, sont
les déficits des
fonctions mnésiques et cognitives qui peuvent conduire à la démence.
Au niveau du système nerveux central, de récentes études neuropharmacologiques
ont montré
que l'histamine via les systèmes histaminergiques centraux jouait un rôle de
neurotransmetteur ou neuromodulateur en situations physiologiques ou
physiopathologiques
(Annu. Rev. Neurosci., 1986, 9, 209-254; Physiol. Rev., 1991, 71, 1-51).
Ainsi, il a été
montré que l'histamine intervenait dans divers processus physiologiques et
comportementaux
tels que la thermorégulaton, la régulation neuro-endocrinienne, le rythme
circadien, les états
cataleptiques, la motricité, l'agressivité, le comportement alimentaire,
l'apprentissage et la
mémorisation, ainsi que la plasticité synaptique (Hass et coll., histaminergic
neurones
morphology and function, Boca Raton, FL : CRC Press, 1991, pp. 196-208 ; Prog.
Neurobiology, 2001, 63, 637-672).
Parmi les 3 sous-types de récepteurs (Hl, HZ et H3) à l'histamine, il a été
initialement montré
que le récepteur de type H3 était un autorécepteur pré-synaptique qui
contrôlait la libération
de l'histamine (Nature, 1987, 327, 117-123). Son activation inhibe la
libération et la synthèse
d'histamine par un mécanisme de feedback négatif (Neuroscience, 1987, 23, 149-
157). Par la
suite, il a été montré l'existence d'hétérorécepteurs pré-synaptiques,
capables de moduler la
libération de quelques neuropeptides et de nombreux neurotransmetteurs tels
que
noradrénaline, sérotonine, dopamine, GABA, acétylcholine et glutamate (TiPS,
1998, 19,
177-183). Des études, réalisées chez l'animal, ont montré que l'augmentation
des taux
CA 02546387 2006-05-12
-2-
endogènes extra-synaptiques d'histamine via le blocage des récepteurs de type
H3 par des
antagonistes H3 permettait de promouvoir les états de vigilance, les processus
d'apprentissage
et de mémoire, de réguler la prise alimentaire, et de s'opposer à des crises
convulsives (Prog.
Neurobiol., 2000, 63, 637-672; Neurosci. Biobehav. Rev., 2000, 24, 107-113).
En
S conséquence, les indications thérapeutiques potentielles pour des
antagonistes H3 sont le
traitement des déficits cognitifs associés au vieillissement cérébral et aux
maladies
neurodégénératives telles que la maladie d'Alzheimer, la maladie de Parkinson,
la maladie de
Pick, la maladie de Korsakoff et les démences frontales ou sous-corticales
d'origine vasculaires
ou autres, ainsi que le traitement des troubles de l'humeur, des crises
convulsives, du syndrome
d'hyperactivité avec déficits attentionnels, de l'obésité, de la douleur et
des états narcoleptiques.
Les composés de la présente invention, outre leur originalité structurale,
présentent des
propriétés pharmacologiques tout à fait surprenantes et intéressantes dans ce
domaine.
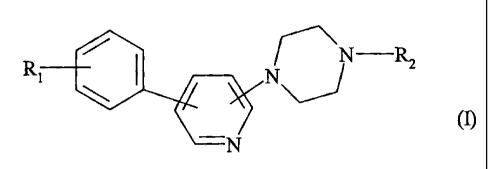
Plus spécifiquement, la présente invention concerne les composés de formule
(I)
~N R2
R N
_ (n
N
dans laquelle
Rl représente un groupement NR3S02R4 dans lequel
- R3 représente un atome d'hydrogène ou un groupement alkyle (C1-C6) linéaire
ou ramifié,
- R4 représente un groupement alkyle (C1-C6) linéaire ou ramifié, un
groupement aryle
ou un groupement NR5R6 dans lequel
RS et R6, identiques ou différents, représentent chacun un atome d'hydrogène
ou
un groupement alkyle (C1-C6) linéaire ou ramifié, cycloalkyle (C3-Cg) ou
cycloalkyl (C3-C8) alkyle (C1-C6) linéaire ou ramifié,
ou RS et R6 forment ensemble avec l'atome d'azote qui les porte un cycle
comportant de 5 à 8 chaînons dont un des atomes de carbone peut être remplacé
par un atome d'azote, d'oxygène ou de soufre, ou par un groupement SO ou SOZ,
CA 02546387 2006-05-12
-3-
le cycle ainsi défini pouvant être ponté par une chaîne alkyle(Cl-C6) linéaire
ou
ramifiée et/ou pouvant être éventuellement substitué par un ou plusieurs
groupements, identiques ou différents, choisis parmi halogène, alkyle (C1-C6)
linéaire ou ramifié, alkoxy (C~-C6) linéaire ou ramifié, polyhalogénoalkyle
(C1-C6)
S linéaire ou ramifié, carboxy, hydroxy, cyano, nitro, amino (éventuellement
substitué par un ou plusieurs groupements alkyle (C1-C6) linéaire ou ramifié),
Rz représente un groupement alkyle (C1-C6) linéaire ou ramifié, un groupement
cycloalkyle
(C3-C8), ou un groupement cycloalkyle (C3-Cg) alkyle (C1-C6) dans lequel la
partie alkyle
peut être linéaire ou ramifiée,
étant entendu que
par groupement aryle, on comprend les groupements phényle, naphtyle et
biphényle, ces
groupements étant éventuellement substitués par un ou plusieurs groupements,
identiques ou
différents, choisis parmi halogène, alkyle (C1-C6) linéaire ou ramifié, alkoxy
(C1-C6) linéaire
ou ramifié, polyhalogénoalkyle (C1-C6) linéaire ou ramifié, carboxy, hydroxy,
cyano, nitro,
amino (éventuellement substitué par un ou plusieurs groupements alkyle (C1-C6)
linéaire ou
ramifié),
leurs énantiomères et diastéréoisomères ainsi que leurs sels d'addition à un
acide ou à une
base pharmaceutiquement acceptable.
Parmi les acides pharmaceutiquement acceptables, on peut citer, à titre non
limitatif, les
acides chlorhydrique, bromhydrique, sulfurique, phosphonique, acétique,
trifluoroacétique,
lactique, pyruvique, malonique, succinique, glutarique, fumarique, tartrique,
maléïque,
citrique, ascorbique, méthane sulfonique, camphorique, etc...
Parmi les bases pharmaceutiquement acceptables, on peut citer, à titre non
limitatif,
l'hydroxyde de sodium, l'hydroxyde de potassium, la triéthylamine, la
tertbutylamine, etc...
Plus particulièrement, l'invention concerne les composés de formule (I) pour
lesquels R4
représente un groupement alkyle, comme le groupement méthyle par exemple.
CA 02546387 2006-05-12
-4-
Le groupement R3 préféré est l'atome d'hydrogène.
Avantageusement, l'invention concerne les composés de formule (I) pour
lesquels RS et Rb
forment ensemble avec l'atome d'azote qui les porte un cycle comportant de 5 à
8 chaînons
dont un des atomes de carbone peut être remplacé par un atome d'azote,
d'oxygène ou de
soufre ou par un groupement SO ou SOZ comme le groupement morpholine par
exemple.
Les groupements RZ préférés sont les groupements isopropyle, cyclopropyle et
cyclopentyle.
Encore plus particulièrement, l'invention concerne les composés de formule (I)
qui sont
~ le N {4-[6-(4-isopropylpipérazin-1-yl)pyridin-3-yl]phényl}benzènesulfonamide
dichlorhydrate,
~ le N {4-[6-(4-cyclopentylpipérazin-1-yl)pyridin-3-
yl]phényl}benzènesulfonamide dichlorhydrate,
~ leN [4-[6-(4-cyclopentyl-1-pipérazinyl)-3-pyridinyl]phényl]-
méthanesulfonamide, dichlorhydrate,
~ le N {4-[6-(4-cyclopropylpipérazin-1-yl~yridin-3-
yl]phényl}méthanesulfonamide dihydrochloride,
~ leN {4-[6-(4-isopropylpipérazin-1-yl~yridin-3-yl]phényl}morpholine-4-
sulfonamidedichlorhydrate,
~ N-{4-[6-(4-isopropylpipérazin-1-yl)pyridin-3-yl]phényl}méthanesulfonamide
dichlorhydrate,
~ N {4-[6-(4-isopropylpipérazin-1-yl)pyridin-3-yl]phényl}propane-2-sulfonamide
dichlorhydrate,
~ N {4-[6-(4-cyclopentylpipérazin-1-yl)pyridin-3-yl]phényl}-4-fluorobenzène
sulfonamide
dichlorhydrate,
~ N {4-[6-(4-cyclopentylpipérazin-1-yl)pyridin-3-yl]phényl}-3-fluorobenzène
sulfonamide
dichlorhydrate,
~ N {4-[6-(4-cyclopentylpipérazin-1-yl)pyridin-3-yl]phényl}-2-fluorobenzène
sulfonamide
dichlorhydrate.
CA 02546387 2006-05-12
-5-
L'invention concerne également le procédé de préparation des composés de
formule (I)
caractérisé en ce que l'on utilise comme produit de départ le composé de
formule (II)
R ~ COR
B~ (II)
OR'
dans laquelle Rl est tel que défini dans la formule (I) et R et R', identiques
ou différents,
représentent chacun un atome d'hydrogène ou un groupement alkyle (C1-C6)
linéaire ou
ramifié, ou forment ensemble une chaîne alkylène (C~-C6) linéaire ou ramifiée,
sur lequel on condense en présence de palladium (0) un composé de formule
(III)
N\ N RZ
Ha ~l
N
dans laquelle R2 est tel que défini dans la formule (I) et Hal représente un
atome d'halogène,
pour conduire au composé de formule (I),
composé de formule (I) que l'on purifie, le cas échéant, selon une technique
classique de
purification, dont on sépare éventuellement les isomères, selon une technique
classique de
séparation, et que l'on transforme, si on le souhaite, en ses sels d'addition,
à un acide ou à une
base pharmaceutiquement acceptable.
Les composés de formule (II) et (III), tels que définis précédemment, sont
commerciaux ou
obtenus par des réactions classiques de la chimie organique.
Les composés de la présente invention, de par leurs propriétés
pharmacologiques de ligands
histaminiques du récepteur H3, sont utiles dans le traitement des déficits
cognitifs associés au
vieillissement cérébral et aux maladies neurodégénératives telles que la
maladie d'Alzheimer,
la maladie de Parkinson, la maladie de Pick, la maladie de Korsakoff et les
démences
frontales ou sous-corticales d'origine vasculaires ou autres, ainsi que le
traitement des
CA 02546387 2006-05-12
-6-
troubles de l'humeur, des crises convulsives, du syndrome d'hyperactivité avec
déficits
attentionnels, de l'obésité, de la douleur et des états narcoleptiques.
La présente invention a également pour objet les compositions pharmaceutiques
renfermant
comme principe actif au moins un composé de formule (I), un de ses isomères,
ou un de ses
S sels d'addition à un acide ou à une base pharmaceutiquement acceptable, seul
ou en
combinaison avec un ou plusieurs excipients ou véhicules inertes, non
toxiques,
pharmaceutiquement acceptables.
Parmi les compositions pharmaceutiques selon (invention, il sera cité plus
particulièrement
celles qui conviennent pour fadministration orale, parentérale (intraveineuse,
intramusculaire,
ou sous-cutanée), per ou trans-cutanée, intravaginale, rectale, nasale,
perlinguale, buccale,
oculaire ou respiratoire.
Les compositions pharmaceutiques selon l'invention pour les injections
parentérales
comprennent notamment les solutions stériles aqueuses et non aqueuses, les
dispersions, les
suspensions ou émulsions ainsi que les poudres stériles pour la reconstitution
des solutions ou
des dispersions injectables.
Les compositions pharmaceutiques selon l'invention, pour les administrations
orales solides,
comprennent notamment les comprimés simples ou dragéifiés, les comprimés
sublinguaux,
les sachets, les gélules, les granules, et pour les administrations liquides
orales, nasales,
buccales ou oculaires, comprennent notamment les émulsions, les solutions, les
suspensions,
les gouttes, les sirops et les aérosols.
Les compositions pharmaceutiques pour (administration rectale ou vaginale sont
préférentiellement des suppositoires, et celles pour l'administration per ou
trans-cutanée
comprennent notamment les poudres, les aérosols, les crèmes, les pommades, les
gels et les
patchs.
Les compositions pharmaceutiques citées précédemment illustrent l'invention
mais ne la
limitent en aucune façon.
CA 02546387 2006-05-12
_7_
Parmi les excipients ou véhicules inertes, non toxiques, pharmaceutiquement
acceptables, on
peut citer à titre indicatif et non limitatif les diluants, les solvants, les
conservateurs, les agents
mouillants, les émulsifiants, les agents dispersants, les liants, les agents
gonflants, les agents
désintégrants, les retardants, les lubrifiants, les absorbants, les agents de
suspension, les
colorants, les aromatisants, etc...
La posologie utile varie selon l'âge et le poids du patient, la voie
d'administration, la
composition pharmaceutique utilisée, la nature et la sévérité de l'affection,
et la prise de
traitements associés éventuels. La posologie s'échelonne de 10 mg à 1 g en une
ou plusieurs
prises par~our.
Les préparations et exemples suivants illustrent l'invention mais ne la
limitent en aucune façon.
Les produits de départ utilisés sont des produits connus ou préparés selon des
modes
opératoires connus.
Les structures des composés, décrits dans les exemple, ont été déterminées
selon les
techniques spectrophotométriques usuelles (infrarouge, RMN, spectrométrie de
masse...).
1 S Prs ~raüc~n 1 : 1-(5-~romc~pyridin-~-y~~-isQpropylpip~ra~în~e
Une solution contenant 12,1 g de 2,5-dibromopyridine (51,1 mmol), 8,8 ml de 1-
isopropylpipérazine (61,5 mmol) et 9,2 ml de DBU (61,5 mmol) est agitée une
nuit à 100 °C.
La réaction est ramenée à température ambiante et la solution diluée dans de
l'eau et extraite
par de l'acétate d'éthyle. Les phases organiques sont rassemblées, lavées par
de la saumure,
séchées (MgS04) et évaporées sous pression réduite. Le résidu est
chromatographié sur
colonne de Si02 en éluant par un mélange CHZCIz/MeOH 98/2 puis 96/4 pour
conduire au
produit du titre.
Point de, usion : 76-78 °C
Microanalyse élémentaire
C H N Br
théorique 50, 72 6, 38 14, 79 28,12
expérimental 50,.96 6,.47 14,53 28,33
CA 02546387 2006-05-12
_g_
Préparation 2 : I-(5-Bromopyridin-2-y1~4-eyclapentylpipérazine
Mode opératoire identique à celui de la Préparation 1 en remplaçant la 1-
isopropylpipérazine
par la 1-cyclopentylpiperazine.
Point de fusion : 127-128 °C
Pré aration 3 : I-(S-Bromogyridin-2-yl)-4-cyclopropylpipérazine
Mode opératoire identique à celui de la Préparation 1 en remplaçant la 1-
isopropylpipérazine
par la 1-cyclopropylpiperazine.
Point de fusion : I10-115 °C
Exemple l : lti {4-[ô-(4-Isopropylpipéra~zin-1-yl)pyridin-3-
yl]phényl}benzènesulfonamide
dichlorhydrate
Stade A : N (4-Iodophényl)benzènesulfonamide
A une solution de 2,0 g de 4-iodoaniline (9,13 mmol) dans 40 ml d'acétonitrile
sont rajoutés
1,48 ml de pyridine (18,26 mmol) puis, goutte à goutte, une solution de 1,28
ml de chlorure
de benzènesulfonyle (10 mmol) dans 20 ml d'acétonitrile. La réaction est
agitée une nuit à
température ambiante et l'acétonitrile est évaporé sous pression réduite. Le
résidu est repris
dans HCl 1N et extrait par l'acétate d'éthyle. La phase organique est lavée
par de la saumure,
séchée (MgS04), évaporée sous pression réduite. Le résidu huileux obtenu est
trituré dans de
l'éther isopropylique jusqu'à cristallisation du produit du titre.
Point de fusion : 141-143 °C
Stade B : N [4-(4,4,5,5-Tétraméthyl-1,3,2-dioxaborolan-2-yl)phényl]benzène
sulfonamide
Dans un bicol de 25 ml sont introduits 500 mg du composé obtenu au Stade A
(1,39 mmol),
389 mg de bis-pinacolatodiborane (1,53 mmol), 410 mg d'acétate de potassium
(4,18 mmol)
CA 02546387 2006-05-12
-9-
et S ml de diméthylformamide. Le milieu réactionnel est dégazé en barbotant un
courant
d'azote pendant 30 min, puis 16 mg d'acétate de palladium (0,07 mmol) sont
ajoutés. La
réaction est agitée sous léger courant d'azote pendant 7 heures à 85
°C. Après refroidissement
à température ambiante, le milieu réactionnel est dilué dans de l'eau et
extrait par de l'acétate
d'éthyle . Les phases organiques sont réunies, lavées par de la saumure,
séchées, évaporées
sous pression réduite. Le résidu d'évaporation est trituré dans l'heptane pour
conduire, après
filtration, au produit du titre sous la forme d'un solide blanc.
Point de, usion : 157-160 °C
Stade C : N {4-[6-(4-Isopropylpipérazin-1-yl)pyridin-3-yl]phényl}benzène
sulfonamide dichlorhydrate
Dans un bicot de 25 ml sont introduits 226mg du composé obtenu dans la
Préparation 1 (0,79
mmol), 300 mg du composé obtenu au Stade B (0,83 mmol), 3 ml de dioxanne et 3
ml de
Na2C03 0,4 M aqueux. Le milieu réactionnel est dégazé en faisant butter de
l'azote pendant
30 min. Le Pd(0)tétrakistriphénylphosphine (45 mg, 0,04 mmol) est introduit et
la réaction est
agitée à 90 °C sous léger courant d'azote pendant 3 heures. Après
refroidissement à
température ambiante, le milieu réactionnel est dilué dans l'eau et extrait
par de l'acétate
d'éthyle. Les phases d'extractions sont jointes, lavées par de la saumure,
séchée (MgS04) et
évaporées sous pression réduite. Le résidu obtenu est chromatographié sur Si02
(CH2C12/MeOH/NH40H 96/4/0,4) pour conduire au produit du titre sous forme de
base. Celle
ci est dissoute dans de l'éther chlorhydrique, puis la solution est concentrée
et filtrée pour
conduire au produit du titre sous forme de chlorhydrate.
Point de fusion : 160-163 °C
Microanalyse élémentaire
C H N S Cl
théorique 56, 58 5, 93 11, 00 6, 29 13, 92
expérimental 55, 36 6, 3 1 D, 62 6, 32 13, 67
CA 02546387 2006-05-12
-10-
Exemple 2 : N (4-[C-(4-Cyelopentylpipéra~ïn-I-yl)pyridin-3-yl]phényl}benzène
sulfhnamîde dïchlorhydrate
Le produit obtenu dans le Stade B de l'Exemple 1 est mis en réaction avec le
composé obtenu
dans la Préparation 2 selon les conditions décrites au Stade C de l'Exemple 1.
Point de fusion : 162-167 °C C
Microanalyse élémentaire
C H N S Cl
thorique 58,31 6,02 10,46 5,99 13,24
exprimental 58, 6, 10, 6, 12,
71 OS 53 03 66
Exem~.~le 3 : N [4-[6-(4-Cyclopentyl-1-pïpérazinyl~3-pyridinyljphényl]méthane
sulfonamïde, dïchlorhydraLe
Stade A : N (4-Iodophényl)méthanesulfonamide
Mode opératoire identique au stade A de l'Exemple 1 mais en remplaçant le
chlorure de
benzènesulfonyle par l'anhydride méthanesulfonique.
Point de, usion : 118-120 °C
Microanalyse élémentaire
C H N S I
théorique 28, 30 2, 71 4, 71 10, 79 42, 71
expérimental 28, 67 2, 83 4, 70 11, 22 43, 44
Stade B : N [4-(4,4,5,5-Tétraméthyl-1,3,2-dioxaborolan-2-yl)phényl]méthane
sulfonamide
Mode opératoire identique au stade B de l'Exemple 1 mais à partir du produit
obtenu dans le
Stade A précédent.
Point de fusion : 180-182 °C
CA 02546387 2006-05-12
-11-
Stade C : N [4-[6-(4-Cyclopentyl-1-pipérazinyl)-3-pyridinyl)phényl]méthane
sulfonamide, dichlorhydrate
Mode opératoire identique au Stade C de l'Exemple 1 à partir du produit obtenu
au Stade B et
en remplaçant le composé obtenu dans la Préparation 1 par le composé obtenu
dans la
Préparation 2.
Point de fusion : 227-229 °C
Microanalyse élémentaire
C H N S Cl
thorique 53,27 6,39 11,83 6,77 14,98
exprimental 53, 6, 11, 6, 14,
22 41 43 85 89
Ex~m~l I~e 4 : N (4-[f-(4-~yciopropylpipérazin-1-yl)Pyridïn-~-
yIIPhënyl}méthane
sulfonamide d~chlarhydrate
Le produit obtenu dans le Stade B de l'Exemple 3 est mis en réaction avec le
composé obtenu
dans la Préparation 3 selon les conditions décrites au Stade C de l'Exemple 1.
Point de fusion : 197°C
Microanalyse élémentaire
C H N S Cl
thorique 51,24 5,88 12,58 7,20 15,92
exprimental 51,70 5,78 12,21 6,81 15,93
Exe~n~ie 5 : N {4-[f-(~-Isopropylpipëra~in-1-yl)pyrïdïn-3-yllPhényllmorpholine-
4-
sulfonamide dxchlorhydrate
Stade A : N (4-Iodophényl)morpholine-4-sulfonamide
A une solution de 10 g de 4-iodoaniline (45,6 mmol) dans 200 ml d'acétonitrile
sont rajoutés
6,41 ml de Et3N (45,6 mmol) et 8,47g de chlorure de morpholine-4-sulfonyle
(45,6 mmol). La
réaction est agitée 16 heures à température ambiante. L'acétonitrile est
évaporé sous vide et le
CA 02546387 2006-05-12
-12-
résidu repris dans HCl 1N et extrait par CHZCIz. Les phases organiques sont
réunies, lavées par
de la saumure, séchée (MgS04) et traitées au noir animal pour conduire au
produit du titre.
Point de fusion : 91 °C
Stade B : N [4-(4,4,5,5-Tétraméthyl-1,3,2-dioxaborolan-2-yl)phényl] morpholine-
4-sulfonamide
Mode opératoire identique au Stade B de l'Exemple 1 à partir du produit obtenu
dans le Stade A.
Point de fusion : 158-161 °C
Stade C : N {4-[6-(4-Isopropylpipérazin-1-yl)pyridin-3-yl]phényl}morpholine -4-
sulfonamide dichlorhydrate
Mode opératoire identique au Stade C de l'Exemple 1 à partir du produit obtenu
dans le Stade B.
Point de fusion : 194-198 °C
Microanalyse élémentaire
C H N S Cl
thorique 50, 96 6, 13, 6,18 13,
41 51 67
exprimental 50, 6, 13, 6, 13,
90 79 23 09 46
ExeJzle G ~ N_{4-[â-(4-Isapropylpipérin-1-yl)pyridin-3-yl]phënyl}méthane
sulfonamide diehlorhydrate
Le produit du stade B de l'Exemple 3 est mis en réaction avec le composé
obtenu dans la
Préparation 1 selon les conditions décrites au Stade C de l'Exemple 1.
Point de fusion : 191 °C
Microanalyse élémentaire
C H N S Cl
thorique 50,19 6, 12, 7, 17,15
25 32 05
exprimental 50,14 6,10 11,49 6,58 17,25
CA 02546387 2006-05-12
-13-
Exemple ~ : lY {4-[~-(4-Isoprt~pylpipérazin-1-yl)gyridin-3-yllphényl}propane<2-
salfonamide dichlorhydrate
Stade A : N (4-Iodophényl)propane-2-sulfonamide
Mode opératoire identique au Stade A de l'Exemple 5 en remplaçant le chlorure
de
morpholine-4-sulfonyle par le chlorure de propane-2-sulfonyle.
Point de fusàon : 96 °C
Microanalyse élémentaire
C H N S I
thorique 33, 3, 4, 9, 39,
24 72 31 86 03
exprimental33,21 3,38 4,17 9,74 38,37
Stade B : N [4-(4,4,5,5-Tétraméthyl-1,3,2-dioxaborolan-2-yl)phényl]propane-2-
sulfonamide
Mode opératoire identique au Stade B de l'Exemple 1, à partir du produit
obtenu au Stade A.
Point de fusion : 192 °C
Microanalyse élémentaire
C H N S
thorique 55,40 7,44 4,31 9,86
exprimental 55, 7, 4, 10,11
46 33 54
Stade C : N {4-[6-(4-Isopropylpipérazin-1-yl)pyridin-3-yl]phényl}propane-2-
sulfonamide dichlorhydrate
Mode opératoire identique au Stade C de l'Exemple 1, à partir du produit
obtenu au Stade B.
Point de fusion : 165 °C
CA 02546387 2006-05-12
-14-
Microanalyse élémentaire
C H N S Cl
thorique 53, 05 6, 11, 6, 14,
78 78 74 91
exprimental 53, 7, 11, 6, 14,
OS 07 58 47 62
Bxemnle g : lY {4-[~-(4-Cyclopentylpipèrazin.-1-yl)pyrldïn-3-yl}Phényl}=4-
fluorobenzènesulfanamide dichlorhydrate
Stade A : {4-[6-(4-Cyclopentylpipérazin-1-yl)pyridin-3-yl]phényl}amine
Mode opératoire identique au Stade C de l'Exemple 1 en utilisant la [4-
(4,4,5,5-tétraméthyl-
1,3,2-dioxaborolan-2-yl)phényl]amine.
Point de fusion : 160-162 °C
Stade B : N {4-[6-(4-Cyclopentylpipérazin-1-yl)pyridin-3-yl]phényl}-4-
fluorobenzènesulfonamide dichlorhydrate
Une suspension contenant 200 mg (0,620 mmol) du produit obtenu au Stade A et
302 mg
(1,55 mmol) du chlorure de l'acide 4-fluorophényl sulfonique dans 2 ml de
pyridine est agitée
3h à 80°C. Après refroidissement à température ambiante, le milieu
réactionnel est précipité
par addition d'eau. Le précipité est récupéré par filtration, dissous dans un
mélange
CH2C12/MeOH, absorbé sur environ 1 g de silice et chromatographié sur colonne
de silice en
éluant avec un mélange CH2C12/MeOH/NH3 98/2/0,2. Le dichlorhydrate est formé
par reprise
de la base dans l'éthanol et addition d'éther chlorhydrique.
Point de~fusion : 256-262 °C
Microanalvse élémentaire
C H N S Cl
thorique 56, 5, 10,12 S, 12,
42 64 79 81
exprimental 56, S, 9, 5, 12,
03 73 77 45 74
CA 02546387 2006-05-12
-15-
Exem""",~e 9 t N ø4-[fr(~-~yclopentylpïpéra~ïn-1-yl~pYrïdin-3-yllphênyl}-~_
fluQrorhen~~nesulfonamïde dichlorhyd~rate
Mode opératoire identique à l'Exemple 8 mais en utilisant au Stade B le
chlorure de l'acide 3-
fluorophényl sulfonique.
Point de fusion : 167-170 °C
Microanalyse élémentaire
C H N S Cl
thorique 56, 42 5, 10,12 5, 12,
64 79 81
exprimental 56, 5, 9, 5, 12,
72 60 96 67 86
Exe~m le-1Q :.ll~ {4-[b-(4..G'Y~lapentylpïp~razin-1-Yl~pYrïdïn-3-yl]Ph~nYl}-2_
fl~Qr~ben~ènes~~fon~mide dichtorhYdrate
Mode opératoire identique à l'Exemple 8 mais en utilisant au Stade B le
chlorure de l'acide 2-
fluorophényl sulfonique.
Point de fusion : 248-253 °C
Microanalyse élémentaire
C H N S Cl
thorique 56, 42 5, 10,12 S, 12,
64 79 81
exprimental 56, 5, 9, 5, 12,
46 63 87 47 80
CA 02546387 2006-05-12
-16-
ÉTUDE PHARMACOLOGI UE DES PRODUITS DE L'INVENTION
E~~IYI~~P".L~ ~ : Ilrosages cérébraux de la N~'-lVléthylhistamlae chez la
souris NNIR.~
Cette étude réalisée selon la méthode de Taylor et Coll. (Biochem. Pharm.,
1992, 44, 1261-
1267), a pour objectif d'évaluer l'activité ex vivo des composés de la
présente invention en
S tant qu'antagonistes des récepteurs histaminergiques centraux de type H3.
Cette activité est
révélée par la mesure, après traitement par voie intrapéritonéale des composés
sous étude, des
taux centraux de N~- Méthylhistamine, métabolite principal de l'histamine. Une
augmentation
des concentrations cérébrales de Nt- Méthylhistamine signe une augmentation du
turn-over de
l'histamine par blocage des récepteurs histaminergiques centraux de type H3.
Des souris NMRI (18-20g) sont traitées par voie intrapéritonéale ou orale par
les composés de
la présente invention ou par leur véhicule (20 ml/kg). Une heure après le
traitement
pharmacologique, les animaux sont sacrifiés, les cerveaux sont prélevés,
congelés dans l'azote
liquide, pesés et homogénéisés dans HC104 O,1N à 4°C. Les homogénats
sont centrifugés
(1SOOOg, 17 min, 4°C). Les surnageants sont récupérés et aliquotés. Les
aliquotes sont
1 S congelés dans l'azote liquide et stockés à -80°C jusqu'à leur
analyse.
La détermination des taux cérébraux de N~- Méthylhistamine est réalisée par
dosage radio-
immunologique (RIA) à l'aide d'un kit de dosage. Les taux tissulaires de Ni-
Méthylhistamine
sont exprimés en pg/g de cerveau frais. La comparaison des taux cérébraux de
Nt-
Méthylhistamine entre les animaux traités par le véhicule (témoins) et les
animaux traités par
les composés de la présente invention est effectuée par une analyse de
variance à un facteur
suivie si nécessaire par une analyse complémentaire (test de Dunnett).
Les résultats montrent que les composés de la présente invention sont
capables, pour des
doses comprises entre 1 et 10 mg/kg PO, d'augmenter de 100% les concentrations
cérébrales
endogènes de NT-Méthylhistamine.
2S A titre d'exemple, les composés des Exemples 4 et 7 administrés
respectivement à 10 et
3 mg/kg PO permettent d'obtenir une augmentation de 162 % et 138 %
respectivement des
concentrations cérébrales endogènes de NT-Méthylhistamine.
CA 02546387 2006-05-12
-17-
Ces résultats indiquent que les composés de la présente invention sont de
puissants
antagonistes des récepteurs histaminergiques centraux de type H3.
E~MFLE B : Enregïstr~ments de l'~lectrarencep~halogramme chez le rat vigile
Des rats Wistar mâles adultes sont implantés de manière chronique par des
électrodes placées
à la surface du cortex frontal et pariétal. Des enregistrements de
l'électroencephalogramme
(EEG) cortical sont effectués chez les rats placés dans des cages dans une
pièce isolée
phoniquement. Les composés et solvant sont administrés de manière randomisée à
10 h les
mêmes jours avec un minimum de 3 jours entre chaque administration, permettant
d'utiliser
chaque rat comme son propre témoin. La puissance absolue des activités lentes
delta (1-4 Hz),
qui prédominent pendant le sommeil lent et disparaissent pendant l'éveil et le
sommeil
paradoxal, est moyennée sur des périodes successives de 30 min. Sur 30 min,
des valeurs
élevées et basses de la puissance des activités lentes delta sont des signes
d'éveil et de
sommeil, respectivement.
Les résultats montrent que les composés de la présente invention augmentent
l'éveil
(diminution des ondes delta) pour des doses comprises entre 0,3 et 3 mg/kg IP.
EXElYIFLE ~ ~ ~c~mgositï~~r gharmaceutlque
Formule de préparation pour 1000 comprimés dosés à 100 mg de N [4-[6-(4-
cyclopentyl-1-
pipérazinyl)-3-pyridinyl]phényl]méthane sulfonamide, dichlorhydrate (exemple
3)........100 g
Hydroxypropycellulose..........................................................
........................2 g
Amidon de blé. ..........................................
................................................10 g
Lactose........................................................................
.........................100 g
Stéarate de magnésium......................
............................................................3 g
Talc...........................................................................
.............................3 g