Note: Descriptions are shown in the official language in which they were submitted.
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
Dérivés d'acylaminothiazole, leur préparation et leur application en
thérapeuticLue
La présente invention a pour objet des dérivés d'acylaminothiazole leur
préparation et leur utilisation en thérapeutique.
On connaît déjà des composés dérivés d'acylaminothiazole, décrits dans les
documents W003/014095 A, W02004/009565 A et W02004/033439 A,
inhibiteurs de la formation du peptide ~3-amyloïde (~i-A4).
II existe toujours une nécessité de trouver et de développer des produits
inhibiteurs de la formation du peptide j3-amyloïde (~i-A4). Les composés de
l'invention répondent à ce but.
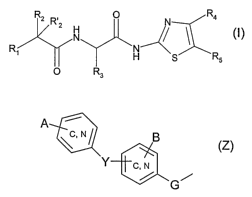
La présente invention a pour premier objet des composés répondant à la
formule générale (I)
Rz R. O N Ra
~1
R~ ~ _H S Rs
O R3
dans laquelle, Vii)
R~ représente
soit un C~_6 alkyle éventuellement substitué par un à trois substituants
choisis
parmi un halogène, un trifluorométhyle, un hydroxy, un C~_6 alcoxy, un C~_6
thioalkyle, un thiophène ou un phényle ; soit un C3_~ cycloalkyle, un
thiophène,
un benzothiophène, un pyridinyle, un furanyle ou un phényle ; les dits groupes
phényle étant éventuellement substitués par un à trois substituants choisis
parmi un atome d'halogène, un C~_6 alkyle, un C~_6 alcoxy, un hydroxy, un
méthylènedioxy, un phénoxy ou un benzyloxy ou un trifluorométhyle ;
R2 et R'2 représentent indépendamment l'un de l'autre un atome d'hydrogène,
un atome d'halogène, un hydroxy, un C~_3 alcoxy, un C~_3 alkyle, un C3_~
cycloalkyle, un groupe O-C(O)-C~_6 alkyle, ou R2 et R'2 forment ensemble un
groupe oxo ;
R3 représente un atome d'hydrogène, un C~_6 alkyle éventuellement substitué
par un hydroxy, un C~_6 cycloalkyle ou un C~_3 alcoxy ;
l'un ou l'autre de R4 ou R5 représente un groupe Z
A
~C, N
(Z)
c, N
G~
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
2
et l'un ou l'autre de R4 ou R5 représente un groupe -C(X)R6 ;
G représente une liaison simple ou un groupe -CH2- ;
Y représente une liaison simple, un atome d'oxygène, de soufre, un groupe C~.~
alkylène ou -N(W)-, le groupe -C~_4 alkylène- étant éventuellement substitué
par
un groupe hydroxy ou C~_3 alcoxy ;
W représente soit un atome d'hydrogène, soit un C~_3 alkyle éventuellement
substitué par un phényle, soit un phényle ;
A et B représentent, indépendamment l'un de l'autre, un atome d'hydrogène,
d'halogène, un groupe hydroxy, C~_3 alkyle, C~_3 alcoxy, trifluorométhyle,
trifluorométhoxy ou -Q-CHF2 ; à la condition que si Y est une liaison simple
ou
un atome d'oxygène et si le groupe Z est du type
g
(Z)
Y
G~
alors A est différent d'un atome d'hydrogène ;
X représente un atome d'oxygène ou un atome de soufre ;
R6 représente un groupe C~_6 alcoxy, hydroxy ou -NR7R$ ; le groupe C~_6 alcoxy
étant éventuellement substitué par un phényle ;
R~ et R$ représentent, indépendamment l'un de l'autre
soit un atome d'hydrogène ; soit un groupe C~_6 alkyle éventuellement
substitué
par un C3_7 cycloalkyle, un C3_7 cycloalkènyle, un C~_3 alcoxy, un phényle, un
morpholinyle ou un pyridinyle ; soit un groupe C3_~ cycloalkyle, C~_6 alcoxy
ou
phényle ; les dits groupes C3_7 cycloalkyle et phényle étant éventuellement
substitués par un ou deux groupes choisis parmi un atome d'halogène, un
groupe hydroxy, C~_3 alkyle ou C1_3 alcoxy ; ou
R~ et R8, avec l'atome d'azote qui les porte, forment un cycle aziridine,
azétidine, pyrrolidine, pipéridine, morpholine ou benzopipéridine.
Parmi les composés de formule générale (I), un premier sous-groupe de
composés est constitué par les composés pour lesquels R~ représente un C~_s
alkyle ou un phényle éventuellement substitué par un à trois atomes
d'halogène.
Parmi les composés de formule générale (1), un second sous-groupe de
composés est constitué par les composés pour lesquels R2 et R'2 représentent
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
3
indépendamment l'un de l'autre un atome d'hydrogène, un hydroxy ou R2
et R'2 forment ensemble un groupe oxo.
Parmi les composés de formule générale (I), un troisième sous-groupe de
composés est constitué par les composés pour lesquels R3 représente un C~_6
alkyle.
Parmi les composés de formule générale (I), un quatrième sous-groupe de
composés est constitué par les composés pour lesquels
l'un ou l'autre de R4 ou R5 représente un groupe Z
A
~C, N ~ B
(Z)
Y C, N
~ G~
et l'un ou l'autre de R4 ou R5 représente un grôupe -C(X)R6;
G représente une liaison simple ;
Y représente une liaison simple, un atome d'oxygène, de soufre, un groupe C~~
alkylène, plus particulièrement méthylène ;
A et B représentent, indépendamment l'un de l'autre, un atome d'hydrogène,
d'halogène, plus particulièrement de fluor, un groupe trifluorométhyle,
trifluorométhoxy ; à la condition que si Y est une liaison simple ou un atome
d'oxygène et si le groupe Z est du type
A
B
(Z)
Y
G~
alors A est différent d'un atome d'hydrogène ;
X représente un atome d'oxygène ou un atome de soufre ;
R6 représente un groupe C~_6 alcoxy, plus particulièrement un méthoxy ou un
éthoxy.
Les composés pour lesquels à la fois A, B, W, X, Y, Z, R~, Ra, R'2, R3, R4,
R5,
R6, R7 et R$ sont tels que définis dans les sous-groupes de composés ci-
dessus, forment un cinquième sous-groupe.
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
4
Parmi les composés de formule générale (I) et des sous-groupes ci-dessus, un
sixième sous-groupe de composés est constitué par les composés pour lesquels
R~ représente un C~_4 alkyle, de préférence un isopropyle ou un tert butyle,
ou
un phényle substitué par deux atomes de fluor ; et/ou
R2 représente un atome d'hydrogène ou un hydroxy et R'2 représente un
atome d'hydrogène ; et/ou
R3 représente un C~~ alkyle, de préférence un méthyle, éthyle ou propyle ;
et/ou
X représente un atome d'oxygène.
Dans le cadre de la présente invention, on entend par
- Ct_Z où t et z peuvent prendre les valeurs de 1 à 7, une chaîne carbonée
pouvant avoir de t à z atomes de carbone, par exemple C~_3 une chaîne
carbonée qui peut avoir de 1 à 3 atomes de carbone, C3_6 une chaîne carbonée
qui peut avoir de 3 à 6 atomes de carbone, ......
- alkyle, un groupe aliphatique saturé, linéaire ou ramifié; par exemple, un
groupe C~_6 alkyle représente une chaîne carbonée de 1 à 6 atomes de
carbone, linéaire ou ramifiée, plus particulièrement un méthyle, éthyle,
propyle,
isopropyle, butyle, isobutyle, sec-butyle, tert-butyle, .....de préférence un
méthyle, éthyle, propyle ou isopropyle ;
- alkylène, un groupe alkyle divalent saturé, linéaire ou ramifié, par exemple
un groupe C~_3-alkylène représente une chaîne carbonée divalente de 1 à 3
atomes de carbone, linéaire ou ramifiée, plus particulièrement un méthylène,
éthylène, isopropylène, propylène ;
- cycloalkyle, un groupe alkyle cyclique, par exemple, un groupe C3_~
cycloalkyle
représente une chaîne carbonée cyclique de 3 à 7 atomes de carbone, plus
particulièrement un cyclopropyle, cyclobutyle, cyclopentyle, cyclohexyle,
cycloheptyle, de préférence un cyclopentyle ou cyclohexyle ;
- cycloalkènyle, un groupe alkyle cyclique mono- ou poly-insaturé, par
exemple,
un groupe C3_~ cycloalkènyle représente une chaîne carbonée cyclique mono-
ou poly-insaturée de 3 à 7 atomes de carbone, plus particulièrement un
cyclopropényle, cyclobutènyle, cyclopentènyle, cyclohexènyle, cycloheptènyle,
de préférence un cyclopentènyle ou cyclohexènyle ;
- thioalkyle, un groupe S-alkyle à chaïne aliphatique saturée, linéaire ou
ramifiée ;
- alcoxy, un groupe -O-alkyle à chaîne aliphatique saturée, linéaire ou
ramifiée ;
- atome d'halogène, un fluor, un chlore, un brome ou un iode ;
- « R2 et R2~ forment ensemble un groupe oxo », le groupe tel que
et
0
R,~~ _
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
et
- dans le groupe Z, le groupe aromatique
~~, N /
5 est tel que un des atomes de carbone du cycle aromatique peut être remplacé
par un atome d'azote dans la position où il n'y a pas de substituant A ou B.
Les composés de formule générale (I) peuvent comporter un ou plusieurs
carbones asymétriques. Ils peuvent donc exister sous forme d'énantiomères ou
de diastéréoisomères. Ces énantiomères, diastéréoisomères, ainsi que leurs
mélanges, y compris les mélanges racémiques, font partie de l'invention.
Lorsque le carbone portant R2 et R'~ et/ou le carbone portant R3 sont
asymétriques, on préfère les composés de formule générale (I) pour lesquels le
carbone portant R2 et R'2 est de configurafiion (S) et/ou le carbone portant
R3
est de configuration (S).
Les composés de formule (I) peuvent exister à l'état de bases ou de sels
d'addition à des acides. De tels sels d'addition font partie de l'invention.
Ces sels sont avantageusement préparés avec des acides
pharmaceutiquement acceptables, mais les sels d'autres acides utiles, par
exemple, pour la purification ou l'isolement des composés de formule (I) font
également partie de l'invention.
Les composés de formule générale (I) peuvent se trouver sous forme
d'hydrates ou de solvats, à savoir sous forme d'associations ou de
combinaisons avec une ou plusieurs molécules d'eau ou avec un solvant. De
tels hydrates et solvats font également partie de l'invention.
La présente invention a pour second objet des procédés de préparation des
composés de formule (I).
Ainsi, ces composés peuvent être préparés par des procédés, illustrés dans les
schémas qui suivent, dont les conditions opératoires sont classiques pour
l'homme du métier.
On entend par groupe protecteur, un groupement permettant d'empêcher la
réactivité d'une fonction ou position, lors d'une réaction chimique pouvant
l'affecter, et qui restitue la molécule après clivage selon des méthodes
connues
de l'homme du métier. Des exemples de groupes protecteurs ainsi que les
méthodes de protection et déprotection sont données, entre autres, dans
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
6
Protective groups in Organic Synthesis, Greene et coll., 2"d Ed.
(John Wiley & Sons, Inc., New York).
Les significations de A, B, W, X, Y, Z, R~, R2, R'a, R3, R4, R5, R6, R7 et R$
dans
les composés de formule (II) à (XVIII) ci-après sont telles que définies pour
les
composés de formule (I), à moins qu'une autre définition ne soit précisée.
Selon le schéma 1 ci-après, le composé de formule (I) peut être obtenu par
couplage peptidique du 2-aminothiazole de formule (III) avec l'acylaminoacide
de formule (II) selon des conditions connues de l'homme du métier, par
exemple en présence d'héxafluorophosphate de benzotriazol-1-yloxy-
tris(pyrrolidino) phosphonium (PyBOP) ou d'héxafluorophosphate de
benzotriazol-1-yloxy-tris(diméthylamino)phosphonium (BOP) ét de N-
éthylmorpholine ou N-méthylmorpholine dans un solvant inerte tel que le N,N-
diméthylformamide, l'acétonitrile ou le dichlorométhane à une température
pouvant aller de 0°C à la température ambiante.
Le composé de formule (II) peut être obtenu par couplage peptidique du
composë de formule (IV) avec l'acide protégé de formule (V), dans laquelle Pg
représente un groupe protecteur, par exemple un benzyle, selon des méthodes
connues de l'homme du métier telles que décrites ci-dessus. Le composé ainsi
obtenu est ensuite déprotëgé. Dans le cas où la protection est un benzyle, le
composé est préalablement hydrogéné en présence de palladium sur charbon
dans de l'éthanol absolu à pression atmosphérique d'hydrogène, à température
ambiante, pour donner le composé de formule (II).
CA 02551142 2006-06-21
WO 2005/073226 _ PCT/FR2005/000032
7
Schéma 1
R2 R~z
+ H2N~C02Pg
C02 ~H
R~ Rs
(IV) (U)
R2 R.2 N Ra
N C02H +
R ~ ~ H2N
O R3 S R
(II) (III)
couplage peptidique
R2 R. O N Ra
N
H ~1
R~ ~ _H S R5
O R3
5 Alternativement, le composé de formule (I) peut être préparé selon le schéma
2.
Selon le schéma 2 ci-après, le composé de formule (I) peut être obtenu par
couplage peptidique du composé de formule (IV) avec l'amine de formule (VI),
selon des méthodes connues de l'homme du métier, comme par exemple en
présence d'hydrate d'hydroxybenzotriazole (HOBt) et de chlorhydrate de 1-
éthyl-3-(3-diméthylamino-propyl)carbodümide (EDAC, HCI).
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
ô
Schéma 2
R O
S 5 PgHN
H2N--<\ I + OH
N R4
R3
III VII)
R2 R 2 O R
H2N S s
'N--~\ I
R~ _ ~2H__ R H N R4
(IV) 3 (VI)
couplage peptidique
R2 R 2 O R
S s
R~ H ~\ I
O R3 N R4
Le composé de formule (VI) peut être obtenu par couplage peptidique du
2-aminothiazole de formule (III) avec l'amine protégée de formule (VII) dans
laquelle Pg représente un groupe protecteur, par exemple un N-tert-
butoxycarbonyl (Boc), selon des méthodes connues de l'homme du métier
telles que décrites ci-dessus. Le composé ainsi obtenu est ensuité déprotégé.
Dans le cas où la protection est un Boc, la déprotection se fait par hydrolyse
acide, en présence d'acide chlorhydrique gazeux dissous dans un solvant
anhydre ou d'acide trifluoroacétique, pour donner le composé de formule (VI).
Les composés de formule (I) dans laquelle Ra et R'2 forme un groupe oxo,
peuvent être obtenus par oxydation d'un composé de formule (I) dans laquelle
R2 ou R'2 représente un groupe hydroxy. La réaction peut être réalisée selon
les
conditions connues de l'homme du métier, par exemple avec le réactif de Dess
Martin. Ces composés peuvent également être obtenus par couplage direct
d'un cétoacide de formule (IV), dans laquelle R2 et R'2 forment ensemble un
groupe oxo, avec une amine de formule (VI) selon les conditions connues de
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
9
l'homme du métier. Les méthodes de préparation de tels cétoacides sont
connues de l'homme du métier.
Le composé de formule (III) dans laquelle R4=-C(O)-R6, R6 représentant un
groupe C~_6 alcoxy, peut être obtenu selon le schéma 3 ci-après.
Schéma 3
o cl
R5 H CI2 ( X)O RS Rs + RS Rs NH2ÇSNH~NHa~s/ Rs
NaOCH3 CI ~ O O RsOH' ~ N COR
s
(VIII)
(X) (XI ) (I I I )
15
Selon le schéma 3, le composé de formule (III) peut ëtre obtenu par réaction
d'un aldéhyde de formule (VIII) dans laquelle R5 est tel que défini ci-dessus
avec le méthyldichloroacétate de formule (IX) dans laquelle R6 représente un
C~_6 alcoxy éventuellement substitué par un phényle, et par exemple le
méthylate ou l'éthylate de sodium à 0°C selon une adaptation du procédé
décrit
par Takeda (Bull. Chem. Soc. JP, 1970, p. 2997). Le mélange de produits (X) et
(XI) obtenu est traité par la thiourée en présence par exemple de méthanol ou
d'éthanol à reflux pendant 4 ou 8 heures pour donner le composé de formule
(III).
Le composé de formule (III) dans laquelle R4=-C(O)-R6, R6 représentant un
hydroxy, peut étre obtenu par hydrolyse des composés ci-dessus pour lesquels
R6 représente un groupe C~_6 alcoxy éventuellement substitué par un phényle,
selon les conditions connues de l'homme du métier.
Le composé de formule (III) dans laquelle R5=-C(O)-R6, R6 représentant un
groupe C~_6 alcoxy, peut être obtenu selon le schéma 4 ci-après.
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
Schéma 4
CO(Rs)~ Br
R CH (XVI) R R Brz' H~O R4 Rs
4~ 3 ----~ 4~~~ 6 ~ (XII)
IO NaHQ THF, O O O O
(XIV) (X111) NH2CSNH2
R60H, o
R4\ /OH ~ ) CDI, THF, o
2) R6COCH2COZK (XVIa), H N S COR
O MgCh, THF 2 ~ / s
(XV) R4
5
Selon le schéma 4, le composé de formule (III), peut être obtenu par bromation
d'un ~i-céto-ester de formule (X111), dans laquelle R6 représente un C~_6
alcoxy
éventuellement substitué par un phényle, pour obtenir le composé de formule
(XII), suivie d'une réaction avec la thiourée selon une adaptation du procédé
10 décrit par A. Barton et colt. (J.C.S Perkin I, 1982, p.159),.
Le (i-céto-ester de formule (X111) peut être obtenu par réaction d'une cétone
de
formule (XIV) avec un dialkylcarbonate de formule (XVI) dans laquelle R6
représente un C~_6 alcoxy éventuellement substitué par un phényle, selon une
adaptation du procédé décrit par L. Crombie et colt. (J.C.S Perkin Trans I,
1987,
p.323). Le (i-céto-ester de formule (X111) peut également être obtenu par
réaction d'un acide de formule (XV) activé par le carbonyldümidazole (CDI)
avec un malonate de formule (XVIa) dans laquelle R6 représente un C~_6 alcoxy
éventuellement substitué par un phényle, selon une adaptation du procédé
décrit par exemple par D.W. Brooks et colt. (Angew. Chem. Int. Ed., 1979,
p.72).
Le composé de formule (III) dans laquelle R5=-C(O)-R6, R6 représentant un
hydroxy, peut être obtenu par hydrolyse des composés ci-dessus pour lesquels
R6 représente un groupe C~_6 alcoxy, selon les conditions connues de l'homme
du métier.
Le composé de formule (III) dans laquelle R4 ou R5 représente un groupe
-C(O)-NR~RB peut être obtenu selon le schéma 5.
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
11
Schéma 5
S R 5 ou C02H R
a 8
PgHN-<\ I + HN~R (XVIII)
N C02H ou R 4
(XVII) 1) Couplage
peptidique
2) Déprotection
S R 5 ou CONR~R$
N H2--<\ I
N CONR~R$ ou R 4
(III)
Selon le schéma 5, le composé de formule (III) est obtenu par couplage
peptidique du composé de formule (XVII), dans laquelle R5 ou R4 représente un
groupe carboxylique et Pg un groupe protecteur tel qu'un Boc, avec un
composé de formule (XVIII) en présence par exemple d'HOBt et (EDAC, HCI).
Le composé ainsi obtenu est ensuite déprotégé selon les conditions connues
de l'homme du métier. Le composé de formule (XVII), dans laquelle Pg
représente un Boc, peut ëtre obtenu par protection d'un composé de formule
(III) dans laquelle R4 ou R5 représente un groupe -C(O)Rs et R6 est un C~_6
alcoxy éventuellement substitué par un phényle, par action de di-tert-
butyldicarbonate dans du tétrahydrofurane anhydre en présence de
diméthylaminopyridine à température ambiante, suivi d'une hydrolyse du
carboxylate selon les conditions connues par l'homme de métier, par exemple
avec de l'hydroxyde de lithium dans un mélange tétrahydrofurane/eau 7:3 (v/v)
à une température de 60°C.
Les composés de formule générale (I), dans laquelle R4 ou R5 représenté un
groupe -C(X)R6 et X=S, peuvent être préparés à partir des composés de
formules générales (I) ou (III) correspondants, dans lesquelles R4 ou R5
représente un groupe -C(X)R6 et X=O, par transformation du groupe C(O) en
groupe C(S), par exemple au moyen du réactif de Lawesson suivant une
méthode analogue à celle décrite par M. P. Cava et colt. dans Tetrahedron,
1985, p.5061.
CA 02551142 2006-06-21
WO 2005/073226 ~ ~ "PCT/FR2005/000032
12
Dans les schémas 1 à 5, les composés de départ et les réactifs,
notamment les composés de formule (III), (IV), (V), (VII), (VIII), (IX),
(XIV), (XV),
(XVI), (XVIa), (XVII) et (XVIII), quand leur mode de préparation n'est pas
décrit,
sont disponibles dans le commerce ou décrits dans la littérature, ou peuvent
être préparés par des méthodes qui y sont décrites ou qui sont connues de
l'homme du métier.
Par exemple, les composés de formule (IV) où R2 ou R'2 représente un hydroxy
peuvent être préparés par addition de cyanure de triméthylsilyle sur un
aldéhyde selon une adaptation du procédé décrit par D.A. Evans et colt. (J. C.
S., Chem. Comm. 1973, p.55) ou par action du nitrite de sodium sur un alpha
aminoacide selon une adaptation du procédé décrit par I. Shinn et coll. (J.
Org.
Chem., 2000, p.7667).
Par exemple, les composés de formule (XV) dans lapuelle Y = O peuvent être
préparés selon une adaptation du procédé décrit par Sindel et colt. (Collect.
csech. chim. Tchecosl., 1982, p.72) ou par Atkison et colt. (J. Med. Chem.,
1983, p.1353).
Par exemple, les composés de formule (XV) dans laquelle Y est du type -C~~
alkylène- peuvent être par exemple préparés selon une adaptation du procédé
décrit par Crow et coll. (Austral. J. Chem., 1981, p.1037) ou alternativement
par
une réaction de Suzuki selon une adaptation du procédé décrit par Chahen et
coll. (Synlett, 2003 p.1668).
Par exemple, les composés de formule (XV) dans laquelle Y = S peuvent être
préparés selon le procédé décrit par Goldberg (Chem. Ber. , 1994, p. 4526).
Par exemple, les composés de formule (XV) dans laquelle Y = N(W) peuvent
être préparés selon le procédé décrit par Chane et coll. (Tetrahedron Letters,
1998, p.2933) ou Chamsin (Tetrahedron Letters, 1998, p.4179) ou Huwe et colt.
(Tetrahedron Letters, 1999, p.683).
Par exemple, les composés de formule (XV) dans laquelle Y est une liaison
simple peuvent être préparés par une réaction de Suzuki selon les conditions
connues de l'homme de métier, par exemple selon le procédé décrit par Deng
et Coll., Synthesis, 2003, p.337 ou Meier et coll., Synthesis, 2003, p. 551.
Par exemple, les composés de formule (VIII) peuvent être obtenus par
réduction des composés de formule (XV) suivant les conditions connues de
l'homme de métier.
Lorsqu'une fonction d'un composé est réactive, par exemple lorsque R~
comporte un hydroxy, elle peut nécessiter une protection préalable avant
réaction. L'homme du métier pourra déterminer aisément la nécessité d'une
protection préalable.
CA 02551142 2006-06-21
WO 2005/073226 ~ ~ ~ ~ ~ PÇT/FR2005/000032.
13
Les exemples suivants décrivent la préparation de certains composés
conformes à l'invention. Ces exemples ne sont pas limitatifs et ne font
qu'illustrer l'invention.
Les numéros des composés exemplifiés renvoient à ceux donnés dans le
tableau ci-après. Les micro-analyses élémentaires et les analyses RMN, IR ou
LC-MS (chromatographie liquide couplée à la spectrométrie de masse)
confirment les structures des composés obtenus.
Exemple 1
2-~2-(S)-[2-(3,5-difluorophényl)acétylamino~pentanoyl}amino-5-[2-(4-
fluorophénoxy)phënyl~thiazole 4-carboxylate de méthyle (composé n°13)
F ~ ~ o
i
0
H ~ g
F \ N~N~\ I
N CO~CH3
F
Exemple 1.1 : acide 2-(4-fluorophénoxy)benzoïque
O OH
\ O ~ \
F
A un mélange de 120 g d'acide 2-iodobenzoïque, 1 g de cuivre en poudre et
54,4 g de 4-fluorophénol dans 200 ml de N,N-diméthylformamide, on additionne
lentement 100 g de carbonate de potassium. On chauffe à 160°C pendant 4
h,
puis on laisse refroidir avant d'évaporer. On reprend le résidu à l'eau
distillée,
on acidifie avec une solution aqueuse 1 N d'acide chlorhydrique, puis on
extrait
avec de l'acétate d'éthyle. On lave la phase organique avec une solution
saturée en chlorure de sodium, on sèche sur sulfate de sodium anhydre puis on
concentre. Le produit désiré cristallise dans un mélange de
diéthyléther/pentane. On obtient 50 g d'un solide blanc.
LC/MS : MH+ = 233
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
14
Exemple 1.2 : 2-(4-fluorophénoxy)-O,N-diméthylbenzamide
O N~OMe
\ O ~ \
F ~ ~
A une solution de 50g d'acide 2-(4-fluorophénoxy)-benzoïque, obtenu à l'étape
1.1, dans 450 ml de N,N-diméthylformamide, on additionne 29,7 g d'hydrate
d'hydroxybenzotriazole, suivi de 37 g de (EDAC, HCI), 19 g de
(O,N-diméthylhydroxylamine, HCI) et de 19,4 g de N-méthylmorpholine. On
agite à température ambiante pendant 16 h. On évapore, on reprend à l'acétate
d'éthyle et on lave 2 fois avec une solution aqueuse saturée en chlorure-de
sodium, 1 fois â l'eau distillée, 1 fois avec une solution aqueuse 1 M
d'hydrogénosulfate de potassium puis avec une solution aqueuse saturée en
chlorure de sodium. On sèche sur du sulfate de sodium anhydre puis on
concentre. On obtient 49 g d'une huile colorée qu'on utilise telle quelle dans
la
suite.
LC/MS : MH+ = 276
Exemple 1.3 : 2-(4-fluorophénoxy)benzaldéhyde
HO
\ O ( \
F
A 100 ml d'une solution 1 M d'hydrure de lithium et d'aluminium dans du
tétrahydrofurane à 0°C, on additionne goutte à goutte 48,5 g de 2-(4-
fluorophénoxy)-O,N-diméthylbenzamide, obtenu à l'étape 1.2, dans 300 ml de
tétrahydrofurane anhydre. On agite à 0°C pendant 1 h puis on hydrolyse
goutte
à goutte avec 40 ml d'une solution aqueuse 1 M d'hydrogénosulfate de
potassium. On évapore, on reprend à l'acétate d'éthyle, on lave 2 fois avec
une
solution aqueuse 1 M d'hydrogénosulfate de potassium puis avec une solution
aqueuse saturée en chlorure de sodium. On sèche sur du sulfate de sodium
anhydre puis on concentre. On obtient 35 g d'une huile colorée.
LC/MS : MH+= 217
RMN 300 MHz (CDC13) âppm : 6,70-7,00 (m, 4H) ; 7,20-7,35 (m,2H) ; 7,55
(t,1 H) ; 7,95 (d,1 H) ; 10,43 (s,1 H) .
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
Exemple 1.4 : 2-amino-5-[2-(4-fluorophénoxy)phényl]thiazole 4-carboxylate
de méthyle
0
i
s
HZN--~~ 1
5 N C02CH3
A 35 g de 2-(4-fluorophénoxy)benzaldéhyde, obtenu à l'étape 1.3, en solution
dans 400 ml de diéthylether, on additionne à 0°C, 30 g de
méthyldichloroacétate, puis goutte à goutte 325 ml d'une solution de méthylate
de sodium (0,5M) dans du méthanol. Après 1 h à 0°C, on évapore
uniquement
10 le diéthyléther en conservant le méthanol, on additionne 11 g de thiourée
et on
chauffe à reflux pendant 6 h. On évapore le milieu réactionnel à sec, on le
reprend à l'acétate d'éthyle et on le lave avec une solution aqueuse à 10
d'hydroxyde d'ammonium, puis avec une solution aqueuse saturée en chlorure
de sodium. On sèche la phase organique sur sulfate de sodium anhydre, puis
15 on la concentre. On reprend le résidu par 100 ml de diéthyléther et on le
filtre
sur fritté. On obtient 30 g d'un solide blanc.
LC/MS : MH~= 345
RMN 300MHz (CDC13) 8ppm : 3.70 (s, 3H) ; 5,55 (s large, 2H) ; 6,55-6,80 (m,
4H) ; 7,00 (d, 1 H) ; 7,20 (t, 1 H) ; 7,35-7,45 (m, 2H) .
Exemple 1.5 : 2-[2-(S)-pentanoylamino]amino-5-[2-(4-fluorophénoxy)-
phényl]thiazole 4-carboxylate de méthyle
o ~
0
H2NV \ S
H-~~ 1
N COzCH3
A 8,6 g de 2-amino-5-[2-(4-fluorophénoxy)phényl]thiazole 4-carboxylate de
méthyle, obtenu à l'étape 1.4, en solution dans 200 ml de N,N-
diméthylformamide à 0°C, on additionne 2,75 g de N-méthylmorpholine,
14,30 g
de PyBOP puis 5,97 g de (S)-BocNorvaline. On laisse revenir le milieu
réactionnel à température ambiante puis on l'agite pendant 16 h. Après
évaporation, on reprend le résidu par de l'acétate d'éthyle et on le lave 2
fois
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
16
avec une solution aqueuse saturée en bicarbonate de sodium, 2 fois à l'eau,
1 fois avec une solution aqueuse 1 M d'hydrogénosulfate de potassium, puis
avec une solution aqueuse saturée en chlorure de sodium. On sèche la phase
organique sur sulfate de sodium anhydre, puis on la concentre. On
chromatographie le résidu sur une colonne de gel de silice, en éluant avec un
mélange d'acétate d'éthyle et d'éther de pétrole 3:7 (v/v). On obtient 8,5 g
d'un
solide blanc.
LC/MS : MH+ = 544
RMN 300 MHz (CDC13) Sppm : 0,88 (t, 3H) ; 1,38 (s, 9H) ; 1,39-1,55 (2m, 2H) ;
1,75 (m, 2H) ; 3,35 (s large, 1 H) ; 3,68 (s, 3H) ; 4,28 (m, 1 H) ; 5,65 (d, 1
H) ;
6,80-6,90 (m, 5H) ; 7,10 (t, 1 H) ; 7,20-7,32 (m, 2H).
On agite 6,5 g de produit obtenu ci-dessus en solution dans 60 ml d'acide
trifluoroacétique à température ambiante pendant 30 min, puis on l'évapore. On
reprend le résidu à l'acétate d'éthyle et on le lave 2 fois avec une solution
aqueuse saturée en carbonate de sodium, puis avec une solution aqueuse
saturée en chlorure de sodium. On sèche la phase organique sur sulfate de
sodium anhydre, puis on l'évapore pour obtenir 3,9 g d'un solide blanc.
LC/MS : MH+ = 444
Exemple 1.6
2-~2-(S)-[2-(3,5-difluorophényl)acétylamino]pentanoyl}amino-5-[2-(4-
fluorophénoxy)phényl]thiazole 4-carboxylate de méthyle
A 0,7 g de 2-amino-2-[2-(S)-pentanoylamino]-5-[2-(4-fluorophénoxy)phényl]
thiazole 4-carboxylate de méthyle, obtenu à l'exemple 1.5, en solution dans
ml de N,N-diméthylformamide à 0°C, on additionne 0,20 g de
N-méthylmorpholine, 0,99 g de PyBOP puis 0,33 g d'acide
3,5-difluorophénylacétique. On laisse revenir la réaction à température
30 ambiante et on l'agite pendant 18 h. On évapore le milieu réactionnel. On
reprend le résidu à l'acétate d'éthyle et on le lave 2 fois avec une solution
aqueuse saturée en bicarbonate de sodium, 2 fois à l'eau, 1 fois avec une
solution aqueuse 1 M d'hydrogénosulfate de potassium, puis avec une
solution aqueuse saturée en chlorure de sodium. On sèche la phase
organique sur sulfate de sodium anhydre puis on la concentre. On
chromatographie le résidu sur une colonne de silice en éluant avec un
mélange éther de pétrole/acétate d'éthyle 1:1 (v/v) pour obtenir 0,56 g d'un
solide blanc.
LC/MS : MH+ = 558
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
17
RMN décrite dans le tableau (composé n°13)
Exemple 2:
2-f2-(S)-[2-(S)-hydroxy-(3,3-diméthyl)butyrylamino]pentanoyl~amino-5-[2-
(phénylthio)3-pyridyl]thiazole 4-carboxylate de méthyle (composé n°19)
~ s
oH o ~
II S
~\H-~' i
N COZCH3
Exemple 2.1 : (2-phénylthio)-O,N-diméthylnicotina~~.de
O N~OMe
\ s I \
N /
Le (2-phénylthio)-O,N-diméthylnicotinamide peut-ëtre obtenu selon une
méthode analogue à celle décrite à l'étape 1.2 de l'exemple 1. A partir de 20
g
d'acide 2-phénylthionicotinique, on obtient 21,9 g d'une huile incolore qu'on
utilise telle quelle dans la suite.
LC/MS : MH+= 275
RMN 300 MHz (CDC13) Sppm : 3,35 (s large, 3H) ; 3,58 (s large, 3H) ; 7,35
(m, 3H) ; 7,50 (m, 2H) ; 7,60 (d, 2H) ; 8,40 (d, 1 H)
Exemple 2.2 : (2-phénylthio)nicotinaldéhyde
HO
I \ S I \
i N i
Le (2-phénylthio)nicotinaldéhyde peut être obtenu selon une méthode analogue
à celle décrite à l'étape 1.3 de l'exemple 1. A partir de 21,9 g de (2-
phénylthio)-O,N-diméthylnicotinamide (amide de Weinreb), obtenu à l'étape 2.1,
et de 48 ml d'une solution 1 M d'hydrure de lithium et d'aluminium dans 300 ml
de tétrahydrofurane, on obtient 16,6 g d'un solide blanc.
RMN 300 MHz (CDC13) âppm : 7,18 (m, 1H) ; 7,42 (m, 3H) ; 7,57 (m, 2H) ; 8,05
(d, 1 H) ; 8,46 (d, 1 H) ; 10,35 (s, 1 H).
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
18
Exemple 2.3 : 2-amino-5-[2-(phénylthio)-3-pyridyl~thiazole 4-carboxylate de
méthyle
s N
s
HZN~\
N COZCH3
Le 2-amino-5-[2-(phénylthio)-3-pyridyl]thiazole 4-carboxylate de méthyle peut
être obtenu selon une méthode analogue à celle décrite à l'étape 1.4 de
l'exemple 1. A partir de 16,5 g de (2-phénylthio)nicotinaldéhyde obtenu à
l'étape
___ __ 2.2, de 11,2 g de dichloroacétate de méthyle et de 150 ml de méthylate
de
sodium 0,5M dans 300 ml de diéthyléther, on obtient 19 g d'un solide jaune
pâle.
LC/MS : MH+ = 344
RMN 300MHz (DMSOd6) Sppm : 3,41 (s large, 2H) ; 3,60 (s, 3H) ; 7,20 (d large,
1 H) ; 7,38-7,48 (m, 5H) ; 7,65 (d large, 1 H) ; 8,30 (d large, 1 H).
Exemple 2.4 : 2-[2-(S)-pentanoylamino]amino-5-(2-(phénylthio)3-pyridyl]-
thiazole 4-carboxylate de méthyle
~ s N
0
H2N~ S
N C02CH3
Le 2-[2-(S)-pentanoylamino]amino-5-[2-(phénylthio)3-pyridyl]thiazole 4-
carboxylate de méthyle peut être obtenu selon une méthode analogue à celle
décrite à l'étape 1.5 de l'exemple 1. A partir de 5,14 g de 2-amino-5-[2-
(phénylthio)-3-pyridyl]thiazole 4-carboxylate de méthyle obtenu à l'exemple
2.3,
et de 3,58 g de (S)-BocNorvaline, en présence de 8,58 g de PyBOP et de 1,66
g de N-inéthylmorpholine dans la N,N-diméthylformamide à O°C, on
obtient
après chromatographie 3,5 g d'un solide jaune pâle.
LC/MS : MH+ = 542
RMN 300 MHz (DMSOd6) 8ppm : 0,87 (t, 3H) ; 1,45 (s,9H) ; 1,70 (m, 2H) ; 1,97
(m, 2H) ; 3,72 (s, 3H) ; 4,45 (m, 1 H) ; 5,23 (m, 1 H) ;7,10 (m, 1 H) ; 7,30
(m, 3H) ;
7,42 (m, 2H) ; 7,50 (d, 1 H) ; 8,39 (d, 1 H).
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
19
On dissout 3,5 g d'amine obtenue ci- dessus dans 150 ml d'une solution
d'acide chlorhydrique 4 M dans du 1,4-dioxane et 20 ml de méthanol. On agite
1 h30 à température ambiante puis on évapore. On obtient 3,2 g d'un solide
jaune pâle.
LC/MS : MH+ = 442
Exemple 2.5
2-f2-(S)-(2-(S)-hydroxy-(3,3-diméthyl)butyrylamino]pentanoyl}amino-5-[2-
(phénylthio)3-pyridyl]thiazole 4-carboxylate de méthyle
Le 2-{2-(S)-[2-(S)-hydroxy-(3,3-diméthyl)butyrylamino]pentanoyl}amino-5-[2-
(phénylthio)3-pyridyl]thiazole 4-carboxylate de méthyle peut ëtre obtenu selon
une méthode analogue à celle décrite à l'étape 1.6 de l'exemple 1. A partir
deA
0,9 g de 2-[2-(S)-pentanoylamino]amino-5-(2-(phénylthio)3-pyridyl]-thiazole-4-
carbo-
xylate de méthyle, obtenu à l'étape 2.4, et de 0,25 g d'acide (S)-2-hydroxy-
3,3-
diméthylbutyrique, en présence de 1 g de PyBOP et de 0,59 g de N-
méthylmorpholine dans 90 ml de N,N-diméthylformamide à 0°C, on obtient
après chromatographie sur colonne de gel de silice éluée avec un mélange
éthyle acétate/éther de pétrole 7 :3(v :v), 0,5 g d'une poudre blanche.
LC/MS : MH+ = 557
RMN décrite dans le tableau (composé n°19)
Exemple 3
2-~2-(S)-[2-(3,5-difluorophényl)acétylamino]pentanoyl~amino-5-[2-(4'-
trifluorométhyl)biphényl]thiazole 4-carboxylate de méthyle (composé
n°5)
F \ N~N~\
H N COzCH3
F
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
Exemple 3.1 : 2-amino-5-[2-(4'-trifluorométhyl)biphényl]thiazole 4-
carboxylate de méthyle
F
F
S U
HAN--<~
N COzCH3
5 Le 2-amino-5-[2-(4'-trifluorométhyl)biphényl]thiazole 4-carboxylate de
méthyle
peut être obtenu selon une méthode analogue à celle décrite aux étapes 1.2 à
1.4 de l'exemple 1, à partir de 26,6 g d'acide 4-trifluorométhyl-2-
biphénylcarboxylique. L'amide de Weinreb de cet acide (28,2 g) est réduit en
aldéhyde avec de l'hydrure de lithium et d'aluminium pour donner ~ 3,7 g d'une
10 huile jaune clair. L'aldéhyde (18 g) est mis en réaction avec 10,3 g de
dichloroacétate de méthyle en présence de 144 ml de méthylate de sodium 0,5
M , puis de 4,7 g de thiourée dans du méthanol à reflux. On obtient 16 g d'un
solide jaune pâle.
LC/MS : MH~ = 379
Exemple 3.2
2-[2-(S)-pentanoylamino]amino-5-[2-(4'-trifluorométhyl)biphényl]thiazole 4-
carboxylate de méthyle
F
0
HZN
.. IV luV~lih'~3
Le 2-[2-(S)-pentanoylamino]amino-5-[2-(4'-trifluorométhyl)biphényl]thiazole 4-
carboxylate de méthyle peut être obtenu selon une méthode analogue à celle
décrite à l'étape 1.5 de l'exemple 1. A partir de 2,26 g de 2-amino-5-[2-(4'-
trifluorométhyl)biphényl]thiazole 4-carboxylate de méthyle, obtenu à l'exemple
3.1, et de 1,43 g de (S)-BocNorvaline, en présence de 3,43 g de PyBOP et de
0,66 g de N-méthylmorpholine dans 120 ml de N,N-diméthylformamide à
0°C,
on obtient après chromatographie sur colonne de gel de silice éluée avec éther
de pétrole/acétate d'éthyle 8 :2 (v :v), 2 g d'un solide jaune pâle.
LC/MS : MH+ = 578
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
21
RMN 300 MHz (CDC13) 8ppm : 0,92 (t, 3H) ; 1,45 (s, 9H) ; 1,70 (m , 2H) ;
1,80 (m, 2H) ; 3,69 (s, 3H) ; 4,40 (m, 1 H) ; 5,10 ( m, 1 H) ; 6,98 (m, 4H) ;
7,27
(m, 2 H) ; 7,32 (d, 2H) .
Le composé obtenu est ensuite déprotégé avec 50 ml d'acide trifluoracétique
suivant le procédé décrit dans l'exemple 1.5. On obtient 1 g d'une mousse
blanche.
LC/MS : MH''' = 478
Exemple 3.3
2-~2(S)-[2-(3,5-difluorophényl)acétylamino]pentanoyl~amino-5-[2-(4'-
trifluorométhyl)biphényl]thiazole 4-carboxylate de méthyle
Le 2-(2(S)-[2-(3,5-difluorophényl)acétylamino]pentanoyl}amino-5-[2-(4'-
trifluoro-
méthyl)biphényl]thiazole 4-carboxylate de méthyle peut étre obtenu selon une
méthode analogue à celle décrite à l'étape 1.6 de l'exemple 1. A partir de
0,94 g
de 2-[2-(S)-pentanoylamino]amino-5-[2-(4'-trifluorométhyl)biphényl]-
thiazole 4-carboxylate de méthyle, obtenu à l'étape 3.2, et de 0,18 g d'acide
3,5-difluorophényle acétique, en présence de 0,55 g de PyBOP et de 0,11 g de
N-méthylmorpholine dans 50 ml de N,N-diméthylformamide à 0°C, on
obtient
après chromatographie sur colonne de gel de silice éluée avec un mélange
éthyle acétate/éther de pétrole 7.3 (v :v), 0,45 g d'une poudre blanche.
LC/MS : MH+ = 632
RMN décrite dans le tableau (composé n°5)
Le tableau qui suit illustre les structures chimiques et les propriétés
physiques
de quelques exemples de composés selon l'invention.
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
22
N ~ ~ N N tn = M
1 = = v ~ _ =I¿
N ._ ._ w N .. ...~' ~ ._ ~t ._ O
~ ~'~ ~ . _ ~p ~ . ' O ~ _ .-. Lf7
cV =~N ==~N
O v= = N v= _ = r-
~~ p ~o M e- N N r ~- N ._ N N r- CV ~- N e- a0 ~ = 00
p.Mt~~ ~'D'~ô* ~'D'O ~= E'p~_ E ~'~~
~ a0~V0'~'Z_ tn~l¿~t_O-p" y h~o~0~'- ~.~~."MN*
~ r~~~N r~~r.O ~~ ~d'~~ N~h~~*_
.~ ...~._-~ ...~~ ...00 __'~ ___"O _N
~~ ZM '' ~ZMrZ_~ ==ao ===ao ~NZf~
N e- N N ~- r- ~ I' N
b N N N ~'a ~ ~ ~ ~ ~ ~ _ ~ 'D ~-. ~ v'a ~-. ~ '-
'~ ~ L
M M O ~ VM v.rvr ~~= v v= r M v= (a
tn c0 CO N ~ ~ ~ ~ ~ N ~? ~ N ~ d~ ~ M ~"~ e- tn
~ Ö M tt7 (~ ~ O M ,~ ~ O ~ O ~ ~ M O ~ P . _ P. E N
°' e" ~==Z ."~-~_ . ~-.M '~~~* ~~~~:* ~_
>~ = N e- M = Z N N N ~ * M M M Z M M M Z M fn N ~
~ O M GO d' CD Cfl O N O M = s- M f~ ~ M M h h ~ N ~ cet' _ ~
.~ O I~ Lt7 Ln 00 00 Cfl 00 ~ 00 tt~ O L 00 ~ O O v O O M
O ~- ~ f~ f~ O ~ M CO ~ N O M i~. ~ O M tn 1~. ~ O ~ f~ ~ ~
m
D.'
I i I i I
W L.
N
O O O O O
z
/ ~ / ~ \ ~ \ ~ /
/ /
/ /
i
0
U U
N
Ö Ö Ö
U U U U U
N _' N N
M ~ I~ I~
.' U" ~:n ~" U ~.'
z x" x s x
U U U U U
f~ (~
Z Z Z Z
Z Z Z Z
O O O O
_a~ a~ a~
i , T >, T
U U ç c c
~ ~ ' n. i~, n. v~ n.
Z Z cn ° rî ° c~ï
U U
tC C
b
.a
0
~i ri ~ vi
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
23
~ ~ ~
N Z = _~-ao* _ ._
_N~N~._._ N ...._" ._~~=N* N~ 00 ._ . ~ _
~ ~ ~ Is
~e=-- ~ZZ~ Z~ ~~_e=- ~e=-~N Z Z~Z ~=NZ
w ~ N ~ ~ ~ r r M N ~ N CV ~ ',~.,D N ~ .Ö I~" t w N
G1 M tN r ~ ~ ~ 'd~ v 'Ö vr v. ~ v v r O ~ ~_ yr N N_ r
O W ~ '. r
C ~~~ ÖMNMM ~ÖN~0~0.-.~= ~ ~OrN,'O NO00*
~'v~ I _ N a~ * ~"' M f' ~ N tt~ f~ e- (V = 00 'û ~ ~ M r M ~ ~
N~N ..,* r ...._ -r r , ~ r N~~v r . ~ ._
~ ~;E ~=_I~== .~___~_ ~-.=O~ ~_~=_'~M .-.O ~_ .__._-.__
v0 ~ ~~ O ~ O r fn ~ N N r ~ _ ~ O ~ N O N ~ Z = r r r
-o N x cV v [yv N -a -v E .~ ~ cL' ~ ~ N N ... r ~ ' ~ E Z r ~ '~ ~ '~ fn
r O ". lfW r = a T' p N ~ r v ~ lfi d' M
~p 'd_ ~ ~ f~ h CO CO 'd~ N CO r. r d. r- O ~ O .d' ~ ~ d' * O ~ ~ 00 i~
o "p '- rt = 1~ N a? M u7 I' N ~' ~i- vi ~ N d' t~ -p" N ~ N r * 00 M ~ ~ N
r ~~r .~r O .~.... O r~NI~Zr ~~._.r r d'~cp* O~._ -r
M ~ , .-.. ~ ~'~ ._~~-.r~_'" ..,_" _ ,~ .~ _ ._
_ _ _~ r _~ ~ ~ _ _
= M c'B N = Z N N = * Z = ~ 2 N Z ~''~ op * _ _ ~ _ = N r N =
~.C M fä- r M " '-Z MMON M fn _* M MOr tn M E r
.,r v ln ~ 'a r-T ~ ~ ~ 'C7 r .v-f fn ~'' .~.; O .f-." ~'''~ ~ * V v .~ ,f..
.e..: ~''
v0 vv v~wr~ ~~ di ~N ~O = _ ~ Vp0 '~M ~ ~ fn
.~. .*, N CO d' h Iw M CO r tI~ O ~ d' 00 N O N CO CO r r M OO M 'd' 1' f~ fs
M N d'
.*. 00 ~ tn M N O Is CO N O L 00 CO 'd~ d~ ~ 00 ~.,~ tn CO CD eh O N 00 r lt~
NI r
Ö . .. Cp ~ Op O r ~ [w Op ~ Ö Ch CO I' N Ö . _ CO ~ ~ Ö M Cfl h r O . _ d' [s
00
ä l.. r
O O O O O O
Z Z Z
Z Z z ~ p O
Ö Ö Ö Ö Ö Ö
N N
/1 ~ ~ N N
N N N
~ ~n ~ ~ ~ vô ~ n ~ V U
x x x x x
U U U U U U
f~ _ (~
Z Z = Z = Z
Z Z O Z O Z
O O O O
a~ a> a~
c c c ~
s (~ ~a~ ~a~ -a~
p n. ~ s ~ s
,., V1 C1 v~ LL v1 ø.
M ~ Z M ~ M o M ~ Z
U ~ U
v 'Wv w
0
Z
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
24
N = ~° a~ ._ ~ ~
._ ~ x x ° x ._ ._
tf) M [~ . _ x N . _ . _ ~- O O? O N . ., .-. . _ . ..~ . _
~j't~.~~ ~ ''r., ~~'~'- ~~~'L7 MCfl~t * ~~_~
w Ö ~I~=.*,~ xx.-.'W . '' ~~ * xNx =~'~
x x N ~ I' * 'i x r
~x ..,r,* Nr=O ~MMI' CO ._~...* rM N M~~Y
y ~~~_ ~ vvl' ~Lf~".., Mrx r ~NOvtn ~Nl(~aCO
Ö4. ~ ~~M~ f~ GOO~~d' ~'* tt~Cflr~* _ ~~N !A rtOffl~N NCOC~rN
~ 'in N d~ ~ ~ r ~. r = * N M O x * N v f~ ~ N_ r _ r CO
TJ b0 et CO f~ _ * r . _ CO r * N pp ~ 00 r M O [' . _ ~ M ' _
d' - . _ _ ~ cD . _ .-. N . _ ._-~ fs ~
G"~ ~ O M CO ~ r N M x ~ r = e=- ~ N vM ~ N ~ ~= Z x r in x ~N
d~ fri M ~~~~' x ~-r NN'C=
b N N N v .-. ~ . ., ~ ~ ~ ch ~ O ~ 'p I' M ~ _ . .. . ., O .p '~ '~ 'fl M
W r
Or~rtrrr'M=vr=vr~.vr~rv~v._~rxN==vM~vCO T O O
ô c~- ~ ~ ~ N ~ ~ = T ~ M ~ = r N ~ ~ .~ 'C6 000 M ~ Ö I~ ~ l~ ~ ~ [y
Ö ~ r' ~..1~ r . _ CO ~ ~ M . _ r CO ' " I' ' e- M . ..
O ~ . ., - O ~ . ..
AM ~ ._~O O ._~._~ ._ .~_~~ ._~COÖ ~O .~_~._~_ ..._~~'~*
Z4.t':."~=~=N.-.=.-.v=~Nx'-'=~~.,~~1' a0~NZ~x*
Cxrcfl opxNx~ x rN x x rxN Z
~.C M.~ ",r ._M NNr M ~ N'a M ~_ ... ._M ~ r * MN ~N ~ fO
r.r .... 'O .~.5 E r-S " 'C7 .~... '-' L _ ,~ .-. .~ .'.." v E .~.5 E * .~.T ~
'O ..r
~r ~ ~~r~I~ ~O ~rl~ N ter= Z Z v0 ~~~ ~r ~.r M
N ~ = M = Cfl ln O r r Cp M N Ln Op M N r = N in Cp O 1~ i' = O O N CO h CO
00 ~ r N ~ 00 ln O N lf) 00 r tn r ~ CO N 00 r tI~ 00 'd~ r f~ f~ d: CO N N
ô r'? ~° r~ ~° ô M cfl rs ao ô . _ ~" ~ . _ ô ~ ~ ~ ~ ô . _ ~t
c~ t~ ~' o r .~~ cfl t~ r
_ ---.. -- : ..
_.. ~ . y m
M
~ ~ ~ ~ ~ ~
O O O O O O
N O O O O O O
O O O O
1
1 1
N N N
N N N N
U ~n U ~n ~ ~ ~ ~ ~ y ~ ~
T x x S x x
U U U U U U
t~ l~J f~
x x x ~ x x
z x z z
0 0 0 0
v v v v
C C ~ C i ~'
~v U ,v U -aï
vi a v, gin. ~,'~ vs n. ~,~~ p â.
M ô M â x M ô x M ô
U 3 U
~ c
v
0
Z tV Ni V: vi
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
N ~~ ~
_~x,
N .
N Z . _~~
~' ôNr'ZZ ~MZZ
* I~.
Wo ~ ~ ~~-â* ~?~-v"°
O,M ~, v v~*
r (fl 'd'
Ö 4:.~ ~ COO ~ N M = ~ ~ N O
b b~DiN ~ ~ ~' O ~ r
~._~
'~
*' Z
ZZ=Z ~~~ ZZ'- '~ M N N C~
N (~ ~ e- _ .~ e- ~- tn xi e- tn O
b N N ~ fn .v...~ "~ fn ~ v -~ ~ Cfl ~ tn CO
w ~v~.r N ~ ~'.CLI
~ CU Ö (~ O s- ~ t~ j ~ f~
rM,~M f' fs~
".-.,...0~.~
.C~- M ~, .-~
~N Z Z Z
.Z~r~" C=NNd-=M ~e-~,e
'Ö vv ~ ~~
'~ t
00 CO O 00 d' f~ I~ I~ fD O
00 tn O~ C? >n 00 ~ tt~ C? M
Ö C'~ CO f~ CO Ö . _ d- (W
_ ____ . . _ . .
i ~ i
_. . ~ ~~n" v.
M .o n
x x x
0. ~ ~ '° x U U U
O O ~ O ~ ~ ~
O O O
Ö Ö Ö
,, cx
f
U
_,.,
N ~ N
û '~ U
Ü ~ x x ~ x
U U U U
N ~ N
x = ~ _ = x x
'" x x
â ~ ô
c ~ T >, >,
c ~ = e
W U ~ s ~ x
,n n. n v~ a v~ a
M O Z ~ M O Z M O M O
O
U ~ U
G c
'fl W b
0 0
Z ~ os Z ~ .-: ri ri
~" c'J N f J C~J
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
26
~ ~
N N ._ ... ~
- N ._Z
~â ~~ ~=N= ö=~-._
'~ e- 'p ~'. ..~
N '- f~ Ö ~ ~ f
p, M ~ r'
M ~ N o0 , " r N 'a
Ö 4:, ~ ~ f~ ~ _ ~- M 'd~
b b~~4~ N ~~ N ~-N M
v' ~
O r, r Q~i~F ~ ~M ~ ~~ ~_ ~_
cmn CO ~c ~ N = vï '~ ~
.d N O yr M '~ r- -Ö
~d0'LC~M* ~~ Is~1'
~ M ~ ~ * N M
C~ M ~ O ~~Cfl =
~ ~ [w ~ ~ M = = e
M~~~v M tn N M !n
in ,~ X00 "= O ~'d ~ ~ r
.~. ,X. CO CO s- ~, LIS Ln LO OO CO CO
O ~- ~ N O M O ~ N
Ö . _ ~ ~ r- O . _ Cp I~ ~
_. _.r..T_. _ . . . . ...
i i ~ i
n"
--
x x x
~ ~ ~ ~ O O
O O O
Ö Ö
1 ~ 1
O O
U U
Ö Ö
U U
1 1
U
H ~ H 1 1
I1
N N N N
x .. M x .,
... ': ~ ~: ~;
U U U U U
N
x x x ~ x x
z ~ ~ z
0 0 0
, a >. T
U U 'â ~ ~â
1 -~ .:
v, a.
o ~ " '~ ô
~ ~ r' ~ ~
c
b 'b
Z ~ 06
N N C'7
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
27
1 ~ ~ 1 0
_ , __ o ,
W.~1". M I~ N ~-~ V cf' = M ~ tt7 ~ O
~, ,~ N ~-~ ' ~ (= O et r r = ~ M ~
'~"Ö ~_~-~_~ tri~~ aj ~~~~~N-'
~~ 0 ~O ~~ _ * Ln '.O .. O = ~.._ .- ..
~yD N = ~r~~ Npp~= (~0 MÖr~~
O. t,.:, M ~ ~ ~ _ ~ ~ = M - -p"
Ö 4~ ~ 'D ~ ~ 00 r f~ M 'p ~ ~ M N 00 'a -â
O W - tii ~- ~ ~- ~ " v ~ ~ lt7 wr
'.~Zt~j~~~ ÖZ~rN
~ *~ ~ o = .-.~CV ~r Ö N N ~N .-.tue
~y~.x. 1 .-.N=Zr =~ ._h~"'=* Z ~_ "~~ ~
1 N = ~ r '~ ... O ~ ~ ...~* M vr ~~_
ôxx v~'~ ~= v'~=== v~~NN ~
r N M r '_ O ~ O
O~f'-N-p o0 ~'~~-â Or~p'a
'' ~ Ö
~ O a~ O ~. M f~ M O N f0 O CO O = M
~ ~ ~ .-. ~ f~
_ = f~ _ ~ ~ ~ f' = N = ~ ., . _
r. ~ M EM ~ Mvr"'~, M ~M~~
ÇD ~~ N fn r ~-. .-: M c0 = ~ ~p '-' N = Z
'y.. 'D = v~p d. N = ~O vr M
f~ CO ~ 1~ r O
Is N d~ 'd~ ~ ~ ~ . ~ ~ ~ h e- f~ ~
O ~- M tn ~ O O M
___ _..__..e . . . __
i
0.'
x x
O O Ö
O O
O
U O O
U U
Ö Ö Ö
1 1 1
N
N
~~./ ~ V
U U U
N
I
Z Z Z
1 1
1 Z
U U U
U U ~
0
Z o: ô
M th
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
28
Dans le tableau
- (S) ou (R) dans les colonnes « R3 » et e<R2, R2~ » indiquent la stéréochimie
du
carbone asymétrique, portant R3 ou R2, dans la formule (I). Pour le carbone
portant R~, l'indication (S) ou (R) ne concerne pas le cas où R2 et R~~
forment
ensemble un groupe oxo ;
- MH+ est la valeur de la masse du composé protonné par un atome
d'hydrogène (masse du composé + 1 ), déterminée par LC-MS.
Les composés de l'invention ont fait l'objet d'essais pharmacologiques qui ont
montré leur intérêt comme substances actives en thérapeutique.
Ils ont en particulier été testés quant à leurs effets d'inhibition de la
production
du peptide ~i-amyloïde (~i-A4). ___ ___
Le peptide ~3-amyloïde ((3-A4) est un fragment d'une protéine précurseur plus
importante appelée APP (Amyloid Precursor Protein). Cette dernière est
produite et présente dans différentes cellules de tissu animal ou humain.
Toutefois, son clivage, dans le tissu cérébral, par des enzymes de type
protéase, conduit à la formation du peptide [3-A4 qui s'accumule sous forme de
plaque amyloïde. Les deux protéases responsables de la production du peptide
amyloide sont connues sous le nom de beta et gamma-secrétases (Wolfe MS,
Secretase targets for Alzheimer's disease: identification and therapeutic
potentiel, J. Med. Chem., 2001, 44(13):2039-60).
Or il a été démontrë que ce dépôt progressif du peptide ~i-A4 est neurotoxique
et pourrait jouer un rôle important dans la maladie d'Alzheimer.
Ainsi, les composés de la présente invention, en tant qu'inhibiteur de la
production du peptide ~i-amyloïde (~i-A4) par inhibition de la gamma
secrétase,
peuvent être utilisés dans le traitement de pathologies comme la démence
sénile, la maladie d'Alzheimer, le syndrome de Down, la maladie de Parkinson,
l'angiopathie amyloïde etlou les désordres cérébro-vasculaires, les démences
fronto-temporales et la maladie de Pick, les démences post-traumatiques, les
pathologies liées à des processus de neuro-inflamation, la maladie de
Huntington et le syndrome de Korsakov.
Les tests ont été réalisés selon le protocole décrit ci-après.
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
29
Pour l'essai cellulaire ~i-amyloïde, la lignée CHO-K1 coexprimant le
CT100 de APP et PS1 M146L clone 30-12 est utilisée. La lignée cible
l'inhibition de gamma secrétase. La préséniline est liée à l'activité gamma-
P
secrétase (Wolfe MS, Haass C., The Role of presenilins in gamma-secretase
activity, (J. Biol. Chem., 2001, 276(8):5413-6) et sa coexpression avec la
protéine amyloïde ou son fragment N-terminal entraîne une augmentation de
secrétion du peptide A1-42 (~i-A4) générant ainsi un outil pharmacologique
permettant d'évaluer l'inhibition par les composés de formule (I) de la
production du peptide ~i-A4. L'ensemencement des plaques de culture de 96
puits est réalisé à raison de 1x105 cellules par puits dans 150p1 de milieu
d'incubation. La présence d'un pourcentage minimal (1,3% final) de sérum
permet l'adhésion cellulaire au plastique après 2-3 heures d'incubation à
37°C,
en présence de 5% C02. Les produits (15p1) sont testés à 10pM DMSO 1
final et sont incubés durant 24-25h à 37°~ ,en présence dé 5% CO~ et de
100% d'humidité. Après cette incubation de 24-25h, les surnageants cellulaires
(100N1) sont transférés dans les plaques ELISA, traitées avec l'anticorps de
capture 6E10 (6E10, épitope : aa1-17, INTERCHIM/SENETEK 320-10), pour
déterminer le taux de peptides amyloïdes sécrété par les cellules en présence
de composés selon l'invention. Une gamme de peptide contrôle, « peptide 1-
40 », synthétique à 5 et 10 ng/ml est traitée parallèlement. Les plaques ELISA
sont incubées pendant une nuit à 4°C.
La quantité de peptide fixé est détectée de façon indirecte en présence d'un
compétiteur correspondant au peptide tronqué, le peptide 1-28 couplé à la
biotine qui est ensuite détectée par la streptavidine couplée à la phosphatase
alcaline. Le substrat, le p-Nitrophényl Phosphate (pNPP FAST p-Nitrophényl
Phosphate, Sigma N2770), donne un produit de réaction soluble jaune lisible à
405nm. La réaction est stoppée avec une solution d'EDTA 0,1M. Pour cela,
après fixation du peptide amyloïde dans la plaque ELISA, 50p1 de péptide 1-28
biotinylé sont ajoutés aux 100p1 de surnageant cellulaire et incubés 30
minutes
à température ambiante. Les plaques ELISA sont ensuite lavées 3 fois. Après
séchage par inversion sur papier absorbant, 100p1 de streptavidine-Alcaline
Phosphatase (Interchim/Jackson ImmunoResearch Laboratories 016-050-
084), sont ajoutés par puits et incubés 1 heure à température ambiante. Les
plaques sont à nouveau laves puis le substrat de la phosphatase alcaline
(pNPP 1 mg/ml) est ajouté à raison de 100p.1 par puits. Après une incubation
de
30 minutes à température ambiante, la réaction est stoppée par ajout de 100,1
par puits d'EDTA 0,1M et la lecture est effectuée à 405nm.
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
Les composés de formule (I) selon la présente invention les plus actifs ont
montré une CE50 (concentration effectrice à 50%) inférieure à 500 nM, plus
particulièrement inférieure à 100 nM. Par exemple le composé n°13 du
tableau
a montré une CE50 de 6nM.
5
Les résultats des tests biologiques montrent que les composés sont des
inhibiteurs de la formation du peptide ~3-amyloïde (~i-A4).
Ainsi, ces composés peuvent être employés dans le traitement des
10 pathologies dans lesquelles un inhibiteur de la formation du peptide ~i-
amyloïde (~i-A4) apporte un bénéfice thérapeutique. Notamment de telles
pathologies sont la démence sénile, la maladie d'Alzheimer, le syndrome de
Down, la maladie de Parkinson, l'angiopathie amyloïde, les désordres cérébro-
vasculaires, les démences fronto-temporales et la maladie de Pick, les
15 démences post-traumatiques, les pathologies liées à des processus de neuro-
inflamation, la maladie de Huntington et le syndrome de Korsakov.
L'utilisation des composés selon l'invention pour la préparation d'un
médicament destiné à traiter les pathologies ci-dessus mentionnées fait partie
intégrante de l'invention.
L'invention a également pour objet des médicaments qui comprennent un
composé de formule (I), ou un sel d'addition de ce dernier à un 'acide
pharmaceutiquement acceptable ou encore un hydrate ou un solvat du
composé de formule (I). Ces médicaments trouvent leur emploi en
thérapeutique, notamment dans le traitement des pathologies ci-dessus
mentionnées.
Selon un autre de ses aspects, la présente invention concerne des
compositions pharmaceutiques renfermant en tant que principe actif, au moins
un composé selon l'invention. Ces compositions pharmaceutiques contiennent
une dose efficace d'un composé selon l'invention, ou d'un sel
pharmaceutiquement acceptable, d'un hydrate ou d'un solvat dudit composé,
et éventuellement un ou plusieurs excipients pharmaceutiquement
acceptables.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration souhaité, parmi les excipients habituels qui sont connus de
l'homme du métier.
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
31
Dans les compositions pharmaceutiques de la présente
invention pour l'administration orale, sublinguale, sous-cutanée,
intramusculaire, intra-veineuse, topique, locale, intratrachéale, intranasale,
transdermique ou rectale, le principe actif de formule (I) ci-dessus, son sel,
son
solvat ou son hydrate éventuel, peut être administré sous forme unitaire
d'administration, en mélange avec des excipients pharmaceutiques classiques,
aux animaux et aux êtres humains pour la prophylaxie ou le traitement des
troubles ou des maladies ci-dessus.
Les formes unitaires d'administration appropriées comprennent les formes par
voie orale telles que les comprimés, les gélules molles ou dures, les poudres,
les granules, les chewing-gums et les solutions ou suspensions orales, les
formes d'administration sublinguale, buccale, intratrachéale, _
intraoculaire,_ .
intra~~~.ale, par inhalation, les formes d'administration sous-cutanée,
intramusculaire ou intraveineuse et les formes d'administration rectale ou
vaginale. Pour l'application topique, on peut utiliser les composés selon
l'invention dans des crèmes, pommades ou lotions.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention sous forme de comprimé peut comprendre les composants suivants
Composé selon l'invention 50,0 mg
Mannitol 223,75 mg
Croscaramellose sodique 6,0 mg
Amidon de maïs 15,0 mg
Hydroxypropyl-méthylcellulose 2,25 mg
Stéarate de magnésium 3,0 mg
Afin d'obtenir l'effet prophylactique ou thérapeutique désiré, la dose de
principe
actif peut varier entre 0,1 mg et 200 mg par kg de poids du corps et par jour.
Bien que ces dosages soient des exemples de situation moyenne, il peut y
avoir des cas particuliers où des dosages plus élevés ou plus faibles sont
appropriés, de tels dosages appartiennent également à l'invention. Selon la
pratique habituelle, le dosage approprié à chaque patient est déterminé par le
médecin selon le mode d'administration, le poids et la réponse dudit patient.
Chaque dose unitaire peut contenir de 0,1 à 1000 mg, de préférence de 0,1 à
500 mg, de principe actif en combinaison avec un ou plusieurs excipients
pharmaceutiques. Cette dose unitaire peut être administrée 1 à 5 fois par jour
CA 02551142 2006-06-21
WO 2005/073226 PCT/FR2005/000032
32
de façon à administrer un dosage journalier de 0,5 à 5000 mg, de
préférence de 0,5 à 2500 mg.
La présente invention selon un autre de ses aspects, concerne également une
méthode de traitement des pathologies ci-dessus indiquées qui comprend
l'administration d'un composé selon l'invention, d'un sel pharmaceutiquement
acceptable ou d'un hydrate dudit composé.