Note: Descriptions are shown in the official language in which they were submitted.
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
NOUVEAU SYSTEME MICROFLUIDIQUE ET PROCEDE DE CAPTURE DE
CELLULES
L'invention,a pour objet un nouveau dispositif microfluidique et son
utilisation pour la capture de sous populations de cellules au sein d'un
fluide biologique.
Plus particulièrement l'invention concerne un dispositif comportant une
chambre de circulation des fluides dont une paroi est dotée d'un greffage
permettant la
capture d'une sous population de cellules au sein d'un échantillon biologique
mis en
circulation dans cette chambre. Ce dispositif permet la capture de cellules
présentes en très
petite quantité dans cet échantillon biologique. L'invention a également pour
objet un
procédé de capture de cellules au sein d'un échantillon biologique, ce procédé
étant
caractérisé en ce qu'il comporte une étape de passage de l'échantillon
biologique dans un
tel dispositif.
Le dispositif de l'invention peut être utilisé pour la purification et la
caractérisation des cellules tumorales circulantes à partir d'un échantillon
de sang du
patient ou pour la purification et la caractérisation de cellules feetales à
partir d'un
échantillon sanguin prélevé chez la mère.
Le cancer du sein est la tumeur maligne la plus fréquente chez la femme
en Europe et aux Etats-Unis. Le contrôle de la dissémination métastatique est
un facteur
important dans le pronostic de la pathologie. La purification et la
caractérisation
moléculaire des cellules tumorales circulantes (CTC) représentent un enjeu
primordial dans
le suivi de patientes, à la fois comme paramètre d'appréciation de la maladie
micrométastatique à un stade précoce, et comine outil phénotypique et
génotypique à un
stade tardif.
La possibilité de purifier et de caractériser des cellules tumorales
circulantes présente un intérêt majeur dans le diagnostic et le suivi de
l'évolution du cancer
du sein mais également d'autres types de cancer comme le cancer de la
prostate, du rein, de
la vessie, du foie, du côlon, du poumon.
Les procédures actuelles de purification de CTC utilisent le CELLection
kit qui fonctionne suivant le principe de séparation des cellules par capture
par des billes
magnétiques sur lesquelles l'anticorps anti-épithélial spécifique est greffé
(Dynal(M RAM
IgGI CELLectionTM Kit). Cette méthode combine plusieurs étapes de
centrifugation très
lourdes. Elle demande pratiquement un jour et demi de manipulation. Les
rendements sont
très faibles. Il y a beaucoup de pertes de CTC principalement dues à leur
accrochage aux
billes magnétiques. C'est pour cette raison que cette technique est
difficilement utilisable
en application clinique de routine.
On connaît dans l'art antérieur des dispositifs comprenant une chambre à
flux laminaire et permettant la capture de cellules.
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
2
Le document WO 03/091730 décrit un dispositif destiné à contrôler la
migration des leucocytes, ce dispositif comportant deux chambres reliées entre
elles par un
canal. L'objectif est d'étudier les mécanismes de liaison des leucocytes aux
parois des
vaisseaux sanguins. Des composés médiateurs de la migration des leucocytes
composés de
cellules endothéliales peuvent être placés dans le canal. Des composés à
tester peuvent
également être placés dans ce dispositif.
Le document US-2003/0044766 décrit un procédé et un dispositif pour
détecter une interaction entre deux types de cellules, l'une étant fixée dans
un passage
soumis à un flux laininaire d'une dispersion comprenant le second type de
cellule.
Ce dispositif est destiné à étudier les interactions entre des populations de
leucocytes et des cellules endothéliales.
Le document A. Pierres et al., Faraday Discuss., 1998, 111, 321-330
décrit l'utilisation d'une chambre à flux laminaire pour étudier la formation
de liaisons
entre des sphères recouvertes de streptavidine et les parois de la chambre
greffées par de la
biotine.
Le document M.R. Wattenberger et al., Biophys. J., vol. 57, April 1990,
765-777 étudie de façon détaillée les paramètres qui régissent l'interaction
entre une
surface recouverte par un ligand et des cellules porteuses d'un récepteur. Des
récepteurs
incorporés dans des liposomes ont servi de modèle de cellule. Les essais ont
été faits dans
une chambre à flux laminaire.
La force de cisaillement, la force de la liaison ligand-récepteur, la densité
de récepteurs sur la surface sont des paramètres importants.
Le document WO 00/23802 décrit une méthode de diagnostic permettant
de détenniner la capacité de liaison de cellules dans un échantillon
biologique consistant à
faire passer cet échantillon sur une surface couverte d'un substrat se liant à
ces cellules.
Ce document est plus particulièrement orienté vers le diagnostic des
anomalies plaquettaires et des thromboses. Les conditions de cisaillement qui
sont
appliquées sont destinées à imiter les conditions que connaissent ces cellules
in vivo dans
les vaisseaux sanguins.
Toutefois, les documents de l'art antérieur concernent essentiellement
des dispositifs et des procédés destinés à étudier des interactions entre deux
populations
cellulaires : les leucocytes et les cellules endothéliales, à étudier
l'adhérence plaquettaire
ou des modèles cellulaires (sphères liposomes) porteurs de récepteurs.
Aucun de ces documents ne concerne la capture et l'étude de cellules
tumorales circulantes ou de cellules foztales.
Les documents de l'art antérieur concernent l'étude du comportement de
populations de cellules qui sont présentes en grande concentration dans les
échantillons
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
3
traités et qui sont couvertes de récepteurs présents à leur surface avec une
densité très
élevée.
Les cellules auxquelles s'intéresse plus particulièrement la présente
invention ont la particularité d'être présentes en très faible concentration
dans les
échantillons biologiques étudiés, au milieu d'autres populations de cellules
fortement
majoritaires. Les récepteurs spécifiques de ces cellules sont exprimés en
faible densité à
leur surface. Ce sont ces deux particularités qui rendent leur capture et leur
identification
au sein d'un échantillon biologique particulièrement difficiles.
L'utilisation d'un dispositif à flux laminaire de l'art antérieur dont une
paroi serait greffée de façon classique par un ligand des CTC ne permet pas de
capturer de
CTC au sein d'un échantillon sanguin car celles-ci sont présentes en trop
faible quantité et
l'interaction antigène-anticorps concernée par cette capture est de l'ordre de
50 à 150
piconewtons, ce qui est extrêmement faible par comparaison avec les
interactions des
molécules d'adhérence entre deux populations de cellules. L'invention concerne
plus
particulièrement la capture d'une population de cellules dont les marqueurs
spécifiques de
surface ont une interaction avec leurs récepteurs d'une intensité allant de
lOpN à 1nN,
avantageusement de 20pN à 500pN, préférentiellement de 30 à 300pN, plus
spécifiquement de 50 à 150pN.
Les problèmes que vise à résoudre la présente invention sont la capture
d'une population cellulaire minoritaire du type CTC au sein d'un échantillon
biologique,
en utilisant une quantité réduite d'échantillon biologique, et en ayant un
rendement de
capture aussi élevé que possible.
Ce problème a pu être résolu grâce à un dispositif comprenant une
chambre de circulation des fluides dont une paroi interne est dotée d'un
greffage
particulier.
Le greffage dont est doté le dispositif de l'invention possède la
particularité de présenter une surface régulière homogène sur laquelle peut
être greffée une
population de ligands spécifiques de la sous population de cellules que l'on
cherche à
capturer. L'homogénéité de surface favorise des interactions ligand-récepteur
ou antigène-
anticorps de faible intensité qui dans d'autres conditions matérielles ne
permettraient pas
d'effectuer cette capture.
Une chambre de circulation des fluides comporte une cavité, de
préférence une cavité de type parallélépipédique, comportant deux orifices
placés à deux
extrémités de la cavité, le fluide étant injecté par un premier orifice et
collecté par un
second orifice.
Les dimensions de la chambre de circulation des fluides sont
avantageusement choisies de façon à ce qu'elle soit une chambre à flux
laminaire. Il peut
également s'agir d'une cavité d'un dispositif microfluidique comme celui
décrit dans le
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
4
document US-6,408,878. Avantageusement, la cavité interne de la chainbre de
circulation
des fluides a un volume inférieur ou égal à 30 l, encore plus
préférentiellement inférieur
ou égal à 12 l, ce qui permet de traiter des échantillons biologiques de
volume réduit.
Avantageusement le dispositif est muni d'une pompe permettant
d'injecter le fluide échantillon dans la chambre de circulation des fluides.
Avantageusement encore le dispositif comporte un circuit de circulation du
fluide en
boucle relié à une pompe, de telle sorte que l'échantillon à traiter passe
plus d'une fois
dans la chambre de circulation des fluides avant d'être collecté.
Selon la présente invention au moins une paroi de la chambre de
circulation des fluides est dotée d'un greffage particulier. De préférence il
s'agit d'une
paroi parallèle au flux qui traverse la chambre de circulation des fluides. De
préférence la
chambre de circulation des fluides est un parallélépipède et l'une de ses
faces internes
comporte un greffage particulier.
La paroi de la chambre de circulation des fluides dotée d'un greffage
particulier est constituée d'un support solide, qui peut être une lame de
verre ou de silicium
ou de toute surface solide métallique comportant des fonctions -OH en surface,
qui est
placée dans la chambre de circulation des fluides.
La surface de support solide, lame de verre, de Si ou autre est
fonctionnalisée par une couche homogène, monomoléculaire auto-assemblée de
chaînes
chlorosilanes.
Une entité protéique de reconnaissance de la population de cellules
cibles, notamment de cellules tumorales circulantes (anticorps ou ligand
protéique) est
greffée directement ou par l'intermédiaire d'un agent de couplage adéquat sur
la couche de
chlorosilanes. La sélectivité de la biomolécule de reconnaissance est
déterminante pour la
capture de la population de cellules cibles. Le support solide (lame) préparé
est ensuite
monté dans le dispositif de circulation des fluides.
La fonctionnalisation du support solide pour la capture cellulaire
comprend 3 étapes : le greffage de cholorosilanes sur la lame de verre, le
greffage d'un
agent de couplage (qui peut être un agent de couplage chimique ou un agent de
type
protéine A ou G) et en final le greffage d'une entité protéique de
reconnaissance
(anticorps, ou le ligand d'un récepteur membranaire d'une cellule). La Figure
1 illustre une
laine de verre de ce type greffée par un anticorps : le support solide est
greffé par une
couche de silane autoassemblée organisée, à laquelle est fixée par une liaison
covalente
une couche d'agent de couplage (linker). Une couche de biomolécules de
reconnaissance
spécifique de la population cellulaire cible est fixée de façon covalente ou
non à l'agent de
couplage. La présence de la couche d'agent de couplage est facultative : selon
une variante
de l'invention, on peut prévoir que les biomolécules de reconnaissance soient
directement
fixées sur la couche de silane autoassemblée organisée.
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
Pour effectuer l'immobilisation de façon covalente de molécules
organiques sur une surface minérale, il est tout d'abord nécessaire de greffer
sur celle-ci
des molécules de couplage qui vont assurer la fixation des molécules
organiques sur le
substrat minéral.
5 Des molécules de couplage organosiliciées ont été proposées dans ce but
par L.A. Chrisey et al. (Nucléic Acids Research, 1996, 24, 15, 3031-3039) et
U. Maskos et
al. (Nucléic Acids Reseai-ch, 1992, 20, 7, 1679-1684). Les molécules
utilisées, à savoir le
3-glycidoxypropyltriméthoxysilane et différents aminosilanes, présentent
toutefois
l'inconvénient de se déposer de façon aléatoire et non reproductible sur la
surface. Ils y
forment un film inhomogène dont l'épaisseur ne peut être contrôlée, film qui
est en outre
peu robuste vis-à-vis de traitements chimiques ultérieurs, l'inhomogénéité du
film
indiquant en effet une mauvaise protection des liaisons siloxaniques. Il est
donc très
difficile d'obtenir un greffage reproductible de ces molécules. Avant de fixer
ou de
synthétiser des oligonucléotides sur le substrat, des réactions de surface
supplémentaires
sont nécessaires pour diminuer la gène stérique à la surface (par exemple
greffage de
molécules hétérocycliques bifonctionnelles, comme décrit par L.A. Chrisey et
al.), rendre
la surface plus hydrophile (U. Maskos et al. décrivent le greffage d'éthylène
glycol, de
penta- ou d'hexa-éthylèneglycol) et/ou pallier la faible réactivité des
fonctions de surface,
opérations supplémentaires qui, elles aussi, ne sont pas maîtrisées.
A. Ulman a décrit, dans Chefu. Rev., 1996, 96, 1533-1554, la formation
de monocouches autoassemblées organisées sur des supports solides à l'aide de
composés
organosiliciés de type alkyltrichlorosilanes fonctionnalisés. Leur utilisation
pour la fixation
de biomolécules est proposée, méthode qui nécessite vraisemblablement, dans ce
contexte,
une modification de la biomolécule par une fonction thiol et une modification
de la surface
par des molécules hétérobifonctionnelles.
Pour pallier ces inconvénients des composés organosiliciés ont été décrits
dans le document WO 01/53303. Ces composés peuvent être utilisés comme
molécules de
couplage pour déposer à la surface d'un support solide, une monocouche
autoassemblée
organisée. De telles molécules ont été utilisées notamment pour
l'imm.obilisation de
biomolécules telles que des acides nucléiques.
Contrairement aux méthodes de greffage de biomolécules de l'art
antérieur, la méthode décrite dans WO 01/53303 permet d'obtenir un support
solide greffé
par des biomolécules immobilisées sur une monocouche autoassemblée organisée.
Cette
caractéristique se traduit par la présentation d'une surface homogène de
biomolécules qui
favorise la capture d'une population minoritaire de cellules, dotées d'une
faible densité de
capteurs spécifiques dans un échantillon biologique circulant sur cette
surface.
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
6
En effet les greffages de l'art antérieur ne permettaient pas d'obtenir une
homogénéité de surface satisfaisante et ce défaut a pour conséquence un faible
taux de
capture de cellules cibles minoritaires au sein d'un échantillon biologique.
Dans le dispositif de l'invention, le support solide est modifié par une
monocouche autoassemblée organisée comprenant au moins un composé
organosilicié
répondant à la formule (I) :
X,
X2\Si-(CH2)n-(A)m-B
X3 (I)
dans laquelle :
- n est compris entre 15 et 35, de préférence entre 20 et 25,
-mestégalà0ouà1,
- Xl, X2 et X3, qui peuvent être identiques ou différents entre eux, sont
sélectionnés dans le groupe constitué par des groupes alkyles saturés en CI à
C6, linéaires
ou ramifiés, et les groupement hydrolysables, au moins l'un de Xi, X2 ou X3
représentant
un groupement hydrolysable,
- A représente un groupement -O-(CH2-CH2-O)k-(CH2);- dans lequel k
représente un nombre entier compris entre 0 et 100, de préférence entre 0 et
5, et i
représente un nombre entier supérieur ou égal à 0, de préférence égal à 0 ou à
1,
- B représente un groupement choisi parmi -OCOR, -OR,
-COOR, -R, -COR, -NR1R2, -CONR1R2, COOR, -SR, un atome d'halogène,
- R, Rl, R2 étant choisis parmi : un atome d'hydrogène, une chaîne
hydrocarbonée éventuellement substituée par un ou plusieurs atomes d'halogène,
saturée
ou insaturée, linéaire ou ramifiée, comprenant 1 à 24 atomes de carbone,
préférentiellement de 1 à 6 atomes de carbone, ou un groupement aromatique
éventuellement substitué par un ou plusieurs atomes d'halogène.
On entend par aromatique tout groupement qui possède un ou
plusieurs noyaux aryles, par exemple un noyau phényle.
On entend par monocouche autoassemblée organisée un assemblage
de molécules dans lequel les molécules sont organisées, organisation due à des
interactions
et à une forte cohésion entre les chaînes des molécules, donnant lieu à un
film anisotrope
stable et ordonné (A. Ulinan, Cheni. Rev., 1996, 96, 1533-1554).
Une monocouche autoassemblée organisée formée sur un support solide
permet l'obtention d'une surface organique dense, homogène et de paramètres
bien définis
à la fois chimiquement et structurellement. La formation de cette monocouche,
obtenue
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
7
grâce aux propriétés d'autoassemblage des composés de formule (I) pour des
valeurs de n,
m, k et i bien définies, est parfaitement reproductible pour chaque composé
organosilicié.
En outre, la formation d'une monocouche autoassemblée organisée, très dense,
protège les
liaisons siloxaniques vis-à-vis des traitements chimiques (acides ou
basiques), ce qui
permet de réaliser des réactions chimiques variées sur cette surface.
Les composés organosiliciés de 'formule (I) utilisés dans la présente
invention présentent avantageusement des fonctionnalités très variées et une
grande
réactivité, eu égard à la nature du groupe A et à la diversité des groupements
B terminaux
utilisables, ces groupement B pouvant bien entendu être modifiés et
fonctionnalisés à
volonté selon les réactions de chimie organique bien connues de l'homme du
métier.
Les composés décrits ci-dessus permettent, de façon particulièrement
avantageuse et de par les composés organosiliciés de formule (I) sélectionnés,
d'immobiliser des biomolécules sur un support de façon fiable et
reproductible, eu égard à
l'homogénéité et à la stabilité de la monocouche autoassemblée organisée
formée sur le
support. Les biomolécules sont immobilisées sur le support modifié par des
liaisons
covalentes fortes, sans dégradation des liaisons siloxaniques développées
entre les
composés organosiliciés et le support solide.
Des supports solides convenables sont, de manière générale, ceux dont la
surface est hydratée et/ou ceux dont la surface présente des groupements
hydroxyles. De
préférence, ledit support est sélectionné dans le groupe constitué par les
verres, les
céramiques (par exemple de type oxyde), les métaux (par exemple l'aluminium ou
l'or) et
les métalloïdes (tel que le silicium).
Au sens de la présente invention, on entend par hydrolysable tout
groupe capable de réagir avec un acide en milieu aqueux de façon à donner les
composés
X1H, X2H ou X3H, XI, X2 et X3 étant tels que définis dans la formule (I).
Selon un mode de mise en oeuvre avantageux, ledit groupement
hydrolysable est sélectionné dans le groupe constitué par les atomes
d'halogène, le
groupement N(R)2 et les groupements -OR', R' étant un groupe alkyle saturé en
CI à C6,
linéaire ou ramifié.
En ce qui concerne les groupements B et les groupements hydrolysables,
des atomes d'halogène convenables sont aussi bien le fluor que le chlore, le
brome ou
l'iode.
Selon un autre mode de mise en oeuvre avantageux, XI, X2 et X3
représentent des atomes de chlore.
Avantageusement, n est supérieur ou égal à 22.
L'utilisation de supports solides modifiés selon la présente invention est
particulièrement avantageuse pour la préparation de supports sur lesquels sont
fixés, de
façon covalente, des entités protéiques (anticorps, ligand d'un récepteur
cellulaire,
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
8
protéine...) susceptibles de fixer de façon sélective des cellules
représentant une sous
population au sein d'un échantillon biologique.
La préparation du support solide greffé selon la présente invention
comprend les étapes suivantes :
a) préparation d'un support solide modifié par une monocouche
autoassemblée organisée comprenant au moins un composé organosilicié répondant
à la
formule (I) telle que définie précédemment, dans lequel lesdits composés
organosiliciés
présentent à leur extrémité une fonction acide carboxylique hydroxyle ou amine
protégée ;
b) éventuellement, déprotection de la fonction acide carboxylique
hydroxyle ou amine ;
c) éventuellement, greffage d'un agent de couplage sur le support solide
modifié ;
d) greffage de l'entité protéique.
L'étape a) est avantageusement réalisée par les étapes suivantes
i) élimination des contaminants du support solide et hydratation et/ou
hydroxylation de sa surface,
j) introduction dans un mélange d'au moins deux solvants comprenant au
moins un solvant hydrocarboné non polaire, sous atmosphère inerte, d'un
composé
organisilicié de formule (I) telle que définie ci-dessus, ledit composé
présentant à une
extrémité une fonction acide carboxylique hydroxyle ou amine protégée,
k) silanisation du support obtenu à l'étape i) par immersion dans la
solution préparée à l'étape j),
1) éventuellement, recuit du support silanisé obtenu à l'étape k), portant la
monocouche autoassemblée, à une température comprise entre 50 et 120 C, pour
une durée
de 5 minutes à une nuit, et
m) rinçage du support modifié obtenu à l'étape k) ou 1) à l'acide d'un
solvant, de préférence polaire.
La préparation de supports solides fonctionnalisés par une couche de
silanes est illustrée de façon détaillée dans le document WO01/53303.
Par contaminants du support solide, on entend tout composé tel que
de la graisse, des poussières ou autres, présent à la surface du support et
qui ne fait pas
partie de la structure chimique du support lui-même.
Selon la nature du support solide, l'étape i) peut être effectuée à l'aide
d'un ou plusieurs solvants et/ou oxydants et/ou hydroxylants (par exemple un
mélange
sulfochromique), d'une solution de détergent (par exemple Hellmanex(D), d'un
traitement
photochimique à l'ozone ou tout autre traitement approprié.
L'étape j) peut avantageusement être réalisée dans un mélange d'au
moins un solvant hydrocarboné non polaire et d'au moins un solvant polaire.
Dans ce cas,
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
9
les proportions volumiques de solvant non polaire et de solvant polaire sont
de préférence
comprises entre 70/30 et 95/5.
A titre d'exemple et de façon non limitative, au cours de l'étape j), un
solvant hydrocarboné non polaire utilisable est le cyclohexane et un solvant
polaire
utilisable est le chloroforme.
Lors de l'étape j), la concentration du composé organosilicié dans le
mélange de solvants est de préférence comprise entre 1.10-5 et 1.10-2
mole/litre.
L'étape k) de silanisation du support peut être effectuée pendant un
temps compris entre 1 minute et 3 jours et à une température comprise entre -
10 C et
120 C selon les solvants utilisés.
L'étape c) de greffage d'un agent de couplage peut être mise en oeuvre de
façon différente en fonction de la nature de la fonction terminale du groupe
de formule (I).
(i) Dans le cas des chaînes à terminaison -NH2 :
Un agent de couplage homo-bifonctionnel ou hétéro-bifonctionnel peut
être choisi. Le groupement fonctionnel destiné à réagir avec la protéine est
soit le
carbonyle en a du sulfosuccinimidyl (BS3) soit l'ester de sulfo NHS (Sulfo-
SMCC). Il
peut s'agir de :
- BS3 : subérate de bis(sulfosuccinimidyle) (Staros JV. (1982) N-
Hydroxysulfosuccinimide active esters: Bis(N-hydroxysulfosuccinimide) esters
of two
dicarboxylic acids are hydrophilic, membrane-impermeant, protein cross-linker.
Biochemistry 21:3950.), que l'on met en oeuvre suivant le schéma 1
S 3Na
N0
~-NH2
Na035 p O 1303Ne ~---
O
~N~"O-G-CMa-'CH7-Gti-CFL~CFtz"CHz-C--0-N ~
~O O
SCHEMA 1
- Sulfo-SMCC : Carboxylate de 1-cyclohexane-4-(N-maléimidométhyle)
sulfosuccinimidyle (Samoszuk MK et al. (1989) Antibody, Immunocojugates.
Radiopharm
2:37), que l'on met en oeuvre suivant le schéma 2:
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
0
NH2 NH---~
0 o sOo
5 O-N Na+O' 2 ~
N _~\-~0 O
~
SCHEMA 2
10 - A la place d'un agent de couplage chimique, la protéine A (PA) ou la
protéine G (PG) peuvent jouer le rôle d'agent de couplage (Eliasson M, Olsson
A,
Palmcrantz E et al. (1988) Chimeric-binding receptors engineered from
Staphylococcal
protein A and Streptococcal protein G. J Biol Chem 263:4323). Dans ce cas, PA
ou PG
peut être couplé directement à la chaîne chlorosilane terminée en NH2 en
présence de EDC
[Chlorydrate de 1-éthyle-3-(3-Diméthylaminopropyle)carbodiimide] (Grabarek Z
and
Gergely J (1990) Zero-length crosslinking procedure with the use of active
esters. Anal
Biochem 185:131). Cette variante est illustrée par le schéma 3
[~-NH2 + NH2 ~~ - NH2
Protéine A ou G
SCHEMA 3
(ii) Dans le cas des chaînes terminées en OH :
Un agent de couplage hétéro-bifonctionnel est :
- PMPI : Isocyanate de N-(p-maléimidophényle) (Annunziato ME et al.
(1993) p-maleimidophenyl isocyanate : a novel heterobifunctionnal linker for
hydroxyl to
thiol coupling. Bioconjug Chem 4:212) dont la mise en oeuvre se fait comme
illustré par le
schéma 4:
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
11
~- p H 0---
N O
O
-=.,~ ~ / o
N
4
SCHEMA 4
(iii) Dans le cas des chaînes terminées en COOH
L' agent de couplage hétéro-bifonctionnel est :
- KMUH : N-hydrazide de l'acide k-maléimidoundécanoique (Trail PA,
et al (1993) Science 261:212) dont la mise en oeuvre se fait comme illustré
par le schéma
5:
/ H
LcooH N ",NH-çQ-~
0 0
H
/N N
0 NHz
SCHEMA 5
- Dans le cas des chaînes à terminaison en -COOH, il est également
possible d'utiliser la protéine A ou la protéine G comme décrit ci-dessus.
A l'étape d) on choisit l'entité protéique en fonction de l'utilisation que
l'on souhaite faire du dispositif :
La nature de la sous-population de cellules que l'on cherche à capturer
est déterminante pour le choix de cette entité protéique. Cette dernière doit
présenter une
affinité spécifique pour la sous-population ciblée.
La stratégie de la capture des CTC est fondée sur les propriétés de
reconnaissance des molécules de la surface cellulaire. Ces molécules sont des
molécules
d'adhérence cellulaire, ou des récepteurs membranaires. La capture cellulaire
est médiée
par l'interaction de ligands spécifiques avec ses récepteurs ou d'anticorps
dirigés contre un
épitope d'une molécule d'adhérence ou d'un récepteur.
Quelle que soit l'entité protéique utilisée pour la capture cellulaire
(ligand ou anticorps), il est nécessaire de modifier les fonctions NH2
latérales des lysines
de la protéine de reconnaissance et de les transformer en groupement
hydrosulfure (SH).
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
12
Dans le cas d'un anticorps, pour une reconnaissance antigène-anticorps,
la modification du NH2 latéral de la lysine située sur la portion Fc a une
grande importance
car elle permet de laisser les sites de liaison libres sur les fragments Fab,
ces sites étant
nécessaires à la reconnaissance des antigènes cellulaires.
La stratégie de fixation de l'entité protéique de reconnaissance peut
consister dans l'utilisation du réactif SATA Acétate de (N-Succinimidyl-S-
acétyle) par un
procédé comprenant deux étapes (Duncan RJS, Weston PD et al. (1983) A new
reagent
which may be used to introduce sulfhydryl groups into proteins, and its use in
the
preparation of conjugates for immunoassays. Anal Biochem 132:68) comme
illustré sur les
schémas 6 et 7, ou du réactif de TRAUT (2-iminothiolane=HCl), comme illustré
sur le
schéma 8, (Ghosh SS, Kao PM, McCue AW et al. (1990) Use of maleimide thiol
coupling
chemistry for efficient suntheses of oligonucleotide-enzyine conjugate
hybridization
probes. Bioconjug Chem 1:71) :
A. Réaction des NH2 avec SATA (étape I)
0
NH2 N~0 J~ S~CH3 H$~CH3
+
H,OH
SCHEMA 6
B. Déprotection des SH par l'hydroxylamine (étape II)
5 CH3 + NHzOH=HCt $x
H H
II
HO-N-C-CH3
H
SCHEMA 7
C. Modification des NHZ par le réactif de TRAUT
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
13
s NH2C( NH2CI
NH2 + ~ -- ~ sH
N
SCHEMA 8
Quelques exemples d'anticorps reconnaissant des molécules de surface et
destinés à être greffés dans le dispositif de l'invention :
a) Sur-expression de la molécule d'adhérence intercellulaire Ep-CAM
Les tumeurs solides du sein dérivant des tissus épithéliaux sur-expriment Ep-
CAM, une
molécule d'adhérence intercellulaire (Gastl G, Spizzo G, Obrist P et al.
(2000) Ep-CAM
overexpression in breast cancer as a predictor of survival. The Lancet 356:198
1). Ep-CAM
est également désigné sous les noms : 17-1A, ESA, EGP40. C'est une
glycoprotéine
épithéliale transmembranaire de 40 kDa codée par le gène GA733-2 (Linnenbach
AJ,
Woicierowski J, Wu S et al. (1989) Sequence investigation for the major
gastrointestinal
tumor-associated antigene family, GA733. Proc natl Acad USA 86:27; Gdttlinger
HG,
Funke I, Johnson JP et al. (1986) The epithelial cell surface antigen, a
target for antibody-
mediated tumor therapy: its biochemical nature, tissue distribution and
recognition by
different monoclonal antibodies. Int J Cancer 38:47). Elle est reconnue comme
un antigène
tumoral sur-exprimé dans la plupart des carcinomes, et est impliquée dans le
processus
métastatique (Litvinov SV, Velders MP, Bakker HA et al. (1994) Ep-CAM : a
human
antigen is a homophilic cell-cell adhesion molecule. J Cell Biol 125:437). Ep-
CAM est
suggéré comme cible thérapeutique, particulièrement en immunothérapie. Divers
anticorps
monoclonaux, 17-1A, MOC31, Ber-EP4, et HA-125 sont dirigés contre divers
épitopes de
cette molécule. L'anticorps monoclonal Ber-EP4 reconnaît deux épitopes de 34
et 39 kDa
de Ep-CAM (Latza U, Niedobitek G, Schawarting R et al. (1990) Ber-EP4: a new
monoclonal antibody which distinguishes epithelia from mesothelia. J Clin
Patho143:213).
Ber-EP4, ou MOC31 ou HA-125 peuvent être liés soit directement sur la
protéine A ou la protéine G, soit à la chaîne chlorosilane à terminaison NH2,
OH ou
COOH, par l'intermédiaire d'un agent de couplage adéquat.
b) Sur-expression de HER-2
Le gène du récepteur du facteur de croissance humain 2(HER-2)lraeu (c-
erbB-2) est localisé sur le chromosome 17q et code pour un récepteur protéique
transmembranaire avec une activité tyrosine kinase, de la famille des
récepteurs des
facteurs de croissance épidermique (EGFR) ou la famille des HER.
L'amplification du
gène HER-2/neu ou la sur-expression de la protéine HER-2 (p185HEI) sont des
facteurs
pronostiques dans le cancer du sein et de divers carcinomes (Slamon DJ, Clark
GM, Wong
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
14
SG et al. (1987) Human breast cancer: correlation of relapse and survival with
amplification of the Her-2-/neu oncogene. Science 235:177). L'anticorps anti-
HER-2
(trastuzumab) est utilisé en thérapie anti-tumorale.
L'anticorps anti-HER-2 (anti-humain ErB2) est utilisé comme marqueur
spécifique pour capturer les CTC du cancer du sein. Associé à la détection par
l'anticorps
Ber-EP4, il jouera le rôle d'un marqueur potentiel des CTC.
Le greffage de l'anticorps anti-Her-2 peut être fait comme celui de
l'anticorps Ber-EP4.
c) Sur-expression.de MUC1
Les mucines sont exprimées par divers types de cellules épithéliales
normales dans un cadre environnemental rugueux comme l'interface air/eau du
système
respiratoire, l'environnement acide de l'estomac, l'environnement complexe du
tractus
intestinal et les surfaces épithéliales sécrétrices des organes spécialisés
comme le foie, le
pancréas, la vésicule biliaire, les reins, les glandes salivaires, les glandes
lacrymales et
l'oeil. La famille des mucines comprend au moins 17 molécules sécrétées ou non
et joue un
rôle central dans le maintien de l'homéostase (Hollingsworth MA and Swanson
BJ. (2004)
Mucins in cancer: protection and control of the cell surface. Nat Reviews
Cancer 4:45).
Les mucines sont des glycoprotéines de haut poids moléculaire avec des
répétitions en tandem de séquences riches en sérine, thréonine et prolines
attachées à des
oligosaccharides par des liaisons 0-glycosidiques. MUCI est une protéine de
membrane
intégrale. Dans les tumeurs du sein, MUC1 est sur-exprimée et glycosylée de
façon
aberrante (Rahn JJ, Dabbagh L, Pasdar M et al. (2001) The importance of MUCl
cellular
localization in patients with breast carcinoma: an immunohistologic study of
71 patients
and review of the literature. Cancer 91:1973).
L'anticorps anti-MUC1 (CT2 Mab) est utilisé comme marqueur
spécifique pour capturer les CTC du cancer du sein. Associé à la détection par
l'anticorps
Ber-EP4, il jouera le rôle d'un marqueur potentiel des CTC.
Le greffage de l'anticorps anti-MUCI peut être fait comme celui de
l'anticorps Ber-EP4.
Les antigènes de membrane choisis comprenant une glycoprotéine de
membrane Ep-CAM, la glycoprotéine MUC1, et un récepteur du facteur de
croissance
HER-2/neu sont des marqueurs tumoraux sur-exprimés dans les CTC. De ce fait,
les
cellules tumorales peuvent révéler une densité de molécules de surface
cellulaire
optimisée, favorisant ainsi la capture cellulaire spécifique. Il est à noter
que la densité de
CTC dans le sang périphérique est un paramètre totalement inconnu. Ce
paramètre peut
varier selon le degré de la pathologie et tourne autour de 1 CTC pour 103 à
2x104
leukocytes.
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
Les anticorps dirigés contre ces molécules sont spécifiques et
suffisamment sélectifs pour perinettre une capture de CTC dans les meilleures
conditions
possibles en termes de conservation, de morphologie cellulaire et de
viabilité.
La stratégie d'utilisation des longues chaînes organosiliciées (n = 22)
5 pour le greffage des surfaces, l'addition d'un agent de couplage, et le
greffage de la portion
Fc de l'anticorps sont des atouts pour optimiser la capture cellulaire.
En effet, la longueur de l'ensemble X3-Si-(CH2)22-agent de couplage-
anticorps varie entre 40 à 50 ~ produisant ainsi une grande flexibilité dans
une
présentation favorable de l'anticorps à l'antigène cellulaire.
10 En effet, en admettant une densité de récepteurs HER-2 sur-exprimés sur la
surface totale
de la cellule tumorale de 106, une évaluation rapide donne 8 récepteurs dans
une surface
carrée de 10 A de côté. Selon l'évaluation par la microscopie de force
atomique (AFM), la
densité de greffage de chaînes organosiliciées étant de 3 à 5 molécules par
nm2, cette
configuration est très favorable à l'obtention d'un bon greffage d'agent de
liaison et
15 d'anticorps.
EXEMPLE
1- Dispositif
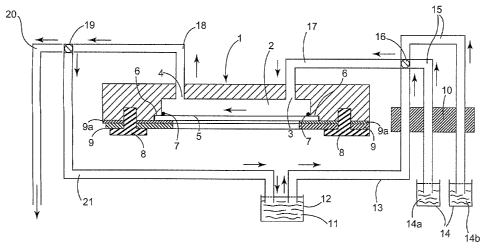
La figure 2 illustre la capture cellulaire au moyen d'une chambre à flux
laminaire.
Le présent procédé de capture cellulaire utilise une chambre à flux
laminaire (1), fabriquée en Plexiglas , comprenant une cavité (2) de
dimension 20 x 6 x
0,2 mm3 (L x 1 x h), et reliée à l'extérieur par des ouvertures d'entrée (3)
et de sortie (4)
pour la circulation des cellules et des fluides.
La paroi (5) constituant le plancher de la chambre est une lame de verre
ou de Si cristallin amovible et fonctionnalisée chimiquement. Cette lame est
appliquée
dans une encoche (6) contre la cavité (2) de la chambre (1) au moyen d'un
joint torique (7)
destiné à en assurer l'étanchéité. On peut prévoir que les extrémités de la
cavité (2) soient
arrondies de façon à favoriser le positionnement du joint torique (7). Elle
est vissée (8) sur
la base en Plexiglas(P par une plaque métallique (9). Un joint en Téflon (9a)
sépare la
lame de verre de la plaque métallique. Tout autre moyen connu de l'homme du
métier et
permettant la fixation du support solide dans la cavité peut être utilisé.
Dans le cas illustré
sur la figure 2, et selon une variante préférée de l'invention, la plaque
métallique (9)
comporte dans sa partie centrale une zone transparente (non hachurée) qui
permet
d'observer l'intérieur de la cavité (2) à l'aide d'un microscope (non
représenté). De même
pour le joint en Téflon (9a) comporte une zone centrale transparente (non
hachurée). La
proportion des zones opaques et transparentes peut varier.
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
16
Les arrivées et les évacuations des fluides par les ouvertures (3, 4) sont
placées sous le contrôle d'une pompe péristaltique (10) imposant le débit et
la vitesse
d'écoulement.
La pompe péristaltique (10) prélève l'échantillon biologique (11) dans un
réceptacle (12), prévu à cet effet, fermé de façon à être maintenu stérile, et
l'injecte dans le
tube de circulation (13). Elle peut prélever des réactifs (14a, 14b) dans les
réceptacles (14),
également fermés de façon à assurer la bonne conservation des produits qu'ils
contiennent,
et les injecter dans les tubes de circulation (15). Une vanne (16) à
l'intersection des tubes
de circulation (15), (13) et (17) permet de réguler la connexion entre les
tubes de
circulation (15) et (13) et le tube (17) d'introduction dans la chambre à flux
laminaire (1).
Les fluides traversent la chambre à flux laminaire (1) sous contrôle de la
pompe
péristaltique (l0) et en sortent par le tube de sortie (18). Une vanne (19)
permet d'orienter
le fluide du tube de sortie (18) soit vers un tube d'évacuation (20) soit vers
un tube de
recyclage (21) relié à la cavité (2), qui permet de faire passer à nouveau le
fluide dans la
chambre à flux laminaire (1). Sur la figure 2 le tube de recyclage (21) est
relié à la cavité
(2) par l'intermédiaire du réceptacle (12), mais il est possible de prévoir
une connexion
directe entre le tube de recyclage (21) et la cavité (2). Le recyclage de
l'échantillon
biologique par ce circuit permet un meilleur rendement de capture des cellules
cibles. Le
sens de la circulation des fluides dans le dispositif est indiqué par des
flèches.
Le dispositif décrit ci-dessus constitue un exemple de mise en eeuvre de
l'invention. D'autres variantes sont incluses dans la portée de l'invention.
La
caractéristique essentielle réside dans la mise en circulation de
l'échantillon biologique
dans une chambre de circulation des fluides permettant un écoulement en flux
laminaire
dont une paroi interne est dotée d'un greffage particulier décrit ci-dessus.
Le circuit de
circulation des fluides en dehors de la chambre de circulation des fluides
peut être aménagé
en fonction des réactifs que l'on souhaite ou non utiliser. Selon une variante
de l'invention,
le dispositif peut comporter plusieurs chambres de circulation des fluides
placées en série
ou en parallèle. Cette chambre de circulation des fluides peut être incluse
dans tout
dispositif microfluidique de configuration appropriée à la capture de
cellules, comme par
exemple un dispositif microfluidique tel que celui décrit dans le document US-
6,408,878.
Lorsque l'échantillon biologique est passé à travers la chambre de
circulation des fluides une ou plusieurs fois, en fonction du protocole
expérimental choisi,
il est possible de récupérer les cellules qui se sont fixées sur la paroi
greffée selon
l'invention en injectant dans la chambre de circulation des fluides un réactif
permettant le
décrochage de ces cellules. Elles sont ensuite récupérées en vue de leur
analyse et de leur
comptage.
Selon une variante de l'invention, le dispositif de la figure 2 peut être
construit de la façon suivante : t
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
17
Un support solide greffé par des fonctions chlorosilane à terminaison
hydroxyle, amine ou acide protégées est fixé dans la cavité (2) comme décrit
ci-dessus, de
façon à fermer la cavité (2). Les autres éléments mécaniques du dispositif
sont placés
comme sur la figure 2. Un réactif de déprotection des fonctions terminales est
injecté dans
la cavité (2) à partir de l'un des réceptacles (14), puis un agent de couplage
est injecté dans
la cavité (2) et enfin la biomolécule de reconnaissance. On peut en effet à
partir du
dispositif mécanique décrit sur la figure 2, fonctionnaliser la paroi (support
solide) greffée
par les chlorosilanes par une séquence appropriée d'injections de réactifs,
des étapes de
rinçage pouvant être prévues de façon intermédiaire.
2- Protocole d'isolement des CTC
Un volume de 3 à 5 ml de sang périphérique de patients développant un
cancer du sein et/ou de témoins sans cancer est prélevé d'une façon classique
dans un
milieu de Hanks (In VitroGen) contenant 5mM d'EDTA (acide éthylène diamine
tétra
acétique). Les cellules nuclées (leukocytes et cellules tumorales) sont
ensuite séparées des
globules rouges et des plaquettes sur un gradient contenant du ficoll
(Amersham) dans des
tubes pré-adaptés (Leucosep). Les fractions de cellules contenant les
leukocytes et les CTC
sont ensuite diluées dans du milieu de Hanks contenant 0,1 % de HSA (albumine
de sérum
humain) à raison de 1 x 106 cellules par ml avant de les souinettre à
l'isolement au moyen
de la chambre à flux laminaire. Le débit de la pompe péristaltique est réglé
autour de 50
jil/min correspondant à une vitesse de cisaillement de 15 s 1 et une
contrainte de
cisaillement de 0,15 dyne/cm2.
La récupération des CTC isolées peut être effectuée par dissociation de la
liaison antigène-anticorps par diverses méthodes : par compétition en
utilisant un inhibiteur
peptidique; soit en augmentant la vitesse de flux d'un facteur de 10 à 100,
soit par une
dissociation des ponts S=S des fragments des anticorps pour le relargage des
cellules
capturées.
D'autres essais ont été faits sur des dispositifs microfluidiques et des
chambres à flux laminaires dont les dimensions sont données dans les tableaux
1 et 2 ci-
dessous :
L x 1 x h mm3 Volume ( 1
20x6x0,10 12
20x6x0,15 18
20 x 6 x 0,20 24
20x6x0,25 30
Tableau 1 : dimensions de la chambre à flux laminaire
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
18
L x 1 x h( m3) Volume (nl)
100 x 50 x 200 1
100 x 100 x 200 2
150 x 100 x 200 3
150 x 150 x 200 4,5
Tableau 2: dimensions du dispositif microfluidique
3- Caractérisation moléculaire du phénotype tumoral
Divers procédés pour la caractérisation des CTC isolées peuvent être
appliqués.
a) Caractérisation morphologique, immuno-c ologique et génétique
des CTC
- par imtnuno-histochifnie (IHC) : détection de marquage par des
anticorps : antikératine (CK19, CK20, CK22), anti-CD45 spécifique des
leukocytes
- Marqueurs tunzof-aux (IHC et RT-PCR) : sur-expression de HER-
2/neu, téloinérase, MUC-1
b) Caractérisation cyto genétique
- CGH (hybridation in situ comparative)
- FISH (fluorescenee in situ lzybridation)
4- Autres applications
a) Le dia n~ ostic prénatal
Le présent procédé peut également être utilisé en obstétrique dans le
diagnostic prénatal pour des analyses génétiques précoces de cellules foetales
dans le sang
maternel (Bianchi D. (1999) Fetal cells in the maternal circulation:
feasibility for prenatal
diagnosis. Br J Maematol 105:574; Fisk N. (1998) Maternal-fetal medicine and
prenatal
diagnosis. Curr Opin Obstet Gynecol 10:81). La population de cellules faetales
visées dans
notre procédé est constituée par des cellules trophoblastiques, de type
épithélial, et de
courte vie pendant le premier trimestre de gestation (Shulman LP. (2003) Fetal
cells in
maternal blood. Current Women's Health Reports 3:47). La densité de cette
population de
cellules est très basse :- 1 trophoblaste feetal pour 106 cellules
maternelles. La capture
cellulaire peut se faire à l'aide d'anticorps dirigés contre des antigènes
épithéliaux
membranaires, ou un anticorps dirigé contre le lactogène placentaire humain
(Latham SE,
Suskin HA, Petropoulos A et al. (1996) A monoclonal antibody to human
placental
lactogen hormone facilitates isolation of fetal cells from maternal blood in a
model system.
Prenat Diagn 16:813).
CA 02573044 2007-01-08
WO 2006/016044 PCT/FR2005/001753
19
Le présent procédé présente un avantage certain par rapport aux
méthodes existantes comme la cytométrie de flux ou les billes magnétiques.
Les cellules fertales isolées sont soumises à une caractérisation
moléculaire génétique pour la détection d'anomalies génétiques (PCR, FISH).
b. Détection de CTC dans le sang périphérique et la moelle osseuse
Une autre application du présent procédé concerne la détection de CTC
dans la moelle osseuse et le sang périphérique (Chapter 15 : Tumor Cell
Contamination
(2001) Autologous blood and Marrow TransplantationX: Proceedings of the Tenth
International Symposium, ed by Karel A. Dicke and A. Keating).
Dans le premier cas, la présence de CTC métastatique dans la moelle
osseuse permet d'évaluer le pronostic afin de cibler les thérapies.
Dans le deuxième cas, le présent procédé concerne une évaluation en
deux étapes sur une même patiente : 1) sur la présence et le pourcentage de
CTC dans le
sang périphérique avant une chimiothérapie ablative de la moelle, et 2)
l'absence de CTC
sur le prélèvement sanguin traité et purgé pour obtenir une population de
cellules souches
hématopoïétiques pour une transplantation autologue.