Note: Descriptions are shown in the official language in which they were submitted.
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
1
DERIVES DE PYRIDINE, LEUR PREPARATION, LEUR APPLICATION EN
THERAPEUTIQUE.
La présente invention se rapporte à des dérivés de pyridine, à leur
préparation et à
leur application en thérapeutique.
La demande de brevet internationale WO 03/082191 décrit des dérivés de
pyridine de formule :
T4
r3
r2
rs
/ ~ (1)
_N TI
r6
T7
dans laquelle les substituants rl à r7 ont différentes valeurs.
La demande de brevet WO 2002/055502 décTit des composés de formule :
r4 ri
(2)
r3 N r2
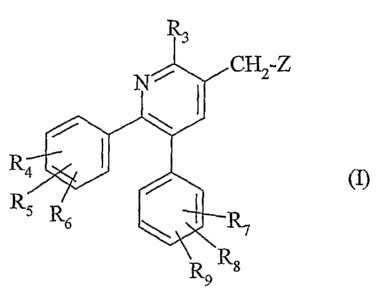
La présente invention a pour objet des composés répondant à la formule :
3
N CH2 Z
R4 1
(1)
R
s R
6 P-7
R9 R$
dans laquelle :
- Z représente un groupe N(Rl)XR2, N(Rl)COOR'2 ou OCON(Rl)R'2 ;
- X représente un groupe -CO-, -S02-, -CON(Rl0)- ou -CSN(RI0)- ~
- Rl représente un atome d'hydrogène ou un groupe (C1-Cq.)alkyle ;
- R2 représente :
un groupe (C3-CI O)alkYle non substitué ou substitué par un groupe CF3 ;
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
2
un radical carbocyclique non aromatique en (C3-C12), non substitué ou
substitué
une ou plusieurs fois par des substituants identiques ou différents choisis
parrni
un groupe (C1-C4)alkyle, hydroxyle, (Cl-C4)alcoxy, (Cl-C4)alkylthio, cyano ;
un radical hétérocyclique de 4 à 8 atomes oxygéné, soufré ou azoté, saturé ou
insaturé, non substitué ou substitué par un ou plusieurs substituants
identiques
ou différents choisis parmi un atome d'halogène, un groupe (C1-C4)alkyle,
hydroxyle, trifluorométhyle, (Cl-C4)alcoxy, trifluorométhoxy, (Cl-
C4)alkylthio, cyano, nitro ;
un indolyle non substitué oû substitué par un atome d'halogène ou par un
groupe
(Cl-C4) alkyle, trifluorométhyle, hydroxyle, (Cl-C4)a.lcoxy, trifluorométhoxy,
(C 1-C4)alkylthio, cyano, nitro ;
ïin tétrahydronaphtalényle -1 ou -2 ; un naphtalényle -1 ou -2 ;
un benzothiophényle ou un benzofuryle ;
un phényle non substitué ou substitué une ou plusieurs fois par des
substituants
identiques ou différents choisis parmi un atome d'halogène, un groupe (C 1-
Cq.)
alkyle, trifluorométhyle, trifluorométhoxy, hydroxyle, (C1-C4)alcoxy, cyano,
nitro, (C 1 -C4)alcanoyle, phényle, un groupement S(O)nAlk ouNR13R14 =
un benzodioxyle ;
un phénoxyméthyle, un 1-phénoxyéthyle, un 1-méthyl-1-phénoxyéthyle, les
groupes phényle étant non substitués ou substitués une ou plusieurs fois par
des
substituants identiques ou différents choisis parmi un atome d'halogène, un
groupe (Cl-C4)alkyle ou trifluorométhyle ;
un phénylcyclopropyle, le groupe phényle étant non substitué ou substitué une
ou
plusieurs fois par des substituants identiques ou différents choisis parmi un
atome d'halogène, un groupe (C1-C4) alkyle ou trifluorométhyle ;
un (C 1-C2)alkylène substitué par un ou deux substituants identiques ou
différents
choisis parmi :
(i) un groupe (C1-C4)alkyle ;
(ii) un radical carbocyclique non aromatique en C3-C12 non substitué ou
substitué une ou plusieurs fois par un groupe (Cl-C4)alkyle ;
(iii) un phényle non substitué ou substitué par un ou plusieurs substituants,
identiques ou différents, choisis parmi un atome d'halogène, un groupe (Cl-
C4)alkyle, hydroxyle, trifluorométhyle, (Cl-C4)alcoxy, trifluorométhoxy,
(C1-C4)alcanoyle, cyano, nitro, phényle, un groupement S(O)nAlk ou
NR13R14 ;
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
3
(iv) un radical hétérocyclique de 4 à 8 atomes, oxygéné, soufré ou azoté,
saturé
ou insaturé, non substitué ou substitué par un ou plusieurs substituants,
identiques ou différents, choisis parmi un atome d'halogène ou un groupe
(C 1-C4)alkyle ou trifluorométhyle ;
de plus lorsque X représente un groupe =CON(R10)- ou -CSN(Rl0)-, R2 peut
représenter un groupe (C1-C6)alkanoyle ou un groupe benzoyle ou
benzylcarbonyle, le groupe phényle desdits groupes étant non substitué ou
substitué par des substituants identiques ou différents choisis parmi un atome
d'halogène, un groupe (C1-C4)alkyle ou trifluorométhyle ;
- R'2 représente un phényle non substitué ou substitué une ou plusieurs fois
par des
substituants identiques ou différents choisis parmi un atome d'halogène ou un
groüpé (C 1-C4)alkyle, trifluoromé"thyle, cyano ou nitro, (C 1-C4)alcoxy ;
- R3 représente un atome d'hydrogène ou un groupe (C1-C4)alkyle, cyano, (C1-
C4)
alcoxyméthyle ou hydroxyméthyle ;
- R4, R5, R6, R7, R8, Rg représentent chacun indépendamment l'un de l'autre un
atome d'hydrogène ou d'halogène, un groupe (C1-C6)alkyle, (C1-C6)alcoxy,
trifluorométhyle, trifluorométhoxy, cyano, nitro ou un groupement S( )nAlk ;
- R10 représente un atome d'hydrogène ou un groupe (C1-C4)alkyle ;
- ou R2 et Rl0 ensemble avec l'atome d'azote auquel ils sont liés constituent
un radical
hétérocyclique de 4 à 8 atomes, contenant ou non un deuxième hétéroatome
choisi
parmi un atome d'oxygène, de soufre ou d'azote, non substitué ou substitué une
ou
plusieurs fois par un groupe (C1-C4)alkyle ; un groupe (C1-C4)alcanoyle ; un
groupement NR11R12 ou CONR11R12 ; un groupe phényle non substitué ou
substitué une ou plusieurs fois par un atome d'halogène, un groupe (C1-
C4)alkyle,
(C 1-C4)alcoxy ou trifluorométhyle ;
- Rl 1 et R12 représentent chacun indépendamment l'un de l'autre un atome
d'hydrogène, un groupe (C 1-C4)alkyle ou Rl l et R12 ensemble avec l'atome
d'azote auquel ils sont liés, constituent un radical hétérocyclique de 4 à 8
atomes ;
- n représente 0, 1 ou 2;
- R13 et Rlq, représentent chacun indépendamment l'un de l'autre un atome
d'hydrogène ou un groupe (C1-C4)alkyle ou R13 et R14 ensemble avec l'atome
d'azote auquel ils sont liés constituent un radical hétérocyclique saturé ou
insaturé
de 4 à 8 atomes ;
- Alk représente un groupe (C1-C4)alkyle ;
à la condition que l'un des substituànts Rl, R3, R5, R6, R8, Rg soit différent
de
l'hydrogène lorsque R4 et R7 représentent simultanément un groupe 4-méthoxy ;
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
4
à l'état de base ou de sel d'addition, ainsi qu'à l'état d'hydrate ou de
solvat.
Plus particulièrement, la présente invention se rapporte aux composés de
formule:
1~5CH2-X-R2
N ~ -5 ~ Ri
/
R4 ~ 55~. (I bis)
RS R
6 R7
R9Rs
dans laquelle :
- X représente un groupe -CO-, -S02- ou -CON(Rl0)- ~
- Rl représente un atome d'hydrogène ou un groupe (C1-Cq.)alkyle ;
- R2 représente :
un groupe (C3-C10)alkyle ;
un radical carbocyclique non aromatique en (C3-C12), non substitué ou
substitué
une ou plusieurs fois par un groupe (C1-C4)alkyle ;
un indolyle non substitué ou substitué sur l'atome d'azote par un (Cl-Cq4)
alkyle ;
. un phényle non substitué ou substitué une ou plusieurs fois par des
substituants
identi ues ou différents choisis armi un atome d'halo ene un C-C
q p g~ ~ groupe ( 1 4)
alkyle, trifluorométhyle, trifluorométhoxy, (C 1-Cq.)alcoxy, cyano, (C 1-
C4)alcanoyle, phényle ;
un benzyle non substitué ou substitué une ou plusieurs fois par des
substituants
identiques ou différents choisis parmi un atome d'halogène, un groupe (C1-C4)
alkyle, trifluorométhyle, (C1 -C4)alcoxY, cyano, PhénYle ;
- R3 représente un atome d'hydrogène ou un groupe (C1-C4)alkyle, cyano ou (Cl-
Cq4) alcoxyméthylène ;
- R4, R5, R6, R7, R8, Rg représentent chacun indépendamment l'un de l'autre un
atome d'hydrogène ou d'halogène, un groupe (Cl-C6)alkyle, (Cl-C6)alcoxy,
trifluorométhyle ou un groupement S(O)nA.lk ;
- Rl0 représente un atome d'hydrogène ou un groupe (Cl-C4)alkyle ;
- ou R2 et R10 ensemble avec l'atome d'azote auquel ils sont liés constftuent
un
radical hétérocyclique de 4 à 8 atoines, contenant ou non un deuxième
hétéroatome
choisi parmi un atome d'oxygène, de soufre ou d'azote, non substitué ou
substitué
une ou plusieurs fois par un groupe (Cl-Cq,)alkyle ; un groupe (Cl-
Cq,)alcanoyle ;
un groupement NR11R12 ou CONR11R12 ; un groupe phényle non substitué ou
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
substitué une ou plusieurs fois par un atome d'halogène, un groupe (C1-
C4)alkyle,
(C1-C4)alcoxy ou trifluorométhyle ;
- R11 et R12 représentent chacun indépendarmnent l'un de l'autre un atome
d'hydrogène, un groupe (C1-C4)alkyle ou Rll et R12 ensemble avec l'atome
5 d'azote auquel ils sont liés, constituent un radical hétérocyclique de 4 à 8
atomes ;
- n représente 0, 1 ou 2;
- Alk représente un groupe (C1-C4)alkyle ;
à la condition que l'un des substituants Rl, R3, R5, R6, Rg, Rg soit différent
de
l'hydrogène lorsque R4 et R7 représentent simultanément un groupe 4-méthoxy.
Les composés de formule (I) peuvent comporter un ou plusieurs atomes de
carbone asymétriques. Ils peuvent donc exister sous forme d'énantiomères ou de
diàstéréoisomères. Ces énantiomères, diastéréoisomères, âirïsi 'què leurs
mélàiges, y
compris les mélanges racémiques, font partie de l'invention.
Les composés de formule (I) peuvent exister à l'état de bases ou de sels
d'addition à des acides. De tels sels d'addition font partie de l'invention.
Ces sels peuvent être préparés avec des acides pharmaceutiquement acceptables,
mais les sels d'autres acides utiles, par exemple, pour la purification ou
l'isolement
des composés de formule (I) font également partie de l'invention.
Les composés de formule (I) peuvent également exister sous forme d'hydrates ou
de solvats, à savoir sous forine d'associations ou de combinaisons avec une ou
plusieurs molécules d'eau ou avec un solvant. De tels hydrates et solvats font
également partie de l'invention.
Dans le cadre de la présente invention, on entend par :
- un atome d'halogène : un fluor, un chlore, un brome ou un iode ;
- un groupe (C1-C4)alkyle ou respectivement (C1-C6)alkyle ou (C3-C10)alkyle :
un
groupe aliphatique saturé linéaire ou ramifié, en (C1-C4), ou respectivement
en
(C1-C6) ou (C3-C10). A titre d'exeinple, on peut citer les groupes méthyle,
éthyle,
propyle, isopropyle, butyle, isobutyle, tert-butyle, pentyle, hexyle, 1-
éthylpropyle,
1-propylbutyle, etc . . . ;
- un groupe (C1-C4)alcoxy : un radical 0-alkyle où le groupe alkyle est tel
que
défini précédemment.
Les radicaux carbocycliques non aromatiques en C3-C12 comprennent les radicaux
mono ou polycycliques, condensés ou pontés. Les radicaux monocycliques
incluent
les cycloalkyles par exemple cyclopropyle, cyclobutyle, cyclopentyle,
cyclohexyle,
cycloheptyle, cyclooctyle ; le cyclohexyle et le cyclopentyle étant préférés.
Les
radicaux di- ou tricycliques condensés, pontés ou spiraniques, incluent par
exemple
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
6
les radicaux norbornyle, bomyle, isobornyle, noradamantyle, adamantyle,
spiro[5.5]undécanyle, bicyclo[2.2.1]heptyle, bicyclo[3.2.1]octyle ;
bicyclo[3.1.1]
heptyle.
Les radicaux hétérocycliques de 4 à 8 atomes comprennent les radicaux
azétidinyle, pyrrolidinyle, pyrrolyle, pipéridyle, perhydroazépinyle,
perhydroazocinyle
les radicaux contenant en outre, un deuxième hétéroatome choisi parmi un atome
d'oxygène, de soufre ou d'azote comprennent en outre les radicaux
imidazolidinyle,
pyrazolidinyle, pipérazinyle, morpholinyle, thiomorpholinyle, etc...
Parmi les composés de formule (I) objets de l'invention, on distingue :
. les composés de formule (IA), (IB), (IC), (ID) dans lesquelles Z représente
un groupe
N(Rl)XR2 et
- soit X représente un groupe -CO- et les substituants Rl à Rg sont tëls que
définis
ci-dessus pour les composés de formule (I) : les composés de formule (IA);
- soit X représente un groupe -S02- et les substituants Rl à Rg sont tels que
définis
ci-dessus pour les composés de formule (I) : les composés de formule (IB);
- soit X représente un groupe -CONR10- et les substituants Rl à R10 sont tels
que
définis ci-dessus pour les composés de formule (I) : les composés de formule
(IC) ;
- soit X représente un groupe -CSNR10 et les substituants Rl et R10 sont tels
que
définis ci-dessus pour les composés de formule (I) : les composés de formule
(ID) ;
les composés de formule (IE) dans laquelle Z représente un groupe N(Rl)COOR'2
et
les substituants Rl à R9 sont tels que définis ci-dessus pour les composés de
formule (I) ;
. les composés de formule (IF) dans laquelle Z représente un groupe OCO(Rl)R'2
et
les substituants Rl à Rg sont tels que défmis ci-dessus pour les composés de
formule (I).
Parmi les composés de formule (I) objets de l'invention, un groupe de composés
est constitué par les composés pour lesquels
- Z représente un groupe N(Rl)XR2 et X a l'une des valeurs défmies pour (I) ;
- Rl représente un atome d'hydrogène;
- et/ou R2 représente un 1-propylbutyle ou un indol-2-yle non substitué ou
substitué
par un groupe (C 1-Cq.)alkyle, ou R2 représente un phényle non substitué ou
substitué une ou plusieurs fois par des substituants identiques ou différents
choisis
parmi un atome d'halogène, un groupe (Cl-C4) alkyle, trifluorométhyle, (Cl-
C4)alcoxy, cyano, phényle ;
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
7
- et/ou R3 représente un groupe méthyle ou méthoxyméthyle ;
- et/ou R4 représente un atome de chlore ou de brome ou un groupe méthoxy ;
- et/ou R7 et R8 représentent chacun un atome de chlore ;
- et/ou R5, R6, R9 représentent l'hydrogène ;
à l'état de bases ou de sels d'addition ainsi qu'à l'état d'hydrates ou de
solvats.
Tout particulièrement, on distingue les composés de formule (IA) dans laquelle
:
- Z représente un groupe NHCOR2 ;
- R2 représente un groupe 1-propylbutyle, un groupe indolyle non substitué ou
substitué par un groupe (Cl-C4)alkyle, un groupe phényle non substitué ou
substitué par un atome d'halogène ou un trifluorométhyle ;
- R3 représente un groupe méthyle ou méthoxyméthyle ;
- Rq, représente un atome de chlore ou de brome ou un groupe méthoxy ;
- R7 et R8 représentent chacun un atome de chlore ;
- R5, R6, Rg représentent l'hydrogène ;
à l'état de bases ou de sels d'addition ainsi qu'à l'état d'hydrates ou de
solvats.
On distingue également les composés de formule (IB) dans laquelle :
- Z représente un groupe NHSO2R2 ;
- R2 représente un groupe phényle non substitué ou substitué par un atome
d'halogène ou par un groupe trifluorométhyle ;
- R3 représente un groupe méthyle ou méthoxyméthyle ;
- R4 représente un atome de chlore ou de brome ou un groupe méthoxy ;
- R7 et R8 représentent chacun un atome de chlore ;
- R5, R6, Rg représentent l'hydrogéne ;
à l'état de bases ou de sels d'addition ainsi qu'à l'état d'hydrates ou de
solvats.
Parmi les composés décrits de l'invention, on peut notamment citer les
composés
suivants :
N- { [-6-(4-Chlorophényl) - 5 - (2,4-dichlorophényl)-2-méthylpyridin-3 -yl]
méthyl } -
1 H-indole-2-carboxamide.
N- { [-6-(4-Chlorophényl)-5-(2,4-dichlorophényl)-2-méthylpyridin-3 -yl]méthyl
} -
4-(trifluorométhyl)benzènesulfonamide.
N- { [-6-(4-Chlorophényl)-5 -(2,4-di chlorophényl)-2-méthylpyridin-3 -yl]
méthyl} -
N'-[4-(trifluorométhyl)phényl]urée.
N-{ [5-(2,4-Dichlorophényl)-2-(méthoxyméthyl)-6-(4-inéthoxy-phényl)pyridin-3-
yl] méthyl }-2-propylp ent an ami de.
N-{ [5-(2,4-Dichlorophényl)-2-(méthoxyméthyl)-6-(4-méthoxy-phényl)pyridin-3-
yl]méthyl} -1 H-indole-2-carboxamide.
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
8
N-{ [6-(4-Chlorophényl)-5-(2,4-dichlorophényl)-2-(méthoxy-méthyl)pyridin-3-
yl]méthyl} -4-(trifluorométhoxy)benzamide.
N-{ [6-(4-Chlorophényl)-5-(2,4-dichlorophényl)-2-(méthoxy-méthyl)pyridin-3-
yl]méthyl } -2-propylpentanamide.
à l'état de bases ou de sels d'addition ainsi qu'à l'état d'hydrates ou de
solvats.
Dans ce qui suit, on entend par groupe protecteur Pg un groupe qui permet,
d'une
part, de protéger une fonction réactive telle qu'un hydroxyle ou une amine
pendant
une synthèse et, d'autre part, de régénérer la fonction réactive intacte en
fin de
synthèse. Des exemples de groupes protecteurs ainsi que des méthodes de
protection
et de déprotection sont données dans Protective Groups in Organic Synthesis
,
Green et al., 2nd Edition (John Wiley & Sons, Inc., New York), 1991.
On èntend par groupe partant, dans ce qui suit, un groùpe pouvant être
facilemënt
clivé d'une molécule par rupture d'une liaison hétérolytique, avec départ
d'une paire
électronique. Ce groupe peut ainsi être remplacé facilement par un autre
groupe lors
d'une réaction de substitution, par exemple. De tels groupes partants sont,
par
exemple, les halogènes ou un groupe hydroxy activé tel qu'un méthanesulfonate,
benzènesulfonate, p-toluènesulfonate, triflate (ou trifluorométhanesulfonate),
acétate,
etc. Des exemples de groupes partants ainsi que des références pour leur
préparation
sont donnés dans Advances in Organic Chemistry , J. March, 3rd Edition,
Wiley
Interscience, 1985, p. 310-316.
Conformément à l'invention, on peut préparer les composés de formule générale
(I) dans laquelle Z représente un groupe N(R1)XR2 ou N(Rl)COOR'2 selon le
procédé caractérisé en ce que l'on traite un composé de formule :
R
,3
N ~ CHZ-NHRI
\ I
/
R4 I (u)
R ~
5 R6 R~ I
R8R
9
dans laquelle les substituants Rl et R3 à Rg sont tels que définis .pour (I)
- soit par un acide de formule R2CO2H (III) dans laquelle R2 est tel que
défini pour
(I), ou par un dérivé activé dudit acide, lorsqu'on doit préparer un composé
de
formule IA dans laquelle X représente un
( ) groupe -CO- ;
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
9
- soit par un halogénure de sulfonyle de formule R2SO2Hal (IV) dans laquelle
R2
est tel que défn' ii pour (I) et Hal représente un atome d'halogène,
préférentiellement
le chlore, lorsqu'on doit préparer un composé de formule (IB) dans laquelle X
représente un groupe -S02- ;
- soit par un halogénure d'aryloxycarbonyle de formule HaICOOR'2 dans laquelle
R'2 est tel que défini pour un composé de formule (I), lorsque l'on doit
préparer un
composé de formule (IE) dans laquelle Z représente un groupe N(Rl)COOR'2 ;
- soit par un isocyanate de formule R2-N = C= O(VII) dans laquelle R2 est tel
que
défini pour (I), pour préparer un composé de formule (IC) dans laquelle X
représente un groupe -CONH-.
- soit par un isothiocyanate de formule R2-N=C=S (VII bis) dans laquelle R2
est tel
qüe défini ci-dessus pour (I) pour préparer un composé de formule (ID) dans
laquelle X représente un groupe -CSNR2-.
Alternativement, on peut traiter un composé de formule (II) tel que défini ci-
dessus par un halogénure d'aryloxycarbonyle de formule HalCOOR'2 dans laquelle
R'2 est tel que défini pour (I) pour former un composé intermédiaire de
formule :
R3 RI
N CH2-NCOOR'2
R4 (V)-(]:E)
R
R ~
6
R9 R8 R7
dans laquelle les substituants R'2 et R1 à Rg sont tels que définis pour (I),
que l'on
traite ensuite par une amine de formule R2RlONH (VI) dans laquelle R2 et R10
sont
tels que définis pour (I), lorsqu'on doit préparer un composé de formule (IC)
dans
laquelle X représente un groupe -CON(R10)' ;
Eventuellement, on transforme le composé de formule (I) :(IA), (IB), (IC),
(ID)
ou (IE) ainsi obtenu en l'un de ses sels d'addition à un acide.
Lors de la préparation d'un composé de formule (IA) dans laquelle X représente
un groupe -CO-, on peut utiliser un dérivé activé de l'acide de formule (III),
c'est à
dire un acide activé par le N,N-dicyclohexylcarbodiimide ou par
l'hexafluorophosphate de benzotriazol-l-yloxytris(diméthylamino)phosphonium
(BOP), l'hexafluorophosphate de benzotriazol-1-
yloxytris(pyrrolidino)phosphonium
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
(PyBOP) ou le tétrafluoroborate de 2-(1H-benzotriazol-1-yl)-1,1,3,3-
tétraméthyluronium (TBTU).
Lors de la préparation d'un composé de formule (IB) dans laquelle X représente
un groupe -S02-, la réaction s'effectue en présence d'une base telle que la
5 triéthylamine ou la diisopropyléthylamine, dans un solvant tel que le
dichlorométhane
ou le tétrahydrofurane, et à une température comprise entre la température
ambiante et
la température de reflux du solvant.
Les composés de formule (IV) sont disponibles dans le commerce ou décrits dans
la littérature, ou peuvent être préparés selon des méthodes qui y sont
décrites telles
10 que dans J. Org. Chem. USSR, 1970, 6, 2454-2458 ; J. Am. Chem. Soc., 1952,
74,
2008 ; J. Med.Chem., 1977, 20(10), 1235-1239 ; EP0469 984 ; W095/18105.
Par exemple les composés de formule (IV) peuvent être préparés par
halogénation
des acides sulfoniques correspondants ou de leurs sels, par exemple de leur
sels de
sodium ou de potassium. La réaction s'effectue en présence d'un agent
halogénant tel
que l'oxychlorure de phosphore, le chlorure de thionyle, le trichlorure de
phosphore, le
tribromure de phosphore ou le pentachlorure de phosphore, sans solvant ou dans
un
solvant tel qu'un hydrocarbure halogéné ou le N,N-diméthylformamide et à une
température comprise entre -10 C et 200 C.
Les halogénures d'aryloxycarbonyle utiles dans la préparation d'un composé de
formule (V) sont connus ou préparés par des méthodes connues.
La demande de brevet WO 2002/055502 décrit un composé de formule (II) dans
laquelle les substituants Rl, R3, R6, R8, Rg représentent l'hydrogène et R4 et-
R7
représentent un groupe 4-méthoxy.
Les composés de form.ule :
N ~ CH2 NHRI
\ I
/
R4 ~ (fl)
R r
5 R6 ~ I
RR
9
dans laquelle :
- Rl représente un atome d'hydrogène ou un groupe (C1-C4)alkyle ;
- R3 représente un atome dou un (C-C Ie, cyano, (C1-C
d'hydrogène groupe 1 4)~Y 4)
alcoxyméthylène ou hydroxyméthyle ;
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
11
- R4, R5, R6, R7, Rg, Rg représentent chacun indépendarmuent l'un de l'autre
un
atome d'hydrogène ou d'halogène, un groupe (C1-C6)allkyle, (C1-C6)alcoxy,
trifluorométhyle, trifluorométhoxy, cyano, nitro ou un groupement S(O)nAlk ;
sont nouveaux à la condition que l'un des substituants Rl, R3, R5, R6, R8, Rg
soit
différent de l'hydrogène lorsque R4 et R7 représentent simultanément un groupe
4-
méthoxy.
Les composés de formule (II) sont préparés selon le Schéma réactionnel ci-
après :
SCHEMA 1
N COA N ~ CH2OH
/ ~ (
R agent réducteur 30 R ~
R (al) R /
5 R6 8 R9 R 5 R6 ~ ~
A = hydroxyle ou8 R9
(Cl-C4)alcoxy (VIII) (lx)
1~3 R3
N, CH2Y N CH2NHR1
~ I / I ~ I
H21 (X) 25 ~1) * R47 (cl) R47
R
s R6 s R6 ~ I
Y groupe partant R8 R9 R8 R9
(X) (II)
Rl, R3, R4 à Rg sont tels que définis pour (I).
A l'étape al), la réaction s'effectue en présence d'un agent réducteur tel que
le
borohydrure de sodium ou l'hydrure d'aluminium et de lithium, dans un solvant
tel que
le tétrahydrofurane, et à une température' comprise entre -20 C et la
température
ambiante. Lorsqu'on réduit un composé de formule (VIII) dans laquelle A OH,
l'acide peut être précédemmerit activé par réaction avec du chloroformiate
d'éthyle en
présence de triéthylamine.
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
12
A l'étape bl), on prépare un composé de formule (X) dans laquelle Y représente
un groupe partant tel que défini ci-dessus, de préférence un atome d'halogène
ou un
groupe hydroxy activé, par exemple un groupe hydroxy activé tel qu'un groupe
méthanesulfonate, benzènesulfonate, p-toluènesulfonate ou triflate.
Ainsi, pour préparer un composé de formule (X) dans laquelle Y représente un
atome d'halogène, on traite un composé de formule (IX) par un agent
d'halogénation
tel que PC15, PBr3, HBr ou BBr3, dans un solvant tel que le dichlorométhane et
à une
température comprise entre 0 C et la température ambiante.
Pour préparer un composé de formule (X) dans laquelle Y représente un
méthanesulfonate, un benzènesulfonate, un p-toluènesulfonate ou un
trifluorométhanesulfonate, on fait réagir un composé de formule (IX) avec un
chlorure
dë sulfonyle de formule Z-S02-Cl dans laquelle Z représente un méthyle, un
phényle,
un p-tolyle ou un trifluorométhyle. La réaction s'effectue en présence d'une
base telle
que la triéthylamine, la pyridine ou la N,N-diisopropyléthylamine, dans un
solvant tel
que le dichlorométhane ou le toluène et à une température comprise entre -20 C
et la
température de reflux du solvant.
A l'étape cl), la réaction s'effectue dans un solvant tel que N,N-
diméthylformamide, l'acétonitrile, le dichlorométhane, le toluène ou le propan-
2-ol, et
en présence ou en l'absence d'une base. Lorsqu'on utilise une base, celle-ci
est choisie
parmi les bases organiques telles que la triéthylamine, la N,N-
diisopropyléthylamine
ou la N-méthylmorpholine. La réaction s'effectue à une température comprise
entre
0 C et la température de reflux du solvant.
Selon une variante, on peut également préparer un composé de formule (II) dans
laquelle R1 = H par réaction d'un composé de formule (X) dans laquelle Y = Cl
avec
le 1,3,5,7-tétraazatricyclo[3.3.13'7 ]décane (ou hexaméthylènetétramine) suivi
d'une
hydrolyse par un acide fort tel que l'acide chlorhydrique.
Les composés de formule (VIII) sont préparés selon des méthodes connues telles
que celles décrites dans WO 03/082191 et WO 2005/00817.
Le cas échéant, on peut préparer un composé de formule (I) dans laquelle Z
représente un groupe N(Rl)XR2 ou N(Rl)COOR'2 avec R1 différent de l'hydrogène
par alkylation d'un composé de formule (I) dans laquelle Z représente un
groupe
NHXR2 ou NHCOOR'2.
Selon la présente invention, les composés de forxnule (IF) dans laquelle Z
représente un groupement O-CO-NH-R'2 peuvent être préparés selon un procédé
caractérisé en ce que l'on traite un composé de formule :
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
13
y:~,fi,,,CH2OH
N /
R I
R
S R6
R8 R9
(lx)
par un composé de formule R'2-N=C=O.
Eventuellement,.ontransforme le_cornposé de iorxnule (IF) ainsi, oùtenu e-Li
l'un de
ses sels d'addition à un acide.
Les composés de formule (VIII) dont laquelle R3 représente un groupe méthyle
permettent de préparer, par des méthodes connues de l'homme de l'art, les
composés
de formule (VIII) dans laquelle R3 représente un atome d'hydrogène, un groupe
(C2-
C4)alkyle, cyano ou (C1-C4)alcoxyméthyle.
Les composés de formule (II) dans laquelle R3 représente un groupe (Cl-
Cq.)alkyle ou (C1-Cç)alcoxyméthyle peuvent également être préparés selon le
schéma
réactionnel suivant :
SCHElV1A 2
O / OH 0 ~~ OMe R7 R7
C ~ R R
C 1) NaI~VIDS/THF $ g
~H2 2) HCl R9 R9
-~
(a2) O\ CCH2 (b2) O\ /C=O
~ + / R4 R
R6 C
R9
R$
R4 R5 R6 R~ RS R6
(XI.II) (Xrv)
R3\ /CH2--, C/OMe + CH3CO2NH4 - R3\ 5~\C/OMe
ii IOI (c2) O NH2
(XV) (-XVI)
R3 = (Cl-C4)alkyle ou (Cl-C4)alcoxyméthyle
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
14
R3
R8 N CO2Me
R9 ~\ /OMe APTS
C~ +
O~ \ CH2 (d2) R4 ~
NH2 R
R6 Ri
R Ra
R4 R5R6 ~II) 9
(~)
R
,3
R3
N ~ COOH N CH2OH
KOH/EtOH / I /
(e2) R4 (f2) R4 ~
RS R6 ~ RS R6 R7
(~.~) R9 Ra R9 Ra
O
P-3
O N
CHz'N
P(C6H5)3, DEAD
ffl)+HN
, \ I (g2) R4 NHZNI-I2, H2O/MeOH
(a)
O Rs R6 R7 (h2)
R R8
(~) 9
A l'étape (a2) on traite le dérivé d'acide phénylacétique de formule (XI) par
le
dérivé d'ester benzoïque de fornmule (XII) en présence de
hexaméthylènedisilazane de
sodium (NaHMDS) dans un solvant tel que le THF puis on acidifie pour obtenir
le
composé de formule (XIII) ; à l'étape (b2) ce composé est traité par la
tétraméthylméthanediamine et l'anhydride acétique pour former le composé de
formule (XIV).
Par ailleurs, on prépare à l'étape (c2) le composé de formule (XVI) par action
de
l'acétate d'ammonium sur un dérivé de 3-oxobutanoate de formule (XV). A
l'étape
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
(d2), l'ester nicotinique de formule (XVII) est ensuite préparé par action du
composé
(XIV) sur le composé (XVI) en présence d'acide para-toluènesulfonique (APTS).
Cet ester est hydrolysé en milieu basique à l'étape (e2), puis la fonction
acide est
réduite à l'étape (f2), par exemple par le complexe borane/THF.
5 Alternativenient pour réaliser l'étape (f2), on peut préparer
intermédiairement un
anhydride puis le réduire, par exemple par action d'un borohydrure métallique.
On
peut également réduire directement par des agents réducteurs, l'ester de
formule
(XVII) en alcool de formule (XIX).
A l'étape (g2), le composé de forinule (XIX) portant un groupe hydroxyméthyle
10 est engagé dans une réaction de Mitsunobu en présence de phtalimide pour
donner un
composé de formule (XX) qui, traité par l'hydrate d'hydrazine, au cours d'une
dernière
étape (h2) conduit au composé (II) attendu.
Les composés de formule (I) dans laquelle R3 = CH2OH peuvent être préparés à
partir des composés de formule (I) dans laquelle R3 = CH2OMe par une réaction
de
15 déméthylation, par exemple en présence d'un acide de Lewis tel que BBr3.
Les EXEMPLES suivants décrivent la préparation de certains composés
conformes à l'invention. Ces exemples ne sont pas limitatifs et ne font
qu'illustrer la
présente invention. Les numéros des composés exemplifiés renvoient à ceux
donnés
dans les TABLEAUX I, II et III ci-après.
Dans les Préparations et dans les Exemples on utilise les abréviations
suivantes :
éther : éther diéthylique
éther iso : éther diisopropylique
DMSO : diméthylsulfoxyde
DIPEA : diisopropyléthylamine
DMF : N,N-diméthylformamide
THF : tétrahydrofurane
DCM : dichlorométhane
AcOEt : acétate d'éthyle.
PyBOP : hexafluorophosphate de benzotriazol- 1 -yloxytris(pyrrolidino)
phosphonium
TBTU : tétrafluoroborate de 2-(1H-benzotriazol-1-yl)yloxytris(pyrrolidino)
phosphonium
NaHMDS : hexaméthylènedisilazane de sodium
APTS : acide payatoluène sulfonique
éther chlorhydrique 2N : solution 2N d'acide chlorhydrique dans l'éther
diéthylique
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
16
DEAD : diéthylazodicarboxylate
solution tampon pH2 : solution de 16,66 g de KHSO4 et 32,32 g de K2S04 dans
1 litre d'eau.
F : point de fusion
TA : température ambiante
Les spectres de résonance magnétique nucléaire sont enregistrés à 200 MHz dans
le DMSO-d6. Pour l'interprétation des spectres, on utilise les abréviations
suivantes
s: singulet, d : doublet, t : triplet, m : massif, mt : multiplet, se :
singulet élargi.
Les composés selon l'invention sont analysés par couplage LC/UV/MS
(chromatographie liquide/détection UV/spectrométrie de masse). On mesure le
pic
moléculaire (MH+) et le temps de rétention (t) en minutes.
Cônditions A :
On utilise une colonne Xterra Waters MS C18, commercialisée par Waters, de
2,1 x 30 mm, 3,5 m, àtempérature ambiante, débit 1 mL/minute.
L'éluant est composé conune suit :
- solvant A: 0,025 % d'acide trifluoroacétique (TFA) dans l'eau
- solvant B : 0,025 % de TFA dans l'acétonitrile.
Gradient : Le pourcentage de solvant B varie de 0 à 100 % en 2 minutes avec un
plateau à 100 % de B pendant 1 minute.
La détection UV est effectuée entre 210 nm et 400 nm et la détection de masse
en
mode ionisation chimique à pression atmosphérique.
Conditions : MS2
On utilise une colonne XTerra MS C18 de 2,1 x 30 mm, 3,5 m, à 30 C, débit 0,8
ml/minute.
L'éluant est composé comme suit :
- solvant A: 0,025 % d'acide trifluoroacétique (TFA) dans l'eau ;
- solvant B: 0,025 % de TFA dans l'acétonitrile.
Gradient :
Temps(mn) %A %B
0 100 0
2 0 100
2,7 0 100
2,75 100 0
La détection UV est effectuée par un détecteur à barette d'iode entre 210 et
400
nm et la détection de masse en mode ionisation chimique ESI positif.
Conditions MS5
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
17
On utilise une colonne XTERRA MS C18 de 2,1 x 30 mm, 3,5 m, débit
1 ml/minute.
L'éluant est composé comme suit :
Solvant A: 0,025 % de TFA dans l'eau,
Solvant B : 0,025 % de TFA dans l'acétonitrile.
Gradient
Temps(mn) % A % B
0 100 0
2 0 100
2,7 0 100
2,75 100 0
_. . .._ - _
_ __ _ - ------ ------ .__--------
La détection UV est effectuée par un détecteur à barette d'iode entre 210 et
400 nm et
la detection de masse en mode ESI positif.
Préparation 1
1-(6-(4-Chlorophényl)-5-(2,4-dichlorophényl)-2-méthylpyridin-3-yl)
méthanamine.
A) 1-(4-Chlorophényl)-2-(2,4-dichlorophényl)prop-2-en-1-one.
On mélange à TA 10 g 1-(4-chlorophényl)-2-(2,4-dichlorophényl)éthanone, 17 ml
de N,N,N,N-tétraméthylméthanediamine et 17 ml d'anhydride acétique ; on
chauffe à
90 C pendant 3 heures puis on laisse revenir à TA. Le mélange est versé dans
la glace
pilée puis filtré. Le solide est séché sous vide. On obtient 10 g du composé
attendu,
F = 89 C.
B) Ester éthylique de l'acide 5-(2,4-dichlorophényl)-6-(4-chlorophényl)-2-
méthyl
pyridine-3 -carboxylique.
On prépare, dans 60 ml de n-butanol, un mélange contenant 7 g du composé de
l'étape précédente, 2,62 g de 3-aminobut-2-ènoate d'éthyle et 140 mg d'acide
para-
toluènesulfonique puis on chauffe pendant 24 heures à reflux du solvant. On
évapore
le solvant au trois-quart puis on ajoute 80 ml de pentane à 0 C. On filtre le
précipité
formé et on concentre le filtrat. Le résidu est chromatographié sur silice en
éluant par
un mélange cyclohexane/AcOEt (90/10 ; v/v). On obtient 7 g du composé attendu,
F = 114 C.
C) (6-(4-Chlorophényl)-5-(2,4-dichlorophényl)-2-méthylpyridin-3-yl)méthanol.
On place 8,4 g du composé obtenu à l'étape précédente dans 200 ml de THF, on
ajouté lentement à TA 0,75 g de LiAIH4 et on laisse sous agitation 1 heure à
TA. On
ajoute 100 ml d'éther, 1 ml d'eau, 1 ml de soude 4N et 3 ml d'eau. On filtre
les sels
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
18
formés puis on cristallise le produit dans un minimum de DCM et on filtre. On
obtient
7 g du composé attendu.
D) 3-Chlorométhyl-6-(4-chlorophényl)-5-(2,4-dichlorophényl)-2-méthylpyridine.
On place 7 g du composé obtenu à l'étape précédente sous azote, dans 150 ml de
DCM et on ajoute lentement, à 0 C, 4 g de PC15. On laisse 1 heure sous
agitation à
TA puis on lave à l'eau et on extrait au DCM. On sèche, filtre et évapore pour
obtenir
7,2 g du composé attendu.
E) Chlorhydrate de 1-(6-(4-chlorophényl)-5-(2,4-dichlorophényl)-2-
méthylpyridin-
3-yl)méthanamine.
On place sous azote 7,2 g du composé obtenu à l'étape précédente dans 200 ml
d'éthanol avec 3,05 g d'hexaméthylènetétramine et 2,7 g de NaI et on laisse 16
heures
s ûs agitation à TA. On ajoüte 20 ml d'HCl concéntré pûis on châüffe 1 heuré à
reflux.
On filtre le précipité formé. Le filtrat est évaporé à sec puis repris dans
100 ml d'eau.
Les impuretés sont extraites par AcOEt. La phase aqueuse est basifiée par NaOH
8 %
et le produit est extrait à l'AcOEt. La phase organique est séchée sur MgSO4,
évaporée à sec, reprise dans Et2O et traitée par HCI/Et2O. Le précipité blanc
obtenu
est filtré et séché sous vide. On obtient 5 g du composé attendu.
MH =377;t=6,85mn.
RMN : 2,65 ppm : s: 3H ; 4,20 ppm : q: 2H ; 7,10 à 8,00 ppm : m: 8H ; 8,40
ppm:se:3H.
Préparation 2
Chlorhydrate de 1-(6-(4-bromophényl)-5-(2,4-dichlorophényl)-2-méthylpyridin-
3-yl)méthanamine.
Ce composé est préparé selon le mode opératoire de la Préparation 1.
MH+ = 421 ; t= 6,05 mn.
Préparation 3
Chlorhydrate de 1-(6-(4-méthoxyphényl)-5-(2,4-dichlorophényl)-2-
méthylpyridin-3 -yl)méthanamine.
MH = 373,0 ; t = 6,37.
Préparation 4
1-(5-(2,4-Dichlorophényl)-2-(méthoxyméthyl)-6-(4-méthoxyphényl)pyridin-3 -yl)
méthanamine.
A) 2-(2;4-Dichlorophényl)-1-(4-méthoxyphényl)éthanone.
On place sous azote 150 ml de NaHMDS à-78 C dilué par 150 ml de THF et l'on
ajoute goutte à goutte 25 g d'acide 2,4-dichlorophénylacétique en solution
dans 150 ml
de THF. A-78 C, après 2 heures sous agitation, on ajoute 20,26 g d'ester
méthylique
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
19
de l'acide 4-méthoxybenzoïque en solution dans 150 ml de THF. On laisse
remonter la
température à 0 C et on maintient l'agitatiôn pendant 2 heures à cette
température. A
0 C, on ajoute goutte à goutte, l'acide chlorhydrique à 10 % en quantité
suffisante
pour hydrolyser le milieu réactionnel et on agite pendant 2 heures à TA. On
extrait à
l'éther puis on sèche la phase organique sur Na2SO4. Le solide fonné est
repris par
250 ml de pentane puis agité, filtré et séché à l'étuve. On obtient 23,43 g du
composé
attendu.
+
LC/MS (conditions A). MH = 295,0 ; t=10,34.
B) 2-(2,4-Dichlorophényl)-1-(4-méthoxyphényl)prop-2-en-1-one.
On prépare sous azote un mélange contenant 23 g du composé obtenu à l'étape
précédente et 40,21 g de tétraméthylméthanediamine auquel on ajoute goutte à
goutte
24 g d'anhydride acétique puis on laisse sous agi"tation 2 héùres à 90 C.
Après retour à
TA, on ajoute 500 ml d'eau. Le précipité formé est filtré puis rincé plusieurs
fois à
l'eau. Le solide obtenu est séché sous vide. On obtient 22,93 g utilisé tel
quel à l'étape
suivante.
LC/MS (conditions A). MH = 307,0 ; t= 10,47.
C) 3-Amino-4-méthoxybut-2-énoate de méthyle.
On place sous azote un mélange contenant 30 g d'acétate d'ammonium
préalablement sublimé, 165 ml de cyclohexane et 15 ml de 4-méthoxy-3-
oxobutanoate
de méthyle et du tamis 4.~. On laisse sous agitation 4 heures à 90 C puis on
évapore à
sec. On lave et extrait au DCM puis la phase organique est filtrée et
évaporée. Le
produit obtenu est utilisé tel quel à l'étape suivante.
D) 5-(2,4-Dichlorophényl)-2-(méthoxyméthyl)-6-(4-méthoxyphényl)nicotinate.
On prépare un mélange contenant 10,63 g du composé obtenu à l'étape C ; 22,5 g
du composé obtenu à l'étape B, 0,50 g de PTSA et 54 ml de butanol. On laisse
sous
agitation à 150 C pendant 3 heures. On évapore le butanol puis le résidu est
repris par
400 ml de DCM. La phase organique est lavée par 400 ml d'eau puis séchée sur
Na2SO4, filtrée et évaporée à sec. On obtient 25,14 g du composé attendu sous
forme
brute.
E) Acide 5-(2,4-dichlorophényl)-2-(méthoxyméthyl)-6-(4-méthoxyphényl)
nicotinique.
On place 25,1 g du composé obtenu à l'étape précédente dans 232 iul d'éthanol,
en
présence de 32,5 g de potasse et on chauffe à reflux pendant 3 heures. Après
retour à
TA, le solvant est évaporé puis le résidu est traité par 300 ml d'eau. La
phase aqueuse
est acidifié par HCI concentré puis extraite par 300 ml d'éther. La phase
organique est
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
séchée sur Na2SO4, filtrée et évaporée à sec. Le produit obtenu est
recristallisé dans
un mélange éther/pentane et l'on obtient 15,11 g du composé attendu.
F) (5-(2,4-Dichlorophényl)-2-(méthoxyméthyl)-6-(4-méthoxyphényl)pyridin-3-yl)
méthanol.
5 Sous azote, on prépare un mélange contenant 80 ml de BH3 1M dans du THF et,
à 0 C, on ajoute goutte à goutte 13,4 g du composé obtenu à l'étape précédente
dans
200 ml de THF. On laisse sous agitation une nuit à TA, puis on ajoute goutte à
goutte
125 ml de méthanol puis, à 0 C, 250 ml d'éther chlorhydrique et on laisse 3
heures
sous agitation. La phase éthérée est séchée puis reprise par 250 ml d'éther et
lavée par
10 une solution de NaHCO3 saturée, puis de l'eau. La phase organique est
ensuite séchée
sur Na2SO4, filtrée et évaporée à sec. Le produit brut obtenu est
chromatographié sur
silicè en éluant par CH2C12 de 0 à 5%o en MéOH. On ôbtient 1,40 g du cômposé
attendu.
+
LC/MS (conditions A). MH = 404,0 ; t = 9,06.
15 G) 2-((5-2-(2,4-Dichlorophényl)-2-(méthoxyméthyl)-6-(4-
méthoxyphényl)pyridin-3-
yl)méthyl)-1 H-isoindole-1,3 -(2H)dione.
On prépare un mélange contenant 1,4 g du composé obtenu à l'étape précédente,
0,9 g de triphénylphosphine, 0,51 g de phtalimide et 0,6 ml d'éther auquel on
ajoute
goutte à goutte à-10 C 0,62 g de DEAD. Après une nuit à TA, on dilue par 100
inl
20 d'éther puis on lave le milieu réactionnel par 100 ml de tampon pH2, 100 ml
de
solution saturée de NaHCO3, 100 ml de solution de NaCl saturée puis on sèche
la
phase organique sur Na2SO4. On purifie le produit brut obtenu par
chromatographie
sur silice en éluant par un mélange DCM/MeOH (97/3 ; v/v). On obtient 1,8 g du
composé attendu.
LC/MS (conditions A). MH = 533,0 ; t= 9,79.
H) 1-(5-(2,4-Dichlorophényl)-2--(méthoxyphényl)-6-(4-méthoxyphényl)pyridin-3-
yl)
méthanamine.
On place sous azote un mélange contenant 1,79 g du çomposé obtenu
précédemment et 0,31 ml d'hydrate d'hydrazine dans 45 ml de méthanol et on
chauffe
à reflux pendant 3 heures. On ajoute 100 ml d'eau et 100 ml de DCM puis on
lave la
phase organique par 100 ml de solution de NaOH à 10 %, 100 ml de solution
saturée
de NaHCO3 et 100 ml de solution de NaCI saturé. La phase organique est séchée
sur
Na2SO4 et évaporée à sec. On obtient 0,944 g du composé attendu.
LC/MS (conditions A). MH+ = 403,0 ; t= 6,58.
Préparation 5
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
21
1 -(6-(4-Chlorophényl)-5 -(2,4-dichlorophényl)-2-(méthoxyméthyl)pyridin-3 -yl)
méthanamine.
Ce composé est préparé selon le procédé décrit à la Préparation 4.
LC/MS (conditions A). MH = 407,0, t= 7,15.
EXEMPLE 1: Composé N 3
N- { [-6-(4-Chlorophényl)-5-(2,4-dichlorophényl)-2-méthylpyridin-3 -yl]méthyl
} -
l.H-indole-2-carboxamide.
On place 0,5 g du composé de la Préparation 1, 0,19 g d'acide indole-2-
carboxylique, 0,75 g de PyBOP et 0,34 ml de triéthylamine dans 10 ml de DCM et
on
laisse 2 heures sous agitation à TA. On lave le milieu réactionnel par HCI à 3
%, de
l'eau, une solution aqueuse de soude à 8 % et de l'eau. On extrait au DCM,
sèche, filtre
et évapore. On chromatogràphie sur silice en éluant par le mélânge
DCI4/1VIéOOH avec
un gradient de 100/0 à 95/5, pour obtenir 130 mg du composé attendu.
RMN:2,65ppm:s:3H;4,60ppm:d:2H;6,90à7,70ppm:m:13H;9,05
ppm : t: 1H ; 11,62 ppm : se : 1H.
EXEMPLE 2: composé N 52
N- { [-6-(4-Chlorophényl)-5-(2,4-dichlorophényl)-2-méthylpyridin-3-yl]méthyl}-
4-(trifluorométhyl)benzènesulfonamide.
On place 0,5 g du composé de la Préparation 1, 0,29 g de chlorure d'acide 4-
trifluorométhylbenzènesulfonique et 0,34 ml de triéthylamine dans 10 ml de DCM
et
on laisse 2 heures sous agitation à TA. On lave le milieu réactionnel par HCl
à 3 %, de
l'eau, une solution aqueuse de soude à 8 % et de l'eau. On extrait au DCM,
sèche, filtre
et évapore. On chromatographie sur silice en éluant par le mélange DCM/MeOH
avec
un gradient de 100/0 à 95/5, pour obtenir 400 mg du composé attendu.
R1VN:2,51ppm:s:3H;4,20ppm:s:2H;7,10à7,70ppm:m:8H;7,80à
8,10 ppm : 2d : 4H; 8,50 ppm : s: 1H.
EXEMPLE 3: Composé N 81
N- { [-6-(4-Chlorophényl)-5-(2,4-dichlorophényl)-2-méthylpyridin-3 -yl]méthyl}
-
N'-[4-(trifluorométhyl)phényl]urée.
On place 0,5 g du composé de la Préparation 1, 0,22 g de 1-isocyanate-4-
(trifluorométhyl)benzène dans 10 ml de DCM et on laisse sous agitation 2
heures à
TA. On lave le milieu réactionnel par HCl à 3 %, de l'eau, une solution
aqueuse de
soude à 8 % et de l'eau. On extrait au DCM, sèche, filtre et évapore. On
chromatographie sur silice en éluant par le mélange DCM/MeOH avec un gradient
de
100/0 à 95/5, pour obtenir 400 mg du composé attendu.
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
22
RMN: 2,60 ppm: s: 3H; 4,40 ppm: d: 2H; 6,87 ppm: t: 1H;7,20à7,65ppm
: m: 12H ; 9,03 ppm : s: 1H.
EXEMPLE 4 : Composé N 121 [6-(4-Chlorophényl)-5-(2,4-dichlorophényl)-2-
méthylpipéridin-3-y11méthyl phénylcarbamate.
On place 0,5 g du coniposé de la Préparation 1, étape C et 0,28 ml
d'isocyanate de
benzène dans 18 ml de DCM et on laisse sous agitation à reflux pendant 1
heure.
Après retour à TA, le milieu réactionnel est traité par 200 ml d'eau et 150 ml
de DCM.
On décante. La phase organique est lavée par 200 ml d'eau, séchée sur Na2SO4
et
évaporée à sec. On purifie sur colonne de silice en éluant par un mëlange
DCM/MeOH (100/0 à 97/3 ; v/v). On obtient 334,8 mg du composé attendu.
EXEMPLE 5
Les composés de formule (IA) N 15 à 50 et (IB) N 60 à 88 daris laquëlle Z
représente N(R1)XR2 et -X- = -CO- ou SO2 sont préparés par chimie combinatoire
selon le procédé décrit ci-après :
on dissout un acide carboxylique de formule (III) ou respectivement un
halogénure de sulfonyle de formule (IV) dans le DMF à la concentration de
0,25M en
présence de 3 équivalents de DIPEA. Dans chaque puits de 2 ml, on place 120 l
de
cette solution et 120 l d'une solution de TBTU dans le DMF à la concentration
de
0,25M. On ajoute dans chaque puits 300 l d'une solution contenant le composé
de
formule (II) correspondant dans le DMF à la concentration 0,1M et 3
équivalents de
DIPEA. Les plaques sont agitées à TA pendant 16 heures puis évaporées. Les
produits
formés sont dissous datis chaque puits par 500 l d'AcOEt, on ajoute 400 1 de
Na2CO3 0,1M et les plaques soiit agitées. Après décantation 430 l de phase
aqueuse
sont écartés puis 300 l de NaC1 à 5 % sont additionnés et les plaques sont
agitées. On
écarte ensuite 350 l de phase aqueuse et les résidus sont analysés par
LC/UV/MS.
EXEMPLE 6
Les composés de formule (IC) N 87 à 116 et (ID) N 117 à 119 dans laquelle Z
représente N(R1)XR2 et -X- =-CON(Ri0) ou -CSN(Rl0) sont préparés par chimie
combinatoire selon le procédé décrit ci-aprés :
on dissout un isocyanate de formule (VII) ou respectivement thioisocyanate de
formule (VlIbis) dans le THF à la concentration de 0,25M en présence de 3
équivalents de DIPEA. Dans chaque puits de 2 ml, on place 120 l de cette
solution et
120 I d'une solution de TBTU dans le DMF à la concentration de 0,25M. On
ajoute
dans chaque puits 300 l d'une solution contenant le composé de formule (II)
correspondant dans le DMF à la concentration 0,1M et 3 équivalents de DIPEA.
Les
plaques sont agitées à TA pendant 16 heures puis évaporées. Les produits
formés sont
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
23
dissous dans chaque puits par 500 l d'AcOEt, on ajoute 400 l de Na2CO3 0,1M
et
les plaques sont agitées. Après décantation 430 l de phase aqueuse sont
écartés puis
300 l de NaCl à 5 % sont additionnés et les plaques sont agitées. On écarte
ensuite
350 l de phase aqueuse et les résidus sont analysés par LC/UV/MS.
Les tableaux qui suivent illustrent les structures chimiques et les propriétés
physiques de quelques composés selon l'invention.
Dans ces tableaux, Me, Et, Pr, nBu, tBu représentent respectivement les
groupes
méthyle, éthyle, propyle, n-butyle et tert-butyle.
Les conditions utilisées pour l'analyse LC/MS des composés sont indiquées par
A,
MS5 ou MS2.
TABLEAU 1
R3
N~ CH2 NH-CO-R2
/ \ I
R ~)
4
RS \ Ri
Rs
Composés N R2 R3 R4, R5 R7, R8 Caractérisation
1 ~~ Me 4-CI 2,4-diC1 MH = 537
tBu t = 11,58
A
F = 202 C
2 ~~ Me 4-Cl 2,4-diCl MH = 549
CF3 t =11,20
A
F = 101,5 C
3 N Me 4-CI 2,4-diCl MH = 520
I ~ \ t = 10,60
A
F =135,5 C
4 ~~ Me 4-Br 2,4-diCl MH = 593
CF3 t = 11,54
A
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
24
Coznposés N R2 R3 R4, R5 R7, R8 Caractérisation
F 102 C
H Me 4-Br 2,4-diCl MH = 564
I t=10,84
5 A
F = 126 C
6 Cl Me 4-Cl 2,4-diCl MH = 515,0
t = 11,31
A
7 Cl Me 4-Cl 2,4-diCl MH = 515,0
t = 10,91
A
8 CH2OMe 4-Cl 2,4-diCl MH = 567,0
t = 12,44
A
9 -CH-,Pr CH2OMe 4-OMe 2,4-diCl MH = 529,0
~Pr t = 11,10
A
10 H CH2OMe 4-OMe 2,4-diCl MH = 546,2
N t =10,45
A
11 /~ CH2OMe 4-Cl 2,4-diCl MH = 595,2
OCH3 t = 11,99
A
12 N CH2OMe 4-Cl 2,4-diCl MH = 550,0
t =11,38
A
13 ~Pr CH2OMe 4-Cl 2,4-diCl MH = 533,0
-CH~Pr t =12,07
A
14 H CH2OMe 4-Cl 2,4-diCl MH = 569,0
t = 12,52
A
H
H
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
Composés N R2 R3 R4, R5 R7, R Caractérisation
15 -CHiEt Me 4-OMe 2,4-diCI MH = 470,9
Et t = 1,65
MS5
5 16 Me 4-OMe 2,4-diCI MH = 496,9
-0 t = 1,70
MS5
17 Me 4-OMe 2,4-diCI MH = 496,9
Me t = 1,65
10 MS5
18 -CH~Pr Me 4-OMe 2;4-diCl MH = 499,0
~pr t 1,71
MS5
15 19 Me 4-OMe 2,4-diCI MH = 469,0
t = 1,63
MS5
20 -Bu Me 4-OMe 2,4-diCI MH = 456,9
t = 1,63
20 MS5
21 Me 4-OMe 2,4-diCI MH = 483,0
-0 t =1,67
MS5
22 H Me 4-OMe 2,4-diCI MH = 515,9
25 I I ~ t =1,78
MS5
23 Me 4-OMe 2,4-diCI MH = 560,9
cOCF3 t 1,74
MS5
24 Me 4-OMe 2,4-diCI MH = 533,0
/>tBu t = 1,79
MS5
25 -CH ~Et Me 4-Cl 2,4-diCI MH = 474,9
Et t = 1,74
MS5
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
26
Composés N R R R4, R5 R7, R Caractérisation
26 Me 4-Cl 2,4-diCI MH = 500,9
-CHZ t = 1,84
MS5
27 OCH3 Me 4-Cl 2,4-diCI MH = 516,9
t = 1,70
MS5
28 Me 4-Cl 2,4-diCI MH = 500,9
t= 1,81 -0 10 MS5
29 Me 4-Cl 2,4-diCI _ MH = 576,9
-CH t = 2,03
\0 MS5
30 Me 4-Cl 2,4-diCI MH = 500,9 -70 t= 1,81
Me MS5
31 Me 4-Cl 2,4-diCI MH = 472,9
t = 1,74
MS5
32 -CH,~tBu Me 4-CI 2,4-diCI MH = 539,9
t =1,99
MS5
33 Me 4-CI 2,4-diCI MH = 498,9
t =1,84
z:; MS5
H
34 -CH-,Pr Me 4-CI 2,4-diCl MH = 502,9
Pr t = 1,90
MS5
Me 4-CI 2,4-diCI MH = 524,8
O t =1,72
MS5
O
35 36 -Bu Me 4-Cl 2,4-diCI MH = 460,9
t =1,76
MS5
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
27
Composés N R2 R3 R4, R5 R7, R8 Caractérisation
37 Me 4-Cl 2,4-diCl MH = 584,8
-CH2-CH t = 1,84
MS5
38 Me 4-Cl 2,4-diCl MH = 500,9
t =1,67
O MS5
Me
39 Me 4-Cl 2,4-diCl MH = 486,9
t =1,77 -0 MS5
40 Me 4-Cl 2;4-diC1 MH = 486,9
t = 1,81
MS5
41 /~ - Me 4-Cl 2,4-diCl MH = 545,8
N t = 1,87
MS5
42 Me 4-Cl 2,4-diCl MH = 470,8
t =1,67
O MS5
43 Me 4-Cl 2,4-diCl MH = 500,8
t =1,76
S Me MS5
44 H Me 4-C1 2,4-diCl MH = 519,8
N t = 1,83
I MS5
45 Cl Me 4-Cl 2,4-diCl MH = 572,8
j\O ~ 1 t=1,99
M - MS5
46 /~ Me 4-Cl 2,4-diCl MH = 564,8
OCF3 t =1,87
MS5
47 Me 4-Cl 2,4-diCl MH = 516,9
OMe t = 1,69
MS5
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
28
Composés N R R3 R4, R5 R7, R8 Caractérisation
48 Me 4-Cl 2,4-diCl MH = 522,8
-(CH2)2 Me t = 1,81
MS5
49 Me 4-Cl 2,4-diCl MH = 576,8
-(CI42)2 C>-CF3 t =1,85
MS5
50 / Me 4-Cl 2,4-diCl MH = 520,7
t = 1,84
S Cl MS5
TABLEAU 2
N CH2-NH-SO2-R2
R4 I / ~)
7
RS R
R8
Composés N R2 R3 R4, R5 R7, R8 Caractérisation
51 Me 4-Cl 2,4-diCl MH+ = 599
-CH2 t =11,45
A
CF3 F = 86 C
52 /~ Me 4-Cl 2,4-diCl MH+ = 585
CF3 t =11,66
A
F = 98 C
53 ~~ Me 4-Cl 2,4-diCl MH = 551
t = 11,47
' Cl A
F = 94 C
54 -nBu Me 4-Cl 2,4-diCl MH = 498
t =10,92
A
F=66 C
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
29
Composés N R2 R3 R4, R5 R7, R8 Caxactérisation
55 Me 4-Br 2,4-diCl MH = 629
cCF3 t = 11,62
A
F = 207 C
56 Cl CH2OMe 4-Cl 2,4-diCl MH = 581,0
t =11,88
A
57 Cl CH2OMe 4-OMe 2,4-diCl MH = 576,8
t =11,01
- A
58 -CH~Pr CH2OMe 4-Cl 2,4-diCl MH = 533,0
pr t = 12,07
A
59 CH2OMe 4-Cl 2,4-diCl MH = 628,8
-CH2 t = 11,92
A
CF3
60 F Me 4-OMe 2,4-diCl MH = 549,5
t =1,68
MS2
F
61 KIIII~ Me 4-OMe 2,4-diCl MH = 531,5
t =1,64
F MS2
62 ~~ Me 4-OMe 2,4-diCl MH = 581,5
t = 1,72
- CF3 MS2
63 Me Me 4-C1 2,4-diCl MH = 588,7
- t = 2,04
O MS5
CF3
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
Composés N R2 R3 R4, R5 R7, R8 Caractérisation
64 f~ Me 4-Cl 2,4-diCl MH = 584,7
t= 2,02
MS5
5 CF3
65 /~ Me 4-Cl 2,4-diCl MH = 584,7
t =1,97
CF3 MS5
66 /~ Me 4-Cl 2,4-diCl MH = 550,8
10 t = 1,98
MS5
Cl
67 Me 4-Cl 2,4-diCl MH = 556,7
t=2,01
15 S Cl MS5
68 Me 4-Cl 2,4-diCl MH = 534,8
t = 1,86
F MS5
69 /~ Me 4-Cl 2,4-diCl MH = 600,7
20 t = 2,01
MS5
OCF3
70 /~ Me 4-Cl 2,4-diCl MH = 564,8
Me t = 2,04
25 ' Cl MS5
71 Cl Me 4-Cl 2,4-diCl MH = 585,4
~ t = 1,97
MS2
C1
30 72 j Me 4-Cl 2,4-diCl MH = 523,4
t = 1,82
S MS2
73 CN Me 4-Cl 2,4-diCl MH = 542,5
~ ~ t =1,82
MS2
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
31
Composés N R2 R3 R4, R5 R7, R Caractérisation
74 F Me 4-Cl 2,4-diCl MH = 535,5
~ ~ t = 1,85
- MS2
75 -Bu Me 4-Cl 2,4-diCl MH = 497,5
t = 1,80
MS2
76 Cl Me 4-Cl 2,4-diCl MH = 569,4
F t =1,93
MS2
77 F Me 4-Cl 2,4-diCl MH = 553,5
t =1,89
MS2
F
TABLEAU 3
R
,3 O
iI
N r I CH2 NH-C-NH-R2
/
R ~ ~C)
4
R5
R
i
R8
Composés N R2 R3 R4, R5 R7, R8 Caractérisation
78 Me 4-Cl 2,4-diCl MH = 572
t = 10,96
A
F =123,5 C
79 Me 4-Cl 2,4-diCl MH = 552
t = 11,28
A
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
32
Composés N R R3 R4, R5 R7, R8 Caractérisation
F = 208 C
80 /~ Me 4-Cl 2,4-diCI MH = 564
t = 11,06
CF3 A
F =110 C
81 /~ Me 4-Cl 2,4-diCl MH = 564
CF3 t =11,14
A
-
82 Me 4-Br 2,4-diCI MH = 608
- ,\
-- _
3 t =11,50
A
F = 230 C
83 Me 4-Cl 2,4-diCI MH = 530
t = 11,20
Cl A
84 i Me 4-Cl 2,4-diCI MH = 524,0
_C t =10,98
A
85 /~ CH2OMe 4-Cl 2,4-diCI MH = 594,0
CF3 t =11,91
A
86 CH2OMe 4-OMe 2,4-diCI MH = 590,0
CF3 t =10,96
A
87 Me 4-OMe 2,4-diCI MH = 484,6
t = 1,49
MS2
88 Me 4-OMe 2,4-diCI MH = 510,6
CF t = 1,55
MS2
89 Me 4-OMe 2,4-diCI MH = 570,5
/>Br t =1,65
MS2
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
33
Composés N R R3 R4, R5 R7, R8 Caractérisation
90 Me 4-OMe 2,4-diCI MH = 526,5
Cl t 1,61
MS2
91 F Me 4-OMe 2,4-diCl MH = 528,6
t =1,59
MS2
F
92 -tBu Me 4-OMe 2,4-diCI MH = 472,6
t =1,49
MS2
93 Mé "4=OMè 2,4-diCI MHT = 524,6
-CH2 t =1,51
MS2
94 F Me 4-OMe 2,4-diCI MH = 510,6
t = 1,57
MS2
95 Cl Me 4-OMe 2,4-diCl MH = 526,5
t =1,62
MS2
96 /~ Me 4-OMe 2,4-diCI MH = 560,6
CF3 t =1,67
-- MS2
97 F Me 4-OMe 2,4-diCl MH = 528,6
t =1,63
MS2
F
98 Me 4-Cl 2,4-diCI MH = 527,8
-CH2 t =1,70
F MS5
99 -tBu Me 4-Cl 2,4-diCI MH = 475,9
t = 1,68
MS5
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
34
Composés N R2 R3 R4, R5 R7, R8 Caractérisation
100 Me 4-Cl 2,4-diCI MH = 585,8
-CH t =1,83
MS5
101 Me 4-C1 2,4-diCI MH = 535,8
~~ -- t = 1,73
MS5
102 / Me 4-CI 2,4-diCI MH = 499,9
-CH2 t =1,60
O MS5
103 Me 4-CI 2,4-diCl MrI = 539,9
-CH2 t = 1,69
OMe MS5
104 /~ Me 4-Cl 2,4-diCI MH = 513,8
t =1,73
F MS5
105 /~ Me 4-Cl 2,4-diCI MH = 527,8
-CHï t =1,71
F MS5
106 C F Me 4-Cl 2,4-diCI MH = 527,8
- ~ t =1,70
MS5
107 -Pr Me 4-CI 2,4-diCI MH = 462,5
t =1,57
MS2
108 /~ Me 4-CI 2,4-diCI MH = 580,5
OCF3 t =1,81
MS2
109 Me 4-Cl 2,4-diCI MH = 526,5
t = 1,70
OMe MS2
110 ~~ Me 4-CI 2,4-diCI MH = 524,5
-(CH2) a t =1,69
MS2
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
Composés N R2 R3 R4, R5 R7, R8 Caractérisation
111 /~ Me 4-Cl 2,4-diCl MH = 514,5
t =1,74
F MS2
112 Me 4-Cl 2,4-diCl MH = 530,5
cCl t = 1,78
MS2
113 /~ Me 4-Cl 2,4-diCl MH = 574,4
Br t = 1,80
10 - MS2
114 Me 4-OMe 2,4-diCl MH = 498,6
-0 t = 1,56
MS2
115 Me 4-Cl 2,4-diCl MH = 502,6
15 -0 t = 1,69
MS2
116 Me 4-Cl 2,4-diCl MH = 496,5
t =1,69
MS2
TABLEAU 4
Me s
N CH2 NH-C-NH-R2
Cl ~ / Cl (ID)
Cl
Composés N R Caractérisation
117 MH = 579,8
CCF3 t =1,90
MS5
MH = 518,5
-0 t=1,81
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
36
MS2
CF3 lvffl = 628,8
-C~ t =11,92
A
TABLEAU 5
Me O
N CH2~0 R!2
ci (IF)
CI
IS
C1
Composés N R' Caractérisation
120 ~ ~ MH = 527,0
t = 11,77
OMe A
121 MH = 497,0
t = 11,81
A
122 Cl MH = 564,8
Cl t =12,84
A
Les composés selon l'invention ont fait l'objet d'essais pharmacologiques
permettant de déterminer leur affinité et leur pouvoir antagoniste vis à vis
des
récepteurs aux cannabinoïdes CB1.
Les composés de formule (I) possèdent une bonne affinité in vitro (IC50 <_
5.10 -7 M) pour les récepteurs aux cannabinoïdes CB1, dans les conditions
expérimentales décrites par M. Rinaldi-Carmona et al. (FEBS Letters, 1994,
350, 240-
244).
La nature antagoniste des composés de formule (I) a été démontrée par les
résultats obtenus dans les modèles de l'inhibition de l'adénylate-cyclase
comme décrits
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
37
dans M. Rinaldi-Carmona et al., J. Pharmacol. Exp. Ther., 1996, 278, 871-878
et M.
Bouaboula et al., J. Biol. Chem., 1997, 272, 22330-22339.
La toxicité des composés de formule (I) est compatible avec leur utilisation
en
tant que médicament.
Ainsi, selon un autre de ses aspects, l'invention a pour objet des médicaments
pour la médecine humaine ou vétérinaire qui comprennent un composé de formule
(I),
ou un sel d'addition de ce dernier à un acide pharmaceutiquement acceptable,
ou
encore un solvat ou un hydrate du composé de formule (I).
Les composés selon l'invention peuvent être utilisés chez l'homme ou chez
l'animal, dans le traitement ou la prévention de maladies impliquant les
récepteurs aux
cannabinoïdes CB l.
Par exemple et de manière non limitative, les composés de formule (I) sont
ut'iles
comme médicaments psychotropes, notamment pour le traitement des désordres
psychiatriques incluant l'anxiété, la dépression, les troubles de l'humeur,
l'insomnie,
les troubles délirants, les troubles obsessionnels, les psychoses en général,
la
schizophrénie, les troubles de l'attention et de l'hyperactivité (TDAH) chez
les enfants
hyperkinétiques (MBD) ainsi que pour le traitement des troubles liés à
l'utilisation de
substances psychotropes, notamment dans le cas d'un abus d'une substance et/ou
de
dépendance à une substance, y compris la dépendance alcoolique et la
dépendance
nicotinique.
Les composés de formule (I) - selon l'invention peuvent être utilisés comme
médicaments pour le traitement de la migraine, du stress, des maladies
d'origine
psychosomatique, des crises d'attaques de panique, de l'épilepsie, des
troubles du
mouvement, en particulier des dyskinésies ou de la maladie de Parkinson, des
trembleinents et de la dystonie.
Les composés de formule (I) selon l'invention peuvent également être utilisés
comme médicaments dans le traitement des troubles mnésiques, des troubles
cognitifs,
en particulier dans le traitement des démences séniles, de la maladie
d'Alzheimer,
ainsi que dans le traitement des troubles de l'attention ou de la vigilance.
De plus, les
composés de formule (I) peuvent être utiles comme neuroprotecteurs, dans le
traitement de l'ischémie, des traumatismes crâniens et le traitement des
maladies
neurodégénératives : incluant la chorée, la chorée de Huntington, le syndrome
de
Tourrette.
Les composés de formule (I) selon l'invention peuvent être utilisés comme
médicaments dans le traitement de la douleur : les douleurs neuropathiques,
les
douleurs aiguës périphériques, les douleurs chroniques d'origine
inflammatoire.
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
38
Les composés de formule (I) selon l'invention peuvent être utilisés comme
médicaments dans le traitement des troubles de l'appétit, de l'appétence (pour
les
sucres, carbohydrates, drogues, alcools ou toute substance appétissante) et/ou
des
conduites alimentaires, notamment pour le traitement de l'obésité ou de la
boulimie
ainsi que pour le traitement du diabète de type II ou diabète non
insulinodépendant et
pour le traitement des dyslipidémies, du syndrome métabolique. Ainsi les
composés
de formule (I) selon l'invention sont utiles dans le traitement de l'obésité
et des risques
associés à l'obésité, notamment les risques cardio-vasculaires. De plus, les
composés
de formule (I) selon l'invention peuvent être utilisés en tant que médicaments
dans le
traitement des troubles gastro-intestinaux, des troubles diarrhéiques, des
ulcères, des
vomissements, des troubles vésicaux et urinaires, des troubles d'origine
endocrinienne, des troubles cardio-vasculaires, de l'hypotension, du choc
hémorragique, du choc septique, de la cirrhose chronique du foie, de la
stéatose
hépatique, de la stéatohépatite, de l'encéphalopathie hépatique chronique, de
l'asthine,
du syndrome de Raynaud, du glaucome, des troubles de la fertilité, des
phénomènes
inflammatoires, des maladies du système immunitaire, en particulier
autoimmunes et
neuroinflammatoires tel que l'arthrite rhumatoïde, l'arthrite réactionnelle,
les maladies
entraînant une démyélinisation, la sclérose en plaque, des maladies
infectieuses et
virales telles que les encéphalites, des accidents vasculaires cérébraux ainsi
qu'en tant
que médicaments pour la chimiothérapie anticancéreuse, pour le traitement du
syndrome de Guillain-Barré et pour le traitement de l'ostéoporose.
Selon la présente invention, les composés de formule (I) sont tout
particulièrement utiles pour le traitement des troubles psychotiques, en
particulier la
schizophrénie, les troubles de l'attention et de l'hyperactivité (TDAH) chez
les enfants
hyperkinétiques (MBD) ; pour le traitement des troubles de l'appétit et de
l'obésité ;
pour le traitement des déficits mnésiques et cognitifs ; pour le traitement de
la
dépendance alcoolique, de la dépendance nicotinique, c'est à dire pour le
sevrage
alcoolique et pour le sevrage tabagique ; et pour le traitement des
dyslipidémies, du
syndrome métabolique.
Plus particulièrement, les composés de formule (I) selon la présente invention
sont utiles dans le traitement et la prévention des troubles de l'appétit, des
troubles
métaboliques, des troubles gastro-intestinaux, des phénomènes inflammatoires,
des
maladies du système immunitaire, des troubles psychotiques, de la dépendance
alcoolique, de la dépendance nicotinique.
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
39
Selon un de ses aspects, la présente invention est relative à l'utilisation
d'un
composé de formule (I), de ses sels pharmaceutiquement acceptables et de leurs
solvats ou hydrates pour le traitement des troubles et maladies indiqués ci-
dessus.
Selon un autre de ses aspects, la présente invention concerne des compositions
pharmaceutiques comprenant, en tant que principe actif, un composé selon
l'invention.
Ces compositions pharmaceutiques contiennent une dose efficace d'au moins un
composé selon l'invention, ou un sel pharmaceutiquement acceptable, un solvat
ou
hydrate dudit composé, ainsi qu'au moins un excipient pharmaceutiquement
acceptable.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration souhaité, parmi les excipients habituels qui sont connus de
l'Homme
du métier.
Dans les conipositions pharmaceutiques de la présente invention pour
l'administration orale, sublinguale, sous-cutanée, intramusculaire, intra-
veineuse,
topique, locale, intratrachéale, intranasale, transdermique ou rectale, le
principe actif
de formule (I) ci-dessus, ou son sel, solvat ou hydrate éventuel, peut être
administré
sous forme unitaire d'administration, en mélange avec des excipients
pharmaceutiques
classiques, aux animaux et aux êtres humains pour la prophylaxie ou le
traitement des
troubles ou des maladies ci-dessus.
Les formes unitaires d'administration appropriées comprennent les formes par
voie orale telles que les comprimés, les gélules molles ou dures, les poudres,
les
granules et les solutions ou suspensions orales, les formes d'administration
sublinguale, buccale, intratrachéale, intraoculaire, intranasale, par
inhalation, les
formes d'administration topique, transdermique, sous-cutanée, intramusculaire
ou
intraveineuse, les formes d'administration rectale et les implants. Pour
l'application
topique, on peut utiliser les composés selon l'invention dans des crèmes,
gels,
pommades ou lotions.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention sous forme de comprimé peut comprendre les composants suivants :
Composé selon l'invention : 50,0 mg
Mannitol : 223,75 mg
Croscarmellose sodique . 6,0 mg
Amidon de maïs . 15,0 mg
Hydroxypropyl-méthylcellulose . 2,25 mg
Stéarate de magnésium : 3,0 mg
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
Par voie orale, la dose de principe actif administrée par jour peut atteindre
0,01 à
100 mg/kg, en une ou plusieurs prises, préférentiellement 0,02 à 50 mg/kg.
Il peut y avoir des cas particuliers où des dosages plus élevés ou plus
faibles sont
appropriés ; de tels dosages ne sortent pas du cadre de l'invention. Selon la
pratique
5 habituelle, le dosage approprié à chaque patient est déterminé par le
médecin selon le
mode d'administration, le poids et la réponse dudit patient.
La présente invention, selon un autre de ses aspects, coilcerne également une
méthode de traitement des pathologies ci-dessus indiquées qui comprend
l'administration, à un patient, d'une dose efficace d'un composé selon
l'invention, ou
10 un de ses sels pharmaceutiquement acceptables ou hydrates ou solvats.
Selon la présente invention, un composé de formule (I) peut être associé à un
autre principe actif choisi patmi l'une des classes thérapeutiques suivantes :
- un antagoniste des récepteurs ATl de l'angiotensine II, seul ou associé à un
diurétique ;
15 - un inhibiteur de l'enzyme de conversion, seul ou associé à un diurétique
ou à un
antagoniste calcique ;
- un antagoniste calcique ;
- un béta-bloquant seul ou associé à un diurétique ou à un antagoniste
calcique ;
- un antihyperlipémiant ou un antihypercholestérolémiant ;
20 - un antidiabétique ;
- un autre agent anti-obésité.
Ainsi, la présente invention a également pour objet des compositions
pharmaceutiques contenant en association un composé de formule (I) et un autre
principe actif choisi parmi l'une des classes thérapeutiques suivantes :
25 - un antagoniste des récepteurs AT1 de l'angiotensine II, seul ou associé à
un
diurétique ou à un antagoniste calcique ;
- un inhibiteur de l'enzyme de conversion, seul ou associé à un diurétique ;
- un antagoniste calcique ;
- un béta-bloquant seul ou associé à un diurétique ou à un antagoniste
calcique ;
30 - un antihyperlipémiant ou un antihypercholestérolémiant ;
- un antidiabétique ;
- un autre agent anti-obésité.
Par antagoniste des récepteurs ATl de l'angiotensine TI, on entend notamment
un
composé tel que candésartan cilexitil, éprosartan, irbésartan, losartan
potassium,
35 olmésartan médoxomil, telmisartan, valsartan, chacun de ces composés
pouvant être
lui-même associé à un diurétique tel que l'hydrochlorothiazide.
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
41
Par inhibiteur de l'enzyme de conversion, on entend notamment un composé tel
que alacépril, bénazépril, captopril, cilazapril, énalapril, énalaprilat,
fosinopril,
imidapril, lisinopril, moexipril, périndopril, quinapril, ramipril, spirapril,
temocapril,
trandolapril, zofénopril, chacun de ces composés pouvant lui-même être associé
à un
diurétique tel que l'hydrochlorothiazide ou l'indapamide ou à un antagoniste
calcique
tel que l'amlodipine, le diltiazem, le félodipine ou le vérapamil.
Par antagoniste calcique, on entend notemment un composé tel que amlodipine,
aranidipine, bénidipine, bépridil, cilnidipine, diltiazem, éfonidipine
hydrochloride
éthanol, fasudil, félodipine, isradipine, lacidipine, lercanidipine
hydrochloride,
manidipine, mibéfradil hydrochloride, nicardipine, nifédipine, nilvadipine,
nimodipine, nisoldipine, nitrendipine, térodiline, véraparnil.
Par béta-bloquant, on entend notaminent un composé tel que acébutolol,
alprénolol, amôsulalol, arotinolol, aténolol, béfunolol, bétaxolol,
bévantolol,
bisoprolol, bopindolol, bucumolol, bufétolol, bunitrolol, butofilolol,
carazolol,
cartéolol, carvédilol, cloranolol, épanolol, esmolol, indénolol, labétalol,
landiolol,
lévobunolol, lévomoprolol, mépindolol, métipranolol, métoprolol, nadolol,
nébivolol,
nifénalol, nipradilol, oxprénolol, penbutolol, pindolol, propanolol,
salmétérol, sotalol,
talinolol, tertatolol, tilisolol, timolol, xamotérol, xibénolol.
Par antihyperlipémiant ou antihypercholestérolémiant, on entend notamment un
composé choisi parmi les fibrates tels que alufibrate, béclobrate,
bézafibrate,
ciprofibrate, clinofibrate, clofibrate, étofibrate, fénofibrate ; les statines
(inhibiteurs de
HMG-CoA reductase), telles que atorvastatine, fluvastatine sodium,
lovastatine,
pravastatine, rosuvastatine, simvastatine, ou un composé tel que acipimox,
aluminum
nicotinate, azacostérol, cholestyramine, dextrothyroxine, méglutol,
nicéritrol,
nicoclonate, acide nicotinique, béta-sitosterin, tiadénol. Plus
particulièrement, la
présente invention a pour objet une composition pharmaceutique contenant en
association un composé de formule (I) et l'atorvastatine ou la pravastatine,
ou
préférentiellement un composé de formule (I) et la simvastatine.
Par antidiabétique, on entend notamment un composé appartenant à l'une des
classes suivantes : les sulfonylurées, les biguanidines, les inhibiteurs
d'alpha
glucosidase, les thiazolidinedione, les métiglinides, tel que acarbose,
acétohexamide,
carbutamide, chlorpropamide, glibenclamide, glibornuride, gliclazide,
glimépiride,
glipizide, gliquidone, glisoxepide, glybuzole, glymidine, métahexamide,
métformin,
miglitol, natéglinide, pioglitazone, répaglinide, rosiglitazone, tolazamide,
tolbutamide,
troglitazone, voglibose.
CA 02582778 2007-03-27
WO 2006/042955 PCT/FR2005/002566
42
Par autre agent anti-obésité, on entend notamment un composé tel que
anifépramone, benfluorex, benzphétamine, indanorex, mazindole, méfénorex,
méihamphétamine, D-norpseudoéphédrine ou un autre antagoniste des récepteurs
CB 1
aux cannabinoïdes.
Tout particulièrement, la présente invention a pour objet une composition
pharmaceutique contenant en association un composé de formule (I) et un
antagoniste
des récepteurs ATi de l'angiotensine II, notamment l'irbesartan, le losartan
ou le
valsartan.
Selon un autre aspect de l'invention, le composé de formule (I) et l'autre
principe
actif associé peuvent être administrés de manière simultanée, séparée ou
étalée dans le
temps.
On entend par "utilisation séparée" l'admi nistration, en même temps, des deux
composés de la composition selon l'invention, chacun compris dans une forme
pharmaceutique distincte.
On entend par "utilisation étalée dans le temps", l'administration successive,
du
premier composé de la . composition selon l'invention, compris dans une forme
pharmaceutique, puis, du deuxième composé de la composition selon l'invention,
compris dans une forme pharmaceutique distincte.
25
35