Note: Descriptions are shown in the official language in which they were submitted.
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
1
DÉRIVÉS DE 2-CARBAMIDE-4-PHENYLTHIAZOLE, LEUR PRÉPARATION ET
LEUR APPLICATION EN THÉRAPEUTIQUE
L'invention se rapporte à des dérivés de 2-carbamide-4-phénylthiazole, à leur
préparation et à leur application en thérapeutique.
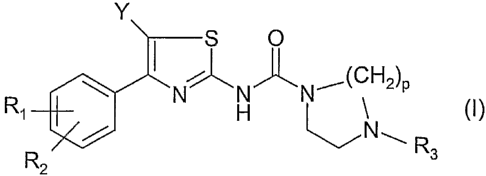
L'invention a pour objet des composés répondant à la formule (I) ci-après :
Y
S O
N~N'J~ N' (CH2)P
Ri H ~ (I)
N~R
R2 3
dans laquelle :
- RI représente un atome d'hydrogène, d'halogène, un groupe (Cl-C8)alkyle,
trifluoro(CI-C4)alkyle, -OH, -O-(Cl-C8)alkyle, -O-trifluoro(CI-C$)alkyle, -O-
(Cl-
C8)alkyle-(C3-C,o)cycloalkyle, -O-(C3-Clo)cycloalkyle, -O-CH2-CH=CHa, -S-(C,-
C4)alkyle ;
- R2 représente un atome d'hydrogène, d'halogène, un groupe -OH, (Ci-
C8)alkyle, trifluoro(C,-C4)alkyle, perfluoro(Cl-C4)alkyle, (C3-
C10)cycloalkyle, -O-(C,-
C$)alkyle, -O-(Cl-Ca)alkyle-(C3-Clo)cycloalkyle, -O-(C3-Clo)cycloalkyle, -O-
CH2-
CH=CH2i -(Cl-C$)alkyle-(C3-C8)cycloalkyle;
- Y représente un atome d'hydrogène ou un halogène ;
- p représente 2 ou 3;
- R3 représente :
a1) un groupe de formule -(CH2)a-A
où a représente 1, 2, 3 ou 4, et A est sélectionné dans le groupe constitué
par:
17 R ~ ~
1 1'
N N N O
D ; ; -0 ; et
O
où R7 est sélectionné dans le groupe constitué par :
= -(Cl-C8)alkyle-COO-(C,-C8)alkyle,
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
2
=-CO-(CI-C8)alkyle où l'alkyle est substitué par au moins un atome
d'halogène,
= -(C3-Clp)cycloalkyle,
= phényle,
= -COO-(C3-Clo)cycloalkyle,
=-S02-(Cl-C8)alkyle où l'alkyle est substitué par au moins un atome
d'halogène,
=-SOz-phényle où le phényle est substitué par au moins un groupe -O-(Cl-
C8)alkyle,
=-SO2-hétéroaryle où l'hétéroaryle est un pyrazole, un isoxazole ou un
imidazole et où l'hétéroaryle est indépendamment substitué par au moins un
groupe choisi parmi halogène ou -(Ci-C8)alkyle,
= -S02-N((Cl-C8)alkyle)2,
= -S02-OH,
= -SO2-(C3-C,o)cycloalkyle,
= -CO-NH((Ci-C8)alkyle),
= -(CI-C8)alkyle-CN,
= -(Ci-C$)alkyle-imidazole,
= -(Ci-C8)alkyle-COOH,
= -(Ci-C8)alkyle-COO"M+,
= -(Ci-C$)aikyle-OH,
= -(Cl-C8)alkyle-tétrazole,
= -(C,-C8)alkyle-CO-NH2,
= -(C,-C8)alkyle-CO-NH((CI-C$)alkyle),
= -(Ci-C8)alkyle-CO-NH((C3-C,o)cycloalkyle),
= -(C,-C8)alkyle-CO-N((CI-C8)alkyle)((C3-Clo)cycloalkyle),
= -(CI-C8)alkyle-CO-N((Ci-C8)alkyle)2a
= -(Ci-C8)alkyle-CO-N((C3-Clo)cycloalkyle)2,
où M+ est un cation de métal alcalin choisi parmi Li+, Na+ et K+, et lorsqu'il
y a deux
substituants alkyle ou cycloalkyle lié à l'atome d'azote, ils peuvent être
indépendamment identiques ou différents ;
a2) un groupe de formule -CO(CH2)b-A
où b représente 0, 1, 2, 3 ou 4, et A est sélectionné dans le groupe constitué
par:
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
3
i7 I7 i7
N N N O
et
O
où R7 est tel que défini précédemment ;
a3) un groupe -B
dans lequel B est sélectionné dans le groupe constitué par :
i, I7
N N O
--CN-R~~ ~ _D; _CO ; -0 ; et
où R7 est tel que défini précédemment ;
a4) un groupe de formule -(CH2),,-C
où a représente 1, 2, 3 ou 4, et C est sélectionné dans le groupe constitué
par:
R Rb Rc Rb 1 8 Rc Rf Rg Rf ~\ //0 Rg R s
Ra O Rd Ra N Rd Re s Rh Re s Rh
; ; y f et
où :
- R8 est sélectionné dans le groupe constitué par:
= un atome d'hydrogène,
= un groupe (Cl-C8)alkyle,
= -(CI-C8)alkyle-COO-(CI-C$)alkyle,
=-CO-(Cl-C8)alkyle où l'alkyle est éventuellement substitué par au moins un
atome d'halogène,
= -(C3-Clp)cycloalkyle,
= phényle,
= -COO-(C3-C,p)cycloalkyle,
=-SO2-(CI-C$)alkyle où l'alkyle est éventuellement substitué par au moins un
atome d'halogène,
=-SO2-phényle où le phényle est éventuellement substitué par au moins un
groupe -O-(Cl-C8)alkyle,
=-SO2-hétéroaryle où l'hétéroaryle est un pyrazole, un isoxazole ou un
imidazole et où l'hétéroaryle est éventuellement indépendamment substitué
par au moins un groupe choisi parmi halogène ou -(Ci-C8)alkyle,
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
4
= -S02-N((Ci-C8)alkyle)2,
= -S02-OH,
= -S02-(C3-Clo)cycloalkyle,
= -CO-NH((CI-C8)alkyle),
= -(Cl-C8)alkyle-CN,
= -(C,-C8)alkyle-imidazole,
= -(C,-C8)alkyle-COOH,
= -(C,-Cg)alkyle-COO"M+,
= -(Ci-C8)alkyie-OH,
= -(Ci-Ca)alkyle-tétrazole,
= -(CI-C8)alkyle-CO-NH2,
= -(C,-C$)alkyle-CO-NH((CI-C8)alkyle),
= -(Ci-C8)alkyle-CO-NH((C3-Clo)cycloalkyle),
= -(CI-C8)alkyle-CO-N((CI-C8)alkyle)((C3-Clo)cycloalkyle),
= -(C,-C8)alkyle-CO-N((CI-Ca)alkyle)2,
= -(C,-C8)alkyle-CO-N((C3-CIo)cycloalkyle)2,
où M+ est un cation de métal alcalin choisi parmi Li+, Na+ et K+, et lorsqu'il
y a deux
substituants alkyle ou cycloalkyle lié à l'atome d'azote, ils peuvent être
indépendamment identiques ou différents;
- R9 est sélectionné dans le groupe constitué par: hydroxyle, O-(C,-C8)alkyle,
-O-
trifluoro(C,-C$)alkyle, -O-(Cl-C8)alkyle-(C3-C,o)cycloalkyle, -O-(C3-
C10)cycloalkyle,
- Ra, Rb, Rc et Rd sont indépendamment un atome d'hydrogène ou un groupe
méthyle, étant donné qu'au moins l'un des Ra, Rb, Rc et Rd est un groupe
méthyle ;
- Re, Rf, Rg et Rh sont indépendamment un atome d'hydrogène ou un groupe
méthyle;
a5) un groupe de formule -CO(CH2)b-C
où b représente 0, 1, 2, 3 ou 4, et C est sélectionné dans le groupe constitué
par :
R
Rb Rc Rb 1 e Rc Rf Rg Rf 00 Rg R
Ra O Rd Ra N Rd Re j Rh Re Rh
, et
où:
- R8, R9, Ra, Rb, Rc, Rd, Re, Rf, Rg et Rh sont tels que définis précédemment,
a6) un groupe -D
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
dans lequel D est sélectionné dans le groupe constitué par :
R Rb Rc Rb 1 e Rc Rf Rg Rf ~\ /% Rg R
Ra Rd Ra N Rd Re s Rh Re s Rh
et
où .
- R8, R9, Ra, Rb, Rc, Rd Re, Rf, Rg et Rh sont tels que définis précédemment,
5 à l'état de base ou de sel d'addition à un acide, ainsi qu'à l'état
d'hydrates ou de
solvats.
Un halogène préféré est un fluor.
1o Les composés de formule (I) peuvent comporter un ou plusieurs atomes de
carbone
asymétriques. Ils peuvent donc exister sous forme d'énantiomères ou de
diastéréoisomères. Ces énantiomères, diastéréoisomères, ainsi que leurs
mélanges, y compris les mélanges racémiques, font partie de l'invention.
Les composés de formule (I) peuvent exister à l'état de bases ou de sels
d'addition
à des acides. De tels sels d'addition font partie de l'invention.
Ces sels sont avantageusement préparés avec des acides pharmaceutiquement
acceptables, mais les sels d'autres acides utiles, par exemple, pour la
purification
ou l'isolement des composés de formule (I) font également partie de
l'invention.
Les composés de formule (I) peuvent également exister sous forme d'hydrates ou
de solvats, à savoir sous forme d'associations ou de combinaisons avec une ou
plusieurs molécules d'eau ou avec un solvant. De tels hydrates et solvats font
également partie de l'invention.
Dans le cadre de la présente invention, on entend par :
- Ct_Z où t et z peuvent prendre les valeurs de 1 à 10, une chaîne carbonée
pouvant avoir de t à z atomes de carbone, par exemple C1_3 une chaîne carbonée
qui peut avoir de 1 à 3 atomes de carbone ;
- un atome d'halogène est par exemple un fluor, un chlore, un brome ou un iode
;
- un groupe alkyle : un groupe aliphatique saturé linéaire ou ramifié,
éventuellement substitué par un atome d'halogène. A titre d'exemples, on peut
citer
les groupes méthyle, éthyle, propyle, isopropyle, butyle, isobutyle,
tertiobutyle,
pentyle, 2-fluoroéthyle, etc ;
- un groupe cycloalkyle : un groupe alkyle cyclique. A titre d'exemples, on
peut
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
6
citer les groupes cyclopropyle, cyclobutyle, cyclopentyle, cyclohexyle, etc ;
- un groupe perfluoroalkyle : un radical alkyle, tel que défini précédemment,
pour
lequel tous les atomes de carbone sont substitués par des atomes de fluor.
Parmi les composés objets de l'invention, on peut notamment citer les composés
de
formule (La) suivante :
y
I S N O
\ ~
N
R I N
H
'R
2 3
(I.a)
où R,, R2, R3 et Y sont tels que définis précédemment.
Des composés préférés de l'invention de formule (La) préférés sont ceux dans
lesquels R, est en position 2 et R2est en position 5 du phényle.
Des composés de l'invention de formule (I.a) sont ceux dans lesquels RI est en
position 2 et R2est en position 5 du phényle.
Parmi les composés objets de l'invention, on peut citer les composés pour
lesquels :
- Ri représente un groupe -O-(Cl_C$)alkyle et/ou;
- R2 représente un groupe (Cl_C8)alkyle, (C3_C,p)cycloalkyle, perfluoro(Ci-
C4)alkyle ou -O-(Cl_C8)alkyle.
Parmi ces composés, on peut citer un sous-groupe de composés pour lesquels :
- Ri représente un groupe -O-(Cl_C$)alkyle et/ou;
- R2 représente un groupe (Cl_Cg)alkyle, (C3_Clp)cycloalkyle ou -O-(Cl_
C8)alkyle.
Parmi les composés objets de l'invention, on peut citer un premier groupe de
composés de formule générale (1) ou (I.a) dans laquelle R3 représente un
groupe de
formule -(CH2)à A où a représente 1, 2, 3 ou 4, et A est sélectionné dans le
groupe
constitué par :
1 1' 1'
'
N N N
_~D ; _ 3 ; -0 ; O et -0
0
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
7
où R7, Rl, R2 , Y et p sont tels que définis précédemment.
Parmi les composés objets de l'invention, on peut citer un deuxième groupe de
composés de formule générale (I) ou (I.a) dans laquelle R3 représente un
groupe de
formule -CO(CH2)b-A où b représente 0, 1, 2, 3 ou 4, et A est sélectionné dans
le
groupe constitué par:
(~ ~7 17
N N\
et
O
où R7, R,, R2 , Y et p sont tels que définis précédemment.
Parmi les composés objets de l'invention précédemment cités dans le premier
groupe et dans le deuxième groupe, on peut citer un sous-groupe de composés
pour lesquels A est sélectionné dans le groupe constitué par:
O
et
où R,, R2 , Y et p sont tels que définis précédemment.
Parmi les composés objets de l'invention, on peut citer un troisième groupe de
composés de formule générale (I) ou (I.a) dans laquelle R3 représente un
groupe -B
dans lequel B est sélectionné dans le groupe constitué par:
IR R
7 17
N N O
-CN-R7;-o ;-0 ; --CO ; --0 ; et
où R7, R,, R2, Y et p sont tels que définis précédemment.
Parmi les composés objets de l'invention cités jusqu'ici, on peut citer un
premier
sous-groupe de composés pour lesquels R7 est sélectionné dans le groupe
constitué par
= -(CI-C8)alkyle-COO-(Ci-C$)alkyle,
=-CO-(Cl-C$)alkyle où l'alkyle est substitué par au moins un atome
d'halogène,
= -(C3-C10)cycloalkyle,
= phényle,
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
8
=-S02-(Cl-C$)alkyle où l'alkyle est substitué par au moins un atome
d'halogène,
=-SOz-phényle où le phényle est substitué par au moins un groupe -O-(Ci-
C8)alkyle,
=-SOZ-hétéroaryle où l'hétéroaryle est un pyrazole ou un isoxazole ou un
imidazole et où l'hétéroaryle est indépendamment substitué par au moins un
groupe choisi parmi halogène ou -(CI-C8)alkyle,
= -S02-N((CI-C8)alkyle)2,
= -SO2-OH,
= -CO-NH((CI-C8)alkyle),
= -(CI-C8)alkyle-CN,
= -(Ci-C8)alkyle-COOH,
= -(Cl-C8)alkyle-COO-M
= -(CI-C8)alkyle-OH,
= -(C,-C8)alkyle-tétrazole,
= -(Cl-C8)alkyle-CO-NH2i
où M+ est un cation de métal alcalin choisi parmi Li+, Na+ et K+, et lorsqu'il
y a deux
substituants alkyle ou cycloalkyle lié à l'atome d'azote, ils peuvent être
indépendamment identiques ou différents. Ainsi qu'un deuxième sous-groupe de
composés pour lesquels R7 représente -SOZ-(C3-Clo)cycloalkyle.
Parmi les composés de formule (I) de l'invention cités jusqu'ici, on peut
notamment
citer les composés suivants :
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((S)-1-
Cyclopropyl-pipéridin-3-ylméthyl)-pipérazine-1 -carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(1-
Isopropylcarbamoyl-pipérid in-3-yl)-pipérazine-1-carboxyliq ue,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(1-
Cyclopropanesulfonyl-pipéridin-4-yl)-pipérazine-l-carboxylique,
ester éthylique de l'acide 3-((R)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-
thiazol-2-
ylcarbamoyl]-pipérazin-1-ylméthyl}-pipéridin-1-yl)-propionique,
acide 3-((R)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-thiazol-2-ylcarbamoyl]-
pipérazin-1-ylméthyl}-pipéridin-1-yl)-propionique,
ester éthylique de l'acide 4-((R)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-
thiazol-2-
ylcarbamoyl]-pipérazin-1-yiméthyl}-pipéridin-1-yl)-butyrique,
acide 4-((R)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-thiazol-2-ylcarbamoyl]-
pipérazin-l-ylméthyl}-pipéridin-1-yl)-butyrique,
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
9
ester éthylique de l'acide 5-((R)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-
thiazol-2-
ylcarbamoyl]-pipérazin-1-ylméthyl}-pipérid in-1-yl)-pentanoiq ue,
acide 5-((R)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-thiazol-2-ylcarbamoyl]-
pipérazin-1-yiméthyl}-pipéridin-1-yl)-pentanoique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-Cyclohexyl-
pipérazine-1 -carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-
(Tetrahydro-
pyran-4-yl)-pipérazi ne-1-carboxyliq ue.
Plus particulièrement, on peut citer le composé suivant :[4-(5-cyclohexyl-2-
1o méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(Tetrahydro-pyran-4-yl)-
pipérazine-
1-carboxylique.
Parmi les composés de formule (I) de l'invention cités jusqu'ici, on peut
encore
notamment citer les composés suivants :
[4-(5-cycloh exyl-2-méthoxy-ph é nyl)-th iazol-2-yl]-a m ide de l'acide 4-((S)-
1-
Cyclopropyl-pipéridi n-3-ylméthyl)-pipérazine-l-carboxyliq ue,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-
(Tetrahydro-
pyran-4-carbonyl)-pipérazine-1 -carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((S)-1-
Carbamoylméthyl-pipéridin-3-ylméthyl)-pipérazine-l-carboxylique,
acide ((S)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-thiazol-2-ylcarbamoyl]-
pipérazin-1-ylméthyl}-pipéridin-1-yl)-acetique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-5-fluoro-thiazol-2-yl]-amide de l'acide 4-
((S)-1-
Cyclopropyl-pipéridin-3-ylméthyl)-pipérazine-l-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-
(Tetrahydro-
pyran-4-ylméthyl)-pipérazine-1-carboxylique,
ester éthylique de l'acide ((S)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-
thiazol-2-
ylcarbamoyl]-pipérazin-1-ylméthyl}-pipéridin-1-yl)-acetique,
[4-(5-cyclohexyl-2-méth oxy-ph ényl)-th iazol-2-yl]-a m ide de l'acide 4-[(R)-
1-(2-Cyano-
éthyl)-pipéridin-3-ylméthyl]-pipérazine-1 -carboxyliq ue,
sel de sodium de l'acide 3-((R)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-
thiazol-2-
ylcarbamoyl]-pipérazin-1-yiméthyl}-pipéridin-1-yl)-propionique,
[4-(5-cycloh exyl-2-méth oxy-p hényl)-th iazol-2-yl]-a m ide de l'acide 4-[(R)-
1-(2-
Carbamoyl-éthyl)-pipéridin-3-ylméthyl]-pipérazine-l-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((R)-1-
Cycl op ro p yl-p i p é ri d i n e-3-ca rbo nyl )-p i p é razi n e-1-ca rboxyl
i q u e,
[4-(5-butyl-2-éthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((S)-1-
Cyclopropyl-
pipéridin-3-ylméthyl)-pipérazine-l-carboxylique,
[4-(5-cyclopentyl-2-éthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((S)-1-
Cyclopropyl-pipéridin-3-ylméthyl)-pipérazine-1-carboxylique,
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
[4-(5-butyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((S)-1-
Cyclopropyl-
pipéridin-3-ylméthyl)-pipérazine-1-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((S)-1-
Cyanométhyl-pipéridin-3-ylméthyl)-pipérazine-1-carboxylique,
5 [4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((R)-1-
Cyclopropyl-pipéridin-3-yl)-pipérazine-1-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(1-
Cyclopropyl-
pipéridin-4-yl)-pipérazine-1-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((S)-1-
10 Cyclopropanesulfonyl-pipéridin-3-ylméthyl)-pipérazine-1-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((S)-1-
phényl-
pipéridin-3-ylméthyl)-pipérazine-1-carboxylique,
acide 2-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-thiazol-2-ylcarbamoyi]-pipérazin-
1-
ylméthyl}-pipéridine-1-suifonique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-[(S)-1-(2-
Hydroxy-éthyl)-pipéridin-3-ylméthyl]-pipérazine-1 -carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-[(S)-1-
(2,2,2-
Trifluoro-acétyl)-pipéridin-3-ylméthyl]-pipérazine-1-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-5-fluoro-thiazol-2-yl]-amide de l'acide 4-
(Tetrahydro-pyran-4-yl)-pipérazine-1-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-((S)-1-
Diméthylsulfamoyl-pipéridin-3-ylméthyl)-pipérazine-1-carboxyliq ue,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-[(S)-1-(2H-
Tetrazol-5-ylméthyl)-pipéridin-3-ylméthyl]-pipérazine-1-carboxyliq ue,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-[1-(5-
Chloro-1,3-
diméthyl-1 H-pyrazole-4-sulfonyl)-pipéridin-2-ylméthyl]-pipérazine-1-
carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-[1-(1,3-
Diméthyl-
1 H-pyrazole-4-sulfonyl)-pipéridi n-2-ylméthyl]-pipérazine-l-carboxyliq ue,
[4-(5-cycloh exyl-2-méthoxy-ph ényl)-th iazol-2-yl]-a m ide de l'acide 4-[1-
(1,5-Diméthyl-
1 H-pyrazole-4-sulfonyl)-pipéridin-2-ylméthyl]-pipérazine-1-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-[1-(1-
Méthyl-1H-
pyrazole-4-sulfonyl)-pipéridin-2-ylméthyl]-pipérazine-1-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-[1-(5-
Méthyl-
isoxazole-4-sulfonyl)-pipéridin-2-ylméthyl]-pipérazine-1-carboxylique,
[4- (5-cycloh exyl-2-méthoxy-p hényl)-th iazol-2-yl]-a m ide de l'acide 4-[1-
(1-Méthyl-lH-
imidazole-4-sulfonyl)-pipéridin-2-ylméthyl]-pipérazine-l-carboxyliq ue,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(1-
Diméthylsulfamoyl-pipéridin-2-ylméthyl)-pipérazine-1-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-[1-(2,2,2-
Trifluoro-ethanesulfonyl)-pipéridin-2-ylméthyl]-pipérazine-1-carboxyliq ue,
[4-(5-cyclohexyl-2-méth oxy-p h ényl)-th iazol-2-yl]-am ide de l'acide 4-[1-(4-
Méthoxy-
benzenesulfonyl)-pipéridin-2-ylméthyl]-pipérazine-1-carboxylique,
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
11
[4-(5-cyclopentyl-2-éthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-
(Tetrahydro-
pyran-4-yl)-pipérazine-1 -carboxyliq ue,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-[1-(3,5-
Diméthyl-
isoxazole-4-sulfonyl)-pipérid in-2-yf méthyl]-pipérazine-1-carboxyliq ue,
[4-(5-butyl-2-éthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(Tetrahydro-
pyran-4-yl)-
pipérazine-1 -carboxylique,'
[4-(5-cyclohexyl-2-méthoxy-phényi)-thiazol-2-yl]-amide de l'acide 4-[(S)-1-(1-
Méthyl-
1 H-imidazole-4-sulfonyl)-pipéridin-3-ylméthyl]-pipérazine-l-carboxylique,
[4-(5-cyclohexyl-2-éthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(Tetrahydro-
pyran-
4-yl)-pipérazine-1=carboxylique,
[4-(5-cyclopentyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-
(Tetrahydro-
pyran-4-yl)-pipérazine-1-carboxylique,
[4-(5-butyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(Tetrahydro-
pyran-4-
yI)-pipérazine-1-carboxylique,
[4-(2-méth oxy-5-p ropoxyp hényl)-thiazol-2-yl]-a m ide de l'acide 4-
(Tetrahydro-pyran-
4-yl)-pipérazi ne-1-carboxyliq ue,
[4-(5-propyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(Tetrahydro-
pyran-
4-yl)-pipérazine-1-carboxylique,
[4-(5-Cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]- amide de l'acide 4-
(tétrahydro-
pyran-4-yl)-[1,4]diazépane-1-carboxyiique.
Parmi les composés objets de l'invention, on peut citer un quatrième groupe de
composés de formule générale (I) ou (La) dans laquelle R3 représente un groupe
de
formule -(CHAI-C où a représente 1, 2, 3 ou 4, et C est sélectionné dans le
groupe
constitué par :
Rb Rc Rb 1 8 Rc Rf Rg Rf 0\ 0 Rg R s
Ra ~ Rd Ra N Rd Re s Rh Re Rh
et
où R8, R9, Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh, Rl, R2, Y et p sont tels que
définis
précédemment.
Parmi les composés objets de l'invention, on peut citer un cinquième groupe de
composés de formule générale (I) ou (La) dans laquelle R3 représente un groupe
de
formule -CO(CH2)b-C où b représente 0, 1, 2, 3 ou 4, et C est sélectionné dans
le
groupe constitué par:
Rb Rc Rb i 8 Rc Rf Rg Rf 0\ o Rg R s
Ra Rd Ra N Rd Re S Rh Re S Rh
, , , et
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
12
où R8, R9i Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh, Rl, R2, Y et p sont tels que
définis
précédemment.
Parmi les composés objets de l'invention précédemment cités dans le quatrième
groupe et dans le cinquième groupe, on peut citer un premier sous-groupe de
composés pour lesquels C est sélectionné dans le groupe constitué par :
Rb o R Rd Re Rf S Rg Rf 0\ /0 Rg R a
Ra Rh Re Rh
et
où R9, Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh, Rl, R2, Y et p sont tels que définis
précédemment.
1o Parmi les composés objets de l'invention précédemment cités dans le
quatrième
groupe et dans le cinquième groupe, on peut citer un deuxième sous-groupe de
composés pour lesquels C représente :
R
Rb 18 Rc
Ra N Rd
où R8, Ra, Rb, Rc, Rd, RI, R2, Y et p sont tels que définis précédemment.
Parmi les composés objets de l'invention, on peut citer un sixième groupe de
composés de formule générale (I) ou (I.a) dans laquelle R3 représente un
groupe -D
dans lequel D est sélectionné dans le groupe constitué par :
Rb Rc Rb 8 Rc Rf Rg Rf 00 Rg R
Ra ~ Rd Ra N Rd Re s Rh Re Rh
et
où R8, R9, Ra, Rb, Rc, Rd, Re, Rf, Rg, Rh, Rl, R2, Y et p sont tels que
définis
précédemment. Parmi ce sixième groupe, on peut citer un sous-groupe de
composés pour lesquels R8 est un atome d'hydrogène ou un groupe (Cl-C8)alkyle
alkyle.
Parmi les composés de formule (I) de l'invention cités dans les troisième,
quatrième,
cinquième groupes et leurs sous-groupes, on peut notamment citer les composés
suivants :
[4-(5-cyclohexyl-2-méthoxy-p h ényl)-th iazol-2-yl]-am ide de l'acide 4-(1,1-
Dioxo-
hexahydro-1 16-thiopyran-4-yl)-pipérazine-1-carboxylique,
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
13
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(4-Hydroxy-
cyclohexyl)-pipérazine-1 -carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(1,2,2,6,6-
Pentaméthyl-pipéridin-4-yl)-pipérazine-1-carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl]-amide de l'acide 4-(2,2,6,6-
Tetraméthyl-pipéridin-4-yl)-pipérazine-1 -carboxylique,
[4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yi]-amide de l'acide 4-(2,2-
Diméthyl-tetrahydro-pyran-4-ylméthyl)-pipérazine-l-carboxyliq ue,
[4-(5-cycloh exyl-2-méthoxy-p hényl)-th iazol-2-yl]-a m ide de l'acide 4-
(Tetrahydro-
thiopyran-4-yl)-pipérazine-1-carboxylique.
Certains intermédiaires utiles pour la préparation des composés de formule (I)
peuvent également servir en tant que produit final de formule (I), ainsi qu'il
apparaîtra dans les exemples donnés ci-après.
De façon similaire, certains composés de formule (I) de l'invention peuvent
servir en
tant qu'intermédiaires utiles pour la préparation de composés de formule (I)
selon
l'invention.
Dans ce qui suit, on entend par groupe protecteur Gp un groupe qui permet,
d'une
part, de protéger une fonction réactive telle qu'un hydroxyle ou une amine
pendant
une synthèse et, d'autre part, de régénérer la fonction réactive intacte en
fin de
synthèse. Des exemples de groupes protecteurs ainsi que des méthodes de
protection et de déprotection sont donnés dans Protective Groups in Organic
Synthesis , Green et al., 2"d Edition (John Wiley & Sons, Inc., New York).
On entend par groupe partant X, dans ce qui suit, un groupe pouvant être
facilement
clivé d'une molécule par rupture d'une liaison hétérolytique, avec départ
d'une paire
électronique. Ce groupe peut ainsi être remplacé facilement par un autre
groupe
lors d'une réaction de substitution, par exemple. De tels groupes partants
sont, par
exemple, les halogènes ou un groupe hydroxyle activé tel qu'un mésyle
(méthanesuifonyle), tosyle (toluènesulfonyle), triflate, acétate, etc. Des
exemples de
groupes partants ainsi que des références pour leur préparation sont donnés
dans
Advances in Organic Chemistry , J. March, 3rd Edition, Wiley Interscience, p.
310-316.
Dans ce qui suit, on entend par précurseur de Rl, R2 ou R3, un substituant
R'l, R'2
ou R'3 pouvant être transformé en Rl, R2 et R3 par ~une ou plusieurs réactions
chimiques.
On entend par groupe Z dans ce qui suit, un groupe partant ou un dérivé
fonctionnel
d'acide carboxylique, tel qu'un chlorure d'acide, un anhydride mixte ou
symétrique,
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
14
ou encore l'acide opportunément activé par exemple avec l'hexafluoro phosphate
de
benzotriazol-1-yloxytris(diméthylamino) phosphonium (BOP), le O-benzotriazol-1-
yl-
N,N,N';'N'-tétraméthyluronium hexafluorophosphate (HBTU) ou le O-benzotriazol-
1-
yl-N,N,N',N'-tétraméthyluronium tétrafiuoroborate (TBTU).
Lorsqu'un ou plusieurs substituants R'l, R'2 et/ou R'3 représentent un
groupement
contenant une fonction amine ou hydroxyle, ces fonctions peuvent être
protégées
intermédiairement : une fonction amine peut être protégée par un groupement
alcanoyle, benzyle, tert-butoxycarbonyle (Boc), benzyloxycarbonyle, ou 9-
fluorénylméthoxycarbonyle (Fmoc), par exemple ; une fonction hydroxyle peut
être
protégée sous forme d'éther ou d'ester, par exemple.
Les composés de l'invention peuvent être préparés selon différentes méthodes
décrites dans la présente demande de brevet. Selon un autre aspect, la
présente
invention se rapporte aux procédés de préparation des produits de formule (I)
et
leurs produits intermédiaires.
Les composés de formule (I) de l'invention peuvent être préparés selon le
schéma
général 1 ci-après.
Schéma 1
Y Y
S
I 1) Agent de couplage R ~ N~H ~ N~(CHZ)P
~ N" NHa ~ J L
Ri t ~N\
e
R 2) R2 Ra
2 2 (II) NH N-R3' (I)
\42 )P
(Ili)
Selon le schéma 1, les composés de l'invention sont obtenus par couplage du
dérivé aminothiazole de formule (II) dans laquelle Rl, R2, Y sont tels que
définis
dans ce qui précède, avec un dérivé amine de formule (III) dans laquelle R'3
représente un groupe précurseur de R3 ou un groupe R3 tel que défini dans ce
qui
précède et p est tel que défini dans ce qui précède.
Les dérivés aminothiazole de formule (II) peuvent être obtenus selon les
méthodes
décrites dans la demande de brevet W02004/096798.
Selon le schéma 1, le dérivé aminothiazole de formule (II) est mis en présence
d'un
agent de couplage pendant une durée de 2 à 16 heures, puis avec le dérivé
amine
de formule (III) pendant une durée de 0,5 à 4 heures.
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
L'agent de couplage peut être choisi parmi ceux connus de l'homme du métier,
par
exemple le phosgène, le di-(N-succinimidyl)carbonate, le 1,1'-carbonyl-
diimidazole,
selon les méthodes décrites dans Encyclopedia of Reagents for Organic
Synthesis , L. A. Paquette, volume 2, p 1006; volume 4, p 2304; volume 6, p
4107.
5 La réaction peut être réalisée dans différents solvants, par exemple le
dichlorométhane, le diméthylformamide, le toluène, en présence d'une base
telle
que la triéthylamine, K2CO3, à une température variant de 0 C à 100 C.
Les dérivés aminés de formule (III) sont connus ou peuvent être préparés selon
les
10 méthodes décrites notamment dans le document WO 87/01706 ou selon les
méthodes décrites dans ce qui suit.
Dans ce qui suit, les groupes A' et C' représentent respectivement un groupe
précurseur du groupe A ou C, ou un groupe A ou C tels que définis
précédemment.
Les composés de formule (III) dans laquelle R'3 représente un groupe
précurseur de
15 R3 ou un groupe R3 tel que défini dans ce qui précède et dans laquelle p
est tel que
défini dans ce qui précède, sont obtenus à partir de composés de formule (IV)
par
déprotection de l'azote de la pipérazine ou de I'homo-pipérazine protégée
selon des
méthodes connues de l'homme du métier ou décrites dans la littérature
(W003/104230 et W003/057145).
A titre d'exemple, on peut procéder comme suit:
Gp H
G
N ~
C ~(CH2)P N \ (CH2)P
N NO
I
R'3 R'3
(IV) (III)
Les composés de formule (IV) sont commerciaux ou peuvent être synthétisés à
partir de composés commerciaux, selon des méthodes connues de l'homme du
métier.
Les composés de formule (IV), dans laquelle R'3 représente un groupe
précurseur
du groupe R3 avec R3 représentant un groupe -CO(CH2)b-A ou -CO(CH2)b-C
(composés de formule (IV.2) ou (IV.5)), peuvent également être obtenus selon
le
schéma 2 suivant :
Schéma 2
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
16
Gp.N__(CHa)p O Gp, N--_~ CH2)p
~,Nf H + Z%_(CHz)b-A' -~ N_~-(CH2)b-A' (IV.2) (R3 =-CO(CHa)b A' )
(V.1) O
Gp.N__CHZ)p 0 Gp=N--_~ CHZ)p
~,N H + Z%1_(CHz)b-C' ~,N-r-(CH2)e-C' (IV.5) (R3 = -CO(CH2)b C')
O
(V.2)
Selon le schéma 2, une pipérazine ou une homo-pipérazine mono-protégée (Gp =
BOC ou Gp = Benzyle) réagit avec un composé de formule (V.1) ou (V.2) dans
lequel Z représente un groupe partant, ou un groupe issu de l'activation d'une
fonction acide carboxylique, pour donner respectivement le composé de formule
(IV.2) ou (IV.5) par acylation ou couplage de type peptidique en présence
d'une
base telle que K2C03, la triéthylamine, la diisopropylethylamine ou le
carbonate de
césium éventuellement en présence d'un réactif de couplage comme le BOP, le
TBTU ou le CDI, dans un solvant comme par exemple le THF, l'acétonitrile ou le
DMF à des températures allant de 0 C à 150 C.
Les composés de formule (IV), dans laquelle R'3 représente un groupe
précurseur
du groupe R3 avec R3 représentant un groupe -(CH2)à A ou -(CH2)a-C (composés
de formule (IV.1) ou (IV.4)), peuvent également être obtenus selon le schéma 3
suivant :
Schéma 3
Gp,Ni(CH ~ H- Gp, N~~CHz)p
~Nf H + H (CHz)a_i -A' ~,N (IV.1) (R3 = -(CH2)â A')
(VL1)
Gp.N__(CH2)P ~ H- Gp-N~(CH~)p
~Nf H + H (CH2)~. l-C' -> ~NI (IV.4) (R3' - -(CH2)â C')
(VI.2) ~(CHz)a-C'
Selon ce procédé, une pipérazine ou une homo-pipérazine mono-protégée (Gp =
BOC ou Gp = Benzyle) réagit avec un aldéhyde de formule (VI.1) ou (VI.2) pour
donner respectivement le composé de formule (IV.1) ou (IV.4) dans les
conditions
d'une réaction d'amination réductrice en présence d'un agent réducteur tel que
NaHB(OAc)3, NaBH3CN dans un solvant tel que le 1,2-dichloroéthane, le
dichlorométhane, le méthanol, le THF à des températures allant de 0 C à 70 C
(Synth. Commun., 1998, 28 (10), 1897-1905, J. Org. Chem., 1992, 57 (11), 3218-
3225, J. Org. Chem, 1996, 61, 3849-3862, Tetrahedron Lett., 1990, 31, 5595-
5598).
Alternativement, les composés de formule (IV.1) et (IV.4) peuvent être
synthétisés
par une réaction de substitution selon le procédé illustré dans le schéma 4
suivant :
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
17
Schéma 4
Gp,N-~,~CH2)p ~ Gp, N~(CHZ)P
~NH + X-(CH2)âA ~NI ~ ~ (IV.1) (R3' _ -(CH~)à A~)
(VI1.1) (CHZa-A
Gp.Ni(CH2)p Gp'N--_~ CH2)p
X-(CH )a C' N
~NH + (VIIz.2) '- (CHz)a-CI (IV.4) (R3' = -(CH2)à C')
Selon le schéma 4, une pipérazine ou une homo-pipérazine mono-protégée (Gp =
BOC ou Gp = Benzyle) réagit avec un composé de formule (VI I.1) ou (VI I.2)
dans
laquelle X représente un groupe partant pour donner respectivement le composé
de
formule (IV.1) ou (IV.4). La réaction est réalisée sans solvant ou dans un
solvant tel
que le tétrahydrofurane, le diméthylformamide, le toluène, ou l'acétonitrile
en
l'absence de base ou en présence d'une base telle que la triéthylamine ou
K2C03, à
des températures variant de la température ambiante à 200 C, pendant une durée
de 1 à 24 heures.
Les composés de formule (IV), dans laquelle R'3 représente un groupe
précurseur
du groupe R3 avec R3 représentant un groupe -B ou -D (composés de formule
(IV.3) ou (IV.6)), peuvent être préparés par réaction d'une pipérazine ou
d'une
homo-pipérazine mono-protégée (Gp = BOC ou Gp = Benzyle) et d'une cétone B'
précurseur de B ou bien d'une cétone D' précurseur de D, par réaction
d'amination
réductrice en présence d'un agent réducteur tel que NaHB(OAc)3, NaBH3CN dans
un solvant tel que le 1,2-dichloroéthane, le méthanol, le dichlorométhane, le
THF à
des températures allant de 0 C à 70 C selon le schéma ci-après :
Schéma 5
Gp.N~(CH2)p B~ Gp, N--~4CH2)p
~Nf H H- ~N\B~ (IV.3) (R3' = D')
Gp.N__CH2)p Dl Gp, N--_(CH2)p
~N H H ~NI ,Dl (IV.6) (Rs = BI)
Les cétones B' et D' utilisées sont commerciales ou peuvent être synthétisées
selon
les méthodes décrites dans Organic Process Research & Development, 2004, 8,
939; Synthesis, 1989, 10, 767
Les composés de formule (I) peuvent aussi être préparés selon le schéma 6 ci-
après.
Schéma 6
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
18
Y S
S 1) Agent de O
NNH couplage I ~NNCHz)P Gp
R z R1 H ~1
N
R2 2) HN--- f CHz)P R2 \GP
(II) ~1N\ Gp (VIII)
0
ZJL- (CHz)b -A' (V.1)
O
ou = Z~1_ (CHz)b-C' (V.2)
O
(CHz)a.1-A NI.1) CH )P
O
eR2 N~NCHz)P ~u = HO N
~SH ou = H~(CH). -' 1.2 H~~ NN' z
R2 z a ~ C (U ) R3
(Ix) ou = x-(CHz)~ A' (Vn.1) (I)
ou = X-(CHz)a C' (VII.2)
ou = B.
ou = U
Selon le schéma 6, le dérivé aminothiazole de formule (II) tel que défini dans
ce qui
précède est couplé à une pipérazine ou une homo-pipérazine mono-protégée (Gp =
BOC ou Gp = Benzyle) pour donner le composé de formule (VIII).
La réaction est conduite dans les mêmes conditions que celles décrites ci-
dessus
pour le schéma 1.
Le composé de formule (VIII) est ensuite déprotégé pour conduire au composé de
formule (IX), selon les méthodes connues de l'homme du métier, qui est mis à
réagir
avec un composé de formule (V.1), (V.2), (VI.1), (VI.2), (VII.1) ou (VII.2),
ou avec
une cétone de formule B' ou de formule D' telles que définis précédemment.
Cette
réaction est réalisée selon les procédés décrits précédemment pour les
synthèses
des intermédiaires de formule (IV).
Dans les schémas généraux de synthèse, les composés de départ et les réactifs,
quand leur mode de préparation n'est pas décrit, sont disponibles dans le
commerce ou décrits dans la littérature, ou bien peuvent être préparés selon
des
méthodes qui y sont décrites ou qui sont connues de l'homme du métier.
Les exemples qui suivent décrivent la préparation de composés conformes à
l'invention. Les numéros des composés exemplifiés renvoient à ceux donnés dans
le tableau I, qui illustre les structures chimiques de quelques composés selon
l'invention.
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
19
Dans les préparations et exemples qui suivent :
- CyHex = un groupe cyclohexyle ;
- DSC = di-(N-succinimidyl)carbonate
- CDI = 1,1'-carbonyl-diimidazole
- DCE = dichloroéthane
- TBME = tert-butyl-methyl-ether
- TA = température ambiante,
- DCM = dichlorométhane,
- DIPEA = diisopropyléthylamine,
- THF = tétrahydrofuranne,
- BOP = benzotriazole-1-yle-oxy-tris(diméthylamino)-phosphonium
hexafluorophosphate,
- DMF = diméthylformamide,
- Boc = tertbutyloxycarbonyle,
- TFA = trifluoroacétic acid (acide trifluoroacétique, en français),
- TBTU = 2-(1H-Benzotriazole-1-yl)-1,1,3,3-
tétraméthyluroniumtétrafluoroborate,
- HOBT = hydroxybenzotriazole,
- BSA = bis(triméthylsilyl)acétamide,
- AcOEt = acétate d'éthyle,
- AcCI = chlorure d'acétyle.
- PF = Point de Fusion (en degré Celsius) tel que mesuré sur un appareil Büchi
B545 avec un gradient de température de 1 C par minute.
- MH+ = masse moléculaire de la forme de la molécule ionisée par un proton.
Les composés sont analysés par couplage HPLC - UV - MS (chromatographie
liquide - détection UV - spectrométrie de masse). L'appareil utilisé,
commercialisé
par Agilent, est composé d'un chromatographe HP1100 équipé d'un détecteur à
barrette de diodes Agilent et d'un spectromètre de masse quadripolaire MSD
Quad.
Les conditions analytiques sont les suivantes :
Colonne : Symmetry C18 (50 x 2,1 mm; 3,5 pm)
Eluant A: H20 + TFA 0,005 % à pH 3,15
Eluant B: CH3CN + TFA 0,005 %
Gradient:
Temps (min) % B
0 0
10 90
15 90
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
16 0
20 0
Température de la colonne : 30 C
Débit : 0,4 mL / min
5 Détection : a= 220 nm
Les composés pour lesquels il est indiqué méthode B dans le tableau I sont
analysés par LCMS dans les conditions suivantes : colonne YMC Jsphere (33 x
2,1
mm, 4pm, éluant: CH3CN + 0,05% TFA : H20 + 0,05% TFA, gradient : 5:95 (0
min), puis 95 :5 (2,5 min), puis 95 :5 (3 min), débit : 1,3 mL/min,
température : 30 C.
lo - tr = temps de rétention.
- RMN = résonance magnétique nucléaire réalisée avec un spectromètre Bruker
Avance 200 (200 MHz). Le solvant employé est le DMSO deutéré et les
déplacements chimiques sont exprimés par rapport au TMS. Les abréviations
utilisées sont :
15 - s = singulet,
- d = doublet,
- d.d = doublet dédoublé,
- t = triplet,
- m = multiplet,
20 - sél = singulet élargi.
- L'analyse de la pureté optique est mesurée par HPLC sur colonne Chiralpak AD
(250 mm x 4,6) éluée par un mélange C02 / MeOH 80 / 20 à 30 C avec un débit
de
3 mL / min à P = 20 MPa. Les composés sont détectés à 220 nm.
- aD = pouvoir rotatoire. Les pouvoirs rotatoires ont été déterminés avec un
polarimètre Perkin-Elmer 241-MC pour la raie D du sodium (X = 589 nm), les
concentrations sont exprimées en 10 mg/mL, les mesures sont effectuées à
température ambiante.
Exemple 1:= f4-(5-cyclohexyl-2-méthoxy-phényi)-thiazol-2-yil-amide de l'acide
4-((S)-1-Cyclopropyl-pipéridin-3-ylméthyl)-pipérazine-l-carboxyligue
(Composé N 1)
1.1. Préparation de l'ester tert-butyligue de l'acide (R)-3-
((méthylsulfonyloxy)méthyl)pipéridine-1-carboxyligue
A une solution de 5 g de l'ester tert-butylique de l'acide (R)-3-
(hydroxyméthyl)pipéridine-1-carboxylique dans 80 mL de DCM refroidie à 0 C, on
ajoute 2,16 mL de chlorure de méthanesulfonyle puis 3,86 mL de triéthylamine.
Le
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
21
milieu est agité 1 h 30 à 0 C puis sont rajoutés 0,7 mL de triéthylamine et
0,54 mL
de chlorure de méthanesulfonyle. Après 30 min à 0 C, le milieu est hydrolysé,
la
phase organique est lavée deux fois dans l'eau puis avec une solution saturée
de
NaCI puis séchée sur MgSO4. Le milieu est évaporé pour donner 6,8 g d'une
huile
jaune pâle.
1.2. Préparation de l'ester tert-butyligue de l'acide (S)-3-((4-
benzylpipérazin-1-
yl)méthyl)pipéridine-1-carboxyligue
Le brut obtenu à l'étape 1.1 est mis en solution dans 75 mL de toluène. On
ajoute 12,16 g de benzylpipérazine, le milieu réactionnel est scellé puis
chauffé
pendant 5 heures à 150 C. Après retour à TA, le milieu est dilué dans un
mélange
éther/pentane (1/1), lavé deux fois par une solution de NaHCO3 saturée, deux
fois
dans l'eau puis avec une solution saturée de NaCI. Après séchage sur MgSO4 et
évaporation, le brut est purifié par flash-chromatographie sur gel de silice
pour
donner 5,73 g du solide attendu.
MH+ = 374,3 à t = 5,26 min
1.3. Préparation de l'ester tert-butyligue de l'acide (S)-3-(pipérazin-1-
ylméthyl)pipéridine-1-carboxyligue
Une solution de 4.0 g du composé obtenu à l'étape 1.2 dans 30 mL de méthanol
est
hydrogénée dans un réacteur fermé, sous irradiation par les micro-ondes, à 80
C
pendant 10 mn en présence de 1,7 g de Pd/C à 10% humide et de 2.02 g de
formate d'ammonium. Le milieu est filtré puis évaporé pour donner 2.89 g d'une
huile incolore.
1.4 Préparation de l'ester tert-butyligue de l'acide (S)-3-((4-(4-(5-
cyclohexyl-2-
méthoxyphényl)thiazol-2-ylcarbamoyl)gipérazin-1-yl)méthyl)pigéridine-1-
carboxVlique
A une solution de 2.78 g de 4-(5-cyclohexyl-2-méthoxyphényl)thiazol-2-amine,
composé décrit dans la demande de brevet W02004/096798, dans 7 mL de
dichlorométhane, on additionne 2.59 g de DSC et on agite le milieu pendant 12
heures à TA. On ajoute 2.59 g du composé décrit à l'étape 1.3 et le milieu est
agité
pendant 3 heures à TA. Le milieu est hydrolysé par une solution de NaHCO3
saturée
puis extrait dans le DCM. La phase organique est lavée à l'eau puis avec une
solution saturée de NaCI. Après séchage sur MgSO4 , la solution est concentrée
et
purifiée par flash-chromatographie sur gel de silice pour donner 4.0 g du
composé
attendu sous la forme d'un solide blanc.
MH+ = 598,7 à t = 8,26 min
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
22
1.5 Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-y11-amide de
l'acide
4-(R)-1-Pipéridin-3-ylméthyl)-pipérazine-1-carbox ligue A une solution de 4 g
du
composé obtenu à l'étape 1.4 dans 10 mL de dioxane, on ajoute 42 mL d'une
solution 4 M d'HCI dans le dioxane. Le milieu est agité 4 h à TA. Le milieu
est filtré,
le solide est rincé à l'éther puis repris dans le DCM et traité par de la
soude 1 M. La
phase organique est lavée à l'eau puis avec une solution saturée de NaCI.
Après
séchage sur MgSO4 , la solution est concentrée pour donner 3.16 g du composé
souhaité.
MH+ = 498,7 à t = 6,27 min
1.6 Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide
4-((S)-1-Cyclopropyl-pipéridin-3-ylméthyl)-pipérazine-1-carboxyligue
A une solution de 0.2 g du composé décrit à l'étape 1.5 dans 5 mL de MeOH, on
ajoute 0.35 g de (1-ethoxycyclopropoxy)triméthylsilane puis 0.05 g de NaBH3CN
et
0.24 g d'acide acétique. Le milieu est agité 2 h à 60 C. Le milieu est
concentré puis
repris dans l'AcOEt. La phase organique est lavée deux fois avec une solution
de
NaHCO3 saturée puis avec une solution saturée de NaCI. Après séchage sur
MgSO4, la phase organique est concentrée puis purifiée par flash-
chromatographie
pour donner 0.16 g du produit attendu.
PF = 88 C
ao=+4 (c=1, MeOH)
Exemple 2 : - [4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide
4-(1-Isopropylcarbamoyl-pipéridin-3-yi)-pipérazine-1-carboxyligue(Composé
N 2)
2.1. Préparation de l'ester tert-butyligue de l'acide 4-(1-benzylpipéridin-3-
yl)pipérazine-1-carboxyligue
A une suspension de 9,96 g de l'hydrate du monochlorhydrate de la 1-
benzylpipéridin-3-one en suspension dans 200 mL de DCM, on ajoute 20 mL d'une
solution de soude à 10%. Le milieu est agité, la phase organique est décantée
puis
lavée avec une solution saturée de NaCI. Après séchage sur MgSO4, la phase
organique est concentrée. La gomme obtenue est reprise dans 180 mL de DCE, on
ajoute 10,1 g de Boc-pipérazine puis 15,9 g de NaBH(OAc)3 et le milieu est
agité 12
h à TA. Le milieu est concentré puis repris dans l'AcOEt. La phase organique
est
lavée deux fois avec une solution de NaHCO3 saturée puis avec une solution
saturée de NaCI. Après séchage sur MgSO4, la phase organique est concentrée
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
23
pour donner 18,63 g du produit attendu.
PF = 103 C
2.2. Préparation de la 1-(1-benzyipipéridin-3-yl)pipérazine
A une solution de 9,2 g du composé obtenu à l'étape 2.1 dans 85 mL de DCM, on
ajoute 30 g de TFA. Le milieu est agité 5 h à TA puis concentré. Le brut
obtenu est
repris dans le DCM puis lavé 4 fois avec une solution de soude 2M. La phase
organique est lavée avec une solution saturée de NaCI. Après séchage sur
MgSO4,
la phase organique est concentrée pour donner 6,32 g du produit attendu.
RMN ' H: S(ppm) = 7.28 (sél, 5H), 3.43 (sél, 2H), 2.88 (d, 1 H), 2.70 (d, 1
H), 2.64
(m, 4H), 2.43-2.22 (m, 5H), 1.85-1.58 (m , 4H), 1.39 (ddd, 1 H), 1.15 (ddd, 1
H).
2.3. Préparation du f4-(5-cyclohexyl-2-méthoxy_phényl)-thiazol-2-yll-amide de
l'acide 4-(1-benzyl-pipéridin-3-yl)-pipérazine-1-carboxyligue
La procédure est identique à celle décrite dans l'exemple 1 à partir de la 4-
(5-
cyclohexyl-2-méthoxyphényl)thiazol-2-amine décrite dans la demande de brevet
W02004/096798 et du composé obtenu à, l'étape 2.2.
PF = 90 C
2.4. Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide 4-pipéridin-3-yl-pipérazine-1-carboxyligue
A une solution de 1,69 g du composé obtenu à l'étape 2.3 dans 10 mL de DCE, on
ajoute à 0 C, 1,26 g de chloroethylchloroformate. Le milieu est ramené à TA
puis
chauffé à reflux pendant 45 min. Le milieu est évaporé puis repris dans 10 mL
de
MeOH et chauffé 1 h à reflux. Le brut est filtré, le solide est rincé à
l'éther puis
séché pour donner 1,27 g du composé attendu sous forme d'un trichlorhydrate.
PF = 240 C
MH+ = 484,7 à 6,81 min
2.5. Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide 4-(1-Isopropylcarbamoyl-pipéridin-3-yl)-pipérazine-1-carboxyligue
A une solution de 0,2 g du composé obtenu à l'étape 2.4 dans 1,2 mL de DCM, on
ajoute à 0 C, 0.06 mL d'isocyanate d'isopropyle. Le milieu est agité 2 h à 0 C
puis
hydrolysé avec 5 mL d'eau et dilué avec 10 mL de DCM. La phase organique est
lavée deux fois avec une solution de NaHCO3 saturée puis avec une solution
saturée de NaCI. Après séchage sur MgSO4, la phase organique est concentrée
puis purifiée par flash-chromatographie pour donner 0,16 g du produit attendu.
PF = 134 C
MH+ = 568,7 à t = 7,61 min
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
24
Exemple 3:= f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de l'acide
441-Cyclopropanesu lfonyl-pipéridin-4-yl)-pipérazine-1 -carboxyligue
(Composé N 3)
3.1 Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide
4-(1-benzyl-pipéridin-4-yl)-pipérazine-1-carboxyligue
La procédure est identique à celle décrite dans l'exemple 1 à partir de 4-(5-
cyclohexyl-2-méthoxyphényl)thiazol-2-amine, décrite dans la demande de brevet
W02004/096798, et de la 1-(1-benzyl-pipéridin-4-yl)-pipérazine.
PF = 81 C
3.2. Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide 4-pipéridin-4-yl-pipérazine-1-carboxyligue
A une solution de 1,77 g du composé obtenu à l'étape 3.1 dans 10 mL de DCE, on
ajoute à 0 C, 1,31 g de chloroethylchloroformate. Le milieu est ramené à TA
puis
chauffé à reflux pendant 45 min. Le milieu est évaporé puis repris dans 10 mL
de
MeOH et chauffé 1 h à reflux. Le brut est filtré, le solide est rincé à
l'éther puis
séché pour donner 1,27 g du composé attendu sous forme d'un trichlorhydrate.
MH+ = 484,6 à 6,21 min
3.3. Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide 4-(1-cyclopropanesulfonyl-pipéridin-4-yl)-pipérazine-1-carboxyligue
A une solution de 0.2 g du composé décrit dans la préparation 3.2 dans le DCM,
on
ajoute 0.04 MI de chlorure de cyclopropylsulfonyl puis 0.06mL de
triéthylamine. Le
milieu est agité à TA pendant 4 h. Le milieu est dilué dans le DCM puis
hydrolysé
avec 5 mL d'eau. La phase organique est lavée deux fois avec une solution de
NaHCO3 saturée puis avec une solution saturée de NaCI. Après séchage sur
MgSO4, la phase organique est concentrée puis purifiée par flash-
chromatographie
pour donner 0,18 g du produit attendu.
PF = 138 C
MH+ = 588,8 à t= 7,49 min
Exemple 4: ester éthylique de l'acide 3-((R)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-
phényl)-thiazol-2-ylcarbamoyll-pipérazin-l-ylméthyl}-pipéridin-1-yl)-
propionigue(Composé N 4)
A une solution de 0.2 g du composé décrit à l'étape 1.5 dans 2 mL de toluène,
on
ajoute 0.08 mL de triéthylamine puis 0.05 mL de l'ester éthylique de l'acide 3-
bromo-
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
propionique. Le milieu est agité 48 h à TA. Le milieu est dilué dans l'éther
éthylique
puis filtré. Le filtrat est lavé à l'eau puis avec une solution saturée de
NaCI. Après
séchage sur MgSO4, la phase organique est concentrée pour donner 0.21 g du
produit attendu.
5 MH+ = 598,8 à t = 6,84 min
Exemple 5: acide 3-((R)-3-{4-[4-(5-Cyclohexyl-2-méthoxy-phényl)-thiazol-2-
ylcarbamoyll-pipérazin-1-ylméthyl}-pipéridin-1-yl)-propionigue(Composé N 5)
A une solution de 0.208 g du composé décrit à l'étape 4 dans 3 mL de méthanol,
on
10 ajoute à 0 C, 0.31 mL de soude 5M. Le milieu est agité 24 h à TA. Le milieu
est
concentré puis repris dans l'eau. On ajoute au goutte à goutte une solution
d'HCI 6N
jusqu'à l'apparition d'un précipité. Le solide est extrait dans le DCM puis
après
séchage sur MgSO4, la phase organique est concentrée pour donner 0.15 g du
produit attendu.
15 MH+ = 570,7 à t = 6,64 min
PF = 144 C
Exemple 6: [4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de I'acide
4-(Tétrahydro-pyran-4-yl)-pipérazine-1-carboxyligue(Composé N 11)
20 Ce composé peut être obtenu selon le procédé décrit dans la préparation 1.4
entre
la 4-(5-cyclohexyl-2-méthoxyphényl)thiazol-2-amine et la 1-(tétrahydro-2H-
pyran-4-
yl)pipérazine décrite dans J. Med. Chem.; EN; 47; 11; 2004; 2833 - 2838.
Une autre méthode de synthèse est possible :
6.1 Préparation de l'ester tert-butyligue de l'acide 4-f4-(5-Cyclohexyl-2-
méthoxy-
25 phényl)-thiazol-2-ylcarbamoyll-pipérazine-1-carboxyligue
A une solution de 3.0 g de 4-(5-cyclohexyl-2-méthoxyphényl)thiazol-2-amine,
composé décrit dans la demande de brevet W02004/096798, dans 100 mL de
dichloroéthane, on additionne 2.9 g de DSC et on agite le milieu pendant 16
heures
à TA. On ajoute 2.0 g de BOC-pipérazine et le milieu est agité pendant 3
heures à
TA. Le milieu est hydrolysé par une solution de NaHCO3 saturée puis extrait
dans le
DCM. La phase organique est lavée à l'eau puis avec une solution saturée de
NaCI.
Après séchage sur MgSO4 , la solution est concentrée et purifiée par flash-
chromatographie sur gel de silice pour donner 5.1 g du composé attendu sous la
forme d'un solide beige.
MH+ = 501,7 à t= 11,72 min
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
26
6.2 Préparation du (4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yl1-amide
de l'acide pipérazine-1-carboxyligue
A une soiution de 5.1 g du composé obtenu à l'étape 6.1 dans 100 mL de
dioxane,
on ajoute au goutte à goutte 19 mL d'une solution 4 M d'HCI dans le dioxane.
Le
milieu est agité 4 h à TA. Le milieu est filtré, le solide est rincé à l'éther
puis séché
pour donner 4.38 g d'une poudre blanche. Le solide est repris dans le DCM et
traité
par de la soude 1 M. La phase organique est lavée à l'eau puis avec une
solution
saturée de NaCI. Après séchage sur MgSO4, la solution est concentrée pour
donner
3.7 g du composé souhaité.
1o MH+ = 401,6 à t = 7,19 min
6.3 Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide
4-(tétrahydro-pyran-4-yl)-pi pérazine-l-carboxylig ue
A une solution de 1.4 g de la pipérazine obtenue à l'étape 6.2 dans 13 mL de
dichloroéthane, on ajoute 0.4 g de dihydro-2H-pyran-4(3H)-one puis 1.59 g de
NaBH(OAc)3 et le milieu est agité 72 h à TA. Le milieu est concentré puis
repris
dans le DCM. La phase organique est lavée deux fois avec une solution de
NaHCO3
saturée puis avec une solution saturée de NaCI. Après séchage sur MgSO4, la
phase organique est concentrée pour donner 1.7 g du produit attendu.
La poudre beige obtenue est purifiée par flash-chromatographie sur gel de
silice
pour donner 1.42 g du composé attendu sous la forme d'un solide blanc.
MH+ = 484,7 à t= 7,42 min
PF = 226 C
Exemple 7: f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de l'acide
4-(Tetrahydro-pyran-4-carbonyl)-pipérazine-1-carboxyligue(Composé N 13)
A une solution de 41 mg de tétrahydro-2H-pyran-4-carboxylique dans 0.7 mL de
DCM, on ajoute, à TA, 122 mg de TBTU, 26 mg de HOBt et 0.17 mL de DIPEA. Le
milieu est agité à TA pendant 1 heure 15 mn puis on ajoute 100 mg du composé
décrit à l'étape 6.2. Le milieu est agité 12 heures à TA. Le milieu est repris
dans le
DCM, lavé trois fois par une solution de Na2CO3 saturée puis avec une solution
saturée de NaCI. Après séchage sur MgSO4 et évaporation, on récupère 0.21 g de
brut réactionnel qui est purifié par flash-chromatographie sur gel de silice
pour
donner 0.08 g du composé attendu sous la forme d'un solide blanc.
MH+ = 513,7 à t = 9,88 min
PF = 276 C
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
27
Exemple 8: f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yil-amide de l'acide
4-(Tetrahydro-pyran-4-yiméthyl)-pipérazi:ne-1-carboxyligue(Composé N 17)
A une solution de 0.155 g de la pipérazine obtenue à l'étape 6.2 dans 1.5 mL
de
dichloroéthane, on ajoute 0.044 g de tétrahydro-2H-pyran-4-carbaldehyde puis,
après 1 heure d'agitation à TA, 0.114 g de NaBH(OAc)3 et le milieu est agité
12 h à
TA. Le milieu est dilué dans le DCM. La phase organique est lavée deux fois
avec
une solution de NaHCO3 saturée puis avec une solution saturée de NaCI. Après
séchage sur MgSO4, la phase organique est concentrée pour donner 0.16 g de
brut.
Le solide est purifié par flash-chromatographie sur gel de silice pour donner
0.12 g
du composé attendu sous la forme d'un solide blanc.
MH+ = 499,7 à t = 7,75 min
PF = 114 C
Exemple 9: f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de l'acide
4-((S)-1-Carbamoylméthyl-pipéridin-3-ylméthyl)-pipérazine-1-carboxyligue
(Composé N 14)
9.1 Préparation de l'ester éthyligue de l'acide ((S)-3-{4-f4-(5-Cyclohexyl-2-
méthoxy-
phényl)-thiazol-2-ylcarbamoyll-pipérazin-1-ylméthyll-pipéridin-1-yl)-
acétigue(Composé N 18)
Ce composé est synthétisé à partir du composé décrit dans la préparation 1.5
et de
l'ethyl 2-bromoacetate selon un procédé identique à celui décrit dans la
préparation
4.
9.2 Préparation de l'acide ((S)-3-f4-f4-(5-Cyclohexyl-2-méthoxy-phényl)-
thiazol-2-
ylcarbamoyll-pipérazin-1-ylméthyl)-pipéridin-l-yl)-acétigue (Composé N 15)
Ce composé est synthétisé à partir du composé décrit dans la préparation 9.1
selon
un procédé identique à celui décrit dans la préparation 5.
9.3 Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide
4-((S)-1-Carbamoylméthyl-pipéridin-3-ylméthyl)-pipérazine-1-carboxylig ue
A une solution de 0.1 g du composé décrit à l'étape 9.2 dans 1 mL de DCM, on
ajoute 0.1 g de TBTU, 0.02 g de HOBt puis 0.08 mL de DIPEA. Après 2 heures
d'agitation à TA, on fait buller un courant d'ammoniac dans la solution
pendant 2
heures: On filtre ensuite le milieu réactionnel, le filtrat est lavé avec une
solution de
NaHCO3 saturée puis avec une solution saturée de NaCI. Après séchage sur
MgSO4, la phase organique est concentrée pour donner 0.09 g de brut.
Le brut est purifié par flash-chromatographie sur gel de silice pour donner
0.052 g
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
28
du composé attendu sous la forme d'un solide blanc.
MH+ = 555,7 à t = 6,68 min
PF = 134 C
Exemple 10 : f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yil-amide de l'acide
4-[(S)-1-(2H-tétrazol-5-ylméthyl)-pipéridin-3-ylméthyll-pipérazine-1-
carboxyligue (Composé N 42)
10.1 Préparation du f4-(5-cycloh exyl-2-méthoxy-p hényl)-th iazol-2-yll-a m
ide de
l'acide 4-((S)-1-Cyanométhyl-pipéridin-3-ylméthyl)-pipérazine-l-carboxyligue
l0 (Composé N 26)
A une solution de 0.45 g du composé obtenu à l'étape 1.5 dans 4 mL d'acétone,
on
ajoute 0.1 g de Na2CO3. Le milieu est refroidi à 0 C puis 0.06 mL de 2-
chloroacetonitrile sont ajoutés et le milieu est agité jusqu'à retour à TA. On
rajoute
0.012 mL de 2-chloroacetonitrile et 0.02 g de Na2CO3. Le milieu est agité 2
heures à
TA puis concentré. Le brut est trituré dans l'eau puis extrait dans l'éther.
La phase
organique est lavée deux fois avec une solution de NaHCO3 saturée puis avec
une
solution saturée de NaCI. Après séchage sur MgSO4, la phase organique est
concentrée puis purifiée par flash-chromatographie sur gel de silice pour
donner
0.34 g du composé attendu sous la forme d'un solide blanc.
MH+ = 537,7 à t = 7,67 min
PF = 106 C
10.2 Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide 4-f(S)-1-(2H-tétrazol-5-ylméthyl)-pipéridin-3-ylméthyll-pipérazine-1-
carboxylique
A une suspension de 0.34 g du composé synthétisé à l'étape 10.1 dans un
mélange
de 3 mL d'eau et 1 mL d'isopropanol, on ajoute 0.06 g de NaN3 et 0.14 g de
ZnBr2.
Le mélange est chauffé à 80 C pendant 40 heures, on rajoute ensuite 0.03 g de
NaN3 et 0.07 g de ZnBr2 et on maintient l'agitation à 80 C pendant 12 heures.
Lé
milieu est filtré, le solide est rincé à l'eau puis à l'éther. Le solide est
purifié par
HPLC préparative pour donner 56 mg du composé attendu.
MH+ = 580,7 à t = 7,32 min
Exemple 11 : f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-vll-amide de l'acide
4-((S)-1-phényl-pipéridin-3-ylméthyl)-pipérazine-1-carboxyligue (Composé
N 30)
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
29
11.1 Préparation de la (R)-1-benzyl-4-(pipéridin-3-ylméthyl)pipérazine
A une solution de 1.35 g du composé obtenu à l'étape 1.2 dans 5 mL de dioxane,
on
ajoute 20 mL d'une solution 4 M d'HCI dans le dioxane. Le milieu est agité 2 h
à TA.
Le milieu est filtré, le solide est rincé à l'éther puis repris dans le DCM et
traité par
de la soude 1M. La phase organique est lavée à l'eau puis avec une solution
saturée de NaCI. Après séchage sur MgSO4, la solution est concentrée pour
donner
1 g de brut.
MH+ = 274,3 à t = 5,52 min
11.2 Préparation de la (S)-1-benzyl-4-((1-phénylpipéridin-3-
yl)méthyl)pipérazine
1o Dans un tube sont placés 0.26 g de trifluorométhanesulfonate de phényle,
0. 8 g de
l'amine préparée à l'étape 11.1 dans 5.6 mL de NMP. Le tube est chauffé sous
pression dans un four à micro-ondes pendant 30 mn à 230 C. Après retour à TA,
le
milieu est hydrolysé puis extrait dans l'éther. La phase organique est lavée à
l'eau
puis avec une solution saturée de NaCI. Après séchage sur MgSO4 , la solution
est
concentrée pour donner 0.41 g de brut. Le solide est purifié par fiash-
chromatographie sur gel de silice pour donner 0.067 g du composé attendu.
MH+ = 350,3 à t = 9,97 min
11.3 Préparation de la (S)-1-((1-phénylpipéridin-3-yl)méthyl)pipérazine
A une solution de 0.066 g du composé obtenu à l'étape 11.2 dans 9 mL de
méthanol, on ajoute 0.05 g de Pd/C 10% humidifié à 50%. Le milieu est agité à
TA
pendant 48 heures sous 10 bars d'hydrogène. Après filtration sur célite, le
filtrat est
évaporé pour donner 0.037 g du composé souhaité.
11.4 Préparation du f4-(5-cyclohexyl-2-méthoxy-phényl)-thiazol-2-yll-amide de
l'acide 4-((S)-1-phényl-pipéridin-3-ylméthyl)-pipérazine-1-carboxyligue
La procédure est identique à celle décrite dans l'exemple 1 à partir de 4-(5-
cyclohexyl-2-méthoxyphényl)thiazol-2-amine, décrite dans la demande de brevet
W02004/096798, et de l'amine obtenue à l'étape 11.3.
MH+ = 574,8 à t = 8,12 min
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
c ~ >, c
Ç'~ ~~ O Ç~(h O Nd N
û
N O C~ ' x OM'O X O=O 8- X
(û ~Q ~ Q~ ~.QO
(~0 O
Ç ~~~ U ~_ O U ~~_ O U
O N N'Q r CV ~ r N ~
~ C X~ Q C X O~ C
z O (iïN O N -N
C.~ (>S ~>+ U tLi C> O(0
~Oj ?+ ~ N V N >, '4) ~ N IC)
> N Q O T ~ ~.n
U.i O'p N Q N
. p'p
O O
~ N p O ~.~ 5
CD
~
OD_c Va0c
a~i~~ ~ O d-(00o co a poE
O pp LON ML!) cr)v)6)
= 11 Lo?
_ 1 ~ ~LL + 02~ QII_Z~ QII_=~
U G Z3~~=~ ~=~ ~=~
z r- N M
O cn -
E
~ (D E E
Z2 O Ç X X X
u) W W W
Z 7)
} n N cV N
i- 2 2 I
M
=
U
/ Z-{ O%
/O~ U ) z = z
~//
N
or-
0 ~
I I
'U)
N
00
n
z ~- N M
E
0
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
31
i-
>,~ ~.E T > ~,E ~> =~ >,E
C=C C X(6 Crj C X(U r C= O X(û ,N >, O
~ dJ N O N N O_Q M=d) N C O..Q (D x C O N
t (0 =- .L '- Ç .O (B ~, -O L Ç ~ L (ü (0 _C '- p_, ~ O Q N
~ N o croi ~ o croi ~ Q â) c o 0 ~)
M X'fl U N ~ "t XO = U N ~ t.() XO O O O U O N!~ N
N 0 ~ !2 O O ~ -i ~ V CV 'Q ~ ~ î7 '~ ~ û ~
>, ~ v O r~ i3 -0 - ~, c- v O w m a a- >+ :n O , .6 'O N O O N _~_
O r N U'O O' N (~ O O r i N O E ~ ' .LT Ç~roE~~vro~= ' -N ':~dX
O N ~ O O N ~ 'ID ~ E 0 c ~' , ,â Q
O X U,O m a>, ' roj N~ N>, LZ- U
N - .-. C i
'~ L Z3 ~~, 0 ON O
N M~ N L U N~~ N C N ~ Q N U N O U N Ç
N ON ,N X (L6 . ~+ N 2, >+ ü -~ i N
.00 i fiS ,OC ~ 0 N RS E ~ 0,O 'N C~ ro,O ~ ~~Q)
Z U =Z U =~ 2- 0 .~i i Ç (U =L~-+ Q ~= ~= I"
ro~o ~ m~a
U) ca~a
U ..~
(D
CC)c U~c CDc U~c ~c Ucc Uti_ Vl~_
OO '~ o OE N~ o dE CO E o OO '~c 0 M c E o LO cE
m ~ I~ r (0 00 N M 6) O OO CO 00
Lnct 'Ytn cp (ON MLC) d- COr LC)tf)r rV Lt) N~tN
II ~ r II cq II cq r II r' II r II r II (c~ N II ";;~
~ Cfl II + CO + Cfl II + CO + CO II + (O II +
tt 11. _ -~! 2 =~! I.L = :I. 11- _ ,I I tl = ; I
~ =cn n- ro ~ ro ~- ro ~ =ro - ~ ro ~- ~ co ~- =ro
LC) nt LO le LO (0 ~
N 4) 4) N 4) 4) N 4)
~ ~ ~ ~ ~ ~ ~ ~
w w w w w w w w
N N N N N N N N
2 I 2 2 2 2 I 2
w = O O O O
O U U U U U
U
0 ~ Z
Co ('i f+) N) P7 F) M C%
U U U U U U U U
O O O O O O O
lf) CO fl- 00 W CD
r
r r
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
32
~ ô ,
ccn>. cd %~ c~ cNa
c ~ c c x~
't ~ â _ 't ~ E'~ ~ M O U C N M ~, ~ E
O u X O U x O U Ç X p_, X~ x O >, x~~'~ d)
C(If C O i .C (p p O~ N O N-p O N O
= C ~ ~ ~ rh Q ~ _ =' ~ ! ~ (D z7 'L Q ~ a d -0 N Q =C (0
~ a) ca ~ O e(0 - N ~ Ln = O Q O C ca ~cNO
v~; ~~~ E ~. X
N U) 'O ~. - N r NE >, ~- = O'N
~6.QN ~ L ~N ~ ~ (u Q~ N Ç
E i C X OO .Ç E~C >, N C X O C~'O Q
~ Q(U ~~ N L O N m C U O Q N ~~ ~(N6 ~E
O L O N Ç L O E L O ~ C N O N L N O
C N O,O L,O ._S ! E
N O _C j, Q N ~ .= >+ X cü Q
V Q- ~i ~ N O i~ ~ 4) ~ U O (6 N O~ N Q
LO N>+ ~ C Iv ~O N O X U
O.O i O i v~ fv N s= Cu
(0 N O
(D ~ d y= (n U) ~,
C_ U I' C_ U C U I' C O C
e o E o cYïE o U n E o c o E o coE o rnE Uv
cfl c0 ~ d' LO oUn rn Ln "r dè oo
LC)~ I~Lf)oO rr) Lf)ti OOU?d) MLf)N ~d LC) 00M (0
11 ~ N 11 c(~ ~ II Lq '- II N '- II c ~ 11 ~ ~
=1~ ul =6~ II =~O + I~ II + f~ =N = i
LL LL = ,.., LL. _ .,-. LL
2E w 0-c>s -> M C-ca -~m ca
rn LO r- ao le
aD a?
n. n Q. fl
aEi aEi aEi aEi
w w w w w w w
LL i
~
N N N N N CV N
2 2 2 LL = I
_ 0
Z~ = O ~> O
QO Z z
_ _ _ _
U U U U U U U
O O O O O O O
N c~) d' LO cO 1l- cU
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
33
C ~ N O N
(1) Lu
p == L Y
n o g c 0 ca Q 'r rr r. cn o-
_
X p ~+ fl i- X p m X p >+ ~ U T>. > v>+ â
+Ç~CQNÇ~-a-QNQ C~n7M0MQ
~ L p r >+ t 'N ~ ~ =(J) _ ~.. =(J Cr - Ç L Q.;O Ç L
V'O p, ~ N n. U~ Oo ~ U ~ ~ N Oo V X~~ V
N~ Q r ~~ Ç N~ Q ~ N O.O c- j, xp O='O ~-
~ N X~ L
x - ~ ~co â x~ c xn ç o~ E c'a -c 'âa~
p ~ L L 7 ~ ~ (0 ~ (4 ~ (ü M U o m ~ M 0
_ >+ p =O N = C 0 >+ ~ N =N
U~ '~ (O!) > O L U N p.~ V .~ U N QQ 2 .Q
Ln p j, ~ Z ~ O Q N -Q ~ Q ~ N ?. ~
N U r -~t ~t ~U
u C 3 u.~ uL d N ~ d
.- a
00 C QO c 00 C: 00 Ç 00 p 00 C I'
U ~ rn~ rn~ NE Ucp r () op r U N M 0 E
Cfl CO LO ~Li)Cp LO M LO Cp LO op ~N ~ pp
II II ~ II m 11 ~ II m 11 II ~ 11 11
LL + LO Ilp * Ilp + I I LL + Ilp LL + Ilp L1 =
2 2E :5~ :~E~ 2E~
LO rn ~- ~- ~ T-
O p N N N N p
~ ~ ~ ~ Q. Q..
X X X X OX OX X
W W ui W w w w
N N (V N N CV N
_ = 2 2 = 2 I
z z
p Ip Z
~o /
Z Z ~ Z
Z
V Z \ / ~ ~ ~
M M
N N
= M = M
U2 U=
YU ; U
2 2 = I = M = M 2
U UU
O O O O D U
, , , , Q Q 0
m O ~- N m "t LO
~ N N CV CV N
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
34
~~_r_~ ~~_ 4) ~ i~ =~=~_ ~ N.~.r =C X N p ,l.N r
fn Ly fn (B -c
'N D c
~ N
=N'..~ -~, "~ =N t?.'Ç 'OU~
~=N p i i û N
n~ n â n â~ n ô~~ o Q
X X ~ .~ X ~ .Q X (1) 'Q Q X ~ N X
O U C~) O O c~ ,~ p O~~ O(~ Q U O cJ X p M 0-0
(B >+ ~ p >. ~ (û i M (ü m
ro O
Q (1) ~ C
.p= .p=-.p= t p~
Q O -p,d p â
(D X X x~ ~ â
N N ~ p N- p N N: N N p ~, U'C N ï3 S_? r
0
xE~c XXQC'o XEc'â XEéci uo NX -éc
N N O~. N.= p tü (If Q- p(û pE~
(a .c i = Q -- D M n n
O p i_O ! O i i p O p N>, O
p U N U ÇD- M U ~+ ~+ Q
>, N A N Q- >, - Q >. N Q>+ N ~r c >,
U O'- U i O U O O U! O~ U! Q i~ U N ô=_
p c p i N i O U p p N ~ i' LC) vN vN O ~C O NE -N C vN~
d Ç U d Ç c) ~Y c~ Ç ~, dM'N
~= ~U U fl- Q uM
UI'c U~c UI'c U c c U c
0 1~ o ~Y E o dE o N 'e E o N
COC~ ~N CflN d'O ~ I' O V' ~
OUï1-- d'iS)r OL()O) ~-(O oo lf)(V T- L()N
11 'q '- II II '- N II
II I~ II ~ f~ II ~= Cfl II {~ + oO II + M
= ~!
u- _ . ! LL _ +! I.L _ .;! u. _ ='~ 2 i! LL
cVI ~ ,~ d ~ =ca
~
Cp r- ~ M r- M 00
a) ID Q) a) a) a)
Q. Q Q Q
Q. Q Q.
E E E E E E E
LU W W W W W W
1 i i 1 1 1 9
N N N CV N N N
I I = 2 2 2 2
z _
O
Z D YI ~ p~~0'\ Q
Z/ 'Zp
II O z
~/ z-cn-o
0 ~
= 2 2 = = I =
O O O O O O
O
~ ~ ~ ~ ~ ~ ~
c0 Il- 00 0) o r- N
N N N N M M M
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
'5:, p~
Ç v d- Ç UJ C, IO_ C C ~ C~ O C~~ C N'~
'N N OE~ O
ro _~ ~ N x Q ~
~ '~ Q. ~ ~ Q Q.
X~ p. X X _ ~ X~ m>, X O O X O
O iu ~ U O O ~ ~ O aÇ 6 ~ Q +~ ~ ~
p N ~ 'N N >+._ p W Q
~._u O - N ~ O >+ ' N ~
~ a~ E U~ExX x ~- .âv a~ ~E,~
N O tU N O N p N N~~ ~1 ~ O
o0 p 'o 0 ô N ~, ro ca O>, ~
p- U
N~ N~ p'p x N U aXi cpi axi ~ C axi '~ axi ~.
>, (Q NMO i C- ~ N p?' U ô~m s.p O N 0 ~ p~ Q
X.N oü û N>, >+p.d) ! i.N >+
U 0 Ç'- U N N~ >+ rÇ~ ~ U N L U N jQ U~ CO ~ U CV
L~ ~ X ~NN " ~(B~ ~N-~ v~N lC) pE
~ O Qi N~~. O N ~ C (~ 'p N(0
L.~- 2~ Ç ~ d v d (6
4- ,~
~
UI'c Il- 11- c U o
O M e 'C O C 0 ~ ib O ~ 0 o
d M G rn o E I- Ci C LO o I- co m 01) ~t
oM LO m LO LO~ od rn co~ c coM~= aoLnco
N II M 11 N II ~ N N N n7
11 + fl- + 00 i 1- 11 + I-- 11 j I I= F rn I I + CO
LLS.I~. _il S.il. LLLLS,p LLS~ LL=
o~=~ ~=~ =~ aO..g ~E o..~=~
CO n Cfl CO N (0 Co
N N -N Q) 4)
Q 4)
Q fl.. Q Q
E ~ E E E E E
W W W w W W W
i 1
N N N N N N N
_ = LL = _ = I
LJ- Ll Z
~ = O r
0 ~=0 Z !n'O
O
il~0 ?
S S S 2 2 S S
O O O O O O O
~ i i i i ~ ~
M "Y LO (0 I~ 00 6)
M (Y) (Y) M M M M
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
36
N >, ~Ln LO >, t ~, t ,C > ~ =N > i' d ~ >+.r~ = >. ~ =
Ccq r-
M Q'a Q r! C
C V O L O~ ~>, O L V N.Q L i O. C i O C
Q >, =O ~ i~ p, (Cf Q s? d N O. cY N
~ ~=O i U O i M i N L~ 7 Rf (0
~,;N0 _ >+ï_ ~0,- N L N
p U C X p- p X p U Q~ O Oa cf CL O O~ Q
C.
N ~(D ~ N çL ~ ~ (U O Q O
= L 1 .~ L,= . U x E~~?,ô E~ x ~_ ~~ x
CV O s c~ NE O ~~ CV N Q N N a O O N~, O
E
N E N ~ ~
~ (~p ' N E >+~ U (D 0 m û ~ r M M
O O ô O ( 0 > ~ O~, c? 'Q ~, C _ Ç C
~ = U
~
N >, =Q- A N -p Ç~ = >, N ,
U U L
O~, 0~ U i=N C U i=N '_
O
LON :n N
,~ (6 N 0
Co
V ç ~Y d N d . tu
cn
O~ O~m (O CO
00 O o0 0) N ~ O LO
~LO CO ~-LC)1,_ LC)N COOO-0 COO-a COc--O
I I I G I I M I I I"-~ Ç I I ~ O I I O
LL+I, II +N =f~ + _
LL=
0p (0 CD M C'M M
N 4) d) Q) N Q)
!? Q O Q. Q fl
w w w W w w
LL U_ U_
I-- f-- F-
N N N N N N
= 2 = 2 = _
Z
Z-~
~
Z Z
Sz-,Cn0, 0~Z z ô ~.Z
2 = = 2 2 =
O O O O O 0
i i ~ ~ i i
O N M L()
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
37
cv
N
~- s >, ~. >, i =p .ü ~+ '- N C O
C r- Q>1 C c- .L , C O~ C ~, v C
X
C~ !3 ~ V X c d s? X ~ d E~ 0
O p
p
Q -0 N s Q~ 0-.Q
X Ç(û X p i. ~- X a C IU X U X
p U p U p U 0 O U pm X p~~ V
..~ m +-C-= ô c! +-C-' _ ~ ,L N .~ -Q ""' ~
N C
~~ '~ ç ~~ ~ ~v~=ç E ~,n ~ ~ ~
N p N~ Na) ~'N N p N~ .~ c~- ~~ N
'(D Xcoô xôcâ
0 coô'Q c a (U CL)=N (D E caQ
~ ~Q~ (t Q -- -, :2 ~ ô ô~~
N O j, (V L
U ~- N U p~ ~Ç' U p='U ~i N~ Q- V N p~
Ln N üO N N -L F ~
~N
m m m m
E E E E
~00~ C~OLf)-0 CIt06)-0 COm 'û COO'0
II II ~.O II c(~ Ç
+ + II ~
_
.p [SI .~ ~ .~ .~ =c6 .~ =t0 .~
Co M c~ (h M
4) 4) N 4) Q)
W W W W W
LaL LL LaL Li L~
I-- F- E-- F- I--
N N N N N
I I I 2 I
LL
s p O Z 0- LL
én-~Z Z-tnZ Z_~
I 2 2 2 I
0 0 0 0 0
tfl I- Co W CD
d d ~t ~t
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
38
C s~ .~ T~ Ç = =M'= N (Lû C 'N ZY
O Q- d C
çd ~ X L~ (NÜ ~ûQO (0 ~6 ~ ~O L-0 (6
- C)
-0
Q
x V.~. (Q Xn X~ C O ~ XO U X~
O O~ U O O O O V O~ O v_- O U~ N
U 7 ~ Q ~ 7
~ J) ? - a) c (D CT
O O
NN~(N â~~ N~N N' C
NO~N NECX X
>+ N
Q
C " QQ 0 ~ N N N
X N N
~ Q. >,~ U N~N Q Ç 6 L M Q L>, Q U
0 O CV O ~p x N N O
~ Q ~ C~ V >+ tA >. N = ~ =~ >, > ~
X 'N t!? (Çf ~
vN O'O LOO~
E N
M ~
M Ç~-= f~. M C_ ~ I~ C_ 00 C 1~- C_
m U m U
eô o ~rï r~ o cYï c~ï oï
E
CO N O 00 U') O r I' N d ~
CO M z7 O'e M Cfl ~ a I~ dM C0 ~- d M
II 00 O '- O II ~_ O ~ II p II ~ il
= II O W= = II O LL, = II ~ +
Z
n-~,~ Co ~ a.~,Cu ~=c~ ~ co
M C0 M CO M CO
Q) U) d) U) 4) N
E E ~ E E ~
X X X X X X
W LL1 W W W W
L~L ' ' '
F-
CV N CV N N
2 2 I 2 2 2
O ~
s 'O
o\/ i p ~ ~O O z O
zcn O zva .z
M
2 ~
U=
M N M N ~ N
U U= U U= U U=
U U
O p O pU 0 O
~ N M d ~ ~
m LO LO LC) LO LO
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
39
O i aD
~ p
O C
Q~ C N fl~~~+ (0 Q~ C ct (~
QO_ tNQ Ç OCY= O06 p(L)
>+ U
X (B -C p =N ~ C -C O X - ~_
Ç O Q dj =O ~ Q~ V Ç 0 N d O
~ p~ C C p N~, V ~ Q N t(S ~ a C
U Xp O O~~ U N O~~
~i -t3 d. X~+ ~ r Q p C X i r~ O~-
X d d) O U N O~ ~ ct X
> N(O ~ L p C Q(ü (iQ ~ N C N tIf 7 Q
p>, S2 U p~ L Lf) p~~ U(Lü O~ N U
Q ~ ~ (6 O j, =O C >,
O N N - O0 N
_ -~ N- O N O.
U O >, > p 0
UN N- N N
LO d N (L6 ~t . ~= (B
Lo (Q d a~
Cfl C CO C CO C C~ C r C
Lo (0
~ M "Zr N
II 0 II c~ II d II ~ II ~?
_~ 2(0 2(0 _!.
cu ~ =cv ~ -ca =co ~ Co
ID a) ID ID
E E E E E
w w w w w
N N CV N cY)
_ _ = 2 =
C1 0 C1 0 ~
ih N N
N = N
UU OU U~
O O O O O
~ ~ ~ ~ ~
ti ao rn o
~
LO ui m
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
Les composés selon l'invention ont fait l'objet d'essais pharmacologiques
permettant
de déterminer leur effet modulateur de l'activité des récepteurs aux
chimiokines.
Les chimiokines sont des protéines de bas poids moléculaire qui appartiennent
à la
famille des cytokines proinflammatoires et sont impliquées dans le
chimiotactisme
5 des leucocytes et des cellules endothéliales. Les chimiokines contrôlent de
nombreux processus biologiques et sont associées à des désordres
inflammatoires
apparaissant lors des états de stress, lors de blessures ou d'infections ; la
modulation des effets des chimiokines permet de prévenir ou de traiter des
pathologies comme l'asthme, l'arthrite, les allergies, les maladies auto-
immunes,
lo l'athérosclérose ou l'angiogénèse (C.D. Paavola et al., J. Biol. Chem.,
1998, 273,
(50), 33157-33165).
Parmi les chimiokines, on distingue le hMCP-1 (de l'anglais human Monocyte
Chemotactic Protein) qui appartient au groupe des CC chimiokines et qui est un
agoniste naturel du récepteur CCR2b.
15 On a mesuré l'activité inhibitrice des composés selon l'invention sur des
cellules
exprimant le récepteur CCR2b humain. La concentration d'agoniste naturel hMCP-
1
qui inhibe 50 %(CI50) de l'activité du récepteur CCR2b est de 0,57 nM. Les
composés selon l'invention présentent une C150 généralement comprise entre 0,1
M et 0.1 nM, et préférentiellement comprise entre 100 nM et 0.1 nM. -
20 Dans des plaques filtre Millipore GF/B (réf. MAFBNOB10 ou 50), on met en
contact
pendant 1 h30 à température ambiante : 5OpL de composé à 3 x 10"5 M dans le
tampon
de réaction ou gamme de MCP-1 froid ((R & D System). Recombinant human MCP-1)
(concentration finale en composé : 10-5 M), ainsi que 50 tal de MCP-1 iodé
((1251]-MCP-
9human recombinant Bolton + Hunter labelled (Amersham)) à 0,3 nM dans de l'eau
25 distillée (concentration finale en MCP-1 iodé : 0,1 nM), ainsi que 50 pI de
cellules CHO-
K1-CCR2B (obtenues chez Euroscreen Bruxelles, Belgique) à 6 x 106 cellules/ml
(concentration finale dans le tampon de réaction: 3 x 105 cellules/puits). Les
filtres ont
précédemment été saturés avec 100pL de PEI à 0,0125% final en PBS pendant 72h
à
4 C et le PEI a été enlevé par filtration. Le contenu des puits est filtré et
lavé deux fois
30 avec le tampon de réaction, et les filtres sont laissés à sécher une nuit.
Le lendemain,
20NL/puits de scintillant <e Optiphase Super Mix Wallac sont distribués. Les
filtres
sont imprégnés pendant 1 à 2h puis comptés au Trilux Iode 125,1 min.
Tampon de réaction = Tampon PBS, 50 nM Hepes, 1 mM CaCI2, 5 mM MgC12 0,5%
BSA sans acide gras, ajusté à pH 7,4.
35 Par exemple, le composé n 9 a présenté une C150 de 4 nM, le composé n 10
a
présenté une C150 de 53 nM, le composé n 22 a présenté une C150 de 4 nM, le
composé n 40 a présenté une C150 de 82 nM, le composé n 41 a présenté une
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
41
CI50 de 39 nM, le composé n 33 a présenté une C150 de 20 nM, le composé n 11
a présenté une C150 dé 20 nM, le composé n 23 a présenté une CI50 de 8 nM, le
composé n 29 a présenté une CI50 de 50 nM et le composé n 45 a présenté une
C150 de 73 nM.
Les composés selon l'invention peuvent donc être utilisés pour la préparation
de
médicaments, en particulier de médicaments antagonistes de l'effet des
chimiokines.
Ainsi, selon un autre de ses aspects, la présente invention a pour objet des
médicaments qui comprennent un composé de formule (I), ou un sel d'addition de
ce dernier à un acide pharmaceutiquement acceptable, ou encore un hydrate ou
un
solvat.
Ces médicaments trouvent leur emploi en thérapeutique, notamment dans la
prévention et le traitement de différentes pathologies telles que :
- les maladies et les syndromes immuno-inflammatoires aigus et chroniques
comme
l'athérosclérose, les resténoses, les maladies pulmonaires chroniques, en
particulier
COPD (de l'anglais chronic obstructive pulmonary disease) ; le syndrome de
détresse respiratoire ; l'hyperactivité bronchique; les colites; la silicose ;
les
pathologies fibreuses, les fibroses pulmonaires, les fibroses kystiques ; les
infections virales ou bactériennes, SIDA, méningite , malaria, lèpre,
tuberculose,
herpès, infections par cytomégalovirus; les chocs septiques, la septicémie,
les
chocs endotoxiques ; les rejets de greffes ; les pathologies osseuses telles
que
l'ostéoporose, les ostéoarthrites ; les conjonctivites ; les dermatites
atypiques ou de
contact; les eczémas ; les glomérulonéphrites ; les pancréatites ; les colites
ulcéreuses, les maladies auto-immunes comme la polyarthrite rhumatoïde, la
sclérose en plaques, la sclérose amyotrophique latérale, la maladie de Crohn,
le
lupus érythémateux, la sclérodermie, le psoriasis; la maladie de Parkinson ;
la
maladie d'Alzheimer ; le diabète ; la cachexie; l'obésité;
- le traitement de la douleur, en particulier neuropathique et inflammatoire;
- les maladies allergiques comme les maladies respiratoires allergiques,
l'asthme,
les rhinites, l'hypersensibilité pulmonaire, l'hypersensibilité retardée;
- les maladies et les désordres dans lesquels les processus angiogéniques sont
impliqués comme les cancers (angiogénèse intratumorale), les maladies
rétiniennes
(dégénérescence maculaire liée à l'age : DMLA );
- les pathologies cardiaques : choc hémodynamique ; les ischémies cardiaques ;
les
attaques de réinfusion post-ischémique ; l'infarctus du myocarde, la thrombose
coronarienne, l'insuffisance cardiaque, l'angine de poitrine.
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
42
Selon un autre de ses aspects, la présente invention concerne des compositions
pharmaceutiques comprenant, en tant que principe actif, un composé selon
l'invention. Ces compositions pharmaceutiques contiennent une dose efficace
d'au
moins un composé selon l'invention, ou un sel pharmaceutiquement acceptable,
un
hydrate ou solvat dudit composé, ainsi qu'au moins un excipient
pharmaceutiquement acceptable.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration souhaité, parmi les excipients habituels qui sont connus de
l'homme du métier.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration orale, sublinguale, sous-cutanée, intramusculaire, intra-
veineuse,
topique, locale, intratrachéale, intranasale, transdermique ou rectale, le
principe actif
de formule (I) ci-dessus, ou son sel, soivat ou hydrate éventuel, peut être
administré
sous forme unitaire d'administration, en mélange avec des excipients
pharmaceutiques classiques, aux animaux et aux êtres humains pour la
prophylaxie
ou le traitement des troubles ou des maladies ci-dessus.
Les formes unitaires d'administration appropriées comprennent les formes par
voie
orale telles que les comprimés, les gélules molles ou dures, les poudres, les
granules et les solutions ou suspensions orales, les formes d'administration
sublinguale, buccale, intratrachéale, intraoculaire, intranasale, par
inhalation, les
formes d'administration topique, transdermique, sous-cutanée, intramusculaire
ou
intraveineuse, les formes d'administration rectale et les implants. Pour
l'application
topique, on peut utiliser les composés selon l'invention dans des crèmes,
gels,
pommades ou lotions.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention
sous forme de comprimé peut comprendre les composants suivants :
Composé selon l'invention 50,0 mg
Mannitol 223,75 mg
Croscaramellose sodique 6,0 mg
Amidon de maïs 15,0 mg
Hydroxypropyl-méthylcellulose 2,25 mg
Stéarate de magnésium 3,0 mg
Par voie orale, la dose de principe actif administrée par jour peut atteindre
0,1 à
1000 mg/kg, en une ou plusieurs prises.
II peut y avoir des cas particuliers où des dosages plus élevés ou plus
faibles sont
appropriés ; de tels dosages ne sortent pas du cadre de l'invention. Selon la
CA 02632854 2008-06-02
WO 2007/077394 PCT/FR2007/000007
43
pratique habituelle, le dosage approprié à chaque patient est déterminé par le
médecin selon le mode d'administration, le poids et la réponse dudit patient.
La présente invention, selon un autre de ses aspects, concerne également une
méthode de traitement des pathologies ci-dessus indiquées qui comprend
l'administration, à un patient, d'une dose efficace d'un composé selon
l'invention, ou
un de ses sels pharmaceutiquement acceptables ou hydrates ou solvats.