Note: Descriptions are shown in the official language in which they were submitted.
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
1
COMPOSES C-GLYCOPEPTIDES GEM-DIFLUORES, LEUR
PREPARATION ET LEUR UTILISATION NOTAMMENT POUR LA
PRESERVATION DE MATERIAUX BIOLOGIQUES.
L'invention concerne un procédé pour la synthèse de composés C-
glycopeptides gem-difluorés. Elle s'applique plus particulièrement, mais non
exclusivement, à la préparation de composés ou compositions utilisables
notamment pour la préservation de matériaux biologiques tels que des
cellules, tissus et organes à différentes températures, mais également dans
le traitement de l'inflammation.
Une famille de glycoprotéines antigels présentent notamment chez certains
poissons et leur permettant de survivre dans un environnement ou les
températures sont voisines ou inférieures à 0 C, a montré une activité
protectrice de matériaux biologiques dans de nombreuses études à basses
voire très basses températures (environ +4 C à-196 C).
Depuis de nombreuses années, les scientifiques étudient l'influence de ces
composés antigels extraits du milieu naturel (poissons, amphibiens, plantes,
insectes...) et s'orientent vers la synthèse de composés analogues
suffisamment stables et présentant une activité au moins égale voire
supérieure aux molécules naturelles pour des applications commerciales.
En effet ces composés naturels présentent de nombreuses limitations :
- une extraction du milieu naturel ou des synthèses difficiles,
- des analyses complexes avec des puretés faibles,
- des produits instables face aux hydrolyses chimiques et
enzymatiques.
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
2
Les glycoprotéines, en raison de la présence d'une liaison osidique (liaison
impliquant l'oxygène dit en position anomérique), sont fragiles vis-à-vis de
plusieurs systèmes enzymatiques dont les enzymes glycosidases et sont
également sensibles aux hydrolyses acido-basiques, ce qui rend leur
synthèse plus difficile.
Il est donc intéressant, pour permettre aux composés de conserver leurs
propriétés biologiques, de remplacer l'oxygène de la liaison osidique afin que
cette liaison ne soit plus dégradée par un processus enzymatique.
Des analogues où l'oxygène est remplacé par un groupement CH2 ont été
synthétisés, mais, en dépit d'un accroissement de la stabilité et d'un
encombrement stérique semblable à celui de l'oxygène, le groupement CH2
ne s'est pas toujours révélé être un bon mime de l'oxygène osidique. En
conséquence, on ne retrouve pas forcément les propriétés biologiques du
composé initial.
D'autres classes de composés où l'oxygène est remplacé par un azote ou un
soufre et plus récemment par un groupe difluorométhylène sont étudiées afin
de conférer aux composés glycoconjugués une stabilité accrue en milieu
biologique.
En effet, le groupe CF2 est particulièrement résistant aux processus de
dégradations biochimiques et il permet donc la synthèse de structures non
hydrolysables.
Cette transposition O/CF2 semble particulièrement adaptée pour mimer
l'oxygène sur le plan électronique ; les deux atomes de fluor jouant le rôle
des deux doublets libres de l'oxygène.
Le Demandeur a développé des gem-difluoroglycopeptides qui ont démontré
une très forte activité de préservation de différentes lignées cellulaires à
des
températures variant de -196 C à +37 C.
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
3
En effet, les modifications structurales apportées par rapport aux composés
natifs et l'observation d'un véritable effet anti-apoptose, c'est-à-dire pas
de
mort cellulaire, à des températures physiologiques ont conduit le Demandeur
à étendre le spectre d'activité des composés.
Ces composés ont été baptisés AAGP pour Anti Aging GlycoProteins.
Dans un souci de développer de nouveaux analogues toujours plus actifs
c'est-à-dire apportant une meilleure préservation des matériaux biologiques
et avec en première instance la volonté d'améliorer la préservation de
fibroblastes pour des applications en cosmétologie, nous nous sommes
orientés vers la synthèse de composés de plus faible poids moléculaire
pouvant ainsi avoir une meilleure biodisponibilité tout en simplifiant les
étapes de synthèse.
De tels composés seraient utilisables en vue de nombreuses applications
telles que la préservation des cellules, plaquettes sanguines, tissus et
organes.
Il existe en effet une forte demande afin d'améliorer le stockage et la
conservation de matériaux vivants avec beaucoup moins de dommages que
par les méthodes couramment utilisées.
On parle plus généralement de préservation en incluant la préservation à des
températures différentes y compris la cryopréservation jusqu'à des
températures de -196 C.
Ainsi, des composés utilisés comme adjuvants lors de la conservation et
présentant une bonne stabilité pourraient être utiles pour préserver des
matériaux biologiques notamment dans le domaine médical :.
- pour maintenir des organes humains entiers tels que des reins, des
corurs et des foies à transplanter sans contrainte de temps,
- pour préserver des cellules ou des tissus délicats avec un minimum
de dommages et suffisamment longtemps pour permettre leur
distribution éventuellement internationale,
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
4
- pour conserver des plaquettes sanguines et différentes cellules,
- pour protéger certains organismes, bactéries, virus ou des vaccins,
mais également dans le domaine dermatologique et/ou cosmétique pour
protéger la peau contre les dégradations causées par le stress oxydant ou
les UV ou par le vieillissement par exemple.
L'invention a pour objet de résoudre ces inconvénients.
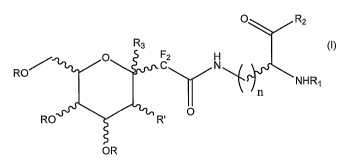
A cet effet, elle propose un composé C-glycopeptide gem-difluoré de formule
R3
O C R2
RO O C N
____( NHR,
RO R' O
OR
où n est un nombre entier compris entre 3 et 4,
R représente un atome d'hydrogène, un groupe alkyle linéaire ou
ramifié, benzyle, acétyle, triméthylsilyle, tert-butyldiméthylsilyle, tert-
butyld iphényisilyle,
R représente OR, NR"R"', N3, ou un phtalimide,
R"et R"', identiques ou différents, représentent un atome
d'hydrogène ou un groupe alkyle linéaire ou ramifié,
aryle, benzyle, benzoyle, acétyle, alkyloxycarbonyle,
allyloxycarbonyle, benzyloxycarbonyle,
R, représente un atome d'hydrogène ou un groupe alkyle linéaire ou
ramifié, benzyle, alkylcarbamate, allylcarbamate, benzylcarbamate,
acétyle, Ri peut également représenter un acide aminé, mais dans ce
cas R2 représente uniquement OR,
R2 représente un acide aminé, mais dans ce cas R, représente un
atome d'hydrogène ou un groupe alkyle linéaire ou ramifié, benzyle,
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
alkylcarbamate, allylcarbamate, benzylcarbamate, acétyle, R2
représente OR quand RI représente un acide aminé,
R3 représente un atome d'hydrogène ou une fonction alcool libre ou
protégé,
5 ainsi que ses dérivés à l'état de base, de sel d'addition à un acide minéral
ou
organique, d'hydrate ou de solvat physiologiquement ou
pharmaceutiquement acceptables.
Les groupes alkyles linéaires ou ramifiés pourront être des groupes
possédant de 1 à 10 atomes de carbones.
Ledit acide aminé pourra être une alanine ou une glycine ou une proline.
Par physiologiquement acceptable, on entend compatible avec la peau, les
lèvres, le cuir chevelu et/ou les cheveux.
L'invention a également pour objet un médicament comprenant en tant que
principe actif au moins un composé C-glycopeptide gem-difluoré de formule I
tel que défini précédemment.
Selon un autre de ses aspects, la présente invention concerne l'utilisation
d'au moins un composé C-glycopeptide gem-difluoré de formule I tel que
défini précédemment pour la préparation de médicaments destinés à traiter
l'inflammation.
L'invention concerne également l'utilisation d'un composé C-glycopeptide
gem-difluoré de formule I pour la préparation de composés ou compositions
utilisables pour la préservation ou la cryopréservation de matériaux
biologiques tels que des fibroblastes.
Un autre objet de l'invention se rapporte à une composition comprenant au
moins un composé C-glycopeptide gem-difluoré de formule I tel que défini
précédemment.
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
6
Bien entendu, la composition selon l'invention pourra comprendre un
composé C-glycopeptide gem-difluoré de formule I seul ou en mélange et en
toutes proportions.
La composition selon l'invention pourra être destinée à un usage cosmétique
ou pharmaceutique notamment dermatologique.
La composition pourra être ingérée, injectée ou appliquée sur la peau, les
lèvres, le cuir chevelu et/ou les cheveux.
Selon le mode d'administration, la composition selon l'invention pourra se
présenter sous toutes les formes galéniques normalement utilisées.
La composition pourra comprendre un milieu et/ou un support
physiologiquement ou pharmaceutiquement acceptable.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration par voir orale, sublinguale, inhalée, sous-cutanée,
intramusculaire, intraveineuse, transdermique, locale ou rectale, les
principes
actifs pourront être administrés sous formes unitaires d'administration, en
mélange avec des supports pharmaceutiquement acceptables classiques.
Les formes unitaires d'administration appropriées comprennent les formes
par voie orale telles que les comprimés, les gélules, les poudres, les
granules et les solutions ou suspensions orales, les formes d'administration
topique, les implants, les formes d'administration sous-cutanée,
intramusculaire, intraveineuse, intranasale ou intraoculaire et les formes
d'administration rectale.
Outre les excipients inertes, non toxiques et pharmaceutiquement
acceptables, tels que l'eau distillée, le glucose, le lactose d'amidon, le
talc,
les huiles végétales, l'éthylène glycol..., les compositions ainsi obtenues
pourront également contenir des agents de préservation.
D'autres principes actifs pourront être ajoutés dans ces compositions.
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
7
La quantité de composé selon l'invention et d'autres éventuels principes
actifs dans de telles compositions pourra varier selon les applications, l'âge
et le poids du malade ou de l'utilisateur le cas échéant.
Pour une application topique sur la peau, les lèvres, le cuir chevelu et/ou
les
cheveux, la composition selon l'invention pourra comprendre un milieu et/ou
un support physiologiquement acceptable.
De plus, la composition pourra se présenter sous toutes les formes
galéniques normalement utilisées pour une application topique, notamment
sous forme d'une solution aqueuse, hydroalcoolique ou huileuse, d'une
émulsion huile-dans-eau ou eau-dans-huile ou multiple, d'un gel aqueux ou
huileux, d'un produit anhydre liquide, pâteux ou solide, d'une dispersion
d'huile dans une phase aqueuse à l'aide de sphérules pouvant être des
micro/nanocapsules ou micro/nanoparticules, des dispersions vésiculaires de
type ionique et/ou non ionique.
Cette composition pourra être plus ou moins fluide et avoir l'aspect d'une
crème blanche ou colorée, d'une pommade, d'un lait, d'une lotion, d'un
sérum, d'une pâte, d'une mousse.
Elle pourra également se présenter sous forme solide et, par exemple, sous
forme de stick.
Elle pourra être utilisée comme produit de soin, comme produit de nettoyage,
comme produit de maquillage.
La composition selon l'invention pourra aussi être une composition pour
soins capillaires, et notamment un shampooing, une lotion traitante, une
crème ou un gel coiffant.
La composition pourra également contenir des adjuvants habituels dans les
domaines cosmétiques ou dermatologiques.
Les quantités des différents adjuvants sont celles classiquement utilisées
dans les domaines considérés.
Ces adjuvants, selon leur nature, pourront être introduits dans une phase
aqueuse, une phase huileuse, dans des vésicules et/ou dans des
micro/nanoparticules.
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
8
Il est entendu que ces adjuvants ainsi que leur concentration devront être
tels qu'ils ne modifient pas la propriété recherchée pour la composition selon
l'invention.
L'invention a également pour objet un procédé de traitement cosmétique
pour protéger la peau, les lèvres et/ou les cheveux, le cuir chevelu contre le
stress oxydant et/ou les UV consistant à appliquer sur la peau, les lèvres
et/ou les cheveux, le cuir chevelu, une composition comportant au moins un
milieu physiologiquement acceptable et au moins un composé C-
glycopeptide gem-difluoré de formule I tel que défini précédemment ou un de
ses dérivés à l'état de base, de sel d'addition à un acide minéral ou
organique, d'hydrate ou de soivat physiologiquement ou
pharmaceutiquement acceptables.
Des modes d'exécution de l'invention seront décrits ci-après, à titre
d'exemples non limitatifs, avec référence aux dessins annexés dans
lesquels :
La figure 1 est une équation de réaction pour obtenir le composé 2;
La figure 2 est une équation de réaction pour obtenir le composé 3;
La figure 3 est une équation de réaction pour obtenir le composé 4;
La figure 4 est une équation de réaction pour obtenir le composé 5;
La figure 5 est une équation de réaction pour obtenir le composé 6;
La figure 6 est une équation de réaction pour obtenir le composé 9;
La figure 7 est une équation de réaction pour obtenir le composé 10 ;
La figure 8 est une équation de réaction pour obtenir le composé 11 ;
La figure 9 est une équation de réaction pour obtenir le composé 12 ;
La figure 10 est une équation de réaction pour obtenir le composé 14;
La figure 11 est une équation de réaction pour obtenir le composé 15 ;
La figure 12 est une équation de réaction pour obtenir le composé 16 ;
La figure 13 est une équation de réaction pour obtenir le composé 19 ;
La figure 14 est une équation de réaction pour obtenir le composé 20 ;
La figure 15 est une équation de réaction pour obtenir le composé 21 ;
La figure 16 est une équation de réaction pour obtenir le composé 22 ;
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
9
La figure 17 est une équation de réaction pour obtenir le composé 24 ;
La figure 18 est une équation de réaction pour obtenir le composé 25;
La figure 19 est une équation de réaction pour obtenir le composé 26 ;
La figure 20 est une équation de réaction pour obtenir le composé 28 ;
La figure 21 est une équation de réaction pour obtenir le composé 29 ;
La figure 22 est une équation de réaction pour obtenir le composé 30 ;
La figure 23 est une équation de réaction pour obtenir le composé 32 ;
La figure 24 est une équation de réaction pour obtenir le composé 33 ;
La figure 25 est une équation de réaction pour obtenir le composé 34;
La figure 26 est une équation de réaction pour obtenir le composé 35 ;
La figure 27 est une équation de réaction pour obtenir le composé 36 ;
La figure 28 est une équation de réaction pour obtenir le composé 37 ;
La figure 29 est une équation de réaction pour obtenir le composé 38 ;
La figure 30 est une équation de réaction pour obtenir le composé 39 ;
La figure 31 est une équation de réaction pour obtenir le composé 41 ;
La figure 32 est une équation de réaction pour obtenir le composé 42 ;
La figure 33 est une équation de réaction pour obtenir le composé 43 ;
La figure 34 est une équation de réaction pour obtenir le composé 44 ;
La figure 35 est une représentation des effets du composé 11 sur des
fibroblastes adultes de la peau traités UV ;
La figure 36 est une représentation des effets du composé 11 sur des
fibroblastes adultes de la peau à-3 C ;
Les figures 37, 38 et 39 sont des représentations des effets des
différents dérivés sur la survie de cellules HELA soumises à des UVC.
Les abréviations rencontrées sont définies ainsi :
éq. : équivalent g: gramme Hz : Hertz
mg : milligramme MHz: mégaHertz min.: minute
mL: millilitre mmol: millimole mol: micromole
nmol : nanomole app : apparent
Les caractéristiques des appareils utilisés pour effectuer les analyses de
tous
les composés décrits dans la présente demande sont indiquées ci-dessous :
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
Les spectres RMN 1 H, "C, '9F ont été enregistrés sur des
spectromètres BRUKER DPX 300 et DPX 600. En RMN 'H et 13C, le
tétraméthylsilane est utilisé comme référence interne. En RMN 19F, la
5 référence externe est le fluorotrichlorométhane CFCI3. Les déplacements
chimiques sont exprimés en partie par million (ppm), les constantes de
couplage J en Hertz (Hz).
Les abréviations suivantes ont été utilisées :
s pour singulet, bs pour un large singulet, d pour doublet, t pour triplet, q
pour
10 quadruplet, m pour multiplet ou massif, dd pour doublet de doublet...
Les spectres de masse ont été obtenus sur un spectrophotomètre de type
Micromass TOF-SPEC, E 20 kV, a-cyano. pour l'ionisation Maldi et JEOL
AX500, 3 kV, Canon FAB JEOL, Xe, 4 kV, courant limite 10 A, Gly-NBA
50 : 50 pour l'ionisation FAB.
Les séparations par chromatographie sur colonne sont réalisées sous
pression légère en suivant les techniques de chromatographie sur silice
Kieselgel 60 (230-400 Mesh, Merck).
Le suivi est assuré par chromatographie sur couches minces (CCM) avec
des plaques Kieselgel 60F-254-0.25mm. On appelle rapport frontal (Rf) le
rapport de la distance de migration d'un composé sur un support donné sur
la distance de migration d'un éluant.
Synthèse du cornposé 2(Figure 1)
6
5 O 1 OMe
Bn0
2
Bn0 4 3 ,'Ill
'/OBn
2 OBn
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
11
Dans un ballon sous atmosphère inerte contenant le méthyl-D-
galactopyranoside 1 (5 g; 26 mmol ;1 éq.) et de l'iodure de
tétrabutylammonium nBu4Nl (500 mg ; 1,3 mmol ; 0,05 éq.) dans le
diméthylformaldéhyde DMF (250 mL) est introduit de l'hydrure de sodium
NaH (3,7 g; 0,15 mol ; 6 éq.) par petites portions. Puis du bromure de
benzyle BnBr (18 mL; 0,15 mol ; 6 éq.) est additionné et le mélange est
laissé sous agitation pendant au moins 24 heures.
Le milieu est hydrolysé avec de l'eau. Puis la phase aqueuse est extraite
trois fois avec de l'éther. Les phases organiques sont ensuite rassemblées,
lavées plusieurs fois à l'eau, séchées sur du sulfate de magnésium, filtrées
puis évaporées.
Le produit ainsi obtenu est purifié par chromatographie sur une colonne de
silice avec comme éluant un mélange cyclohexane / acétate d'éthyle dans
des proportions de neuf pour un. Après concentration des fractions
recueillies, le produit 2 se présente sous la forme de cristaux blancs avec un
rendement pondéral de 95%.
C35H3806 M= 554,67 g.moi-1
Rf : 0.38 (cyclohexane/acétate d'éthyle 8/2).
Synthèse du composé 3 (Figure 2)
6
5 O 1 OH
BnO
2
BnO 4 3 ,,1//
'/OBn
3 OBn
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
12
Dans un ballon contenant le 1-O-Méthyl-2,3,4,6-Tetra-O-Benzyl-D-
galactopyranose 2(5,5g ; 9,92 mmol) dans 80 mL d'acide acétique, est
additionné 11 mL d'acide sulfurique HZSO4 à une concentration molaire de
3M. Le milieu réactionnel est chauffé à 100 C pendant une heure. La
solution est ensuite diluée dans 100 mL d'eau froide.
Le mélange est extrait quatre fois avec 100 mL de toluène. Les phases
organiques sont rassemblées, puis lavées avec 100 mL d'eau, 100 mL d'une
solution saturée d'hydrogénocarbonate de sodium NaHCO3 et enfin avec 100
mL d'eau. La phase organique est ensuite séchée sur sulfate de magnésium,
filtrée puis concentrée.
Le produit ainsi obtenu est purifié par chromatographie sur une colonne de
silice avec comme éluant un mélange cyclohexane / acétate d'éthyle dans
des proportions de 8,5 pour 1,5. Après concentration des fractions
recueillies, le produit 3 se présente sous la forme de cristaux blancs avec un
rendement pondéral de 75%.
C34H3606 M= 540,65 g.mol-1
Rf : 0,65 (cyclohexane/acétate d'éthyle 6/4).
Synthèse du composé 4 (Figure 3)
6
5 O 1 O
BnO
2
BnO 4 3 '~~~~'/OBn
4 OBn
Dans un ballon sous atmosphère inerte, contenant le 2,3,4,6-Tétra-O-Benzyl-
D-Galactopyranose 3 (4 g; 7,4 mmol) sont introduits le diméthylsulphoxyde
DMSO (25,6 mL) et l'anhydride acétique Ac20 (16,8 mL). Le mélange est
laissé sous agitation pendant 12 heures.
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
13
Puis, de l'eau est ajoutée et la phase aqueuse est extraite trois fois avec de
l'éther. Les phases organiques sont rassemblées, puis lavées avec une
solution saturée d'hydrogénocarbonate de sodium NaHCO3 puis de l'eau. La
phase organique est ensuite séchée sur sulfate de magnésium, filtrée puis
concentrée.
Le produit est ensuite purifié par chromatographie sur une colonne de silice
avec comme éluant un mélange cyclohexane / acétate d'éthyle dans des
proportions de huit pour deux. Après concentration des fractions recueillies,
la lactone 4 se présente sous la forme d'une huile incolore avec un
rendement pondéral de 82%.
C34H3406 M= 538,63 g.mol-'
Rf : 0,61 (cyclohexane/acétate d'éthyle 8/2).
RMN 'H (CDCI3, 300 MHz)
3,6 (m, 2H, H6) ; 3,8 (dd, 2,1-9,6, 1H, H3) ; 4,1 (s, 1H, H4) ; 4,2 (m, 1H,
H5) ;
4,4-5,1 (m, 9H, H2; 4OCH2Ph) ; 7,2 (m, 20H, H ar.)
RMN 13C (CDCI3, 75,5 MHz)
67,4 (C6) ; 72,4 (C5) ; 72,6 (OÇH2Ph) ; 73,5 (OÇHZPh) ; 74,5 (C4) ; 75,1
(OÇH2Ph) ; 77,1 (C2) ; 79,9 (C3) ; 127,4 -128,3 (Car.) ; 137,2 ; 137,3 ; 137,6
(Çar. quat.) ; 169,8 (CO).
ao=+79,0 (c=1; CHCI3)
Synthèse du composé 5 (Figure 4)
6 OH
O CF2CO2Et
Bn0 V'/BnOOBn
5 OBn
Dans un ballon sous atmosphère inerte contenant du zinc Zn (1,7 g; 26
mmol ; 7 éq.) préalablement activé et décapé dans du tétrahydrofurane THF
(30 mL) au reflux, un mélange constitué de la lactone 4 (2 g; 3,7 mmol ; 1
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
14
éq.) et de bromodifluoroacétate d'éthyle (1,42 mL ; 11 mmol ; 3 éq.) dans le
THF (30 mL) est additionné goutte à goutte. La réaction est laissée au reflux
pendant 3 heures. Après retour à la température ambiante, le zinc est filtré,
puis une solution d'acide chlorhydrique HCI 1 N (60 mL) puis du
dichlorométhane (6 mL) sont ajoutés au milieu réactionnel.
Les phases aqueuses et organiques sont séparées et la phase aqueuse est
extraite à nouveau deux fois au dichlorométhane. Les phases organiques
sont rassemblées, séchées sur sulfate de magnésium, filtrées puis
concentrées.
Le produit est ensuite purifié par chromatographie sur une colonne de silice
avec comme éluant un mélange cyclohexane / acétate d'éthyle dans des
proportions de huit pour deux. Après concentration des fractions recueillies,
le produit 5 se présente sous la forme de cristaux blancs avec un rendement
pondéral de 82%.
C38H4oF20$ M= 662,72 g.mol-'
Rf : 0,35 (cyclohexane/acétate d'éthyle 8/2).
RMN 19F (CDCI3; 282,5 MHz)
-118,4 (d, JF_F=256Hz) ; -120,2 (d, JF_F=256Hz).
RMN 'H (CDCI3, 300MHz)
1,1 (t; 7,2; 3H; CH3); 3,4-3,5 (m; 2H; H6) ; 3,7-3,8 (dd; 2,5-9,5; 1 H; H3);
3,8
(d; 2; 1 H; H4) ; 4-4,1 (m; 3H; H5 ; CHz) ; 4,25-4,85 (m; 9H; H2 ; 4OCH2Ph) ;
7,2 (m; 20H; Har).
RMN 13C (CDCI3, 75,5 MHz)
14,2 (ÇH3) ; 63,6 (CH2) ; 68,6 (C6) ; 71,7 (C5) ; 73,2 (OCH2Ph); 73,9
(OÇH2Ph) ; 74,1 (C4) ; 74,9 (OÇH2Ph) ; 75,1 (C2) ;75,8 (OÇH2Ph) ; 81,2
(C3) ; 96,9 (t, 27Hz, C1) ; 113 (t, 264Hz, ÇF2) ; 128,0 -128,9 (Car.) ;
138,2 ;138,3 ; 138,6 ; 139,1 (Car. quat.) ; 163,3 (t, 31 Hz, CO2Et).
ap=+52,6 (c=1; CHCI3)
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
Synthèse du composé 6 (Figure 5)
6 OH
O
Bn0 CF2CO2H
5 j3l0Bn
Bn0 4 6 OBn
Dans un ballon contenant l'ester 5 (0,5 g ; 1,75 mmol, 1 éq.) dans le THF
5 (5 mL) est ajoutée une solution aqueuse de lithine LiOH (84 mg ; 3.5 mmol,
2 éq.) solubilisée dans une quantité minimum d'eau. Le mélange est laissé
12 heures sous agitation puis repris dans l'acétate d'éthyle. Le mélange est
acidifié avec une solution aqueuse d'acide chlorhydrique 1 N puis extrait
plusieurs fois avec de l'acétate d'éthyle. Les phases organiques sont
10 rassemblées, séchées sur sulfate de magnésium, filtrées puis concentrées
Le composé 6 est obtenu sous la forme d'une huile blanche avec un
rendement quantitative.
15 C36H36 F208 M= 634,66g.mol-1
RMN 19F (CDCI3, 282,5 MHz)
-117,3 (d, JF_F=259Hz) ; -119,0 (d, JF_F=259Hz).
RMN 'H (CDCI3, 300 MHz)
3,2 (dd; 4,5Hz et 9,8Hz ;1 H; H6) ; 3,5 (dd; 7,7Hz et 9,8Hz,1 H; H6) ; 3,7 (d;
2Hz; 1 H; H4) ; 3,8 (dd; 2,6Hz et 9,5Hz; 1 H; H3); 4 (dd; 4,5Hz et 7,7Hz ;1 H,
H5) ; 4,3-4,9 (m; 9H; H2 ; 4OCH2Ph) ; 7,2 (m; 20H; Har).
RMN 13C (CDCI3, 75,5 MHz)
69,4 (C6) ; 71,7 (C5) ; 73,5 (OÇHZPh) ; 74,0 (OCH2Ph); 74,1 (C4) ; 75,0
(OÇH2Ph) ; 75,1 (C2) ; 75,9 (OCH2Ph) ; 80,8 (C3) ; 95,4 (t, 27Hz, C1) ; 112,5
(t, 260Hz, ÇF2) ; 127,8 -129,0 (Çar.) ; 137,6 ; 138,0 ; 138,1 (Çar. quat.) ;
163,1 (t; 30Hz; ÇO2H).
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
16
Synthèse du composé 9 (Figure 6)
0
H
PhO N OCH2Ph
N
= H
O O
9 1-1
NHBoc
Dans un ballon sous atmosphère inerte contenant la 7-Lysine(Boc)-OH 8
(2 g; 5,26 mmol ; 1 éq.) dans le dichlorométhane (40 mL), le
carbonyldiimadozale CDI (878 mg ; 5,42 mmol ; 1,03 éq.) est additionné. La
réaction est laissée sous agitation pendant une heure. Puis à ce mélange est
ajouté une solution préparée sous atmosphère inerte et constituée de CI-
+H3N-AlanineOBn 7 (1,13g; 5,26 mmol ; 1 éq.), et de diisopropyléthylamine
DIEA (1,92 mL; 11,04 mmol ; 2, éq.) dans dichlorométhane (40 mL). La
réaction est poursuivie pendant 24 heures puis hydrolysée avec de l'eau et
extraite trois fois au dichlorométhane. Les phases organiques sont
rassemblées, séchées sur sulfate de magnésium, filtrées puis concentrées.
Le mélange est ensuite purifié par chromatographie sur une colonne de silice
avec comme éluant un mélange cyclohexane / acétate d'éthyle dans des
proportions de sept pour trois. Après concentration des fractions recueillies,
le produit 9 se présente sous la forme d'un solide jaune pâle avec un
rendement pondéral de 66%.
C32H37N307 M=544,5 g.mol"1
RMN ' H (CDCI3, 300 MHz)
1,3 (m; 16H; CH3; (CH3)3C; 2CH2) ;1,6-1,7 (m; 2H; CH2) ; 3,0 (m; 2H;
NHCH2) ; 4,1 (m; 1 H; CHLys) ; 4,5 (m; 1 H; CHAIa) ; 4,6 (m; 1 H; NH) ; 5,0
(s;
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
17
2H; OCH2Ph) ; 5,1 (m; 1 H; ZNH); 5,5 (d; 7Hz; 1H; NH) ; 6,8 (d; 6,5Hz;1 H;
NH) ; 7,3 (m; 5H; Har.).
RMN "C (CDCI3, 75,5 MHz)
18,4 (CH3) ; 22,6 (CH2) ; 28,8 ((CH3)3C) ; 29,8 (CH2) ; 32,6 (ÇH2) ; 40,1
(NÇH2) ; 48,6 (ÇHAIa) ; 54,9 (ÇHLys) ; 67,4 et 67,5 (2OÇH2Ph) ; 80,2
((CH3)3Ç) ; 128,5 -129 (Çar.) ; 135,6 et 136,6 (Çar. quat.) ; 156,6 (ÇO(Boc)
et ÇO(Z)) ; 171,8 et 172,9 (ÇONH et ÇO2Et).
Synthèse du composé 10 (Figure 7)
0
6 OH
O C OCH2Ph
BnO 5 l'
N
H
4 Ph O NH O
BnO 3 ~OBn
OBn 10 0
Déprotection du peptide
Dans un ballon sous atmosphère inerte contenant le peptide 9(1,8 g
3,36 mmol; 1 éq.) dans le dichlorométhane (40 mL) est introduit de l'acide
trifluoroacétique TFA (5 mL; 67,2 mmol ; 20 éq.). Le mélange est laissé à
réagir pendant 12 heures puis le milieu réactionnel est concentré. Quatre à
cinq co-évaporations au toluène sont effectuées pour obtenir le produit
déprotégé avec un rendement quantitatif.
Couplage
Dans uh ballon sous atmosphère inerte contenant l'acide 6 (1,38 g;
2,18 mmol ; 1,05 éq.), le peptide précédemment déprotégé (1,15 g;
2,08 mmol ; 1 éq.), le 1-hydroxybenzotriazole HOBT (0,336 g; 2,5 mmol ;
1,2 éq.) et la N-méthylmorpholine NMM (0,57 mL ; 5,2 mmol; 2,5 éq.) dans
le DMF (35 mL), l'EDCI (0,478 g ; 2,49 mmol ; 1,2 éq.) est ajouté. La réaction
est laissée sous agitation pendant 24 heures, puis le solvant est évaporé et
le milieu est repris dans le dichlorométhane. Le milieu est ensuite extrait
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
18
deux fois avec HCI 1 M (2*100 mL). La phase organique est collectée, séchée
sur sulfate de magnésium, filtrée puis concentrée.
Le mélange est ensuite purifié par chromatographie sur une colonne de silice
avec comme éluant un mélange cyclohexane/acétate d'éthyle. Après
concentration des fractions recueillies, le produit 10 se présente sous la
forme d'un solide blanc avec un rendement pondéral de 83%.
C60H65F2N3012 M=1058,17 g.mol"1
Rf : 0,48 (Cyclohexane/acétate d'éthyle 5/5).
RMN '9F (CDCI3, 282,5 MHz)
-116,9 (d, JF_F=259Hz) ; -121,7 (d, JF_F=259Hz).
RMN 'H (CDCI3, 300 MHz)
1,2-1,4 (m; 7H; 1CH3; 2CH2); 1,5 (m; 1H; CH2) ; 1,6 (m; 1H; CFi2); 3,0 et
3,2 (2m; 2H; NHCH2); 3,4 (m; 2H; H6); 3,8-3,9 (m; 2H; H3; H4); 4,0 (m; 2H;
CHNH (Lys); H5); 4,2-4,9 (m; 9H; 4OCH2Ph ; CH (Ala)); 4,2 (d; 9Hz; 1 H; H2);
5,0 (s; 2H; OCH2Ph) ; 5,1 (m; 1 H; ZNH); 5,4 (d; 7,8 ; 1 H; NH); 6,5 (d; 7,2
1 H; NH) ; 6,7 (s; 1 H; NH); 7,2 (m; 30H; Har.).
RMN 13C (CDCI3, 75,5 MHz)
18,3 (ÇH3) ; 22,4 (ÇH2) ; 28,7 (ÇH2) ; 32,5 (CH2) ; 39,3 (CH2N) ; 48,6 (CH
Ala) ; 54,9 (NCH Lys) ; 67,4 et 67,6 (2OÇH2Ph); 68,7 (C6) ; 71,2 (C5) ; 73,5
et 73,8 (2OCH2Ph) ; 74,4 (C4) ; 75,0 (OCH2Ph ; C2) ; 75,8 (OÇH2Ph) ; 80,9
(C3) ; 97,2 (t, 27Hz, C1) ; 113 (t, ÇF2); 127,9 -129 (Çar.) ; 135,7; 136,7;
138,2 ;138,3 ;138,7 ; 139,0 (Car. quat.) ; 156,0 (CO(Z)) ;163,7 (t, 28Hz,
CFZÇONH) ; 172,0 (CONH) ; 173,0 (CO2Bn).
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
19
Synthèse du composé 11 (Figure 8)
0
6' OH
F
HO O C N N OH
l'
Z, H
HO 4' "",,/"OH O NH3+CI- O
oH 11
H
O FZ H
H o H C N OH
N
HO HO,H
5 3 2 OH O NH3+CI'
6 H OH
5 Un ballon contenant le produit de départ 10 (150 mg ; 0,133 mmol ) dans un
mélange de tétrahydrofurane THF (3 mL) et d'HCI 1 N(2 mL) en présence
d'une pointe de spatule de palladium sur charbon Pd/C est placé sous
atmosphère d'hydrogène. Le mélange est laissé sous agitation pendant une
nuit puis filtré sur un filtre Millipore . Le mélange est ensuite concentré
pour
obtenir le produit 11 sous la forme d'un solide jaune orangé avec un
rendement de 92%.
C17H30CIF2N3O1o M=509,88 g.mol"1
RMN 19F (D20, 282,5 MHz)
-119,4 (d, JF_F=256Hz) ; -120,6 (d, JF_F=256Hz) ; -121,0 (d, JF_F=257Hz) ;
-122,0 (d, JF_F=257Hz).
RMN 'H (D20, 300 MHz)
1,4 (d; 7,3Hz; CH3) ; 1,4 (m; 2H; CH2); 1,5 (m; 2H; CH2) ; 1,8 (m; 2H; CH2);
3,2 (m; 2H; NHCH2); 3,5-3,6 (m; 2H6',2H6); 3,7 (m; H4 H5) ;3,8 (dd, 3,4Hz et
9,9Hz, H3') 3,9 (m; CH,H4',H5',H2'); 4,0 (t, 8,2Hz, H3); 4,3 (m; CH); 4,36 (d,
8,2Hz,H2).
NMR 13C (D20, 75,5 MHz)
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
16,2 (ÇH3) ; 21,5 (CH2) ; 28,0 (CH2) ; 30,7 (ÇH2) ; 39,3 (ÇH2N) ; 49,1 (ÇH) ;
53,2 (NCH) ; 61,1 (C6') ; 62,6 (C6) ; 67,0 (C5') ; 68,9 (C4') ; 70,6 (C3') ;
70,9
(C5) ; 72,5 (C2') ; 73,9 (C3) ; 75,5 (C2) ; 80,2 (C4) ; 169,9 et 176,3 (ÇO).
5 Synthèse du composé 12 (Figure 9)
O
_
6' OH
F
HO O C N OH
5 l' N
2, H
HO 4 3' """""OH o NH2 O
OH 12
H
O F2 H
HO H C N OH
N
HO HOH
5 3 2 OH 0 NH2
6 H OH
Dans un ballon, le composé 10 (0.81 mmol) est dissout dans un mélange
eau / tétrahydrofurane (1 : 1; 20 mL) et le palladium sur charbon et placé
10 sous une atmosphère d'hydrogène. Le mélange est agité pendant 2 jours à
température ambiante. Le mélange réactionnel est filtré, et concentré. Le brut
est repris avec du dichlorométhane (20 mL) qui est éliminé, puis avec de
l'eau (10 mL) qui est filtrée. La phase aqueuse est ensuite concentrée pour
ainsi laisser le produit désiré en tant qu'un solide blanc avec un rendement
15 de 54%.
C1$H3lF2N301o M=473,42 g.mol-1
RMN 19F (D20, 282MHz)
-119.3 (1 F, d, 2JF-F 255.5), 120.4 (1 F, d, 2JF-F 255.5)
20 -120.7 (1 F, d, 2JF-F 256.6), 121.8 (1 F, d, 2JF-F 255.5)
RMN 'H (D20, 300MHz)
1.31 (3H, d, 3JH11-H9 7=3, CFI3), 1.37-1.45 (2H, m, H CH2), 1.52-1.61 (2H, m,
CH2), 1.74-1.87 (2H, m, CH2), 3.25-3.31 (2H, m, NCH2), 3.57-3.75 (4H, m,
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
21
2H6',2H6,H4,H5), 3.82 (dd, 3JH_H 3.2, 3JH_H 9.7, H3'), 3.95-4.02
(CH,H4',H5',H2'), 4.08-4.17 (m, CH,H3), 4.39 (d, 3JH_H 8.3,H2),
RMN 13C (D20, 75MHz)
17.5 (CH3), 21.9 (CH2), 28.0 (CH2) 31.8 (ÇH2), 39.5 (NCH2), 51.5 (CH), 53.8
(CH), 61,1 (C6') ; 62,6 (C6) ; 67,1 (C5') ; 68,9 (C4') ; 70,6 (C3') ; 70,9
(C5) ;
72,4 (C2') ; 74,0 (C3) ; 75,6 (C2) ; 80,2 (C4) ; 96.1 (d, 2Jc, '_F 25.7), 98.9
(t,
2Jc, _F 28.6) (C1 et C1'), 114.0 (t, 2JcT_F 256.5, ÇF2), 163.9 (t, 2JCW_F
28.0,
CF2CO), 169,9 et 176,3 (CO).
Spectrométrie de masse :ESI+ : 496 (MH+Na)+, 474 (MH)+.
Synthèse du composé 14 (Figure 10)
0
PhO N OCH3
N
= H
O O
14
NHBoc
Dans un ballon sous atmosphère inerte contenant la Z-Lysine(NHBoc)-OH 8
(5 g; 13,14 mmol ; 1 éq.) dans le dichlorométhane (50 mL), le
carbonyldiimadozale CDI (2,56 g; 15,8 mmol ; 1,2 éq.) est additionné. La
réaction est laissée sous agitation pendant une heure. Puis à ce mélange est
ajouté une solution préparée sous atmosphère inerte et constituée de CI"
+H3N-AlanineOMe 13 (1,84g; 13,14 mmol ; 1 éq.), et de
diisopropyléthylamine DIEA (4,8 mL; 27,6 mmol ; 2,1 éq.) dans
dichlorométhane (50 mL). La réaction est poursuivie pendant 24 heures puis
une solution d'acide chlorhydrique 1 N(50 mL) est additionnée, puis le
mélange est extrait avec du dichlorométhane (3 x 50 mL). Les phases
organiques sont lavées avec une solution saturée de NaCI (100 mL),
séchées sur MgSO4 et concentrées sous vide pour laisser le composé 14
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
22
sous la forme d'un solide blanc qui est utilisé directement dans la suite de
la
synthèse avec un rendement de 99%.
C23H35N307 M=465,5 g.mol-1
Rf = 0.43, éluant : cyclohexane / acétate d'éthyle (1 : 1).
RMN 1H (CDCI3, 300 MHz)
1.30 (d, 3H, 3j H12-H9 7.4, CH3;), 1.33-1.45 (m, 12H, (ÇH3)3C; CH2), 1.52-1.69
(m, 2H, CH2), 1.76-1.82 (m, 1H, CH2), 3.00-3.08 (m, 2H, NCH2), 3.66 (s, 3H,
CH3), 4.25 (m, 1 H, (ÇH), 4.48 (qt, 1 H, 3j H9-H12 7.4, (ÇH), 5.03 (s, 3H,
OCH2Ph, NH), 6.03 (d, 1 H, 3JNH-H6 7=8, NH), 7.22-7.31 (m, 6H, HAr, NH).
RMN 13C (CDCI3, 75,5 MHz)
18,0 (CH3) ; 22,6 (ÇH2) ; 28,8 ((CH3)3C) ; 29,7 (ÇH2) ; 32,7 (CH2) ; 40,2
(NCH2); 48,4 (ÇH(Ala)) ; 52,7 (ÇH(Lys)) ; 67,2 (OCH2Ph) ; 79,3 ((CH3)3Ç) ;
128,3 ; 128,4(2C) ; 128,8 (2C) (Car.) ; 136,6 (Çar. quat.) ; 156,6 et 156,7
(ÇO(Boc) et ÇO(Z)) ; 172,4 et 173,6 (CONH et ÇO2Et).
Synthèse du composé 15 (Figure 11)
O
6 OH
F
B O O YN OMe
5 1 N
2 H
Bn0 4 3 ~sOBn O PhO NH O
OBn 15 O
Déprotection du peptide
Dans un ballon sous atmosphère inerte contenant le peptide 14 (6 g
13 mmol; 1 éq.) dans le dichlorométhane (100 mL) est introduit de l'acide
trifluoroacétique TFA (20 mL; 263 mmol ; 20 éq.). Le mélange est laissé à
réagir pendant 12 heures puis le milieu réactionnel est concentré. Quatre à
cinq co-évaporations au toluène sont effectuées pour obtenir le produit
déprotégé avec un rendement quantitatif.
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
23
Couplage
Dans un ballon sous atmosphère inerte contenant l'acide 6 (2,15 g
2,49 mmol ; 1,0 éq.), le peptide précédemment déprotégé (1,20 g;
2,49 mmol ; 1 éq.), le 1-hydroxybenzotriazole HOBT (0,37 g; 2,75 mmol ;
1,1 éq.) et la N-méthylmorpholine NMM (0,83g; 8,22 mmol ; 3,3 éq.) dans le
DCM (100 mL), l'EDCI (0,53 g; 2,75 mmol ; 1,1 éq.) est ajouté après 15
minutes. La réaction est laissée sous agitation pendant 24 heures, puis L'eau
(100 mL) est ajoutée ainsi que du dichlorométhane, et la phase aqueuse est
extraite avec du DCM (3 x 100 mL). Les phases organiques sont lavées avec
une solution saturée de NaCI (200 mL), séchées sur MgSO4 et concentrées
sous vide pour laisser un solide beige.
Le résidu est purifié par chromatographie sur gel de silice avec un mélange
cyclohexane / AcOEt (1 : 1) comme éluant pour donner le produit 15 pur
sous forme d'un solide blanc avec un rendement de 38 %
C54H61 F2N3012 M=982,07g.mol-1
Rf = 0.27, éluant : cyclohexane / acétate d'éthyle (1 : 1).
RMN 19F (CDCI3, 282MHz)
-117.0 (1 F, d, 2JF-F 258.0), -121.9 (1 F, d, 2JF-F 258.0).
RMN 1H (CDCI3, 300MHz)
1.31 (d, 3H, 3JH12-H9 7.1, CI-I3), 1.30-1.78 (m, 6H, 3CH2), 3.05-3.38 (m, 2H,
NCH2), 3.42-3.51 (m, 2H, H6), 3.66 (s, 3H, OCH3), 3.88 (m, 2H), 4.10 (m,
1 H), 4.28 (d, 1 H, J 9.0), 4.39-4.55 (m, 4H), 4.68-4.92 (m, 5H), 5.02-5.06
(m,
2H), 5.40 (d, 1H, 3J7.9, NH), 6.35 (d, 1H, 3J7.2, NH), 6.78 (Is, 1H, NH),
7.22-7.29 (m, 25H, HAr).
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
24
Synthèse du composé 16 (Figure 12)
0
6, OH
F
OMe
HO O C N H 'y
N
2,
HO 4 "~~'~~OH O NH3+CI- O
3'
OH 16
H
O F2 H
HO H 1 C N OM
N
HOH
HO
5 3 2 OH O NH3+CI'
6 H H OH
5 Un ballon contenant le produit de départ 15 (497 mg ; 0,488 mmol ) dans un
mélange de tétrahydrofurane THF (10 mL) et d'HCI 1 N (1,2eq.) en présence
d'une pointe de spatule de palladium sur charbon Pd/C est placé sous
atmosphère d'hydrogène. Le mélange est laissé sous agitation pendant une
nuit puis filtré sur un filtre Millipore . Le mélange est ensuite concentré
pour
obtenir le produit 16 sous la forme d'un solide blanc avec un rendement de
87%.
C1$H32CIF2N3010 M=523,5 g.mol"1
RMN 19F (D20, 282MHz)
-119.1 (1 F, d, 2JF_F 256.4), -120.5 (1 F, d, 2JF_F 256.4),
-120.3 (1 F, d, 2JF_F 256.4), -121.7 (1 F, d, 2JF-F 256.4).
RMN 'H (D20, 300MHz)
1.37-1.48 (m, 5H, CH3,CH2), 1.54-1.65 (m, 2H, CFi2), 1.72-1.91 (m, 2H, CH2),
3.24-3.32 (m, 2H, NCH2), 3.59-3.85 (m), 3.96-4.02 (m), 4.13 (, 1 H, 3J 7.9,
H2).
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
Synthèse du composé 19 (Figure 13)
0
H
N
ZHN OMe
O
19
NHBoc
5 Dans un ballon sous atmosphère inerte contenant la Z-AIa-OH 17 (752 mg ;
3.37 mmol ; 1.0 éq.) dans le dichlorométhane (15 mL), le
carbonyldiimadozale CDI (656 g; 4,05 mmol ; 1,2 éq.) est additionné. La
réaction est laissée sous agitation pendant une heure. Puis à ce mélange est
ajouté une solution préparée sous atmosphère inerte et constituée de CI-
10 +H3N-Lys(NHBoc)OMe 18 (1g; 3,37 mmol ; 1 éq.), et de
diisopropyléthylamine DIEA (1,25 mL; 7,1 mmol ; 2,1 éq.) dans
dichlorométhane (15 mL). La réaction est poursuivie pendant 24 heures Une
solution d'acide chlorhydrique 1 N(20 mL) est additionnée, puis le mélange
est extrait avec du dichlorométhane (3 x 20 mL). Les phases organiques sont
15 lavées avec une solution saturée de NaCI (50 mL), séchées sur MgSO4 et
concentrées sous vide pour laisser un solide blanc. Le résidu est purifié sur
colonne chromatographique sur gel de silice avec un mélange cyclohexane /
acétate d'éthyle (1 : 1) comme éluant afin d'isoler le produit 19 pur sous
forme d'un solide blanc avec un rendement de 72%.
20 C23H35N307 M=465,5 g.mol-1
Rf = 0.25, éluant : cyclohexane / acétate d'éthyle (1 : 1).
RMN 'H (CDCI3, 300 MHz)
1.38 (d, 3H, 3J 6,8, CH3;), 1.25-1.84 (m, 6H, 3CH2), 1,42 (s, 9H, C(CH3)3),
3.02-3.09 (m, 2H, NCH2), 3.72 (s, 3H, OCH3), 4.29 (tapp., 6,8Hz, 1H, CH),
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
26
4.54-4,58 (m, 1 H, CH), 4,77 (Is, 1 H) ; 5.1 (s, 2H, OCH2Ph), 5,56 (s, 1 H,
NH),
6.71 (d, 1H, 3J 7.5, NH), 7.33 (m, 5H, HAr).
Synthèse du composé 20 (Figure 14)
O OMe
O
6 OH
F
O
Bn0 5 C N NHZ
N
n=4H
4 =
-
Bn0 3 2 '"~~//OBn 0
OBn
Déprotection du peptide
Dans un ballon sous atmosphère inerte contenant le peptide 19 (1 éq.) dans
10 le dichlorométhan est introduit de l'acide trifluoroacétique TFA (20 éq.).
Le
mélange est laissé à réagir pendant 12 heures puis le milieu réactionnel est
concentré. Quatre à cinq co-évaporations au toluène sont effectuées pour
obtenir le produit déprotégé avec un rendement quantitatif.
Couplage
15 Dans un ballon sous atmosphère inerte contenant l'acide 6 (1,26 g;
2,0 mmol ; 1,0 éq.), le peptide précédemment déprotégé (0,95 g; 2,0 mmol ;
1 éq.), le 1-hydroxybenzotriazole HOBT (0,29 g; 2,25 mmol ; 1,1 éq.) et la N-
méthylmorpholine NMM (0,28g; 3 mmol ; 1,5 éq.) dans le DMF (35 mL),
l'EDCI (0,44 g; 2,0 mmol ; 1,1 éq.) est ajouté après 15 minutes. La réaction
20 est laissée sous agitation pendant 24 heures puis concentrée. Une solution
d'HCI 1 N(20 mL) est ajoutée ainsi que du dichlorométhane, et la phase
aqueuse est extraite avec du DCM (3 x 30 mL). Les phases organiques sont
lavées avec une solution saturée de NaCI (50 mL), séchées sur MgSO4 et
concentrées sous vide.
Le résidu est purifié par chromatographie sur gel de silice avec un mélange
cyclohexane / AcOEt (1 : 1) comme éluant pour donner le produit 20 pur
sous forme d'un solide blanc avec un rendement de 33 %.
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
27
C541-161 F2N3012 M=982,07g.mol-1
Rf = 0.30, éluant : cyclohexane / acétate d'éthyle (1 : 1).
RMN 19F (CDCI3, 282MHz)
-117.8 (1 F, d, 2JF_F 259.2), -120.3 (1 F, d, 2JF_F 259.2).
RMN 1H (CDCI3, 300MHz)
1.32 (d, 3H, 3J 7.0, CIi3), 1.35-1.80 (m, 6H, 3CH2), 2,92-3,18 (m,1H, NCH2),
3,25-3,36 (m,IH, NCH2), 3.51 (d, 6,5Hz, 2H, H6), 3.71 (s, 3H, OCH3),
3.88-3,96 (m, 2H, H3, H4), 4.13 (t, 2,3Hz, 1H, H5), 4.15-4,26 (m, 1H, CH),
4.33 (d, 10Hz, 1H, H2); 4.42 (d, 2H, OCH2Ph), 4.45-4.52 (m, 1H, CH), 4.58
(d, 1H, 2J 11.5, OCH2Ph), 4.71 (s, 2H, OCH2Ph), 4.77 (d, 1H, 2J 10.2,
OCH2Ph), 4.85 (d, 1H, 2J 10.2, OCH2Ph), 4.95 (d, 1H, 2J 11.5, OCH2Ph),
5.05 (s, 2H, OCH2Ph), 5.32 (d, 1 H, 3J7.6, NH), 5.32 (s, 1 H, OH), 6.67 (d, 1
H,
3J 7.4, NH), 6.93 (Is, 1H, NH), 7.21-7.38 (m, 25H, HA,).
RMN 13C (CDCI3, 75MHz)
18,4 (ÇH3) ; 21,9 (CH2) ; 28,2 (CH2) ; 31,2 (CH2) ; 38,6 (CH2N) ; 50,6 (ÇH) ;
52,1 (CH) ; 52,6 (OCH3); 67,1 (OCH2Ph); 68,6 (C6) ; 70,9 (C5) ; 73,3 et 73,5
(2OÇH2Ph) ; 74,1 (C4) ; 74,7 (OÇH2Ph) ; 74,8 (C2) ; 75,6 (OCH2Ph) ; 80,7
(C3) ; 96,7 (t, 25,7Hz, Cl); 127,7; 127,8; 127,9; 128,0; 128,1; 128,2; 128,4
(2C); 128,6; 128,7 (Car.) ; 136,3; 137,9; 138,0 ;138,4 ;138,7 (Car. quat.) ;
164 (CF2CONH) ; 172,6 (CONH) ; 172,7 (ÇO2Me).
Synthèse du composé 21 (Figure 15)
O OH
6 OH O
_
5 _ F
Bn0 O C~N NHZ
1 -
=4H
4 =
Bn0 3 2 OBn 0
_
21
OBn
Dans un ballon sous atmosphère inerte contenant le composé 20 (575 mg ;
0.586 mmol ; 1 éq.) en solution dans le tétrahydrofurane (8 mL), une solution
aqueuse de lithine (2M ; 2 éq.) est ajoutée et le mélange est agité pendant la
nuit à température ambiante. Le milieu est acidifié avec une solution d'HCI
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
28
1 M(10 mL) puis extrait avec de l'acétate d'éthyle (3 x 10 mL), et les phases
organiques sont combinées, lavées avec une solution saturée de NaCI (20
mL) et concentrées directement. L'acide 21 est isolé ainsi comme un solide
jaune pâle qui peut être utilisée directement pour la prochaine étape sans
purifications supplémentaires avec un rendement brut de 81%.
C53H59F2N3012 M=961 g.mol-,
RMN 19F (CDCI3, 282MHz)
-118.1 (1 F, d, 2JF_F 258.6), -119.9 (1 F, d, 2JF_F 258.6).
RMN 'H (CDCI3, 300MHz)
1.29 (tapp., 3H, 3J 9,7, CH3), 1.10-1.41 (m, 4H, 2CH2), 1.50-1.72 (m, 2H,
CH2), 2,88-2,95 (m, 1 H, NCH2), 3,22-3,32 (m,1 H, NCH2), 3.49 (dapp, 6,0Hz,
2H, H6), 3.89-3,92 (m, 2H, H3, H4), 4.13 (t, 6Hz, 1H, H5), 4.22-4,43 (m, 3H,
2CH, H2); 4.38 (d, 2H, OCH2Ph), 4.54 (d, 1 H, 2J 11.5, OCH2Ph), 4.67 (s, 2H,
OCH2Ph), 4.73 (d, 1 H, 2J 10.2, OCH2Ph), 4.81 (d, 1 H, 2J 10.2, OCH2Ph),
4.91 (d, 1H, 2J 11.4, OCH2Ph), 4,97 (s, 2H, OCH2Ph), 5.62 (d, 1 H, 3J7.7,
NH), 7,07 (Is, 2H, 2NH), 7.18-7.32 (m, 25H, HAr).
RMN '3C (CDCI3, 75MHz)
19,0 (CH3) ; 22,4 (CH2) ; 28,8 (CH2) ; 30,9 (CH2) ; 39,0 (CH2N) ; 50,9 (ÇH) ;
52,9 (CH) ; 67,6 (OÇH2Ph); 69,0 (C6) ; 71,2 (C5) ; 73,7 et 73,9 (2OÇH2Ph) ;
74,6 (C4) ; 75,1 (OCH2Ph) ; 75,3 (C2) ; 75,9 (OCH2Ph); 81,0 (C3) ; 97,1 (t,
27,4Hz, C1) ; 128,1; 128,3; 128,5; 128,7; 128,8; 129,0; 129,1 (Çar.) ; 136,7;
138,2; 138,4 ;138,7 ;138,9 (Car. quat.) ; 164,9 (CF2CONH) ; 174,1 (ÇONH) ;
175,1 (ÇO2H).
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
29
Synthèse du composé 22 (Figure 16)
O OH
OH O
__
F
HO O C N NH3*CI'
1 ~
n=H
4 =
H O =
HO 3 z,~~'11~O
22
O
OH OH
0
H
0 C H
HO H NH3*GI'
HO HO, 4 n=4 H
3 2 OH O =
6 H OH
5 Un ballon contenant le produit de départ 21 (458 mg ; 0,473 mmol ) dans un
mélange de tétrahydrofurane THF (15 mL) et d'HCI 1N (1,2eq.) en présence
d'une pointe de spatule de palladium sur charbon Pd/C est placé sous
atmosphère d'hydrogène. Le mélange est laissé sous agitation pendant une
nuit puis filtré sur un filtre Millipore . Le mélange est ensuite concentré
pour
obtenir le produit 16 sous la forme d'un solide blanc avec un rendement de
82%.
C17H30CIF2N3010 M=509 g.mol-1
RMN '9F (D20, 282MHz)
-116.7 (1 F, d, 2JF_F 256.4), -117.8 (1 F, d, 2JF_F 256.4),
-118.2 (1 F, d, 2JF_F 256.4), -119.3 (1 F, d, 2JF_F 256.4).
RMN ' H (D20, 300MHz)
1.51 (3H, d, 3J 7.1 Hz, CFI3), 1.,25-1.90 (6H, m, 3CH2), 3.25-3.32 (2H, m,
NCH2), 3.59-3.74 (m, 2H6',2H6,H4,H5), 3.81-4,17 (m, H3',CH,H4',H5',H2'),
4.32-4,41 (m, CH,H3,H2),
RMN 13C (D20, 75MHz)
18,4 (ÇH3), 24,1 (CH2), 29,5 (CH2) 31.7 (ÇH2), 41,1 (NCH2), 50,8 (ÇH), 54,6
(ÇH), 62,7 (C6') ; 64,2 (C6) ; 68,7 (C5') ; 70,5 (C4') ; 72,2 (C3') ; 72,5
(C5) ;
74,1 (C2') ; 75,6 (C3) ; 77,2 (C2) ; 81,9 (C4) ; 172,8 (CO).
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
Synthèse du composé 24 (Figure 17)
ZHN"'n'N~CO2Bn
= H
24
NHBoc
5
Dans un ballon sous atmosphère inerte contenant la Z-Orn(Boc)-OH 23 (1,00
g; 2,73 mmol; léq) dissout dans le dichlorométhane (13 mL), le
carbonyldiimidazole (532 mg; 3,28 mmol; 1,2 éq) est ajouté par petites
portions. Le milieu est agité pendant uné heure. Puis sur ce produit est
10 additionné une solution préparée sous atmosphère inerte et constituée du CI-
+H3N-Ala-OBn 7(589 mg ; 2,73 mmol ; léq) et de DIEA (947pL ; 5,73 mmol ;
2,1 éq) dans le dichlorométhane (13 mL). Ce mélange est agité pendant 12
heures. Le milieu est hydrolysé avec une solution d' acide chlorhydrique 1 N,
puis la phase acqueuse obtenue est extraite trois fois au dichlorométhane.
15 Les phases organiques sont rassemblées, séchées sur MgSO4, filtrées, puis
concentrées. Le brut est chromatographié sur colonne de silice (Eluant
Cyclohexane/ Acétate d'éthyle 50/50) pour obtenir le composé 24 sous la
forme d'un solide blanc avec un rendement de 70%.
C28H37N307 M=527,62 g.mol-1
20 Rf : 0,44 (Cyclohexane/Acétate d'éthyle 50/50).
RMN 1H (CDC13, 300 MHz) :
1,4 (m, 12H, C(CH3)3 ,CH3); 1,47-1,53 (m, 2H, CH ); 1,80-1,87 (m, 2H, CH2) ;
3,01-3,33 (m, 1H, CH NH) ; 3,31-3,33 (m, 1H, CH2NH) ; 4,4 (m, 1H, CH(Orn)) ;
4,55-4,62 (m, 1H, CH(Ala)) ; 4,73 (m, 1H, BocNH) ; 5,08 (s, 2H, OCH Ph) ; 5,08-
25 5,11 (m, 1H, OCH2Ph) ; 5,18 (d, 1H, OCH Ph 2JH_H=12,2Hz) ; 5,6 (m, H, ZNH)
; 7,0
(m, 1H, NH) ; 7,29-7,37 (m, 10H, Haz)
RMN 13C (CDC13, 75,51VHz) :
17,8 (ÇH3) ; 26,3 (ÇH2) ; 28,5 (C(ÇH3)3) ; 30,5 (ÇHZ) ; 39,2 (ÇH2NH) ; 48,5
(ÇH(Ala)) ; 53,6 (ÇH(Orn)) ; 67,3 et 67,5 (2 OÇH2Ph) ; 79,4 (Ç(CH3)3 ; 128,2;
30 128,3 (2C); 128,5; 128,6; 128,7 (Çar) ; 135,5; 136,4 (Çar.quat) ; 156,4 et
156,8
(ZCO et BocÇO); 171,8 et 172,5 (ÇONH et C02)
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
31
M(ES+) :[M+H]+=528,87 ;[M+Na]+=551,00 ;[M+K]+=566,73 ;[2M+Na]+=1077,5
et [2M+K]+=1093,13
Synthèse du composé 25 (Figure 18)
O
ZHN~NCO Bn
= H 2
~HCF2 NH
BnO ~ 25
6 V~2à
BOBn O
OOBn
Déprotection du peptide
Dans un ballon sous atmosphère inerte contenant le peptide 24 (563 mg
0,80 mmol ;1 éq) dissout dans le dichlorométhane (11 mL), I' acide
trifluoroacétique (1,9 mL ;25,7 mmol; 20 éq) est ajouté. La solution est
agitée
pendant 12 heures. Le milieu réactionnel est concentré puis coévaporé 4 à 5
fois au toluène . Le résidu est trituré au tert-butylméthylether et enfin
filtré et
le peptide déprotégé est obtenu avec un rendement de 72%.
Couplage
Dans un ballon sous atmosphère inerte contenant l'acide 6 (508 mg ; 0,80
mmol ; 1éq) le peptide précédemment déprotégé (433 mg ; 0,80 mmol ; 1éq)
dans le diméthylformamide (8 mL), sont ajoutés I' HOBT (119 mg ; 0,88
mmol ; 1,1 éq) puis la NMM (220 pL; 2,00 mmol; 2,5 éq). Puis après 15
minutes, I' EDCI (169 mg; 0,88 mmol; 1,1 éq) est introduite. La solution est
agitée pendant 48 heures.
Le solvant est évaporé. Le résidu est repris au dichlorométhane puis
hydrolysé avec une solution d'acide chlorhydrique 1 N. La phase acqueuse
est extraite trois fois au dichlorométhane. Les phases organiques, une fois
rassemblées sont séchées sur MgSO4, filtrées puis concentrées. Le brut
ainsi obtenu est chromotographié sur colonne de silice pour conduire au
composé 25 sous la forme d'un solide blanc avec un rendement de 27%.
C59H63F2N3012 M=1044,17 g.mol-1
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
32
Rf=0,44 (Eluant Cyclohexane/Acétate d' éthyle 50/50)
RMN '9F (CDCI3), 282,5MHz:
-117,7 (d, 2JF-F=260Hz) ; -120,3 (d, 2JF-F=260Hz)
RMN 1H (CDC13, 300 MHz) :
1,33 (d, 3H, CH , 3JH-H=7,3Hz) ; 1,41-1,49 (m, 2H, CH ); 1,73-1,81 (m, 2H, CH
3,0 (m, 1H, CH NH) ; 3,47-3,64 (in, 3H, 2H6 et CH NH) ; 3,93-3,96 (m, 2H, H3
et
H) ; 4,18 (t, 1H, H5~ 3JH5-H6=6,5Hz) ; 4,36 (d, 1H, H, 3JH2-H3=9,5 Hz) ; 4,39-
4,54
(m, 4H, CH(Orn), CH(Ala) et OCH2Ph) ; 4,59 (d, 1H, OCHPh, 2JH-H=11,4 Hz) ;
4,75 (s, 2H, OGH Ph) ; 4,80 (d, 1H, OCHPh, 2JH_H=10,3 Hz) ; 4,89 (d, 1H,
OCH Ph, 2JH-H=10,3 Hz) ; 4,96 (d, 1H, OCH Ph, 2JH-H=11,4 Hz) ; 5,07 (s, 2H,
OCH Ph) ; 5,11 (s, 2H, OCHPh) ; 5,2 (s, 1H, OH) ; 5,53 (d, 8,1Hz, 1H, ZNII ;
6,7
(d, 7,2Hz, 1H, NH); 7,1 (m, 1H, NI-I ; 7,27-7,34 (m, 30H, H~)
RMN 13C (CDC13, 75,5 MHz) :
17,6 (ÇH3) ; 24,8 (ÇH2) ; 30,0 (ÇH2) ; 37,9 (ÇH2N) ; 48,3 (ÇH(Ala)) ; 52,3
(ÇH(Orn)) ; 67,0 et 67,3 (2 OCH2Ph) ; 68,4 (Ç6) ; 70,7 (Ç5) ; 73,2 et 73,4 (2
OÇH2Ph) ; 74,0 (Ç4) ; 74,7 (OÇH2Ph) ; 74,7 (C ) ; 75,5 (OÇH2Ph) ; 80,7 (C ) ;
96,7
(t, Çi 1Jc-F=27,6 Hz) ; 127,7; 127,8; 128,1 (2C); 128,2; 128,3; 128,4; 128,5;
128,6
(3C); 128,7 (Çar) ; 135,4; 136,4; 137,7; 137,9; 138,3; 138,6 (Çquat) ; 156,3
(ZNHÇO) ; 164,3 (t, CF2ÇO, ZJC-F=28,2Hz) ; 171,6 et 173,2 (ÇONH et Ç02)
M(ES+) :[M+H]+ = 1044,33 et [M+Na]+=1066,47 et [M-H2O]+=1026,27
Analyse élémentaire : Théorique %C 67,87 %H 6,08 %N 4,02
Expérimentale %C 67,96 %H 6,39 %N 3,46
Synthèse du composé 26 (Figure 19)
0
6, OH
O C F OH
N N
H
5
HO y
2 NH3+CI- O
HO 4 ~~~~~~OH 0
3'
OH O 26
"
O FZ H OH
C` /N N
HO ~I/
HO HO/sO
NH3'CI' 0
5 3 OH p
6 " H OH
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
33
Dans un ballon contenant le composé 25 (104 mg; 0,0996 mmol; léq)
dissout dans le THF (10 mL), l'acide chlorhydrique 1N (0,13 mL; 0,129
mmol ; 1,3 éq), puis une pointe de spatule de Pd/C sont ajoutés. Le solution
est placée sous atmosphère d' hydrogène et agitée pendant 48 heures.
Le milieu est filtré sur millipore puis concentré et le composé 26 est obtenu
sous la forme d'un solide jaune pâle avec un rendement de 97%.
C16H28CIF2N3010 M=495,86 g.mol-1
RMN 19F (D20, 282,5 MHz)
-119,4 (d, JF_F=256Hz) ; -120,6 (d, JF_F=256Hz) ; -121,0 (d, JF_F=257Hz) ;
-122,1 (d, JF_F=257Hz).
RMN 1 H(D2O, 300 MHz)
1,43 (d; 6,7Hz; CFI3) ; 1,66-1,78 (m; 2H; CH2); 1,92 (m; 2H; CH2) ; 3,34 (m;
2H; NHCH2); 3,64-3,71 (m; 2H6',2H6); 3,75-3,77 (m; H4 H5) ;3,83-3,86 (m,
H3') 3,99-4,03 (m; CH(Orn),H4',H5',H2'); 4,16 (t, 7,5Hz, H3); 4,4-4,43 (m;
CH, H2).
NMR 13C (D20, 75,5 MHz)
16,2 (CH3) ; 20,8 (ÇH2) ; 23,8 (CH2) ; 39,0 (CH2N) ; 49,1 (CH(Ala)) ; 53,2
(ÇH(Orn)) ; 61,1 (C6') ; 62,5 (C6) ; 67,0 (C5') ; 69,0 (C4') ; 70,6 (C3') ;
71,0
(C5) ; 72,5 (C2') ; 74,0 (C3) ; 75,5 (C2) ; 80,2 (C4) ;96,3 et 98,8 (Cl et
C1');
113,9 et 117,4 (ÇF2) ; 169,6 et 176,3 (CO).
M(ES+) : : [M+H]+ = 461,2 et [M+Na]+=483,3 et [M-H2O]+=441,3
Synthèse du composé 28 (Figure 20)
0
PhO OCHpPh
\\H~
O O
28
NHBoc
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
34
Dans un ballon sous atmosphère inerte contenant la Z-Lys(Boc)-OH 8(1,90
g; 5,00 mmol; léq) dissout dans le dichlorométhane (25 mL), le
carbonyldiimidazole (973 mg; 6,00 mmol; 1,2 éq) est ajouté par petites
portions. Le milieu est agité pendant une heure. Puis sur ce produit est
additionné une solution préparée sous atmosphère inerte et constituée du CI"
+H3N-Gly-OBn 27 (1,00 mg ; 5,00 mmol ; léq) et de DIEA (1,7 mL; 10,50
mmol ; 2,1 éq) dans le dichlorométhane (25 mL). Ce mélange est agité
pendant 12 heures. Le milieu est hydrolysé avec une solution d'acide
chlorhydrique 1 N, puis la phase aqueuse obtenue est extraite trois fois au
dichlorométhane. Les phases organiques sont rassemblées, séchées sur
MgSO4, filtrées, puis concentrées.
Le brut est chromatographié sur colonne de silice (Eluant
Cyclohexane/Acétate d' éthyle 50/50) pour obtenir le composé 28 sous la
forme d'un solide blanc avec un rendement de 89%.
C28H37N307 M=527,62g.mol-1
Rf : 0,41 (Acétate d' éthyle).
RMN 1H (CDC13, 300 MHz) :
1,40 (s, 13H, C(CH )3, 2CH ,); 1,67 (m, 1H, CH ); 1,82 (m, 1H, CH:?) ; 3,07
(m, 2H,
CH NH(Lys)) ; 4,04 (m, 2H, CH (G1y)) ; 4,21-4,23 (m, 1H, CH(Lys)) ; 4,71 (m,
1H,
BocNH) ; 5,08 (s, 2H, OCH2Ph) ; 5,16 (s, 2H, OCH Ph) ; 5,66 (d, 7,3Hz, 1H, ZNI-
I ;
6,85 (m, 1H, NH) ; 7,30 (m, 10, Har).
RMN 13C (CDC13, 75,5 MHz) :
22,4 (ÇH2) ; 28,5 (C(CH3)3) ; 29,7 (LH2) ; 32,0 (ÇH2) ; 39,8 (ÇH2NH(Lys)) ;
41,1
(ÇH2NH(Gly)) ; 54,8 (LH(Lys)) ; 67,2 et 67,3 (OCH2Ph) ; 79,3 (Ç(CH3)3) ;
128,2;
128,3; 128,5; 128,6; 128,7 (3C) (Ç~ ); 135,2; 136,2 (Çquat) ; 156,4 (_CO);
169,67 et
172,3 (ÇONH et C02)
M ES+ :[M+H]+ = 528,53 et [M+Na]+=550,53 et [M+K]+=566,27
Analyse élémentaire : Théorique %C 63,74 %H 7,07 %N 7,96
Expérimentale %C 63,71 %H 7,03 %N 7,85
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
Synthèse du composé 29 (Figure 21)
6 OH 0
_ F
BnO O C N OCH2Ph
5 N
2 H
Bn0 4 g ""//iOBn O PhO NH O
joBn 29 0
Déprotection du peptide
5 Dans un ballon sous atmosphère inerte contenant le peptide 28 (2,04 g ; 3,87
mmol ; léq) dissout dans le dichlorométhane (32 mL), l' acide
trifluoroacétique (5,7 mL ;77,3 mmol; 20 éq) est ajouté. La solution est
agitée
pendant 12 heures. Le milieu réactionnel est concentré puis co-évaporé 4 à 5
fois au toluène pour conduire au peptide déprotégé avec un rendement
10 quantitatif.
Couplage
Dans un ballon sous atmosphère inerte contenant l'acide 6(317mg ; 0,50
mmol ; 1éq) le peptide précédemment déprotégé (271 mg ; 0,50 mmol ; 1éq)
dans le diméthylformamide (5 mL), sont ajoutés I' HOBT (74 mg ; 0,55
15 mmol ; 1,1 éq) puis la NMM (137 pL; 1,25 mmol ; 2,5 éq). Puis une fois
après 15 minutes, I' EDCI (105 mg; 0,55 mmol; 1,1 éq) est introduite. La
solution est agitée pendant 48 heures. Le solvant est évaporé. Le résidu est
repris au dichlorométhane puis hydrolysé avec une solution d'acide
chlorhydrique 1 N. La phase aqueuse est extraite trois fois au
20 dichlorométhane. Les phases organiques, une fois rassemblées sont
séchées sur MgSO4, filtrées puis concentrées. Le brut ainsi obtenu est
chromotographié sur colonne de silice (Eluant Cyclohexane/Acétate d'éthyle
50/50) pour conduire au composé 29 sous la forme d'un solide blanc avec un
rendement de 47%.
25 C59H63F2N3012 M=1044,17 g.mol-'
Rf=0,47 (Eluant Cyclohexane/Acétate d'éthyle 50/50)
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
36
RMN 19F (CDCI3), 282,5MHz :
-116,6 (d, 2JF_F=260Hz) ; -122,1 (d, 2JF_F=261Hz)
RiyIN 1H (CDC13, 300 MHz) :
1,30-1,81 (m, 6H, 3CH ); 3,05-3,11 (m, 1H, CH NH(Lys)) ; 3,31-3,38 (m, 1H,
CH2NH(Lys)) ; 3,55 (d, 2H, H6, 2J=6,2 Hz) ; 3,86-4,04 (m, 4H, H, H4 et
CH2(Gly));
4,16-4,20 (m, 2H, 115 et CH(Lys)) ; 4,33 (d, 1H, H2, 3JH2_H3=10,0Hz) ; 4,44
(d, 1H,
OCH2Ph, 2JH_H=12,0 Hz) ; 4,49 (d, 1H, OCH Ph, 2JH_H=12,0 Hz) ; 4,57 (d, 1H,
OCH Ph, 2JH_H=11,2Hz) ; 4,74 (s, 2H, OCII Ph) ; 4,79 (d, 1H, OCH Ph, 2JH_
H=10,3Hz) ; 4,87 (d, 1H, OCH Ph, 2JH_H=10,3Hz) ; 4,97 (d, 1H, OCHZPh, 2JH_
H=11,2Hz) ; 5,12 (s, 2H, OCH2Ph) ; 5,17(s, 2H, OCHPh) ; 5,53 (d, 1H, NHZ, 3JH_
H=7,4Hz) ; 6,57 (m, 1H, NH(Gly)) ; 6,93 (m, 1H, NH) ; 7,28-7,35 (m, 30H, IIar)
RMN 13C (CDC13, 75,5 MHz) :
21,9 (ÇH2) ; 28,2 (ÇHZ) ; 31,8 (CH2) ; 38,9 (ÇH2NH(Lys)) ; 41,4 (LH2(Gly)) ;
54,4
(ÇH(Lys)) ; 67,2 et 67,4 (2OÇH2Ph) ; 68,3 (Ç6) ; 70,7 (Ç5) ; 73,2 et 73,4
(OÇHZPh) ;
74,1 (Ç4) ; 74,6 (Çz) ; 74,8 et 75,5 (OÇH2Ph) ; 80,6 (C ) ; 96,9 (t, C1,
1Jc_F=27Hz) ;
127,6; 127,8 (2C); 128,0; 128,1; 128,2; 128,3 (3C); 128,4; 128,5; 128,6 (2C);
128,8
(Ç~) ; 135,2; 136,3; 137,9 (2C); 138,4; 138,6 (Çquat) ; 156,2 (ZNHCO) ; 163,9
(t,
CF2ÇO, 2JC_F=27Hz) ; 169,9 et 172,0 (NHÇO et Ç02)
M ES+ : [M+H]+ = 1045,4 et [M+Na]+=1067,53.
Analyse élémentaire : Théorique %C 67,87 %H 6,08 %N 4,02
Expérimentale %C 67,80 %H 6,03 %N 3,99
Synthèse du composé 30 (Figure 22)
0
6, OH
0 FC N OH
HO 5 N
HO 4 3' j/OpH 0 NH3+CI' O
H 30
O -
0
H
0 1 C N OH
HO H
H~s~ ~ {N
HO
5 3 2 pH 0 NH3*CI' 0
6 H OH
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
37
Dans un ballon contenant le composé 29 (104 mg; 0,0996 mmol; léq)
dissout dans le THF 3mL, l'acide chlorhydrique 1N (1,3 mL; 0,128 mmol ;
1,3 éq), puis une pointe de spatule de Pd/C sont ajoutés. Le solution est
placée sous atmosphère d'hydrogène et agitée pendant 48 heures.
Le milieu est filtré sur millipore puis concentré. Le composé 30 est obtenu
sous la forme d'un solide jaune pâle avec un rendement de 98%.
C16H28CIF2N3010 M=495,86 g.mol-1
RMN 19F (D20, 282,5 MHz)
-119,4 (d, JF_F=256Hz) ; -120,5 (d, JF_F=256Hz) ; -120,9 (d, JF_F=257Hz) ;
-122,0 (d, JF_F=257Hz).
RMN 'H (D20, 300 MHz)
1,41-1,46 (m; 2H; CH2); 1,53-1,60 (m; 2H; CH2) ; 1,85-1,92 (m; 2H; CH2)
3,27 (m; 2H; NHCH2(Lys)); 3,57-3,74 (m; 2H6',2H6;H4; H5) ;3,83 (dd, 2,9Hz
et 9,3Hz, H3'); 3,95-4,04 (m; CH2,CH H4',H5',H2 ); 4,14 (t, 8,3Hz, H3); 4,39
(d, 8Hz, H2).
NMR 13C (D20, 75,5 MHz)
21,6 (CH2) ; 28,0 (CH2) ; 30,6 (CH2) ; 39,3(ÇH2N(Lys)) ; 41,4 (ÇH2(Gly)) ;
53,4 (ÇH(Lys)) ; 61,1 (C6') ; 62,6 (C6) ; 67,1 (C5') ; 68,9 (C4') ; 70,6 (C3 )
;
70,9 (C6) ; 72,5 (C2') ; 73,9 (C3) ; 75,5 (C2) ; 80,2 (C4) ;96,3(t, 26Hz) et
98,8
(t, 29Hz) (C1 et C1'); 114,0 et 117,4 (ÇF2) ; 163,9 (t, 28 Hz, CF2CO) ;170,7
et 173,2 (2Ç0).
M(ES+) : : [M+H]+ = 461,2 et [M+Na]+=483,3 et [M-H2O]+=441,3
Synthèse du composé 32 (Figure 23)
0 Co2Bn
Pho N
o
32
NHBoc
Dans un ballon sous atmosphère inerte contenant la Z-Lys(Boc)-OH 8(760
mg; 2,00 mmoi; léq) dissout dans le dichlorométhane (20 mL), le
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
38
carbonyidiimidazole (389 mg; 2,40 mmol; 1,2 éq) est ajouté par petites
portions. Le milieu est agité pendant une heure. Puis sur ce produit est
additionné une solution préparée sous atmosphère inerte et constituée du CI-
+HN-Pro-OBn 31 (483 mg ; 2,00 mmol; léq) et de DIEA (690 pL; 4,20
mmol ; 2,1 éq) dans le dichlorométhane (20 mL). Ce mélange est agité
pendant 12 heures. Le milieu est hydrolysé avec une solution d'acide
chlorhydrique 1 N, puis la phase aqueuse obtenue est extraite trois fois au
dichlorométhane. Les phases organiques sont rassemblées, séchées sur
MgSO4, filtrées, puis concentrées. Le brut est chromatographié sur colonne
de silice (Eluant Cyclohexane/Acétate d'éthyle 50/50) pour conduire au
composé 32 sous la forme d'un solide blanc avec un rendement de 29%.
C31 H41 N307 M=567,69 g.mol-1
Rf : 0,51 (Cyclohexane/Acétate d'éthyle 50/50).
RMN 'H (CDCI3, 300MHz) :
1,3 (s, 9H, (CH3)3) ; 1,4-2,2 (m, 10H, 3 CH2 Lys et 2 CH2 Pro); 3,0 (m, 2H,
CH2NH(Lys)); 3,5 (m, 1H, CHgN(Pro)); 3,6 (m, 1H, CH2N(Pro)); 4,4 (m, 1H,
CH(Lys)); 4,5 (m, 1H, CH(Pro)); 4,9 (d, 6,5Hz, NHBoc), 4,97 (s, 2H,
OCH2Ph); 4,9 (m, 1 H, OCH2Ph); 5,09 (d, 1H, OCH2Ph, 2JH_H=12,3 Hz); 5,8
(d, 7,6Hz, 1H, ZNH); 7,2 (m, 10H, Har)
RMN 13C (CDCI3, 75,5MHz) :
21,8 (ÇH2) ; 24,7 (CH2) ; 28,3 (C(ÇH3)3) ; 28,7 (CH2) ; 29,2 (ÇH2) ; 31,8
(ÇH2) ; 39,8 (ÇH2NH(Lys)) ; 46,8 (ÇH2N(Pro)) ; 52,0 (ÇH(Lys)); 58,7
(ÇH(Pro)) ; 66,6 et 66,7 (OÇH2Ph) ; 78,6 (Ç(CH3)3 ; 127,8; 127,9; 128,0;
128,1; 128,3; 128,4 (Car) ; 135,4; 136,3 (Cquat) ; 155,9 et 156,0 (COZ et CO
Boc) ; 170,7 (ÇONH) ; 171,6 (CO2Bn)
M(ES+) : [M+H]+=568,33 ; [M+Na]+=590,40 ; [M+K]+=560,27
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
39
Synthèse du composé 33 (Figure 24)
OH O COZBn
6
O 2 N
Bn0 5 N
4 2/i/j O Ph O NH `--~
Bn0 3 OBn
OBn 33 O
Déprotection du peptide
Dans un ballon sous atmosphère inerte contenant le peptide 32 (318 mg ;
0,56 mmol ;1 éq) dissout dans le dichlorométhane (6 mL), I' acide
trifluoroacétique (833 pL; 11,22 mmol; 20 éq) est ajouté. La solution est
agitée pendant 12 heures. Le milieu réactionnel est concentré puis
coévaporé 4 à 5 fois au toluène pour conduire quantitativement au peptide
déprotégé.
Couplage
Dans un ballon sous atmosphère inerte contenant I' acide 6 (368mg ; 0,58
mmol ; léq) le peptide précédemment déprotégé (339 mg ; 0,58 mmol; léq)
dans le diméthylformamide (6 mL), sont ajoutés I' HOBT (87 mg ; 0,64
mmol ; 1,1 éq) puis la NMM (192 pL; 1,75 mmol; 3 éq). Puis après environ
15 minutes, I' EDCI (123 mg; 0,64 mmol; 1,1 éq) est introduite. La solution
est agitée pendant 48 heures. Le solvant est évaporé. Le résidu est repris au
dichlorométhane puis hydrolysé avec une solution d'acide chlorhydrique 1 N.
La phase aqueuse est extraite trois fois au dichlorométhane. Les phases
organiques, une fois rassemblées sont séchées sur MgSO4, filtrées puis
concentrées. Le brut ainsi obtenu est chromatographié sur colonne de silice
(Eluant Cyclohexane/Acétate d'éthyle 50/50) pour obtenir le composé 33
sous forme de solide blanc avec un rendement de 29%.
C62H67F2N3012 M=1083,83 g.mol-1
Rf=0,60 (Eluant Cyclohexane/Acétate d'éthyle 50/50)
RMN 19F (CDCl3; 282,51VIHz) :
-116,1 (d, JF-F=259 Hz) ;-122,9 (d, JF_F= 259 Hz)
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
RMN 1H (CDC13, 300 MHz) :
1,2-1,9 (m, 10H, 3CH (Lys) et 2CH (Pro)) ; 3,1 (m, 1H, CH NH(Lys)) ; 3,3 (m,
1H,
CH NH(Lys)) ; 3,5 (m, 4H, H6 et CH N(Pro)) ; 4,0 (m, 2H, H3 et H4) ; 4,2 (t,
1H,
H5, 2J=6,4 Hz) ; 4,3 (d, 1 H, H2, 2JH_H=9,1) ; 4,4-4,5 (m, 1 H, CH(Lys)) ;
4,44 (d, 1 H,
5 OCHZPh, 2JH_H=12,1 Hz) ; 4,49 (d, 1H, OCH2Ph, 2JH_H=11,9 Hz) ; 4,5-4,6 (m,
1H,
CH(Pro)) ; 4,55 (d, 1H, OCH2Ph, 2JH_H=11,3 Hz) ; 4,72 (s, 2H, OCH Ph) ; 4,76
(d,
1H, OCH2Ph, 2JH-H=10,4 Hz) ; 4,84 (d, 1H, OCH Ph, 2JH_H=10,4 Hz) ; 4,93 (d,
1H,
OCHZPh, 2JH_H=11,3 Hz) ; 5,05 (d, 1H, OCH2Ph, 2JH_H=12,3 Hz) ; 5,07 (d, 1H,
OCH2Ph, 2JH_H=9,3 Hz) ; 5,11 (d, 1H, OCHzPh, 2JH-H=9,3 Hz) ; 5,17 (d, 1H,
10 OCH2Ph, 2JH_H=12,4 Hz) ; 5,4 (, 1H, OH) ; 5,6 (d, 8,3Hz, 1H, ZNH) ; 7,1 (m,
1H,
CONH) ; 7,3 (m, 30H, Haz)
RMN 13C (CDC13, 75,5 MHz) :
21,6 (LH2) ; 24,9 (LH2) ; 27,9 (LH2) ; 28,9 (LH2) ; 32,1 (ÇHZ); 39,5
(LH2NH(Lys))
; 47,2 (CH2N(Pro)) ; 52,1 (LH(Lys)) ; 59,0 (ÇH(Pro)) ; 66,9 et 67,2 (2OÇH2Ph)
;
15 68,2 (L6) ; 70,7 (C5) ; 73,2 et 73,5 (2OÇH2Ph); 74,3 (Ç4) ; 74,6 (Ç2) ;
74,9 et 75,4
(2OÇH2Ph) ; 80,5 (L3); 97,0 (t, L1, 1JC_F=27 Hz) ; 127,9; 128,0; 128,3; 128,4;
128,5 ; 128,6; 128,7; 128,8; 128,9 (3C) ;129,0 LQ,) ; 135,5; 136,5 ; 138,0;
138,4 ;138,8 (Car.quat) ; 156,0 (LONHZ)-164,0 (CF2CO); 170,7 et 1'72,2 (LONH
et
C02)
20 M(ES+) : [M+H]+ = 1084,6 et [M+Na]+=1106,67
M(ES-) : [M-H]- = 1082,27
Analyse élémentaire : Théorique %C 68,68 %H 6,23 %N 3,88
Expérimentale %C 68,53 %H 6,76 %N 3,62
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
41
Synthèse du composé 34 (Figure 25)
6, O O COZBn
H
O C N
HO 5 1i N
z
HO 4 3' ,~~~//OH O NH3+CI
oH 34
O CO2Bn
0 1 C N
HO H ~ N
HO HO/''%
3 Z OH 0 NH3+CP
6 H OH
H
Dans un ballon contenant le composé 33 (155 mg; 0,14 mmoi; léq) dissout
dans le THF (5mL), L'acide chlorhydrique IN (175 pL; 0,19 mmol ; 1,2 éq),
5 puis une pointe de spatule de Pd/C sont ajoutés. Le solution est placée sous
atmosphère d'hydrogène et agitée pendant 48 heures. Le milieu est filtré sur
millipore puis concentré pour obtenir avec un rendement quantitatif le
composé 34 sous la forme d'un solide blanc.
C19H32CIF2N3010 M=536,01 g.moi-1
RMN 19F (D20, 282,5 MHz)
-119,4 (d, JF_F=256Hz) ; -120,5 (d, JF_F=256Hz) ; -121,0 (d, JF_F=257Hz) ;
-122,0 (d, JF_F=257Hz).
RMN 'H(D20, 300 MHz)
1,45 (m; 2H; CH2); 1,60 (m; 2H; CH2) ; 1,89-1,92 (m; 2H; CH2) ; 2,01 (m; 3H;
CH2) ; 2,33 (m; 1H; CH2) ; 3,28-3,30 (m; 2H; NHCHZ(Lys)); 3,61-3,74 (m;
2H6',2H6;H4; H5, NHCH2(Pro), NCH'(Lys)) ;3,83 (dd, 2,9Hz et 9,9Hz, H3');
3,94-4,01 (m= H4',H5',H2'); 4,14 (t, 8,2Hz, H3); 4,31 (t, 5,8Hz, CH(Lys));
4,39
(d, 8,2Hz, H2); 4,38-4,51 (m, CH).
NMR13C (D20, 75,5 MHz)
21,3 (CH2) ; 25,0 (CHZ) ; 28,1 (CH2) ; 29,0 (ÇH2); 29,7 (ÇH2) ;
39,3(CH2N(Lys)) ; 48,0 (CH2(Pro)) ; 52,0 (CH(Lys)) ; 53,4 (ÇH'(Lys)) ; 59,9
(ÇH(Pro)) 61,1 (C6') ; 62,6 (C6) ; 67,1 (C5') ; 68,9 (C4') ; 70,6 (C3') ; 70,9
(C5) ; 72,5 (C2') ; 73,9 (C3) ; 75,5 (C2) ; 80,2 (C4) ;96,3 (t, 26Hz) et 98,8
(t,
29Hz) (Cl et C1'); 114 (t, 258Hz, CF2) ; 163,9 ( 2t, 28 Hz, CFZÇO) ;168,8;
170,7 et 173,2 (CO).
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
42
Synthèse du composé 35 (Figure 26)
6 Br
Bn0 O CF2CO2Et
1
2
BnO 4 3 ,~~OBn
- OBn
5 Dans un ballon sous atmosphère inerte contenant difluoroester 5(989 mg ;
1,49 mmol : 1 éq.) en solution dans le dichlorométhane anhydre (7,5 mL) à
-30 C, on additionne goutte à goutte le SOBr2 (173 L ; 2,24 mmol ; 1,5 éq.).
Après 30 minutes, on introduit la pyridine (181 L ; 2,24 mmol ; 1,5 éq.). et
on laisse sous agitation 30 minutes de plus à-30 C. Une solution d'HCI 2M
10 est ajoutée et la phase est extraite trois fois avec du dichlorométhane.
Les
phases organiques sont rassemblées, séchées sur MgSO4, filtrées et
concentrées sous pression réduite. Le produit 35 brut est obtenu sous forme
de cristaux jaunes avec un rendement pondéral quantitatif sans purification
supplémentaire.
15 C38H39BrF2O7 M= 725,61 g.mol-1
Rf : 0,54 (cyclohexane/acétate d'éthyle 8/2).
RMN 19F (CDCI3, 282,5MHz)
-107,5 (d, 249 Hz, 1 F) ; -111,9 (d, 249 Hz, 1 F) .
RMN 'H (CDCI3, 300MHz)
20 1,2 (t, 7,1 Hz, 3H, CH3); 3,7 (dd, 5,7 et 9,4Hz, 1 H, 1 H6) ; 3,8 (dd, 7,5
et 9,4
Hz, 1 H, 1 H6) ; 4,2 (m , 2H, H3 et H4); 4,2-4,3 (m, 2H, CH2) ; 4,3 (m, 1 H,
H5) ; 4,5-5,1 (m, 9H, H2 et 4OCH2Ph) ; 7,2 (m, 20H, Har)
RMN 13C (CDCI3,75,5MHz)
12,6 (CH3) ; 62,4 (CH2) ; .66,2 (C6) ; 72,0 (OCH2Ph) ; 72,1 (C4) ; 72,4
25 (OÇH2Ph) ; 73,6 (OCH2Ph) ; 73,7 (OÇH2Ph) ; 74,4 (C2) ; 74,5 (C5) ; 80,5
(C3) ; 102,4 (dd, 24 et 30 Hz, C1) ; 110,6 (tapp. , 264 Hz, ÇF2) ; 126,3;
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
43
126,4; 126,5; 126,6; 126,7; 126,8; 127,1 ; 127,2; 127,4 (Çar.) ; 136,5 ;
136,9 ; 137,2 ; 137,3 (Car. quat.) ; 160,1 (tapp., 33Hz, ÇOZEt).
Masse (ESI+) : 748,98 (M+Na) ; 774,88 (M+K).
Synthèse du composé 36 (Figure 27)
6 H
O CF
Bn0 5 aCO2Et
2
BnO 3 "I,///OBn
36
OBn
Dans un ballon contenant l'ester 35 (519mg ; 0,72 mmol ; 1 éq.) en solution
dans le toluène anhydre (15 mL) sous atmosphère d'azote, on additionne
goutte à goutte le Bu3SnH préalablement distillé (291 L ; 1,08 mmol ; 1,5
éq.). On chauffe reflux pendant 1 heure.
Le produit est concentré puis purifié sur colonne de silice (éluant
cyclohexane/acétate d'éthyle 9,3/0,7) pour récupérer le produit 36 attendu
sous la forme d'une huile incolore.
C38H40F207 M= 646,7 g.mol-1
RMN 19F (CDC13, 282,5MHz)
-116 ,7 (dd, 12 et 259 Hz, 1 F) ;-118,2 (dd,10 et 259 Hz, 1 F) .
RMN 'H (CDCI3, 300MHz)
1,05 (t, 7,2Hz, 3H, CH3); 3,47-3,53 (m, 3H, 2H6, H5) ; 3,57 (dd, 2,6 et 9,4
Hz,
1 H, H3) ; 3,80-3,94 (m , 4H, H1, H4, CH2) ; 4,09 (tapp., 9,5Hz, 1 H, H?) ;
4,31 (d, 11,8Hz, 1 H, OCH2Ph) ; 4,37 (d, 11,8Hz, 1 H, OCH2Ph) ; 4,51 (d,
11,5Hz, 1H, OCH2Ph) ; 4,54 (d, 10,4Hz, 1H, OCH2Ph) ; 4,56 (d, 11,7Hz, 1H,
OCH2Ph) ; 4,65 (d, 11,7Hz, 1H, OCH2Ph) ; 4,85 (d, 11,7Hz, 1H, OCH2Ph) ;
4,86 (d, 10,4Hz, 1 H, OCH2Ph) ;7,20 (m, 20H, Har)
RMN13C (CDCI3,75,5MHz)
14,2 (CH3) ; 63,1 (CH2) ; 68,9 (C6) ; 72,8 (OCH2Ph) ; 73,6 (C4) ; 74,0
(OÇH2Ph) ; 74,1 (C2) ; 74,9 (OCH2Ph); 75,3 (OCH2Ph) ; 77,9 (tapp., 23Hz,
C1) ; 78,2 (C5) ; 84,7 (C3) ; 113,9 (tapp. , 256Hz, CF2) ; 128,0-128,9 (Car.)
;
138,2 ; 138,3 ; 138,5 ; 139,0 (Car. quat.) ; 163,2 (tapp., 31 Hz, CO2Et).
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
44
Masse (ESI+) : 647,33 (M+H) ; 669,4 (M+Na).
Synthèse du composé 37 (Figure 28)
6
O CF2CO2H
Bn0 5
2
Bn0 3 ,""///OBn
37
OBn
Dans un ballon contenant l'ester 36 (0,4 g ; 0,618 mmol, 1 éq.) dans le THF
(5 mL) est ajoutée une solution aqueuse de lithine LiOH (30 mg ; 1,25 mmol,
2,02éq.) solubilisée dans une quantité minimum d'eau. Le mélange est
laissé 12 heures sous agitation puis repris dans l'acétate d'éthyle. Le
mélange est acidifié avec une solution aqueuse d'acide chlorhydrique 1 N
puis extrait plusieurs fois avec de l'acétate d'éthyle. Les phases organiques
sont rassemblées, séchées sur sulfate de magnésium, filtrées puis
concentrées
Le composé 37 est obtenu sous la forme d'une huile blanche avec un
rendement quantitatif.
C36H36 F207 M= 618,66g.mol-1
RMN 19F (CDCI3, 282,5 MHz)
-117,1 (d, JF_F=260Hz) ; -118,6 (d, JF_F=260Hz).
RMN 'H (CDCI3, 300 MHz)
3,38-3,52 (m, 4H, 2H6, H5) ; 3,57 (dd, 2,6 et 9,4 Hz, 1H, H3) ; 3,79 (d
2,4Hz, 1 H, H4); 3,79-3,88 (m, 1 H, H1); 4,09 (t, 9,6Hz, 1 H, H2) ; 4,32 (d,
11,9Hz, 1H, OCH2Ph) ; 4,41 (d, 11,9Hz, 1H, OCH2Ph) ; 4,47-4,64 (m, 4H,
2OCH2Ph) ; 4,81-4,86 (m, 2H, OCH2Ph) ; 7,20 (m, 20H, Har)
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
Synthèse du composé 38 (Figure 29)
0
6 H
O F
BnO C N OCH2Ph
' N
2 H
BnO 4 g """/Ogn O PhOyNH O
oBn 38 0
5 Dans un ballon sous atmosphère inerte contenant l'acide 37 (383 mg ;
0,619 mmol ; 1,0 éq.), le peptide déprotégé (379 mg ; 0,679 mmol ; 1,1 éq.),
le 1-hydroxybenzotriazole HOBT (92 mg ; 0,681 mmol ; 1,1 éq.) et la N-
méthylmorpholine NMM (204 L ; 1,8 mmol ; 2,9 éq.) dans le DMF (5 mL),
l'EDCI (130 mg ; 0,678 mmol ; 1,1 éq.) est ajouté. La réaction est laissée
10 sous agitation pendant 24 heures, puis le solvant est évaporé et le milieu
est
repris dans le dichlorométhane. Le milieu est ensuite extrait deux fois avec
HCI 1 M(2*15 mL). La phase organique est collectée, séchée sur sulfate de
magnésium, filtrée puis concentrée.
Le mélange est ensuite purifié par chromatographie sur une colonne de silice
15 avec comme éluant un mélange cyclohexane/acétate d'éthyle. Après
concentration des fractions recueillies, le produit 38 se présente sous la
forme d'un solide blanc avec un rendement pondéral de 53%.
C60H65F2N3011 M=1042,17 g.moi-'
RMN 19F (CDCI3, 282,5 MHz)
20 -112,5 (dd, J 7,5Hz et 260Hz) ; -119,6 (d, J14,5 et 260Hz).
RMN 'H (CDCI3, 300 MHz)
1,17-1,19 (m, 2H, CH2); 1,29-1,35 (m; 5H; CH3 ; CHZ); 1,44-1,66 (m; 2H;
CH2); 2,90-2,94 (m; 1H; NHCH2); 3,11-3,15 (m; 1H; NHCH2); 3,43-3,54 (m;
4H; H6, H3;H5); 3,87 (d, 2,6Hz, 1H, H4); 3,88-4,02 (m; 2H; CHNH(Lys); H1);
25 4,07 (t, 9,6Hz, H2); 4,36 (s, 2H, OCH2Ph); 4,46-4,52 (m; 3H; OCH2Ph ; CH
(Ala)); 4,61-4,66 (m, 2H, OCH2Ph) ; 4,77-4,87 (m, 2H, OCH2Ph); 5,0 (s; 2H;
OCH2Ph) ; 5,01-5,13 (m, 2H, OCH2Ph ) 5,35 (d; 7,5Hz, 1 H; ZNH); 6,38 (d;
7,1 ; 1 H; NH); 6,53 (Is, 1 H; NH) ; 7,2 (m; 30H; Har.).
RMN 13C (CDCI3, 75,5 MHz)
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
46
18,4 (ÇH3) ; 22,4 (ÇH2) ; 28,8 (CHZ) ; 32,3 (ÇH2) ; 39,2 (CH2N) ; 48,6
(ÇH(Ala)) ; 54,9 (NÇH(Lys)) ; 67,4 et 67,6 (2OCH2Ph); 68,5 (C6) ; 73,1
(OÇH2Ph) ; 73,7 (C4) ; 73,8 (OÇH2Ph) ; 74,3 (C2) ; 75,1 (OCH2Ph);
75,4 (OÇH2Ph) ; 77,1 (tapp, C.1); 77,7 (C5); 84,4 (C3) ; 127,9 -129 (Çar.) ;
135,6; 136,6; 138,1 ;138,5 (2C) ;138,9 (Çar. quat.) ; 156,0 (CONH(Z)) ; 171,6
(ÇONH) ; 172,9 (ÇO2Bn).
Synthèse du composé 39 (Figure 30)
O
6, H
F
HO O C N OH
5 l' N
2, H
HO 4 3 ,~~~OH O 39 NH3+CI- O
OH
Un ballon contenant le produit 38 (400 mg ; 0,384 mmol ) dans un mélange
de tétrahydrofurane THF (5 mL) et d'HCI 1 N(576 L) et d'eau (1,5mL) en
présence d'une pointe de spatule de palladium sur charbon Pd/C est placé
sous atmosphère d'hydrogène. Le mélange est laissé sous agitation pendant
une nuit puis filtré sur un filtre Millipore . Le mélange est ensuite
concentré
pour obtenir le produit 39 sous la forme d'un solide blanc avec un rendement
quantitatif.
C17H30CIF2N309 M=493,88 g.mol-'
RMN 19F (D20, 282,5 MHz)
-116,7 (ddd, J=257Hz,17,2Hz et 10,7Hz,) ; -119,6 (ddd, J=257Hz et 14Hz).
RMN'H (D20, 300 MHz)
1,32 (d; 7,3Hz; CH3) ; 1,31-1,34 (m, 2H, CH2); 1,43-1,52 (m; 2H; CH2); 1,75-
1,83 (m; 2H; CH2) ; 3,14-3,18 (m; 2H; NHCH2); 3,42-3,61 (m; 4H, H6', H5',
H3'); 3,72-3,79 (m; 2H H1',H2') ;3,82-3,90 (m, 2H, CH(Lys), H4'); 4,24-4,32
(m; CH(Ala).
NMR 13C (D20, 75,5 MHz)
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
47
16,3 (CH3) ; 21,5 (ÇH2) ; 27,9 (CH2) ; 30,8 (ÇH2) ; 39,4 (CH2N); 49,1
(ÇH(Lys)) ; 53,2 (NÇH(Ala)) ; 61,3 (C6'); 66,1 (C2') ; 69,0 (C4') ; 74,0 (C5'
ou
C3 ) ; 77,3 (t, 24Hz, C1); 79,6 (C3' ou C5') ; 164,8 (d, 26Hz, CO); 169,9 et
176,3 (2Ç0).
Synthèse du composé 41 (Figure 31)
6 OH
O
Bn0 _ CF2CO2Et
1
2
BnO\\,\`` 3 ""//OBn
41
OBn
Dans un ballon sous atmosphère inerte contenant le zinc (3.34 g 51 mmol ;
7 éq.) préalablement activé, le THF (60 mL) est ajouté et le mélange est ainsi
chauffé à reflux. La lactone 40 (3.94 g; 7.3 mmol ; 1 éq.) est lentement
additionné avec le bromodifluoroacétate d'éthyle (2.83 mL; 22 mmol ; 3 éq.)
dans le THF (60 mL). La réaction est agitée à reflux pendant 3 heures. Le
mélange est refroidi à température ambiante et une solution d'HCI 1 M(120
mL) est ajoutée. On filtre le mélange sur Buchner pour éliminer le zinc en
excès. On ajoute à la solution du dichlorométhane (40mL). On sépare les 2
phases et on extrait à nouveau deux fois la phase aqueuse au
dichlorométhane. Les phases organiques sont séchées sur MgSO4, filtrées et
concentrées sous pression réduite. Le résidu est purifié sur colonne
chormatographique sur gel de silice avec un mélange cyclohexane / acétate
d'éthyle (8 : 2) comme éluant afin d'isoler le produit 41 pur sous forme d'une
huile incolore avec un rendement de 75%.
Cs8H4oF20s M= 662,72 g.mol-1
Rf = 0.35, éluant : cyclohexane / acétate d'éthyle (8 : 2).
RMN 19F (CDCI3 28, 2MHz)
-117.7 (d, 1 F, 2JF_F 256.4), -120.1 (d, 1 F, 2JF_F 256.4).
RMN 'H (CDCI3 300MHz
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
48
1.30 (t, 3H, 3J7.1, CH3), 3.63-3.81 (m, 3H, H3, H6), 4.01-4.10 (m, 2H, H4,
H5), 4.16 (s, 1H, H2), 4.29 (q, 2H, 3J 7.1, CH2), 4.50-4.81 (m, 4H,
2OCH2Ph), 4.85-4.92 (m, 4H, 2OCH2Ph), 7.21-7.38 (m, 20H, HAr).
RMN 13C (CDCI3, 75MHz)
14.3 (CH3), 63.7 (ÇH2), 68.6 (C6), 73.0 (C2), 73.8 (OCH2Ph), 75.5 (OÇH2Ph),
75.7 (OÇH2Ph), 76.4 (OCH2Ph), 77.8 (C3), 78.6 (C4), 83.7 (C5), 96.5 (t, 2Jc_F
25.5, C1), 128.0 (2C), 128.1 (2C), 128.1, 128.2, 128.3 (2C), 128.6, 128.7
(2C), 128.8 (2C), 128.8 (2C), 128.9 (2C) (Car.), 137.9, 138.3, 138.7, 138.7
(Car.quat.),163.3 (t, 2Jc_F 30.3, CO).
Synthèse du composé 42 (Figure 32)
6 OH
O CF2CO2H
Bn0 5
2
BnO\\\\`"4 3 ~""//OBn
OBn 42
Dans un ballon contenant l'ester 41 (615 mg ; 0,93 mmol ; 1 eq.) dans le THF
(5 mL) est ajoutée une solution aqueuse de lithine LiOH (2M, 2 éq.)
solubilisée dans une quantité minimum d'eau. Le mélange est laissé 12
heures sous agitation puis repris dans l'acétate d'éthyle. Le mélange est
acidifié avec une solution aqueuse d'acide chlorhydrique 1 N puis extrait
plusieurs fois avec de l'acétate d'éthyle. Les phases organiques sont
rassemblées, séchées sur sulfate de magnésium, filtrées puis concentrées.
Le composé 42 est obtenu sous la forme d'une huile blanche avec un
rendement 90%.
C36H36 F208 M= 634,66g.mol"1
Rf = 0,50; éluant : DCM / methanol (9 : 1).
RMN 19F (CDCI3, 282,5 MHz)
-117,2 (d, 1 F, 2JF_F 259Hz); -119,0 (d, 1 F, 2JF-F259HZ).
RMN 'H(CDCI3, 300 MHz)
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
49
3,4-3,5 (m, 2H, H3, 1 H6); 3,5-3,6 (m, 1H, 1 H6); 3,9 (m, 2H, H4, H5); 4,0 (m,
1H, H2); 4,4 (m, 8H; 4OCH2Ph); 6,1 (s, 2H, OH, COOH); 7,0-7,3 (m, 20H,
HAr) =
RMN 13C (CDCI3, 75,5 MHz)
68,0 (C6) ; 71,4 (C2) ; 73,0; 74,9; 75,1 ; 75,9; 77,2 (C3) ; 77,9 (C4) ; 82,1
(C5) ; 94,9 (t, 2JcF 27, C1) ; 126,6; 126,7; 126,9; 127,0; 127,0; 127,3;
127,3 ; 127,4 ; 127,5 (Ç ar.); 135,6 ; 136,2 ; 136,4 ; 137,1 (Çar.quat.).
Synthèse du composé 43 (Figure 33)
0
6 OH
F
O N OCH2Ph
BnO C
5 ~ N
2 H
y
BnO~~\I`` 4 3 ~~"//OBn O PhO NH O
Bn 43 0
Dans un ballon sous atmosphère inerte contenant l'acide 42 (383 mg ;
0,603 mmol ; 1 éq.), le peptide précédemment déprotégé (370 mg ;
0,664 mmol ; 1,1 éq.), le 1-hydroxybenzotriazole HOBT (0,090 g;
0,664 mmol ; 1,1 éq.) et la N-méthylmorpholine NMM (0,198 mL; 1,8 mmol;
3 éq.) dans le DMF (10 mL), l'EDCI (127 mg ; 0,664 mmol ; 1,1 éq.) est
ajouté. La réaction est laissée sous agitation pendant 24 heures, puis le
solvant est évaporé et le milieu est repris dans le dichlorométhane. Le milieu
est ensuite extrait deux fois avec HCI 1 M (2*20 mL). La phase organique est
collectée, séchée sur sulfate de magnésium, filtrée puis concentrée.
Le mélange est ensuite purifié par chromatographie sur une colonne de silice
avec comme éluant un mélange cyclohexane/acétate d'éthyle. Après
concentration des fractions recueillies, le produit 43 se présente sous la
forme d'un solide blanc avec un rendement pondéral de 43%.
C60H65F2N3012 M=1058,17 g.mol-1
RMN 19F (CDCI3, 282,5 MHz)
-116,8 (d, JF_F=260Hz) ; -122,3 (d, JF_F=259Hz).
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
RMN 'H (CDCI3, 300 MHz)
1,18-1,68 (m; 9H; CH3; 3CH2); 3,00-3,05 (m; 1H; NHCH2); 3,21-3,26 (m; 1H;
NHCH2); 3,54-3,69 (m; 3H; H4, H6); 3,81 (d; 1 H; 9,3Hz, H2) ; 3,94 (t, 9,2Hz,
2H, H5, H3); 4,0 (m; 1 H; CHNH(Lys);); 4,34-4,50 (m; 4H; OCH2Ph ; CH
5 (Ala)); 4,71-5,13 (m; 9H; OCH2Ph) ; 5,2 (s; 1H, OH); 5,40 (d; 7,8 ; 1H; NH);
6,4 (m ; 1 H; NH) ; 6,9 (s; 1 H; NH); 7,2 (m; 30H; Har.).
RMN 13C (CDCI3, 75,5 MHz)
18,1 (CH3) ; 22,4 (ÇH2) ; 28,4 (CH2); 32, (CH2) ; 39, (ÇH2N) ; 48,7
(ÇH(Ala)) ; 54,8 (NCH Lys) ; 67,4 et 67,7 (2OÇH2Ph); 68,8 (C6) ; 72,0 (C5) ;
10 73,8 (OCH2Ph) ; 75,4 (OCH2Ph); 75,7 (OCH2Ph) ; 76,4 (OÇH2Ph); 77,8
(C4) ; 78,7 (C2) ; 83,5 (C3); 128,2 -129,0 (Çar.) ; 135,6; 136,6;
138,0 ;138,2 ;138,4 138,7 (Car. quat.) ; 156,5 (CO(Z)) ; 171,5 (ÇONH) ;
173,1 (ÇO2Bn).
Synthèse du composé 44 (Figure 34)
0
6, OH
F
HO O CZ N OH
5 ë ~ N
H
HO~~~~ '4 OH O NH3*CP O
6 OH 44
0
HO O 1 C2 N OH
HO HO H \/
I(~I N
H
3 OH 0 NH3+CI' 0
OH
Un ballon contenant le produit 43 (220 mg ; 0,208 mmol) dans un mélange
de tétrahydrofurane THF (3 mL) , d'HCI 1 N(312 L) et d'eau (environ 1,7mL)
en présence d'une pointe de spatule de palladium sur charbon Pd/C est
placé sous atmosphère d'hydrogène. Le mélange est laissé sous agitation
pendant une nuit puis filtré sur un filtre Millipore . Le mélange est ensuite
concentré pour obtenir le produit 44 sous la forme d'un solide blanc avec un
rendement de 97%.
C17H30CIF2N301o M=509,88 g.mol-1
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
51
RMN 19F (DZ0, 282,5 MHz)
-119,9 (s) ; -119,9 (s)
RMN 'H (D20, 300 MHz)
1,33 (m; 5H; CH2 et CH3) ; 1,48 (m; 2H; CH2); 1,80 (m; 2H; CH2) ; 3,17 (m;
2H; NHCH2); 3,29-3,63 (m;2H6, H4 HS,CH, H3; H2); 4,3 (m; CH).
Résultats de préservation de cellules
Expérience 1
Introduction:
Les expériences ont été réalisées afin de démontrer l'efficacité du composé
11 contre les expositions aux UV.
Résultats: (Figures 35)
Dans les expériences suivantes, les études ont été réalisées à 37 C sur des
fibroblastes primaires adultes de la peau. Les cellules ont été exposées à
une irradiation sous UV-C pendant 2 heures en présence des dérivés
d'AAGP.
Protocolës ex rim ~~~"~ pe entaux sur les Fibroblastes
Températures utilisées 37 C
Type de cellules fibroblastes adultes primaires de la
peau
Pour ces expériences, un milieu
sans sérum avec 0.5mM EDTA a été
utilisé. Les cellules ont été exposées
Conditions de culture sous UV-C (254nm) pendant 2
heures à température ambiante, puis
placées à 37 C pendant la durée de
l'expérience.
- A 0, 6, 18, 48, 72 jours après
Temps d'échantillonnage exposition UV pour AAGP-11
Composés AAGP - AAGP-15
Concentration AAGP - 8.6mM
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
52
Lors de ces expériences, nous constatons que le composé AAGP-15
présente d'excellentes propriétés protectrice.
Résultats Ex érimentaux
Température Résultats Préliminaires Commentaires
- Après 3 jours, le composé
Après 72 heures, toutes les AAGP-11 montre un très haut
ellules du contrôle sont niveau de protection des
mortes alors qu'avec AAGP- cellules face aux UV.
11, on observe encore 92% Après 4 jours, on trouve
37 C e cellules vivantes (Figure encore 60% de cellules
35). vivantes avec AAGP-11, alors
que toutes sont presque
mortes dans le contrôle (ne
figure pas sur le graphe)
Expérience 2
Introduction:
Dans l'expérience suivante, le but est de tester l'activité préservatrice des
composés AAGP 11 à basses températures.
Résultats: (Figures 36)
Les cellules sont ainsi incubées à-3 C en présence du composé AAGP 11.
Protocoles ex érimentaux sur IesFibroblastes
Températures utilisées - A -3 C
Type de cellules - fibroblastes adultes primaires de la peau
- Pour ces expériences, un milieu sans sérum
Conditions de culture avec 0.5mM EDTA a été utilisé.
Les cellules ont été incubées à-3 C.
Temps d'échantillonnage - A 0, 1, 2, 4, et 6 jours
Composés AAGP - AAGP-11
Concentration AAGP - 8.6mM
CA 02649993 2008-10-21
WO 2007/125203 PCT/FR2007/000716
53
De la même façon lors de cette expérience, on observe une très forte activité
de préservation d'AAGP-11 sur les fibroblastes à basses températures.
Résultats Expérimentaux
Température Résultats préliminaires Commentaires
Après 6 jours, les cellules du - AAGP-11 montre dans
ontrôle sont toutes mortes alors ces résuitats une très forte
-3 C ue celles traitées par AAGP-11 activité de préservation
présentent environ 100% de des cellules.
survie (Figure 36).
Expérience 3
Des études ont été réalisées sur des cellules HELA, soumises à des UVC,
en présence des différents composés synthétisés, à faible concentration.
On obtient de très bons résultats pour le composé 11, mais au vue des
figures 37, 38 et 39, d'autres dérivés donnent une amélioration de la survie
de ces cellules par rapport au contrôle. C'est le cas des composés : 39, 22,
30 et 34.
Par contre, les composés 26, 12 et 44 donnent, quant à eux, de moins bons
résultats que le contrôle.