Note: Descriptions are shown in the official language in which they were submitted.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
DERIVES DE 1,3-DIPHENYLPROPANE SUBSTITUES, PREPARATIONS ET
UTILISATIONS
La présente invention concerne des composés dérivés de 1,3-
diphénylpropane substitués, les compositions pharmaceutiques les comprenant
ainsi que leurs applications thérapeutiques, notamment dans les domaines de la
santé humaine et animale.
Les inventeurs ont mis en évidence, de manière surprenante, que les
composés selon l'invention possèdent de manière intrinsèque des propriétés
agonistes PPAR (Peroxisome Proliferator-Activated Receptor).
Les molécules décrites dans l'invention sont donc d'un intérêt particulier
pour traiter les complications associées au syndrome métabolique, l'insulino-
résistance, le diabète, les dyslipidémies, l'athérosclérose, les maladies
cardiovasculaires, l'obésité, l'hypertension, les maladies inflammatoires
(asthme,
etc.), les pathologies neurodégénératives (Alzheimer, etc.), les cancers,
etc., ainsi
que pour permettre la diminution du risque global. Préférentiellement, les
composés selon l'invention sont utilisables pour le traitement des
dyslipidémies.
Le diabète, l'obésité et les dyslipidémies (taux plasmatiques de cholestérol
LDL et de triglycérides élevés, cholestérol HDL faible, etc.) font partie des
facteurs
de risque cardiovasculaire clairement identifiés qui prédisposent un individu
à
développer une pathologie cardiovasculaire (Mensah M, 2004). Ces facteurs de
risque s'additionnent aux facteurs de risque liés au mode de vie tels que le
tabagisme, l'inactivité physique et les régimes alimentaires déséquilibrés. Un
effet
synergique existe entre ces différents facteurs : la présence concomitante de
plusieurs d'entre eux conduit à une aggravation dramatique du risque
cardiovasculaire et il convient alors de parler de risque global ( global
risk ) pour
les maladies cardiovasculaires. La prévalence des dyslipidémies atteignait
43,6%
de la population en 2004 dans les principaux pays développés. La prévalence du
diabète, actuellement en nette augmentation, est en passe de devenir de plus
en
plus significative dans l'épidémiologie des maladies cardiovasculaires : la
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
2
prévalence du diabète est en effet estimée à 7,6% de la population pour 2010
(Fox-Tucker J, 2005).
Selon l'International Atherosclerosis Society (International Atherosclerosis
Society, 2003), les maladies cardiovasculaires représentent la première cause
de
mortalité dans les pays industrialisés et deviennent de plus en plus
fréquentes
dans les pays en voie de développement. Ces maladies sont notamment les
maladies coronariennes, l'ischémie cérébrale et les maladies artérielles
périphériques.
Ces données justifient donc l'adoption de mesures énergiques pour réduire
significativement la morbidité et la mortalité cardiovasculaires et la
nécessité de
trouver des traitements efficaces, complémentaires d'une modification de
l'hygiène
de vie, agissant sur les facteurs de risque des maladies cardiovasculaires et
sur
leurs conséquences devient une urgence mondiale.
Les composés selon l'invention, par leurs propriétés agonistes PPAR,
présentent un intérêt particulier pour le traitement des pathologies liées aux
dérèglements du métabolisme lipidique et/ou glucidique, telles que le diabète,
l'obésité, les dyslipidémies ou l'inflammation, ainsi que pour la diminution
du
risque cardiovasculaire global.
Les PPAR (a, y et 8) sont en effet connus comme étant impliqués dans ce
type de pathologies (Kota BP et al., 2005) : des ligands de ces récepteurs
sont
donc commercialisés pour traiter de telles pathologies (Lefebvre P et al.,
2006) et
de nombreux modulateurs PPAR, agonistes ou antagonistes, sélectifs ou non,
sont actuellement en développement avancé. Un modulateur PPAR ayant des
effets bénéfiques sur la résistance à l'insuline, l'obésité, les
dyslipidémies,
l'hypertension et/ou l'inflammation pourrait être utilisé dans le traitement
du
syndrome métabolique (ou syndrome X) (Liu Y and Miller A, 2005).
La famille des PPAR comprend trois isoformes, désignés a, y et 8 (encore
appelé 13), chacun codé par un gène différent. Ces récepteurs font partie de
la
superfamille des récepteurs nucléaires et des facteurs de transcription qui
sont
activés par la liaison de certains acides gras et/ou de leurs métabolites
lipidiques.
Les PPAR activés forment des hétérodimères avec les récepteurs de l'acide
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
3
rétindique 9-cis (RXR ou Retinoid X Receptor) et se fixent sur des éléments de
réponse spécifiques (PPRE ou Peroxisome Proliferator Response Element) au
niveau du promoteur de leurs gènes cibles, permettant ainsi le contrôle de la
transcription.
PPARa contrôle le métabolisme lipidique (hépatique et musculaire) et
l'homéostasie du glucose, influence le métabolisme intracellulaire des lipides
et
des sucres par un contrôle direct de la transcription de gènes codant pour des
protéines impliquées dans l'homéostasie lipidique, exerce des effets anti-
inflammatoires et anti-prolifératifs et prévient les effets pro-athérogéniques
de
l'accumulation du cholestérol dans les macrophages en stimulant l'efflux du
cholestérol (Lefebvre P, Chinetti G, Fruchart JC and Staels B, 2006). Les
fibrates
(fénofibrate, bézafibrate, ciprofibrate, gemfibrozil), par l'intermédiaire de
PPARa,
sont ainsi utilisés en clinique dans le traitement de certaines dyslipidémies
en
baissant les triglycérides et en augmentant les taux de HDL (High Density
Lipoprotein).
PPARy est un régulateur-clé de l'adipogenèse. De plus, il est impliqué dans
le métabolisme lipidique des adipocytes matures, dans l'homéostasie du
glucose,
notamment dans la résistance à l'insuline, dans l'inflammation, dans
l'accumulation de cholestérol au niveau des macrophages et dans la
prolifération
cellulaire (Lehrke M and Lazar MA, 2005). PPARy joue par conséquent un rôle
dans la pathogenèse de l'obésité, de l'insulino-résistance et du diabète. Les
thiazolidinediones (Rosiglitazone, Troglitazone, etc.) sont des ligands du
récepteur
PPARy utilisés dans le traitement du diabète de type 2.
Il existe des ligands de PPAR8 (L-165041, GW501516 actuellement en
développement clinique) mais aucun ligand PPAR8 n'est actuellement utilisé
comme médicament. Ce récepteur est cependant une cible attractive pour le
développement de médicaments utilisables dans le traitement des dyslipidémies,
de l'athérosclérose, de l'obésité et de la résistance à l'insuline : PPAR8 est
en
effet impliqué dans le contrôle du métabolisme lipidique et glucidique, dans
la
balance énergétique, dans la neurodégénération, dans l'obésité, dans la
formation
des cellules spumeuses et dans l'inflammation (Cross B et al., 2005).
CA 02655643 2013-10-09
4
Au-delà du rôle direct joué par les ligands PPAR sur la régulation du
métabolisme des lipides et des glucides, ces molécules ont un spectre d'action
pléiotropique dû à la grande diversité des gènes cibles des PPAR. Ces
multiples
propriétés font des PPAR des cibles thérapeutiques d'intérêt pour le
traitement de
maladies comme l'athérosclérose, l'ischémie cérébrale, l'hypertension, les
maladies
liées à une néo-vascularisation (rétinopathies diabétiques, etc.), les
maladies
inflammatoires et auto-immunes (maladie de Crohn, psoriasis, sclérose en
plaques,
asthme, etc), les maladies néoplasiques (carcinogenèse, etc.), les maladies
neurodégénératives, les complications associées au syndrome métabolique,
l'insulino-résistance, le diabète, les dyslipidémies, les maladies
cardiovasculaires,
l'obésité, etc., ainsi que pour permettre la diminution du risque global.
Les composés selon l'invention, par leurs propriétés agonistes PPAR,
représentent donc un outil thérapeutique avantageux pour l'amélioration des
pathologies liées aux dérèglements du métabolisme lipidique et/ou glucidique,
notamment des dyslipidémies, ainsi que pour la diminution du risque
cardiovasculaire global.
Plus généralement, en agissant de manière simultanée sur plusieurs
processus de régulation, les composés selon l'invention représentent un moyen
thérapeutique avantageux pour traiter les complications associées au syndrome
métabolique (dont les caractéristiques sont l'obésité, en particulier
l'obésité
abdominale, une concentration anormale de lipides sanguins (taux élevé de
triglycérides et/ou faible taux de cholestérol HDL (dyslipidémie)), une
glycémie
élevée et/ou une résistance à l'insuline et une hypertension),
l'athérosclérose, les
maladies cardiovasculaires, l'insulino-résistance, l'obésité, l'hypertension,
le
diabète, les dyslipidémies, les maladies cardiovasculaires, les maladies
inflammatoires (asthme, etc.), les pathologies neurodégénératives (Alzheimer,
etc.),
les cancers, etc., ainsi que pour permettre la diminution du risque global.
CA 02655643 2014-06-25
La présente invention a pour objet des composés dérivés de 1,3-
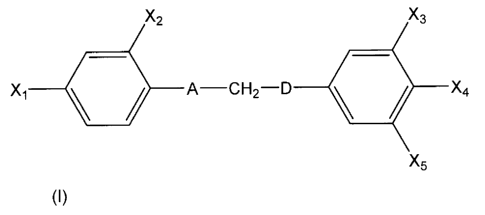
diphénylpropane substitués de formule générale (I) :
X2 X3
X1 A¨CH2¨D 11 X4
X5
(I)
dans laquelle :
X1 représente un groupement R1 ou G1-R1;
X2 représente un atome d'halogène, un groupement R2 ou G2-R2 ou X2 représente
G2 lorsque D est un atome de carbone lié d'une part à un atome d'hydrogène et
d'autre part à G2 de façon à former avec les atomes auxquels ils sont liés un
hétérocycle oxygéné ou soufré;
X3 représente un groupement R3 ou G3-R3;
X4 représente un atome d'halogène, un groupement R4 ou G4-R4;
X5 représente un groupement R5 ou G5-R5;
R1 représentant un atome d'hydrogène ou un radical hydrocarboné saturé,
linéaire,
ramifié ou cyclique non halogéné;
R2 représentant un atome d'hydrogène ou un radical hydrocarboné saturé,
linéaire,
ramifié ou cyclique, halogéné ou non ;
R3, R4 et R5, identiques ou différents, représentant un atome d'hydrogène ou
un
radical hydrocarboné saturé, linéaire, ramifié ou cyclique, halogéné ou non,
et
substitué ou non par un ou plusieurs substituants du groupe 1 ou du groupe 2 ;
Cl, G2, G3, G4 et G5, identiques ou différents, représentant un atome
d'oxygène
ou de soufre ;
CA 02655643 2014-06-25
6
avec au moins un des groupements X3, X4 ou X5 répondant à la formule R3, G3R3,
R4, G4R4, R5 ou G5R5, dans laquelle :
G3, G4 et G5 sont tels que définis ci-avant, et
R3, R4 et R5, identiques ou différents, représentent un radical hydrocarboné
saturé,
linéaire, ramifié ou cyclique, halogéné ou non, et substitué par un ou
plusieurs
substituants du groupe 1 ou du groupe 2;
A représente :
(i) un groupement -CR6R7, dans lequel
R6 et R7, identiques ou différents, représentent un atome d'hydrogène,
un groupement hydroxy, un radical hydrocarboné saturé, linéaire, ramifié
ou cyclique, halogéné ou non, ou un groupement -0R8, R8 étant tel que
défini ci-dessous,
(ii) un groupement carbonyle (CO), ou
(iii) un groupement oxime (C=N-0-H) ou ether d'oxime (C=N-O-R8),
R8, identique ou différent, représentant un radical hydrocarboné saturé,
linéaire, ramifié ou cyclique, halogéné ou non, et substitué ou non par des
groupements aromatiques éventuellement interrompus par un ou
plusieurs hétéroatomes choisis parmi N, 0, S ou P, ou un groupe
cycloalkyle;
D représente :
(i) un atome de carbone lié à deux atomes d'hydrogène (CH2), ou
(ii) un atome de carbone lié d'une part à un atome d'hydrogène et d'autre
part à G2 de façon à former, avec les atomes auxquels ils sont liés un
hétérocycle oxygéné ou soufré lorsque X2 représente G2;
CA 02655643 2014-06-25
6a
les substituants du groupe 1 sont -COOR9 ou -CONR9R10 ;
les substituants du groupe 2 sont -S03H ou -SO2NR9R10 ;
R9 et R10, identiques ou différents, représentant un atome d'hydrogène ou un
radical hydrocarboné saturé, linéaire, ramifié ou cyclique, halogéné ou non;
à l'exclusion des composés de formule générale (I) dans laquelle A représente
un
groupement -CR6R7, R6 et R7 représentant un atome d'hydrogène, et dans
laquelle au moins trois des groupements X1, X2, X3, X4 et/ou X5 représentent
des
atomes d'hydrogène ;
leurs stéréoisomères, purs ou en mélange, mélanges racémiques, isomères
géométriques, tautomères, sels, hydrates, solvates, formes solides ou leurs
mélanges.
Dans le cadre de la présente invention, le terme alkyle désigne un radical
hydrocarboné saturé, linéaire, ramifié ou cyclique, halogéné ou non, ayant
plus
particulièrement de 1 à 24, de préférence 1, 2, 3, 4, 5, 6, 7, 8, 9 ou 10,
_____
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
7
atomes de carbone. On peut citer, par exemple, les radicaux méthyle,
trifluorométhyle, éthyle, n-propyle, isopropyle, n-butyle, isobutyle,
tertiobutyle, sec-
butyle, pentyle, néopentyle, n-hexyle ou cyclohexyle.
Le terme cycloalkyle désigne un groupe alkyle tel que défini ci-dessus
et formant au moins un cycle. On peut citer à titre de groupes cycloalkyle
ayant de
3 à 8 atomes de carbone, le cyclopropyle, cyclobutyle, cyclopentyle,
cyclohexyle,
cycloheptyle, et cyclooctyle.
Le terme alkyloxy fait référence à une chaîne alkyle liée à la molécule
par l'intermédiaire d'un atome d'oxygène (liaison éther). La chaîne alkyle
répond à
la définition précédemment énoncée. A titre d'exemple, on peut citer les
radicaux
méthoxy, trifluorométhoxy, éthoxy, n-propyloxy, isopropyloxy, n-butoxy, iso-
butoxy,
tertio-butoxy, sec-butoxy ou hexyloxy.
Le terme aryle fait référence à des groupes aromatiques comprenant de
préférence 5 à 14 atomes de carbone, avantageusement 6 à 14 atomes de
carbone, éventuellement interrompus par un ou plusieurs hétéroatomes choisis
parmi N, 0, S ou P (nommés plus spécifiquement hétéroaryle ). Ils sont
généralement mono- ou bi-cycliques et comprennent avantageusement de 6 à 14
atomes de carbone, tels que le phényle, a-naphtyle, 13-naphtyle, anthracényle
ou
fluorényle.
Le terme hétérocycle oxygéné ou soufré désigne un groupe cycloalkyle
tel que défini ci-dessus interrompu par un ou plusieurs hétéroatomes choisis
parmi
0 et S. On peut ainsi citer à titre d'exemple le thiopyrane ou pyrane.
Par atome d'halogène, on entend un atome de brome, chlore, fluor ou iode.
Un radical alkyle non halogéné est un radical alkyle tel que défini ci-dessus
ne présentant aucun atome d'halogène.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
8
Les composés de formule (I) présentant au moins un des groupements X3,
X4 ou X5 répondant à la formule R3, G3R3, R4, G4R4, R5 ou G5R5, dans
laquelle :
G3, G4 et G5 sont tels que définis ci-avant, et
R3, R4 et R5, identiques ou différents, représentent un groupement alkyle
substitué par un ou plusieurs substituant(s) du groupe 1 ou du groupe 2,
ont donc au moins un des groupements R3, R4 et R5 de X3, X4 ou X5
respectivement représentant un groupement alkyle substitué par un ou plusieurs
substituant(s) du groupe 1 ou du groupe 2.
Un aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle A représente un groupement carbonyle (CO).
Un autre aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle A représente un groupement oxime (C=N-0-H) ou éther
d'oxime (C=N-O-R8), R8 représentant un groupement alkyle, substitué ou non par
un groupement aryle ou cycloalkyle. Préférentiellement, R8 représente un
groupement méthyle.
Un autre aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle A représente un groupement CH2.
Un autre aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle A ne représente pas un groupement CH2.
Un autre aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle A représente un groupement -CR6R7, R6 représentant
un atome d'hydrogène et R7 représentant un groupement hydroxy, un groupement
alkyle ou un groupement -0R8, R8 représentant un groupement alkyle, substitué
ou non par un groupement aryle ou cycloalkyle.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
9
Préférentiellement, l'invention concerne les composés de formule générale
(I) dans laquelle A représente un groupement -CR6R7, R6 représentant un atome
d'hydrogène et R7 représentant un groupement hydroxy.
Un autre aspect préféré de l'invention concerne les composés de formule
générale (I) dans laquelle A représente un groupement -CR6R7, R6 représentant
un atome d'hydrogène et R7 représentant un groupement -0R8, R8 étant tel que
défini ci-dessus. En particulier, R8 représente un groupement alkyle
comprenant
préférentiellement 1, 2, 3 ou 4 atomes de carbone. Encore plus
préférentiellement,
R8 représente un groupement alkyle substitué par un groupement aryle ou
cycloalkyle, ledit groupement aryle ou cycloalkyle comportant en particulier 6
atomes de carbone.
Un autre aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle A représente un groupement -CR6R7, R6 et R7,
identiques ou différents, représentant un groupement hydroxy, un groupement
alkyle ou un groupement -0R8, R8 représentant un groupement alkyle, substitué
ou non par un groupement aryle ou cycloalkyle.
Un autre objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X3 et X5, identiques ou différents, représentent
respectivement un groupement R3 et R5, avec en particulier R3 et R5
représentant un atome d'hydrogène.
Un autre objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X3 et X5, identiques ou différents, représentent
respectivement un groupement R3 et R5, R3 et R5, identiques ou différents,
représentant un groupement alkyle substitué ou non par un ou plusieurs
substituant(s) du groupe 1 ou du groupe 2, tels que définis ci-avant.
Préférentiellement, X3 et X5, identiques ou différents, représentent
respectivement un groupement R3 et R5, R3 et R5, identiques ou différents,
représentant un groupement alkyle non substitué, comportant préférentiellement
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
1, 2, 3 ou 4 atomes de carbone. Encore plus préférentiellement, X3 et X5,
identiques ou différents, représentent un groupement méthyle.
Un autre aspect particulier de l'invention concerne les composés de formule
5 générale (I) dans laquelle X3 et X5, identiques ou différents,
représentent
respectivement un groupement G3R3 ou G5R5,
G3 et G5 étant tels que définis ci-avant, et
R3 et R5, identiques ou différents, représentant un atome d'hydrogène.
10 Un autre aspect particulier de l'invention concerne les composés de
formule
générale (I) dans laquelle X3 et X5, identiques ou différents, représentent
respectivement un groupement G3R3 ou G5R5,
G3 et G5 étant tels que définis ci-avant, et
R3 et R5, identiques ou différents, représentant un groupement alkyle
substitué ou
non par un ou plusieurs substituant(s) du groupe 1 ou du groupe 2, tels que
définis
ci-avant.
Un autre aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X3 et X5, identiques ou différents, représentent
respectivement un groupement G3R3 ou G5R5,
G3 et G5 étant tels que définis ci-avant, et
R3 et R5, identiques ou différents, représentant un groupement alkyle
substitué
par un ou plusieurs substituant(s) du groupe 1 ou du groupe 2, tels que
définis ci-
avant.
Un autre aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X4 représente un atome d'halogène (brome, chlore,
fluor, iode).
Un autre aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X4 représente un groupement R4 ou G4-R4,
G4 étant tel que défini ci-avant, et
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
11
R4 représentant un atome d'hydrogène.
Un autre aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X4 représente un groupement R4 ou G4-R4,
G4 étant tel que défini ci-avant, et
R4 représentant un groupement alkyle substitué ou non par un ou plusieurs
substituant(s) du groupe 1 ou du groupe 2, tels que définis ci-avant.
Un autre aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X4 représente un groupement R4 ou G4-R4,
G4 étant tel que défini ci-avant, et
R4 représentant un groupement alkyle substitué par un ou plusieurs
substituant(s)
du groupe 1 ou du groupe 2, tels que définis ci-avant. Préférentiellement, G4
représente un atome d'oxygène et/ou R4 représente un groupement alkyle
substitué par un substituant du groupe 1, en particulier par COOH. Encore plus
préférentiellement, X4 représente un groupement -0C(CH3)2COOH, -OCH2COOH
ou -SC(CH3)2COOH.
Un autre objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle un seul des groupements X3, X4 et X5 représente un
groupement R3, R4, R5, G3R3, G4R4 ou G5R5,
G3, G4 et G5 étant tels que définis ci-avant, et
R3, R4 ou R5, identiques ou différents, représentant un groupement alkyle
substitué par un ou plusieurs substituant(s) du groupe 1 ou du groupe 2, tels
que
définis ci-avant.
Un autre objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle seul X4, parmi X3, X4 et X5, représente un
groupement
R4 ou G4R4,
G4 étant tel que défini ci-avant, et
R4 représentant un groupement alkyle substitué par un ou plusieurs
substituant(s)
du groupe 1 ou du groupe 2, tels que définis ci-avant.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
12
Un autre objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle deux ou trois des groupements X3, X4 ou X5
représentent un groupement R3, R4, R5, G3R3, G4R4 ou G5R5,
G3, G4 et G5 étant tels que définis ci-avant, et
R3, R4 et R5, identiques ou différents, représentant un groupement alkyle
substitué par un ou plusieurs substituant(s) du groupe 1 ou du groupe 2, tels
que
définis ci-avant.
Un autre objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle G3, G4 et/ou G5 représentent un atome d'oxygène.
Préférentiellement, l'invention concerne les composés de formule générale
(I) dans laquelle un seul des groupements X3, X4 ou X5 répond à la formule
G3R3, G4R4 ou G5R5,
G3, G4 et G5 représentant un atome d'oxygène, et
R3, R4 ou R5, identiques ou différents, représentant un groupement alkyle
substitué par un ou plusieurs substituant(s) du groupe 1 ou du groupe 2, tels
que
définis ci-avant.
Encore plus préférentiellement, l'invention concerne les composés de
formule générale (I) dans laquelle seul X4, parmi X3, X4 et X5, répond à la
formule G4R4,
G4 représentant un atome d'oxygène, et
R4 représentant un groupement alkyle substitué par un ou plusieurs
substituant(s)
du groupe 1 ou du groupe 2, tels que définis ci-avant.
Un autre aspect préférentiel de l'invention concerne les composés de
formule générale (I) dans laquelle deux ou trois des groupements X3, X4 ou X5
répondent à la formule G3R3, G4R4 ou G5R5,
G3, G4 et G5 représentant un atome d'oxygène, et
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
13
R3, R4 et R5 représentant un groupement alkyle substitué par un ou plusieurs
substituant(s) du groupe 1 ou du groupe 2, tels que définis ci-avant.
Un aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle le substituant est choisi parmi les substituants du
groupe 1. Préférentiellement, le substituant du groupe 1 est du type -COOR9,
R9
étant tel que défini ci-avant et représentant préférentiellement un atome
d'hydrogène ou un groupement alkyle comprenant 1, 2, 3, 4, 5 ou 6 atomes de
carbone.
Un aspect particulier de l'invention concerne les composés de formule
générale (I) dans laquelle un seul des groupements X3, X4 ou X5 répond à la
formule -0C(CH3)2C00R9, R9 étant tel que défini ci-avant et représentant
préférentiellement un atome d'hydrogène ou un groupement alkyle comprenant 1,
2, 3, 4, 5 ou 6 atomes de carbone.
Encore plus préférentiellement, X4 représente un groupement
-0C(CH3)2C00R9, R9 étant tel que défini ci-avant et représentant
préférentiellement un atome d'hydrogène ou un groupement alkyle comprenant 1,
2, 3, 4, 5 ou 6 atomes de carbone.
Un objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X1 représente un groupement R1 ou G1 Ri,
G1 étant tel que défini ci-avant, et
R1 représentant un groupement alkyle non halogéné.
A titre d'exemple, X1 peut représenter un groupement -OCH2CH2CH3,
-SCH2CH2CH3 ou un groupement alkyle présentant 7 atomes de carbone.
Préférentiellement, R1 représente un groupement alkyle non halogéné
comportant 1, 2 ou 3 atomes de carbone.
Encore plus préférentiellement, X1 représente un groupement -CH3, -SCH3,
-OCH3, .
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
14
Un objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X1 représente un atome d'hydrogène. De préférence,
lorsque X1 représente un atome d'hydrogène, X2 est différent d'un atome
d'hydrogène.
Un objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X2 représente un atome d'hydrogène. De préférence,
lorsque X2 représente un atome d'hydrogène, X1 est différent d'un atome
d'hydrogène.
Un objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X2 représente un atome d'halogène (brome, chlore,
fluor, iode).
Un objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle X2 représente un groupement R2 ou G2R2, R2 et G2
étant tels que définis ci-avant. Préférentiellement, R2 représente un atome
d'hydrogène, un groupement -CF3 ou un groupement alkyle comprenant 1, 2, 3, 4,
5, 6, 7 ou 8 atomes de carbone. Encore plus préférentiellement, X2 représente
un
groupement -OR, R représentant un groupement alkyle, -CF3, -0CF3, -OH.
Un objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle D représente un groupement CH2.
Un autre objet particulier de l'invention concerne les composés de formule
générale (I) dans laquelle G2 forme avec D un hétérocycle oxygéné ou
soufré pour former un composé de formule (II) suivante :
X3
X4
el
Xi G2 1__
X5
A
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
(Il)
Préférentiellement, G2 représente un atome de soufre dans la formule
générale (II).
5
Selon un mode particulier de l'invention, les composés préférés sont
indiqués ci-dessous:
Composé 1: Acide
242,6-diméthy1-44344-(méthylthio)phény1]-3-oxo-
propyl]phénoxy]-2-méthyl-propanoïque
o
si OiOH
si
O
0
10 Composé 2: Acide 242,6-diméthy1-44342-(hexyloxy)phény1]-3-oxo-
propyl]phénoxy]-2-méthyl-propandique
o
0 U-L
le OH
lel
w.,,,...0 0
Composé 3: Acide
242,6-diméthy1-44344-(méthylthio)phény1]-3-
benzyloxypropyl]phénoxy]-2-méthyl-propandique
o
I . o)-
s OH
gW1
15 0
Composé 4: Acide
242,6-diméthy1-44344-(méthylthio)phény1]-3-
hydroxypropyl]phénoxy]-2-méthyl-propanoïque
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
16
o
I s =70H
IV
OH
Composé 5: Acide 2-[2,6-diméthy1-4-[344-(méthylthio)phényl]-3-méthoxyimino-
propyl]phénoxy]-2-méthyl-propandique
o
sl c'
si ohl
.
i
N
2
0
I
Composé 6: Acide 2-[2,6-diméthy1-4-[344-(méthoxy)phényl]-3-oxo-
propyl]phénoxy]-2-méthyl-propandique
o
. 0OH
o.
0
Composé 7 : Acide 2,6-diméthy1-4-[3-[4-(méthylthio)phényl]-3-oxo-
propyl]phénoxy-
éthanoïque
o
,s.
o
Composé 8: Acide 2-[2,6-diméthy1-4-[344-(propyloxy)phényl]-3-
oxo-
propyl]phénoxy]-2-méthyl-propandique
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
17
o
= c4o1-1
o
el
/
o
Composé 9: Acide 2-[2-méthy1-4-[344-(heptyl)phény1]-3-oxo-propyl]phénoxy]-2-
méthyl-propanoïque
o
. OH
*
0
Composé 10 : Acide 2-[2,6-diméthy1-4-[344-(méthylthio)phényl]-3-
éthyloxypropyl]phénoxy]-2-méthyl-propanoïque
o
is
*
0
1
COMPOSé 11 : Acide 2-[2,6-diméthy1-4-[342-
(trifluorométhyl)phény1]-3-oxo-
propyl]phénoxy]-2-méthyl-propandique
o
. Ofl
el
F 0
F F
COMPOSé 12: Acide 2-[2,6-diméthy1-4-[344-(méthylthio)phényl]propyl]phénoxy]-2-
méthyl-propanoïque
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
18
o
sl = c)OH
.
COMPOSé 13 : 2-[2,6-diméthy1-4-[344-(méthylthio)phényl]-3-oxo-propyl]phénoxy]-
2-
méthyl-propanoate d'isopropyle
o
s . lel ()() (
o
Composé 14: Acide 2-[2,6-diméthy1-4-[344-(méthylthio)phényl]-3-hydroxyimino-
propyl]phénoxy]-2-méthyl-propandique
o
. 0OH
S go
i
N
2
OH
COMPOSé 15: Acide
2-[2,6-diméthy1-4-[344-(propyloxy)phényl]-3-
hydroxypropyl]phénoxy]-2-méthyl-propanoïque
o
. OH
/\(:' lei
OH
COMPOSé 16: Acide 2-[2,6-diméthy1-4-[342-(trifluorométhoxy)phényl]-3-oxo-
propyl]phénoxy]-2-méthyl-propandique
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
19
o
= '30H
*
FO 0
r-F
F
COMPOSé 17: Acide 2-[2,6-diméthy1-4-[344-
(méthylthio)phényl]-3-
méthoxypropyl]phénoxy]-2-méthyl-propanoïque
o
. 0OH
sI
.
0
/
Composé 18: Acide 2-[2,6-diméthy1-4-[2,3-dihydro-4H-1-benzothiopyran-4-one-2-
yl]phénoxy]-2-méthyl-propandique
o
s . 0OH
O
0
Composé 19: Acide 2-[2-méthy1-4-[344-(propylthio)phényl]-3-oxo-propyl]phénoxe
2-méthyl-propanoïque
o
= OH
.........--...S oil
0
COMPOSé 20 : Acide 2-[3-[344-(méthylthio)phényl]-3-oxo-propyl]phénoxy]-2-
méthyl-propanoïque
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
"c7.7Y
S
do OH
el
o
Composé 21: Acide 2-[4-[344-méthylphényl]-3-oxo-propyl]phénoxy]-2-méthyl-
propanoïque
o
el ()OH
el
0
5 Composé 22: Acide 2-[2,6-diméthy1-4-[344-(méthylthio)phényl]-3-
cyclohexylméthoxypropyl]phénoxy]-2-méthyl-propanoïque
0
- OH
S
10 el
0
el
Composé 23: Acide 2-[2,6-diméthy1-4-[344-
(méthylthio)phényl]-3-
0
(>)L
0
/
15 butyloxypropyl]phénoxy]-2-méthyl-propanoïque
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
21
Composé 24: Acide 2-[2,6-diméthy1-4-[344-
(méthylthio)phényl]-3-
isopropyloxypropyl]phénoxy]-2-méthyl-propanoïque
o
si oOH
sI
.
0
Composé 25: Acide 2-[2,6-diméthy1-4-[344-(méthylthio)phényl]-3-
cyclohexyléthyloxypropyl]phénoxy]-2-méthyl-propandique
o
o\)-L
is W OH
W
CnO
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
22
L'invention concerne encore plus préférentiellement les composés suivants:
Composé 1: Acide
242,6-diméthy1-44344-(méthylthio)phény1]-3-oxo-
propyl]phénoxy]-2-méthyl-propandique ;
Composé 2: Acide 242,6-d
iméthy1-44342-(hexyloxy)phény1]-3-oxo-
propyl]phénoxy]-2-méthyl-propandiq ue ;
Composé 8 : Acide
242,6-d i méthy1-44344-(propyloxy)phény1]-3-oxo-
propyl]phénoxy]-2-méthyl-propandiq ue ;
Composé 13 : 242,6-diméthy1-44344-(méthylthio)phény1]-3-oxo-propyl]phénoxy]-2-
méthyl-propanoate d'isopropyle ;
Composé 16 : Acide 242,6-diméthy1-44342-(trifluorométhoxy)phény1]-3-oxo-
propyl]phénoxy]-2-méthyl-propanoïque.
Les composés de la présente invention comprennent leurs stéréoisomères
(diastéréoisomères, énantiomères), purs ou en mélange, leurs mélanges
racémiques, leurs isomères géométriques, leurs tautomères, leurs sels, leurs
hydrates, leurs solvates, leurs formes solides ainsi que leurs mélanges.
Les composés selon l'invention peuvent contenir un ou plusieurs centres
asymétriques. La présente invention inclut les stéréoisomères
(diastéréoisomères,
énantiomères), purs ou en mélange, ainsi que les mélanges racémiques et les
isomères géométriques. Quand un mélange énantiomériquement pur (ou enrichi)
est souhaité, il pourra être obtenu soit par purification du produit final ou
d'intermédiaires chiraux, soit par synthèse asymétrique suivant des méthodes
connues de l'homme de métier (utilisant par exemple des réactifs et
catalyseurs
chiraux). Certains composés selon l'invention peuvent avoir différentes formes
tautomères stables et toutes ces formes ainsi que leurs mélanges sont inclus
dans
l'invention.
La présente invention concerne également les sels pharmaceutiquement
acceptables des composés selon l'invention. D'une manière générale, ce terme
désigne les sels peu ou non toxiques obtenus à partir de bases ou d'acides,
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
23
organiques ou inorganiques. Ces sels peuvent être obtenus lors de l'étape de
purification finale du composé selon l'invention ou par incorporation du sel
sur le
composé déjà purifié.
Certains composés selon l'invention et leurs sels pourraient être stables
sous plusieurs formes solides. La présente invention inclut toutes les formes
solides des composés selon l'invention ce qui inclut les formes amorphes,
polymorphes, mono- et poly-cristallines.
Les composés selon l'invention peuvent exister sous forme libre ou sous
forme solvatée, par exemple avec des solvants pharmaceutiquement acceptables
tels que l'eau (hydrates) ou l'éthanol.
Les composés selon l'invention marqués par un ou des isotopes sont
également inclus dans l'invention : ces composés sont structurellement
identiques
mais diffèrent par le fait qu'au moins un atome de la structure est remplacé
par un
isotope (radioactif ou non). Des exemples d'isotopes pouvant être inclus dans
la
structure des composés selon l'invention peuvent être choisis parmi
l'hydrogène,
le carbone, l'oxygène, le soufre tels que 2H, 3H, 13C, 14C, 180, 170, 35s
respectivement. Les isotopes radioactifs 3H et 14C sont particulièrement
préférés
car faciles à préparer et à détecter dans le cadre d'études de
biodisponibilité in
vivo des substances. Les isotopes lourds (tels que 2H) sont particulièrement
préférés car ils sont utilisés comme standards internes dans des études
analytiques.
La présente invention a également pour objet un procédé de synthèse des
composés de formule générale (I) telle que définie ci-avant.
Le procédé de la présente invention comprend :
- une étape de mise en contact (i) en milieu basique ou en milieu acide d'au
moins
un composé de formule (A) avec au moins un composé de formule (B):
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
24
x x
i 10 2
(A)
x,
x
9
1 X,
0 (B)
dans lesquelles X1, X2, X3, X4 et X5 ont les définitions données précédemment,
- puis (ii) une étape de réduction des composés ainsi obtenus,
- et éventuellement (iii) une étape d'insertion de groupements fonctionnels.
Les conditions de mise en oeuvre de l'étape (i) en milieu acide ou basique et
de
l'étape (ii) sont à la portée de l'homme du métier et peuvent varier dans une
large
mesure. Les protocoles de synthèse peuvent être en particulier ceux présentés
dans la partie exemples de la présente invention.
La mise en contact de ces deux composés est avantageusement réalisée
de manière stoechiométrique. Elle est réalisée de préférence à une température
ambiante (entre environ 18 C et 25 C) et à pression atmosphérique.
En milieu basique, la réaction est de préférence réalisée en présence d'une
base forte, tel qu'un hydroxyde de métal alcalin, comme l'hydroxyde de sodium
ou
un alcoolate de métal alcalin comme l'éthylate de sodium.
En milieu acide, la réaction est de préférence réalisée en présence d'un
acide fort, tel que l'acide chlorhydrique.
Les composés ainsi obtenus peuvent être isolés par des méthodes
classiques et connues de l'homme du métier. Ils peuvent être ensuite utilisés
notamment à titre de médicaments ou de produits cosmétiques.
La présente invention a aussi pour objet les composés tels que décrits ci-
avant, à titre de médicaments.
La présente invention a également pour objet une composition
pharmaceutique comprenant, dans un support acceptable sur le plan
pharmaceutique, au moins un composé tel que décrit ci-dessus, éventuellement
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
en association avec un ou plusieurs autres principes actifs thérapeutiques
et/ou
cosmétiques.
Il s'agit avantageusement d'une composition pharmaceutique pour le
traitement des complications associées au syndrome métabolique, de l'insulino-
5
résistance, du diabète, des dyslipidémies, de l'athérosclérose, des maladies
cardiovasculaires, de l'obésité, de l'hypertension, des maladies
inflammatoires
(asthme, etc.), des pathologies neurodégénératives (Alzheimer, etc.), ou des
cancers, etc. La composition pharmaceutique selon l'invention est
préférentiellement utilisée pour traiter les dyslipidémies.
10 Il
s'agit préférentiellement d'une composition pharmaceutique pour traiter
les facteurs de risque cardiovasculaire liés aux dérèglements du métabolisme
lipidique et/ou glucidique (hyperlipidémie, diabète de type II, obésité etc.)
en
permettant la diminution du risque global.
15 Un
autre objet de l'invention concerne une composition nutritionnelle
comprenant au moins un composé tel que décrit ci-dessus.
Un autre objet de l'invention réside dans l'utilisation d'au moins un composé
tel que décrit ci-avant pour la préparation de compositions pharmaceutiques
20
destinées au traitement de diverses pathologies, notamment liées à des
troubles
du métabolisme parmi lesquelles on peut citer les dyslipidémies. Plus
généralement, l'invention a pour objet l'utilisation d'au moins un composé tel
que
décrit ci-avant pour la préparation de compositions pharmaceutiques destinées
à
traiter les facteurs de risques pour les maladies cardiovasculaires liés aux
25
dérèglements du métabolisme des lipides et/ou des glucides et destinées à
diminuer ainsi le risque global.
A titre d'exemple (et de manière non limitative), les composés selon
l'invention
pourront de manière avantageuse être administrés en combinaison avec d'autres
agents thérapeutiques et/ou cosmétiques, commercialisés ou en développement,
tels que :
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
26
- des anti-diabétiques : les insulinosécréteurs (sulfonylurées
(glibenclamide,
glimépiride, gliclazide, etc.) et glinides (répaglinide, natéglinide, etc.)),
les
inhibiteurs de l'alpha-glucosidase, les agonistes PPARy (thiazolidinediones
telles que rosiglitazone, pioglitazone), les agonistes mixtes PPARa/PPARy
(tesaglitazar, muraglitazar), les pan-PPAR (composés activant
simultanément les 3 isoformes PPAR), des biguanides (metformine), les
inhibiteurs de la Dipeptidyl Peptidase IV (MK-431, vildagliptin), les
agonistes du Glucagon-Like Peptide-1 (GLP-1) (exenatide), etc.
- l'insuline
- des molécules hypolipémiantes et/ou hypocholestérolémiantes : les fibrates
(fenofibrate, gemfibrozil), les inhibiteurs de la HMG CoA réductase ou
hydroxylméthylglutaryl Coenzyme A reductase (les statines telles que
atorvastatine, simvastatine, fluvastatine), les inhibiteurs de l'absorption du
cholestérol (ezetimibe, phytostérols), les inhibiteurs de la CETP ou
Cholesteryl Ester Transfer Protein (torcetrapib), les inhibiteurs de l'ACAT ou
Acyl-Coenzyme A cholesterol acylTransferase (Avasimibe, Eflucimibe), les
inhibiteurs MTP (Microsomal Triglyceride Transfer Protein), les agents
séquestrants des acides biliaires (cholestyramine), la vitamine E, les acides
gras poly-insaturés, les acides gras oméga 3, les dérivés de type acide
nicotinique (niacine), etc.
- des agents anti-hypertenseurs et les agents hypotenseurs : les
inhibiteurs
ACE (Angiotensin-Converting Enzyme) (captopril, enalapril, ramipril ou
quinapril), les antagonistes du récepteur de l'angiotensine II (losartan,
valsartan, telmisartan, eposartan, irbesartan, etc.), les béta-bloquants
(atenolol, metoprolol, labetalol, propranolol), les diurétiques thiazidiques
et
non thiazidiques (furosemide, indapamide, hydrochlorthiazide, anti-
aldosterone), les vasodilatateurs, les bloquants des canaux calciques
(nifedipine, felodipine ou amlodipine, diltiazem ou verapamil), etc.
- des agents anti-
plaquettaires : Aspirine, Ticlopidine, Dipyridamol,
Clopidogrel, flurbiprofen, etc.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
27
- des agents anti-obésité : Sibutramine, les inhibiteurs de lipases
(orlistat),
les agonistes et antagonistes PPAR8, les antagonistes du récepteur
cannabinoïde CB1 (rimonabant), etc.
- des agents anti-inflammatoires : par exemple, les corticoïdes
(prednisone,
betamethasone, dexamethasone, prednisolone, méthylprednisolone,
hydrocortisone, etc.), les AINS ou Anti-Inflammatoires Non Stéroidiens
dérivés de l'indole (indomethacine, sulindac), les AINS du groupe des
arylcarboxyliques (acide tiaprofenique, diclofenac, etodolac, flurbiprofen,
ibuprofen, ketoprofen, naproxen, nabumetone, alminoprofen), les AINS
dérivés de l'oxicam (meloxicam, piroxicam, tenoxicam), les AINS du groupe
des fénamates, les inhibiteurs sélectifs de la COX2 (celecoxib, rofecoxib),
etc.
- des agents anti-oxydants : par exemple le probucol, etc.
- des agents utilisés dans le traitement de l'insuffisance cardiaque : les
diurétiques thiazidiques ou non thiazidiques (furosemide, indapamide,
hydrochlorthiazide, anti-aldosterone), les inhibiteurs de l'ACE (captopril,
enalapril, ramipril ou quinapril), les digitaliques (digoxin, digitoxin), les
béta
bloquants (atenolol, metoprolol, labetalol, propranolol), les inhibiteurs de
Phosphodiesterases (enoximone, milrinone), etc.
- des agents utilisés pour le traitement de l'insuffisance coronaire : les
béta-
bloquants (atenolol, metoprolol, labetalol, propranolol), les bloquants des
canaux calciques (nifedipine, felodipine ou amlodipine, bepridil, diltiazem ou
verapamil), les agents donneurs de NO (trinitrine, isosorbide dinitrate,
molsidomine), l'Amiodarone, etc.
- des anticancéreux : les agents cytotoxiques (agents intéragissants avec
l'ADN, agents alkylants, cisplatine et dérivés), les agents cytostatiques (les
analogues GnRH (Gonatropin-Releasing Hormone), les analogues de la
somatostatine, les progestatifs, les anti-oestrogènes, les inhibiteurs de
l'aromatase, etc.), les modulateurs de la réponse immunitaire (interférons,
IL2, etc.), etc.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
28
- des anti-asthmatiques tels que des bronchodilatateurs (agonistes des
récepteurs béta 2), des corticoïdes, le cromoglycate, les antagonistes du
récepteur aux leucotriènes (montelukast), etc.
- des corticoïdes utilisés dans le traitement des pathologies de la peau
telles
que le psoriasis et les dermatites
- des vasodilatateurs et/ou des agents anti-ischémiques (buflomedil,
extrait
de Ginkgo Biloba, naftidrofuryl, pentoxifylline, piribédil), etc.
L'invention concerne également une méthode de traitement des pathologies
liées au métabolisme des lipides et/ou des glucides comprenant
l'administration à
un sujet, notamment humain, d'une quantité efficace d'un composé ou d'une
composition pharmaceutique tels que définis ci-avant. Au sens de l'invention
le
terme une quantité efficace se réfère à une quantité du composé suffisante
pour produire le résultat biologique désiré. Au sens de la présente invention
le
terme sujet signifie un mammifère et plus particulièrement un humain.
Le terme traitement désigne le traitement curatif, symptomatique ou
préventif. Les composés de la présente invention peuvent ainsi être utilisés
chez
des sujets (comme les mammifères, en particulier humains) atteints d'une
maladie
déclarée. Les composés de la présente invention peuvent aussi être utilisés
pour
retarder ou ralentir la progression ou prévenir une progression plus en avant
de la
maladie, améliorant ainsi la condition des sujets. Les composés de la présente
invention peuvent enfin être administrés aux sujets non malades, mais qui
pourraient développer normalement la maladie ou qui ont un risque important de
développer la maladie.
Les compositions pharmaceutiques selon l'invention comprennent
avantageusement un ou plusieurs excipients ou véhicules, acceptables sur le
plan
pharmaceutique. On peut citer par exemple des solutions salines,
physiologiques,
isotoniques, tamponnées, etc., compatibles avec un usage pharmaceutique et
connues de l'homme du métier. Les compositions peuvent contenir un ou
plusieurs agents ou véhicules choisis parmi les dispersants, solubilisants,
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
29
stabilisants, conservateurs, etc. Des agents ou véhicules utilisables dans des
formulations (liquides et/ou injectables et/ou solides) sont notamment la
méthylcellulose, l'hydroxyméthylcellulose, la carboxyméthylcellulose, le
polysorbate 80, le mannitol, la gélatine, le lactose, des huiles végétales,
l'acacia,
les liposomes, etc. Les compositions peuvent être formulées sous forme de
suspensions injectables, gels, huiles, comprimés, suppositoires, poudres,
gélules,
capsules, aérosols, etc., éventuellement au moyen de formes galéniques ou de
dispositifs assurant une libération prolongée et/ou retardée. Pour ce type de
formulation, on utilise avantageusement un agent tel que la cellulose, des
carbonates ou des amidons.
Les composés ou compositions selon l'invention peuvent être administrés
de différentes manières et sous différentes formes. Ainsi, ils peuvent être
par
exemple administrés de manière systémique, par voie orale, parentérale, par
inhalation ou par injection, comme par exemple par voie intraveineuse, intra-
musculaire, sous-cutanée, trans-dermique, intra-artérielle, etc. Pour les
injections,
les composés sont généralement conditionnés sous forme de suspensions
liquides, qui peuvent être injectées au moyen de seringues ou de perfusions,
par
exemple.
Il est entendu que le débit et/ou la dose injectée peuvent être adaptés par
l'homme du métier en fonction du patient, de la pathologie, du mode
d'administration, etc. Typiquement, les composés sont administrés à des doses
pouvant varier entre 1 pg et 2 g par administration, préférentiellement de 0,1
mg à
1 g par administration. Les administrations peuvent être quotidiennes voire
répétées plusieurs fois par jour, le cas échéant. D'autre part, les
compositions
selon l'invention peuvent comprendre, en outre, d'autres agents ou principes
actifs.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
LEGENDES DES FIGURES
Abréviations employées sur les figures :
- Cpd = composés ;
5 - Ctrl = contrôle ;
- mpk = mg/kg/jour ;
- LDL-cholesterol = Low Density Lipoprotein cholestérol ;
- HDL-cholesterol = High Density Lipoprotein cholestérol ;
- VLDL-cholesterol = Very Low Density Lipoprotein cholesterol.
Figures 1-1 à 1-66: Evaluation in vitro des propriétés activatrices PPAR des
composés selon l'invention en fonction de la dose
L'activation des PPAR est évaluée in vitro sur une lignée de fibroblastes de
rein de
singe (COS-7), par la mesure de l'activité transcriptionnelle de chimères
constituées du domaine de liaison à l'ADN du facteur de transcription Ga14 de
la
levure et du domaine de liaison au ligand des différents PPARs.
Les composés sont testés à des doses comprises entre 10-7 et 100 pM sur les
chimères Ga14-PPAR a, y, 8. Le facteur d'induction, c'est-à-dire le rapport
entre la
luminescence induite par le composé et la luminescence induite par le
contrôle, est mesuré pour chaque condition. Plus le facteur d'induction est
élevé,
plus le composé a un caractère activateur de PPAR.
- Figures 1-1, 1-2, 1-3 : Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 1 ;
- Figures 1-4, 1-5, 1-6 : Evaluation in vitro des propriétés activatrices de
PPARa, y, 8 du composé 2;
- Figures 1-7, 1-8, 1-9 : Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 3;
- Figures 1-10, 1-11, 1-12 : Evaluation in vitro des propriétés
activatrices de
PPARa, y, 8 du composé 4;
- Figure 1-13, 1-14, 1-15: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 6 du composé 5;
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
31
-
- Figures 1-16, 1-17, 1-18: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 6
- Figures 1-19, 1-20, 1-21: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 7
- Figures 1-22, 1-23, 1-24: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 8
- Figures 1-25, 1-26, 1-27: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 9
- Figures 1-28, 1-29, 1-30: Evaluation in vitro des propriétés activatrices de
PPARa, y, 8 du composé 10
- Figures 1-31, 1-32, 1-33: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 11
- Figures 1-34, 1-35, 1-36: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 12
- Figures 1-37, 1-38, 1-39: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 14
- Figures 1-40, 1-41, 1-42: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 17
- Figures 1-43, 1-44, 1-45: Evaluation in vitro des propriétés activatrices de
PPARa, y, 8 du composé 18
- Figures 1-46, 1-47, 1-48: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 19
- Figures 1-49, 1-50, 1-51: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 20
- Figures 1-52, 1-53, 1-54: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 21
- Figures 1-55, 1-56, 1-57: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 22
- Figures 1-58, 1-59, 1-60: Evaluation in vitro des propriétés activatrices de
PPARa, y, 6 du composé 23
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
32
- Figures 1-61, 1-62, 1-63: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 24
- Figures 1-64, 1-65, 1-66: Evaluation in vitro des propriétés activatrices
de
PPARa, y, 8 du composé 25
Figures 2-1 à 2-9: Evaluation in vivo, chez la souris ApoE2/E2, des propriétés
hypolipémiantes et des propriétés stimulatrices de la synthèse de HDL-
cholestérol des composés selon l'invention
L'effet des composés selon l'invention est évalué in vivo chez la souris
humanisée
pour l'isoforme E2 de l'apolipoproteine E (E2/E2).
Les taux de cholestérol total, de triglycérides et d'acides gras libres
plasmatiques
sont mesurés chez la souris dyslipidémique E2/E2 après 8 ou 14 jours de
traitement par voie orale avec les composés selon l'invention. Ces paramètres
sont comparés à ceux obtenus avec des animaux contrôles (non traités par les
composés selon l'invention) : la différence mesurée témoigne de l'effet
hypolipémiant des composés selon l'invention.
- Figure 2-1 : Taux de cholestérol plasmatique après 8 jours de traitement
avec le composé 1, administré à 50 mpk;
- Figure 2-2: Taux de triglycérides plasmatiques après 8 jours de
traitement
avec le composé 1, administré à 50 mpk
- Figure 2-3: Taux de cholestérol plasmatique après 14 jours de traitement
avec le composé 8, administré à 3 et 10 mpk.
L'efficacité des composés selon l'invention est aussi évaluée par mesure, dans
le
tissu hépatique, de l'expression de gènes impliqués dans le métabolisme
lipidiques et/ou glucidique et la dissipation d'énergie. Les niveaux
d'expression de
chaque gène sont normalisés par rapport au niveau d'expression du gène de
référence 36B4. Le facteur d'induction, c'est-à-dire le rapport entre le
signal relatif
(induit par le composé selon l'invention) et la moyenne des valeurs relatives
du
groupe contrôle, est ensuite calculé. Plus ce facteur est élevé, plus le
composé a
CA 02655643 2013-10-09
=
33
un caractère activateur d'expression génique. Le résultat final est représenté
comme moyenne des valeurs d'induction dans chaque groupe expérimental.
- Figure 2-4: Expression de PDK4 (Pyruvate Deshydrogenase Kinase,
isoforme 4) dans le tissu hépatique, chez la souris E2/E2, après 8 jours de
traitement avec le composé 1, administré à 50 mpk
- Figure 2-5: Expression de l'ApoCIII (Apolipoprotéine C3) dans le tissu
hépatique, chez la souris E2/E2, après 8 jours de traitement avec le composé
1, administré à 50 mpk
- Figure 2-6: Expression de l'ACO (acyl-Coenzyme A oxidase 1, palmitoyl)
dans le tissu hépatique, chez la souris E2/E2, après 8 jours de traitement
avec le composé 1, administré à 50 mpk
- Figure 2-7: Expression de PDK4 (Pyruvate Deshydrogenase Kinase,
isoforme 4) dans le tissu hépatique, chez la souris E2/E2, après 14 jours de
traitement avec le composé 8, administré à 3 et 10 mpk
- Figure 2-8: Expression de l'ApoCIII (Apolipoprotéine C3) dans le tissu
hépatique, chez la souris E2/E2, après 14 jours de traitement avec le
composé 8, administré à 3 et 10 mpk
- Figure 2-9: Expression de l'ACO (acyl-Coenzyme A oxidase 1, palmitoyl)
dans le tissu hépatique, chez la souris E2/E2, après 14 jours de traitement
avec le composé 8, administré à 3 et 10 mpk
Figures 3-1 à 3-6: Evaluation in vivo, chez la souris db/db, des propriétés
hypolipémiantes et stimulatrices de la synthèse de HDL-cholestérol des
composés selon l'invention
L'effet des composés selon l'invention est évalué in vivo chez la souris db/db
par la
mesure des taux de HDL-cholestérol, de triglycérides et d'acides gras libres
plasmatiques après 28 jours de traitement par voie orale avec les composés
selon
l'invention. Ces paramètres sont comparés à ceux obtenus avec des animaux
contrôles (non traités par les composés selon l'invention) : la différence
mesurée
témoigne de l'effet hypolipémiant des composés selon l'invention.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
34
- Figure 3-1 : Taux de HDL-cholestérol plasmatique après 28 jours de
traitement avec le composé 8, administré à 50 mpk
- Figure 3-2 : Taux de triglycérides plasmatiques après 28 jours de
traitement
avec le composé 8, administré à 50 mpk
- Figure 3-3: Taux d'acides gras libres plasmatiques après 28 jours de
traitement avec le composé 8, administré à 50 mpk.
L'efficacité des composés selon l'invention est aussi évaluée par mesure, dans
les
tissus hépatiques et musculaires (squelettiques), de l'expression de gènes
impliqués dans le métabolisme lipidique, glucidique et la dissipation
d'énergie. Les
niveaux d'expression de chaque gène sont normalisés par rapport au niveau
d'expression des gènes de référence 36B4 dans le tissu hépatique ou 18S dans
le
muscle squelettique gastrocnémien. Le facteur d'induction, c'est-à-dire le
rapport
entre le signal relatif (induit par le composé selon l'invention) et la
moyenne des
valeurs relatives du groupe contrôle, est ensuite calculé. Plus ce facteur est
élevé,
plus le composé a un caractère activateur d'expression génique. Le résultat
final
est représenté comme moyenne des valeurs d'induction dans chaque groupe
expérimental.
- Figure 3-4: Expression de PDK4 (Pyruvate Deshydrogenase Kinase,
isoforme 4) dans le tissu hépatique, chez la souris db/db, après 28 jours de
traitement avec le composé 8 administré à 50 mpk
- Figure 3-5: Expression de l'ACO (acyl-Coenzyme A oxidase 1, palmitoyl)
dans le tissu hépatique, chez la souris db/db, après 28 jours de traitement
avec le composé 8 administré à 50 mpk
- Figure 3-6: Expression d'UCP2 (uncoupling protein 2) dans le muscle
squelettique, chez la souris db/db, après 28 jours de traitement avec le
composé 8, administré à 50 mpk
CA 02655643 2013-10-09
Figure 4-1: Evaluation in vitro des propriétés anti-inflammatoires des
composés selon l'invention par mesure de la sécrétion de MCP1 par des
monocytes traités avec les composés selon l'invention et stimulés avec du
PMA
Les effets anti-inflammatoires des composés selon l'invention ont été évalués
par la
mesure de la sécrétion de MCP1 (Monocyte chemotactic protein-1) par des
monocytes THP1 traités pendant 24 heures avec les composés selon l'invention
et
stimulés simultanément avec du PMA (Phorbol 12-myristate 13-acetate, provoque
10 une réponse inflammatoire des cellules et leur différenciation en
macrophages).
Plus la quantité de MCP-1 sécrétée est diminuée, plus le composé selon
l'invention
inhibe la réaction inflammatoire.
- Figure 4-1: Sécrétion de MCP1 (Monocyte chemotactic protein-1) dans les
monocytes THP1, après 24 heures de traitement avec le composé 8
administré à 1pM
ANALYSES STATISTIQUES
Les études statistiques réalisées consistent en un test T de student
(0/00,000,
) et/ou
une Analyse de la Variance univariée à un facteur (ANOVA), suivie d'un test de
Tukey (*/**/***). Les résultats sont comparés par rapport au groupe contrôle
selon la
valeur du paramètre p:
0/*: p<0,05 ; 00/**: p<0,01 ; 000/***: p<0,001.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
36
EXEMPLES
Les réactifs et catalyseurs usuels sont disponibles commercialement (Aldrich,
Alfa Aesar, Acros, Fluka ou Lancaster selon les cas).
Les spectres de Résonance Magnétique Nucléaire du Proton (RMN 1H) ont été
enregistrés sur un spectromètre Bruker AC300P. Les déplacements chimiques
sont exprimés en ppm (partie par million) et les multiplicités par les
abréviations
usuelles.
Exemple 1 : Description des protocoles généraux de synthèse selon
l'invention
Les composés selon l'invention sont obtenus par réduction, selon l'un des
protocoles mentionnés ci-dessous, des composés revendiqués et/ou décrits dans
le brevet US2005176808.
Procédure générale A: réduction des diphénylpropénones par le triéthylsilane
La diphénylpropèn-2-one est solubilisée dans du dichlorométhane. Le
triéthylsilane est ajouté puis, goutte à goutte, l'acide trifluoroacétique
(7,5
équivalents). Le mélange réactionnel est agité à température ambiante et
l'avancement de la réaction est suivi par chromatographie sur couche mince.
Une
fois le produit de départ consommé, le milieu est lavé avec de l'eau. La phase
aqueuse est extraite par du dichlorométhane, les phases organiques sont
réunies,
séchées sur sulfate de magnésium puis le solvant est éliminé par évaporation
sous pression réduite. Le résidu d'évaporation est purifié par chromatographie
sur
gel de silice (HPLC préparative, lichrospher (Merck) RP18 12pm 100A, colonne :
25*250 mm).
Procédure générale B: réduction des diphénylpropénones par le
tétrachlorosilane
La diphénylpropèn-2-one est solubilisée dans de l'acétonitrile. L'iodure de
sodium
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
37
est ajouté puis le tétrachlorosilane goutte à goutte. Le mélange réactionnel
est
agité à température ambiante, l'avancement de la réaction est suivi par
chromatographie sur couche mince. Une fois le produit de départ consommé (30
min à 2 heures), le milieu est dilué avec du chloroforme puis lavé avec de
l'eau. La
phase aqueuse est extraite par du chloroforme, les phases organiques sont
réunies et lavées avec une solution saturée de sulfite de sodium puis séchées
sur
sulfate de magnésium. Le solvant est éliminé par évaporation sous pression
réduite. Le résidu d'évaporation est purifié par chromatographie sur gel de
silice
(HPLC préparative, lichrospher (Merck) RP18 12pm 100A, colonne : 25*250 mm).
Procédure générale C : synthèse des oximes et des éthers d'oxime
La diphénylpropan-3-one est solubilisée dans de la pyridine. Le chlorhydrate
de 0-
alkylhydroxylamine est ajouté. Après 16 h de reflux, le milieu est évaporé
sous
pression réduite et le résidu d'évaporation est purifié par chromatographie
flash
sur gel de silice.
Procédure générale D : synthèse des alcools
La diphénylpropan-3-one est solubilisée dans de l'éthanol. Le borohydrure de
sodium est ajouté. Le mélange réactionnel est maintenu 16 heures sous
agitation
à 50 C, le milieu est refroidi et hydrolysé. Les solvants sont éliminés par
évaporation sous pression réduite, le résidu est repris par une solution
aqueuse
diluée d'acide chlorhydrique et extrait par du chlorure de méthylène.
La phase organique est lavée avec de l'eau, séchée sur sulfate de magnésium,
le
chlorure de méthylène est éliminé par évaporation sous pression réduite et le
résidu est purifié par chromatographie sur gel de silice (HPLC préparative,
lichrospher (Merck) RP18 12pm 100A, colonne : 25*250 mm).
Procédure générale E : synthèse des éthers
Le diphénylpropan-3-ol est solubilisé dans un mélange eau/alcool en présence
d'une quantité catalytique d'acide trifluoroacétique. Le milieu réactionnel
est
maintenu sous agitation vive à la température adéquate puis, concentré sous
pression réduite et, extrait au chlorure de méthylène. Les phases organiques
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
38
combinées sont séchées sur sulfate de magnésium, filtrées puis concentrées
sous
pression réduite. Le résidu d'évaporation est purifié par chromatographie sur
gel
de silice (HPLC préparative, lichrospher (Merck) RP18 12pm 100A, colonne :
25*250 mm).
Exemple 2 : Synthèse des composés selon l'invention
Composé 1: Acide
212,6-diméthvI-41314-(méthvIthio)phénv11-3-oxo-
probvflphénoxv1-2-méthvl-probandique
o
o\)-L
sI
el OH
gW1
0
Ce composé a été préparé selon la procédure générale A, à partir de l'acide 2-
[2,6-diméthy1-44344-(méthylthio)phény1]-3-oxo-prop-2-ényl]phénoxy]-2-méthyl-
propanoïque, au moyen de 1,3 équivalents de triéthylsilane ;
Aspect : solide blanc ; F= 109-110 C.
RMN 1H (300 MHz, CDCI3, 8 en ppm) : 1,42 (s, 6H), 2,19 (s, 6H), 2,53 (s, 3H),
2,89 (t, 2H, J=7,59Hz), 3,25 (t, 2H, J=7,59Hz), 6,89 (s, 2H), 7,31 (d, 2H,
J=8,17Hz), 7,88 (d, 2H, J=8,17Hz).
SM(ES-MS) : 385,3 (M-1).
Composé 2: Acide
2-1.2,6-diméthv1-41312-(hexvIoxv)phénv11-3-oxo-
probvflphénoxv1-2-méthvl-probandique
o
le (1)-LOH
lel
///() o
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
39
Ce composé a été préparé selon la procédure générale A, à partir de l'acide 2-
[2,6-diméthy1-44342-(hexyloxy)phény1]-3-oxo-prop-2-ényl]phénoxy]-2-méthyl-
propanoïque au moyen de 1 équivalent de triéthylsilane ;
Aspect : solide blanc ; F= 73-75 C.
RMN 1H (300 MHz, CDCI3, 8 en ppm) : 0,89 (t, 3H, J=6,72Hz), 1,32 (m, 4H), 1,45
(m, 2H), 1,52 (s, 6H), 1,82 (m, 2H), 2,21 (s, 6H), 2,93 (t, 2H, J=8,19Hz),
3,33 (t,
2H, J=8,19Hz), 4,05 (t, 2H, J=6,42Hz), 6,87 (s, 2H), 6,95 (m, 1H), 7,01 (m,
1H),
7,44 (m, 1H), 7,68 (dd, 1H, J=1,77Hz, J=7,89Hz).
SM(ES-MS) : 439,4 (M-1).
Composé 3: Acide
212,6-diméthvI-41314-(méthvIthio)phénv11-3-
benzvloxvpropvflphénoxv1-2-méthvl-propanoïque
o
,c),V-
I . s OH
gW1
o,
L'acide
242,6-diméthy1-44344-(méthylthio)phény1]-3-hydroxypropyl]phénoxy]-2-
méthyl-propanoïque est solubilisé dans du N,N-diméthylformamide puis, cette
solution est traitée à 0 C par de l'hydrure de sodium (2,2 équivalents)
pendant 15
minutes. Le bromure de benzyle (2,2 équivalents) est alors ajouté et le milieu
est
laissé 16 heures sous agitation, pour revenir à température ambiante. Le
milieu
est dilué à l'aide d'une solution saturée de chlorure d'ammonium puis extrait
par
de l'acétate d'éthyle. Les phases organiques combinées sont séchées sur
sulfate
de magnésium, filtrées puis concentrées sous pression réduite.
Le résidu d'évaporation est solubilisé dans de l'éthanol en présence de soude
2N
(20 éq.). Après 6 heures sous agitation, les solvants sont évaporés sous
pression
réduite. Le résidu est acidifié à l'aide d'une solution diluée d'acide
chlorhydrique
puis extrait par du chlorure de méthylène. Les phases organiques combinées
sont
séchées sur sulfate de magnésium, filtrées puis concentrées sous pression
réduite. Le résidu d'évaporation est purifié par chromatographie sur gel de
silice
(HPLC préparative, lichrospher (Merck) RP18 12pm 100A, colonne : 25*250 mm).
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
Aspect : solide blanchâtre ; F=69-71 C.
RMN 1H (300 MHz, CDCI3, 8 en ppm) : 1,49 (s, 6H), 1,90 (m, 1H), 2,14 (m, 1H),
2,19 (s, 6H), 2,52 (m, 1H), 2,52 (s, 3H), 2,68 (m, 1H), 4,24 (d, 1H,
J=11,8Hz), 4,28
(t, 1H, J=5,25Hz), 4,47 (d, 1H, J=11,8Hz), 6,77 (s, 2H), 7,31 (m, 9H).
5 SM(ES-MS) : 477,3 (M-1).
Composé 4: Acide 212,6-diméthy1-41314-(méthylthio)phény11-
3-
hydroxybropyllphénoxyl-2-méthyl-probanoïque
o
. o)-LOH
S
gel
OH
10 Ce composé a été préparé selon la procédure générale D à partir de
l'acide 242,6-
diméthy1-44344-(méthylthio)phény1]-3-oxo-propyl]phénoxy]-2-méthyl-propanoïque
au moyen de 3 équivalents de borohydrure de sodium ;
Aspect : solide jaunâtre ; F= 49-51 C.
RMN 1H (300 MHz, CDCI3, 8 en ppm) : 1,52 (s, 6H), 2,04 (m, 2H), 2,22 (s, 6H),
2,5
15 (s, 3H), 2,63 (m, 2H), 4,66 (dd, 1H, J=5,7Hz, J=7,5Hz), 6,84 (s, 2H),
7,27 (m, 4H).
SM(ES-MS) : 389,3 (M-F1).
Composé 5: Acide 212,6-diméthy1-41314-(méthylthio)phény11-3-méthoxvimino-
propyllphénoxyl-2-méthyl-probandique
o
sI . ()).OH
O'
N
2
?
Ce composé a été préparé selon la procédure générale C, à partir de l'acide 2-
[2,6-diméthy1-44344-(méthylthio)phény1]-3-oxo-propyl]phénoxy]-2-méthyl-
propanoïque ;
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
41
Aspect : huile visqueuse jaunâtre.
RMN 1H (300 MHz, CDCI3, 8 en ppm) : 1,50 (s, 6H), 2,21 (s, 6H), 2,49 (s, 3H),
2,73 (m, 2H), 2,96 (m, 2H), 3,99 (s, 3H), 6,84 (s, 2H), 7,20 (d, 2H,
J=8,47Hz), 7,51
(d, 2H, J=8,47Hz).
SM(MALDI TOF) :416,4 (M-F1).
Composé 6: Acide
212,6-diméthy1-41314-(méthoxv)phény11-3-oxo-
propyllphénoxyl-2-méthyl-probanoïque
o
o\)-LOH
/C) = W
0
Ce composé a été préparé selon la procédure générale B, à partir de l'acide 2-
[2,6-d iméthy1-44344-(méthoxy)phény1]-3-oxo-prop-2-ényl]phénoxy]-2-méthyl-
propanoïque au moyen de 5 équivalents d'iodure de sodium et 5 équivalents de
tétrachlorosilane ;
Aspect : solide blanc ; F= 279-281 C.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 1,52 (s, 6H), 2,22 (s, 6H), 2,94 (t, 2H,
J=7,59
Hz), 3,20 (t, 2H, J=7,59Hz), 3,87 (s, 3H), 6,88 (s, 2H), 6,93 (d, 2H,
J=8,76Hz),
7,95 (d, 2H, J=8,76Hz).
SM(ES-MS) : 369,3 (M-1).
Composé 7 : Acide 2,6-diméthy1-41314-(méthylthio)phény11-3-oxo-propyllphénoxv-
éthanoïque
o
o)-L
OH
0
Ce composé a été préparé selon la procédure générale B à partir de l'acide 2,6-
diméthy1-44344-(méthylthio)phény1]-3-oxo-prop-2-ényl]phénoxy-éthanoïque
au
moyen de 5 équivalents d'iodure de sodium et 5 équivalents de
tétrachlorosilane;
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
42
Aspect : solide blanc ; F= 138-139 C.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 2,28 (s, 6H), 2,54 (s, 3H), 2,96 (t, 2H,
J=7,60Hz), 3,24 (t, 2H, J=7,60Hz), 4,45 (s, 2H), 6,92 (s, 2H), 7,27 (d, 2H,
J=8,47Hz), 7,88 (d, 2H, J=8,47Hz).
SM(ES-MS) : 357,2 (M-1).
Composé 8: Acide 2-1.2,6-diméthyl-41314-(propyloxv)phény11-3-
oxo-
propyllphénoxyl-2-méthyl-probandique
o
/C) s W
/
0
Ce composé a été préparé selon la procédure générale B, à partir de l'acide 2-
[2,6-d iméthy1-44344-(propyloxy)phény1]-3-oxo-prop-2-ényl]phénoxy]-2-méthyl-
propanoïque au moyen de 5 équivalents d'iodure de sodium et 5 équivalents de
tétrachlorosilane;
Aspect : solide blanc ; F= 89-92 C.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 1,06 (t, 3H, J=7,30Hz), 1,54 (s, 6H), 1,85
(m,
2H), 2,23 (s, 6H), 2,95 (t, 2H, J=7,75Hz), 3,22 (t, 2H, J=7,75Hz), 3,99 (t,
2H,
J=6,57Hz), 6,89 (s, 2H), 6,93 (d, 2H, J=8,91Hz), 7,95 (d, 2H, J=8,91Hz).
SM(ES-MS) : 397,3 (M-1).
Composé 9: Acide 2-12-méthy1-41314-(heptyl)phény11-3-oxo-propyllphénoxyl-2-
méthyl-probanoïque
o
W
el
0
Ce composé a été préparé selon la procédure générale B, à partir de l'acide
242-
méthy1-44344-(heptyl)phény1]-3-oxo-prop-2-ényl]phénoxy]-2-méthyl-propanoïq ue
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
43
au moyen de 5 équivalents d'iodure de sodium et 5 équivalents de
tétrachlorosilane ;
Aspect : solide blanc ; F= 53-54 C.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 0,89 (t, 3H, J=6,72Hz), 1,29 (m, 8H), 1,61
(s,
6H), 1,62 (m, 2H), 2,24 (s, 3H), 2,66 (t, 2H, J=7,74Hz), 2,99 (t, 2H,
J=7,59Hz),
3,26 (t, 2H, J=7,59Hz), 6,78 (d, 1H, J=8,46Hz), 7,01 (d, 1H, J=8,46Hz), 7,08
(s,
1H), 7,26 (d, 2H, J=8,16Hz), 7,89 (d, 2H, J=8,16Hz).
SM(ES-MS) : 423,3 (M-1).
Composé 10 : Acide 212,6-diméthy1-41314-(méthylthio)phény11-3-
éthyloxybrobvflphénoxv1-2-méthyl-probanoïque
o
is
.
0
1
Ce composé a été préparé selon la procédure générale E à partir de l'acide
242,6-
diméthy1-44344-(méthylthio)phény1]-3-hydroxypropyl]phénoxy]-2-méthyl-
propanoïque au reflux d'un mélange éthanol / eau 2/3 :1/3 pendant 72 heures ;
Aspect : huile visqueuse.
RMN 1H (300 MHz, CDCI3, 8 en ppm) : 1,19 (t, 3H, J=7,02Hz), 1,48 (s, 6H), 1,87
(m, 1H), 2,07 (m, 1H), 2,19 (s, 6H), 2,5 (s, 3H), 2,53 (m, 1H), 2,64 (m, 1H),
3,34
(m, 2H), 4,14 (dd, 1H, J=2,34Hz, J=5,55Hz), 6,8 (s, 2H), 7,24 (m, 4H).
SM(ES-MS) : 417,4 (M-F1).
Composé 11 : Acide 212,6-diméthy1-41312-(trifluorométhyl)phény11-
3-oxo-
probvflphénoxyl-2-méthyl-probandique
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
44
o
. (1)LOH
lei
F 0
F F
Ce composé a été préparé selon la procédure générale A, à partir de l'acide 2-
[2,6-d iméthy1-44342-(trifluorométhyl)phény1]-3-oxo-prop-2-ényl]phénoxy]-2-
méthyl-
propanoïque au moyen de 1 équivalent de triéthylsilane;
Aspect : huile visqueuse jaunâtre.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 1,53 (s, 6H), 2,22 (s, 6H), 2,95 (t, 2H,
J=7,30Hz), 3,15 (t, 2H, J=7,30Hz), 6,86 (s, 2H), 7,32 (m, 1H), 7,56 (m, 2H),
7,71
(m, 1H).
SM(ES-MS) : 407,3 (M-1).
Composé 12: Acide 212,6-diméthvI-41314-(méthvIthio)phénvflpropvflphénoxv1-2-
méthvl-propanoïque
o
sl . o
OH
.
L'acide 242,6-diméthy1-44344-(méthylthio)phény1]-3-oxo-prop-2-ényl]phénoxy]-2-
méthyl-propandique est solubilisé dans de l'acide trifluoroacétique. Le
triéthylsilane est ajouté (2,7 équivalents) goutte à goutte. L'ensemble est
agité à
température ambiante pendant 16h, l'avancement de la réaction est suivi par
chromatographie sur couche mince. Une fois le produit de départ consommé, le
milieu est lavé avec de l'eau. La phase aqueuse est extraite par du
dichlorométhane, les phases organiques sont réunies, séchées sur sulfate de
magnésium puis le solvant est éliminé par évaporation sous pression réduite.
Le
résidu d'évaporation est purifié par chromatographie sur gel de silice (Eluant
:
dichorométhane 95, méthanol 5).
Aspect : solide blanc ; F= 181-182 C.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
RMN 1H (300 MHz, DMSO-d6, 8 ppm) : 1,24 (s, 6H), 1,81 (m, 2H), 2,16 (s, 6H),
2,42 (m, 2H), 2,44 (s, 3H), 2,54 (m, 2H), 6,73 (s, 2H), 7,15 (m, 4H).
SM(ES-MS) : 371,4 (M-1).
5 Composé 13 : 212,6-diméthy1-41314-(méthylthio)phény11-3-oxo-
propyllphénoxy1-2-
méthyl-propanoate d'isopropyle
o
s = W
o
Ce composé a été préparé selon la procédure générale A, à partir du 242,6-
diméthy1-44344-(méthylthio)phény1]-3-oxo-prop-2-ényl]phénoxy]-2-méthyl-
10 propanoate d'isopropyle au moyen de 1 équivalent de triéthylsilane;
Aspect : solide blanc ; F= 64-65 C.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 1,34 (d, 6H, J=6,15Hz), 1,45 (s, 6H), 2,19
(s,
6H), 2,54 (s, 3H), 2,93 (t, 2H, J=7,89Hz), 3,21 (t, 2H, J=7,89Hz), 5,14 (sep,
1H,
J=6,15Hz), 6,84 (s, 2H), 7,26 (d, 2H, J=8,49Hz), 7,89 (d, 2H, J=8,49Hz).
15 SM(MALDI-TOF) : 429,3 (M-F1).
Composé 14: Acide 212,6-diméthy1-41314-(méthylthio)phény11-3-hydroxyimino-
propyllphénoxy1-2-méthyl-propandique
o
o\)-
W OH
S
/ le
I
N
2
OH
20 Ce composé a été préparé selon la procédure générale C, à partir de
l'acide 2-
[2,6-diméthy1-44344-(méthylthio)phény1]-3-oxo-propyl]phénoxy]-2-méthyl-
propanoïque ;
Aspect : solide blanc ; F= 144-147 C.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
46
RMN 1H (300 MHz, DMSO-d6, 8 ppm) : 1,31 (s, 6H), 2,11 (s, 6H), 2,49 (s, 3H),
2,61 (dd, 2H, J=7,17Hz, J=8,76Hz), 2,91 (t, 2H, J=8,47Hz),6,85 (s, 2H), 7,23
(d,
2H, J=8,47Hz), 7,54 (d, 2H, J=8,47Hz), 11,21 (s, 1H), 12,81 (s, 1H).
SM(ES-MS) : 400,3 (M-1).
Composé 15: Acide 212,6-diméthy1-41314-(propyloxv)phény11-3-hydroxv-
propyllphénoxv1-2-méthyl-propandique
o
00 o
OH
OH
Ce composé a été préparé selon la procédure générale D à partir de l'acide 2-
[2,6-
diméthy1-44344-(propyloxy)phény1]-3-oxo-propyl]phénoxy]-2-méthyl-propanoïque ;
Aspect : huile visqueuse jaunâtre.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 1,05 (t, 3H, J=7,46Hz), 1,50 (s, 6H), 1,82
(m,
2H), 2,04 (m, 2H ), 2,20 (s, 6H), 2,56 (m, 2H), 3,93 (t, 2H, J= 6,57Hz), 4,63
(t,
1H, J=6,57Hz), 6,81 (s, 2H), 6,88 (d, 2H, J=8,61Hz), 7,25 (d, 2H, J=8,61Hz).
SM(ES-MS) : 399,4 (M-1).
Composé 16: Acide 212,6-diméthy1-41312-(trifluorométhoxv)phény11-3-oxo-
propyllphénoxv1-2-méthyl-propandique
o
. 0
OH
fel
F 0 0
r----F
F
Ce composé a été préparé selon la procédure générale B, à partir de l'acide 2-
[2,6-d iméthy1-44342-(trifluorométhoxy)phény1]-3-oxo-prop-2-ènyl]phénoxy]-2-
méthyl-propanoïque au moyen de 5 équivalents de iodure de sodium et 5
équivalents de tétrachlorosilane ;
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
47
Aspect : huile visqueuse jaunâtre.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 1,53 (s, 6H), 2,21 (s, 6H), 2,94 (t, 2H,
J=7,46Hz), 3,23 (t, 2H, J=7,46Hz), 6,85 (s, 2H), 7,36 (m, 2H), 7,54 (m, 1H),
7,63
(dd,1H, J=1,74Hz, J=7,59Hz).
SM(ES-MS) : 423,0 (M-1).
Composé 17: Acide 212,6-diméthvI-41314-(méthvIthio)phénv11-
3-
méthoxvpropvflphénoxv1-2-méthvl-propanoïque
o
. oOH
si
gW1
0
/
Ce composé a été préparé selon la procédure générale E à partir de l'acide
242,6-
d i méthy1-44344-(méthylthio)phény1]-3-hyd roxy-propyl]phénoxy]-2-méthyl-
propandique au reflux d'un mélange méthanol / eau 2/3 :1/3 pendant 16 heures ;
Aspect : huile visqueuse.
RMN 1H (300 MHz, CDCI3, 8 en ppm) : 1,51 (s, 6H), 1,89 (m, 1H), 2,08 (m, 1H),
2,21 (s, 6H), 2,5 (s, 3H), 1,56 (m, 2H), 3,22 (s, 3H), 4,05 (dd, 1H, J=5,82Hz,
J=7,32Hz), 6,79 (s, 2H), 7,26 (d, 2H, J=8,46Hz), 7,21 (d, 2H, J=8,46Hz).
SM(ES-MS) : 401,3 (M-1).
Composé 18: Acide 2-1.2,6-diméthvI-412,3-dihydro-4H-1-benzothiopvran-4-one-2-
vflphénoxv1-2-méthvl-propanoïque
o
0 \)-L
S WI OH
IW
0
Ce composé a été préparé selon la procédure générale B, à partir de l'acide 2-
[2,6-d iméthy1-44342-(méthylthio)phény1]-3-oxo-prop-2-ényl]phénoxy]-2-méthyl-
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
48
propanoïque au moyen de 6 équivalents d'iodure de sodium et 6 équivalents de
tétrachlorosilane ;
Aspect : solide jaunâtre ; F=60-63 C.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 1,53 (s, 6H), 2,26 (s, 6H), 3,18 (dd, 1H,
J=3,35Hz, J=16,37Hz), 3,28 (dd, 1H, J=12,87Hz, J=16,37Hz), 4,62 (dd, 1H,
J=3,35Hz, J=12,87Hz), 7,06 (s, 2H), 7,22 (d, 1H, J=7,02Hz), 7,29 (m, 1H), 7,43
(m, 1H), 8,15 (d, 1H, J= 7,89Hz).
SM(ES-MS): 369,1 (M-1).
Composé 19: Acide 2-12-méthy1-4-1.3-14-(propylthio)phény11-3-oxo-
propyllphénoxy1-
2-méthyl-propandique
o
S
()OH
S go
0
Ce composé a été préparé selon la procédure générale B, à partir du 2-méthy1-2-
(2-méthy1-4-(3-oxo-3-(4-(propylthio)phényl)prop-1-ényl)phénoxy)propanoate
de
tertiobutyle au moyen de 3 équivalents d'iodure de sodium et 3 équivalents de
tétrachlorosilane ;
Aspect : huile visqueuse.
RMN 1H (300 MHz, CDCI3, 8 en ppm) : 1,07 (t, 3H, J=7,3Hz), 1,61 (s, 6H), 1,73
(m, 2H), 2,24 (s, 3H), 2,98 (m, 4H), 3,23 (t, 2H, J=7,32Hz), 6,76 (d, 1H,
J=8,19Hz),
6,97 (d, 1H, J=8,19Hz), 7,06 (s, 1H), 7,29 (d, 2H, J=8,76Hz), 7,86 (d, 2H,
J=8,76Hz).
SM(ES-MS) : 392,2 (M-1).
Composé 20 : Acide 21313-14-méthylthiophény11-3-oxo-propyllphénoxy1-2-méthyl-
propanoïque
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
49
-0-->yo
OH
Wi
S
/ *
0
Ce composé a été préparé selon la procédure générale B, à partir de l'acide
243-
[344-(méthylthio)phény1]-3-oxo-prop-2-ényl]phénoxy]-2-méthyl-propanoïque
au
moyen de 7 équivalents d'iodure de sodium et 7 équivalents de
tétrachlorosilane ;
Aspect : solide blanc ; F=67-68 C.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 1,62 (s, 6H), 2,51 (s, 3H), 3,01 (t, 2H, J=
7,60Hz), 3,23 (t, 2H, J=7,60Hz), 6,76 (d, 1H, J=8,16Hz), 6,86 (s, 1H), 6,93
(d, 1H,
J=7,62Hz), 7,16 (t, 1H, J=7,89Hz), 7,25 (d, 2H, J=8,48Hz), 7,85 (d, 2H,
J=8,48Hz).
SM(ES-MS) : 357,3 (M-1).
Composé 21: Acide 2141314-méthylphény11-3-oxo-propyllphénoxyl-2-méthyl-
probanoïque
o
le O OH
igel
0
Ce composé a été préparé selon la procédure générale B, à partir de l'acide 2-
[4-
[344-méthylphény1]-3-oxo-prop-2-ényl]phénoxy]-2-méthyl-propanoïque au moyen
de 5 équivalents d'iodure de sodium et 5 équivalents de tétrachlorosilane;
Aspect : solide blanc ; F= 124-125 C.
RMN 1H (300 MHz, CDCI3, 8 ppm) : 1,56 (s, 6H), 2,43 (s, 3H), 3,04 (t, 2H,
J=7,52Hz), 3,27 (t, 2H, J=7,52Hz), 6,9 (d, 2H, J=8,34Hz), 7,19 (d, 2H,
J=8,34Hz),
7,24 (d, 2H, J=8,19Hz), 7,87 (d, 2H, J=8,19Hz).
SM(ES-MS) : 325,3 (M-1).
Composé 23: Acide
212,6-diméthy1-41314-(méthylthio)phény11-3-
butyloxybropyllphénoxyl-2-méthyl-probanoïque
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
0
. 0)=L
OH
S *
0
/
Ce composé a été préparé selon la procédure générale E à partir de l'acide
242,6-
diméthy1-44344-(méthylthio)phény1]-3-hydroxypropyl]phénoxy]-2-méthyl-
propanoïque au moyen d'un mélange butanol/eau 50/50 porté à 70 C pendant 32
5 heures ;
Aspect : huile visqueuse.
RMN 1H (300 MHz, CDCI3, 8 en ppm) : 0,81 (t, 3H, J=8,72Hz), 1,38 (m, 2H), 1,52
(m, 2H), 1,51 (s, 6H), 1,86 (m, 1H), 2,05 (m, 1H), 2,21 (s, 6H), 2,5 (s, 3H),
2,55 (m,
1H), 2,63 (m, 1H), 3,26 (m, 2H), 4,13 (m, 1H), 6,81 (s, 2H), 7,24 (m, 4H).
10 SM(ES-MS) : 443,5 (M-1).
Composé 24: Acide 212,6-diméthy1-41314-(méthylthio)phény11-
3-
isobropyloxybropyllphénoxyl-2-méthyl-probanoïque
o
si 0OH
si
gW1
0
15 Ce composé a été préparé selon la procédure générale E à partir de
l'acide 242,6-
diméthy1-44344-(méthylthio)phény1]-3-hydroxy-propyl]phénoxy]-2-méthyl-
propandique au moyen d'un mélange alcool isopropylique/eau 50/50 porté à 70 C
pendant 32 heures ;
Aspect : huile visqueuse.
20 RMN 1H (300 MHz, CDCI3, 8 en ppm) : 1,09 (d, 3H, J=6,12Hz), 1,14 (d, 3H,
J=6,12Hz), 1,5 (s, 6H), 1,79-1,90 (m, 1H), 1,97-2,09 (m, 1H), 2,2 (s, 6H),
2,44-2,54
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
51
(m, 1H), 2,5 (s, 3H), 2,67 (m, 1H), 3,47 (m, 1H), 4,27 (dd, 1H, J=5,27Hz,
J=8,17Hz), 6,82 (s, 2H), 7,24 (s, 4H).
SM(ES-MS) : 429,3 (M-1).
Les composés 22 et 25 ont été synthétisés selon l'un des protocoles A à E, de
la
manière décrite pour les composés 1-21 et 23-24.
Exemple 3: Evaluation in vitro des propriétés activatrices PPAR des
composés selon l'invention
Les propriétés activatrices des PPARs des composés selon l'invention sont
évaluées in vitro.
Principe
L'activation des PPARs est évaluée in vitro sur une lignée de fibroblastes de
rein
de singe (COS-7) par la mesure de l'activité transcriptionnelle de chimères
constituées du domaine de liaison à l'ADN du facteur de transcription Ga14 de
la
levure et du domaine de liaison au ligand des différents PPARs. Les composés
sont testés à des doses comprises entre 10-7 et 100 pM sur les chimères Ga14-
PPAR a, y, 8.
Protocole
Culture des cellules
Les cellules COS-7 proviennent de l'ATCC et sont cultivées dans du milieu DMEM
supplémenté de 10% (vol/vol) de sérum de veau foetal, 100 U/ml de pénicilline
(Gibco, Paisley, UK) et 2 mM de L-Glutamine (Gibco, Paisley, UK). Les cellules
sont incubées à 37 C dans une atmosphère humide contenant 5% de CO2.
Description des plasmides utilisés en transfection
Les plasmides Ga14(RE)_TkpGL3, pGa14-hPPARa, pGa14-hPPARy, pGa14-
hPPAR8 et pGa14-0 ont été décrits dans la littérature (Raspe E et al., 1999).
Les
constructions pGa14-hPPARa, pGa14-hPPARy et pGa14-hPPAR8 ont été obtenues
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
52
par clonage dans le vecteur pGa14-0 de fragments d'ADN amplifiés par PCR
correspondants aux domaines DEF des récepteurs nucléaires PPARa, PPARy et
PPAR8 humains.
Transfection
Les cellules COS-7 en suspension sont transfectées avec 150 ng d'ADN par
puits,
avec un ratio pGa14-PPAR / Ga14(RE)_TkpGL3 de 1/10, en présence de 10%
sérum de veau foetal. Les cellules sont ensuite ensemencées dans des plaques
de 96 puits (4x104 cellules/puits) puis incubées pendant 24 heures à 37 C.
L'activation avec les composés à tester s'effectue pendant 24h à 37 C dans du
milieu sans sérum. A l'issue de l'expérience, les cellules sont lysées et
l'activité
luciférase est déterminée à l'aide du Steady-LiteTM HTS (Perkin Elmer) ou du
Steady Glow Luciferase (Promega) selon les recommandations du fournisseur.
Résultats
Les composés selon l'invention ont été testés sur les 3 isoformes de PPAR. Les
résultats obtenus avec les composés 1 à 12, 14, 16 à 25 sont détaillés sur les
figures (1-1) à (1-66).
Les inventeurs mettent en évidence une augmentation significative et dose-
dépendante de l'activité luciférase dans les cellules transfectées avec les
plasmides pGa14-hPPAR et traitées avec les composés selon l'invention.
Conclusion
De manière inattendue, les données expérimentales présentées montrent que les
composés selon l'invention lient les PPARs in vitro et induisent une
activation de
l'activité transcriptionnelle.
Exemple 4: Evaluation in vivo, chez la souris ApoE2/E2, des propriétés
hypolipémiantes et stimulatrices de la synthèse de HDL-cholestérol des
composés selon l'invention
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
53
Principe
Les propriétés hypolipémiantes des composés selon l'invention sont évaluées in
vivo par dosage des lipides plasmatiques et par analyse de l'expression
génique
de gènes cibles des PPARs dans le foie après traitement de la souris E2/E2
dyslipidémique par les composés selon l'invention.
Le modèle murin utilisé est la souris de type ApoE2/E2, souris transgénique
pour
l'isoforme E2 de l'apolipoprotéine E humaine (Sullivan PM et al., 1998). Chez
l'homme, cette apolipoprotéine, constituant des lipoprotéines de faible et
très
faible densité (LDL-VLDL), est présente sous trois isoformes E2, E3 et E4. La
forme E2 présente une mutation sur un acide aminé en position 158, ce qui
affaiblit considérablement l'affinité de cette protéine pour le récepteur aux
LDL. La
clairance des VLDL est de ce fait quasi nulle. Il se produit alors une
accumulation
des lipoprotéines de faible densité et une hyperlipidémie mixte dite de type
III
(cholestérol et triglycérides élevés).
PPARa régule l'expression de gènes impliqués dans le transport des lipides
(apolipoprotéines telles que Apo AI, Apo All et Apo CIII, transporteurs
membranaires tels que FAT) ou le catabolisme des lipides (ACO, CPT-I ou CPT-
II,
enzymes de la p-oxydation des acides gras). Un traitement par les activateurs
de
PPARa se traduit donc, chez l'homme comme chez le rongeur, par une diminution
des taux circulants de triglycérides. La mesure des lipides plasmatiques après
traitement par les composés selon l'invention sera donc un indicateur du
caractère
agoniste de PPAR et donc du caractère hypolipémiant des composés selon
l'invention.
Un traitement par les activateurs de PPARs se traduit aussi parfois chez
l'homme
comme chez le rongeur, par une augmentation du taux de HDL-cholestérol
plasmatique. La mesure du taux de HDL-cholesterol plasmatique permet donc de
mettre en évidence le caractère stimulateur de la synthèse du HDL-cholestérol
des composés selon l'invention.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
54
Les propriétés agonistes de PPARa préalablement mesurées in vitro doivent se
traduire au niveau hépatique par une sur-expression des gènes cibles
directement
sous le contrôle du récepteur PPARa : les gènes que nous étudions dans cette
expérience sont PDK-4 (Pyruvate Deshydrogénase Kinase isoforme 4, enzyme du
métabolisme glucidique), l'Apo CIII (apolipoprotéine impliquée dans le
métabolisme lipidique) et l'Acox1 (L'Acox1 présent chez la souris correspond
au
gène de l'ACO chez l'homme (Acyl Co-enzymeA Oxydase, une enzyme clé dans
le mécanisme de la p-oxydation des acides gras)). La mesure de l'activité
transcriptionnelle des gènes cibles PPARa après traitement par les composés
selon l'invention sera donc aussi un indicateur du caractère hypolipémiant des
composés selon l'invention.
Protocole
Traitement des animaux
Des souris transgéniques ApoE2/E2 ont
été maintenues sous un cycle
lumière/obscurité de 12 heures/12 heures à une température constante de 20
3 C Après une acclimatation d'une semaine, les souris ont été pesées et
rassemblées par groupes de 6 animaux sélectionnés de telle sorte que la
distribution de leurs poids corporels et de leurs taux de lipides plasmatiques
déterminés une première fois avant l'expérience soient uniformes. Les composés
testés ont été suspendus dans la carboxyméthylcellulose (Sigma C4888) et
administrés par gavage intra-gastrique, à raison d'une fois par jour pendant 8
jours
(pour le composé 1) ou 14 jours (pour le composé 8) aux doses choisies. Les
animaux ont eu un accès libre à l'eau et à la nourriture (régime standard). La
prise
de nourriture et la prise de poids sont enregistrées tout au long de
l'expérience. A
l'issue de l'expérience, les animaux ont été anesthésiés après un jeûne de 4
heures, un prélèvement sanguin a été effectué sur anticoagulant (EDTA)puis les
souris ont été pesées et euthanasiées. Le plasma a été séparé par
centrifugation à
3000 tours/minutes pendant 20 minutes, les échantillons sont conservés à + 4
C.
Des échantillons de foie ont été prélevés, congelés dans l'azote liquide puis
conservés à -80 C pour des analyses ultérieures.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
Mesure des lipides plasmatiques
Les concentrations plasmatiques de lipides (cholestérol total et
triglycérides) sont
mesurées par dosages enzymatiques (bioMérieux-Lyon-France) selon les
recommandations du fournisseur.
5 Les taux de cholestérol et de triglycérides plasmatiques sont mesurés
après 8 ou
14 jours de traitement par voie orale avec les composés selon l'invention ;
ces
taux sont comparés à ceux obtenus avec des animaux contrôles (non traités par
les composés selon l'invention) : la différence mesurée témoigne de l'effet
hypolipémiant des composés selon l'invention.
Analyse d'expression génique par RT-PCR quantitative
L'ARN total est extrait à partir de fragments de foie en utilisant le kit
NucleoSpin
96 RNA (Macherey Nagel, Hoerdt, France) selon les instructions du
constructeur.
1 pg d'ARN total (quantifié en utilisant le Ribogreen RNA quantification kit
(Molecular Probes)) est ensuite reverse transcrit en ADN complémentaire par
une
réaction d'1 heure à 37 C dans un volume total de 20 pl contenant du tampon 1X
(Sigma), 1,5mM de DTT, 0,18mM de dNTPs (Promega), 200ng de pdN6
(Amersham), 30U d'inhibiteur de RNase (Sigma) et 1p1 de MMLV-RT (Sigma).
Les expériences de PCR quantitative ont été effectuées en utilisant le MyiQ
Single-Color Real-Time PCR Detection System (Biorad, Marnes-la-Coquette,
France) et ont été réalisées en utilisant le kit iQ SYBR Green Supermix selon
les
recommandations du fournisseur, en plaques 96 puits, sur 5 pl de réactions de
reverse transcription diluées avec une température d'hybridation de 55 C. Des
paires d'amorces spécifiques des gènes étudiés ont été utilisées :
= PDK4 : amorce sens : 5'-TACTCCACTGCTCCAACACCTG-3' (SEQ
ID NO: 1) et amorce antisens 5'- GTTCTTCGGTTCCCTGCTTG-3'
(SEQ ID NO : 2))
= ApoCIII : amorce sens : 5'-CTCTTGGCTCTCCTGGCATC-3' (SEQ
ID NO: 3) et amorce antisens 5'-GCATCCTGGACCGTCTTGGA-3'
(SEQ ID NO : 4).
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
56
= ACO : amorce sens : 5'-GAAGCCAGCGTTACGAGGTG-3' (SEQ ID
NO: 5) et amorce anti-sens : 5'-TGGAGTTCTTGGGACGGGTG-3'
(SEQ ID NO : 6)
La quantité de fluorescence émise est directement proportionnelle à la
quantité
d'ADN complémentaire présent au début de la réaction et amplifié au cours de
la
PCR. Pour chaque cible étudiée, une gamme est réalisée par des dilutions
successives d'un pool constitué de quelques pl de différentes réactions de
reverse
transcription. Les niveaux d'expression relatifs de chaque cible sont ainsi
déterminés en utilisant les courbes d'efficacité obtenues avec les points de
gamme.
Les niveaux d'expression des gènes d'intérêt sont ensuite normalisés par
rapport
au niveau d'expression du gène de référence 36B4 (dont les amorces spécifiques
sont : amorce sens : 5'-CATGCTCAACATCTCCCCCTTCTCC-3' (SEQ ID NO:
79) et amorce antisens : 5'-GGGAAGGTGTAATCCGTCTCCACAG-3' (SEQ ID
NO: 10)).
Le facteur d'induction, c'est-à-dire le rapport entre le signal relatif
(induit par le
composé selon l'invention) et la moyenne des valeurs relatives du groupe
contrôle, est ensuite calculé pour chaque échantillon. Plus ce facteur est
élevé,
plus le composé a un caractère activateur d'expression génique. Le résultat
final
est représenté comme moyenne des valeurs d'induction dans chaque groupe
expérimental.
Résultats
Mesure des lipides plasmatiques
La figure 2-1 compare le taux plasmatique de cholestérol total après 8 jours
de
traitement avec le composé 1 administré à 50 mpk aux taux obtenus avec les
animaux contrôle. De manière inattendue, les taux circulants de cholestérol
total
ont été très significativement diminués par le traitement.
La figure 2-2 compare le taux plasmatique de triglycérides après 8 jours de
traitement avec le composé 1 administré à 50 mpk aux taux obtenus avec les
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
57
animaux contrôle. De manière inattendue, les taux circulants de triglycérides
ont
été très significativement diminués par le traitement.
La figure 2-3 compare le taux plasmatique de cholestérol total après 14 jours
de
traitement avec le composé 8 administré à 3 et 10 mpk aux taux obtenus avec
les
animaux contrôle. De manière inattendue, les taux circulants de cholestérol
total
ont été très significativement diminués par le traitement.
Analyse de l'expression génique par RT-PCR quantitative
Les inventeurs ont aussi mis en évidence que les composés selon l'invention
sont,
in vivo, des régulateurs de l'expression de gènes cibles des PPARs. Les
résultats
présentés sur les figures 2-4, 2-5 et 2-6 montrent que le composé 1 administré
à
50 mpk pendant 8 jours à des souris E2/E2, induit une augmentation
significative
de l'expression hépatique des gènes codant pour PDK4 (figure 2-4), une
diminution de l'expression hépatique du gène codant pour ApoCIII (figure 2-5),
et
une augmentation significative de l'expression hépatique des gènes codant pour
l'ACO (figure 2-6).
Les résultats présentés sur les figures 2-7, 2-8 et 2-9 montrent que le
composé 8
administré à 3 et 10 mpk pendant 14 jours à des souris E2/E2, induit une
augmentation significative de l'expression hépatique des gènes codant pour
PDK4
(figure 2-7), une diminution de l'expression hépatique du gène codant pour
ApoCIII (figure 2-8), et une augmentation significative de l'expression
hépatique
des gènes codant pour l'ACO (figure 2-9).
L'ensemble de ces gènes codent pour des enzymes fortement impliquées dans le
métabolisme des lipides et des glucides et le fait que leur expression soit
modulée
par les composés selon l'invention renforce l'idée que les composés selon
l'invention présentent un intérêt potentiel majeur dans le cadre des
pathologies
métaboliques.
Conclusion
De manière inattendue, les données expérimentales présentées montrent que les
composés selon l'invention induisent un effet hypolipémiant (diminution des
taux
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
58
plasmatiques de cholesterol total et de triglycérides). De plus, les données
expérimentales présentées montrent que les composés selon l'invention modulent
l'expression de gènes régulés par l'activation des PPARs qui codent pour des
enzymes fortement impliquées dans le métabolisme des lipides et des glucides.
Exemple 5: Evaluation in vivo, chez la souris db/db, des propriétés
hypolipémiantes et stimulatrices de la synthèse de HDL-cholestérol des
composés selon l'invention.
Principe
Les propriétés hypolipémiantes des composés selon l'invention sont évaluées in
vivo par mesure des taux plasmatiques des lipides plasmatiques et par analyse
de
l'expression génique de gènes cibles des PPARs après traitement par voie
orale,
par les composés selon l'invention, de la souris db/db.
Protocole
Traitement des animaux
Des souris db/db femelles ont été maintenues sous un cycle lumière/obscurité
de
12/12 heures à une température constante de 20 3 C. Après une acclimatation
d'une semaine, les souris ont été pesées et rassemblées par groupes de 8
animaux sélectionnés de telle sorte que la distribution de leurs poids
corporel et
de leurs taux de lipides plasmatiques déterminés une première fois avant
l'expérience soient uniformes. Les composés testés ont été suspendus dans la
carboxyméthylcellulose (Sigma C4888) et administrés par gavage intra-
gastrique,
à raison d'une fois par jour pendant 28 jours à la dose choisie. Les animaux
ont eu
un accès libre à l'eau et à la nourriture (régime standard). La prise de
nourriture et
la prise de poids sont enregistrées tout au long de l'expérience. A l'issue de
l'expérience, les animaux ont été anesthésiés après un jeûne de 4 heures, un
prélèvement sanguin a été effectué sur anticoagulant (EDTA) puis les souris
ont
été pesées et euthanasiées. Le plasma a été séparé par centrifugation à 3000
tours/minutes pendant 20 minutes, les échantillons ont été conservés à + 4 C.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
59
Des échantillons de tissu hépatique et de tissu musculaire squelettique ont
été
prélevés et congelés immédiatement dans de l'azote liquide puis conservés à -
80 C pour les analyses ultérieures.
Mesure des lipides plasmatiques
Les concentrations plasmatiques de triglycerides sont mesurées par dosages
enzymatiques (bioMérieux-Lyon-France) selon les recommandations du
fournisseur.
Mesure du HDL-cholestérol
Les lipoprotéines de basse densité (VLDL et LDL) sont précipitées par
Phosphotungstate. Le précipité est éliminé par centrifugation. Le HDL-
cholestérol
présent dans le surnageant est quantifié par dosages enzymatiques (bioMérieux-
Lyon-France) selon les recommandations du fournisseur.
Analyse d'expression génique par RT-PCR quantitative
Tissu hépatique
L'ARN total a été extrait à partir de fragments de foie en utilisant le kit
NucleoSpin0 96 RNA (Macherey Nagel, Hoerdt, France) selon les instructions du
fabricant.
Tissu squelettique
L'ARN total a été extrait à partir de fragments de muscle squelettique
gastrocnémien en utilisant le kit RNeasy Fibrous Tissue kit (Qiagen) selon
les
instructions du fabricant.
1 pg d'ARN total (quantifié par spectrophotométrie) a ensuite été reverse
transcrit
en ADN complémentaire par une réaction d'1 heure à 37 C dans un volume total
de 20 pl contenant du tampon 1X (Sigma), 1,5mM de DTT, 0,18mM de dNTPs
(Promega), 200ng de pdN6 (Amersham), 30U d'inhibiteur de RNase (Sigma) et
1p1 de MMLV-RT (Sigma).
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
Les expériences de PCR quantitative ont été effectuées en utilisant le MyiQ
Single-Color Real-Time PCR Detection System (Biorad, Marnes-la-Coquette,
France) et ont été réalisées en utilisant le kit iQ SYBR Green Supermix selon
les
recommandations du fournisseur, en plaques 96 puits, sur 5 pl de réaction de
5 reverse transcription diluée avec une température d'hybridation de 55 C.
Des
paires d'amorces spécifiques des étudiés ont été utilisées.
= PDK4 : amorce sens : 5'-TACTCCACTGCTCCAACACCTG-3' (SEQ
ID NO: 1) et amorce antisens 5'-GTTCTTCGGTTCCCTGCTTG-3'
(SEQ ID NO : 2))
10 =
ACO : amorce sens : 5'-GAAGCCAGCGTTACGAGGTG-3' (SEQ ID
NO: 5) et amorce anti-sens : 5'-TGGAGTTCTTGGGACGGGTG-3'
(SEQ ID NO : 6)
= UCP2: amorce sens: 5'-GTCGGAGATACCAGAGCACTGTCG-3'
(SEQ ID NO : 7) et amorce antisens 5'-
15
CACATCAACAGGGGAGGCGA-3' (SEQ ID NO :8)
La quantité de fluorescence émise est directement proportionnelle à la
quantité
d'ADN complémentaire présent au début de la réaction et amplifié au cours de
la
PCR. Pour chaque cible étudiée, une gamme est réalisée par des dilutions
20 successives d'un pool constitué de quelques microlitres de différentes
réactions
de reverse transcription. Les niveaux d'expression relatifs de chaque cible
sont
ainsi déterminés en utilisant les courbes d'efficacité obtenues avec les
points de
gamme.
Les niveaux d'expression des gènes d'intérêt ont ensuite été normalisés, dans
le
25 tissu hépatique par rapport au niveau d'expression du gène de référence
36B4
(dont les amorces spécifiques sont : amorce
sens : 5'-
CATGCTCAACATCTCCCCCTTCTCC-3' (SEQ ID NO : 9) et amorce antisens : 5'-
GGGAAGGTGTAATCCGTCTCCACAG-3' (SEQ ID NO: 10) et, dans le tissu
musculaire squelettique par rapport au niveau d'expression du gène de
référence
30 185
(dont les amorces spécifiques sont : amorce sens : 5'-
CGGACACGGACAGGATTGACAG-3' (SEQ ID NO: 11) et l'amorce antisens: 5'-
AATCTCGGGTGGCTGAACGC-3' (SEQ ID NO: 12). Le facteur d'induction, a
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
61
ensuite été calculé pour chaque échantillon. Plus ce facteur est élevé, plus
le
composé a un caractère activateur d'expression génique. Le résultat final est
représenté comme moyenne des valeurs d'induction dans chaque groupe
expérimental.
Résultats
Mesure des lipides plasmatiques
La figure 3-1 compare les taux plasmatiques de HDL-cholestérol après 28 jours
de
traitement avec le composé 8 administré à 50 mpk aux taux obtenus avec les
animaux contrôle. De manière inattendue les taux de HDL-cholestérol ont été
significativement augmentés.
Les figures 3-2 et 3-3 comparent les taux plasmatiques de triglycérides et
d'acides
gras libres après 28 jours de traitement, avec le composé 8 à 50 mpk aux taux
obtenus avec les animaux contrôle. De manière inattendue, les taux circulants
de
triglycérides et d'acides gras libres ont été très significativement diminués
par les
traitements.
Analyse de l'expression génique par RT-PCR quantitative
Les inventeurs ont aussi mis en évidence que les composés selon l'invention
sont,
in vivo, des régulateurs de l'expression de gènes cibles des PPARs. Les
résultats
présentés sur les figures 3-4, 3-5 et 3-6 montrent que le composé 8 administré
à
50 mpk pendant 28 jours à des souris db/db, induit une augmentation
significative
de l'expression hépatique des gènes codant pour PDK4 (figure 3-4) et pour
l'ACO
(figure 3-5), et une augmentation de l'expression dans le muscle squelettique
du
gène codant pour UCP2 (figure 3-6). L'ensemble de ces gènes codent pour des
enzymes fortement impliquées dans le métabolisme des lipides, des glucides et
la
dissipation d'énergie et le fait que leur expression soit modulée par les
composés
selon l'invention renforce l'idée que les composés selon l'invention
présentent un
intérêt potentiel majeur dans le cadre des pathologies métaboliques.
Conclusion
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
62
De manière inattendue, les données expérimentales présentées montrent que les
composés selon l'invention stimulent in vivo la synthèse de HDL-cholestérol en
parallèle d'un effet hypolipémiant (diminution des taux plasmatiques de
triglycérides et d'acides gras libres). De plus, les données expérimentales
présentées montrent que les composés selon l'invention modulent l'expression
de
gènes régulés par l'activation des PPARs qui codent pour des enzymes fortement
impliquées dans le métabolisme des lipides, des glucides et la dissipation
d'énergie.
Exemple 6: Evaluation in vitro des propriétés anti-inflammatoires des
composés selon l'invention
Principe
Les effets anti-inflammatoires des composés selon l'invention ont été évalués
par
la mesure de la sécrétion de MCP1 (Monocyte chemotactic protein-1) par des
monocytes THP1 traités pendant 24 heures avec les composés selon l'invention
et
simultanément stimulés avec du PMA (Phorbol 12-myristate 13-acetate, provoque
une réponse inflammatoire des cellules et leur différentiation en
macrophages).
Plus la quantité de MCP1 sécrétée est diminuée, plus le composé selon
l'invention
inhibe la réaction inflammatoire.
Protocole
Culture et traitement des cellules THP-1.
La lignée de monocytes humains THP1 (provenance ATCC) est cultivée dans du
milieu RPMI1640 additionné de 25mM Hepes (Gibco ; 42401-018), 1% glutamine
(Gibco ; 25030-24) 1% pénicilline/streptomycine (Biochrom AG; A 2213) et 10%
sérum de veau foetal décomplémenté (SVF. Gibco ; 26050-088).
Les cellules sont ensemencées sur des plaques de 24 puits (Primaria BD Falcon)
à la densité de 870000 cellules/puits puis sont incubées à 37 C et 5% de CO2
pendant 24h dans du milieu de culture contenant 0.2% de sérum de veau foetal
en
présence de 5 ng/ml de phorbol 12-myristate 13-acetate (PMA) et 1pM du
composé 8 selon l'invention. Le composé selon l'invention est dissout dans du
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
63
diméthyl sulfoxide (DMSO, Fluka ; 41640). L'effet des composés selon
l'invention
est comparé à l'effet du DMSO seul.
Mesure de la sécrétion de MCP1
Le milieu de traitement est récupéré et la concentration de MCP1 est mesurée
en
utilisant la trousse Elisa Human MCP-1 ELISA Set (BD OptElA ; 555179) selon
les recommandations du fabricant.
MCP1 est fixé sur une plaque et reconnue par un anticorps spécifique anti-
MCP1.
L'anticorps est, à son tour, spécifiquement reconnu par un deuxième type
d'anticorps couplé à une enzyme peroxydase. La coloration résultant de
l'activité
enzymatique est proportionnelle à la quantité de MCP1 fixée et peut être
mesurée
par spectrophotométrie. Une gamme est réalisée à partir d'un point de
concentration connue et permet de calculer la concentration en MCP1 de chaque
échantillon.
Le facteur d'induction, c'est-à-dire le rapport entre le signal induit par le
composé
selon l'invention et le signal du groupe contrôle, a ensuite été calculé. Plus
ce
facteur est faible, plus le composé a un caractère inhibiteur de la sécrétion
de
MCP1. Le résultat final est représenté comme moyenne des valeurs d'induction
de
chaque groupe expérimental.
Résultats
Les inventeurs ont mis en évidence, sur des monocytes in vitro, que les
composés
selon l'invention ont des effets anti-inflammatoires. Les résultats présentés
sur la
figure 4-1 montrent que le composé 8 selon l'invention, à 1pM, induit une
diminution significative de la sécrétion de MCP1 par les monocytes.
Conclusion
De manière inattendue, les données expérimentales présentées montrent que les
composés selon l'invention ont une action anti-inflammatoire dans des
monocytes
stimulés au PMA.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
64
Conclusion générale
Les inventeurs ont mis en évidence que les composés selon l'invention, ont des
propriétés hypolipémiantes, en baissant les taux de cholestérol et de
triglycérides
plasmatiques ainsi que des propriétés stimulatrices de la synthèse de HDL-
cholestérol. De plus, les inventeurs ont mis en évidence que les composés
selon
l'invention sont des régulateurs de l'expression de gènes codant pour des
enzymes fortement impliquées dans le métabolisme des lipides, des glucides et
la
dissipation d'énergie.
Les inventeurs ont également mis en évidence que les composés selon
l'invention
présentaient des propriétés anti-inflammatoire.
Ces résultats, obtenus in vivo et in vitro témoignent du potentiel
thérapeutique des
composés selon l'invention vis-à-vis de pathologies majeures telles que les
dyslipidémies, le diabète de type 2 et l'obésité.
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
BIBLIOGRAPHIE
Fox-Tucker J, The Cardiovasular Market Outlook to 2010, BUSINESS INSIGHTS
REPORTS, 2005, 1-174
5
Cross B, et al., Peroxisome Proliferator-Activated Receptor b/d: A novel
target for
the reduction of atherosclerosis, DRUG DISCOVERY TODAY: THERAPEUTIC
STRATEGIES, 2005, 2 (3), 237-243
10 International Atherosclerosis Society, Harmonized Clinical. Guidelines
on
Prevention of Atherosclerotic Vascular Disease, 2003,
Kota BP, et al., An overview on biological mechanisms of PPAR, Pharmacol Res,
2005, 51(2), 85-94
Lefebvre P, et al., Sorting out the roles of PPARalpha in energy metabolism
and
vascular homeostasis, J Clin Invest, 2006, 116 (3), 571-580
Lehrke M and Lazar MA, The many faces of PPARgamma, Cell, 2005, 123 (6),
993-9
Liu Y and Miller A, Ligands to peroxisome proliferator-activated receptors as
therapeutic options for metabolic syndrome, DRUG DISCOVERY TODAY:
THERAPEUTIC STRATEGIES, 2005, 2 (3), 165-169
Mensah M, The Atlas of Heart Disease and Stroke, 2004,
Raspe E, et al., Modulation of rat liver apolipoprotein gene expression and
serum
lipid levels by tetradecylthioacetic acid (TTA) via PPAR{alpha} activation, J.
Lipid
Res., 1999, 40 (11), 2099-2110
Sullivan PM, et al., Type III hyperlipoproteinemia and spontaneous
atherosclerosis
CA 02655643 2008-12-17
WO 2007/147879 PCT/EP2007/056224
66
in mice resulting from gene replacement of mouse Apoe with human Apoe*2, J
Clin Invest, 1998, 102 (1), 130-5.