Note: Descriptions are shown in the official language in which they were submitted.
CA 02658459 2009-01-20
WO 2008/009831 1 PCT/FR2007/001259
NOUVEAUX DERIVES DE CYCLODEXTRINES AMPHIPHILES'
DESCRIPTION
Domaine technique
La présente invention concerne de nouveaux dérivés de
cyclodextrines, et leur application, notamment dans les
domaines pharmaceutiques, cosmétiques et alimentaires et tout
particulièrement le domaine du transfert d'acides nucléiques
dans des cellules.
Cette invention concerne encore la préparation de
nouveaux dérivés de cyclodextrines et leur application à la
production de nouveaux nanosystèmes.
Etat de la technique
Les cyclodextrines, ou cyclomaltooligosaccharides (CDs),
sont des oligosaccharides cycliques connus pour leur aptitude
à inclure dans leur cavité des molécules diverses, de taille
adaptée à celle de la structure hôte. Le caractère
généralement apolaire de ces associations conduit
généralement à inclure des structures de type hydrophobe.
Ceci peut permettre la solubilisation dans l'eau de composés
peu ou pas solubles dans l'eau et l'amélioration de leur
stabilité. Ces propriétés sont notamment utilisées pour
améliorer la biodisponibilité de médicaments.
Les cyclodextrines sont disponibles commercialement en
trois tailles différentes, à savoir les alpha-, béta- et
gamma-cyclodextrines, qui comportent six, sept et huit
résidus d'a-D-glucopyranose. Cette disponibilité impose une
limitation importante quant à la taille des molécules hôtes
qui peuvent être incluses dans leur cavité. A titre
d'exemple, l'a-cyclodextrine, la plus petite, peut complexer
des cycles aromatiques tels que les dérivés du benzène, alors
que la y-cyclodextrine, qui présente une cavité plus large,
CA 02658459 2009-01-20
WO 2008/009831 2 PCT/FR2007/001259
est capable d'inclure des cycles fusionnés tels que des
dérivés de l'anthracène. Les molécules de taille plus
importante, en particulier les macromolécules, ne sont en
général pas adaptées à l'inclusion dans les cyclodextrines.
De plus, le rapport molaire cyclodextrine : molécule hôte des
complexes d'inclusion est en général 1:1 ou supérieur;
autrement exprimé, au maximum une molécule est transportée
par molécule de cyclodextrine.
La solubilité relativement faible dans l'eau des
cyclodextrines, en particulier des cyclodextrines
commerciales, et notamment de la plus accessible d'entre-
elles sur le plan économique, la béta-cyclodextrine (18 g/L,
soit 15 mmol/l, à 25 C), peut constituer une limite dans
leur utilisation en pharmacie. Par ailleurs, les
cyclodextrines ne possédant pas de capacité particulière de
reconnaissance vis-à-vis de récepteurs biologiques dans
l'organisme, ces entités ne peuvent donc pas être utilisées
pour l'adressage et la vectorisation de principes actifs.
Afin de remédier à cet état de fait, des cyclodextrines
ont été modifiées chimiquement, par exemple les alcools
primaires ont été substitués par des groupes
monosaccharidiques ou oligosaccharidiques, de façon à
améliorer leur solubilité dans l'eau d'une part et, d'autre
part, pour incorporer dans leur structure des signaux de
reconnaissance cellulaire (demandes internationales PCT WO
95/19994, WO 95/21870 et WO 97/33919).
Cependant, les dérivés de cyclodextrines de l'art
antérieur peuvent présenter certaines limitations, notamment
vis-à-vis des principes actifs susceptibles d'être
transportés, de la capacité de charge de principe actif par
unité de masse du dérivé de cyclodextrine, de leur capacité à
CA 02658459 2009-01-20
WO 2008/009831 3 PCT/FR2007/001259
s'auto-organiser , de leur capacité à adresser une
molécule hôte, notamment un principe actif, de leur coût, de
leur toxicité, de leur facilité à être synthétisé et/ou de
leur solubilité dans certains solvants, en particulier dans
l'eau.
Il subsiste donc un besoin pour des composés permettant
de résoudre en tout ou en partie les problèmes techniques
évoqués ci-dessus. En particulier en terme de charge et de
type de composé transporté ainsi que pour un procédé de
préparation simple à mettre en aeuvre, présentant un bon
rendement, permettant d'obtenir un produit avec une haute
pureté, à un faible coût et/ou qui permette d'obtenir une
large gamme de composés.
La présente invention vise encore à proposer de nouveaux
dérivés de cyclodextrines qui, tout en comportant une variété
de groupements fonctionnels ou éléments de bio-reconnaissance
ou de visualisation, sont capables de s'auto-organiser sous
forme de systèmes colloïdaux dispersibles.
Description de l'invention
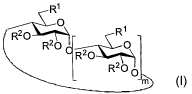
La présente invention concerrîe une cyclodextrine de
Formule (I) suivante :
R'
R20 RI
R20 O
R20
R20 0
Formule (I)
dans laquelle
- m 5, 6 où 7
- les radicaux R', identiques ou différents, représentent :
(1) un groupement OA dans lequel A représente un atome
d'hydrogène, un radical alkyle, aryle, ou encore un
groupement protecteur, comme un groupement silylé, notamment
CA 02658459 2009-01-20
WO 2008/009831 4 PCT/FR2007/001259
tert-butyldiméthylsilyl ou tert-butyldiphénylsilyl, en
particulier le groupement OA représente un groupe hydroxyle
(OH);
(2) un groupement fonctionnel choisi parmi:
= un atome d'halogène ;
= un groupement azoture (N3) ;
= un groupement soufré du type SR3, dans lequel R3 est
(i) un substituant alkyle ou aryle ou ;
(ii) un élément de laioreconnaissance tel qu'un dérivé
d'acide aminé, un peptide, un monosaccharide, un
oligosaccharide, un élément de multiplication à
plusieurs ramifications, lesquelles ramifications
peuvent porter des groupements glucidiques qui peuvent
être identiques ou différents, une sonde de
visualisation ou de détection fluorescente ou
radioactive, ou d'autres groupements fonctionnels ;
( iii ) CH2- ( CH2 ) n-B avec n = 1 à 5, B est :
- NHX et X est un atome d'hydrogène, un groupement
alkyle ou aryle, ou
- NZC(=Q)NTW, où Z représente un atome d'hydrogène,
un groupe alkyle ou aryle, Q représente un atome
d'oxygène ou un atome de soufre et T et W, identiques
ou différents, représentent un atome d'hydrogène, un
substituant alkyle, aryle ou un élément de
reconnaissance cellulaire tel qu'un acide aminé, un
peptide, un monosaccharide, un oligosaccharide ou
encore un élément de multiplication à plusieurs
ramifications portant des groupements glucidiques qui
peuvent être identiques ou différents, ou des
groupements chargés tels que des groupements
ammonium;
= un groupement aminé du type NHR4, dans lequel R4 est
(i) un atome d'hydrogène ;
(ii) un substituant alkyle ou aryle ;
CA 02658459 2009-01-20
WO 2008/009831 5 PCT/FR2007/001259
(iii) un substituant acyle ou ;
(iv) un substituant du type carbamate, urée ou
thiourée, éventuellement substitué par au moins un
groupement choisi parmi les groupements alkyle, aryle,
des éléments de bioreconnaissance, de visualisation ou
de détection, notamment tels que ceux mentionnés ci-
dessus pour R3
- les radicaux R2, identiques ou différents, représentent :
(1) un hydrogène H, ou ;
(2) un groupement acyle, aryle ou alkyle ;
avec au moins un des radicaux R' différent de OH et au moins
un des radicaux R2 différent de H,
ainsi que leurs sels et leurs isomères.
Les cyclodextrines représentées précédemment par la formule
(I) peuvent concerner à la fois des dérivés de cyclodextrines
amphiphiles per(C-6)fonctionnalisés et mono(C-
6)fonctionnalisés. Dans le premier cas, tous les groupements
R' sont identiques, alors que dans le deuxième cas l'un des
R' est différent des autres.
Les cyclodextrines selon l'invention présentent ainsi un
caractère amphiphile pouvant leur permettre de présenter une
solubilité intéressante dans différents solvants, notamment
dans l'eau, et/ou leur permettre de s'autoorganiser pour
former des systèmes formant des suspensions colloïdales.
D'autre part, ces cyclodextrines peuvent être associées
à, ou former des complexes avec, des molécules hôtes dans un
rapport molécule hôte / cyclodextrine allant de 1/2 à
1000/1, notamment de 1/1 à 100/1, en particulier de 1,1/1 à
20/1, voire de 1,5/1 à 10/1.
On entend par groupement protecteur au sens de la
présente invention, un groupe permettant d'éviter que la
fonction sur laquelle 'il est présent ne réagisse avec des
CA 02658459 2009-01-20
WO 2008/009831 6 PCT/FR2007/001259
réactifs utilisés dans les réactions subies par le composé
sur lequel il est présent. En particulier, ce type de
groupement est décrit dans les ouvrages Protective groups
in organic synthesis , Wiley, de T.W. Green et P.G.M. Wuts,
3e ed, 1999, ou Protective groups , Georg Thieme Verlag
de P. Kocienski, 3e ed, 2003.
On entend par alkyle au sens de la présente
invention, un radical carboné, linéaire, ramifié ou cyclique,
saturé ou insaturé, notamment comprenant de 1 ou 2 à 12
atomes de carbone.
On entend par aryle au sens de la présente invention,
un radical comprenant au moins un cycle aromatique,
éventuellement substitué, notamment par un alkyle. Ledit
aryle peut comprendre de 6 à 20 atomes de carbone.
Les radicaux R2, R3 et/ou R4 peuvent être choisis parmi
les groupements benzyle, phényle, allyle, méthyle, éthyle,
propyle, butyle, pentyle, hexyle ou homologues supérieurs
comprenant jusqu'à 12 atomes de carbone, linéaires, ramifiés
ou cycliques, saturés ou insaturés, ces groupements pouvant
comporter d'autres groupements fonctionnels neutres ou
chargés.
On entend par groupement fonctionnel au sens de la
présente invention, un ensemble mono- ou polyatomique ayant
une réactivité caractéristique ou encore un groupement
d'atomes ayant une valence propre et caractérisant une
fonction.
Les radicaux R 2 et/ou R4 peuvent être choisis parmi les
groupements acétyle, propionyle, butyroyle, pentanoyle,
hexanoyle ou homologues comprenant jusqu'à 22 atomes de
carbone, linéaires, ramifiés ou cycliques, saturés ou
insaturés, ces groupements pouvant être porteurs d'autres
groupements fonctionnels neutres ou chargés.
On entend par acyle au sens de la présente invention,
un radical carboné comprenant au moins une fonction
CA 02658459 2009-01-20
WO 2008/009831 7 PCT/FR2007/001259
carbonyle, de type Ra-C(=O)-, dans lequel Ra représente
notamment un radical aryle ou alkyle.
On entend par "élément de bio-reconnaissance" au sens de
la présente invention, une structure moléculaire
complémentaire d'un récepteur biologique, capable de
s'associer spécifiquement à ce dernier, notamment par des
liaisons non-covalentes, et en particulier de conduire à une
réponse spécifique, par exemple :
- une induction ou inhibition d'un signal de transduction
induite après association avec le récepteur,
- une induction et régulation de la biosynthèse d'un
enzyme,
- une inhibition de l'activité d'un enzyme par fixation
sur son site actif,
- une induction d'une réponse immunitaire suite à une
affection bactérienne, une infection virale, et/ou
- une inhibition d'un processus inflammatoire par blocage
du site actif d'une sélectine.
On entend par "élément de multiplication à plusieurs
ramifications", au sens de la présente invention, notamment
une chaîne carbonée ramifiée comprenant soit un atome de
carbone quaternaire tétrasubstitué comme les dérivés du
tris(2-aminométhyl)méthylamine (TRIS) et du pentaérythritol,
soit un atome d'azote trisubstitué comme le tris(2-
aminoéthyl)amine (TREN). Ces éléments de multiplication
peuvent encore être incorporés en combinaison avec un
deuxième élément de ramification comprenant, notamment, un
atome d'azote tertiaire comme les dérivés du tris(2-
aminoéthyl)amine (TREN).
On entend par "sonde de visualisation ou de détection",
au sens de la présente invention, une structure moléculaire
permettant la détection d'un système par une technique
physicochimique, telle que la fluorescence ou la
radioactivité. Parmi les sondes fluorescentes, on peut
CA 02658459 2009-01-20
WO 2008/009831 8 PCT/FR2007/001259
notamment citer les dérivés de la fluorescéine, du dansyle
(5-(diméthylamino)-1-naphtalènesulfonyle) ou de la coumarine.
Parmi les sondes radioactives, on peut citer les produits
marqués par un isotope radioactif.
Selon un mode de réalisation, les éléments de
reconnaissance cellulaire et/ou les éléments de
bioreconnaissance précités sont liés au reste de la molécule
directement ou par l'intermédiaire d'un bras espaceur, par
exemple un bras espaceur alkyle en C, à Clo ou hétéroalkyle en
C1 à Clo, éventuellement substitué. Par exemple, le bras
espaceur peut être -CHZCHa-NHC (=S )NHCH2CH2SCH2-, comme illustré
dans les exemples 25 et 26.
Selon un mode de réalisation, la cyclodextrine
amphiphile répond à la Formule (I) dans laquelle tous les
radicaux R' sont identiques et représentent des atomes
d'halogènes, soit Fluor, Chlore, Brome et Iode et notamment
choisis parmi l'Iode et le Brome.
En particulier, la cyclodextrine répond à la Formule (I)
dans laquelle au moins un groupement R', voire tous les
groupements R~, représentent l'isotope radioactif de l'iode
de masse atomique 129. Ce groupement radioactif peut
notamment permettre de visualiser les systèmes
nanoparticulaires dans lesquels il s'intègre. Ceci peut être
particulièrement utile pour des études de transport et de
biodistribution de principes actifs in vivo.
En particulier, une cyclodextrine selon l'invention
répond à la Formule (III)
N3
O
(t0rn~i
CA 02658459 2009-01-20
WO 2008/009831 9 PCT/FR2007/001259
Formule (III)
m et R2 ayant la signification indiquée ci-dessus.
La présence du groupement azoture, dans ces dérivés, peut
être intéressante notamment pour promouvoir l'auto-
organisation de cyclodextrines amphiphiles dans des systèmes
colloïdaux stables du type nanocapsules ou nanosphères.
Lorsque des groupements R', voire tous les groupements R',
représentent des atomes d'halogènes et que ces derniers sont
déplacés par des nucléophiles soufrés, on peut alors obtenir
des composés répondant à la Formule (I) dans laquelle R'
représente SR3, R3 ayant la signification indiquée ci-
dessus pour la Formule (I).
Selon un mode de réalisation particulier, la présente
invention concerne un composé répondant à la Formule (IV) :
S^f1R
R
0
m+1
Formule (IV)
dans laquelle m et R2 ont la signification indiquée ci-
dessus,
n = 1, 2, 3, 4 ou 5 et R représente une fonction aminée telle
que :
(i) un groupement aminé du type NHY, Y représentant un atome
d'hydrogène ou un substituant alkyle, acyle ou carbamate ; ou
(ii) un groupement ammonium quaternaire du type -NY31 Y
représentant un substituant alkyle.
CA 02658459 2009-01-20
WO 2008/009831 10 PCT/FR2007/001259
En particulier, un composé selon l'invention répond à la
Formule (IV) dans laquelle n=2, et R représente le groupement
tert-butoxycarbonylamino (NHBoc) ou NH2, le groupement amine
résultant pouvant être protoné.
Dans ces dérivés, la présence d'un groupe espaceur du
type co-aminoalcanethiol, et notamment cystéaminyle, peut
permettre d'accéder à des dérivés polycationiques
amphiphiles.
La présence d'un groupe espaceur du type cu-
aminoalcanethiol, et notamment cystéaminyle, peut également
permettre d'augmenter la réactivité des groupements aminés,
en particulier dans le cas des composés répondant à la
formule (IV) avec R=-NHY, Y représentant un atome
d'hydrogène, un alkyle ou aryle.
Il est à noter par ailleurs que ce groupe espaceur peut
être introduit d'une façon simple en utilisant la cystéamine
commerciale ou un w-aminoalcanethiol homologue comme
réactif. Ceci évite notamment l'étape de réduction nécessaire
lorsque les groupements aminés sont préparés à partir d'un
précurseur de type azoture comme c'est le cas dans les
exemples décrits dans le document WO 97/33919.
Ce groupement espaceur préfonctionnalisé peut permettre
d'associer la cyclodextrine à un motif hydrophile et de
reconnaissance cellulaire tel qu'un dérivé glucidique, ou
encore un acide aminé ou un peptide, par des liaisons de type
urée, thiourée, amide et thioéther qui sont très stables et
donnent lieu à des structures bien définies.
La liaison thiourée est créée dans une dernière étape ce
qui permet de coupler la cyclodextrine à de nombreux
substituants, en particulier des substituants comportant un
élément de multiplication à plusieurs ramifications portant
divers motifs glucidiques, et/ou des groupements chargés,
1
CA 02658459 2009-01-20
WO 2008/009831 11 PCT/FR2007/001259
et/ou une sonde de visualisation ou de détection fluorescente
ou radioactive. Ces thiouréidocystéaminyl-cyclodextrines
amphiphiles sont des produits originaux qui montrent une
affinité remarquable vis-à-vis des lectines complémentaires.
Les cyclodextrines selon l'invention, notamment de type
ureido- et thiouréidocystéaminyl-cyclodextrines, peuvent être
représentés par la Formule (V) suivante :
Z T
S~N~NW
R2O O
(2oO
m+
Formule (V)
dans laquelle m et R 2 ont la signification indiqué ci-dessus,
et
- n représente un nombre entier choisi parmi 1, 2, 3, 4 ou 5,
- Z représente un atome d'hydrogène, un groupe alkyle ou
aryle,
- Q représente un atome d'oxygène ou un atome de soufre et
- T et W, identiques ou différents, représentent un atome
d'hydrogène, un substituant alkyle, aryle ou un élément de
reconnaissance cellulaire tel qu'un acide aminé, un peptide,
un monosaccharide; un oligosaccharide ou encore un élément de
multiplication à plusieurs ramifications portant des
groupements glucidiques qui peuvent être identiques ou
différents, notamment portant des substituants, ou des
groupements chargés tels que des groupements ammonium,
notamment de type -NHY protoné ou -NY3. Y représentant un
atome d'hydrogène, un substituant alkyle ou aryle.
Tout particulièrement, lorsque T et/ou W représentent un
substituant alkyle, ce substituant est un alkyle de 1 à 12
atomes de carbone linéaire, ramifié ou cyclique.
CA 02658459 2009-01-20
WO 2008/009831 12 PCT/FR2007/001259
Lorsque T et/ou W représentent un groupement aryle,
celui-ci peut notamment être choisi parmi le phényle, le
benzyle, le naphtyle ou des dérivés de ces groupements
portant d'autres substituants sur le cycle aromatique.
Lorsque T et/ou W représentent un substituant dérivé de
monosaccharides, ce dernier peut être un dérivé du glucose,
du mannose et du galactose, sous forme a, ou P.
Le groupe dérivé du monosaccharide peut être substitué,
notamment un ou plusieurs groupes hydroxyle du monosaccharide
peuvent être remplacés par des groupes alcoxy de 1 à 16
atomes de carbone, des groupes acyloxy, par exemple le groupe
acétoxy, des groupes amines et amides.
Lorsque T et/ou W représentent des dérivés
oligosaccharide, les groupes dérivés d'oligosaccharides
peuvent être les groupes maltosyle, maltotriosyle, lactosyle,
ou encore des tri- ou tétrasaccharides, notamment marqueurs
d'affinité cellulaire du type Lewis X ou sialyl Lewis X, ou
encore des oligosaccharides dérivés de l'héparine. Ces
groupes dérivés d'oligosaccharides peuvent également être
substitués par des groupes alcoxy, acyloxy, des groupements
aminés, sulfatés ou phosphatés.
Lorsque T et/ou W représentent un groupe comportant un
élément de multiplication ramifié, cet élément peut être un
groupe dérivé du tris(2-hydroxyméthyl)méthylamine (TRIS), du
pentaérythritol ou du tris(2-aminoéthyl)amine (TREN).
Ces éléments de multiplication ramifiés peuvent comporter
dans leurs ramifications des groupes dérivés de mono- ou
d'oligosaccharides identiques ou différents. Å titre
d'exemples, on peut citer les groupes dérivés de mono- ou
oligosaccharides cités dans le paragraphe précédent, qui
peuvent également comporter des substituants oxygénés ou
aminés. Ces groupes glucidiques peuvent être liés à l'élément
CA 02658459 2009-01-20
WO 2008/009831 13 PCT/FR2007/001259
de multiplication par une liaison oxygénée, soufrée ou
aminée.
Selon un mode particulier de réalisation au moins une des
ramifications comporte une sonde, en particulier de type
fluorescent ou radioactif, permettant notamment la
visualisation ou la détection du système
Un composé particulier selon l'invention répond à la
Formule (V) dans laquelle n = 2, Q représente un atome de
soufre, Z et T représentent un atome d'hydrogène et W
représente le groupement méthyle.
D'autres composés particuliers selon l'invention
répondent à la Formule (V) dans laquelle m = 6, n = 2, Q
représente un atome de soufre, Z et T représentent un atome
d'hydrogène et W représente respectivement, (i) le groupement
2-hydroxyéthyle, (ii) le groupement 2-(tert-
butoxycarbonylamino)éthyle, (iii) le groupement 2-
aminoéthyle, le groupement amine pouvant être protoné ou (iv)
le groupement 2-(a,-D-mannopyranosyloxy)éthyle.
D'autres composés particuliers selon l'invention
répondent à la Formule (V) dans laquelle m = 6, n = 2, Q
représente un atome de soufre, Z et T représentent un atome
d'hydrogène et W représente l'élément de ramification 2-[2-
azidoéthyl-2'-(tert-butoxycarbonylamino)éthyl]aminoéthyle ou
2,2-bis[2-(tert-butoxycarbonylamino)éthyl]aminoéthyle.
Un autre composé particulier selon l'invention répond à
la Formule (V) dans laquelle m = 6, n = 2, Q représente un
atome de soufre, Z représente un atome d'hydrogène, T et W
sont identiques et représentent le groupement 2-(tert-
butoxycarbonylamino)éthyle.
CA 02658459 2009-01-20
WO 2008/009831 14 PCT/FR2007/001259
Un autre composé particulier selon l'invention répond à
la Formule (V) dans laquelle m= 6, n= 2, Q représente un
atome de soufre, Z représente un atome d'hydrogène, T
représente le groupement 2-azidoéthyle et W représente le
groupement 2-(tert-butoxycarbonylamino)éthyle.
L'invention concerne également des dérivés répondant à la
formule (V) dans laquelle au moins l'un des deux substituants
T et W représentent un substituant portant d'autres
groupements fonctionnels, en particulier des groupements
chargés tels que des groupements ammonium, notamment de type
-NHY protoné ou de type -NY3. Y représentant un atome
d'hydrogène, un substituant alkyle ou aryle.
En particulier, les cyclodextrines répondent à la Formule
(V) dans laquelle tous les radicaux R2 représentent un
groupement hexanoyle.
Dans un mode de réalisation particulier de l'invention,
les composés répondant à la Formule (IV) dans laquelle Y
représente un atome d'hydrogène ou un substituant alkyle ou
aryle ainsi que les dérivés répondant à la formule (V) dans
laquelle au moins un des substituants T et W portent un
groupement de type NHY, Y ayant la même signification ci-
dessus mentionnée, peuvent être isolés sous forme de sels
d'ammonium ou de base libre.
Dans le cas de sels, le contre-ion peut être un anion
monovalent, en particulier un halogénure tel que le chlorure,
le bromure ou l'iodure. Aussi bien la base libre que le sel
peuvent être utilisés comme précurseurs dans la préparation
de thiouréidocystéaminyl-cyclodextrines amphiphiles.
Dans un mode de réalisation préféré, les composés
répondent aux formules (I) à (V), dans lesquels tous les
CA 02658459 2009-01-20
WO 2008/009831 15 PCT/FR2007/001259
radicaux R2 représentent le groupement hexanoyle et/ou le
groupement tétradécanoyle (myristoyle) et m= 6.
Selon un mode de réalisation, le composé selon
l'invention répond à la Formule (VI) suivante :
SNCS
n
R20 O
R200
m+1
Formule (VI)
dans laquelle
- n= 1, 2, 3, 4 ou 5, et m et R2 ont la signification
indiquée ci-dessus,
- le groupement NCS représente le groupement
isothiocyanate.
Des composés particuliers selon l'invention répondent à
la Formule ( VI ) dans laquelle n = 2, m = 6 et R2 représente
respectivement le groupement hexanoyle et le groupement
tétradécanoyle (myristoyle).
Selon un autre mode de réalisation, le composé selon
l'invention répond à la Formule (VII) suivante
RI
O
70ts~~)
Formule (VII)
dans laquelle m, R' et R 2 ont la signification indiquée
ci-dessus.
CA 02658459 2009-01-20
WO 2008/009831 16 PCT/FR2007/001259
La cyclodextrine correspondant à la Formule (VII)
présente des groupements hydroxyle sur le carbone en position
6 de chacun des monomères, excepté pour l'un des monomères
dont le carbone en C6 porte un substituant R1 différent du
groupement hydroxyle.
Des composés particuliers selon l'invention répondent à
la Formule (VII) dans laquelle le groupement R' représente
respectivement le groupement 2-(tert-
butoxycarbonylamino)éthylthio, le groupement 2-
aminoéthylthio, le groupement 2-[N'-(2-a-D-
mannopyranosyloxyéthyl)thiouréido]éthylthio et le groupement
2-(N'-(2-(cyclomaltoheptaose-61-désoxy-62-
yl)éthylthio)thiouréido)éthylthio.
Des composés particuliers selon l'invention
correspondent à la Formule (VII) dans laquelle m = 6 et tous
les groupements R2 représentent un groupement hexanoyle.
Tout particulièrement, l'invention concerne des
cyclodextrines selon l'invention susceptibles de développer
des interactions notamment non-covalentes avec, au moins une
molécule hôte, notamment formant ainsi un complexe
d'inclusion.
La présente invention concerne également la préparation
des composés (cyclodextrines) décrits ci-dessus.
La méthode de synthèse est très flexible en ce qui
concerne la nature des groupements R' et R2. Elle peut
notamment permettre d'optimiser les caractéristiques
amphiphiles, l'aptitude à l'auto-organisation en milieu
aqueux, les propriétés des systèmes colloïdaux résultants
CA 02658459 2009-01-20
WO 2008/009831 17 PCT/FR2007/001259
et/ou la capacité de complexer, entre autres, des petites
molécules ou des macromolécules.
Le procédé de préparation de cyclodextrine selon
l'invention comprend les étapes suivantes consistant à :
(i) introduire au moins un groupement R' sur au moins un
des carbones portant l'hydroxyle primaire ou à protéger au
moins une des hydroxyles primaires du composé de départ,
notamment d'une cyclodextrine ;
(ii) introduire au moins un groupement R2 sur au moins
un hydroxyle secondaire porté par le carbone en position 3
des monomères formant une cyclodextrine ; et
(iii) récupérer au moins une cyclodextrine selon
l'invention, en particulier un composé de Formule (I),
obtenue.
Selon une première variante, le procédé peut comprendre
une étape préalable à l'introduction de R2 consistant à
protéger au moins un hydroxyle primaire, voire tous les
hydroxyles primaires.
Le groupement protecteur introduit initialement à partir
d'une cyclodextrine commerciale peut être un groupement du
type silyléther, en particulier le tert-
butyldiméthylsilyléther, notamment dans le cas des dérivés
per(C-6)fonctionnalisés et lorsque les groupements R 2
représentent un substituant alkyle.
La protection des hydroxyles primaires peut notamment
être effectuée par réaction avec le chlorure de tert-
butyldiméthylsilyle et l'imidazole dans un solvant polaire
aprotique, de préférence la N,N-diméthylformamide.
Les dérivés sélectivement silylés sur les OH primaires
peuvent être ensuite alkylés par réaction avec un halogénure
d'alkyle, notamment dans un solvant polaire aprotique, comme
CA 02658459 2009-01-20
WO 2008/009831 18 PCT/FR2007/001259
la N,N-diméthylformamide, en présence d'une base, en
particulier l'hydrure de sodium.
Ultérieurement, les groupements silylés peuvent être
hydrolysés, notamment par action d'un acide aqueux, de
préférence l'acide acétique ou l'acide trifluoroacétique, ou
bien par traitement avec un sel de l'acide fluorhydrique, de
préférence le fluorure de tétra-n-butylammonium.
Les dérivés déprotégés résultants, présentant des
fonctions OH primaires libres et, portant des chaînes alkyle
sur les OH secondaires, peuvent être transformés en d'autres
dérivés portant des groupements fonctionnels divers sur la
face primaire suivant des méthodes de transformation des
hydroxyles primaires, en particulier l'halogénation. On peut
suivre pour cela les procédés commentés ci-dessous pour la
fonctionnalisation des cyclodextrines commerciales sur la
face primaire.
Selon une seconde variante, le procédé peut comprendre
une étape préalable à l'introduction de R2 consistant à
substituer au moins un hydroxyle primaire, voire tous les
hydroxyles primaires, par un groupement R'.
En particulier, le procédé peut comprendre une étape
d'halogénation des cyclodextrines sur au moins un carbone
portant un hydroxyle primaire, voire sur tous les carbones
portant un hydroxyle primaire.
En particulier, le procédé selon l'invention comprend
une étape de substitution des OH primaires par des
groupements halogénés, de préférence l'iode ou le brome,
suivie d'une acylation d'au moins un hydroxyle secondaire,
voire de tous les hydroxyles secondaires, pour conduire à un
composé de Formule (I) dans lequel R2 représente au moins un
groupement acyle.
CA 02658459 2009-01-20
WO 2008/009831 19 PCT/FR2007/001259
Les dérivés de cyclodextrines persubstitués en position
alcool primaire par des groupements halogénés peuvent
notamment être préparés à partir de la cyclodextrine
commerciale en une seule étape et avec de bons rendements par
réaction avec divers réactifs d'halogénation sélective. On
peut utiliser pour cela les procédés décrits par J. Defaye et
col. dans les documents Supramol. Chem, 2000, 12, pp. 221-
224, Polish J. Chem. 1999, 73, pp. 967-971, Tetrahedron Lett.
1997, 38, pp. 7365-7368, Carbohydr. Res. 1992, 228, pp. 307-
314, et Angew. Chem., Int. Ed. Eng1. 1991, 30, pp. 78-80.
Les cyclodextrines per(C-6)halogénée peuvent subir une
réaction d'acylation des OH secondaires dans une seconde
étape, notamment pour obtenir des composé de Formule (I) dans
lesquels au moins un groupement R 2 représente un acyle.
On peut suivre le procédé décrit par P. Zhang et al. dans
Tetrahedron Lett. 1991, 32, 2769-2770. Cependant, ce procédé
peut demander des temps de réaction longs et des températures
élevées, conduisant à des rendements modestes, voire faibles,
dans le cas de ces dérivés halogénés.
Selon une autre méthode, l'acylation des cyclodextrines
per(C-6)halogénées peut être effectuée par réaction avec un
anhydride d'acide dans un solvant polaire aprotique,
notamment la N,N-diméthylformamide, en présence d'une base,
notamment la N,N-diméthylaminopyridine. Dans ces conditions,
la réaction peut être complète en 45 min. à température
ambiante, avec des rendements en produit pur de l'ordre de
70%.
Dans un mode particulier de l'invention, la préparation
de cyclodextrines répondant à la Formule (I) dans laquelle
tous les groupements R' représentent un atome d'halogène, à
la Formule (III) et à la Formule (IV) dans laquelle R
représente NHY, Y représente un groupement acyle ou carbamate
CA 02658459 2009-01-20
WO 2008/009831 20 PCT/FR2007/001259
et le radical R2 représente un groupement acyle, peut être
réalisée selon le procédé qui consiste à faire réagir un
dérivé de cyclodextrine sélectivement halogéné, azidé ou
fonctionnalisé avec des groupements NHY en position alcool
primaire avec un anhydride d'acide, notamment dans la N,N-
diméthylformamide, en présence d'une base, de préférence la
N,N-diméthylaminopyridine.
Les cyclodextrines amphiphiles per(C-6)halogénées
répondant à la formule (I) pour laquelle tous les R' sont
identiques peuvent être utilisées comme produits de départ
dans la préparation des dérivés incorporant d'autres
groupements fonctionnels sur la face primaire.
Les groupements halogénés, qui sont de bons groupements
partants, peuvent être déplacés par des groupements
nucléophiles azotés ou soufrés, tels que l'anion azoture, les
amines ou les thiols. On peut suivre à ce propos les procédés
décrits par J. Defaye et col. dans les documents Carbohydr.
Res. 1995, 268, 57-61, J. Che.m. Soc., Perkin Trans., 2, 1995,
pp. 1479-1487 et W02004087768.
Les composés de formule (III) peuvent être préparés à
partir d'un précurseur répondant à la formule (I) dans
laquelle les groupements R' sont tous des atomes d'halogène
par réaction avec un anion azoture.
Alternativement, les cyclodextrines de Formule (III)
peuvent être obtenues par acylation de la per(6-azido-6-
désoxy)cyclodextrine correspondante. On peut suivre à ce
propos le procédé décrit par P. Zhang et al. dans Tetrahedron
Lett. 1991, 32, 2769-2770 ou bien le nouveau procédé
utilisant la N,N-diméthylformamide commenté ci-dessus pour
l'acylation des cyclodextrines per(C-6)halogénées.
CA 02658459 2009-01-20
WO 2008/009831 21 PCT/FR2007/001259
Ainsi, dans un mode particulier de l'invention, le
procédé de préparation de cyclodextrine de Formule (III)
consiste à faire réagir un dérivé halogéné de cyclodextrine
de Formule (I) où R' est un atome d'halogène avec anion
azoture dans la N,11T-diméthylformamide.
Les cyclodextrines de l'invention répondant à la Formule
(III) peuvent en outre être utilisées comme produits de
départ dans la préparation d'autres dérivés neutres ou
chargés grâce à la réactivité du groupement azoture.
Ainsi, une réaction d'addition 1,3-dipolaire catalysée
par le cation cuivre (II) avec un alcyne peut permettre
d'attacher une variété de substituants au moyen d'un cycle
1,2,3-triazole. On peut suivre pour cela le procédé décrit
par Santoyo-Gonzâlez et col. dans Org. Lett. 2003, 5, 1951-
1954.
Par ailleurs, la réduction des groupes azoture peut
conduire à la per(C-6)amine correspondante. Cette réduction
peut être réalisée par une variété de procédés tels que
l'hydrogénation en présence d'un catalyseur hétérogène à base
de palladium, platine ou nickel, la réaction avec une
phosphine, de préférence la triphényl- ou la
tributylphosphine, ou la réaction avec le propanedithiol. On
peut suivre pour cela les procédés décrits par J. Defaye et
col. dans Carbohydr. Res. 1995, 268, 57-61 ou par L.
Jicsinszky et col. dans Comprehensive Supramolecular
Chemistry, Vol. 3 (Eds J. Szejtli et T. Osa), Pergamon,
Oxford, 1996, pp. 57-198.
Les composés de Formule (IV) peuvent être préparés à
partir d'un composé de Formule (I) dans laquelle les radicaux
R1 sont identiques et représentent des atomes d'halogène par
CA 02658459 2009-01-20
WO 2008/009831 22 PCT/FR2007/001259
réaction avec un nucléophile soufré, notamment de formule
HSCH2 ( CH2 ) nR.
On peut suivre à ce propos le procédé décrit dans le
document W02004087768.
Alternativement, un composé neutre de Formule (IV) (R =
NHY, avec Y = acyle ou carbamate) peut être obtenu par
acylation du dérivé correspondant où les Rz représentent H,
obtenu comme décrit dans le même document cité, par
acylation. On peut suivre à ce propos le procédé décrit par
P. Zhang et al. dans Tetrahedron Lett. 1991, 32, 2769-2770 ou
bien le nouveau procédé utilisant la N,N-diméthylformamide
commenté ci-dessus pour l'acylation des cyclodextrines per(C-
6)halogénées. Ce procédé ne permet pas d'accéder directement
à des dérivés chargés. Cependant, ce type de dérivés peut
être obtenu à partir des carbamates correspondants, de
préférence le dérivé tert-butoxycarbonyle (formule IV avec R
= NHBoc) par hydrolyse acide de la fonction carbamate.
Dans un mode de réalisation particulier, le procédé de
préparation de cyclodextrine de Formule (IV), consiste à
faire réagir un dérivé de cyclodextrine de Formule (I) dans
laquelle les radicaux R1 sont identiques et représentent des
atomes d'halogène avec de la cystéamine, un co-aminothiol, ou
un de leur dérivé, notamment dans la N,N-diméthylformamide,
en présence d'une base, telle que la triéthylamine ou le
carbonate de césium.
Dans un autre mode de réalisation particulier, le procédé
de préparation de cyclodextrines répondant à la Formule (IV)
dans laquelle R représente un groupement amine primaire (NH2)
consiste à hydrolyser le groupement carbamate dans un
précurseur de Formule (IV) dans lequel R représente un
groupement NHBoc.
CA 02658459 2009-01-20
WO 2008/009831 23 PCT/FR2007/001259
Les composés de Formule (V) (uréido- ou
thiouréidocystéaminyl-cyclodextrines) peuvent être préparés
par un procédé comprenant les étapes consistant à faire
réagir un composé de Formule (IV) où R représente NHY, avec Y
représentant un atome d'hydrogène ou un substituant alkyle ou
aryle, avec un isocyanate ou isothiocyanate de formule W-NCQ
(Q représente un atome d'oxygène ou un atome de soufre,
respectivement) dans laquelle W a la signification donnée ci-
dessus.
Cette réaction peut être effectuée dans un solvant
organique tel que la pyridine ou encore dans un mélange d'eau
avec un solvant organique miscible tel que l'acétone. On
obtient ainsi un composé de Formule (V) (uréido- ou
thiouréidocystéaminyl-cyclodextrine) dans laquelle T
représente un atome d'hydrogène.
Lorsque Y représente H dans la formule (IV), les
thiourées obtenues sont N,N'-disubstituées, alors que lorsque
Y représente un substituant alkyle, tel que méthyle, éthyle,
propyle ou butyle, les thiourées obtenues sont N,N,N'-
trisubstituées.
Le composé isothiocyanate W-NCS peut être préparé de
différentes manières :
- lorsque W est un groupe dérivé d'un monosaccharide ou
d'un oligosaccharide, par réaction du thiophosgène sur un
aminodésoxyglycose ou un glycoside comportant un groupement
aminé dans l'aglycone,. On peut suivre pour celà les procédés
rapportés par J. M. Garcia Fernandez et C. Ortiz Mellet dans
Adv. Carbohydr. Chem. Biochem. 1999, 55, pp. 35-135.
- lorsque W comporte un élément de multiplication
ramifié dérivé du tris(2-hydroxyméthyl)méthylamine (TRIS), on
peut préparer l'isothiocyanate correspondant par réaction du
thiophosgène sur le dérivé aminé portant des substituants
glucidiques sur les positions alcool primaire, comme décrit
CA 02658459 2009-01-20
WO 2008/009831 24 PCT/FR2007/001259
dans le document Chem. Commun., 2000, pp 1489-1490. Le
glycodendron trivalent aminé précurseur peut être obtenu par
glycosidation d'un dérivé du TRIS avec la fonction amine
convenablement protégée sous forme de dérivé carbobenzoxy,
comme décrit par P. R. Ashton et al. dans J. Org. Chem. 1998,
63, pp 3429-3437.
- Lorsque W comporte un élément de multiplication
ramifié dérivé du tris(2-aminoéthyl)amine (TREN), on peut
préparer l'isothiocyanate correspondant par réaction du
thiophosgène sur un dérivé sélectivement protégé sur deux des
groupements amines primaires, par exemple par le groupement
Boc. On peut suivre pour cela le procédé décrit par Benito et
al. dans J. Am. Chem. Soc. 2004, 126, 10355-10363. Il est
aussi possible d'utiliser un dérivé portant deux groupements
protecteurs différents, tel que le groupement Boc et le
groupement trifluoroacétyle. Ces types d'éléments de
ramification peuvent être préparés par protection sélective
partant du TREN commercial ou par réaction du bis(2-
aminoéthyl)amine, sélectivement protégé sur les groupements
amines primaires par les groupements mentionnés, avec le 2-
azidoéthyl-p-toluènesulfonate, suivi de la réduction du
groupement azoture puis réaction avec le thiophosgène.
- Lorsque W comporte un élément de multiplication
ramifié dérivé du pentaérythritol, les glycodendrons
convenablement fonctionnalisés avec un groupement
isothiocyanate peuvent être préparés à partir du
pentaérythritol commercial par une séquence de réactions qui
implique:
(a) une triallylation sélective par traitement avec le
bromure d'allyle, ce qui laisse un seul groupe hydroxyle
libre ;
(b) l'addition radicalaire d'un 1-thiosucre à la double
liaison des groupements allyle.
CA 02658459 2009-01-20
WO 2008/009831 25 PCT/FR2007/001259
Cette réaction peut se faire, soit par activation par la
lumière ultraviolette, soit en présence d'un initiateur de
radicaux libres tel que l'azobis(isobutyronitrile) ou l'acide
p-nitroperbenzoique. A titre d'exemple, on peut adapter les
conditions réactionnelles décrites par D. A. Fulton et J. F.
Stoddart dans Org. Lett. 2000, 2, pp 1113-1116 ou par X.-B.
Meng et al. dans Carbohydr. Res. 2002, 337, pp 977-981.
Cette réaction peut permettre l'addition séquentielle
des différentes ramifications glucidiques.
Il est ainsi possible d'accéder à des glycodendrons
(polyconjugué qui comporte plusieurs unités glucidiques,
identiques ou différentes, liées de façon covalente à un
noyau ramifié, le noyau ramifié portant en outre un
groupement fonctionnel permettant son greffage sur une autre
plateforme) homogènes aussi bien qu'hétérogènes dans lesquels
les substituants glucidiques répondent aux structures
mentionnées ci-dessus. On peut suivre pour cela le procédé
décrit par Gômez-Garcla et al. dans J. Am. Chem. Soc. 2005,
127, 7970-7971.
Cette approche permet également l'incorporation d'un
substituant autre qu'un dérivé glucidique à la structure, en
particulier une sonde de type fluorescent telle qu'un dérivé
de la fluorescéine.
(c) la transformation du groupement alcool primaire
restant en groupement isothiocyanate. Cette transformation
peut se faire par exemple par transformation du groupe
hydroxyle en un bon groupe partant tel que le p-
toluènesulfonate ou le trifluorométhanesulfonate, suivi de
déplacement nucléophile par l'anion azoture et
isothiocyanation de l'azoture résultant par réaction avec la
triphénylphosphine et le disulfure de carbone. Pour cette
transformation, on peut suivre le procédé décrit dans le
document Chem. Commun., 2000, pp 1489-1490.
CA 02658459 2009-01-20
WO 2008/009831 26 PCT/FR2007/001259
Les composés répondant à la formule (V)
(thiouréiocystéaminyl-cyclodextrines) avec Q représentant un
atome de soufre et Z représentant un atome d'hydrogène
peuvent être également préparés à partir d'un précurseur
répondant à la Formule (VI), correspondant à la Formule (I)
dans laquelle m et R2 ont la signification indiquée ci-dessus
et les R' représentent le groupement -SCH2 ( CH2) nNCS, avec n
1, 2, 3, 4 ou 5.
Ces composés de Formule (VI) peuvent être obtenus à
partir de l'amine correspondante de Formule (IV), dans
laquelle m et R2 ont la signification indiquée ci-dessus avec
n = 1, 2, 3, 4 ou 5 et où R représente NHY, avec Y représente
un atome d'hydrogène, par réaction avec un agent
d'isothiocyanation, de préférence le thiophosgène.
Le couplage d'un produit de Formule (VI) avec une amine
primaire ou secondaire de formule générale WiJHT, ou T et W
ont la signification indiquée ci-dessus, conduit à un composé
de Formule (V) (thiouréidocystéaminyl-cyclodextrine
amphiphile).
Dans un mode de réalisation particulier, le procédé de
préparation de composés de Formule (V) dans laquelle Q
représentant un atome de soufre et Z représentant un atome
d'hydrogène consiste à faire réagir un précurseur répondant à
la Formule (VI) avec une amine WNHT, W et T ayant la
signification ont la signification donnée ci-dessus.
Les composés correspondant à la Formule (VII) dans
laquelle l'un des substituants R' est différent de
l'hydroxyle et les autres représentent OH, peuvent être
préparés selon le procédé consistant à:
(i) introduire sélectivement un groupement fonctionnel
sur une des positions primaires de la cyclodextrine;
CA 02658459 2009-01-20
WO 2008/009831 27 PCT/FR2007/001259
(ii) protéger les autres hydroxyles primaires avec un
groupement protecteur, en particulier sous forme de
silyléther;
(iii) introduire ensuite les substituants sur les
hydroxyles primaires; et
(iv) éventuellement hydrolyser les groupements
protecteurs.
A partir des 61-p-tolylsulfonyl cyclodextrines, un
procédé particulier de production des composés répondant à la
Formule (VII) (préparation décrite dans WO 99/61483),
consiste à:
(i) déplacer le groupement p-toluènesulfonate par un
nucléophile, notamment halogénure, azoture, dérivé soufré ou
dérivé aminé, ;
(ii) protéger des OH primaires restants, notamment sous
forme de groupements silyléther, notamment de tert-
butyldiméthylsilyléther ;
(iii) acyler ou alkyler des OH secondaires, et ;
(iv) hydrolyser ou fluorolyser des groupements
silyléther pour régénérer les hydroxyles correspondants.
Les composés de Formule (VII) (dérivés de type
cystéaminyl-cyclodextrine amphiphiles) dans laquelle m, et Ra
ont la signification indiquée ci-dessus et R' représente
SCH2( CH2) nR, n et R ayant la signification indiquée ci-dessus
pour les composés de Formule (IV), peuvent être obtenus à
partir d'un dérivé de cyclodextrine monosubstituée en
position alcool primaire par un groupement halogéné, en
particulier les 62-bromodésoxy ou 6'-désoxyiodo-
cyclodextrines. La réaction avec un dérivé de cystéamine
protégée sur le groupement aminé, de préférence par le
groupement Boc, ou, en général, avec un dérivé d'un w-
aminoalcanethiol N-protégé, éventuellement N-alkylé, suivant
CA 02658459 2009-01-20
WO 2008/009831 28 PCT/FR2007/001259
la méthodologie décrite ci-dessus pour la préparation des
dérivés persubstitués en position alcool primaire, conduit à
des monocystéaminyl-cyclodextrines. La séquence de réactions
commentée ci-dessus pour accéder aux dérivés de Formule (VII)
permet d'obtenir les dérivés amphiphiles de l'invention.
Les dérivés de cyclodextrines monosubstituées en
position alcool primaire par des groupements halogénés,
utilisés comme produits de départ dans ce procédé, peuvent
être préparés à partir du dérivé 61-O-p-tolylsulfonylé de la
cyclodextrine en une étape et avec un bon,rendement par
déplacement nucléophile du groupe tosylate par un anion
halogénure dans la N,N-diméthylformamide.
De façon générale, les procédés de préparation de
cyclodextrines amphiphiles per(C-6)substituées sont aussi
applicables à la préparation des dérivés monofonctionnalisés
en position primaire, c'est-à-dire substitués au niveau d'un
carbone portant un hydroxyle primaire.
Les procédés de préparations de cyclodextrines selon
l'invention et décrits ci-dessus ont l'avantage de permettre
l'obtention des dérivés souhaités sous forme de produits purs
et homogènes en un nombre réduit d'étapes et avec des
rendements élevés. En outre, ces procédés permettent
d'accéder à des dérivés aussi bien neutres que polychargés,
en particulier polycationiques, qui peuvent porter des
éléments de bioreconnaissance ou de visualisation.
Les nouveaux dérivés de cyclodextrines selon l'invention,
tout en comportant une variété de groupements fonctionnels ou
éléments de bio-reconnaissance ou de visualisation, peuvent
être capables de s'auto-organiser, notamment,sous forme de
systèmes colloïdaux dispersibles.
CA 02658459 2009-01-20
WO 2008/009831 29 PCT/FR2007/001259
En outre, la possibilité d'incorporer dans ces nouveaux
dérivés différents groupements sur la face des alcools
primaires est intéressante, notamment pour moduler les
propriétés d'interaction de la surface extérieure des
systèmes colloïdaux nanoparticulaires (nanocapsules ou
nanosphères) qu'ils permettent d'obtenir.
Ainsi, selon un autre de ses aspects, l'invention a pour
objet des nanostructures comprenant au moins une
cyclodextrine de Formule (I) selon l'invention,
éventuellement comprenant au moins une molécule hôte.
En particulier, ces nanostructures peuvent incorporer,
comprendre, être associées ou former un complexe, avec au
moins une molécule hôte.
Les nanostructures peuvent tout particulièrement se
présenter sous forme de nanosphères, de nanocapsules et ou de
nanoparticules.
Les nanostructures, notamment les nanosphères et/ou
nanocapsules peuvent comprendre en outre au moins une
molécule hôte.
La molécule hôte peut être tout principe actif, notamment
une molécule pharmacologiquement active, par exemple des
médicaments ou des acides nucléiques.
La molécule hôte peut être une molécule choisie dans le
groupe comprenant les nutriments, les oligoéléments, les
vitamines, les arômes.
La molécule hôte peut encore être une molécule utilisable
en cosmétologie, notamment les molécules citées dans le
International Cosmetic Ingredient Dictionary and Handbook"
de John A. WENNINGER et G.N. McEWEN.
La molécule hôte peut encore être un acide nucléique,
notamment sélectionnée dans le groupe comprenant l'ADN,
l'ARN, des acides nucléiques modifiés tels que les
ribonucléotides ou les désoxyribonucléotides présentant un
CA 02658459 2009-01-20
WO 2008/009831 30 PCT/FR2007/001259
groupement sucre ou un groupement carboné modifié, ou bien
encore des analogues synthétiques de nucléotides.
Les nanocapsules peuvent enfermer ou contenir une phase
organique, notamment telle que le Miglyol 812 (marque
déposée).
Les nanoparticules peuvent comprendre au moins un acide
nucléique, notamment sélectionné dans le groupe comprenant
l'ADN (linéaire ou plasmidique), l'ARN (et notamment les ARN
interférants ARNi- ou encore silencing -RNAsi-, les
micro-ARN), des acides nucléiques modifiés, tels que les
ribonucléotides ou les désoxyribonucléotides présentant un
groupement sucre ou un groupement carboné modifié, ou encore
des analogues synthétiques de nucléotides.
En particulier, les cyclodextrines répondant à la Formule
(I) dans laquelle R' représente un= atome d'halogène,
présentent une excellente auto-organisation dans des systèmes
colloïdaux stables du type nanocapsules ou nanosphères.
Par ailleurs, les composés neutres répondant aux Formules
(I) à (VII) se sont révélés particulièrement intéressants en
ce qui concerne leur capacité d'auto-organisation, notamment
en nanocapsules ou nanosphères, dans des systèmes colloïdaux
stables.
On entend par nanosphère blanche ou nanocapsule
blanche au sens de la présente invention, des nanosphères
ou des nanocapsules non chargées en molécule hôte, et
notamment en principe actif.
Les nanostructures, en particulier les nanosphères,
notamment blanches et/ou homogènes, c'est-à-dire dans
lesquelles les cyclodextrines sont toutes de même nature, en
particulier présentent toutes la même formule, peuvent être
CA 02658459 2009-01-20
WO 2008/009831 31 PCT/FR2007/001259
préparées selon le procédé comprenant les étapes consistant
à:
(i) ajouter un solvant organique miscible à l'eau,
contenant au moins un composé de Formule (I) à une solution
aqueuse, le volume d'eau variant notamment de une à deux fois
le volume de solvant organique, sous agitation ;
(ii) puis après nanoprécipitation, c'est-à-dire
formation des nanosphères, éliminer le solvant organique.
La suspension aqueuse obtenue, qui peut présenter un
aspect opalescent à laiteux (suivant les produits mis en
oeuvre), peut ensuite être concentrée jusqu'à un volume final
souhaité.
Le procédé de préparation de nanosphères présentée ci-
dessus peut être appliqué à la préparation de nanosphères
hétérogènes. Pour cela, l'étape (i) du procédé de préparation
présenté ci-dessus consiste à introduire dans une solûtion
aqueuse au moins deux solutions organiques miscibles à l'eau,
contenant des dérivés de cyclodextrine amphiphile différents,
notamment de formules chimiques différentes, en proportion
variable sous agitation. Le volume de solution aqueuse peut
aller de une à deux fois le volume de solvant organique.
Cette méthode de préparation de nanosphères de nature
hétérogène permet d'incorporer des cyclodextrines amphiphiles
chargées dans la nanosphère même lorsque ces dérivés utilisés
seuls ne forment pas de nanosphères.
Les nanostructures, et notamment les nanocapsules, en
particulier les nanocapsules blanches, c'est-à-dire des
nanocapsules n'incorporant pas de principe actif, peuvent
être préparées par un procédé comprenant les étapes
consistant à :
(i) préparer une phase acétonique contenant une petite
fraction de triglycérides, de préférence une proportion
CA 02658459 2009-01-20
WO 2008/009831 32 PCT/FR2007/001259
acétone : triglycérides allant de 1000:1 à 10:1, au moins une
cyclodextrine amphiphile, au moins un agent tensioactif
lipophile non ionique, et une phase hydrophile contenant de
l'eau distillée et au moins un agent tensioactif hydrophile
non ionique ;
(ii) introduire la phase organique dans la phase
hydrophile sous agitation magnétique ;
(iii) Après formation des nanocapsules
(nanoprécipitation), éliminer le solvant organique, notamment
sous pression réduite à +35 C.
En particulier, dans l'étape (i) on ajoute au moins deux
préparations de cyclodextrines, en proportion variable,
contenant respectivement des cyclodextrines de Formule (I) de
formules chimiques différentes.
La suspension aqueuse présentant un aspect laiteux peut
ensuite être concentrée jusqu'au volume final souhaité.
Selon un autre de ses aspects, l'invention concerne un
procédé de préparation de nanostructures, en particulier de
nanosphères et/ou de nanocapsules, comprenant, contenant ou
portant au moins une molécule hôte tel que défini ci-dessus,
le procédé comprenant les étapes suivantes :
(i) introduire au moins une phase organique contenant un
solvant miscible à l'eau, comme l'acétone, un dérivé de
cyclodextrine, ou, alternativement, plusieurs préparations
comprenant respectivement des cyclodextrines répondant à la
Formule (I) de formules chimiques différentes en proportion
variable, et le principe actif, dans une phase aqueuse,
notamment contenant de l'eau distillée, éventuellement avec
un tensioactif, en particulier hydrophile non ionique, sous
agitation,
(ii) puis après nanoprécipitation, c'est-à-dire
formation des nanocapsules ou de nanosphères, éliminer le
solvant organique.
CA 02658459 2009-01-20
WO 2008/009831 33 PCT/FR2007/001259
Selon un autre de ses aspects, la présente invention a
pour objet des compositions, notamment cosmétique,
alimentaire et/ou pharmaceutique, comprenant au moins une
cyclodextrine et/ou une nanostructure selon l'invention et
une molécule hôte, notamment une molécule pharmacologiquement
active.
En particulier l'invention concerne une composition
pharmaceutique contenant par dose unitaire de 50 mg à 500 mg
de cyclodextrine et/ou de nanostructures selon l'invention et
une molécule hôte pharmacologiquement active dans une
proportion molaire dérivé de cyclodextrine/molécule hôte qui
peut aller de 50:1 à 1:500, notamment de 25:1 à 1:10, en
particulier de 20:1 à 1:1, voire de 10:1 à 1,5:1.
Un avantage important de la présente invention, réside
dans le fait que l'auto-organisation dans des systèmes
colloïdaux nanoparticulaires (nanosphères ou nanocapsules)
permet d'augmenter significativement la capacité de charge en
principe actif, bien au-delà d'une proportion molaire 1:1. Le
principe actif peut se localiser aussi bien dans la cavité de
la cyclodextrine qu'en surface ou dans la matrice des
nanosphères ou encore dans le coeur lipophile des
nanocapsules.
On peut noter que pour les cyclodextrines classiques,
non nanoparticulaires, il peut y avoir une limitation
importante dans la taille des molécules susceptibles d'être
encapsulées, limitation déterminée par la taille de la cavité
hydrophobe. La limite se situerait vers 900 Dalton (D) de
masse moléculaire. La capacité de prise en charge maximale
est de 1:1 en base molaire. Avec les systèmes
CA 02658459 2009-01-20
WO 2008/009831 34 PCT/FR2007/001259
nanoparticulaires on va bien au delà. Par exemple, des
plasmides de 4000 kD ont été encapsulés.
L'invention concerne encore des dérivés de
cyclodextrines capables de former des nanostructures stables
de quelques dizaines ou centaines de nanomètres par
désolvatation en présence d'un non solvant (nanosphères),
éventuellement en présence d'une phase lipophile
(nanocapsules). Ces suspensions colloïdales prennent en
charge des quantités importantes de molécule hôte, dans une
proportion molaire dérivé de cyclodextrine/molécule hôte qui
peut aller de 50:1 à 1:500, notamment de 25:1 à 1:10, en
particulier de 20:1 à 1:1, voire de 10:1 à 1,5:1, et
permettent notamment (i) de modifier, améliorer et contrôler
les propriétés pharmacocinétiques de principes
pharmacologiquements actifs, (ii) de transporter des composés
actifs, et (iii) de faciliter ou améliorer le transfert
intracellulaire de composés actifs.
Les cyclodextrines et/ou les nanostructures selon
l'invention peuvent être utilisées pour la complexation des
acides nucléiques et/ou pour l'introduction d'acides
nucléiques dans des cellules.
Les cyclodextrines et/ou les nanostructures selon
l'invention peuvent aussi être utilisées pour faciliter et/ou
améliorer le transfert intracellulaire de molécule hôte et/ou
pour contrôler la libération d'une molécule hôte.
Les cyclodextrines et/ou les nanostructures selon
l'invention peuvent aussi être utilisées pour l'introduction
d'acides nucléiques dans des cellules, notamment eucaryotes.
Selon un mode de réalisation particulier de la présente
invention, les nanoparticules selon l'invention comprennent
en outre un acide nucléique.
CA 02658459 2009-01-20
WO 2008/009831 35 PCT/FR2007/001259
On entend par acide nucléique l'ADN (linéaire ou
plasmidique), l'ARN (et notamment les ARN interférants -ARNi-
ou encore silencing -RNAsi-, les micro-ARN) ou les acides
nucléiques modifiés, notamment les ribonucléotides ou les
désoxyribonucléotides présentant un groupement sucre ou un
groupement carboné modifié. Les acides nucléiques peuvent
être utilisées sous forme simple brin, double brin ou
partiellement double brin.
Les acides nucléiques peuvent également être composés ou
contenir des analogues synthétiques de nucléotides, notamment
les ribonucléotides présentant un groupement sucre ou
groupement carboné modifié. Par exemple, les analogues
synthétique de ribonucléotides présentant un groupement sucre
modifié présentent un groupement 2'-OH remplacé par un
groupement sélectionné parmi un atome d'hydrogène, un
halogène, un groupement OR, R, SH, SR, NH2, NHR, NR2 ou CN,
dans lequel R est un groupement alkyle, alcényle ou alcynyle
de 1 à 6 carbone et l'halogène est le fluor, le chlore, le
brome ou l'iode. Les ribonucléotides présentant un groupement
carboné modifié peuvent avoir leur groupement phosphoester
lié au ribonucléotide adjacent qui est remplacé par un
groupement modifié tel qu'un groupement phosphothioate. Les
ribonucléotides peuvent être des ribonucléotides présentant
un noyau purine ou pyrimidine modifié. Comme exemples de tels
noyaux modifiés, on citera notamment les uridines ou les
cytidines modifiées en position 5, telles que la 5-(2-
amino)propyl uridine et la 5-bromo uridine, les adénosines et
guanosines modifiées en position 8, telle que la 8-bromo
guanosine, les nucléotides déazotés, telle que la 7-déaza-
adénosine, les nucléotides N- et 0-alkylés, telle que la N6-
méthyl adénosine.
Les inventeurs ont notamment constaté en ce qui concerne
les cyclodextrines de formule (V) que lorsque le groupement
CA 02658459 2009-01-20
WO 2008/009831 36 PCT/FR2007/001259
urée ou thiourée porte des groupements chargés positivement,
des effets de synergie dans la complexation des acides
nucléiques peuvent se produire, les cyclodextrines étant
alors optimisées pour l'introduction (la transfection) de
matériel génétique dans des cellules.
Les dérivés de cyclodextrines amphiphiles
polycationiques sont particulièrement efficaces pour
complexer les acides nucléiques. Ces dérivés s'auto-
organisent autour d'un acide nucléique en milieu aqueux,
donnant lieu à formation des nanoparticules qui renferment
l'acide nucléique et qui sont capables de traverser la
membrane cellulaire, comme cela est mis en évidence dans la
partie exemples, pour libérer l'acide nucléique qui peut
alors exprimer son activité biologique à l'intérieur de la
cellule.
Un mode de réalisation particulier de l'invention
concerne un procédé in vitro de transfert de molécules hôtes
dans des cellules, notamment des cellules eucaryotes
consistant à :
(i) mettre en contact le complexe nanostructure/molécule
hôte et/ou le complexe cyclodextrine/molécule hôte autre avec
des cellules ;
(ii) laisser en contact les cellules avec le complexe
nanostructure/molécule hôte et/ou le complexe
cyclodextrine/molécule hôte pendant un temps T de préférence
compris entre 4 et 72 heures ;
(iii) retirer le milieu de culture et laver les
cellules.
Le temps de contact pourra dépendre des cyclodextrines
utilisées pour former les nanostructures, notamment de la
présence d'éléments de bio-reconnaissance pouvant se lier
CA 02658459 2009-01-20
WO 2008/009831 37 PCT/FR2007/001259
spécifiquement à un récepteur membranaire et faciliter ainsi
la pénétration du complexe cyclodextrine/molécule hôte et/ou
complexe nanostructure/molécule hôte dans la cellule.
Le temps optimal de contact pourra aisément être
déterminé par l'homme du métier en effectuant des expériences
à différents temps, par exemple 4, 8, 12, 24, 36, 48, 60 et
72 heures.
L'incorporation d'éléments de bioreconnaissance, par
exemple le ou les ligands complémentaires à un récepteur,
permet aux dérivés les incorporant d'être reconnus de façon
très efficace par les récepteurs membranaires spécifiques.
Notamment, un élément de reconnaissance glucidique sera
reconnu spécifiquement par une lectine en fonction des
substituants glucidiques incorporés, permettant de cette
façon la vectorisation de petites molécules ou macromolécules
au niveau de cellules cibles.
L'invention a encore pour objet une composition
pharmaceutique comprenant soit (i) un dérivé de cyclodextrine
amphiphile de formule (I) ou (ii) un système colloïdal selon
l'invention préparé à partir d'une ou plusieurs
cyclodextrines amphiphïles de formule (I), (iii) soit un
complexe d'un dérivé de cyclodextrine amphiphile de formule
(I) ou (iv) un système colloïdal préparé à partir d'une ou
plusieurs cyclodextrines amphiphiles de formule (I) et d'une
molécule pharmacologiquement active, préférentiellement avec
un véhicule pharmacologiquement acceptable.
L'invention a aussi pour objet une composition
pharmaceutique comprenant (i) un dérivé de cyclodextrine
amphiphile de formule (I) selon l'invention et/ou une
nanostructure selon l'invention et (ii) un acide nucléique,
en particulier un fragment d'ADN, de préférence avec un
polymère biocompatible tel que le polyéthylèneglycol.
CA 02658459 2009-01-20
WO 2008/009831 38 PCT/FR2007/001259
La composition peut comprendre en plus un élément
d'adressage, tel qu'un dérivé glucidique ou peptidique ou
bien encore un dérivé d'un ligand se liant spécifiquement à
un récepteur cellulaire, notamment l'acide folique, ou encore
la transferrine. Cet élément d'adressage peut s'intégrer dans
la nanoparticule cyclodextrine amphiphile-ADN ou bien peut
s'ancrer sur ce système par inclusion d'un motif hydrophobe
porté par l'élément de vectorisation, par exemple un
substituant dérivé de l'adamantane, dans la cavité de la
cyclodextrine.
Les compositions pharmaceutiques de l'invention, qui
peuvent être administrées par voie orale ou parentérale,
peuvent être notamment sous forme de solutions, des poudres,
des suspensions.
D'autres caractéristiques et avantages de l'invention
apparaîtront mieux â la lecture des exemples suivants donnés
à titre illustratif et non limitatif.
Exemple 1 : Préparation de l'heptakis(6-désoxy-2,3-di-0-
hexanoyl-6-iodo)cyclomaltoheptaose (composé no. 1).
Ce composé répond à la formule I dans laquelle tous les
R' sont identiques, avec m = 6, R1 = I et dans laquelle R2
représente le groupement hexanoyle.
A une solution de l'heptakis(6-deoxy-6-
iodo)cyclomaltohepaose (0.5 g, 0.26 mmol) dans la DMF séchée
(20 ml), sous argon, a 0 QC, on ajoute la N,N-
diméthylaminopyridine (DMAP, 1.35 g, 11.0 mmol, 3 eq). On
ajoute alors l'anhydride hexanoïque (3.4 ml, 14.7 mmol, 4.0
eq) goutte à goutte et le mélange réactionnel est agité
CA 02658459 2009-01-20
WO 2008/009831 39 PCT/FR2007/001259
pendant 45 min à température ambiante. La réaction est
terminée par addition de MeOR (25 ml). Le mélange est encore
agité pendant 1 h, puis versé dans l'eau glacé (50 ml) et
extrait par le CH2C12 (4 x 50 ml). La phase organique et
lavée successivement par l'acide sulfurique dilué (2 N ; 2 x
50 ml) et une solution saturée de NaHCO3 (4 x 50 ml), puis
séchée (NaZSO4), concentrée et purifiée par chromatographie
sur colonne de gel de silice avec un mélange EtOAc-éther de
pétrole 1:12 - 1:10 comme éluant. On obtient ainsi le
composé no. 1 (0.58 g, 68%) ayant les caractéristiques
suivantes :
Rf = 0.40 (EtOAc-éther de pétrole 1: 5)
[a]D = +63.8 (C 1.0, CHC13)
Exemple 2 : Préparation de l'heptakis(6-bromo-6-désoxy-2,3-
di-O-hexanoyl)cyclomaltoheptaose (composé no. 2).
Ce composé répond à la formule I dans laquelle tous les
R1 sont identiques, avec m = 6, R' = Br et dans laquelle R 2
représente le groupement hexanoyle.
Le composé no. 2 est obtenu par acylation de
l'heptakis(6-bromo-6-désoxy)cyclomaltoheptaose (0.61 g, 0.39
mmol) dans la DMF séchée (29 ml) avec le DMAP (2.0 g, 16.3
mmol, 3 eq) et l'anhydride hexanoique (5.0 ml, 21.7 mmol, 4.0
eq), suivant le procédé commenté ci-dessus pour la
préparation du composé no. 1. La purification du mélange
réactionnel par chromatographie sur colonne de gel de silice
avec un mélange EtOAc-éther de pétrole 1:10 1:8 comme éluant
conduit au composé no. 2 (715 mg, 63%) ayant les
caractéristiques suivantes :
.- Rf = 0.60 (EtOAc-éther de pétrole 1:8)
[a,]D = +73.3 (C 0.8, CHC13)
Exemple 3 : Préparation de 1'heptakis(6-azido-6-désoxy-2,3-
di-O-hexanoyl)cyclomaltoheptaose (composé no. 3).
CA 02658459 2009-01-20
WO 2008/009831 40 PCT/FR2007/001259
Ce composé répond à la formule III avec m= 6 et dans
laquelle R 2 représente le groupement hexanoyle.
A une solution de l'heptakis(6-azido-6-
désoxy)cyclomaltoheptaose (0.2 g, 0.15 mmol) dans la DMF
séchée (20 ml) sous argon, a 0 C, on ajoute la N,N-
diméthylaminopyridine (DMAP ; 783 mg, 6.4 mmol, 3 eq). On
ajoute alors l'anhydride hexanoique (2.0 ml, 8.5 mmol, 4.0
eq) goutte à goutte et le mélange réactionnel est agité
pendant 16 h à température ambiante, puis concentré sous
pression réduite et dilué avec du CH2ClZ (20 ml). La solution
résultante est lavée par l'acide sulfurique dilué (2 N ; 2 x
10 ml) et concentrée. Le résidu est repris par MeOH (15 ml)
et additionné d'une solution aqueuse saturée de NaHCO3 (50
ml). Le mélange est agité a température ambiante pendant 1 h,
puis extrait par CH2C12 (3 x 30 ml), la phase organique est
séchée (Na2SO4), concentrée, et le résidu purifié par
chromatographie sur colonne de gel de silice avec un mélange
EtOAc-éther de pétrole 1:15 - 1:9 comme éluant. On obtient
ainsi le composé no. 3 (286 g, 71%) ayant les
caractéristiques suivantes :
Rf = 0.42 (EtOAc-éther de pétrole 1:9)
[a]D = +115.0 (C 1.0, CHaCla)
IR: v max 2117 cAl 1
Exemple 4 : Préparation de l'heptakis(6-désoxy-6-iodo-2,3-di-
O-myristoyl)cyclomaltoheptaose (composé no. 4).
Ce composé répond à la formule I dans laquelle tous les
R' sont identiques, avec m = 6, R' = I et dans laquelle R2
représente le groupement tétradécanoyle (myristoyle).
A une solution de l'heptakis(6-désoxy-6-
iodo)cyclomaltoheptaose (100 mg, 53 mol) dans la DMF séchée
sous argon (5 ml), a 0 C, on ajoute la N,N-
diméthylaminopyridine (DMAP, 269 mg, 2.2 mmol, 3 eq). On
ajoute alors l'anhydride tétradécanoique (1.29 g, 2.94 mmol,
CA 02658459 2009-01-20
WO 2008/009831 41 PCT/FR2007/001259
4.0 eq) et la suspension résultante est agitée pendant 16 h à
température ambiante, puis filtrée. Le solide résultant est
lavé par l'eau distillée puis MeOH, puis chauffé à reflux
dans un mélange CH2Cla-MeOH (5:95, 50 mL) pendant 1 h,
décanté et purifiée par chromatographie sur colonne de gel de
silice avec un gradient éther de pétrole - mélange EtOAc-
éther de pétrole 1:12 - 1:10 comme éluant. On obtient ainsi
le composé no 4 (0.58 g, 68%) ayant les caractéristiques
suivantes :
.- Rf = 0.49 (EtOAc-éther de pétrole 1:8)
[a]D = + 49.2 (C 1.0, CH2ClZ)
Exemple 5 : Préparation de l'heptakis(6-bromo-6-désoxy-2,3-
di-O-myristoyl)cyclomaltoheptaose (composé no. 5).
Ce composé répond à la formule I dans laquelle tous les
R' sont identiques, avec m = 6, R' = Br et dans laquelle R2
représente le groupement tétradécanoyle (myristoyle).
Le composé no. 5 est obtenu par acylation de
l'heptakis(6-bromo-6-désoxy)cyclomaltoheptaose (100 mg, 63.5
~imol) dans la DMF séchée (5 mL) avec le DMAP (326 mg, 2.67
mmol, 3 eq) et l'anhydride tétradécanoique (1.56 g, 3.55
mmol, 4.0 eq), suivant le procédé décrit ci-dessus pour la
préparation du composé no 4. La purification du mélange
réactionnel par chromatographie sur colonne de gel de silice
avec un gradient éther de pétrole - mélange EtOAc-éther de
pétrole 1:12 comme éluant conduit au composé no. 5 (193 mg,
67%) ayant les caractéristiques suivantes :
Rf = 0.31 (1:8 EtOAc-éther de pétrole)
[a]p = +49.3 (C 1.0, CH2C12)
Exemple 6 : Préparation de l'heptakis(6-azido-6-désoxy-2,3-
di-O- myristoyl)cyclomaltoheptaose (composé no. 6).
CA 02658459 2009-01-20
WO 2008/009831 42 PCT/FR2007/001259
Ce composé répond à la formule III avec m= 6 et dans
laquelle R2 représente le groupement tétradécanoyle
(myristoyle).
A une solution de l'heptakis(6-azido-6-
désoxy)cyclomaltoheptaose (100 mg, 76.3 mol) dans la DMF
séchée (7 mL), sous argon, a 0 QC, on ajoute la N,.i1T-
diméthylaminopyridine (DMAP; 392 mg, 3.2 mmol, 3 eq). On
ajoute alors l'anhydride tétradécanoique (1.87 g, 4.3 mmol,
4.0 eq) et la suspension résultante est agitée pendant 16 h à
température ambiante, puis filtrée. Le solide résultant est
lavé par l'eau distillée, puis chauffé à reflux dans un
mélange CHaCl2-MeOH ( 5: 95 , 25 mL) pendant 1 h, et f iltré . On
obtient ainsi le composé no. 6 (315 mg, 97%) ayant les
caractéristiques suivantes :
Exemple 7 Préparation de l'heptakis[6-(2-tert-
butoxycarbonylaminoethylthio)-6-désoxy-2,3-di-O-
hexanoyl]cyclomaltoheptaose (composé no. 7).
Ce composé répond à la formule IV avec m = 6, n = 1 et
dans laquelle R représente le groupement tert-
butoxycarbonylamino (NHBoc) et R2 représente le groupement
hexanoyle.
Ce composé est préparé en effectuant les deux étapes
suivantes:
a) Préparation de 1'heptakis[6-(2-tert-
butoxycarbonylaminoethylthio)-6-désoxy]cyclomaltoheptaose.
A une solution de l'heptakis(6-désoxy-6-
iodo)cyclomaltoheptaose (1 g, 0.53 mmol) ou de l'heptakis(6-
bromo-6-désoxy)cyclomaltoheptaose (0.84 g, 0.53 mmol) dans la
DMF séchée (10 ml), on ajoute le carbonate de césium (1.71 g,
5.25 mmol) et le tert-butyl-N-(2-mercaptoéthyl)carbamate (5.3
mmol, 1.4 eq). La suspension résultante est chauffée sous Ar
à 70 PC pendant 48 h, puis refroidie à température ambiante,
CA 02658459 2009-01-20
WO 2008/009831 43 PCT/FR2007/001259
versée dans l'eau glacée et agitée pendant une nuit. On
obtient un solide qui est filtré, lavé d'abord par l'eau
distillée, puis par l'éther. Le résidu est purifié par
chromatographie sur colonne de gel de silice avec un mélange
CHaClZ-MeOH-Ha0 40:10:1 - 30:10:1 comme éluant. On obtient
ainsi l'heptakis[6-(2-tert-butoxycarbonylaminoethylthio)-6-
désoxy]cyclomaltoheptaose (787 mg, 66%) ayant les
caractéristiques suivantes :
. -Rf = 0. 60 ( 40 : 10 : 1 CHaCl2-MeOH-eau )
.- [a]D = + 79.7 (c 0.8, MeOH)
b) Préparation du composé no. 7.
A une solution de l'heptakis[6-(2-tert-
butoxycarbonylaminoéthylthio)-6-désoxy]cyclomaltoheptaose
(0.2 g, 89 fflol) dans la pyridine séchée (10 ml), sous argon,
on ajoute la N,N-diméthylaminopyridine (DMAP, 456 mg, 3.73
mmol, 3 eq). On ajoute alors l'anhydride hexanoique (3.4 ml,
14.7 mmol, 4.0 eq) et le mélange réactionnel ést agité
pendant 5 h à 70 PC. La réaction est terminée par addition de
MeOH (10 ml) et chauffée encore à 70 9C pendant 3 h. Le
mélange est alors versé dans l'eau glacé (50 ml) et extrait
par CHaClz (4 x 50 ml). La phase organique est lavée
successivement par l'acide sulfurique dilué (2 N ; 2 x 50 ml)
et une solution saturée de NaHCO3 (4 x 50 ml), puis séchée
(Na2SO4), concentrée et purifiée par chromatographie sur
colonne de gel de silice avec un mélange EtOAc-éther de
pétrole 1:3 comme éluant. On obtient ainsi le composé no. 7
(225 mg, 76%) ayant les caractéristiques suivantes :
Rf = 0.45 (1:2 EtOAc-éther de pétrole)
.- [a]D = + 84.1 (C 0.9, CHC13)
Alternativement, le composé no. 7 a été préparé a partir
du composé no. 1 (164 mg, 50 mol) par réaction avec le tert-
butyl-N-(2-mercaptoéthyl)carbamate (82 ~t1, 0.5 mmol) et le
CA 02658459 2009-01-20
WO 2008/009831 44 PCT/FR2007/001259
carbonate de césium (163 mg, 0.5 mmol) dans la DMF séchée (3
mL) suivant le procédé décrit ci-dessus pour la préparation
de l'heptakis[6-(2-tert-butoxycarbonylaminoéthylthio)-6-
désoxy]cyclomaltoheptaose (rendement 88 mg, 49%).
Exemple 8 : Préparation de l'heptakis[6-(2-aminoéthylthio)-6-
désoxy-2,3-di-O-hexanoyl]cyclomaltoheptaose heptachlorhydrate
(composé no. 8).
Ce composé répond à la formule IV avec m = 6, n = 1, R
NH2 et dans laquelle R2 représente le groupement hexanoyle.
Ce composé a été isolé sous forme de son sel
heptachlorhydrate.
Le composé no. 6 (71 mg, 0.02 mmol) est traité par un
mélange d'acide trifluoroacétique (TFA)-eau 1:1 (4 mL) à 40
QC pendant 7 h. La solution résultante est concentrée et co-
évaporée avec de l'eau distillée. Le résidu est repris par
l'acide chlorhydrique dilué (pH 4) et lyophilisé. On obtient
ainsi le composé no. 8. (60 mg) ayant les caractéristiques
suivantes :
.- [a]p = +72.6 (c 1.0, CH3OH)
Exemple 9 : Préparation de l'heptakis[6-désoxy-2,3-di-O-
hexanoyl-6-(2-isothiocyanatoéthylthio)]cyclomaltoheptaose
(composé no. 9).
Ce composé répond à la formule VI avec m= 6, n = 1 et
dans laquelle R 2 représente le groupement hexanoyle.
A un mélange hétérogène du composé no. 8 (200 mg, 63
umol) dans l'acétone (2.4 mL), CaCO3 (176 mg, 1.76 mmol) et
l'eau (3.6 mL), est ajouté du CSC1. (69 L, 0.88 mmol). La
suspension est agitée vigoureusement pendant 2.5 h. On ajoute
alors CH2C12 (6 mL) et une solution aqueuse saturée de NaHCO3
(6 mL). La phase organique est décantée, séchée et
concentrée. Le résidu est purifié par chromatographie sur
colonne de gel de silice avec un mélange EtOAc-éther de
CA 02658459 2009-01-20
WO 2008/009831 45 PCT/FR2007/001259
pétrole 1:4 - 1:3 comme éluant. On obtient ainsi le composé
no 9 (130 mg, 64%) ayant les caractéristiques suivantes :
Rf = 0.34 (1:3 EtOAc-éther de pétrole)
[a]D = +118.8 (c 1.0, CHC13)
Exemple 10 : Préparation de l'heptakis[6-(2-tert-
butoxycarbonylaminoéthylthio)-6-désoxy-2,3-di-O-
myristoyl]cyclomaltoheptaose (composé no. 10).
Ce composé répond à la formule IV avec m = 6, n = 1 et
dans laquelle R représente le groupement tert-
butoxycarbonylamino (NHBoc) et R2 représente le groupement
tétradécanoyle (myristoyle).
A une solution de l'heptakis[6-(2-tert-
butoxycarbonylaminoéthylthio)-6-désoxy]cyclomaltoheptaose
(0.2 g, 89 ~tmol), préparé suivant le procédé décrit dans
l'exemple 7, dans la DMF séchée (15 ml), sous argon à 0QC,
on ajoute la N,N-diméthylaminopyridine (DMAP, 456 mg, 3.73
mmol, 3 eq). On ajoute alors l'anhydride tétradécanoique
(2.18 g, 4.97 mmol, 4.0 eq) et la suspension résultante est
agitée pendant 5 h à 70 QC. La réaction est terminée par
addition de MeOH (10 ml) et chauffée encore à température
ambiante pendant 48 h, puis concentrée Le résidu est alors
repris dans un mélange CH2C12-MeOH (5:95, 100 mL) et chauffé
à reflux pendant 1 h, le solide est décanté et purifié par
chromatographie sur colonne de gel de silice avec un mélange
EtOAc-éther de pétrole 1:2 comme éluant. On obtient ainsi le
composé no. 10 (321 mg, 67%) ayant les caractéristiques
suivantes :
Rf = 0.56 (1: 2 EtOAc-éther de pétrole)
.- [a]D = +49.2 (C 1.0, CHaClZ)
Exemple 11 : Préparation de 1'heptakis[6-(2-aminoéthylthio)-
6-désoxy-2,3-di-O-myristoyl]cyclomaltoheptaose
heptachlorhydrate (composé no. 11).
CA 02658459 2009-01-20
WO 2008/009831 46 PCT/FR2007/001259
Ce composé répond à la formule IV avec m = 6, n = 1, R =
NH2 et dans laquelle R 2 représente le groupement
tétradécanoyle (myristoyle). Ce composé a été isolé sous
forme de son sel heptachlorhydrate.
Le composé no. 10 (112 mg, 21.6 ~tmol) est traité par un
mélange d'acide trifluoroacétique (TFA)-eau 1:1 (4 mL) à 40
PC pendant 8 h. La solution résultante est concentrée et co-
évaporée avec de l'eau distillée. Le résidu est repris par
l'HCl dilué (pH 4) et lyophilisée. On obtient ainsi le
composé no. 11 (102 mg) ayant les caractéristiques
suivantes :
.- [a]p = +43.3 (c 1.0, CH2Cl2)
Exemple 12 : Préparation de l'heptakis[6-désoxy-2,3-di-0-
myristoyl-6-(2-isothiocyanatoéthylthio)]cyclomaltoheptaose
(composé no. 12).
Ce composé répond à la formule VI avec m = 6, n = 1 et
dans laquelle R 2 représente le groupement tétradécanoyle
(myristoyle).
Un mélange hétérogène du composé no. 11 (102 mg, 21.2
mol) dans CH2ClZ (1.6 mL), CaCO3 (59 mg, 0.59 mmol, 4 eq) et
l'eau (6.6 mL), est additionné de CSC12 (23 ~tL, 0.30 mmol, 2
eq). La suspension est agitée vigoureusement pendant 16 h. On
ajoute alors CHZCIa (15 mL) et la phase organique est
décantée, lavée par l'eau (6 mL), séchée et concentrée. Le
résidu est purifié par chromatographie sur colonne de gel de
silice avec un mélange EtOAc-éther de pétrole 1:6 comme
éluant. On obtient ainsi le composé no. 12 (54 mg, 54%) ayant
les caractéristiques suivantes :
.- Rf = 0.38 (1:4 EtOAc-éther de pétrole)
[a]D = +72.3 (c 0.6, CHC13)
Exemple 13 : Préparation de l'heptakis[6-désoxy-2,3-di-0-
hexanoyl-6-(2-(N'-
CA 02658459 2009-01-20
WO 2008/009831 47 PCT/FR2007/001259
méthylthiouréido)éthylthio)]cyclomaltoheptaose (composé no.
13).
Ce composé répond à la formule V avec m = 6, n = 1, Z
H, Q = S, T = H, dans laquelle W représente le groupement
méthyle et R 2 représente le groupement hexanoyle.
A une solution du composé no. 8 (85 mg, 27 ~Cmol) dans
CH2C12 (3 mL), on ajoute Et3N jusqu'à pH 8. On ajoute alors le
méthyl isothiocyanate (20.5 mg, 0.28 mmol, 1.5 eq) et le
mélange réactionnel est agité à température ambiante pendant
16 h. puis concentré. Le résidu est purifié par
chromatographie sur colonne de gel de silice avec un mélange
CH2C12:MeOH 20:1 comme éluant. On obtient ainsi le composé
no. 13 (57 mg, 62%) ayant les caractéristiques suivantes
Rf = 0.41 ( 2 0:1 CH2C12 : MeOH )
.- [a]D = +108.1 (C 1.0, CHC13)
Exemple 14 : Préparation de 1'heptakis[6-désoxy-2,3-di-O-
hexanoyl-6-(2-(N'-(2-
hydroxyéthyl)thiouréido)éthylthio)]cyclomaltoheptaose
(composé no. 14).
Ce composé répond à la formule V avec m = 6, n = 1, Z
H, Q = S, T = H, dans laquelle W représente le groupement 2-
hydroxyéthyle et R 2 représente le groupement hexanoyle.
A une solution du composé no. 9 (112 mg, 35 ~tmol) dans
CH2C12 (2 ml), on ajoute une solution d'éthanolamine (0.37
mmol, 22.2 ~t1, 1.5 eq) dans CHzClZ (1 ml), et le mélange est
agité à température ambiante pendant 20 h. On ajoute alors
l'eau (10 ml) et on extrait par CH2ClZ (3 x 10 mL).
L'ensemble des extraits organiques est séché (NaZSO4),
concentré et purifié par chromatographie sur colonne de gel
de silice avec le mélange CHZCl2:MeOH 9:1-6:1 comme éluant.
on obtient ainsi le composé no. 14 (82 mg, 64%) ayant les
caractéristiques suivantes :
. - Rf = 0.34 ( 6 :1 CHzCla-MeOH )
CA 02658459 2009-01-20
WO 2008/009831 48 PCT/FR2007/001259
.- [a,]D = + 80.9 (c 0.97, MeOH)
Exemple 15 : Préparation de l'heptakis[6-désoxy-6-(2-(N'-(2-
N-tert-butoxycarbonylaminoéthyl)thiouréido)éthylthio)-2,3-di-
O-hexanoyl]cyclomaltoheptaose (composé no. 15).
Ce composé répond à la formule V avec m= 6, n = 1, Z
H, Q = S, T = H, dans laquelle W représente le groupement 2-
N-tert-butoxycarbonylaminoéthyle et R2 représente le
groupement hexanoyle.
A une solution du composé no. 9 (112 mg, 35 ~tmol) dans
CH2C12 (2 mL), on ajoute une solution de la mono-N-tert-
butoxycarbonyl-éthylenediamine (0.37 mmol, 59 ~tL, 1.5 eq)
dans CH2C12 (1 mL), et le mélange est agité à température
ambiante pendant 20 h. On ajoute alors l'eau (10 mL) et on
extrait par CH2Cl2 (3 x 10 mL). L'ensemble des extraits
organiques est séché (NaaSO4), concentré et purifié par
chromatographie sur colonne de gel de silice avec un mélange
CHZC12:MeOH 20:1 comine éluant. On obtient ainsi le composé
no. 15 (129 mg, 85%) ayant les caractéristiques suivantes :
.- Rf = 0.27 ( 2 0: 1 CH2C12 : MeOH )
[a]D = +78.4 (c 1.05, CHC13)
Exemple 16 : Préparation de l'heptakis[6-désoxy-6-(2-(N'-(2-
aminoéthyl)thiouréido)ethylthio)-2,3-di-O-
hexanoyl]cyclomaltoheptaose heptachlorhydrate (composé no.
16).
Ce composé répond à la formule V avec m = 6, n = 1, Z=
H, T = H, dans laquelle W représente le groupement 2-
aminoéthyle et R 2 représente le groupement tétradécanoyle
(myristoyle). Ce composé a été isolé sous forme de son sel
heptachlorhydrate.
Le composé no. 15 (104 mg, 24 pmol) est traité par un
mélange d'acide trifluoroacétique (TFA)-eau 1:1 (2 mL) à 45
QC pendant 2 h. La solution résultante est concentrée et co-
CA 02658459 2009-01-20
WO 2008/009831 49 PCT/FR2007/001259
évaporée avec de l'eau distillée. Le résidu est repris par
l'HCl dilué (pH 4) et lyophilisé. On obtient ainsi le composé
no. 16 (90 mg, 96%) ayant les caractéristiques suivantes :
[a]p= +80.7 (c 1.0, DMSO)
Exemple 17 : Préparation de l'heptakis[6-désoxy-2,3-di-O-
hexanoyl-6-(2-(N'-(2-a -D-
mannopyranosyloxyéthyl)thiouréido)éthylthio)]cyclomaltoheptao
se (composé no. 17).
Ce composé répond à la formule V avec m = 6, n = 1, Z
H, Q= S, T = H, dans laquelle W représente le groupement 2-
a-D-mannopyranosyloxyéthyle et R 2 représente le groupement
hexanoyle.
Une solution du composé no. 8 (85 mg, 27 ~tmol ) dans un
mélange eau-acétone 2:1 (3 ml) à pH 8(NaHCO3) est agitée à
température ambiante pendant 20 min. On ajoute alors une
solution de 2-isothiocyanatoéthyl-a-A-mannopyranoside (75 mg,
0.28 mmol, 1.5 eq) dans l'eau (1 mL). Après 2 h on observe
l'apparition d'un précipité qui est dissous par addition de
CH2C12 (0.5 mL) et le mélange réactionnel est agité à
température ambiante pendant 16 h. On évapore les solvants
organiques et la phase aqueuse est extraite par CH2C12 (3 x 5
mL). La phase organique est séchée (Na2SO4), filtrée et
concentrée. Le résidu est purifié par chromatographie sur
colonne de gel de silice avec un mélange CHZCla:MeOH 1:1 -3
1:2 comme éluant. On obtient ainsi le composé no. 17 (49 mg,
38%) ayant les caractéristiques suivantes
.- [a]D = +75.1 (C 1.0, CHC13)
Exemple 18 : Préparation de l'heptakis[6-désoxy-6-(2-(N'-
méthylthiouréido)éthylthio)-2,3-di-O-
myristoyl]cyclomaltoheptaose (composê no. 18).
Ce composé répond à la formule V avec m = 6, n = 1, Z
H, Q= S, T = H, dans laquelle W représente le groupement
CA 02658459 2009-01-20
WO 2008/009831 50 PCT/FR2007/001259
méthyle et R2 représente le groupement tétradécanoyle
(myristoyle).
A une solution du composé no. 11 (65 mg, 14.8 mol) dans
CH2C12 (3 mL), on ajoute Et3N jusqu'à pH 8. On ajoute alors le
méthyl isothiocyanate (11.3 mg, 0.16 mmol, 1.5 eq) et le
mélange réactionnel est agité à température ambiante pendant
16 h. puis concentré. Le résidu est purifié par
chromatographie sur colonne de gel de silice avec un mélange
CH2C12:MeOH 30:1 comme éluant. On obtient ainsi le composé
no. 18 (48 mg, 72%) ayant les caractéristiques suivantes :
Rf = 0.55 ( 9: 1 CH2C12-MeOH )
=- [ct]D = +60.8 (c 1.0, CHC13)
Exemple 19 : Préparation de l'heptakis[6-désoxy-6-[2 -[N -[2-
bis[2-(tert-
butoxycarbonylamino)éthyl]amino]éthyl]thioureido]éthylthio-
2,3-di-O-hexanoyl]cyclomaltoheptaose (composé no. 19).
Ce composé répond à la formule V avec m= 6, n = 1, Z
H, Q = S, T = H, dans laquelle W représente l'élément de
ramification 2-bis[2-(tert-
butoxycarbonylamino)éthyl]aminoéthyle (voir formule ci-
dessous)
W= C
BocHN,~N '-"~NHBoc
et R2 représente le groupement hexanoyle.
Ce composé est préparé en effectuant les deux étapes
suivantes:
CA 02658459 2009-01-20
WO 2008/009831 51 PCT/FR2007/001259
a) Préparation de la bis[2-(tert-
butoxycarbonylamino)éthyl] 2-isothiocyanatoéthylamine (voir
formule ci-dessous)).
N CS
BocHN~~N~~NHBoc
Une solution de 2-azidoéthyl bis[2-(tert-
butoxycarbonylamino)éthyl] amine (0.35 g, 0.94 mmol), préparé
comme décrit dans le document J. Am. Chem Soc. 2004, 126,
10355-10363, et la triphénylphosphine (0.27 g, 1.03 mmol, 1.1
eq) dans le dioxane sec (10 mL), sous Na, est additionnée de
CS2 (0.57 mL, 9.4 mmol, 10 eq). La solution est agitée à
température ambiante pendant 24 h, puis concentrée et le
résidu purifié par chromatographie sur colonne de gel de
silice avec un mélange EtOAc-éther de pétrole 30:1 comme
éluant. On ~ obtient ainsi la bis[2-(tert-
butoxycarbonylamino)éthyl] 2-isothiocyanatoéthylamine (285
mg, 78%) ayant les caractéristiques suivantes
Rf = 0.72 (1:1 EtOAc-ether de pétrole)
b) Préparation du composé no. 19.
A une solution du composé no. 8 (50 mg, 13.4 ~tmol) dans
CHaCl2 (2 mL), on ajoute Et3N jusqu'à pH 8. On agite la
solution pendant 10 min et on additionne alors une solution
de la bis[2-(tert-butoxycarbonylamino)éthyl] 2-
isothiocyanatoéthylamine (51 mg, 0.13 mmol, 1.2 eq) dans
CHaCla (3 mL). Le mélange réactionnel est agité à température
ambiante pendant 24 h, puis concentré. Le résidu est purifié
par chromatographie sur colonne de gel de silice avec le
mélange éluant CH2C12:MeOH 40:1. On obtient ainsi le composé
no. 19 (35 mg, 46%) ayant les caractéristiques suivantes
Rf 0.37 (20:1 CHaC12-MeOH)
.- [a]D = +55.0 (c 1.0, CHZC12)
CA 02658459 2009-01-20
WO 2008/009831 52 PCT/FR2007/001259
Exemple 20 : Préparation de l'heptakis[6-désoxy-6-[2-[N'-[2-
bis[2-(tert-
butoxycarbonylamino)éthyl]amino]éthyl]thiouréido]éthylthio-
2,3-di-O-hexanoyl]cyclomaltoheptaose (composé no. 20).
Ce composé répond à la formule V avec m= 6, n = 1, Z
H, Q= S, T = H, dans laquelle W représente l'élément de
ramification 2-[2-azidoéthyl-2'-(tert-
butoxycarbonylamino)éthyl]aminoéthyle (voir formule ci-
dessous)
W=
BocHN ~ N -N3
et R 2 représente le groupement hexanoyle.
Ce composé est préparé en effectuant les étapes
suivantes:
a) Préparation de la 2-(tert-
butoxycarbonylamino)éthyl 2-aminoéthylamine.
Une solution de triéthylenediamine (10 mL, 93 mmol) dans
le dioxane (40 mL), à 0QC, est additionnée d'une solution de
Boc2O (2.75 g, 12.6 mmol) dans le dioxane (40 mL). Le mélange
est agité pendant 4 h à 0 C, puis on le laisse revenir à la
température ambiante. On le concentre sous pression réduite
et le résidu est additionné d'eau (20 mL) et extrait par
CH2C12 (6 x 40 mL). La phase organique est séchée ( NaaSO4 ),
filtrée, concentrée et purifiée par chromatographie sur
colonne de gel de silice avec un gradient MeOH-MeOH-NH40H
(30% dans l'eau) 100:3 comme éluant. On obtient ainsi la 2-
(tert-butoxycarbonylamino)éthyl 2-aminoéthylamine (2.25 mg,
88%) ayant les caractéristiques suivantes :
CA 02658459 2009-01-20
WO 2008/009831 53 PCT/FR2007/001259
R f 0.42 ( 2 0:1 MeOH- NH4OH )
b) Préparation de la 2-(tert-
butoxycarbonylamino)éthyl 2-(trifluoroacétamido)éthylamine.
Une solution de la 2-(tert-
butoxycarbonylamino)éthyl 2-aminoéthylamine (2 g, 10 mmol)
dans l'acétonitrile (20 mL) est additionnée de
trifluoroacétate d'éthyle (4.17 mL, 35 mmol). Le mélange est
agité a 90 QC, à reflux, pendant 5 h, puis concentré et le
résidu purifié par chromatographie sur colonne de gel de
silice avec un mélange EtOAc-EtOH-eau 45:5:3 comme éluant. On
obtient ainsi la 2-(tert-butoxycarbonylamino)éthyl-2-
(trifluoroacétamido)éthylamine (2.58 mg, 64%) ayant les
caractéristiques suivantes :
.- R f 0.65 ( 3 0: 2: 1 MeCN-H20-NH40H )
C) Préparation du méthanesulfonate de 2-
azidoéthyle.
Une solution de 2-bromoéthanol (5 g, 40 mmol) et
d'azoture de sodium (3.12 g, 48 mmol, 1.2 eq) dans l'eau (15
mL) est agité à 60 QC pendant 4 h, puis refroidie à
température ambiante et extraite par CHzCla (4 x 20 mL). La
phase organique est séchée (Na2SO4), filtrée et concentrée
jusqu'à une huile qui est ensuite reprise dans CHaCl2 (30
mL). On ajoute Et3N (1.5 eq, 8.3 mL) puis le chlorure de
méthanesulfonyle (5.5 g, 48 mmol, 1.2 eq) goutte à goutte à 0
QC. On laisse revenir à température ambiante et on agite le
mélange pendant 4 h. On additionne d'eau (40 mL), on extrait
le mélange par CHaC12 (3 x 20 mL), puis la phase organique
est séchée (NaaSO4), filtrée et concentrée. On obtient ainsi
le méthanesulfonate de 2-azidoéthyle (5.31 mg, 80%) ayant les
caractéristiques suivantes :
CA 02658459 2009-01-20
WO 2008/009831 54 PCT/FR2007/001259
.- données de 1H RMN (300 MHz, CDC13): cS 4.33 (t, 2 H,
3JH,H = 5.0 Hz,CH2OMs), 3.58 (t, 2 H, CH2N3) , 3.07 (s, 3 H, Me)
.- données de 13C RMN (125.7 MHz, CDC13 ): b 67.7 ( CHaOMs ),
50.2 ( CH2N3 ), 38.2 ( Me ).
d) Préparation de la 2-azidoéthyl 2-(tert-
butoxycarbonylamino)éthyl 2-(trifluoroacétamido)éthylamine.
Une solution de 2-(tert-butoxycarbonylamino)éthyl 2-
(trifluoroacétamido)éthylamine (1 g, 2.8 mmol) et du
méthanesulfonate de 2-azidoéthyle (1.02 g, 4.2 mmol) dans la
DMF (10 mL) est additionnée de CS2CO3 (1.37 g, 4.2 mmol) et
la suspension résultante est agitée à 50 QC pendant 24 h,
puis concentrée. Le résidu est repris dans CH2C12 (40 mL) et
lavé par l'eau ( 20 mL). La phase organique est séchée
(Na2SO4), filtrée, concentré et purifiée par chromatographie
sur colonne de gel de silice avec un mélange EtOAc-éther de
pétrole 1:1 comme éluant. On obtient ainsi la 2-azidoéthyl-2-
(tert-butoxycarbonylamino)éthyl-2-
(trifluoroacétamido)éthylamine (531 mg, 80%) ayant les
caractéristiques suivantes :
Rf 0.61 (1:1 EtOAc-éther de pétrole)
e) Préparation de la 2-aminoéthyl-2-azidoéthyl-2-
(tert-butoxycarbonylamino)éthylamine.
Une solution de la 2-azidoéthyl-2-(tert-
butoxycarbonylamino)éthyl-2-(trifluoroacétamido)éthylamine
(450 mg, 1.22 mmol ) dans un mélange de NH4OH ( 30 %, 4 ml) et
MeOH (16 mL) est agitée à 40 QC pendant 16 h, puis
concentrée. On obtient ainsi la 2-aminoéthyl-2-azidoéthyl 2-
(tert-butoxycarbonylamino)éthylamine, en rendement
quantitatif, ayant les caractéristiques suivantes
.- R f 0.59 ( 10 : 1: 1 CH3CN-eau-NH40H )
CA 02658459 2009-01-20
WO 2008/009831 55 PCT/FR2007/001259
f) Préparation de la 2-azidoéthyl 2-(tert-
butoxycarbonylamino)éthyl-2-isothiocyanatoéthylamine.
Un mélange hétérogène contenant la 2-aminoéthyl-2-
azidoéthyl-2-(tert-butoxycarbonylamino)éthylamine (272 mg, 1
mmol) et le CaCO3 (300 mg, 1.5 eq, 1.5 mmol ) dans CH2C12-eau
1:1 (10 mL) est additionné de C12CS (115 L, 1.5 mmol). Le
mélange est agité vigoureusement à température ambiante
pendant 1.5 h, puis les deux phases sont séparées, la phase
organique est séchée (Na2SO4), filtrée, concentré et purifiée
par chromatographie sur colonne de gel de silice avec un
mélange EtOAc-éther de pétrole 1:1 comme éluant. On obtient
ainsi la 2-azidoéthyl 2-(tert-butoxycarbonylamino)éthyl-2-
isothiocyanatoéthylamine (198 mg, 63%) ayant les
caractéristiques suivantes :
.- Rf 0.72 (1:2 EtOAc-ether de pétrole)
g) Préparation du composé no. 20.
A une solution du composé no. 8 (50 mg, 13.4 ~tmol) dans
CH2C12 (2 mL), on ajoute Et3N jusqu'à pH 8. On agite la
solution pendant 10 min et on ajoute alors une solution de la
2-azidoéthyl 2-(tert-butoxycarbonylamino)éthyl-2-
isothiocyanatoéthylamine (38 mg, 0.13 mmol, 1.2 eq) dans
CHzCla (3 mL). Le mélange réactionnel est agité à température
ambiante pendant 24 h, puis concentré. Le résidu est purifié
par chromatographie sur colonne de gel de silice avec un
mélange CH2C12:MeOH 40:1 comme éluant. On obtient ainsi le
composé no. 20 (55 mg, 80%) ayant les caractéristiques
suivantes :
Rf 0.37 (20:1 CH2C12-MeOH)
.- [a]D = +57.4 (c 1.0, CH2C12)
Exemple 21 : Préparation de 1'heptakis[6-désoxy-6-[2-[N',N'-
bis[2-(tert-butoxycarbonylamino)éthyl]thiouréido]éthylthio]-
2,3-di-O-hexanoyl]cyclomaltoheptaose (composé no. 21).
CA 02658459 2009-01-20
WO 2008/009831 56 PCT/FR2007/001259
Ce composé répond à la formule V avec m= 6, n = 1, Z =
H, Q = S, dans laquelle T et W sont identiques et
représentent le groupement 2-(tert-butoxycarbonylamino)éthyle
et R 2 représente le groupement hexanoyle.
A une solution du composé no. 9 (50 mg, 15.5 mol) dans
CH2CZ2 (5 mL), on ajoute Et3N (15 L, 1 eq, 0.11 mmol) et la
bis(2-tert-butoxycarbonylaminoéthyl)amine (36 mg, 1.1 eq,
0.12 mmol). La solution est agitée pendant 6 h, puis
concentrée. Le résidu est purifié par chromatographie sur
colonne de gel de silice avec un mélange CH2C12:MeOH 40:1
comme éluant. On obtient ainsi le composé no. 21 (76 mg, 92%)
ayant les caractéristiques suivantes
Rf 0. 41 ( 20 : 1 CHzCl2-MeOH )
.- [a]D = +57.0 (C 1.0, CHZC12)
Exemple 22 : Préparation de 1'heptakis[6-désoxy-6-[2-[N'-(2-
azidoéthyl)-N'-[2-(tert-
butoxycarbonylamino)éthyl]thiouréido]éthylthio]-2,3-di-O-
hexanoyl]cyclomaltoheptaose (composé no. 22).
Ce composé répond à la formule V avec m= 6, n = 1, Z
H, Q = S, dans laquelle T répresente le groupement 2-
azidoéthyle, W représente le groupement 2-(tert-
butoxycarbonylamino)éthyle et R2 représente le groupement
hexanoyle.
Ce composé est préparé en effectuant les étapes
suivantes:
a) Préparation de la 2-azidoéthyl 2-N-(tert-
butoxycarbonyl)aminoéthyl)amine.
Une solution de IV-tert-butoxycarbonyléthylenediamine
(0.47 g, 2.9 mmol) et du p-toluènesulfonate de 2-azidoéthyle
(0.70 g, 1 eq, 2.9 mmol) dans l'acétonitrile (10 mL) est
CA 02658459 2009-01-20
WO 2008/009831 57 PCT/FR2007/001259
additionnée de K2CO3 (0.40 g, 2.9 mmol). Le mélange est agité
pendant 12 h, puis concentré sous pression réduite et le
résidu est additionné d'eau (40 mL) et extrait par CH2Cla (2
x 20 mL). La phase organique est séchée (NaZSO4), filtrée,
concentrée et purifiée par chromatographie sur colonne de gel
de silice avec un mélange CH2C12-MeOH 20:1 comme éluant. On
obtient ainsi la 2-azidoéthyl 2-N-(tert-
butoxycarbonyl)aminoéthyl)amine (0.43 mg, 65%) ayant les
caractéristiques suivantes :
.- Rf 0.48 (20:1 CHZCla-MeOH)
b) Préparation du composé no. 22.
A une solution du composé no. 9 (50 mg, 15.5 ~tmol) dans
CH2C12 (5 mL), on ajoute Et3N (15 L, 1 eq, 0.11 mmol) et la
2-azidoéthyl-2-N-(tert-butoxycarbonyl)aminoéthyl)amine (27
mg, 1.1 eq, 0.12 mmol). La solution est agitée pendant 3 h,
puis concentrée Le résidu est purifié par chromatographie sur
colonne de gel de silice avec un mélange CH2C12:MeOH 60:1'
comme éluant. On obtient ainsi le composé no.22 (48 mg, 92%)
ayant les caractéristiques suivantes :
Rf 0.24 (60:1 CHzCl2-MeOH)
.- [a]D = +47.2 (c 1.0, MeOH)
Exemple 23 : Préparation du 6=-[2-(tert-
butoxycarbonylamino)éthylthio]-61-désoxy-heptakis(2,3-di-0-
hexanoyl)cyclomaltoheptaose (composé no. 23).
Ce composé répond à la formule VII avec m = 6 et dans
laquelle R1 représente le groupement 2-(tert-
butoxycarbonylamino)éthylthio et R2 représente le groupement
hexanoyle.
Ce composé est préparé en effectuant les quatre étapes
suivantes:
CA 02658459 2009-01-20
WO 2008/009831 58 PCT/FR2007/001259
a) Préparation du 6=-[2-(tert-
butoxycarbonylamino)éthylthio]-6=-désoxycyclomaltoheptaose.
A une solution du 6r-déoxy-61-iodocyclomaltoheptaose
(1.42 g, 1.14 mmol) dans la DMF séchée (18 ml), sous Ar, on
ajoute le carbonate de césium (0.48 g, 1.48 mmol, 1.3 eq) et
le tert-butyl N-(2-mercaptoéthyl)carbamate (250 lul, 1.48
mmol, 1.3 eq). La suspension résultante est chauffée à 75 QC
pendant 3 h, puis concentrée. Le résidu solide résultant est
lavé successivement par CH2C12 et l'acétone et finalement
purifié par chromatographie sur colonne de gel de silice avec
un mélange CH3CN-eau-NH4OH 6:3:1 comme éluant. On obtient
ainsi le 6=-[2-(tert-butoxycarbonylamino)éthylthio]-6=-
désoxycyclomaltoheptaose (777 mg, 53%) ayant les
caractéristiques suivantes :
.- Rf = 0.47 ( 6: 3: 1 CH3CN-eau-NH4OH )
[a.]D = +115.3 (c 1.0, DMSO)
b) Préparation du 6=-[2-(tert-
butoxycarbonylamino)éthylthio]-61z- z1-hexa-O-tert-
butyldiméthylsilylcyclomaltoheptaose.
Une solution de 62-[2-(tert-
butoxycarbonylamino)éthylthio]-6=-désoxycyclomaltoheptaose
(378 mg, 0.29 mmol) dans la pyridine (15 mL) est additionnée
de TBDMSC1 (528 mg, 3.5 mmol, 2 eq). Le mélange réactionnel
est agité pendant 3 jours, puis versé dans l'eau glacée (50
mL) et extrait par CH2C12 (4 x 50 ml). La phase organique est
lavée successivement par l'acide sulfurique dilué (2 N, 2 x
50 ml), une solution aqueuse saturée de NaHCO3 (4 x 50 ml),
séchée (Na2SO4), concentrée et purifié par chromatographie
sur colonne de gel de silice avec un mélange CH2C12-MeOH-eau
50:10:1 comme éluant. On obtient ainsi le 6=-[2-(tert-
butoxycarbonylamino)éthylthio]-612- II-hexa-O-tert-
butyldiméthylsilylcyclomaltoheptaose (494 mg, 86%) ayant les
caractéristiques suivantes :
CA 02658459 2009-01-20
WO 2008/009831 59 PCT/FR2007/001259
Rf = 0.38 (45:5:3 AcOEt-EtOH-eau)
[a]D = +84.0 (C 1.0, CHC13)
C) Préparation du 6=-[2-(tert-
butoxycarbonylamino)éthylthio]-61=- I=-hexa-O-tert-
butyldiméthylsilyl-61-désoxy-heptakis(2,3-di-O-
hexanoyl)cyclomaltoheptaose.
A une solution de 61-[2-(tert-
butoxycarbonylamino)éthylthio]-621-"==-hexa-O-tert-
butyldiméthylsilylcyclomaltoheptaose (0.85 g, 0.43 mmol) dans
la DMF séchée (34 ml), sous argon, on ajoute la N,N-
diméthylaminopyridine (DMAP, 2.19 g, 17.9 mmol, 3 eq). On
ajoute alors l'anhydride hexanoique (5.54 ml, 23.9 mmol, 4.0
eq) et le mélange réactionnel est agité pendant 4 h à
température ambiante. La réaction est terminée par addition
de MeOH (70 ml) et on continue l'agitation pendant 24 h. Le
mélange est alors concentré,le résidu est repris par le
CH2Clz ('150 ml), lavée successivement par l'acide sulfurique
dilué (2 N ; 2 x 50 ml) et une solution saturée de NaHCO3 (4
x 50 ml), puis séchée ( NaZSO4 ), concentrée et purifiée par
chromatographie sur colonne de gel de silice avec un mélange
EtOAc-éther de pétrole 1:20 - 1:9 comme éluant. On obtient
ainsi le 6=-[2-(tert-butoxycarbonylamino)éthylthio]-6=I- I=-
hexa-O-tert-butyldiméthylsilyl-61-désoxy-heptakis(2,3-di-O-
hexanoyl)cyclomaltoheptaose (806 mg, 56%) ayant les
caractéristiques suivantes :
Rf = 0.62 (1:8 EtOAc- éther de pétrole)
[a]D = +72.1 (c 1.0, CHC13)
c) Préparation du composé no. 23.
A une solution de la 62-[2-(tert-
butoxyc arbonylamino ) ethylthio ] -61=- I=-hexa-O- tert-
butyldiméthylsilyl-62-désoxy-heptakis(2,3-di-O-
hexanoyl)cyclomaltoheptaose (78.2 mg, 23.3 ~tmol) dans le
CA 02658459 2009-01-20
WO 2008/009831 60 PCT/FR2007/001259
tétrahydrofurane sec (3 mL) on ajoute le fluorure de
tétrabutylammonium (TBAF, solution 1 N dans le THF, 167 l,
167 Eamol, 1.2 eq). Le mélange réactionnel est agité à
température ambiante pendant 16 h, puis concentré et le
résidu purifié par chromatographie sur colonne de gel de
silice avec un gradient EtOAc - mélange EtOAc-EtOH comme
éluant. On obtient ainsi le composé no. 23 (38 mg, 61%) ayant
les caractéristiques suivantes :
Rf = 0.47 (20:1 EtOAc-EtOH)
.- [a]p = +94.4 (C 1.0, CHC13)
Exemple 24 : Préparation du chlorhydrate de 6=-(2-
aminoéthylthio)-6=-désoxy-heptakis(2,3-di-O-
hexanoyl)cyclomaltoheptaose (composé no. 24).
Ce composé répond à la formule VII avec m = 6 et dans
laquelle R' représente le groupement 2-aminoéthylthio et R2
représente le groupement hexanoyle. Ce composé est isolé sous
forme de son sel heptachlorhydrate.
Le composé no. 23 (71 mg, 0.02 mmol) est traité par un
mélange d'acide trifluoroacétique (TFA)-CH2C12 1:1 (0.26 mL)
à température ambiante pendant 3 h. La solution résultante
est concentrée et le résidu est purifié par chromatographie
sur colonne de gel de silice avec un gradient EtOAc-EtOH 20:1
- EtOAc-EtOH-eau 45:5:3 comme éluant. Le produit purifié est
repris par l'HCl dilué (pH 4) et lyophilisé. On obtient ainsi
le composé no. 24 (36 mg, 64%) ayant les caractéristiques
suivantes :
Rf = 0.19 (20:1 AcOEt-EtOH)
[a]D = +80.4 (C 1.0, CHzCla)
Exemple 25 : Préparation du 6=-désoxy-6=- [ 2- [ N'- ( 2-a-n-
mannopyranosyloxyéthyl)thiouréido]éthylthio]-heptakis(2,3-di-
O-hexanoyl)cyclomaltoheptaose (composé no. 25).
CA 02658459 2009-01-20
WO 2008/009831 61 PCT/FR2007/001259
Ce composé répond à la formule VII avec m = 6 et dans
laquelle R1 représente le groupement 2-[N'-(2-a-D-
mannopyranosyloxyéthyl)thiouréido]éthylthio (voir formule)
OH
HO O
RI = HO S
HOO~N~N,~,/s~
H H
et R2 représente le groupement hexanoyle.
Une solution du composé no. 24 (113 mg, 42 ~tmol) dans un
mélange eau-acétone 2:1 (4 mL) à pH 8(NaHCO3) est agité
pendant 20 min à température ambiante. On ajoute alors une
solution de 2-isothiocyanatoéthyl-a-D-mannopyranoside (22 mg,
83 mol, 2 eq) dans l'eau (0.5 mL). Après 2 h on observe
l'apparition d'un précipité qui est dissous par addition de
CH2Cl2 (0.5 mL) et le mélange réactionnel est agité à
température ambiante pendant 48 h. On évapore les solvants
organiques et la phase aqueuse est extraite par CHzCl2 (3 x 5
mL). La phase organique est séchée (NaZSO4), filtrée et
concentrée. Le résidu est purifié par chromatographie sur
colonne de gel de silice avec un gradient EtOAc-EtOH 20:1 -
EtOAc-EtOH-HZ0 45:5:3 comme éluant. On obtient ainsi le
composé no. 25 (46 mg, 39%) ayant les caractéristiques
suivantes :
.- Rf = 0.52_(45:5:3 EtOAc-EtOH-HaO)
.- [a]p = +92.5 (c 1.0, CHZClZ)
Exemp].e 26: Préparation du 61-[2-(N'-(2-(cyclomaltoheptaose-
61-désoxy-6=-yl)éthylthio)thiouréido)éthylthio]-6=-désoxy-
heptakis-(2,3-di-O-hexanoyl)cyclomaltoheptaose (composé no.
26).
CA 02658459 2009-01-20
WO 2008/009831 62 PCT/FR2007/001259
Ce composé répond à la formule VII avec m 6, Ra
représente le groupement hexanoyle ( C5H11COa ) et R' le
groupement ci-dessous:
H H
SN
H~\S~
O s
HO O H
RI_ HO
HO
HO O
6
Il est préparé par la suite d'étapes suivantes partant
du composé 24 (Exemple 24) et du 6=-[2-(tert-
butoxycarbonylamino)éthylthio]-61-désoxycyclomaltoheptaose
préparé dans l'exemple 23a.
a) 61-(2-Aminoéthylthio)-6=-désoxy-cyclomaltoheptaose
trifluoroacétate.
Une solution du 62-[2-(tert-
butoxycarbonylamino)éthylthio]-62-désoxycyclomaltoheptaose
(300 mg, 0.23 mmol) dans un mélange TFA-eau (1:1, 2.7 mL) est
agité à température ambiante pendant 2 h, puis concentrée. On
obtient ainsi le 61-(2-aminoéthylthio)-61-désoxy-
cyclomaltoheptaose trifluoroacétate qui est utilisé
directement dans la prochaine étape.
b) 6=-Désoxy-6=-(2-isothiocyanatoéthylthio)
cyclomaltoheptaose.
A une solution du 6=-(2-aminoéthylthio)-61-désoxy-
cyclomaltoheptaose trifluoroacétate (270 mg, 0.20 mmol) dans
un mélange acétonitrile-eau (1:1, 6 mL), à 0 C, on ajoute le
carbonate de calcium (82 mg, 0,82 mmol) et le thiophosgène
(31 L, 0.41 mmol ). La réaction est agité pendant 2 h, puis
filtrée, les solvants sont évaporés et le résidu est purifié
par chromatographie sur colonne de gel de silice avec un
mélange CH3CN-eau 9:1 - 3:1 comme éluant. On obtient ainsi
CA 02658459 2009-01-20
WO 2008/009831 63 PCT/FR2007/001259
le 6=-désoxy-62-(2-isothiocyanatoéthylthio)cyclomaltoheptaose
(129 mg, 50%) ayant les caractéristiques suivantes
Rf = 0.36 (3:1 CH3CN-eau)
.- [a]p = +56.1 (c 1.0, DMSO)
C) 6=-Désoxy-heptakis(2,3-di-0-hexanoyl)-6Z-(2-
isocyanatoéthylthio)cyclomaltoheptaose.
A une solution du composé 24 (215 mg, 82.6 ~tmol) dans un
mélange dichlorométhane-eau (1:1, 2 mL), à 0PC, on ajoute le
carbonate de calcium (25 mg, 0,25 mmol) et le thiophosgène
(9.5 L, 0.12 mmol). La réaction est agitée à température
ambiante pendant 4 h. On ajoute alors le dichlorométhane (5
mL). La phase organique est séparée, lavée par l'eau (3 mL),
séchée (Na2SO4) et concentrée. Le résidu est purifié par
chromatographie sur colonne de gel de silice avec un mélange
CHZClZ-MeOH 15:1 - 9:1 comme éluant. On obtient ainsi le 6=-
désoxy-heptakis(2,3-di-O-hexanoyl)-61-(2-
isocyanatoéthylthio)cyclomaltoheptaose (130 mg, 60%) ayant
les caractéristiques suivantes:
.- Rf = 0.28 ( 9: 1 CHzCla-MeOH )
[a]D = +89.6 (c 0.3, CHC13)
d) Composé no. 26.
A une solution du composé 24 (121 mg, 46.5 mol) dans la
DMF (2 mL) on ajoute le bicarbonate de sodium (solution
saturée dans l'eau) jusqu'à pH 8, et on agite le mélange
réactionnel à température ambiante pendant 20 min. On ajoute
alors une solution du 61-désoxy-62-(2-
isothiocyanatoéthylthio)cyclomaltoheptaose (86 mg, 70 ~Lmol)
dans la DMF (0.5 mL) et la solution résultante est agité à
température ambiante pendant 24 h. Le solvant est évaporé à
pression réduite, le résidu est repris dans le
dichlorométhane (5 mL), lavé par l'eau (2 mL), la phase
organique est séchée (Na2SO4) et concentrée. Le résidu est
CA 02658459 2009-01-20
WO 2008/009831 64 PCT/FR2007/001259
purifié par chromatographie sur colonne de gel de silice avec
un mélange CH2C12-MeOH 10:1 comme éluant, puis par
chromatographie de filtration sur gel (Sephadex LH-20, MeOH).
On obtient ainsi le composé 26 (80 mg, 45%) ayant les
caractéristiques suivantes:
.- [a]D = +91.6 (C 1.0, CHC13)
Alternativement, le composé 26 (105 mg, 60%) a été
préparé par réaction entre le 6=-(2-aminoéthylthio)-61-
désoxy-cyclomaltoheptaose trifluoroacétate (66 mg, 51 mol)
et le 6=-désoxy-heptakis(2,3-di-o-hexanoyl)-62-(2-
isocyanatoéthylthio)cyclomaltoheptaose (121 mg, 46.4 ~tmol)
dans la DMF (3 mL) a pH 8(NaHCO3) suivant la même procédure.
Exemple 27. Formulation de nanosphères blanches homogènes.
La méthode utilisée pour préparer des nanosphères
blanches homogènes consiste à introduire une phase organique
d'acétone (ou de tétrahydrofurane) et d'un dérivé de
cyclodextrine amphiphile de l'invention (1 mg=mL-1) dans une
phase aqueuse de volume équivalent ou d'un volume double (eau
distillée), sous agitation magnétique (500 tr=min`1) à 25 C.
Après nanoprécipitation, le solvant organique est éliminé
sous pression réduite à +35 C. La suspension aqueuse
présentant un aspect opalescent à laiteux (suivant les
produits mis en oeuvre) est ensuite concentrée jusqu'au volume
final souhaité, puis filtrée sur filtre 0.8 pm (Millex AA,
Millipore, France).
Les suspensions de nanoparticules ont été triplées.
La Figure 1 représente une photographie en cryo-transmission
des nanosphères observées par microscopie électronique à
transmission après cryofracture.
Les suspensions colloïdales sont ensuite caractérisées sur le
plan granulométrique (taille moyenne et polydispersité) et,
lorsqu'ils incorporent des cyclodextrines amphiphiles
CA 02658459 2009-01-20
WO 2008/009831 65 PCT/FR2007/001259
chargées, par leur potentiel zéta. La caractérisation est
effectuée en suivant les procédés ci-après :
a) Mesure de la taille des nanoparticules.
La diffusion quasi-élastique de la lumière est mise en
oeuvre. Un appareil Zetasizer 3000 équipé d'un corrélateur
K7132 (Malvern Instruments, RU) a été utilisé. Les conditions
de mesure sont les suivantes . angle de détection 900,
température 25 0.1 C, viscosité apparente 0.89 mPa.s. Avant
de réaliser les mesures de taille, les échantillons sont
dilués dans l'eau distillée si nécessaireõ Le diamètre
hydrodynamique (Z moyen) et l'indice de polydispersité (IP)
des nanoparticules en suspension ont été calculés en
intensité par la méthode des cumulants en réalisant 3 mesures
d'un même échantillon. La valeur du diamètre hydrodynamique
est calculée à partir de la mesure du coefficient de
diffusion translationnel des particules animées de mouvement
brownien. Un appareil NanoZS (Malvern Instruments) a
également été utilisé *pour la mesure de taille des
nanocapsules. De la même manière, les échantillons sont
dilués avant la mesure, si nécessaire dans l'eau additionnée
de Montanox 80 (marque déposée).
b) Mesure du potentiel zéta des nanoparticules
Un appareil zétasizer 3000 (laser HeNe 10 mW à 632.8 nm)
(Malvern Instruments, Malvern, RU) a été utilisé. Les mesures
sont réalisées à une température de 25 0.1 C après dilution
des échantillons dans une solution de chlorure de sodium (10-
3M). Les valeurs de potentiel zéta sont obtenues en réalisant
3 mesures d'un même échantillon.
Les études de stabilité physique des particules ont été
réalisées sur des périodes s'étalant de 1 moi~ à 8 mois. Les
données correspondantes pour une série de cyclodextrines
amphiphiles de l'invention sont recueillies dans le Tableau 1
CA 02658459 2009-01-20
WO 2008/009831 66 PCT/FR2007/001259
fournissant les caractéristiques granulométriques (taille
moyenne et indice de polydispersité ou IP moyen), avec
évolution dans le temps, de divers nanosphères homogènes
issues des composés indiqués dans la colonne de gauche, les
numéros de référence des composés en question correspondant à
ceux des composés décrits dans les exemples de préparations
ci-dessus.
composé initial 3 mois 6 mois 8 mois
no.
Taille IP Taille IP Taille IP Taille IP
moyenne moyenne moyenne moyenne
déviation déviation déviation déviation
standard standard standard standard
(n=3) (n=3) (n=3) (n=3)
(nm) (nm) (nm) (nm)
1 251 0.08 236 0.03
62 13
2 238 0.02 182 0.01
29 22
3 181 5 0.08 157 8 0.06 206 0.18
17
4 217 0.04 206 0.03 227 0.06
17 20 26
5 244 0.13 232 0.05 242 0.03
13 22 27
6 171 9 0.03 157 8 0.06 198 0.04
12
7 283 0.06 194 2 0.02
29
9 123 2 0.03 138 2 0.09
10 212 0.11 207 1 0.07 269 0.32
CA 02658459 2009-01-20
WO 2008/009831 67 PCT/FR2007/001259
14 64
12 72 32 0.31
13 115 0.16
31
26 100 0.06
Exemple 28. Formulation de nanosphères blanches mixtes.
La méthode utilisée pour préparer des nanosphères
5 blanches mixtes consiste à introduire une phase organique de
deux dérivés de cyclodextrines amphiphiles dans l'acétone, en
proportions variables (1mg.mL-1), dans une phase aqueuse de
volume équivalent (eau distillée), sous agitation magnétique
(500 tr=miril) à 25 C. Après nanoprécipitation, le solvant
10 organique est éliminé sous pression réduite à 35 C. La
suspension aqueuse présentant un aspect opalescent est
ensuite concentrée jusqu'au volume final souhaité, puis
filtrée (0.8 pm, Millex AA, Millipore, France). Les
suspensions de nanoparticules sont triplées. Les suspensions
15 colloïdales ont ensuite été caractérisées en terme de taille
moyenne et potentiel zéta, suivant les procédés décrits ci-
dessous, puis sont stockées à+6 C.
Dans un exemple typique, on utilise comme phase
organique une solution des composés no. 2 et no. 8(1 mg=mL'
20 1), dans des proportions relatives 4:1 et 7:3, dans l'acétone
avec comme phase aqueuse l'eau distillée (proportion eau-
acétone 1:1 v/v). On obtient dans le cas d'une proportion 4:1
des composés no. 2 et no. 8, dans une série d'expériences
indépendantes, des nanosphères blanches avec une taille
moyenne qui varie de 110 à 138 nm avec des IP qui varient de
0.16 à 0.27 et un potentiel zéta qui varie de 43 à 47 mV.
Dans le cas d'une proportion 7:3 des composés no. 2 et no. 8,
dans une série d'expériences indépendantes, on obtient des
CA 02658459 2009-01-20
WO 2008/009831 68 PCT/FR2007/001259
nanosphères blanches avec une taille moyenne qui varie de 88
à 162 nm avec des IP qui varient de 0.14 à 0.2 et un
potentiel zéta qui varie de 40 à 45 mV.
Dans un autre exemple typique, on utilise comme phase
organique une solution des composés no.25 et 26 (1mg.mL-1),
dans des proportions relatives 1:4, dans l'acétone avec comme
phase aqueuse l'eau distillée (proportion eau/ acétone 1 :1
v/v). On obtient dans le cas d'une proportion 1:4 des
composés no. 25 et 26, dans une série d'expériences
indépendantes, des nanosphères blanches avec une taille
moyenne qui varie de 95 à 120 nm avec des IP de 0.03 à 0.08.
Exemple 29. Formulation de nanocapsules blanches.
La méthode utilisée pour préparer des nanocapsules
blanches consiste tout d'abord à préparer une phase
acétonique contenant une petite fraction de triglycérides à
chaînes caprique/caprylique (Miglyol 812 (marque déposée)),
un dérivé de cyclodextrine amphiphile de l'invention, un
agent tensioactif lipophile non ionique (Montane 80 (marque
déposée)) et une phase hydrophile contenant de l'eau
distillée et un agent tensioactif hydrophile non ionique. La
phase organique est ensuite introduite dans la phase
hydrophile sous agitation magnétique (500 tr=miril) à 25 C.
Après nanoprécipitation, le solvant organique est éliminé
sous pression réduite à 35 C. La suspension aqueuse
présentant un aspect laiteux est ensuite concentrée jusqu'au
volume final souhaité. Les lots de suspensions colloïdales
ont été triplés. Les nanoparticules ont ensuite été
caractérisées en terme de taille moyenne puis ont été
stockées à +6 C.
Dans un exemple typique, on utilise comme phase
organique l'acétone, le Miglyol 812 (marque déposée)
(proportion acétone-Miglyol 812 (marque déposée) 100:1 v/v),
le Montane 80 (marque déposée )( 4 mg =mL-1) et le composé no.
CA 02658459 2009-01-20
WO 2008/009831 69 PCT/FR2007/001259
3 (2 mg=mL-1), et comme phase aqueuse l'eau distillée
(proportion eau-acétone 2:1 v/v) contenant le Montanox 80
(marque déposée) (2 mg=mL'1). On obtient dans ce cas là, dans
une série d'expériences indépendantes, des nanocapsules
blanches avec une taille moyenne qui varie de 203 à 255 nm
avec des IP qui varient de 0.04 à 0.24.
Exemple 30. Formulation des nanosphères chargées de principe
actif (diazepam).
La méthode utilisée pour préparer des nanosphères
chargées de molécule hôte, ici un principe actif (le
diazepam), consiste à introduire une phase organique
contenant l'acétone, un dérivé de cyclodextrine amphiphile de
l'invention et le diazépam (DZ) dans une phase aqueuse
contenant de l'eau distillée avec ou sans tensioactif
hydrophile non ionique (par exemple le poloxamer 188), sous
agitation magnétique (500 tr=min-1) à 25 C. Après
nanoprécipitation, le solvant organique est éliminé sous
pression réduite à 35 C. La suspension aqueuse présentant un
aspect opalescent est ensuite concentrée jusqu'au volume
final souhaité.
Les lots de suspensions colloïdales ont été triplés. Les
nanoparticules ont ensuite été caractérisées sur le plan
granulométrique. La quantité de diazépam fixée aux
nanosphères a été évaluée par différence entre la quantité de
diazépam présente dans la suspension colloïdale finale et la
quantité de diazépam présente dans le surnageant. Le dosage
du diazépam a été réalisé par spectrophotométrie à 285 nm. Le
taux d'encapsulation ou d'association du principe actif aux
nanoparticules (TEeXP) et le rendement ou efficacité
d'encapsulation (RE) ont donc été évalués. Les suspensions
aqueuses ont été stockées à + 6 C.
Dans un exemple typique, la phase organique est
constituée par l'acétone, le composé no. 3 ( 1 mg=mL'1) et le
CA 02658459 2009-01-20
WO 2008/009831 70 PCT/FR2007/001259
diazépam (0.5 mg=mL-1), et la phase aqueuse est constituée
par l'eau distillée (proportion eau-acétone1 1:1 v/v). On
obtient dans ce cas là, dans une série d'expériences
indépendantes, des nanosphères chargées avec une taille
moyenne qui varie de 135 à 175 nm avec des IP1 qui varient de
0.01 à 0.02, des valeurs de TEe,p comprises entre 24 et 28% et
des valeurs de RE comprises entre 74 et 89%.
TEth correspond au pourcentage massique de I DZ introduit
initialement (DZi). Il est déterminé de la manière suivante
100 x DZi (mg) /(DZi + CD) mg
TEeXP correspond au pourcentage de DZ réellement associé aux
nanoparticules (DZa)
RE : 100x DZa(mg) / DZi (mg)
Exemple 31. Formulation de nanocapsules chargées de principe
actif (diazépam)
La méthode utilisée pour préparer des nanocapsules
chargées de molécule hôte, ici un principe actif (le
diazépam), consiste tout d'abord à préparer une phase
acétonique contenant une petite fraction de triglycérides à
chaînes caprique/caprylique (Miglyol 812 (marque déposée)),
un dérivé de cyclodextrine amphiphile de l'invention, un
agent tensioactif lipophile non ionique (Montane 80 (marque
déposée)), le diazépam (DZ) et une phase hydrophile contenant
de l'eau distillée et un agent tensioactif hydrophile non
ionique. La phase organique est ensuite introduite dans la
phase hydrophile sous agitation magnétique (500 tr.miril) à
25 C. Après nanoprécipitation, le solvant organique est
éliminé sous pression réduite à+35 C. La suspension aqueuse
présentant un aspect laiteux est ensuite concentrée jusqu'au
volume final souhaité. Les lots de suspensiôns colloïdales
ont été triplés. Les nanoparticules ont ensuite été
CA 02658459 2009-01-20
WO 2008/009831 71 PCT/FR2007/001259
caractérisées en terme de taille moyenne puis ont été
stockées à +6 C.
Dans un exemple typique, on utilise comme phase
organique, l'acétone, le Miglyol 812 (marque déposée)
(proportion acétone - Miglyol 812 (marque déposée) 100 :1
v/v), le Montane 80 (marque déposée) (4mg.mL-1) et le composé
no. 3 (2 mg.mL'1), le diazépam (1 mg.mL'1) et comme phase
aqueuse l'eau distillée (proportion eau-acétone 2 :1 v/v)
contenant le Montanox 80 (marque déposée) (4 mg.mL'1). On
obtient dans ce cas là, dans une série d'expériences
indépendantes, des nanocapsules chargées avec une taille
moyenne qui varie de 215 à 225 nm avec des IP qui varient de
0.03 à 0.07 , des valeurs de RE comprises entre 85 et 93%.
Exemple 32. Préparation de complexes avec les composés no. 8
ou 16 et le plasmide pTG11236, caractérisation et capacité de
transfection.
a) Préparation
Le plasmide pTG11236 (pCMV-SV40-luciferase-SV40pA),
utilisé pour la préparation des complexes d'ADN et pour les
tests de transfection est un plasmide de 5739 paires de
bases. Les quantités de composés utilisées sont calculées
pour obtenir une concentration d'ADN de 0.1 mg=mL'1 (303 uM
en équivalent phosphate) et les valeurs désirées des rapports
Azote / Phosphate (N/P). Des tests pour des valeurs de N/P =
5, 10, 30 et 50 ont été effectués aussi bien pour le composé
no. 8 que pour le composé no. 16. Comme formulation de
transfection de référence (contrôle positif), nous avons
utilisé les polyplexes formulés avec le même plasmide et le
polymère polycationique polyéthylèneimine (PEI ramifié, 25
kDa), et comme contrôle négatif l'ADN nu.
Pour la préparation des complexes, l'ADN est dilué dans
l'HEPES (20 mM, pH 7.4) jusqu'à une concentration finale de
303 pM en équivalent phosphate, puis la quantité nécessaire
CA 02658459 2009-01-20
WO 2008/009831 72 PCT/FR2007/001259
de composé no. 8 ou no. 16 obtenue à partir d'une solution
mère de 20 mg=mL'1 dans le DMSO-eau 1:2 (v/v) est ajoutée
afin d'obtenir le rapport N/P désiré. Pour le PEI, on utilise
une solution mère 0.1 M dans l'eau. Les mélanges sont
vortexés pendant 10 s et utilisés pour la caractérisation et
pour les tests de transfection, comme décrit ci-dessous.
b) Caractérisation des complexes ADN-composé no. 8 ou
no. 16
b-1) Mesure de taille et polydispersité des
nanoparticules d'ADN.
La diffusion quasi-élastique de la lumière est mise en
uvre comme décrit ci-dessus en utilisant un appareil
CoulterN4 MD. Les mesures sont effectuées directement sur les
préparations ci-dessus soit à une concentration d'ADN de 0.1
mg=mL-1 (303 MM en équivalent phosphate).
Dans le cas des nanoparticules d'ADN formulées pour un
rapport N/P de 10~ et 30 avec les composés no. 8 ou no. 16, on
obtient, dans une série d'expériences indépendantes, des
nanoparticules avec une taille moyenne qui varie de 150
(Déviation Standard - SD - = 100) à 200 (SD = 190) nm. A
titre de comparaison, les polyplexes formulés avec le PEI
pour un rapport N/P de 10 ont une taille moyenne de 160 nm
(SD = 100).
b-2) Analyse électrophorétique des nanoparticules d'ADN.
10 pl de chaque formulation de complexes préparés comme
mentionnés ci-dessus sont dilués une fois dans du tampon de
charge (glycérol + bleu de bromophénol + Tris-acétate-EDTA ou
TAE). 10 ul de cette solution sont déposés sur un gel à 0,8%
d'agarose. Le reste de l'échantillon est dilué une fois avec
une solution de décomplexant à 8% de sodium dodécyl sulfate
( SDS ) dans le TAE, puis 10 pl sont également déposés sur un
gel. L'électrophorèse est réalisée pendant 90 min à 50 V. Le
CA 02658459 2009-01-20
WO 2008/009831 73 PCT/FR2007/001259
gel est ensuite développé avec le bromure d'éthidium (Sigma)
dans le TAE (20 uL d'une solution de bromure d'éthidium de
concentration 10 mg=mL-1 dans 200 mL du TAE). L'ADN est ainsi
visualisé et photographié avec un transilluminateur UV. Les
Figures 2 et 3 sont des photographies des analyses
électrophorétiques, réalisées sur gel d'agarose en présence
de bromure d'éthidium, des complexes ADN/nanoparticules
obtenus avec le composé no. 8 selon des rapport N/P
respectivement de 5, 10, 30 et 50.
L'analyse de la Figure 2 montre l'absence totale de
bandes correspondant à l'ADN en ce qui concerne les
nanoparticules d'ADN issues de préparation ayant un rapport
N/P ? 10 (couloir 3 à 5) comparativement à l'ADN nu qui est
clairement visible couloir 1. Ce résultat indique une
complexation totale de l'ADN. Cependant, pour un rapport N/P
= 5 (couloir 6), l'ADN reste encore partiellement accessible
à l'intercalation par le bromure d'éthidium.
Des résultats très similaires ont été obtenus avec les
complexes formulés avec le composé no. 16, celui-ci formant
des complexes avec l'ADN dès un rapport N/P 5, l'ADN n'étant
plus accessible à l'intercalation du bromure d'éthidium.
L'intégrité du plasmide dans chaque échantillon est confirmée
par électrophorèse sur gel après décomplexation avec le SDS,
comme le montrent la Figure 3 pour un temps d'incubation de
10 min.
Exemple 33. Tests de transfection in vitro des nanoparticules
d'ADN.
Des cellules murines d'embryon BNL-CL2 sont cultivées en
plaques 96-puits jusqu'à une densité de 2 x 104
cellules/puits dans un milieu de culture DMEM (Dulbelcco's
Modified Eagle Medium, Gibco-BRL) contenant 10% de sérum de
veau foetal (SVF; Sigma) à 37 QC dans une atmosphère humide
avec une proportion 5% C02/95% air.
CA 02658459 2009-01-20
WO 2008/009831 74 PCT/FR2007/001259
Les complexes entre le composé no. 8, no. 16 ou le
polyéthylèneimine (PEI), et le plasmide pTG11236 sont dilués
dans 100 pL de DMEM de façon à avoir 0.5 pg d'ADN dans le
puits.
Le milieu de culture est enlevé et remplacé par 100 pL de
solution de complexe nanoparticule/ADN dans le DMEM. Après 4
h et 24 h, 50 et 100 pL de DMEM contenant 30% et 10% de SVF,
respectivement, sont additionnés. Après 48 h, la transfection
est arrêtée, le milieu de culture est retiré et les cellules
sont lavées par le PBS (2 x 100 pL ), puis lysées avec 50 ~tL
de tampon de lyse (Promega, Charbonnières, France). Les
lysats sont congelés à -32 QC jusqu'au dosage de luciférase
et des protéines.
Le dosage de la luciférase permet d'évaluer l'efficacité
de transfection. Ce dosage est basé sur une réaction de
chimioluminescence dont le principe repose sur l'oxydation
par la luciférase de son substrat (la luciférine) avec
production concomitante d'un photon. La mesure de l'activité
de la luciférase est réalisée avec un appareil Biolumat LB96P
WMP100 (BERTHOLD) pendant 10 s après l'injection de 50 p1 de
réactif contenant la luciférine (kit de dosage Proméga) dans
chaque puits contenant 10 pl d'extrait cellulaire. Pour
chaque dosage, une gamme étalon de 1 fg/ul à 1 ng/pl est
réalisée avec de la R-luciférase (Bio-Rad) ce qui permet de
convertir les mesures RLU en femtogrammes (fg) de luciférase
par puits. Le dosage des protéines dans chaque puits (cf. ci-
après) permet de convertir ces mesures en fg de luciférase
par mg de protéine.
Le dosage des protéines s'effectue au moyen du test BCA
(Pierce). Le dosage des protéines est réalisé sur 15 pl de
lysat cellulaire auxquels sont rajoutés 300 ul de réactif de
Pierce (BCA Protein Assay Reagent). Il s'agit d'un dosage
colorimétrique qui est réalisé avec un spectrophotomètre
UV/visible MRX (DYNEX Technologies). Pour chaque dosage, une
CA 02658459 2009-01-20
WO 2008/009831 75 PCT/FR2007/001259
gamme étalon est réalisée avec de la BSA (Bovine Serum
Albumin, BIO-RAD), de 0 à 30 ug par puits. La lecture est
faite à 570 nm, après 30 mn d'incubation à 37 C et 15 min à
température ambiante. Grâce à la gamme étalon de BSA, les DO
peuvent être exprimées en mg de protéines/puits.
Le rapport des quantités de protéines correspondant aux
cellules transfectées et non transfectées (100 % de viabilité
cellulaire) permet d'évaluer la viabilité cellulaire des
complexes (exprimée en %).
Toutes les formulations sont testées au moins 3 fois.
Les résultats obtenus ont été traités au moyen du logiciel
STATGRAPHICS Plus5.1 (marque déposée). L'analyse de variance
Anova est effectuée sur les valeurs des efficacités de
transfection (Log10(fg luciférase / mg protéine)) et sur la
viabilité cellulaire. Il est possible d'analyser l'impact
(sur la transfection ou la viabilité cellulaire) de la
variation d'un ou de plusieurs facteurs en appliquant
respectivement une analyse de variance mono- ou
multifactorielle. La méthode utilisée pour la comparaison des
moyennes est le HSD (honestly significant difference)
intervals de Tukey. Cette technique du HSD de Tukey permet de
comparer toutes les paires de moyennes et d'y montrer des
différences avec un risque alpha.
Deux facteurs, la nature de l'agent de complexation
(composés no. 8, no. 16, ou PEI) et le rapport N/P, ont été
analysés comme source de variation des pourcentages de
viabilité cellulaire (Figure 4) et du logarithme des niveaux
de transfection (Figure 5 et 6).
La Figure 4, représente les moyennes et intervalles
significatifs à 95 % de Tukey de la viabilité cellulaire
après transfection de cellules BNL-CL2 par des complexes
formulés avec les composés no. 8, no. 16 ou PEI et l'ADN
plasmidique pTG11236, en fonction du rapport N/P allant de 5
CA 02658459 2009-01-20
WO 2008/009831 76 PCT/FR2007/001259
à 50, et déterminée pour une concentration en plasmide de 0,5
g/puits.
L'analyse de la Figure 4 indique d'excellentes viabilités
cellulaires après transfection des complexes formulés avec le
composé no. 8 ou no. 16.
Pour des rapports N/P > 10, les transfections réalisées avec
des complexes formulés avec l'ADN et les composés no. 8 ou
no. 16 révèle que la viabilité cellulaire est
significativement supérieure à celle obtenue après
transfection des cellules, pour les mêmes rapports N/P, par
les polyplexes issus des complexes PEI/ADN.
La Figure 5 représente les moyennes et intervalles
significatifs à 95 % de Tukey de la transformation
logarithmique de l'expression de luciférase (fg de luciférase
/ mg de protéine) par les cellules BNL-CL2 transfectées avec
des complexes formés par les composés no. 8, no. 16 ou PEI et
l'ADN plasmid-ique pTG11236 pour un rapport NIP = 5, 10, 30 et
50, et pour 0,5 pg d'ADN par puits sur des cellules BNL-CL2.
La Figure 6 représente les moyennes et intervalles
significatifs à 95 % de Tukey de la transformation
logarithmique de l'expression de luciférase (fg de luciférase
/ mg de protéine) par les cellules BNL-CL2 transfectées avec
des complexes formulés avec les composés no. 8, no. 16 ou PEI
et l'ADN plasmidique pTG11236 pour N/P = 10 et pour 0,5 ug
d'ADN par puits.
L'analyse des Figures 5 et 6 indique des niveaux de
transfection qui sont, pour des rapports NIP > 10, de l'ordre
de 100 fois supérieurs à ceux de l'ADN nu, et environ 100
fois inférieurs à ceux mesurés pour les polyplexes N/P 10
formulés avec le PEI.
CA 02658459 2009-01-20
WO 2008/009831 77 PCT/FR2007/001259
Pour les complexes formulés avec le composé no. 16,
cette analyse statistique indique des niveaux de transfection
qui sont de l'ordre de 10.000 fois supérieurs à ceux de l'ADN
nu, et équivalents à ceux mesurés pour les polyplexes N/P 10
formulés avec le PEI qui correspondent à l'optimum de la
formulation de référence (figure 6).