Note: Descriptions are shown in the official language in which they were submitted.
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
1
NOUVEAUX DERIVES de 2,4-DIANILINOPYRIMIDINES, LEUR
PREPARATION, A TITRE DE MEDICAMENTS, COMPOSITIONS
PHARMACEUTIQUES ET NOTAMDENT COMME INHIBITEURS DE IKK
La présente invention concerne de nouveaux dérivés de
2,4-dianilinopyrimidines, leur procédé de préparation,
les nouveaux intermédiaires obtenus, leur application à
titre de médicaments, les compositions pharmaceutiques
les renfermant et la nouvelle utilisation de tels dérivés
de 2,4-dianilinopyrimidines.
Le brevet W0200164654-Al mentionne des 2,4-di-(hétéro)-
arylpyrimidines substituées en 5, inhibitrices des
kinases CDK2 et FAK, de même d'autres aminopyrimidines
inhibitrices de sérine-thréonine kinases et de CDK sont
présentées dans W02003030909-Al. Le brevet W02004046118-
A2 décrit des dérivés des 2,4-diphénylaminopyrimidines
comme inhibiteurs de la prolifération cellulaire.
Une série de 5-cyano-2-aminopyrimidines sont présentées
comme inhibitrices des kinases KDR et FGFR, dans
W0200078731-A1, d'autres pyrimidines comme inhibitrices
de FAK et de IGFR dans W02004080980A-1, et aussi de ZAP-
70, FAK et/ou Syk tyrosine kinase dans W02003078404A1, et
des polokinases PLK dans W02004074244-A2, comme agents
cytostatiques.
De même d'autres brevets décrivent des pyrimidines
inhibitrices de la transcriptase inverse pour le
traitement des infections liées à HIV (W0200185700-A2 ;
W0200185699-A2 ; W0200027825A1 et W02003094920A1).
La présente invention a ainsi pour objet de nouveaux
dérivés de 2,4-dianilinopyrimidines dotés d'effets
inhibiteurs vis-à-vis de protéines kinases.
Les produits de la présente invention peuvent ainsi
notamment être utilisés pour la prévention ou le
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
2
traitement d'affections capables d'être modulées par
l'inhibition de l'activité de protéines kinases.
Parmi ces protéines kinases, on cite plus
particulièrement la protéine kinase IKK-alpha (IKK(x) et
IKK-béta ( IKK(3 ) .
Les composés de la présente invention sont des
inhibiteurs de kinase en particulier de IKK-alpha et
IKK-béta, par conséquent inhibent l'activité NF-KB
(nuclear factor kappa B), ainsi ils peuvent être utilisés
dans le traitement de la prophilaxie et les maladies
inflammatoires, dans le cancer et le diabète.
Le NF-kB (Nuclear factor kappa B) appartient à une
famille de complexes de facteurs transcriptionnels
constitués de différentes combinaisons de polypeptides
Rel/NF-KB. Les membres de cette famille de polypeptides
reliés à NF-KB régulent l'expression de gènes impliqués
dans les réponses immunes et inflammatoires. ((Bames PJ,
Karin M(1997) N Engl J Med 336,1066-1071) et (Baeuerle
PA, Baichwal VR (1997) Adv Immunol 65, 111-137)). Dans
les conditions basales, les dimères de NF-KB sont retenus
sous forme inactive dans le cytoplasme, par des protéines
inhibitrices membres de la famille IKB (Beg et. al.,
Genes Dev., 7:2064-2070, 1993; Gilmore and Morin, Trends
Genet. 9:427-43)3), 199'); Haskil et. al., Cell 65: 1281-
1289, 1991). Les protéines de la famille IKB masquent le
signal de translocation nucléaire de NF-KB. La
stimulation de la cellule par différents types de ligands
tels que les cytokines, le ligand anti-CD40, le
lipopolysaccharide (LPS), les oxydants, des mitogènes
comme le phorbol ester, des virus ainsi que beaucoup
d'autres stimulants, entraîne l'activation du complexe
IKB-Kinase (IKK) qui va à son tour phosphoryler IKB au
niveau des résidus serines 32 et 34. Une fois
phosphorylé, IKB sera sujet à des ubiquitinations menant
à sa dégradation par le protéasome (26S), permettant
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
3
ainsi la libération et la translocation de NE-KB dans le
noyau ou il va se lier à des séquences. spécifiques au
niveau des promoteurs de gènes cibles induisant ainsi
leur transcription.
Dans le complexe IKB-Kinase (IKK), les principales
kinases sont IKK1(IKKa) et IKK2 (IKK(3) qui sont capables
de phosphoryler directement les différentes classes
d'IKB. Dans ce complexe IKK, IKK2 est la kinase dominante
(Mercurio et. al., Mol. Cell Biol., 19:1526, 1999-, Zandi
et. al., Science; 28 1: 1 3) 60, 1998; Lee et. al, Proe.
Natl. Acad. Sci. USA 95:93) 19, 1998).
Parmi les gènes régulés par NF-KB, beaucoup codent pour
des médiateurs pro-inflammatoires, des cytokines, des
molécules d'adhésion cellulaire, des protéines de la
phase aigüe, qui également vont à leur tour induire
l'activation de NF-KB par des mécanismes autocrines ou
paracrines.
L'inhibition de l'activation de NF-KB semble très
importante dans le traitement des maladies
inflammatoires.
En plus NF-KB, joue un rôle dans la croissance des
cellules normales mais aussi des cellules malignes.
Les protéines produites par l'expression de gènes régulés
par NF-KB comprennent des cytokines, chemokines,
molécules d'adhésion, des médiateurs de la croissance
cellulaire, de l'angiogénèse. Par ailleurs différentes
études ont montré que NF-KB joue un rôle essentiel dans
les transformations néoplastiques. Par exemple NF-KB peut
être associé avec la transformation des cellules in vitro
et in vivo suite à des événement de sur-expression,
amplification, réarrangement ou translocation (Mercurio,
R, and Manning, A.M. (1999) Oncogene, 18:6163-6171). Dans
certaines cellules de tumeurs lymphoïdes humaines, les
gènes codant pour les différents membres NF-KB sont
réarrangés ou amplifiés. Il a été montré que NF-KB peut
promouvoir la croissance cellulaire en induisant la
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
4
transcription de la cycline D, qui associées à
l'hyperphosphorylation de Rb entraîne la transition des
phases G1 à S et l'inhibition de l'apoptose.
Il a été montré que dans un nombre important de lignées
de cellules tumorales, on trouve une activité
constitutive de NF-KB suite à l'activation de IKK2. NF-KB
est constitutivement activé dans les maladies de Hodgkin
et l'inhibition de NF-KB bloque la croissance de ces
lymphomes. D'autre part, l'inhibition de NF-KB par
l'expression du répresseur IKBa induit l'apoptose des
cellules exprimant l'allèle oncogénique H-Ras (Baldwin,
J. Clin. Invest., 107:241 (2001), Bargou et al., J. Clin.
Invest., 100:2961 (1997), Mayo et al., Science 178:1812
(1997).
L'activité constitutive de NF-KB semble contribuer à
l'oncogénèse à travers l'activation de plusieurs gènes
anti-apoptotiques tels que Al/Bfi-1, IEX-1, MAP, ce qui
entraîne ainsi la suppression de la voie de mort
cellulaire. A travers l'activation de la cycline D, NF-KB
peut promouvoir la croissance des cellules tumorales. La
régulation des molécules d'adhésion et des protéases de
surface suggèrent un rôle de la signalisation NF-KB dans
les métastases.
NF-KB est impliqué dans l'induction de la
chimiorésistance. NF-KB est activé en réponse à un
certain nombre de traitements en chimiothérapie. Il a été
montré que l'inhibition de NF-KB par l'utilisation de la
forme super-répresseur de IKBa en parallèle au traitement
de chimiothérapie augmente l'efficacité de la
chimiothérapie dans des modèles de xénogreffe.
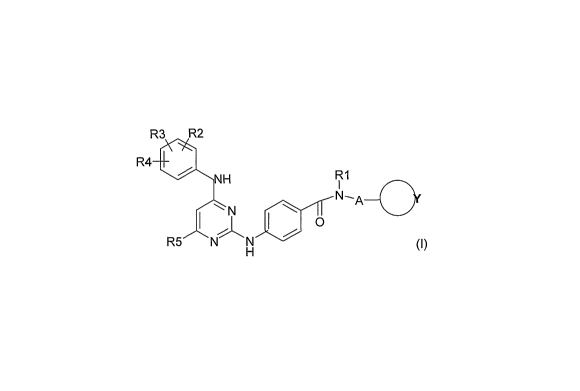
La présente invention a pour objet les produits de
formule (I) :
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
R3 R2
R4
NH R1
N,A
N
R5 N H / (I)
dans laquelle:
R2, R3 et R4, identiques ou différents, sont tels que
l'un représente un atome d'halogène ou CF3 et les deux
autres, identiques ou différents, représentent un atome
5 d'hydrogène ou un atome d'halogène ou un radical alkyle
ou un radical alcoxy éventuellement substitués par un ou
plusieurs atomes d'halogène;
R5 représente un atome d'hydrogène ou un atome
d'halogène;
R1 représente un atome d'hydrogène, un radical
cycloalkyle ou un radical alkyle, alkényle ou alkynyle,
tous éventuellement substitués par un ou plusieurs
radicaux, identiques ou différents, choisis parmi les
atomes d'halogène, 0R8 et NR8R9, les radicaux alkyles que
représente R1 étant de plus éventuellement substitués par
un radical hétérocyclique saturé ou insaturé à 5 chaînons
attaché par un atome de carbone et éventuellement
substitué par un ou plusieurs radicaux choisis parmi les
atomes d'halogène et les radicaux alkyle ou alcoxy,
A représente une simple liaison ou un radical -CH2-CO-
NR6-, et R6, identique ou différent de R1, est choisi
parmi les valeurs de R1;
le cycle renfermant Y (ou cycle(Y))étant monocyclique ou
bicyclique, constitué de 4 à 10 chaînons et étant saturé
ou partiellement saturé avec Y représentant un atome
d'oxygène 0, un atome de soufre S éventuellement oxydé
par un ou deux atomes d'oxygène ou un radical choisi
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
6
parmi N-R7, C=O ou son dioxolanne comme groupement
protecteur de la fonction carbonyle, CF2, CH-OR8 ou CH-
NR8R9;
étant entendu que le cycle renfermant Y (ou cycle(Y))
lorsque Y représente NR7, peut renfermer un pont carboné
constitué de 1 à 3 carbones,
R7 représente l'atome d'hydrogène, un radical cycloalkyle
ou un radical alkyle, CH2-alkényle ou CH2-alkynyle, tous
éventuellement substitués par un radical naphtyle ou par
un ou plusieurs radicaux identiques ou différents choisis
parmi les atomes d'halogène et les radicaux hydroxyle,
alcoxy, phényle et hétéroaryle, les radicaux alkyles que
représente R7 étant de plus éventuellement substitués par
un radical hydroxyle, -NR8R9, -CO-NR8R9, phosphonate,
alkylthio éventuellement oxydé en sulfone ou
hétérocycloalkyle éventuellement substitué ;
R8 représente l'atome d'hydrogène ou les radicaux alkyle,
cycloalkyle ou hétérocycloalkyle eux-mêmes éventuellement
substitués par un ou plusieurs radicaux choisis parmi les
atomes d'halogène et les radicaux hydroxyle, alcoxy, NH2,
NHalkyle, N(alkyle)2, -CONH2, -CONHalkyle ou
-CON(alkyle)2, les radicaux alkyles que représente R8
étant de plus éventuellement substitués par un radical
alkylthio, par un radical phényle éventuellement
substitué ou par un radical hétérocyclique saturé ou
insaturé éventuellement substitué ;
NR8R9 est tel que soit R8 et R9, identiques ou
différents, sont choisis parmi les valeurs de R8 soit R8
et R9 forment avec l'atome d'azote auxquels ils sont liés
une amine cyclique pouvant éventuellement renfermer un ou
deux autres hétéroatomes choisis parmi 0, S, N ou NR10,
l'amine cyclique ainsi formée étant elle-même
éventuellement substituée;
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
7
tous les radicaux hétérocycliques, hétérocycloalkyle et
hétéroaryle ci-dessus étant constitués de 4 à 10 chaînons
(sauf spécifié) et renfermant 1 à 4 hétéroatomes
choisi(s) le cas échéant parmi O, S éventuellement oxydé,
N et NR10 ;
tous les radicaux naphtyle, phényle, hétérocycliques,
hétérocycloalkyle et hétéroaryle ci-dessus ainsi que
l'amine cyclique que peuvent former R8 et R9 avec l'atome
d'azote auxquels ils sont liés étant eux-mêmes
éventuellement substitués par un ou plusieurs radicaux
identiques ou différents choisis parmi les atomes
d'halogène et les radicaux hydroxyle, alcoxy, alkyle,
hydroxyalkyle, alcoxyalkyle, CN, CF3, NH2, NHalk ou
N (alk) 2 ;
R10 représente un atome d'hydrogène ou un radical
alkyle,
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques desdits produits de formule
(I)-
Parmi les produits de formule (I) tels que définis ci-
dessus dans lesquels R1, R2, R3, R4, R5 et A ont les
significations indiquées ci-dessus, on peut citer
particulièrement ceux dans lesquels le cycle(Y) est
choisi parmi les définitions suivantes:
- Lorsque cycle(Y) est tel que Y représente C-OH, CF2,
CH-OR8 ou CH-NR8R9, le cycle formé peut notamment être un
cyclobutyle, cyclopentyle, cyclohexyle ou cycloheptyle et
particulièrement un cyclohexyle, ces radicaux étant donc
substitués notamment en para respectivement par OH, 2 F,
le radical OR8 ou le radical NR8R9 dans lesquels R8 et R9
sont choisis parmi les significations définis ci-dessus.
- Lorsque cycle(Y) est tel que Y représente NR7, le cycle
formé peut notamment être un radical azétidine,
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
8
pyrrolidine ou pipéridine avec l'atome d'azote N en para
ou en meta, qui porte donc le substituant R7 tel que
défini ci-dessus. Lorsque cycle(Y) tel que Y représente
NR7 renferme un pont carboné constitué de 1 à 3 carbones,
le cycle formé peut notamment être le cycle 8-
azabicyclo(3,2,1)octan-3yle ou encore un cycle choisi
parmi les suivants : le N,9-diméthyl-9-
azabicyclo[3.3.1]nonan-3-yl, le N,6-diméthyl-6-
azabicyclo[3.2.1]octan-3-yl, le N,3-diméthyl-3-
azabicyclo[3.2.1]octan-8yl ou encore, le N,3-diméthyl-3-
azabicyclo[3.3.1]nonan-9-yl.
- Lorsque cycle(Y) est tel que Y représente NR7, le cycle
formé peut notamment être un radical bicyclique tel que
par exemple quinolinyle ou indolizinyle.
- Lorsque cycle(Y) est tel que Y représente S, le cycle
formé peut notamment être un tétrahydrothiopyranyle ou un
tétrahydrothiophènyle: lorsque cycle(Y) est tel que Y
représente S02, le cycle formé peut notamment être un
dioxidotétrahydro-3-thiophènyle
- Lorsque cycle(Y) est tel que Y représente 0, le cycle
formé peut notamment être un tétrahydrofurane ou
tétrahydropyrane. Lorsque cycle(Y) est tel que Y
représente le dioxolanne de C=O, le cycle formé peut
notamment être le dioxaspiro(4,5)dec-8-yl.
La présente invention concerne particulièrement les
produits de formule (I) tels que définis ci-dessus dans
lesquels R2, R3, R4, R5, A et cycle(Y) ont les
significations indiquées ci-dessus et R1 représente un
atome d'hydrogène ou un radical alkyle renfermant de 1 à
5 atomes de carbone linéaire ou ramifié ou bien R1
représente ce radical alkyle substitué par un hétérocycle
saturé ou insaturé de préférence monocyclique à 5
chaînons lui-même éventuellement substitué comme indiqué
ci-dessus,
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
9
diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques desdits produits de formule
(I) =
La présente invention concerne particulièrement les
produits de formule (I) tels que définis ci-dessus dans
lesquels R2, R3, R4, R5 et A ont les significations
indiquées ci-dessus, R1 représente un atome d'hydrogène
ou un radical alkyle renfermant de 1 à 4 atomes de
carbone linéaire ou ramifié éventuellement substitué et
notamment CH3 et cycle(Y) est tel que Y représente NR7
avec R7 représente un radical alkyle renfermant de 1 à 6
atomes de carbone linéaire ou ramifié éventuellement
substitué par un radical choisi parmi les radicaux
hydroxyle, CF3, phosphonate, sulfone, phényle et
hétérocyclique saturé ou insaturé monocyclique ou
bicyclique, ces radicaux phényle et hétérocyclique étant
eux-mêmes éventuellement substitués comme indiqué ci-
dessus,
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques desdits produits de formule
(I) .
La présente invention concerne tout particulièrement les
produits de formule (I) tels que définis ci-dessus dans
lesquels R2, R3, R4, R5 et A ont les significations
indiquées ci-dessus,
R1 représente un radical alkyle renfermant de 1 à 4
atomes de carbone linéaire ou ramifié et notamment CH3 et
cycle(Y) est tel que Y représente NR8R9 dans lequel R8
représente un atome d'hydrogène ou CH3 et R9 représente
un radical alkyle renfermant de 1 à 6 atomes de carbone
linéaire ou ramifié éventuellement substitué par un
radical choisi parmi les râdicaux hydroxyle, CF3,
phosphonate, sulfone, phényle et hétérocyclique saturé ou
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
insaturé monocyclique ou bicyclique, ces radicaux phényle
et hétérocyclique étant eux-mêmes éventuellement
substitués comme indiqué ci-dessus,
lesdits produits de formule (I) étant sous toutes les
5 formes isomères possibles racémiques, énantiomères et
diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques desdits produits de formule
(I).
La présente invention concerne ainsi notamment les
10 produits de formule (I) tels que définis ci-dessus dans
lesquels R2, R3, R4, R5 et A sont choisis parmi les
significations indiquées ci-dessus et les autres
substituants sont choisis parmi des valeurs préférées
définies comme suit :
- R1 représente un atome d'hydrogène, un radical CH3 ou
un radical alkyle renfermant de 1 à 4 atomes de carbone
linéaire ou ramifié éventuellement substitué par un
radical NH2, NHalk, N(alk)2 ou par un hétérocycle saturé
ou insaturé de préférence un monocycle à 5 ou 6 chaînons
tels que définis ci-dessus et éventuellement substitués
comme indiqué ci-dessus ou ci-après et cycle(Y)
représente une pipéridinyle ou pyrrolidinyle substitué
sur son atome d'azote par R7 qui représente un radical
alkyle éventuellement substitué par un radical hydroxyle,
-NR8R9, -CO-NR8R9, phosphonate, ou alkylthio
éventuellement oxydé en sulfone;
- R1 est choisi parmi les valeurs définis ci-dessus et
cycle(Y) représente un radical cyclohexyle substitué par
un radical NR8R9 tel que défini ci-dessus
- R1 représente un radical CH3 éventuellement substitué
par un hétérocycle saturé ou insaturé tel que défini ci-
dessus et R7 représente un radical CH3
- R1 représente un atome d'hydrogène ou un radical CH3 et
cycle(Y) représente une pipéridine ou un cycle 8-
azabicyclo(3,2,1)octan-3yle substitué sur leur atome
d'azote par R7 avec R7 tel que défini ci-dessus.
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
11
Parmi les produits de formule (I) tels que définis ci-
dessus dans lesquels R1, R2, R3, R4, R5 et A ont les
significations indiquées ci-dessus, on peut citer par
exemples ceux dans lesquels cycle(Y) est choisi parmi les
définitions suivantes :
- Cycle(Y) tel que Y représente -N-R7 avec R7 représente
H
- Cycle(Y) tel que Y représente -N-R7 avec R7 représente
CH3
- Cycle(Y) tel que Y représente -N-R7 avec R7 représente
cycloalkyle tel que notamment cyclopropyle ;
- Cycle(Y) tel que Y représente -N-R7 avec R7 représente
un radical alkyle notamment CH3, C2H5 ou C3H7 substitué
par un phosphonate
- Cycle(Y) tel que Y représente -N-R7 avec R7 représente
un radical alkyle notamment CH3, C2H5 ou C3H7 substitué
par un alkylthio tel que S-CH3 ou S-C2H5 avec S
éventuellement oxydé en sulfone pour former par exemple
S02-CH3 ou S02-C2H5;
- Cycle(Y) tel que Y représente -N-R7 avec R7 représente
alkyle tel que notamment CH3 ou C2H5 substitués par un ou
plusieurs radicaux choisis parmi les atomes d'halogène
tel que notament F, et les radicaux phényle et
hétérocycle mono ou bicyclique, phényle et hétérocycle
eux-mêmes éventuellement substitués par un ou plusieurs
radicaux choisi(s) parmi les atomes d'halogène et les
radicaux alkyle, alcoxy, OH, CN, CF3, NH2, NHalk et
N(alk)2 : parmi ces hétérocycles que porte R7, on peut
citer notamment les hétérocycles insaturés de 5 chaînons
renfermant un à quatre hétéroatomes choisi(s) parmi N, 0
et S: ainsi R7 peut représenter notamment les radicaux -
CH2-thiophényle, -CH2-thiazolyle (N,S), -CH2-
thiadiazolyle (N,N,S), -CH2-furanyle (0), -CH2-pyrazolyle
(N,N), -CH2-isoxazolyle (N,O), -CH2-pyrrolyle (NH, NCH3),
ces radicaux, notamment pyrazolyle, isoxazolyle, e~t
pyrrolyle, ou tétrazolyle, étant eux-mêmes éventuellement
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
12
substitués notamment par alkyle renfermant de 1 à 3
atomes de carbone tel que notamment CH3 ou C2H5.
R7 peut également porter des hétérocycles tels que
définis ci-dessus tels que les radicaux pyridinyle (avec
N de la pyridine à 3 positions différentes) ; 2,3-
Dihydro-lH-indolyle; quinolyle; isoquinolyle ;
pyrimidinyle ; 2,3-Dihydro-benzofuranyle ;
([1,8]naphthyridinyle ; pyridinyle N oxyde ; 4-
[(Benzo[1,2,5]oxadiazolyle ; (2,3-Dihydro-benzofuranyle.
- Cycle(Y) tel que Y représente CH-NR8R9 avec NR8R9 tel
que R8 représente un atome d'hydrogène ou un radical
alkyle tel que notamment CH3 et R9 représente un radical
alkyle linéaire ou ramifié tel que notamment CH3, C2H5 ou
-CH2- ou -CH(CH3)- ou -CH(CH3)-CH2- substitués soit par
un hétérocycle mono ou bicyclique saturé ou insaturé
éventuellement substitué soit par un radical phényle
éventuellement substitué. Parmi les hétérocycles que
porte R9, on peut citer notamment les radicaux suivants:
pyridine (avec N de la pyridine à 3 positions
différentes) ; 2,3-Dihydro-lH-indolyle ; quinolyle;
isoquinolyle; pyrimidinyle; 2,3-Dihydro-benzofuranyle;
([1,8]naphthyridinyle; 4-[(Benzo[2,1,3]oxadiazolyle;
Benzo[2,1,3]thiadiazolyle;
De tels hétérocycles sont éventuellement substitués par
un ou plusieurs radicaux comme définis ci-dessus ou ci-
après.
Parmi les produits de formule (I) tels que définis ci-
dessus dans lesquels R2, R3, R4, R5, A et le cycle(Y) ont
les significations indiquées ci-dessus, on peut citer par
exemple ceux dans lesquels R1 est choisi parmi les
définitions suivantes
- R1 représente H
- R1 représente CH3
- R1 représente des radicaux alkényle (3C) tel que
allyle ou alkynyle (3C) tel que propargyle
- R1 représente alkyle et notamment CH3, C2H5, C3H7
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
13
substitués par un ou plusieurs radicaux identiques ou
différents choisis parmi les atomes d'halogène et les
radicaux NH2, NH(alk), N(alk)2, NH-CH2-CH2OH, NH-CH2-
C3H7-OH, NH(CH2-CF3), alcoxy, OH, ou un hétérocycle
saturé tel que par exemple pyrrolidinyle, pipéridinyle,
morpholinyle, tétrahydrofuranyle ou un hétérocycle
insaturé tel que notamment ceux définis ci-dessus pour
R7.
La présente invention a ainsi pour objet les produits de
formule (I) tels que définis ci-dessus dans laquelle:
R2, R3 et R4, identiques ou différents, sont tels que
l'un représente un atome d'halogène ou CF3 et les deux
autres, identiques ou différents, représentent un atome
d'hydrogène, un atome d'halogène ou un radical alkyle ou
alcoxy éventuellement substitués par un ou plusieurs
atomes d'halogène;
R5 représente un atome d'hydrogène ou un atome
d'halogène;
R1 représente un atome d'hydrogène, un radical
cycloalkyle ou un radical alkyle, alkényle ou alkynyle,
tous éventuellement substitués par un ou plusieurs
radicaux, identiques ou différents, choisis parmi les
atomes d'halogène, OR8 et NR8R9 ;
A représente une simple liaison ou un radical -CH2-CO-
NR6-, et R6, identique ou différent de R1, est choisi
parmi les valeurs de R1;
le cycle renfermant Y (ou cycle(Y))étant monocyclique ou
bicyclique, constitué de 4 à 10 chaînons, et étant saturé
ou partiellement saturé avec Y représentant un atome
d'oxygène 0, un atome de soufre S éventuellement oxydé
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
14
par ou deux atomes d'oxygène ou un radical choisi parmi
N-R7, C=O, CF2, CH-OR8 ou CH-NR8R9;
R7 représente un atome d'hydrogène ou un radical alkyle,
CH2-alkényle ou CH2-alkynyle, tous éventuellement
substitués par un radical naphtyle ou par un ou plusieurs
radicaux identiques ou différents choisis parmi les
atomes d'halogène et les radicaux hydroxyle, phényle et
hétéroaryle, tous ces radicaux naphtyle, phényle et
hétéroaryle étant eux-mêmes éventuellement substitués ;
les radicaux hétéroaryle étant constitués de 5 à 10
chaînons et renfermant 1 à 4 hétéroatomes choisi(s) parmi
0, S, N et NR10 ;
R8 représente l'atome d'hydrogène ou les radicaux alkyle,
cycloalkyle ou hétérocycloalkyle eux-mêmes éventuellement
substitués par un ou plusieurs radicaux choisis parmi les
atomes d'halogène et les radicaux hydroxyle, alcoxy, NH2,
Nalkyle ou N(alkyle)2;
NR8R9 est tel que soit R8 et R9, identiques ou
différents, sont choisis parmi les valeurs de R8 soit R8
et R9 forment avec l'atome d'azote auxquels ils sont liés
une amine cyclique pouvant éventuellement renfermer un ou
deux autres hétéroatomes choisis parmi 0, S, N ou
NR10 éventuellement substitué ;
R10 représente un atome d'hydrogène ou un radical
alkyle ;
tous les radicaux naphtyle, phényle et hétéroaryle ainsi
que l'amine cyclique que peuvent former R8 et R9 avec
l'atome d'azote auxquels ils sont liés étant eux-mêmes
éventuellement substitués par un ou plusieurs radicaux
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
identiques ou différents choisis parmi les atomes
d'halogène et les radicaux hydroxyle, alcoxy, alkyle,
hydroxyalkyle, alcoxyalkyle, CF3, NH2, NHalk ou N(alk)2
lesdits produits de formule (I) étant sous toutes les
5 formes isomères possibles racémiques, énantiomères et
diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques desdits produits de formule
(I) =
Dans les produits de formule (I) et dans ce qui suit, les
10 termes indiqués ont les significations qui suivent :
- le terme halogène désigne les atomes de fluor, de
chlore, de brome ou d'iode et de préférence de fluor,
chlore ou brome ;
- le terme radical alkyle désigne un radical linéaire
15 ou ramifié renfermant au plus 6 atomes de carbone et
notamment les radicaux méthyle, éthyle, propyle,
isopropyle, n-butyle, isobutyle, sec-butyle, tert-butyle,
pentyle, isopentyle, sec-pentyle, tert-pentyle, néo-
pentyle, hexyle, isohexyle, sec-hexyle, tert-hexyle ainsi
que leurs isomères de position linéaires ou ramifiés ;
- le terme radical hydroxyalkyle désigne les radicaux
alkyle indiqués ci-dessus substitués par un ou plusieurs
radicaux hydroxyle ;
- le terme radical alkényle désigne un radical linéaire
ou ramifié renfermant au plus 6 atomes de carbone et
préférentiellement 4 atomes de carbone choisi par exemple
parmi les valeurs suivantes: éthényle ou vinyle,
propényle ou allyle, 1-propényle, n-butényle, i-butényle,
3-méthylbut-2-ényle, n-pentényle, hexényle, ainsi que
leurs isomères de p'osition linéaires ou ramifiés : parmi
les valeurs alkényle, on cite plus particulièrement les
valeurs allyle ou butényle.
- le terme radical alkynyle désigne un radical linéaire
ou ramifié renfermant au plus 6 atomes de carbone et
préférentiellement 4 atomes de carbone choisi par exemple
parmi les valeurs suivantes: éthynyle, propynyle ou
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
16
propargyle, butynyle, n-butynyle, i-butynyle, 3-
méthylbut-2-ynyle, pentynyle ou hexynyle ainsi que leurs
isomères de position linéaires ou ramifiés : parmi les
valeurs alkynyle, on cite plus particulièrement la valeur
propargyle.
- le terme radical alkylène désigne un radical bivalent
linéaire ou ramifié renfermant au plus 6 atomes de
carbone, issu du radical alkyle ci-dessus et ainsi choisi
par exemple parmi les radicaux méthylène, éthylène,
propylène, isopropylène, butylène, isobutylène, sec-
butylène, pentylène ;
- le terme radical alcoxy désigne un radical linéaire ou
ramifié renfermant au plus 6 atomes de carbone choisi par
exemple parmi les radicaux méthoxy, éthoxy, propoxy,
isopropoxy, butoxy linéaire, secondaire ou tertiaire,
pentoxy, hexoxy et heptoxy ainsi que leurs isomères de
position linéaires ou ramifiés ;
-le terme radical cycloalkyle désigne un radical
carbocyclique monocyclique ou bicyclique renfermant de 3
à 7 chaînons et désigne notamment les radicaux
cyclopropyle, cyclobutyle, cyclopentyle, cyclohexyle et
cycloheptyle ;
- le terme radical aryle désigne les radicaux insaturés,
monocycliques ou constitués de cycles condensés,
carbocycliques. Comme exemples de tel radical aryle, on
peut citer notamment les radicaux phényle ou naphtyle ;
- le terme radical hétérocyclique désigne un radical
carbocylique saturé (hétérocycloalkyle) ou partiellement
ou totalement insaturé (hétéroaryle) constitué de 4 à 10
chaînons interrompus par un ou 3 hétéroatomes, identiques
ou différents, choisis parmi les atomes d'oxygène,
d'azote ou de soufre :
parmi les radicaux hétéroaryles à 5 chaînons, on peut
citer notamment les radicaux renfermant un à quatre
hétéroatomes choisi(s) parmi N éventuellement oxydé, 0 et
S éventuellement oxydé tels que les radicaux on peut
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
17
citer les radicaux thiophenyle tel que 2-thiophenyle, 3-
thiophenyle, dioxidothiényle, -thiazolyle (N,S), - furyle
(0) õ 2-furyle, pyrrolyle (NH, NCH3), isothiazolyle,
diazolyle, thiadiazolyle (N,N,S), 1,3,4-thiadiazolyle,
oxazolyle, oxadiazolyle, isoxazolyle (N,O), 3-
isoxazolyle, 4-isoxazolyle, imidazolyle, pyrazolyle
(N,N), groupes triazolyle, tétrazolyle et plus
particulièrement les radicaux oxazolyle, isoxazolyle
(N,O), ou pyrazolyle; tous ces cycles étant
éventuellement substitués par un ou plusieurs radicaux
comme défini ci-dessus ou ci-après, ces substituants se
situant bien sûr aux positions chimiquement acceptables
pour chacun de ces cycles.
parmi les radicaux hétéroaryles à 6 chaînons on peut
citer notamment les radicaux pyridyle tel que 2-pyridyle,
3-pyridyle et 4-pyridyle, pyridyle N oxyde, pyrimidinyle,
pyridazinyle et pyrazinyle ;
parmi les radicaux hétéroaryles condensés contenant au
moins un hétéroatome choisi parmi le soufre, l'azote et
l'oxygène, on peut citer par exemple les radicaux
benzothiophényle, benzofuryle, benzofurannyle,
benzoxazolyle, indazolyle, indolyle, indolinyle,
indolinonyle, quinolyle, isoquinolyle, azaindolyle,
benzimidazolyle, benzothiazolyle, naphtyridinyle tel que
[1,8]naphthyridinyle; imidazo(4,5)pyridinyle ;
indolizinyle ; quinazolinyle ; 2,3-Dihydro-lH-indolyle;
2,3-Dihydro-benzofuranyle ;4-[(Benzo[1,2,5]oxadiazolyle
(2,3-Dihydro-benzofuranyle ;
parmi les radicaux hétérocycles condensés, on peut citer
plus particulièrement les radicaux benzothiophényle,
benzofuranyle, benzodihydrofuranyle, indolyle,
indolinyle, indolinonyle, benzimidazolyle,
benzothiazolyle, benzoxodiazolyle , benzothiodiazolyle,
naphtyridinyle, indazolyle, quinolyle tel que 4-
quinolyl, 5-quinolyl, isoquinolyle, azaindolyle tel que
4-azaindolyl, 3 azaindolyl, imidazo(4,5)pyridyle,
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
18
indolizinyle, quinazolinyle.
Comme Hétérocycloalkyle (saturé), on peut citer par
exemple les radicaux oxiranyle, oxetanyle,
tétrahydrofuranyle, dioxolanyle, dithiolanyle,
tétrahydropyranyle, dioxanyle, aziridinyle, azétidinyle,
pyrrrolidinyle, pipéridinyle, azépinyle, diazépinyle,
pipérazinyle, morpholinyle, thiomorpholinyle,
dioxydomorpholinyle, imidazolidinyle; on peut citer plus
particulièrement les radicaux pyrrrolidinyle,
pipéridinyle, azépinyle, pipérazinyle ou morpholinyle ;
tous les radicaux cycliques étant éventuellement
substitués comme indiqué ci-dessus ou ci-après.
- les termes radical alkylamino ou NH(alk) et radical
dialkylamino ou N(alk)2 désigne ainsi des radicaux amino
NH2 substitués respectivement par un ou deux radicaux
alkyles, linéaires ou ramifiés, identiques ou différents
dans le cas de dialkylamino, choisis parmi les radicaux
alkyles tels que définis ci-dessus et éventuellement
substitué comme indiqué ci-dessus ou ci-après: on peut
citer par exemple les radicaux méthylamino, éthylamino,
propylamino ou butylamino, les radicaux diméthylamino,
diéthylamino, méthyléthylamino.
- le terme radical cycloalkylamino désigne ainsi un
radical amino substitué notamment par un radical
cycloalkyle choisi parmi les radicaux définis ci-dessus:
on peut citer ainsi par exemple les radicaux
cyclopropylamino, cyclobutylamino, cyclopentylamino ou
encore cyclohexylamino.
- le terme amine cyclique désigne un radical monocyclique
ou bicyclique renfermant de 3 à 10 chaînons dans lequel
au moins un atome de carbone est remplacé par un atome
d'azote, ce radical cyclique pouvant renfermer également
un ou plusieurs autres hétéroatomes choisi(s) parmi 0, S,
S02, N ou NR10 avec R10 tel que défini ci-dessus : comme
exemples de telles amines cycliques, on peut citer par
exemple les radicaux pyrrolyle, pipéridyle, morpholinyle,
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
19
pipérazinyle, pyrrolidinyle, azétidinyle. On peut citer
plus particulièrement les radicaux pipéridinyle,
morpholinyle, pipérazinyle ou azétidinyle.
Le terme patient désigne les êtres humains mais aussi les
autres mammifères.
Le terme "Prodrug" désigne un produit qui peut être
transformé in vivo par des mécanismes métaboliques (tel
que l'hydrolyse) en un produit de formule (I). Par
exemple, un ester d'un produit de formule (I) contenant
un groupe hydroxyle peut être converti par hydrolyse in
vivo en sa molécule mère.
On peut citer à titre d'exemples des esters de produits
de formule (I) contenant un groupe hydroxyle tels que les
acétates, citrates, lactates, tartrates, malonates,
oxalates, salicylates, propionates, succinates,
fumarates, maléates, méthylene-bis-b-hydroxynaphthoates,
gentisates, iséthionates, di-p-toluoyltartrates,
méthanesulfonates, éthanesulfonates, benzenesulfonates,
p-toluènesulfonates, cyclohexylsulfamates et quinates.
Des esters de produits de formule (I) particulièrement
utiles contenant un groupe hydroxyle peuvent être
préparés à partir de restes acides tels que ceux décrits
par Bundgaard et. al., J. Med. Chem., 1989, 32, page
2503-2507: ces esters incluent notamment des
(aminométhyl)-benzoates substitués, dialkylamino-
méthylbenzoates dans lesquels les deux groupements alkyle
peuvent être liés ensemble ou peuvent être interrompus
par un atome d'oxygène ou par un atome d'azote
éventuellement substitué soit un atome d'azote alkylé ou
encore des morpholino-méthyl)benzoates, e.g. 3- ou 4-
(morpholinométhyl)-benzoates, et (4-alkylpiperazin-1-
yl)benzoates, e.g. 3- ou 4-(4-alkylpiperazin-1-
yl)benzoates.
Lorsque les produits de formule (I) comportent un radical
amino salifiable par un acide il est bien entendu que ces
sels d'acides font également partie de l'invention. On
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
peut citer par exemple les sels fournis avec les acides
chlorhydrique ou méthanesulfonique.
Les sels d'addition avec les acides minéraux ou organi-
ques des produits de formule (I) peuvent être, par
5 exemple, les sels formés avec les acides chlorhydrique,
bromhydrique, iodhydrique, nitrique, sulfurique,
phosphorique, propionique, acétique, trifluoroacétique,
formique, benzoïque, maléique, fumarique, succinique,
tartrique, citrique, oxalique, glyoxylique, aspartique,
10 ascorbique, les acides alcoylmonosulfoniques tels que par
exemple l'acide méthanesulfonique, l'acide
éthanesulfonique, l'acide propanesulfonique, les acides
alcoyldisulfoniques tels que par exemple l'acide
méthanedisulfonique, l'acide alpha, bêta-
15 éthanedisulfonique, les acides arylmonosulfoniques tels
que l'acide benzènesulfonique et les acides
aryldisulfoniques.
On peut rappeler que la stéréoisomérie peut être définie
dans son sens large comme l'isomérie de composés ayant
20 mêmes formules développées, mais dont les différents
groupes sont disposés différemment dans l'espace, tels
que notamment dans des cyclohexanes monosubstitués dont
le substituant peut être en position axiale ou
équatoriale. Cependant, il existe un autre type de
stéréoisomérie, dû aux arrangements spatiaux différents
de substituants fixés, soit sur des doubles liaisons,
soit sur des cycles, que l'on appelle souvent isomérie
géométrique E/Z ou isomérie cis-trans ou
diastéréoisomère. Le terme stéréoisomère est utilisé dans
la présente demande dans son sens le plus large et
concerne donc l'ensemble des composés indiqués ci-dessus.
La présente invention a notamment pour objet les produits
de formule (I) tels que définis ci-dessus dans laquelle
R2, R3 et R4, identiques ou différents, sont tels que
l'un représente un atome de fluor ou de chlore ou CF3 et
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
21
les deux autres, identiques ou différents, représentent
un atome d'hydrogène, un atome de fluor ou de chlore ou
un radical méthyle ou méthoxy éventuellement substitués
par un ou plusieurs atomes de fluor;
R5 représente un atome d'hydrogène ou un atome de fluor
ou de chlore;
R1 représente un atome d'hydrogène, un radical
cycloalkyle ou un radical alkyle éventuellement substitué
par un ou plusieurs radicaux, identiques ou différents,
choisis parmi l'atome de fluor, 0R8 et NR8R9;
A représente une simple liaison ou un radical -CH2-CO-
NR6-, et R6 représentant un atome d'hydrogène ou un
radical alkyle linéaire ou ramifié renfermant au plus 4
atomes de carbone ;
le cycle renfermant Y (ou cycle(Y)) étant monocyclique ou
bicyclique, constitué de 4 à 10 chaînons, et étant saturé
ou partiellement saturé avec Y représentant un atome
d'oxygène 0, un atome de soufre S éventuellement oxydé
par ou deux atomes d'oxygène ou un radical choisi parmi
N-R7, C=O, CF2, CH-0R8 ou CH-NR8R9 ;
R7 représente un atome d'hydrogène ou un radical alkyle
éventuellement substitué par un ou plusieurs radicaux
identiques ou différents choisis parmi les atomes
d'halogène et les radicaux phényle et hétéroaryle, les
radicaux phényle et hétéroaryle étant eux-mêmes
éventuellement substitués par un ou plusieurs radicaux
identiques ou différents choisis parmi les atomes
d'halogène et les radicaux hydroxyle, alcoxy, alkyle,
hydroxyalkyle, alcoxyalkyle, CF3, NH2, NHalk ou N(alk)2
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
22
les radicaux hétéroaryle étant constitués de 5 à 7
chaînons et renfermant un 1 à 3 hétéroatomes choisi(s)
parmi O, S, N et NR10 ;
R8 représente l'atome d'hydrogène, les radicaux alkyle
linéaires ou ramifiés renfermant au plus 4 atomes de
carbone ou les radicaux cycloalkyle renfermant de 3 à 6
chaînons, alkyle et cycloalkyle eux-mêmes éventuellement
substitués par un radical hydroxyle ;
NR8R9 est tel que soit R8 et R9, identiques ou
différents, sont choisis parmi les valeurs de R8 soit R8
et R9 forment avec l'atome d'azote auxquels ils sont liés
une amine cyclique choisie parmi les radicaux radicaux
pyrrolyle, pipéridyle, morpholinyle, pyrrolidinyle,
azétidinyle et pipérazinyle éventuellement substitué sur
son deuxième atome par un radical alkyle ;
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques desdits produits de formule
(1).
Notamment le cycle renfermant Y peut être constitué de 4
à 7 chaînons, et saturé avec Y représentant un atome
d'oxygène 0, un atome de soufre S éventuellement oxydé
par ou deux atomes d'oxygène ou un radical choisi parmi
N-R7 , CH-NH2, CH-NHalk ou CH-N(alk)2, avec R7 tel que
défini ci-dessus ou ci-après.
La présente invention a notamment pour objet les produits
de formule (I) tels que définis ci-dessus dans laquelle:
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
23
R2, R3 et R4, identiques ou différents, sont tels que
l'un représente un atome de fluor ou CF3 et les deux
autres représentent l'un, un atome d'hydrogène et
l'autre, un atome de fluor ou de chlore ou un radical
méthyle;
R5 représente un atome d'hydrogène ou un atome de
chlore ;
R1 représente un atome d'hydrogène ou un radical
cyclopropyle, méthyle, éthyle, propyle ou butyle
éventuellement substitués par-un ou plusieurs radicaux
identiques ou différents choisis parmi l'atome de fluor
et les radicaux hydroxyle, amino, alkylamino,
dialkylamino, pipéridinyle, morpholinyle, azétidinyle,
pipérazinyle, pyrrolidinyle et pyrrolyle;
A représente une simple liaison, -CH2-CO-NH- ou -CH2-CO-
NCH3- et le cycle renfermant Y est choisi parmi les
radicaux cyclohexyle lui-même éventuellement substitué
par amino; tétrahydropyranne; dioxidothiophényle; et les
radicaux pyrrolidinyle, pipéridinyle, azépinyle,
indolizinyle et quinazolinyle éventuellement substitués
par un ou plusieurs radicaux identiques ou différents
choisis parmi les radicaux méthyle, propyle, butyle,
isopropyle, isobutyle, isopentyle ou éthyle, eux-mêmes
éventuellement substitués par un ou plusieurs radicaux
choisis parmi les atomes d'halogène et les radicaux
hydroxyle, phényle lui-même éventuellement substitué par
un ou plusieurs atomes d'halogène, quinolyle, pyridyle
éventuellement oxydé sur son atome d'azote, thiophényle,
thiazolyle, thiadiazolyle, tétrazolyle, pyrazinyle,
furyle et imidazolyle lui-même éventuellement substitué
par alkyle;
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
24
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques desdits produits de formule
(1).
La présente invention a notamment pour objet les produits
de formule (I) telle que définie ci-dessus dans laquelle
R2, R3 et R4, identiques ou différents, sont tels que
l'un représente un atome de fluor ou CF3 et les deux
autres représentent l'un, un atome d'hydrogène et
l'autre, un atome de fluor ou de chlore ou un radical
méthyle;
R5 représente un atome d'hydrogène ;
R1 représente un radical méthyle; ou un radical éthyle,
éventuellement substitués par un radical amino,
alkylamino, dialkylamino ou pyrrolidinyle;
A représente une simple liaison et le cycle renfermant Y
représente un radical cyclohexyle lui-même éventuellement
substitué par amino ou un radical pipéridinyle ou
pyrrolidinyle éventuellement substitué sur son atome
d'azote par un radical méthyle, propyle, butyle,
isopropyle, isobutyle, isopentyle ou éthyle, eux-mêmes
éventuellement substitués par un ou plusieurs atomes
d'halogène ou un radical choisi parmi hydroxyle ;
thiadiazolyle ; tétrazolyle; phényle lui-même
éventuellement substitué par halogène ; quinolyle ;
pyridyle éventuellement oxydé sur son atome d'azote ;
furyle ; et imidazolyle lui-même éventuellement substitué
par alkyle;
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques desdits produits de formule
5 (1).
On cite particulièrement les produits de formule (I) dans
lesquels A représente une simple liaison, les autres
substituants R1,R2,R3,R4,R5 et cycle(Y) desdits produits
de formule (I) étant choisis parmi les valeurs indiquées
10 ci-dessus.
On cite ainsi particulièrement les produits de formule
(I) dans lesquels R5 représente un atome d'hydrogène, les
autres substituants R1,R2,R3,R4,A et cycle(Y) desdits
produits de formule (I) étant choisis parmi les valeurs
15 indiquées ci-dessus.
On préfère les produits de formule (I) tels que définis
ci-dessus dans lesquels, lorsque NR8R9 ne forme pas une
amine cyclique, alors NR8R9 est tel que R8 représente un
atome d'hydrogène ou un radical alkyle et R9 est choisi
20 parmi l'ensemble des valeurs définies pour R8.
Lorsque l'un de R2,R3,R4 représente alcoxy, on préfère
méthoxy.
Produits de formule (I) telle que définie ci-dessus dans
laquelle :
25 R2, R3 et R4, identiques ou différents, sont tels que
l'un représente un atome de fluor ou CF3 et les deux
autres représentent l'un, un atome d'hydrogène et
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
26
l'autre, un atome de fluor ou de chlore ou un radical
méthyle;
R5 représente un atome d'hydrogène;
R1 représente un atome d'hydrogène ou un radical méthyle;
A représente une simple liaison et le cycle renfermant Y
est choisi parmi les radicaux tétrahydropyranne,
dioxidothiophènyle et les radicaux pyrrolidinyle,
pipéridinyle et azépinyle éventuellement substitués sur
leur atome d'azote (en 2 ou 3 du cycle) par un radical
méthyle ou éthyle, propyle ou butyle eux-mêmes
éventuellement substitués par un ou plusieurs atomes
d'halogène ou un radical phényle, pyridyle, thiophényle,
ou thiazolyle, thiadiazolyle, pyrazinyle, furyle ou
imidazolyle ;
Lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques desdits produits de formule
(I).
La présente invention a particulièrement pour objet les
produits de formule (I) répondant aux noms suivants
- 4-[4-(4-Fluoro-3-methyl-phenylamino)-pyrimidin-2-
ylamino]-N-methyl-N-(1-methyl-piperidin-4-yl)-benzamide
- 4-[4-(4-Fluoro-3-methyl-phenylamino)-pyrimidin-2-
ylamino]-N-methyl-N-[1-(4,4,4-trifluoro-butyl)-piperidin-
3-yl]-benzamide
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
27
- 4-[4-(4-Fluoro-3-methyl-phenylamino)-pyrimidin-2-
ylamino]-N-methyl-N-(1[1,2,3]thiadiazol-4-ylmethyl-
piperidin-3-yl)-benzamide
- N-Methyl-N-(1-methyl-piperidin-4-yl)-4-[4-(4-
trifluoromethyl-phenylamino)-pyrimidin-2-ylamino]-
benzamide
- N-Methyl-N-(tetrahydro-pyran-4yl)-4-[4-(4-
trifluoromethyl-phenylamino)-pyrimidin-2-ylamino]-
benzamide
- N-(1-Methyl-piperidin-4-yl)-N-(2pyrrolidin-1-yl-
ethyl)-4-[4-(4-trifluoromethyl-phenylamino)-pyrimidin-2-
ylamino]-benzamide,
- 4-({4-[(4-Fluorophenyl)amino]pyrimidin-2-yl}amino)-N-
(octahydroindolinizin-7-yl)benzamide
lesdits produits de formule (I) étant sous toutes les
formes isomères possibles racémiques, énantiomères et
diastéréoisomères, ainsi que les sels d'addition avec les
acides minéraux et organiques desdits produits de formule
(I).
La présente invention a également pour objet les procédés
de préparation des produits de formule (I) tels que
définis ci-dessus.
La présente invention a notamment pour objet le procédé
de préparation des produits de formule (I) tels que
définis ci-dessus caractérisé en ce que l'on fait réagir
un produit de formule (II):
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
28
CI
~ (~~)
R5' N cl
dans laquelle R5' a la signification indiquée ci-dessus
pour R5 dans lesquelles les éventuelles fonctions
réactives sont éventuellement protégées,
que l'on fait réagir avec un produit de formule (III)
R'
R
~'
(III)
R41
dans laquelle R2', R3' et R4' ont les significations
indiquées ci-dessus respectivement pour R2, R3 et R4 dans
lesquelles les éventuelles fonctions réactives sont
éventuellement protégées,
pour obtenir un produit de formule (IV),
R3' C
R
4' NH
~ '2'~ (IV)
R5' N CI
dans laquelle R2', R3', R4' et R5' ont les significations
indiquées ci-dessus,
produit de formule (IV) tel que défini ci-dessus que l'on
fait réagir avec l'ester méthylique de l'acide 4-amino
benzoïque de formule (V) pour obtenir le produit de
formule (VI):
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
29
R31 R21
R4'
NH ~OMe
N
N~N rCO
(V~)
~
H
dans laquelle R2', R3', R4' et R5' ont les significations
indiquées ci-dessus, produit de formule (VI) que l'on
5 saponifie en son acide correspondant de formule (VII):
R31 R21
R'
q
NH ~OH
CO
~
R51 N~ H (VII)
(XI I)
dans laquelle R2', R3', R4' et R5' ont les significations
indiquées ci-dessus,
produit de formule (VII) que l'on fait réagir avec une
amine de formule (VIII):
(VIII)
R,' H
N
dans laquelle R1' a la signification indiquée ci-dessus
pour R1, dans laquelle les éventuelles fonctions réacti-
ves sont éventuellement protégées par des groupements
protecteurs,
pour obtenir un produit de formule (I1):
Rs1 RZ
R~
4
'
NH
N ~ CO A
~ ~ /
RF N N (I.)
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
dans laquelle R1', R2', R3', R4' et R5' ont les
significations indiquées ci-dessus,
produits de formule (Il) qui peuvent être des produits de
formule (I) et que, pour obtenir des ou d'autres produits
5 de formule (I), l'on peut soumettre, si désiré et si
nécessaire, à l'une ou plusieurs des réactions de
transformations suivantes, dans un ordre quelconque
a) une réaction d'oxydation de groupement alkylthio en
sulfoxyde ou sulfone correspondant,
10 b) une réaction de transformation de fonction alcoxy en
fonction hydroxyle, ou encore de fonction hydroxyle en
fonction alcoxy,
c) une réaction d'oxydation de fonction alcool en
fonction aldéhyde ou cétone,
15 d) une réaction d'élimination des groupements protecteurs
que peuvent porter les fonctions réactives protégées,
e) une réaction de salification par un acide minéral ou
organique pour obtenir le sel correspondant,
f) une réaction de dédoublement des formes racémiques en
20 produits dédoublés,
lesdits produits de formule (I) ainsi obtenus étant sous
toutes les formes isomères possibles racémiques,
énantiomères et diastéréoisomères.
La présente invention a également pour objet un procédé
25 de préparation des produits de formule (I) telle que
définie ci-dessus dans lesquels Y représente le radical
NR7 tel que défini ci-dessus avec R7 représente CH2-RZ et
RZ représente un radical alkyle, alkényle ou alkynyle,
tous éventuellement substitués comme indiqué ci-dessus et
30 notamment par un radical naphtyle ou par un ou plusieurs
radicaux identiques ou différents choisis parmi les
atomes d'halogène et les radicaux phényle et hétéroaryle,
tous ces radicaux naphtyle, phényle et hétéroaryle étant
eux-mêmes éventuellement substitués par un ou plusieurs
radicaux identiques ou différents choisis parmi les
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
31
atomes d'halogène et les radicaux hydroxyle, alcoxy,
alkyle, hydroxyalkyle, alcoxyalkyle, CF3, NH2, NHalk ou
N (alk) 2.
Un tel procédé est caractérisé en ce que l'on soumet le
composé de formule (A):
Rs1 R2
1
R4 NH R~
1
N CO N YO~
R N~N~ \ /
0
5 (A)
H
dans laquelle Rl', R2', R3', R4', R5' et cycle(N) ont les
significations indiquées ci-dessus,
à une réaction de déprotection de la fonction carbamate
pour obtenir un produit de formule (IX):
R3 '
4 1'2
RI1
NH R '
H
CO
N I \
R N~N ~ (lX)
H
dans laquelle Rl', R2', R3', R4', R5' et cycle(N) ont les
significations indiquées ci-dessus,
produit de formule (IX) que l'on soumet à des conditions
d'amination réductrice
en présence de l'aldéhyde ou cétone de formule (X)
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
32
RZ' -CR8' 0 (X)
dans laquelle RZ' a la signification indiquée ci-dessus
et représente un radical alkyle, alkényle ou alkynyle
éventuellement substitués comme indiqué à l'une
quelconque des revendications précédentes et dans
laquelle les éventuelles fonctions réactives sont éven-
tuellement protégées par des groupements protecteurs,
et R8' a la significations indiquées ci-dessus pour R8,
dans laquelle les éventuelles fonctions réactives sont
éventuellement protégées par des groupements protecteurs,
pour obtenir un produit de formule (12) R3' R2'
R~
4
'
NH I1
CO N -CHR$'-R'
I \
N
R N~N ~ (12)
5 H
dans laquelle R1', R2', R3', R4', R5', cycle(N), RZ' et
R8' ont les significations indiquées ci-dessus,
produits de formule (12) qui peuvent être des produits de
formule (I) et que, pour obtenir des ou d'autres produits
de formule (I), l'on peut soumettre, si désiré et si
nécessaire, dans un ordre quelconque, à l'une ou plu-
sieurs des réactions de transformations a) à f) telles
que définies ci-dessus,
lesdits produits de formule (12) ainsi obtenus étant sous
toutes les formes isomères possibles racémiques,
énantiomères et diastéréoisomères.
Dans des conditions préférentielles de mise en oeuvre de
l'invention, les procédés décrits ci-dessus peuvent être
réalisés de la façon suivante :
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
33
Le produit de formule (II) est soumis à l'action du
produit de formule (III) telle que définie ci-dessus
notamment dans un alcool tel que par exemple le butanol,
le propanol, l'éthanol ou la diméthylformamide entre 80
et 140 C., pour donner un produit de formule (IV) telle
que définie ci-dessus.
Le produit de formule (IV) tel que défini ci-dessus est
soumis à l'action de l'ester méthylique de l'acide 4-
amino benzoïque de formule (V) notamment dans un alcool
tel que le butanol à une température de 100 à 140 C, pour
donner le produit de formule (VI) tel que défini ci-
dessus.
On saponifie ce produit de formule (VI) en son acide
correspondant de formule (VII) en procédant selon les
méthodes usuelles connues de l'homme du métier telles que
notamment par action de la soude ou de la potasse dans
l'eau.
On fait réagir le produit de formule (VII) ainsi obtenu
avec l'amine de formule (VIII) définie ci-dessus selon
les méthodes de couplage connues de l'homme du métier
telles que par exemple par un couplage amidique en
présence d'agent de couplage tel que la BOP, DCC ou TBTU
dans un solvant tel que par exemple la diméthylformamide
ou le dichlorométhane pour donner un produit de formule
(Il) telle que définie ci-dessus.
La réaction de déprotection de la fonction carbamate du
composé de formule (A) pour obtenir un produit de formule
(IX) peut être réalisée en utilisant par exemple un agent
acide tel que l'acide trifluoroacétique pur à une
température proche de 0 C ou à un mélange de cet acide
avec un solvant adéquat comme le chlorure de méthylène à
environ 0 C ou encore en = utilisant de l'acide
chlorhydrique en solution dans l'éther ou le dioxanne à
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
34
une température comprise entre 0 C et la température
ambiante.
Le produit de formule (IX) est soumis à des conditions
d'amination réductrice en présence de l'aldéhyde ou de la
cétone de formule (X) pour donner un produit de formule
(12) tel que défini ci-dessus par exemple avec du
borocyanure de sodium ou du triacétoxyborohydrure de
sodium dans un solvant tel que le méthanol, le
tétrahydrofuranne (THF) ou leur mélange en milieu de pH
entre 4 et 7.
Selon les valeurs de R1', R2, R3, R4 et R5, et RZ', les
produits de formules (Il) et (12) telles que définies ci-
dessus peuvent donc constituer des produits de formule
(I) telle que définie ci-dessus ou peuvent être
transformées en produits de formule (I) par les méthodes
usuelles connues de l'homme du métier et par exemple en
étant soumis à une ou plusieurs des réactions a) à f)
indiquées ci-dessus.
Par ailleurs, on peut noter que de telles réactions de
transformation a) à f) de substituants en d'autres
substituants peuvent également être effectuées sur les
produits de départ ainsi que sur les intermédiaires tels
que définis ci-dessus avant de poursuivre la synthèse
selon les réactions indiquées dans les procédés ci-
dessus.
Les diverses fonctions réactives que peuvent porter
certains composés des réactions définies ci-dessus
peuvent, si nécessaire, être protégées : il s'agit par
exemple des radicaux hydroxyle, acyle ou encore amino et
monoalkylamino qui peuvent être protégés par les
groupements protecteurs appropriés.
La liste suivante, non exhaustive, d'exemples de protec-
tion de fonctions réactives peut être citée :
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
- les groupements hydroxyle peuvent être protégés par
exemple par les radicaux alkyle tels que tert-butyle,
triméthylsilyle, tert-butyldiméthylsilyle,
méthoxyméthyle, tétrahydropyrannyle, benzyle ou acétyle,
5 - les groupements amino peuvent être protégés par exemple
par les radicaux acétyle, trityle, benzyle, tert-
butoxycarbonyle, benzyloxycarbonyle, phtalimido ou
d'autres radicaux connus dans la chimie des peptides et
peuvent alors être libérées dans les conditions usuelles
10 connues de l'homme du métier.
Les réactions auxquelles les produits de formule (I')
telle que définie ci-dessus peuvent être soumis, si
désiré ou si nécessaire, peuvent être réalisées, par
exemple, comme indiqué ci-après.
15 Les réactions de saponification peuvent être réalisées
selon les méthodes usuelles connues de l'homme du métier,
telles que par exemple dans un solvant tel que le
méthanol ou l'éthanol, le dioxane ou le diméthoxyéthane,
en présence de soude ou de potasse.
20 Les réactions de réduction ou oxydation peuvent être
réalisées selon les méthodes usuelles connues de l'homme
du métier telles que par exemple dans un solvant tel que
l'éther éthylique ou le tétrahydrofurane, en présence de
borohydrure de sodium ou d'hydrure de lithium aluminium;
25 ou par exemple dans un solvant tel que l'acétone ou le
tetrahydrofurane en présence de permanganate de potassium
ou de chlorochromate de pyridinium.
a) Les éventuels groupements alkylthio des produits
décrits ci-dessus peuvent être, si désiré, transformés en
30 les fonctions sulfoxyde ou sulfone correspondantes dans
les conditions usuelles connues de l'homme du métier
telles que par exemple par les peracides comme par
exemple l'acide peracétique ou l'acide
métachloroperbenzoïque ou encore par l'oxone, le
35 périodate de sodium dans un solvant tel que par exemple
le chlorure de méthylène ou le dioxanne à la température
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
36
ambiante.
L'obtention de la fonction sulfoxyde peut être favorisée
par un mélange équimolaire du produit renfermant un
groupement alkylthio et du réactif tel que notamment un
peracide.
L'obtention de la fonction sulfone peut être favorisée
par un mélange du produit renfermant un groupement
alkylthio avec un excès du réactif tel que notamment un
peracide.
b) Les éventuelles fonctions alcoxy telles que notamment
méthoxy des produits décrits ci-dessus peuvent être, si
désiré, transformées en fonction hydroxyle dans les
conditions usuelles connues de l'homme du métier par
exemple par du tribromure de bore dans un solvant tel que
par exemple le chlorure de méthylène, par du bromhydrate
ou chlorhydrate de pyridine ou encore par de l'acide
bromhydrique ou chlorhydrique dans de l'eau ou de l'acide
trifluoro acétique au reflux.
c) Les éventuelles fonctions alcool des produits décrits
ci-dessus peuvent être, si désiré, transformées en
fonction aldéhyde ou cétone par oxydation dans les
conditions usuelles connues de l'homme du métier telles
que par exemple par action de l'oxyde de manganèse pour
obtenir les aldéhydes ou par action du permanganate
depotassium ou de chlorochromate de pyridinium pour
accéder aux cétones pour accéder aux cétones.
d) L'élimination de groupements protecteurs tels que par
exemple ceux indiqués ci-dessus peut être effectuée dans
les conditions usuelles connues de l'homme de métier
notamment par une hydrolyse acide effectuée avec un acide
tel que l'acide chlorhydrique, benzène sulfonique ou
para-toluène sulfonique, formique ou trifluoroacétique ou
encore par une hydrogénation catalytique.
Le groupement phtalimido peut notamment être éliminé par
l'hydrazine.
On trouvera une liste de différents groupements protec-
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
37
teurs utilisables par exemple dans le brevet BF 2 499
995.
e) Les produits décrits ci-dessus peuvent, si désiré,
faire l'objet de réactions de salification par exemple
par un acide minéral ou organique selon les méthodes
usuelles connues de l'homme du métier.
f) Les éventuelles formes optiquement actives des
produits décrits ci-dessus peuvent être préparées par
dédoublement des racémiques selon les méthodes usuelles
connues de l'homme du métier.
Des illustrations de telles réactions définies ci-dessus
sont données dans la préparation des exemples décrits ci-
après.
Les produits de départ de formules (II), (III) et (VIII)
peuvent être connus, peuvent être obtenus commercialement
ou être préparés selon les méthodes usuelles connues de
l'homme du métier, notamment à partir de produits de
commerciaux par exemple en les soumettant à une ou
plusieurs réactions connues de l'homme du métier telles
que par exemple des réactions décrites ci-dessus en a) à
f).
Les produits de formule (II) qui sont donc des dérivés de
la pyrimidine et les produits de formules (III) qui sont
des dérivés de l'aniline peuvent être des produits
commercialisés comme par exemple la dichloropyrimidine,
la trichloropyrimidine, la 4-fluoroaniline, la 3,4-
difluoroaniline, la 4-fluoro3-chloroaniline, ou
l'aniline.
Les anilines de formule (III) peuvent notamment être des
anilines commerciales telles que par exemple les anilines
trihalogénées suivantes
-3,4,5-trifluoroaniline
-2,3,4 -trifluoroaniline
-2-chloro- 4,6-difluoroaniline
-2,4,5-,trifluoroaniline
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
38
-3-chloro-2,4-difluoroaniline
-2,4-dichloro-5-fluoroaniline
-4-trifluorométhylaniline.
Les amines de formule (VIII) peuvent également être
commerciales comme par exemple la Methyl-(1-methyl-
piperidin-4-yl)-amine.
Les préparations des amines de formule (VIII) non
commerciales peuvent être réalisées selon des méthodes
connues de l'homme du métier.
On peut indiquer que pour obtenir des produits de formule
(I) tels que définis ci-dessus dans lesquels Rl, R2, R3,
R4, R5 et A ont les significations indiquées ci-dessus,
et cycle(Y) est tel que Y représente NR7 et renferme un
pont carboné constitué de 1 à 3 carbones, on peut
utiliser comme produits de départ des amines bicycliques
pouvant être obtenus à partir de composés commerciaux
tels que la tropinone, la pseudo-pelletrivine selon les
références ci-dessous:
Tetrahedron 2002, 58, 5669-5674
J.Org.Chem. 1996, 61, 3849-3862
J.Med.Chem. 1993, 36, 3703-3720
J.Chem.Soc. Perkin Transl 1991, 1375-1381
J.Med.Chem. 1994, 37, 2831-2840
A titre d'exemples, on peut citer les composés suivants
N,9-diméthyl-9-azabicyclo[3.3.1]nona-3-amine
\
N N\
N,6-diméthyl-6-azabicyclo[3.2.1]octan-3-amine
/N N \
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
39
N,3-diméthyl-3-azabicyclo[3.2.1]octan-8-amine
N
YN-__
N,3-diméthyl-3-azabicyclo[3.3.1]nonan-9-amine
N
N___
Des exemples d'aldéhydes ou de cétones de formule (X),
sont donnés dans la partie expérimentale à titre
d'exemples non limitatifs.
La présente invention concerne également le procédé selon
le schéma 1 ci-dessous, de préparation de produits de
formule (I) tels que définis ci-dessus:
F\ F
N N`^N~ 0 N
I / I CO T ~ E ~~RB - j
N
`-, c I
CO N ~ RA
N lv ~` H ~ N N R8 N N RS
Schéma 1
Dans un tel schéma 1, le radical NR8 -CH (RA) (RB)
représente certaines valeurs de NR8R9 tel que défini ci-
dessus avec R8 tel que défini ci-dessus et R9 représente
-CH(RA) (RB) càd, comme défini pour R9, un radical alkyle
linéaire ou ramifié éventuellement substitué par un ou
plusieurs radicaux choisis parmi les atomes d'halogène et
les radicaux hydroxyle, alcoxy, NH2, NHalkyle,
N(alkyle)2, alkylthio, phényle et hétérocycles saturés ou
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
insaturés, phényle et hétérocycle eux-mêmes
éventuellement substitués comme indiqué ci-dessus.
Notamment RA peut représenter un atome d'hydrogène ou
CH3, et RB peut représenter (CH2)n-A avec A représente un
5 radical hétérocycle ou phényle éventuellement substitués
comme défini ci-dessus et n représente un entier de 0 à
5.
Les étapes du procédé de synthèse du schéma 1 ci-dessus
peuvent être réalisées selon les méthodes usuelles
10 connues de l'homme du métier.
La présente invention concerne également le procédé selon
le schéma 2 ci-dessous, de préparation de produits de
formule (I) tels que définis ci-dessus:
o CoCH31 O1
CO2CH3
2 o N ~ J_ N
4
R2
R3 I1 I
~
R~
6 E ~
A COOH
R4 N I I C1 N~
/Ii ~~NI o-A~ co
`J~N \ N N
Schéma 2
Dans un tel schéma 2, R1, R2, R3, R4, A et cycle(Y) ont
les significations indiquées ci-dessus pour les produits
de formule (I).
Les étapes du procédé de synthèse du schéma 2 ci-dessus
peuvent être réalisées en utilisant l'ester méthylique de
l'aniline à l'étape 2 et l'aniline substitué par R2',R3'
ou R4' à l'étape 6 et en procédant selon les méthodes
usuelles connues de l'homme du métier ou comme décrit
dans la présente invention.
La partie expérimentale ci-après donne des exemples non
limitatifs de préparation de produits de formule (I)
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
41
selon la présente invention et également des exemples de
produits de départ non limitatifs utilisés dans ces
préparations.
La présente invention a enfin pour objet à titre de
produits industriels nouveaux, certains composés de
formules (A), (IX), (VI) et (VII).
Les produits de formule (I) tels que définis ci-dessus
ainsi que leurs sels d'addition avec les acides
présentent d'intéressantes propriétés pharmacologiques.
Les composés de la présente invention peuvent donc
inhiber l'activité des kinases, en particulier IKK1 et
IKK2 avec une IC50 inférieure à 10 pM.
Les composés de la présente invention peuvent ainsi
inhiber l'activation de NF-KB, et la production de
cytokines avec des IC50 inférieures à 10 pM.
Les composés de la présente invention peuvent ainsi
inhiber la prolifération d'un large panel de cellules
tumorales avec des IC50 inférieures à 10 pM.
Les composés de la formule (I) peuvent donc avoir une
activité de médicament en particulier comme inhibiteurs
de IKK1 et IKK2 et peuvent être utilisés dans la
prévention ou le traitement de maladies dans lesquelles
l'inhibition de IKK1 ou IKK2 est bénéfique. Par exemple
la prévention ou le traitement de maladies telles que les
maladies inflammatoires ou maladies avec une composante
inflammatoire comme par exemple l'arthrite inflammatoire
y compris l'arthrite rhumatoïde, l'ostéoarthrite
spondylique, le syndrome de Reiters, l'arthritis
psoriatique, les maladies de résorption osseuse; la
scléroses en plaques, les maladies inflammatoires de
l'intestin incluant la maladie de Crohn's; l'asthme,
l'obstruction pulmonaire chronique, l'emphysème, les
rhinites, la myasthénie acquise, la maladie de Graves, le
rejet de greffe, le psoriasis, les dermatites, les
troubles allergiques, les maladies du système
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
42
immunitaire, la cachexie, le syndrome respiratoire aigüe
sévère, le choc septique, l'insuffisance cardiaque,
l'infarctus du myocarde, l'athérosclérose, les lésions de
reperfusion, le SIDA, les cancers et les troubles
caractérisés par une résistance à l'insuline tels que les
diabètes, l'hyperglycémie, l'hyperinsulinémie, la
dyslipidémie, l'obésité, les maladies ovariennes
polycystiques, l'hypertension, les troubles
cardiovasculaires, le Syndrome X, les maladies
autoimmunes telles que notamment le lupus systémique, le
lupus érythémateux, les glomérulonéphrites induites par
des déficiences du système immunitaire, les diabètes
autoimmunes insulino-dépendants, les rétinites
pigmentaires, les rhinosinusites sensibles à l'aspirine.
Les produits de formule (I) selon la présente invention
comme modulateurs de l'apoptose, peuvent être utiles dans
le traitement de différentes maladies humaines incluant
des aberrations dans l'apoptose telles que des cancers:
telles que notamment mais à titre non limitatif, les
lymphomes folliculaires, les carcinomes avec des
mutations p53, des tumeurs hormone-dépendantes du sein,
de la prostate et de l'ovaire, et des lésions pré-
cancéreuses comme l'adénome familial polyposis, des
infections virales (telles que notamment mais à titre non
limitatif celles causées par le virus Herpès, le
poxvirus, le virus d'Epstein-Barr, virus de Sindbis et
l'adénovirus), les syndromes myélodysplastiques, les
désordres ischémiques associés à l'infarctus du myocarde,
la congestion cérébrale, l'arythmie, l'athérosclérose,
les troubles hépatiques induits par des toxines ou
l'alcool, les désordres hématologiques telles que
notamment mais à titre non limitatif, l'anémie chronique
et l'anémie aplasique, les maladies dégénératives du
système musculosquelettal telles que notamment mais à
titre non limitatif, l'ostéoporose, les fibroses
cystiques, les maladies des reins et les cancers.
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
43
Il apparaît donc que les composés selon l'invention ont
une activité anticancéreuse et une activité dans le
traitement des autres maladies prolifératives telles que
le psoriasis, la resténose, l'arthérosclérose, le SIDA
par exemple, ainsi que dans les maladies provoquées par
la prolifération des cellules du muscle lisse vasculaire
de l'angiogénèse et dans la polyarthrite rhumatoïde, la
neuro-fibromatose, l'athérosclérose, les fibroses
pulmonaires, les resténoses suivant de l'angioplastie ou
de la chirurgie vasculaire, la formation de cicatrices
hypertrophiques, l'angiogénèse et le choc endotoxique.
Ces médicaments trouvent leur emploi en thérapeutique,
notamment dans le traitement ou la prévention des
maladies causées ou exacerbées par la prolifération des
cellules et en particulier des cellules tumorales.
Comme inhibiteur de la prolifération des cellules
tumorales, ces composés sont utiles dans la prévention et
le traitement des leucémies, des tumeurs solides à la
fois primaires et métastasiques, des carcinomes et
cancers, en particulier: cancer du sein, cancer du
poumon, cancer de l'intestin grêle, cancer du colon et du
rectum, cancer des voies respiratoires, de l'oropharynx
et de l'hypopharynx, cancer de l'oesophage, cancer du
foie, cancer de l'estomac, cancer des canaux biliaires,
cancer de la vésicule biliaire, cancer du pancréas,
cancers des voies urinaires y compris rein, urothélium et
vessie, cancers du tractus génital féminin y compris le
cancer de l'utérus, du col de l'utérus, des ovaires,
chloriocarcinome et trophoblastome; cancers du tractus
génital masculin y compris cancer de la prostate, des
vésicules séminales, des testicules, tumeurs des cellules
germinales; cancers des glandes endocrines y compris
cancer de la thyroïde, de l'hypophyse, des glandes
surrénales ; cancers de la peau y compris hémangiomes,
mélanomes, sarcomes, incluant le sarcome de Kaposi ;
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
44
tumeurs du cerveau, des nerfs, des yeux, des méninges,
incluant astrocytomes, gliomes, glioblastomes,
rétinoblastomes, neurinomes, neuroblastomes, schwannomes,
méningiomes ; tumeurs malignes hématopoïétiques ;
leucémies telles que leucémie aigüe lymphoïde, leucémie
aigüe myéloïde, leucémie myéloïde chronique, leucémie
lymphoïde chronique, chloromes, plasmocytomes, leucémies
des cellules T ou B, lymphomes non hodgkiniens ou
hodgkiniens, myélomes, hémopathies malignes diverses.
La présente invention a notamment pour objet les
combinaisons définies comme suit.
Selon la présente invention, le ou les composés de
formule (I) peuvent être administrés en association avec
un (ou plusieurs) principe(s) actif(s) anticancéreux, en
particulier des composés antitumoraux tels que les agents
alkylants tels que les alkylsulfonates (busulfan), la
dacarbazine, la procarbazine, les moutardes azotées
(chlorméthine, melphalan, chlorambucil),
cyclophosphamide, ifosfamide; les nitrosourées tels que
la carmustine, la lomustine, la sémustine, la
streptozocine; les alcaloïdes antinéoplasiques tels que
la vincristine, la vinblastine ; les taxanes tel que le
paclitaxel ou le taxotère ; les antibiotiques
antinéoplasiques tels que l'actinomycine; les agents
intercalants, les antimétabolites antinéoplasiques, les
antagonistes des folates, le méthotrexate; les
inhibiteurs de la synthèse des purines; les analogues de
la purine tels que mercaptopurine, 6-thioguanine; les
inhibiteurs de la synthèse des pyrimidines, les
inhibiteurs d'aromatase, la capécitabine, les analogues
de la pyrimidine tels que fluorouracil, gemcitabine,
cytarabine et cytosine arabinoside; le bréquinar ; les
inhibiteurs de topoisomérases tels que la camptothécine
ou l'étoposide ; les agonistes et antagonistes hormonaux
anticancéreux incluant le tamoxifène; les inhibiteurs de
kinase, l'imatinib; les inhibiteurs de facteurs de
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
croissance; les antiinflammatoires tels que le pentosane
polysulfate, les corticostéroïdes, la prednisone, la
dexamethasone; les antitopoisomérases tels que
l'étoposide, les antracyclines incluant la doxorubicine,
5 la bléomycine, la mitomycine et la méthramycine; les
complexes métalliques anticancéreux, les complexes du
platine, le cisplatine, le carboplatine, l'oxaliplatine;
l'interféron alpha, le triphénylthiophosphoramide,
l'altrétamine; les agents antiangiogéniques; la
10 thalidomide; les adjuvants d'immunothérapie; les vaccins.
Selon la présente invention les composés de formule (I)
peuvent également être administrés en association avec un
ou plusieurs autres principes actifs utiles dans une des
pathologies indiquées ci-dessus, par exemple un agent
15 anti-émétiques, anti-douleurs, anti-inflammatoires, anti-
cachexie.
La présente invention a ainsi pour objet à titre de
médicaments, les produits de formule (I) telle que
définie ci-dessus ainsi que les sels d'addition avec les
20 acides minéraux et organiques pharmaceutiquement
acceptables desdits produits de formule (I).
La présente invention a notamment pour objet à titre de
médicaments, les produits de formule (I) tels que définis
ci-dessus dont les noms suivent :
25 - 4-[4-(4-Fluoro-3-methyl-phenylamino)-pyrimidin-2-
ylamino]-N-methyl-N-(1-methyl-piperidin-4-yl)-benzamide
- 4-[4-(4-Fluoro-3-methyl-phenylamino)-pyrimidin-2-
ylamino]-N-methyl-N-[1-(4,4,4-trifluoro-butyl)-piperidin-
3-yl]-benzamide
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
46
- 4-[4-(4-Fluoro-3-methyl-phenylamino)-pyrimidin-2-
ylamino]-N-methyl-N-(1[1,2,3]thiadiazol-4-ylmethyl-
piperidin-3-yl)-benzamide
- N-Methyl-N-(1-methyl-piperidin-4-yl)-4-[4-(4-
trifluoromethyl-phenylamino)-pyrimidin-2-ylamino]-
benzamide
- N-Methyl-N-(tetrahydro-pyran-4yl)-4-[4-(4-
trifluoromethyl-phenylamino)-pyrimidin-2-ylamino]-
benzamide
- N-(1-Methyl-piperidin-4-yl)-N-(2pyrrolidin-1-yl-
ethyl)-4-[4-(4-trifluoromethyl-phenylamino)-pyrimidin-2-
ylamino]-benzamide,
- 4-({4-[(4-Fluorophenyl)amino]pyrimidin-2-yl}amino)-N-
(octahydroindolinizin-7-yl)benzamide,
ainsi que les sels d'addition avec les acides minéraux et
organiques pharmaceutiquement acceptables desdits
produits de formule (I).
La présente invention a également pour objet les
compositions pharmaceutiques contenant à titre de
principe actif l'un au moins des produits de formule (I)
tels que définis ci-dessus ou un sel pharmaceutiquement
acceptable de ce produit ou un prodrug de ce produit et
un support pharmaceutiquement acceptable.
La présente invention a particulièrement pour objet
l'utilisation des produits de formule (I) tels que
définis ci-dessus ou de sels pharmaceutiquement
acceptables de ces produits pour la préparation d'un
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
47
médicament destiné au traitement ou à la prévention d'une
maladie par l'inhibition de l'activité de la protéine
kinase IKK.
La présente invention a ainsi pour objet l'utilisation
telle que définie ci-dessus dans laquelle la protéine
kinase est dans un mammifère.
La présente invention a ainsi pour objet l'utilisation
d'un produit de formule (I) tel que défini ci-dessus pour
la préparation d'un médicament destiné au traitement ou à
la prévention d'une maladie choisie parmi les maladies
indiquées ci-dessus.
La présente invention a notamment pour objet
l'utilisation d'un produit de formule (I) tel que défini
ci-dessus pour la préparation d'un médicament destiné au
traitement ou à la prévention d'une maladie choisie dans
le groupe suivant : maladies inflammatoires, diabètes et
cancers.
La présente invention a notamment pour objet
l'utilisation d'un produit de formule (I) tel que défini
ci-dessus pour la préparation d'un médicament destiné au
traitement ou à la prévention de maladies inflammatoires.
La présente invention a notamment pour objet
l'utilisation d'un produit de formule (I) tel que défini
ci-dessus pour la préparation d'un médicament destiné au
traitement ou à la prévention de diabètes.
La présente invention a notamment pour objet
l'utilisation d'un produit de formule (I) tel que défini
ci-dessus pour la préparation d'un médicament destiné au
traitement de cancers.
La présente invention a notamment pour objet
l'utilisation d'un produit de formule (I) tel que défini
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
48
ci-dessus destinée au traitement de tumeurs solides ou
liquides.
La présente invention a notamment pour objet
l'utilisation d'un produit de formule (I) tel que défini
ci-dessus destinée au traitement de cancers résistant à
des agents cytotoxiques.
La présente invention a notamment pour objet
l'utilisation d'un produit de formule (I) tel que défini
ci-dessus pour la préparation de médicaments destinés à
la chimiothérapie de cancers.
La présente invention a notamment pour objet
l'utilisation d'un produit de formule (I) tel que défini
ci-dessus pour la préparation de médicaments destinés à
la chimiothérapie de cancers seul ou en en association ou
sous forme de combinaison tel que défini ci-dessus.
La présente invention a notamment pour objet
l'utilisation d'un produit de formule (I) tel que défini
ci-dessus comme inhibiteurs de IKK.
La présente invention concerne tout particulièrement les
produits de formule (I) tels que définis ci-dessus qui
constituent les exemples 1 à 6 de la présente invention.
Les exemples suivants illustrent l'invention sans toute-
fois la limiter.
Les exemples suivants illustrent l'invention sans toute-
fois la limiter.
Partie expérimentale
Procédure 1 : préparation de 4-[4-(4-Fluoro-3-methyl-
phenylamino)-pyrimidin-2-ylamino]-benzoic acide.
Stade 1 : (2-Chloro-pyrimidin-4-yl)-(4-fluoro
-phenyl)-amine
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
49
A un mélange contenant 6.3 g de dichloropyrimidine dans
100 mL de n-butanol, sous agitation,on additionne 5.3 g
de 4-fluoro-3-methyl-phenylamine puis 7 mL de di-
isopropyl-ethylamine. Le mélange réactionnel est porté
sous agitation, à reflux, pendant 2 heures. Le milieu
réactionnel est refroidi, concentré à sec. Ajouter une
solution de K2C03 au résidu et extraire 3 fois avec de
l'acétate d'éthyle, lavage avec une solution saturée de
NaCl et séchage sur Na2SO4, le brut réactionnel est
purifié par chromatographie sur colonne de silice(DCM
puis 30% d'AcOEt dans DCM). On obtient 3.8 g de produit
attendu (Point de fusion= 130-131 C).
Stade 2 : 4-[4-(4-Fluoro-3-methyl-phenylamino)-pyrimidin-
2-ylamino]-benzoic acidmethyl ester
Un mélange contenant 8 g de chloropyrimidine obtenu au
stade 1 et 5.1 g de d'amino-4-benzoate de méthyle dans le
n-butanol, est chauffé à 140 C pendant une nuit. Après
refroidissement, on filtre le précipité. On lave ce
précipité avec de Et20 et on le recristallise dans une
mélange DCM-MeOH-iPr2O. On obtient ainsi 10.5 g de
produit attendu.
Stade 3 : 4-[4-(4-Fluoro-3-methyl-phenylamino)-pyrimidin-
2-ylamino]-benzoic acid
2.08 g de produit obtenu à stade 2, en présence de 410 mg
de soude dans un mélange de MeOH(5 mL), eau(5 mL) et
dioxane(20 mL) sont portés à une température de 40 C
pendant une nuit. Le milieu réactionnel est concentré à
sec et repris dans 100 mL d'eau. On extrait les impuretés
par deux volumes de Et20, puis on acidifie la phase
acqueuse à pH 6 avec HCl 1 N. Le précipité formé est
filtré, rincé par l'eau distillée et mis en suspension
dans du DCM et le solvant est évaporé. On obtient 1.3 g
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
d'acide attendu.
Procédure 2 : 4-[4-(4-Trifluoromethyl-phenylamino)-
pyrimidin-2-ylamino]-benzoic acid.
5
Stade 1 : (2-Chloro-pyrimidin-4-yl)-(4-triflu
oromethyl-phenyl)-amine
De la même manière qu'à l'exemple 1 de la procédure 1, à
partir de 15 g de dichloropyrimidine dans 200 mL de n-
10 butanol, sous agitation, on additionne 16 g de 4-
trifluoromethyl-phenylamine puis 18 mL de di-isopropyl-
ethylamine. Le mélange réactionnel est porté sous
agitation, à reflux, toute la nuit. Le milieu réactionnel
est refroidi, concentré à sec. Ajouter une solution de
15 K2C03 au résidu et extraire 3 fois avec de l'acétate
d'éthyle, lavage avec une solution saturée de NaCl et
séchage sur Na2SO4, le brut réactionnel est purifié par
chromatographie sur colonne de silice(DCM puis 2% de MeOH
dans DCM). On obtient 5 g de produit attendu.
20 MH+ = 274.3
Stade 2 : 4-[4-(4-Trifluoromethyl-phenylamino)-pyrimidin-
2-ylamino]-benzoic acid methyl ester
De même qu'au stade 2 de la procédure 1, à partir de 4.6
25 g de chloropyrimidine obtenu au stade 1 et de 2.6 g de
d'amino-4-benzoate de méthyle, On obtient ainsi 6.4 g de
produit attendu.
Stade 3 : 4-[4-(4-Trifluoromethyl-phenylamino)-pyrimidin-
2-ylamino]-benzoic acid.
30 De même qu'au stade 3 de la procédure 1, à partir de 6.4
g d'ester obtenu au stade 2 et de 2.26 g de de soude, On
obtient ainsi 4.2 g de produit attendu.
MH+ = 375.1
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
51
Exemple 1 : 4-[4-(4-Fluoro-3-methyl-phenylamino)-
pyrimidin-2-ylamino]-N-methyl-N-(1-methyl-piperidin-4-
yl)-benzamide
NI N
F I/ I iN I/ N
O N~
On fait réagir à température ambiante, pendant 3 heures,
un mélange contenant 470 mg de l'acide obtenu à la
procédure 1, 230 pL de la methyl-(1-methyl-piperidin-4-
yl)-amine en présence de 610 mg de BOP, de 700 pL de
DIPEA dans 15 mL de DCM. On évapore à sec, on ajoute une
solution 10 % de carbonate de potassium et on extrait par
l'acétate d'éthyle. Après lavage par de l'eau et séchage
sur Na2SO4 de la phase organique, on chromatographie sur
une colonnë de silice utilisant comme éluant du DCM/
MeOH(88/12; v/v) . On évapore à sec et on recristallise
dans un mélange DCM-.ïPr20 pour obtenir 289 mg de produit
attendu.
MH+ = 449.2
PF = 88 OC
1H RMN (DMSO) : 1.57 (m,2) ; 1.81 (m,4) ; 2.14 (1s,3) ;
2.25 (s,3) ; 2.74-2.94 ( masif,5) ; 4.03 (1s,1) ; 6.21
(d, 1) ; 7.09 (t, 1) . 7.25 (d,2) ; 7.46 (m, 1) ; 7.59 (d,l)
; 7.77 (d,2) ; 8.03 (d,1) ; 9.33 (s,l) ; 9.37 (s,l)
Exemple 2 : 4-[4-(4-Fluoro-3-methyl-phenylamino)-
pyrimidin-2-ylamino]-N-methyl-N-[1-(4,4,4-trifluoro-
butyl)-piperidin-3-yl]-benzaxnide
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
52
F I iN N N^ /F
~N~N I/ \
O ~ v ~F
F
Stade 1: 3-({4-[4-(4-Fluoro-3-methyl-phenylamino)-
pyrimidin-2-ylamino]-benzoyl}-methyl-amino)-piperidine-l-
carboxylic acid tert-butyl ester
Suivant le mode opératoire décrit à l'exemple 1, à partir
de 1.3 g de l'acide obtenu à la procédure 1 et de 800 mg
de 3-methylamino-piperidine-l-carboxylic acid tert-butyl
ester, on obtient 1.1 g de produit attendu.
Stade 2 : 4-[4-(4-Fluoro-3-methyl-phenylamino)-pyrimidin-
2-ylamino]-N-methyl-N-piperidin-3-yl-benzamide
1.05 g de produit obtenu à stade 1 sont dissouts dans 5
mL de MeOH. On ajoute , à température ambiante, 15 mL
d'éther chlorhydrique 2 N et on laisse sous agitation
toute la nuit. On évapore plusieurs fois en présence de
DCM. On obtient 940 mg de chlorhydrate de pipéridine
attendu.
Stade 3 : 4-[4-(4-Fluoro-3-methyl-phenylamino)-pyrimidin-
2-ylamino]-N-methyl-N-[1-(4,4,4-trifluorobutyl)
-piperidin-3-yl]-benzamide
Le chlorhydrate obtenu au stade 2 (300 mg), en présence
de 90 mg de 4,4,4-trifluoro-butyraldehyde et de 250 mg de
NaBH(OAc)3 dans 10 mL de THF. Après une nuit de réaction,
reprendre avec une solution de soude, extraire au DCM,
laver et secher sur Na2SO4 la phase organique. On
chromatographie sur une colonne de silice utilisant comme
éluant du CH2C12/ CH30H(99/1; v/v). On évapore à sec et
on recristallise dans un mélange CH2C12-ether
isopropylique pour obtenir 141 mg de produit attendu.
MH+ = 545.3
PF = 100-110 C
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
53
1H RMN (DMSO) : 1. 62-2. 09 (massif,6) ; 2.24 (s,3) ; 2.38
(m,2) ; 2.89 (s,3) ; 2.96 (m,l) ; 3.16-3.33 (2m,3) ;3.49
(m,2) ; 4.47 (m,l) ; 6.48 (d, l) ; 7.13 (t, l) ; 7.37 (m, l)
; 7.42 (d,2) ; 7.49 (m,l) ; 7.59 (d,2) ; 8.00 (d,l)
Exemple 3 : 4-[4-(4-Fluoro-3-methyl-phenylamino)-
pyrimi.din-2-ylamino]-N-methyl-N-(1[1,2,3]
thiadiazol-4-ylmethyl-piperi.din-3-yl)-benzamide
N~y N N F I(DY ~ 'N
O `=-S
Suivant le mode opératoire décrit au stade 3 de l'exemple
2, à partir de 330 mg de chlorhydrate obtenu au stade 2
de l'exemple 2 et de 100 mg de [1,2,3]thiadiazole-4-
carbaldehyde, on obtient 191 mg de produit attendu.
MH+ = 533.2
PF = 125-130 C
1H RMN (DMSO) : 1.08-2.04 (massif,5) ; 2.23 (s,4) ; 2.63-
2.99 (massif,5) ; 3.46-4.66 (massif,3) ; 6.22 (d,1)
7.08 (t,l) ; 7.22 (m,2) ; 7.47 (m, l) ; 7.58 (d, l) ; 7.64
(d,2) ; 8.04 (d,l) ; 9.03 (1s,1) ; 9.34 (s,l) ; 9.37
(s, 1)
Exemple 4 : N-Methyl-N-(1-methyl-piperidin-4-yl)-4-[4-(4-
trifluoromethyl-phenylamino)-pyrimidin-2-ylamino]-
benzamide
N\
/N ~ F I i7N I/ Y
z
F F O
Suivant le mode opératoire décrit à l'exemple 1, à partir
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
54
de 400 mg de l'acide de l'acide obtenu à la procédure 2
et de 130 mg de la methyl-(1-methyl-piperidin-4-yl)-
amine, on obtient 285 mg de produit attendu.
MH+ = 485.0
PF = 238-244 C
1H RMN (DMSO) :
1.59(m, 2) ; 1.77-1.93(massif, 4) ; 2.15(s, 3) ; 2.82(d,
2) ; 2. 85 (s, 3) ; 3. 86 (sl, 1) ; 6.36(d, 1) ; 7.28(d, 2) ;
7. 61 (d, 2) ; 7.77(d, 2) ; 7.92(d, 2) ; 8.13(d, 1) ;
9. 12 (s, 1) ; 9. 52 (s, 1).
Exemple 5 : N-Methyl-N-(tetrahydro-pyran-4y1)-4-[4-(4-
trifluoromethyl-phenylamino)-pyrimidin-2-ylamino]-
benzamide
~
F N`/N ~ O I
F I/ I i `7 N I/ N
F O
Suivant le mode opératoire décrit à l'exemple 1, à partir
de 400 mg de l'acide obtenu à la procédure 2 et de 115 mg
de la methyl-(tetrahydro-pyran-4-yl)-amine, on obtient
288 mg de produit attendu.
MH+ = 471.9
PF = 254-256 C
1H RMN (DMSO) :
1.56(dl, 2) ; 1.81(m, 2) ; 2.83(s, 3) ; 3.25(sl, 2) ;
3.88(dl, 2) ; 4.13(sl, 1) ; 6.34(d, 1) ; 7.32(d, 2) ;
7.63(d, 2) ; 7.80(d, 2) ; 7.97(d, 2) ; 8.14(d, 1) ;
9.51(s, 1) ; 9. 83 (s, 1).
Exemple 6 : N-(1-Methyl-piperidin-4-yl)-N-(2pyrrolidi.n-1-
yl-ethyl)-4-[4-(4-trifluoromethyl-phenylamino)-pyrimidin-
2-ylamino]-benzamide
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
`N>
\ N I Ny N \
F l/ N (/ N
F F O N~
Stade 1 : (1-Methyl-piperidin-4-yl)-(2-pyrrolidin-1-yl-
ethyl)-amine
Comme au stade 3 de l'exemple 2, à partir de 3 mL 1-
5 methyl-piperidin-4-one et de 3.35 mL de 2-pyrrolidin-1-
yl-ethylamine, On obtient 4.4 g de produit attendu.
Stade 2 : (1-Methyl-piperidin-4-yl)-(2-pyrrolidin-1-yl-
ethyl)-carbamic acid tert-butyl ester
Un mélange contenant 4.4 g du composé obtenu au stade 1
10 est mis en solution dans 100 mL de dichlorométhane. On
additionne 4.7 g Boc20 dans le milieu réactionnel et on
chauffe à 50 C pendant 1h30. Après concentration à sec
le brut est purifié sur colonne d'alumine(dichlorométane
en gradient jusqu'à 2% de méthanol). On obtient au total
15 2.35 g de composé attendu.
Stade 3 : chlorhydrate de (1-methyl-piperidin-4-yl)-(2-
pyrrolidin-1-yl-ethyl)-amine
Suivant la réaction de décarboxylation décrite au stade 2
de l'exemple 2, à partir de 1.85 g d'amine obtenue au
20 stade 2, On obtient 1.65 g d'amino piperidine attendu.
Stade 4 : N-(1-Methyl-piperidin-4-yl)-N-(2pyrrolidin-1-
yl-ethyl)-4-[4-(4-trifluoromethyl-phenylamino)-pyrimidin-
2-ylamino]-benzamide
Suivant le mode opératoire décrit à l'exemple 1, à partir
25 de 400 mg de l'acide obtenu à la procédure 2 et de 310 mg
d'amino piperidine obtenu au stade 4, on obtient 44 mg de
produit attendu.
MH+ = 558.1
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
56
PF = 115-120 C
1H RMN (DMSO) :
1.52 -1.96 (masif,10 ) ; 2.12 (s,3) ; 2.43 (massif,4) ;
2.56 (t,2) ; 2.78 (d,2) ; 3.38 (t,2) ; 3.68 (m,l) ; 6.35
(d,l) ; 7.25 (d,2) ; 7.66 (d,2) ; 7.77 (d,2) ; 7.94 (d,2)
; 8.13 (d, 1) ; 9.24 (s, 1) ; 9.62 (s, 1)
Exemple 7 : 4-({4-[(4-Fluorophenyl)amino]pyrimidin-2-
yl}ami.no)-N-(octahydroindolinizin-7-yl)benzamide
~ N N\ 'N
F ~/ `7N
Stade 1 :Hexahydroindolizin-7(1H)-one
Suivant le mode opératoire décrit dans J. Chem. Soc.
Perkin Trans. I 1986, 447-453, dans un mélange contenant
6 mL de 4,4-diéthoxy-1-amine dans 20 mL d'Et20, on
additionne goutte à goutte à froid 3.6 mL de but-3-en-2-
one. Le milieu réactionnel est laissé sous agitation à TA
pendant 1 h. Le milieu réactionnel est transvasé dans 50
mL d'une solution 2.5 M de HCl et extrait avec l'ether.
La phase acqueuse est laissée pendant 3 h en chauffant.
Après refroidissement et évaporation à sec, reprendre le
brut avec H20/K2C03 et extraire au DCM, sechée et
concentrée.
Le produit attendu est obtenu par distillation sous
vide(40 C, 0.3 mm Hg). On obtient 1.5 g de produit
attendu.
Stade 2 : N-méthyloctahydroindolizin-7-amine
Par une réaction d'amination réductrice, à partir de 1.5
g de la cétone obtenue au stade 1, de 10.7 mL d'une
solution 2 M de méthylamine dans le THF et de 3 g de
NaHB(OAc)3 dans 20 mL de THF, le mileiu réactionnel est
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
57
chauffé à 60 C pendant 1 h. Après évaporation, reprise
par H20/NaOH et extraction au DCM, on séche et on obtient
après concentration à sec 1.25 g d'amine attendu.
Stade 3 : 4-({4-[(4-Fluorophenyl)amino]pyrimidin-2-
yl}amino)-N-(octahydroindolinizin-7-yl)benzamide
Suivant le mode opératoire décrit à l'exemple 1, à partir
de 600 mg e l'acide obtenu à la procédure 1 et de 255 mg
de la N-méthyloctahydroindolizin-7-amine, on obtient 172
mg de benzamide attendu.
MH+ = 461.1
PF = 230-235 C
1H RMN (DMSO) :
1.2 -2.14 (masif,ll ) ; 2.84 (s,3) ; 2.92 (t,l) ; 3.03
(m,1) ; 3.96 (m,1) ; 6.23 (d,1) ; 7.13 (t,2) ; 7.25 (d,2)
; 7.65 (m,2) ; 7.77 (d,2) ; 8.04 (d,l) ; 9.04 (s,l) ;
9.15 (s, 1) .
Exemple 8: Composition pharmaceutique
On a préparé des comprimés répondant à la formule
suivante :
Produit de l'exemple 1 ....................... 0,2 g
Excipient pour un comprimé terminé à .......... 1 g
(détail de l'excipient : lactose, talc, amidon,
stéarate de magnésium).
L'exemple 1 est pris à titre d'exemple dans la
préparation pharmaceutique qui constitue l'exemple 8 ci-
dessus, cette préparation pharmaceutique pouvant être
réalisée différemment comme indiqué ci-dessus et si
désiré avec d'autres produits en exemples dans la
présente demande.
Partie pharmacologique:
Protocoles d'essais biochimiques sur IKK.
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
58
I) Evaluation des composés sur IKK1 et IKK2:
Les composés sont testés pour l'inhibition de IKK1 et
IKK2 en utilisant un test kinase sur support flash-plate.
Les composés à tester sont dissous à 10 mM dans du DMSO
puis dilués dans du tampon kinase(50 mM Tris, pH 7.4
contenant 0.1 mM EGTA, 0.1 mM sodium orthovanadate et
0.1% de p- mercaptoéthanol).
Des dilutions en série de 3 en 3 sont réalisées à partir
de cette solution. 10 pl de chaque dilution sont ajouté
dans les puits d'une plaque 96 puits en duplicata. 10 }il
de tampon kinase est ajouté dans les puits contrôles qui
serviront de 0% inhibition et 10 pl de 0.5 mM EDTA est
ajouté aux puits contrôles (100% d'inhibition) . 10 pl du
mélange IKK1 ou IKK2 ( 0.1 ug/puits), peptide substrat
25-55 IKB-biotinilé et BSA (5 pg) est ajouté à chaque
puit. pour démarrer la réaction kinase, 10 pl du mélange
de 10 mM magnésium acétate, 1 pM ATP froid et 0.1 }iCi
33P- ATP est ajouté à chaque puit pour un volume final de
30 pl. La réaction est incubée à 30 C pendant 90 min puis
stoppée par l'ajout de 40 pl de 0.5 mM EDTA. Après
agitation, 50 pl sont transférés vers une plaque flash-
plate recouverte de streptavidine.
min après, les puits sont lavés 2 fois par une
solution de 50 mM Tris-EDTA pH7.5 et la radioactivité
25 déterminée sur un compteur microbeta.
Les composés de l'invention testés dans cet essai
montrent une IC50 inférieure à 10 pM, ce qui montre qu'il
peuvent être utilisés pour leur activité thérapeutique.
II) Evaluation des composés sur la viabilité et la
30 prolifération des cellules tumorales:
Les composés selon l'invention ont fait l'objet d'essais
pharmacologiques permettant de déterminer leur activité
anticancéreuse.
Les composés de formule (I) selon la présente invention
ont été testés in vitro sur un panel de lignées tumorales
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
59
d'origine humaine provenant :
- de cancer du sein: MDA-MB231 (American Type culture
collection, Rockville, Maryland, USA, ATCC-HTB26), MDA-A1
ou MDA-ADR (dite lignée multi-drug resistant MDR, et
décrite par E.Collomb et al., dans Cytometry, 12(1):15-
25, 1991), et MCF7 (ATCC-HTB22),
- de cancer de la prostate: DU145 (ATCC-HTB81) et PC3
(ATCC-CRL1435),
- de cancer du colon: HCT116 (ATCC-CCL247) et HCT15
(ATCC-CCL225),
- de cancer du poumon: H460 (décrite par Carmichael dans
Cancer Research 47 (4):936-942, 1987 et délivré par le
National Cancer institute, Frederick Cancer Research and
Development Center, Frederick, Maryland, USA),
- de glioblastome (SF268 décrite par Westphal dans
Biochemical & Biophysical Research Communications 132
(1): 284-289, 1985 et délivré par le National Cancer
institute, Frederick Cancer Research and Development
Center, Frederick, Maryland, USA),
- de leucémie (CMLT1 décrite par Kuriyama et al. dans
Blood, 74: 1989, 1381-1387, par Soda et al. dans British
Journal of Haematology, 59: 1985, 671-679 et par
Drexler, dans Leukemia Research, 18: 1994, 919-927 et
délivré par la société DSMZ, Mascheroder Weg lb, 38124
Braunschweig, Germany).
La prolifération et la viabilité cellulaire ont été
déterminées dans un test utilisant le 3-(4,5-
diméthylthiazol-2-yl)-5-(3-carboxyméthoxyphényl)-2-(4-
sulfophényl)-2H-tétrazolium (MTS) selon Fujishita T. et
al., Oncology, 2003, 64 (4), 399-406. Dans ce test, on
mesure la capacité mitochondriale des cellules vivantes à
transformer le MTS en un composé coloré après 72 heures
d'incubation d'un composé de formule (I) selon
l'invention. Les concentrations en composé selon
l'invention, qui conduisent à 50 % de perte de
prolifération et de viabilité cellulaire (C150) sont
CA 02672955 2009-06-16
WO 2008/099072 PCT/FR2008/000001
inférieure à 10 pM, selon la lignée tumorale et le
composé testé.
Ainsi, selon la présente invention, il apparaît que les
composés de formule (I) entraînent une perte de
5 prolifération et de viabilité des cellules tumorales avec
une IC50 inférieure à 10 pM.
15
25
35