Note: Descriptions are shown in the official language in which they were submitted.
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
1
DÉRIVÉS DE TRIAZOLOPYRIDINE-CARBOXAMIDES ET
TRIAZOLOPYRIMIDINE-CARBOXAMIDES, LEUR PRÉPARATION ET LEUR
APPLICATION EN THÉRAPEUTIQUE
La présente invention se rapporte à des dérivés de triazolopyridine-
carboxamides et de
triazolopyrimidine-carboxamides, à leur préparation et à leur application en
thérapeutique.
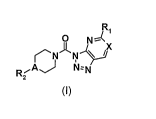
La présente invention a pour objet les composés répondant à la formule (I)
R
O N
r'N-1 N X
- ~ ~
RiA~ N-N
2
(I)
dans laquelle :
A et X représentent, indépendamment l'un de l'autre, un atome d'azote ou un
groupement CH ;
R, représente un groupe NR3R4, dans lequel R3 et R4 forment avec l'atome
d'azote
qui les porte un groupe hétérocyclique de 3 à 7 chaînons pouvant incorporer un
atome
d'oxygène ou de soufre, un groupe NR ou NR'-CO, ledit cycle étant
éventuellement
substitué par un ou plusieurs groupes choisis parmi un atome d'halogène ou un
groupe
(Cl-C6)alkyle, (Cl-C6)alcoxy, halo(C1 -C6) alkyle, halo(Cl-C6)alcoxy,
R2 représente un groupement aryle, éventuellement substitué par un ou
plusieurs
groupes choisis parmi un atome d'halogène, un groupe méthyle,
trifluorométhyle,
méthoxy, trifluorométhoxy,
R représente un groupe choisi parmi un atome d'hydrogène, un groupe (Ci-
C6)alkyle, (C3-C7)cycloalkyle, (C3-C,)cycloalkyle(Cl-C6)alkyle, C(O)R', CO2R',
SOzR',
CONR'R", SO2NR'R",
R' et R" représentent, indépendamment l'un de l'autre, un ou plusieurs groupes
choisis parmi un atome d'hydrogène, un groupe (C,-C6)alkyle, un groupe (C3-
C7)cycloalkyle ou (C3-C7)cycloalkyle(Cl-C6)alkyle.
Les composés de formule (I) peuvent comporter un ou plusieurs atomes de
carbone
asymétriques. Ils peuvent donc exister sous forme d'énantiomères ou de
diastéréoisomères. Ces énantiomères, diastéréoisomères, ainsi que leurs
mélanges, y
compris les mélanges racémiques, font partie de l'invention.
Les composés de formule (I) peuvent exister à l'état de bases ou de sels
d'addition à des
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
2
acides. De tels sels d'addition font partie de l'invention.
Ces sels peuvent être préparés avec des acides pharmaceutiquement acceptables,
mais
les sels d'autres acides utiles, par exemple, pour la purification ou
l'isolement des
composés de formule (I) font également partie de l'invention.
Les composés de formule (I) peuvent également exister sous forme d'hydrates ou
de
solvates, à savoir sous forme d'associations ou de combinaisons avec une ou
plusieurs
molécules d'eau ou avec un solvant. De tels hydrates et soivates font
également partie
de l'invention.
Dans le cadre de la présente invention, on entend par:
- Ct_Z, où t et z peuvent prendre les valeurs de 1 à 7, une chaîne ou un cycle
carboné pouvant avoir de t à z atomes de carbone, par exemple C1_3 peut
caractériser
une chaîne carbonée ayant de 1 à 3 atomes de carbone;
- un atome d'halogène : un fluor, un chlore, un brome ou un iode ;
- un groupe alkyle : un groupe aliphatique saturé linéaire ou ramifié. A titre
d'exemples, on peut citer les groupes méthyle, éthyle, propyle, isopropyle,
butyle,
isobutyle, tertbutyle, pentyle, etc ;
- un groupe cycloalkyle : un groupe aliphatique cyclique saturé. A titre
d'exemples, on peut citer les groupes cyclopropyle, cyclobutyle, cyclopentyle,
cyclohexyle, etc ;
- un groupe haloalkyle : un groupe alkyle dont un ou plusieurs atomes
d'hydrogène ont été substitués par un atome d'halogène ;
- un groupe alcoxy : un radical -O-alkyle où le groupe alkyle est tel que
précédemment défini ;
- un groupe haloalcoxy : un groupe alcoxy dont un ou plusieurs atomes
d'hydrogène ont été substitués par un atome d'halogène ;
- un groupe aryle : un groupe aromatique cyclique comprenant entre 6 et 14
atomes de carbone. A titre d'exemples de groupe aryle, on peut citer phényle
ou
naphthyle;
- un groupe hétérocyclique : un groupe cyclique saturé de 5 à 7 chaînons
comportant un à plusieurs hétéroatomes tels que les atomes d'azote, d'oxygène
ou de
soufre. A titre d'exemples, on peut citer les groupes pyrrolidinyle,
pipéridinyle,
imidazolidine, pyrazolidine, dioxane, tétrahydropyranyle, pipéridonyle,
morpholinyle,
pipérazinyle, azétidine, azépine, thiomorpholinyle, N-méthyl-pipérazinyle,
homopipérazine.
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
3
- les atomes de soufre peuvent être présents à l'état oxydé (sulfoxyde,
sulfone).
Dans les différents groupes tel que définis ci-dessous, les groupes R, et R2,
A et X,
lorsqu'ils ne sont pas définis, ont les mêmes définitions que celles
mentionnées ci-
dessus.
Parmi les composés de formule (I) objets de l'invention, un premier groupe de
composés
est constitué par les composés pour lesquels :
A représente un atome d'azote,
X représente un groupe CH.
Parmi les composés de formule (I) objets de l'invention, un second groupe de
composés
est constitué par les composés pour lesquels :
A et X représentent un groupe CH.
Parmi les composés de formule (I) objets de l'invention, un troisième groupe
de
composés est constitué par les composés pour lesquels :
Ri représente un groupe hétérocyclique, éventuellement substitué par un ou
plusieurs groupes choisis parmi un atome d'halogène ou un groupe haloalkyle.
Parmi les composés de formule (I) objets de l'invention, un quatrième groupe
de
composés est constitué par les composés pour lesquels :
Ri représente un groupe morpholinyle, pyrrolidinyle ou pipéridinyle,
éventuellement substitué par un ou plusieurs groupes choisis parmi un atome
d'halogène
ou un groupe trifluorométhyle.
Les combinaisons des groupes un à quatre ci-dessus font également partie de
l'invention.
Parmi les composés de formule (I) objets de l'invention, on peut notamment
citer les
composés suivants :
- (5-morpholin-4-yl-[1,2,3]triazolo[4,5-b]pyridin-3-yl)-[4-(3-trifluorométhyl-
phényl)-
pipérazin-1-yl]-méthanone ;
- [4-(4-méthoxy-phényl)-pipérazin-1-yl]-(5-pyrrolidin-1-yl-[1,2,3]triazolo[4,5-
b]pyridin-3-yl)-
méthanone ;
- [5-(3,3-difluoro-pyrrolidin-1-yl)-[1,2,3]triazolo[4,5-b]pyridin-3-yl]-[4-(4-
trifluorométhyl-
phényl)-pipérazin-1-yl]-méthanone ;
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
4
- (5-pyrrolidin-1-yl-[1,2,3]triazolo[4,5-b]pyridin-3-yl)-[4-(3-trifluorométhyl-
phényl)-pipérazin-
1-yl]-méthanone ;
- (4-phényl-pipéridin-1-yl)-[5-(4-trifluorométhyl-pipéridin-1-yl)-
[1,2,3]triazolo[4,5-b]pyridin-
3-yl]-méthanone.
Dans ce qui suit, on entend par groupe protecteur Pg un groupe qui permet,
d'une part,
de protéger une fonction réactive telle qu'un hydroxy ou une amine pendant une
synthèse et, d'autre part, de régénérer la fonction réactive intacte en fin de
synthèse. Des
exemples de groupes protecteurs ainsi que des méthodes de protection et de
déprotection sont données dans Protective Groups in Organic Synthesis ,
Green
et al., 2"d Edition (John Wiley & Sons, Inc., New York), 1991.
On entend par groupe partant, dans ce qui suit, un groupe pouvant être
facilement clivé
d'une molécule par rupture d'une liaison hétérolytique, avec départ d'une
paire
électronique. Ce groupe peut ainsi être remplacé facilement par un autre
groupe lors
d'une réaction de substitution, par exemple. De tels groupes partants sont,
par exemple,
les halogènes ou un groupe hydroxy activé tel qu'un méthanesulfonate,
benzènesulfonate, p-toluènesulfonate, triflate, acétate, etc. Des exemples de
groupes
partants ainsi que des références pour leur préparation sont donnés dans
Advances in
Organic Chemistry , J. March, 3rd Edition, Wiley Interscience, 1985, p. 310-
316.
Conformément à l'invention, on peut préparer les composés de formule générale
(I) selon
le procédé du schéma 1 qui suit.
Dans une première étape, on transforme les composés de formule générale (II),
dans laquelle X est tel que défini ci-dessus, en composés de formule générale
(III), dans
laquelle X et RI sont tels que définis ci-dessous. La transformation est
réalisée par une
réaction d'aminolyse avec une amine de formule générale (IV) dans laquelle R3
et R4 sont
tels que définis ci-dessus, dans un solvant tel que l'isopropanol ou le
diméthylsulfoxyde
ou un mélange de ces solvants, en présence d'une base telle que le carbonate
de
potassium ou la diisopropyléthylamine.
Dans une deuxième étape, on transforme les composés de formule générale (III),
dans laquelle X et R, sont tels que définis ci-dessus, en composés de formule
générale
(V), dans laquelle X, RI, R2 et A sont tels que définis ci-dessus, par
réaction avec un
chlorure de carbamoyle de structure générale (VI). La réaction est conduite
dans un
solvant tel que le N,N-diméthylformamide ou le N-méthylpyrrolidone en présence
d'une
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
base telle que l'hydrure de sodium ou le tert-butoxyde ou tert-pentoxyde de
potassium.
Dans une troisième étape, on transforme les composés de formule générale (V)
en composés de formule générale (VII) dans laquelle X, Rl, R2 et A sont tels
que définis
ci-dessus, par réduction de groupement nitro en groupement amino. La réaction
peut être
5 conduite par différentes méthodes décrites dans la littérature ou connues de
l'homme de
métier, comme par exemple l'hydrogénation en présence d'un catalyseur à base
de
Palladium, Platine ou Nickel et leurs variantes.
Schéma 1
ci
N~11 X
H2N
y
NO2
(II)
HNR3R4 (IV)
R1
NX
I ,
HaN
NOZ
(III) O
~ci (VI)
Å N
R~ 2
O N 11X O N 1X (I)
~N N NN~
~~
A~ H NO2 R H NH2
RZ Z
(V) (Vii)
Dans la quatrième étape, on transforme les composés de formule générale (VII)
en composés de formule générale (I) par une réaction de diazotation-
cyclisation. La
réaction peut être conduite en utilisant un nitrite, par exemple le nitrite de
sodium ou de
potassium en milieu acide ou le nitrite d'isoamyle ou de tert-butyle, dans des
solvants tels
que l'eau ou le tétrahydrofurane ou leur mélange.
Les composés de formule générale (II) sont disponibles dans le commerce. Les
amines de formule générale (IV) et les chlorures de carbamoyle de formule
générale (VI),
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
6
s'ils ne sont pas disponibles dans le commerce, peuvent être préparés par
toute méthode
décrite dans la littérature ou connues de l'homme de métier.
Les exemples qui suivent illustrent la préparation de quelques composés de
l'invention.
Ces exemples ne sont pas limitatifs et ne font qu'illustrer l'invention. Les
microanalyses,
les spectres IR et RMN et ou les LC-MS confirment les structures et les
puretés des
composés obtenus. Les points de fusion (PF) sont indiqués en degrés Celsius.
Exemple 1(composé N 2 du tableau)
[4-(4-methoxy-phényl)-pipérazin-1-yl]-(5-pyrrolidin-1-yl-[1,2,3]triazolo[4,5-
b]pyridin-3-yl)-
méthanone
1.1. 3-nitro-6-pyrrolidin-1-yl-pyridin-2-yl-amine
On chauffe à 60 C sous agitation dans un tube scellé, pendant 20 heures, une
suspension de 1,735 g (10 mmoles) de 2-amino-6-chloro-3-nitro-pyridine, 1,66
mL (20
mmoles) de pyrrolidine et 1,66 mL (10 mmoles) de diisopropylethylamine dans un
mélange de 1 mL de diméthylsuifoxyde et de 5 mL d'isopropanol. On refroidit à
température ambiante puis on dilue par 10 mL d'isopropanol. On collecte le
solide par
filtration puis on le lave par 2x5 mL d'isopropanol. On reprend le solide par
20 mL d'eau.
On agite la suspension pendant 30 minutes. On filtre le solide puis on le lave
par 2x5 mL
d'eau et 2x5 mL d'éther et on le sèche sous vide en présence de pentoxyde de
phosphore pour obtenir 1,91 g (9,17 mmoles) de produit sous forme de poudre
jaune
intense.
'H-RMN (DMSO-d6, S ppm) : 8,15 (d, 1H), 7,95 (m, 2H), 6,15 (d, 1H), 3,60 (m,
4H), 2,00 (m, 4H).
1.2. 4-(4-méthoxy-phényl)-pipérazine-1-carboxylique acide, (3-nitro-6-
pyrrolidin-1-
yl-pyridin-2-yl)-am ide
Sous atmosphère d'Argon, on ajoute par portion 0,25 g (6,25 mmoles) d'hydrure
de sodium à 60% dans l'huile à une solution de 0,520 g (2,50 mmoles) de 3-
nitro-6-
pyrrolidin-1-yl-pyridin-2-ylamine obtenu à l'étape 1.1. et de 0,764 g (1,20
mmoie) de
chlorure 4-(4-méthoxyphényl)-1-pipérazinecarbonyle (préparé à partir de 1-(4-
méthoxy-
phényl)pipérazine et de triphosgène) dans 8,5 mL de diméthylformamide
refroidie par un
bain de glace. On poursuit l'agitation du mélange réactionnel à la température
du bain de
glace pendant 1 heure puis à température ambiante pendant 2 heures. On
refroidit par un
bain de glace et on ajoute par portion 50 mL d'une solution aqueuse 1M de
chlorure
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
7
d'ammonium puis 20 mL d'acétate d'éthyle. On agite le mélange vigoureusement
pendant 15 minutes. On filtre le solide puis on le lave par 10 mL d'acétate
d'éthyle, 5 mL
d'eau et 2x5 mL d'éther. On le sèche sous vide en présence de pentoxyde de
phosphore
pour obtenir 0,79 g (1,85 mmole) de produit sous forme de poudre jaune
intense.
'H-RMN (DMSO-d6, â ppm) : 8,15 (d, 1H), 6,95 (d, 2H), 6,85 (d, 2H), 6,25 (d,
1H),
3,70 (s, 3H), 3,65 (m, 4H), 3,55 (m, 4H), 3,05 (m, 4H), 1,95 (m, 4H).
1.3. [4-(4-méthoxy-phényl)-pipérazin-1-yl]-(5-pyrrolidin-1-yl-
[1,2,3]triazolo[4,5-
b]pyridin-3-yl)-méthanone
On dissout 0,730 g (1,71 mmole) de 4-(4-méthoxy-phényl)-pipérazine-1-
carboxylique acide, (3-nitro-6-pyrrolidin-1-yl-pyridin-2-yl)-amide obtenu à
l'étape 1.2.,
dans un mélange de 68 mL de méthanol et 1,0 mL d'une solution 5N d'acide
chlorhydrique (5,14 mmoles) dans l'isopropanol. On ajoute 0,333 g de platine
(0,17
mmole) à 10% sur charbon. On agite le mélange sous atmosphère d'hydrogène à la
pression de 30 Psi (2 bars) pendant 2,5 heures. On filtre et on évapore le
filtrat pour
obtenir 0,97 g de produit sous forme de mousse solide violette, engagé tel
quel dans
l'étape suivante.
1.4 On met le solide en suspension dans 8,5 mL de tétrahydrofurane puis on
ajoute 0,30 mL (2,21 mmoles) de nitrite d'isoamyle et 0,694 g (5,10 mmoles)
d'acétate de
sodium trihydrate. On agite le mélange pendant 18 heures à température
ambiante. On
ajoute 50 mL d'acétate d'éthyle et 25 mL d'une solution aqueuse 0,5M de
carbonate de
potassium. On décante la phase organique, on la lave par 25 mL d'une solution
aqueuse
0,5M de carbonate de potassium puis par 25 mL d'eau et 25 mL d'une solution
aqueuse
saturée en chlorure de sodium. On sèche sur sulfate de sodium et on évapore à
sec. On
purifie le produit par chromatographie sur gel de silice en éluant par un
mélange 40:60
puis 50:50 et 60:40 d'acétate d'éthyle et de cyclohexane. On repurifie le
produit obtenu
par chromatographie sur gel de silice en éluant par un mélange 95:5 puis
90:10, 85:15 et
80:20 de dichlorométhane et d'acétate d'éthyle. On recristallise le produit
dans
l'isopropanol pour obtenir 0,175 g (0,43 mmole) de produit sous forme de
cristaux
rosâtres.
Point de fusion ( C) : 138-140
LC-MS (m/z) : 408 (MH+), 380 (MH+-N2)
IR (KBr, cm"') : 1704, 1612
'H-RMN (CDCI3i S ppm) : 8,05 (d, 1 H), 6,95 (d, 2H), 6,90 (d, 2H), 6,55 (d, 1
H),
4,05 (m, 2H), 3,80 (m+s, 5H), 3,60 (m, 4H), 3,25 (m, 4H), 2,05 (m, 4H).
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
8
Le tableau 1 qui suit illustre les structures chimiques et les propriétés
physiques de
quelques exemples de composés selon l'invention. Dans ce tableau :
- dans la colonne sel , - représente un composé sous forme de base
libre,
alors que HCI représente un composé sous forme de chlorhydrate;
- Ph représente un groupe phényle.
- PF représente le point de fusion des composés en degrés Celsius.
Tableau 1
Ri
O N
~N%, N X
RiA~ N- -N
z
(I)
N R1 R2 X A Sel PF ( C)
1 morpholin-4-yl 3-CF3-Ph CH N 172-174
2 pyrrolidin-1-yl 4-CH30-Ph CH N - 138-140
3 pyrrolidin-1-yl 3-CF3-Ph CH N - 158-160
4 3,3-difluoro- 4-CF3-Ph CH N - 141-143
rrolidin-1- I
5 4-CF3-pipéridin-lyl Ph CH CH - 146-148
Les composés selon l'invention présentent de façon surprenante un effet
inhibiteur sur
l'enzyme MGL (monoacyl glycerol lipase). L'enzyme MGL catalyse l'hydrolyse de
dérivés
endogènes d'esters monoglycérides de différents acides gras (FEBS Letters
1998, 429,
152-156) et en particulier l'hydrolyse du 2-arachidonoylglycérol (2-AG) et du
1(3)-
arachidonoylglycérol (1(3)-AG) (J. Biol. Chem. 1987, 272 (48), 27218-27223;
Proc. Natl.
Acad. Sci. USA 2002, 99 (16), 10819-10824; Biochem. Pharmacol. 2004, 67, 1381-
1387; Mol. Pharmacol. 2004, 66 (5), 1260-1264). Les dérivés 2-AG et 1-(3)-AG
en
particulier interagissent avec les récepteurs cannabinoïdes (J. Biol. Chem.
1999, 274 (5),
2794-2801 ; J. Biol. Chem. 2000, 275 (1), 605-612 ; British. J. Pharmacol.
2001, 134,
664-672).
Les composés de l'invention bloquent cette voie de dégradation et augmentent
les
taux tissulaires de ces dérivés et en particulier du 2-AG et/ou du 1(3)-AG. A
ce titre, ils
peuvent être utilisés dans la prévention et le traitement de pathologies dans
lesquelles
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
9
sont impliqués le 2-AG et/ou le 1(3)-AG en particulier et/ou tout autre
substrat métabolisé
par l'enzyme MGL (Progress Lipid Research 2006, 45, 405-446).
Les composés selon l'invention peuvent également avoir de façon additionnelle
un effet
inhibiteur sur l'enzyme FAAH (Fatty Acid Amide Hydrolase). L'enzyme FAAH
(Chemistry
and Physics of Lipids, (2000), 108, 107-121) catalyse l'hydrolyse de dérivés
endogènes
d'amides et d'esters de différents acides gras tels que la N-
arachidonoyléthanolamine
(anandamide), la N-palmitoyléthanolamine, la N-oléoyléthanolamine ou
l'oléamide. Ces
dérivés exercent différentes activités pharmacologiques en interagissant,
entre autres,
avec les récepteurs cannabinoïdes et vanilloïdes.
Les composés de l'invention bloquent cette voie de dégradation et augmentent
le taux
tissulaire de ces substances endogènes. Ils peuvent être utilisés à ce titre
dans la
prévention et le traitement des pathologies dans lesquelles les cannabinoïdes
endogènes
et/ou tout autre substrat métabolisé par l'enzyme FAAH, sont impliqués.
Des essais ont consisté à mesurer l'activité in vitro des composés de
l'invention sur
l'enzyme MGL.
L'activité inhibitrice a été mesurée dans un test radio-enzymatique basé sur
la mesure du
produit d'hydrolyse du 2-Oléoyl Glycérol ([3H] 2-OG) par la MGL. Les produits
d'hydrolyse du [3H] 2-OG, marqué sur le glycérol, sont l'acide olëique et le
[3H]glycérol et
la source d'enzyme MGL est un homogénat de cerveau de souris où le cervelet et
le
bulbe rachidien ont été éliminés. Les cerveaux de souris sont prélevés,
stockés à-80 C
jusqu'à leur utilisation ou homogénéisés immédiatement 2 fois 5 secondes à
l'aide de
l'appareil Precellys à 5000 rpm (Bertin) dans un tampon Tris-HCI 10 mM, NaCI
l5OmM,
EDTA lmM (pH8) à 4 C. La concentration des homogénats est ensuite ajustée à
7,5
pg/pL.
La gamme de dilution des composés est réalisée à partir de solutions stocks à
20
mM en 100 % DMSO. La première dilution de cette gamme est réalisée en 100 %
DMSO
puis la deuxième dans le tampon de réaction enzymatique (50 mM phosphate, BSA
0,1
%) aboutissant à la réalisation d'une gamme de concentration 10 fois
concentrée. Les
composés à tester sont préincubés à la concentration choisie pendant 20
minutes avec la
préparation d'homogénat de cerveaux de souris. La concentration finale de DMSO
dans
la réaction enzymatique n'excède pas 0,1%.
Le dosage de l'activité MGL est réalisée en microplaque 96 puits dans un
volume
réactionnel final de 100 pL. Brièvement, 75 pg de protéines, préincubés avec
les
composés à tester, sont dilués dans 50 mM de tampon phosphate contenant 0,1 %
de
BSA et incubés, pendant 20 minutes à température ambiante, en présence de 50
pM de
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
2-OG contenant une quantité de [3H] 2-OG de 0,027 pCi/puits (Activité
spécifique de 20
Ci/mmole). La réaction est arrêtée et les produits formés sont séparés par
l'addition et le
mélange de 100 pL de chloroforme/méthanol (1/1). Après 10 minutes d'agitation,
la
microplaque est centrifugée pendant 15 minutes à 4000g et un aliquot de 30 pL
de la
5 phase aqueuse contenant le [3H]glycérol produit est prélevé puis compté
pendant 5
minutes par scintillation liquide (Wallac 1450 Microbeta).
L'activité inhibitrice vis à vis de MGL est donnée par la concentration qui
inhibe 50% de
l'activité de MGL.
10 Dans ces conditions, les composés les plus actifs de l'invention présentent
une C150
(concentration inhibant de 50% l'activité enzymatique contrôle de la MGL)
comprise entre
0,001 et 0,1 PM.
Par exemple, le composé n 1 a montré une C150 de 0,004 pM.
Des essais ont consisté à mesurer l'activité in vitro des composés de
l'invention sur
l'enzyme FAAH.
L'activité inhibitrice a été mesurée dans un test radioenzymatique basé sur la
mesure du produit d'hydrolyse (éthanolamine [1-3H]) de l'anandamide par la
FAAH (Life
Science (1995), 56, 1999-2005 et Journal of Pharmacology and Experimented
Therapeutics (1997), 283, 729-734). Les produits d'hydrolyse de l'[3H]
anandamide,
marqué sur l'éthanolamine, sont l'acide arachidonique et l'[3H] éthanolamine
et la source
d'enzyme FAAH est un homogénat de cerveau de souris où le cervelet et le bulbe
rachidien ont été éliminés. Les cerveaux de souris sont prélevés, stockés à-80
C jusqu'à
leur utilisation ou homogénéisés immédiatement 2 fois 5 secondes à l'aide de
l'appareil
Precellys à 5000 rpm (Bertin) dans un tampon Tris-HCI 10 mM, NaCi l5OmM, EDTA
lmM (pH8) à 4 C. La concentration des homogénats est ensuite ajustée à une
concentration de 20 pg/pL.
La gamme de dilution des composés est réalisée à partir de solutions stocks à
20
mM en 100 % DMSO. La première dilution de cette gamme est réalisée en 100 %
DMSO
puis la deuxième dans le tampon de réaction enzymatique (Tris-HCI 10 mM, NaCI
l5OmM, EDTA lmM (pH8), BSA 0,1 %) aboutissant à la réalisation d'une gamme de
concentration 10 fois concentrée. Les composés à tester sont préincubés à la
concentration choisie pendant 20 minutes avec la préparation d'homogénat de
cerveaux
de souris. La concentration finale de DMSO dans la réaction enzymatique
n'excède pas
0,1%.
Le dosage de l'activité FAAH est réalisée en microplaque 96 puits dans un
volume réactionnel final de 70 pL. Brièvement, 200 pg d'homogénat de cerveau
de
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
11
souris, préincubés avec les composés à tester, sont dilués dans Tris-HCI 10
mM, NaCI
150mM, EDTA lmM (pH8) contenant 0,1 % de BSA et incubés, pendant 20 minutes à
température ambiante, en présence de 10 pM d'anandamide contenant une quantité
de
[3H]-anandamide de 0,01 pCi/puits (Activité spécifique de 60 Ci/mmole). La
réaction est
arrêtée et les produits formés sont séparés par l'addition et le mélange de
140 pL de
chloroforme/méthanol (2/1). Après 10 minutes d'agitation, la microplaque est
centrifugée
pendant 15 minutes à 4000g et un aliquot de 30 pL de la phase aqueuse
contenant
l'[3H]éthanolamine produit est prélevé puis compté pendant 5 minutes par
scintillation
liquide (Wallac 1450 Microbeta).
Dans ces conditions, les composés les plus actifs de l'invention présentent
une C150
(concentration inhibant de 50% l'activité enzymatique contrôle de la FAAH)
comprise
entre 0,001 et 0,1 pM.
Par exemple, le composé n 1 a montré une C150 de 0,01 pM.
Il apparaît donc que les composés selon l'invention ont une activité
inhibitrice sélective
vis-à-vis de MGL ou mixte vis-à-vis de MGL et FAAH.
Les composés selon l'invention peuvent donc être utilisés pour la préparation
de
médicaments, en particulier de médicaments inhibiteurs de l'enzyme MGL ou des
enzymes MGL et FAAH.
Ainsi, selon un autre de ses aspects, l'invention a pour objet des médicaments
qui
comprennent un composé de formule (I), ou un sel d'addition de ce dernier à un
acide
pharmaceutiquement acceptable, ou encore un hydrate ou un solvate du composé
de
formule (I).
Ces médicaments trouvent leur emploi en thérapeutique, notamment dans le
traitement
et la prévention de :
la douleur notamment les douleurs aiguës ou chroniques de type neurogène :
migraine, douleurs neuropathiques incluant les formes associées au virus de
l'herpès et
au diabète ;
les douleurs aiguës ou chroniques associées aux maladies inflammatoires :
arthrite, arthrite rhumatoïde, ostéoarthrite, spondylite, goutte, vascularite,
maladie de
Crohn, syndrome du colon irritable ;
les douleurs aiguës ou chroniques périphériques ;
les vertiges, les vomissements, les nausées en particulier celles consécutives
à
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
12
une chimiothérapie ;
les troubles du comportement alimentaire en particulier les anorexies et
cachexies de diverses natures ;
le syndrome métabolique et ses manifestations, incluant l'obésité ;
les dyslipidémies et leurs manifestations, incluant l'athérosclérose et les
maladies
coronariennes ;
les pathologies neurologiques et psychiatriques : tremblements, dyskinésies,
dystonies, spasticité, comportements compulsifs et obsessionnels, syndrome de
Tourette, toutes les formes de dépression et d'anxiété de toute nature et
origine, troubles
de l'humeur, psychoses ;
les maladies neuro-dégénératives aiguës et chroniques : maladie de Parkinson,
maladie d'Alzheimer, démence sénile, chorée de Huntington, lésions liées à
l'ischémie
cérébrale et aux traumatismes crâniens et médullaires, la sclérose latérale
amyotrophique ;
l'épilepsie ;
les troubles du sommeil incluant les apnées du sommeil ;
les maladies cardiovasculaires en particulier hypertension, arythmies
cardiaques,
artériosclérose, crise cardiaque, ischémies cardiaques ;
l'ischémie rénale ;
les cancers : tumeurs bénignes de la peau, papillomes et tumeurs cérébrales,
tumeurs de la prostate, tumeurs cérébrales (glioblastomes, médullo-
épithéliomes,
médulloblastomes, neuroblastomes, tumeurs d'origine embryonnaires,
astrocytomes,
astroblastomes, épendyomes, oligodendrogliomes, tumeur du plexus,
neuroepithéliomes,
tumeur de l'épiphyse, épendymoblastomes, méningiomes malins, sarcomatoses,
mélanomes malins, schwénnomes) ;
les désordres du système immunitaire, notamment les maladies auto-immunes :
psoriasis, lupus érythémateux, maladies du tissu conjonctif ou connectivites,
syndrome
de Sjôgren's, spondylarthrite ankylosante, spondylarthrite indifférenciée,
maladie de
Behcet's, anémies auto-immunes hémolytiques, sclérose en plaques, sclérose
latérale
amyotrophique, amyloses, rejet de greffes, maladies affectant la lignée
plasmocytaire ;
les maladies allergiques : l'hypersensibilité immédiate ou retardée, rhinites
ou
conjonctivites allergiques, dermatites de contact ;
les maladies infectieuses parasitaires, virales ou bactériennes : SIDA,
méningites ;
les maladies inflammatoires, notamment les maladies articulaires : arthrite,
arthrite
rhumatoïde, ostéoarthrite, spondylite, goutte, vascularite, maladie de Crohn,
syndrome
du colon irritable ;
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
13
l'ostéoporose ;
les affections oculaires : hypertension oculaire, glaucome ;
les affections pufmonaires : maladies des voies respiratoires, bronchospasmes,
toux, asthme, bronchite chronique, obstruction- chronique des voies
respiratoires,
emphysème ;
les maladies gastro-intestinales: syndrome du colon irritable, désordres
inflammatoires intestinaux, ulcères, diarrhées ;
l'incontinence urinaire et l'inflammation vésicale.
Selon un autre de ses aspects, la présente invention concerne des compositions
pharmaceutiques comprenant, en tant que principe actif, un composé selon
l'invention.
Ces compositions pharmaceutiques contiennent une dose efficace d'au moins un
composé selon l'invention, ou un sel pharmaceutiquement acceptable, un hydrate
ou
soivate dudit composé, ainsi qu'au moins un excipient pharmaceutiquement
acceptable.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration souhaité, parmi les excipients habituels qui sont connus de
l'Homme du
métier.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration
orale, sublinguale, sous-cutanée, intramusculaire, intra-veineuse, topique,
locale,
intratrachéale, intranasale, transdermique ou rectale, le principe actif de
formule (i)
ci-dessus, ou son sel, solvate ou hydrate éventuel peut être administré sous
forme
unitaire d'administration, en mélange avec des excipients pharmaceutiques
classiques,
aux animaux et aux êtres humains pour la prophylaxie ou le traitement des
troubles ou
des maladies ci-dessus.
Les formes unitaires d'administration appropriées comprennent les formes par
voie orale
telles que les comprimés, les gélules molles ou dures, les poudres, les
granules et les
solutions ou suspensions orales, les formes d'administration sublinguale,
buccale,
intratrachéale, intraoculaire, intranasale, par inhalation, les formes
d'administration
topique, transdermique, sous-cutanée, intramusculaire ou intraveineuse, les
formes
d'administration rectale et les implants. Pour l'application topique, on peut
utiliser les
composés selon l'invention dans des crèmes, gels, pommades ou lotions.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention sous
forme de comprimé peut comprendre les composants suivants :
CA 02683929 2009-10-14
WO 2008/145839 PCT/FR2008/000532
14
Composé selon l'invention 50,0 mg
Mannitol 223,75 mg
Croscarmellose sodique 6,0 mg
Amidon de maïs 15,0 mg
Hydroxypropyl-méthylcellulose 2,25 mg
Stéarate de magnésium 3,0 mg
La présente invention, selon un autre de ses aspects, concerne également une
méthode
de traitement des pathologies ci-dessus indiquées qui comprend
l'administration, à un
patient, d'une dose efficace d'un composé selon l'invention, ou un de ses sels
pharmaceutiquement acceptables ou hydrates ou solvates.