Note: Descriptions are shown in the official language in which they were submitted.
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
1
Uitilisation de 4-phenyl-imidazole-2-thiones comme inhibiteurs de la
tyrosinase, pour la préparation de compositions pharmaceutiques ou
cosmétiques destinées au traitement ou à la prévention des désordres
pig mentai res
L'invention se rapporte à l'utilisation de composés 4-phényle-imidazole-2-
thiones
comme inhibiteurs de la tyrosinase pour la préparation de compositions
pharmaceutiques ou cosmétiques destinées au traitement ou la prévention des
désordres pigmentaires.
La pigmentation de la peau, notamment humaine, résulte de la synthèse de
mélanine
par les cellules dendritiques, les mélanocytes. Les mélanocytes contiennent
des
organelles appelés mélanosomes qui transfèrent la mélanine dans les couches
supérieures de kératinocytes qui sont alors transportés à la surface de la
peau par la
différentiation de l'épiderme. (Gilchrest BA, Park HY, Eller MS, Yaar M,
Mechanisms
of ultraviolet light-induced pigmentation. Photochem Photobiol 1996; 63 : 1-10
;
Hearing VJ, Tsukamoto K, Enzymatic control of pigmentation in mammals. FASEB J
1991; 5 : 2902-2909).
Parmi les enzymes de la mélanogenèse, la tyrosinase est une enzyme clé qui
catalyse les deux premières étapes de la synthèse de mélanine. Des mutations
homozygotes de la tyrosinase provoquent un albinisme oculocutané de type I
caractérisé par une totale absence de synthèse de mélanine. (Toyofuku K, Wada
I,
Spritz RA, Hearing VJ, The molecular basis of oculocutaneous albinism type 1
(OCA1) : sorting failure and degradation of mutant tyrosinases results in a
lack of
pigmentation. Biochem J 2001; 355: 259-269).
Pour traiter les désordres de la pigmentation résultant d'un accroissement de
la
production de mélanine pour lesquels il n'existe pas de traitement répondant à
toutes
les attentes des patients et des dermatologues il s'avère important de
développer de
nouvelles approches thérapeutiques
La plupart des composés éclaircissants de la peau déjà connus sont des
phénols/catéchols. Ces composés inhibent la tyrosinase mais la majorité
d'entre eux
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
2
sont cytotoxiques envers les mélanocytes par la formation de quinones. Cet
effet
toxique risque de provoquer une dépigmentation permanente de la peau.
Or, la Demanderesse a maintenant découvert de manière inattendue et
surprenante
que certains 4-phenyl-imidazole-2-thiones déjà connus dans l'art antérieur
présentent une très bonne activité inhibitrice de l'enzyme tyrosinase et une
très faible
cytotoxicité.
Ces composés trouvent des applications en médecine humaine, notamment en
dermatologie, et dans le domaine de la cosmétique.
Parmi les dérivés imidazole-2-thiones déjà connus, certains ont été décrits
comme
ayant des propriétés anti-inflammatoires (S. maeda, M. suzuki, T. Iwasaki, K.
Matsumoto, Y. Iwazawa, Chem. Pharm. Bull. 1984, 32, 7, 2536-2543).
D'autres ont été rapportés dans le brevet US4798843 pour être des inhibiteurs
de la
dopamine-beta-hydroxylase. Les composés décrits dans ce brevet sont efficaces
pour prévenir des ulcères gastriques.
D'autres imidazole-2-thiones sont également décrits comme intermédiaires
réactionnels dans la synthèse d'antagonistes du récepteur H3 (M. Mor, F.
Bordi, C.
Silva, S. Rivara, P. Crivori, P. V. Plazzi, V. Ballabeni, A. Caretta, E.
Barocelli, M.
lmpicciatore, P.-A. Carrupt, and B. Testa J. Med. Chem. 1997, 40, 2471-2578).
D'autres encore ont été décrits dans le brevet W02006019962 comme modulateurs
de TLR et TNF-alpha. Dans ce brevet, les composés revendiqués sont utilisés
dans
le traitement de l'IBD (inflammatory bowel disease) et des pathologies gastro-
intestinales.
Le brevet EP131973 enseigne également l'utilisation de certains composés
dérivés
d'imidazole-2-thiones comme inhibiteurs de la sécrétion d'acide gastrique
utiles dans
le traitement contre les ulcères
Le brevet JP05132422 divulgue l'utilisation de certains imidazole-2-thiones
comme
inhibiteur de la tyrosinase. Toutefois, aucun dérivé d'imidazole-2-thiones
substitué en
4 par un aryle n'est décrit dans ce document. Aucune activité inhibitrice de
la
tyrosinase n'est montrée pour des composés de structure 4-aryle-imidazole-2-
thione.
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
3
Or, la demanderesse a trouvé de façon inattendue et surprenante que certains
composés de structure 4-phenyl-imidazole-2-thione, objet de la présente
invention,
présentent une activité inhibitrice de la tyrosinase largement supérieure à
celle des
composés du brevet JP05132422.
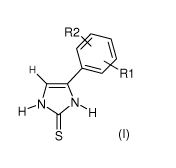
Ainsi, la présente invention concerne l'utilisation des composés de formule
générale
(I) suivante pour la préparation d'une composition pharmaceutique destinée au
traitement ou à la prévention des désordres pigmentaires.:
R2
nRl
H H'N y N`I H
S (I)
avec R1 et R2, identiques ou différents, représentent
- un hydrogène,
- un radical alkyle en C1-C7,
- un radical hydroxymethyl, trifluoromethoxy, difluoromethoxy ou
trifluoromethyl,
- un radical cycloalkyle en C3-C7, un des atomes de carbone du cycle pouvant
éventuellement être remplacé par un atome d'oxygène, ou de soufre,
- un radical cycloalkylalkyle en C4-C9,
- un groupement morpholinyl, thiomorpholinyl, piperazinyl, N-
methylpiperazinyl,
- un carboxy,
- un alkoxy C1-C4 carbonyle,
- un alkoxy C1-C6, ou
- un halogène,
avec la condition que lorsque R2 est en position ortho par rapport à R1, alors
R1 et
R2, identiques ou différents, représentent un radical alkyle en C1-C5, ou
forment un
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
4
cycle hydrocarboné à 5 ou 6 atomes, étant entendu que 1 ou 2 atome(s) de
carbone
dudit cycle hydrocarboné peuvent éventuellement être remplacés par 1 ou 2
atome(s) d'oxygène,
ainsi que les sels des composés de formule (I) et leurs formes tautomères.
Les formes tautomères peuvent être représentées de la manière suivante
R2 R2 R2 \
H R1 H R1 H - R1
H-N Ix` 'N-H ~ H-N` / N NN, H
SI IYS, H H'S
(I) (la) (Ib)
Parmi les sels d'addition des composés de formule générale (I) avec un acide
pharmaceutiquement acceptable, on peut citer de préférence les sels avec un
acide
organique ou avec un acide inorganique.
Les acides inorganiques appropriés sont par exemple les acides halohydriques
comme l'acide chlorhydrique ou l'acide bromhydrique, l'acide sulfurique,
l'acide
nitrique.
Les acides organiques appropriés sont par exemple l'acide picrique, l'acide
méthane
sulfonique, l'acide éthane sulfonique, l'acide trifluorométhane-sulfonique.
Les composés de formule générale (I), peuvent également exister sous formes
d'hydrates ou de solvates avec de l'eau ou avec un solvant.
Les solvants appropriés pour former des solvates ou des hydrates sont par
exemple
les alcools comme l'éthanol ou l'isopropanol ou l'eau.
Selon la présente invention, on désigne par cycloalkyle en C3-C7 une chaîne
hydrocarbonée saturée, cyclique, comprenant de 3 à 7 atomes de carbone. De
préférence, le radical cycloalkyle en C3-C7 est choisi parmi les radicaux
cyclopropyle, cyclobutyle, cyclopentyle, cyclohexyle et cycloheptyle.
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
Selon la présente invention, on désigne par alkyle en C1-C7 une chaîne
hydrocarbonée saturée, linéaire ou ramifiée, comprenant de 1 à 7 atomes de
carbone. De préférence, le radical alkyle en C1-C7 est choisi parmi les
radicaux
méthyle, éthyle, propyle, i-propyle, butyle, t-butyle, pentyle, hexyle et
heptyle.
Selon la présente invention, on désigne par cycloalkylalkyle en C4-C9 une
chaîne
hydrocarbonée saturée, linéaire ou ramifiée, substituée par un radical
cycloalkyle et
comprenant de 4 à 9 atomes de carbone. De préférence, le radical
cycloalkylalkyle
en C4-C9 est choisi parmi les radicaux cyclopropylméthyle, cyclopropylethyle,
cyclobutylmethyle, cyclobutylethyle, cyclopentylmethyle, cyclopentylethyle,
cyclohexylmethyle, cyclohexylethyle,
Selon la présente invention, on désigne par alkoxy C1-C4 carbonyle un radical
carboxy substitué par un radical alkyle comprenant de 1 à 4 atomes de carbone.
De
préférence, le radical alkoxy C1-C4 carbonyle est choisi parmi les radicaux
méthoxycarbonyle, éthoxycarbonyle, propoxycarbonyle et butoxycarbonyle
Selon la présente invention, on désigne par alkoxy C1-C6 un atome d'oxygène
substitué par une chaîne hydrocarbonée saturée, linéaire ou ramifiée,
comprenant de
1 à 6 atomes de carbone. De préférence, le radical alkoxy C1-C6 est choisi
parmi les
radicaux méthoxy, éthoxy, propoxy, butoxy, pentoxy et hexyloxy.
Selon la présente invention on désigne par halogène un atome de fluor, de
chlore ou
de brome.
Selon la présente invention, les composés de formule générale (I) préférés
sont ceux
pour lesquels R1 et R2, identiques ou différents, représentent un hydrogène ou
un
radical alkyle en C1-C7 ou un radical cycloalkyle en C3-C7.
Selon la présente invention, les composés de formule générale (I)
particulièrement
préférés sont ceux pour lesquels:
- R2 représente un hydrogène et
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
6
- R1 représente un hydrogène ou un radical alkyle en C1-C7 ou un radical
cycloalkyle en C3-C7.
Parmi les composés de formule (I) entrant dans le cadre de la présente
invention, on
peut notamment citer les suivants :
1. 4-phenyl-1,3-dihydro imidazole-2-thione : RN6857-34-7
2. chlorhydrate de 4-phenyl-1,3-dihydro imidazole-2-thione: RN93168-73-1
3. 4-(4-methoxyphenyl)-1,3-dihydro imidazole-2-thione : RN10486-41-6
4. 4-(3-bromophenyl)-1,3-dihydro imidazole-2-thione : RN192800-59-2
5. 4-(4-bromophenyl)-1,3-dihydro imidazole-2-thione : RN 436095-86-2
6. 4-(2-fluorophenyl)-1,3-dihydro imidazole-2-thione : RN93103-13-0
7. 4-(3-fluorophenyl)-1,3-dihydro imidazole-2-thione : RN93103-14-1
8. 4-(4-fluorophenyl)-1,3-dihydro imidazole-2-thione : RN93103-15-2
9. 4-(2-chlorophenyl)-1,3-dihydro imidazole-2-thione : RN93103-16-3
10.4-(3-chlorophenyl)-1,3-dihydro imidazole-2-thione : RN93103-17-4
11.4-(4-chlorophenyl)-1,3-dihydro imidazole-2-thione : RN93103-18-5
12.4-(4-butoxyphenyl)-1,3-dihydro imidazole-2-thione : RN192800-50-3
13.4-(4-methylphenyl)-1,3-dihydro imidazole-2-thione : RN93103-19-6
14.4-(4-trifluoromethylphenyl)-1,3-dihydro imidazole-2-thione : RN38575-47-2
15.4-(4-isopropylphenyl)-1,3-dihydro imidazole-2-thione : RN93103-20-9
16.4-(4-propylphenyl)-1,3-dihydro imidazole-2-thione : RN192800-52-5
17.4-(4-tertbutylphenyl)-1,3-dihydro imidazole-2-thione : RN93103-21-0
18.4-(3,4-dimethoxyphenyl)-1,3-dihydro imidazole-2-thione : RN117877-37-9
19.4-(3-propyloxyphenyl)-1,3-dihydro imidazole-2-thione : RN192800-64-9
De façon avantageuse, les composés de la présente invention présentent une
valeur d'IC50 (dose inhibant 50% de l'activité enzymatique) vis-à-vis de la
tyrosinase
inférieure ou égale à 10pM et plus particulièrement inférieure ou égale à 1
M.
L'invention vise donc l'utilisation d'au moins un composé de formule générale
(I) tel
que défini ci-dessus pour la préparation d'une composition pharmaceutique ou
cosmétique dans laquelle ledit composé a une activité inhibitrice de la
tyrosinase.
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
7
L'invention concerne également un produit choisi parmi les composés de formule
(I)
pour leur utilisation dans le traitement et/ou la prévention des désordres
pigmentaires.
L'invention concerne également une méthode de traitement thérapeutique ou
cosmétique, comprenant l'administration d'une composition pharmaceutique ou
cosmétique comprenant ledit composé, en tant qu'inhibiteur de la tyrosinase.
L'invention concerne également l'utilisation d'un composé de formule générale
(I) tel
que défini ci-dessus pour la préparation d'un médicament destiné au traitement
des
désordres pigmentaires, et de préférence des désordres hyperpigmentaires.
En effet, les composés utilisés selon l'invention sont particulièrement
appropriés au
traitement et/ou à la prévention des désordres pigmentaires, et de préférence
des
désordres hyperpigmentaires tels que le melasma, le chloasma, les lentigines,
le
lentigo sénile, les hyperpigmentations irrégulières liées au photo
vieillissement, les
taches de rousseur, les hyperpigmentations post-inflammatoires dues à une
abrasion
et/ou une brûlure et/ou une cicatrice et/ou une dermatose et/ou une allergie
de
contact; les nevi, les hyperpigmentations à déterminisme génétique, les
hyperpigmentations d'origine métabolique ou médicamenteuse, les mélanomes ou
tout autre lésion hyperpigmentaire.
La présente invention a aussi pour objet une composition pharmaceutique
destinée
notamment au traitement des affections susmentionnées, et qui comprend, dans
un
support pharmaceutiquement acceptable et compatible avec le mode
d'administration retenu pour cette dernière, un composé de formule générale
(I) sous
une de ses formes tautomériques, ou un de ses sels avec un acide
pharmaceutiquement acceptable.
Par support pharmaceutiquement acceptable, on entend un milieu compatible avec
la peau, les muqueuses et les phanères.
L'administration de la composition selon l'invention peut être effectuée par
voie
topique. De préférence, la composition pharmaceutique est conditionnée sous
une
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
8
forme convenant à une application par voie topique. Par voie topique, on
entend une
administration sur la peau ou les muqueuses.
Par voie topique, la composition pharmaceutique selon l'invention est plus
particulièrement destinée au traitement de la peau et des muqueuses et peut se
présenter sous forme liquide, pâteuse, ou solide, et plus particulièrement
sous forme
d'onguents, de crèmes, de laits, de pommades, de poudres, de tampons imbibés,
de
syndets, de solutions, de gels, de sprays, de mousses, de suspensions, de
sticks, de
shampoings, ou de bases lavantes. Elle peut également se présenter sous forme
de
suspensions de microsphères ou nanosphères ou de vésicules lipidiques ou
polymériques ou de patches polymériques ou gélifiés permettant une libération
contrôlée.
Les compositions utilisées pour une application par voie topique ont une
concentration en composé selon l'invention généralement comprise entre 0,001%
et
10% en poids, de préférence entre 0,01 % et 5% en poids, par rapport au poids
total
de la composition.
Les composés de formule générale (I) selon l'invention trouvent également une
application dans le domaine cosmétique, en particulier dans la protection
contre les
aspects néfastes du soleil, pour prévenir et/ou pour lutter contre le
vieillissement
photo-induit ou chronologique de la peau et des phanères.
L'invention a donc également pour objet une composition comprenant, dans un
support cosmétiquement acceptable, au moins un des composés de formule
générale (I). Par support cosmétiquement acceptable, on entend un milieu
compatible avec la peau, les muqueuses et les phanères.
L'invention a également pour objet l'utilisation cosmétique d'un composé de
formule
(I) ou d'une composition comprenant au moins un composé de formule générale
(I)
pour prévenir et/ou traiter les signes du vieillissement cutané.
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
9
L'invention a aussi pour objet l'utilisation cosmétique d'un composé de
formule (I) ou
d'une composition comprenant au moins un composé de formule générale (I) pour
l'hygiène corporelle ou capillaire.
La composition cosmétique selon l'invention contenant, dans un support
cosmétiquement acceptable, un composé de formule générale (I), ou une de ses
formes tautomères ou un de ses sels avec un acide pharmaceutiquement
acceptable, peut se présenter notamment sous forme d'une crème, d'un lait,
d'un gel,
de suspensions de microsphères ou nanosphères ou vésicules lipidiques ou
polymériques, de tampons imbibés, de solutions, de sprays, de mousses, de
sticks,
de savons, de bases lavantes ou de shampooings.
La concentration en composé de formule générale (I) dans la composition
cosmétique est de préférence comprise entre 0,001 % et 10% en poids, par
rapport
au poids total de la composition.
Les compositions pharmaceutiques et cosmétiques telles que décrites
précédemment peuvent en outre contenir des additifs inertes, ou même
pharmacodynamiquement actifs pour ce qui concerne les compositions
pharmaceutiques, ou des combinaisons de ces additifs, et notamment :
- des agents mouillants ;
- des agents d'amélioration de la saveur ;
- des agents conservateurs tels que les esters de l'acide parahydroxybenzoïque
;
- des agents stabilisants ;
- des agents régulateurs d'humidité
- des agents régulateurs de pH ;
- des agents modificateurs de pression osmotique ;
- des agents émulsionnants
- des filtres UV-A et UV-B ;
- des antioxydants, tels que l'a-tocophérol, le butyl-hydroxy-anisole ou le
butyl-
hydroxy-toluène, la Super Oxyde Dismutase, l'Ubiquinol
- des émollients ;
- des agents hydratants comme le glycérol, le PEG 400, la thiamorpholinone, et
ses
dérivés ou l'urée ;
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
- des agents antiséborrhéiques ou antiacnéiques, tels que la S-
carboxyméthylcystéine, la S-benzyl-cystéamine, leurs sels ou leurs dérivés, ou
le
peroxyde de benzoyle ;
Bien entendu, l'homme du métier veillera à choisir le ou les éventuels
composés à
ajouter à ces compositions de telle manière que les propriétés avantageuses
attachées intrinsèquement à la présente invention ne soient pas ou
substantiellement
pas altérées par l'addition envisagée.
Il va maintenant être donné, à titre d'illustration et sans aucun caractère
limitatif,
plusieurs exemples de formulation à base de composés de formule générale (I)
ainsi
que des résultats d'activité biologique desdits composés.
Exemple 1: Test d'inhibition de l'activité tyrosinase
L'activité des inhibiteurs est mesurée à partir d'un lysat de cellules B16F1
(lignée de
mélanome murin). En présence du substrat L-tyrosine, la tyrosinase présente
dans
ces cellules catalyse l'hydroxylation de la L-tyrosine en L-DOPA puis
l'oxydation de
la L-DOPA en dopaquinone. En présence de MBTH (3-methyl-2-benzo-thiazolinone
hydrazone), la dopaquinone est piégée pour former un complexe rose qui absorbe
à
520 nm.
Les cellules B16F1 sont cultivées en milieu DMEM + 10% de sérum de veau fcetal
+
10-9 M d'aMSH pendant 4 jours à 37 C sous 7% de C02. Elles sont traitées à la
Trypsine, lavées en PBS, numérées et culottées. Le culot est repris à 10'
cellules/ml
en tampon de lyse (phosphate de sodium 10 mM pH 6.8 - Igepal 1%) et la
suspension est traitée aux ultra-sons pendant 10 secondes. Après
centrifugation 30
minutes à 4000 rpm, le surnageant obtenu constitue le lysat cellulaire utilisé
comme
source de tyrosinase dans le test enzymatique.
Les essais sont réalisés en duplicates en plaques 384 puits sous un volume
total de
50 pl. Chaque puits contient :
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
11
- 40 pl de solution contenant 1.25 mM L-tyrosine, 6.25 pM L-DOPA (cofacteur)
et
3.75 mM MBTH en tampon B (phosphate de sodium 62.25 mM pH 6.8 - 2.5%
dimethylformamide)
- 5 pl d'inhibiteur dilué en DMSO
- 5pl de lysat cellulaire dilué au'/2 en tampon Tris HCI 50 mM pH 7.5
La plaque est incubée à 37 C et une lecture spectrophotométrique est réalisée
à 520
nm après 6 heures d'incubation. Pour s'affranchir d'une absorption éventuelle
des
produits, on travaille en absorbance corrigée (absorbance au temps 6h -
absorbance
au temps zéro).
Les inhibiteurs sont testés en dose réponse pour calculer une IC50 (dose
inhibant
50% de l'activité enzymatique).
Plusieurs contrôles internes sont ajoutés dans chaque expérience
- contrôle 100% d'activité : les 5 pl d'inhibiteur sont remplacés par 5 l de
DMSO
- contrôle 50% d'activité : les 5 pl d'inhibiteur sont remplacés par 5pl de
phénylthiourée à 300 pM en DMSO
- contrôle 0% d'activité : le substrat L-tyrosine est remplacé par du tampon
B.
Les résultats obtenus pour les composés de l'invention sont présentés dans le
tableau A :
Tableau A
Nom structure Tyrosine
hydroxylase/Dopa
ox daselC50 M
H
Composé 1 S 0.25
H
N
Composé 3 H ~S 0.9
O
I
N
Br
Composé 4 ~ ~ /N~S 3
H
H
/ N
Composé 8 ~~ NS 0.3
F H
CA 02688234 2009-11-25
WO 2008/152330 PCT/FR2008/050993
12
H
N
Composé 13 S 0.5
H
Exemple 2: Formulations
Dans cet exemple, on a illustré diverses formulations concrètes à base des
composés selon l'invention.
VOIE TOPIQUE
(a) Onguent
- Composé 1 0,020 g
- Myristate d'isopropyle 81,700 g
- Huile de vaseline fluide 9,100 g
- Silice ("Aérosil 200") 9,180 g
(b) Onguent
- Composé 6 0,300 g
- Vaseline blanche codex qsp 100 g
(c) Crème Eau-dans-Huile non ionique
- Composé 1 0,100 g
- Mélange d'alcools de lanoline émulsifs, de cires
et d'huiles ("Eucerine anhydre" 39,900 g
- Parahydroxybenzoate de méthyle 0,075 g
- Parahydroxybenzoate de propyle 0,075 g
- Eau déminéralisée stérile qsp 100 g
(d) Lotion
- Composé 6 0,100 g
- Polyéthylène glycol (PEG 400) 69,900 g
- Ethanol à 95% 30,000 g