Note: Descriptions are shown in the official language in which they were submitted.
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
PROCEDE DE FONCTIONNALISATION DE LA PAROI D'UN PORE.
La présente invention a pour objet un procédé de
fonctionnalisation et plus particulièrement de bio-fonctionnalisation d'au
moins
une partie de la paroi d'un pore.
Le terme pore (ou canal ou capillaire) désigne toute cavité
débouchante ou non d'un matériau.
La structure en trois dimensions d'un pore ou d'un canal ou
d'un capillaire rend difficile sa fonctionnalisation. En effet, des techniques
couramment utilisées pour la fonctionnalisation de surfaces planes, comme la
io pulvérisation ou bien le "spotting" par exemple, deviennent difficiles,
voire
impossibles à mettre en pratique pour des pores, canaux ou capillaires, cela
étant d'ailleurs d'autant plus vrai que leur dimension diminue.
D'une manière générale, les procédés de fabrication connus
ne permettent pas ou permettent très difficilement de fonctionnaliser des
pores de manière localisée.
Afin de fonctionnaliser un pore, il est courant d'utiliser des
techniques classiques de fonctionnalisation de surface. Les plus courantes
utilisent des propriétés d'auto-assemblage des molécules sur support.
La silanisation, tout d'abord, réalise le greffage covalent
d'organosilanes à la surface de matériaux comme le verre ou le silicium. Ce
procédé consiste le plus souvent à réaliser d'abord une fonctionnalisation par
un groupement réactif qui permettra ensuite l'immobilisation de la molécule
d'intérêt (Igbal, S. et collaborateurs, "Solid-State nanopore channels with
DNA
selectivity", Nature Nanotechnology, 2007, 2: p. 243 et suivantes ; Karnik et
collaborateurs, Nano-Letters, 2007, 7(3) : p. 547 et suivantes; Kim, Y. - R.
et
collaborateurs, Biosensors & Bioelectronics, 2007. 22: p. 2926 et suivantes;
Wanunu, M. et collaborateurs, Nano-Letters, 2007, 7(6) : p. 1580 et
suivantes). Malgré son usage courant, le processus de silanisation reste
encore mal maîtrisé et réclame un contrôle des paramètres du matériau qui
3o est critique pour la fiabilité de la modification de surface et la
stabilité du
dépôt (nature des fonctions de surface, absence de contamination, rugosité
de la surface...).
La formation de monocouches auto-assemblées d'alcanes-
thiols (Lee S. B. and Martin C. R., Chemistry of Materials, 2001, 13 (10) : p.
3236 et suivantes; Smuleac V. et collaborateurs, Chemistry of Materials,
2004, 16 (14) : p. 2762 et suivantes; Jagerski et collaborateurs, Nano-
Letters,
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
2
2007, 7 (6) .: p. 1609 et suivantes) se base sur la chimisorption des
groupements thiol sur différentes surfaces métalliques comme l'or (le plus
utilisé), l'argent, le platine, le cuivre ... Cette stratégie a été mise en
pratique
afin de réaliser la fonctionnalisation des nanopores par des brins d'ADN
thiolés (Harrell, C. C. et collaborateurs, Journal of the American Chemical
Society, 2004, 126, p. 15646 et suivantes).
Un des inconvénients majeurs des techniques énoncées
précédemment est le fait que la fonctionnalisation concerne le plus souvent
non seulement le pore mais également la surface plane réactive qui l'entoure,
io partout où il y a un dépôt de solution contenant l'organosilane ou l'alcane-
thiol, sans localisation. Dans le cas des alcanes-thiol, le support est
nécessairement métallique.
Un article récent de Joakim Nilsson et collaborateurs, intitulé
"Localized Functionalization of Single Nanopores" (Advanced Materials, 2006,
18, p. 427 à 431) décrit l'utilisation d'un nano faisceau d'ions focalisé ou
nanoFlB (FIB : "Focused Ion Beam") pour la création d'un pore dans une
surface de nitrure de silicium. La gravure du pore, le dépôt d'une couche de
dioxyde de silicium sous le faisceau du faisceau FIB et une silanisation
conduisent à la création de fonctions réactives en surface permettant
l'accrochage localisé de brins d'ADN. Cependant, ce procédé est multi-étapes
et nécessite une silanisation préalable du support.
D'autres auteurs ont décrit l'immobilisation de polymères
conducteurs sur des surfaces diélectriques par le biais d'une silanisation du
support par un organosilane fonctionnalisé par un pyrrole. Des monomères
pyrrole sont ensuite ajoutés dans le milieu et la polymérisation est amorcée
grâce à un agent oxydant (Simon et collaborateurs, Journal of the American
Chemical Society, 1982, 104 : p. 2031 et suivantes; Faverolle et
collaborateurs, Chemistry of Materials, 1998. 10 : p. 740 et suivantes).
Il a également été décrit dans la littérature qu'il est possible
de fonctionnaliser des pores, dans des membranes de polycarbonate par
exemple, en faisant intervenir des entités polymérisables. Il est ainsi
possible
d'obtenir des tubes de polymère conducteur en réalisant la polymérisation
dans un cadre confiné, délimité par des barrières physiques (pore, canal...)
(Martin, C. R. et collaborateurs, Journal of the American Chemical Society,
1990, 112, p. 8976 et suivantes, Martin, C. R., Science, 1994, 266 (5193) : p.
1961 et suivantes) ou en présence d'agents externes qui structurent le milieu
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
3
de polymérisation de manière à ce qu'elle se fasse de façon orientée
(Carswell et collaborateurs Journal of the American Chemical Society, 2003,
125 : p. 14793 et suivantes; Qu et collaborateurs, Journal of Polymer
Science : Part A : Polymer Chemistry, 2004, 42: p. 3170 et suivantes).
L'application de ces structures est le plus souvent reliée à la connectique,
ce
qui conduit la plupart des auteurs, le cas échéant, à dissoudre la matrice
après création des tubes de polymère. Le pore est ici seulement un "moule",
créateur de la forme cylindrique des polymères générés, et n'a pas vocation à
être utilisé comme support actif.
Schématiquement, deux procédés différents sont connus et
utilisés : la polymérisation chimique et l'électropolymérisation.
1) Polymérisation chimique (article précité de Martin, C.R.,
Science, 1994, 266 (5193) : p. 1961 et suivantes; Martin C.R., Advanced
Materials, 1991, 3 : p. 457 et suivantes).
Un moyen d'obtenir des nanotubes de polymères est de
réaliser une polymérisation dite "chimique" d'un monomère tel que le pyrrole
couramment cité. La technique expérimentale consiste à placer une
membrane poreuse (polycarbonate ....) entre deux solutions aqueuses : une
solution contenant le monomère pyrrole et l'autre solution contenant un agent
oxydant (comme FeCI3 par exemple) qui induit la polymérisation aux points de
rencontre des deux solutions, c'est-à-dire dans les pores de la membrane.
2) Electropolymérisation (Menon, V. P. et collaborateurs,
chemistry of Material, 1996, 8: p. 2382 et suivantes; Demoustier-Champagne
et collaborateurs, European Polymer Journal, 1998, 34 (12) : p; 1767 et
suivantes).
Il s'agit dans ce cas de déposer premièrement sur un côté
d'une membrane une couche d'adhésion (du chrome par exemple) et de
déposer ensuite par-dessus une couche métallique (or). On peut alors
procéder à l'électropolymérisation du pyrrole sur cette surface grâce à une
cellule électrolytique à trois électrodes.
Ces procédés permettent d'obtenir, lors d'une des étapes, des
pores fonctionnalisés par un polymère pour obtenir des structures organisées
utilisant le pore comme "moule". Des fonctionnalisations par des biotines ont
ainsi été réalisées par Sapp et Collaborateurs (Chemistry of Materials, 1999,
11: p. 1183 et suivantes) en réalisant la polymérisation électrochimique des
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
4
monomères thiophène et pyrrole porteurs d'une fonction amine permettant le
greffage d'un dérivé de la biotine.
On notera par ailleurs que des monomères pyrrole porteurs
de biomolécules sont connus en tant que tels (notamment Demandes de
brevet français FR 2 703 359 et FR 2 720 832).
Les Demandes de Brevet FR 2 787 582 et FR 2 784 466
concernent une technique classique d'électro-polymérisation selon laquelle
une électrode est disposée au fond d'une microcuvette tronconique non
débouchante et une autre électrode dans un électrolyte, dans une position
io non spécifiée. Il n'y a pas dans ce cas de fonctionnalisation de la surface
de
la microcuvette, mais seulement de l'électrode située au fond de celle-ci. En
d'autres termes, cette technique connue ne permet de réaliser de dépôt que
sur une des électrodes.
L'invention concerne un procédé permettant de réaliser une
fonctionnalisation d'un pore localisée à sa surface, tout en simplifiant le
procédé. L'idée de base de l'invention est de générer dans le pore un gradient
de tension électrique apte à permettre un dépôt sur les parois du pore.
L'invention concerne ainsi un procédé de fonctionnalisation
d'au moins une partie de la paroi d'au moins un pore d'un matériau support
caractérisé en ce qu'il comporte :
a) mettre en contact le pore avec une solution d'entités
électroactivables et positionner deux électrodes dans ladite solution, de part
et d'autre du pore, de manière à créer à l'intérieur du pore et lorsqu'un
signal
électrique est appliqué entre les deux électrodes, une chute de tension,
notamment supérieure à 1000 V/m, apte à générer un dépôt localisé sur
ladite paroi.
b) appliquer un signal électrique, différence de potentiel ou
courant, entre les deux électrodes pour réaliser ladite fonctionnalisation.
En générant un gradient de tension élevé entre les électrodes
à l'intérieur du pore, on obtient un dépôt sur la paroi du ou des pores, et
aussi
de manière concommitante un dépôt sur l'électrode de polarisation anodique
comme observé lors d'un dépôt par électro-polymérisation classique.
Dans le cas d'un pore non débouchant, une électrode est
disposée au fond d'une cavité non débouchante ou au fond du pore. L'autre
électrode est disposée à l'extrémité du pore (d = 0) ou à distance de
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
l'extrémité du pore (d > 0), la chute de tension dans le pore étant suffisante
pour permettre un dépôt sur les parois.
Dans le cas d'un pore débouchant, les électrodes sont
disposées aux extrémités du pore (d = 0) et/ou à distance de cette extrémité
5 (d > 0), la chute de tension dans le pore étant suffisante pour permettre un
dépôt sur sa paroi.
Par exemple, le champ peut atteindre 106 V/m, voire plus.
Le signal électrique peut être constant ou bien modulé en
fonction du temps (périodique ou non, pulsé, modulé en amplitude ou en
io fréquence, en escalier, en rampe, etc...).
Le support n'est pas nécessairement conducteur. Nul besoin
de tapisser l'intérieur des pores d'une couche conductrice comme décrit pour
l'électropolymérisation, ce qui simplifie grandement la démarche
expérimentale. L'électropolymérisation est réalisée "à distance" avec des
électrodes situées de part et d'autre de la surface à fonctionnaliser. On
comprendra que l'expression "de part et d'autre du pore" inclut le cas où d =
0. Le support, constitué de matériau organique ou inorganique, peut être de
nature isolante, semi-conductrice ou conductrice.
L'électropolymérisation à distance ne nécessite pas la
présence d'un agent chimique oxydant.
Le procédé d'électropolymérisation à distance est réalisable
en une seule étape de manipulation.
La formation préférentielle du polymère sur tout ou partie de
la paroi du pore peut s'expliquer par le fait que, un signal électrique étant
appliqué de part et d'autre du pore, la chute de tension qu'il produit est
principalement localisée à l'intérieur du pore d'où un fort gradient de
potentiel
induisant une formation préférentielle du polymère.
Le procédé peut comporter au moins une itération de a et de
b avec une deuxième solution d'entités électroactivables. Ces entités peuvent
être les mêmes ou avantageusement des entités différentes, ce qui permet
notamment de disposer des couches déposées les unes sur les autres ou
côte à côte.
Selon une première variante, le pore est ouvert à ses deux
extrémités et une solution est placée dans deux compartiments dans chacun
desquels débouche une extrémité du pore, au moins un des deux
compartiments contenant lesdites entités électroactivables.
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
6
Selon une deuxième variante, le pore présente une seule
extrémité débouchante et une des deux électrodes est placée au fond du
pore, l'autre électrode étant placée dans un compartiment en communication
avec l'extrémité débouchante du pore.
Après b, il peut être prévu un rinçage.
Le matériau support peut être à base de silicium.
Les entités électroactivables peuvent être des monomères
électropolymérisables, notamment des monomères conducteurs pi-
conjugués, de préférence un pyrrole, ou bien être porteuses de fonctions
io électrogreffables, notamment les groupements de diazonium, ou bien encore
être choisies parmi les métaux, les oxydes métalliques, les particules
catalytiques, les sels et les complexes métalliques ou être constituées par
une peinture électrophorétique.
La solution d'entités électroactivables peut comporter des
ligands.
La solution d'entités électroactivables peut comporter un
mélange d'entités électroactivables, notamment un monomère
électropolymérisable et desdites entités électroactivables couplées à des
ligands, par exemple greffées avec un oligonucléotide.
En particulier, la solution peut présenter une sonde
oligonucléotidique (pyrrole-oligonucléotide), ou plus généralement du pyrrole
couplé à une biomolécule.
La solution d'entités électroactivables peut inclure des ions
dopants d'intérêt, notamment l'héparine et/ou la chondroitine..
Le matériau support peut être à base de silicium.
Le signal électrique peut être une tension comprise entre
10 mV et 500 V et de préférence entre 100 mV et 10 V. Le critère à respecter
est que le champ à l'intérieur du pore soit suffisant pour générer un dépôt
sur
sa paroi. La différence de tension peut être appliquée pendant une durée
comprise entre 10 s et 100 s et plus particulièrement entre 10 ms et 100 s,
par exemple sous forme d'une d'impulsion. Le temps d'application de la
tension détermine l'épaisseur du dépôt.
La concentration en entités électroactivables peut s'étendre
dans une large gamme, à savoir entre 1 nM et 500 mM.
Le procédé peut présenter une étape de détachement des
entités électroactivables du support, par exemple par destruction de ce
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
7
dernier ou sous l'action d'ultrasons. Le support peut présenter au moins une
région de fonctionnalisation évasée (comportant ou non des paliers) qui
prolonge la paroi d'un pore.
Les entités électroactivables peuvent comporter des
molécules sondes, et le procédé peut comporter une étape d'association par
reconnaissance notamment d'hybridation avec des molécules cibles
complémentaires.
Le procédé peut ensuite comporter une étape de dénaturation
de ladite association par reconnaissance, éventuellement suivie d'une étape
io de nouvelle association par reconnaissance, notamment de réhybridation.
Le procédé permet ainsi l'association par affinité d'une entité
d'intérêt et permet la fabrication d'assemblages moléculaires.
D'autres caractéristiques et avantages de l'invention
apparaîtront mieux à la lecture de la description ci-après, en liaison avec
les
dessins dans lesquels :
- la figure 1 est un schéma de principe illustrant le procédé
selon l'invention,
- les figures 2a à 2c représentent une cellule destinée à
recevoir une puce présentant un pore (montage a),
- les figures 3 et 4 illustrent un montage adopté à une puce
multi-pores, la figure 4 en étant un détail relatif au pore Pl dans les
conditions
d'expérience,
- la figure 5 illustre le format du test de fluorescence utilisé
pour valider la fonctionnalisation des pores
- les figures 6, 7, 8a et 8b représentent différents profils de
pores mis en oeuvre dans les exemples.
- et les figures 9a et 9b représentent deux exemples de profils
de pores non débouchants.
La présente invention est relative à un procédé de
fonctionnalisation de la surface d'un pore par une entité organique ou
inorganique, en particulier par un polymère, qui a été générée électriquement
grâce à l'application d'un signal électrique, notamment une différence de
potentiel électrique de part et d'autre du pore. Il permet de réaliser une
fonctionnalisation de pores ou de canaux quelle que soit leur taille (par
exemple de diamètre compris entre 1 nm et 5 mm), en particulier des pores
ou des canaux de dimension micrométrique et/ou nanométrique, par :
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
8
- des groupements actifs permettant des interactions de faible
énergie comme par exemple :
. des charges de surface
.des groupements de reconnaissance moléculaire ou
biomoléculaire, tels que par exemple des biomolécules, des groupements
chimiques réactifs ou encore des chélateurs d'ions.
- des entités organiques ou inorganiques notamment dans le
but de réduire le diamètre d'ouverture du pore.
On entend par le terme "pore" ou "canal" ou "capillaire" toute
io cavité, débouchante ou non, se trouvant dans un matériau. Leur distribution
spatiale sur le support peut être définie (cas d'une membrane usinée par
exemple) ou statistique (cas typique d'un fritté). L'invention concerne toute
taille de pore.
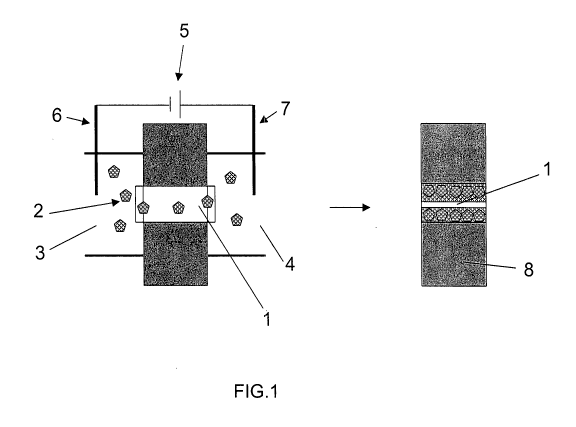
Un pore 1 (figure 1) est placé entre deux compartiments 3 et
4 étanches contenant une solution 2 d'entités électroactivables qui baigne
également le pore 1. Une différence de potentiel par exemple 2 V est
appliquée par une source de tension 5 entre deux électrodes 6 et 7 disposées
de part et d'autre du pore 1, à une distance de quelques millimètres l'une de
l'autre.
L'entité électroactivable peut être choisie notamment parmi :
- Des monomères électropolymérisables tels les pyrroles, les
thiophènes, les indoles, les anilines, les azines, les phénylènevinylènes, les
phénylènes, les pyrènes, les furanes, les sélénophènes, les pyrridazines, les
carbazoles, les acrylates, les méthacrylates et leurs dérivés. De préférence,
le
motif électropolymérisable est un pyrrole. Ce monomère est facilement
fonctionnalisable par une entité d'intérêt. De plus, le polypyrrole est un
polymère biocompatible, stable à l'air et en solution à pH physiologique, ce
qui constitue un atout dans le cadre d'une application dans le domaine des
biocapteurs,
- Des dérivés porteurs de fonctions électrogreffables telles les
groupements diazonium,
- Les métaux et oxydes métalliques, par exemple l'oxyde
d'iridium, les particules catalytiques, les sels et les complexes métalliques
- Les peintures électrophorétiques.
Le support poreux peut être de nature organique et/ou
inorganique et indifféremment conducteur, semi-conducteur ou isolant
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
9
électrique. On utilise de préférence des matériaux semi-conducteurs comme
le silicium ou ses dérivés oxyde et nitrure.
Dans l'exemple I ci-après, le monomère utilisé est le pyrrole.
En effet, le polypyrrole est un polymère qui présente l'avantage d'être
biocompatible et est donc très intéressant pour élaborer des biocapteurs. Il
possède également l'atout d'être stable dans les conditions de manipulation
des tests biochimiques (pH physiologique, tampons aqueux, présence
d'oxygène ...). Il s'agit également d'un polymère conducteur qui présente un
caractère hydrophile permettant son utilisation dans des systèmes
io biologiques. De plus chimiquement, la synthèse de conjugués pyrrole-
biomolécule est très bien maîtrisée et se fait avec un bon rendement.
Le polypyrrole, le polycarbazole, la polyaniline, le PEDOT, le
polyindole, et le polythiophène appartiennent au groupe des polymères
conducteurs pi-conjugués.
II est connu que les monomères correspondants sont
électropolymérisables, à savoir qu'ils conduisent à la formation d'un polymère
sous l'effet de l'application d'un potentiel anodique à la surface d'une
électrode. Ces entités se comportent donc de la même manière en tenant
compte de conditions de solvant et d'oxydation qui ne sont pas identiques
d'une entité à une autre.
POLYPYRROLE - MISE EN OEUVRE DES EXEMPLES
1. - Matériel
A) Réactifs et consommables :
Le pyrrole est aliquoté à une concentration de 1 M en solvant
acétonitrile puis conservé à -20 C. Le pyrrole porteur d'un oligonucléotide a
été préparé selon le protocole décrit dans la Demande de Brevet
FR 2 703 359.
Les séquences ADN utilisées sont les suivantes :
Py-sondeZip6: Py5'-(T)1o- GAC CGG TAT GCG ACC TGG TAT GCG3'
(Py-SEQ ID NO. 1)
. Cible-Zip6-bio: biotine-5' CGC ATA CCA GGT CGC ATA CCG GTCY
(biotine-SEQ ID NO. 2)
Les puces utilisées sont des membranes d'oxyde de silicium
ou de nitrure de silicium. Elles comportent neuf pores de taille micrométrique
répartis sur une surface de 2x2 cm2.
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
B) Tampons utilisés (donnés à titre indicatif) :
. Tampon d'électropolymérisation : 6g/L Na2HPO4/NaH2PO4,
2,9 g/L NaCI, 10 % v/v glycérol, 2% v/v acétonitrile (v/v = en volume).
. Tampon d'hybridation: 0,02 M Na2HPO4/NaH2PO4,1,1 M
5 NaCI, 5,4 mM KCI, 4% v/v 50X Denhardt , 0,2% v/v ADN de sperme de
saumon, 0,3% v/v Tween 20 à pH 7,4
. Tampon de rinçage : PBS 5 comprimés/L, NaCI 23.375 g/L,
Tween 20 0.15% v/v.
C) Montages expérimentaux pour l'électropolymérisation à
1o distance :
Deux montages expérimentaux ont été validés.
a) Cellule d'électropolymérisation (voir figure 2a à 2c) :
Le matériau de cette cellule C est du "Delrin" (marque
déposée) polyoxyméthylène dit "Delrin POM". La cellule est scindée en deux
compartiments étanches 3 et 4 en introduisant dans son réceptacle
rectangulaire 34 une pièce support 8 comportant un ou plusieurs pores 1. Des
fils de platine par exemple peuvent être introduits dans chacun des
compartiments 3 et 4 à travers les ouvertures 91 et 92 du couvercle 9 pour
former les électrodes. 93 et 94 désignent les ouvertures de fixation du
couvercle 9 sur la cellule C, et 95 et 96 les trous de fixation des vis sur la
cellule C.
b) Montage sur puce "multipores"
Si on souhaite fonctionnaliser de manière différente chacun
des pores d'une puce, il convient de travailler en parallèle avec une source
de
tension multivoies ou plusieurs sources de tension monovoie, par exemple un
potentiostat multi-voies, ou plusieurs potentiostats mono-voie.
Dans le montage décrit en relation avec la figure 3, la puce 10
présente 9 pores P1..... Pg. Chaque pore est isolé entre deux compartiments
étanches (31, 41 ; 32, 42 ; .... 39, 49). Autrement dit, il est possible de
mettre
chacun des neuf pores Pl, P2...... P9 qui ont ou non le même diamètre en
contact avec une solution différente Si, S2...... S9 d'entités
électroactivables.
Chacun de ces compartiments est équipé d'électrodes auxquelles est
appliquée une différence de potentiel électrique donnée et qui sont disposées
à une distance d de l'extrémité de chaque pore. La distance d peut être ou
non la même pour les deux électrodes d'un même pore. Elle peut être
différente d'un pore à l'autre selon les nécessités de la fonctionnalisation.
Il y
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
11
a ainsi neuf électrodes de travail Et,, Et2,... Et3... Et9 qui sont reliées ou
non au
même potentiostat (ou plus généralement à la même source de tension) et
neuf contre-électrodes qui peuvent être couplés à des électrodes de
référence Eai, Ea2,..... Ea9. Les solutions S1, S2,..... S9 peuvent être ou
non les
mêmes. Un potentiostat PT "multi-voies"permet d'appliquer ces tensions
simultanément (même si les valeurs en sont différentes).
Chaque pore (Pl, ... P9) d'une puce 10 est positionné entre
deux compartiments étanches 31, 41,... ; 39, 49 qui ont ici un volume de 10
l.
Le montage comporte un ou deux circuits imprimés 21, 22
(Fig. 4) ayant une électrode circulaire intégrée 23, 28 reliable à un
potentiostat extérieur. Dans au moins une des électrodes sont percés deux
trous 26, 27 permettant d'introduire et d'évacuer du liquide via des
capillaires
en polytétrafluoroéthylène. Deux compartiments étanches 31 et 41 sont créés
entre la puce 10 et les circuits imprimés 21 et 22 grâce à des joints toriques
24 et 25 (Figure 4). Afin de réaliser l'électropolymérisation de manière à
obtenir un dépôt localisé 30 sur les parois des pores, on utilise :
- soit les électrodes intégrées aux circuits imprimés
- soit des électrodes (fils métalliques non représentés)
introduites dans des capillaires de part et d'autre du pore,
- soit des électrodes trempant directement dans un
compartiment. Dans ce cas, une carte plastique (non représentée) est utilisée
à la place du circuit imprimé.
II) MISE EN OEUVRE
A) Préparation du substrat :
a) Nettoyage :
Dans un premier temps, la puce subit un nettoyage (67%
acide sulfurique, 33% peroxyde d'hydrogène v/v) en salle blanche afin
d'éliminer tout contaminant d'origine organique. La puce est trempée 10 min
dans la solution puis rincée grâce à une circulation d'eau jusqu'à obtenir une
3o résistivité de 9 MQ.m. La puce est ensuite séchée dans une étuve à 180 C
pendant 10 min. Elle peut ensuite être stockée à température ambiante.
b) Augmentation de l'hydrophilie de la surface grâce à
l'application d'un plasma oxygène :
Cette étape permet de rendre la surface hydrophile, ce qui est
avantageux dans l'objectif de remplir le pore, quel que soit sa taille, par
une
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
12
solution majoritairement aqueuse. La puce est ainsi placée pendant 45
secondes dans un plasma 02 à une puissance de 100 W.
c) Dépôt de polypyrrole :
Une solution de polymérisation contenant 20 mM de pyrrole et
5 M de py-sondeZip6 en Tampon d'électropolymérisation a été utilisée pour
réaliser des dépôts de polymère dans les pores.
Les deux montages (a et b ci-dessus) ont été utilisés.
Dans chaque cas, la puce comprenant des pores
débouchants est introduite de manière à se trouver entre deux
1o compartiments. La solution de polymérisation est introduite dans les deux
compartiments. Une électrode est insérée dans chaque compartiment et une
différence de potentiel égale à 2 V est appliquée. On notera qu'en pratique,
on peut utiliser une tension comprise entre 10 mV et 500 V et de préférence
entre 100 mV et 10V selon la dimension des pores, le but poursuivi étant
l'obtention d'un champ suffisamment élevé à l'intérieur du pore pour que le
dépôt ait lieu sur sa paroi. Le suivi du déroulement du dépôt se fait en
traçant
la courbe de l'évolution de l'intensité du courant en fonction du temps :
l'allure
de cette courbe (présence ou absence de signal électrique) permet de voir si
le liquide a pénétré à l'intérieur du pore (contact électrique) ou non
(absence
de signal électrique). La puce est ensuite retirée du montage puis rincée à
l'eau, séchée à l'air comprimé et conservée sèche à 4 C.
d) Vérification de la fonctionnalisation par microscopie de
fluorescence
Afin de vérifier la formation d'un dépôt de polypyrrole, on
utilise la microscopie de fluorescence. Le format du test utilisé est illustré
à la
figure 5. Il est réalisé en déposant des gouttes de 15 I de liquide sur un
pore.
Le pore est tout d'abord saturé en Tampon d'hybridation (5 min à température
ambiante). Puis une goutte de cible biotinylée à 100 nM en Tampon
d'hybridation est ajoutée (15 min, température ambiante). La puce est ensuite
3o rincée abondamment avec le Tampon de rinçage. Chaque pore est ensuite
incubé dans une solution de streptavidine-phycoérythrine (SAPE) à 10%
(v/v = en volume) en Tampon de rinçage (15 min. à température ambiante).
La puce est ensuite placée entre lame et lamelle pour être observée en
microscopie de fluorescence à 530 nm, longueur d'onde d'émission de la
phycoérythrine.
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
13
BIO FONCTIONNALISATION D'UN PORE PAR DES
ACIDES NUCLEIQUES
EXEMPLE I - (Montage a)
i) Création d'un dépôt de polypyrrole
Une puce multi-pores comportant des pores de rapport de
forme variables (rapport de forme Rf = diamètre du pore / épaisseur de la
membrane dans laquelle il est percé) et ayant subi un traitement plasma est
introduite dans la cellule bi-compartiments "Delrin POM" décrite ci-dessus. La
solution de polymérisation est introduite successivement dans les deux
1o compartiments de la cellule. Elle est constituée de 20 mM de pyrrole et 5
M
de pyrrole-sonde Zip6 (py-sonde Zip 6) en tampon d'électropolymérisation.
Puis, deux fils de platine sont introduits, un de chaque côté de la puce. Le
premier est relié à la contre-électrode couplée à l'électrode de référence du
potentiostat et le second à l'électrode de travail. Un potentiel de 2 V est
appliqué pendant une durée donnée (entre 100 ms et 1 s) entre les deux
électrodes (électrode de travail et contre-électrode). La puce est ensuite
retirée de la cellule, abondamment rincée à l'eau puis séchée à l'air comprimé
et stockée à 4 C.
L'efficacité de la fonctionnalisation est vérifiée par
microscopie de fluorescence selon le procédé décrit ci-dessus.
ii) Résultats
La manipulation a été réalisée avec des pores présentant
différents rapports de forme :
. Rf = 35: pore de 70 m de diamètre dans une membrane de
2 gm d'épaisseur et de 500 .xm de côté (voir figure 6).
On observe une émission de fluorescence sous la forme d'un
cercle lumineux présent de chaque côté de la puce. Ses dimensions
correspondent à celles du contour du pore, ce qui permet de déduire que la
technique de fonctionnalisation est efficace et permet un dépôt de polymère
localisé sur les parois d'un pore de taille micrométrique.
Les clichés de microscopie électronique à balayage montrent
une fine couche de dépôt - de l'ordre de 30 nm - sur le contour d'un pore. Ce
dépôt est absent d'un pore non fonctionnalisé.
. Rf = 1 avec un pore circulaire de 18 m de diamètre dans
une membrane de 20 m d'épaisseur : cas d'un pore percé dans une
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
14
membrane carrée de 50 m de côté et de 20 m d'épaisseur. Le dépôt est
réalisé à une tension de 2 V appliquée pendant 100 millisecondes (figure 7).
La réalisation du test de fluorescence exposé ci-dessus
conduit à la présence d'anneaux lumineux de chaque côté du pore qui certifie
de la fonctionnalisation efficace et localisée du pore par un polymère porteur
d'oligonucléotides.
. Rf = 0,25 pore de diamètre 2 pm dans une membrane de
8 m d'épaisseur. Le pore d'une taille de 2 m se trouve au fond d'un cône de
plus grand diamètre égal à 10 m. L'environnement du pore est dit de type
entonnoir (figures 8a et 8b).
Les clichés de microscopie de fluorescence montrent que la
paroi du pore a été fonctionnalisée de manière localisée, ainsi que le contour
du haut du cône (de dimension 10 m).
Cela constitue un résultat qui laisse la possibilité de contrôler
le lieu de la fonctionnalisation selon la morphologie de l'environnement du
pore.
EXEMPLE Il (montage b) :
i) Création d'un dépôt de polypyrrole
Une puce multi-pores comportant des pores de rapports de
forme Rf variables et ayant subi un traitement plasma 02 est placée au sein
du montage b décrit ci-dessus (figures 3 et 4). La solution de polymérisation
est introduite successivement dans les deux compartiments. Elle est
constituée de 20 mM de pyrrole et 5 M de pyrrole-sonde-Zip6 en Tampon
d'électropolymérisation. Puis, deux électrodes sont positionnées de chaque
côté de la puce. La première est reliée aux électrodes auxiliaires et de
référence du potentiostat et la seconde à l'électrode de travail. Un potentiel
de 2V est appliqué pendant 100 ms entre les deux électrodes. La puce est
ensuite retirée de la cellule, abondamment rincée à l'eau puis séchée à l'air
comprimé et stockée à 4 C.
ii) Résultats
L'efficacité de la fonctionnalisation a été vérifiée par
microscopie de fluorescence selon le procédé décrit ci-dessus. Chacun des 9
pores de la puce multi-pores peut être étudié indépendamment,
éventuellement avec une fonctionnalisation spécifique pour chaque pore.
. Rf = 1 pore de 18 m de diamètre dans une membrane de
18 m d'épaisseur.
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
La microscopie à fluorescence confirme que le procédé de
fonctionnalisation de surface fonctionne également pour toutes les valeurs
précitées de Rf en utilisant ce montage (présence d'un anneau fluorescent).
Des témoins ont été réalisés pour établir la spécificité de
5 l'interaction biochimique aboutissant à la fonctionnalisation caractérisée
par
l'émission de fluorescence. Ces contrôles ont été réalisés sur les pores de
18.tm de diamètre (Rf= 1) d'une puce multi-pores :
a) Potentiel électrique
Pour ce faire, 15 l d'une solution de polymérisation
lo composée de 20 mM de pyrrole et 5 .iM de pyrrole-sonde-Zip6 en tampon
d'électropolymérisation sont déposés sur un pore et laissés en contact avec la
surface pendant 5 min. La puce est ensuite rincée à l'eau et séchée à l'air
comprimé (procédure identique à celle réalisée après une
électropolymérisation à distance). La puce est conservée à 4 C puis elle subit
15 la procédure du test de fluorescence décrit précédemment. Aucune
fluorescence n'a pu être observée, preuve que l'application d'un potentiel
électrique est nécessaire pour la fonctionnalisation du pore.
b) Adsorption de conjugué pyrrole-oligonucléotide
Un autre contrôle a été réalisé dans le but d'étudier si
l'application d'un potentiel favorise l'adsorption d'ADN à la surface du
support.
Pour ce faire, une solution de py-SondeZip6 à 5 M en Tampon
d'électropolymérisation a été utilisée (pas de pyrrole dans ce cas), puis une
différence de potentiel électrique a été appliquée selon le même protocole
que celui utilisé pour le copolymère pyrrole/py-SondeZip6. L'absence de
fluorescence montre que dans les conditions de travail, l'adsorption non
spécifique de conjugué pyrrole-oligonucléotide est négligeable.
c) Adsorption non spécifique lors de la procédure de
révélation
i) Sur un pore non fonctionnalisé et n'ayant pas été en contact
3o avec la solution de polymérisation, on réalise la procédure d'hybridation
et de
révélation décrite précédemment, la première étape étant la saturation du
pore en Tampon d'hybridation. Il n'y a pas, dans les conditions opératoires,
de fluorescence parasite liée à l'adsorption non spécifique de la cible ADN
biotinylée.
ii) Sur un pore non fonctionnalisé et n'ayant pas été en
contact avec la solution de polymérisation, on réalise la procédure de
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
16
révélation décrite précédemment, la première étape étant la saturation du
pore en tampon d'hybridation suivie par une incubation de 15 minutes en
tampon d'hybridation seul (sans la cible correspondante). La SAPE diluée en
tampon de rinçage est ensuite ajoutée selon le protocole décrit ci-dessus (II.
A, d). Le cliché de microscopie de fluorescence confirme que dans les
conditions opératoires testées, la SAPE ne s'adsorbe pas sur la surface du
support.
d) Dénaturation de l'hybridation
Sur un pore fonctionnalisé et ayant subi la procédure de
1o révélation en fluorescence décrite précédemment, on effectue un rinçage
avec une solution de NaOH à 0,2 M pendant 2 s puis un rinçage abondant à
l'eau et un séchage à l'air comprimé. On observe ensuite le pore en
microscopie de fluorescence à la longueur d'onde habituelle et avec les
mêmes paramètres de sensibilité de la caméra (luminosité, contraste). On
observe la disparition de la fluorescence après dénaturation de l'hybridation.
Cela montre la spécificité de l'émission de fluorescence observée dans le cas
d'une hybridation complémentaire.
e) Fluorescence après réhybridation
La fluorescence d'un pore ayant subi une dénaturation via
l'ajout de NaOH (d) réapparaît après réhybridation des sondes ADN par leur
cible complémentaire. La démarche expérimentale suivie pour cette deuxième
hybridation et sa révélation en fluorescence est exactement la même que
celle précédemment décrite pour l'hybridation.
EXEMPLE III : FONCTIONNALISATION PAR DE L'OXYDE
D'IRIDIUM :
i) Création d'un dépôt d'oxyde d'iridium
Une solution d'oxalate d'iridium est préparée selon le
protocole suivant (décrit dans l'article de A. M. Marsouk, Analytical
Chemistry,
2003, 75 : p.1258 et suivantes) : 75 mg d'IrCl4 monohydrate sont dissous
3o dans 50 mL d'eau distillée ; sont ajoutés ensuite 0.5 ml de peroxyde
d'hydrogène à 30 %, 365 mg d'oxalate de potassium hydraté et du carbonate
de potassium anhydre pour ajuster le pH à 10.5. Une agitation de 10 minutes
est requise entre chaque ajout de produit. La solution est ensuite chauffée à
90 C pendant quelques minutes, jusqu'à atteindre une couleur finale bleu
nuit caractéristique de la forme complexée de l'Iridium (IV). La solution peut
ensuite être stockée plusieurs mois à 4 C.
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
17
Une puce multi-pores comportant des pores de rapport de
forme Rf = 1 et ayant subi un traitement plasma 02 est placée au sein du
montage b décrit ci-dessus (figures 3 et 4).
La solution d'oxalate d'iridium est introduite successivement
dans les deux compartiments. Puis, deux électrodes sont positionnées de
chaque côté de la puce. La première est reliée aux électrodes auxiliaire et de
référence du potentiostat et l'autre à l'électrode de travail. Un potentiel de
0.80 V ou 0.85 V ou 0.90 V est appliqué pendant une durée de 5 s ou 10 s.
De la même manière que pour les dépôts de polypyrrole, le suivi du dépôt se
1o fait par chronoampérométrie afin de vérifier le bon contact électrique au
travers du pore.
La puce est ensuite retirée de la cellule, abondamment rincée
à l'eau puis séchée à l'air comprimé et stockée à 4 C.
ii) Résultats
ls L'efficacité de la fonctionnalisation a été vérifiée par
microscopie électronique à balayage (MEB).
Les clichés qui ont été obtenus montrent qu'un dépôt est
créé sur les parois du pore et seulement à l'intérieur de celui-ci, la surface
alentour restant parfaitement propre. Un pore témoin, n'ayant pas subi de
20 fonctionnalisation, ne présente quant à lui aucun dépôt sur les parois
internes
du pore. Cela montre que le procédé de fonctionnalisation fonctionne
également pour des entités électroactivables tels que ces oxydes métalliques.
La texture des différents dépôts obtenus paraît différente d'un
pore à l'autre, ceci pouvant être possiblement expliqué par des degrés
25 d'oxydation de l'iridium variables. Ainsi, les demi-réactions
électrochimiques
impliquées dans le cas des oxydes d'iridium sont les suivantes:
Ir(OH) + H2O <-> Ir(OH)2 + H+ + e (-0,1 V)
lr(OH)2 + H2O <-> Ir(OH)3 + H+ + é (0,3 V)
lr(OH)3 + H2O <-> lr(OH)4 + H+ + e- (0,8 V)
30 ou lr02 + 2H20 + H+ + e (divergence selon les
publications)
Etant donné l'aspect visuel hétérogène des dépôts observés
en MEB à l'intérieur des pores, il est possible que, selon les conditions
expérimentales utilisées, on n'obtienne pas les mêmes degrés d'oxydation
35 moyens de l'iridium dans le (ou les) oxyde(s) formé(s).
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
18
EXEMPLE IV : OBTENTION D'OBJETS STRUCTURES PAR
LA TECHNIQUE D'ELECTRODEPOT A DISTANCE :
i) Création d'un dépôt de polypyrrole :
Une membrane de polycarbonate, comportant des pores de
taille nanométrique, peut être insérée indifféremment dans les montages a ou
b. Des dépôts de copolymère pyrrole/pyrrole-couplé avec un oligonucléotide
peuvent ensuite être obtenus à l'intérieur de ces pores en suivant le
protocole
précédemment décrit.
:
ii) Détachement des dépôts formés de leur support
La membrane est ensuite rincée à l'eau et introduite dans un
bain de dichlorométhane afin de dissoudre le polycarbonate et libérer en
solution les objets créés à l'intérieur des pores. Les entités
électroactivables
peuvent être aussi détachées sans dissolution de la membrane, par exemple
sous l'action de vibrations créées par des ultrasons. Par filtrations
successives, les objets d'intérêt sont ensuite isolés ; il s'agit de
nanostructures de pyrrole porteuses de sondes ADN possédant la forme des
pores de la membrane.
EXEMPLE V :
Les figures 9a et 9b sont deux variantes de formes de pore
non débouchant avec une électrode 61 qui recouvre en tout ou partie le fond
de la cavité 60. Dans le cas des figures 9a et 9b, la zone du pore où a lieu
le
dépôt correspond à la seule région de striction 62, 62' qui concentre le
champ. Ainsi, la forme du pore permet de localiser spécifiquement le dépôt
sur une partie seulement de sa paroi.
Pour le dépôt d'un polymère tel que le polypyrrole ou un
dérivé fonctionnel, la polarisation de l'électrode 61 au fond de la cavité 60
peut être anodique ou cathodique pour respectivement former ou non un
dépôt du même polymère sur la surface de l'électrode 61, en plus du dépôt
sur la région de striction 62, 62'.
CONCLUSION :
Le procédé technique de fonctionnalisation selon l'invention
est efficace et relativement facile à mettre en pratique.
La reproductibilité des dépôts est satisfaisante et peut être
encore améliorée en contrôlant les paramètres de manipulation plus
strictement :
- distance inter-électrodes figée
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
19
- contrôle de température
- contrôle de l'hygrométrie
Cette nouvelle technique, permet de contrôler de manière
efficace la localisation de la fonctionnalisation de la surface d'un pore par
des
groupements réactifs. En effet, cette dernière est pour l'essentiel liée à
l'organisation des lignes de champ électrique au sein du pore, elle-même
dépendante de la structure de l'environnement du pore (à savoir de sa
géométrie).
Le procédé selon l'invention présente l'avantage d'être peu
1o coûteux :
- en termes financiers car seul un équipement réduit est
nécessaire : potentiostats, électrodes...
- en termes de temps car la procédure de dépôt dure
seulement quelques minutes.
Le dispositif expérimental est de plus peu encombrant et
facilement transportable.
La stratégie est adaptable à tout type de support poreux, de
nature organique ou inorganique, conducteur, semi-conducteur ou isolant,
quelle que soit la dimension des pores.
Pour mesurer si le liquide a pénétré à l'intérieur du pore, un
moyen est de contrôler si le contact électrique entre les deux électrodes est
effectif, auquel cas le chronoampérogramme mesuré lors du dépôt (par
exemple de polypyrrole) présente un signal en intensité non nul.
Pour caractériser la formation du dépôt par exemple de
polypyrrole, il est possible d'utiliser la microscopie de fluorescence, voire
même la microscopie de fluorescence confocale afin d'avoir un aperçu tri-
dimensionnel de la fluorescence à l'intérieur de la cavité. La microscopie
électronique à balayage peut également permettre, par exemple dans le cas
de dépôt d'oxyde d'iridium, de caractériser le dépôt formé.
Les entités électroactivables, en particulier
électropolymérisables (pyrroles, thiophènes...), pouvant être fonction
nalisées,
cette technique est parfaitement transposable à l'immobilisation au sein de
pores de groupements actifs intervenant dans des interactions d'énergie
faible comme les groupements ioniques, peptides, anticorps, enzymes,
chélateurs d'ions par exemple.
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
Le polymère peut également servir de couche de départ
pour un dépôt localisé, en particulier en utilisant des anions dopants
d'intérêt
comme les polysaccharides (héparine par exemple favorisant l'adhésion de
cellules (Zhou et al. Reactive & Functional Polymers, 1999. 39 : p. 19 et
5 suivantes)) ou les surfactants.
Des empilements de type multi-couche peuvent être
envisagés à partir des dépôts obtenus par électrodépôt à distance . Il est
ainsi possible de préparer un dépôt localisé (première couche) présentant par
exemple une certaine charge de surface ou un groupement chimique réactif
io qui favorise la fixation d'une deuxième couche d'entités organiques ou
inorganiques donnée par rapport au support vierge.
La technique a permis expérimentalement la mise en oeuvre
d'une immobilisation d'ADN, ce dernier étant une biomolécule présentant un
aspect modulaire, c'est-à-dire pouvant être utilisée comme élément de
15 reconnaissance biomoléculaire pour l'immobilisation via une hybridation
d'une
molécule d'intérêt fonctionnalisée par des cibles ADN complémentaires. Le
procédé a également permis d'immobiliser une entité d'intérêt biologique, la
biotine, par hybridation avec des sondes ADN immobilisées avec une cible
complémentaire biotinylée, ce qui souligne l'aspect modulaire de la technique.
20 Le dispositif expérimental peut de plus intégrer des dispositifs
thermiques et optiques permettant par exemple des expériences de
réticulation ou encore une visualisation de l'organisation des dépôts
réalisés.
Plusieurs applications peuvent être envisagées dans le
domaine des biocapteurs miniaturisés ultrasensibles. Des membranes
poreuses biofonctionnalisées peuvent trouver des applications dans le
domaine de la santé, en particulier pour la détection de (bio)molécules
présentes en petite quantité dans des échantillons biologiques. De
nombreuses équipes de recherche ont ainsi orienté leurs travaux vers la
conception de systèmes permettant la détection de molécules uniques. Ces
compteurs de Coulter moléculaires ont fourni des résultats encourageants
avec des pores protéiques (Vercoutere, W. et collaborateurs, Nature
Biotechnology, 2001. 19: p. 248 ; Bayley and Cremer, Nature, 2001. 413: p.
226 et suivantes).
L'avantage considérable des pores synthétiques par rapport à
ces derniers réside dans la possibilité de :
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
21
- moduler leurs propriétés en créant des charges, des
groupements réactifs en surface,
- contrôler la géométrie (diamètre du pore, épaisseur de la
membrane... ),
- réaliser une intégration plus aisée dans un appareillage
microfluidique.
Le procédé convient également à des applications dans le
domaine de la micro- ou nano-chromatographie (échange d'ions, exclusion
stérique, chromatographie d'affinité ou d'adsorption) pour la purification de
(bio)molécules.
Des pores fonctionnalisés peuvent également être utiles pour
réaliser la capture de bactéries ou de cellules, notamment en immobilisant de
l'héparine ou de la chondoitine à l'intérieur d'un pore.
Les membranes poreuses fonctionnalisées trouvent
également classiquement des applications dans les systèmes de purification
et de filtration (eau, effluents... ), la présence de chélateurs ou
d'échangeurs
d'ions à la surface des pores étant susceptible de permettre de séparer
sélectivement certains composants du liquide passant au travers de la
membrane.
L'immobilisation de particules catalytiques, contenant par
exemple des métaux tels que le palladium ou le platine dans des pores, par
l'intermédiaire du procédé décrit, pourrait permettre la création de micro-
voire
nano-réacteurs pour réaliser des réactions chimiques comme les
hydrogénations par exemple. Le fait de pouvoir paralléliser ces réactions en
utilisant des réseaux de pores répartis dans une membrane permet de faire
de la micro/nano-chimie combinatoire. L'électrodépôt de métaux par cette
technique peut trouver également des applications dans les domaines des
pots catalytiques (catalyse en phase gazeuse).
Le procédé est enfin compatible avec la mise en oeuvre de
techniques d'impression moléculaire ( molecular imprint ), ce qui ouvre des
applications intéressantes dans le domaine de l'électrophorèse capillaire par
exemple.
On comprendra que la solution d'entités électroactivables
pour laquelle on a mentionné ci-dessus la présence éventuelle de sondes
ADN, peut de manière plus générale comporter optionnellement des ligands,
à savoir :
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
22
- des éléments de reconnaissance moléculaire et/ou
biomoléculaire notamment les nucléotides, oligonucléotides, polynucléotides,
ADN, ARN, PNA, peptides, polypeptides, anticorps, antigènes, enzymes,
protéines, acides aminés, glycopeptides, biotines, haptènes, sucres,
oligosaccharides, polysaccharides, lipides, glycolipides, stéroïdes, hormones,
récepteurs.
- d'autres groupements affins notamment les chélateurs
d'ions et les échangeurs d'ions.
- des fonctions chimiquement actives notamment les
io fonctions amine, amide, oxy-amine, ester actif, alcool, acide carboxylique,
alcyne, thiol, époxyde, anhydride, chlorure d'acyle, aldéhyde et leurs
dérivés.
- des objets uniques (dans le cadre d'une immobilisation
individuelle ou collective d'objets) notamment des microparticules et
nanoparticules. Les particules peuvent être et/ou contenir des cellules
biologiques et/ou des composants et/ou des produits cellulaires, notamment
des lignées cellulaires et/ou des globules et/ou des liposomes et/ou des
noyaux cellulaires et/ou des chromosomes et/ou des brins d'ADN ou d'ARN
et/ou des nucléotides et/ou des ribosomes et/ou des enzymes et/ou des
anticorps et/ou des protides et/ou des protéines et/ou des peptides et/ou des
principes actifs et/ou des parasites et/ou des bactéries et/ou des virus et/ou
des pollens et/ou des polymères et/ou des facteurs biologiques et/ou des
stimulants et/ou des inhibiteurs de croissance et/ou des billes en suspension
dans un liquide, et/ou des bioparticules en suspension dans une solution,
et/ou des molécules. Les particules manipulées peuvent être et/ou contenir
des particules solides insolubles telles que des particules magnétiques et/ou
des particules diélectriques, ou des particules conductrices, ou des
particules
fonctionnalisées, ou des pigments, ou des colorants, ou des cristaux de
protéines, ou des poudres, ou des structures de polymères, ou des
substances pharmaceutiques insolubles, ou des fibres, ou des fils, ou des
3o nanotubes de carbone, ou des agrégats (clusters) de petite taille formés
par
agglomération de colloïdes
- des groupements
o présentant des particularités surfaciques
= en termes de pH, notamment les couples acides/bases
faibles et les composés amphotères
CA 02714185 2010-08-04
WO 2009/109727 PCT/FR2009/000133
23
= et/ou en termes d'hydrophilie et/ou d' hydrophobie et/ou
d'amphiphilie,
= et/ou en termes de polarité,
o et/ou présentant des interactions de faible énergie
notamment
= liaisons hydrogène,
= interactions de Van der Waals,
= interactions ioniques notamment échange de protons
interactions électrostatiques,
ponts salins notamment ceux formés par des ions
divalents comme les ions calcium et magnesium entre les groupements
chargés négativement
o et/ou étant des surfactants.
- des modifications de surface préparant une modification
ultérieure : la couche de fonctionnalisation déposée sur les parois du pore
comporte par exemple des moyens d'interaction ou de réaction avec des
molécules et/ou biomolécules.ll s'agit notamment de groupements
modulaires tels que l'ADN, photoactivables tels que la benzophénone,
électroactivables tels que les entités électroactivables mentionnées ci-
dessus,
ou bien encore thermoactivables tels que les polymères thermodurcissables.
On notera que le ligand doit être couplé à une entité
électroactivable pour permettre la fonctionnalisation par le procédé selon la
présente invention.
Il n'est pas nécessaire qu'il y ait dans la solution à la fois des
entités électroactivables et des entités électroactivables couplées à un
ligand : il peut aussi y avoir seulement des entités électroactivables
couplées
à un ligand, ou bien seulement des entités électroactivables .