Note: Descriptions are shown in the official language in which they were submitted.
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
1
COMPOSES D'AZÉTIDINES POLYSUBSTITUES, LEUR PRÉPARATION ET LEUR
APPLICATION EN THÉRAPEUTIQUE
La présente invention se rapporte à des dérivés d'azétidines, à leur
préparation et à leur
application en thérapeutique dans le traitement ou la prévention de maladies
impliquant les
récepteurs aux cannabinoïdes CB 1.
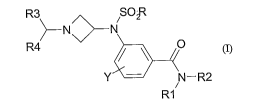
La présente invention a pour objet des composés répondant à la formule (I)
R3 SOF
~--N>N
R4 O
Y N-R2
i
R1
dans laquelle :
R représente un groupe (Cl-C6)alkyle, un groupe halo(C1-C6)alkyle;
Rl représente un atome d'hydrogène;
R2 représente un
- groupe hétéroaromatique ou un groupe hétéroaromatique(Ci-C4)alkyle, ces
groupes étant
éventuellement substitués par un ou plusieurs atomes ou groupes choisis parmi
un halogène, un
hydroxy, un cyano, oxo, NH2, C(O)NH2, un groupe (Cl-C6)alkyle, un groupe
halo(C1-C6)alkyle, un
groupe (CI-C6)alcoxy, un groupe halo(C1-C6)alcoxy ou un groupe COO(C1-
C6)allcyle;
R3 et R4 représentent indépendamment l'un de l'autre un groupe phényle,
éventuellement substitué
par un ou plusieurs atomes ou groupes choisis parmi un halogène, un cyano, un
groupe (CI-
C6)alkyle, un groupe halo(C1-C6)alkyle, un groupe (C1-C6)alcoxy ou un groupe
halo(CI-C6)alcoxy;
Y représente un atome d'hydrogène, un halogène, un cyano, un groupe (CI-
C6)alkyle, un groupe
halo(C1-C6)alkyle, un groupe (C1-C6)alcoxy, un groupe halo(C1-C6)alcoxy ou un
groupe (C1-
C6)alkylS(O)p ;
p est compris entre 0 et 2 ;
à l'état de base ou de sel d'addition à un acide.
Les composés de formule (I) peuvent comporter un ou plusieurs atomes de
carbones asymétriques.
Ils peuvent donc exister sous forme d'énantiomères ou de diastéréoisomères.
Ces énantiomères,
diastéréoisomères, ainsi que leurs mélanges, y compris les mélanges
racémiques, font partie de
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
2
l'invention.
Parmi les composés de formule (I) objets de l'invention, un premier groupe de
composés
est constitué des composés en mélange de diastéréoisomères et d'énantiomères
pour lesquels
R représente un méthyle,
R3 et R4 représentent chacun un groupe phényle éventuellement substitué par un
atome de chlore en
position para,
Y représente un atome d'hydrogène ou un halogène
RI représente un atome d'hydrogène,
R2 représente un
1-0 groupe hétéroaromatique ou un groupe hétéroaromatique(CI-C4)alkyle et le
groupe
hétéroaromatique représentant un thiazole, imidazole, thiadiazole, pyridine,
isoxazole, pyrimidine,
pyrazole, oxadiazole, triazole, isothiazole éventuellement substitué par un ou
plusieurs (CI-
C6)alkyle, halogène, hydroxy, amino, C(O)NH2, halo(CI-C6)alkyle;
à l'état de base ou de sel d'addition à un acide.
Les combinaisons des groupes mentionnés ci-dessus sont également des groupes
de composés objets
de l'invention.
Dans le cadre de la présente invention, on entend par :
- un halogène : un fluor, un chlore, un brome ou un iode ;
- un (Cù Ct) represente un groupe ayant de u à t atomes de carbone ;
- un groupe (CI-C6)alkyle: un groupe aliphatique comprenant de 1 à 6 atomes de
carbone saturé,
cyclique, ramifié ou linéaire pouvant éventuellement être substitué par un ou
plusieurs groupements
(CI-C6)alkyle linéaires, ramifiés ou cycliques. A titre d'exemples, on peut
citer les groupes méthyle,
éthyle, propyle, isopropyle, butyle, isobutyle, tertbutyle, pentyle, hexyle,
cyclopropyle, cyclobutyle,
cyclopentyle, cyclohexyle, cycloheptyle, cyclopropylméthyle, etc ;
- un groupe halo(CI-C6)allcyle : un groupe (CI-C6)alkyle dont un ou plusieurs
atomes d'hydrogène
ont été substitués par un atome d'halogène. A titre d'exemples, on peut citer
les groupes CF3,
CH2CF3, CHF2, CC13
- un groupe hydroxy(CI-C6)alkyle : un groupe (CI-C6)alkyle dont un ou
plusieurs atomes
d'hydrogène ont été substitué par un ou plusieurs hydroxy
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
3
- un groupe (CI-C6)alcoxy : un groupe (CI-C6)alkyle-O- où le groupe (CI-
C6)alkyle est tel que
précédemment défini.
- un groupe halo(Cr-C6)alcoxy : un groupe halo(CI-C6)alkyle-O- où le groupe
halo(CI-C6)alkyle
est tel que précédemment défini.
- un groupe hétéroaromatique est un groupe aromatique monocyclique à 5 ou 6
chaînons
comportant de 1 à 4 hétéroatomes choisis parmi O, S, N. Les hétéroatomes N
peuvent être présents
sous la forme oxydée c'est-à-dire N-O. A titre d'exemples, on peut citer
pyrrole, furane, thiophène, pyrazole, imidazole, triazole, tétrazole, oxazole,
isoxazole, oxadiazole,
thiazole, isothiazole, thiadiazole, pyridine, pyrimidine, pyrazine,
pyridazine, triazine.
- un groupe hétéroaromatique(CI-C4)alkyle est un groupe alkyle substitué par
un
hétéroaromatique tel que défini précédemment.
Les composés de formule (1) peuvent exister à l'état de bases ou de sels. De
tels sels d'addition font
partie de l'invention.
Ces sels peuvent être préparés avec des acides pharmaceutiquement acceptables,
mais les
sels d'autres acides utiles, par exemple, pour la purification ou l'isolement
des composés de formule
(I) font également partie de l'invention.
Les composés de formule (I) peuvent également exister sous forme d'hydrates ou
de solvats,
à savoir sous forme d'associations ou de combinaisons avec une ou plusieurs
molécules d'eau ou
avec un solvant. De tels hydrates et solvats font également partie de
l'invention.
Les composés de formule (I) peuvent également exister sous forme de tautomères
et font
partie également de l'invention.
Parmi les composés de formule (I) objets de l'invention, on peut notamment
citer les
composés suivants ; la nomenclature utilisée correspond à la nomenclature
IUPAC.
3-[ {1 -[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-
(1,3-thiazol-2-
yl)benzamide
3-[ {1 -[bis(4-chlorophényl)méthyl]azétidin-3 -yl} (méthylsulfonyl)amino]-N-[2-
(1 H-imidazol- l -
yl)éthyl]benzamide
3-[ 11 -[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-
(1,3,4-thiadiazol-2-
yl)benzamnide
3-[f 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-(4-
hydroxy-1-méthyl-
1 H-imidazol-2-yl)benzamide
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
4
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-
(isoxazol-3-
yl)benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-(5-
cyclopropyl-1,3,4-
thiadiazol-2-yl)benzamide
3-[ {l -[bis(4-ehlorophényl)méthyllazétidin-3-ylj (méthylsulfonyl)amino]-N-
(pyridin-2-yl)benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-
(pyrimidin-2-
yl)benzamide
3-[f 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-(1H-
pyrazol-3-
yl)benzamide
N-(4-amino-1,2,5-oxadiazol-3-yl)-3-[j 1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl} (méthylsulfonyl)amino]benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-(4-
hydroxypyridin-2-
yl)benzamide
3-[({3-[f 1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl} (méthylsulfonyl)amino]phényl} carbonyl)amino]-1 H-pyrazole-4-carboxamide
3 -[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-(1
H-1,2,4-triazol-3 -
yhnéthyl)benzamide
3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino] N-(1H-
pyrazol-3-
ylméthyl)benzamide
3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-[2-
(1H-pyrazol-1-
yl)éthyl]benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-[2-
(pyrimidin-2-
yl)éthyl]benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino]-5-
fluoro-N-(isoxazol-3-
yl)benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-
fluoro-N-(pyridin-2-
yl)benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-
fluoro-N-(1,3-thiazol-2-
yl)benzamide
3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-
fluoro-N-(pyrimidin-2-
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
yl)benzamide
3-[f 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-
fluoro-N-(5-
méthylisoxazol-3-yl)benzamide
3-[{ 1-[bis(4-chlorophényl)méthyl] azétidin-3-yl} (méthylsulfonyl)amino]-5 -
fluoro-N-[4-
(trifluorométhyl)-1,3-thiazol-2-yl]benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-
fluoro-N-(3-
méthylisothiazol-5-yl)benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-y1} (inéthylsulfonyl)amino]-5-
fluoro-N-(isoxazol-4-
yl)benzamide
3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-y1}(méthylsulfonyl)amino]-5-
fluoro-N-(4-méthyl-l,3-
thiazol-2-yl)benzamide
3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-
fluoro-N-(3-
méthylisoxazol-5-yl)benzamide
3-[{ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-
fluoro-N-(4-
méthylpyridin-2-yl)benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-
fluoro-N-(6-
méthylpyridin-2-yl)benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-
fluoro-N-(1H-pyrazol-3-
yl)benzamide
N-(6-aminopyridin-3-yl)-3-[f 1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl} (méthylsulfonyl)amino]benzamide
N-(3-amino-1H-1,2,4-triazol-5-yl)-3-[ {l -[bis(4-chlorophényl)méthyl]azétidin-
3-
yll(méthylsulfonyl)amino]benzamide
3-[ { 1-[bis(4-chlorophényl)méthyl] azétidin-3-yl} (méthylsulfonyl)amino]-N-
[(3 -hydroxyisoxazol-5 -
yl)méthyl]benzamide
3-[ {l -[bis(4-chlorophényl)méthyl]azétidin-3-ylj (méthylsulfonyl)amino]-N-(2H-
tétrazol-5-
ylméthyl)benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-N-(4-
cyano-pyridin-2-yl)-
5-fluoro-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-pyridin-2-
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
6
ylméthyl-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-(pyridin-3-
ylméthyl)-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-[1-(pyridin-3-
yl)-éthyl]-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-[2-(pyridin-3-
yl)-propyl]-benzamide
3-({1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-fluoro
N [1-(pyridin-2-
yl)-éthyl]-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} -méthylsulfonyl-amino)-5-
fluoro-N-[(2-méthyl-
thiazol-4-yl)inéthyl]-benzainide
3-({1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-fluoro-
N-[ 2-
([1,2,4]triazol-1-yl)-propyl]-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-y1}-méthylsulfonyl-ainino)-5-
fluoro-N-[1-(2-méthyl-
thiazol-4-yl)-éthyl]-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-[1-(1-méthyl-
1 H-pyrazol-4-yl)-éthyl]-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-(pyridin-3-yl)-
benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-[1-(-2-pyrazol-
1-yl)-propyl]-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-(pyridin-4-
ylméthyl)-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-[(6-oxo-1,6-
dihydro-pyridin-3-yl)méthyl]-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-y1} -méthylsulfonyl-amino)-5-
fluoro-N-[(1-pyridin-4-
yl)-éthyl]-benzamide
3-({ 1-[bis(4-chlorophényl)inéthyl]azétidin-3-yl}-méthylsulfonyl-amino)-N-[(6-
diméthylaminopyridin-3-yl)méthyl]-5-fluoro-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-[ 2-(pyrazin-2-
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
7
yl)-propyl]-benzamide
3-({ 1-[bis(4-chlorophényl)méthyl] azétidin-3-yl} -méthylsulfonyl-amino)-5-
fluoro-N-(pyridin-4-yl)-
benzamide
3-({ 1-[bis(4-chlorophényl)inéthyl]azétidin-3-yl}-méthylsulfonyl-amino)-5-
fluoro-N-[2-hydroxy-2-
(pyridin-4-yl)-éthyl]-benzamide
et leurs sels pharmaceutiquement acceptables.
La présente invention a également comme objet l'utilisation des composés de
l'invention de
formule (I) pour la préparation d'un médicament pour le traitement ou la
prévention des maladies
dans lesquelles le récepteur CBI est impliqué.
La présente invention a également comme objet l'utilisation des composés de
l'invention de
formule (I) pour la préparation d'un médicament pour le traitement ou la
prévention des désordres
psychiatriques, de la dépendance et du sevrage à une substance, du sevrage
tabagique, des troubles
cognitifs et de l'attention et des maladies neurodégénératives aiguës et
chroniques ; du métabolisme,
des troubles de l'appétence, des troubles de l'appétit, de l'obésité, du
diabète (de type I et/ou II), du
syndrome métabolique, de la dyslipidémie, de l'apnée du sommeil ; de la
douleur, de la douleur
neuropathique, des douleurs neuropathiques induites par les anticancéreux ;
des troubles gastro-
intestinaux, des vomissements, de l'ulcère, des troubles diarrhéiques, des
troubles vésicaux et
urinaires, des troubles d'origine endocrinienne, des troubles cardio-
vasculaires, de l'hypotension, du
choc hémorragique, du choc septique, des maladies du foie, de la cirrhose
chronique du foie, des
fibroses, de la stéatohépatite non alcoolique (NASH), de la stéatohépatite et
de la stéatose hépatique,
quelle que soit l'étiologie de ces affections (alcool, médicament, produit
chimique, maladie auto-
immune, obésité, diabète, maladie métabolique congénitale) ; des maladies du
système immunitaire,
de l'arthrite rhumatoïde, de la démyélinisation, de la sclérose en plaques,
des maladies
inflammatoires ; de la maladie d'Alzheimer, de Parkinson, de la schizophrénie,
des troubles cognitifs
associés à la schizophrénie, au diabète, à l'obésité, au syndrome métabolique
; de l'asthme, des
maladies pulmonaires chronique obstructive, du syndrome de Raynaud, du
glaucome, des troubles
de la fertilité ; des maladies infectieuses et virales telles que les
encéphalites, des accidents
vasculaires cérébraux, du syndrome de Guillain-Barré, de l'ostéoporose et de
l'apnée du sommeil et
pour la chimiothérapie anticancéreuse ; les troubles liés aux traitements
antipsychotiques (prise de
poids, trouble du métabolisme).
Conformément à l'invention, on peut préparer les composés de formule générale
(I) selon le
procédé décrit dans le schéma 1 :
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
8
SO2R
HN HzN
R3 ~-N>OMs c-~O OR, / \ OW
R4 Y Y O
3 2 1
R3 SO2R R3 SO2R R2 R3\ Nef NSO'R
} N~-N ~N>N HN,R1 R4 v} O
6 N-R2
R4 OR" R4 c-~OH
ie A Y R1
O 5 Vo
Y Y 4
R2
HN.R1
Voie B 6
Schéma 1
La inésylation du composé 1 en dérivé 2 peut se faire selon les méthodes
connues de
l'homme de l'art ou bien décrites dans T.W. GREENE, Protective Group in
Organic Synthesis,
fourth edition. Cette réaction se fera dans un solvant chloré tel que le
dichlorométhane en présence
d'une base telle que la pyridine et d'un dérivé mésylate tel que le chlorure
de mésyle à une
température comprise entre -10 C et 40 C.
Les dérivés 1 sont commerciaux ou synthétisés, selon les méthodes connues de
l'homme du
métier, à partir des précurseurs adéquats commerciaux, R" représente un
groupement protecteur de
la fonction OH de l'acide.
Le dérivé 4 est accessible par réaction du mésylate 2 avec l'azétidine 3.
Cette étape
s'effectue de préférence sous atmosphère inerte, au sein d'un solvant inerte
tel que la 4-méthyl-2-
pentanone en présence d'une base minérale comme le carbonate de potassium au
reflux du mélange
réactionnel.
La synthèse de l'azétidine 3 est décrite dans la demande de brevet WO01064634.
L'hydrolyse de l'ester 4 en acide 5 s'effectue d'après les méthodes connues de
l'homme de
l'art et, plus précisément, dans un mélange de solvants polaires tels que le
tétrahydrofuranne et l'eau
en présence d'une base telle que l'hydroxyde de lithium hydratée à une
température voisine de 20 C.
La formation des composés de formule (I) peut se faire :
2-0belon la voie A, par réaction entre l'acide 5 et un dérivé aminé 6. Cette
réaction peut être effectuée :
= au sein d'un solvant chloré tel que le dichlorométhane, en présence d'un
agent de
couplage tel que le chlorhydrate de 1-(3-diméthylaminopropyl)-3-
éthylcarbodiimide,
= au sein d'un solvant polaire tel que le tétrahydrofuranne ou le
diméthylformamide,
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
9
en présence d'une base telle qu'une trialkylamine (triéthylamine ou
diisopropyléthylamine, par
exemple), en présence ou non d'un agent de couplage tel que le chlorhydrate de
1-(3-
diméthylaminiopropyl)-3-éthylcarbodiimide, en présence d'un ou plusieurs
additifs (1-
hydroxybenzotriazole, benzotriazol-1-yloxytris-(diméthylamino)-phosphonium-
hexafluor, par
exemple),
au sein d'un solvant polaire tel que le tétrahydrofuranne, en présence d'une
base
telle qu'une trialkylamine (triéthylamine, par exemple), en présence d'un
agent permettant la
synthèse peptidique via la formation d'un anhydride mixte tel que
l'isobutylchloroformate,
au sein d'un solvant polaire tel que le tétrahydrofuranne ou d'un solvant
chloré tel
que le dichlorométhane, en présence d'un aliquot de diméthylformamide, en
présence d'un agent
permettant la formation intermédiaire d'un chlorure d'acide (chlorure de
thionyle, par exemple)
et à une température comprise entre -20 C et la température d'ébullition du
solvant.
- selon la voie B, par réaction entre l'ester 4 et un dérivé aminé 6. Cette
réaction peut être effectuée au
sein d'un solvant inerte tel que le toluène, en présence d'un dérivé
trialkylaluminium tel que le
triméthylaluminium à une température comprise entre 0 C et la température
d'ébullition du solvant.
Les dérivés 6 sont commerciaux ou synthétisés, selon les méthodes connues de
l'homme du
métier, à partir des précurseurs adéquats commerciaux.
Les composés de formule (I) peuvent être préparés par réaction d'un dérivé
acide 5 avec un dérivé
aminé 6 dans un solvant inerte ; en présence d'un agent de couplage et
éventuellement d'un additif
évitant la racémisation, on déprotège éventuellement le produit puis on isole
le produit et on le
transforme éventuellement en sel d'addition à un acide.
Les composés de formule (I) peuvent être purifiés par les méthodes connues
habituelles, par
exemple, par cristallisation, chromatographie ou extraction.
Les énantiomères des composés de formule (I) peuvent être obtenus par
dédoublement des
racémiques, par exemple, par chromatographie sur colonne chirale selon PIRKLE
W.H. et coll.,
Asymmetric Synthesis, vol. 1, Academic Press (1983) ou, par formation de sels
ou par synthèse à
partir des précurseurs chiraux. Les diastéréoisomères peuvent être préparés
selon les méthodes
classiques connues (cristallisation, chromatographie ou à partir des
précurseurs chiraux).
La présente invention concerne également le procédé de préparation des
intermédiaires.
Les exemples suivants décrivent la préparation de certains composés conformes
à
l'invention. Ces exemples ne sont pas limitatifs et ne font qu'illustrer la
présente invention. Les
numéros des composés exemplifiés renvoient à ceux donnés dans le tableau ci-
après, qui illustre les
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
structures chimiques et les propriétés physiques de quelques composés selon
l'invention.
EXEMPLES
Exemple 1 : 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-N-
(1,3-thiazol-2-yl)benzamide (Composé N 1)
5 A une solution de 300 mg d'acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]benzoïque et de 65,4 mg de 2-aminothiazole dans 3 cm3
de
dichlorométhane agitée 10 minutes à une température voisine de 20 C, sont
ajoutés 136,5 mg de
chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide. Le milieu
réactionnel est agité une
nuit à une température voisine de 20 C avant d'être dilué avec de l'eau. La
phase aqueuse est
10 extraite avec du dichlorométhane. Les phases organiques sont réunies,
séchées sur du sulfate de
magnésium, filtrées et concentrées à sec sous pression réduite pour donner un
produit brut qui est
purifié par chromatographie flash sur une colonne Sep Pack de 5 g de silice
(gradient d'élution :
dichlorométhane/méthanol 100/0 à 96/4). Après concentration des fractions sous
pression réduite,
on obtient 170 mg de 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-N-
(1,3-thiazol-2-yl)benzamide sous la forme de cristaux blancs.
Pf : 244 C
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,74
(m, 2H);
3,00 (s, 3H); 3,37 (m, 2H); 4,39 (s, 1H); 4,74 (m, 1H); 7,27 (m masqué, 1H);
7,29 (d, J=8,4 Hz,
4H); 7,35 (d, J=8,4 Hz, 4H); 7,51 - 7,61 (in, 3H); 8,02 - 8,08 (m, 2H); 12,72,
(m étalé, 1H)
Spectre de masse: ES m/z=587 (M+H)'; ni/z--585 (M-H)"
Analyse élémentaire:
Calculée: C: 55,20%- H: 4,12%- N: 9,54%- S: 10,91%
Mesurée: C: 53,99%- H: 4,10%- N. 9,02%- S: 10,12% - H2O : 2,65%
Exemple 2 : 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-N-
(pyridin-2-yl)benzamide (Composé N 7)
A une solution de 300 mg d'ester méthylique de l'acide 3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino] benzoïque et de 3 cm3
de
triméthylaluminium dans 5 cm3 de toluène sont additionnés 90,6 mg de 2-
aminopyridine. Le milieu
réactionnel, placé dans un tube Radley, est agité une nuit à une température
voisine de 50 C avant
d'être dilué avec de l'eau. La phase aqueuse est extraite avec du
dichlorométhane sur une seringue
filtrante hydrophobe. Le produit brut est chromatographié sur une colonne de
silice de 30 g (éluant :
dichlorométhane/méthanol 90/10). Après concentration des fractions sous
pression réduite, on
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
11
obtient 50 mg de 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-N-
(pyridin-2-yl)benzamide sous la forme de cristaux beiges.
Pf : 202 C
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,75
(m, 2H);
3,00 (s, 3H); 3,36 (m, 2H); 4,39 (s, 1H); 4,75 (m, 1H); 7,18 (in, 1H); 7,30
(d, J=8,8 Hz, 4H); 7,35
(d, J=8,8 Hz, 4H); 7,51 - 7,57 (m, 2H); 7,85 (m, 1H); 7,97 (s, 1H); 8,00 (m,
1H); 8,18 (d, J=8.,4
Hz, 1H); 8,40 (d large, J=5,0 Hz, 1H); 10,89 (s large, 1H);
Spectre de masse: ES m/z=581 [M+H]+; ni/z=347 [M+H-C,3H8C12]+; m/z=579 [M-H]
m/z=1159
[2M-H]-
Exemple 3: 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino] N
(1H-1,2,4-triazol-3-ylméthyl)benzamide (Composé N 13)
A une solution de 500 mg d'acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]benzoïque, 66,8 mg de 1-hydroxybenzotriazole, 0,138
cm3 de
triéthylamine et de 265 mg de chlorhydrate de 1-(3-diméthylaminopropyl)-3-
éthylcarbodiimide dans
15 cm3 de tétrahyfiofuranne sont additionnés goutte à goutte 97 mg de 1H-1,2,4-
triazole-3-
méthanamine. Le milieu réactionnel est agité une nuit à une température
voisine de 20 C avant
d'être concentré à sec sous pression réduite. Le résidu est repris avec un
mélange
dichlorométhane/eau. Après décantation, la phase organique est séchée sur du
sulfate de
magnésium, filtrée puis concentrée à sec sous pression réduite. Le brut
réactionnel obtenu est purifié
par chromatographie flash sur une colonne de 30 g de silice (Merck ; gradient
d'élution :
dichlorométhane/méthanol 100/0 à 95/5). Après concentration des fractions sous
pression réduite,
on obtient 320 mg de 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-N-
(1H-1,2,4-triazol-3-ylméthyl)benzamide sous la forme de cristaux blancs.
Pf : 210 C
Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,70
(m, 2H);
2,97 (s, 3H); 3,34 (m partiellement masqué, 2H); 4,37 (s, 1H); 4,55 (d, J=5,9
Hz, 2H); 4,73 (m,
1H); 7,31 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz, 4H); 7,46 -7,54 (m, 2H); 7,80
(s large, 1H); 7,87
(m, 1H); 8,17 (m étalé, 1H); 9,10 (t large, J=5,6 Hz, 1H); 13,80 (m très
étalé, 1H)
Spectre de masse: ES m/z=585 [M+H]+; m/z=583 [M-H]-
Exemple 4 : 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino] N-
(1H-pyrazol-3-ylméthyl)benzamide (Composé N 14)
A une solution de 400 mg d'acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
12
y1}(inéthylsulfonyl)amino]benzoïque, 55 mg de 1-hydroxybenzotriazole, 0,113
cm3 de triéthylamine
et de 213 mg de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide
dans du
tétrahyfrofuranne sont additionnés, goutte à goutte, 77 mg de 1H-pyrazol-3-yl-
méthylamine. Le
milieu réactionnel est agité à une température voisine de 20 C pendant une
nuit avant d'être
concentré à sec sous pression réduite. Le résidu est purifié par
chromatographie flash sur une
colonne de 30 g de silice (Merck; gradient d'élution :
dichlorométhane/méthanol 100/0 à 96/4).
Après concentration des fractions sous pression réduite, on obtient 390 mg de
3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-N-(1H-pyrazol-3-
ylméthyl)benzainide
sous la forme de cristaux blancs.
Pf:224 C
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,70
(m, 2H);
2,96 (s, 3H); 3,33 (m, 2H); 4,37 (s, 1H); 4,47 (m étalé, 2H); 4,72 (m, 1H);
6,16 (s large, 1H); 7,30
(d, J=8,7 Hz, 4H); 7,35 (d, J=8,7 Hz, 4H); 7,44 - 7,67 (m, 3H); 7,79 (s large,
1H); 7,86 (m, 1H);
8,96 (m étalé, 1H); 12,57 (m étalé, 1H)
Spectre de masse: ES m/z=584 ([M+H]+, pic de base); m/z=350 [M+H-C13H$Cl2]+
Exemple 5 : 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-5-
fluoro-N-(pyrimidin-2-yl)benzamide (Composé N 20)
5a : Ester éthylique de l'acide 3-fluoro-5-méthanesulfonylamino-benzoïque
A une solution de 4 g d'ester éthylique de l'acide 5-amino-3-fluoro benzoïque
dans 100 cm3 de
dichlorométhane agitée sous atmosphère d'argon, sont additionnés 2,65 cm3 de
pyridine. Le milieu
réactionnel est refroidi à une température voisine de 0 C à l'aide d'un bain
de glace, puis, une
solution de 1,78 cm3 de chlorure de méthane sulfonyle dans 2 cm3 de
dichlorométhane est
additionnée goutte à goutte. La solution orangée obtenue est laissée revenir à
une température
voisine de 20 C et est agitée à cette température pendant 20h. Après addition
de 40 cm3 d'eau
distillée et de 50 cm3 de dichlorométhane, suivie de décantation, la phase
organique est
successivement lavée avec 35 cm3 d'eau distillée puis 40 cm3 d'une solution
aqueuse saturée en
chlorure de sodium. La phase organique est séchée sur sulfate de sodium,
filtrée sur verre fritté puis
concentrée à sec sous pression réduite pour donner 5,8 g d'un solide orangé.
Le brut réactionnel est
purifié par chromatographie flash sur une cartouche de 400 g de silice Merck
(granulométrie : 15-40
m ; éluant : dichlorométhane/méthanol 98/2). Après concentration des fractions
sous pression
réduite, on obtient 5,09 g d'ester éthylique de l'acide 3-fluoro-5-
méthanesulfonylamino-benzoïque
sous la forme d'un solide blanc.
Spectre de masse: EI m/z=261 (M+', pic de base), m/z=233 [(M - C2H4)+'],
m/z=216 [(M-
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
13
OC2H5)1, m/z=182 [(M-SO2CH3)+], m/z=138 [(m/z=182-OC2H4)+]
5b : Ester éthylique de l'acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl} (méthylsulfonyl)amino]-5-fluorobenzoïque
A une suspension de 3,7 g de méthanesulfonate de 1-[bis(4-
chlorophényl)méthyl]azétidin-3-
yle, 3,5 g d'ester éthylique de l'acide 3-fluoro-5-méthanesulfonylamino-
benzoïque dans 130 cm3 de
4-méthyl-2-pentanone sont additionnés 3,97 g de carbonate de potassium. Le
milieu réactionnel est
agité au reflux pendant 7 heures puis laissé revenir à une température voisine
de 20 C pendant 16
heures. A la suspension crème obtenue sont ajoutés 50 cm3 d'eau distillée et
100 cm3 d'acétate
d'éthyle. Après 30 minutes d'agitation suivie de décantation, la phase aqueuse
est extraite deux fois
par 100 cm3 d'acétate d'éthyle. Les phases organiques réunies sont lavées avec
80 cm3 d'une
solution aqueuse saturée en chlorure de sodium, séchées sur sulfate de sodium,
filtrées sur verre
fritté puis concentrées à sec sous pression réduite pour donner 7,2 g d'un
résidu orangé. Le brut
réactionnel est purifié par chromatographie flash sur une cartouche de 400 g
de silice Merck
(granulométrie : 15-40 gm ; gradient d'élution : dichlorométhane/méthanol 98/2
à 95/5). Après
concentration des fractions sous pression réduite, on obtient 4,03 g d'ester
éthylique de l'acide 3-
[{1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino]-5-
fluorobenzoïque sous la
forme d'une meringue blanche.
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 1,32
(t, J=7,2 Hz,
3H) ; 2,73 (t, J=7,3 Hz, 2H) ; 2,98 (s, 3H) ; 3,35 (m, 2H) ; 4,34 (q, J=7,2
Hz, 2H) ; 4,43 (s, 1H)
4,77 (m, IH) ; 7,31 (d, J=8,8 Hz, 4H) ; 7,37 (d, J=8,8 Hz, 4H) ; 7,56 (dt,
J=9,8 ; 2,4 Hz, 1H) ;
7,66 (d large, J=9,1 Hz, 1H) ; 7,70 (s large, 1H)
Spectre de masse: ES m/z=551 (MH+), ni/z=235 (C13H9C12+', pic de base)
5c : Acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-5-
fluorobenzoïque
A une solution de 2,5 g d'ester éthylique de l'acide 3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino)-5-fluorobenzoïque
dans un mélange
constitué de 34 cm3 de tétrahydrofuranne et 9 cm3 d'eau, agitée sous
atmosphère d'argon, est
additionné en deux fois, 0,222 g d'hydroxyde de lithium. Le milieu réactionnel
est agité à une
température voisine de 20 C pendant 24 heures. Puis, 100 cm3 d'une solution
aqueuse saturée en
hydrogénophosphate de sodium sont additionnés pour amener le pH à 5. La phase
aqueuse est
extraite quatre fois avec 200 cm3 d'acétate d'éthyle. Les phases organiques
réunies sont séchées sur
sulfate de sodium, filtrées sur verre fritté puis concentrées à sec sous
pression réduite pour donner
une meringue qui est reprise deux fois par 150 cm3 d'éther éthylique. Après
concentration sous
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
14
pression réduite, on obtient 2,3 g d'acide 3-[{1-[bis(4-
chlorophényl)méthyl]azétidin-3-
yl}(inéthylsulfonyl)amino]-5-fluorobenzoïque sous la forme d'un solide blanc.
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,74
(t, J=6,9 Hz,
2H) ; 2,98 (s, 3H) ; 3,33 (m masqué, 2H) ; 4,43 (s, 1H) ; 4,76 (quin, J=6,9
Hz, 1H) ; 7,31 (d, J=8,8
Hz, 4H) ; 7,36 (d, J=8,8 Hz, 4H) ; 7,51 (dt, >9,4; 2,0 Hz, 1H) ; 7,64 (dt,
J=8,9 ; 2,0 Hz, 1H) ;
7,70 (t, J=2,0 Hz, 1H) ; 13,25 (in très étalé, IH)
Spectre de masse: ES rn/z=523 (MH+), m/z=235 (C13H9CI2+', pic de base)
5d : 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-yl}(méthylsulfonyl)amino]-5-
fluoro-N-
(pyrimidin-2-yl)benzamide (Composé N 20)
A une solution de 500 mg d'acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl} (méthylsulfonyl)ainino]-5-fluorobenzoïque dans 10 cm3 de dichlorométhane
sont
successivement additionnées 4 gouttes de diméthylformamide puis une solution
de 400 l de
chlorure de thionyle dans 1 cm3 de dichlorométhane. Le milieu réactionnel est
agité pendant 45
minutes à une température voisine de 20 C avant d'être concentré à sec sous
pression réduite
après ajout de quelques cm3 de toluène. Le résidu obtenu est solubilisé dans 5
cm3 de
dichlorométhane. A cette solution, sont successivement additionnés, une
solution de 109 mg de 2-
aminopyrimidine dans un mélange tétrahydrofurane 4 cm3/dichlorométhane 4 cm3,
puis 400 l de
triéthylamine. Le milieu réactionnel est agité à une température voisine de 20
C pendant 2 heures
30 minutes avant d'être concentré à sec sous pression réduite. Le résidu
obtenu est repris avec
40 cm3 de dichlorométhane et 10 cm3 d'une solution aqueuse saturée en
bicarbonate de sodium.
Après décantation, la phase aqueuse est extraite 2 fois avec 15 cm3 de
dichlorométhane. Les
phases organiques sont réunies, séchées sur du sulfate de magnésium, filtrées
puis concentrées à
sec sous pression réduite pour donner 811 mg d'un produit brut qui est purifié
par
chromatographie flash sur une colonne de 70 g de silice (Merck 15-40 m;
éluant : acétate
d'éthyle 100). Après concentration des fractions sous pression réduite, on
obtient 470 mg d'une
huile jaune qui, après trituration dans du pentane, filtration et séchage sous
vide à une
température voisine de 40 C, donne 184 mg d'un solide jaune pâle. Ce dernier
est de nouveau
purifié par chromatographie flash sur une colonne de 10 g de silice (Merck 15-
40 rm ; éluant :
dichlorométhane/méthanol 98/2). Après concentration des fractions sous
pression réduite, on
obtient 159 mg d'un solide qui est séché 48 heures sous vide à une température
voisine de 40 C
pour donner 137 mg de 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-
5-fluoro-N-(pyrimidin-2-yl)benzamide sous la forme d'un solide jaune pâle.
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,77
(m, 2H);
3,03 (s, 3H); 3,37 (m, 2H); 4,41 (s, 1H); 4,73 (m, 1H); 7,26 (t, J=4,9 Hz,
1H); 7,31 (d, J=8,6 Hz,
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
4H); 7,36 (d, J=8,6 Hz, 4H); 7,47 (dt, J=9,5; 2,0 Hz, 1H); 7,67 - 7,83 (m,
2H); 8,73 (d, J=4,9 Hz,
2H); 11,17 (m étalé, 1H)
Spectre de masse: ES m/z=600 [M+H]+; ni/z=366 ([M+H-C13H8C12]+, pic de base);
m/z=235
[C13H9C12]+; m/z=598 [M-H]-
5 Analyse élémentaire:
Calculée: C. 56,01%- H: 4,03%- N: 11,66%- S: 5,34%
Mesurée: C: 55,26%- H: 4,03%- N: 11,50%- S: 5,22%- H20=0,85%
Exemple 6: 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-3-
yl}(méthylsulfonyl)amino]-5-
fluoro-N-(5-méthylisoxazol-3-yl)benzamide (Composé 21)
10 A une solution de 400 mg d'acide 3-[{1-[bis(4-chlorophényl)méthyl]azétidin-
3-
yl}(méthylsulfonyl)amino]-5-fluorobenzoïque et de 4 gouttes de
diméthylformamide dans 4 cm3
de dichlorométhane est additionnée une solution de 245 I de chlorure de
thionyle dans 1 cm3 de
dichlorométhane. Le milieu réactionnel est agité pendant 2 heures 20 minutes à
une température
voisine de 35 C, puis refroidi à une température voisine de 20 C, avant d'être
concentré à sec
15 sous pression réduite après ajout de quelques cm3 de toluène. Le solide
obtenu est solubilisé dans
10 cm3 de dichlorométhane et 10 cm3 de tétrahydrofuranne. A cette solution est
additionnée une
solution de 90 mg de 3-amino-5-méthyloxazole dans 2 cm3 de dichlorométhane. Le
milieu
réactionnel est agité à une température voisine de 20 C pendant une nuit avant
d'être concentré à
sec sous pression réduite. Le résidu obtenu est repris avec 50 cm3 de
dichlorométhane, 15 cm3
d'eau et 15 cm3 d'une solution aqueuse saturée en bicarbonate de sodium. Après
décantation, la
phase aqueuse est extraite 2 fois avec 30 cm3 de dichlorométhane. Les phases
organiques sont
réunies, lavées avec 15 cm3 d'une solution aqueuse saturée en chlorure de
sodium, séchées sur du
sulfate de sodium, filtrées puis concentrées à sec sous pression réduite pour
donner 0,44 g d'une
meringue. Ce produit brut est purifié par chromatographie flash sur une
colonne de 30 g de silice
(Merck 15-40 gm ; éluant : heptane/acétate d'éthyle 60/40). Après
concentration des fractions
sous pression réduite et séchage sous vide à une température voisine de 40 C,
on obtient 240 mg
de 3-[ { 1-[bis(4-chlorophényl)méthyl]azétidin-3-yl} (méthylsulfonyl)amino]-5-
fluoro-N-(5-
méthylisoxazol-3-yl)benzamide sous la forme d'un solide blanc.
Pf : 222-224 C
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé à 2,50 ppm): 2,42
(s large,
3H); 2,76 (m, 2H); 3,02 (s, 3H); 3,38 (m, 2H); 4,41 (s, 1H); 4,72 (m, 1H);
6,75 (s large, 1H); 7,31
(d, J=8,6 Hz, 4H); 7,36 (d, J=8,6 Hz, 4H); 7,49 (dt, J=9,3; 2,2 Hz, 1H); 7,79 -
7,85 (m, 2H);
11,45 (s, 1H)
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
16
Spectre de masse: ES m/z=603 [M+H]+; ni/z=601 [M-H]-
Analyse élémentaire:
Calculée: C: 55,73%- H: 4,18%- N: 9,28%- S: 5,31%
Mesurée: C: 55,72%- H: 4,18%- N: 9,17%- S: 5,32%
Le tableau 1 qui suit illustre les structures chimiques (I) et les propriétés
physiques de
quelques exemples de composés selon l'invention. Dans ce tableau :
- R représente un groupe méthyle;
- R3 et R4 représentent chacun un groupe phényle substitué par un atome de
chlore en
position para;
R3 SOF2
>--NN
R4 > O
Y N-R2
RI (I)
Tableau 1
R1~ R2
N N Y Caractérisations
f : 244 C ; Spectre RMN 1H (400 MHz ; (b en pp.) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,74 (m, 2H); 3,00 (s, 3H); 3,37 (m,
H); 4,39 (s, 1H); 4,74 (m, 1H); 7,27 (m masqué, 1H); 7,29 (d,
H N H =8,4 Hz, 4H); 7,35 (d, J=8,4 Hz, 4H); 7,51 - 7,61 (m, 3H); 8,02
S 8,08 (m, 2H); 12,72 (m étalé, 1H); Spectre de masse: ES m/z=587
(M+H)+; m/z=585 (M-H)- ; Analyse élémentaire: Calculée: C:
55,20%- H. 4,12%- N: 9,54%- S: 10,91%; Mesurée: C: 53,99%-
: 4,10%- N: 9,02%- S: 10,12% - H20 : 2,65%
S ectre RMN 1H (300 MHz ; (6 en ppm) ; (DMSO-d6) ; référenc é
H ' 2,50 ppm): 2,69 (m, 2H) ; 2,96 (s, 3H) ; 3,31 (in masqué, 2H) ;
2 'IN'--' L H 3,58 (m, 2H) ; 4,16 (t, J=6,1 Hz, 2H); 4,37 (s, 1H); 4,72 (m,
1H);
N 6,85 (s large, 1H); 7,14 (s large, 1H); 7,31 (d, J=8,7 Hz, 4H); 7,36
(d, J=8,7 Hz, 4H); 7,44 - 7,53 (in, 2H); 7,59 (s large, 1H); 7,70 (s
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
17
large, 1H); 7,76 (m, 1H); 8,65 (t large, J=5,6 Hz, 1H); S ectre de
masse: ES m/z=598 (M+H)+; m/z=364 ([M+H-C13HgC12]+, pic de
base); m/z=596 [M-H]- ; m/z=642 ([M+HCO2H-H]-, pic de base)
S ectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-d6) ; référencé
2,50 ppm): 2,74 (m, 2H); 3,01 (s, 3H); 3,37 (in, 2H); 4,39 (s,
H 1H); 4,74 (m, 1H); 7,30 (d, J=8,6 Hz, 4H); 7,35 (d, J=8,6 Hz, 4H);
3 NN N H 7,59 (m, 2H); 8,01 - 8,11 (m, 2H); 9,21 (s, 1H); 13,18 (m étalé,
S 1H); Spectre de masse: ES in/z=588 [M+H]+; Analyse élémentaire:
alculée: C: 53,06%- H: 3,94%- N: 11,90%- S: 10,90% ; Mesurée:
53,02%- H: 4,20%- N: 11,59%- S: 10,41% - H2O : 0,99%
f : 134 C ; Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,71 (m, 2H) ; 2,94 (s, 3H) ; 3,10 (s,
4 oNYN H 3H); 3,34 (m partiellement masqué, 2H); 4,10 (s, 2H); 4,39 (s,
N / OH 1H); 4,77 (m, 1H); 7,30 (d, J=8,6 Hz, 4H); 7,35 (d, J=8,6 Hz, 4H);
,35 (m, 2H); 7,99 (s large, 1H); 8,10 (m, 1H); 11,23 (m étalé, 1H);
Spectre de masse: ES m/z=600 [M+H]+; m/z=598 [M-H]-
f : 218 C ; Spectre RMN 1H (400 MHz ; (8 en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,74 (m, 2H); 3,00 (s, 3H); 3,36 (m,
H); 4,38 (s, 1H); 4,74 (m, 1H); 7,05 (d, J=1,7 Hz, 1H); 7,29 (d,
=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz, 4H); 7,56 (m, 2H); 7,95 (s large,
H N H 1H); 7,99 (m, 1H); 8,86 (d, J=1,7 Hz, 1H); 11,51 (s, 1H); S ectre
e masse: ES mlz=571 ([M+H]+, pic de base) ; m/z = 569 [M-H]-;
al se élémentaire: Calculée: C: 56,75%- H: 4,23%- N: 9,80%- S:
5,61%; Mesurée: C: 56,07%- H: 4,14%- N: 9,73%- S: 5,46% -
H20: 1,31%
f : 226 C ; Spectre RMN 1H (400 MHz ; (6 en ppin) ; (DMSO-
6) ; référencé à 2,50 ppm): 1,01 (m, 2H); 1,16 (in, 2H); 2,42 (m,
1H); 2,74 (m, 2H); 3,00 (s, 3H); 3,37 (m, 2H); 4,38 (s, 1H); 4,73
6 H-{N N H (m, 1H); 7,30 (d, J=8,5 Hz, 4H); 7,35 (d, J=8,5 Hz, 4H); 7,58 (m,
SJ'
H); 8,00 - 8,13 (m, 2H); 12,97 (m étalé, 1H); Spectre de masse:
ES m/z=628 ([M+H]+, pic de base) ; m/z=394 [M+H-C13H8C12]+ ;
z = 626 [M-H]-; Analyse élémentaire: Calculée: C: 55,41%- H:
,33%- N: 11,14%- S: 10,20%; Mesurée: C: 55,50%- H: 4,36%-
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
18
11,16%- S: 9,94%
f : 202 C ; Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,75 (m, 2H); 3,00 (s, 3H); 3,36 (m,
H); 4,39 (s, 1H); 4,75 (m, 1H); 7,18 (m, 1H); 7,30 (d, J=8,8 Hz,
7 /N N H H); 7,35 (d, J=8,8 Hz, 4H); 7,51 - 7,57 (m, 2H); 7,85 (m, 1H);
1,97 (s, 1H); 8,00 (m, 1H); 8,18 (d, J=8,4 Hz, 1H); 8,40 (d large,
=5,0 Hz, 1H); 10,89 (s large, 1H); Spectre de masse: ES m/z=581
[M+H]+; ni/z--347 [M+H-C13H8C12]+; m/z=579 [M-H] ; m/z=1159
[2M-H]-
f : 137 C ; Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
6) ; référencé à 2,50 pprn), tous les signaux sont larges avec : 2,74
8 INN H (m, 2H); 3,00 (s, 3H); 3,35 (m, 2H); 4,39 (s, IH); 4,74 (m, 1H);
NJ ,22 - 7,39 (m, 9H); 7,54 (m, 2H); 7,88 (s, 1H); 7,93 (in, 1H); 8,73
(d, J=4,9 Hz, 2H); 11,09 (s, 1H); Spectre de masse: ES m/z= 582
[M+H]+; m/z=235 ([C13H9C12]+, pic de base); m/z=580 [M-H]"
f : 150 C ; Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,74 (m, 2H); 2,99 (s, 3H); 3,36 (m,
H); 4,38 (s, 1H); 4,74 (m, 1H); 6,65 (m large, 1H); 7,30 (d, J=8,8
9 --N NH H z, 4H); 7,35 (d, J=8,8 Hz, 4H); 7,46 - 7,56 (m, 2H); 7,66
N
arge, 1H); 7,94 (s large, 1H); 7,97 (m, 1H); 10,90 (m large, 1H);
12,46 (m large, 1H); Spectre de masse: ES n /z=570 ([M+H]+, pic
e base); m/z=336 [M+H-C13H$C12]+; ni/z=1139 [2M+H]+
f : 255 C ; Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,73 (m, 2H); 3,00 (s, 3H); 3,37 (m,
HzN
H); 4,39 (s, 1H); 4,75 (ni, 1H); 6,07 (s large, 2H); 7,31 (d, J=8,8
-N-- 1 H
H N_o Hz, 4H); 7,36 (d, J=8,8 Hz, 4H); 7,59 (m, 2H); 7,91 (s large, 1H);
,97 (m, 1H); 10,98 (s large, 1H); Spectre de masse: ES in/z--587
([M+H]+, pic de base); m/z=1173 [2M+H]+
,N N f : 208 C ; Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
11 H d6); référencé à 2,50 ppm): 2,74 (m, 2H); 3,00 (s, 3H); 3,36 (m,
OH H); 4,39 (s, 1H); 4,75 (m, 1H); 6,58 (d large, J=5,9 Hz, 1H); 7,30
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
19
(d, J=8,6 Hz, 4H); 7,35 (d, J=8,6 Hz, 4H); 7,49 - 7,57 (m, 2H);
7,71 (m large, 1H); 7,90 - 8,00 (m, 2H); 8,07 (d large, J=5,9 Hz,
1H); 10,22 - 10,85 (m large, 2H); Spectre de masse: ES m/z=597
([M+H]+, pic de base); m/z=363 [M+H-C13H8C12]+
f : 174 C ; Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,74 (m, 2H); 2,98 (s, 3H); 3,38 (m,
O NHZ H); 4,42 (s, 1H); 4,78 (m, 1H); 7,30 (d, J=8,7 Hz, 4H); 7,36 (d,
12 H =8,7 Hz, 4H); 7,42 (m étalé, 1H); 7,61 (m étalé, 3H); 7,85
H N -NH 'talé, 3H); 11,15 (m étalé, 1H); 12,76 (m étalé, 1H); Spectre d
masse: ES m/z=613 [M+H]+; ni/z=379 [M+H-C13H$C12]+; m/z
611 [M-H]-
f : 210 C ; Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,70 (m, 2H); 2,97 (s, 3H); 3,34 (m
H artiellement masqué, 2H); 4,37 (s, 1H); 4,55 (d, J=5,9 Hz, 2H);
13 H ) > H ,73 (m, 1H); 7,31 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz, 4H); 7,46
N
-7,54 (m, 2H); 7,80 (s large, 1H); 7,87 (m, 1H); 8,17 (m étalé, 1H);
9,10 (t large, J=5,6 Hz, 1H); 13,80 (m très étalé, 1H); Spectre d
asse: ES m/z=585 [M+H]+; m/z=583 [M-H]-
f : 224 C ; Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,70 (m, 2H); 2,96 (s, 3H); 3,33 (m,
H); 4,37 (s, 1H); 4,47 (m étalé, 2H); 4,72 (m, 1H); 6,16 (s large,
14 sN N NH H 1H); 7,30 (d, J=8,7 Hz, 4H); 7,35 (d, J=8,7 Hz, 4H); 7,44 - 7,67
(m, 3H); 7,79 (s large, 1H); 7,86 (m, 1H); 8,96 (m étalé, IH); 12,57
(m étalé, 1H) ; Spectre de masse: ES m/z=584 ([M+H]+, pic de
ase); m/z=350 [M+H-C13HSC12]+
f : 264 C ; Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,68 (m, 2H); 2,95 (s, 3H); 3,33 (m
partiellement masqué, 2H); 3,62 (m, 2H); 4,29 (t, J=6,3 Hz, 2H);
15 ,37 (s, 1H); 4,71 (m, 1H); 6,17 (t, J=2,0 Hz, 1H); 7,31 (d, J=8,8
,N
, ~ H
z, 4H); 7,36 (d, J=8,8 Hz, 4H); 7,41 (d large, J=2,0 Hz, 1H); 7,44
7,52 (m, 2H); 7,67 (d, J=2,0 Hz, 1H); 7,70 (s large, 1H); 7,76 (m,
1H); 8,61 (t, J=5,7 Hz, 1H); Spectre de masse: ES m/z= 598
[M+H]+; m/z=364 [M+H-C13H$Cl2]+; m/z=596 [M-H] ; m/z=642
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
([M+HCO2H-H]", pic de base)
f : 120 C ; Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,69 (m, 2H); 2,95 (s, 3H); 3,14 (t,
=7,3 Hz, 2H); 3,33 (m, 2H); 3,71 (m, 2H); 4,37 (s, 1H); 4,72 (m,
H 1H); 7,28 - 7,39 (m, 9H); 7,41 - 7,54 (in, 2H); 7,72 (s large, 1H);
16 `N_,II N
H ,77 (m, 1H); 8,63 (t large, J=5,6 Hz, 1H); 8,71 (d, J=4,9 Hz, 2H);
N i
Spectre de masse: ES in/z=610 ([M+H]+, pic de base); m/z=376
[M+H-C13H$Cl2]+; Analyse élémentaire: Calculée: C: 59,02%- H:
,79%- N: 11,47%- S: 5,25%; Mesurée: C: 59,04%- H: 5,33%- N:
10,70%- S: 4,77% - H20: 1,10%
f : 219-221'C; Spectre RMN 1H (400 MHz ; (ô en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm): 2,76 (m, 2H); 3,03 (s, 3H);
,39 (in, 2H); 4,41 (s, 1H); 4,73 (m, 1H); 7,05 (d, J=1,7 Hz, 1H);
,31 (d, J=8,6 Hz, 4H); 7,36 (d, J=8,6 Hz, 4H); 7,50 (dt, J=9,5; 2,0
17 JH N-0 F Hz, 1H); 7,80 - 7,85 (in, 2H); 8,88 (d, J=1,7 Hz, 1H); 11,60 (s,
1H); Spectre de masse: ES m/z=589 [M+H]+; m/z=587 [M-H]-;
Analyse élémentaire: Calculée: C: 55,02%- H: 3,93%- N: 9,50%- S:
,44% ; Mesurée: C: 55,21%- H: 4,04%- N: 9,30%- S: 4,96%
Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé
2,50 ppm): 2,77 (m, 2H); 3,03 (s, 3H); 3,39 (m, 2H); 4,42 (s,
1H); 4,74 (m, 1H); 7,20 (dd large, J=7,2; 4,9 Hz, 1H); 7,31 (d,
=8,6 Hz, 4H); 7,37 (d, J=8,6 Hz, 4H); 7,46 (dt, J=9,5; 2,0Hz, 1H);
18 F 1,78 - 7,90 (m, 3H); 8,17 (d, J=8,3 Hz, 1H); 8,41 (d large, J=4,9
Hz, 1H); 10,99 (s, 1H); Spectre de masse: ES ni/z=599 [M+H];
tn/z=365 ([M+H-C13H8C12]+; pic de base); m/z=597 [M-H]-;Analyse
élémentaire: Calculée: C: 58,10%- H: 4,20%- N: 9,35%- S: 5,35% ;
Mesurée: C: 57,79%- H: 4,37%- N: 9,26%- S: 4,98%
Spectre RMN 1H (400 MHz ; (S en ppin) ; (DMSO-d6) ; référenc é
N ' 2,50 ppm): 2,77 (m, 2H); 3,03 (s, 3H); 3,40 (m, 2H); 4,41 (s,
19 H--</ J F 1H); 4,73 (m, 1H); 7,27 - 7,33 (m, 5H); 7,36 (d, J=8,6 Hz, 4H);
s 7,49 (dt, J=9,3; 2,2 Hz, 1H); 7,58 (d, J=3,7 Hz, 1H); 7,85 - 7,93
(m, 2H); 12,80 (m étalé, 1H); Spectre de masse: ES m/z=605
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
21
[M+H]+; in/z=371 [M+H-C13H8Cl2]+; in/z=235 ([Cl3H9CI21+, pic de
base); ni/z--603 [M-H}
'
S ectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-d6) ; référencé
2,50 ppm): 2,77 (m, 2H); 3,03 (s, 3H); 3,37 (m, 2H); 4,41 (s,
1H); 4,73 (m, 1H); 7,26 (t, J=4,9 Hz, 1H); 7,31 (d, J=8,6 Hz, 4H);
H ,36 (d, J=8,6 Hz, 4H); 7,47 (dt, J=9,5; 2,0 Hz, 1H); 7,67 - 7,83
20 II F (m, 2H); 8,73 (d, J=4,9 Hz, 2H); 11,17 (in étalé, 1H); Spectre de
N
asse: ES ni/z--600 [M+H]+; m/z=366 ([M+H-C13H8C12]+, pic de
ase); m/z=235 [C13H9C12]+; m/z=598 [M-H] Analyse élémentaire:
Calculée: C: 56,01%- H: 4,03%- N: 11,66%- S: 5,34%; Mesurée:
55,26%- H: 4,03%- N: 11,50%- S: 5,22% - H2O : 0,85%
f : 222-224 C ; Spectre RMN 1H (400 MHz ; (S en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm): 2,42 (s large, 3H); 2,76 (m,
H); 3,02 (s, 3H); 3,38 (m, 2H); 4,41 (s, 1H); 4,72 (in, 1H); 6,75 (s
21 N--I F large, 1H); 7,31 (d, J=8,6 Hz, 4H); 7,36 (d, J=8,6 Hz, 4H); 7,49
~H N-0 (dt, J=9,3; 2,2 Hz, 1H); 7,79 - 7,85 (m, 2H); 11,45 (s, 1H); S ectr
e masse: ES m/z=603 [M+H]+; ni/z--601 [M-H]-; Analys
élémentaire: Calculée: C: 55,73%- H: 4,18%- N: 9,28%- S: 5,31 % ;
Mesurée: C: 55,72%- H: 4,18%- N: 9,17%- S: 5,32%
Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-d6) ; référencé
s ' 2,50 ppm): 2,77 (m, 2H); 3,04 (s, 3H); 3,40 (m, 2H); 4,41 (s,
22 N F F 1H); 4,73 (m, 1H); 7,30 (d, J=8,7 Hz, 4H); 7,36 (d, J=8,7 Hz, 4H);
F F 1,52 (d large, J=9,2 Hz, 1H); 7,87 - 7,95 (m, 2H); 8,04 (m large,
1H); 13,21 (s, 1H); Spectre de masse: ES m/z=673 [M+H]+;
M=671 [M-H]-
Spectre RMN 1H (400 MHz ;. (6 en ppm) ; (DMSO-d6) ; référencé
2,50 ppm): 2,37 (s, 3H); 2,76 (m, 2H); 3,03 (s, 3H); 3,39 (m,
H); 4,41 (s, 1H); 4,76 (m, 1H); 6,94 (s, 1H); 7,31 (d, J=8,6 Hz,
23 N YI F H); 7,36 (d, J=8,6 Hz, 4H); 7,55 (dt, J=9,6; 2,0 Hz, 1H); 7,84 (t,
H SAN
1=2,0 Hz, 1H); 7,87 (dt, J=9,0; 2,0 Hz, 1H); 12,30 (s large, 1H);
S ectre de masse: ES m/z=619 [M+H]+; in/z=385 ([M+H-
13H8Cl2]+, pic de base); m/z=235 [C13H9C12]+; m/z=617 [M-H]"
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
22
f : 234-236 C; Spectre RMN 1H (400 MHz ; (S en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm): 2,75 (m, 2H); 3,02 (s, 3H);
3,34 - 3,41 (m, 2H); 4,40 (s, 1H); 4,75 (in, 1H); 7,31 (d, J=8,7 Hz,
1H); 7,37 (d, J=8,7 Hz, 4H); 7,52 (dt, J=9,3; 2,2 Hz, IH); 7,74
N
24 _- \ ô F 7,80 (m, 2H); 8,75 (s, 1H); 9,27 (s, 1H); 10,81 (s large, 1H);
S ectre de masse: ES m/z=589 ([M+H]+, pic de base); m/z=235
[C13H9Cl2]+; in/z=587 ([M-H]", pic de base); m/z=1175 [2M-H]-;
Analyse élémentaire: Calculée: C: 55,02%- H: 3,93%- N: 9,50%- S:
5,44% ; Mesurée: C: 54,72%- H: 4,06%- N: 9,3 9%- S: 5,24%
Spectre RMN 1H (400 MHz ; (â en ppm) ; (DMSO-d6) ; référenc é
2,50 ppm): 2,31 (s, 3H); 2,77 (m, 2H); 3,03 (s, 3H); 3,39 (m,
H); 4,41 (s, 1H); 4,72 (m, 1H); 6,83 (s, 1H); 7,30 (d, J=8,8 Hz,
25 -- -~~N F H); 7,36 (d, J=8,8 Hz, 4H); 7,47 (dt, J=9,5; 2,0 Hz, 1H); 7,82
s
,94 (m, 2H); 12,74 (in étalé, 1H); Spectre de masse: ES m/z=619
[M+H]+; m/z=385 ([M+H-C13H8Cl2]+, pic de base); m/z=235
[C13H9C12]+; m/z=617 ([M-H]-, pic de base);
f : 224-226 C; Spectre RMN 1H (400 MHz ; (6 en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm): 2,22 (s, 3H); 2,76 (m, 2H);
3,02 (s, 3H); 3,38 (m, 2H); 4,41 (s, 1H); 4,73 (m, 1H); 6,32 (s,
1H); 7,31 (d, J=8,6 Hz, 4H); 7,36 (d, J=8,6 Hz, 4H); 7,50 (dt,
26 N F =9,5; 2,2 Hz, 1H); 7,73 - 7,87 (m, 2H); 12,03 (m, 1H); Spectre d
o-
asse: ES m/z=603 ([M+H]+, pic de base); m/z=235 [C13H9C12]+;
z=601 [M-H]-; Analyse élémentaire: Calculée: C: 55,73%- H:
1,18%- N: 9,28%- S: 5,31%; Mesurée: C: 55,56%- H: 4,17%- N:
9,10%- S: 4,75%
f : 184-186 C; Spectre RMN 1H (400 MHz ; (â en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm): 2,36 (s, 3H); 2,78 (m, 2H);
3,03 (s, 3H); 3,38 (m, 2H); 4,42 (s, 1H); 4,74 (m, 1H); 7,04 (dd,
N-
27 ~N F =4,9; 1,5 Hz, 1H); 7,31 (d, J=8,6 Hz, 4H); 7,37 (d, J=8,6 Hz, 4H);
,46 (dt, J=9,3; 2,2 Hz, 1H); 7,77 - 7,86 (m, 2H); 8,02 (s large,
1H); 8,26 (d, J=4,9 Hz, 1H); 10,90 (s, 1H); Spectre de masse:
S m/z=613 [M+H]+; m/z=379 ([M+H-C13H8C12]+, pic de base);
z=235 [Ci3H9C12]+; m/z=611 [M-H]; Analyse élémentaire:
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
23
Calculée: C: 58,73%- H: 4,44%- N: 9,13%- S: 5,23% ; Mesurée: C:
58,99%- H: 4,66%- N: 8,77%- S: 4,85%
f : 176-178 C; Spectre RMN 1H (400 MHz ; (6 en ppm) ;
(DMSO-d6) ; référencé à 2,50 ppm) : 2,46 (s, 3H); 2,78 (m, 2H);
3,03 (s, 3H); 3,38 (m, 2H); 4,42 (s, 1H); 4,74 (m, 1H); 7,05 (d,
=8,0 Hz, 1H); 7,30 (d, J=8,7 Hz, 4H); 7,37 (d, J=8,7 Hz, 4H);
28 N-. F ,45 (dd, J=9,3; 2,0 Hz, 1H); 7,74 (t, J=8,0 Hz, 1H); 7,79 - 7,88
-'H (m, 2H); 7,99 (d, J=8,0 Hz, 1H); 10,92 (s, 1H); Spectre de masse-
ES m/z=613 [M+H]+; m/z=379 ([M+H-C13H$C12]+, pic de base);
z=235 [C]3H9C12]+ ; m/z=611 [M-H]-; Analyse élémentaire:
alculée: C: 58,73%- H: 4,44%- N: 9,13%- S: 5,23%; Mesurée: C:
58,48%- H: 4,83%- N: 8,75%- S: 4,88% - H2O : 2,65%
S ectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-d6) ; référencé
2,50 ppm): 2,77 (m, 2H); 3,02 (s, 3H); 3,38 (m, 2H); 4,41 (s,
1H); 4,73 (m, 1H); 6,65 (s large, 1H); 7,31 (d, J=8,6 Hz, 4H); 7,36
NON
29 -~H F (d, J=8,6 Hz, 4H); 7,43 (dt, J=9,5; 2,0 Hz, 1H); 7,67 (s large, 1H);
,76 - 7,95 (m, 2H); 11,00 (s large, 1H); 12,49 (s large, 1H);
Spectre de masse: ES m/z=588 [M+H]+; m/z=354 [M+H-
13H8C12]+; m/z=235 ([C13H9C12]+, pic de base); m/z=586 [M-H]"
f : 210 C; Spectre RMN 1H (400 MHz ; (6 en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,73 (m, 2H); 2,98 (s, 3H); 3,35 (m,
H); 4,38 (s, 1H); 4,75 (m, 1H); 5,78 (s, 2H); 6,46 (d, J=8,8 Hz,
H
30 /N N H 1H); 7,30 (d, J=8,8 Hz, 4H); 7,36 (d, J=8,8 Hz, 4H); 7,44 - 7,60
NH2 (m, 2H); 7,66 (dd, J=8,8; 2,6 Hz, 1H); 7,85 (t, J=1,5 Hz, 1H); 7,92
(dt, J=7,3; 1,5 Hz, 1H); 8,18 (d, J=2,6 Hz, 1H); 9,99 (s, 1H);
Spectre de masse: ES m/z=596 [M+H]+; ni/z=362 [M+H-
13HsC12]+; m/z=235 ([C13H9C12]+, pic de base)
f : 222 C ; Spectre RMN 1H (400 MHz ; (S en ppm) ; (DMSO-
NHZ 6) ; référencé à 2,50 ppm): 2,72 (m, 2H); 2,97 (s, 3H); 3,35 (m,
N H); 4,40 (s, 1H); 4,73 (m, 1H); 5,65 (s large, 2H); 7,30 (d, J=8,8
31 N ~N H
H N' Hz, 4H); 7,36 (d, J=8,8 Hz, 4H); 7,48 - 7,55 (m, 2H); 7,62 (s large,
H
H); 7,93 (s large, 1H); 8,04 (m, 1H); Spectre de masse:
S m/z=586 [M+H]+ ; m/z=352 [M+H-C13H$C12]+ ; ni/z=235
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
24
([C13H9C12]+, pic de base) ; Analyse élémentaire: Calculée: C:
53,25%- H: 4,30%- N: 16,72%- S: 5,47%; Mesurée: C: 53,33%-
: 4,34%- N: 16,63%- S: 5,26%
f : 209 C ; Spectre RMN 1H_ (300 MHz ; (S en ppm) ; (DMSO-
OH 16); référencé à 2,50 ppm): 2,71 (m, 2H); 2,96 (s, 3H); 3,33 (m
masqué, 2H); 4,37 (s, 1H); 4,45 (d, J=6,3 Hz, 2H); 4,73 (m, 1H);
32 H N H
O 5,85 (s, 1H); 7,30 (d, J=8,8 Hz, 4H); 7,35 (d, J=8,8 Hz, 4H); 7,42
7,59 (m, 2H); 7,79 (s large, 1H); 7,85 (m, 1H); 9,13 (t, J=6,3 Hz,
1H); Spectre de masse: ES ni/z=601 [M+H]+
f : 124 'C; Spectre RMN 1H (400 MHz ; (8 en ppm) ; (DMSO-
6) ; référencé à 2,50 ppm): 2,70 (m, 2H); 2,96 (s, 3H); 3,33
H partiellement masqué, 2H); 4,37 (s, 1H); 4,71 (d, J=5,6 Hz, 2H);
33 NIA g N H
N ,74 (m, 1H); 7,31 (d, J=8,4 Hz, 4H); 7,35 (d, J=8,4 Hz, 4H); 7,45
H
7,56 (m, 2H); 7,80 (s large, 1H); 7,86 (m, 1H); 9,15 (t, J=5,6 Hz,
1H); Spectre de masse: ES m/z=586 [M+H]+; m/z=584 [M-H]-
f : 165 C ; Spectre RMN 1H (400MHz, ô en ppm , DMSO-d6) :
/N N .77 (m, , 2 H); 3.03 (s, 3 H); 3.38 (m, 2 H); 4.42 (s, 1H); 4.74
34 F (quin, J=6.6 Hz, 1 H); 7.29 à 7.33 (m, 4 H); 7.34 à 7.41 (m, 4 H);
49 (d, J=9.3 Hz, 1 H); 7.64 (d,J=4.9 Hz, 1 H); 7.79 à 7.90 (m, 2
N ); 8.48 (s, 1 H); 8.66 (d, J=4.9 Hz, 1 H); 11.43 (s large, 1 H)
Spectre de masse: ES [M+H]+ : m/z 624 ; [M-H]- : m/z 622
Spectre RMN 1H (400MHz, 6 en ppm , DMSO-d6) : 2.71 à 2.77
(m, 2 H); 3.01 (s, 3 H); 3.33 à 3.39 (m, 2H); 4.40 (s, 1 H); 4.57 (d,
N N
35 H ~ F =6.0 Hz, 2 H); 4.72 (dq, J=6.7 et 6.8 Hz, 1 H); 7.25 à 7.38 (m, 9
7.44(dt,J2.2et 9.5Hz,1H);7.68à7.78(m,3H);8.50(d,
=3.9 Hz, 1 H); 9.25 (t, J=6.0 Hz, 2 H) Spectre de masse:
S [M+H]+ : m/z 613 ; [M-H]- : m/z 611
Spectre RMN 1H (400MHz,,6 en ppm , DMSO-d6) : 2.69 à 2.76
(m, 2 H); 2.99 (s, 3 H); 3.33 à 3.43 (m, 2H); 4.40 (s, 1 H); 4.50 (d,
36 N F =5.8 Hz, 2 H); 4.72 (quin, J=6.6 Hz, 1 H); 7.28 à 7.38 (in, 9 H);
7.44 (dt, J=1.9et 9.6 Hz, 1 H); 7.64 à 7.75 (m, 3 H); 8.47 (dd,
=1.8 et 4.8 Hz, 1 H); 8.56 (d, J=1.3 Hz, 1 H); 9.22 (t, J=5.8 Hz, 1
Spectre de masse: ES [M+H]+ : mlz 613 ; [M-H]- : m/z 611
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
Spectre RMN 1H (400MHz, ô en ppm , DMSO-d6) : 1.52 (d, J=7.3
Hz, 3 H); 2.68 à 2.76 (m, 2 H); 2.99 (s,3 H); 3.37 (m masqué, 2 H);
.40 (s, 1 H); 4.73 (quin, J=6.7 Hz, 1 H); 5.18 (q, 7.3 Hz, 1 H);
37 H N F 7.29 à 7.38 (m,9 H); 7.45 (dt, J=2.2 et 9.3 Hz, 1 H); 7.68 (s, 1 H);
.73 à 7.81 (m, 2 H); 8.46 (dd, J=1.7 et 4.9 Hz, 1 H); 8.61 (d,
=2.2 Hz, 1 H); 9.02 (d, J=7.6 Hz, 1 H) Spectre de masse:
S [M+H]+ : m/z 627 ; [M-H]- : m/z 625
Spectre RMN 1H (400MHz, 6 en ppm , DMSO-d6) : 1.19 (d, J=6.6
Hz, 3 H); 2.65 à 2.74 (m, 2 H); 2.83 (d,J=7.1 Hz, 2 H); 2.99 (s, 3
H ); 3.28 à 3.32 (m masqué, 2 H); 4.17 à 4.28 (m, lH); 4.61 (s, 1
38 N F ; 4.72 (q,J=6.6 Hz, 1 H); 7.15 à 7.25 (in, 1 H); 7.27 à 7.45 (m, 9
); 7.50 à 7.65 (m, 3 H); 8.34 (dd, J=1.7 et 4.6 Hz,1 H); 8.40
8.50 (m, J=2.4 Hz, 2 H) Spectre de masse: ES [M+H]+ : m/z 641
[M-H]- : m/z 639
Spectre RMN 1H (400MHz, S en ppm, DMSO-d6) : 1.52 (d, J=7.1
Hz, 3 H); 2.70 à 2.78 (m, 2 H); 2.99 (s,3 H); 3.30 à 3.33
39 N N F masqué, 2 H); 4.40 (s, 1 H); 4.72 (, J=6.2 et 6.5 et 6.6 Hz, 1 H);
H 5.19 (qd, J=7.1 et 7.3Hz, 1 H); 7.20 à 7.48 (m, 11 H); 7.60 à 7.84
(m, 3 H); 8.51 (d, J=4.6 Hz, 1 H); 8.96 (d, J=7.8 Hz, 1 H) Spectre
e masse: ES [M+H]+ : m/z 627 ; [M-H]- : m/z 625
Spectre RMN 1H (400MHz, â en ppm , DMSO-d6) : 2.62 (s, 3 H);
.70 à 2.77 (m, 2 H); 3.00 (s, 3 H); 3.32à 3.39 (m, 2 H); 4.40 (s, 1
N ); 4.51 (d, J=5.9 Hz, 2 H); 4.72 (quin, J=6.7 Hz, 1 H); 7.24 (s, 1
40 H ~%- F
s ); 7.28 à 7.38(m, 8 H); 7.42 (dt, J=2.3 et 9.4 Hz, 1 H); 7.66
77 (m, 2 H); 9.15 (t, J=6.0 Hz, 1 H) Spectre de masse: ES
[M+H]+ : m/z 633 ; [M-H]- : m/z 631
Spectre RMN 1H (400MHz, ô en ppm, DMSO-d6) : 1.16 (d, J=6.6
Hz, 3 H); 2.72 (q, J=5.5 Hz, 2 H); 2.99(s, 3 H); 3.32 à 3.45 (m, 2
41 F ); 4.23 à 4.48 (m, 4 H); 4.71 (quin, J=6.8 Hz, 1 H); 7.29 à 7.39
H (m, 8 H); 7.41(dt, J=2.4 et 9.3 Hz, 1 H); 7.53 à 7.63 (m, J=1.0 Hz,
H); 7.89 (s, 1 H); 8.41 à 8.50 (m, 2 H) Spectre de masse:
S [M+H]+ : m/z 631 ; [M-H]- : m/z 629
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
26
Spectre RMN 1H (400MHz, ô en ppm , DMSO-d6) : 1.51 (d, J=7.1
z, 3 H); 2.62 (s, 3 H); 2.74 (q, J=6.9Hz, 2 H); 3.00 (s, 3 H); 3.31
3.40 (m, 2 H); 4.40 (s, 1 H); 4.72 (quin, J=6.7 Hz, 1 H); 5.25
42 F (quin, J=7.3 Hz,1 H); 7.24 (s, 1 H); 7.27 à 7.39 (m, 8 H); 7.42 (dt,
s =2.2 et 9.5 Hz, 1 H); 7.69 (s, 1 H); 7.76 (d, J=8.8 Hz, 1H); 8.91
(d, J=7.8 Hz, 1 H) Spectre de masse: ES [M+H]+ : m/z 647 ; [M-
: m/z 645
Spectre RMN 1H (400MHz, 6 en ppm , DMSO-d6) : 1.45 (d, J=6.8
Hz, 3 H); 2.69 à 2.76 (m, 2 H); 2.99 (s,3 H); 3.32 à 3.38 (m, 2 H);
43 F 3.78 (s, 3 H); 4.40 (s, 1 H); 4.65 à 4.77 (m, 1 H); 5.13 (quin, J=7.3
N N
H N Hz, 1 H);7.27 à 7.49 (m, 10 H); 7.60 (s, 1 H); 7.67 (s, 1 H); 7.71
(d, .1=9.3 Hz, 1 H); 8.72 (d, J=8.1 Hz, 1 H) Spectre de masse:
S [M+H]+ : m/z 630 ; [M-H]- : m/z 628
Spectre RMN 1H (400MHz, 6 en ppm , DMSO-d6) : 2.73 à 2.79
(m, 2 H); 3.03 (s, 3 H); 3.35 à 3.42 (m, 2H); 4.42 (s, 1 H); 4.76
H (dq, J=6.7 et 7.0 Hz, 1 H); 7.29 à 7.39 (m, 8 H); 7.42 (dd, J=4.6 e
44 I \ N F 8.3 Hz, 1 H); 7.51(dt, J=2.2 et 9.5 Hz, 1 H); 7.77 (s, 1 H); 7.79
7.85 (m, 1 H); 8.11 à 8.17 (m, 1 H); 8.32 à 8.36 (m, 1 H);8.90 (d,
=2.7 Hz, 1 H); 10.49 (s, 1 H) Spectre de masse: ES [M+H]+ : m/
599 ; [M-H]- : m/z 597
Spectre RMN 1H (400MHz, 6 en ppm , DMSO-d6) : 1.12 (d, J=6.8
Hz, 3 H); 2.69 à 2.77 (m, 2 H); 2.99 (s,3 H); 3.32 à 3.40 (m, 2 H);
45 F .15 à 4.30(m,2H);4.31à4.44(m,2H);4.71(,J=6.7et6.8e
H .1 Hz, 1 H);6.13 (t, J=2.1 Hz, 1 H); 7.24 à 7.46 (m, 10 H); 7.53
62 (m, 2 H); 7.66 (d, J=2.2 Hz, 1 H); 8.43 (d, J=8.lHz, 1 H)
Spectre de masse: ES [M+H]+ : m/z 630 ; [M-H]- : m/z 628
Spectre RMN 1H (400MHz, ô en ppm , DMSO-d6) : 2.70 à 2.78
(m, J=7.6 et 7.6 Hz, 2 H); 3.00 (s, 3 H);3.33 à 3.40 (m, 2 H); 4.40
46 \ F (s, 1 H); 4.50 (d, J=5.9 Hz, 2 H); 4.72 (quin, J=6.6 Hz, 1 H); 7.25
H
N ' 7.39 (m, 10H); 7.45 (ddd, J=2.2 et 2.3 et 9.4 Hz, 1 H); 7.64
75 (m, 2 H); 8.50 (d, J=5.9 Hz, 2 H); 9.25 (t, J=6.1 Hz,1 H)
S ectre de masse: ES [M+H]+ : m/z 613 ; [M-H]- : rn/z 611
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
27
Spectre RMN 1H (400MHz, S en ppm , DMSO-d6) : 2.68 à 2.75
(m, 2 H); 2.98 (s, 3 H); 3.32 à 3.38 (m, 2H); 4.19 (d, J=5.6 Hz, 2
H NH F ); 4.39 (s, 1 H); 4.71 (quin, J=6.7 Hz, 1 H); 6.30 (d, J=9.5 Hz, 1
47
o 1); 7.26 à 7.38(m, 9 H); 7.42 (dd, J=2.6 et 9.4 Hz, 2 H); 7.61
7.69 (m, 2 H); 8.97 (t, J=5.7 Hz, 1 H); 11.44 (s large, 1 H) S ectre
e masse: ES [M+H]+ : m/z 629 ; [M-H]- : m/z 627
Spectre RMN 1H (400MHz, 6 en ppm, DMSO-d6) : 1.49 (d, J=7.1
z, 3 H); 2.69 à 2.79 (m, 2 H); 2.99 (s,3 H); 3.33 à 3.38 (m, 2 H);
48 40 (s, 1 H); 4.73 (quin, J=6.7 Hz, 1 H); 5.13 (qd, J=6.8 et 7.1 Hz,
H F
N 1 H); 7.25 à 7.40 (m, 10 H); 7.45 (d, J=8.6 Hz, 1 H); 7.69 (s, 1 H);
77 (d, J=8.4 Hz, 1 H); 8.44 à 8.53 (m, 2 H); 8.99(d, J=7.6 Hz, 1
Spectre de masse: ES [M+H]+ : m/z 627 ; [M-H]- : m/z 625
Spectre RMN 1H (400MHz, 6 en ppm , DMSO-d6) : 2.69 à 2.75
(m, 2 H); 2.99 (s, 6 H); 3.29 (s, 3 H); 3.32 à 3.38 (m, 2 H); 4.32 (d,
=5.6 Hz, 2 H); 4.39 (s, 1 H); 4.71 (dq, J=6.7 et 7.0 Hz, 1 H); 6.59
H / IN
49 N F (d, J=8.8 Hz, 1H); 7.33 (d, J=10.3 Hz, 8 H); 7.41 (dt, J=2.3 et 9.4
Hz, 1 H); 7.47 (dd, J2.4 et 8.8 Hz, 1 H); 7.60 à 7.71 (m, J=0.7 e
1.5 Hz, 2 H); 8.06 (d, J=1.7 Hz, 1 H); 9.02 (t, J=5.6 Hz, 1 H)
Spectre de masse: ES [M+H]+ : m/z 656 ; [M-H]- : m/z 654
Spectre RMN 1H (400MHz, â en ppm, DMSO-d6) : 1.21 (d, J=6.6
Hz, 3 H); 2.65 à 2.76 (m, 2 H); 2.93 à3.1(m, 5 H); 3.30 à 3.39
50 N IN F (m, 2 H); 4.34 à 4.50 (m, 2 H); 4.71 (quin, J=6.7 Hz, 1 H); 7.26 à
N,% 7.44 (m, 9 H);7.52 à 7.61 (m, 2 H); 8.41 (d, J=2.7 Hz, 1 H); 8.43 à
8.50 (in, 2 H); 8.54 (d, J=1.5 Hz, 1 H) Spectre de masse:
S [M+H]+ : m/z 642; [M-H]- : m/z 640
Spectre RMN 1H (400MHz, ô en ppm , DMSO-d6) : 2.71 à 2.80
(m, 2 H); 3.03 (s, 3 H); 3.35 à 3.41 (m, 2H); 4.42 (s, 1 H); 4.76
N
51 F (quin, J6.7 Hz, 1 H); 7.28 à 7.40 (m, 8 H); 7.52 (dt, J=2.2 et 9.6
iN z,1H);7.72à7.77(m,3H);7.79à7.85(m,1H);8.44à8.55
(m, 2 H); 10.61 (s, 1 H) Spectre de masse: ES [M+H]+ : m/z 599 ;
[M-H]-: m/z 597
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
28
Spectre RMN 1H (400MHz, 8 en ppm , DMSO-d6) : 2.69 à 2.76
(m, J=7.6 et 7.6 Hz, 2 H); 2.99 (s, 3 H);3.33 à 3.52 (m, 4 H); 4.40
OH
52 ~IN F (s, 1 H); 4.67 à 4.81 (ni, 2 H); 5.76 (d, J=4.6 Hz, 1 H); 7.28 à 7.44
(m, 11 H);7.58 à 7.66 (m, J=2.2 Hz, 2 H); 8.47 à 8.51 (m, 2 H);
8.74 (t, J=5.5 Hz, 1 H) Spectre de masse: ES [M+H]+ : m/z 643
[M-H]- : m/z 641
Les composés selon l'invention ont fait l'objet d'essais pharmacologiques
permettant de
déterminer l'activité vis-à-vis des récepteurs humains aux cannabinoïdes de
type CB1. L'efficacité
des composés de formule (I) a été déterminée dans un test fonctionnel mesurant
l'activité des
récepteurs aux cannabinoïdes CBI (test de VAMP cyclique intracellulaire). Le
test de détection de
l'AMP cyclique intracellulaire dans les cellules U373MG exprimant
naturellement le récepteur CB1
humain, a été effectué comme décrit dans la référence: Bouaboula et al., 1995,
J. Biol. Chem.
270:13973-13980. Le kit HTRF cAMP Dynamic Kit de CisBio a été utilisé pour la
quantification de
l'AMP cyclique intracellulaire. Dans ce test, les CI50 sont comprises entre
0,001 M et 2 M.
Par exemple, les composés n S 5, 10, 11, 15, 18, 34, 39 et 47 ont montré des
CI5o
respectivement 0,006 ; 0,04 ; 0,170 ; 0,134 ; 0,006, 0,02, 0,033 et 0,009 M.
D'autres essais consistant à mesurer l'activité in vivo des composés de
l'invention ont été
effectués. Leur activité antagoniste a été montrée au moyen du modèle
d'hypothermie induite par un
agoniste des récepteurs aux cannabinoïdes CB1 (CP55,940 racémique (1RS, 3RS,
4RS)- 3-
[hydroxy-2-(1,1-diméthylheptyl)phényl]-4-(3-hydroxypropyl)cyclohexane-1-ol) à
une dose de
1,25mg/kg) chez la souris, selon la méthode décrite par Pertwee R.G. dans
Marijuana 84, Harvey
D.J. eds, Oxford IRL Press, 263-277 (1985).
Par exemple, les composés n s 5 et 7 ont montré respectivement un pourcentage
d'inhibition de 28%
et 32% à 3mg/kg po .
Leur activité antagoniste a également été montrée au moyen du modèle de
l'inhibition du
transit gastrointestinal induit par le CP55,940 racémique (1RS, 3RS, 4RS-3-
[hydroxy-2-(1,1-
diméthylheptyl)phényl]-4-(3-hydroxypropyl)cyclohexane-l-ol) chez la souris,
selon la méthode
décrite par Rinaldi-Carmona et al., J.Pharmacol.Exp.Ther. 2004, 310, 905-914.
En bref, des souris
mâles CD1 reçoivent le produit à tester per os 30 minutes ou 2 heures avant
l'administration de
l'agoniste CP55,940 racémique (1RS, 3RS, 4RS-3-[hydroxy-2-(1,1-
diméthylheptyl)phényl]-4-(3-
hydroxypropyl)cyclohexane-1-ol) (0,15 mg/kg ip en crémophore 10%). Après
encore 30 minutes,
les animaux reçoivent un bolus de charbon po. Trente minutes plus tard, les
animaux sont
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
29
euthanasiés (C02/02) et l'intestin est disséqué. La progression du bolus de
charbon dans l'intestin est
exprimée en pourcentage de la longueur totale de l'intestin.
Par exemple, les composés n 5 5 , 7 , 34, 39 et 47 ont montré un pourcentage
d'inhibition à lmg/kg
respectivement de 82% , 68 %, 46%, 66% et 68% à 3 heures après
l'administration du produit.
En conséquence, les composés de l'invention de formule (I) sont des
antagonistes des récepteurs aux
cannabinoïdes de type CB1 in vitro et in vivo. Certains composés sont actifs
in vivo à la fois sur le
test d'hypothermie et de transit, et certains composés montrent des activités
dissociées entre le test
d'hypothermie et de transit.
Ainsi les composés selon l'invention peuvent être utilisés dans le traitement
ou la prévention
de maladies impliquant les récepteurs aux cannabinoïdes CB1. Ces composés
présentent une activité
périphérique dissociée de l'activité centrale.
Par exemple et de manière non limitative, les composés de formule (I) sont
utiles comme
médicaments psychotropes, notamment pour le traitement des désordres
psychiatriques incluant
l'anxiété, la dépression, les troubles de l'humeur, l'insomnie, les troubles
délirants, les troubles
obsessionnels, les psychoses en général, la schizophrénie, les troubles
déficit de l'attention et de
l'hyperactivité (TDAH) chez les enfants hyperkinétiques (MBD) ainsi que pour
le traitement des
troubles liés à l'utilisation de substances psychotropes, notamment dans le
cas d'un abus d'une
substance et/ou de dépendance à une substance, y compris la dépendance
alcoolique et la
dépendance nicotinique et les troubles de sevrage. Les composés de formule (I)
selon l'invention
peuvent être utilisés comme médicaments pour le traitement de la migraine, du
stress, des maladies
d'origine psychosomatique, des crises d'attaques de panique, de l'épilepsie,
des troubles du
mouvement, en particulier des dyskinésies ou de la maladie de Parkinson, des
tremblements et de la
dystonie.
Les composés de formule (I) selon l'invention peuvent être utilisés comme
médicaments
pour le cancer de la peau et la protection de la peau.
Les composés de formule (I) selon l'invention peuvent également être utilisés
comme
médicaments dans le traitement des troubles mnésiques, des troubles cognitifs,
en particulier dans le
traitement des troubles cognitifs liés aux démences séniles, à la maladie
d'Alzheimer, à la
schizophrénie et aux maladies neurodégénératives, ainsi que dans le traitement
des troubles de
l'attention ou de la vigilance.
De plus, les composés de formule (I) peuvent être utiles comme
neuroprotecteurs, dans le
traitement de l'ischémie, des traumatismes crâniens et le traitement des
maladies
neurodégénératives : incluant la chorée de Huntington, le syndrome de
Tourrette.
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
Les composés de formule (I) selon l'invention peuvent être utilisés comme
médicaments
dans le traitement de la douleur : les douleurs neuropathiques, les douleurs
aiguës périphériques, les
douleurs chroniques et les douleurs d'origine inflammatoire.
Les composés de formule (I) selon l'invention peuvent être utilisés comme
médicaments
5 dans le traitement des troubles de l'appétit, de l'appétence (pour les
sucres, carbohydrates, drogues,
alcools ou toute substance appétissante) et/ou des conduites alimentaires,
notamment pour le
traitement de la boulimie ainsi que pour le traitement du diabète de type II
ou diabète non
insulinodépendant et pour le traitement des dyslipidémies, du syndrome
métabolique. Ainsi les
composés de formule (I) selon l'invention sont utiles dans le traitement de
l'obésité et des risques
10 associés à l'obésité, notamment les risques cardio-vasculaires.
De plus, les composés de formule (I) selon l'invention peuvent être utilisés
en tant que
médicaments dans le traitement des troubles gastro-intestinaux, des troubles
diarrhéiques, des
ulcères, des vomissements, des troubles vésicaux et urinaires, des troubles
d'origine endocrinienne,
des troubles cardio-vasculaires, de l'hypotension, du choc hémorragique, du
choc septique, de la
15 cirrhose, de la fibrose hépatique, de la stéatohépatite et de la stéatose
hépatique, quelle que soit
l'étiologie de ces affections : en particulier virus, alcool, médicament,
produit chimique, maladie
auto-immune, obésité, diabète, maladie métabolique congénitale,
(hémochroinatose, déficit en alpha-
1 antitrypsine, maladie de Wilson, etc...), de la cirrhose chronique du foie,
des fibroses, de la
stéatohépatite non alcoolique (NASH), de l'asthme, des maladies pulmonaires
chronique
20 obstructive, du syndrome de Raynaud, du glaucome, des troubles de la
fertilité, des phénomènes
inflammatoires, des maladies inflammatoires, des maladies du système
immunitaire, en particulier
auto-immunes et neuroinflammatoires telles que l'arthrite rhumatoïde,
l'arthrite réactionnelle, les
maladies entraînant une démyélinisation, la sclérose en plaque, des maladies
infectieuses et virales
telles que les encéphalites, des accidents vasculaires cérébraux ainsi qu'en
tant que médicaments
25 pour la chimiothérapie anticancéreuse, pour le traitement du syndrome de
Guillain-Barré, pour le
traitement de l'ostéoporose et l'apnée du sommeil.
Selon un de ses aspects, la présente invention est relative à l'utilisation
d'un composé de
formule (I), de ses sels pharmaceutiquement acceptables et de leurs solvats ou
hydrates pour le
traitement des troubles et maladies indiqués ci-dessus.
30 Selon un autre de ses aspects, la présente invention concerne des
compositions
pharmaceutiques comprenant, en tant que principe actif, un composé selon
l'invention. Ces
compositions pharmaceutiques contiennent une dose efficace d'au moins un
composé selon
l'invention, ou un sel pharmaceutiquement acceptable, dudit composé, ainsi
qu'au moins un
excipient pharmaceutiquement acceptable.
CA 02733397 2011-02-07
WO 2010/018328 PCT/FR2009/001003
31
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration
souhaité, parmi les excipients habituels qui sont connus de l'Homme du métier.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration orale,
sublinguale, sous-cutanée, intramusculaire, intra-veineuse, topique, locale,
intratrachéale,
intranasale, transdermique ou rectale, le principe actif de formule (I) ci-
dessus, ou son sel, peut être
administré sous forme unitaire d'administration, en mélange avec des
excipients pharmaceutiques
classiques pour le traitement des troubles ou des maladies cités ci-dessus.
Les formes unitaires d'administration appropriées comprennent les formes par
voie orale
telles que les comprimés, les gélules molles ou dures, les poudres, les
granules et les solutions ou
suspensions orales, les formes d'administration sublinguale, buccale,
intratrachéale, intraoculaire,
intranasale, par inhalation, les formes d'administration topique,
transdermique, sous-cutanée,
intramusculaire ou intraveineuse, les formes d'administration rectale et les
implants. Pour
l'application topique, on peut utiliser les composés selon l'invention dans
des crèmes, gels,
pommades ou lotions.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention sous
forme de comprimé peut comprendre les composants suivants :
Composé selon l'invention 50,0 mg
Mannitol 223,75 mg
Croscarmellose sodique 6,0 mg
Amidon de maïs 15,0 mg
Hydroxypropyl-méthylcellulose 2,25 mg
Stéarate de magnésium 3,0 mg
Il peut y avoir des cas particuliers où des dosages plus élevés ou plus
faibles sont
appropriés ; de tels dosages ne sortent pas du cadre de l'invention. Selon la
pratique habituelle, le
dosage approprié à chaque patient est déterminé par le médecin selon le mode
d'administration, le
poids et la réponse dudit patient.
La présente invention, selon un autre de ses aspects, concerne également une
méthode de
traitement des pathologies ci-dessus indiquées qui comprend l'administration,
à un patient, d'une
dose efficace d'un composé selon l'invention, ou d'un de ses sels
pharmaceutiquement acceptables.