Note: Descriptions are shown in the official language in which they were submitted.
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
1
DERIVES DE N-[(6-AZA-BICYCLO[3.2.1 ]OCT-1-YL)-ARYL-METHYL]-BENZAMI DE,
LEUR PREPARATION ET LEUR APPLICATION EN THERAPEUTIQUE
La présente invention se rapporte à des dérivés de N-[(6-aza-bicyclo[3.2.1]oct-
1-yl)-
aryl-méthyl]-benzamide, à leur préparation et leur application en
thérapeutique, dans
le traitement ou la prévention de maladies impliquant les transporteurs de la
glycine
Glyt1.
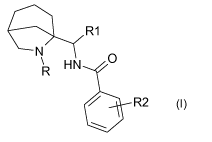
Les composés de l'invention répondent à la formule générale (I)
R1
NM ~ R HN O
/ R2
(I)
dans laquelle :
- R représente un atome d'hydrogène ou un groupe choisi parmi les groupes (C,-
C6)alkyle, (C3-C7)-cycloalkyle, ces groupes étant éventuellement substitués
par un
ou plusieurs groupes choisis indépendamment l'un de l'autre parmi l'atome de
fluor,
les groupes (C3-C7)-cycloalkyle, (C2-C4)alcényle, phényl, (C,-C6)alcoxy,
hydroxy ; le
groupe phényle étant éventuellement substitué par un ou plusieurs groupes
alcoxy ;
- R, représente un groupe phényle ou naphtyle, éventuellement substitué par un
ou
plusieurs substituants choisis indépendamment l'un de l'autre parmi les atomes
d'halogène, les groupes (C,-C6)alkyle, (C,-C6)alcoxy, halo-(C,-C6)alkyle,
NR4R5,
NR3C(O)OR4, NR3SO2R4, NR3C(O)R6, hydroxy, halo-(C,-C6)alcoxy, (C,-C6)alkyle-
thio, (C,-C6)alkyle-SO2, phényle ou hétéroaryle, le groupe phényle étant
éventuellement substitué par un ou plusieurs substituants choisis
indépendamment
parmi les atomes d'halogène, les groupes (C,-C6)alkyle, (C,-C6)alcoxy, halo-
(C,-
C6)alkyle, NR4R5, NR3C(O)OR4, NR3SO2R4, NR3C(O)R6, hydroxy, halo-(C,-
C6)alcoxy,
(C,-C6)alkyle-thio, (C,-C6)alkyle-SO2, le groupe hétéroaryle étant
éventuellement
substitué par ou plusieurs substituants choisis indépendamment parmi les
atomes
d'halogène, les groupes (C,-C6)alkyle, (C,-C6)alcoxy, halo-(C,-C6)alkyle,
NR4R5 ;
- R2 représente un ou plusieurs substituants choisis parmi l'atome
d'hydrogène, les
atomes d'halogène, les groupes (C,-C6)alkyle, (C3-C7)cycloalkyle, (C3-C7)-
cycloalkyl-
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
2
(C,-C3)alkyle, halo-(C,-C6)alkyle, (C,-C6)alcoxy, NR4R5, phényle, hétéroaryle,
cyano,
acétyle, (C1-C6)thioalkyle, (C1-C6)alkylsulfonyle, carboxy ou (Ci-
C6)alcoxycarbonyle ;
le groupe phényle étant éventuellement substitué par un ou plusieurs
substituants
choisis indépendamment parmi les atomes d'halogène, les groupes (C,-C6)alkyle,
(C,-C6)alcoxy, halo-(C,-C6)alkyle, NR4R5, NR3C(O)OR4 NR3SO2R4, NR3C(O)R6,
hydroxy, halo-(C,-C6)alcoxy, (C,-C6)alkyle-thio, (C,-C6)alkyle-SO2, le groupe
hétéroaryle étant éventuellement substitué par ou plusieurs substituants
choisis
indépendamment parmi les atomes d'halogène, les groupes (C,-C6)alkyle, (C,-
C6)alcoxy, halo-(C,-C6)alkyle, NR4R5;
- R3, R4 et R5 représentent indépendamment l'un de l'autre un atome
d'hydrogène ou
un groupe (C,-C6)alkyle ;
- R6 représente un groupe (Ci-C6)alkyle ;
- R4 et R5 peuvent former ensemble, avec l'atome d'azote qui les portent, un
cycle
choisi parmi les cycles azétidine, pyrrolidine, pipéridine, morpholine,
thiomorpholine,
pipérazine, azépine, éventuellement substitué par un groupe (Ci-C6)alkyle ;
- R3 et R4 peuvent former ensemble, avec les atomes qui les portent, un cycle
à 5 ou
6 chaînons ;
- R3 et R6 peuvent former ensemble, avec les atomes qui les portent, un cycle
à 5 ou
6 chaînons ;
à l'état de base ou de sel d'addition à un acide.
Les composés de formule (I) comportent 3 atomes de carbones asymétriques. Ils
peuvent donc exister sous forme de diastéréoisomères et d'énantiomères. Ces
énantiomères y compris les mélanges racémiques, font partie de l'invention.
Les composés de formule (I) peuvent exister à l'état de bases ou de sels
d'addition à
des acides. De tels sels d'addition font partie de l'invention.
Ces sels sont avantageusement préparés avec des acides pharmaceutiquement
acceptables, mais les sels d'autres acides utiles, par exemple, pour la
purification ou
l'isolement des composés de formule (I) font également partie de l'invention.
Dans le cadre de l'invention, on entend par :
- Ct_CZ où t et z peuvent prendre les valeurs de 1 à 6, une chaîne carbonée
pouvant avoir de t à z atomes de carbone, par exemple Cl-C6 une chaîne
carbonée qui peut avoir de 1 à 6 atomes de carbone ;
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
3
- alkyle, un groupe aliphatique saturé, linéaire ou ramifié ; par exemple un
groupe
C,_C6-alkyle représente une chaîne carbonée de 1 à 6 atomes de carbone,
linéaire ou ramifiée, par exemple un méthyle, éthyle, propyle, isopropyle,
butyle,
isobutyle, tert-butyle, pentyle, hexyle;
- alcényle, un groupe aliphatique mono- ou poly-insaturé, linéaire ou ramifié,
comprenant par exemple une ou deux insaturations éthyléniques,
- amino, un groupe NH2
- alcoxy, un groupe -O-alkyle ;
- acétyle, un groupe -C(O)-,
- cyano, un groupe -CN,
- hydroxy, un groupe -OH,
- thioalkyle, un atome de soufre substitué par un groupe alkyle ;
- atome d'halogène, un fluor, un chlore, un brome ou un iode,
- haloalkyle, un groupe alkyle dont un ou plusieurs atomes d'hydrogène ont été
substitués par un halogène. A titre d'exemple, on peut citer les groupes
trifluorométhyle, trifluoroéthyle, pentafluoro-éthyle,
- hétéroaryle, un groupe monocyclique aromatique à 5 ou 6 chaînons comprenant
de 1 à 3 hétéroatomes choisis parmi l'azote, l'oxygène et le soufre. A titre
d'exemple de groupe hétéroaryle, on peut citer les groupes pyrrole, furane,
thiophène, pyrazole, imidazole, triazole, tétrazole, oxazole, isoxazole,
oxadiazole,
thiazole, isothiazole, thiadiazole, pyridine, pyrimidine, pyrazine,
pyridazine,
triazine.
Parmi les composés de formule générale (I) objets de l'invention, un premier
groupe
de composés est constitué par les composés pour lesquels R représente un atome
d'hydrogène ou un groupe (C,-C6)alkyle ;
R,, R2, R3, R4 et R5 étant tels que définis ci-dessus.
Parmi les composés de formule générale (I) objets de l'invention, un deuxième
groupe de composés est constitué par les composés pour lesquels R représente
un
atome d'hydrogène ou un groupe méthyle, éthyle ;
R,, R2, R3, R4, R5et R6 étant tels que définis ci-dessus.
Parmi les composés de formule générale (I) objets de l'invention, un troisième
groupe de composés est constitué par les composés pour lesquels R, représente
un
groupe phényle, éventuellement substitué par un ou plusieurs substituants
choisis
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
4
indépendamment l'un de l'autre parmi les atomes d'halogène, les groupes (C,-
C6)alkyle, halo-(C1-C6)alkyle, (C1-C6)alcoxy, hydroxy;
R, R2, R3, R4 et R5 étant tels que définis ci-dessus.
Parmi les composés de formule générale (I) objets de l'invention, un quatrième
groupe de composés est constitué par les composés pour lesquels R, représente
un
groupe phényle, éventuellement substitué par un ou plusieurs substituants
choisis
indépendamment l'un de l'autre parmi les atomes d'halogène, les groupes
méthyle,
éthyle, trifluorométhyle, méthoxy, hydroxy ;
R,, R2, R3, R4, R5et R6 étant tels que définis ci-dessus.
Parmi les composés de formule générale (I) objets de l'invention, un cinquième
groupe de composés est constitué par les composés pour lesquels R2 représente
un
ou plusieurs substituants choisis parmi l'atome d'hydrogène, les atomes
d'halogène,
les groupes halo-(C,-C6)alkyle, (C,-C6)alkyle, (C,-C6)alcoxy, (C,-C6)alkyle-
SO2;
R, R,, R3, R4 et R5 étant tels que définis ci-dessus.
Parmi les composés de formule générale (I) objets de l'invention, un sixième
groupe
de composés est constitué par les composés pour lesquels R2 représente un ou
plusieurs substituants choisis parmi l'atome d'hydrogène, les atomes
d'halogène, les
groupes trifluorométhyle, méthyle, méthoxy, éthanesulfonyle
R, R,, R3, R4 et R5 étant tels que définis ci-dessus.
Parmi les composés de formule générale (I) objets de l'invention, un septième
groupe de composés est constitué par les composés pour lesquels :
- R représente un atome d'hydrogène ou un groupe méthyle, éthyle ;
- R, représente un groupe phényle, éventuellement substitué par un ou
plusieurs
substituants choisis indépendamment l'un de l'autre parmi les atomes
d'halogène,
les groupes méthyle, éthyle, trifluorométhyle, méthoxy, hydroxy ;
- R2 représente un ou plusieurs substituants choisis parmi l'atome
d'hydrogène, les
atomes d'halogène, les groupes trifluorométhyle, méthyle, méthoxy,
éthanesulfonyle,
à l'état de base ou de sel d'addition à un acide.
Les combinaisons des groupes un à sept tels que définis ci-dessus font
également
partie de l'invention.
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
Parmi les composés de formule générale (I) objets de l'invention, on peut
notamment citer les composés suivants :
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(2-méthyl-3-trifluorométhyl)-
benzamide ;
5 N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(3-méthoxy-2-méthyl)-
benzamide ;
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-phenyl-méthyl]-(2,6-dichloro-3-
trifluorométhyl)-
benzamide et son chlorhydrate ;
N-[6-Aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(2-chloro-3-trifluorométhyl)-
benzamide et son chlorhydrate ;
(+)-N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(2-chloro-3-
trifluorométhyl)-
benzamide et son chlorhydrate ;
(-)-N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(2,6-dichloro-3-
trifluorométhyl)-
benzamide et son chlorhydrate ;
(-)-N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(2-chloro-3-
trifluorométhyl)-
benzamide et son chlorhydrate ;
(+)-N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(2,6-dichloro-3-
trifluorométhyl)-
benzamide et son chlorhydrate ;
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(4-chloro-5-éthanesulfonyl-2-
méthoxy)-benzamide et son chlorhydrate ;
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(2-chloro-5-trifluorométhyl)-
benzamide et son chlorhydrate ;
N-[(6-Aza-bicyclo[3.2.1]oct-5-yl)-phényl-méthyl]-(2,6-dichloro)-benzamide ;
N-[(6-Aza-bicyclo[3.2.1]oct-5-yl)-phényl-méthyl]-(3-chloro-2-méthyl)-benzamide
;
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-(4-fluoro-phényl)-méthyl]-(2-chloro-3-
trifluorométhyl)-benzamide ;
N-[(-6-Aza-bicyclo[3.2.1 ]oct-5-yl)-(4-fluoro-phényl)-méthyl]-(2,6-dichloro-3-
trifluorométhyl)-benzamide ;
N-[(-6-Aza-bicyclo[3.2.1 ]oct-5-yl)-(3-méthoxy-phényl)-méthyl]-(2,6-dichloro-3-
trifluorométhyl)-benzamide ;
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl-(3-méthoxy-phényl)-méthyl]-(2-chloro-3-
trifluorométhyl)-benzamide ;
N-[6-Aza-bicyclo[3.2.1 ]oct-5-yl-(3-hydroxy-phényl)-méthyl]-(2-chloro-3-
trifluorométhyl)-benzamide ;
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-(3-hydroxy-phényl)-méthyl]-(2,6-dichloro-3-
trifluorométhyl)-benzamide ;
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
6
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-m-tolyl-méthyl]-(2-chloro-3-
trifluorométhyl)-
benzamide et son chlorhydrate ;
2-Chloro-N-[(6-éthyl-6-aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(3-
trifluorométhyl)-
benzamide;
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl-m-tolyl-méthyl]-(2,6-dichloro-3-
trifluorométhyl)-
benzamide;
2-Chloro-N-[(6-méthyl-6-aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(3-
trifluorométhyl)-
benzamide et son chlorhydrate ;
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-(3-bromo-phényl)-méthyl]-(2-chloro-3-
trifluorométhyl)-benzamide et son chlorhydrate ;
N-[(6-Aza-bicyclo[3.2.1 ]oct-5-yl)-(3-bromo-phényl)-méthyl]-(2,6-dichloro-3-
trifluorométhyl)-benzamide et son chlorhydrate ;
N-[6-Aza-bicyclo[3.2.1 ]oct-5-yl-(3-trifluorométhyl-phényl)-méthyl]-(2-chloro-
3-
trifluorométhyl)-benzam ide et son chlorhydrate;
(+)-2,6-Dichloro-N-[(6-éthyl-6-aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(3-
trifluorométhyl)-benzamide et son chlorhydrate;
2-Chloro-N-[(6-éthyl-6-aza-bicyclo[3.2.1 ]oct-5-yl)-(3-trifluorométhyl-phényl)-
méthyl]-
(3-trifluorométhyl)-benzamide et son chlorhydrate ;
Les composés de l'invention présentent une activité particulière comme
inhibiteurs
des transporteurs de la glycine Glyt1, notamment un profil d'activité et de
sécurité
améliorés.
Les composés de formule générale (I), peuvent être préparés par un procédé
illustré par le schéma 1 qui suit
SCHEMA 1
Y O
(III )
Ri R2
N
R NH2 - (I )
(II )
On effectue un couplage d'une diamine de formule générale (11), dans laquelle
R et
R, sont tels que définis ci-dessus, notamment quand R représente un atome
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
7
d'hydrogène, un groupement allyle ou phénylméthyle, avec un acide activé, par
exemple via un anhydride mixte ou un chlorure d'acide de formule générale
(III) dans
laquelle Y représente un groupe partant dérivé par exemple de benzotriazole,
d'acylurée ou un atome d'halogène et R2 est tel que défini ci-dessus, en
utilisant les
méthodes connues de l'Homme du métier.
Les composés de formule générale (I) dans laquelle R représente un atome
d'hydrogène peuvent être aussi préparés à partir de composés de formule
générale
(I) dans laquelle R représente :
- soit un groupe phénylméthyle en déprotégeant l'azote par hydrogénolyse,
- soit un groupe alcényle, de préférence allyle, en déprotégeant l'azote, par
exemple
par un complexe du palladium zéro selon les méthodes connues de l'Homme du
métier.
Les composés de formule générale (I) dans laquelle R est différent de l'atome
d'hydrogène peuvent être aussi préparés, à partir de composés de formule
générale
(I) dans laquelle R représente un atome d'hydrogène, soit par alkylation avec
un
halogénure ou mésylate du type RX, dans lequel R est tel que défini ci-dessus
et X
est mésylate ou halogène, en présence d'une base minérale, par exemple le
carbonate de potassium dans l'acétonitrile, soit par une réaction de type
Eschweiler-
Clarke ou par une amination réductrice avec un aldéhyde ou une cétone
appropriés
selon les méthodes connues de l'Homme du métier, selon les méthodes connues de
l'Homme du métier.
Les composés de formule générale (I) dans lequel le groupe R, est un groupe
phényle substitué par un hydroxy peuvent être obtenus à partir du composé
correspondant de formule générale (I) substitué par un méthoxy, en utilisant
les
méthodes connues de l'Homme du métier.
La diamine de formule générale (II) peut être préparée par les procédés
illustrés par
les schémas 2 pour l'amine (Ila) et (Ilb) et 3 pour l'amine (Ilc) qui suivent.
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
8
SCHEMA 2
RiLi
(V)' N
N CN H R H Ri
Kl"-CH3 C 3 NH2 H2N
(IVa) (Ila) (Ilb)
SCHEMA 3
RiLi
(V)
N N
dl---l CN R1
H2H2C H2N
(IVc) (IIc)
Selon le schéma 2, on fait réagir le nitrile de formule (IVa), avec
l'aromatique lithié
de formule générale (V), dans laquelle R, est tel que défini ci-dessus, dans
un
solvant éthéré tel que le tétrahydrofurane ou l'éther, à basse température,
par
exemple à -70 C. On obtient ainsi une imine qui est notamment réduite
diastéréosélectivement avec un réducteur tel que le borohydrure de sodium,
dans un
solvant protique tel que le méthanol pour donner l'amine de formule générale
(Ila).
L'amine (Ila) peut être débenzylée par hydrogénation en présence de catalyseur
au
palladium pour fournir l'amine déprotégée (l lb) (Schéma 2).
Selon le schéma 3, on peut faire également réagir le nitrile de formule (IVc),
avec
l'aromatique lithié de formule générale (V), dans laquelle R, est tel que
défini ci-
dessus, dans un solvant éthéré tel que le tétrahydrofurane ou l'éther, à basse
température par exemple à -70 C. On obtient ainsi une imine qui est réduite
avec un
réducteur tel que le borohydrure de sodium dans un solvant protique tel que le
méthanol pour donner l'amine de formule générale (IIc) (Schéma 3).
Par ailleurs les composés chiraux de formule générale (I) peuvent être obtenus
par
séparation des composés racémiques par chromatographie liquide à haute
performance (CLHP) sur colonne chirale, ou par séparation par chromatographie
sur
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
9
gel de silice des diastéréoisomères chiraux de l'amine de formule générale
(Ila) puis
débenzylation, comme décrit dans le schéma 2.
Le nitrile de formule (IVa) est préparé selon une méthode décrite dans
Tetrahedron :
Asymmetry, 2006 (17), 252-258 et le nitrile de formule (IVc) est synthétisé
selon
cette même référence, en utilisant l'allylamine.
Les aryles lithiés de formule générale (V) peuvent être préparés selon des
méthodes
connues de l'Homme du métier.
Les acides et chlorures d'acide de formule générale (III) sont disponibles
dans le
commerce ou préparés par analogie à des méthodes connues de l'Homme du métier
Les exemples qui vont suivre illustrent la préparation de quelques composés de
l'invention. Dans ces exemples :
- Les microanalyses élémentaires, les spectres I.R. et R.M.N. et la CLHP sur
colonne chirale confirment les structures et les puretés énantiomériques des
composés obtenus,
- Pour les descriptions RMN, "m" signifie multiplet, "s" singulet, "t"
triplet, "d" doublet,
"q" quadruplet, dxd signifie double doublet, txt signifie triple triplet, dxt
double triplet,
etc.
- Les numéros indiqués entre parenthèses dans les titres des exemples
correspondent à ceux de la lère colonne du tableau donné plus loin,
- "décomp." signifie "décomposition",
- Les chiffres romains entre parenthèses correspondent aux formules générales
correspondantes qui sont indiquées dans les schémas de synthèse,
- La nomenclature employée est la nomenclature suivant les recommandations
IUPAC (International Union of Pure and Applied Chemistry).
Dans les noms des composés, le tiret "-" fait partie du mot, et le tiret "-"
ne sert que
pour la coupure en fin de ligne ; il est à supprimer en l'absence de coupure,
et ne
doit être remplacé ni par un tiret normal ni par un espace.
Exemple 1 (composé n 3) : Chlorhydrate de N-[(6-aza-bicyclo[3.2.1]oct-5-yl)-
phényl-méthyl]-(2,6-di chloro-3-trifluorométhyl)-benzamide (1 :1).
1.1 Phényl-[6-((R)-1-phényl-éthyl)-6-aza-bicyclo[3.2.1 loct-5-VII-méthylamine
(I la).
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
Dans un tricol de 100 ml sous argon, on place 1 g de 6-((R)-1-phényl-éthyl)-6-
aza-
bicyclo[3.2.1]octane-5-carbonitrile (IVa) (4,16 mmoles) à -70 C dans 35 ml de
tétrahydrofurane anhydre. On additionne goutte à goutte 7,4 ml d'une solution
1,13M
(cyclohexane/éther) de phényl lithium (8,32 mmoles).
5 On laisse pendant 2 heures et demie à -70 C puis on hydrolyse à -20 C avec
15 ml
d'eau.
Après extraction, la phase organique est concentrée sous pression réduite puis
le
résidu est repris dans 20 ml de méthanol. 0,79 g de borohydrure de sodium
(20,8
mmoles) y sont ajoutés par portions. Le milieu réactionnel est laissé sous
agitation la
10 nuit à température ambiante.
Après évaporation sous pression réduite, le résidu est repris par 50 ml
d'éther et 50
ml d'eau. On acidifie le milieu avec une solution d'acide chlorhydrique 1N
puis on
extrait. La phase aqueuse est basifiée avec de l'ammoniaque puis réextraite 2
fois
avec 50 ml de dichlorométhane. Les phases organiques sont réunies, séchées sur
sulfate de sodium, filtrées et évaporées sous pression réduite. On obtient
ainsi 1,5 g
d'une huile qui est purifiée par chromatographie sur colonne de gel de silice
en
éluant avec un mélange de dichlorométhane et de méthanol. On obtient ainsi
1,15 g
de phényl-[6-((R)-1-phényl-éthyl)-6-aza-bicyclo[3.2.1 ]oct-5-yl]-méthylamine
(I la),
mélange de 2 diastéréoisomères chiraux, sous forme d'huile.
1.2 (6-Aza-bicyclo[3.2.lloct-5-yl)-phényl-méthylamine (Ilb).
Dans une fiole de Parr, on place 4 g de composé de formule (Ila) (12,5 mmoles)
dans 80 ml de méthanol en présence d'une pointe de spatule d'hydroxyde de
palladium à 20%, sous 4 atmosphères d'hydrogène à température ambiante pendant
6 heures.
Après filtration du catalyseur et évaporation du filtrat sous pression
réduite, le résidu
est repris par 10 ml de dichlorométhane et 20 ml d'ammoniaque. Après
extraction, la
phase organique est lavée dans une solution saturée de chlorure de sodium,
séchée
sur sulfate de sodium, filtrée puis le solvant est évaporé sous pression
réduite. On
obtient ainsi 1 g de (6-aza-bicyclo[3.2.1]oct-5-yl)-phényl-méthylamine de
formule
(Ilb) sous forme d'huile qui peut être utilisée brute dans l'étape suivante.
Un échantillon analytique est obtenu par salification de la base avec une
solution
d'éther chlorhydrique 2N puis trituration dans l'éther.
PF = 215-225 C
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
11
RMN 'H (400 MHz, DMSO-d6) 8 ppm 9,14 (m, 4H), 7,76 (m, 2H), 7,56 -7,43 (m,
4H), 5,09 (s élargi, 1 H), 3,49 (m, 1 H), 3,11 (m, 1 H), 2,72 (m, 1 H), 2,19
(m, 1 H), 1,87
(m, 1 H), 1,83 -1,37 (m, 8H).
1.3 Chlorhydrate de N-[(6-aza-bicyclo[3.2.1loct-5-yl)-phényl-méthyll-(2,6-
dichloro-3-
trifluorométhyl)-benzamide (1:1).
Dans un ballon de 25 ml, on place 240 mg d'acide (2,6-dichloro-3-
trifluorométhyl)-
benzoïque (0,92 mmole), 124 mg d'hydroxybenzotriazole (0,92 mmole), 180 mg de
chlorhydrate de 1-[3-(diméthylamino)propyl]-3-éthylcarbodiimide (0,92 mmole)
en
solution dans 5 ml de dichlorométhane et on agite le mélange à température
ambiante pendant 15 minutes. On ajoute 200 mg (0,92 mmole) de (6-aza-
bicyclo[3.2.1]oct-5-yl)-phényl-méthylamine de formule (Ilb) en solution dans 5
ml de
dichlorométhane et on agite à température ambiante pendant une nuit.
Le milieu réactionnel est ensuite dilué avec 10 ml de dichlorométhane puis
lavé
successivement à l'eau (5 ml), à la soude 1 N (5 ml) et avec une solution
saturée de
chlorure de sodium (5 ml).
La phase organique est séchée sur sulfate de sodium, filtrée et évaporée sous
pression réduite.
Le résidu est purifié par chromatographie sur colonne de gel de silice en
éluant avec
un mélange de dichlorométhane et de méthanol. On obtient ainsi 180 mg de N-[(6-
aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(2,6-d ichloro-3-trifluorométhyl)-
benzam ide
qui est salifié sous forme de chlorhydrate par solubilisation de la base dans
le
dichlorométhane, ajout d'un excès d'acide chlorhydrique 1 N dans l'éther puis
concentration sous pression réduite.
PF = 249,5-250,5 C
RMN 'H (400 MHz, DMSO-d6) 8 ppm 9,79 (m, 1 H), 9,66 (d, J = 9 Hz, 1 H), 8,86
(m,
1 H), 8,01 (m, 1 H), 7,84 (m, 1 H), 7,69 (m, 2H), 7,50 (m, 2H), 7,42 (m, 1 H),
5,79 (d, J
= 9,1 Hz, 1H), 3,57 (m, 1H), 3,16 (m, 1H), 2,69 (m, 1H), 2,16-1,84 (m, 3H),
1,77 -
1,38 (m, 5H).
Exemple 2 (composé n 8): Chlorhydrate de (+)-N-[(6-aza-bicyclo[3.2.1]oct-5-yl)-
phényl-méthyl]-(2,6-dichloro-3-trifluorométhyl)-benzamide (1:1).
2.1. Premier diastéréoisomère de phényl--[6-((R)-1-phényl-éthyl)-6-aza-
bicyclo[3.2.1loct-5-yll-méthylamine (Ila1)
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
12
Les 2 diastéréoisomères (Ila) peuvent être séparés par séparation sur gel de
silice
avec comme éluant un mélange de dichlorométhane et de méthanol. Le composé le
moins polaire est le phényl-[6-((R)-1-phényl-éthyl)-6-aza-bicyclo[3.2.1]oct-5-
yl]-
méthylamine (Ila1).
RMN 'H (400 MHz, DMSO-d6) 8 ppm 7,47 (m, 4H), 7,39 -7,17 (m, 6H), 4,26 (s,
1H),
4,23 (m, 1 H), 3,17 (m, 1 H), 3,56 (d, J = 8,7 Hz, 1 H), 2,28 (m, 1 H), 2,07
(m, 1 H), 2,00
(m, 2H), 1,65 (m, 1H), 1,54 (d, J = 6,8 Hz, 3H), 1,28-0,86 (m, 6H)
2.2. Énantiomère (+) (6-aza-bicyclo[3.2.lloct-5-yl)-phényl-méthylamine (Ilb1)
Ce composé est obtenu selon l'exemple 1.2 en partant de du composé de formule
(Ila1).
Composé de formule (Ilb1) sous forme base.
PF= 84-85 C
ee=100%
[DI 20-C CHC13 = +55.2 c = 0,80g/100 ml
RMN 'H (400 MHz, CDC13) 8 ppm 7,29 7,13 (m, 5H), 3,72 (s, 1H), 3,01 (m, J =
5,4
Hz et 10 Hz, 1 H), 2,87 (m, J = 10 Hz et 1 Hz, 1 H), 2,25 (m, 1 H), 1,83 (m, 1
H), 1,70
(m, 3H), 1,58 (m, 1 H), 1,52-1,39 (m, 2H), 1,31- 1,08 (m, 4H).
2.3 Chlorhydrate de (+)-N-[(6-aza-bicyclo[3.2.1loct-5-yl)-phényl-méthyll-(2,6-
dichloro-3-trifluorométhyl)-benzamide (1:1).
Ce composé est obtenu selon l'exemple 1.3 en partant du composé de formule
(Ilb1). Un échantillon analytique est obtenu sous forme de chlorhydrate par
solubilisation de la base dans le dichlorométhane, ajout d'un excès d'acide
chlorhydrique 1 N dans l'éther puis concentration sous pression réduite.
PF:241-242 C
ee:95%
[D] 20-C MeOH = +30,7 c = 0,75 g/100 ml
RMN ' H (400 MHz, DMSO-d6) 8 ppm 9,62 (d, J = 8,9 Hz, 1 H), 9,42 (m, 1 H),
8,84 (m,
1 H), 7,97 (m, 1 H), 7,80 (m, 1 H), 7,59 (m, 2H), 7,46 (m, 2H), 7,39 (m, 1 H),
5,70 (d
élargi, J = 9 Hz, 1H), 3,49 (m, 1H), 3,13 (m, 1H), 2,65 (m, 1H), 2,11-1,20
(m,9H)
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
13
Exemple 3 (composé n 6) : Chlorhydrate de (-)-N-[(6-aza-bicyclo[3.2.1]oct-5-
yl)-
phényl-méthyl]-(2,6-dichloro-3-trifluorométhyl)-benzamide (1:1).
3.1 Deuxième diastéréoisomère de phénol-[6-((R)-1-phénol-éthyl)-6-aza-
bicyclo[3.2.1loct-5-yll-méthvlamine (Ila2)
Les 2 diastéréoisomères (Ila) peuvent être séparés par séparation sur gel de
silice
avec comme éluant un mélange de dichlorométhane et de méthanol. Le composé
le plus polaire est le phényl-C-[6-((R)-1-phényl-éthyl)-6-aza-
bicyclo[3.2.1]oct-5-yl]-
méthylamine (Ila2).
RMN 'H (400 MHz, DMSO-d6) 8 ppm 7,46 (m, 2H), 7,34 (m, 2H), 7,29-7,14 (m,
6H), 4,23 (q, J = 6,8 Hz, 1 H), 3,56 (m, 1 H), 3,21 (m, 1 H), 3,06 (m, 1 H),
2,26 (m, 1 H),
2,19 (m, 2H), 1,75 -1,16 (m, 10H), 0,89 (m, 2H).
3.2 Énantiomère (-)-(6-aza-bicyclo[3.2.lloct-5-yl)-phényl-méthylamine (IIb2)
Ce composé est obtenu selon l'exemple 1.2 en partant du composé de formule
(Ila2).
Composé de formule (IIb2) sous forme base
PF=82,5-83,5 C
ee=93%
[DI 20-C CHCI3 = -18.3 c = 0,58g/100 ml
RMN 'H (400 MHz,CDCl3) 8 ppm 7,29 -7,13 (m, 5H), 3,72 (s, 1H), 3,02 (m, J =
5,4
Hz et 10 Hz, 1 H), 2,88 (m, J = 10 Hz et 1 Hz, 1 H), 2,25 (m, 1 H), 1,83 (m, 1
H), 1,70
(m, 3H), 1,59 (m, 1 H), 1,52-1,39 (m, 2H), 1,33-1,08 (m, 4H).
3.3 Chlorhydrate de (-)-N-[(6-aza-bicyclo[3.2.1loct-5-yl)-phénol-méthyll-(2,6-
dichloro-
3-trifluorométhyl)-benzamide (1:1).
Ce composé est obtenu selon l'exemple 1.3 en partant du composé de formule
(IIb2)
PF : 192-193 C
ee=92%
[DI 20-C MeOH = -40,5 c= 0,194g/100 ml
RMN ' H (400 MHz, DMSO-d6) 8 ppm 9,61 (d, J = 8,6 Hz, 1 H), 9,54 (m, 1 H),
8,83 (m,
1 H), 7,97 (m, J = 8,8 Hz, 1 H), 7,79 (m, 1 H), 7,60 (m, 2H), 7,46 (t, J = 7,7
Hz, 2H),
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
14
7,38 (m, 1 H), 5,71 (d, J = 8,5 Hz, 1 H), 3,49 (m, 1 H), 3,13 (m, 1 H), 2,65
(m, 1 H),
2,11-1,78 (m,3H), 1,71-1,22 (m, 6H).
Exemple 4 (Composé n 20) : 2-Chloro-N-[(6-éthyl-6-aza-bicyclo[3.2.1]oct-5-yl)-
phényl-méthyl]-(3-trifluorométhyl)-benzamide.
Dans un ballon de 25 ml on place 0,17 g de N-[(6-aza-bicyclo[3.2.1]oct-5-yl)-
phényl-
méthyl]-(2-chloro-3-trifluorométhyl)-benzamide (0,40 mmole) et 0,084 g de
carbonate
de potassium (0,60 mmole) dans 4 ml d'acétonitrile, auxquels on ajoute 50 pl
d'iodoéthane (0,60 mmole).
Le milieu réactionnel est agité une nuit à température ambiante, puis 3 heures
à
50 C et ensuite concentré sous pression réduite. Le résidu est ensuite dilué
avec 10
ml de dichlorométhane puis lavé à l'eau (5 ml).
Après extraction, la phase organique est séchée sur sulfate de sodium, filtrée
et
concentrée sous pression réduite. On obtient ainsi 158 mg d'une huile qui est
purifiée par chromatographie sur colonne de gel de silice en éluant avec un
mélange
de dichlorométhane et de méthanol. On obtient ainsi 84 mg de 2-chloro-N-[(6-
éthyl-
6-aza-bicyclo[3.2.1 ]oct-5-yl)-phényl-méthyl]-(3-trifluorométhyl)-benzamide
sous
forme de poudre.
PF: 160-162 C
RMN 1H (400 MHz, DMSO-d6) 8 ppm 8,60 (d, J = 7,7 Hz, 1 H), 7,92 (m, 1 H), 7,63
(m, 2H), 7,43-7.21 (m, 5H), 4,93 (d, J = 7,7 Hz, 1 H), 3,41 (m, 1 H), 2,82 (m,
1 H), 2,62
-2.39 (m, 2H), 2,20 (m, 2H), 1,72 (m, 1H), 1.53-0.84 (m, 9H).
Exemple 5 (Composé n 22) : Chlorhydrate de 2-chloro-N-[(6-méthyl-6-aza-
bicyclo[3.2.1]oct-5-yl)-phényl-méthyl]-(3-trifluorométhyl)-benzamide (1:1).
Dans un ballon de 25 ml, on place 0,127 g de N-[(6-aza-bicyclo[3.2.1]oct-5-yl)-
phényl-méthyl]-(2-chloro-3-trifluorométhyl)-benzamide (0,30 mmole) et 1 ml de
formaldéhyde dans 2 ml d'acide formique. Le mélange réactionnel est chauffé à
100 C pendant une nuit. Après refroidissement, le milieu est hydrolysé,
basifié à pH
9 avec de l'ammoniaque puis extrait avec de l'acétate d'éthyle. La phase
organique
est séchée sur sulfate de sodium, filtrée et évaporée sous pression réduite.
Le résidu est purifié par chromatographie sur colonne de gel de silice en
éluant avec
un mélange de dichlorométhane et de méthanol ammoniacal. On obtient ainsi 113
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
mg d'une huile qui est salifiée sous forme de chlorhydrate par solubilisation
de la
base dans le dichlorométhane, ajout d'un excès d'acide chlorhydrique 1N dans
l'éther puis concentration sous pression réduite.
5 PF : 186-188 C
RMN 1H (400 MHz, DMSO-d6) 8 ppm 10,20 (m, 1 H), 9,34 (d, J = 9,8 Hz, 1 H),
8,06
(d, J = 7,7 Hz, 1 H), 7,97 (d, J = 7,7 Hz, 1 H), 7,68 (m, 3H), 7,53 -7.38 (m,
3H), 5,74
(d, J = 9,8 Hz, 1 H), 4,16 (m, 1 H), 3,10 (m, 1 H), 2,73 -2,50 (m, 4H), 2,40
(m, 1 H),
2,10 -1,38 (m, 7H).
Exemple 6 (Composé n 23): Chlorhydrate de N-[(6-aza-bicyclo[3.2.1]oct-5-yl)-
(3-bromo-phényl)-méthyl]-(2-chloro-3-trifluorométhyl)-benzamide (1:1).
6.1. 6-Allyl-6-aza-bicyclo[3.2.1loctane-5-carbonitrile (IVc).
Dans un tube scellé de 5 ml sous argon, on place 0,5 g de 3-
chlorométhylcyclohexanone (3,4 mmoles), 3 ml de méthanol anhydre, 0,93 ml
d'acétone cyanhydrine (10,2 mmoles) et 0,26 ml d'allylamine (3,4 mmoles). Le
mélange réactionnel est chauffé 3 jours à 100 C. Après refroidissement, le
milieu
réactionnel est versé sur 10 ml d'une solution de soude aqueuse 1N. Après deux
extractions au dichlorométhane, les phases organiques réunies sont lavées avec
une solution saturée de chlorure de sodium, séchées sur sulfate de sodium,
filtrées
puis le solvant est évaporé sous pression réduite. Le résidu est purifié par
chromatographie sur colonne de gel de silice en éluant avec un mélange d'éther
de
pétrole et d'acétate d'éthyle. On obtient ainsi 426 mg de 6-aIIyI-6-aza-
bicyclo[3.2. 1]octane-5-carbonitrile (IVc) sous forme d'huile.
RMN 1H (400 MHz, DMSO-d6) 8 ppm 8,60 (d, J = 7,7 Hz, 1 H), 7,92 (m, 1 H), 7,63
(m, 2H), 7,43-7.21 (m, 5H), 4,93 (d, J = 7,7 Hz, 1 H), 3,41 (m, 1 H), 2,82 (m,
1 H),
2,62-2,39 (m, 2H), 2,20 (m, 2H), 1,72 (m, 1 H), 1,53 -0,84 (m, 9H).
6.2. (6-Allyl-6-aza-bicyclo[3.2.lloct-5-yl)-(3-bromo-phényl)-méthylamine
(IIc).
Le composé est obtenu suivant la méthode décrite dans l'exemple 1.1, en
partant de
1 g de 6-allyl-6-aza-bicyclo[3.2.1]octane-5-carbonitrile (IVc), de 2,5
équivalents de 3-
bromophényl lithium et de 5 équivalents de borohydrure de sodium. Après
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
16
purification par chromatographie sur colonne de gel de silice en éluant avec
un
mélange de dichlorométhane et de méthanol ammoniacal, on obtient 260 mg d'une
huile contenant 140mg de (6-allyl-6-aza-bicyclo[3.2.1]oct-5-yl)-(3-bromo-
phényl)-
méthylamine (Ilc) (0,42 mmole) utilisée telle que dans l'étape suivante.
6.3 N-[(6-Allyl-6-aza-bicyclo[3.2.1 loct-5-yl)-(3-bromo-phényl)-méthyll-(2-
chloro-3-
trifluorométhyl)-benzamide.
Dans un ballon de 25 ml, on place 260 mg de (6-allyl-6-aza-bicyclo[3.2.1]oct-5-
yl)-(3-
bromo-phényl)-méthylamine (Ilc) (0,42 mmole) dans 8 ml de dichlorométhane à 0
C
en présence de 118 mg de carbonate de potassium (0,78 mmole).
On ajoute alors 189 mg de chlorure d'acide de l'acide (2-chloro-3-trifluoro)-
benzoïque (0,78 mmole). Le milieu réactionnel est agité une nuit à température
ambiante. Après hydrolyse et extraction, la phase organique est lavée avec de
la
soude 1 N, séchée sur sulfate de sodium, filtrée puis concentrée sous pression
réduite. Après purification par chromatographie sur colonne de gel de silice
en
éluant avec un mélange de dichlorométhane et de méthanol ammoniacal, on
obtient
146 mg de N-[(6-allyl-6-aza-bicyclo[3.2.1 ]oct-5-yl)-(3-bromo-phényl)-méthyl]-
(2-
chloro-3-trifluorométhyl)-benzamide sous forme d'une huile.
RMN'H (400 MHz, DMSO-d6) 8 ppm 8,68 (d, J = 7,7 Hz, 1H), 7,91 (d, J = 7,7 Hz,
1 H), 7,63 (m, 2H), 7,58 (m, 1 H), 7,44 (m, 1 H), 7,40 (m, 1 H), 7,28 (d, J =
7,8 Hz, 1 H),
5,81 (m, 1 H), 5,22 (m, 1 H), 5,00 (m, 1 H), 4,97 (d, J = 7,7 Hz, 1 H), 3,53
(m, 1 H), 3,34
(m, 1 H), 3,07 (m, 1 H), 2,37 (m, 1 H), 2,18 (m, 1 H), 1,77 (m, 1 H), 1,54-
0,77 (m, 7H).
6.4 Chlorhydrate de N-[(6-aza-bicyclo[3.2.1loct-5-yl)-(3-bromo-phényl)-méthyll-
(2-
ch loro-3-trifluorométhyl)-benzam ide.
Dans un tube scellé sous argon, on place 19 mg de palladium
tétrakis(triphénylphosphine) (0,02 mmole) et 0,078 g d'acide N,N-
diméthylbarbiturique (0,5 mmole) en solution dans 3 ml de dichlorométhane. Le
milieu réactionnel est chauffé à 40 C avant d'ajouter 0,09 g de N-[(6-allyl-6-
aza-
bicyclo[3.2.1 ]oct-5-yl)-(3-bromo-phényl)-méthyl]-(2-chloro-3-trifluorométhyl)-
benzamide (0,17 mmole) dans 3 ml de dichlorométhane. On chauffe 2 heures à
40 C. Après refroidissement, on dilue avec 10 ml de dichlorométhane et on
hydrolyse ensuite avec 5 ml d'une solution de carbonate de sodium.
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
17
La phase organique est séparée et lavée 2 fois avec 5 ml de l'acide
chlorhydrique 1
N. Les phases aqueuses sont réunies puis basifiées avec de l'ammoniaque à pH
9,
puis extraites 2 fois avec 25 ml de dichlorométhane. Les phases organiques
sont
séchées sur sulfate de sodium, filtrées et évaporées sous pression réduite. Le
résidu
est purifié par chromatographie sur colonne de gel de silice en éluant avec un
mélange de dichlorométhane et de méthanol ammoniacal. On obtient ainsi 62 mg
de
N-[(6-aza-bicyclo[3.2.1 ]oct-5-yl)-(3-bromo-phényl)-méthyl]-(2-chloro-3-
trifluorométhyl)-benzamide qui est salifié sous forme de chlorhydrate par
solubilisation de la base dans le dichlorométhane, ajout d'un excès d'acide
chlorhydrique 1N dans l'éther, concentration sous pression réduite,
trituration dans
l'éther puis filtration.
PF : 250,5-251,5 C
RMN 1H (400 MHz, DMSO-d6) 8 ppm 9,62 (m, 1 H), 9,45 (d, J= 9,2 Hz, 1 H), 8,94
(m,
1 H), 7,97 (dxd, J= 8 et 1,5 Hz,1 H), 7,91 (m, 1 H) 7,77 (dxd, J= 7,8 et 1,4
Hz, 1 H),
7,67 (t, J= 7,6 Hz,2H), 7,59 (m, J=8 Hz, 1H), 7,43 (t, J= 7,9 Hz, 2H), 5,74
(d, J= 9,1
Hz, 1 H), 3,50 (m, 1 H), 3,15 (m, 1 H), 2,64 (m, 1 H), 2,08 (m, 1 H)1,94 (m, 1
H), 1,80 (m,
1 H), 1,72-1,40 (m, 5H).
Les autres composés listés dans le tableau 1 sont obtenus suivant les méthodes
décrites dans les exemples 1 à 6, à partir des amines de formule (Ila), (Ilb),
(Ilc), de
lithiens de formule (V), de dérivés d'acides carboxyliques de formule (III) ou
d'agents
alkylants appropriés.
Le tableau 1 qui suit illustre les structures chimiques de quelques composés
de
l'invention.
Dans la colonne
- "Sels", - désigne un composé à l'état de base, "HCI", désigne un
chlorhydrate, le
chiffre entre parenthèse indique le rapport (acide : base),
- Les composés du tableau se présentent sous la forme de chlorhydrate solvaté
par
une ou plusieurs molécules d'eau,
Dans les colonnes R, R, et R2 :
- - CI signifie chlore,
- CH3 signifie méthyle,
- NH2 signifie amino,
- OCH3 signifie méthoxy,
- Ph signifie phényle,
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
18
- SO2C2H5 signifie éthanesulfonyle,
- CF3 signifie trifluorométhyle,
- dans la colonne R2 , le chiffre devant les substituants indique leur
position dans la
formule générale (I).
Le tableau 2 donne les propriétés physiques, points de fusion et pouvoirs
rotatoires
des composés du tableau 1.
Dans le tableau 2 :
- la colonne [ad 20-c renseigne le résultat d'analyse du pouvoir rotatoire des
composés du tableau à la longueur d'onde de 589 nM et à la température de
C. Le solvant indiqué entre parenthèses correspond au solvant employé pour
réaliser la mesure du pouvoir rotatoire en degrés et la lettre c indique
la
concentration du solvant en g/100 ml. N.A. signifie que la mesure du
pouvoir
rotatoire n'est pas applicable,
15 - la colonne "m/z" renseigne l'ion moléculaire (M+H+) ou (M+) observé par
analyse
des produits par spectrométrie de masse, soit par LC-MS (Liquid Chromatography
coupled to Mass Spectroscopy) réalisée sur un appareil de type Agilent LC-MSD
Trap en mode ESI positif, soit par introduction directe par MS (Mass
Spectroscopy) sur un appareil Autospec M (EBE) en utilisant la technique DCI-
20 NH3 ou en utilisant la technique d'impact électronique sur un appareil de
type
Waters GCT.
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
19
TABLEAU 1
R1
NM 0
R HN
/ R2
N R R, R2 Sels stéréochimie
Diastéréoisomère 1,
1 H Ph 2-CH3,3-CF3 -
racémique
Diastéréoisomère 1,
2 H Ph 2-CH3,3-OCH3 -
racémique
HCI Diastéréoisomère 1,
3 H Ph 2,6(CI)2,3-CF3
(1:1) racémique
HCI Diastéréoisomère 1,
4 H Ph 2-C1,3-CF3
(1 :1) racémique
HCI
H Ph 2-C1,3-CF3 (1:1) Chiral dextrogyre
HCI
6 H Ph 2,6-(CI)2,3- CF3 (1:1) Chiral lévogyre
HCI
7 H Ph 2-C1,3-CF3 (1:1) Chiral lévogyre
HCI
8 H Ph 2,6-(CI)2,3- CF3 (1) Chiral dextrogyre
9 H Ph 2-OCH3,4-C1,5-SO2C2H5 HCI Diastéréoisomère 1,
(1 :1) racémique
HCI Diastéréoisomère 1,
H Ph 2-C1, 5-CF3
(1 :1) racémique
Diastéréoisomère 1,
11 H Ph 2,6-(CI)2 -
racémique
Diastéréoisomère 1,
12 H Ph 2-CH3,3-CI -
racémique
13 H 4-F-Ph 2-C1,3-CF3 - Diastéréoisomère 1,
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
racémique
Diastéréoisomère 1,
14 H 4-F-Ph 2,6-(CI)2,3-CF3 -
racémique
3-OCH3- Diastéréoisomère 1,
15 H 2,6-(CI)2,3-CF3 -
Ph racémique
3-OCH3- Diastéréoisomère 1,
16 H 2-C1,3-CF3 -
Ph racémique
Diastéréoisomère 1,
17 H 3-OH-Ph 2-C1,3-CF3 -
racémique
Diastéréoisomère 1,
18 H 3-OH-Ph 2,6-(CI)2,3-CF3 -
racémique
HCI Diastéréoisomère 1,
19 H 3-CH3-Ph 2-C1,3-CF3
(1 :1) racémique
Diastéréoisomère 1,
20 C2H5 Ph 2-C1,3-CF3 -
racémique
Diastéréoisomère 1,
21 H 3-CH3-Ph 2,6-(CI)2,3-CF3 -
racémique
HC Diastéréoisomère 1,
22 CH3 Ph 2-C1,3-CF3
(1:1)1 racémique
HCI Diastéréoisomère 1,
23 H 3-Br-Ph 2-C1,3-CF3
(1:1) racémique
HCI Diastéréoisomère 1,
24 H 3-Br-Ph 2,6-(CI)2,3-CF3
(1:1) racémique
HCI Diastéréoisomère 1,
H 3-CF3-Ph 2-C1,3-CF3
(1:1) racémique
HCI
26 C2H5 Ph 2,6-(CI)2,3-CF3 (1:1) Chiral dextrogyre
HCI Diastéréoisomère 1,
27 C2H5 3-CF3-Ph 2-C1,3-CF3
(1:1) racémique
TABLEAU 2
LCMS
N F C [a0] 20 C MH+
1 58,5-59,5 N.A 403
2 233-234 N.A 365
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
21
3 249,5-250,5 N.A 457
4 260-262 N.A 423
265,5-266,5 32,0 (MeOH, c=0,66g/100 ml) 423
6 192-193 -40.5 (MeOH, c=0,196g/100 ml) 457
7 266,5-267,5 -26,4 (MeOH, c=0,73g/100 ml) 423
8 241-242 30,7 (MeOH, c=0,75g/100ml) 457
9 185-187 N.A 477
188-190 N.A 423
11 172-174 N.A 389
12 132-134 N.A 369
13 244-246 N.A 441
14 188-190 N.A 475
208-210 N.A 487
16 67-69 N.A 453
17 180-182 N.A 439
18 208-210 N.A 473
19 257-259 N.A 437
160-162 N.A 451
21 186-188 N.A 471
22 186-188 N.A 437
23 250-251 N.A 501
24 278,5-279 N.A 535
236-238 N.A 491
+55,37 (CHC13, c=0,736g/100
26 270,5-272,5 C 485
MI)
27 147-148 C N.A 519
Les composés de l'invention ont été soumis à une série d'essais
pharmacologiques qui
ont mis en évidence leur intérêt comme substances à activités thérapeutiques.
5
Etude du transport de la glycine dans les cellules SK-N-MC exprimant le
transporteur
humain glyt1 natif.
La capture de [14C]glycine est étudiée dans les cellules SK-N-MC (cellules
neuro-
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
22
épithéliales humaines) exprimant le transporteur humain glyt1 natif par la
mesure de la
radioactivité incorporée en présence ou en absence du composé à tester. Les
cellules
sont cultivées en monocouche pendant 48 h dans des plaques prétraitées à la
fibronectine à 0,02%. Le jour de l'expérience, le milieu de culture est
éliminé et les
cellules sont lavées par un tampon Krebs-HEPES (acide [4-(2-
hydroxyéthyl)pipérazine-
1-éthanesulfonique) à pH 7,4. Après 10 min de préincubation à 37 C en présence
soit
de tampon (lot témoin), soit de composé à tester à différentes concentrations
ou de
mM de glycine (détermination de la capture non spécifique), 10 pM de
[14C]glycine
(activité spécifique 112 mCi/mmole) sont ensuite ajoutés. L'incubation se
poursuit
10 pendant 10 min à 37 C, et la réaction est arrêtée par 2 lavages avec un
tampon
Krebs-HEPES à pH 7,4. La radioactivité incorporée par les cellules est alors
estimée
après ajout de 100 pl de scintillant liquide et agitation pendant 1 h. Le
comptage est
réalisé sur compteur Microbeta Tri-IuxTM. L'efficacité du composé est
déterminée par la
C150, concentration du composé qui diminue de 50% la capture spécifique de
glycine,
définie par la différence de radioactivité incorporée par le lot témoin et le
lot qui a reçu
la glycine à 10 mM.
Les composés de l'invention, dans ce test, ont une C150 de l'ordre de 0,001 à
10 pM.
Le tableau 3 indique quelques exemples de résultats de C150 pour des composés
selon
l'invention.
TABLEAU 3
Composé C150 (pM)
2 1
4 0,020
5 0,04
7 0,29
11 0,90
16 0,163
17 0,045
20 0,006
23 0,036
0,547
Les résultats des essais effectués sur les composés chiraux de l'invention et
leurs
racémates dans la formule générale (1) dans laquelle R2 représente notamment
un ou
25 plusieurs atomes d'halogènes ou groupes trifluorométhyle montrent qu'ils
sont des
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
23
inhibiteurs du transporteur de la glycine glyt1 présents dans le cerveau.
Ces résultats suggèrent que les composés de l'invention peuvent être utilisés
pour le
traitement des troubles cognitifs et/ou comportementaux associés à des
maladies
neurodégénératives, à la démence ; pour le traitement des psychoses, notamment
de
la schizophrénie (forme déficitaire et forme productive), des symptômes
extrapyramidaux aigus ou chroniques induits par les neuroleptiques ; pour le
traitement
des diverses formes d'anxiété, des attaques de panique, des phobies, des
troubles
obsessionnels compulsifs ; pour le traitement des différentes formes de
dépression, y
compris la dépression psychotique ; pour le traitement des troubles
bipolaires, des
troubles maniaques, des troubles de l'humeur; pour le traitement des troubles
dus à
l'abus ou au sevrage d'alcool, des troubles du comportement sexuel, des
troubles de la
prise de nourriture, de la migraine ; de la douleur ; des troubles du sommeil.
Les composés selon l'invention peuvent donc être utilisés pour la préparation
de
médicaments, en particulier de médicaments inhibiteurs du transporteur de la
glycine
glyt1.
Ainsi, selon un autre de ses aspects, l'invention a pour objet des médicaments
qui
comprennent un composé de formule (I), ou un sel d'addition de ce dernier à un
acide
pharmaceutiquement acceptable ou encore un hydrate ou un solvate du composé de
formule (I).
La présente invention a également pour objet des compositions pharmaceutiques
contenant une dose efficace d'au moins un composé selon l'invention, à l'état
de base
ou de sel ou de solvat pharmaceutiquement acceptable, et en mélange, le cas
échéant, avec des excipients convenables.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration souhaité.
Les compositions pharmaceutiques selon l'invention peuvent ainsi être
destinées à
l'administration orale, sublinguale, sous-cutanée, intramusculaire,
intraveineuse,
topique, intratrachéale, intranasale, transdermique, rectale, intraocculaire.
Les formes unitaires d'administration peuvent être, par exemple, des
comprimés, des
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
24
gélules, des granules, des poudres, des solutions ou suspensions orales ou
injectables, des timbres transdermiques ("patch"), des suppositoires. Pour
l'administration topique on peut envisager des pommades, lotions et collyres.
Lesdites formes unitaires sont dosées pour permettre une administration
journalière de
0,01 à 20 mg de principe actif par kg de poids corporel, selon la forme
galénique.
Pour préparer des comprimés on ajoute au principe actif, micronisé ou non, un
véhicule pharmaceutique qui peut être composé de diluants, comme par exemple
le
lactose, la cellulose microcristalline, l'amidon, et des adjuvants de
formulation comme
des liants, (polyvinylpyrrolidone, hydroxy-propylméthylcellulose, etc), des
agents
d'écoulement comme la silice, des lubrifiants comme le stéarate de magnésium,
l'acide
stéarique, le tribehenate de glycerol, le stéaryl-fumarate de sodium. Des
agents
mouillants ou tensioactifs tels que le laurylsulfate de sodium peuvent aussi
être
ajoutés.
Les techniques de réalisation peuvent être la compression directe, la
granulation
sèche, la granulation humide ou la fusion à chaud.
Les comprimés peuvent être nus, dragéifiés, par exemple par du saccharose, ou
enrobés avec divers polymères ou autres matières appropriées. Il peuvent être
conçus
pour permettre une libération rapide, retardée ou prolongée du principe actif
grâce à
des matrices polymères ou à des polymères spécifiques utilisés dans
l'enrobage.
Pour préparer des gélules on mélange le principe actif avec des véhicules
pharmaceutiques secs (simple mélange, granulation sèche ou humide, ou fusion à
chaud), liquides ou semi-solides.
Les gélules peuvent être dures ou molles, pelliculées ou non, de manière à
avoir une
activité rapide, prolongée ou retardée (par exemple pour une forme entérique).
Une composition sous forme de sirop ou d'élixir ou pour l'administration sous
forme de
gouttes peut contenir le principe actif conjointement à un édulcorant, de
préférence
acalorique, du méthylparaben ou du propylparaben comme antiseptique, un agent
de
sapidité et un colorant.
Les poudres et granules dispersibles dans de l'eau peuvent contenir le
principe actif en
mélange avec des agents de dispersion ou des agents mouillants, ou des agents
dispersants comme la polyvinylpyrrolidone, de même qu'avec des édulcorants et
des
agents correcteurs de goût.
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
Pour l'administration rectale, on recourt à des suppositoires préparés avec
des liants
fondant à la température rectale, par exemple du beurre de cacao ou des
polyéthylèneglycols.
5
Pour une administration parentérale, on utilise des suspensions aqueuses, des
solutions salines isotoniques ou des solutions stériles injectables contenant
des agents
de dispersion et/ou des mouillants pharmacologiquement compatibles, par
exemple le
propylèneglycol ou le butylène-glycol.
Le principe actif peut être formulé également sous forme de microcapsules,
éventuellement avec un ou plusieurs supports ou additifs, ou bien avec une
matrice
polymère ou avec une cyclodextrine (timbres transdermiques, formes à
libération
prolongée).
Les compositions topiques selon l'invention comprennent un milieu compatible
avec la
peau. Elles peuvent se présenter notamment sous forme de solutions aqueuses,
alcooliques ou hydroalcooliques, de gels, d'émulsions eau-dans-huile ou huile-
dans-
eau ayant l'aspect d'une crème ou d'un gel, de microémulsions, d'aérosols, ou
encore
sous forme de dispersions vésiculaires contenant des lipides ioniques et/ou
non
ioniques. Ces formes galéniques sont préparées selon les méthodes usuelles des
domaines considérés.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention
sous forme de comprimé peut comprendre les composants suivants :
Composé selon l'invention 50,0 mg
Mannitol 223,75 mg
Croscaramellose sodique 6,0 mg
Amidon de maïs 15,0 mg
Hydroxypropyl-méthylcellulose 2,25 mg
Stéarate de magnésium 3,0 mg
Par voie orale, la dose de principe actif administrée par jour peut atteindre
0,1 à 20
mg/kg, en une ou plusieurs prises.
Il peut y avoir des cas particuliers où des dosages plus élevés ou plus
faibles sont
CA 02751866 2011-08-08
WO 2010/092287 PCT/FR2010/050204
26
appropriés ; de tels dosages ne sortent pas du cadre de l'invention. Selon la
pratique
habituelle, le dosage approprié à chaque patient est déterminé par le médecin
selon le
mode d'administration, le poids et la réponse dudit patient.
La présente invention, selon un autre de ses aspects, concerne également une
méthode de traitement des pathologies ci-dessus indiquées qui comprend
l'administration, à un patient, d'une dose efficace d'un composé selon
l'invention, ou un
de ses sels pharmaceutiquement acceptables.