Note: Descriptions are shown in the official language in which they were submitted.
WO 2010/109122 PCT/FR2010/050511
DERIVES DE NICOTINAMIDE, LEUR PREPARATION ET LEUR APPLICATION EN
THERAPEUTIQUE COMME ANTICANCEREUX
La présente invention se rapporte à des dérivés de nicotinamide, les
compositions les
contenant et leur application en thérapeutique, notamment comme anticancéreux.
L'invention
se rapporte aussi au procédé de préparation de ces composés ainsi qu'à
certains des
produits intermédiaires.
[L'art antérieur]
La demande internationale WO 2005/051366 décrit des composés de formule
générale (A)
CH2)
A=~.A~ ~i O
(Y2). R5 (A)
dans laquelle Z représente un groupe phényle ou indanyle et non un groupe
pyridinyle.
La demande internationale WO 2007/016538 décrit des composés de formule
générale (B) :
O OH
R¾
s YEN 2Rs
r\- T
R\ ~
R1R
H (B)
dans laquelle Q peut représenter un groupe R13-NR12-C(=O)-, R13 pouvant être
un groupe 2-,
3- ou 4- pyridinyle, R4 et R5 représentant un atome d'hydrogène, un groupe
alkyle, alcoxy, -
OH, -CF3 ou -CN. Ces composés sont utilisés dans le traitement de l'obésité.
[Description de l'invention]
Définitions utilisées
Dans le cadre de la présente invention, on entend par :
= atome d'halogène : un atome de fluor, de chlore, de brome ou d'iode ;
= groupe alkyle : un groupe hydrocarboné aliphatique saturé comprenant de 1 à
6 atomes
de carbone (avantageusement, de 1 à 4 atomes de carbone) obtenu en enlevant un
atome d'hydrogène d'un alcane. Le groupe alkyle peut être linéaire ou ramifié.
A titre
WO 2010/109122 PCT/FR2010/050511
2
d'exemples, on peut citer les groupes méthyle, éthyle, propyle, isopropyle,
butyle, iso-
butyle, tertio-butyle, pentyle, 2,2-diméthylpropyle, hexyle ;
= groupe alcoxy : un groupe -0-alkyle, où le groupe alkyle est tel que défini
ci-dessus ;
= groupe cycloalkyle : un groupe alkyle cyclique comprenant entre 3 et 8
atomes de
carbone, tous les atomes de carbone étant engagés dans la structure cyclique.
A titre
d'exemples, on peut citer les groupes cyclopropyle, cyclobutyle, cyclopentyle,
cyclohexyle ;
= groupe hétérocycloalkyle : un groupe cycloalkyle comprenant au moins un
hétéroatome
(O, S, N) engagé dans le cycle et relié aux atomes de carbone formant le
cycle. A titre
d'exemples, on peut citer les groupes pyrrolidinyle, pipéridinyle,
pipérazinyle ou N-(C1-
C4)alkyle-pipérazinyle, azépanyle, thiomorpholinyle, 1-oxo-thiomorpholinyle,
1,1-dioxo-
thiomorpholinyle.
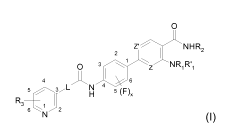
Selon un 1er aspect, la présente invention a pour objet un composé de formule
(I)
0
Z'- NHR2
z
o y 3 IZ~ NRIR-1
5 a L~N 4 6
H 5(F)x
Rat
5 z
N (I)
dans laquelle
= Z et Z' représentent N ou CH ;
= x est un entier valant 1 ou 2, représentant le nombre d'atome(s) de fluor
attaché(s) au
noyau phényle central ;
= L représente un groupe -CH=CH- ou -(CH2)nNH- dans lequel le groupe NH est
rattaché
au C=O et n est un entier valant 0, 1 ou 2 ;
= R1 représente un atome d'hydrogène, un groupe (C1-C6)alkyle, (C3-
C6)cycloalkyle,
phényle ;
= R'1 représente un atome d'hydrogène ou un groupe (C1-C6)alkyle ;
= R2 représente :
- un groupe (C3-C6)cycloalkyle ;
- un groupe (C1-C6)alkyle, éventuellement substitué par :
o un ou plusieurs groupes hydroxy ou (C1-C4)alcoxy ;
o un groupe -NRaRb dans lequel Ra et Rb représentent indépendamment l'un de
l'autre un atome d'hydrogène ou un groupe (C1-C6)alkyle ou forment ensemble
avec l'atome d'azote auquel ils sont reliés un groupe (C4-C6)hétérocycloalkyle
WO 2010/109122 PCT/FR2010/050511
3
comprenant éventuellement dans le cycle le groupe -S(O)q avec q= 0, 1 ou 2 ou
le
groupe -NH- ou -N(C1-C4)alkyle- et
étant éventuellement substitué par un ou plusieurs substituant(s), identiques
ou
différents les uns des autres lorsqu'il y en a plusieurs, choisi(s) parmi un
groupe -
OH ; (C1-C4)alcoxy ou (C1-C4)alkyle ;
= R3 représente au moins un substituant du noyau pyridine choisi parmi un
atome
d'hydrogène ou de fluor, un groupe (C1-C4)alkyle ou -NRcRd dans lequel Rc et
Rd
représentent un atome d'hydrogène ou un groupe (C1-C4)alkyle ;
R1 représente un atome d'hydrogène, un groupe (C1-C6)alkyle, (C3-
C6)cycloalkyle, par
exemple cyclopropyle, un groupe phényle. R'1 représente un atome d'hydrogène
ou un
groupe (C1-C6)alkyle. Plus particulièrement, R'1 représente un atome
d'hydrogène. On pourra
choisir R1 et/ou R'1 parmi ceux décrits dans le tableau I.
R2 représente :
- un groupe (C3-C6)cycloalkyle, tel que par exemple le groupe cyclopropyle ou
cyclopentyle ;
- un groupe (C1-C6)alkyle, éventuellement substitué par :
o un ou plusieurs groupe(s) -OH ou (C1-C4)alcoxy, par exemple méthoxy ;
o un groupe -NRaRb dans lequel Ra et Rb représentent indépendamment l'un de
l'autre un atome d'hydrogène ou un groupe (C1-C6)alkyle ou forment ensemble
avec
l'atome d'azote auquel ils sont reliés un groupe (C4-C6)hétérocycloalkyle
comprenant
éventuellement dans le cycle le groupe -S(O)q avec q= 0, 1 ou 2 ou le groupe -
NH-
ou -N(C1-C4)alkyle-. De préférence, q= 1 ou 2.
Le groupe hétérocycloalkyle formé par Ra et Rb peut être par exemple le groupe
pyrrolidinyle
( ), pipéridinyle ( ), pipérazinyle ( HN ) ou N-(C1-C4)alkyle-pipérazinyle
~N N
Alk-N~ G
( ), notamment N-méthyle-pipérazinyle, azépanyle ( ), thiomorpholinyle
r_~N s
g~ 0 SI_~j 11 ~_j
), 1-oxo-thiomorpholinyle ( ), 1,1-dioxo-thiomorpholinyle ( ).
WO 2010/109122 PCT/FR2010/050511
4
Le groupe hétérocycloalkyle formé par Ra et Rb peut être éventuellement
substitué par un ou
plusieurs substituant(s), identiques ou différents les uns des autres
lorsqu'il y en a plusieurs,
choisi(s) parmi : -OH ; (C1-C4)alcoxy : par exemple méthoxy ; (C1-C4)alkyle :
par exemple
méthyle. Ainsi, l'hétérocycloalkyle substitué pourra être le groupe 3-
hydroxypipéridinyle
N~ N
( OH ou 4-hydroxy-pipéridinyle (HO 4-méthoxy-pipéridinyle (Meo
) ))N L N
cis-3,5-diméthyl-pipéridinyle ( ), cis-2,6-diméthyl-pipéridinyle ( ).
On pourra choisir R2 parmi l'un de ceux décrits dans le tableau I.
Le noyau pyridine peut comprendre de 1 à 4 substituants R3 choisi(s) parmi un
atome
d'hydrogène ou de fluor, un groupe (C1-C4)alkyle ou -NRcRd dans lequel Rc et
Rd
représentent un atome d'hydrogène ou un groupe (C1-C4)alkyle. On pourra
choisir R3 parmi
ceux décrits dans le tableau I. De préférence, R3 est en position 5 et/ou 6
sur le noyau
pyridine. De préférence, le nombre de substituants R3 est égal à 1 et/ou R3
est en position 5
ou 6 sur le noyau pyridine comme cela est représenté ci-dessous :
R3
F23 N N
position 6 position 5
R3 est encore plus préférentiellement en position 6. De préférence, R3
représente un atome
d'hydrogène ou -NH2.
L représente un groupe -CH=CH- ou -(CH2)nNH- dans lequel le groupe NH est
rattaché au
C=O et n est un entier valant 0, 1 ou 2. De préférence, n est égal à 1. L peut
être l'un de ceux
décrits dans le tableau I. On préfère aussi, dans le cas où L représente le
groupe -CH=CH-,
les isomères E plutôt que les isomères Z.
Z et Z' représentent N ou CH. Par exemple, Z et Z' peuvent représenter
respectivement N et
CH ; CH et CH ou N et N :
/ CONHR2 OCNR: ixN Il, N NR R' R R'
C , C2 C3
WO 2010/109122 PCT/FR2010/050511
x est un entier valant 1 ou 2, représentant le nombre d'atome(s) de fluor
attaché(s) au noyau
phényle central. Plus particulièrement, x vaut 1.
On distingue le sous-groupe de formule (l')
0
NHR2
z
o 3 N NR1R'1
a
CHZNH H 5 (F)x
5 R3 N (I')
dans laquelle R1, R'1, R2, R3 et x sont tels que définis précédemment.
On distingue le sous-groupe de formule (I")
0
NHR2
z
o 3 N L NHRI
CHZNH H 5 (F)x
R3 N (I")
dans laquelle Ri représentent un groupe (C1-C4)alkyle, R2 représente un groupe
(C1-C6)alkyle
éventuellement substitué par le groupe -NRaRb dans lequel Ra et Rb forment
ensemble avec
l'atome d'azote auquel ils sont reliés le groupe (C4-C6)hétérocycloalkyle
comprenant
éventuellement dans le cycle le groupe -S(O)q avec q= 0, 1 ou 2 ou le groupe -
NH- ou -N(C1-
C4)alkyle et R3 et x étant tels que définis précédemment. Plus
particulièrement, x vaut 1. Plus
particulièrement encore, x vaut 1 et l'atome de fluor est en position 3.
Parmi les composés objets de l'invention, on peut citer ceux du Tableau I.
Les composés de l'invention, y compris les composés exemplifiés, peuvent
exister à l'état de
bases ou de sels d'addition à des acides. De tels sels d'addition font
également partie de
l'invention. Ces sels sont avantageusement préparés avec des acides
pharmaceutiquement
acceptables, mais les sels d'autres acides utiles, par exemple, pour la
purification ou
l'isolement des composés font également partie de l'invention. Les composés
selon
l'invention peuvent également exister sous forme d'hydrates ou de solvats, à
savoir sous
forme d'associations ou de combinaisons avec une ou plusieurs molécules d'eau
ou avec un
solvant. De tels hydrates et solvats font également partie de l'invention.
WO 2010/109122 PCT/FR2010/050511
6
Les composés peuvent comporter un ou plusieurs atomes de carbone asymétriques.
Ils
peuvent donc exister sous forme d'énantiomères ou de diastéréoisomères. Ces
énantiomères, diastéréoisomères, ainsi que leurs mélanges font partie de
l'invention.
Selon la présente invention, les N-oxydes des composés comportant une amine ou
un atome
d'azote font également partie de l'invention.
Selon un 2ème aspect, l'invention a pour objet le procédé de préparation des
composés de
l'invention ainsi que certains des intermédiaires réactionnels.
Préparation des composés de formule (I) ou (l') pour lesquels L = -(CH22) NH-
On peut préparer ces composés selon l'un des Schémas 1-3 suivants.
Schéma 1
OK O
O H O B.OK' Z'i,NHR2
NHRZ CNxNe [Pd] C 1 z R R'1
Hal NR R + Rs Jn H H (F)x N i
Z
1 1 Rs -Q4~H H (F)x
P1 P2 (~)
Schéma 1
On réalise un couplage de type Suzuki de Pl et P2. Hal représente un atome
d'halogène
(chlore, brome, iode). Le couplage est réalisé en présence d'un complexe de
palladium (à
l'état d'oxydation (0) ou (II)) en milieu basique. Le complexe peut être par
exemple Pd(PPh3)4,
PdCI2(PPh3)2, Pd(OAc)2, PdCI2(dppf) ou le bis(di-tert-butyl(4-
diméthylaminophényl)phosphine)dichloropalladium(II). Les complexes les plus
fréquemment
utilisés sont des complexes de palladium(0). La base peut être par exemple
K2CO3, NaHCO3,
Et3N, K3PO4, Ba(OH)2, NaOH, KF, CsF, Cs2CO3... Le couplage peut être conduit
dans un
mélange d'un solvant éthéré et d'un alcool, par exemple un mélange
diméthoxyéthane
(DME)/éthanol ; il peut s'agir aussi d'un mélange toluène/eau. La température
est comprise
entre 50 et 120 C. La durée de la réaction peut dans certains cas être longue
(voir ex. 1.3.).
On trouvera plus de détails sur le couplage de Suzuki, sur les conditions
opératoires ainsi que
sur les complexes de palladium utilisables dans : N.Miyaura et A.Suzuki, Chem.
Rev. 1995,
95, 2457-2483; A.Suzuki dans "Metal-catalyzed cross-coupling reactions";
Diederich, F.;
Stang, P.J. Eds. Wiley-VCH: Weinhein, Germany, 1998, chap. 2, 49-97 ; Littke,
A. et Fu, G.,
WO 2010/109122 PCT/FR2010/050511
7
Angew. Chem. Int., Ed. 1999, 38, 3387-3388 et Chemler, S. R.
Angew.Chem.Int.Ed. 2001, 40,
4544-4568.
K et K' représentent un atome d'hydrogène, un groupe alkyle ou aryle,
éventuellement reliés
entre eux pour former ensemble avec l'atome de bore et les deux atomes
d'oxygène un cycle
de 5 à 7 chainons éventuellement substitué par au moins un groupe (C1-
C4)alkyle ou auquel
éventuellement est accolé sur deux atomes de carbone consécutifs dudit cycle
un groupe
phényle. Par exemple, on peut utiliser l'un des groupes suivants :
OH O O O O
3CB-OH 3tB0B0 3CB~0 0
Schéma 2
O OK O
Y
NHR2 B OK' [Pd] Z'iNHR2 H -
Z'
Hal~z NRR'+ H2N (F) I \ Z R R'1+R CiivH2 C-011
X HzN
p p P3 (F)X P4 PS O
Z'i,NHR2
C xN R1R
Z
R H H (F)X
(I)
Selon le Schéma 2, on réalise un couplage de Suzuki (voir plus haut) entre Pl
et P3 pour
obtenir P4, puis on fait réagir P4 avec P5 en présence d'un agent permettant
d'introduire le
motif "C=O" (par exemple le phosgène, le triphosgène ou le carbonate de N,N'-
disuccinimidyle DSC). La réaction permettant d'introduire "C=O" est conduite
de préférence
en présence d'une base telle que par exemple la triéthylamine et à une
température comprise
entre -5 C et la température ambiante. Le solvant peut être le THF. Voir ex.
1.4.
Schéma 3
COOH O
C NHR2
H O Zlz NR' Z'iY-,-
Qq N R2NH2 H O I -R'1
Rs j H _ C xN Ri
(F)X Rs l H
P6 (F)X
(I)
Selon le Schéma 3, on obtient le composé de formule (I) par une réaction
d'amidification à
partir de P6 et de l'amine R2NH2 ou d'un sel de cette amine, par exemple le
chlorhydrate (voir
ex.3.2). L'amidification peut être conduite avantageusement en présence d'un
activateur
WO 2010/109122 PCT/FR2010/050511
8
d'acide (aussi appelé coupling agent ) comme par exemple le benzotriazol-1-
yloxytris(dimethylamino)-phosphonium hexafluorophosphate (ou BOP, CAS N 56602-
33-6,
voir aussi B.Castro., Dormoy, J.R. Tetrahedron Letter 1975, 16, 1219). La
réaction est
conduite de préférence en présence d'une base (telle que la triéthylamine) à
température
ambiante, dans un solvant tel que le tétrahydrofurane (THF) ou le
diméthylformamide (DMF).
P6 est obtenu quant à lui par une réaction de couplage de type Suzuki entre P2
et le composé
P8 de formule :
0
z' OH
I ~
Hal z NRlR'l
P8 selon un schéma similaire au Schéma 1.
préparation de Pl
o o o
Z R,R',NH ~^
Z' OH Z' \ OH RZNHZ Z.
NHRZ 10 Hal z Hal Hal z NR,R', Hal ' NR,R',
P7 P8 Pl
Schéma 4
P8 est obtenu à partir de l'acide P7 par monosubstitution par une amine de
formule R1R'1NH.
Dans le cas d'une amine aliphatique, la réaction peut être conduite à
température ambiante et
dans un solvant protique tel qu'un alcool ou de l'eau ou dans un solvant
aprotique tel que le
THF. Dans le cas d'une aniline, on ajoute une base forte telle que par exemple
le LiHMDS
(((CH3)3Si)2NLi) et la réaction est conduite à chaud. La monosubstitution est
décrite en pages
14-15 de FR 2917412 dans le cas où Z=N et Z'=CH mais peut s'appliquer à
d'autres Z/Z'.
Voir aussi ex.1.1.
Z=N, Z'=CH : P7 est un acide 2,6-dihalogénonicotinique, par exemple l'acide
2,6-
dichloronicotinique qui est commercial (voir ex. 1.1) ;
Z=N, Z'=N : P7 est un acide 2,4-dihalogéno-pyrimidine carboxylique, par
exemple l'acide
2,4-dichloro-pyrimidine carboxylique qui est commercial (CAS N 37131-89-8) ;
Z=CH, Z'=CH : P7 est un acide 2,4-dihalogéno-benzoïque, par exemple l'acide
2,4-
dichloro-benzoïque qui est commercial (CAS N 50-84-0).
Dans le cas où Z et Z' représentent tous les deux N et Hal représente un atome
de chlore, P8
peut aussi être obtenu à partir du composé commercial 5-pyrimidinecarboxylic
acid, 2,4-
WO 2010/109122 PCT/FR2010/050511
9
dichloro-, ethyl ester :
N OEt R,R',NH~ OEt LiOH.H2O OH
CI N CI
THFCI N NRlR'l CI I N NRlR'l
CAS : 51940-64-8 Pe
Schéma 5
Le Schéma 5 utilisant une fonction ester transformée ensuite en fonction acide
s'applique
aussi au cas où Z=N et Z'=CH : voir les conditions dans Chem.Pharm.Bull. 2000,
48(12),
1847-1853 (réactions des tableaux 1 et 2).
P1 est obtenu à partir de l'acide P8 par amidification utilisant l'amine R2NH2
ou un sel de cet
amine, par exemple le chlorhydrate. L'amidification peut être conduite
avantageusement en
présence d'un activateur d'acide (aussi appelé coupling agent ) comme par
exemple le
benzotriazol-l-yloxytris(diméthylamino)-phosphonium hexafluorophosphate (ou
BOP,
CAS N 56602-33-6, voir aussi Castro, B., Dormoy, J.R. Tetrahedron Letter 1975,
16, 1219).
La réaction est conduite de préférence en présence d'une base (telle que la
triéthylamine) à
température ambiante, dans un solvant tel que le tétrahydrofurane (THF) ou le
diméthylformamide (DMF). Voir ex.1.2.
préparation de P3
0
Les composés P3 pour lesquels K et K' forment le groupe suivant : sont
commerciaux ou peuvent être préparés selon la réaction de couplage entre une
bromo-aniline
fluorée et le bis(pinacolato)diboron qui est décrite sur le schéma 2 en page
150-151 de WO
2007/064931 : 3-F (4-amino-3-fluorophénylboronic acid pinacol ester, CAS N
819058-34-9,
société Boron Molecular Inc, PO Box 12592, Research Triangle Park, NC 27709) ;
2-F (4-
amino-2-fluorophénylboronic acid pinacol ester, CAS N 819057-45-9, Boron
Molecular, décrit
en page 185 de WO 20071064931); 2-F, 5-F (CAS N 939807-75-7, composé décrit en
page
184 de WO 20071064931); 3-F, 5-F (CAS N 939968-08-8, décrit en page 182 de WO
2007/064931).
Les composés P3 pour lesquels K et K' représentent un atome d'hydrogène
peuvent être
préparés à partir de la bromo-aniline fluorée par les réactions décrites dans
Tetrahedron
Letters 2003, 44, 7719-7722.
WO 2010/109122 PCT/FR2010/050511
préparation de P2
Les composés P2 sont obtenus à partir des composés P3 et P5 en présence d'un
agent
permettant d'introduire le motif "C=O", selon une réaction telle que décrite
précédemment.
5
composés R2NH2
Les amines R2NH2 sont des produits commerciaux ou déjà décrits dans des
documents
publiés ; par exemple :
= 1-(2-aminoéthyl)pipéridine: CAS N 27578-60-5, décrit dans Justus Liebigs
Annalen der
10 Chemie 1950, 566, 210-44, commercialisé par ACROS ;
= 1-Pipéridinepropanamine: CAS N 3529-08-6, décrit dans Bioorganic & Med.
Chem.Lett.
2006, 16(7), 1938-1940 ;
= 1-pipéridinebutanamine: CAS N 74247-30-6, décrit dans Bioorganic & Med.
Chem.Lett.
2006, 16(7), 1938-1940 ;
=4-pipéridinol, 1-(2-aminoéthyl)-: CAS N 129999-60-6, décrit dans J.Med.Chem.
2005,
48(21), 6690-6695 ainsi qu'en page 17 de WO 2005/061453 (ref.ex.10) ;
= 3-pipéridinol, 1-(2-aminoéthyl)-: CAS N 847499-95-0, décrit dans J.Med.Chem.
2005,
48(21), 6690-6695 ainsi qu'en page 16 de WO 2005/061453 (ref.ex.8) ;
= 2-(4-méthoxy-1-pipéridinyl)éthylamine : CAS N 911300-69-1, décrit dans
J.Med.Chem.
2007, 50(20), 4818-4831 ;
= pyrrolidineéthanamine : CAS N 7154-73-6, décrit dans Anales de Quimica 1974,
70(9-10),
733-737, commercialisé par International Laboratory Ltd, 1067 Sneath Ln, San
Bruno,
CA94066, USA;
= 1-pipérazineéthanamine : CAS N 140-31-8, décrit dans EP 151232 ;
= azépan-1-yléthylamine: CAS N 51388-00-2, décrit dans Anales de Quimica 1974,
70(9-10),
733-737 ;
= 2-(1,1-dioxothiomorpholin-4-yl)éthylamine : CAS N 89937-52-0, commercialisé
par Intern.
Lab. Ltd ;
= N-(2-aminoéthyl)thiamorpholine-1-oxide : CAS N 1017791-77-3, commercialisé
par Sinova
Inc. 3 Bethesda Metro Center, Suite 700, Bethesda, MD, 20814, USA.
Une méthode d'obtention des composés pour lesquels R2 représente un groupe (C1-
C6)alkyle
substitué par le groupe -NRaRb dans lequel Ra et Rb forment ensemble avec
l'atome d'azote
auquel ils sont reliés le groupe (C4-C6)hétérocycloalkyle comprenant
éventuellement dans le
cycle le groupe -S(O)q avec q= 0, 1 ou 2 ou le groupe -NH- ou -N(C1-C4)alkyle
est décrite sur
WO 2010/109122 PCT/FR2010/050511
11
le Schéma 6 qui s'inspire du schéma 3 de Bioorg. Med. Chem. 2007, 15, 365-373
ou du
schéma 2 de Bioorg. Med. Chem. Lett. 2008, 18, 1378-1381 :
o o
base
N (C,-C6)Alk-Br + NHRaRb C_~N-(CI-C6 )Alk-NRaRb
hydrazine
O O
NH 1-(Cl-C6 )AIk-NRaRb
Schéma 6
Une autre méthode décrite sur le Schéma 6' s'inspire de la figure 2 de Bioorg.
Med. Chem.
Lett. 2006, 16, 1938-1940 :
base hydrogénation
NC-(Ci-C5)Alk-Br + NHRaRb - NC-(Cl-C5)Alk-NRaRb ~ NH2 (CI -C6)AIk-NRaRb
Schéma 6'
composés P5
P5 peut être soit commercial soit préparé selon les méthodes connues de
l'homme de l'art.
On peut par exemple utiliser l'hydrogénation du composé cyano pour obtenir P5
avec n=1
CN H2 CH2NH2
3 3 N
R R
P5 avec n=1
Schéma 7
Les conditions d'hydrogénation peuvent être celles décrites dans les ex.19 et
20 de WO
00/46179 ou dans Synlett 2001, 10, 1623-1625.
Les composés 3-picolylamine (CAS N 3731-52-0), 3-(2-aminoéthyl)pyridine (CAS N
20173-
24-4), 2-amino-5-aminométhylpyridine (CAS N 156973-09-0), 2-méthyl-5-
aminométhylpyridine (CAS N 56622-54-9), 3-méthyl-5-aminométhylpyridine (CAS N
771574-
45-9), 2-(BOC-amino)-5-aminométhyl-pyridine (CAS N 187237-37-2), 2,5-
diaminopyridine
(CAS N 4318-76-7) sont des produits commerciaux. Le 2-amino-5-
aminométhylpyridine peut
aussi être préparé selon EP 0607804. Le 5-aminométhyl-2-
(diméthylamino)pyridine (CAS
N 354824-17-2) est commercial ou peut être préparé selon J.Agr.Food Chem.
2008, 56(1),
204-212. Le 2-amino-3-méthyl-5-aminométhylpyridine (CAS N 187163-76-4) peut
être obtenu
par hydrogénation catalytique du composé 6-amino-5-méthyl-nicotinonitrile (CAS
N 183428-
91-3), la fonction amine étant doublement protégée par le BOC. L'hydrogénation
catalytique
WO 2010/109122 PCT/FR2010/050511
12
du 6-méthylamino-3-pyridinecarbonitrile (CAS N 261715-36-0) permet d'accéder
au 2-
méthylamino-5-aminométhylpyridine.
La préparation du 5-aminométhyl-2-(diméthylamino)pyridine (CAS N 779324-37-7)
et du 5-
aminométhyl-2-(diméthylamino)pyridine (CAS N 354824-17-2) sous forme de
chlorhydrate
est également décrite en page 106 de WO 2007/044449 (ex. 207 et 208).
Préparation des composés de formule (I) pour lesquels L = -CH=CH-
Ces composés sont obtenus par une réaction d'amidification entre P4 et l'acide
P1o ou
l'halogénure d'acyle P'10, dérivé de P1o. L'amidification utilisant P1o peut
être réalisée
avantageusement en présence d'un activateur d'acide comme par exemple le BOP.
0 0
R3 OH R3 Hal
P1o P'1 avec Hal=F, Br, CI
P1o peut être soit commercial soit préparé selon les méthodes connues de
l'homme de l'art.
Par exemple, l'acide trans-3-(3-pyridyl)acrylique est commercialisé par Sigma-
Aldrich. Le (6-
aminopyridin-3-yl)acrylic acid (CAS N0234098-57-8; composé E : CAS N 167837-43-
6) est
décrit dans J.Med.Chem. 2002, 45(15), 3246-3256 (voir schéma 4). P1o peut être
préparé à
partir d'une bromo aniline et de l'acide acrylique selon l'enseignement de
J.Med.Chem. 2002,
45(15), 3246-3256. On peut également utiliser un couplage utilisant une bromo
aniline et un
acrylate d'alkyle, puis saponifier la fonction ester en fonction acide (voir à
ce propos, la
méthode permettant de préparer le (6-aminopyridin-3-yl)acrylic acid décrite au
paragraphe
[483] de US 2008269220 ou [354] de EP1726580).
P1o peut être aussi préparé selon J.Org.Chem. 1998, 63, 8785-8789 à partir de
la béta-
formylpyridine correspondante ou bien selon J.Med.Chem. 1989, 32(3), 583-93 à
partir de la
2-chloro-5-nitro-pyridine. L'halogénure d'acyle P'1o est obtenu par une
réaction connue de
l'homme de l'art à partir de l'acide P1o et d'un agent acylant tel que par
exemple SOC12 ou
(COCI)2.
WO 2010/109122 PCT/FR2010/050511
13
On peut également préparer ces composés selon le schéma 8 suivant:
Schéma 8
O
Z NH-R2
Z. N-R'
O 1
P4 + CI NH F R1
Pli
O
Z NH-R2 ,Hal O I i -R'
R3 \
NH (F) R1
R3
12 N
(I)
Selon le Schéma 8, on fait réagir P4 avec le chlorure d'acryloyle, en présence
d'une
base telle que par exemple la triéthylamine et à une température comprise
entre 0 C et
la température ambiante pour obtenir P,,. Le solvant peut être le
dichlorométhane
(DCM) (voir ex. 4.1).
Puis on fait réagir Põ avec P12 (Hal représente un atome d'halogène), en
présence d'un
complexe de palladium tel que par exemple Pd(OAc)2, de tri-orthotolylphosphine
et
d'une base telle que par exemple la diisopropyléthylamine. Le solvant peut
être par
exemple le propionitrile. La température est comprise entre la température
ambiante et
la température de reflux du solvant.
Protection de la fonction amine primaire ou secondaire
Il peut être nécessaire d'utiliser à au moins une des étapes un groupe
protecteur (PG) afin de
protéger une ou plusieurs fonction(s) chimique(s), notamment une fonction
amine primaire ou
secondaire. Par exemple, lorsque Ra et Rb représentent tous deux un atome
d'hydrogène,
l'amidification du Schéma 3 est réalisée en utilisant pour R2NH2 le composé
2HN-(C1-
C6)alkyle-NH-PG, où PG représente avantageusement le BOC (tert-
butoxycarbonyle). De
même, lorsque le groupe hétérocycloalkyle formé par Ra et Rb représente le
groupe
WO 2010/109122 PCT/FR2010/050511
14
pipérazinyle (HN~ ), on peut en protéger avantageusement la fonction -NH- en
utilisant
2HN-(C1-C6)alkyle- N N-PG
le composé R2NH2 suivant \_, où PG représente avantageusement le
BOC. De même, lorsque R3 représente le groupe -NH2 ou -NHRc, on peut protéger
avantageusement la fonction amine par un ou deux groupe(s) PG, de préférence
le BOC ou
le FMOC (9-fluorénylméthyl carbamate). On peut par exemple utiliser le composé
P5
NH2
suivant : (BOC)2N N , ou bien les composés P1o ou P'10 suivants
0 0
NH(FMOC) _ OH NH(FMOC) Hal
P10 P'10 avec Hal=F, Br, CI
La/les fonction(s) chimique(s) est/sont ensuite obtenue(s) par une étape de
déprotection
(finale ou intermédiaire) dont les conditions dépendent de la nature de la/des
fonction(s)
protégée(s) et de groupe protecteur utilisé. On pourra se reporter à
Protective groups in
Organic Synthesis de T.Greene, Wiley, 4ème éd., isbn = 978-0-471-69754-1,
notamment au
chap.7 pour ce qui concerne les groupes protecteurs de la fonction amine. Dans
le cas de la
protection des fonctions -NH2 ou -NH- par le BOC, l'étape de déprotection est
conduite en
milieu acide à l'aide par exemple de HCI ou de l'acide trifluoroacétique
(TFA). On obtient
ainsi le cas échéant le sel associé (chlorhydrate ou trifluoroacétate).
Obtention des sels
Les sels sont obtenus lors de l'étape de déprotection décrite ci-dessus ou
bien par mise en
contact de l'acide et du composé sous sa forme base.
Dans les Schémas précédents, les composés de départ et les réactifs, quand
leur mode de
préparation n'est pas décrit, sont disponibles dans le commerce ou décrits
dans la littérature,
ou bien peuvent être préparés selon des méthodes qui y sont décrites ou qui
sont connues de
l'homme du métier. L'homme du métier pourra aussi s'inspirer des conditions
opératoires
données dans les exemples qui sont décrits ci-après.
Obtention des N-oxydes
Les N-oxydes des composés comportant une amine ou un atome d'azote sont
préparés selon
les méthodes connues de l'homme du métier par réaction de l'amine avec des
péracides
WO 2010/109122 PCT/FR2010/050511
organiques tels que les acides peracétiques, trifluoroperacétiques,
performiques,
perbenzoïques ou ses dérivés tel l'acide 3-chloroperbenzoïque, à des
températures
comprises entre 0 C et 90 C, de préférence à des températures inférieures à 50
C.
Selon un 3ème aspect, l'invention concerne une composition pharmaceutique
comprenant un
5 composé tel que défini précédemment en combinaison avec un excipient
pharmaceutiquement acceptable. L'excipient est choisi parmi les excipients
habituels connus
de l'homme du métier selon la forme pharmaceutique et le mode d'administration
souhaité. Le
mode d'administration peut être par exemple par voie orale ou par
intraveineuse.
10 Selon un 4ème aspect, l'invention a pour objet un médicament qui comprend
un composé tel
que défini précédemment ainsi que l'utilisation d'un composé tel que défini
précédemment,
pour la fabrication d'un médicament. Il peut être utile pour traiter un état
pathologique, en
particulier le cancer. Le médicament (ainsi qu'un composé selon l'invention)
peut être administré
en association avec un (ou plusieurs) anticancéreux. Ce traitement peut être
administré
15 simultanément, séparément ou bien séquentiellement. Le traitement sera
adapté par le
praticien en fonction du malade et de la tumeur à traiter.
Selon un 5ème aspect, l'invention concerne également une méthode de traitement
des
pathologies indiquées précédemment qui comprend l'administration, à un
patient, d'une dose
efficace d'un composé selon l'invention ou un de ses sels pharmaceutiquement
acceptables
ou hydrates ou solvats.
[Exemples]
Les exemples suivants illustrent la préparation de certains composés conformes
à l'invention.
Les numéros des composés exemplifiés renvoient à ceux donnés dans le tableau
ci-après,
qui illustre les structures chimiques et les propriétés physiques de quelques
composés selon
l'invention.
Dans les exemples on utilise les abréviations suivantes
AcOEt : acétate d'éthyle
MeOH : méthanol
DIPEA : diisopropyléthylamine
Les composés ont été analysés par couplage HPLC-UV-MS (chromatographie
liquide,
détection d'ultraviolet (UV) et détection de masse). L'appareil utilisé est
composé d'une
WO 2010/109122 PCT/FR2010/050511
16
chaine chromatographique Agilent équipé d'un détecteur à barrette de diodes
Agilent et d'un
spectromètre de masse simple quadripôle ZQ Waters ou un spectromètre de masse
triple
quadripôle Quattro-MicroWaters.
Les composés ont été analysés par couplage HPLC-UV-MS (chromatographie
liquide,
détection d'ultraviolet (UV) et détection de masse). L'appareil utilisé est
composé d'une
chaine chromatographique équipée d'un détecteur à barrette de diodes (HP1110
Agilent ou
UPLC Acquity Waters) et d'un spectromètre de masse quadripôlaire (ZQ, QM ou
SQD
Waters).
conditions de spectrométrie de masse
Les spectres de chromatographie phase liquide/spectromètre de masse (LC/MS)
ont été
enregistrés en mode électrospray (ESI) positif, afin d'observer les ions issus
de la protonation
de composés analysés (MH+) ou de la formation d'adduits avec d'autres cations
tels que Na+,
K+, etc... Les conditions de HPLC sont choisies parmi l'une des méthodes
suivantes :
conditions TFA15 TFA3 TFA6
Colonne Symmetry C18 (50x2,1 Acquity BEH C18 (50x2,1 mm ; Acquity BEH C18
(50x2,1 mm
mm ; 3,5 Nm) 1,7 pm) 1,7 pm)
Eluant A H2O + TFA 0,005% à H2O + TFA 0,05% à environ pH H2O + TFA 0,05% à
environ pH
environ pH 3,1 3,1 / CH3CN (97/3) 3,1 / CH3CN (97/3)
Eluant B CH3CN + TFA 0,005% CH3CN + TFA 0,035% CH3CN + TFA 0,035%
Gradient 100:0 (0 min) 10:90 100:0 ou 99:1 (0 min) 5:95 100:0 ou 99:1 (0 min)
5:95
A:B (10 min) 10:90 (15 (2,3 min) 5:95 (2,9 min) (4.8 min) 5:95 (6 min)
min) 100:0 (16 min) 100:0 ou 99:1 (3 min) 100:0 100:0 ou 99 :1 (6.1 min)
100:0 (20 min) ou 99 :1 (3,5 min) 100:0 ou 99 :1 (6.6 min)
T.colonne 30 C 40 C 40 C
Débit 0,4 ml/min 1 ml/min 1 ml/min
Détection A = 220 nm X = 220 nm X = 220 nm
TFA: acide trifluoroacétique
Conditions de RMN
Les spectres 'H RMN sont enregistrés sur un spectromètre Bruker Avance 250 /
Bruker
Avance 400 ou Bruker Avance II 500. Le pic central du DMSL-d6 (2,50 ppm) est
utilisé
comme référence interne. Les abréviations suivantes sont utilisées : s :
singulet ; d : doublet ;
dd : doublet dédoublé ; t : triplet ; q : quadruplet ; m : massif/multiplet ;
br.s : signal large.
WO 2010/109122 PCT/FR2010/050511
17
Exemple 1 : 6-{4-[3-(6-amino-pyridin-3-ylméthyl)-ureido]-3-fluoro-phényl}-2-
éthylamino-
N-(2-pipéridin-1-yl-éthyl)-nicotinamide (composé n 1 préparé selon le Schéma
2)
OH OH HN'D OÇ HN, __N
GN 'G CI N NHEt G N NHEt HzN F N 'NHEt
0 0-'eB
HzN
HN, N
F
bocN HN-iN O
tioc ~O O N NHEt
O N NH Et NH
uH F
i N/ N HiN N//
H H F
BOCN N
1.1. acide 6-chloro-2-éthylamino-nicotinique
Dans un ballon, mélanger 26,1 g (0,136 M) d'acide 2,6-dichloro-nicotinique et
180 mL de
solution aqueuse d'éthylamine à 70%. Agiter à température ambiante (TA)
pendant 5 jours.
Evaporer sous pression réduite (PR). Reprendre le résidu par 100 mL d'eau.
Refroidir par un
bain de glace et acidifier à pH 3 avec une solution HCI 5N. Filtrer le
précipité, laver avec de
l'eau froide et sécher sous vide sur P205 à 60 C. On obtient 24,93 g (91,4%)
de solide blanc.
PF=157-159 C.
1.2. 6-chloro-2-éthylamino-N-(2-pipéridin-1-yl-éthyl)-nicotinamide
Dans un ballon, dissoudre 5,0 g (24,92 mM) d'acide 6-chloro-2-éthylamino-
nicotinique dans
300 mL de THF. Ajouter 10,41 mL (74,77 mM) de triéthylamine, puis 7,08 mL
(49,84 mM) de
1-(2-aminoéthyl)pipéridine et ensuite 11,02 g (24,92 mM) de BOP. Agiter à TA
durant 15 h.
Evaporer le solvant et reprendre le résidu par de l'acétate d'éthyle. Laver la
phase organique
avec de l'eau puis une solution saturée en NaCI. Sécher sur Na2SO4, filtrer et
évaporer. Le
résidu est purifié par flah chromatographie (gradient DCM-MeOH 1 à 10%). On
obtient 7,5 g
(rdt : 96,8%) LCMS : M+ 310, tr (temps de rétention)=1,01 min.
1.3. 6-(4-amino-3-fluoro-phényl)-2-éthylamino-N-(2-pipéridin-1-yl-ethyl)-
nicotinamide
Dans un tricol d'l litre, introduire 5 g (16,1 mmol) de 6-chloro-2-éthylamino-
N-(2-pipéridin-1-
yl-ethyl)-nicotinamide. Ajouter le 4-amino-3-fluorophénylboronic acid pinacol
ester (1,1 éq, 4,2
g), 300 ml de 1,2-diméthoxyéthane, 60 ml d'éthanol et 120 ml d'une solution de
NaHCO3
saturée. Faire buller de l'argon 15 min, puis ajouter le palladium tétrakis
Pd(PPh)4 (0,1 éq,
1,86 g). Chauffer à reflux (-100 C) pendant 16 h. Concentrer, reprendre dans
du DCM, laver
avec H2O 2 fois, H20/NaCI, sécher sur sulfate de sodium et concentrer.
Chromatographie
flash sur colonne de silice 400 g, gradient DCM/méthanol 99/1 jusqu'à 90/10.
On obtient 4,8
WO 2010/109122 PCT/FR2010/050511
18
g (rdt=78%) de 6-(4-amino-3-fluoro-phényl)-2-éthylamino-N-(2-pipéridin-1 -yl-
éthyl)-
nicotinamide. LCMS(TFA3) : MH+ 386, tr=0,90 min.
1.4. 6-{4-f3-(6-ami no-pyridin-3-ylméthyl)-uréidol-3-fluoro-phényl}-2-
éthylamino-N-(2-
pipéridin-1-yI-éthyl)-nicotinamide
o
\ NN
H
O N NH
NI~, N
H H F
H2N N
Dans 1 ballon de 1 litre, dissoudre 3,5 g (9,1 mmol) de 6-(4-amino-3-fluoro-
phényl)-2-
éthylamino-N-(2-pipéridin-1-yl-éthyl)-nicotinamide dans 300 ml de THF anhydre.
Ajouter la
DMAP (1,2 éq, 1,33 g) ainsi que le N,N'-disuccinimidyl carbonate ([74124-79-
1], 1,2 éq,
2,8 g). Agiter à TA pendant 5 h. Ajouter alors la triéthylamine (3 éq, 3,8 ml)
et la 2-(di-boc-
amino)-5-(aminométhyl)pyridine (1,2 éq, 3,53 g) et agiter à TA une nuit.
Concentrer.
Reprendre avec du DCM, laver avec H2O 2 fois, H2O/NaCI, sécher et concentrer.
Chromatographie Flash sur silice, gradient DCM/MeOH 95/5 jusqu'à 79/20 + 1%
NH4OH
20%. Après concentration, reprendre la fraction ainsi obtenue dans 200 ml de
DCM, puis
ajouter à froid 35 mL (50 éq) de TFA. Agitation à TA jusqu'à disparition du
produit di-boc-
amino . Concentrer, puis reprendre le résidu avec une solution de Na2CO3 10%.
Extraire la
phase organique avec DCM, concentrer. Cristallisation à chaud dans l'acétate
d'éthyle. Filtrer,
rincer avec AcOEt, sécher à l'étuve. On obtient 3 g (rdt=63%) de 6-{4-[3-(6-
amino-pyridin-3-
ylméthyl)-uréido]-3-fluoro-phényl}-2-éthylamino-N-(2-pipéridin-1-yl-éthyl)-
nicotinamide.
LCMS(TFA3) : MH+ 535, tr=0,79 min ; 1H RMN (250 MHz, DMSO-d6) 8 ppm 1,22 (t, 3
H),
1,29 - 1,68 (m, 6 H), 2,26 - 2,47 (m, 6 H), 3,28 -3,42 (m, 2 H), 3,43 - 3,62
(m, 2 H), 4,13 (d, 2
H), 5,83 (s, 2 H), 6,44 (d, 1 H), 6,97 (t, 1 H), 7,16 (d, 1 H), 7,35 (dd, 1
H), 7,79 - 8,07 (m, 4 H),
8,28 (t, 1 H), 8,33 - 8,46 (m, 2 H), 8,49 (s, 1 H). PF (point de fusion) = 175-
177 C.
Exemple 2 : 6-{4-f3-(6-Amino-pyridin-3-ylmethyl)-ureidol-3-fluoro-phenyl}-2-
ethylamino-
N-(2-hydroxy-ethyl)-nicotinamide (composé n 8 préparé selon le Schéma 1)
2.1. 6-chloro-2-(éthylamino)-N-(2-hydroxyéthyl)nicoti namide
HN'- OH
O
CI N NI H
Dissoudre 0,5 g (2,49 mM) d'acide 6-chloro-2-(éthylamino)nicotinique dans 30
mL de THF.
Ajouter 1,04 mL (0,76 mM) de triéthylamine, 0,304 g (4,98 mM) de 2-
hydroxyéthylamine et
WO 2010/109122 PCT/FR2010/050511
19
1,10 g (2,49 mM) de BOP. Agiter 70 h à TA. Evaporer le solvant et reprendre le
résidu par de
l'acétate d'éthyle ; laver avec de l'eau puis une solution saturée en NaCI.
Sécher sur Na2SO4,
filtrer et évaporer. Purifier par chromatoflash (DCM/MeOH 1-5%). On obtient
600 mg
(rdt=99%) LCMS(TFA3) : MH+ 244, tr=1,03 min.
2.2. di-tert-butyl {5-f({f2-fluoro-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-
yl)phenyllcarbamoyl}amino)méthyllpyrid1n-2-yI}imidodicarbonate
0
F B O
O
NH J- NH
O N N
O/ O
X
Dissoudre 5,0 g (21,09 mM) de 2-fluoro-4-(4,4,5,5-tétraméthyl-1,3,2-
dioxaborolan-2-yl)aniline
et 3,09 g (25,31 mM) de DMAP (4-diméthylaminopyridine) dans 500 mL de THF.
Ajouter 6,48
g (23,31 mM) de DSC et agiter à TA 18 h. Ajouter 8,81 mL (63,27 mM) de
triéthylamine et
8,18 g (23,31 mM) de di-tert-butyl [5-(aminomethyl)pyridin-2-
yl]imidodicarbonate. Agiter à TA
5 h. Evaporer le solvant et reprendre le résidu par DCM. Laver la phase
organique avec de
l'eau puis une solution saturée en NaCI. Sécher sur sulfate de sodium, filtrer
et évaporer.
Purifier par chromatoflash. On obtient 12 g de produit constitué par un
mélange 50/50 d'ester
pinacolique et d'acide boronique. LCMS(LS) MH+ 587 tr=6,17 min et MH+ 505,
tr=4,97 min.
2.3. di-tert-butyl f5-({1(4-{6-(ethylamino)-5-f(2-
hydroxyethyl)carbamoyllpyridin-2-vl}-2-
fluorophenyl)carbamoyllamino}methyl)pyrid1n-2-yllimidodicarbonate
/OH
HN
O
rE-
O F N NH
N N
H H
N(BOC)z N
Dans un tricol, placer 0,3 g (1,23 mM) de composé obtenu à l'étape 2.1, 0,794
g (1,35 mM)
de composé obtenu étape 2.2, 15 mL de solution saturée de NaHCO3, 38 ml de DME
et 7 mL
d'éthanol. Dégazer avec de l'argon puis ajouter 0,142 g (0,12 mM) de
Pd(PPh3)4. Chauffer à
reflux 6 h. Evaporer les solvants et reprendre le résidu par DCM. Laver avec
de l'eau puis
une solution saturée NaCI. Sécher sur Na2SO4, filtrer et évaporer. Purifier
par chromatoflash
(DCM/MeOH 0-15%). On obtient 600 mg (rdt=73%) LCMS(TFA3) : MH+ 668, tr=1,44
min.
WO 2010/109122 PCT/FR2010/050511
2.4. 6-{4-I3-(6-Amino-pyridin-3-yl methyl)-ureidol-3-fluoro-phenyl}-2-
ethylamino-N-(2-
hydroxy-ethyl)-nicotinamide
HN--~-OH
'O
O F -'N NH
NH NH
H,NIN
5 Dissoudre 0,6 g (0,9 mM) du composé obtenu à l'étape 2.3 dans 20 mL de DCM.
Refroidir
par un bain de glace et ajouter 2,08 mL (27 mM) de TFA. Agiter 18 h à TA.
Evaporer les
solvants et reprendre le résidu par une solution Na2CO3. Filtrer, rincer avec
de l'eau et sécher
à l'étuve sur P205. On obtient 200 mg (rdt= 47,6%) LCMS(TFA3) : MH+ 468,
tr=0,72 min ; 1H
RMN (250 MHz, DMSO-d6) 8 ppm 1,22 (t, 3 H), 3,31 (s, 2 H), 3,43 - 3,62 (m, 4
H), 4,13 (d, 2
10 H), 4,71 (t, 1 H), 5,83 (s, 2 H), 6,44 (d, 1 H), 6,97 (t, 1 H), 7,16 (d, 1
H), 7,35 (dd, 1 H), 7,78 -
7,98 (m, 3 H), 8,01 (d, 1 H), 8,28 (t, 1 H), 8,34 - 8,47 (m, 2 H), 8,49 (d, 1
H).
Exemple 3 : 6-{4-f3-(6-Amino-pyridin-3-ylmethyl)-ureidol-3-fluoro-phenyl}-N-(2-
azepan-
1-yl-ethyl)-2-ethylamino-nicotinamide (composé n 15 préparé selon le Schéma 3)
15 3.1. 6-(4-{I({6-Ibis(tert-butoxycarbonyl)aminolpyridin-3-
yl}methyl)carbamoyllamino}-3-
fluorophenyl)-2-(ethylamino)nicotinic acid
OH
4 I ~ O
O F N NH
X NH%IIINH
O N N
Olk,O
X
Dans un tricol, placer 1,2 g (5,98 mM) d'acide 6-chloro-2-
(éthylamino)nicotinique, 3,86 g (6,58
mM) de di-tert-butyl {5-[({[2-fluoro-4-(4,4,5,5-tetraméthyl-1,3,2-dioxaborolan-
2-
20 yl)phényl]carbamoyl}amino)méthyl]pyridin-2-yl}imidodicarbonate, 80 mL de
DME, 15 mL
d'éthanol et 40 mL de solution saturée NaHCO3. Dégazer avec de l'argon puis
chauffer à
reflux 18 h. Evaporer les solvants et reprendre le résidu par de l'eau.
Filtrer, rincer avec de
l'eau et sécher à l'étuve sur P205. Purifier par chromatoflash DCM/MeOH 1-20%.
On obtient
1,8 g de mélange de composé mono et di-Boc. LCMS(LS) MH+ 525 tr=4,60 min et
MH+ 625
tr=5,59 min.
WO 2010/109122 PCT/FR2010/050511
21
3.2. 6-{4- f3-(6-Amino-pyridin-3-yl methyl)-ureidol-3-fluoro-phenyl}-N-(2-
azepan-1-yl-
ethyl)-2-ethylamino-nicotinamide
HN ,NN
-O
O F ~0 N NH
H2N IN
Dissoudre 0,2 g (0,32 mM) de composé obtenu à l'étape 3.1 dans 30 mL de THF.
Ajouter
0,115 g (0,64 mM) de chlorhydrate de 2-azépan-1-yléthanamine, 0,18 mL (0,13
mM) de
triéthylamine et 0,142 g (0,32 mM) de BOP. Agiter 18 h à TA. Evaporer,
reprendre le résidu
par DCM, laver avec de l'eau puis une solution saturée NaCI. Sécher sur
Na2SO4, filtrer et
évaporer. Purifier par chromatoflash DCM/MeOH 0-10%. On obtient 0,250 g de
mélange de
mono et diBoc. Dissoudre ce produit dans 15 mL DCM, refroidir par un bain de
glace et
ajouter 0,5 mL de TFA. Agiter 18 h à TA. Evaporer et reprendre le résidu par
une solution
Na2CO3. Filtrer le précipité, laver à l'eau et sécher à l'étuve sur P205. On
obtient 0,13 g
(rdt=74%) LCMS (TFA3) MH+ 549, tr=0,85 min; tH RMN (400 MHz, DMSO-d6) 8 ppm
1,22
(t, 3 H), 1,56 (m, 8 H), 2,67 (m, 6 H), 3,32 (m, 2 H), 3,45 - 3,63 (m, 2 H),
4,13 (d, 2 H), 5,84
(s, 2 H), 6,43 (d, 1 H), 6,97 (t, 1 H), 7,15 (d, 1 H), 7,34 (d, 1 H), 7,83 -
8,00 (m, 4 H), 8,27 (t, 1
H), 8,35 (t, 1 H), 8,41 (t, 1 H), 8,49 (s, 1 H).
Exemple 4 6-{4-f(E)-3-(6-amino-pyridin-3-yl)-acryloylaminol-3-fluoro-phenyl}-2-
ethylamino-N-(2-piperidin-1-yI-ethyl)-nicotinamide (composé n 43 préparé
selon le
Schéma 8)
N
N H N'
N
HN^~
\ O + ci O
I i
N NH O
N I N
HZN
F
Br HN'-"/N
HZN N I \ O
O I \ N NH
Pd(OAc)Z
N
P(o-tolyl)3
H
F
HZN N
WO 2010/109122 PCT/FR2010/050511
22
4.1. 6-(4-Acryloylamino-3-fluoro-phenyl)-2-ethylamino-N-(2-piperidin-1-yI-
ethyl)-
nicotinamide
Dissoudre 0,385g (lmM) de composé obtenu à l'étape 1.3 dans 20mL de DCM ;
ajouter
0,28mL (2mM) de triethylamine et 0,111g (1,1 mM) de DMAP puis 0,2mL (2,2mM) de
chlorure
d'acryloyle. Agiter à température ambiante 18H. Evaporer les solvants et
reprendre le résidu
par du DCM. Laver avec une solution Na2CO3 puis une solution saturée en NaCI.
Sécher sur
sulfate de sodium, filrer puis évaporer le filtrat. Le résidu est purifié par
chromatoflash (DCM -
DCM/CH3OH/NH4OH 20% 95/5/0.2). On obtient 0,195g (44,4%).
LCMS (TFA3) MH+ 440, tr = 2,44 min.
4.2 6-{4-f(E)-3-(6-Amino-pyridin-3-yl)-acryloylaminol-3-fluoro-phenyl}-2-
ethylamino-N-(2-piperidin-1-yI-ethyl)-nicotinamide
Dissoudre 0.187g (0.43mM) de composé obtenu à l'étape 4.1 dans 15mL de
propionitrile ;
ajouter 0,074g (0,43mM) de 2-amino-5-bromo pyridine et 0,11mL (0,64mM) de
DIPEA.
Dégazer avec de l'argon pendant 30 minutes puis ajouter 0,01g (0,04mM) de
Pd(OAc)2 et
0,022g (0,07mM) de tri-orthotolyl phosphine. Porter à reflux 3H. Apres retour
à température
ambiante diluer avec du DCM et filtrer sur Whatman. Evaporer le filtrat et
purifier le résidu par
chromatoflash DCM - DCM/CH3OH/NH4OH 20% 85/15/0.2. On obtient 0,120g (53%).
Exemple 5 : 2-Ethylamino-6-[3-fluoro-4-((E)-3-pyridin-3-yl-acryloylamino)-
phenyl]-N-(2-
piperidin-1-yl-ethyl)-nicotinamide (composé n 44)
HN N
HN--_iN O
O O
O -N 'NH
N NH + j ci
N
N H F
H2 N N
F
Dissoudre 0,25g (0,65mM) de composé obtenu à l'étape 1.3 dans 20mL de DCM et
ajouter
0,27mL (1,95mM) de triéthylamine. Refroidir le milieu réactionnel par un bain
de glace et
ajouter goutte à goutte 0,163g (0,97mM) de (E)-3-Pyridin-3-yl-acryloyl
chloride. Agiter à
température ambiante 18H. Laver la solution organique avec une solution NaOH
10%, sécher
sur Na2SO4, filtrer et évaporer le filtrat. Purifier le résidu par
chromatoflash Si02 C18
CH3OH/H20 50/50 - 90/10. On obtient 0,035g (10,4%).
WO 2010/109122 PCT/FR2010/050511
23
Exemple 6: 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-
ethylamino-
N-[2-(1-oxy-piperidin-1-yl)-ethyl]-nicotinamide (composé n 45)
HNHN
o MCPBA o
IOI N 'NH O N NIH
HH F H~H F
40NN 4 HN
N
HN- I
O
TFA o
O N NH
H
-LIN
HzN N
6.1 5-f3-(4-{6-Ethylamino-5-f2-(1-oxy-piperidin-1-yl)-ethylcarbamoyll-pyridin-
2-
yl}-2-fluoro-phenyl)-ureidomethyll-pyridin-2-yl}-carbamic acid tert-butyl
ester
Mettre 0,35g (0,55mM) de [5-(3-{4-[6-ethylamino-5-(2-piperidin-1-yl-
ethylcarbamoyl)-pyridin-
2-yl]-2-fluoro-phenyl}-ureidomethyl)-pyridin-2-yl]-carbamic acid tert-butyl
ester en suspension
dans 35mL DCM et 10mL de CHC13. Refroidir par un bain de glace et ajouter
0,105g
(0,61 mM) d'acide meta chloro perbenzoïque. Agiter 0,5H à froid puis 2H à
température
ambiante. Laver la phase organique avec une solution NaHCO3 puis H2O puis une
solution
saturée NaCI. Sècher sur Na2SO4, filtrer et évaporer. Le résidu est purifié
par chromatoflash
sur A1203 neutre DCM/CH3OH - 98/2 à 92/8.
On obtient 0,340g (94,7%).
LCMS (TFA3) MH+ 651, tr = 2,07 min.
6.2 6-{4-f3-(6-Amino-pyridin-3-ylmethyl)-ureidol-3-fluoro-phenyl}-2-
ethylamino-N-f2-(1-oxy-piperidin-1-yl)-ethyll-nicotinamide
Dissoudre 0,328g (0,5mM) de composé obtenu à l'étape 6.1 dans 20mL de CH2CI2.
Refroidir par un bain de glace et ajouter 0,85mL (11,1 mM) de TFA. Agiter à
température
ambiante 44H. Evaporer et reprendre le résidu par une solution Na2CO3 10% et
extraire
DCM. Sècher sur Na2SO4, filtrer et évaporer. Le résidu est purifié par
chromatoflash sur
WO 2010/109122 PCT/FR2010/050511
24
A1203 neutre DCM/CH3OH - 95/5 à 88/12. On obtient 0,213g (76,9%).
'H RMN des composés du tableau 1
Les déplacements 8 chimiques sont donnés en ppm.
composé n 2 : (400 MHz) 1,22 (t, 3 H), 1,35 - 1,81 (m, 6 H), 2,54 - 3,16 (m, 6
H), 3,45 -3,57 (m,
4 H), 4,13 (d, 2 H), 5,88 (s, 2 H), 6,44 (d, 1 H), 7,02 - 7,14 (m, 2 H), 7,35
(dd, 1 H), 7,85 - 7,92
(m, 2 H), 7,98 (d, 1 H), 8,16 (dd, 1 H), 8,35 (t, 1 H), 8,61 (br. s., 1 H),
8,75 (s, 1 H).
composé n 3 : (250 MHz) 1,22 (t, 3 H), 1,32 - 1,60 (m, 6 H), 2,40 - 2,65 (m, 6
H), 3,29 -3,46 (m,
2 H), 3,58 (m, 2 H), 4,13 (d, 2 H), 5,84 (s, 2 H), 6,44 (d, 1 H), 7,03 (t, 1
H), 7,35 (dd, 1 H), 7,88(d,
1 H), 8,00 - 8,19 (m, 2 H), 8,25 - 8,39 (m, 1 H), 8,50 - 8,63 (m, 2 H), 8,68
(s, 1 H), 8,75 (t, 1 H).
composé n 4 : (250 MHz) 1,22 (t, 3 H), 1,32 - 1,60 (m, 6 H), 2,40 - 2,65 (m, 6
H), 3,29 -3,46 (m,
2 H), 3,58 (m, 2 H), 4,13 (d, 2 H), 5,84 (s, 2 H), 6,44 (d, 1 H), 7,03 (t, 1
H), 7,35 (dd, 1 H), 7,88(d,
1 H), 8,00 - 8,19 (m, 2 H), 8,25 - 8,39 (m, 1 H), 8,50 - 8,63 (m, 2 H), 8,68
(s, 1 H), 8,75 (t, 1 H).
composé n 5 : (250 MHz) 1,28 - 1,65 (m, 6 H), 2,32 - 2,47 (m, 6 H), 3,35 -
3,52 (m, 2 H), 4,13
(d, 2 H), 5,84 (s, 2 H), 6,44 (d, 1 H), 7,02 (t, 2 H), 7,26 - 7,52 (m, 4 H),
7,75 (d, 2 H), 7,82 -
8,04(m, 3 H), 8,16 (d, 1 H), 8,34 (t, 1 H), 8,53 (s, 1 H), 8,69 (t, 1 H),
11,06 (s, 1 H).
composé n 6 : (250 MHz) 0,97 (d, 6 H), 1,21 (t, 3 H), 1,57 (br. s., 1 H), 2,58-
2,87 (m, 3H), 3,23
- 3,34 (m, 2 H), 3,43 - 3,61 (m, 2 H), 4,13 (d, 2 H), 5,84 (s, 2 H), 6,44 (d,
1 H), 6,99 (t, 1 H), 7,16
(d, 1 H), 7,35 (dd, 1 H), 7,80 - 8,10 (m, 4 H), 8,28 (t, 1 H), 8,34 - 8,48 (m,
2 H), 8,51 (d, 1 H).
composé n 7 : (250 MHz) 1,22 (t, 3 H), 2,66 (t, 2 H), 2,89 - 3,17 (m, 8 H),
3,31 - 3,42 (m, 2H),
3,45 - 3,61 (m, 2 H), 4,13 (d, 2 H), 5,84 (s, 2 H), 6,44 (d, 1 H), 6,98 (t, 1
H), 7,17 (d, 1 H), 7,35
(dd,1 H), 7,83 - 8,03 (m, 4 H), 8,28 (t, 1 H), 8,34 - 8,46 (m, 2 H), 8,50 (d,
1 H).
composé n 9 : (250 MHz) 0,49 - 0,60 (m, 2 H), 0,77 - 0,94 (m, 2 H), 1,29 -
1,57 (m, 6 H), 2,28 -
2,48 (m, 6 H), 2,99 - 3,11 (m, 1 H), 3,31 - 3,42 (m, 2 H), 4,13 (d, 2 H), 5,83
(s, 2 H), 6,44 (d, 1
H), 7,03 (t, 1 H), 7,36 (dd, 1 H), 7,88 (d, 1 H), 8,05 - 8,23 (m, 2 H), 8,28 -
8,38 (m, 1 H), 8,50 -
8,64 (m, 2H), 8,69 (s, 1 H), 8,77 (d, 1 H).
composé n 10 : (250 MHz) 1,27 - 1,70 (m, 6 H), 2,49 - 2,87 (m, 6 H), 3,40 -
3,58 (m, 2 H), 4,14
(d, 2 H), 5,84 (s, 2 H), 6,44 (d, 1 H), 7,07 (t, 1 H), 7,15 (t, 1 H), 7,36
(dd, 1 H), 7,40 - 7,50 (m, 2
H), 7,77 (d, 2 H), 7,88 (d, 1 H), 8,03 (dd, 1 H), 8,13 (dd, 1 H), 8,38 (t, 1
H), 8,63 (d, 1 H), 8,81 -
9,04 (m, 2H), 11,15 (s, 1 H).
WO 2010/109122 PCT/FR2010/050511
composé n 11 : (250 MHz) 1,20 (t, 3 H), 1,29 - 1,66 (m, 6 H), 2,11 - 2,47 (m,
6 H), 3,25 -3,40
(m, 2 H), 3,42 - 3,62 (m, 2 H), 4,11 (d, 2 H), 5,76 (s, 2 H), 6,43 (d, 1 H),
6,61 (br. s., 1 H), 6,97
(d,1 H), 7,12 (d, 1 H), 7,35 (d, 1 H), 7,62 (d, 1 H), 7,77 - 8,05 (m, 3 H),
8,28 - 8,48 (m, 2 H), 8,91
(s, 1 H).
5
composé n 12 : (250 MHz) 1,22 (t, 3 H), 1,57 - 1,86 (m, 4 H), 2,43 - 2,52 (m,
4 H), 2,57 (t, 2H),
3,29 - 3,43 (m, 2 H), 3,43 - 3,60 (m, 2 H), 4,13 (d, 2 H), 5,83 (s, 2 H), 6,44
(d, 1 H), 6,99 (t, 1 H),
7,15 (d, 1 H), 7,35 (dd, 1 H), 7,80 - 8,04 (m, 4 H), 8,28 (t, 1 H), 8,35 -
8,48 (m, 2 H), 8,51 (br. s.,
1 H).
composé n 13 : (250 MHz) 1,22 (t, 3 H), 2,75 (d, 3 H), 3,43 - 3,66 (m, 2 H),
4,13 (d, 2 H), 5,83
(s, 2 H), 6,44 (d, 1 H), 6,98 (t, 1 H), 7,15 (d, 1 H), 7,35 (dd, 1 H), 7,82 -
8,04 (m, 4 H), 8,28 (t, 1
H), 8,35 - 8,62 (m, 3 H).
composé n 14 : (250 MHz) 1,22 (t, 3 H), 3,27 (s, 3 H), 3,35 - 3,62 (m, 6 H),
4,13 (d, 2 H), 5,83
(s, 2 H), 6,44 (d, 1 H), 6,97 (t, 1 H), 7,15 (d, 1 H), 7,37 (dd, 1 H), 7,82 -
8,07 (m, 4 H), 8,28 (t, 1
H), 8,50 (br. s., 3 H).
composé n 16 : (400 MHz) 1,22 (t, 3 H), 2,56 (t, 2 H), 2,66 - 2,75 (m, 4 H),
2,82 - 3,04 (m, 4H),
3,34 - 3,41 (m, 2 H), 3,45 - 3,60 (m, 2 H), 4,13 (d, 2 H), 5,87 (s, 2 H), 6,44
(d, 1 H), 6,99 (t, 1 H),
7,15 (d, 1 H), 7,35 (dd, 1 H), 7,82 - 7,99 (m, 4 H), 8,27 (t, 1 H), 8,34 -
8,47 (m, 2 H), 8,50 (d, 1
H).
composé n 17: (250 MHz) 1,22 (t, 3 H), 1,29 - 1,62 (m, 6 H), 2,04 (s, 3 H),
2,29 - 2,47 (m, 6H),
3,30 - 3,41 (m, 2 H), 3,44 - 3,60 (m, 2 H), 4,13 (d, 2 H), 5,62 (s, 2 H), 6,96
(t, 1 H), 7,16 (d, 1 H),
7,22 (s, 1 H), 7,76 (s, 1 H), 7,82 - 8,06 (m, 3 H), 8,28 (t, 1 H), 8,33 - 8,46
(m, 2 H), 8,48 (d, 1 H).
composé n 18 : (250 MHz) 0,32 - 0,57 (m, 1 H), 0,78 (d, 6 H), 1,18 (t, 3 H),
1,35 - 1,70 (m,5 H),
2,39 (t, 2 H), 2,79 (d, 2 H), 3,22 - 3,38 (m, 2 H), 3,41 - 3,56 (m, 2 H), 4,09
(d, 2 H), 5,78 (s, 2 H),
6,39 (d, 1 H), 6,92 (t, 1 H), 7,11 (d, 1 H), 7,30 (dd, 1 H), 7,74 - 7,98 (m, 4
H), 8,23 (t, 1 H), 8,28 -
8,42 (m, 2 H), 8,44 (d, 1 H).
composé n 19 : (250 MHz) 1,11 (d, 6 H), 1,02 - 1,32 (m, 3 H), 1,21 (t, 3 H),
1,39 - 1,73 (m,3 H),
2,37 - 2,51 (m, 2 H), 2,59 - 2,78 (m, 2 H), 3,11 - 3,29 (m, 2 H), 3,42 - 3,59
(m, 2 H), 4,13 (d, 2
H), 5,83 (s, 2 H), 6,44 (d, 1 H), 6,97 (t, 1 H), 7,16 (d, 1 H), 7,35 (dd, 1
H), 7,83 - 8,01 (m, 4 H),
8,28 (t, 1 H), 8,35 - 8,59 (m, 3 H).
composé n 20 : (250 MHz) 0,94 - 1,13 (m, 4 H), 1,22 (t, 3 H), 1,30 - 1,68 (m,
6 H), 2,41 -2,65
WO 2010/109122 PCT/FR2010/050511
26
(m, 6 H), 3,31 - 3,68 (m, 4 H), 5,70 (s, 2 H), 6,43 (d, 1 H), 6,67 (br. s., 1
H), 7,16 (d, 1 H), 7,29
(d,1 H), 7,73 - 8,07 (m, 4 H), 8,19 - 8,34 (m, 1 H), 8,42 (br. s., 2 H), 8,54
(s, 1 H).
composé n 21 : (250 MHz) 1,13 (t, 3 H), 1,27 - 1,69 (m, 6 H), 2,16 - 2,47 (m,
6 H), 3,32 -3,43
(m, 4 H), 4,11 (d, 2 H), 5,81 (s, 2 H), 6,43 (d, 1 H), 6,61 - 6,82 (m, 2 H),
7,23 (d, 2 H), 7,35 (d,
1H), 7,87 (s, 1 H), 7,92 (d, 1 H), 8,27 (br. s., 1 H), 8,41 (br. s., 1 H),
9,03 (s, 1 H).
composé n 22 : (250 MHz) 1,19 (t, 3 H), 1,30 - 1,64 (m, 6 H), 2,31 - 2,50 (m,
6 H), 3,32 -3,42
(m, 2 H), 3,41 - 3,58 (m, 2 H), 4,13 (d, 2 H), 5,84 (s, 2 H), 6,44 (d, 1 H),
6,89 - 7,06 (m, 2 H),
7,35(dd, 1 H), 7,70 - 7,83 (m, 1 H), 7,88 (d, 1 H), 7,96 (d, 1 H), 8,09 (t, 1
H), 8,35 (t, 1 H), 8,43 (t,
1 H), 8,67(d, 1 H).
composé n 23: (250 MHz) 1,22 (t, 3 H), 1,33 - 1,68 (m, 6 H), 2,52 - 2,92 (m, 6
H), 3,15 -3,27
(m, 2 H), 3,34 - 3,50 (m, 2 H), 4,12 (d, 2 H), 5,83 (s, 2 H), 6,44 (d, 1 H),
6,80 - 6,90 (m, 2 H),
6,94(t, 1 H), 7,35 (dd, 1 H), 7,48 (d, 1 H), 7,52 - 7,66 (m, 2 H), 7,78 - 7,93
(m, 2 H), 8,13 - 8,37
(m, 2 H), 8,43 (d, 1 H).
composé n 24: (250 MHz) 0,39 - 0,51 (m, 2 H), 0,51 - 0,59 (m, 2 H), 0,59 -
0,75 (m, 2 H), 0,75
- 0,90 (m, 2 H), 2,68 - 2,86 (m, 1 H), 2,86 - 3,09 (m, 1 H), 4,13 (d, 2 H),
5,83 (s, 2 H), 6,44 (d, 1
H), 6,98 (t, 1 H), 7,21 (d, 1 H), 7,35 (dd, 1 H), 7,83 - 8,13 (m, 4 H), 8,29
(t, 1 H), 8,38 - 8,65 (m, 3
H).
composé n 25: (250 MHz) 0,35 - 0,55 (m, 2 H), 0,69 - 0,84 (m, 2 H), 1,41 -
2,01 (m, 8 H), 2,85
- 3,05 (m, 1 H), 4,13 (d, 2 H), 4,13 - 4,26 (m, 1 H), 5,83 (s, 2 H), 6,44 (d,
1 H), 6,98 (t, 1 H), 7,22
(d, 1 H), 7,35 (dd, 1 H), 7,84 - 8,08 (m, 4 H), 8,22 - 8,37 (m, 2 H), 8,44 -
8,57 (m, 2 H)
composé n 26: (250 MHz) 0,37 - 0,55 (m, 2 H), 0,71 - 0,83 (m, 2 H), 0,89 (t, 3
H), 1,18 -1,41
(m, 2 H), 1,41 - 1,63 (m, 2 H), 2,84 - 3,05 (m, 1 H), 3,21 (q, 2 H), 4,13 (d,
2 H), 5,86 (s, 2 H),
6,45 (d, 1 H), 6,98 (t, 1 H), 7,23 (d, 1 H), 7,36 (dd, 1 H), 7,83 - 8,09 (m, 4
H), 8,29 (t, 1 H), 8,39 -
8,68 (m, 3H)
composé n 27: (250 MHz) 1,22 (t, 3 H), 1,29 - 1,58 (m, 6 H), 2,28 - 2,47 (m, 6
H), 3,30 -3,41
(m, 2 H), 3,43 - 3,62 (m, 2 H), 4,37 (d, 2 H), 7,16 (d, 1 H), 7,23 (t, 1 H),
7,39 (dd, 1 H), 7,69 -
7,79 (m, 1 H), 7,82 - 8,03 (m, 3 H), 8,26 (t, 1 H), 8,31 - 8,46 (m, 2 H), 8,49
(dd, 1 H), 8,56 (d, 1
H), 8,64 (d, 1 H).
composé n 28 : (250 MHz) 1,22 (t, 3), 1,23 - 1,6 (m, 6), 2,30 - 2,50 (m, 6),
2,75 (d, 3), 3,34 (m,
2), 3,52 (qui, 2), 4,13 (d, 2), 6,39 (q, 1), 6,43 (d, 1), 6,98 (t, 1), 7,16
(d, 1), 7,37 (dd,1), 7,80 - 8,02
WO 2010/109122 PCT/FR2010/050511
27
(m, 4), 8,28 (t, 1), 8,37 (t, 1), 8,41 (t, 1), 8,49 (d, 1).
composé n 29 : (250 MHz) 1,22 (t, 3 H), 1,29 - 1,60 (m, 6 H), 2,31 - 2,47 (m,
6 H), 3,00 (s, 6H),
3,26 - 3,42 (m, 2 H), 3,45 - 3,60 (m, 2 H), 4,18 (d, 2 H), 6,64 (d, 1 H), 7,01
(s, 1 H), 7,16 (d, 1 H),
7,49 (dd, 1 H), 7,81 - 8,01 (m, 3 H), 8,06 (d, 1 H), 8,28 (t, 1 H), 8,33 -
8,46 (m, 2 H), 8,51 (d, 1 H)
composé n 30 : (250 MHz) 1,22 (t, 3 H), 1,30 - 1,63 (m, 6 H), 2,29 - 2,47 (m,
6 H), 3,29 -3,40
(m, 2 H), 3,44 - 3,63 (m, 2 H), 4,22 (d, 2 H), 5,32 (s, 2 H), 6,86 (s, 1 H),
7,03 - 7,22 (m, 2 H),
7,71(s, 1 H), 7,79 - 8,02 (m, 4 H), 8,28 (t, 1 H), 8,33 - 8,51 (m, 2 H), 8,58
(s, 1 H)
composé n 31 : (500 MHz) 1,23 (t, 3 H), 1,34 - 1,43 (m, 2 H), 1,45 - 1,57 (m,
4 H), 2,31 -2,49
(m, 6 H), 3,31 - 3,39 (m, 2 H), 3,46 - 3,59 (m, 2 H), 4,43 (d, 2 H), 7,17 (d,
1 H), 7,27 (t, 1 H), 7,62
-7,76 (m, 1 H), 7,88 (dd, 1 H), 7,91 - 8,02 (m, 2 H), 8,24 (t, 1 H), 8,38 (t,
1 H), 8,42 (t, 1 H), 8,46
(s, 1 H), 8,49 (d, 1 H), 8,69 (d, 1 H)
composé n 32 : (400 MHz) 1,22 (t, 3 H), 1,33 - 1,61 (m, 6 H), 2,31 (s, 3 H),
2,51 (s, 6 H), 3,34 -
3,43 (m, 2 H), 3,46 - 3,60 (m, 2 H), 4,34 (d, 2 H), 7,16 (d, 1 H), 7,21 (t, 1
H), 7,54 (s, 1 H), 7,87(d,
1 H), 7,90 - 8,05 (m, 2 H), 8,21 - 8,29 (m, 1 H), 8,29 - 8,37 (m, 2 H), 8,37 -
8,49 (m, 2 H), 8,62
(d, 1 H)
composé n 33 (250 MHz) 1,22 (t, 3 H), 1,31 - 1,59 (m, 6 H), 2,22 - 2,47 (m, 6
H), 3,29 -3,41 (m,
2 H), 3,53 (m, 2 H), 5,67 (s, 2 H), 6,45 (d, 1 H), 7,17 (d, 1 H), 7,51 (dd, 1
H), 7,80 - 8,05 (m, 4H),
8,27 (t, 1 H), 8,41 (d, 2 H), 8,70 (br. s., 2 H).
composé n 34 : (400 MHz) 1,22 (t, 3 H), 1,40 (d, 2 H), 1,53 (quin, 4 H), 2,41 -
2,60 (m, 6H), 2,45
(s, 3 H), 3,34 - 3,42 (m, 2 H), 3,47 - 3,57 (m, 2 H), 4,32 (d, 2 H), 7,11 -
7,21 (m, 2 H), 7,23 (d,
1 H), 7,61 (dd, 1 H), 7,87 (d, 1 H), 7,90 - 8,03 (m, 2 H), 8,25 (t, 1 H), 8,41
(s, 3 H), 8,60 (d, 1 H)
composé n 35 : (400 MHz) 1,22 (t, 3 H), 1,32 - 1,45 (m, 2 H), 1,64 - 1,78 (m,
2 H), 2,06 (t, 2H),
2,43 (t, 2 H), 2,64 - 2,77 (m, 2 H), 3,32 (s, 2 H), 3,37 - 3,48 (m, 1 H), 3,48
- 3,57 (m, 2 H), 4,13
(d, 2H), 4,52 (d, 1 H), 5,83 (s, 2 H), 6,43 (d, 1 H), 6,97 (t, 1 H), 7,15 (d,
1 H), 7,34 (dd, 1 H), 7,86
(d, 2 H), 7,89 - 7,99 (m, 2 H), 8,27 (t, 1 H), 8,33 - 8,45 (m, 2 H), 8,49 (d,
1 H)
composé n 36 : (250 MHz) 0,94 - 1,15 (m, 1 H), 1,22 (t, 3 H), 1,30 - 1,52 (m,
1 H), 1,52 -1,69
(m, 1 H), 1,69 - 1,97 (m, 3 H), 2,44 (t, 2 H), 2,62 - 2,77 (m, 1 H), 2,85 (dd,
1 H), 3,28 - 3,39 (m,
2H), 3,39 - 3,62 (m, 3 H), 4,13 (d, 2 H), 4,56 (d, 1 H), 5,83 (s, 2 H), 6,44
(d, 1 H), 6,99 (t, 1 H),
7,16 (d, 1H), 7,35 (dd, 1 H), 7,82 - 8,03 (m, 4 H), 8,28 (t, 1 H), 8,33 - 8,46
(m, 2 H), 8,51 (d, 1 H)
WO 2010/109122 PCT/FR2010/050511
28
composé n 37 : (400 MHz) 0,99 (d,12), 1,22 (t, 3), 2,51 (m, 2), 2,99 (m, 2),
3,19 (q, 2), 3,53 (qui,
2), 4,13 (d, 2), 5,83 (s, 2), 6,43 (d,1), 6.97 (t, 1), 7,15 (d, 1), 7,34 (dd,
1), 7,80 - 8,00 (massif, 4) ;
8,27 (t, 1), 8,37 (t, 1), 8,42 - 8,54 (massif, 2)
composé n 38 : (400 MHz) 1,22 (t, 3), 1,40 (m, 2), 1,82 (m , 2), 2,12 (t, 2),
2,44 (t, 2), 2,72 (m,
2), 3,15 (sep, 1), 3,22 (s, 3), 3,32 (m, 2), 3,52 (qui, 2), 4,15 (d, 2), 5,84
(s , 2), 6,43 (d,1), 6,97 (t,
1), 7,15 (d, 1), 7,34 (dd, 1), 7,80 - 8,00 (m, 4), 8,27 (t, 1), 8,37 (t, 1),
8,40 (t, 1), 8,49 (d,1).
composé n 39 : (250 MHz) 1,22 (t, 3 H), 1,30 - 1,57 (m, 6 H), 1,66 (t, 2 H),
2,18 - 2,41 (m, 6H),
3,16 - 3,29 (m, 2 H), 3,40 - 3,60 (m, 2 H), 4,13 (d, 2 H), 5,83 (s, 2 H), 6,44
(d, 1 H), 6,97 (t, 1 H),
7,15 (d, 1 H), 7,35 (dd, 1 H), 7,81 - 8,03 (m, 4 H), 8,28 (t, 1 H), 8,36 -
8,58 (m, 3 H).
composé n 40 : (400 MHz) 1,22 (t, 3), 1,30 - 1,59 (m, 10), 2,23 (t, 2), 2,28
(sl, 4), 3,23 (q, 2) ;
3,52 (qui, 2), 4,13 (d, 2), 5,83 (s, 2), 6,43 (d, 1), 6,99 (t, 1), 7,14 (d,
1), 7,34 (dd, 1), 7,82 - 8,00
(m, 4), 8,26 (t, 1), 8,43 (m, 2), 8,51 (sl, 1).
composé n 41 : (400 MHz) 1,22 (t, 3 H), 2,14 (s, 3 H), 2,18 - 2,49 (m, 10 H),
3,31 - 3,39 (m, 2
H), 3,44 - 3,58 (m, 2 H), 4,13 (d, 2 H), 5,83 (s, 2 H), 6,43 (d, 1 H), 6,97
(t, 1 H), 7,15 (d, 1 H), 7,34
(dd, 1 H), 7,81 - 7,89 (m, 2 H), 7,89 - 7,98 (m, 2 H), 8,27 (t, 1 H), 8,32 -
8,45 (m, 2 H), 8,49 (d, 1
H)
composé n 42 : (250 MHz) 1,22 (t, 3 H), 2,02 (br. s., 1 H), 2,27 - 2,38 (m, 4
H), 2,41 (t, 2H), 2,62
- 2,74 (m, 4 H), 3,22 - 3,41 (m, 2 H), 3,44 - 3,59 (m, 2 H), 4,13 (d, 2 H),
5,83 (s, 2 H), 6,44
(d,1H), 7,00 (t, 1 H), 7,16 (d, 1 H), 7,35 (dd, 1 H), 7,82 - 8,02 (m, 4 H),
8,28 (t, 1 H), 8,33 - 8,46
(m, 2 H), 8,51 (d, 1 H)
composé n 43 : 1H NMR (500 MHz, DMSO-d6) 8 ppm 1.24 (t, 3 H), 1.35 - 1.44 (m,
2 H), 1.51
(quin, 4 H), 2.33 - 2.50(m, 6 H), 3.33 - 3.41 (m, 2 H), 3.50 - 3.59 (m, 2 H),
6.48 - 6.56 (m, 3 H),
6.86 (d, 1 H), 7.22 (d, 1 H),7.49 (d, 1 H), 7.66 (dd, 1 H), 7.90 - 8.06 (m, 3
H), 8.16 (d, 1 H), 8.31 (t,
1 H), 8.41 (q, 2 H), 9.88 (s, 1 H).
composé n 44 : 1H NMR (250 MHz, DMSO-d6) d ppm 1.23 (t, 3 H), 1.31 - 1.64 (m,
6 H), 2.23 -
2.47 (m, 6 H), 3.29 -3.41 (m, 2 H), 3.46 - 3.65 (m, 2 H), 7.21 (s, 1 H), 7.26
(d, 1 H), 7.51 (dd, 1 H),
7.69 (d, 1 H), 7.93 - 8.13(m, 4 H), 8.31 (t, 1 H), 8.37 - 8.47 (m, 2 H), 8.62
(d, 1 H), 8.85 (d, 1 H),
10.17 (s, 1 H).
composé n 45 : 1 H NMR (250 MHz, DMSO-d6) d ppm 1.22 (t, 7 H), 1.96 - 2.26 (m,
2 H), 3.16 (d,
WO 2010/109122 PCT/FR2010/050511
29
4 H), 3.40 (t, 2 H),3.52 (ddt, 2 H), 3.71 (d, 2 H), 4.13 (d, 2 H), 5.83 (s, 2
H), 6.44 (d, 1 H), 7.07 (t,
1 H), 7.13 (d, 1 H), 7.35(dd, 1 H), 7.73 (d, 1 H), 7.80 - 7.96 (m, 3 H), 8.28
(t, 1 H), 8.55 (br. s., 2
H), 11.05 (br. s., 1 H)
WO 2010/109122 PCT/FR2010/050511
X r4p
E
d QN N N N N
N
O U
Z
Z z z Z z z
0
0
u
LL LL
a LL
- 'a â â â â â â
LL LL LL LL LL LL
t7, t7, t7,
N a) W N m
v O O O O O O
N +
= Co ln Co m m Co 0)
CO O
LO LO LO LO LO
U
Z
N
O Z Z U N N
Z Z Z Z Z Z 2
N
z= w w w w
J
ZOO- LL LL Lf') LL LL LL LL
O M LL M M M M
Q N
Ir
x r N r r r
Z
Z z z z Z Z
2 2 2 2 2 2
J Z Z Z Z Z Z
2 2 2 2 2 2
U U U O O O
2 2 2 2 2 2
Z z z z z z
N
O
Q o
E Ç r N M Ln Co
O
0
WO 2010/109122 PCT/FR2010/050511
31
Cu N M
E N N
N .O M Co N Co Co Co .O Co N
V > >
N Co
z
z z z z z z z z z z z
u-
a
Q) M M M M M M M M M M
0 Q Q Q Q Q Q Q Q Q Q Q
LL LL LL LL LL LL u u u LL LL
00
00 ô 00 00 00
E m 00
ô ô ô ô ô ô ô ô ô ô
N +
W C O 00 00 cq 0)
= M
W Co N Co W (
V W) LO V V LO LO
O
O
2 =
U
0 en
w w w w w w w w w
.O LL LL LL LL LL LL LL LL LL LL LL LL
y0 M M M M N M M M M M M
Q
x r r r r r r r r
N Z Z
Z Z z z z z z z z z
2 2 2 2 2 2 2 2 2 2 2
Z Z Z Z Z Z Z Z Z Z Z
J 2 2 2 2 2 2 2 2 2 2 2
U U U U U U U U U U U
N N N N N N N N N N CO
M 2 2 2 2 2 2 2 2 2 2 N
z z z z z z z z z z Z
Cfl Cfl Cfl Cfl Cfl Cfl
C)
N
O
O o O r N M Lf) Co
f.
Ç I~ OO Qi r r r r r r r r
CO
0
WO 2010/109122 PCT/FR2010/050511
32
Cu
E
Co Co N N N N Co Co Co
t)
z
z z z z z z z z z
u-
a
0 â â â â â â â â â
U t b b b b b b b b b
J m co rn co o rn
E rn co cô co o
CD ô ô ô ô ô ô
N +
0) Co Co
= CO CO V LO LO Co N- O m
Z 7
Z Z Z Z Z
Ç LL LL
O LL ~ LL LL LL CO M LL LL LL LL
.O M M M LL LL M M M M
Q N N
x r r r N N r r r r
N U U U U U U U U U
z z z z z U z z z
x x Z x x x x x x
Z Z U 2 Z Z Z Z Z Z
J 2 2 2 2 2 2 2 2
U U U U U U U U U
2 2 2 2 2 2 2 2 2
z z z z z z z z z
N
O CD m Ln Co
E 0 Ç r r N N N N N N N
O
0
WO 2010/109122 PCT/FR2010/050511
33
Cu
E
d N N N N N N N N Co
L)
z
z z z z z z z z z
tL
a
- 'a â â â â â â â Co
C
o
r ~ ~ ~ ~ ~ ~ ~ ~ F
d W N- ~
O O O O O O O O
N +
_ V M Co
ln
NN CO Co N Co
uuuuuuu uz~~
O
.O lL LL LL LL LL LL LL LL LL LL
O ~ M M M M M M M M M
X r r r r r r r r r
Z z z z z z z z z
2 2 2 2 2 2 2 2
Z Z Z Z Z Z = Z Z
J 2 2 2 2 2 2 Z 2 2
U U U U U U U U
w N
LL Z Z
Z Z
N
Q. Ç f~ 00 m O r N M Lf)
E N N N M M M M M M
O
L)
WO 2010/109122 PCT/FR2010/050511
34
Cu
E
Co Co Co Co Co Co Co
()
z
z z z z z z z z z
u-
a
- 'a â â â â â â â â â
t7, t7, t7, t7, t7,
J d N I, O O O Il- tn t` O
E N- W I- I- I- CO CO - W
... O O O O O O O O
N +
= LO 0) Co In zi; (D (D OLO Co Co
In In In In In In In In In
Z Z
N Z
Z O 1: Z Z ~~ (\/Z (\/Z
w w w w w w w w w
.O LL LL LL LL LL LL LL LL LL LL
.O M M M M M M M M M
Q
x r r r r r r r r
Z z z z z z z z z
2 2 2 2 2 2 2 2 2
Z Z Z Z Z Z Z O O
J 2 2 2 2 2 2 2 2 2
O O O O O O O O O
N N N N N N N N
z z z z z z z z T
N
E 0 Ç M M M M CD m
O
Q
WO 2010/109122 PCT/FR2010/050511
Cu
E
C.)
z
o
0
u-
a
U t r
J d N
E CO
E
LO
z
Q
w- 2
Q
O
I
LL LL
.O
G)
O M
N
X
N
>,
z c
x
z
J =
U
O
O
M 2
z
C T
z
J
d
N
Q o Ln Q
E
O
Q
WO 2010/109122 PCT/FR2010/050511
36
Les composés du Tableau I ont pour nom chimique (obtenus à partir du logiciel
Autonom )
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
(2-piperidin-
1-yl-ethyl)-nicotinamide (composé n 1)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-2,5-difluoro-phenyl}-2-
ethylamino-N-(2-
piperidin-1-yl-ethyl)-nicotinamide (n 2)
^ 2-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-4-ethylamino-
pyrimidine-5-
carboxylic acid (2-piperidin-1-yl-ethyl)-amide (n 3)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-
cyclopropylamino-N-(2-
piperidin-1-yl-ethyl)-nicotinamide (n 4)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-phenylamino-
N-(2-
piperidin-1-yl-ethyl)-nicotinamide (n 5)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
(2-
isopropylamino-ethyl)-nicotinamide (n 6)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-N-[2-(1,1-
dioxo-
thiomorpholin-4-yl)-ethyl]-2-ethylamino-nicotinamide (n 7)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
(2-hydroxy-
ethyl)-nicotinamide (n 8)
^ 2-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-4-
cyclopropylamino-
pyrimidine-5-carboxylic acid (2-piperidin-1-yl-ethyl)-amide (n 9)
^ 2-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-4-phenylamino-
pyrimidine-5-
carboxylic acid (2-piperidin-1-yl-ethyl)-amide (n 10)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-2-fluoro-phenyl}-2-ethylamino-N-
(2-piperidin-
1-yl-ethyl)-nicotinamide (n 11)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
(2-pyrrolidin-
1-yl-ethyl)-nicotinamide (n 12)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
methyl-
nicotinamide (n 13)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
(2-methoxy-
ethyl)-nicotinamide (n 14)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-N-(2-azepan-1-
yl-ethyl)-2-
ethylamino-nicotinamide (n 15)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
[2-(1-oxo-
thiomorpholin-4-yl)-ethyl]-nicotinamide (n 16)
^ 6-{4-[3-(6-Amino-5-methyl-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-
ethylamino-N-(2-
piperidin-1-yl-ethyl)-nicotinamide (n 17)
WO 2010/109122 PCT/FR2010/050511
37
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-N-[2-((cis-3,5-
dimethyl-
piperidin-1-yl)-ethyl]-2-ethylamino-nicotinamide (n 18)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-N-[2-(cis-2,6-
dimethyl-
piperidin-1-yl)-ethyl]-2-ethylamino-nicotinamide (n 19)
^ 6-(4-{3-[2-(6-Amino-pyridin-3-yl)-ethyl]-ureido}-3-fluoro-phenyl)-2-
ethylamino-N-(2-
piperidin-1-yl-ethyl)-nicotinamide (n 20)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-2,6-difluoro-phenyl}-2-
ethylamino-N-(2-
piperidin-1-yl-ethyl)-nicotinamide (n 21)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-2,3-difluoro-phenyl}-2-
ethylamino-N-(2-
piperidin-1-yl-ethyl)-nicotinamide (n 22)
^ 4'-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-ethylamino-3'-fluoro-biphenyl-4-
carboxylic acid
(2-piperidin-1-yl-ethyl)-amide (n 23)
^ 6-{4-[3-(6-Ami no-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-N-cyclopropyl-
2-
cyclopropylamino-nicotinamide (n 24)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-N-cyclopentyl-
2-
cyclopropylamino-nicotinamide (n 25)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-N-butyl-2-
cyclopropylamino-
nicotinamide (n 26)
^ 2-Ethylamino-6-[3-fluoro-4-(3-pyridin-3-ylmethyl-ureido)-phenyl]-N-(2-
piperidin-1-yl-ethyl)-
nicotinamide (n 27)
^ 2-Ethylamino-6-{3-fluoro-4-[3-(6-methylamino-pyridin-3-ylmethyl)-ureido]-
phenyl}-N-(2-
piperidin-1-yl-ethyl)-nicotinamide (n 28)
^ 6-{4-[3-(6-Dimethylamino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-
ethylamino-N-(2-
piperidin-1-yl-ethyl)-nicotinamide (n 29)
^ 6-{4-[3-(5-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
(2-piperidin-
1-yl-ethyl)-nicotinamide (n 30)
^ 2-Ethylamino-6-{3-fluoro-4-[3-(5-fluoro-pyridin-3-ylmethyl)-ureido]-phenyl}-
N-(2-piperidin-1-
yl-ethyl)-nicotinamide (n 31)
^ 2-Ethylamino-6-{3-fluoro-4-[3-(5-methyl-pyridin-3-ylmethyl)-ureido]-phenyl}-
N-(2-piperidin-
1-yl-ethyl)-nicotinamide (n 32)
^ 6-{4-[3-(6-Amino-pyridin-3-yl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-(2-
piperidin-1-yl-
ethyl)-nicotinamide (n 33)
^ 2-Ethylamino-6-{3-fluoro-4-[3-(6-methyl-pyridin-3-ylmethyl)-ureido]-phenyl}-
N-(2-piperidin-
1-yl-ethyl)-nicotinamide (n 34)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
[2-(4-
hydroxy-piperidin-1-yl)-ethyl]-nicotinamide (n 35)
WO 2010/109122 PCT/FR2010/050511
38
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
[2-(3-
hydroxy-piperidin-1-yl)-ethyl]-nicotinamide (n 36)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-N-(2-
diisopropylamino-ethyl)-
2-ethylamino-nicotinamide (n 37)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
[2-(4-
methoxy-piperidin-1-yl)-ethyl]-nicotinamide (n 38)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
(3-piperidin-
1-yl-propyl)-nicotinamide (n 39)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
(4-piperidin-
1-yl-butyl)-nicotinamide (n 40)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
[2-(4-methyl-
piperazin-1-yl)-ethyl]-nicotinamide (n 41)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
(2-piperazin-
1-yl-ethyl)-nicotinamide (n 42)
^ 6-{4-[(E)-3-(6-Amino-pyridin-3-yl)-acryloylamino]-3-fluoro-phenyl}-2-
ethylamino-N-(2-
piperidin-1-yl-ethyl)-nicotinamide (n 43)
^ 2-Ethylamino-6-[3-fluoro-4-((E)-3-pyridin-3-yl-acryloylamino)-phenyl]-N-(2-
piperidin-1-yl-
ethyl)-nicotinamide (n 44)
^ 6-{4-[3-(6-Amino-pyridin-3-ylmethyl)-ureido]-3-fluoro-phenyl}-2-ethylamino-N-
[2-(1-oxy-
piperidin-1-yl)-ethyl]-nicotinamide (n 45)
Les composés décrits dans le Tableau I ont fait l'objet d'essais
pharmacologiques permettant
de déterminer l'activité anticancéreuse. Ils ont été testés in vitro sur la
lignée tumorale
HCT116 (ATCC-CCL247). La prolifération et la viabilité cellulaire ont été
déterminées dans un
test utilisant le 3-(4,5-diméthylthiazol-2-yl)-5-(3-carboxyméthoxyphényl)-2-(4-
sulfophényl)-2H-
tétrazolium (MTS) selon Fujishita T. et al. Oncology 2003, 64(4), 399-406.
Dans ce test, on
mesure la capacité mitochondriale des cellules vivantes à transformer le MTS
en un composé
coloré après 72 heures d'incubation du composé testé. La concentration en
composé qui
conduit à 50% de perte de prolifération et de viabilité cellulaire est notée
IC50.
Pour les composés du Tableau I, on trouve une IC5o<1000 nM (1 pM) sur la
lignée HCT116.
Certains composés (par ex. n 1, 5, 11, 19, 27) présentent même une activité <1
nM.