Note: Descriptions are shown in the official language in which they were submitted.
WO 2010/109084 1 PCT/FR2009/052330
DERIVES D'AZACARBOLINES 9H-PYRROLO[2,3-b:5,4-c']DIPYRIDINE, LEUR
PREPARATION ET LEUR UTILISATION THERAPEUTIQUE
La présente invention se rapporte à des dérivés d'a-aza-R-carbolines 9H-
pyrrolo
[2,3-b:5,4-c']dipyridine, à leur préparation et à leur application en
thérapeutique.
On définit les a-aza-R-carbolines par les dérivés du 1,7 diaza carbazole ou de
la 8-
aza -R-carboline ; en nomenclature IUPAC française (utilisation de ACD/Name
12.00) le nom de ce motif tricyclique est 9H-pyrrolo[2,3-b:5,4-c']dipyridine.
La présente invention vise des composés agissant sur des protéines kinase
comme
par exemple : CHK1, CDK1, CDK2, dyrk2, Flt3, GSK3 beta, MNK2, PDGFR beta,
P13K, PIM1, PIM2, PIM3, PLK, TrkB, toutes étant impliquées dans le
développement
des cancers. Plus particulièrement la présente invention vise des composés
agissant
sur une cible dénommée Pim impliquée dans le développement des cancers.
Les kinases Pim, englobant Pim-1, Pim-2 et Pim-3, forment une famille
distincte de
sérine/thréonine kinases, et jouent un rôle fonctionnel dans la croissance
cellulaire,
la différenciation et l'apoptose. L'un des mécanismes par lesquels les kinases
Pim
peuvent accroître la survie des cellules cancéreuses et favoriser l'évolution
du
cancer passe par la modulation de l'activité de BAD, un régulateur clé de
l'apoptose.
Les kinases Pim sont fortement homologues les unes aux autres et affichent un
comportement oncogène similaire.
Des rapports cliniques soulignent l'importance du rôle des kinases Pim dans le
développement de cancers humains :
Les kinases Pim, en particulier Pim-1 et Pim-2, se sont avérées être
anormalement
exprimées dans un grand nombre de maladies hématologiques malignes. Amson et
al. signalent la surexpression de Pim-1 dans la leucémie myéloïde aiguë et la
leucémie lymphoïde aiguë, et que la surexpression de Pim-1 semble résulter
d'une
activation inappropriée dans diverses leucémies (Proc. Nati. Acad. Sci., Vol.
86.,
8857-8861 (1989)). Des études ont mis en évidence la surexpression de Pim-1
dans le lymphome primitif et métastatique du SNC, une forme agressive de
lymphome non hodgkinien (Rubenstein et al., Blood, Vol. 107, n 9, 3716-3723
(2006)). Hüttmann et al. ont également découvert une surexpression de Pim-2
dans
WO 2010/109084 2 PCT/FR2009/052330
la leucémie lymphocytaire chronique à cellules B et suggèrent qu'une
régulation à la
hausse de Pim-2 peut être associée à une évolution plus agressive de la
maladie
(Leukemia, 20, 1774-1782 (2006)). Une expression anormale de Pim-1 et de Pim-2
a été liée au myélome multiple (Claudio et al., Blood, v. 100, n 6, 2175-2186
(2002)).
Des hypermutations de Pim-1 ont été identifiées dans les lymphomes diffus à
grandes cellules (Pasqualucci et al., Nature, Vol. 412, 2001, p. 341-346
(2001)) et
dans le lymphome hodgkinien classique et nodulaire à prédominance
lymphocytaire
(Liso et al., Blood, Vol. 108, n 3, 1013-1020 (2006)).
De nombreuses études ont également relié une expression anormale des kinases
Pim à divers cancers humains non hématologiques (prostate, pancréas, tête et
cou,
etc.) et leur présence est souvent associée à un phénotype plus agressif. Par
exemple, Pim-1 et Pim-2 ont toutes deux été impliquées dans le cancer de la
prostate (Chen et al., Mol Cancer Res, 3(8) 443-451 (2005)). Valdman et al.
ont mis
en évidence une régulation à la hausse de Pim-1 chez des patients atteints
d'un
carcinome de la prostate et dans la néoplasie intraépithéliale prostatique de
haut
grade (lésions précancéreuses) (The Prostate, (60) 367-371 (2004)), tandis que
Dai
et al. suggèrent que la surexpression de Pim-2 dans le cancer de la prostate
est
associée à des caractéristiques cliniques plus agressives (The Prostate,
65:276-286
(2005)). Xie et al. ont découvert que la Pim-1 de 44kDa (Pim-1 L) était
significativement régulée à la hausse dans des échantillons de tumeur de la
prostate
humaine, et indiquent que Pim-1 L a un effet anti-apoptotique sur les cellules
de
cancer de la prostate humain en réponse à des médicaments chimiothérapeutiques
(Oncogene, 25, 70-78 (2006)).
Pim-2 est liée à l'invasion périneurale (PNI), au cours de laquelle les
cellules
cancéreuses s'enroulent autour des nerfs, que l'on retrouve souvent dans
certains
cancers tels que les cancers de la prostate, du pancréas, des canaux biliaires
et de
la tête et du cou (Ayala et al., Cancer Research, 64, 6082 - 6090 (2004)).
D'après Li
et al., Pim-3 est exprimée de façon aberrante dans les hépatocarcinomes
humains
et de souris et les tissus de cancer du pancréas humain (Cancer Res. 66 (13),
6741-
6747 (2006)). Une expression aberrante de Pim-3 a également été observée dans
l'adénome gastrique et les sites métastatiques du carcinome gastrique (Zheng
et al.,
J Cancer Res Clin Oncol, 134:481-488 (2008)).
WO 2010/109084 3 PCT/FR2009/052330
Ensemble, ces rapports suggèrent que les inhibiteurs des kinases Pim sont
utiles
pour le traitement du cancer, notamment des leucémies, des lymphomes, des
myélomes et de diverses tumeurs solides, notamment les cancers de la tête et
du
cou, le cancer du côlon, le cancer de la prostate, le cancer du pancréas, le
cancer
du foie et le cancer buccal, par exemple. Dans la mesure où le cancer reste
une
maladie pour laquelle les traitements existants sont insuffisants, il est
manifestement
nécessaire d'identifier de nouveaux inhibiteurs des kinases Pim qui sont
efficaces
pour le traitement du cancer.
Parmi les demandes de brevet revendiquant des composés de la classe des
azacarbolines, objet de notre invention, on peut citer les documents suivants
:
La demande de brevet WO 2007/044779 décrit des 9H-pyrrolo[2,3-b:5,4-
c']dipyridine
ou a-aza-R-carbolines de formule générale suivante, partiellement restreinte,
par
rapport à la demande telle que publiée :
/ R2
ZZ~
I II
R5 3&Z',
R6~Z-Z3\ R4
114
2
R7IIZN N
H
Dans laquelle - Z5, Z4 et Z3 peuvent représenter C et
- Z et Z2 peuvent aussi représenter C,
- Z1 peut enfin représenter C ou N et
- R2 peut représenter une liaison carbonée ou un radical alkylène
chacun pouvant être substitué par de nombreuses possibilités parmi lesquelles
les
hétéroaryloxy, les hétéroaryl(C1-C5)alkyl, les hétéroaryles et les
hétérobicycloaryles.
Le procédé de préparation ainsi que l'ensemble des exemples de cette demande
sont limités à des dérivés substitués en position 2 et 8 et éventuellement en
position
5.
Le brevet EP 1 209 158 revendique des composés de formule suivante :
WO 2010/109084 4 PCT/FR2009/052330
R7
R6
N
l'
8- NR5
1 9
Dans laquelle B6, B7, B8, B9 peuvent représenter C ou N, mais R7 ne représente
jamais un hétéroaryle. L'activité des composés de cette invention vise
particulièrement le traitement des problèmes cardiaques.
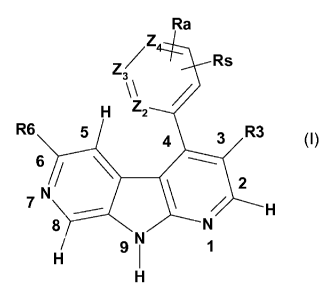
La présente invention concerne des composés de formule générale suivante (I):
Ra
z
Z/ Rs
3
H Z2
R6 5 4 3 R3
6 / \
N
2
7 H
8 N
H 9N
dans laquelle
- Z2, Z3, Z4 identiques ou différents, représentent CH, CRa, CRs ou N
- R3 est choisi parmi :
1. H;
2. halogène (F, CI, Br, I) ;
3. -CF3, -CHF2 ;
4. -OH
5. alkoxy dont la partie alkyle est éventuellement mono, di ou tri substitué;
6. -NH2, -NH(alkyle), -N(alkyle)2 dont la partie alkyle est éventuellement
mono, di ou tri substitué;
WO 2010/109084 5 PCT/FR2009/052330
7. -C(O)Oalkyle éventuellement mono, di ou tri substitué;
8. -CONH(alkyle),CON(alkyle)2 dont la partie alkyle est éventuellement
mono, di ou tri substituée;
9. -C,-C,o alkyle linéaire, ramifié ou cyclique comportant éventuellement un
hétéroatome et éventuellement mono, di ou tri substitué ;
10. aryle ou hétéroaryle éventuellement mono, di ou tri substitué ;
- R6 étant un hétéroaryle (5 ou 6 chaînons avec 1 à 4 hétéroatomes choisis
parmi N,
S ou O) lié au motif azacarboline soit par un C soit par un N appartenant à
R6, R6
étant éventuellement mono ou poly substitué;
- Ra étant obligatoirement choisi parmi :
1. -CONH2,
2. -CONHalkyle,CONHcycloalkyle éventuellement mono, di ou tri substitué;
3. -CONHhétérocycloalkyle éventuellement mono, di ou tri substitué;
4. -CON(alkyle)2 éventuellement mono, di ou tri substitué;
5. -CON(alkyle)(hétérocycloalkyle) éventuellement mono, di ou tri substitué;
6. -CONHN(alkyle)2 dont la partie alkyle est éventuellement mono, di ou tri
substitué ;
7. -C(O)hétérocycloalkyle le radical hétérocycloallkyle renfermant au moins
un atome d'azote lié au C(O) ; et étant éventuellement mono, di ou tri
substitué;
- Rs étant choisi parmi les groupes suivants
1. H;
2. F;CI;Br;I
3. -OH ;
4. -O-alkyle(C,-C,o) linéaire ou ramifié éventuellement mono ou poly
substitué;
5. -NH2 ;
6. -N(alkyle(C,-C,o) ou cycloalkyle(C3-C7))2 chaque groupe étant
éventuellement mono ou poly substitué;
7. -NHC(O)R3a;
8. -N(alkyle(C,-C,o)C(O)R3a;
9. -NHS(02)R3a ;
10. -N(alkyle(C,-C,0)S(02)R3a ;
11 . -CO2R3a ;
WO 2010/109084 6 PCT/FR2009/052330
12. -SR3a ; -S(O)R3a ;-S(02)R3a
Ra et Rs pouvant éventuellement former un cycle substitué par un radical oxo,
renfermant de 4 à 7 chainons, comprenant au moins un atome d'azote et
eventuellement un autre hétéroatome choisi parmi N, O et S et éventuellement
substitué par un ou plusieurs radicaux choisi(s) parmi les radicaux oxo, F,
CI, Br, I,
CF3, CHF2, alkyle, OH, Oalkyle, N02, NH2, NHAIk ou N(Alk)2 ;
R3a étant choisi parmi :
1. F; CI;Br;I
2. -CF3;
3. -C1-C10 alkyle linéaire ou ramifié
4. -C3-C7 cycloalkyle;
5. -C2-C6 alkenyle;
6. -C2-C6 alkynyle ;
7.-OH;
8. -O-alkyle(C1-C10) linéaire, ramifié ou cyclique (C3-C7) ;
9. hétérocycloalkyle (C3-C7) ;
10.-NH2;
11. -NH-(alkyle(C1-C10) ou cycloalkyle(C3-C7));
12. -N(alkyle(C1-C10) ou cycloalkyle(C3-C7))2;
13. -NH-(alkyle(C1-C10) ou hétérocycloalkyle (C3-C7));
14. -N(alkyle(C1-C10) ou hétérocycloalkyle (C3-C7))2;
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréo-isomères, ainsi que les sels d'addition
avec
les acides minéraux et organiques ou avec les bases minérales et organiques
desdits produits de formule (I).
Les produits de formule (I) selon la présente invention sont tels que le cycle
ci-
après :
Ra
Z Rs
Z2
WO 2010/109084 7 PCT/FR2009/052330
ne porte qu'un seul substituant Ra et un seul substituant Rs tels que définis
ci-
dessus, Ra et Rs étant liés aux chaînons carbonés ou à Z2, Z3 ou Z4 lorsque
ceux
représentent un chaînon carboné.
La présente invention a ainsi pour objet les composés tels que définis ci-
dessus
caractérisés en ce que les éventuels substituants de R3, R6 et Ra sont choisis
parmi
les groupes R2a, R2b ou R2c choisis indépendamment l'un de l'autre parmi
1. F;
2. CI ;
3. Br ;
4. I ;
5. -CF3 ; -CHF2
6. -C,-C,o alkyle linéaire ou ramifié éventuellement mono ou poly substitué ;
7. -C3-C7 cycloalkyle éventuellement mono ou poly substitué;
8. -OH ;
9. -O-alkyle(C,-C,o) linéaire ou ramifié éventuellement mono ou poly
substitué;
10. -O-cycloalkyle (C3-C7) éventuellement mono ou poly substitué ;
11. -0-aryle éventuellement mono ou poly substitué;
12. aryle éventuellement mono ou poly substitué;
13. hétéroaryle éventuellement mono ou poly substitué;
14. hétérocycloalkyle éventuellement mono ou poly substitué;
15. -NO2;
16.-NH2;
17. -NH-(alkyle(C,-C,o) ou cycloalkyle(C3-C7) ou hétérocycloalkyle) chaque
groupe éventuellement mono ou poly substitué;
18. -N(alkyle(C,-C,o) ou cycloalkyle(C3-C,))2 chaque groupe étant
éventuellement mono ou poly substitué;
19. -NHaryle ou NH hétéroaryle éventuellement mono ou poly substitué
20. -NHC(O)substitué;
21. -N(alkyle(C,-C,0)C(O)substitué;
22. -NHS(02)substitué ;
23. -N(alkyle(C,-C10)S(02)substitué ;
24. -C02substitué ;
25. -Ssubstitué ;
WO 2010/109084 8 PCT/FR2009/052330
26. -S(02)substitué ;
27. -S(O) substitué
28. oxo (double liaison 0);
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréo-isomères, ainsi que les sels d'addition
avec
les acides minéraux et organiques ou avec les bases minérales et organiques
desdits produits de formule (I).
La présente invention a ainsi pour objet les composés tels que définis ci-
dessus
caractérisés en ce que les éventuels substituants de tous les groupes
substitués et
des groupes Rs, R2a, R2b et R2c ou les groupes sont choisis parmi :
1. F; CI;Br;1
2. -CF3 ;
3. -C,-C,o alkyle linéaire ou ramifié
4. -C3-C7 cycloalkyle;
5. -C2-C6 alkenyle;
6. -C2-C6 alkynyle ;
7. -OH ;
8. -O-alkyle(C,-C,o) linéaire, ramifié ou cyclique (C3-C7) ;
9. hétérocycloalkyle (C3-C7) ;
10. -NH2 ;
11. -NH-(alkyle(C1-C1o) ou cycloalkyle(C3-C,));
12. -N(alkyle(C1-C1o) ou cycloalkyle(C3-C,))2;
13. -NH-(alkyle(C,-C,o) ou hétérocycloalkyle (C3-C7));
14. -N(alkyle(C,-C,o) ou hétérocycloalkyle (C3-C7))2;
lesdits produits de formule (1) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréo-isomères, ainsi que les sels d'addition
avec
les acides minéraux et organiques ou avec les bases minérales et organiques
desdits produits de formule (1).
La présente invention a ainsi pour objet les composés de formule générale (1)
tels
que définis ci-dessus dans laquelle
- Z2, Z3, Z4 identiques ou différents, représentent CH, CRa, CRs ou N
- R3 est choisi parmi :
1. H;
2. halogène (F, Cl, Br, 1) ;
WO 2010/109084 9 PCT/FR2009/052330
3. -CF3, -CHF2 ;
4. -OH
5. alkoxy dont la partie alkyle est éventuellement mono, di ou tri substitué
par R2a, R2b, R2c;
6. -NH2, -NH(alkyle), -N(alkyle)2 dont la partie alkyle est éventuellement
mono, di ou tri substitué par R2a, R2b, R2c;
7. -C(O)Oalkyle éventuellement mono, di ou tri substitué par R2a, R2b, R2c;
8. -CONH(alkyle),CON(alkyle)2 dont la partie alkyle est éventuellement
mono, di ou tri substitué par R2a, R2b, R2c;
9. -C,-C,o alkyle linéaire, ramifié ou cyclique comportant éventuellement un
hétéroatome et éventuellement mono, di ou tri substitué par R2a, R2b, R2c ;
10. aryle ou hétéroaryle éventuellement mono, di ou tri substitué par R2a,
R2b, R2c;
- R6 étant un hétéroaryle (5 ou 6 chaînons avec 1 à 4 hétéroatomes choisis
parmi N, S ou O) lié au motif azacarboline soit par un C soit par un N
appartenant à
R6, R6 étant éventuellement mono ou poly substitué par R2a, R2b, R2c;
- Ra étant obligatoirement :
1. -CONH2,
2. -CONHalkyle, CONHcycloalkyle éventuellement mono, di ou tri
substitué par R2a, R2b, R2c;
3. -CONHhétérocycloalkyle éventuellement mono, di ou tri substitué par
R2a, R2b, R2c;
4. -CON(alkyle)2 éventuellement mono, di ou tri substitué par R2a, R2b,
R2c;
5. -CON(alkyle)(hétérocycloalkyle) éventuellement mono, di ou tri
substitué par R2a, R2b, R2c;
6. -CONHN(alkyle)2 dont la partie alkyle est éventuellement mono, di ou tri
substituée par R2a, R2b, R2c;
7. -C(O)hétérocycloalkyle le radical hétérocycloallkyle renfermant au
moins un atome d'azote lié au C(O) ; et étant éventuellement mono, di ou tri
substitué;
- Rs étant choisi parmi les groupes suivants
1. H;
2. F;CI;Br;I
WO 2010/109084 10 PCT/FR2009/052330
3. -OH;
4. -O-alkyle(C,-C,o) linéaire ou ramifié éventuellement mono ou poly
substitué par des groupes R3a identiques ou différents;
5. -NH2 ;
6. -N(alkyle(C,-C,o) ou cycloalkyle(C3-C7))2 chaque groupe étant
éventuellement mono ou poly substitué par des groupes R3a identiques ou
différents;
7. -NHC(O)R3a;
8. -N(alkyle(C,-C,o)C(O)R3a;
9. -NHS(02)R3a ;
10. -N(alkyle(C,-C,0)S(02)R3a ;
11. -CO2R3a ;
12. -SR3a ; -S(O)R3a ; -S(02)R3a
Ra et Rs peuvent éventuellement former un cycle substitué par un radical oxo,
renfermant de 5 à 6 chainons et comprenant au moins un atome d'azote et
éventuellement substitué par un ou plusieurs radicaux choisi(s) parmi les
radicaux
oxo, F, CI, Br, I, CF3, CHF2, alkyle, OH, Oalkyle, N02, NH2, NHAIk ou N(Alk)2;
Les groupes R2a, R2b ou R2c sont choisis indépendamment l'un de l'autre parmi
1. F;
2. CI ;
3. Br ;
4. I ;
5. -CF3 ; -CHF2
6. -C,-C,o alkyle linéaire ou ramifié éventuellement mono ou poly substitué
par des groupes R3a identiques ou différents;
7. -C3-C7 cycloalkyle éventuellement mono ou poly substitué par des
groupes R3a identiques ou différents;
8. -OH ;
9. -O-alkyle(C,-C,0) linéaire ou ramifié éventuellement mono ou poly
substitué par des groupes R3a identiques ou différents;
10. -O-cycloalkyle (C3-C7) éventuellement mono ou poly substitué par des
groupes R3a identiques ou différents;
11. -0-aryle éventuellement mono ou poly substitué différents par R3a;
WO 2010/109084 11 PCT/FR2009/052330
12. aryle éventuellement mono ou poly substitué par des groupes R3a
identiques ou différents;
13. hétéroaryle éventuellement mono ou poly substitué par des groupes R3a
identiques ou différents;
14. hétérocycloalkyle éventuellement mono ou poly substitué par des
groupes R3a identiques ou différents;
15. -NO2
16. -NH2 ;
17. -NH-(alkyle(C,-C,o) ou cycloalkyle(C3-C7) ou hétérocycloalkyle) chaque
groupe éventuellement mono ou poly substitué par des groupes R3a
identiques ou différents;
18. -N(alkyle(C,-C,o) ou cycloalkyle(C3-C7))2 chaque groupe étant
éventuellement mono ou poly substitué par des groupes R3a identiques ou
différents;
19 NHaryle ou NH hétéroaryle éventuellement mono ou poly substitué par des
groupes R3a identiques ou différents
20. NHC(O)R3a;
21. N(alkyle(C1-C10)C(O)R3a;
22. NHS(02)R3a;
23. N(alkyle(C,-C,0)S(02)R3a ;
24. CO2R3a ;
25. SR3a ; S(O)R3a ; S(02)R3a;
26. N(alkyle(C,-C,0) ou cycloalkyle(C3-C7))2 chaque groupe étant
éventuellement mono ou poly substitué par des groupes R3a identiques ou
différents;
27. oxo (double liaison O) ;
Les éventuels substituants des groupes R2a, R2b et R2c ou les groupes R3a sont
choisis parmi :
2. F;CI;Br;I
3. -CF3 ;
4. -C,-C,o alkyle linéaire ou ramifié
5. -C3-C7 cycloalkyle;
6. -C2-C6 alkenyle;
WO 2010/109084 12 PCT/FR2009/052330
7. -C2-C6 alkynyle ;
8. -OH ;
9. -O-alkyle(C,-C,o) linéaire, ramifié ou cyclique (C3-C7) ;
10. hétérocycloalkyle (C3-C7) ;
11. -NH2 ;
12. -NH-(alkyle(C1-C1o) ou cycloalkyle(C3-C,));
13. -N(alkyle(C1-C1o) ou cycloalkyle(C3-C,))2;
14. -NH-(alkyle(C,-C,o) ou hétérocycloalkyle (C3-C7));
15. -N(alkyle(C,-C,o) ou hétérocycloalkyle (C3-C7))2;
Dans le cadre de la présente invention les positions 2 et 8 ne doivent pas
être
substituées contrairement aux documents de l'art antérieur.
Les substituants Ra et Rs tels que définis ci-dessus sont respectivement et
indifféremment liés à l'un quelconque des carbones du cycle ci-dessous
Z
Z/
3
Z2
dans lequel Z2, Z3 et Z4 ont les significations indiquées ci dessus
La présente invention a particulièrement pour objet les produits de formule
appartenant à la formule la :
Ra
Z Rs
3\ /
R6 R3
N~
N N
la
dans laquelle Z2 représente CH, Z4 représente -C-Ra et R3, R6, Ra et Rs ont
l'une
quelconque des significations indiquées ci-dessus et Z3 représente CH ou N,
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréo-isomères, ainsi que les sels d'addition
avec
les acides minéraux et organiques ou avec les bases minérales et organiques
desdits produits de formule (I).
La présente invention a particulièrement pour objet les produits de formule
appartenant à la formule lb :
WO 2010/109084 13 PCT/FR2009/052330
Ra
R6 R3
N i
N N
dans laquelle Rs représente un atome d'hydrogène, Z2 et Z3 représentent CH, Z4
représente -C-Ra et R3, R6 et Ra ont l'une quelconque des significations
indiquées
ci-dessus, lesdits produits de formule (I) étant sous toutes les formes
isomères
possibles racémiques, énantiomères et diastéréo-isomères, ainsi que les sels
d'addition avec les acides minéraux et organiques ou avec les bases minérales
et
organiques desdits produits de formule (I).
La présente invention a particulièrement pour objet les produits de formule
appartenant à la formule le :
Ra
Rp Rp
N Rp R3
N~
N N
dans laquelle Rs représente un atome d'hydrogène, Z2 et Z3 représentent CH, Z4
représente -C-Ra, R6 représente un radical pyridyle éventuellement mono ou
poly
substitué par un ou plusieurs radicaux Rp identiques ou différents choisis
parmi les
radicaux F, CI, Br, I, CF3, CHF2, alkyle, OH, Oalkyle, N02, NH2, NHAIk ou
N(Alk)2
et R3 et Ra ont l'une quelconque des significations indiquées ci-dessus,
lesdits
produits de formule (I) étant sous toutes les formes isomères possibles
racémiques,
énantiomères et diastéréo-isomères, ainsi que les sels d'addition avec les
acides
minéraux et organiques ou avec les bases minérales et organiques desdits
produits
de formule (I).
La présente invention a particulièrement pour objet les produits de formule
appartenant à la formule Id :
WO 2010/109084 14 PCT/FR2009/052330
R P HRa
I NN Rp
R3
Rp
N~
N N
H
dans laquelle Rs représente un atome d'hydrogène, Z2 et Z3 représentent CH, Z4
représente -C-Ra, R6 représente un radical pyrazolyle éventuellement mono ou
poly
substitué par un ou plusieurs radicaux Rp identiques ou différents choisis
parmi les
radicaux F, CI, Br, I, CF3, CHF2, alkyle, OH, Oalkyle, N02, NH2, NHAIk ou
N(Alk)2
et R3 et Ra ont l'une quelconque des significations indiquées ci-dessus,
lesdits
produits de formule (I) étant sous toutes les formes isomères possibles
racémiques,
énantiomères et diastéréo-isomères, ainsi que les sels d'addition avec les
acides
minéraux et organiques ou avec les bases minérales et organiques desdits
produits
de formule (I).
Les termes ci-après utilisés ci-dessus ou ci-dessous ont les significations
suivantes
- Alkyle, alkyle(C,-C10) ou C,-C,o alkyle signifie toutes les chaînes
carbonées de 1 à
10 carbones, saturées, linéaires ou ramifiées.
- Aryle signifie phényle ou naphtyle.
- Hétéroaryle signifie tous les monocycles aromatiques à 5 ou 6 chaînons
possédant
au moins un hétéroatome (N, O, S) notamment : pyridine, pyrimidine, imidazole,
pyrazole, triazole, thiophène, furanne, thiazole, oxazole..., ainsi que les
systèmes
bicycliques aromatiques possédant au moins un hétéroatome (N, O, S) notamment
indole, benzimidazole, azaindole, benzofuranne, benzothiophène, quinoléïne,
tétrazole
- Hétérocycloalkyle signifie tous les monocycles et bicycles (spiro ou non)
non
aromatiques possédant au moins un hétéroatome (N, O, S aux différents états
d'oxydation possibles) avec ou sans insaturation notamment : morpholine,
pipérazine, pipéridine, pyrrolidine, oxétane, époxyde, dioxane, imidazolone,
imidazolinedione, 7-oxa-bicyclo[2.2.1]heptane, azétidine, azépine,
hexahydropyrrolo[3,4-b]pyrrole, hexahydropyrrolo[2,3-b]pyrrole,
hexahydropyrrolo[3,4-c]pyrrole, hexahydropyrrolo[2,3-c]pyrrole, 2,7-
WO 2010/109084 15 PCT/FR2009/052330
diazaspiro[4,4]nonane, 2,6-diazaspiro[4,4]nonane, 3,6-diazaspiro[4,4]nonane,
3,7-
diazaspiro[4,4]nonane, 3,8-diazaspiro[4,4]nonane, 3,9-diazaspiro[4,4]nonane,
4,6-
diazaspiro[4,4]nonane, 4,7-diazaspiro[4,4]nonane, 4,8-diazaspiro[4,4]nonane,
4,9-
diazaspiro[4,4]nonane, 1,6-diazaspiro[4,4]nonane, 1,7-diazaspiro[4,4]nonane,
1,8-
diazaspiro[4,4]nonane, 1,9-diazaspiro[4,4]nonane, octahydropyrrolo[3,4-
c]piridine,
octahydropyrrolo[3,4-d]piridine, octahydropyrrolo[3,4-e]piridine,
octahydropyrrolo[2,3-
c]piridine, octahydropyrrolo[2,3-d]piridine, octahydropyrrolo[2,3-e]piridine,
et
notamment hexahydropyrrolo[3,4-b]pyrrole, 2,7-diazaspiro[4,4]nonane et
octahydropyrrolo[3,4-c]piridine.
- Cycloalkyle(C3-C7) signifie tout les cycles non-aromatiques constitués
uniquement
d'atome de carbone, notamment cyclopropane, cyclobutane, cyclopentane,
cyclohexane, cycloheptane ; mais pouvant aussi porter une insaturation par
exemple
cyclopentène, cyclohexène, cycloheptène, bicyclo[2.2.1]heptane.
- C1-C10 alkylhydroxy signifie toutes les chaînes carbonées de 1 à 10
carbones,
saturées, linéaires ou ramifiées portant au moins un groupe hydroxy (OH).
- C,-C,o alkoxy signifie toutes les chaînes carbonées de 1 à 10 carbones,
saturées,
linéaires ou ramifiées dans lesquelles se trouve au moins une fonction éther
(C-O-C).
- C1-C10 alkylamino signifie toutes les chaînes carbonées de 1 à 10 carbones,
saturées, linéaires ou ramifiées dans lesquelles se trouve au moins une
fonction
amine (primaire, secondaire ou tertiaire).
La présente invention a notamment pour objet les produits de formule (I) tels
que
définis ci-dessus dont les noms suivent :
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-(1 H-
tétrazol-5-
ylméthyl)benzamide
- [(3R)-3-(diméthylamino)pyrrolidin-1-yl]{4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrol o[2,3-
b:5,4-c']dipyridin-4-yl]phényl}méthanone
- {4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-
yl]phényl}[(3aS,6aS)-
5-méthylhexahydropyrrolo[3,4-b]pyrrol-1(2H)-yl]méthanone
- N-[2-(acétylamino)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-
4-yl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[3-(2-
oxopyrrolidin-1-yl)propyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
(phénylamino)éthyl]benzamide
WO 2010/109084 16 PCT/FR2009/052330
- N-[(1-éthylpyrrol idin-2-yl)méthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzamide
- N-[3-(diméthylamino)-2,2-diméthylpropyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridin-4-yl]benzamide
- N-{[(2S)-1-éthylpyrrol idin-2-yl]méthyl}-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrol o[2,3-
b:5,4-c']dipyridin-4-yl]benzamide
- N-(1-éthylpipéridin-3-yl)-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-
4-yl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-(2-
méthylpipéridin-1-yl)éthyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-(1-
méthylazétid in-3-yl)benzamide
- [3-(diméthylamino)pipéridin-1-yl]{4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol
o[2,3-b:5,4-
c']dipyridin-4-yl]phényl}méthanone
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
méthyl-2-
(pyrrolidin-1-yl)propyl]benzamide
- N-[3-(diméthylamino)propyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]-N-méthylbenzamide
- N-[2-(azépan-1-yl)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-
4-yl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-(1-
méthylpipéridin-4-yl)éthyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-{2-
[(méthylsulfonyl)amino]éthyl}benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
(pyrrolidin-1-
yl)propyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-
méthyl-N-[(1-
méthylpipéridin-2-yl)méthyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-(1-
méthylpyrrol idin-2-yl)éthyl]benzamide
- N-[2-(dipropan-2-ylamino)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- N-[2-(diméthylamino)éthyl]-N-éthyl-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzamide
WO 2010/109084 17 PCT/FR2009/052330
- N-[1-(diméthylamino)propan-2-yl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- [(3S)-3-(diméthylamino)pyrrolidin-1-yl]{4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrol o[2,3-
b:5,4-c']dipyridin-4-yl]phényl}méthanone
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-
méthyl-N-(1-
méthyl pyrrol idin-3-yl)benzamide
- N-[2-(diéthylamino)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]-N-méthylbenzamide
- {4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-
yl]phényl}[4-(2-
méthoxyéthyl)pipérazin-1-yl]méthanone
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-[(3-
méthyl-1 H-
pyrazol-4-yl)méthyl]benzamide
- {4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-
yl]phényl}(2-
méthyloctahydro-5H-pyrrolo[3,4-c]pyridin-5-yl)méthanone
- N-[4-(diméthylamino)butyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-(1 H-
imidazol-2-
ylméthyl)benzamide
- {4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-
yl]phényl}(7-méthyl-
2,7-diazaspiro[4.4]non-2-yl)méthanone
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
(pyridin-2-
ylamino)éthyl]benzamide
- N-éthyl-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-
N-[(1-
méthyl pyrrol idin-3-yl)méthyl]benzamide
- 1,3'-bipyrrol idin-l'-yl{4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-
yl]phényl}méthanone
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-
méthyl-N-(1-
méthylpipéridin-4-yl)benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[(2-
hydroxypyridin-4-yl)méthyl]benzamide
- N-[2-(éthylamino)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-
4-yl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
(méthylamino)éthyl]benzamide
WO 2010/109084 18 PCT/FR2009/052330
- N-[(1-aminocyclopropyl)méthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- N-(3-a mino-2,2-difluoropropyl)-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- N-(2-amino-3,3,3-trifluoro-2-méthylpropyl)-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 R,2 R)-2-a minocycl ohexyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol
o[2,3-b:5,4-
c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-aminocycl ohexyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-aminocycl opentyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol
o[2,3-b:5,4-
c']dipyridin-4-yl]benzamide
- N-[(1 R,2R)-2-am inocyclopentyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-(4-
méthylpipérazin-1-yl)benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-(1-
méthylpipéridin-4-yl)benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(3 R)-3-hydroxypyrrolid in-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(3S)-3-hydroxypyrrolid in-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-(2-
hydroxyéthyl)benzamide
- N-[(1 S,2S)-2-aminocyclohexyl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-(d iéthylamino)cyclohexyl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-
4-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-(éthylamino)cyclohexyl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-
yl]benzamide
- 4-[6-(5-chloro-1-méthyl-1 H-pyrazol-4-yl)-3-fluoro-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-
yl]-N-(4-méthylpipérazin-1-yl)benzamide
WO 2010/109084 19 PCT/FR2009/052330
- 4-[6-(5-chloro-1-méthyl-1 H-pyrazol-4-yl)-3-fluoro-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-
yl]-N-(1-méthylpipéridin-4-yl)benzamide
- N-[2-(diméthylamino)éthyl]-4-[3-(2-méthoxyéthoxy)-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridin-4-yl]benzamide
- N-[2-(diméthylamino)éthyl]-5-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]pyridine-2-carboxamide
- N-[2-(diméthylamino)éthyl]-2-fluoro-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzamide.
La présente invention a encore pour objet les produits de formule (I) tels que
définis
ci-dessus dont les noms suivent :
- N-(2-aminoéthyl)-4-[3-(2-méthoxyéthoxy)-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-(2-aminoéthyl)-4-[6-(1-méthyl-1 H-pyrazol-4-yl)-3-(oxétan-3-yloxy)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-am inocyclopentyl]-4-[3-(2-méthoxyéthoxy)-6-(1-méthyl-1 H-
pyrazol-4-
yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-(éthylamino)cyclopentyl]-4-[3-(2-méthoxyéthoxy)-6-(1-méthyl-1
H-
pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- 4-[6-(1-éthyl-1 H-pyrazol-4-yl)-3-méthoxy-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(2R)-pyrrolidin-2-ylméthyl]benzamide
- N-[(1 S,2S)-2-(cyclopropylamino)cyclohexyl]-4-[3-fluoro-6-(1-méthyl-1 H-
pyrazol-4-
yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S ,2S)-2-am inocyclohexyl]-4-[3-méthoxy-6-(1-méthyl-1 H-pyrazol-4-yl)-
9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- 4-[6-(1-méthyl-1 H-pyrazol-4-yl)-3-(oxétan-3-yloxy)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-
4-yl]-N-[(2R)-pyrrolidin-2-ylméthyl]benzamide
- 4-[3-méthoxy-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(2S)-pyrrolidin-2-ylméthyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-
{[(2R,3R)-3-
hydroxypyrrolidin-2-yl]méthyl}benzamide
- N-[(3R,4R)-4-aminotétrahydrofuran-3-yl]-4-[3-(2-méthoxyéthoxy)-6-(pyridin-3-
yl)-
9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 R,2R)-2-(éthylamino)cyclohexyl]-4-[3-méthoxy-6-(1-méthyl-1 H-pyrazol-4-
yl)-
9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
WO 2010/109084 20 PCT/FR2009/052330
- N-{[(2R,3R,4S)-3,4-di hydroxypyrrolidin-2-yl]méthyl}-4-[3-méthoxy-6-(1-
méthyl-1 H-
pyrazol-4-yl)-9 H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-hydroxycyclohexyl]-4-[3-méthoxy-6-(1-méthyl-1 H-pyrazol-4-yl)-
9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-({4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-
yl]phényl}carbonyl)-bêta-D-galactopyranosylamine
- N-[(3 R,4R)-4-am inotétrahydrofuran-3-yl]-4-[3-fluoro-6-(1-méthyl-1 H-
pyrazol-4-yl)-
9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,2R,3S,4S)-2,3-dihydroxy-4-(hydroxyméthyl)cyclopentyl]-4-[3-fluoro-6-
(1-
méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3S,4 R)-4-hydroxytétrahydrofuran-3-yl]benzam ide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(1 S,2S)-2-hydroxycyclopentyl]benzamide
- N-[(1 R)-7-azaspiro[3.5]non- 1-yl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-
9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S)-7-azaspiro[3.5]non- 1-yl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-
9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(1 S,2S)-2-hydroxycyclohexyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3S,4S)-4-hydroxypyrrolidin-3-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3R,4R)-4-hydroxypyrrolidin-3-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3S,4R)-4-hydroxypyrrolidin-3-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3R,4S)-4-hydroxypyrrolidin-3-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3R,4R)-4-hydroxy-1, 1 -dioxidotétrahydrothiophén-3-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3R,4S)-4-hydroxy-1,1-dioxidotétrahydrothiophén-3-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(2R)-2-(hydroxyméthyl)pyrrolidin-1-yl]éthyl}benzamide
WO 2010/109084 21 PCT/FR2009/052330
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(2S)-2-(hydroxyméthyl)pyrrolidin-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(1 S,3R)-3-hydroxycyclopentyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(1 R,3R)-3-hydroxycyclopentyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(1 S,3S)-3-hydroxycyclopentyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(1 R,3S)-3-hydroxycyclopentyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(1 S,2R)-2-(hydroxyméthyl)cyclopentyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(1 S,2R)-2-(hydroxyméthyl)-1-méthylcyclopentyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(2S,3 R)-3-(hydroxyméthyl)bicyclo[2.2.1 ]hept-2-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(2 R,3S)-3-(hydroxyméthyl)bicyclo[2.2.1 ]hept-2-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(2R)-2-(hydroxyméthyl)pipéridin-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(2S)-2-(hydroxyméthyl)pipéridin-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(3S)-3-(hydroxyméthyl)pipéridin-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(3R)-3-(hydroxyméthyl)pipéridin-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(3S)-3-hydroxypipérid in-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(3R)-3-hydroxypipéridin-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(1 S,2S)-2-(hydroxyméthyl)cyclohexyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(1 R,2R)-2-(hydroxyméthyl)cyclohexyl]benzamide
WO 2010/109084 22 PCT/FR2009/052330
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(2 R,3 R)-3-(hydroxyméthyl)-7-oxabicyclo[2.2.1 ]hept-2-yl]benzamide
- N-[(1 R,3R)-5-azaspiro[2.4]hept-1-yl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 R,3S)-5-azaspiro[2.4]hept-1-yl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,3R)-5-azaspiro[2.4]hept-1-yl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,3S)-5-azaspiro[2.4]hept-1-yl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 R,3R)-5-azaspiro[2.5]oct-1-yl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 R,3S)-5-azaspiro[2.5]oct-1-yl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,3R)-5-azaspiro[2.5]oct-1-yl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,3S)-5-azaspiro[2.5]oct-1-yl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(2S)-pyrrolidin-2-ylméthyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(2R)-pyrrolidin-2-ylméthyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3R)-pyrrolidin-3-ylméthyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3S)-pyrrolidin-3-ylméthyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(2S)-pipéridin-2-ylméthyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(2R)-pipéridin-2-ylméthyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3R)-pipéridin-3-ylméthyl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3S)-pipéridin-3-ylméthyl]benzamide
WO 2010/109084 23 PCT/FR2009/052330
- 3,4-dihydro-1,8-naphtyridin-1(2H)-yl{4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]phényl}méthanone
- 1-({4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-
yl]phényl}carbonyl)-2,3-dihydro-1,8-naphtyridin-4(1 H)-one
- {4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-
yl]phényl}(octahydroquinoxalin-1(2H)-yl)méthanone
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
(1,3-thiazol-2-ylméthyl)benzamide
- N-[(5-cyano-1,3-thiazol-2-yl)méthyl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-[1-
(1,3-thiazol-2-yl)éthyl]benzamide
- {4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-
yl]phényl}[2-(1,3-thiazol-2-yl)pipéridin-1-yl]méthanone
- {4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-
yl]phényl}[2-(1,3-thiazol-2-yl)pyrrolidin-1-yl]méthanone
- [(3S)-3-aminopipéridin-1-yl]{4-[3-méthoxy-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]phényl}méthanone
- [(3R,4R)-3-amino-4-hydroxypipéridin-1-yl]{4-[3-méthoxy-6-(1-méthyl-1 H-
pyrazol-4-
yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]phényl}méthanone
- N-[(3R,4R)-4-hydroxypipéri din-3-yl]-4-[3-méthoxy-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(3S,4S)-4-hydroxypipéri din-3-yl]-4-[3-méthoxy-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(3R,4S)-4-hydroxypipéri din-3-yl]-4-[3-méthoxy-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(3S,4R)-4-hydroxypipéri din-3-yl]-4-[3-méthoxy-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(3S,5R)-5-hydroxypipéri din-3-yl]-4-[3-méthoxy-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-aminocyclopentyl]-4-[6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol
o[2,3-
b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-(éthylamino)cyclopentyl]-4-[3-méthyl-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
WO 2010/109084 24 PCT/FR2009/052330
- 4-[6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[(2S)-
pyrrolidin-2-
ylméthyl]benzamide
- N-[(1 S,2S)-2-aminocyclohexyl]-4-[6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol
o[2,3-
b:5,4-c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-
4-yl]-N-
[(3S,4S)-4-hydroxypipérid in-3-yl]benzamide
- N-{2-[(3S)-3-hydroxypyrrolidin-1-yl]éthyl}-4-[3-méthyl-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridin-4-yl]benzamide
- 2-(3-aminopropyl)-5-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]-2,3-dihydro-1 H-isoindol-1 -one
Les composés de formule (I) peuvent comporter un ou plusieurs atomes de
carbones asymétriques. Ils peuvent donc exister sous forme d'énantiomères ou
de
diastéréoisomères. Ces énantiomères, diastéréoisomères, ainsi que leurs
mélanges,
y compris les mélanges racémiques, font partie de l'invention.
Les composés de formule (I) peuvent comporter une ou plusieurs stéréochimies
de
type E/Z sur des doubles liaisons ou cis/trans sur des cycles non aromatiques.
Ces
différents stéréoisomères ainsi que leurs mélanges, font partie de
l'invention.
Les composés de formule (I) peuvent exister à l'état de bases ou de sels
d'addition à
des acides. De tels sels d'addition font partie de l'invention.
Ces sels peuvent être préparés avec des acides pharmaceutiquement acceptables
(P.Stahl, C.Wermuth ; Handbook of Pharmaceutical Salts ; Wiley Ed.), mais les
sels
d'autres acides utiles, par exemple, pour la purification ou l'isolement des
composés
de formule (I) font également partie de l'invention.
Les composés de formule (I) peuvent comporter un ou plusieurs isotopes des
atomes décrits ci-dessus, notament le deutérium D, le tritium T, le 11C, 13C
le 14C, le
150, le 15N, le 18F, 1231, 1241 et 1351. Ces composés, quelles que soient
leurs
compositions isotopiques, font partie de l'invention.
Tous les intermédiaires de synthèse non-décrits dans la littérature menant à
l'obtention des composés appartenant à la formule générale font également
partie
de l'invention.
La stratégie est de synthèse du noyau tricyclique est basée sur deux réactions
de
couplage ; une liaison carbone-carbone est tout d'abord créée entre deux
pyridines
convenablement choisies, conduisant aux intermédiaire de formule Bn, puis la
formation d'une liaison carbone-azote intramoléculaire conduit au motif 9H-
WO 2010/109084 25 PCT/FR2009/052330
pyrrolo[2,3-b:5,4-c']dipyridine (intermédiaire de formule Cn voir schéma 1 ci-
dessous).
La présente invention a également pour objet tout procédé de synthèse connu de
l'homme du métier permettant de préparer les produits de formule (I) tels que
définis
ci-dessus.
La présente invention a notamment pour objet un procédé général de synthèse
des
produits de formule (I) tels que définis ci-dessus, décrit ci-après dans le
schéma
général :
M ou X R4 Couplage H2N N
CI X ou M L R3 (Stille, Suzuki,...R
R3
Ni R H2N N N CI R4
An B
X=Brou) p
M = SnMe3 ou B(OH)2 ou HB
0
R = CI, -OMe, -OH, -OS02CF3 Hartwig Buchwald
R4 = H, I, -OMe, -OH, -OS02CF3 Co2Me Co2H ou sel de cuivre
Ra
Z /Z4 Rs R R4
s R3
R6 Z2 \ / \
R3 N
N
N
N N H ouGP
H GP : groupe protecteur tosyle, SEM,
?n: ?:as s de F~Drrn iie = , . d r;: Ã cu 3s R$. Piv, Ac,
Ra et R wn'L , qua._;,.. . `._.s:,w,-
Schéma général
La présente invention a notamment pour objet un procédé de synthèse des
produits
de formule (la) tels que définis ci-dessus, décrit ci-après dans le schéma 1.
WO 2010/109084 26 PCT/FR2009/052330
----
M ou X R4 Couplage H2N N
CI X ou M \ R3 (Stille, Suzuki,...R \
R3
CI
Ni R H 2 N D~N N R4
`,''' X=Brou) o
M = SnMe3 ou B(OH)2 ou HB
o Hartwig-Buchwald
R = CI, -OMe, -OH, -OSO2CF3 ou sel de cuivre
R4 = H, I, -OMe, -OH, -OSO2CF3, CO2Me C02H
Ra
z Rs R R4 R3
R6 R3 N
N N N
N N Hou GP
GP : groupe protecteur tosyle, SEM,
Piv, Ac,
sont a ;` ,,is :..: c.. u, _;,,, oser t , e` Z,
Schéma 1
Les conditions opératoires pour obtenir les produits de formule la tels que
définis ci-
dessus, à partir des intermédiaires de formule An, Bn et Cn dans lesquels X,
M, R,
R4, GP ont les définitions indiquées dans le schéma général tels que définis
ci-
dessus, sont décrites ci-après.
Par exemple, le procédé de préparation des composés possédant un motif (3'-
pyridinyle) en position 6 selon l'invention consiste dans une première étape à
préparer le 5-chloro-4-(triméthylstannanyl)-2,3'-bipyridine Al à partir du 2-
(3'-
pyridyl)-5-chloropyridine (Journal of the Chemical Society, Perkin
transactions 1
2002, (16), 1847-1849) (schéma 2)
CI LDA, THF, -78 OC SnMe3
puis Me3SnCl CI \
YN_ I \ - i
N
N
Al N
Schéma 2
Dans une deuxième étape à réaliser un couplage de Stille avec un dérivé 2-
amino-3-
(bromo ou iodo)-pyridine éventuellement substitué en position 5 (intermédiaire
B1
schéma 3):
WO 2010/109084 27 PCT/FR2009/052330
SnMe3 Pd(PPh3)4
CI Cul dioxanne H2N N
95 C 1 nuit I
N R3
N Brou 1R3 N CI
1, N n-
HN ~ N Bi
z
Schéma 3
Dans une troisième étape, le motif tricyclique (intermédiaire de type Cl) est
obtenu
par une réaction d'amination d'aryle intramoléculaire, catalysée soit par un
complexe
de palladium, soit par de l'iodure de cuivre (I) (schéma 4) :
Pd(OAc)21 Josiphos
tBuOK, dioxanne N
H2N N 95 C 1 nuit
N / \ I ou micro-onde 120 C 1 h R3
R3
N ou Cul N
CI K2C03, DMSO N N
170 C une nuit
H
Schéma 4
où le Josiphos est un composé de formule suivante :
PtBuz
PCy2
Fe
\ /
Dans une quatrième étape à réaliser la fonctionnalisation de la position 4
(C1-C2-C3) (schéma 5) :
R3 NaH R3
\ R3 LDA, THF I \ I _
TsCI
N1 DMF NI puis, I2 N
N I N N N -78 C N. N
H S%
O2Tol C3 SO2Tol
Schéma 5
La fin de la synthèse s'effectue en 4 étapes : un couplage de type Suzuki (C3-
C4),
une déprotection par action de lithine (C4-C5), une activation de la fonction
acide
WO 2010/109084 28 PCT/FR2009/052330
par le chlorure de thionyle ou bien par un réactif connu d'activation d'acide
carboxylique, suivie de la réaction avec l'amine choisie (C5-1b) (schéma 6):
0-
0
R3 Pd(PPh3)4 Cs2CO3
dioxanne/eau Rs
micro-onde 120-130 C 1 h N/
N / / I \ N h R3
Rs
N N -o Bo N
S02Tol o N N
C3 C4 SO2ToI
;.. _1 . _ .::. LiOH, H2O
THF, McOH
OH
H Ra
1 ) SOCI2 reflux Rs
Zs Rs D:,_ N /
N
R3 R3 Q 2 ) Amine -
N \ / \ CH2CI2, 25 C N N
i
N N
Ig, N H
H .H
Schéma 6
La présente invention a ainsi notamment pour objet un procédé de synthèse des
produits de formule (Ib) tels que définis ci-dessus, décrit dans le schéma 6.
Selon la disponibilité commerciale des dérivés boroniques, les produits de
formule I
de structure le peuvent être obtenus avec un dérivé boronique comportant déjà
un
motif carboxamide Ra (Schéma 7) :
WO 2010/109084 29 PCT/FR2009/052330
R3
1 - LiOH, H2O R3
N/ I \ N THF, McOH N/ N
N N N
% N
SO Tol H
Pd(PPh3)4 Cs2CO3
Ra ~_~ B dioxanne/eau
o micro-onde 120-130 C 1 h
Ra
N/ /
R3
N~
N N
H
Schéma 7
La présente invention a ainsi notamment pour objet un procédé de synthèse des
produits de formule (Ic) tels que définis ci-dessus, décrit dans le schéma 7.
Le réactif boronique, avec la fonction carboxamido, pouvant également être
préparé
avant condensation comme pour un dérivé commercial.
Le procédé de préparation des composés possédant un motif (1'-methyl-l'H-
pyrazol-
4'-yle) en position 6 selon l'invention consiste dans une première étape en la
préparation de l'intermédiaire A2 (schéma 8):
LiTMP, Me3SnCI \ /
CI THF, -78 C Sn
CI
O N 1
~O N
Schéma 8
Dans une deuxième étape à réaliser un couplage de Stille (A2-B2) avec un
dérivé
2-amino-3-(bromo ou iodo)-pyridine éventuellement substitué en position 4 ou
5,
suivi par une réaction d'amination d'aryle intramoléculaire (B2-C7), catalysée
soit
par un complexe de palladium, soit par de l'iodure de cuivre (I) (schéma 9) :
WO 2010/109084 30 PCT/FR2009/052330
Pd(OAc)21 Josiphos
Pd(PPh3)4 tBuOK, dioxanne
\ / Cul dioxanne H2N N 95 C 1 nuit O R4 R3
,Sn MW 120 C l h I ou micro-onde 120 C 1 h
et O
R3 N ( i
/ R4 NI / R4 ou Cul N
O N R3` Br ci K2co3, DMSO H
A2. 170 C une nuit
N NHZ
Schéma 9
L'installation du motif (1'-methyl-l'H-pyrazol-4'-yle) se fait par une
séquence de trois
étapes comprenant : une réaction de déméthylation (C7-C8), la formation d'un
dérivé triflate (C8-C9) et une réaction de couplage de type Suzuki (C9-C10)
(schéma 10):
HCI, AcOH
R4 micro-onde 1 h HO R4 R3
O R3 120 C-150 C
N\ N\ hd
H N ~.* H
(CF3SO2)20
Pyridine
F
N N N-BO F F~SO
R4 O R4
R3 O R3
N PdCl2(dppf) N
N N dioxanne/eau N N
C-10 H Cs2C03 :>' H
Schéma 10
L'introduction du motif phénylcarboxamido a lieu comme précédemment par un
couplage pallado-catalysé de type Suzuki à partir d'un triflate ou d'un
iodure (intermédiaire Cl 1, schéma 11):
Ra
R4 R3 Pd(PPh3)4 Cs2CO3
N dioxanne/eau N
N micro-onde 120-130 C 1 h R3
N NN O H Ra / \B N
U
== , ;.-I-, H
Schéma 11
WO 2010/109084 31 PCT/FR2009/052330
La présente invention a ainsi notamment pour objet un procédé de synthèse des
produits de formule (Id) tels que définis ci-dessus, décrit dans le schéma 11.
Une synthèse alternative pour l'obtention des composés Id possédant le groupe
(1'-
methyl-1'H-pyrazol-4'-yle) a également été utilisée. La première étape est la
préparation du 2,5-dichloro-4-(triméthylstannanyl)-pyridine A3 par une méthode
analogue à celle décrit plus haut. Le couplage de Stille (A3-B3) avec un
dérivé 2-
amino-3-(bromo ou iodo)-pyridine substitué en position 5, est dans ce cas
suivi par
une réaction d'amination d'aryle intramoléculaire (B3- C12), catalysée par un
sel de
cuivre au degré d'oxidation (I) ou (II) (schéma 12) :
-------------------------------------------------------------------------------
-------------------------------------------------------------------------------
-------------------------------------------------------
Pd(PPh3)4
LDA, THF, -78 C SnMe Cul dioxanne H2N N
iCI puis Me3SnCI CI 3 MW120 C 1h
R3
N CI R4
R4
N CI R3 Br N CI
N NH2 Cul ou Cu(acac)2
K2CO3, DMSO
140-170 C, 2-12h
CI R4 R3
N~
N
N
~.., H
Schéma 12
Dans une deuxième étape à réaliser, la fonctionnalisation de la position 4 se
fait par
la même séquence (C1-C2-C3-C6) que pour les composés portant un groupe 3'-
pyridyle (schéma 13).
R3 NaH R3 R3
LDA, THF I
TsCI
ci / / DMF CI / \ N puis, I2 ci N
N N N~ I N 78 C N N
H , 3 SO2ToI õ14 SO2ToI
12 R = R4, LiOH, H2O
McOH,THF
R3
CI
N
N~ N
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
Schéma 13
WO 2010/109084 32 PCT/FR2009/052330
La fin de la synthèse met tout d'abord en jeu deux couplages consécutifs
chimiosélectifs de type Suzuki (C15-C16-C17). Après saponification de l'ester,
l'amide final D2 est formé par des méthodes classiques d'activation des acides
carboxyliques (schéma 14). Les intermédiaires de type C5 et les produits de
formule
(I) de formule le sont également accessibles par cette voie de synthèse.
~ -- -----
O, OH
R3 Pd(PPh3)4 Cs2CO3 Pd(PPh3)4 Cs2CO3
dioxanne/eau dioxanne/eau N
::CI micro-onde 120 C 1 h / micro-onde 140 C 1 h NV / /
N et R3 R3
o
N H Bo N N~B'o N
0 0
Cl H N puis NaOH :.#, H N
0 1 ) SOCI2
Pd(PPh3)4 Cs2CO3 B reflux
dioxanne/eau N o ou HATU DMF
micro-onde 140 C 1 h puis NaOH
2 ) Amine
OH CH2CI21 25 C
0
Ra
N N
R3
R3
N
N N
H N N
-------------------------------------------------------------------------------
-------------------------------------------------------------------------------
--------------------------------------------------------------
Schéma 14
La présente invention a ainsi notamment pour objet un procédé de synthèse des
produits de formule (Id) tels que définis ci-dessus, décrit dans le schéma 14.
L'introduction de groupement alkoxy en position 3 (intermédiaire C18) est
effectuée
à partir du dérivé 3-bromo-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine
obtenu
par action du dibrome dans l'acide acétique sur le 6-(pyridin-3-yl)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridine. Par exemple un motif méthoxy ou éthoxyméthoxy peut être
introduit en présence d'iodure de cuivre (I) (schéma 15).
WO 2010/109084 33 PCT/FR2009/052330
----
Cul, DMF
'= Br2 N%N\ RONa, ROH N
Schéma 15
Les étapes suivantes, à savoir l'introduction de l'atome d'iode en position 4
ainsi que
la formation de la chaine phénylcarboxamido sont identiques à celles décrites
plus
haut (C18- C2- C3- C6-Ic avec R3 = alcoxy).
La présente invention a également pour objet à titre de médicaments, les
produits de
formule (I) telle que définie ci-dessus, ainsi que leurs prodrogues, lesdits
produits de
formule (I) étant sous toutes les formes isomères possibles racémiques,
énantiomères et diastéréo-isomères, ainsi que les sels d'addition avec les
acides
minéraux et organiques ou avec les bases minérales et organiques
pharmaceutiquement acceptables desdits produits de formule (I).
La présente invention a notamment pour objet à titre de médicaments les
produits de
formule (I) tels que définis ci-dessus dont les noms suivent :
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-(1 H-
tétrazol-5-
ylméthyl)benzamide
- [(3R)-3-(diméthylamino)pyrrolidin-1-yl]{4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridin-4-yl]phényl}méthanone
- {4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-
yl]phényl}[(3aS,6aS)-
5-méthylhexahydropyrrolo[3,4-b]pyrrol-1(2H)-yI]méthanone
- N-[2-(acétylamino)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-
4-yl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-[3-
(2-
oxopyrrolidin-1-yl)propyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
(phénylamino)éthyl]benzamide
- N-[(1-éthylpyrrol idin-2-yl)méthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzamide
WO 2010/109084 34 PCT/FR2009/052330
- N-[3-(diméthylamino)-2,2-diméthylpropyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridin-4-yl]benzamide
- N-{[(2S)-1-éthylpyrrol idin-2-yl]méthyl}-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridin-4-yl]benzamide
- N-(1-éthylpipéridin-3-yl)-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-
4-yl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
(2-
méthylpipéridin-1-yl)éthyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-(1-
méthylazétidin-3-yl)benzamide
- [3-(diméthylamino)pipéridin-1-yl]{4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol
o[2,3-b:5,4-
c']dipyridin-4-yl]phényl}méthanone
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
méthyl-2-
(pyrrolidin-1-yl)propyl]benzamide
- N-[3-(diméthylamino)propyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]-N-méthylbenzamide
- N-[2-(azépan-1-yl)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-
4-yl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-(1-
méthylpipéridin-4-yl)éthyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-{2-
[(méthylsulfonyl)amino]éthyl}benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
(pyrrolidin-1-
yl)propyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-
méthyl-N-[(1-
méthylpipéridin-2-yl)méthyl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
(1-
méthyl pyrrol idin-2-yl)éthyl]benzamide
- N-[2-(dipropan-2-ylamino)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
WO 2010/109084 35 PCT/FR2009/052330
- N-[2-(diméthylamino)éthyl]-N-éthyl-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzamide
- N-[1-(diméthylamino)propan-2-yl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- [(3S)-3-(diméthylamino)pyrrolidin-1-yl]{4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrol o[2,3-
b:5,4-c']dipyridin-4-yl]phényl}méthanone
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-
méthyl-N-(1-
méthyl pyrrol idin-3-yl)benzamide
- N-[2-(diéthylamino)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]-N-méthylbenzamide
- {4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-
yl]phényl}[4-(2-
méthoxyéthyl)pipérazin-1-yl]méthanone
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-[(3-
méthyl-1 H-
pyrazol-4-yl)méthyl]benzamide
- {4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-
yl]phényl}(2-
méthyloctahydro-5H-pyrrolo[3,4-c]pyridin-5-yl)méthanone
- N-[4-(diméthylamino)butyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-(1 H-
imidazol-2-
ylméthyl)benzamide
- {4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-
yl]phényl}(7-méthyl-
2,7-diazaspiro[4.4]non-2-yl)méthanone
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
(pyridin-2-
ylamino)éthyl]benzamide
- N-éthyl-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-
N-[(1-
méthyl pyrrol idin-3-yl)méthyl]benzamide
- 1,3'-bipyrrol idin-l'-yl{4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-
yl]phényl}méthanone
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-
méthyl-N-(1-
méthylpipéridin-4-yl)benzamide
WO 2010/109084 36 PCT/FR2009/052330
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-[(2-
hydroxypyridin-4-yl)méthyl]benzamide
- N-[2-(éthylamino)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-
4-yl]benzamide
- 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]-N-[2-
(méthylamino)éthyl]benzamide
- N-[(1-ami nocyclopropyl)méthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- N-(3-a mino-2,2-difluoropropyl)-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- N-(2-amino-3,3,3-trifluoro-2-méthylpropyl)-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 R,2R)-2-aminocyclohexyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrol o[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-aminocyclohexyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-aminocyclopentyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- N-[(1 R,2R)-2-aminocyclopentyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-(4-
méthylpipérazin-1-yl)benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-(1-
méthylpipéridin-4-yl)benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(3R)-3-hydroxypyrrolid in-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-{2-
[(3S)-3-hydroxypyrrolid in-1-yl]éthyl}benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]-N-(2-
hydroxyéthyl)benzamide
WO 2010/109084 37 PCT/FR2009/052330
- N-[(1 S ,2S)-2-am inocyclohexyl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-
9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-(diéthylamino)cyclohexyl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-
4-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- N-[(1 S,2S)-2-(éthylamino)cyclohexyl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
- 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-
yl]benzamide
- 4-[6-(5-chloro-1-méthyl-1 H-pyrazol-4-yl)-3-fluoro-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-
yl]-N-(4-méthylpipérazin-1 -yl)benzamide
- 4-[6-(5-chloro-1-méthyl-1 H-pyrazol-4-yl)-3-fluoro-9H-pyrrol o[2,3-b:5,4-
c']dipyridin-4-
yl]-N-(1-méthylpipéridin-4-yl)benzamide
- N-[2-(diméthylamino)éthyl]-4-[3-(2-méthoxyéthoxy)-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridin-4-yl]benzamide
- N-[2-(diméthylamino)éthyl]-5-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]pyridine-2-carboxamide
- N-[2-(diméthylamino)éthyl]-2-fluoro-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzamide
lesdits produits de formule (I) étant sous toutes les formes isomères
possibles
racémiques, énantiomères et diastéréo-isomères, ainsi que les sels d'addition
avec
les acides minéraux et organiques ou avec les bases minérales et organiques
pharmaceutiquement acceptables desdits produits de formule (I).
La présente invention a également pour objet les compositions pharmaceutiques
contenant en tant que principe actif, un composé selon l'une quelconque des
revendications précédentes ainsi qu'au moins un excipient pharmaceutiquement
compatible.
La présente invention a également pour objet les compositions pharmaceutiques
selon la revendication précédente utilisées pour le traitement du cancer.
Ainsi, selon un autre de ses aspects, la présente invention concerne des
compositions pharmaceutiques comprenant, en tant que principe actif, un
composé
selon l'invention. Ces compositions pharmaceutiques contiennent une dose
efficace
WO 2010/109084 38 PCT/FR2009/052330
d'au moins un composé selon l'invention, ou un sel pharmaceutiquement
acceptable,
du dit composé, ainsi qu'au moins un excipient pharmaceutiquement acceptable.
Les dits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration souhaité parmi les excipients habituels qui sont connus de
l'Homme
du métier.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration orale, sublinguale, sous-cutanée, intramusculaire, intra-
veineuse, le
principe actif de formule (I) ci-dessus, ou son sel, peut être administré sous
forme
unitaire d'administration, en mélange avec des excipients pharmaceutiques
classiques, aux animaux et aux êtres humains pour le traitement des troubles
ou des
maladies ci-dessus.
Les formes unitaires d'administration appropriées comprennent les formes par
voie
orale telles que les comprimés, les gélules molles ou dures, les poudres, les
granules et les solutions ou suspensions orales, les formes d'administration
sublinguale, buccale, sous-cutanée, intramusculaire ou intraveineuse.
Ces médicaments trouvent leur emploi en thérapeutique, notamment dans le
traitement des cancers sensibles à la dérégulation des kinases PIM.
Les inhibiteurs des kinases Pim objets de la présente invention sont utiles
pour le
traitement du cancer. Dans la mesure où le cancer reste une maladie pour
laquelle
les traitements existants sont insuffisants, il est manifestement nécessaire
d'identifier
de nouveaux inhibiteurs des kinases Pim qui sont efficaces pour le traitement
du
cancer.
La présente invention, selon un autre de ses aspects, concerne également une
méthode de traitement des pathologies ci-dessus indiquées qui comprend
l'administration, à un patient, d'une dose efficace d'un composé selon
l'invention, ou
un de ses sels pharmaceutiquement acceptables.
Les exemples suivants décrivent la préparation de certains composés conformes
à
l'invention. Ces exemples ne sont pas limitatifs et ne font qu'illustrer la
présente
invention. Les numéros des composés exemplifiés renvoient à ceux donnés dans
le
tableau ci-après, qui illustre les structures chimiques et les propriétés
physiques de
quelques composés selon l'invention.
Parmi les exemples de préparation des produits de formule I tels que définis
ci-
dessus, certains exemples constituent des produits de formule I tels que
définis ci-
dessus ou encore des intermédiaires de synthèse permettant d'obtenir les dits
produits de formule I, comme défini ci-après :
WO 2010/109084 39 PCT/FR2009/052330
Les exemples 7, 9, 10, 11, 12, 13, 14, 15, 16, 17, 19, 20, 21, 22, 23, 24, 25,
26, 27,
28, 37, 38, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59,
60, 61, 62,
63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81,
82, 83, 84,
85, 86, 87, 88, 89, 90, 91, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108,
109, 112,
113, 120 constituent les produits de formule I
Les composés Al, A2 et A3 constituent les intermédiaires de synthèse de
formule
An
M ou X
CI
N ' R
`
dans lesquels X, M et R ont les définitions indiquées dans le schéma général
Les exemples 1, 29, 39, 92, 114 constituent les intermédiaires de synthèse de
formule Bn
H 2 N N
R
R3
N R4
CI
dans lesquels R et R4 ont les définitions indiquées dans le schéma général
Les exemples 2, 3, 4, 5, 6, 8, 18, 30, 31, 32, 33, 34, 35, 36, 40, 41, 42, 43,
93, 94, 95,
96, 97, 98, 110, 111, 115, 116, 117, 118, 119 constituent les intermédiaires
de
synthèse de formule Cn
R R4 R3
N\
N N
C ' H ouGP
dans lesquels R, R3, R4 et GP ont les définitions indiquées dans le schéma
général
Ainsi X, M, R, R3, R4 et GP représentent les définitions indiquées dans la
préparation des exemples selon la présente invention et notamment ci-dessous :
WO 2010/109084 40 PCT/FR2009/052330
----------- -------------------------------------------------------------------
------------------------------------------
X = Br ou l o
M = SnMe3 ou B(OH)2 ou HB T
0
R = CI, -OMe, -OH, -OSO2CF3
R4 = H, I, -OMe, -OH, OSO2CF3 COZMe Co2H
GP : groupe protecteur tosyle, SEM,
Piv, Ac,
La présente invention a ainsi notamment pour objet, à titre de produits
industriels
nouveaux, les intermédiiares de synthèse des produits de formule (I) décrits
dans les
schémas ci-dessus général et 1 à 15.
La présente invention a ainsi pour objet à titre de produits industriels
nouveaux, les
intermédiaires de synthèse de formules An, Bn et Cn tels que définis dans le
schéma général ci-dessus et ci-après :
La présente invention a ainsi notamment pour objet, à titre de produits
industriels
nouveaux, les intermédiiares de synthèse des produits de formule An décrits
dans
les schémas ci-dessus :
La présente invention a ainsi notamment pour objet, à titre de produits
industriels
nouveaux, les intermédiiares de synthèse des produits de formule Bn décrits
dans
les schémas ci-dessus :
La présente invention a ainsi notamment pour objet, à titre de produits
industriels
nouveaux, les intermédiiares de synthèse des produits de formule Cn décrits
dans
les schémas ci-dessus
GENERALITES :
Abréviations :
1 H NMR : résonance magnétique nucléaire du proton
DAD : détecteur à balayage de longueur d'onde
DCM : dichlorométhane
DME : 1,2-diméthoxyéthane
DMF : diméthylformamide
DMSO : diméthylsulfoxyde
ELSD : détecteur à diffusion de lumière
HATU : O-(7-Azabenzotriazol-1-yl)-N,N,N',N'-tetra-methyluronium
hexafluorophosphate
HPLC, UPLC : chromatographie liquide haute performance
WO 2010/109084 41 PCT/FR2009/052330
LC : chromatographie liquide
LDA : diisopropylamidure de lithium
LiTMP : amidure de lithium de la 2,2,6,6-tétraméthylpipéridine
MS : spectrométrie de masse
THF : tétrahydrofuranne
Tr : temps de rétention
- Toutes les réactions sont effectuées avec des solvants anhydres de la gamme
Acros Organics AcroSeal. Les solvants utilisés pour les extractions et les
chromatographies proviennent de chez SDS. Les réactions sous micro-ondes sont
effectuées sur un appareil Biotage ou CEM. Les purifications sur gel de silice
sont
effectuées en utilisant des cartouches de silice VWR-MERCK (Silica gel 60 15-
40pm). Les purifications HPLC préparatives sont effectuées sur des colonnes
Macherey-Nagel (phase NUCLEODUR C18) ou d'autres phases (Chiralcel OD-I ou
OJ-H ou AS-H, Chiralpak, Kromasil C,8) avec des éluants appropriés.
- Analyse LC-MS-DAD-ELSD : 2 conditions expérimentales possibles :
O Analyse LC-MS-DAD-ELSD: MS=Waters ZQ; electrospray mode +/-; domaine de
masse m/z=100-1200; LC= Agilent HP 1100; colonne LC= X Bridge 18 C Waters
3.0 x 50 mm -2,5 pm; four LC=60 C; débit =1,1 ml/min.
Eluants : A=Eau + 0,1 % Acide formique B=Acétonitrile, avec le gradient
suivant :
Temps A% B%
0.0 95 5
5.0 0 100
5.5 0 100
6.5 95 5
7.0 95 5
Analyse LC-MS-DAD-ELSD : MS=Platform Il Waters Micromass; electrospray
domaine de masse m/z=100-1100; LC Alliance 2695 Waters; colonne X Terra 18C
Waters 4.6 mm x 75 mm - 2,5 pm; four LC=60 C; débit=1.0 ml/min.
Eluants : A=Eau + 0,1 % Acide formique B= Acétonitrile, avec le gradient
suivant :
Temps A% B%
0 95 5
6.0 5 95
8.0 5 95
9.0 95 5
13.0 95 5
WO 2010/109084 42 PCT/FR2009/052330
- Analyse UPLC-MS-DAD-ELSD : 2 conditions expérimentales possibles :
O Analyse UPLC-MS-DAD-ELSD :MS=Quattro Premier XE Waters; electrospray +/-
; domaine de masse m/z=100-1100; UPLC Waters; colonne Acquity UPLC BeH C18
2,1 mm x 50 mm - 1,7 pm; four UPLC=70 C; débit=0,7 ml/min.
Eluants: A= Eau +0,1% Acide formique B=Acétonitrile + 0 ,1 % Acide formique,
avec
le gradient :
Temps A% B%
0 95 5
5 0 100
5.5 95 5
6.0 95 5
O Analyse UPLC-MS-DAD-ELSD :MS=SQD Waters; electrospray+/-; domaine de
masse m /z=100-1 100; UPLC-Waters; colonne Acquity UPLC Beh C18 2,1 mm x 50
mm - 1,7 m; four UPLC=70 C; débit =1 ml/min.
Eluants: A= Eau + 0,1% Acide formique B=Acétonitrile + 0 ,1 % Acide formique,
avec le gradient :
Temps A% B%
0 95 5
0.8 50 50
1.2 0 100
1.85 0 100
1.95 95 5
2.00 95 5
Pour la détection :
DAD longueur d'onde considérée A=210-400 nm
ELSD : Sedere SEDEX 85 ; température de nébulisation=35 C ; pression de
nébulisation =3,7 bars
N.B : En fonction des structures analysées les solvants de dilution sont :
diméthylsulfoxyde ; méthanol ; acétonitrile ; dichlorométhane.
EXEMPLES
5-chloro-4-(triméthylstannanyl)-2,3'-bipyridine Al
WO 2010/109084 43 PCT/FR2009/052330
CI LDA, Me3SnCl SnMe3
THF, -78 C CI
/ I\
N I \ N
N Al N
Un mélange de 15 ml de diisopropylamine et 40 ml de tétrahydrofuranne est
refroidi
à -74 C puis sont ajoutés 64 ml de n-butyllithium 1,6 N dans l'hexane en 20
min en
maintenant la température inférieure à -70 C. Au mélange réactionnel, sont
ajoutés
16,2 g de 2-(3'-pyridyl)-5-chloropyridine préparé selon la référence Journal
of the
Chemical Society, Perkin Transactions 1, 2002, 16, 1847-1849 en solution dans
170
ml de tétrahydrofuranne en maintenant toujours la température inférieure à -70
C.
Le mélange est agité à -74 C pendant 1 h 30 min puis sont ajoutés
progressivement
19,47 g de chlorure de triméthylétain dissous dans 100 ml de tétrahydrofuranne
en
maintenant la température inférieure à -70 C. Le mélange réactionnel est
agité de
nouveau 1 h à une température inférieure à -72 C puis sont ajoutés 100 ml
d'eau.
Le mélange revenu à température ambiante est versé sur 300 ml d'eau et 100 ml
de
solution aqueuse saturée d'hydrogénocarbonate de potassium puis extrait par 2
fois
400 ml d'acétate d'éthyle. Les phases organiques réunies sont concentrées à
sec
sous pression réduite puis le résidu est purifié sur cartouche VARIAN SCX en
éluant
par du méthanol pur puis du méthanol ammoniacal 2 N puis par chromatographie
sur colonne de silice en éluant par un mélange heptane : acétate d'éthyle 100
/ 0 à
50 / 50 pour donner 19,22 g de 5-chloro-4-(triméthylstannanyl)-2,3'-bipyridine
Al
sous forme de poudre beige.
UPLC-MS-DAD-ELSD : Tr (min)=4,29; [M+H]+: m/z 355 ; pureté : 98%
1 H NMR (400 MHz, DMSO-d6) : ppm 0.45 (s, 9 H) 7.52 (dd, J=7.6, 5.1 Hz, 1 H)
7.94
(d, J=1.0 Hz, 1 H) 8.40 (dt, J=7.9, 2.1 Hz, 1 H) 8.63 (s, 1 H) 8.64 - 8.66 (m,
1 H) 9.22
(d, J=2.4 Hz, 1 H)
Exemple 1 : 5'-chloro-5"-fluoro-3,2':4',3"-terpyridin-2"-amine
SnMe3 Pd(PPh3)4
CI Cul dioxanne HZN N
micro-onde 120 C l h
F I Br N CI
Al N NH2 1
WO 2010/109084 44 PCT/FR2009/052330
Un mélange de 10 g de 2-amino-3-bromo-5-fluoropyridine, 19,2 g de 5-chloro-4-
(triméthylstannanyl)-2,3'-bipyridine Al, 4,24 g de
tetrakis(triphenylphosphine)palladium(0) et 2,095 g d'iodure de cuivre (I)
dans 120
ml de 1,4-dioxanne est porté au reflux 18 heures. Le milieu réactionnel est
traité par
une solution aqueuse d'hydrogénocarbonate de sodium à 10% puis dilué à
l'acétate
d'éthyle. Après décantation, la phase aqueuse est extraite deux fois à
l'acétate
d'éthyle. Les phases organiques réunies sont séchées sur sulfate de sodium
anhydre, filtrées et concentrées sous pression réduite. Le résidu est repris
dans un
mélange de dichlorométhane et de méthanol, puis est essoré pour donner 11,67 g
de 5'-chloro-5"-fluoro-3,2':4',3"-terpyridin-2"-amine sous forme d'un solide
beige.
Le filtrat est concentré sous pression réduite puis repris dans le
dichlorométhane et
additionné de silice. Après concentration sous pression réduite, le dépôt est
purifié
par chromatographie sur colonne de silice en éluant par un mélange
dichlorométhane / méthanol 98 / 2 à 90 / 10 pour donner 1,98 g de 5'-chloro-5"-
fluoro-3,2':4',3"-terpyridin-2"-amine sous forme d'un solide beige.
UPLC-MS-DAD-ELSD : Tr (min)=2,71 ; [M+H]+: m/z 301 ; pureté : 95%
1 H NMR (400 MHz, DMSO-d6):ppm : 5.78 (s, 2 H) 7.47 (dd, J=8.8, 2.9 Hz, 1 H)
7.55
(br. s., 1 H) 8.06(s, 1 H) 8.12 (s, 1 H) 8.49 (d, J=7.8 Hz, 1 H) 8.68 (br. s.,
1 H) 8.84 (s,
1 H) 9.35 (br. s., 1 H)
Exemple 2 : 3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine
Pd(OAc)2, Josiphos N
HZN N tBuOK, dioxanne
N 100 C 1 nuit F
F
1 ci 2 N N
"
Dans un réacteur de 100 ml, on place 1,574 g de (R)-(-)-1-[(S)-2-
(dicyclohexylphosphino)ferrocenyl]ethylditerbutylphosphine et 0,558 g
d'acétate de
palladium (11) dans 40 ml de 1,4-dioxanne anhydre sous atmosphère d'argon et
agite
10 min à 40 C.
Dans un réacteur de 500 ml, on place sous argon 11,6 g de 5'-chloro-5"-fluoro-
3,2':4',3"-terpyridin-2"-amine dans 160 ml de 1,4-dioxanne anhydre et ajoute
la
WO 2010/109084 45 PCT/FR2009/052330
solution préparée précédemment puis 5,97 g de terbutylate de potassium. Le
mélange réactionnel est porté au reflux 18 h. Le mélange est dilué par un
mélange
dichlorométhane / méthanol 71 : 29 puis est filtré sous vide. Après
concentration
sous pression réduite, le dépôt est purifié par chromatographie sur colonne de
silice
en éluant par un mélange dichlorométhane / méthanol 98 / 2 à 92 / 8 pour
donner
6,5 g de 3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine sous
forme d'un
solide brun.
UPLC-MS-DAD-ELSD : Tr (min)=0,42 ; [M+H]+ : m/z 265; [M-H]- : m/z 263; pureté
:
98%
1 H NMR (400 MHz, DMSO-d6) : ppm 7.54 (ddd, J=8.0, 4.7, 0.7 Hz, 1 H) 8.48 (dt,
J=7.8, 2.0 Hz, 1 H) 8.60 (dd, J=4.6, 1.5 Hz, 1 H) 8.65 (s, 1 H) 8.65 - 8.68
(m, 1 H)
8.90 (d, J=1.2 Hz, 1 H) 9.05 (d, J=1.2 Hz,1 H) 9.34 (d, J=1.5 Hz, 1 H) 12.39
(br. s., 1
H)
Exemple 3 : 3-fluoro-9-[(4-méthylphényl)sulfonyl]-6-(pyridin-3-yl)-9H-
pyrro l o[2,3 -b: 5, 4-c'] d i pyri d î ne
N N
TsCI, NaH F
F DMF
N~ N N
N N
2 Fi 3 SO2ToI
Dans un réacteur de 250 ml, on place sous argon 3,20 g de 3-fluoro-6-(pyridin-
3-yl)-
9H-pyrrolo[2,3-b:5,4-c']dipyridine dans 80 ml de diméthylformamide et 0,847g
d'hydrure de sodium à 60 % dans l'huile. Après 3 h d'agitation à température
ambiante sont ajoutés 4,61 g de chlorure de paratoluènesulfonyle dissous dans
20
ml de diméthylformamide. Le milieu réactionnel est agité 3 h à température
ambiante
puis traité par une solution aqueuse d'hydrogénocarbonate de sodium à 10 %
puis
dilué à l'acétate d'éthyle. Après décantation, la phase aqueuse est extraite
deux fois
à l'acétate d'éthyle. Les phases organiques réunies sont lavées à l'eau puis
séchées
sur sulfate de magnésium anhydre, filtrées et concentrées sous pression
réduite. Le
résidu est purifié par chromatographie sur colonne de silice en éluant par un
mélange dichlorométhane / méthanol 100 / 0 à 95 / 5 pour donner 4,75 g de 3-
fluoro-
9-[(4-méthylphényl)sulfonyl]-6-(pyridin-3-yl)-9H-pyrrol o[2,3-b:5,4-
c']dipyridine.
WO 2010/109084 46 PCT/FR2009/052330
UPLC-MS-DAD-ELSD : Tr (min)=0,90; [M+H]+ : m/z 419 ; pureté : 98 %
1 H NMR (400 MHz, DMSO-d6) ppm : 2.32 (s, 3 H) 7.39 (d, J=8.1 Hz, 2 H) 7.59
(dd,
J=8.1, 4.6 Hz, 1 H) 8.03 (d, J=8.6 Hz, 2 H) 8.51 (dt, J=8.0, 2.0 Hz, 1 H) 8.67
(dd,
J=4.8, 1.6 Hz, 1 H) 8.73 (dd, J=8.3, 2.9
Hz, 1 H) 8.78 (dd, J=2.9, 1.2 Hz, 1 H) 8.98 (d, J=0.5 Hz, 1 H) 9.36 (d, J=1.7
Hz, 1 H)
9.70 (d, J=0.7 Hz,1 H)
Exemple 4: 3-fluoro-9-[(4-méthylphényl)sulfonyl]-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridine
N 1 ) LDA, THF N
-78 C
F 2-)12 F
N~ N~
N N N N
I I
3 SOZToI 4 SOZToI
Dans un ballon, on charge 0,43 ml de diisopropylamine dans 10 ml de
tétrahydrofuranne. Après agitation et refroidissement à -78 C, on ajoute 1,15
ml de
n-butyllithium 2,5 N dans l'hexane. Le mélange réactionnel est agité 15 min à -
78 C
puis est ajouté 0,800 g de 3-fluoro-9-[(4-méthylphényl)sulfonyl]-6-(pyridin-3-
yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridine dans 50 ml de tétrahydrofuranne. Après 2 h
d'agitation
à -78 C, on ajoute 0,776 g d'iode dans 5 ml de tétrahydrofuranne. Après 1 h
d'agitation, le mélange réactionnel est coulé dans 150 ml d'une solution
aqueuse de
chlorure d'ammonium à 10 % et 50 ml d'eau, extrait par deux fois avec 150 ml
d'acétate d'éthyle. Les phases organiques sont lavées par une solution aqueuse
de
thiosulfate de sodium à 5 %, séchées sur sulfate de sodium, filtrées et
concentrées à
sec sous pression réduite. On obtient 1,03 g de 3-fluoro-4-iodo-9-[(4-
méthylphényl)sulfonyl]-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine.
UPLC-MS-DAD-ELSD : Tr (min)=1,05 ; [M+H]+ : m/z 545 ; pureté : 66 %
1H NMR (400 MHz, DMSO-d6) ppm : 2.33 (s, 3 H) 7.40 (d, J=8.1 Hz, 2 H) 7.60
(dd,
J=7.8, 4.6 Hz, 1 H) 8.05 (d, J=8.3 Hz, 2 H) 8.47 (dt, J=7.9, 2.0 Hz, 1 H) 8.65
(s, 1 H)
8.69 (dd, J=4.8, 1.6 Hz, 1 H) 9.19 (s, 1 H) 9.29 (d, J=2.0 Hz, 1 H) 9.79 (s, 1
H)
WO 2010/109084 47 PCT/FR2009/052330
Exemple 5 : 4-{3-fluoro-9-[(4-méthylphényl)sulfonyl]-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl}benzoate de méthyle
O-
N O
Pd(PPh3)4
F Cs2CO3 oNI / N N
4 5 1
so2Tol
Dans un réacteur, on place 800 mg de 3-fluoro-4-iodo-9-[(4-
méthylphényl)sulfonyl]-
6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine, 847 mg de 4-
methoxycarbonylphenylboronic acid pinacol ester, 170 mg de
tetrakis(triphenylphosphine)palladium(0), 718 mg de carbonate de césium dans
12
ml de 1,4-dioxanne et 3 ml d'eau, scelle le tube et soumet à irradiation
microonde à
120 C pendant 1 h. Au milieu réactionnel sont ajoutés 3 ml de méthanol et 100
ml
d'eau puis celui-ci est extrait par 5 fois 150 ml d'acétate d'éthyle. Les
phases
organiques sont réunies, séchées sur sulfate de sodium, filtrées et
concentrées à
sec sous pression réduite. Le résidu est purifié par chromatographie sur
colonne de
silice en éluant par un mélange dichlorométhane / méthanol 100 / 0 à 97 / 3
pour
donner 793 mg de 4-{3-fluoro-9-[(4-méthylphényl)sulfonyl]-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl}benzoate de méthyle.
UPLC-MS-DAD-ELSD : Tr (min)=1,10 ; [M+H]+: m/z 553 ; pureté : 40 %
1H NMR (400 MHz, DMSO-d6) ppm : 2.35 (s, 3 H) 3.95 (s, 3 H) 7.44 (d, J=7.8 Hz,
2
H) 7.47 - 7.52 (m,2 H) 7.87 (d, J=7.8 Hz, 2 H) 8.12 (d, J=8.3 Hz, 2 H) 8.13 -
8.17 (m,
1 H) 8.26 (d, J=8.3 Hz, 2 H) 8.59 (dd, J=4.9, 1.5 Hz, 1 H) 8.86 (d, J=2.4 Hz,
1 H)
8.89 (d, J=1.5 Hz, 1 H) 9.77 (s, 1 H)
Exemple 6 : acide 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-
yl]benzoïque
WO 2010/109084 48 PCT/FR2009/052330
O- OH
O O
F UGH \ / F
MeOH/THF/eau
N~ N N~ N
N H 6 N H
Dans un ballon, on place 790 mg de 4-{3-fluoro-9-[(4-méthylphényl)sulfonyl]-6-
(pyridin-3-yl)-9 H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl}benzoate de méthyle
dans 10 ml
5 de méthanol et 20 ml de tétrahydrofuranne puis 479 mg d' hydroxyde de
lithium
dissous dans 15 ml d'eau. Le mélange réactionnel est agité 2 h à température
ambiante puis sont ajoutés 30 ml d'eau et 10 ml de solution aqueuse d'acide
chlorhydrique 2 M. Le précipité est essoré et séché sous vide pour donner 340
mg
d'acide 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-
yl]benzoïque.
UPLC-MS-DAD-ELSD : Tr (min)=0,56 ; [M+H]+ : m/z 385; [M-H]- : m/z 383 ; pureté
:
95%
1 H NMR (400 MHz, DMSO-d6), ppm : 7.48 (dd, J=7.6, 4.9 Hz, 1 H) 7.68 (s, 1 H)
7.91 (d, J=8.1 Hz, 2 H) 8.17 (d, J=8.1 Hz, 1 H) 8.27 (d, J=8.3 Hz, 2 H) 8.54
(d, J=4.4
Hz, 1 H) 8.78 (d, J=2.2 Hz, 1 H) 8.92 (s, 1 H) 9.09 (s, 1 H) 12.65 (s, 1 H)
13.24 (br. s.,
1 H)
Exemple 7 : 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-
yl]-N-
(4-méthylpipérazin-1-yl)benzamide
OH H N
O N-N J
O
F 1 ) SOCI2, reflux
F
W\ 2 ) CH2CI2 -N N-NH2
N \ \ \ N
N N
6 H 7 N N
H
Dans un ballon, un mélange de 150 mg d'acide 4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzoique et de 928 mg de chlorure de
thionyle est
chauffé au reflux pendant 12 h puis évaporé sous pression réduite. Au résidu
sont
ajoutés 450 mg de 1-amino-4-méthylpipérazine dissous dans 5 ml de
WO 2010/109084 49 PCT/FR2009/052330
dichlorométhane. Après 1 h d'agitation à température ambiante, le mélange
réactionnel est évaporé sous pression réduite, repris dans le dichlorométhane
et
additionné de 150 g de silice. Le dépôt est concentré sous pression réduite
puis est
purifié par chromatographie sur colonne de silice en éluant par un mélange
dichlorométhane / méthanol 98 / 2 à 90 / 10 pour donner 34 mg de 4-[3-fluoro-6-
(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]-N-(4-méthylpipérazin-1-
yl)benzamide.
UPLC-MS-DAD-ELSD : Tr (min)=0,38 ; [M+H]+ : m/z 482 ; [M-H]- : m/z 480 ;
pureté :
98%
1H NMR (400 MHz, DMSO-d6), ppm: 2.21 (s, 3 H) 2.41 - 2.48 (m, 4 H) 2.96 (t,
J=4.6 Hz, 4 H) 7.46 (dd, J=8.1, 4.6 Hz, 1 H) 7.67 (s, 1 H) 7.85 (d, J=8.3 Hz,
2 H)
8.10 (d, J=8.3 Hz, 2 H) 8.12 - 8.16 (m, 1 H)
8.54 (dd, J=4.6, 1.2 Hz, 1 H) 8.77 (d, J=2.4 Hz, 1 H) 8.92 (d, J=2.0 Hz, 1 H)
9.09 (s,
1 H) 9.63 (s, 1 H) 12.62 (br. s., 1 H)
Exemple 8 : 3-fluoro-4-iodo-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridine
N N
I
F LiOH F
N N MeOH/THF/eau N/ N
4 s'IO2Toi 8 H
Dans un ballon, on place 2,2 g de 3-fluoro-4-iodo-9-[(4-méthylphényl)sulfonyl]-
6-
(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine dans 50 ml de méthanol et
100 ml de
tétrahydrofuranne puis 2,1 g d' hydroxyde de lithium dissous dans 100 ml
d'eau. Le
mélange réactionnel est agité 3 heures à température ambiante puis sont
ajoutés
200 ml d'eau et une solution aqueuse d'acide chlorhydrique 2 M jusqu'à pH 6.
Le
précipité est essoré et séché sous vide pour donner 1,16 g de 3-fluoro-4-iodo-
6-
(pyri d i n-3-yl)-9 H-pyrrol o[2, 3-b:5, 4-c']d i pyri d i n e.
UPLC-MS-DAD-ELSD : Tr (min)= 2,91 ; [M+H]+ : m/z 391 ; [M-H]- : m/z 389 ;
pureté : 98%
WO 2010/109084 50 PCT/FR2009/052330
1H NMR (400 MHz, DMSO-d6) : ppm 7.56 (dd, J=8.1, 4.6 Hz, 1 H) 8.43 (dt, J=7.8,
2.0 Hz, 1 H) 8.56 (s,1 H) 8.62 (dd, J=4.6, 1.2 Hz, 1 H) 9.09 (s, 1 H) 9.11 (s,
1 H) 9.27
(d, J=2.0 Hz, 1 H) 12.63 (br. s., 1 H)
Exemple 9 : N-[2-(diméthylamino)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b: 5,4-c']dipyridin-4-yl]benzami de
-N
Pd(PPh3)4 0
N Dioxanne eau H
F cs2c03
F
H O N \ \ /
N N NN B
o o
H N
8 9 N N
H
Dans un réacteur de 20 ml, on place 1,1 g de 3-fluoro-4-iodo-6-(pyridin-3-yl)-
9H-
pyrrolo[2,3-b:5,4-c']dipyridine, 1,9 g N-(2-dimethylaminoethyl)-4-(4,4,5,5-
tetramethyl-
1,3,2-dioxaborolan-2-yl)benzamide, 326 mg de
tetrakis(triphenylphosphine)palladium(0), 1,84 g de carbonate de césium dans
15 ml
de 1,4-dioxanne et 2,5 ml d'eau, scelle le tube et soumet à irradiation
microonde 1
heure à 130 C. Le mélange réactionnel est filtré puis versé sur 100 ml d'eau
et 250
ml d'acétate d'éthyle sous forte agitation. Après décantation, la phase
aqueuse est
extraite par 100 ml d'acétate d'éthyle et les phases organiques réunies sont
séchées
sur sulfate de magnésium, filtrées puis évaporées sous pression réduite. Le
résidu
est purifié par chromatographie sur colonne de silice en éluant par un mélange
dichlorométhane / méthanol / ammoniaque aqueux à 28 % 100 / 0 / 0 à 90 / 10 /
0,2 ;
le produit est mis en suspension dans 15 ml d'acétate d'éthyle. Après 16 h
sous forte
agitation à température ambiante, le solide est essoré sous vide pour donner
1,02 g
de N-[2-(diméthylamino)éthyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide.
UPLC-MS-DAD-ELSD : Tr (min)=0,41 ; [M+H]+ : 455 m/z ; [M-H]- : 453 m/z;
pureté : 95%
1H NMR (400 MHz, DMSO-d6) : ppm 2.22 (s, 6 H) 2.45 - 2.49 (m, 2 H) 3.44 (q,
J=6.5 Hz, 2 H) 7.46(dd, J=7.8, 4.6 Hz, 1 H) 7.68 (s, 1 H) 7.87 (d, J=8.1 Hz, 2
H) 8.11
WO 2010/109084 51 PCT/FR2009/052330
- 8.15 (m, 1 H) 8.16 (d, J=8.1 Hz, 2 H) 8.54 (dd, J=4.6, 1.5 Hz, 1 H) 8.61 (t,
J=5.6 Hz,
1 H) 8.77 (d, J=2.4 Hz, 1 H) 8.91 (d, J=2.0 Hz, 1 H) 9.08 (s, 1 H) 12.61 (br.
s., 1 H)
Exemple 10 : N-[3-(diméthylamino)propyl]-4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
N
Pd(PPh3)4 O
N Dioxanne / eau H
1 F Cs2co3
F
N N N -N `N \/ B O: N
8 H 10 N1 N
H
De façon analogue à l'exemple 9, l'exemple 10 est obtenu à partir de 150 mg de
3-
fluoro-4-iodo-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine et de 383 mg
de N-(3-
dimethylaminopropyl)-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)benzamide.
UPLC-MS-DAD-ELSD : Tr (min)= 2,21 ; [M+H]+ : m/z 469 ; [M-H]- : m/z 467 ;
pureté:
98%
1H NMR (400 MHz, DMSO-d6) : ppm 1.72 (quin, J=7.1 Hz, 2 H) 2.16 (s, 6 H) 2.31
(t,
J=7.1 Hz, 2 H) 3.35 - 3.41 (m, 2 H) 7.46 (dd, J=7.9, 4.8 Hz, 1 H) 7.68 (d,
J=1.1 Hz, 1
H) 7.87 (d, J=7.9 Hz, 2 H) 8.12 -8.15 (m, 1 H) 8.16 (d, J=8.3 Hz, 2 H) 8.53
(dd, J=4.6,
1.5 Hz, 1 H) 8.73 - 8.77 (m, 1 H) 8.77 (d, J=2.4Hz, 1 H) 8.91 (d, J=1.8 Hz, 1
H) 9.09
(d, J=0.9 Hz, 1 H) 12.62 (br. s., 1 H)
Exemples 11 à 17
Procédure générale pour les exemples 11 à 17:
R O
N Pd(PPh3)4 N
Cs2C03 R' -
F dioxanne/ eau
F
N N O OR" N1 -
g H R-N \ B OR" \ \ N
R' N / N
H
WO 2010/109084 52 PCT/FR2009/052330
Dans un réacteur, on place 0,2 mmol de 3-fluoro-4-iodo-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridine, 0,4 mmol de réactif boronique dans 2 ml de
1,4-
dioxanne, 0,4 mmol de carbonate de césium dans 0,5 ml d'eau, sous argon 0,02
mmol de tetrakis(triphenylphosphine)palladium(0) dans 0,5 ml de
diméthylformamide,
scelle le tube et mis sous agitation à 110 C pendant 18 h. Après
refroidissement, le
mélange réactionnel est dilué par 6 ml de 1,4-dioxanne, 2 ml de méthanol et
0,1 ml
d'acide trifluoroacétique puis traité par 150 mg de résine de type
propanethiol
greffée sur silice pendant 4 h à température ambiante. Le mélange réactionnel
est
filtré puis lavé 2 fois par un mélange 1,4-dioxanne / méthanol 4/1. Après
évaporation
sous pression réduite, le résidu est dissous dans 2 ml de diméthylformamide et
0,1
ml d'acide trifluoroacétique, filtré puis purifié par HPLC préparative.
Les amides 11 à 17 sont détaillés dans le tableau 1.
Tableau 1 :
Acide ou
ester Structure obtenue Nom Analyse
boronique
UPLC-MS-DAD-ELSD : Tr
(min)= 2,37 ; [M+H]+ : m/z
424,09 ; pureté : 100 %
1H NMR (400 MHz, DMSO-
d6) : 8 ppm 0.62 - 0.69 (m, 2
H O NH N-cyclopropyl- H) 0.72 - 0.81 (m, 2 H) 2.91 -
o~ N 4-[3-fluoro-6- 3.02 (m, 1 H)
\ (pyridin-3-yl)- 7.48 (dd, J=9.2, 4.6 Hz, 1 H)
N/ 9H-pyrrolo[2,3- 7.69 (s, 1 H) 7.87 (d, J=8.2 Hz,
b:5,4- 2 H) 8.16 (d, J=8.7 Hz, 2 H)
N c']dipyridin-4- 8.56 (d, J=6.1
N N yl]benzamide Hz, 1 H) 8.67 (d, J=4.8 Hz, 1
H H) 8.79 (d, J=2.5 Hz, 1 H)
8.93 (d, J=2.3 Hz, 1 H) 9.11 (s,
11 1 H) 12.63 (s, 1 H)
WO 2010/109084 53 PCT/FR2009/052330
UPLC-MS-DAD-ELSD : Tr
(min)= 2,10 ; [M+H]+: m/z
455,11 ; pureté : 100 %
1H NMR (400 MHz, DMSO-
N- N-[2- d6) : 8 ppm 2.84 (s, 6 H) 3.30
N N (diméthylamino) (t, J=5.2 Hz, 2 H) 3.61 - 3.71
f H éthyl]-3-[3- (m, 2 H) 7.58
HN fluoro-6- (dd, J=8.3, 5.0 Hz, 1 H) 7.78
o~ N F (pyridin-3-yl)- (s, 1 H) 7.91 (t, J=8.0 Hz, 1 H)
9H-pyrrolo[2,3- 8.03 (d, J=7.4 Hz, 1 H) 8.23
N (d, J=8.1 Hz, 1
N b:5,4-
N H) 8.31 (d, J=8.1 Hz, 1 H) 8.33
H c']dipyridin-4- (s, 1 H) 8.63 (d, J=3.8 Hz, 1 H)
12 yl]benzamide
8.86 (d, J=2.3 Hz, 1 H) 8.96 (t,
J=6.0 Hz, 1 H) 9.03 (br. s., 1
H) 9.17 (s, 1 H) 9.40 (br. s., 1
H) 12.75 (s, 1 H)
UPLC-MS-DAD-ELSD : Tr
o (min)= 2,55 ; [M+H]+ : m/z
N 454,07 ; pureté : 100 %
1H NMR (400 MHz,
0 _ {4-[3-fluoro-6-
N/ (pyridin-3-yl)- DMSOd6) : 8 ppm 3.63 - 3.78
N F 9H-pyrrolo[2,3- (m masqué, 8 H) 7.62 (dd,
o b:5,4- J=8.3, 5.2 Hz, 1 H) 7.74
N (s, 1 H) 7.78 (d, J=8.7 Hz, 2 H)
H N c ]dipyridin-4- yl]phényl}(morp 7.83 - 7.93 (m, J=8.2 Hz, 2 H)
holin-4- 8.35 (d, J=8.4 Hz, 1 H) 8.65
yI)méthanone (d, J=6.1 Hz,1 H) 8.81 (d,
13 J=2.3 Hz, 1 H) 8.99 (s, 1 H)
9.13 (s, 1 H) 12.69 (s, 1 H)
UPLC-MS-DAD-ELSD : Tr
(min)= 2,34 ; [M+H]+ : m/z
-0 H o 442,05 ; pureté : 100
1H NMR (400 MHz, DMSO-
o 4-[3-fluoro-6- d6) : 8 ppm 3.30 (s, 3 H) 3.46 -
(pyridin- ,3- 3.56 (m, 4 H) 7.73 (dd, J=8.0,
o NH N 9H-pyrrolo[2,3- 5.4 Hz, 1 H)
b:5,4- 7.81 (s, 1 H) 7.93 (d, J=8.4 Hz,
N c']dipyridin-4-yl]- N N_(2_
H méthoxyéthyl)b 2 H) 8.24 (d, J=8.6 Hz, 2 H)
N 8.43 (d, J=8.6 Hz, 1 H) 8.72
enzamide (d, J=4.3 Hz, 1 H) 8.82 (t, J=5.1
14 Hz, 1 H) 8.86 (d, J=2.5 Hz, 1
H) 9.11 (br. s., 1 H) 9.19 (s, 1
H) 12.77 (s, 1 H)
WO 2010/109084 54 PCT/FR2009/052330
UPLC-MS-DAD-ELSD : Tr
o (min)= 2,35; [M+H]+ : m/z
N0 454,07 ; pureté : 94 %
{3-[3-fluoro-6- 1H NMR (400 MHz, DMSO-
N/ (pyridin-3-yl)- d6) : 8 ppm 3.54 - 3.89 (m
o~ N _ F 9H-pyrrolo[2,3- masqué, 8 H) 7.70 (dd, J=8.2,
b:5,4- 4.8 Hz, 1 H) 7.73 -
c']dipyridin-4- 7.79 (m, 1 H) 7.80 - 7.94 (m, 4
H N yl]phényl}(morp H) 8.54 (d, J=7.9 Hz, 1 H) 8.68
holin-4- (br. s., 1 H) 8.83 (d, J=2.5 Hz,
yl)méthanone 1 H) 9.15
15 (s, 1 H) 9.20 (br. s., 1 H) 12.73
(s, 1 H)
UPLC-MS-DAD-ELSD : Tr
(min)= 2,05 ; [M+H]+ : m/z
467,12 ; pureté : 100 %
o {4-[3-fluoro-6- 1H NMR (400 MHz, DMSO-
(pyridin-3-yl)- d6) : 8 ppm 2.88 (s, 3 H) 3.36 -
9H-pyrrolo[2,3-
0 b:5,4- 3.80 (m masqué, 8 H) 7.55
N N F c']dipyridin-4- (ddHz,, 1 J=8H).57, 5.0
7.77 (s, 1 H) 7.85 (d,
C yl]phényl}(4- J=8.4 Hz, 2 H) 7.90 - 8.01 (m,
N méthylpipérazin
N N -1- 2 H) 8.30 (d, J=8.7 Hz, 1 H)
H yI)méthanone 8.63 (d, J=3.8
Hz, 1 H) 8.85 (d, J=2.3 Hz, 1
16 H) 9.01 (br. s., 1 H) 9.16 (s, 1
H) 12.71 (s, 1 H)
UPLC-MS-DAD-ELSD : Tr
(min)= 2,39 ; [M+H]+ : m/z
456,09 ; pureté 93 %
H o 4-[3-fluoro-6- 1H NMR (400 MHz, DMSO-
N (pyridin-3-yl)- d6) : 8 ppm 1.81 (quin, J=6.9
o 9H-pyrrolo[2,3- Hz, 2 H) 3.27 (s, 3 H) 3.35 -
NH b:5,4- 3.46 (m, 4 H) 7.47
F c']dipyridin-4- (dd, J=8.3, 5.0 Hz, 1 H) 7.69
ô3 yl]-N-(3- (s, 1 H) 7.88 (d, J=8.4 Hz, 2 H)
N méthoxypropyl) 8.12 - 8.22 (m, 3 H) 8.56 (dd,
N N benzamide J=4.8, 1.5 Hz,
H 1 H) 8.71 (t, J=5.9 Hz, 1 H)
8.80 (d, J=2.5 Hz, 1 H) 8.94 (d,
17 J=2.3 Hz, 1 H) 9.12 (s, 1 H)
12.64 (s, 1 H)
Exemple 18 : chlorure de 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c'] d i pyri d i n -4-yl ] be n zoyl e
WO 2010/109084 55 PCT/FR2009/052330
OH CI
O _ CI~_CI O
S _
F 0 F
NI-
I N~
N I N
N N N N
6 H 18 H
Un mélange de 100 mg d'acide 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzoïque et de 12 ml de chlorure de thionyle est chauffé à
70 C
pendant 20 h. Le mélange réactionnel est concentré à sec sous pression réduite
pour donner 105 mg de chlorure de 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzoyle sous forme d'une poudre jaune. Le produit est
caractérisé
par ajout de méthanol pour donner l'ester correspondant.
Exemples 19 à 28
Procédure générale pour les exemples 19 à 28
CI
Ra
O
F Amine F
N I I \ N CH2ci2 N I\ \ N
N N N N
18 H H
Un mélange de 105 mg de chlorure de 4-[3-fluoro-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridin-4-yl]benzoyle, 10 équivalents d'amine (cf tableau 2) et 10
ml de
dichlorométhane est agité à température ambiante pendant 20 h puis le mélange
réactionnel est concentré à sec sous pression réduite. Le résidu est repris
par 300
ml d'eau et 300 ml d'acétate d'éthyle. Après décantation, la phase aqueuse est
extraite par 100 ml d'acétate d'éthyle puis les phases organiques sont réunies
et
concentrées sous pression réduite.
Les amides sont détaillés dans le tableau 2 (rendement entre 10 et 79 % selon
les
réactifs).
WO 2010/109084 56 PCT/FR2009/052330
Tableau 2 :
Réactif Structure obtenue et n Nom Analyse
d'exemple
UPLC-MS-DAD-ELSD : Tr
(min)= 0,42 ; [M+H]+ : m/z
511 ; [M-H]- : m/z 509 ; pureté :
95%
H 0 1 H NMR (400 MHz, DMSO-
N d6) : 8 ppm 1.76 (quin, J=7.2
NH2 4-[3-fluoro-6- Hz, 2 H) 2.35 - 2.41 (m, 6 H)
(pyridin-3-yl)-9H- 3.38 (q, J=6.6 Hz,
N F pyrrolo[2,3-b:5,4- 2 H) 3.57 (t, J=4,7 Hz, 4 H)
/ - c']dipyridin-4-yl]-N- 7.46 (dd, J=7.8, 4.9 Hz, 1 H)
NC N [3-(morpholin-4- 7.67 (s, 1 H) 7.87 (d, J=7.8 Hz,
N N yl)propyl]benzamid 2 H) 8.12 - 8.15
0 H e (m, 1 H) 8.16 (d, J=8.3 Hz, 2
19 H) 8.53 (dd, J=4.8, 1.6 Hz, 1
H) 8.71 (t, J=5.6 Hz, 1 H) 8.77
(d, J=2.2 Hz, 1
H) 8.90 (d, J=2.0 Hz, 1 H) 9.08
(s, 1 H) 11.81 (br. s., 1 H)
UPLC-MS-DAD-ELSD : Tr
(min)= 0,44 ; [M+H]+ : m/z
595; pureté : 70 %
1 H NMR (400 MHz, DMSO-
d6) : 8 ppm 1.64 - 1.70 (m, 4
H) 1.76 (quin, J=7.0 Hz, 2 H)
N 2.42 - 2.47 (m, 4
NH2 CN 4-[3-fluoro-6- H) 2.48 - 2.54 (m, 2 H) 3.35 -
(pyridin-3-yl)-9H- 3.43 (m, 2 H) 7.46 (dd, J=7.9,
N pyrrolo[2,3-b:5,4- 4.8 Hz, 1 H) 7.67 (d, J=1.0 Hz,
F c']dipyridin-4-yl]-N- 1 H) 7.86 (d,
N N/ [3-(pyrrolidin-1- J=7.8 Hz, 2 H) 8.10 - 8.18 (m,
N N yl)propyl]benzamid 3 H) 8.53 (dd, J=4.6, 1.7 Hz, 1
H e H) 8.77 (d, J=2.2 Hz, 1 H) 8.77
20 - 8.82 (m, 1 H) 8.91 (d, J=2.2
Hz, 1 H) 9.09 (d, J=1.0 Hz, 1
H) 12.42 (br. s., 1 H)
WO 2010/109084 57 PCT/FR2009/052330
UPLC-MS-DAD-ELSD : Tr
(min)= 2,23 ; [M+H]+ : m/z
497 ; [M-H]- : m/z 495 ; pureté :
N N 0 95%
1 H NMR (400 MHz, DMSO-
oj d6) : 8 ppm 2.44 - 2.57 (m, 8
NH2 - 4-[3-fluoro-6- H) 3.48 (q, J=6.4 Hz, 2 H) 3.60
N F (pyridin-3-yl)-9H- (t, J=4.4 Hz, 2H) 7.46 (dd,
pyrrolo[2,3-b:5,4- J=7.8, 4.9 Hz, 1 H) 7.68 (s, 1
CN
D N c']dipyridin-4-yl]-N- H) 7.87 (d, J=8.3 Hz, 2 H) 8.12
N N [2-(morpholin-4- - 8.14 (m, 1 H) 8.16 (d,
o H yl)éthyl]benzamide J=7.8Hz, 2 H) 8.53 (dd, J=4.9,
1.5 Hz, 1 H) 8.63 (t, J=5.6 Hz,
21 1 H) 8.77 (d, J=2.0 Hz, 1 H)
8.91 (d, J=2.0 Hz, 1 H) 9.09 (s,
1 H)
UPLC-MS-DAD-ELSD : Tr
(min)= 0,42 ; [M+H]+ : m/z
N 481 ; [M-H]- : m/z 479 ; pureté :
80%
1 H NMR (400 MHz, DMSO-
N 4-[3-fluoro-6- d6) : 8 ppm 1.55 - 1.72 (m, 2
NH2 H (pyridin-3-yl)-9H- H) 1.77 - 1.89 (m, 2 H) 1.92 -
- pyrrolo[2,3-b:5,4- 2.06 (m, 2 H) 2.19 (s, 3 H)
N / c']dipyridin-4-yl]-N- 2.75 - 2.88 (m, 2 H) 3.74 - 3.91
CN F (1-méthylpipéridin- (m, 1 H) 7.40 - 7.53 (m, 1 H)
N/ 4-yl)benzamide 7.68 (s, 1 H) 7.86 (d, J=7.6Hz,
N 2 H) 8.07 - 8.15 (m, 1 H) 8.17
N H (d, J=8.3 Hz, 2 H) 8.43 - 8.49
(m, 1 H) 8.50 - 8.59 (m, 1 H)
22 8.77 (s, 1
UPLC-MS-DAD-ELSD : Tr
(min)= 0,41 ; [M+H]+ : m/z
-N
469 ; [M-H]- : m/z 467 ; pureté :
95%
/ N N-[2- 1 H NMR (400 MHz,DMSO-
HN (diméthylamino)éth d6+ ACOD) : 8 ppm 2.89 (br.
yl]-4-[3-fluoro-6- s., 6 H) 3.12 (s, 3 H) 3.38 (br.
(pyridin-3-yl)-9H- s., 2 H) 3.90 (br.
N- N F pyrrolo[2,3-b:5,4- s., 2 H) 7.46 (dd, J=7.7, 4.8
N c']dipyridin-4-yl]-N- Hz, 1 H) 7.69 (br. s., 1 H) 7.82
N méthylbenzamide (d, J=8.1 Hz, 2 H) 7.87 (d,
H J= 7.8 H z, 2 H) 8.19 (d, J= 7.6
Hz, 1 H) 8.55 (dd, J=4.6, 1.2
23 Hz, 1 H) 8.76 (d, J=2.4 Hz, 1
H) 8.92 (br. s., 1 H) 9.10 (d,
WO 2010/109084 58 PCT/FR2009/052330
J=1.0 Hz, 1 H)
UPLC-MS-DAD-ELSD : Tr
(min)= 0,41 ; [M+H]+ : m/z
510 ; [M-H]- : m/z 508 ; pureté :
N 90%
1 H NMR (400 MHz, DMSO-
N d6) : 8 ppm 2.15 (s, 3 H) 2.25 -
CN ND (pyridin-3-yl)-9H- 2.38 (m, 4 H) 2.45 - 2.58 (m, 6
N H) 3.41 - 3.51
H pyrrolo[2,3-b:5,4- (m, 2 H) 7.46 (dd, J=7.8, 4.6
- c']dipyridin-4-yl]-N- Hz, 1 H) 7.68 (d, J=1.0 Hz, 1
N [2-(4- H) 7.87 (d, J=7.8 Hz, 2 H) 8.10
méthylpipérazin-1- _
NH2 yl)éthyl]benzamide g 19 (m, 3H) 8.54 (dd, J=4.8,
N 1.6 Hz, 1 H) 8.61 (t, J=5.1 Hz,
N N 1 H) 8.77 (d, J=2.2 Hz, 1 H)
H 8.91 (dd, J=2.2, 0.7 Hz, 1 H)
9.09 (d, J=1.0 Hz, 1 H) 12.61
24 (br. s., 1 H)
UPLC-MS-DAD-ELSD : Tr
(min)= 2,23 ; [M+H]+ : m/z
495 ; [M-H]- : m/z 493 ; pureté :
97%
1 H NMR (400 MHz, DMSO-
d6) : 8 ppm 1.24 (qd, J=12.1,
N 4-[3-fluoro-6- 3.2 Hz, 2 H) 1.52 - 1.64 (m, 1
H _ (pyridin-3-yl)-9H- H) 1.65 - 1.76
N pyrrolo[2,3-b:5,4- (m, 2 H) 1.80 - 1.94 (m, 2 H)
2.17 (s, 3 H) 2.74 - 2.85 (m, 2
N F c ]dipyridin-4-yl]-N- H) 3.24 (t, J=6.2 Hz, 2 H) 7.45
[(1-méthylpipéridin- (dd, J=8.1,4.6 Hz, 1 H) 7.65 (s,
HN N \ 4 1 H) 7.86 (d, J=8.1 Hz, 2 H)
2 H N yI)méthyl]benzamid 8.13 (dt, J=8.1, 1.8 Hz, 1 H)
N
e 8.17 (d, J=8.3 Hz, 2 H)8.54
25 (dd, J=4.9, 1.5 Hz, 1 H) 8.68
(t, J=5.5 Hz, 1 H) 8.77 (d,
J=2.4 Hz, 1 H) 8.91 (d, J=2.2
Hz, 1 H) 9.08
(s, 1 H) 12.62 (br. s., 1 H)
WO 2010/109084 59 PCT/FR2009/052330
UPLC-MS-DAD-ELSD : Tr
N-(2-amino-2- (min)= 2,21 ; [M+H]+ : m/z
méthylpropyl)-4-[3- 455 ; [M-H]-: m/z 453 ; pureté :
fluoro-6-(pyridin-3- 97 %
HZN yl)-9H-pyrrolo[2,3- 1 H NMR (400 MHz, DMSO-
NH H b:5,4-c']dipyridin-4- d6) : 8 ppm 1.08 (s, 6 H) 3.25 -
yl]benzamide 3.28 (m, 2 H) 7.44 (dd, J=8.1,
4.6 Hz, 1 H)
N 7.68 (s, 1 H) 7.87 (d, J=7.8 Hz,
NH2 F 2 H) 8.13 (dt, J=8.0, 2.0 Hz, 1
H) 8.19 (d, J=8.3 Hz, 2 H) 8.48
N - N (t, J=5.3
N H Hz, 1 H) 8.54 (dd, J=4.8, 1.6
26 Hz, 1 H) 8.77 (d, J=2.2 Hz, 1
H) 8.93 (d, J=2.0 Hz, 1 H) 9.09
(s, 1 H)
UPLC-MS-DAD-ELSD : Tr
(min)= 2,12 ; [M+H]+: m/z
471 ; [M-H]- : m/z 469 ; pureté :
95%
HO
--~-N 1 H NMR (400 MHz, DMSO-
OH d6) : 8 ppm 2.62 - 2.69 (m, 2
N 4-[3-fluoro-6- H) 2.76 (t, J=6.4 Hz, 2 H) 3.39
H (pyridin-3-yl)-9H- - 3.51 (m, 4 H)
pyrrolo[2,3-b:5,4- 4.46 (br. s., 1 H) 7.47 (dd,
HN N c']dipyridin-4-yl]-N- J=8.1, 4.9 Hz, 1 H) 7.69 (d,
F {2-[(2- J=1.0 Hz, 1 H) 7.87 (d, J=7.6
N hydroxyéthyl)amino Hz, 2 H) 8.12 - 8.15
N ]éthyl}benzamide (m, 1 H) 8.17 (d, J=8.6 Hz, 2 N NH2 H H) 8.54 (dd, J=4.8,
1.6 Hz, 1
H) 8.64 (t, J=5.9 Hz, 1 H) 8.77
27 (d, J=2.2 Hz, 1 H) 8.92 (d,
J=1.5 Hz, 1 H) 9.09 (d, J=1.0
Hz, 1 H)
UPLC-MS-DAD-ELSD : Tr
HZ (min)= 0,39 ; [M+H]+ : m/z
427 ; [M-H]- : m/z 425 ; pureté :
H N-(2-aminoéthyl)-4- 95
NH2 [3-fluoro-6-(pyridin- 1 H NMR (400 MHz, DMSO-
J 3-yl)-9H- d6) : b ppm 2.75 (t, J=6.6 Hz,
r N F pyrrolo[2,3-b:5,4- 2 H) 3.33 - 3.38 (m, 2 H) 7.46
NH2 c']dipyridin-4- (dd, J=8.2, 4.8
N yl]benzamide Hz, 1 H) 7.69 (s, 1 H) 7.86 (d,
N H N J=7.8 Hz, 2 H) 8.14 (dt, J=8.0,
2.0 Hz, 1 H) 8.18 (d, J=8.6 Hz,
28 2 H) 8.53
WO 2010/109084 60 PCT/FR2009/052330
(d, J=4.2 Hz, 1 H) 8.62 (t,
J=5.7 Hz, 1 H) 8.74 - 8.77 (m,
1 H) 8.92 (d, J=1.7 Hz, 1 H)
9.08 (s, 1 H)
5-chloro-2-méthoxy-4-(triméthylstannanyl)pyridine A2
LiTMP, Me3SnCI \ /
/CI THF, 78 C --Sn
O N 1
O N
A2
Un mélange de 10 g de 5-chloro-2-méthoxypyridine et 220 ml de
tétrahydrofuranne
est refroidi à -78 C puis est ajoutée progressivement une solution
fraichement
préparée à partir de 14,1 ml de 2,2,6,6-tetramethylpipéridine dans 50 ml de
tétrahydrofuranne et 36,4 ml de n-butyllithium 2,3 N dans l'hexane. Après 4 h
d'agitation à -78 C, sont ajoutés au mélange réactionnel 17,3 g de chlorure
de
triméthylétain dissous dans 30 ml de tétrahydrofuranne. Le mélange réactionnel
est
agité à température ambiante pendant 18 h puis traité par 200 ml d'eau et 200
ml de
solution aqueuse de chlorure d'ammonium à 10 % et extrait par 500 ml puis 200
ml
d'acétate d'éthyle. Les phases organiques réunies sont séchées sur sulfate de
magnésium, filtrées puis concentrées à sec sous pression réduite. Le résidu
est
purifié par chromatographie sur colonne de silice en éluant par le
dichlorométhane
pour donner 17,7 g de 5-chloro-2-méthoxy-4-(triméthylstannanyl)pyridine A2
sous
forme d' une huile incolore.
UPLC-MS-DAD-ELSD : Tr (min)= 1,24; [M+H]+ : m/z 308 ; pureté : 98 %
1H NMR (400 MHz, DMSO-d6) : ppm 0.16 (t, J=29.6 Hz, 9 H) 3.62 (s, 3 H) 6.61
(t,
J=20.5 Hz, 1 H) 7.90 (t, J=8.3 Hz, 1 H)
Exemple 29 : 5'-chloro-5-fluoro-2'-méthoxy-3,4'-bipyridin-2-amine
WO 2010/109084 61 PCT/FR2009/052330
Pd(PPh3)4
,Sn Cul dioxanne H 2 N N
micro-ondes 120 C 1 h I
\ CI \ F
~p N 1 , N CI
A2 N NHZ 29
Un mélange de 13,2 g de 5-chloro-2-méthoxy-4-(triméthylstannanyl)pyridine ,
7,5 g
de 2-amino-3-bromo-5-fluoropyridine, 3,1 g de
tetrakis(triphenylphosphine)palladium(0) et 1,6 g d'iodure de cuivre dans 100
ml de
1,4-dioxanne est chauffé au reflux pendant 18 h. Le mélange réactionnel est
hydrolysé par un mélange de 200 ml de solution aqueuse d'hydrogénocarbonate de
sodium à 10 % et de 100 ml d'eau puis est extrait par 2 fois 200 ml d'acétate
d'éthyle.
Les phases organiques réunies sont séchées sur sulfate de magnésium, filtrées
puis
concentrées à sec sous pression réduite. Le résidu est purifié par trituration
dans
120 ml d'acétate d'éthyle pour donner 8,7 g de 5'-chloro-5-fluoro-2'-méthoxy-
3,4'-
bipyridin-2-amine sous forme d'une huile incolore.
UPLC-MS-DAD-ELSD : Tr (min)= 0,94; [M+H]+ : m/z 253 ; pureté : 72%
1H NMR (400 MHz, DMSO-d6): ppm 3.89 (s, 3 H) 5.65 (s, 2 H) 6.86 (s, 1 H) 7.33
(dd, J=8.7, 3.1 Hz, 1 H) 8.01 (d, J=2.9 Hz, 1 H) 8.32 (s, 1 H)
Exemple 30 : 3-fluoro-6-méthoxy-9H-pyrrolo[2,3-b:5,4-c']dipyridine
Pd(OAc)2, Josiphos F
H2N N tBuOK, DME
100 C 1 nuit
u O
F I ç N
N N , N
CI
29 30 H
Dans un tube sec, on place sous atmosphère d'argon 1,12 g de (R)-(-)-1-[(S)-2-
(dicyclohexylphosphino)ferrocenyl]ethyldi-terbutylphosphine et 0,40 g
d'acétate de
palladium (II) dans 15 ml de 1,2-dimethoxyéthane anhydre et agite pendant 10
min à
40 C.
Dans un réacteur de 250 ml, on place sous argon 6,38 g de 5'-chloro-5-fluoro-
2'-
méthoxy-3,4'-bipyridin-2-amine dans 80 ml de 1,2-diméthoxyéthane anhydre et
WO 2010/109084 62 PCT/FR2009/052330
ajoute la solution préparée précédemment puis 5,64 g de terbutylate de
potassium.
Le mélange réactionnel est porté au reflux pendant 18 h puis sont rajoutés 3
ml
d'une solution de catalyseur fraîchement préparée de même concentration et
1,41 g
de terbutylate de potassium. Après 6 heures à reflux, sont ajoutés au mélange
réactionnel 10 ml de méthanol et 300 ml d'acétate d'éthyle. La phase organique
est
lavée par 200 ml de solution aqueuse d'hydrogénocarbonate de sodium à 5 % puis
séchée sur sulfate de magnésium, filtrée et concentrée à sec sous pression
réduite.
Le résidu est purifié par trituration dans 100 ml d'acétate d'éthyle pour
donner 2,23 g
de 3-fluoro-6-méthoxy-9H-pyrrolo[2,3-b:5,4-c']dipyridine.
UPLC-MS-DAD-ELSD : Tr (min)= 0,58; [M+H]+ : m/z 218 ; pureté : 98 %
1H NMR (400 MHz, DMSO-d6) : ppm 3.91 (s, 3 H) 7.58 (s, 1 H) 8.49 (s, 1 H) 8.54
-
8.61 (m, 2 H) 11.85
(br. s., 1 H)
Exemple 31 : 3-fluoro-9H-pyrrolo[2,3-b:5,4-c']dipyridin-6-ol
F F
HCI
O o N/ HO N
N / N AcOH NI / C N
H H
30 31
Dans un réacteur, on place 600 mg de 3-fluoro-6-méthoxy-9H-pyrrolo[2,3-b:5,4-
c']dipyridine dans 3 ml d'acide acétique et 2 ml d'une solution aqueuse
d'acide
chlorhydrique à 37 %, scelle le tube et soumet à irradiation microonde 30 min
à
130 C. Le mélange réactionnel est essoré sous vide puis lavé par de l'éther
éthylique pour donner 755 mg de 3-fluoro-9H-pyrrolo[2,3-b:5,4-c']dipyridin-6-
ol sous
forme de solide jaune.
UPLC-MS-DAD-ELSD (LS) : Tr (min)= 0,45; [M+H]+ : m/z 204; pureté : 91 %
1H NMR (400 MHz, DMSO-d6) : ppm 5.47 (br. s., 1 H) 7.92 (s, 1 H) 8.52 (s, 1 H)
8.75 (dd, J=2.7, 1.7Hz, 1 H) 8.87 (dd, J=8.7, 2.8 Hz, 1 H) 12.52 (s, 1 H)
Exemple 32 : trifluorométhanesulfonate de 3-fluoro-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-6-yle
WO 2010/109084 63 PCT/FR2009/052330
F F
F F y F
(CF3s02)20 O'S~O
HO \ Ç / _ 0
Pyridine N N
N C/
/ H
N
31 32 H
Un mélange de 755 mg de 3-fluoro-9H-pyrrolo[2,3-b:5,4-c']dipyridin-6-ol dans
15 ml
de pyridine et 4,32 ml d'anhydride trifluorométhanesulfonique est agité à
température ambiante pendant 30 min. Le mélange réactionnel est dilué avec 100
ml
d'acétate d'éthyle et lavé avec 100 ml d'une solution aqueuse saturée de
bicarbonate de sodium. Après décantation, la phase aqueuse est extraite par
100 ml
d'acétate d'éthyle puis les phases organiques sont réunies, séchées sur
sulfate de
magnésium, filtrées puis concentrées sous vide pour donner 978 mg de
trifluorométhanesulfonate de 3-fluoro-9H-pyrrolo[2,3-b:5,4-c']dipyridin-6-yle
sous
forme de solide brun.
UPLC-MS-DAD-ELSD : Tr (min)= 4,22 ; [M+H]+ : m/z 336; [M-H]- : m/z 334 ;
pureté :
98%
1 H NMR (400 MHz, DMSO-d) ppm 8.41 (d, J=0.7 Hz, 1 H) 8.71 - 8.78 (m, 3 H)
12.69
(br. s., 1 H)
Exemple 33 : 3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridine
F F F PdC12(dppf)
O`` .O F Cs2co3 N
SI Dioxanne / eau N F
N N N N N
~B H N
32 ~ O 33
Dans un réacteur, on place 960 mg de trifluorométhanesulfonate de 3-fluoro-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-6-yle, 43,7 mg de 1,1'-
bis(diphenylphosphino)ferrocenedichloropalladium(lI), 372 mg de 1-methyl-4-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1H-pyrazole, 1,17 g de carbonate
de
césium dans 10 ml de 1,4-dioxanne et 2,5 ml d'eau, scelle le tube et soumet à
irradiation microonde à 125 C pendant 1 h. Le mélange réactionnel est dilué
par 50
ml d'acétate d'éthyle et lavé par 50 ml d'eau. Après décantation, la phase
aqueuse
WO 2010/109084 64 PCT/FR2009/052330
est extraite par 100 ml d'acétate d'éthyle puis les phases organiques sont
réunies,
séchées sur sulfate de magnésium, filtrées puis concentrées sous vide. Le
résidu est
purifié par chromatographie sur colonne de silice en éluant par de l'acétate
d'éthyle
pour donner 168 mg de 3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridine sous forme de solide jaune.
UPLC-MS-DAD-ELSD : Tr (min)= 2,24 ; [M+H]+ : m/z 268; [M-H]- : m/z 266 ;
pureté :
98%
1 H NMR (400 MHz, DMSO-d6) : ppm 3.91 (s, 3 H) 7.96 (d, J=0.5 Hz, 1 H) 8.19
(s, 1
H) 8.41 (d, J=1.OHz, 1 H) 8.55 (dd, J=8.8, 2.9 Hz, 1 H) 8.59 - 8.61 (m, 1 H)
8.86 (d,
J=1.2 Hz, 1 H) 12.14 (br. S., 1 H)
Exemple 34 : 3-fluoro-9-[(4-méthylphényl)sulfonyl]-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine
N
\N
N F
TsCI, NaH I I N
N F DMF N N
/ I I \ 0=5=0
N N
33 H 34
Dans un ballon de 100 ml, on place, sous argon 168 mg de 3-fluoro-6-(1-méthyl-
1 H-
pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine dans 10 ml de
diméthylformamide et
ajoute 11 mg d'hydrure de sodium. Le mélange réactionnel est agité pendant 3 h
à
température ambiante puis sont ajoutés 240 mg de chlorure de
paratoluènesulfonyle. Le mélange réactionnel est agité pendant 45 min à
température ambiante puis est versé sur un mélange d'eau et de solution
d'hydrogénocarbonate de sodium : un précipité blanc apparaît. Après agitation,
celui-ci est essoré sous vide puis lavé par de l'éther diéthylique. Le solide
blanc
obtenu est purifié par chromatographie sur colonne de silice en éluant par de
l'acétate d'éthyle pour donner 225 mg de 3-fluoro-9-[(4-méthylphényl)sulfonyl]-
6-(1-
méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine sous forme d'un
solide
blanc.
UPLC-MS-DAD-ELSD (LS) : Tr (min)= 1,26 ; [M+H]+ : m/z 422,26; pureté : 93 %
WO 2010/109084 65 PCT/FR2009/052330
Exemple 35 : 3-fluoro-4-iodo-9-[(4-méthylphényl)sulfonyl]-6-(1-méthyl-1 H-
pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine
N\ N\
F \ N- F
I I 1 ) LiTMP, THF / I I\
N N N 20) 12 N N N
o=s=o o=s=o
34 35
Un mélange de 53 pl de 2,2,6,6-tetramethylpiperidine et 2 ml de
tétrahydrofuranne
est refroidi à -78 C puis sont ajoutés 100 pl de n-butyllithium 2,7 N dans
l'hexane.
Après 15 min sont ajoutés au mélange réactionnel 75 mg de 3-fluoro-9-[(4-
méthylphényl)sulfonyl]-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridine
en solution dans 5 ml de tétrahydrofuranne et celui-ci est agité à -78 C 1
heure
puis sont ajoutés 72 mg d'iode en solution dans 2 ml de tétrahydrofuranne. Le
mélange réactionnel est versé sur un mélange d'eau et d'une solution aqueuse
saturée de chlorure d'ammonium puis extrait par de l'acétate d'éthyle. La
phase
organique est lavée par une solution aqueuse de thiosulfate de sodium, séchée
sur
du sulfate de magnésium, filtrée puis concentrée à sec sous pression réduite.
Le
résidu est purifié par chromatographie sur colonne de silice en éluant par de
l'acétate d'éthyle pour donner 60 mg de 3-fluoro-4-iodo-9-[(4-
méthylphényl)sulfonyl]-
6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine sous forme de
solide
jaune.
UPLC-MS-DAD-ELSD (LS) : Tr (min)= 1,37 ; [M+H]+ : m/z 548; pureté : 71 %
Exemple 36 : 3-fluoro-4-iodo-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridine
_N\
N-
F / I I \ LiOH N
N N N McOH / THF F N-
o=s=o N
N H
36
WO 2010/109084 66 PCT/FR2009/052330
Dans un ballon, on place 60 mg de 3-fluoro-4-iodo-9-[(4-méthylphényl)sulfonyl]-
6-(1-
méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine dans 5 ml de
méthanol et 5
ml de tétrahydrofuranne puis ajoute 60 mg d'hydroxyde de lithium. Le mélange
réactionnel est agité pendant 18 h à température ambiante puis sont ajoutés un
peu
d'eau et quelques ml de solution aqueuse de chlorure d'ammonium. Le précipité
est
essoré, lavé à l'eau, à l'acétate d'éthyle et à l'éther diéthylique puis séché
sous vide
pour donner 25 mg de 3-fluoro-4-iodo-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-
pyrrolo[2,3-
b:5,4-c']dipyridine.
1 H NMR (400 MHz, DMSO-d6): ppm 3.94 (s, 3 H) 8.03 (s, 1 H) 8.34 (s, 1 H) 8.59
(s,
1 H) 8.83 (s, 1 H) 8.99 (s, 1 H) 12.73 (br. s., 1 H)
Exemple 37 : N-[3-(diméthylamino)éthyl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
H -N
Pd(PPh3)4 O
N F Dioxanne eau
N cs2co3 N F
N H
0::~ N~ N
36 H H 37
Dans un réacteur, on place 55 mg de 3-fluoro-4-iodo-6-(1-méthyl-1 H-pyrazol-4-
yl)-
9H-pyrrolo[2,3-b:5,4-c']dipyridine, 16 mg de
tetrakis(triphenylphosphine)palladium(0),
134 mg de N-(2-dimethylaminoéthyl)-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-
yl)benzamide, 68 mg de carbonate de césium dans 2 ml de 1,4-dioxanne et 500 pl
d'eau, scelle le tube et soumet à irradiation microonde à 120 C pendant 1 h.
Le
mélange réactionnel est dilué avec de l'acétate d'éthyle et de l'eau puis le
précipité
jaune formé est essoré sous vide et lavé avec de l'acétate d'éthyle, de l'eau
et de
l'éther diéthylique pour donner 45 mg N-[3-(diméthylamino)éthyl]-4-[3-fluoro-6-
(1-
méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide sous
forme
de solide jaune.
WO 2010/109084 67 PCT/FR2009/052330
UPLC-MS-DAD-ELSD : Tr (min)= 0,38 ; [M+H]+ : m/z 458; ; [M-H]- : m/z 456;
pureté : 98 %
1H NMR (400 MHz, DMSO-d6): 8 ppm 2.23 (s, 6 H) 2.46 - 2.49 (m, 2 H) 3.45 (q,
J=6.6 Hz, 2 H) 3.85 (s,3 H) 7.29 (d, J=1.2 Hz, 1 H) 7.54 (d, J=0.7 Hz, 1 H)
7.82 (d,
J=7.8 Hz, 2 H) 7.92 (s, 1 H) 8.14 (d, J=8.3Hz, 2 H) 8.61 (t, J=5.5 Hz, 1 H)
8.71 (d,
J=2.4 Hz, 1 H) 8.89 (d, J=1.0 Hz, 1 H) 12.36 (br. s., 1 H)
Exemple 38 : N-[2-(diméthylamino)propyl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-
yl)-9H-pyrrolo[2,3-b: 5,4-c']dipyridin-4-yl]benzam ide
N-
H-/
N
Pd(PPh3)4 O
IV F Dioxanne / eau
N cs2co3 IV F
N N\
N H N
-N `N a ô N N
36 H H 38
De façon analogue à l'exemple 37, à partir de 55 mg de produit de l'exemple 36
sont
obtenus 35 mg de N-[2-(diméthylamino)propyl]-4-[3-fluoro-6-(1-méthyl-1 H-
pyrazol-4-
yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide sous forme d'un solide
jaune pâle.
UPLC-MS-DAD-ELSD : Tr (min)= 0,39; [M+H]+: m/z 472 ; pureté : 95 %
1H NMR (400 MHz, DMSO-d6) : 8 ppm 1.73 (quin, J=7.0 Hz, 2 H) 2.17 (s, 6 H)
2.32 (t, J=7.0 Hz, 2 H) 3.38 (q, J=6.4 Hz, 2 H) 3.84 (s, 3 H) 7.30 (s, 1 H)
7.54 (s, 1 H)
7.81 (d, J=8.1 Hz, 2 H) 7.92 (s, 1 H) 8.14 (d, J=8.1 Hz, 2 H) 8.68 - 8.76 (m,
2 H) 8.89
(s, 1 H) 12.37 (br. s., 1 H)
Exemple 39 : 5'-chloro-2',4-diméthoxy-3,4'-bipyridin-2-amine
Pd(PPh3)4
Cul / CsF H2N N
MeO SnMe3 DMF
NI /
CI HZN N I NI / CI
A2 39
`
WO 2010/109084 68 PCT/FR2009/052330
Dans un tube, on place 368 mg de 5-chloro-2-méthoxy-4-
(triméthylstannanyl)pyridine B, 250 mg de 3-iodo-4-methoxy-pyridin-2-ylamine,
304
mg de fluorure de césium, 38 mg d'iodure de cuivre dans 2 ml de
diméthylformamide
puis ajoute 116 mg de tetrakis(triphenylphosphine)palladium(0) et 2 ml de
diméthylformamide, scelle le tube et soumet à irradiation microonde à 125 C
pendant 2 h. Le mélange réactionnel est filtré sur célite, rincé par 10 ml
d'acétate
d'éthyle puis lavé par 2 fois 10 ml d'eau. Après décantation, la phase
organique est
séchée sur sulfate de magnésium, filtrée puis concentrée à sec sous pression
réduite. Le résidu est purifié par chromatographie sur colonne de silice en
éluant par
un mélange heptane : acétate d'éthyle : 50/50 à 0/100 pour donner 125 mg de 5'-
chloro-2',4-diméthoxy-3,4'-bipyridin-2-amine sous forme d'un solide blanc.
UPLC-MS-DAD-ELSD : Tr (min)= 0,44; [M+H]+: m/z 266; pureté : 98 %
1 H NMR (400 MHz, DMSO-d6) : 8 ppm 3.68 (s, 3 H) 3.87 (s, 3 H) 5.40 (s, 2 H)
6.42
(d, J=5.9 Hz, 1 H)6.72 (d, J=0.5 Hz, 1 H) 7.94 (d, J=5.9 Hz, 1 H) 8.28 (d,
J=0.5 Hz, 1
H)
Exemple 40 : 4,6-diméthoxy-9H-pyrrolo[2,3-b:5,4-c']dipyridine
HZN N O/
Pd(OAc)2 / Josiphos -O
tBuOK / dioxanne N
ci N
39 40 H
Dans un tube de 2 ml, on place sous atmosphère d'argon 10,3 mg de (R)-(-)-1-
[(S)-
2-(dicyclohexylphosphino)ferrocenyl]ethylditerbutylphosphine et 3,8 mg
d'acétate de
palladium (II) dans 0,35 ml de 1,4-dioxanne anhydre, et agite 10 min à 35 C.
Dans un réacteur de 2 ml, on place sous argon 45 mg de 5'-chloro-2',4-
diméthoxy-
3,4'-bipyridin-2-amine et 38 mg de terbutylate de potassium dans 0,35 ml de
1,4-
dioxanne anhydre puis ajoute la solution préparée précédemment et 0,20 ml de
1,4-
dioxanne, scelle le tube et soumet à irradiation microonde pendant 1 h à 130
C. Le
mélange réactionnel est dilué par un mélange dichlorométhane / méthanol 90 /
10
puis filtré. Après concentration sous pression réduite, le résidu est purifié
par
chromatographie sur colonne de silice en éluant par un mélange dichlorométhane
/
WO 2010/109084 69 PCT/FR2009/052330
méthanol 98 / 2 à 94 : 6 pour donner 28,5 mg de 4,6-diméthoxy-9H-pyrrolo[2,3-
b:5,4-
c']dipyridine sous forme d'un solide jaune.
UPLC-MS-DAD-ELSD : Tr (min)= 0,40; [M+H]+: m/z 230; pureté : 95 %
1H NMR (400 MHz, DMSO-d6): 8 ppm 3.89 (s, 3 H) 4.09 (s, 3 H) 6.85 (d, J=5.9
Hz,
1 H) 7.30 (d, J=1.0Hz, 1 H) 8.39 - 8.42 (m, 2 H) 11.70 (br. s., 1 H)
Exemple 41 : chlorhydrate de 9H-pyrrolo[2,3-b:5,4-c']dipyridine-4,6-diol
O HO HO
.O
HCI aq conc N/ \ \ %
N AcOH N
N H
H CIH
40 41
Dans un réacteur de 20 ml, on place 1,52 g de 4,6-diméthoxy-9H-pyrrolo[2,3-
b:5,4-
c']dipyridine dans 22,1 ml d'acide acétique et 7,3 ml d'une solution d'acide
chlorhydrique à 37%, scelle le tube et soumet à irradiation microonde 2 heures
à
140 C. Après concentration du mélange réactionnel, le solide obtenu est
empâté
dans 2 fois 25 ml d'éther diéthylique puis séché sous pression réduite 18
heures
pour donner 1,72 g de chlorhydrate de 9H-pyrrolo[2,3-b:5,4-c']dipyridine-4,6-
diol
sous forme de solide beige foncé.
UPLC-MS-DAD-ELSD : Tr (min)= 0,14 ; [M+H]+ : m/z 202 ; [M-H]- : m/z 200 ;
pureté : 98 %
1 H NMR (400 MHz, DMSO-d6) : 8 ppm 6.48 (m, 1 H) 7.62 (s, 1 H) 8.06 (d, J=7.1
Hz,
1 H) 8.34 (s, 1 H) 12.48 (br. s., 1 H)
Exemple 42 : bis(trifluorométhanesulfonate) de 9H-pyrrolo[2,3-b:5,4-
c']dipyridine-4,6-diyle
HO HO Tf 2 0 TfO TfO
N Py / TEA N
N N N N
H CIH H
41 42
WO 2010/109084 70 PCT/FR2009/052330
Un mélange de 1,72 g de chlorhydrate de 9H-pyrrolo[2,3-b:5,4-c']dipyridine-4,6-
diol
dans 35 ml de pyridine et 9,1 ml de triéthylamine est refroidi à 5 C puis
sont ajoutés
2,8 ml d'anhydride trifluorométhanesulfonique. Le mélange réactionnel est
agité à 0-
C pendant 1 h puis versé sur un mélange de 200 ml d'eau et de 50 ml de
solution
5 aqueuse saturée de chlorure de sodium et extrait par 250 ml d'acétate
d'éthyle.
Après décantation, la phase aqueuse est extraite par 200 ml d'acétate d'éthyle
puis
les phases organiques sont réunies et concentrées sous vide. Le résidu est
repris
dans un mélange de 100 ml de mélange dichlorométhane : acétate d'éthyle 80/20,
additionné de 6,0 g de silice et concentré sous pression réduite. Le dépôt
solide formé est purifié par chromatographie sur colonne de silice en éluant
par un
mélange dichlorométhane : acétate d'éthyle 100 / 0 à 80 / 20 pour donner 124
mg de
bis(trifluorométhanesulfonate) de 9H-pyrrolo[2,3-b:5,4-c']dipyridine-4,6-diyle
sous
forme de solide rouille.
UPLC-MS-DAD-ELSD : Tr (min)= 4,81 ; [M+H]+ : m/z 466 ; [M-H]- : m/z 464 ;
pureté : 98 %
1 H NMR (400 MHz, DMSO-d6) : 8 ppm 7.59 (d, J=5.6 Hz, 1 H) 7.96 (s, 1 H) 8.88
(d,
J=0.7 Hz, 1 H) 8.89 (d, J=5.6 Hz, 1 H) 13.32 (br. s., 1 H)
Exemple 43 : trifluorométhanesulfonate de 4-(4-{[2-
(diméthylamino)éthyl]carbamoyl}phényl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-6-yle
-Ni
PdCI2(dppf) 0
H
Dioxanne / eau
Tf0 Tf0
Cs2C03
N Tf0
h\N,
H /NN Bo N/
N N
42 H 4 H
Dans un réacteur, on place 124 mg de bis(trifluorométhanesulfonate) de 9H-
pyrrolo[2,3-b:5,4-c']dipyridine-4,6-diyle, 85 mg de N-(2-dimethylaminoethyl)-4-
(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)benzamide, 130 mg de carbonate de
césium dans 1,2 ml de 1,4-dioxanne puis sous argon 19 mg de 1,1'-
bis(diphenylphosphino)ferrocenedichloropalladium(II) et 0,12 ml d'eau, scelle
le tube
WO 2010/109084 71 PCT/FR2009/052330
et soumet à irradiation microonde à 140 C pendant 15 min. Le mélange
réactionnel
est dilué par 10 ml d'acétate d'éthyle et lavé par 10 ml d'eau. Après
décantation, la
phase aqueuse est extraite par 10 ml d'acétate d'éthyle puis les phases
organiques
sont réunies, séchées sur sulfate de magnésium, filtrées puis concentrées sous
vide.
Le résidu est repris dans un mélange de 30 ml de mélange dichlorométhane /
méthanol 90 : 10, additionné de 600 mg de silice et concentré sous pression
réduite.
Le dépôt solide formé est purifié par chromatographie sur colonne de silice en
éluant
par un mélange dichlorométhane / méthanol 100 / 0 à 90 / 10 pour donner 56 mg
de
trifluorométhanesulfonate de 4-(4-{[2-(diméthylamino)éthyl]carbamoyl}phényl)-
9H-
pyrrolo[2,3-b:5,4-c']dipyridin-6-yle sous forme de solide beige.
UPLC-MS-DAD-ELSD : Tr (min)= 4,81 ; [M+H]+ : m/z 466 ; [M-H]- : m/z 464 ;
pureté : 98 %
1H NMR (400 MHz, DMSO-d6) : 8 ppm 2.36 (s, 6 H) 2.62 - 2.69 (m, 2 H) 3.48 (q,
J=6.5 Hz, 2 H) 7.33 -7.38 (m, 2 H) 7.85 (d, J=8.3 Hz, 2 H) 8.12 (d, J=8.3 Hz,
2 H)
8.61 - 8.67 (m, 1 H) 8.74 - 8.78 (m, 2 H)
12.86 (br. s., 1 H)
Exemple 44 : N-[2-(diméthylamino)éthyl]-4-[6-(1-méthyl-1 H-pyrazol-4-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
-Ni -N/
PdC12(dppf)
O O
N Dioxanne / eau N
H Csco3 H
N
TfO Ni >B o
=o
N N/
43 H N 44 H N
Dans un réacteur, on place 53 mg de trifluorométhanesulfonate de 4-(4-{[2-
(diméthylamino)éthyl]carbamoyl}phényl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-6-
yle, 33
mg de 1-methyl-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1 H-pyrazole,
51 mg
de carbonate de césium dans 0,8 ml de 1,4-dioxanne puis sous argon 8 mg de
1,1'-
bis(diphenylphosphino)ferrocenedichloropalladium(II) et 85 pl d'eau, scelle le
tube et
soumet à irradiation microonde à 140 C pendant 30 min. Au mélange
réactionnel,
WO 2010/109084 72 PCT/FR2009/052330
sont ajoutés 21 mg de 1-methyl-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-
1H-
pyrazole et 8 mg de 1,1'-bis(diphenylphosphino)ferrocenedichloropalladium(II)
puis
le mélange est de nouveau soumis à irradiation micro onde à 140 C pendant 30
min.
Le mélange réactionnel est dilué par 10 ml d'acétate d'éthyle et traité par 10
ml
d'eau. Après décantation, la phase aqueuse est extraite par 10 ml d'acétate
d'éthyle
puis les phases organiques sont réunies, séchées sur sulfate de magnésium,
filtrées
puis concentrées sous vide. Le résidu est purifié par chromatographie sur
colonne
de silice en éluant par un mélange dichlorométhane / méthanol 100 / 0 à 88 /
12 ; le
solide obtenu est lavé par l ml d'éther diéthylique pour donner 7 mg de N-[2-
(diméthylamino)éthyl]-4-[6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzamide sous forme de solide beige.
UPLC-MS-DAD-ELSD : Tr (min)= 2,01 ; [M+H]+ : m/z 440 ; [M-H]- : m/z 438 ;
pureté : 90 %
1H NMR (500 MHz, DMSO-d6) : 8 ppm 2.22 (s, 6 H) 2.44 - 2.49 (m, 2 H) 3.45 (q,
J=6.6 Hz, 2 H) 3.86 (s,3 H) 7.26 (d, J=4.9 Hz, 1 H) 7.61 (s, 1 H) 7.63 (s, 1
H) 7.86 (d,
J=8.2 Hz, 2 H) 7.98 (s, 1 H) 8.13 (d,J=8.2 Hz, 2 H) 8.60 (t, J=5.4 Hz, 1 H)
8.64 (d,
J=4.9 Hz, 1 H) 8.89 (s, 1 H) 12.32 (br. s., 1 H)
Exemples 45 à 82
Procédure générale pour les exemples 45 à 82 :
H O2C Ra
N/ HATU, DiPEA, DMF N/
F - F
Amine D
N~ NC\/, N N N N
H
6 45-82 H
Une solution contenant l'acide carboxylique 6 (2,51 g, 5,6 mmol), HATU (6,16
mmol
1,1 eq.) et la diisopropylethylamine (DIPEA, 7 mmol, 1,25 eq.) dans 80 mL de
DMF
est préparée. 2 mL de cette solution sont prélevés puis ajoutés à 0,175 mmol
(1,25
eq.) de l'amine D dans un tube. Si l'amine D est sous forme de chlorhydrate
1,25 eq
de DIPEA sont ajoutés par molécule de HCI présente dans D. Les tubes sont
fermés
puis les différents mélanges sont chauffés une nuit sous agitation à 50 C.
Après
WO 2010/109084 73 PCT/FR2009/052330
refroidissement, 0,1 mL de TFA est ajouté. Après filtration les produits
attendus 45-
83, présents dans les différents filtrats sont purifiés par HPLC préparative.
Conditions analytiques :
HPLC : YMC-Pack Jshere H80 33*2,1 ; 4u; H20+0,0,5%TFA / CH3CN : 98/2 (1 min)
à 5/95 (5 min). MS : Waters LCT classic TOF-MS, 8-channel Mux, 0.15s scantime
for
mass 100-1500
Ou
HPLC : Waters UPLC BEH C18XBridge C18 50*2,1 mm; 1,7u ; H20+0,1% HCOOH
/ CH3CN+0,08% HCOOH : 95/5 (0 min) à 5/95 (1,1 min) à 5/95 (1,7 min) à 95/5
(1,8
min) à 95/5 (2 min). MS : Waters SQQ Single Quadrupol, 0.5s scantime for mass
120-1200.
Les structures obtenues par ce procédé sont décrites dans le tableau 3
Tableau 3
Temps
Ex. n Structure Nom de [M+H+]
rétention observé
min
NN'
11 N
H
\/J! H
O NH 4-[3-fluoro-6-(pyridin-3-yl)-
9 H-pyrrol o[2,3-b: 5,4-
45 c']dipyridin-4-yl]-N-(1 H- 2,27 466,23
NQ/\ tétrazol-5-
F ylméthyl)benzamide
N N N
\N
NJ [(3R)-3-
o (diméthylamino)pyrrolidin-1 -
46 yl]{4-[3-fluoro-6-(pyridin-3-
/ \ \ / yl)-9H-pyrro1o[2,3-b:5,4- 2,12 481,3
N - F c']dipyridin-4-
yl]phényl}méthanone
N,
N N
H
WO 2010/109084 74 PCT/FR2009/052330
N
H
H 4- 3-fluoro-6- radin-3- I
N { [ (py y )-
o 0 9H-pyrrolo[2,3-b:5,4-
47 c']dipyridin-4- 2,18 493,31
N/ yl]phényl}[(3aS,6aS)-5-
F méthylhexahydropyrrolo[3,4-
b]pyrrol-1(2H)-yI]méthanone
N~
N N
H
H
N
NH
N-[2-(acétylamino)éthyl]-4-
48 _ H -
2 , 2 2 2 22 469,24
pyr
rolo[2,3-b:5,4-c']dipyridin-
F 4-yl]benzamide N N
Nq\1
H
OnN
NH 4-[3-fluoro-6-(pyridin-3-yl)-
O 9H-pyrrol o[2,3-b:5,4-
49 c']dipyridin-4-yl]-N-[3-(2- 2,37 509,27
oxopyrrolidin-1-
NQ/\ yl)propyl]benzamide
F
NI\
N N
H
0-N
O NH 4-[3-fluoro-6-(pyridin-3-yl)-
9 H-pyrrol o[2,3-b: 5,4-
50 c']dipyridin-4-yl]-N-[2- 2,50 503,27
N/ (phénylamino)éthyl]benzami
F de
N~
N N
H
WO 2010/109084 75 PCT/FR2009/052330
U N
NH N-[(1-éthylpyrrol idin-2-
o yl)méthyl]-4-[3-fluoro-6-
51 (pyridin-3-yl)-9H-pyrrol o[2,3- 2,17 495,31
N \ \ / b:5,4-c']dipyridin-4-
F yl]benzamide
N~
N N
H
N
NH N-[3-(diméthylamino)-2,2-
diméthylpropyl]-4-[3-fluoro-6-
52 (pyridin-3-yl)-9H-pyrrol o[2,3- 2,22 497,32
N/ \ b:5,4-c']dipyridin-4-
F yl]benzamide
N~
N N
H
NN n
L '
N-{[(2S)-1-éthylpyrrol idin-2-
yl]méthyl}-4-[3-fluoro-6-
53 N / \ \ / (pyridin-3-yl)-9H-pyrrol o[2,3- 2,22 495,31
F b:5,4-c']dipyridin-4-
yl]benzamide
N\
N N
H
N
NH
o N-(1-éthylpipéridin-3-yl)-4-[3-
54 fluoro-6-(pyridin-3-yl)-9H-
Ni 2,17 495,31
/ pyrrolo[2,3-b:5,4-c']dipyridin-
F 4-yl]benzamide
N~
N N
H
WO 2010/109084 76 PCT/FR2009/052330
N
4-[3-fluoro-6-(pyridin-3-yl)-
o NH 9H-pyrrolo[2,3-b:5,4-
55 c']dipyridin-4-yl]-N-[2-(2- 2,29 509,33
N/ méthylpipéridin-1-
F yl)éthyl]benzamide
N~
N N
H
N
q
o NH 4-[3-fluoro-6-(pyridin-3-yl)-
9H-pyrrolo[2,3-b:5,4-
56 c']dipyridin-4-yl]-N-(1- 0,77 453,25
N méthylazétidin-3-
F yl)benzamide
N~
N N
H
QN
[3-(diméthylamino)pipéridin-
1-yl]{4-[3-fluoro-6-(pyridin-3-
57 N/ \ / yl)-9H-pyrrolo[2,3-b:5,4- 2,17 495,32
F c']dipyridin-4-
yl]phényl}méthanone
N~
N N
D
N
NH 4-[3-fluoro-6-(pyridin-3-yl)-
9H-pyrrolo[2,3-b:5,4-
58 / \ - c']dipyridin-4-yl]-N-[2-méthyl- 2,25 509,33
N \ / 2-(pyrrolidin-1-
F yl)propyl]benzamide
N\
N N
H
WO 2010/109084 77 PCT/FR2009/052330
O
N_ N-[3-(diméthylamino)propyl]-
N/ 4-[3-fluoro-6-(pyridin-3-yl)-
59 - F 9H-pyrrolo[2,3-b:5,4- 2,15 483,31
c']dipyridin-4-yl]-N-
N \ N méthylbenzamide
N
H
0
N
NH N-[2-(azépan-1-yl)éthyl]-4-
[3-fluoro-6-(pyridin-3-yl)-9H-
60 2,29 509,33
pyrrolo[2,3-b:5,4-c']dipyridin-
N/ 4-yl]benzamide
F
N~
N N
H
N
4-[3-fluoro-6-(pyridin-3-yl)-
O NH 9H-pyrrol o[2,3-b:5,4-
61 c']dipyridin-4-yl]-N-[2-(1- 2,23 509,33
méthylpipéridin-4-
N/ yl)éthyl]benzamide
F
N~
N N
H
WO 2010/109084 78 PCT/FR2009/052330
O, /
HN' s,
O
NH 4-[3-fluoro-6-(pyridin-3-yl)-
0 9H-pyrrolo[2,3-b:5,4-
62 c']dipyridin-4-yl]-N-{2- 2,32 505,24
[(méthylsulfonyl)amino]éthyl}
Ni F benzamide
NI\
N N
HH
D
N
NH
NH 4-L3-fluoro-6-(pyridin-3-yI)-
0 9H-pyrrolo[2,3-b:5,4-
63 c']dipyridin-4-yl]-N-[2- 2,22 495,33
NQ/\ (pyrrolidin-1-
F yl)propyl]benzamide
N N
H
-N
N- 4-[3-fluoro-6-(pyridin-3-yl)-
0
9 H-pyrrol o[2,3-b: 5,4-
64 c']dipyridin-4-y1]-N-méthyl-N- 2,20 509,35
Ni [(1-méthylpipéridin-2-
F yl)méthyl]benzamide
N N
H
NH 4-[3-fluoro-6-(pyridin-3-yl)-
0 9H-pyrrolo[2,3-b:5,4-
65 NQ/\ c']dipyridin-4-yl]-N-[2-(1- 2,20 495,3
\ / méthyl pyrrolidin-2-
F yl)éthyl]benzamide
N N
H
WO 2010/109084 79 PCT/FR2009/052330
NH N-[2-(dipropan-2-
N
o ylamino)éthyl]-4-[3-fluoro-6-
66 (pyridin-3-yl)-9H-pyrrolo[2,3- 2,29 511,33
N/ \ b:5,4-c']dipyridin-4-
F yl]benzamide
N\
N N
H
O N
N N-[2-(diméthylamino)éthyl]-
\ N-éthyl-4-[3-fluoro-6-
67 N \ \ / (pyridin-3-yl)-9H-pyrrolo[2,3- 2,18 483,3
F b:5,4-c']dipyridin-4-
N yl]benzamide
N N
H
-N
NH
o N-[1-(diméthylamino)propan-
68 2-yl]-4-[3-fluoro-6-(pyridin-3- 0
Q \ / yl)-9H-pyrrolo[2,3-b:5,4- ,8 469,26
N F c']dipyridin-4-yl]benzamide
N~
N N
H
NJ [(3S)-3-
(diméthylamino)pyrrolidin-1-
69 yl]{4-[3-fluoro-6-(pyridin-3-
N/ \ \ / yl)-9H-pyrrolo[2,3-b:5,4- 0,76 481,29
F c ]dipyridin-4-
yl]phényl}méthanone
N\ \
N N
H
WO 2010/109084 80 PCT/FR2009/052330
O N l_'
4-[3-fluoro-6-(pyridin-3-yl)-
9 H-pyrrol o[2,3-b:5,4-
70 N/ \ F c']dipyridin-4-yl]-N-méthyl-N- 2,14 481,29
(1-méthylpyrrol idin-3-
N yl)benzamide
N N
H
O
N N-[2-(diéthylamino)éthyl]-4-
71 N \ \ / ) [3-fluoro-6-(pyridin- 3-yl)-9H- 2 18 497,33
F pyrrolo[2,3-b:5,4-c]dipyridin-
4-yl]-N-méthylbenzamide
N~
N N
H
/_ N o
`N
O
{4-[3-fluoro-6-(pyridin-3-yl)-
/ \ 9H-pyrrolo[2,3-b:5,4-
72 N _ F c']dipyridin-4-yl]phényl}[4-(2- 2,12 511,32
méthoxyéthyl)pipérazin-1-
N yl]méthanone
N N
H
H
HI /N
N
O 4-[3-fluoro-6-(pyridin-3-yl)-
_ 9H-pyrrolo[2,3-b:5,4-
73 c']dipyridin-4-yl]-N-[(3- 2,32 478,26
N _ F méthyl-1 H-pyrazol-4-
yl)méthyl]benzamide
N~ ~ \
N N
H
WO 2010/109084 81 PCT/FR2009/052330
O N
{4-[3-fluoro-6-(pyridin-3-yl)-
9 H-pyrrol o[2, 3-b:5, 4-
N/ c']dipyridin-4-yl]phényl}(2-
74 0,79 507,23
F méthyloctahydro-5H-
pyrrolo[3,4-c]pyridin-5-
N N yl)méthanone
N
H
-N
NH N-[4-(diméthylamino)butyl]-
0 4-[3-fluoro-6-(pyridin-3-yl)-
75 9H-pyrrolo[2,3-b:5,4- 2,20 483,32
c']dipyridin-4-yl]benzamide
N
F
N~
Ni'
N
H
N~
JL
H N
O N H
4-[3-fluoro-6-(pyridin-3-yl)-
9 H-pyrrol o[2,3-b:5,4-
76 N/ \ \ / c']dipyridin-4-yl]-N-(1 H- 2,14 464,27
F imidazol-2-
ylméthyl)benzamide
N~ \ /
N N
H
N
{4-[3-fluoro-6-(pyridin-3-yl)-
0
9 H-pyrrol o[2,3-b: 5,4-
77 c']dipyridin-4-yl]phényl}(7- 2,15 507,33
N/ méthyl-2,7-
F diazaspiro[4.4]non-2-
N yl)méthanone
N
N
H
WO 2010/109084 82 PCT/FR2009/052330
N/ \
HN
4-[3-fluoro-6-(pyridin-3-yl)-
0 NH 9H-pyrrolo[2,3-b:5,4-
78 c']dipyridin-4-yl]-N-[2- 0,83 504,26
(pyridin-2-
N ylamino)éthyl]benzamide
F
N\ /
N N
H
N
o N N-éthyl-4-[3-fluoro-6-
(pyridin-3-yl)-9H-pyrrol o[2,3-
79 b:5,4-c']dipyridin-4-yl]-N-[(1- 2,22 509,34
N méthylpyrrolidin-3-
F yl)méthyl]benzamide
N N
H
N
N
O
1,3'-bipyrrol idin-1'-yl{4-[3-
80 N \ \ / fluoro-6-(pyridin-3-yl)-9H- 2,14 507,33
F pyrrolo[2,3-b:5,4-c']dipyridin-
4-yl]phényl}méthanone
N~ ~ \ N
N
H
N
N_ 4-[3-fluoro-6-(pyridin-3-yl)-
0 9H-pyrrolo[2,3-b:5,4-
81 c']dipyridin-4-yl]-N-méthyl-N- 2,15 495,34
N \ \ / (1-méthylpipéridin-4-
F yl)benzamide
N\ /
N N
H
WO 2010/109084 83 PCT/FR2009/052330
HO
N
H
N 4-[3-fluoro-6-(pyridin-3-yl)-
0
9 H-pyrrol o[2,3-b: 5,4-
82 c']dipyridin-4-yl]-N-[(2- 2,32 491,27
N/ / hydroxypyridin-4-
F yl)méthyl]benzamide
N N
N
H
Exemples 83 à 86
Procédure générale pour les exemples 83 à 86 :
ci (::~_NH2
O NH
;2:H:w N N NHZ N I /
H E \ N
18 83-86 N N
H
Le chlorure de 4-[3-fluoro-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-
4-
yl]benzoyle 18 (1 eq.) est mis en suspension dans du dichlorométhane (50 mL
pour
1 mmol de 18). Dans un ballon sec et sous atmosphère d'argon, 5 à 10
équivalents
de diamine E sont dissous dans du dichlorométhane (même volume utilisé que
pour
mettre 18 en suspension). La suspension de 18 est ensuite ajoutée à la
solution
contenant E sous agitation à température ambiante. Le mélange est laissé entre
2
et 20 heures sous agitation. Du méthanol est ensuite ajouté jusqu'à
disparition du
précipité, puis de la silice (10 mg pour 1 mg de 18) est ajoutée. Les solvants
sont
évaporés sous pression réduite et le produit est récupéré par chromatographie
sur
gel silice (éluant : CH2CI2 / MeOH ou CH2CI2 / NH3 2N dans MeOH : gradient de
100/0 à 85/15).
Les exemples 83 à 86 obtenus par cette méthode sont décrits dans le tableau 4.
WO 2010/109084 84 PCT/FR2009/052330
Tableau 4
Temps
Ex. de [M+H+]
Structure Nom
n rétention observé
(min)
0-N0
N-[(1 R,2R)-2-
H aminocyclohexyl]-4-[3-
83 F fluoro-6-(pyridin-3-yl)-9H- 0,51 481,36
pyrrolo[2,3-b:5,4-
N\ c']dipyridin-4-
I N yl]benzamide
N N
H
q-H NHZ
NN-[(1 S,2S)-2-
- fluoro-6-(pyridin-3-yl)-9H- 2,51 481,15
F pyrrolo[2,3-b:5,4-
c']dipyridin-4-
N I N yl]benzamide
N
00
H
HNP
N-[(1 S,2S)-2-
o NH 2 aminocyclopentyl]-4-[3-
85 F fluoro-6-(pyridin-3-yl)-9H- 0,46 467,37
N\ c']dipyridin-4-
N yl]benzamide
N N
H
HN" 4 -
p NH2 N [(1 R,2R)-2-
_ aminocyclopentyl]-4-[3-
86 F fluoro-6-(pyridin-3-yl)-9H- 0,46 467,38
pyrrolo[2,3-b:5,4-
N\ c']dipyridin-4-
\ N yl]benzamide
N N
H
WO 2010/109084 85 PCT/FR2009/052330
Exemples 87 à 91
Synthèse de la 1-aminométhyl-cyclopropylamine :
La synthèse de la 1-aminométhyl-cyclopropylamine est effectuée par
hydrogénation
tel que décrit dans J.Org.Chem. 1992, 57(22), 6071-6075.
Synthèse de la 2,2-difluoro-propan-1,3-diamine :
F F NH3 / McOH F F BH3 / THF
HZN~ NHZ F~/F
_ H2NNH2
O O O O
Dans un tricol de 250 mL, 45 mL de méthanol ammoniacal (7N) sont ajoutés sur 5
g
(25 mmol) de difluoromalonate d'éthyle à 0 C. Le mélange est agité jusqu'à un
retour à température ambiante, puis laissé une nuit sous agitation. Le
difluoromalonadiamide est récupéré en évaporant le mélange sous pression
réduite
(3,35 g ; 95% rdt). 500 mg de ce résidu sont placés dans un tube micro-onde,
puis
17 mL d'une solution d'hydrure de bore - tetrahydrofuranne (BH3-THF 1M dans
THF) sont ajoutés lentement à 0 C. Après un retour à température ambiante, le
mélange est laissé sous agitation jusqu'à la fin du dégagement gazeux. Le tube
est
scellé puis chauffé sous micro-onde 30 minutes à 120 C. 5 mL de méthanol sont
alors ajoutés sur le milieu réactionnel préalablement refroidi à 0 C. Les
solvants sont
évaporés sous pression réduite. Le résidu est repris avec 20 mL de méthanol
puis
amené à sec, cette opération étant renouvelée deux fois. 291 mg de 2,2-
difluoro-
propan-1,3-diamine sont obtenus et seront utilisés dans l'étape suivante sans
purification supplémentaire.
Synthèse de la 2-trifluorométhyl-propan-1,2-diamine :
La 2-trifluorométhyl-propan-1,2-diamine est préparée de façon racémique en
suivant la synthèse décrite dans J.Org.Chem. 2006, 71(18), 7075-7079. Pour
obtenir
le composé racémique, l'alpha-méthyle-benzylamine optiquement pure utilisée
dans
la publication est juste remplacée par de la benzylamine dans la première
étape du
procédé. La suite de la synthèse se déroule conformément à la publication.
Procédure générale pour les exemples 87 à 91
WO 2010/109084 86 PCT/FR2009/052330
et Ra
F Pyridine, TEA F
N
N \ / Amine D N
N N
N
o0
18 H 87-91 H
Dans un ballon sec et sous atmosphère d'argon, 1,2 mmol (10 éq.) d'amine D
sont
dissous dans 0,5 mL de pyridine anhydre (ajout de triéthylamine au cas où
l'amine E
soit sous forme de chlorhydrate). Le chlorure de 4-[3-fluoro-6-(pyridin-3-yl)-
9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzoyle 18 (50 mg, 0,124 mmol, 1 eq.) est
dissous
dans 1 mL de pyridine. Cette solution est ensuite ajoutée à la solution
contenant D
sous agitation à température ambiante. Le mélange est laissé entre 30 minutes
et 2
heures sous agitation, si la réaction est incomplète au bout de 2 heures, elle
peut
également être chauffée 30 minutes sous micro-ondes à 140 C. La pyridine est
ensuite évaporée sous pression réduite. Le résidu est dissous dans un mélange
CH2CI2/MeOH et 500 mg de silice sont ajoutés. Les solvants sont évaporés sous
pression réduite et le produit est récupéré par chromatographie sur gel silice
(éluant : CH2CI2 / MeOH ou CH2CI2 / NH3 2N dans MeOH : gradient de 100/0 à
85/15).
Les exemples 87 à 91 obtenus par cette méthode sont décrits dans le tableau 5.
Tableau 5
Temps
Ex. n Structure Nom de [M+H+]
rétention observé
(min)
WO 2010/109084 87 PCT/FR2009/052330
O NH
N-[2-(éthylamino)éthyl]-4-
[3-fluoro-6-(pyridin-3-yl)- 0,41
87 N F 9H-pyrrolo[2,3-b:5,4- 455,16
/ \ - c']dipyridin-4-yl]benzamide
N \ i
N N
H
N H
O
4-[3-fluoro-6-(pyridin-3-yl)-
9 H-pyrrol o[2,3-b: 5,4-
88 Ni Q\/, / F c']dipyridin-4-yl]-N-[2- 0,40 441,14
(méthylamino)éthyl]benza
/ \ - mide
N
N N
H
H
Nom/ NHZ
4/, N-[(1-
aminocyclopropyl)méthyl]-
89 N 4-[3-flu
oro-6-(pyridin-3-yl)- 0,42 453,17
F 9H-pyrrolo[2,3-b:5,4-
c']dipyridin-4-yl]benzamide
N H
F F NH
H Z
lue/
N
4\/ N-(3-amino-2,2-
d ifluoropropyl)-4-[3-fluoro-
90 N 6-(pyridin-3-yl)-9H- 2,24 477,13
F pyrrolo[2,3-b:5,4-
c']dipy
ridin-4-yl]benzamide
N H
F F
H
N ~F
N-(2-amino-3,3,3-trifluoro-
2-méthylpropyl)-4-[3-
91 - \ / fluoro-6-(pyridin-3-yl)-9H- 2,62 509,14
N F pyrrolo[2,3-b:5,4-
/ c']dipyridin-4-yl]benzamide
N \ i
N N
H
WO 2010/109084 88 PCT/FR2009/052330
Exemples 92 à 98
Exemple 92 : 2',5'-dichloro-5-fluoro-[3,4']bipyridinyl-2-ylamine
Pd(PPh3)4 F
CI LDA / THF Dioxane/Cul ci
Me3SnCI / -78 C Sn, rfx
N CI \ - , \ N
NHZ N > NH2
CI N CI ~
N
A3 CI 92
F
Une solution de 10,45 mL (74,32 mmol) de diisopropylamine dans 1000 mL de
tétrahydrofuranne est agitée sous atmosphère d'argon à -78 C. 28,6 ml (74,32
mmol) d'une solution de butyllithium (2,5 M) dans l'hexane sont additionnés
lentement en conservant la température en dessous de -70 C. Après 30 minutes
d'agitation à -78 C, une solution de 10 g (67,57 mmol) de 2,5-dichloropyridine
dans
200 mL de tétrahydrofuranne est additionée en 25 minutes. Après 1 h30
d'agitation à
-78 C, 17,5 g (87,84 mmol) de chlorure de triméthylétain et 100 mL de
tétrahydrofuranne sont additionnés goutte à goutte. Le mélange réactionnel est
agité
14 heures à température ambiante puis hydrolysé avec 400 mL de solution
saturée
de chlorure d'ammonium et 350 mL d'eau. La suspension est extraite avec 3 fois
500 mL d'acétate d'éthyle. La solution organique est décantée, séchée sur
sulfate de
magnésium puis concentrée à sec à l'évaporateur rotatif pour donner 27 g d'une
huile mobile qui est purifiée par chromatographie sur silice (200 g), éluant :
cyclohexane / acétate d'éthyle = 97,5 / 2,5 en volume. 12,46 g (59%) de 2,5-
dichloro-4-triméthylstannanyl-pyridine A3 sous forme d'une poudre blanche sont
obtenus.
La réaction est réalisée en 4 passes d'environ 1,5 g dans un réacteur de 20 mL
type
vial Biotage et au four micro-ondes Biotage.
Une suspension de 1,5 g de 5-fluoro-3-iodo-2-aminopyridine (6,3 mmol), 2,15 g
(6,93 mmol) de 2,5-dichloro-4-triméthylstannanyl-pyridine, 0,25 g (1,32 mmol)
de
chlorure de cuivre (I), et 0,515 g (0,44 mmol) de
tetrakis(triphenylphosphine)palladium(0) dans 15 mL de dioxane et 0,1 mL de
diméthylformamide est chauffée à 120 C pendant 1 h20 aux micro-ondes.
Les quatre bruts réactionnels sont ensuite rassemblés et dilués dans 80 mL
d'acétate d'éthyle, lavés avec 90 mL d'une solution saturée de bicarbonate de
WO 2010/109084 89 PCT/FR2009/052330
sodium, puis avec 90 mL d'eau. Après séchage sur sulfate de magnésium, la
phase
organique est concentrée à l'évaporateur rotatif puis purifiée par
chromatographie
sur silice (90 g), éluant : cyclohexane / acétate d'éthyle = 9 / 1 puis 8 / 2
en volume
pour donner 4, 22 g (68%) de 2',5'-dichloro-5-fluoro-[3,4']bipyridinyl-2-
ylamine 92
sous forme d'une poudre jaune pâle.
UPLC-MS-DAD-ELSD : Tr (min) = 3,35; [M+H]+ : m/z 299,06 et 301,08
Exemple 93 : 6-chloro-3-fluoro-9H-pyrrolo[2,3-b:5,4-c']dipyridine
F KZCO3
DMSO/Cul F
e,IN 170 C 1 Oh -
CI /
N
N N
H
CI 92 93
Une suspension de 4,2 g (16,27 mmol) de 2',5'-dichloro-5-fluoro-
[3,4']bipyridinyl-2-
ylamine, 7 g (48,81 mmol) de carbonate de potassium et 0,62 g (3,25 mmol)
d'iodure
de cuivre dans 100 mL de diméthylsulfoxyde est chauffée au bain d'huile à 170
C
pendant 3h30. Le mélange réactionnel est alors agité dans 300 g de glace et
250 mL
de solution à 28% d'ammoniaque pendant 1 heure puis extrait avec 5 fois 300 mL
d'acétate d'éthyle. Les phases organiques sont rassemblées, séchées sur
sulfate de
magnésium et concentrées à sec à l'évaporateur rotatif pour donner un solide
âcre
qui est trituré dans 80 mL d'éther éthylique. La suspension est filtrée,
éssorée et
séchée pour donner 1,75 g (49%) de 6-chloro-3-fluoro-9H-dipyrido[2,3-b:4',3'-
d]pyrrole 93 sous forme d'une poudre ocre.
UPLC-MS-DAD-ELSD : Tr (min) = 0,73; [M+H]+ : m/z 257,95 et 259,93
Exemple 94: 6-chloro-3-fluoro-9-[(4-méthylphényl)sulfonyl]-9H-pyrrolo[2,3-
b:5,4-c']dipyridine
F
F NaH / DMF
puis TsCI CI /
CI \ N N / N\ N
N - N 0=S
H 93 94 p
Le 6-chloro-3-fluoro-9H-dipyrido[2,3-b:4',3'-d]pyrrole 93 (800 mg, 3,6 mmol)
est
dissous dans 20 mL de DMF dans un monocol sec et sous argon (un léger
WO 2010/109084 90 PCT/FR2009/052330
chauffage à 35 C peut-être nécessaire dans certains cas pour une dissolution
complète). L'hydrure de sodium (245 mg, 6,1 mmol, 1,7 eq.) est ajouté en une
seule
fois, puis le mélange réactionnel est agité sous atmosphère inerte durant 3
heures.
Le chlorure de tosyle dissous dans 2 mL de DMF est ensuite ajouté (durée
d'introduction environ deux minutes). Après une heure le milieu réactionnel
est versé
sur un mélange d'une solution aqueuse de NaHCO3 10% (50 mL) et d'eau (30 mL).
Le précipité est filtré puis essoré avec 50 mL d'eau. Après séchage (une
nuit), le
précipité est purifié par chromatographie sur gel de silice (pas besoin
d'empattage
sur silice le produit est suffisamment soluble dans le dichlorométhane 70 g
Si02,
CH2CI2/AcOEt: 100/0 à 90/10). On obtient 1,02 g (75%) de 6-chloro-3-fluoro-9-
(toluene-4-sulfonyl)-dipyrido[2,3-b:4',3'-d]pyrrole 94.
UPLC-MS-DAD-ELSD : Tr (min)=1,10; [M+H]+: m/z 375,99 et 377,95
Exemple 95 : 6-chloro-3-fluoro-4-iodo-9-[(4-méthylphényl)sulfonyl]-9H-
pyrrolo[2,3-b:5,4-c']dipyridine
F F
LDA/THF
CI / I2 / -78 C CI /
N N
N N N / N
o=S o=S
Il Il
94 O \ 95 O \
A une solution de 0,37 mL (2,6 mmol) de diisopropylamine dans 6 mL de
tétrahydrofuranne est ajoutée sous atmosphère d'argon goutte à goutte en
environ
deux minutes à -78 C 1 ml (2,5 mmol) d'une solution de butyllithium (2,5 M)
dans
l'hexane. Après 30 minutes d'agitation à -78 C, une solution de 94 (620 mg,
1,6
mmol) dans 25 mL de THF est ajoutée lentement (durée totale de l'introduction
environ 10 minutes). Après 3 heures à -78 C une solution de diiode (670 mg)
dans 2
mL de THF est ajoutée rapidement. Après 30 minutes d'agitation à -78 C, le
milieu
réactionnel est versé sur un mélange d'acétate d'éthyle (150 mL) et d'une
solution
aqueuse de chlorure d'ammonium demi-saturée (50 mL de NH4CI aq saturée + 50
mL d'eau). Les phases sont séparées, puis la phase organique est lavée par une
solution aqueuse de thiosulfate de sodium 5%. La phase organique est séchée
sur
MgSO4, filtrée puis évaporée sous pression réduite. On obtient 615 mg (74%) de
6-
chloro-3-fluoro-4-iodo-9-(toluene-4-sulfonyl)-dipyrido[2,3-b:4',3'-d]pyrrole
95.
WO 2010/109084 91 PCT/FR2009/052330
UPLC-MS-DAD-ELSD : Tr (min)=1,19; [M+H]+: m/z 501,89 et 503,85
Exemple 96 : 6-chloro-3-fluoro-4-iodo-9H-pyrrolo[2,3-b:5,4-c']dipyridine
F
LiOH / H20 F
CI N THF /MeOH CI
N
N N
O=S N N
95 0 / 96 H
Le 6-chloro-3-fluoro-4-iodo-9-(toluene-4-sulfonyl)-dipyrido[2,3-b:4',3'-
d]pyrrole 95
(615 mg, 1,2 mmol) est dissous dans 40 mL de THF et 15 mL de MeOH. Une
solution aqueuse de lithine monohydratée (503 mg, 12 mmol dans 20 mL d'eau)
est
ajoutée rapidement. Après 2 heures sous agitation, 80 mL d'eau sont ajoutés
puis le
milieu est acidifié par ajout d'une solution aqueuse d'acide chlorhydrique 1 N
(environ
12 ml-) jusqu'à pH = 4. Le précipité est filtré sur un verre fritté porosité
4, essoré
avec 20 mL d'eau puis séché (une nuit). On obtient 415 mg (97%) de 6-chloro-3-
fluoro-4-iodo-9H-dipyrido[2,3-b:4',3'-d]pyrrole 96.
UPLC-MS-DAD-ELSD : Tr (min)=0,93; [M+H]+ : m/z 347,91 et 349,90
Exemple 97 : acide 4-[3-fluoro-6-chloro-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-
yl]benzoïque
Pd(PPh3)4
Cs2C03 dioxanne/ eau OH
-o o~ O
B
o
CI O F
N
N N puis NaOH 1 N CI
H N
96 N / N 97
H
Dans un tricol, on place 625 mg de 6-chloro-3-fluoro-4-iodo-9H-dipyrido[2,3-
b:4',3'-
d]pyrrole 96, 1,415 g de 4-methoxycarbonylphenylboronic acid pinacol ester,
208 mg
de tetrakis(triphenylphosphine)palladium(0), 1,76 g de carbonate de césium
dans 40
ml de 1,4-dioxanne et 8 ml d'eau, le mélange est ensuite chauffé à reflux
durant 18-
20 heures. Au milieu réactionnel sont ajoutés 4 ml d'une solution aqueuse
d'hydroxyde de sodium 1 N, le milieu réactionnel est laissé une heure
supplémentaire
à reflux. Après refroidissement, le milieu réactionnel est versé sur un
mélange d'eau
et d'acétate d'éthyle sous forte agitation. Les phases sont séparées, le pH de
la
phase aqueuse est ensuite ramené à 4 par ajout d'une solution aqueuse d'acide
WO 2010/109084 92 PCT/FR2009/052330
chlorhydrique. Le précipité se formant lors de cette acidification est filtré,
essoré et
séché sous vide. 540 mg (88%) de l'acide 4-[3-fluoro-6-chloro-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzoïque 97 sont ainsi obtenus.
UPLC-MS-DAD-ELSD : Tr (min)= 0,73 ; [M-H]- m/z 340,08 et 342,02
Exemple 98 : acide 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-
b: 5,4-c']dipyridin-4-yl]benzoïque
OH OH
O Pd(PPh3)4 O
Cs2CO3 dioxanne/ eau
F Micro-onde 140 C \ \ / F
N
N
CI I N \N:>-'O I \ N
97 N/ N N/ N
H 98 H
Dans un réacteur pour micro-onde de 50 mL, sont placés 440 mg d'acide 4-[3-
fluoro-
6-chloro-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzoïque 97, 148 mg de
tetrakis(triphenylphosphine)palladium(0), 804 mg de 1 -methyl-4-(4,4,5,5-
tetramethyl-1,3,2-dioxaborolan-2-yl)-1 H-pyrazole, 1,26 g de carbonate de
césium
dans 25 ml de 1,4-dioxanne et 5 ml d'eau, le tube est scellé puis soumis à
irradiation
microonde à 140 C pendant 2 heures. Le mélange réactionnel est dilué par 50
ml
d'acétate d'éthyle et lavé par 50 ml d'eau. Après décantation, la phase
aqueuse est
extraite par 100 ml d'acétate d'éthyle puis les phases organiques sont
réunies,
séchées sur sulfate de magnésium, filtrées puis concentrées sous vide. Le
résidu est
purifié par chromatographie sur colonne de silice (éluant: CH2CI2/MeOH 100/0 à
95/5). 321 mg (64%) de l'acide 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzoïque 98 sont obtenus sous forme de
solide
jaune.
UPLC-MS-DAD-ELSD : Tr (min)= 0,55; [M+H]+: m/z 388,14 et [M-H]- m/z 386,20
Exemples 99 à 105
Procédure générale pour les exemples 99 à 105 :
WO 2010/109084 93 PCT/FR2009/052330
OH Ra
O
1 ) SOCIZ
\ F reflux IV \ F
N
N 2 ) Amine D N
\ \ N CH2CI2 N1 N
9g N H H 99-105
Un mélange de 100 mg d'acide 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzoique et de 12 ml de chlorure de
thionyle est
chauffé à reflux pendant 2 heures. Le mélange réactionnel est concentré à sec
sous
pression réduite pour donner 105 mg de chlorure de 4-[3-fluoro-6-(1-méthyl-1 H-
pyrazol-4-yl)-9 H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]benzoyle sous forme
d'une poudre
jaune.
Le chlorure de 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-
c']dipyridin-4-yl]benzoyle (1 eq.) est mis en suspension dans du
dichlorométhane (50
mL pour 1 mmol de chlorure d'acyle). Dans un ballon sec et sous atmosphère
d'argon, 5 à 10 équivalents de l'amine D sont dissous dans du dichlorométhane
(même volume utilisé que pour mettre 18 en suspension). La suspension est
ensuite
ajoutée à la solution contenant D sous agitation à température ambiante. Le
mélange est laissé entre 2 et 20 heures sous agitation. Du méthanol est
ensuite
ajouté jusqu'à disparition du précipité, puis de la silice (10 mg pour 1 mg
d'acide 98
engagé dans la réaction) est ajoutée. Les solvants sont évaporés sous pression
réduite et le produit est récupéré par chromatographie sur gel silice (éluant
: CH2CI2 /
MeOH ou CH2CI2 / NH3 2N dans MeOH : gradient de 100/0 à 85/15).
Les exemples 99 à 105 obtenus par cette méthode sont décrits dans le tableau
6.
Tableau 6
Temps
Ex. n Structure Nom de [M+H+]
rétention observé
min
WO 2010/109084 94 PCT/FR2009/052330
(N
\-N, 0 4-[3-fluoro-6-(1 -méthyl-1 H-
H pyrazol-4-yl)-9H-
99 \ / F pyrrolo[2,3-b:5,4- 0,37 485,14
N c']dipyridin-4-yl]-N-(4-
N~ I - méthylpipérazin-1-
1 N yl)benzamide
N
H
N
0 4-[3-fluoro-6-(1 -méthyl-1 H-
N pyrazol-4-yl)-9H-
H _
100 / pyrrolo[2,3-b:5,4- 0,40 484,16
F c']dipyridin-4-yl]-N-(1-
NN méthylpipéridin-4-
1 yl)benzamide
N N
H
OH
C~N 0 4-[3-fluoro-6-(1 -méthyl-1 H-
~N pyrazol-4-yl)-9H-H pyrrolo[2,3-b:5,4-
101 0,38 500,38
F c']dipyridin-4-yl]-N-{2-[(3R)-
N 3-hydroxypyrrolidin-1-
1 N
N I \ \ yl]éthyl}benzamide
N N
H
OH
ON
0 4-[3-fluoro-6-(1 -méthyl-1 H-
N pyrazol-4-yl)-9H-
102 H pyrrolo[2,3-b:5,4- 0,39 500,38
F c']dipyridin-4-yl]-N-{2-[(3S)-
N 3-hydroxypyrrolidin-1-
1 N
N I \ \ yl]éthyl}benzamide
N N
H
WO 2010/109084 95 PCT/FR2009/052330
HO
O
H 4-[3-fluoro-6-(1-méthyl-1 H-
- pyrazol-4-yl)-9H-
103 F pyrrolo[2,3-b:5,4- 0,45 431,22
N c']dipyridin-4-yl]-N-(2-
I N
N I \ \ hydroxyéthyl)benzamide
N N
H
O NH2
4-[3-fluoro-6-(1-méthyl-1 H-
F pyrazol-4-yl)-9H-
104 N pyrrolo[2,3-b:5,4- 0,46 387,16
I N
N I \ \ c']dipyridin-4-yl]benzamide
N N
H
OENNHZ
H aminocyclohexyl]-4-[3-
fluoro-6-(1-méthyl-1 H-
105 N F pyrazol-4-yl)-9H- 0,47 484,38
N pyrrolo[2,3-b:5,4-
I N c']dipyridin-4-yl]benzamide
N N
H
Exemples 106 et 107
OH Ra
O
1 ) SOCI2
\ F reflux 24 heures \N et F
N _
N 2 ) Amine D N
I \ N CH2CI2 NI / N
98 N / H N
106-107
Un mélange de 100 mg d'acide 4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzoique et de 20 ml de chlorure de
thionyle est
chauffé à reflux pendant 24 heures. Le mélange réactionnel est concentré à sec
sous pression réduite pour donner 105 mg de chlorure de 4-[3-fluoro-6-(5-
chloro-1-
méthyl-1 H-pyrazol-4-yl)-9H-pyrrol o[2,3-b:5,4-c']dipyridin-4-yl]benzoyle sous
forme
d'une poudre jaune.
WO 2010/109084 96 PCT/FR2009/052330
Le chlorure de 4-[3-fluoro-6-(5-chloro-1 -méthyl-1 H-pyrazol-4-yl)-9H-pyrrol
o[2,3-b:5,4-
c']dipyridin-4-yl]benzoyle (1 eq.) est mis en suspension dans du
dichlorométhane (50
mL pour 1 mmol de chlorure d'acyle). Dans un ballon sec et sous atmosphère
d'argon, 5 à 10 équivalents de l'amine D sont dissous dans du dichlorométhane
(même volume utilisé que pour mettre 18 en suspension). La suspension est
ensuite
ajoutée à la solution contenant D sous agitation à température ambiante. Le
mélange est laissé 2 heures sous agitation. Du méthanol est ensuite ajouté
jusqu'à
disparition du précipité, puis de la silice (10 mg pour 1 mg d'acide 98 engagé
dans la
réaction) est ajoutée. Les solvants sont évaporés sous pression réduite et le
produit
est récupéré par chromatographie sur gel silice (éluant : CH2CI2 / MeOH ou
CH2CI2 /
NH3 2N dans MeOH : gradient de 100/0 à 85/15).
Les exemples 106 et 107 obtenus par cette méthode sont décrits dans le tableau
7.
Tableau 7
Temps
Ex. n Structure Nom de [M+H+]
rétention observé
min
No
N O
H 4-[6-(5-chloro-1 -méthyl-1 H-
pyrazol-4-yl)-3-fluoro-9H- 519,16
106 N ci F pyrrolo[2,3-b:5,4-c']dipyridin-4- 2,34 et
N' yl]-N-(4-méthylpipérazin-1- 521,13
i N yl)benzamide
N N
H
N 4-[6-(5-chloro-1 -méthyl-1 H-
H - pyrazol-4-yl)-3-fluoro-9H-
107 ci \ / F pyrrolo[2,3-b:5,4-c']dipyridin-4- 2,45 518,17
N yl]-N-(1-méthylpipéridin-4-
N\ I I yl)benzamide
N
N N
H
WO 2010/109084 97 PCT/FR2009/052330
Exemples 108 et 109
NH2 1 1
0 =.NH õ= N/
Acétaldéhyde O O
H NaBH3CN N Q Q
N
McOH,AcOH H H
\N \ / F F + \ / F
N 1 N N
\ N N
N I il N N il N
105 H 108 N N 109 N N
H H
Dans un tube sec sous atmosphère d'argon, 13 mg de N-[(1 S,2S)-2-
aminocyclohexyl]-4-[3-fluoro-6-(1-méthyl-1 H-pyrazol-4-yl)-9H-pyrrolo[2,3-
b:5,4-
c']dipyridin-4-yl]benzamide 105 sont dissous dans 2,5 mL de méthanol et 0,1 mL
d'acide acétique glacial. L'acétaldéhyde est ensuite introduit via une
seringue (35 pL
d'une solution méthanolique d'acétaldéhyde 1 M fraichement préparée). Le
mélange
est laissé 5 minutes sous agitation puis le cyanoborohydrure de sodium est
ajouté
en une portion. Après 1 h30, le produit de mono réaction 108 est majoritaire,
lorsque
la réaction est laissée une nuit sous agitation, le dérivé diéthylamino 109
est alors
majoritaire. Dans les deux cas, la réaction est hydrolysée par une solution
aqueuse
de bicarbonate de sodium à 5%, puis extraite par 40 mL d'acétate d'éthyle.
Après
séparation des phases, la phase organique est séchée sur MgSO4, filtrée puis
évaporée. Le résidu est purifié par chromatographie sur gel de silice (5g de
silice,
éluant: CH2CI2 / NH3 2N dans MeOH : 100/0 à 98/2). Dans chacun des cas 10 mg
des composés 108 et 109 sont obtenus.
Les exemples 108 et 109 obtenus par cette méthode sont décrits dans le tableau
8.
Tableau 8
Temps
Ex. n Structure Nom de [M+H+]
rétention observé
(min)
WO 2010/109084 98 PCT/FR2009/052330
0
OEN NH
H (éthylamino)cyclohexyl]-4-[3-
108 N \ / F fluoro-6-(1-méthyl-1 H-pyrazol- 2,52 512,35
N 4-yl)-9H-pyrrolo[2,3-b:5,4-
N I \ c']dipyridin-4-yl]benzamide
il N
N N
H
Nô N-[(1 S,2S)-2-
N (diéthylamino)cyclohexyl]-4-[3-
H fluoro-6-(1 -méthyl-1 H-pyrazol-
109 2,62 540,37
F 4-yl)-9H-pyrrolo[2,3-b:5,4-
N c']dipyridin-4-yl]benzamide
N
N N
H
Exemples 110 à 113
Exemples 110 et 111
1 ) Pd(PPh3)4, CuCI
OH Cs2CO3 DMF 1 ) Pd(PPh3)4, CuCI OH
O' F N CS2CO3 DMF O_
F B ~ o
B N
ô o F o N o N
N~
F 2 ) LiOH,H20 2 ) LiOH,H20 F
d THF, McOH, H2O N N THF, MeOH, H2O N~
N puis HClaq SO ToI puis HClaq N
111 H z 110 H
Dans un tube micro-onde de 5 mL, 250 mg de 3-fluoro-4-iodo-9-[(4-
méthylphényl)su lfonyl]-6-(pyridin-3-yl)-9 H-pyrrolo[2,3-b:5,4-c']dipyridine
4, 3
équivalents du boronate de pinacol approprié, 53 mg de
tetrakis(triphenylphosphine)palladium(0), 300 mg de carbonate de césium et 68
mg
de chlorure de cuivre (I) sont mis en suspension dans 4,5 ml de DMF, le tube
est
scellé et soumis à une irradiation micro-onde à 120 C pendant 1 h. Le milieu
réactionnel est hydrolysé par 100 ml d'eau puis celui-ci est extrait par 2
fois 250 ml
WO 2010/109084 99 PCT/FR2009/052330
d'acétate d'éthyle. Les phases organiques sont réunies, séchées sur sulfate de
sodium, filtrées et concentrées à sec sous pression réduite. Le résidu est
ensuite
repris dans un mélange de tétrahydrofuranne (2,5 ml-) et de méthanol (2,5 mL),
puis
2,5 mL une solution aqueuse d'hydroxyde de lithium 2N sont ajoutés. Après
disparation totale du produit de départ, de l'eau est ajoutée au milieu
réactionnel et
le pH est ramené à 4 par ajout d'une solution aqueuse d'acide chlorhydrique.
Le
précipité formé est isolé par filtration, rincé par de l'eau distillée, essoré
puis séché
sous vide.
138 mg (74%) de 110 sont ainsi obtenus
UPLC-MS-DAD-ELSD : Tr (min)= 0,57; [M+H]+: m/z 386,12
144 mg (69%) de 111 sont ainsi obtenus
UPLC-MS-DAD-ELSD : Tr (min)= 0,69 ; [M+H]+: m/z 403,11
Exemples 112 et 113 :
OH HN--,,,N
O O
-N 1 ) SOCIZ -N
F reflux
F
2 ) CHZCIZ
N
N N^,NH2 N N
N
110 H 112 N N
H
OH HN--\_N
O O
1 SOCIZ
F F reflux F
F
2 ) CHZCIZ _
N
N NCiNH2 N N
111 N H 113 N N
H
0,35 mmol de l'acide approprié (110 ou 111) est mis en suspension dans 10 ml
de
chlorure de thionyle, le mélange est ensuite chauffé à reflux pendant une
nuit. Le
mélange réactionnel est concentré à sec sous pression. Le résidu est mis en
suspension dans 5 mL de dichlorométhane, puis 3,5 mmol (10 éq.) de N,N-
diméthyléthylènediamine sont ensuite ajoutées. Après une nuit à température
ambiante sous agitation, du méthanol est ensuite ajouté jusqu'à disparition du
précipité, puis de la silice (1 à 2 g) est ajoutée. Les solvants sont évaporés
sous
WO 2010/109084 100 PCT/FR2009/052330
pression réduite et le produit est récupéré par chromatographie sur gel silice
(éluant : CH2CI2 / NH3 2N dans MeOH : gradient de 100/0 à 90/10).
Les exemples 112 et 113 obtenus par cette méthode sont décrits dans le tableau
9.
Tableau 9
Temps
Ex. n Structure Nom de [M+H+]
rétention observé
(min)
- - ' \ , N
O
-N N-[2-(diméthylamino)éthyl]-5-
112 \ / F [3-fluoro-6-(pyridin-3-yl)-9H- 0,38 456,16
pyrrolo[2,3-b:5,4-c']dipyridin-4-
N \ I yl]pyridine-2-carboxamide
il N
N N
H
HN \
O
N-[2-(d i méthylam i no)éthyl]-2-
113 F \ / F fluoro-4-[3-fluoro-6-(pyridin-3- 0,41 473,17
yl)-9H-pyrrolo[2,3-b:5,4-
N~ N c']dipyridin-4-yl]benzamide
il
N N
H
Exemples 114 à 120
SnMe3 Pd(PPh3)4 H N N Pd(OAc)2, Josiphos N
CI 2 95 lCi1 nuite ,-,r-,D tBuOK, dioxanne
N 95 C 1 nuit
N i N
N Ci N N
Al N HZN N 114 115 H
2,90 g (13,8 mmol) de 2-amino-3-iodo-pyridine, 4,7 g (13,2 mmol) de 5-chloro-4-
(triméthylstannanyl)-2,3'-bipyridine Al sont placés dans un tricol de 250 mL,
1,07 g
(7% mol) de tetrakis(triphenylphosphine)palladium(0) et 531 mg d'iodure de
cuivre(I)
sont ajouté en une portion ainsi que 80 ml de 1,4-dioxanne. Le mélange est
porté au
WO 2010/109084 101 PCT/FR2009/052330
reflux durant 18 heures. Après refroidissement, le milieu réactionnel est
traité par
une solution aqueuse d'hydrogénocarbonate de sodium à 10% puis dilué à
l'acétate
d'éthyle. Après décantation, la phase aqueuse est extraite deux fois à
l'acétate
d'éthyle. Les phases organiques réunies sont séchées sur sulfate de sodium
anhydre, filtrées et concentrées sous pression réduite. Le résidu est repris
dans un
mélange de dichlorométhane et de méthanol, puis est essoré pour donner 1,9 g
(51%) de 5'-chloro-3,2':4',3"-terpyridin-2"-amine 114 sous forme d'un solide
beige
clair qui sera utilisé sans autre purification dans l'étape suivante.
Dans un ballon de 25 ml sec et sous atmosphère d'argon, 237 mg de (R)-(-)-1-
[(S)-
2-(dicyclohexylphosphino)ferrocenyl]ethylditerbutylphosphine et 85 mg
d'acétate de
palladium (II) sont dissous dans 4 ml de 1,4-dioxanne anhydre sous atmosphère
d'argon et le mélange est agité 10 min à 40 C.
Dans un réacteur de 100 ml, sous argon, 1,8 g de 5'-chloro-3,2':4',3"-
terpyridin-2"-
amine sont dissous dans 30 ml de 1,4-dioxanne anhydre avec 1,12 g de
terbutylate
de potassium puis la solution de catalyseur préparée précédemment est ajoutée.
Le
mélange réactionnel est porté au reflux 18 h. Après concentration sous
pression
réduite, le produit est purifié par chromatographie sur colonne de silice
(éluant :
CH2CI2 / MeOH : 98/2 à 92/8) pour donner 1,06 g (68%) de 6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridine sous forme d'un solide marron clair.
1H NMR (400 MHz, DMSO-d6) 8 ppm : 7.35 (dd, J=8.0, 4.5 Hz, 1 H) 7.53 (dd,
J=8.5,
4.5 Hz, 1 H) 8.51 (dt, J=8.5, 1.5 Hz, 1 H) 8.59 (dd, J=4.5, 1.5 Hz, 1 H) 8.62
(dd,
J=4.5, 1.5 Hz, 1 H) 8.72 (dd, J=8.0, 1.5 Hz, 1 H) 8.91 (d, J=1.0 Hz, 1 H) 9.03
(d,
J=1.0 Hz, 1 H) 9.37 (d, J=1.5 Hz, 1 H) 12.3 (m étalé, 1 H)
LC-MS-DAD-ELSD : [M+H]+ : m/z 247
Exemple 116 : 3-bromo-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine
N
Br
Br2 N
N N\ -N
N H
N
115 H 116
Dans un ballon, on introduit 360 mg de 115, 15 mL d'acide acétique et 10 mL de
diméthylformamide. Après agitation, on ajoute goutte à goutte 0,3 mL de brome.
WO 2010/109084 102 PCT/FR2009/052330
Après 3 heures d'agitation à température ambiante, le précipité est filtré
puis rincé
par une solution aqueuse de thiosulfate de sodium et par de l'eau. Après
séchage on
obtient 463 mg (97%) de 3-bromo-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridine
116.
1H NMR (400 MHz, DMSO-d6) 8 ppm : 7.54 (dd, J=8.0, 4.9 Hz, 1 H) 8.47 (dt,
J=8.0,
2.0 Hz, 1 H) 8.60 (dd, J=4.9, 2.0 Hz, 1 H) 8.69 (d, J=2.4 Hz, 1 H) 8.93 (s, 1
H) 9.00
(d, J=2.4 Hz, 1 H) 9.05 (s, 1 H) 9.34 (d, J=2.0 Hz, 1 H) 12.55 (m étalé, 1 H)
Exemple 117 : 3-(2-méthoxyéthoxy)-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridine
N N
NaH, DMF I
Br Cul O-)
N O.Na N \
N N
116 H _\oH 117 H
Dans un tube micro-onde de 5 mL, 180 mg de 3-bromo-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridine 116, 169 mg d'iodure de cuivre(I) sont mis en
solution
dans 4,1 ml de méthoxyethanoate de sodium à 21 % en solution dans le
méthoxyéthanol et 0,4 ml de diméthylformamide, le tube est scellé puis soumis
à
une irradiation micro-onde pendant 45 min à 120 C. Après refroidissement, le
milieu
réactionnel est versé sur un mélange de 50 ml d'acétate d'éthyle et d'une
solution
aqueuse de chlorure d'ammonium sous forte agitation. Après décantation, la
phase
organique est séchée sur sulfate de sodium, filtrée et concentrée à sec. Le
résidu
est purifié par chromatographie sur colonne de silice (éluant CH2CI2/MeOH :
100 / 0
à 95 / 5) pour donner 132 mg (74%) de 3-(2-méthoxyéthoxy)-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridine 117.
1H NMR (400 MHz, DMSO-d6) 8 ppm 3.36 (s, 3 H) 3.76 (t, J=4.9 Hz, 2 H) 4.27 (t,
J=4.4 Hz, 2 H) 7.53 (dd, J=7.9, 4.8 Hz, 1 H) 8.39 - 8.41 (m, 2 H) 8.48 (dt,
J=8.0, 2.0
Hz, 1 H) 8.58 (dd, J=4.6, 1.7 Hz, 1 H) 8.87 (d, J=1.0 Hz, 1 H) 8.99 (d, J=1.0
Hz, 1 H)
9.34 (d, J=2.2 Hz, 1 H) 12.11 (br. s., 1 H).
LC-MS-DAD-ELSD : Tr (min) = 2,31 ; [M+H]+ : m/z 321 ; [M-H]- : m/z 319.
WO 2010/109084 103 PCT/FR2009/052330
Exemple 118 : 3-(2-méthoxyéthoxy)-9-[(4-méthylphényl)sulfonyl]-6-(pyridin-3-
yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridine
CO
CO
\ NaH / DMF o
O puis TsCI I -
N N / N
N H O
117 H 118
Le 117 (70 mg, 0,22 mmol) est dissous dans 2 mL de DMF dans un monocol sec et
sous argon. L'hydrure de sodium (15 mg, 1,7 eq.) est ajouté en une seule fois,
puis
le mélange réactionnel est agité sous atmosphère inerte durant 3 heures. Le
chlorure de tosyle dissous dans 0,5 mL de DMF est ensuite ajouté (durée
d'introduction environ deux minutes). Après une heure le milieu réactionnel
est versé
sur un mélange d'une solution aqueuse de NaHCO3 10% (50 mL) et d'eau (50 mL)
et extrait par 2 fois 100 mL d'acétate d'éthyle. Après séchage sur MsSO4 des
phases organiques réunies, celles-ci sont filtrées puis évaporées sous
pression
réduite. Le résidu est purifié par chromatographie sur gel de silice (25 g
Si02,
CH2CI2/MeOH : 100/0 à 95/5). On obtient 77 mg (72%) de 6-chloro-3-(2-
méthoxyéthoxy)-9-(tol uene-4-sulfonyl)-dipyrido[2,3-b:4',3'-d]pyrrole 118.
UPLC-MS-DAD-ELSD : Tr (min)= 1,18 ; [M+H]+: m/z 475,33
Exemple 119: 4-iodo-3-(2-méthoxyéthoxy)-6-(pyridin-3-yl)-9H-pyrrolo[2,3-b:5,4-
c']dipyridine
CO \ C
O 1 ) LDA, THF O
- 12-78 C I -
N~ I N N~ I \ N
N N 2 ) LiOH, H2O N N
THF,MeOH H
118 0=s
119
Une solution de 34 pL (0,24 mmol) de diisopropylamine dans 1 mL de
tétrahydrofuranne est agitée sous atmosphère d'argon à -78 C. 0,1 ml (2,4
mmol)
d'une solution de butyllithium (2,4 M) dans l'hexane sont additionnés
lentement
WO 2010/109084 104 PCT/FR2009/052330
goutte à goutte en environ deux minutes. Après 30 minutes d'agitation à -78 C,
une
solution de 118 (77 mg, 0,16 mmol) dans 3 mL de THF est ajoutée lentement
(durée
totale de l'introduction environ 10 minutes). Après 3 heures à -78 C une
solution de
diiode (66 mg) dans 0,5 mL de THF est ajoutée rapidement. Après 30 minutes
d'agitation à -78 C, le milieu réactionnel est versé sur un mélange d'acétate
d'éthyle
(50 mL) et d'une solution aqueuse de chlorure d'ammonium demi-saturée (30 mL
de
NH4CI aq saturée + 30 mL eau). Les phases sont séparées, puis la phase
organique
est lavée par une solution aqueuse de thiosulfate de sodium 5%. La phase
organique est séchée sur MgSO4, filtrée puis évaporée sous pression réduite.
On
obtient 89 mg (91%) de 6-chloro-3-(2-méthoxyéthoxy)-4-iodo-9-(toluene-4-
sulfonyl)-
dipyrido[2,3-b:4',3'-d]pyrrole. Le produit est engagé dans l'étape suivante
sans
purification supplémentaire.
Le 6-chloro-3-(2-méthoxyéthoxy)-4-iodo-9-(toluene-4-sulfonyl)-dipyrido[2,3-
b:4',3'-
d]pyrrole (85 mg, 0,14 mmol) est dissous dans 1,5 mL de THF et 1,5 mL de MeOH.
Une solution aqueuse de lithine monohydratée (61 mg, 2,55 mmol dans 1,5 mL
d'eau) est ajoutée rapidement. Après 2 heures sous agitation, 10 mL d'eau sont
ajoutés puis le milieu est acidifié par ajout d'une solution aqueuse d'acide
chlorhydrique jusqu'à pH = 4. Le précipité est filtré sur un verre fritté
porosité 4,
essoré avec 5 mL d'eau puis séché une nuit sous vide. On obtient 40 mg (97%)
de
6-chloro-3-(2-méthoxyéthoxy)-4-iodo-9H-dipyrido[2,3-b:4',3'-d]pyrrole 119.
UPLC-MS-DAD-ELSD : Tr (min)= 0,85; [M+H]+ : m/z 447,00
Exemple 120: N-[2-(diméthylami no)éthyl]-4-[3-(2-méthoxyéthoxy)-6-(pyridin-3-
yl)-9H-pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide
Pd(PPh3)4 -N
N 0
(_ \ Dioxanne /eau N
0 Cs2C03 H _ C0
N~ 0 N "--\~\ / BH ô NH
N
119 120 N N
H
Dans un réacteur micro onde de 2 ml, 40 mg de 119, 57 mg N-(2-
dimethylaminoethyl)-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)benzamide,
10
mg de tetrakis(triphenylphosphine)palladium(0), 58 mg de carbonate de césium
sont
mis en suspension dans 0,5 ml de 1,4-dioxanne et 0,1 ml d'eau, le tube est
scellé
WO 2010/109084 105 PCT/FR2009/052330
puis soumis à une irradiation microonde 1 heure à 130 C. Le mélange
réactionnel
est filtré puis versé sur 25 ml d'eau et 50 ml d'acétate d'éthyle sous forte
agitation.
Après décantation, la phase aqueuse est extraite par 30 ml d'acétate d'éthyle
et les
phases organiques réunies sont séchées sur sulfate de magnésium, filtrées puis
évaporées sous pression réduite. Le résidu est purifié par chromatographie sur
colonne de silice (éluant CH2CI2 / NH3 2N dans MeOH : 100/0 à 90/10) pour
donner
30 mg de N-[2-(diméthylamino)éthyl]-4-[3-(2-méthoxyéthoxy)-6-(pyridin-3-yl)-9H-
pyrrolo[2,3-b:5,4-c']dipyridin-4-yl]benzamide.
UPLC-MS-DAD-ELSD : Tr (min) = 0,39 ; [M+H]+ : m/z 511,25
Exemple 121: Composition pharmaceutique
On a préparé des comprimés répondant à la formule suivante :
Produit de l'exemple 44 ....................... 0,2 g
Excipient pour un comprimé terminé à .......... 1 g
(détail de l'excipient : lactose, talc, amidon,
stéarate de magnésium).
Exemple 122: Composition pharmaceutique
On a préparé des comprimés répondant à la formule suivante :
Produit de l'exemple 87 ....................... 0,2 g
Excipient pour un comprimé terminé à .......... 1 g
(détail de l'excipient : lactose, talc, amidon, stéarate de magnésium).
Les exemples 44 et 87 sont pris à titre d'exemples de préparation
pharmaceutique,
cette préparation pouvant être réalisée si désiré avec d'autres produits en
exemples
dans la présente demande.
Procédures de test biochimique ln Vitro
Les propriétés pharmacologiques des composés de l'invention peuvent être
confirmées par un certain nombre de dosages pharmacologiques. Les exemples de
dosages pharmacologiques qui suivent ont été réalisés avec des composés selon
l'invention.
Exemple 1
WO 2010/109084 106 PCT/FR2009/052330
Dosage TR-FRET
Afin de déterminer l'inhibition de l'activité de kinases Pim, les composés de
l'invention sont testés conformément à un dosage TR-FRET ("Time Resolved-
Fluorescence Resonance Energy Transfer", transfert d'énergie de fluorescence
par
résonance en temps résolu) in vitro utilisé en routine. Le dosage TR-FRET est
basé
sur la détection de la phosphorylation du résidu spécifique Sen 12 dans la
protéine
Bad, qui s'est avérée être un substrat naturel des kinases Pim dans les
cellules.
Pour le dosage, les réactifs suivants sont utilisés :
Kinase Pim - protéine Pim-1, Pim-2 ou Pim-3 humaine de pleine longueur
recombinante à étiquette His6 (préparé selon le J. Mol. Biol. (2005) 348, 183-
193) ;
Bad - protéine Bad humaine de pleine longueur recombinante à étiquette His6
(préparé selon le J. Mol. Biol. (2005) 348, 183-193) ;
a-His6-APC - anticorps monoclonal de souris conjugué à l'allophycocyanine
SureLightTM dirigé contre l'étiquette His6 (Perkin Elmer, n ADO059H, Waltham,
Massachusetts, Etats-Unis) ;
a-P--Bad-Eu - anticorps monoclonal de souris (Cell Signaling Technology
#9296B,
Danvers, Massachusetts, Etats-Unis) dirigé contre phosphoBad (Ser112) (7E11)
marqué à la demande par Perkin Elmer avec le réactif LANCETM Eu-W1024.
Le dosage est basé sur la technologie LANCE Tm de PerkinElmer: l'anticorps
marqué
au Eu se lie à phospho-Ser112 et génère un signal TR-FRET par interaction avec
l'anticorps dirigé contre His6 marqué à l'APC, lié à l'étiquette His6 de Bad.
Le signal
TR-FRET est détecté à l'aide d'un lecteur de plaques SpectraMax M5 (Molecular
Devices) avec les réglages suivants : a,ex = 340 nm, a,em1 = 615 nm, a,em2 =
665
nm. Le rapport signal de fluorescence à 665 nm sur signal de fluorescence à
615
nm est utilisé comme lecture de signal pour la C150 (calculs basés sur le
modèle
logistique à 4 paramètres). Le dosage est mis en oeuvre dans un format à 384
puits ; les manipulations de liquides sont réalisées à l'aide d'un poste de
manipulation de liquides Beckman 3000. Les composés à l'essai sont testés à 10
points de concentration en duplicats ; la concentration de composé la plus
élevée est
de façon typique égale à 30 pM. La concentration d'ATP est égale à 40 pM.
Exemple 2
Dosage de la viabilité cellulaire
WO 2010/109084 107 PCT/FR2009/052330
Les composés représentatifs de l'invention sont également criblés en ce qui
concerne leurs effets sur la prolifération et la viabilité cellulaires en
utilisant une
variété de lignées cellulaires tumorales provenant de l'homme, représentatives
de
différentes indications pathologiques. Ces lignées cellulaires incluent
Modèles de cancers hématologiques :
TF-1 (leucémie myélogène aiguë; AML M6 au moment du
diagnostic) ;
KG-1 (AML ; érythroleucémie évoluant en AML) ;
KG-1a (AML ; sous-clone dérivé de KG-1 immature) ;
EOL-1 (AML ; leucémie à éosinophiles) ;
PL-21 (AML ; M3) ;
ML-2 (AML ; T-NHL évoluant en T-ALL évoluant en AML M4) ;
HL-60 (AML, M3) ;
Kasumi-1 (AML) ;
GDM-1 (AML) ;
K-562 (CML - leucémie myélogène chronique ; crise blastique) ;
JURL-MK1 (CML ; crise blastique) ;
DND-41 (T-ALL - leucémie aiguë lymphoblastique à cellules T) ;
Jurkat (T-ALL) ; NALM-6 (B-ALL -ALL à cellules B) ;
CEM (ALL ; lymphosarcome évoluant en ALL) ;
Jeko-1 (B-NHL - lymphome non hodgkinien à cellules B ; lymphome à
cellules du manteau dérivé d'un variant à grandes cellules en
transformation leucémique) ;
WSU-DLCL2 (B-NHL ; lymphome diffus à grandes cellules B) ;
RL (B-NHL ; diffus indifférencié) ;
OCI-Lyl0 (B-NHL) ;
DoHH-2 (B-NHL) ;
RPMI-8226 (MM - myélome multiple) ;
JVM-2 (B-CLL - leucémie lymphocytaire chronique à cellules B) ; et
JVM-3 (B-CLL).
Modèles de tumeurs solides
HCT-116 (cancer du côlon) ;
HT-29 (cancer du côlon) ;
WO 2010/109084 108 PCT/FR2009/052330
HC-15 (cancer du côlon) ;
H460 (cancer du poumon ; cancer du poumon non à petites cellules) ;
A375 (mélanome) ;
B16F10 (mélanome) ;
MDA-A1 (cancer du sein) ;
MDA-MB231 (cancer du sein) ;
MDA-MB231 adr (cancer du sein) ;
PANC-1 (cancer du pancréas) ; et
PC-3 (cancer de la prostate).
Afin de mesurer la viabilité, les cellules tumorales sont incubées dans un
format à 96
puits ou à 384 puits pendant 48, 72 ou 96 heures, de préférence 72 heures,
avec un
composé de l'invention à des dilutions d'un facteur 3 avec en général neuf
doses au
total, la dose la plus élevée étant égale à 10 pM ou 30 pM. La viabilité
cellulaire est
évaluée par l'ajout de CeIlTiter-Blue (Promega, Madison, Wisconsin, Etats-
Unis)
pendant 4 heures et des lectures de point final sont réalisées en utilisant un
lecteur
de plaques SpectraMax Genmini EM (Molecular Devices, Sunnyvale, Californie,
Etats-Unis). Le dosage de viabilité cellulaire CeIlTiter-Blue mesure
l'aptitude des
cellules en culture à effectuer la réduction de la résazurine en résorufine,
l'intensité
du signal de fluorescence étant directement proportionnelle au nombre de
cellules
vivantes. La CE50 représente la concentration de composé qui conduit à une
réduction de 50 % de la viabilité/de l'expansion proliférative des cellules.
Exemple 3
L'activité des molécules est évaluée sur la lignée cellulaire JEKO ou DND-41
en
mesurant le niveau de phosphorylation de Bad et le taux de Bad total, et ce,
par la
technique Elisa.
Les cellules JEKO ou DND-41 sont remises en suspension à une concentration de
500 000 cellules par ml. Les cellules sont ensuite diluées dans du milieu RPMI-
1640
contenant 20% de sérum de veau foetal. 225 pl de cellules sont placés dans une
plaque. Les dilutions sérielles des molécules sont ensuite effectuées (8
points,
dilution au tiers, début de gamme à 10 mM). Chaque point de dilution est
ensuite
dilué au 1/100 dans du milieu. Ensuite, 25 pl de chacune des concentrations
sont
ajoutées aux cellules puis incubés pendant 3 heures à 37 C.
WO 2010/109084 109 PCT/FR2009/052330
100 pl des cellules sont transférés dans une plaque traitée poly-D-Lysine. La
plaque
est ensuite incubée 5-10 minutes à 37 C puis centrifugée pendant 5 minutes à
1500
rpm. Un volume de 100 pL de solution de fixation à 8% (solution de
formaldehyde
dans du tampon PBS) est ajouté dans chacun des puits. Après avoir été
recouverte
d'un film autocollant et d'un couvercle, la plaque est incubée 20 minutes à
température ambiante puis stockée à 4 C pendant une nuit.
Ensuite, le liquide est éliminé et deux lavages successifs sont effectués avec
du
tampon de lavage. 100 pl de tampon de quenching sont ajoutés puis incubés
pendant 15 minutes à température ambiante. Après un lavage, 100 pl de tampon
d'arrêt sont ajoutés suivis d'une incubation de 1 heure à température
ambiante.
Après un lavage, 50 pl de l'anticorps primaire dilué au 1/250 pour pBAD (Cell
Signaling Cat# 5284) et au 1/500 pour Bad (MBL Cat# 591) sont ajoutés dans
chacune des plaques. Chacune des plaques est incubée pendant 2 heures à
température ambiante. Après deux lavages, 50 pl de l'anticorps secondaire
(dilué au
1/16) sont ajoutés à la plaque Pbad (tebu-bio ref: FE-021) et 50 pl de
l'anticorps
secondaire IgG conjugué à la HRP (Santa Cruz Cat # SC-2004 ; dilué au 1/1000)
sont ajoutés à la plaque Bad. Une incubation de 1 heure à température ambiante
est
effectuée. 4 lavages avec la solution de lavage sont effectués suivis de 3
lavages au
PBS. Enfin, 100 pl de la solution de révélation sont ajoutés suivi d'une
incubation de
10 minutes. Finalement, 100 pl de la solution d'arrêt sont ajoutés avant
lecture à 450
nm.
RESULTATS BIOCHIMIQUES
Les résultats biochimiques sont exprimés selon la classification suivante
Classe A : IC50 inférieur à 100 nM
Classe B : 1C50 compris entre 100 nM et 1000 nM (ou 1 pM)
Classe C : IC50 compris entre 1 pM et 5 pM
Classe D : IC50 supérieur à 5pM
Exemple
n IC50 Pim1 IC50 Pim2 IC50 Pim3 IC50 CDK1 IC50 PLK1
7 A B A C B
9 A A A B B
10 A B A C C
WO 2010/109084 110 PCT/FR2009/052330
Haut du
formulaire
11 A C B Bas du
formulaire
12 A C A C C
13 A C B
Haut du
formulaire
14 A C B Bas du
formulaire
15 B D C
16 A C B
17 A C B
19 A B A C B
20 A B A B B
21 A C A B C
22 A B A C C
23 A A A C B
24 A C A C C
25 A C A C C
26 A A A C B
27 A A A C B
28 A A A B B
37 A A A B C
38 A A A B C
44 A A A B B
45 B D B B A
46 A C A B B
47 A A A B B
48 A C B B A
49 B D B C B
50 B D B B A
51 A B A C B
52 A B A C B
WO 2010/109084 111 PCT/FR2009/052330
53 A B A C B
54 A B A B B
55 A B A B B
56 A A A B B
57 A C A B B
58 A B A C B
59 A B A B C
60 A B A B B
61 A B A C C
62 A C A B B
63 A B A C B
64 A B A C B
65 A B A C B
66 A B A C B
67 A A A C B
68 A A A C C
69 A B A B B
70 A C B C C
71 A C A C C
72 B D B C B
73 A B A B A
74 A B A C B
75 A B A B C
76 A B A B A
77 A C A C C
78 A B A B A
79 A B A C B
80 A B A B B
81 A C A C B
82 A B A B B
83 A A A
84 A A A B B
85 A A A
WO 2010/109084 112 PCT/FR2009/052330
86 A A A
87 A A A B B
88 A A A B B
89 A A A B B
90 A B A B B
91 B C B B B
99 A B A C D
100 A A A C C
104 A B A B B
106 A A A B C
107 A A A C D
112 B C B
Haut du
formulaire
113 A B A Bas du
formulaire
120 A A A
RESULTATS CELLULAIRES
Les résultats de prolifération cellulaires sont exprimés selon la
classification
suivante :
Classe A : EC50 ou IC50 inférieur à 100 nM
Classe B : EC50 ou IC50 compris entre 100 nM et 1000 nM (ou lpM)
Classe C : EC50 ou IC50 compris entre 1 pM et 5 pM
EC50 EOL-1 EC50 EC50 IC50
Exempl NM MV4-11 MOLM-13 IC50
e n pM M phosphoBAD phosphoBAD
(lymphome) (mélo (myélome) (JEKO) (DND-41)
7 A B B
9 A A B B C
10 B B B
WO 2010/109084 113 PCT/FR2009/052330
11 B
12 B C B
19 B B
20 B B
21 B B B
22 B B C
23 B B
24 B B B C
25 B B C B
26 C
28 B B C
37 C
38 A B B
44 A A B B
52 A B B
56 A A
59 B B C
61 B B C
63 B B B
64 B B B
66 A B B
68 A B A
75 B B C
87 B B
89 B B
90 B B
106 A B
107 B B
120 A A B