Note: Descriptions are shown in the official language in which they were submitted.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
1
Utilisation d'éthers de glycérol comme activateurs des effets biologiques
d'une
substance herbicide, fongicide ou insecticide
La présente invention concerne généralement de nouvelles compositions
comprenant au moins une substance active choisie parmi un herbicide, un
insecticide au Lin fongicide et a essentiellement pour objet l'utilisation de
certains
éthers de glycérol comme activateurs permettant d'intensifier les effets
biologiques d'au moins une substance active choisie parmi un herbicide, un
insecticide ou un fongicide.
L'invention trouve notamment application dans le domaine agricole.
Les éthers de glycérol utilisés dans le cadre de la présente invention sont
des dérivés mono- ou dialkylés du glycérol. Ces composés sont généralement
connus dans l'état de la technique.
Ainsi, le 3-(2-éthylhexyloxy)propane-1,2-diol (également dénommé
ethylhexylglycérine) qui est l'un des composés utilisés de façon préférée dans
le
cadre de la présente invention, est connu dans le domaine cosmétique où il est
notamment utilisé en tant qu'amplificateur de senteur dans des formulations de
déodorant.
Il a été découvert, et ceci constitue le fondement de la présente invention
que certains éthers de glycérol présentent la propriété remarquable
d'accélérer le
passage de substances actives variées à travers les membranes cellulaires
d'êtres
unicellulaires ou pluricellulaires du règne animal ou végétal et que cette
propriété
remarquable permet :
(1) Dans le cadre de leur utilisation en association avec une substance
herbicide :
- d'une part, d'augmenter la vitesse de désherbage dans la mesure
oà le seuil létal pour la plante est atteint plus rapidement ; et
- d'autre part, de diminuer par un facteur de 2 à 4 la quantité
minimum de substance herbicide à mettre en oeuvre pour obtenir l'effet
recherché ;
(2) Dans le cadre de leur utilisation en association avec une substance
fongicide, de diminuer la quantité minimum de substance fongicide à mettre en
oeuvre pour obtenir l'effet recherché
(3) Dans le cadre de leur utilisation en association avec une substance
insecticide, d'c1UUmenter le taux de {Mortalité chez les insectes traités de f
çon
significative.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
2
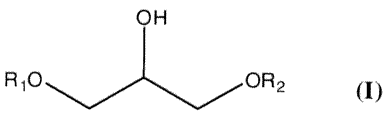
Ainsi, selon un premier aspect, l'invention a pour objet l'utilisation d'un
éther de glycérol de formule :
?H
R,O OR2 (I)
dans laquelle
- R1 représente un groupe alkyle ayant de 1 à 18 atomes de carbone ;
- R2 représente un atome d'hydrogène ou un groupe alkyle ayant de 1 à
18 atomes de carbone, de préférence un groupe méthyle ou éthyle ;
en tant qu'agent activateur des effets biologiques d'au moins une substance
active choisie parmi un herbicide, un fongicide ou un insecticide.
L'effet activateur des éthers de glycérol vis-à-vis d'une substance
herbicide s'entend :
- d'une part, de l'effet d'augmentation de la vitesse de désherbage pour
une concentration en substance active donnée ; et
- d'autre part, d'un effet de potentialisation de l'activité de la substance
herbicide, permettant de diminuer la quantité à mettre en oeuvre pour obtenir
l'effet recherché.
Une première famille préférée d'éthers de glycérol susceptibles d'être
utilisés dans le cadre de la présente invention est constituée par les
composés de
formule (I) précitée dans laquelle :
- R1 représente un groupe alkyle de formule générale CXH2X+1 où x = 1 à 9 ;
- R, représente un groupe alkyle de formule générale C,,H2y+1 oû y = 0 à 8 ;
et respectant la condition 4 <_ x + y <_ 10.
Une autre famille préférée d'éthers de glycérol susceptibles d'être utilisés
dans le cadre de la présente invention est constituée par les composés
monoalkylés du glycérol de formule (I) précitée, dans laquelle :
R, représente un groupe alkyle ayant de 4 à 9 atomes de carbone ; et
R,, représente un atome d'hydrogène.
Des résultats particulièrement remarquables ont été obtenus avec le 3-
pentyloxypropan,e 1,Z diol, le 3-h exyloxypropane-1,2-diol et le 3-(2
éthylhexyloxy)propane-l,2-diol qui constituent par conséquent des composés
particulièrement préférés pour leur utilisation en tant qu'activateur cl'ef' 1
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
3
biologiques d'une substance herbicide, fongicide ou insecticide dans le cadre
de
la présente invention.
Une autre famille préférée d'éthers de glycérol susceptibles d'être utilisés
dans le cadre de la présente invention est constituée par les composés
dialkylés
du glycérol de formule (I) précitée, dans laquelle :
- R, représente un groupe méthyle ou éthyle ; et
- R, représente un groupe méthyle ou éthyle.
De préférence, R, et R, sont identiques dans ces composés dialkylés de
formule (I).
Les éthers de glycérol de formule (I) précités agissent en tant
qu'activateurs des effets herbicides d'une substance herbicide quelconque.
Par groupe alkyle on entend un groupe hydrocarboné linéaire ou
ramifié.
Toutes substances herbicide, fongicide et insecticide connues peuvent
être utilisées dans le cadre de la présente invention.
Parmi les substances herbicides pouvant être utilisées dans le cadre de
l'invention, on peut citer :
- les inhibiteurs de la synthèse des lipides tels qu'en particulier:
- les aryloxyphénoxyproprionates (clodinafop-propargyl, diclofop-méthyl,
fénoxaprop-p-éthyl, fluazifop-p-butyl, quizalofop-p-éthyl, haloxyfop-R,
propaquizafop),
- les cyclohexanédiones (cléthodime, cycloxydime, séthoxydime,
tralkoxydime),
- les benzofuranes (éthofumésate) ;
- les inhibiteurs de l'acétolactase synthèse (ALS) tels qu'en particulier
- tes imidazolinones (imazarnox, imazapyr, imazéthapyr, imazaquine),
- les sulfonylurées (amidosulfuron, azimsulfuron, bensulfuron-methyl,
Chlorimuron, chlorsuifuron, éthametsuIfuron-méthyl, flazasuIfuron,
flupyrsulfuron-methyl-Na, foramsulfuron, iodosuifuron-methyl-sodium,
mesosulfuron-methyl, metsulfuron-methyl, nicosulfuron, primisulfuron,
prsulfuron, rimsulfuron, sulfosulfuron, thiefensulfuron-méthyl, tribénuron-
méthyl, triflusulfuron-méthyl),
- les sulfonanilides (cloransulam, flumetsulam florasulam),
es triazolopyrimidines (pyroxsulame) ;
les inhibiteurs de la synthèse des acides aminés arum 3tiques tels qu'en
particulier :
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
4
- les giyphosate sous forme de sel d'isopropylamine, sous forme de sel de
triméthylsulfonium (sulfosate) ;
- les herbicides auxiniques tels qu'en particulier
- les acides phénoxys (2,4-D, 2,4-DB, 2,4,5-T, dichlorprop, MCPA, MCPB,
mécroprop),
- les acides benzoïques (dicamba),-
- les acides pyridiniques (clopyralide, piclorame, triclopyr),
- le quinmerac ;
- les inhibiteurs des pigments tels qu'en particulier :
- les triazotes (amitrole, clomazone),
- les isoxazolidinones (clomazone),
- les isoxazoles (isoxaflutole),
- les trikétones (mésotrione, sulcotrione),
- les isoxazoles (isoxafiutole),
- les diphényléthers (aclonifen),
- le phénoxybutamide (béflubutamide),
- la flurochloridone,
-la flurtamone, ;
- les inhibiteurs de la photosynthèse tels qu'en particulier :
- les triazines (atrazine, cyanazine, hexazinone, métribuzine, prométryne,
simazine),
- les uraciles (lenacile, bromacil, terbacil),
- les phényl-carbamates (desmédiphame, phenmédiphame),
- les pyridazinones (pyrazone),
- les urées substituées (isoproturon, diuron, linuron, chlortoluron,
métobromuron, monolinuron),
- les phényl-pyridazines (pyridate),
- les benzothiadiazones (bentazone),
- les nitriles (bromoxynil, ioxynil) ,
- les inhibiteurs de la croissance des plantules tels qu'en particulier:
- les dinitroanalines (éthalfluraline, pendiméthaline, trifluraline),
- les benzamides (propyzamide),
- les pyridines (dithiopyr),
- les carbamates (carbétarrnide),
les carbamothioates (butylate cycloate, EPTC, triallate),
les phosphorodithioates (bensulide),
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
- les chloro-acétamides (alachlor, acétochlor, dimethénamide,
diméthachlore, flufenacet, metazachiore, s-métolachlore),
- es acétamides (Napropamide) ;
- les herbicides perturbant les membranes cellulaires tels qu'en particulier
5 - es acides aminés phosphorylés (glufosinate, glufosinate ammonium),
- les éthers de diphényle (acifluorfène, fomésafène, oxyfluorfène,
bifénox),
- les oxadiazoles (oxydiazon, oxadiargyl),
- es dipyridyles (difenzoquat, paraquat, diquat),
- es benzamides (isoxaben),
- les nitriles (dichlobenyl) ;
- la triazinone (Métamitrone)
- les substances herbicides non répertoriées dans les classes précédentes
(bispyribac sodium, diflufenican, lactofen, norflurazon)
A titre de substances herbicides préférées dans le cadre de la présente
invention, on peut citer les substances suivantes:
- Dichlobénil (arbres et arbustes d'ornement) ;
- Ethofumesate (betterave fourragère, betterave industrielle) ;
- Glyphosate d'isopropylamine (traitements généraux) ;
- Glufosinate d'ammonium (traitements généraux) ;
- Isoproturon (blé tendre d'hier, orge d'hiver) ;
- Linuron (cultures légumières, tournesol) ;
- Métamitrone (betterave fourragère, betterave industrielle, betterave
potagère) ;
- Oxyfluorfène/Propyzamide (vignes, verger, arbres et arbustes
d'ornement) ;
- Phenmédiphame (betterave fourragère, betterave industrielle, betterave
potagène) ;
- Trifluraline (colza, colza d'hiver, colza de printemps, tournesol, soja).
Des résultats particulièrement remarquables ont été obtenus avec le
glyphosate sous forme de sel d'isopropylamine qui constitue l'une des
substances
herbicides les plus utilisées au monde.
Parmi les substances fongicides pouvant être utilisées dans le cadre de
I'invention, on peut citer
es substances polyvalentes ou multisites - dithiocarbamates
(mancozèbe, manèbe, zinèbe, zirame, thirame), chloronitriles (chlorothalonil),
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
6
phtalirnides (captane, folpel), les sulfamides (tolylfluanide) et les
guanidines
(doguadine) ;
- les subtances inhibitrices de la respiration mitochondriale
phénylamides (carboxine, flutolanil), méthyl beta-methoxyacrylates
(azoxystrobine, picoxystrobine), cyanoimidazoles (cyazofamide), imidazolinones
(fenamidone), oxazolidinediones (famoxadone), méthyl méthoxyacétates
(krésoxim-méthyl), méthylniéthoxycarbamates (pyraclostrobine), crotonates de
nitrophényle (dinocap), dinitroanilines (filuazinam), silylamide (silthiofam)
;
- les substances inhibitrices de la biosynthèse des lipides tels qu'en
particulier: les dicarboximides (iprodione, procymidone, vinclozoline), les
organophosphorés (tolclophos-méthyl), les carbamates (propamocarbe) ;
- les substances inhibitrices de la biosynthèse des stérols membranaires :
pyrimidines (fénarimol, nuarimol), imidazoles (imazalil, prochloraze),
triazoles
(bitertanol, difénoconazole, flusilazole, propiconazole, triadiménol),
hydroxyanilides (fenhexamide), morpholines (dodémorphe, fenpropimorphe,
tridémorphe), pipéridines (fenpropidine), spirocétalamine (sp roxamine) ;
- les substances inhibitrices de la synthèse d'acides nucléiques :
phénylamides (bénalaxyl, méfénoxame), hydroxypyrimidines (bupirimate),
hyméxazole ;
- les substances agissant sur la formation des parois cellulaires :
acétamides (cymoxanil), diméthomorphe, aminoacide carbamate (iprovalicarbe) ;
- les substances affectant la transduction des signaux : quinoléines
(quinoxyfène), phénylpyrroles (fludioxonil) ;
- les substances inhibitrices de la biosynthèse de méthionine
anilinopyrimidines (cyprodinil, pyriméthanil, mépanipyrime) ;
- les substances affectant l'assemblage de la beta-tubuline : benzamides
(zoxamide), phenylurées (pencycuron), benzimidazoles (carbendazime,
thiabendazole), N-phénylcarbamates (diéthofencarbe) ,
- les substances naturelles telles que les huiles essentielles (girofle,
laurier, sarriette, thym, melaleuca alternifolia, géranium) ;
ainsi que les substances fongicides non répertoriées dans les classes
précédentes.
A titre de substances fongicides préférées dans le cadre de la présente
invention, on oeuf citer les substances suivantes:
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
7
- azoxystrobine, pyraclostrobine, difenoconazole, fenpropimorphe,
mancozèbe, cyproconazole, metconazole, tébuconazole, prothiconazole,
prochloraze, boscalid (indiquées pour la culture des oléagineux).
Parmi les substances insecticides pouvant être utilisées dans le cadre de
l'invention, on peut citer :
- les substances agissant sur le système nerveux : organophosphorés
(dichlorvos, dimethoate, chlorpyriphos, parathion, malathion, diazinon,
phosmet),
carbamates (carbofuran, carbaryl, méthomyl, aldicarbe, carbosulfan,
fenoxydarbe), Pyréthrinoïdes (perméthrine, deltaméthrine, cyperméthrine,
fenvalerate, téfluthrine), phénylpyrazoles (fipronil), avermectines
(ivermectine,
selamectine, milbemectine,...), chloronicotiniles (imidaclopride, nytempyram,
thiamethoxam), formamidines (Amitraze) ;
- les subtances agissant sur la respiration cellulaire : amidinohydrazones
(hydraméthylnon), roténone (roténone), pyrazoles (fenpyroximate,
tébufenpyrad), dérivés stanniques (azocyclotin, cyhexatin), sulfones
sulfonates
(clorfénizon, tétradifon) ;
- les substances agissant sur la croissance de l'insecte : benzoylurées et
acylurées (diflubenzuron, hexaflumuron, lufénuron, téflubenzuron,
Flufenoxuron),
benzhydrazides (tébufénozide, méthoxyfénozide) ;
- les substances naturelles telles que les huiles essentielles (thym, anis
vert, ail, lavande, citron, eucalyptus, menthe,...) et le pyrèthre
(pyréthrines) ;
- les substances insecticides non répertoriées dans les classes
précédentes : spinosynes (spinétorame), (Methoprène, Pyriproxyféne) ;
A titre de substances insecticides préférées dans le cadre de la présente
invention, on peut citer les substances suivantes:
- tau-fluvalinate, lambda-cyhalotrine, pyriniicarbe, alphaméthrine,
bétacyfluthrine, bifenthrine, cfluthrine, cypermethrine, deltamethrine,
esfenvalérate, zétacyperméthrine, thiaclopride, chlorpyriphos ethyl,
diflubenzuron
(indiquées pour la culture des oléagineux).
Bien entendu, les éthers de glycérol selon l'invention peuvent être utilisés
pour activer les effets biologiques d'une substance herbicide, fongicide ou
insecticide utilisée seule ou en mélange avec au moins une autre substance
herbicide, fongicide ou insecticide.
Au moins deux éthers de glycérol selon l'invention peuvent également
<.r~ utilisés en association pour activer les effets biologiques d'unr
substance
herbicide, fongicide ou insecticide. Ainsi, par exemple, un mélange d'au moins
un
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
8
éther de glycérol rnonoalkylé selon l'invention et d'au moins un éther de
glycérol
dialkylé selon l'invention peut être utilisé pour activer les effets
biologiques d'une
substance herbicide, fongicide ou insecticide.
D'une façon générale, les éthers de glycérol seront utilisés en une
quantité en masse comprise entre 0,Q5 et 2 exprimée relativement à la quantité
en masse de substance(s) herbicide(s) utilisée(s), une quantité en masse
comprise entre 0.01 et 10 exprimée relativement à la quantité en masse de
substance(s) fongicide(s) utilisée(s) ou une quantité en masse comprise entre
0.05 et 2 exprimée relativement à la quantité en masse de substance(s)
insecticide(s) utilisée(s).
Selon un deuxième aspect, la présente invention a pour objet une
composition phytosanitaire comprenant :
- au moins une substance active choisie parmi un herbicide, un insecticide
ou un fongicide; et
- au moins un éther de glycérol de formule (I) tel que défini
précédemment.
Par composition phytosanitaire on entend une composition capable de
soigner ou prévenir les maladies des organismes végétaux et préférablement
possédant des effets herbicides et/ou fongicides et/ou insecticides.
Avantageusement, cette composition comprendra
- une (ou plusieurs) substance(s) herbicide(s) en une quantité totale de
100 parties en masse ; et
- un (ou plusieurs) éther(s) de glycérol de formule (I) en une quantité
totale de 5 à 200 parties en masse exprimée relativement à la quantité en
masse
de substance(s) fongicide(s) utilisée(s) ; ou
- une (ou plusieurs) substance(s) fongicide(s) en une quantité totale de
100 parties en masse ; et
- un (ou plusieurs) éther(s) de glycérol de formule (I) en une quantité
totale de 10 à 1000 parties en masse exprimée relativement à la quantité en
masse de substance(s) fongicide(s) utilisée(s) ; ou
- une (ou plusieurs) substance(s) insecticide(s) en une quantité totale de
100 parties en masse ; et
un (ou plusieurs) éther(s) de glycérol de formule (I) en une quantité
totale Cie 5 à 200 parties <en masse exprimée relativement à !a quantitc en
cm, usse
de substance(s) insecticide(s) ._itilisée(s;l.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
9
Etant donné que les éthers de glycérol précités sont liquides et solubles
dans les principaux solvants organiques, une composition herbicide selon
l'invention se présentera avantageusement sous forme de solution liquide
contenant de préférence de 0,5 à 3 g/l, et de préférence encore de 0,8 à 1 g/I
d'éther de glycérol de formule (I).
De même, une composition fongicide selon l'invention se présentera
avantageusement sous forme de solution contenant de 0,01 à 3 g f, et de
préférence de 0,05 à 0,25 g/I d'éther de glycérol de formule (I).
Une composition insecticide selon l'invention se présentera quant à elle
sous forme de solution contenant de 0,01 à 3 g/l, et de préférence de 0,01 à
0,25 g/I d'éther de glycérol de formule (I).
Une telle composition peut contenir des tensioactifs anioniques,
nonioniques, cationiques ou amphotères de manière à améliorer le pouvoir
mouillant de la composition. La seule règle à observer sera d'utiliser le
tensioactif
à une concentration au moins égale à la C.M.C. (concentration micellaire
critique)
lors de la pulvérisation. Il sera également possible d'introduire des
colorants dans
cette composition de façon à faciliter lldentification de la composition par
l'utilisateur.
A titre d'exemple de tensioactif cationique susceptible d'être utilisé, on
peut citer le polyoxyéthylène amine (POSA).
A titre d'exemple de tensioactif anionique susceptible d'être utilisé, on
peut citer les alkylsulfates de métal alcalin, notamment de sodium, comme
notamment le produit commercialisé sous la dénomination Melioran 118 par la
société CECA.
De préférence, la composition phytosanitaire selon l'invention comprend
une teneur en poids d'un agent tensioactif tel que précité par rapport au
poids
total de la composition choisie parmi au plus environ 66 %, au plus 50 %, au
Plus 40 4%,au Plus 30%, au plus 20 %, au plus 10 % ou au plus 5 7o, et de
préférence encore ne comprend aucun agent tensioactif.
Les monoéthers de glycérol (ou éthers de glycérol monoalkyl(l's) utilisés
dans le cadre de la présente invention (composés de formule (I) dans laquelle
R
représente un atome d'hydrogène) sont généralement des produits
commerciaux. Alternativement, ces produits peuvent être préparés par action,
de
préférence en milieu basique, du glycidol et d'un alcool approprie utilisé en
large
excès.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
D'une façon générale, le rapport molaire entre l'alcool et le glycidol peut
varier entre 5 et 20, tandis que le rapport molaire entre la base (catalyseur)
et le
glycidol peut varier entre 0,04 et 0,2.
Cette réaction peut être représentée par le schéma réactionnel suivant
5
Base OH
OH + R -OH 110- OR
D'une façon générale, cette réaction est réalisée à une température
comprise entre 40 et 150 C.
10 Dans un premier temps, l'alcoolate est formé sous vide, à la température
de synthèse.
Le glycidol (pur ou dilué dans l'alcool) est ensuite ajouté au milieu
réactionnel. Pour éviter toute dégradation due à la présence d'eau, il est
préférable d'opérer en milieu anhydre, en maintenant un vide primaire.
La durée de réaction est de l'ordre de 30 min pour une consommation
totale du glycidol.
Le produit résultant est distillé et on obtient dans un premier temps
l'alcool résiduel, puis l'éther de glycérol recherché.
Les diéthers de glycérol "symétriques" utilisés dans le cadre de la
présente invention (composés de formule (I) dans laquelle R1 et R2 sont
identiques et différents d'un atome d'hydrogène) peuvent être des produits
commerciaux. Alternativement, ces produits peuvent être préparés par action,
de
préférence en milieu basique, de l'épichlorhydrine et d'un alcool approprié
utilisé
en large excès.
D'une façon générale, le rapport molaire entre l'alcool et l'épichlorhydrine
peut varier entre 2 et 6, tandis que le rapport molaire entre la base
(catalyseur)
et l'épichlorhydrine peut varier entre 0,3 et 2,0.
Cette réaction peut être représentée par le schéma réactionnel suivant
--- - e
+ 2 R O Fi
RO OH
;~i
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
11
D'une façon générale, cette réaction est réalisée à une température
comprise entre 40 et 150 C.
Dans un premier temps, l'alcoolate est formé sous vide, à la température
de synthèse.
L'épichlorhydrine (pur ou dilué dans l'alcool) est ensuite ajouté au milieu
réactionnel. Pour éviter toute dégradation due à la présence d'eau, il est
préférable d'opérer en milieu anhydre, en maintenant un vide primaire.
La durée de réaction est de l'ordre de 3 heures pour une consommation
totale de l'épichlorhydrine.
Le produit résultant est distillé et on obtient dans un premier temps
l'alcool résiduel, puis le diéther de glycérol recherché.
Les diéthers de glycérol "disymétriques" utilisés dans le cadre de la
présente invention (composés de formule (I) dans laquelle Rl et R2 sont
différents entre eux, et chacun différent d'un atome d'hydrogène) peuvent être
des produits commerciaux. Alternativement, ces produits peuvent être préparés
par action, de préférence en milieu basique, du monoéther de glycérol de
formule :
OH
HO OR,
et d'un alcool approprié utilisé en large excès.
D'une façon générale, le rapport molaire entre l'alcool et le monoéther de
glycérol peut varier entre 2 et 6, tandis que le rapport molaire entre la base
(catalyseur) et le monoéther de glycérol peut varier entre 0,3 et 2,0.
Cette réaction peut être représentée par le schéma réactionnel suivant
OH O.#
HO OR + R2 RO OR,
D'une façon générale, cette réaction est réalisée à une température
comprise entre 0 et t50 C.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
12
Dans un premier temps, Valcoolate est formé à la température de
synthèse.
Le monoéther de glycérol est ensuite ajouté au milieu réactionnel. Pour
éviter toute dégradation due à la présence d'eau, il est préférable d'opérer
en
milieu anhydre, en maintenant un vide primaire.
La durée de réaction est de l'ordre de 5 heures pour une consommation
totale du monoéther de glycérol.
Le produit résultant est distillé et on obtient dans un premier temps
l'alcool résiduel, puis le diéther de glycérol recherché.
Selon un troisième aspect, la présente invention a pour objet un procédé
de traitement phytosanitaire choisi parmi un traitement herbicide, un
traitement
fongicide et un traitement insecticide qui consiste à appliquer une
composition
phytosanitaire telle que définie précédemment sur une surface à traiter.
D'une façon générale, dans le cadre d'un procédé de traitement herbicide,
les éthers de glycérol seront appliqués en une quantité comprise entre 100 et
1
500 g, de préférence entre 150 et 1 350 g de matière active par hectare de
surface à désherber.
Dans le cadre d'un procédé de traitement fongicide, la quantité d'éthers
de glycérol appliquée sera comprise entre 50 et 5 000 g, de préférence entre
150
et 4 500 g par hectare de surface à traiter.
Dans le cadre d'un procédé de traitement insecticide, la quantité d'éthers
de glycérol appliquée sera comprise entre 40 et 1 000 g, de préférence entre
75
et 750 g par hectare de surface à traiter.
L'invention sera maintenant illustrée par les exemples non limitatifs
suivants.
A - Exemples de préparation d'un éther de glycérol utilisé dans le cadre
de la présente invention
Préparation-1,
Dans un récipient de 250 mL à 20L, muni d'une agitation allant de 150 à
300 rpm, chauffé à 120 C et sous pression atmosphérique, on a introduit de
l'alcool isononylique (Exxal 9, commercialisé par la société Exxon Mobil
Corporation) et de la soude (hydroxyde de sodium) dans un rapport molaire
10:0,1.
(_a rf action entre l'alcool et la soude a ét sous vide à 120 C pour
conduire à la formation de l'alcooiate.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
13
On a ensuite introduit du glycidol, en une quantité telle que le rapport
molaire entre l'alcool isononylique et le glycidol soit de 10:1 (cette
introduction
est réalisée à pression atmosphérique pendant une durée de 15 min).
La consommation du glycidol a été totale dès la fin de l'introduction.
Le mélange réactionnel a été purifié par distillation.
On a ainsi obtenu d'abord l'alcool isononylique (113-115 C sous 20-
25 mb), puis l'éther de glycérol (191-215 C sous 20-25 mb).
Rendement : 27,6 %.
Préparation 2
On a opéré de façon analogue à la préparation 1.
Le rapport molaire alcool/glycidol/soude était de 6:1:0,1.
La formation de l'alcoolate a été réalisée sous vide à 80 C avec la moitié
de la quantité totale de l'alcool et l'hydroxyde de sodium.
Le glycidol, préalablement dilué dans la seconde moitié de l'alcool a été
introduit sous 20-25 mb pendant une durée de 15 min.
La consommation de glycidol a été totale dès la fin de l'introduction.
Le mélange réactionnel a été purifié par distillation. On a ainsi obtenu
d'abord l'alcool (113-115 C sous 20-25 mb), puis l'éther de glycérol (191-215
C
sous 20-25 mb).
Rendement : 30 %.
B - Mise en évidence des propriétés d'activateurs des effets herbicides
des éthers de glycérol
Les tests suivants ont été réalisés sur des parcelles de terrain de 5Ox5Ocm
où se trouvent des herbacées. Chacune des solutions testées est pulvérisée sur
une parcelle qui lui est attribuée.
Exemple 1
Sur des parcelles semblables plantées d'herbacées, on a comparé le
temps nécessaire à la destruction totale de la végétation avec un herbicide
seul
d'une part et le même herbicide additionné d'un éther de glycérol : le 3-
Me'e 1,?_ diol d'autre part.
Sur la parcelle 1, on a pulvérisé une solution comprenant 6 g; I ce
glyphosate (sous forme acide.), à raison de 36 grammes au ni'.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
14
Sur la parcelle 2, on e pulvérisé une solution comprenant 6 g/1 de
glyphosate et 0,9 g/l de 3-méthyloxypropane-1,2-diol , à raison de 36 grammes
au m`.
Sur la parcelle 1, on a observé
- le début de la dégradation au bout de 8 jours
- la fin de la dégradation au bout de 18 jours.
Sur la parcelle 2, on a observé :
- le début de la dégradation au bout de 4 jours
- la fin de la dégradation au bout de 13 jours.
Exemple 2
Sur des parcelles semblables plantées d'herbacées, on a comparé le
temps nécessaire à la destruction totale de la végétation avec un herbicide
seul
d'une part et le même herbicide additionné d'un éther de glycérol : le 1,3-
diméthyloxypropan-2-ol d'autre part.
Sur la parcelle 1, on a pulvérisé une solution comprenant 6 g/l de
glyphosate, à raison de 36 grammes au m2.
Sur la parcelle 2, on a pulvérisé une solution comprenant 6 g/l de
glyphosate et 0,9 g/1 de 1,3-diméthyloxypropan-2-ol, à raison de 36 grammes au
mz
Sur la parcelle 1, on a observé
- le début de la dégradation au bout de 8 jours
- la fin de la dégradation au bout de 18 jours.
Sur la parcelle 2, on a observé :
- le début de la dégradation au bout de 4 jours
- la fin de la dégradation au bout de 15 jours.
Exemple 3
Sur des parcelles semblables plantées d'herbacées, on a comparé le
temps nécessaire à la destruction totale de la Végetation avec un herbicide
seul
d'une part et le même herbicide additionné d'un éther de glycérol : le 3-
isopropyloxypropane-l,2-diol d'autre part.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
Sur la parcelle 1, on a pulvérisé une solution comprenant 6 g/l de
glyphosate, à raison de 36 grammes au m2.
Sur la parcelle 2, on a pulvérisé une solution comprenant 6 g/I de
glyphosate et 0,9 g(I de 3-isopropyloxypropane-1,2-diol, à raison de 36
grammes
5 au m2.
Sur la parcelle 1, on a observé
- le début de la dégradation au bout de 8 jours
- la fin de la dégradation au bout de 18 jours.
Sur la parcelle 2, on a observé
- le début de la dégradation au bout de 3 jours
- la fin de la dégradation au bout de 12 jours.
Exemple 4
Sur des parcelles semblables plantées d'herbacées, on a comparé le
temps nécessaire à la destruction totale de la végétation avec un herbicide
seul
d'une part et le même herbicide additionné d'un éther de glycérol : le 3-
butyloxypropane-1,2-diol d'autre part.
Sur la parcelle 1, on a pulvérisé une solution comprenant 6 g/l de
glyphosate, à raison de 36 grammes au m2.
Sur la parcelle 2, on a pulvérisé une solution comprenant 6 g/l de
glyphosate et 0,9 g/l de 3-butyloxypropane-1,2-diol, à raison de 36 grammes au
m.
Sur la parcelle 1, on a observé
- le début de la dégradation au bout de 8 jours
- la fin de la dégradation au bout de 18 jours.
Sur la parcelle 2, on a observé :
- le début de la dégradation au bout de 3 jours
- la fin de la dégradation au bout de 10 jours.
Exemple 5
Sur des parcelles semblables plant :c :> d'herbacées, en a comparé le
temps r ~`~ raire à la destruction totale de la végétation avec un herbicide
seul
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
16
d'une part, et le méme herbicide additionné d'un éther de glycérol : le 3-
éthyloxypropane-1,2-dioi d'autre part.
Sur la parcelle 1, on a pulvérisé une solution comprenant 6 g/l de
glyphosate, à raison de 36 grammes au m2.
Sur la parcelle 2, on a pulvérisé une solution comprenant 6 g/l de
glyphosate et 0,9 g/l de 3-éthyloxypropane-1,2-diol, à raison de 36 grammes au
m.
Sur la parcelle 1, on a observé
- le début de la dégradation au bout de 8 jours
- la fin de la dégradation au bout de 18 jours.
Sur la parcelle 2, on a observé :
- le début de la dégradation au bout de 3 jours
- la fin de la dégradation au bout de 11 jours.
Exemple 6
Sur des parcelles semblables plantées d'herbacées, on a comparé le
temps nécessaire à la destruction totale de la végétation avec un herbicide
seul
d'une part, et le même herbicide additionné d'un éther de glycérol : le 1,3-
diéthyloxypropan-2-ol d'autre part.
Sur la parcelle 1, on a pulvérisé une solution comprenant 6 g/l de
glyphosate, à raison de 36 grammes au m2.
Sur la parcelle 2, on a pulvérisé une solution comprenant 6 g/l de
glyphosate et 0,9 g/l de 1,3-diéthyloxypropan-2-ol, à raison de 36 grammes au
m2.
Sur la parcelle 1, on a observé :
- le début de la dégradation au bout de 8 jours
- la fin de la dégradation au bout de 18 jours.
Sur la parcelle 2, on a observé :
- le début de la dégradation au bout: de 4 jours
- la fin de la dégradation au bout de 13 jours.
Exemple 7
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
17
Sur des parcelles semblables plantées d'herbacées, on a comparé le
temps nécessaire à la destruction totale de la végétation avec un herbicide
seul
d'une part, et le même herbicide additionné d'un éther de glycérol : le 3
pentyloxypropane-1,2-diol d'autre part.
Sur la parcelle 1, on a pulvérisé une solution comprenant 6 g/l de
glyphosate, à raison de 36 grammes au m .
Sur la parcelle 2, on a pulvérisé une solution comprenant 6 g/l de
glyphosate et 0,9 g/I de 3-pentyloxypropane-1,2-diol, à raison de 36 grammes
au
m
Sur la parcelle 1, on a observé :
- le début de la dégradation au bout de 8 jours
- la fin de la dégradation au bout de 18 jours.
Sur la parcelle 2, on a observé :
- le début de la dégradation au bout de 3 jours
- la fin de la dégradation au bout de 10 jours.
Exemple 8
Sur des parcelles semblables plantées d'herbacées, on a comparé le
temps nécessaire à la destruction totale de la végétation avec un herbicide
seul
d'une part, et le même herbicide additionné d'un éther de glycérol : le 3-
hexyloxypropane-1,2-diol d'autre part.
Sur la parcelle 1, on a pulvérisé une solution comprenant 6 g/l de
glyphosate à raison de 36 grammes au m2.
Sur la parcelle 2, on a pulvérisé une solution comprenant 6 g/l de
glyphosate et 0,9 g/1 de 3-hexyloxypropane-1,2-diol, à raison de 36 grammes au
m `.
Sur la parcelle 1, on a observé
- le début de la dégradation au bout de 8 jours
la fin de la dégradation au bout de 18 jours.
Sur la parcelle 2, ors e observé
- le début de ici dégradation au bout de 3 jours
- la fin de la dégradation au bout de 10 jours.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
18
Exemple 9
Sur des parcelles semblables plantées d'herbacées, on a comparé le
temps nécessaire à la destruction totale de la végétation avec un herbicide
seul
d'une part, et le même herbicide additionné d'un éther de glycérol : le 3-(2-
éthylhexyloxy)propane-l,2-dioi d'autre part.
Sur la parcelle 1, on a pulvérisé une solution comprenant 6 g/l de
glyphosate, à raison de 36 grammes au m'.
Sur la parcelle 2, on a pulvérisé une solution comprenant 6 g/l de
glyphosate et 0,9 gJl de 3-(2-éthylhexyloxy)propane-1,2-diol, à raison de 36
grammes au m2.
Sur la parcelle 1, on a observé :
- le début de la dégradation au bout de 8 jours
- la fin de la dégradation au bout de 18 jours.
Sur la parcelle 2, on a observé :
- le début de la dégradation au bout de 3 jours
- la fin de la dégradation au bout de 11 jours.
Exemple 10
Sur des parcelles semblables plantées d'herbacées, on a comparé le
temps nécessaire à la destruction totale de la végétation avec un herbicide
seul
d'une part et le même herbicide additionné d'un éther de glycérol : le 3-
décyloxypropane-1,2-diol d'autre part.
Sur la parcelle 1, on a pulvérisé une solution comprenant 6 g/l de
glyphosate, à raison de 36 grammes au m`'.
Sur la parcelle 2, on a pulvérisé une solution comprenant 6 g/l de
glyphosate et 0,9 g/l de 3-décyloxypropane-1,2-diol à raison de 36 grammes au
m' .
Sur la parcelle 1, on e observé
le début de la dégradation au bout de 8 jours
la fun de la dégradation au bout de 18 joui-s.
Sur la parcelle 2, on a observé
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
19
- le début de la dégradation au bout de 4 jours
- la fin de la dégradation au bout de 11 jours.
Exemple 11
Sur 4 parcelles recouvertes d'herbacées, on a réalisé les pulvérisations
suivantes :
- Parcelle 1 : Glyphosate à 6 g/l (36 g de la solution au m2)
- Parcelle 2 : Glyphosate à 4,5 g/l (36 g de la solution au m2)
- Parcelle 3 : une solution de Glyphosate à 1,5 g/l + 3-pentyloxypropane-
1,2-diol à 0,9 g/l à raison de 36 g de la solution au m2.
- Parcelle 4 : une solution de Glyphosate à 0,75 g/l+ 3-pentyloxypropane-
1,2-diol à 0,9 g/l à raison de 36 g de la solution au m2.
On a observé qu'au bout de 30 jours, les parcelles 1 et 3 sont dégradées
complètement, tandis que les parcelles 2 et 4 ne sont pas touchées.
Exemple 12
Sur 4 parcelles recouvertes d'herbacées, on a réalisé les pulvérisations
suivantes :
- Parcelle 1 : Glyphosate à 6 g/l (36 g de la solution au m2)
- Parcelle 2 : Glyphosate à 4,5 g/l (36 g de la solution au rn2)
- Parcelle 3 : une solution de Glyphosate à 3 g/l + 3-butyloxypropane-1,2-
diol à 0,9 g/l à raison de 36 g de la solution au m2
- Parcelle 4 : une solution de Glyphosate à 1,5 g/l + 3-butyloxypropane-
1,2-diol à 0,9g/I à raison de 36 g de la solution au m2.
On a observé qu'au bout de 30 jours , les parcelles 1 et 3 sont dégradées
complètement, tandis que les parcelles 2 et 4 ne sont pas touchées.
Exemple 13
Sur 4 parcelles recouvertes d'herbacées, on a réalisé les pulvérisations
suivantes :
- Parcelle 1 : Glyphosate à 6 g/l (36 g de la solution au mr)
- Parcelle 2 Glyphosate à 4,5 g/l (36 g de la solution au m`)
- Parcelle 3 une solution de Glyphosate à 3 g/l + 3-hexyloxypropane-
1,2-diol à 0,9 g%1 à raison de 36 g de la solution au ni
Parcelle 4 : une solution de Glyphosate à 1,5 g/l 3-hexyloxypropane
1,2 diol à 0,9 g/l à raison de 36 g de la solution au m`.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
On a observé qu'au bout de 30 jours , les parcelles 1 et 3 sont dégradées
complètement, tandis que les parcelles 2 et 4 ne sont pas touchées.
Exemple 14
5 Sur 4 parcelles recouvertes d'herbacées, on a réalisé les pulvérisations
suivantes :
- Parcelle 1 : Glyphosate à 6 g/l (36 g de la solution au m2)
- Parcelle 2 : Glyphosate à 4,5 g/I 36 g de la solution au m2)
- Parcelle 3 : une solution de Glyphosate à 3 g/l + 3-(2-
10 éthylhexyloxypropane-1,2-diol à 0,9 g/l à raison de 36 g de la solution au
m2
- Parcelle 4: une solution de(Glyphosate à 1,5 g/l + 3-(2-
éthyihexyloxypropane-1,2-diol à 0,9 g/I à raison de 36 g de la solution au m2.
On observe qu'au bout de 30 jours, les parcelles 1 et 3 sont dégradées
complètement tandis que les parcelles 2 et 4 ne sont pas touchées.
Exemple 15
Sur 4 parcelles recouvertes d'herbacées, on a réalisé les pulvérisations
suivantes :
- Parcelle 1 : Glyphosate à 6 g/l (36 g de la solution au m2)
- Parcelle 2 : Glyphosate à 4,5 g/l (36 g de la solution au m2)
- Parcelle 3 : une solution de Glyphosate à 3 g/l + 3-isopropyloxypropane-
1,2-diol à 0,9 g/l à raison de 36 g de la solution au m2
- Parcelle 4 : une solution de Glyphosate à 1,5 g/l + 3-
isopropyloxypropane-1,2-diol à 0,9 g/l à raison de 36 g de la solution au m2.
On a observé qu'au bout de 30 jours, les parcelles 1 et 3 sont dégradées
complètement tandis que les parcelles 2 et 4 ne sont pas touchées.
Exemple 16
Sur 4 parcelles recouvertes d'herbacées, on a réalisé les pulvérisations
suivantes :
- Parcelle 1 : Glyphosate à 6 g/l (36 g de la solution au m`)
- Parcelle 2 : Glyphosate à 4,5 g/l (36 g de la solution au m' )
- Parcelle 3 : une solution de Glyphosate à 3 g/l t 3-isononyloxypropane-
1,2-diol à 0,9 gI à raison de 36 g de la solution au ni
Parcelle 4: une solution de Glyphosate â 1,'5 g/l + 3-
sononyloxypropane 1,2 diol à 0,9 g/i à raison de 36 g de la solution au m'.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
21
On e observé qu'au bout de 30 jours, les parcelles 1 et 3 sont dégradées
complètement tandis que les parcelles 2 et 4 ne sont pas touchées.
Tous ces exemples montrent que les éthers de glycérol de formule (I)
sont des accélérateurs de dégradation des herbacées d'une part et qu'ils
diminuent les quantités d'herbicide(s) à mettre en oeuvre pour effectuer un
désherbage.
C - Mise en évidence des propriétés d'activateurs des effets fongicides
des éthers de glycérol
Dans les exemples suivant la souche test de Candida a/bicans utilisée est
commercïalisée sous la référence ATCC 10231, Collection Institut Pasteur.
Exemple 17
Dans une boite de pétri, une souche de Candida albicans a été ensemencée sur
gélose. On a ensuite déposé à sa surface des disques de papier buvard imbibés
des solutions suivantes
- le disque 1 est imbibé d'une solution comprenant 0,8 g/l de mancozèbe.
- le disque 2 est imbibé d'une solution comprenant 0,5 g/l de mancozèbe.
- le disque 3 est imbibé d'une solution comprenant 0,2 g/l de mancozèbe.
- le disque 4 est imbibé d'une solution comprenant 0,2 g/l de mancozèbe
et 0,19/1 de 3-butyloxypropanc-1,2-diol
On a observé la croissance de Candida albicans (au milieu de la boite) ainsi
que
- Autour des disques 1 et 4 : la formation de zones d'inhibition de la
croissance
circulaires, à proximité de chaque disque.
- Autour des disques 2 et 3 : l'absence de zone d'inhibition.
Exemple 18
Dans une boite de pétri, une souche de Candida albicans e été
ensemencée sur gélose. On e ensuite déposé à sa surface des disques de papier
buvard imbibés des solutions suivantes :
- le disque 1 est imbibé d'une solution comprenant 0,8 gjl de mançozébe.
- le disque 2 est imbibé d'une solution comprenant 0,5 g/I de mancozèbe.
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
22
- le disque 3 est imbibé d'une solution comprenant 0,2 g/l de mancozèbe.
- le disque 4 est imbibé d'une solution comprenant 0,2 g/l de mancozèbe
et 0,25 g/l de 3-pentyloxypropane-1,2-dioi
On a observé la croissance de Candida a/bieans (au milieu de la boite)
ainsi que :
- Autour des disques 1 et 4 : la formation de zones d'inhibition de la
croissance
circulaires, à proximité de chaque disque.
- Autour des disques 2 et 3 : l'absence de zone d inhibition.
Exemple 19
Dans une boite de pétri, une souche de Candida albicans a été
ensemencée sur gélose. On a ensuite déposé à sa surface des disques de papier
buvard imbibés des solutions suivantes
- le disque 1 est imbibé d'une solution comprenant 0,8 g/l de mancozèbe.
- le disque 2 est imbibé d'une solution comprenant 0,5 g/l de mancozèbe.
- le disque 3 est imbibé d'une solution comprenant 0,2 g/l de mancozèbe.
- le disque 4 est imbibé d'une solution comprenant 0,2 g/l de mancozèbe
et 0,05 g/l de 3-(2-éthylhexyloxy)-propane-1,2-diol
On a observé la croissance de Candida albicans (au milieu de la boite)
ainsi que :
- Autour des disques 1 et 4 : la formation de zones dinhibition de la
croissance
circulaires, à proximité de chaque disque.
- Autour des disques 2 et 3 : l'absence de zone d'inhibition.
Ces exemples montrent que les éthers de glycérol de formule (I)
diminuent les quantités de fongicide(s) à mettre en oeuvre pour inhiber la
croissance des champignons.
D - Mise en évidence des propriétés d'activateurs des effets insecticides
des éthers de glycérol
Dans !e's exemples su!vant les mouches de l'espèce' LU(///a C ?E'.Sa Ont été
obtenues en disposant des morceaux de viande hachée ainsi qu'une vingtaine
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
23
d'asticots issus d'une mouche de l'espèce Luci/ia caesar (origine commerciale,
article de pêche) ; au bout de 5 jours des cocons se forment pour donner
naissance aux mouches.
Les pucerons de l'espèce Sitobion avenae utilisés dans les exemples
suivants ont été fournis par l'Université de Picardie d'Amiens, laboratoire de
biologie des plantes et contrôle des insectes ravageurs EA3900, 33, rue Saint
Leu, Amiens 80000.
Exemple 20
Dans chacune des cages faites d'un cadre cubique à partir de tasseaux en
bois et de moustiquaires, on a introduit 30 mouches de l'espèce Lucr"/ra
caesar.
L'une des faces a été percée d'un trou par lequel on introduit un
pulvérisateur de
la solution à tester :
- dans la cage 1, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg/l de diflubenzuron
- dans la cage 2, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg/1 de diflubenzuron et 47.0 mg/1 de 3-isopropyloxypropane-1,2-diol
On a établi le taux de mortalité de la population de mouches dans chaque cage:
- dans la cage 1, on a observé un taux de mortalité de 29%.
- dans la cage 2, on a observé un taux de mortalité de 64%.
Exemple 21
Dans chacune des cages faites d'un cadre cubique à partir de tasseaux en
bois et de moustiquaires, on a introduit 30 mouches de l'espèce Luci/ia
caesar.
L'une des faces e été percée d'un trou par lequel on introduit un
pulvérisateur de
la solution à tester
- dans la cage 1, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg/l de ditlubenzuron
- dans la cage 2, on a pulvérisé 1.8 g d'une solution comprenant 39.0
nig/I de diflubenzuron et 17.0 mg/l de 3 { ethylhexyloxy)propun~ 1, -
2 dot
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
24
On a établi le taux de mortalité de la population de mouches dans chaque cage:
- dans la cage 1, on a observé un taux de mortalité de 29%.
- dans la cage 2, on a observé un taux de mortalité de 56%.
Exemple 22
On a introduit 25 pucerons de l'espèce Sitobion avenae, dans une boite
de pétri dans laquelle la solution à tester a été pulvérisée :
- dans la boite 1, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg/l de diflubenzuron ;
- dans la boite 2, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg/1 de diflubenzuron et 47.0 mg/l de 3-isopropyloxypropane-1,2-diol.
On a établi le taux de mortalité de la population de pucerons dans chaque
cage:
- dans la boite 1, on a observé un taux de mortalité de 21%.
- dans la boite 2, on a observé un taux de mortalité de 54%.
Exemple 23
On a introduit 25 pucerons de l'espèce Sitobion avenae, dans une boite
de pétri dans laquelle la solution à tester a été pulvérisée :
- dans la boite 1, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg/l de diflubenzuron ;
- dans la boite 2, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg/1 de diflubenzuron et 47.0 mg/l de 3-pentyloxypropane-1,2-diol.
On a établi le taux de mortalité de la population de pucerons dans chaque
cage:
- dans la boite 1, on a observé un taux de mortalité de 21131,).
- dans la boite 2, on e observé un taux de modalité de 81` .
Exemple 24
On a introduit 25 pucerons de l'espèce Si 0t?/oi7 avoua fans une boite
de pétri dans laquelle le solution à tester a été pulvérisée :
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
- dans la boite 1, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg/I de diflubenzuron ;
- dans la boite 2, on a pulvérisé 1.8 g d'une solution comprenant 39.0
5 mg/1 de diflubenzuron et 47.0 mg/1 de 3-hexyloxypropane-1,2-diol.
On a établi le taux de mortalité de la population de pucerons dans chaque
cage:
- dans la boite 1, on a observé un taux de mortalité de 21%.
10 - dans la boite 2, on a observé un taux de mortalité de 67%.
Exemple 25
On a introduit 25 pucerons de l'espèce Sitobion avenae, dans une boite
de pétri dans laquelle la solution à tester a été pulvérisée :
- dans la boite 1, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg/l de diflubenzuron ;
- dans la boite 2, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg/1 de diflubenzuron et 47.0 mg/l de 3-(2éthylhexyloxy)propane-1,2-
diol.
On a établi le taux de mortalité de la population de pucerons dans chaque
cage:
- dans la boite 1, on a observé un taux de mortalité de 21% ;
- dans la boite 2, on a observé un taux de mortalité de 77%.
Exemple 26
On a introduit 25 pucerons de l'espèce Sitobioi1 avenae, dans une boite
de pétri dans laquelle la solution à tester a été pulvérisée
- dans la boite 1, on a pulvérisé 1.8 g d'une solution comprenant 39.0
mg//I de diflubenzuron ;
- dans la boite 2, on a pulvérisé 1.8 g d'une solution comprenant X9.0
mg/l de diflubenzuron et. 47.0 mg/l de 3 décyloxypropane 1,2 diol.
on a établi le taux de mortalité de la population de pucerons dans chaque
cage:
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
26
- dans la boite 1, on a observé un taux de mortalité de 21%
- dans la boite 2, on a observé un taux de mortalité de 60%.
Exemple 27
On a introduit 25 pucerons de l'espèce Sitobion avenae, dans une boite
de pétri dans laquelle la solution à tester a été pulvérisée :
- dans la boite 1, on a pulvérisé 1.8 g d'une solution comprenant 78.1
mg/1 de pirimicarbe ;
- dans la boite 2, on a pulvérisé 1.8 g d'une solution comprenant 78.1
mg/l de pirimicarbe et 62.5 mg/l de 3-méthyloxypropane-1,2-diol.
On a établi le taux de mortalité de la population de pucerons dans chaque
cage:
- dans la boite 1, on a observé un taux de mortalité de 16% ;
- dans la boite 2, on a observé un taux de mortalité de 100%.
Exemple 28
On a introduit 25 pucerons de l'espèce Sitobion avenae, dans une boite
de pétri dans laquelle on pulvérise la solution à tester :
- dans la boite 1, on a pulvérisé 1.8 g d'une solution comprenant 78.1
mg/l de pirimicarbe ;
- dans la boite 2, on a pulvérisé 1.8 g d'une solution comprenant 78.1
mg/l de pirimicarbe et 62.5 mg/l de 3-butyloxypropane-1,2-diol.
On a établi le taux de mortalité de la population de pucerons dans chaque
cage.
- dans la boite 1, on a observé un taux de mortalité de 16%
- dans la boite 2, on a observé un taux de mortalité de 100`'0.
Exemple 29
On a introduit 25 pucerons de l'espece Sitobio/7 a1,VfU', dans boite
de pétri dans laquelle la solution à tester a été pulvérisée :
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
27
- dans la boite 1, on a pulvérisé 1.8 g d'une solution comprenant 78.1
mg/l de pirimicarbe ;
- dans la boite 2, on a pulvérisé 1.8 g d'une solution comprenant 78.1
mg/1 de pirimicarbe et 62.5 mgil de 3-pentyloxyproparie- 1,2-diol.
On a établi le taux de mortalité de la population de pucerons dans chaque
cage:
- dans la boite 1, on a observé un taux de mortalité de 16% ;
- dans la boite 2, on a observé un taux de mortalité de 87%.
Exemple 30
On a introduit 25 pucerons de l'espèce Sftoblon avenae, dans une boite
de pétri dans laquelle la solution à tester a été pulvérisée :
- dans la boite 1, on a pulvérisé 1.8 g d'une solution comprenant 78.1
mg/1 de pirimicarbe ;
- dans la boite 2, on a pulvérisé 1.8 g d'une solution comprenant 78.1
mg/1 de pirimicarbe et 62.5 mg/l de 3-hexyloxypropane-1,2-diol.
On a établi le taux de mortalité de la population de pucerons dans chaque
cage:
- dans la boite 1, on a observé un taux de mortalité de 161x.
- dans la boite 2, on a observé un taux de mortalité de 9211,'0.
Exemple 31
On a introduit 25 pucerons de l'espèce Sitobion avenae, dans une boite
de pétri dans laquelle la solution à tester a été pulvérisée
dans la boite 1, on a pulvérisé 1.8 g d'une solution comprenant 78.1
mg/l de pirimicarbe ;
- dans la boite 2, on a pulvérisé 1.8 g d'une solution comprenant 73,1
mg/l de pirimicarbe et 62.5 mg/l de 3 decyloxypropane 1,2 diol.
On a établi le taux de mortalité de la pop~ilation de pucerons dans chaque
caage:
CA 02772060 2012-02-23
WO 2011/030061 PCT/FR2010/051875
28
- dans la boite 1, on a observé un taux de mortalité de 16% ;
- dans la boite 2, on a observé un taux de mortalité de 100%.
Ces exemples montrent que les éthers de glycérol de formule (I)
diminuent les quantités d'insecticide(s) à mettre en ouvre pour tuer les
insectes
nuisibles dans les cultures concernées.