Note: Descriptions are shown in the official language in which they were submitted.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
1
Utilisation de déri%és d'indole comme actuateurs de \ISIZ-1,
pour leur application en tant que médicament pour le traitement (le la maladie
de Parkinson.
l_a pré,ente un ciiiion concerne de nouveaux coinpo,c, incloliclues,
pré lérenliellen~ent dos dérivés de type indole benzoïque, ainsi duc leur
procédé de
prepurut1on et leur uutill,aiion en tant que principe oeuf de Illtdlcuinent,,
Ilotuin ne nt
tle,tiné, au traitement: et/ou â la prévention de niulaclie, impliquant le,
récepteurs
nucléaire, NURR-1. Plus spécifiquenient, cette in~eution concerne l'ut ïli,
iti )u de ces
coniposc, pour la Cahrication d'un médicament pour le traitement et/eii la
prévention
des urtladie, nettrod<pénfratives et en particulier de la maladie de
Parkinson.
Art antérieur
Les maladies neurodégénératives sont définies comme des maladies
caractérisées par un dysfonctionnement progressif du système nerveux. Elles
sont
souvent associées à une atrophie des structures du système nerveux central ou
périphérique touché. Elles incluent, entre autres, des maladies telles que la
maladie
d'Alzheimer, la maladie de Creutzfeldt-Jakob, la maladie de Huntington, la
maladie
de Parkinson, les maladies lysosomales, la paralysie supranucléaire
progressive, la
sclérose en plaques et la sclérose latérale amyotrophique. Parmi ces maladies
neurodcc<nératives, la maladie de Parkinson est une affection qui touche
environ
quatre mi Ilions de personnes dans le monde. Bien qu'elle at'fcete des
individus de tout
âge. elle est plus commune chez les personincs âgées (av cc -' "-, de la
population des
peI_umne, de p1ws de 65 an, touchées par cette maladie). Elle e,t caractérisée
par une
(léuréncrescelice cils neurones dopuininer~ciquc, (le la ,uh tautiii niera.
Ces t}pe, cie
neurones sriithcliseut la dopamine et i'utili,cut comme neurouammelletu~.
Ou a pu ciuhlir une relui ion <nlie le dclicil cle la dopamine et lei troubles
ner~ctt,r. I.,t dop<uriine eyerce un o le central (laps le contiole ~le<
n~ou~emenl,
~olonl,tirc,. le, liucliom c~i~enitive, et le (lé\elt ppenient de
sit La ,irat~d,ciLe ihcr<tpctitique actuelle pour le ir,iitenlci t de la 111,1
lacl1e de I'urkiit,0n.
repo,c no 1 alicntuttion (les ,~niptornes en )tlpplcaiil I,l deli<icuce eu
tlopuniine par
Ia~inlini,lr,ttion cl'un prcci_tr,eur lnctaholiulue tel Iluc la L I)Up:1.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
2
Or, auj(iurd}iui. 1'au~~nlcntation (ic la lic(lucucc clé cette patholo-'le a
réndu
nécc~,~lirc le développcriicilt (le n(iu~eaus rlécnt, thérapcuti(Ilicti.
c~crç<<ut, Lui rûle
1~cncf iyué clans lu suri ic ci la (Ill érenciatiun ncur(~nalc.
Cc J ycloppenicnt a conduit à i((cntit,ier cles cenlpoecs capable, d acti~cr
les
récepteurs iiuclcalré, iiupliquc, tdarl, la pathoL'Cné,c lie la nlalatlic (le
harkul, (On.
Forieriient exprimé clan, le cci eau. le i ctetur tic uanscrihti(~u tiURR-1,
membre tic le superlanlille cdc récepteurs uuclcrlires orpliclin,. e cté
identifié comme
ayant LUI r<lIe e,.,cntiel dans le dév eloppenient et le inainticn des
ucurortes
dopaiuiiiergique, du tiicscncéphale ( cttersiroin. Solomin et al. 1997,
Science. 1997
Apr 11;276 5310).248-5L).
Le récepteur nucléaire NURR-1 intervient dans le maintien du phénotype
dopaminergique via la régulation des gènes spécifiques des neurones
dopaminergiques (DA). Il favorise aussi la survie des neurones DA en les
protégeant
des agressions toxiques. Le récepteur nucléaire NURR-1 sert donc de facteur de
transcription spécifique des neurones dopaminergiques pour lequel les
activités
pourraient être régulées en modulant la neurotransmission dopaminergique dans
la
maladie de Parkinson.
Ce récepteur se lie à l'ADN sous forme de monomères, d'homodimères ou
d'hétérodiméres avec RXR (Retinoid X Receptor) un récepteur nucléaire qui est
l'hétéropartenaire de nombreux autres membres de la famille des récepteurs
nucléaires. RXR intervient dans de nombreux processus physiologiques comme le
Inctai)olisme des lipides et du glucose, le dév-cloppcntent et la
dilfércnciation. NURR-
1 interagit ainsi avec lcs isof'ornies IX et -f de RXR. RXRc ct exprimé de
leçon
ul)i(luitaire alors tlue I'éxprc,sion de RXR 1, sc concentre principalCiUcl1L
rions le
cerceau et noienuucnt drln, le ,triatuul. 1,11vpoiiIa1 a,uus et l'h,poplly,C.
Les eornpleres f(~rniés (kR 1%RXRu et ~L RR I~RXR; sont capables de
recculer le transcription Cil rcpun;c l1 un liLend de KXR. RXR rii(~clule
(1(~nc
p(~siti~rmcnt le p(~ten~iel d'ec~tir(Iii(~n de le iran,crihti(~n (le M RR-l.
L idéutitirati(>n cic. ~Inp~.,=c, cipeHIes (_I'induire l a(~ti~ ii des
r(lmple~c;
\tI R LkXRti et t RR 1 1ZXR;r dc~r:1il en COil C(Ill
enrc permettre (lc (li,p(~,cr (le
n(ui~ et le, (pic, pour traiter la ulal,idic (le l'ar4 in~(,n.
On ~(inn,iil par le (IOcuil enl x\021)1 VIII L)) (lc, ~~(~nipu,é
hétér(~e~eliync,
a~lit>pour le tr,iiteuient (le le mala(ii(~ cic l'rir! in,(~n.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
3
Par iillcur~. les <lOcunientti W02004/072050, H Z ? I)O 10S. 1-R 2 OO 106 et
f R _' ~)O3 I07 dccrivunt clrs counpooscs acti~atuurs <lu rccuptuur v1 RR 1,
tandis dite
l'utili,ation du c~n~hc~,c; I tcroc~clicluus nrcuitrlatcurs de l activ lié dcs
r7ccpic;urs de
la Iumillu dcs V'G1 1-13 (donnt.:NC~RR-1 est unn iuciubr-e) est clecrite daims
le document
\10_'(}U5iU47 20.
Par ailleurs, div CO s caîî1J)O Cs inclnliyue1 ont été déerits crin, l'art
arlt7rieur.
Ainsi :
- les documents WO 00/46196 et WO 99/07678 dit ulguent tics composes
dl7riv cs de l'ueidu irrdole-2-carboxylique pour leur activité anti-
inflammatoire ;
- le document WO 98/41092 décrit des dérivés d'indole-2-carboxamide actifs
contre la douleur ;
- le document W02005/056522 décrit des dérivés de l'indole qui trouvent
application en tant que principes actifs de médicaments pour le traitement de
certaines maladies du système cardiovasculaire.
Enfin, par les documents : Journal of Organic Chemistry, vol. 54, no.14, 1989,
pages 3264-3269 ; Journal of Organic Chemistry, American Chemical Society,
Easton.; vol. 57, 23 octobre 1992, pages 5891-5899 ; Journal of Medicinal
Chemistry,
vol. 35, no. 26, 1992, pages 4854-4857 ; Journal of Chemical Society, Perkin
Transactions 1, Chemical Society, no. 12, 1 janvier1991, pages 3165-3172 ;
Journal
of Organic Chemsitry, American Chemical Society, Easton.; vol. 50, no. 26, 27
decculbre 1985, pages 5451-5457 ; EP 1 086 950 ; Heterocycles, Elservier
Science
Publishers B. V. Amsterdam, NL, vol. 34, no. 8, 27 avril 1996, paucs 1()13-
1621 et
ty-'02001.082909, on cannait les cOn p().es OUv anis :
\cide [fil (phén~lsrrlfanvl)-Ili inclal ~Ilcarhanyl]-3-pyridinecalbovvliclue;
- .lciclc I1 5-oni7thoyv 1-(plrrn~hul1'on}l)-111 indol-2-yl]carbonyl]-3
pvriclinc_
curhoy~ li~luu
\ciclu O il~cthovy 1 (phcn~1011lonvI) 111 incl~l ~1;carh<,n~l~ .~ p~ri~Jir~c
c,~rlu Y hyuc
- :1c idu ~-I I I u phrnv lsulHnv I)- l I l iI]do1 v I juw holmv l j- 3-pv
riclincc~r oyv lujou
~cicic -I 1 (plr7n~ l=uli~n~ l) I I1 incl~1 ~ Ijcarhouv I I i p~ridincc~irhu~~
licluc
- \ciclu 4-j 5-rn7iIîo -I (pfi7io kullinty I)-1l i-lIuIol-2 IRJrhouv I j -p,
riclinu-
- Ait . 7-I 1 1 phcn~ 1 0111 K)nv 1 ~-III-inclrl- 2-hiCrirl~onYI l-hci1to ~1ue
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
4
\cidc i-[( -mctho\\-1-(flh~nVl~Hftou\l)-1[[-inchl-`'-VIjcWJon\l7--t-hAridinc-
c~trho.yv liyuc ;
\Cicle -1-J 1 -Nvdroy 1 ~> tl~éthoxy-I (l~hen~l,ulfon~ t) 11l inci 1 2
}lléIllvll - 3-
pyriclinccarhoxvlique
4-i 1-~5-niéthuxy-l-(phénylsulfonyl)-1I1-enclot-2-yl]éthyl]- 3 h}ridinc
cru hoxy ligue ;
\ci~le 4-1I3-chlom-1-(phéii 1,ull()n}1} lH indol-2 yl~c4uhon}l( 3-pyridinc-
carboxv lique, ester méthylique ;
Acide 5-Lhydro~V 15-(méthylthio)-1-(phénylsulfonyl)-1H-indol-2-yl] méthyl]-2-
furancarboxylique, ester éthylique ;
Acide 5-[[5-(méthylthio)-1-(phénylsulfonyl)-1H-indol-2-yl]méthyl]-2-furan-
carboxylique, ester éthylique ;
- Acide 4-[[3-bromo-l-(phénylsulfonyl)-1H-indol-2-yl]carbonyl]- 3-pyridine-
carboxylique ;
- 4-[[1-(phénylsulfonyl)-1H-indén-2-yl]carbonyl]-benzonitrile.
Dans tous ces documents, lesdits composés sont présentés comme intermédiaires
de
synthèse.
Objet de l'invention
Selon un premier aspect, la présente invention concerne des composés dérivés
de l'indole qui sont des agonistes NURR-1/RXRa et NURR-1IRXRy, capables
d'inhiber la dé ernérescence des neurone, ob,crv éc dans la maladie de
Parkinson pour
leur Utilisation en tant que médicament et sont choixis parmi ;
i) le, Conupoe) de formule
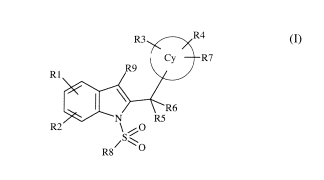
R3 R4
C R7
IZv
RI
1 `ç)
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
(1)
Clan, la(lucllc
C~ représente un ci upc pheuvlc ou un groupe hcicroaronlatiyuc a ttttl ou G
chuluuon,
5 R1 et R2 représentent chacun. in(lcpendanlmcnt l'un de l'autre. un atonie
d'lltidlroLéuc,
un atonie (l haloe aie. Ili] croupe nitro. tlu groupe alk~ le a~ unt 1 à --
atomes (le
carbone, éventuellement totalci ent ou pariicllemueut halo~a~n~, un groupe
alcoxy
ayant 1 à -1 atomes de carbone, un groupe hétérocyclique a~ant 4 à 6 atomes,
un
groupe -SCH -OCF3 , -NI I.,. -NHR ou -NR>:
R3 et R4 représentent chacun, indépendamment l'un de l'autre, un atome
d'hydrogène,
un atome d'halogène, un groupe alkyle ayant 1 à 4 atomes de carbone, un groupe
hydroxy ou un groupe alcoxy ayant 1 à 4 atomes de carbone ;
R5 et R6 représentent chacun, indépendamment l'un de l'autre, un atome
d'hydrogène,
un atome d'halogène, un groupe alkyle ayant 1 à 4 atomes de carbone, un groupe
hydroxy;
ou R5 et R6 forment ensemble avec l'atome de carbone auquel ils sont rattachés
un
groupe cycloalkyle ayant 3 à 6 atomes de carbone, un groupe éthylène (C=CH2)
ou
un groupe carbonyle (C=O) ;
R7 représente un groupe -COOR, un groupe bioisostère d'acide carboxylique ou
un
groupe -CN ;
R8 représente
- un `croupe alkyle ayant 1 à 6 atomes ale carbone ;
- un croupe ar}le. hétéroaryle, Cyclique ou hétérocyclique, non substitué oit
,nl),tiiu par III, deux ou trois ,IIh,lltuanKS i(lenil(lues ()Il dillerenis.
clioi iS
p u tni le, atome, (l'halogène. les croupes tllhy le av ani 1 à 6 atomes clc
carbone.
éventuclleuient totaleumni oIl puriiclle111Ciut hall~~c né o cveuiuellelnent
hvdro.xvlc,. les cmonpe, alcoxv avare I f (' clame, (le carbone.
cventneilerneni
lotalenleni ou partiellenieut lialoccuue . le groupe hhcnoyv, le, croupes
e~cl1que, tuant ,~ ~I O atonie, (le carbone. c, ~r(ull_~c< ;talc et héicroar~
le, en
il particulier phcnr le et pv raiol~ Ic, non ibuitnf, ou ,uh,lituc, par un oit
deux
suHiituant,. RicntiLine ou JmItcienis. Choisis parmi les atonies (I ltalocemie
et
= croupe, alla le ar tint 1 â 1 atonie> (lc carbone, les g onpes S( 111 et
acyl
li;ulpllolinc ;
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
6
IZ9 rcpresentc [il] atome il'h~dro~~ène. tin atome dll ilo,~clle ou un croupe
alk~fc uvnnt
1 i 4 atomes (le carbone
IZ ircprésentc un ,itonlc dhti~1rlndne ou un croupe alkvfe avant 1 t 4 atomes
de
c,u hune.
ii) les sels pharnlaccutipueincnt -IcccptabIC desdits composes de formule (I).
Scion tin Peuyicmc aspect. 1'inventioll concerna les composes précités pour
leur
uUIlsation en tant que snhstances tharupeutiqueInent uct~ e .dans le
traitement et/ou
la prévention des nuifaddies ncurodépcnérativves, en particulier la maladie de
Parkinson. ainsi que les compositions pharmaceutiques les consternant.
Selon uIt troisième aspect, l'invention concerne l'utiJisauoin d'au moins un
composé de formule (1) ou l'un de ses sels pharmaceutiquenient acceptable en
tant
que principe actif pour la préparation d'un médicament destiné au traitement
des
maladies dans lesquelles le récepteur NURR-1 est impliqué, notamment des neuro-
dégénérescences, comme en particulier la maladie de Parkinson.
Selon un quatrième aspect, la présente invention concerne de nouveaux
composés dérivés de l'indole qui sont des agonistes NURR-1/RXRa et NURR-
1/RXRy, capables d'inhiber la dégénérescence des neurones observée dans la
maladie
de Parkinson, qui sont choisis parmi les composés de formule (I) telle que
définie
précédemment à l'exclusion des composés suivants :
- Acide 2-[[1-(phénylsulfonyl)-1H-indol-2-yl]carbonyl]-3-pyridinecarboxylique
;
- Acide 2-[[5-méthoxy-l-(phénylsulfonyl)-1H-indol-2-yl]carbonyl]-3-pyridine-
carboxylique ;
- Acide 2-[[6-méthoxy-I-(phcnvlsulfonyl)-1H-indol-2-yl]carbonyl]- 3-pyridine-
clu-boxuli(jue ;
vide > ~ ~ I i pllcnl lsulfon~ l)-1T1-inclof-H-v I carhon~ 1 3-pvridinccarhor
11 (lue
;
- .Acide 3-111 -(phrn~ l;uIf~,nv 1) 11l iiidol ? l;ca hon~ I ~ ->
p~ritlinecarho~~ ligue ;
Ilc I H m~tilovv 1 (phcnv knIt~~n~ 11 1_H inil<~l '_ v c<u hoily I h~ ri~linc
~trh~Iyv li pie
- Acide 2-i 1-(pheuv kLiiionv l t-1 l f-iiidOI- v I carhonv i hcn/LH(tuc =
- Acide 2- l l 4 ulcthoyv - 1 i phen~ l ~ i i l l o n ~ I ) l I f intlof ~ l
~carhon~ l j f pv l idnic-
cluhoyvlic ic
~cide,~ 1 hvdi >s~ 1 mcthl~~t~ ] tplten~l>ul(i>n~11-III in~lol ~ ~I~cth~l I-
pv ridinec. i hovv lipnc ;
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
7
~cüle 1 1 - [ > L I O H lé e l)-11 I-inUlol- yl ~eth~ 1] -p ine-
cnrhovyIiyuc ;
cicle-1 LI;-chloio 1 -( plicny1u11'O n1H-indol-2-}IJcuu-h(ni1]-3-pyridine-
ca1 I ~x}Tique, ester mctli}ligue ;
;lcidlc 5-[hydroxy[5-(nicthvlthio)-1-(phcny-l,,ulfooiiy-1)-1N indol y1]
iiiéthyl] `_'-
'Ili arl~oxyliclue, e~tei cthv tique ;
Acide 5-[[5-(inctl) y 1thio)-1-(phénylsullony 1)-1H-indol-2-yl]niéthyl]-2-
furan-
carboxylique, e' ter éthylique ;
Acide 4-[[3-bromo-l-(phénty'1 ulfo ii.yl)-IH-indol-2-y1]carbonyl]- 3-pyridine-
cunc~~x~'li(lue ;
4-[[1-(phénylsulfonyl)-I H-indén-2-yl]carbonyl]-benzonitrile.
Selon un dernier aspect de l'invention, la présente demande vise à couvrir une
méthode de prévention et/ou de traitement des maladies dans lesquelles le
récepteur
NURR-1 est impliqué, notamment les maladies neurodégénératives, et plus
particulièrement la maladie de Parkinson, qui consiste à administrer à un
patient en
ayant besoin une quantité thérapeutiquement efficace d'un composé de formule
(I) ou
d'une composition pharmaceutique contenant un tel composé.
Description détaillée
On entend par "groupe alkyle", une chaîne hydrocarbonée saturée qui peut être
linéaire et ayant au moins 1 atome de carbone ou ramifiée ou cyclique et ayant
au
moins 3 atomes de carbone (également désigné par l'expression "cycloalkyle").
Par
exemple et sans limitation, un groupe alkyle ayant de 1 à 6 atomes de carbone
peut
Cire un yrotipe méth3le. éthyle. propyle, butyle. pentyle, hcx'le. 1-
nuéthvlc1liyle. 1-
inéthn lprnpv lu. ' ii~cth~ lpr~~p~ 1e. 1.1-dlimcthv lctlly le. 1
niéih~lhutvle. 1,1-
din~etllylpIopvle. 1 mcthvlpentvle. l.l-dinicthylhut~le. cvclopIopvle.
cyclohutvle.
cvclopentxle. evel )hexvle ou evclopentvlrncillyle.
On entend par li~iloeene . uu utoomc de l,roine. die 1-1 uer oii de chlore.
On entend par croupe ulhvle p utiellenient ou totalement Ii.il~~chnc" uu
?loup~
;t) ulkr le tel (lue dhhui ei de iii rlan lequel tin (~~u phi enr utouie(>t h
h~clroeene
e t( uiti renipluce(~) pair uiuou (le") uton~e(~) hliulocene. .A titre
hexeuiple de tel
croule. Oïl peut citer le cioiipe~ X111111 r~~mcthv le ou tri(lu~~iolnhtllv
le.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
8
On entend Iru "groupe uikvle h~drox~le utr rouge alkyle tel duc dct'ini ci-
dcõgis (lan, lequel t_tn atome d'hvdrourcne c't remplace pur un croupe
hvdr()xy.
On entend par ''<uroupe alcoxti", un groupe OR dans lequel R est un groupe
alk~ le tel clac dcliui piécédemmIIienl. <A titre d'eXemplc rie croupe alcoxv
ay ant de 1 à
4 atomes de carl7~~tte, on peut citer lei ,~roupe, mcthoxr, éthoxy, propoxy,
hutox}, 1-
mél h~ léthox y, 1,1 dimeth~lethoxti. 1-liaithylpropoxy, 2-Inéth}`Ipropoxy ou
cyclopropv itnéthoxy.
On entend par "groupe aryle", un groupe hydrocarbond aromatique
monocyclique ou bicyelique ayant de 6 à 12 atomes de carbone. A titre
d'exemple de
groupe aryle, on peut citer les groupes phényle et naphtyle.
On entend par "groupe hétéroaryle", un groupe hydrocarboné aromatique
monocyclique, bicyclique ou tricyclique comprenant au moins un hétéroatome
dans
l'un des cycles, ledit hétéroatome étant choisi parmi l'azote, l'oxygène et le
soufre
(ainsi que leur forme oxydée, comme par exemple le N-oxyde, le sulfoxyde ou la
sulfone).
Un groupe hétéroaryle peut être par exemple un groupe monocyclique ayant 5
ou 6 chaînons, un groupe bicyclique ayant 7 à 11 chaînons ou un groupe
tricyclique
ayant 10 à 16 chaînons, ledit groupe contenant 1 à 3 hétéroatomes, de
préférence 1 ou
2 hétéroatomes, choisis parmi l'azote, l'oxygène et le soufre.
A titre d'exemple de groupe hétéroaryle monocyclique ayant 5 ou 6 chaînons
(cgalernent dé,,i,-,né par l'expression "groupe hétéroaromatique'). on peut
citer les
groupes pyrrohle. p~rutolyle, irnidazolyle, oxazol}le, ioxa/olyle, triazolyle,
furuty le. thicn~ le. thiazolyle. i~r~tlliuzolyle, thiadiazolvle_ p ridyle,
pyrida/.itt~ Ic,
p~ riu~idiu~ le. p~razin~ le et tria/in~ le.
1 titre d'exctnple dC groupe hctcroar~ le hïcvt ligue. on peut citer le,
groupes
hcn/othia/olv le. heu/oxa/olé le. heu/oya/inone. hen/o.adia/olv le. I.3 heu/o-
dioxoly le. hentol trv le. hen/opv ra/wv le. hen/otltic u le. indoly le.
inda/oly le.
hen/inuda/ol~ le, hernzopv rani le. pv rrolopv ridv m le. t uropv ridinv le.
i"odllinolinv le,
3t) duirtoliit>le et in~ida/othia/olvle.
Ou entend p~tr groupe \eiI&lue", tttt 'roupe hVdrocarllonc ~aturc ou
p~utiellcn~cnt in~ature contenant 1 Ft evclc~ ~t~<tnt 3e 3 ut ,ttume~ (le
carbone par
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
9
titre d'cyclnple de ,croupe monoc clique. on peut citer lei ~~roupe~
c~clopropvle. eyelohut~le. e~elopent}le. c~'clohev le, cvclohrptvle.
e)elohuten,),le,
evelopentcn} le et evelohe.yeii ie.
litre d'e en~plc de groupe bicyrliclue. on peut citer le groupe 1.2.3.4
tétrall drouaphtalcne.
On entend pur "croupe hctérocycli9ue un groupe c}elique tel yue défini
précédennnent. dont un (ou pluoieurs) atome(,) de carbone (c~eutuellement
uS;ocic,, u
un ou plusieurs atc~me~ d'hydrogene) e,t(~ont) remplacé(s) pztr un (ou
plusieurs)
hctéroutoi e(s) choisis notanunenit parmi l'ox} -,ë lie et l'azote.
A titre d'exemple de groupe Jiëtcroc}clique, on peut citer les groupes
monocycliques tels que les groupes tétrahydrofuryle, pipéridinyle,
pyrrolidinyl,
tétrahydropyranyle, morpholinyle, thiamorpholinyle, ou encore les groupes
bicycliques tels que les groupes dihydroquinazolinyle, dihydrobenzofuryle,
notamment 2,3-dihydrobenzofuryle, dihydrobenzothiényle, dihydrobenzoxazinyle,
notamment 3,4-dihydro-1,4-benzoxazinyle et 3-oxo-3,4-dihydro-1,4-
benzoxazinyle,
dihydrobenzodioxinyle, notamment 2,3-dihydrobenzodioxinyle,
dihydrobenzopyrannyle, 1,2,3,4-tétrahydroquinolinyle, 2,3-dihydroindolyle,
dihydrobenzodioxépinyle notamment 3,4-dihydro-2H-1,5-benzodioxépinyle.
On entend par "groupe bioisostère d'acide carboxylique", un groupe présentant
des similitudes chimiques et physiques et produisant des propriétés
biologiques
largement semblables à un groupe carboxylique comme décrit dans Lipinski,
Annual
Reports in Medicinal Chemistry, 19,S6.21, p. 283 "Bioisosterism In Drug Dc~si
n";
Graham. Theochem, 1995,343, p.105-109 "Theoretieal Studies Applied To Drin
De~On: ale initio Electronic Di,,Lributio_ons In Bto~iso"teres
titre ti'esemple de gr~uipe hioiso,icre d'acide carboxylique. on peut citer
les
coupe uevLh~draiine~ optionnellennettt suhstitue . aevl hvdratine carhoyvlate~
optionnellenient cul tituc~. alh'.l et un I uIHnv learHinov le:
optionnellement
niHtituJ . >ultonamide, optionnellenient >uhnituc~. oyudia/olone~.
pluopIioutte~
optionnellement ,uhnituA. i,otlua/oles optionnellenient >iil nituJ . noyutole~
optionnellenieut ~uh~tiluJ . o~~lzoloncs optiounelleiueut ~uh~titnr~.
tctra~olc~.
iLaioIidine-dicne~ optionnellement ul tituA, tlic'yothia/oliJnione;
optionnellenierit yuh~litue .
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
des cor pose, de b ,cime (I) dans Iagi_teiie les substituant, R5 et R6 sont
dillcrcnt, prescntcnt un ccrntrc as~niétriquc. Pour ces composés, i'in~cution
ci~u~le
aussi bien le composé rticélllique que chacuri de isomères optiques con~idcres
sparénicrit.
5 I_c, composés de forniule (1) dans laquelle P7 représente un groupe COOTI
surit ries acides carhor~liqucs qui peuveut cire utilisés sous la forme
dacides libre,
ou sous la forme de sels. lesdits sel, ctaut obtenus par combinaison de
l'acide a~cc
une hase luincrale ou orLnaniyue lion torique. de préfciretice
phartuaceutiqucinent
acceptable. Parmi le, bases minérales, on peut utiliser par exemple les
hydroxydes de
10 sodium, de potassium, de magnésium ou de calcium. Parmi les bases
organiques, on
peut utiliser par exemple les amines, les aminoalcools, des acides aminés
basiques
tels que la lysine ou l'arginine ou encore des composés porteurs d'une
fonction
ammonium quaternaire tels que par exemple la bétaïne ou la choline.
Une première famille de composés selon l'invention répond à la formule I dans
laquelle :
Cy représente un groupe de formule
dans laquelle :
A représente un atome de carbone monosubstitué par un atome d'hydrogène ou un
atome d'azote;
ou un groupe hétéroaroniatique ayant 5 chaînons et comportant un ou deri.
liétcnoatonie ;
RI et R2 represertent chacun, indcpendaninieut l'un de l'autre, tui atonie d
h~dro~cene,
i.u~ atome d h iioccne. ui groupe alkL le avant 1 à 4 atonies de ça hune,
é~cntueihenient totalement out partielleuicnt lialoeenc, un croupe alto avaiit
1 à 4
atonie, de carbone. nui croupe licteror~clique .n,tnt 1 ;r 6 atonies ou un
groupe UC C'.
1\>-,) et R4 representent chacun. indépeudairuueui l'un de l'autre. un atonie
d'livdrocene.
un atonie d h,iloceile. r_rn croupe aiL le tir tint 1 <t 1 atonie) de ~
arhoue, un groupe
h~dro~~ ou un ~roi_rli< alcot~ ,i~an(1 ït 1 atom1ne de carbone
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
11
Rs et RO rehrescntent chacun, l'un de l'autre, tin atotutc d h~dro~cdnc.
titi atou~e iii tJo~f~ne. uti croupe <ilkyIe avuttnt 1 à Aatonlc', (Ic
carbone, tin roule
Indrayy' ;
ou R~ et R6 formcm ~iv cc luuome de carbone auquel ils sont rattachés un
groupe
éth~ Inc cou carbone le:
R7 représente un ~roupe COOR, ttu Lroupc bioisostére d`acide carbovyIirluc ou
un
groupe -C\ ;
R8 représente
- un pr{ope alkyle ayant 1 à 6 atomes de carbone,
- un groupe aryle, hétéroaryle, cyclique ou hétérocyclique, non substitué ou
substitué par un, deux ou trois substituants identiques ou différents, choisis
parmi les atomes d'halogène, les groupes alkyle ayant 1 à 6 atomes de carbone,
éventuellement totalement ou partiellement halogénés, ou éventuellement
hydroxylés, les groupes alcoxy ayant 1 à 6 atomes de carbone, éventuellement
totalement ou partiellement halogénés, le groupe phénoxy, les groupes
cycliques ayant 3 à 6 atomes de carbone, les groupes aryle et hétéroaryle, en
particulier phényle et pyrazolyle, non substitués ou substitués par un ou deux
substituants, identiques ou différents, choisis parmi les atomes d'halogène et
les groupes alkyle ayant 1 à 4 atomes de carbone, les groupes SCHF2 et acyl-
morpholine ;
R9 rcpresciitc un atome d'hydrogène, un atome d'halogène ou un groupe alkyle
ayant
1 à 4 atomes de carbone,
R représente un atome d'hydro<gènc ou un groupe alkyle (linéaire ou ruminé)
ayant 1
à 4 atorncs de c:ubonc.
I ne tanti l le hrdtdréc (le composés aclon l'it>,v ctntiun est constituée des
conipo H
de formule 1 hrccitéc, dans laquelle
J rcprc~cntc
- un ~-Iroupc :tlkv le :1v iwt 1 il() atome, de c.Il haine
un croul~c pltcuv le ,ttbstituc pur un ou det_tx substituant, idcnti<lucs ou
diflcrcnt,,
choisis harnni le, utonncs d italoccnc. Ics ~rouhc, utlkvIL' uvun1 I à 0
atounc> de
curhottc. cr cntucllctncnl totalcnncnt >u l,~u ticl lcutrttt Il,tloarnc,. ou
Cv cntt_tcllcu~ent
h~~1ro~~Ic . le, ~r~_uiln< ~tlco.~~ ,tant I t ~, atome, de carhotic.
cvcntucllcnncnt
tot~tl~ntent ou p uticllcutent Italoccu c,, H proupc plt~ttoyr. le _uutipc
cvcli(Iuuc,
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
12
avant 3 â atomes de car! ol~e. le, ,_~rouhe, ary le et I idroar~ le, Cil
particulier phény le
et p~raiolrle. roll ulr,titué, ou uh,titué', par un ou deux ,uh,titrrlnt,.
identiques ou
dilterent,. choisi, paruui, le, atome, d'haloet les groupe, alkyle a~ailt 1 à
4
utonIes de c.urhone. ics groupes SCfII-z et ace 1-nnorphcoline
- un troupe naphtyle ; un groupe thiduvlc lion ,uh,titué ou ,uh~titué par un
croupe phényle ; lin groupe pyridinvle non ,uhstitué ou ,tth,titué par un
,uhstituaitt
choisi parn>i le, groupes alcoxy ayant 1 à -1 atonies de carbone. le groupe
phenoxy,
le, groupes hétérocycliques ayant 6 chaînon,, en particulier le groupe
morpholiriyie ;
un groupe benzofuranyle ; un groupe dihydrobenzosazinone substitué par un
groupe
n:éth}le
- un groupe tétrahydronaphtyle, non substitué ou substitué par un à quatre
groupes
alkyle ayant 1 à 4 atomes de carbone, un groupe dihydrobenzodioxinyle non
substitué
ou substitué par un groupe alkyle ayant 1 à 4 atomes de carbone, un groupe
dihydrobenzodioxazinyle non substitué ou substitué par un groupe alkyle ayant
1 à 4
atomes de carbone, un groupe dihydrobenzodioxépinyle, un groupe pipéridinyle,
un
groupe dihydrobenzofuranyle non substitué ou substitué par un ou deux groupes
alkyle ayant 1 à 4 atomes de carbone, un groupe dihydrobenzopyranyle non
substitué
ou substitué par un ou deux groupes alkyle ayant 1 à 4 atomes de carbone.
Parmi les composés de l'invention, on préfère plus particulièrement les
composés de formule I, dans laquelle l'une au moins des conditions suivantes
est
réalisée
Cy représente un noyau phényle, pyridyle, furanyle, thiényle, pyrrolyle ou
thiazolyle;
RI rept'éscnte un atome d'hydrogène, l'atome de chlore, l'atome de brome, un
groupe
-CF;. OCI 1 -OC F:. -C(CI4,), ou pyrrolidinyle ;
R' rc presente un atome d'hv drog~ne
R représente I'atouie d h,drocdne. 1atome de chlore. l'atome de iluur, tin
groupe
hrdroyr. un ,croupe métltr le gui un ,criuipe udlhoyr
R-1 représente un allume dhr~iroceite ou l'atonie de fluor
k5 et R( rcpre ment chacun. indépendamment l'un de l'autre. tin atonie
d'h~~Iri ge!ie.
au croupe méthyle ou hrdroxr ou to ment en,emhle arec l'atonie de carbone
atlcitie1
~k ,ont r;t(tachc, uu ~_roupe éthr léue ou carhouv le:
1Z ieprc,ente un croupe phénr le uth,titae par un croupe aller e en C-3-C4
ramifié ; et
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
13
RI) rcprccn c un alomc d'h~dro<<ène, tin atoinc de 1,11lor ou un ~roupe
lneth}le. (1e
PI I'CIIce yin atonie d h~efrc~~ène.
Parmi Ic, compo',c, de l'inv culion, on pré icrc cucore les compo,c, de
formule I,
dais, laducllc le groupé R- reprc,eiitc un ~roupe hioi,o,trre d acide carhox~
ligue et
plu, particulièrement 1e, groupe, iso..\a/olonc, optio11 nc11e111 e11 t
,uh,ti. tné
ovadia/olo>lc,. a11:Y 1 et arv 1 ,ulli~n~ Icarhamov I optionnellcmciit
snh,titnés.
A turc de compo;é, parti~ulicreu~eltt préféré, on petit citer ;
l'acide 4-111-1(3-( 1-méthvIéthvl)phén}1j,u1Con}1]--s-{trilluorométhyl)-1H-
indol-2-yl] méthyl] lie n /oïque,
l'acide 4-[[1-[[3-(1,1-dinnéthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-yl]méthyl] benzoïque,
l'acide 6-[[1-[[3-(1,1-dimethyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-yl]hydroxymethyl] -3-pyridinecarboxylique,
l'acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl] sulfonyl] -5-trifluorométhyl-lH-
indol-2-yl]méthyl]-3-fluoro-benzoïque,
l'acide 5-[[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indol-2-yl ] méthyl] -furan-2-carboxylique,
l'acide 4-[[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indol-2-yl]méthyl] -thiophène-2-carboxylique,
l'acide 5-[[ 1-[[-1-(1-méthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indol-
2-yl]méthyl]-thiophèue-2-carboxylique,
l'acide 4-J 1 1-1 [ 4-(1-nméthyléthyl)-phényl]sulfonyl]-5-trifluorométha-1-IH-
indol-
2-yl]mcthy1] thiophcnc-2-carb oxxylique,
l'uicidc > I 4-mégi]YI'3.4-dihYdro-2H-benro[1.4]oxazin-6-ylj ~u1fon~t] 5-
trifluuron~éthvl 1 H indol ? ~l mcth~l thiophcnc ? ruho~~lidt~e.
l'acide 1-H 1 It-LI]Ictliv 13,4-dihtidro-?H-hcrt/off 1. ~~oya/in-h-v I)-
,ulfonv (J-5-
trilluoronIéthv l- I H-iudol-2-v I ntcthv l 1-thiophcrIc carhnty (ipuc.
l'acide -l l I -Jt-1-nIetlty l-3.4 Llilty drK+-~i i hcn/o~ I . ~nx<vin-t)-~ I)-
,uIto.mv I '-
trit luoroincti] I 1 H-ind~.l- -v I !mcllty l -turan- carhoyv iiLluc.
~O uciLic ~j 1 j l met Il 1-.~.4-dihv(Iro-_'11-h<n/o( I.l~oti~i/in C~1)
trifh_ioromcth. I-1 11 indol-2-v I ntethv I H uran 3-c:u hoyv IlL1uc.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
14
l'acide 4-(~(-IL ([,1-diméthcléthvl)-hhCf~IG.ulf~~ny1~ -triflunr~~n1éthv] 1Il-
iudnl-2-vIl-Il cl i-oyy-rnéth~1]-1-nfétIl vI-111 1~yrrc>le yl carh~~_~yliclurc
(1,1-diIl lé thA-
éthyl) c>icr,
l'acide [[1 [[3 (1,1 ciin~éih~létll~1?-phénvl? sullt~nrtl]-~ méthyl trilluor-
méthyl-1H indol y~1]méthy~l] thiu!ulc carh~~xrli~lue cthyl c,1er.
l'acide ? j~ 1 [[3 (l.1 diméthv L il l)-phcny 1J;ulfouy'I -i-trifluorométhyl-
1H-
indol-`?-V 11rnéihy 1 Lhlazole 4 carlin vhque éthv1 cslcr,
l`acide -4-([l-[[3-(1.l-diirnéthvlcthv1)phényl]sulfonyl]-5-(trifluoro)-6-
fluoro-
1H-indol-2-yliméttyyljbenzoïgluc, méthyl ester.
l'acide 4-[[1-[[3-(1-iiic:t1i lét.hyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-yl]méthyl] benzoïque,
l'acide 4-[[ 1-[[3-(1,1-diméthyléthyl)phényl] sulfonyl]-3-fluoro-5-
(trifluorométhyl)-1H-indol-2-yl]méthyl]-benzoïque, méthyl ester,
l'acide 4- [[ 1-[[3-(1,1-diméthyléthyl)phényl] sulfonyl]-3-fluoro-5-
(trifluorométhyl)-1H-indol-2-yl]méthyl]-benzoïque,
l'acide 4-[[[1-[3,3-diméthyl-2,3-dihydro-benzofuran-5-sulfonyl]-5-(chloro)-
1H-indol-2-yl]méthyl]benzoïque, méthyl ester,
l'acide 4-[[[1-[3,3-dimethyl-2,3-dihydro-benzofuran-5-sulfonyl]-5-(chloro)-
1 H-indol-2-yl ] méthyl]benzoïque,
l'acide 4-[[ 1-[[3-(1,1-diméthyléthyl)phényl] sulfonyl]-3-méthyl-5-
(trifluorométhyl)-1H-indol-2-yl]méthyl]-benzoïque,
l'acide 5-[[1-[[3-(1,1-ditnéthv-léthyl)-phéinyç]sulfonyl]-5-trifluorométhyl-lH-
indol ? yl] méfhyI thi~~phène carh~~aylique méthyl ester,
l'acide 3-[[1-H3 (1.1-diméth}léthyl) hhënyl.]sulfonyl]-5-L ifluurnn1éthyl-lH-
ind~~l 11 ~lnclhv 11 1 l ltrr,rc> hcnz~~ic{ue,
l acide 3 !~ 1 ~~3 t 1.1-dundtllvlcfhv! -pl nyll~l Ikuivlj i trilluo n iicW~l-
lH-
ind<>1 ~ I Jmcthv I > ilcoi -hcn/.nïyuc.
l ~rcidc 3; 1-fi l i-(I .1 dimdiIi léthv l)-phcriv l ~uli~n~ I)-5-
triiliioiciiréthv I-111-
iid~d ~I métIiv1j-5-11u~,ru-hcli/oiclue.
I aci~lc 3 ! l ~_~ 1 I.1 diniclliv Icih~ I) pllc~n~ l'~ulfun~ lj
(rillir~~rnni3th~ I 1 I [,
iid~~l -v I ~méthv I j (,-niole yv Hcirui~1uc .
IHaciclc 3 ~ I ~ i 3-t 1. l -diiiiclhv kilts l)-phi iiv l .ull, cv 1 j Iril
lui>i~ni~ Iiyl-lH-
indol lni3tllvlj-4. clilvro
(-Iiut>r~~ hcirzniclu~.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
hici(Ic [[1 [[?-( 1,l-(1iil lctIl viétIl 1)-hhén~Il,il Coi )IJ-5-
trilluoromét}r1-1H-
indol ~1]ntéth~l~ ~~ridinc curl o ~liduc.
1 ucidc 1-J[1 [[3 (1,1 diu~cthvféthyl)-phényl]sulfonyl]-5-trifluoroni tlryl-lH-
indol-`2-yljmeth}IJ-2-c} oro hcntoi iuc,
5 l'acïd~ 1 ~I I [(? (1.1 din~cth~léih~} hllcuvI .u1tonyTJ > tri1(uoroméditil
1H-
indol-2-yl]nhé1l II C> fluom hciizoicluc.
l'acide 3-((1-1 J4-méta} I-3.-1-ddthydro-2H-benzo[1,4]oxazin-6-yl]-,iiIlbny1]-
5-
trifluorutnéthyl-I EI-iridol-2-yllnuéthyl]-6-fluoro-hcnzo'iqu.e,
l'acide 4-[[1-[[3-(1,1-diniéthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-
10 indol-2-yl]fluoro-méthyl]benzoïque,
le 4-[1-[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-indol-
2H-tétrazol-5-yl-benzyl,
le N-[4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-yl]méthyl]benzyl]-méthanesulfonamide ;
15 et les sels pharmaceutiquement acceptables de ces composés.
Les composés de formule 1 selon l'invention dans laquelle R5 et R6
représentent un atome d'hydrogène peuvent être préparés selon un premier
procédé
consistant à :
a) faire réagir le composé de formule II
R1 R9
WN
R2 H (11)
dans }a~lucllc
R1 ci k2 rchré,crntcnt 1, indddcn InInnucrti I'un de Panic, un aionmc
d,hvdlhcrnc,
titi atome ~l h~ilo~cnc. un coulpe nilr~~. 1111 4 de
~arhonc. c~cniucllcni nl toial~~mrnt ou l~artiell~~ntcm linl ~~cn~~. un
_>r~~ul~c alco~~
a~ an1 I ~i atoinc dr rarhonr. un _ i n if~c SC! f -OC f un ~Trouf~c hé(ért>c
r cli~l c
axant 4 à F, atornc . ~I{_. IIEZ gui N k2;
}: r~ ~~ré,~~nic tni atonie, (I'hvdroo,-,cnc ou nec 1 à 4 30
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
16
R9 rcp1 ente [Ill atome d'h}droe 1le. un uitomc d'huloL'eue, Lui ,étoupe ulk~
le uti tint là
4 uton~e~ de carbone
av ce un composé clé I lrotule {III)
RSO 0l (III)
dans laquelle
RS rchrC,cnte un grc~uhc alk}le uyant 1 à 6 utOme~ de curho1le, un croupe
aryle ou
hétéroarv le. ~uh,titué ou lion. un croupe cyclique ou 6etemc cliduc,
suhtititué ou non
en présence d'un solvant, comme pur e'cmplc le tétrahydrofuranc, et d'une
base,
cotuunlc par exemple l'hydrure de sodiuni, à température ambiante, pendant
environ 2
à 24 heures, pour obtenir le composé de formule IV :
R9
R1
/ N
R2 S
O O
't
R8 (IV)
dans laquelle :
RI, R2, R8 et R9 conservent la même signification que dans les composés de
départ ;
b) faire réagir le composé de formule IV avec un borate de formule B(OAlk)3
dans laquelle Alk repré'eutc uu groupe alkyle ayant 1 à 4 atomes de carbones,
tel
qu'en particulier B(OiPr). cu pré5erncc d'une base, comme en particulier le
butyl-
11(liitun ([311Li) ou le dii~oprop} le amidure de lithium (LDA), et d'un
solvant tel que le
tdtraludro(uranc (lu l'éther. à une température d'euv iron -100 C à
température
çnnhiante. de prélcrcnce i 7 C. pendti ti fine (lutée et env iron 1 à 21
heure>, (le
plulelcnce IS he~.ire~. polir ohieuir le eonipo5e de formule A'
R1 P9
GA[k
g
OAlk
R2 0
0 R8
i~~
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
17
ci~In~ 1aclucllc R1. R?. R3, R9 et AIk con,cr~cnt la lnêIUC ;i~r~i(icati~~n
Liuc dans les
<<)In1 O L de clclrurt ;
c) 1'uire réagir le composé V ainsi obtenu avec un composé de formule VI
R4
R3 R7
Cy
Br (VI)
dans Iaqucllc R3 et R4 rcprc,entent chacun, indépendamment l'un de l'autre, un
dolne
d'hydrogène. un atome d'halogène, un groupe alkyle ayant 1 à 4 atomes de
carbone,
un groupe hydroxy, un groupe alcoxy ayant 1 à 4 atomes de carbone ;
R7 représente un groupe -COOR dans lequel R représente un atome d'hydrogène ou
un groupe alkyle ayant 1 à 4 atomes de carbone, un groupe bioisostère d'acide
carboxylique ou un groupe -CN, et
Cy représente un groupe phényle ou un groupe hétéroaromatique ayant 5 ou 6
chaînons ;
en présence d'une base telle que le carbonate de sodium, d'un solvant tel
qu'en
particulier un mélange diméthyléther/eau ou éthanol/eau, et d'une source de
palladium telle qu'en particulier le tétrakis(triphénylphosphine)palladium,
pour
obtenir le composé de formule la :
R3 R4
R1 R9 Cy R7
CEN
R2
4
fs~
0 R8 (la)
di iw, lrRRiuelic
IZ 1. R R R-L. R 7, R'. Rc) rt f_ y cOn>crv unt la Inclne ~i I~i1 i~~I~i(~u
LUC (Ian le
c~~mlu)~~~ cic clclr,Irt
1) ~i nêcc~,~ùrc. ll~clr~_,lr,cr la !~_)n~U~~n r<lcr ciu ~~~ml)~>>c J]c
1i>rlnl_IIc (Ia). 1pur
CvC111plc pul ,I~Lou d'une kt c niiiiLralc ic le ciao 1a Jiihirre ~el~~n Jc,
iodc>
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
18
opcratoires hicn connu> (Ic l'homme (Iu mcticr. pour t~hlenir. <tpres
traitement aci(ic.
le uumpo,c du du mule Ih pou: sa lornlc d auiclc lihic
R4 U
R3
R9~ OH
R1
R2 l -
R8 (lb)
Les composés de formule I selon l'invention dans laquelle R9 est un atome
d'hydrogène peuvent également être préparés selon un deuxième procédé
consistant à :
a) faire réagir le composé de formule VII :
:::2 (VII)
dans laquelle R1 et R2 représentent chacun, indépendamment l'un de l'autre, un
atome
d'hydrogène, un atome d'halogène, un groupe nitro, un groupe alk } lu ayant 1
à 4
atomes de carbone, éventuullemcnt totalement ou partiellement ha(oo,iénd. un
groupe
ztict~x; ayant 1 à 4 atomes (Ic carbone, un coupe: SCH , UCl un groupe
hctrrouvulitltic ayant i à 0atomc,_ -MIR ou
LG icprcuntc tin atoinu c1 iode. (Ic prame. un ~~roupc to~~ latc ou un u rouge
rilltioron~éthanc ,ulfonate et R repréxntc un atome cl'h~clrc~~->~nc uu un
groupe alhvlu
Ili lé airc ou tamil ic ,it an(1 n 4 aton~c> du <arhouu
avuu le compo~c du loriuulu III tel clou dormi pruuudcnununl,
"i clans nu olvnui tu'l chic par uyuinplc la p~riclinc. à ten~pcralurc an
ihiautu pCnclallt une
d_luccc (Ic ul I-S licurc~. pour t~htrnir le co~npo~r c1e l~,rnlulu A 111
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
19
R1
` LG
R2 NH
O= =o
1
R3 (VIII)
dan,, laquelle RI. R2. R8 et LG consertient la même que dau les
cumpo~c dC départ :
b} taire réagir le composé de turiuule VIII avec un dérivé acétylénique de
formule IX :
R4
R7
e_
R H
dans laquelle R3 et R4 représentent chacun, indépendamment l'un de l'autre, un
atome
d'hydrogène, un atome d'halogène, un groupe alkyle ayant 1 à 4 atomes de
carbone,
un groupe hydroxy, un groupe alcoxy ayant 1 à 4 atomes de carbone ;
R5 reprr~en e un atome d'hydrogène, un groupe alkyle ayant 1 à 4 atomes de
carbone ;
R7 représente un groupe -COOR, dans lequel R ~ epré~ente un atome d'hydrogène
ou
un groupé alkyle a}oint 1 i1 4 atome de carbone, un groupe plténv le On un
croupe bétcroar~~n~atïyue a ont ou 6
chaîn~~ii
en prcxnrc cl'10(lure ~~ui~~eu d`un ealul~~etu i hase clé palla~iiu>>> tel que
pur
eyenuple le chlorure (le hi~ttril~hén~lpho pltine pallaclitu>>. et d'une hase
or~caui<{uc
(elle glue la ~li~~tlt~lamine mi la Il i<111~1amine. cl~u~, tin ~ol~:uu connue
par e.yemple le
~lin~cth~lt~~rnt~uni~le. au re!iu.~, pendant 30 muant, ~P S hewne,. pour
obtenir le
~mpioe (_le lorm_ile te
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
R4
R1 RS R7
Cy
eN~ R5 OH
R2
~-C}
af
R8 (Ic)
dans laquelle R1, R2, R3, R4, R5, R7, R8 et Cy conservent la même
signification que
dans les composés de départ ;
5 c) si néce,,saire soit réduire ou éliminer le groupe hydroxy du composé de
formule le ainsi obtenu par traitement avec un mélange de triéthylsilane, de
diéthyléthérate de trifluorure de bore et une quantité catalytique optionnelle
d'acide
trifluoroacétique dans un solvant tel que le dichlorométhane, à température
ambiante,
pendant une durée de quelques minutes à 24 heures, ou selon d'autres méthodes
de
10 réduction bien connues de l'homme du métier telles que le traitement par le
zinc en
milieu acide après chloration ; soit oxyder le composé de formule le par
traitement
par le dichromate de pyridinium dans le dichlorométhane à température ambiante
pendant une durée de 1 heure à 24 heures ; soit substituer le groupe hydroxy
par un
atome de fluor par traitement par du trifluorure de diéthylaminosulfure (DAST)
dans
15 du dichlorométhane, pour obtc n i r le composé de formule If :
R4
R1 R3 R7
Cy
N
R2 RR6
S0
R8
~1an~ Ia~lucllc
R1. R . lz R1, k-, k et C~ c I crvcul 1a nie ac ~ianificaii~~n (pic 1c c~nnpa
L
2t) (lc ci~ 1r,ut. ;
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
21
J et R6 repi ',Cille lit chacun, ïnlicper lamnlent l'un (le l'attire. un atome
ri i~~~lroePrie,
un atonie cl'halo~~éne un Crollpe alky le a; ont 1 à 4 atome, (le carbone;
1111 ~-1rollpe
h3drox} ;
ou R5 et R6 farinent cn,cnlhlc avec l'atome de carbone auquel ils sont
rattachés un
groupe ccloalkvle a~ ant 3 3 0 atome, ((e carbone, un groupe étlivlénc tC=CH2)
ou
un Llroupe earhon l '=O):
d l ,i n3ces,aire, hydrolv,er la fonction ester du coinpo,é de formule If, par
exemple par action d'une base minérale telle que la lithine selon des nuxie,
opératoire bien connus de l'homme du métier, pour obtenir, après traitement
acide,
le composé de formule Id sous sa forme d'acide libre :
R4 0
R3 OH
R1 C
R6
e)N Y
R2 R5
sf
t3 o
'
R8 (Id)
Selon une variante de réalisation de ce deuxième procédé, le composé de
formule VIII précité peut être obtenu t partir du composé de formule VII
précité par
un procédé de sulfoity-lation comportant le pa,sage par un composé disulfonylé
de
formule X :
R1 LG
i
E~2
B8 (N
Clau laquelle Rl. R2. RS et [(I olil la même
Sl Ion celle vouante
hall, llite plelulere clapi', tell tortue un 111elarice Jauu de pr(~purtuun
VturuaPles
du i?I~Xllnl tlloruo ultonv ~e (le 11uruluUle A Ill et dut pro~ltlll
~11,UIIouu~ lP de lot nulle par
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
22
un traitement identique d celui décrit à 2 tuhc a) du ~ec~_~nd hr~~cédé. lu
réacti~~n étant
cependant réalisée pendant une durée leunec~t~p plus l~~n~uiie poutiani aller
ju;(iu'à 3
emaine, : l,~ii,
- dans une deuxi~me dtnpu. le produit brut réaciiounel obtenu est traité
directement par de lu p(tuse dans un saly uni tel qu'en particulier le
diosuIle pendant
tille durée de 2 â 2-1 liclires cnv non.
Le, composés de formule IX précité, peuvent être obtenus en 1bisunt r a,-,ir
un
composé de formule XXII :
R3 R4
R7
O à
R5 (XXII)
dans laquelle R3, R4, R5, R7 et Cy ont la même signification que dans le
produit IX,
avec du bromure d'éthynylmagnésium à une température de 0 C pendant une durée
de 10 minutes à 18 heures.
Les composés de formule I selon l'invention dans laquelle R9 représente un
atome d'hydrogène ou un atome d'halogène et R7 est un groupe carboxylique -
COOH
peuvent encore être préparés selon un troisième procédé coni.stant à :
a) faire réagir le composé de formule VII tel que défini précédemment avec un
dérivé acétylénique de formule XI :
R4
R3 COCR
Cy
R5 R6 (XI)
dune laquelle IZ_; et R-1 relnc~~enteni Juteun. in~léheudanunent l un de
l'autre. un at~une
d'hvclloudue. ~_ i atome d lialoedne. un cro~_~pe alk leu nul 1 à 4 nioiue; de
enidone.
un croupe hvdroy\ ou Un croupe nIco~~ nlvuu]i 1 à 1 atonie de emboue
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
23
R5 et R6 rcprdnentcnt charnu, indcpetldanllnent lin de Faure un atoinu
ddvdioWenc,
un nronpc alkyle Uvunt 1 à 4 atomes de carh(lne. un groupe hvdroxy
ou A et R6 t'arment ensemble u'cc l'atumc de carbone audncl il; ont rattaché,
un
groupe cvcloalkvlu ayant 3 à 6 atomes du carhone. tin Lroupe éthvlènc (C=CkL)
ou
un groupe carhonp (C=O) ;
R représente un groupe alkyle ayant 1 â 4 atome; du cLUlxun.e, et
Cy représente un groupe phényle ou un groupe lletcroaromatiquc ayant 5 ou 6
chaînons ;
en présence d'iodure cuivreux, d'un catalyseur à base de palladium tel que par
exemple le chlorure de bis(triphénylphosphine)palladium, et d'une base
organique
telle que la diéthylamine ou la triéthylamine, dans un solvant comme par
exemple le
diméthyl-formamide, au reflux, pendant 30 minutes à 8 heures, pour obtenir le
composé de formule XII :
R4
R3 COOR
R1 Cy
eN R5 R6
R2
(XII)
dans laquelle R1, R2, R3, R4, R5, R6, R et Cy conservent la même signification
que
dans les composes de départ ;
h) si nécessaire l'aire réauir lu composé de formulé XlT avec un muent
halondnant nommé par exemple le 1-cllloronlcthv f l fluoro 1. ~-
dlu7oiliahic~rlo 2.~Penne hiPtétrallwuoh(rate) à tcnlpéruturc ambiante pendant
cunv iron 30 minutes i 2 hctuc,, patin obtenir le coulposc de (ornlule MOI :
R4
HaIR3 ' COOR
Fil
Cy
N
R2 R5 R6
H XXII i
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
24
clam 1atli_iclle R 1, R?, k-1. R4. R>. R6. R et cveonserveut la incme
~ïTifieation que
dans le con~~oscs de dclxart : et
llal rchresente un atonie d halo c?ne ;
e faire r a<çir le eompo ? dde formule XII ou ie compo'é de formule XII ainsi
o>btcnn avec le composé de fornrtile 111 tel (lue défini hrécederniment. Cri
préseiiee d'un
solvant tel que la \-mcth~ lptil7'olidone (N.MP) ou le tünuclh~ Itorinamitfe
(D\IF), et
d'une base, comme par exemple l'hydrure de sodium, d temhérature ambiante,
pendant environ 2 à 24 heures, de préférence l S heures, pour obtenir le
cornpo é de
formule 1g :
R4
R9 efflCOOR
R1 R2 / N RO
0
R8 (1g)
dans laquelle R1, R2, R3, R4, R5, R6, R8 et Cy conservent la même
signification que
dans les composés de départ ; et
R9 représente un atome d'hydrogène ou un atome d'halogène ;
d) traiter le produit réactionnel ainsi obtenu par l'hydroxyde de lithium dans
un
solvant tel que le tétrahydrofurane, à température ambiante, pendant environ 2
à
24 heures, de préférence 18 heures, pour obtenir le composé de formule Ik :
R3 R4 0
R9 OH
R1
Cy
N R5
R2 0
S
0 R8
"(~ Lins lacj celle Rl. R?. R?_ R-l. R?, RO, R~. Ru et C} eouiyer~cul lei
meure ,i uiii~aii~,n
(duc dans le, e ouirpo c~ pie ~l?part.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
Les cr~inposés de tornlule I selon l'in~cniion dans laquelle R9 représeriie un
alonm d'll~~ir~~ac c et IZ7 est un NioLipe ranc~~t~li~luc COOH hcrneut encore
dtie
prcpares selon un (Iuatriemc procédé cru~sis(ant à
a) laine reaair le compose rie formule VIII avec le dérive aeetlenïdue de
5 formule XI tel que défini prcecdenuiient, en prc~cnee diodure euiv reux.
d'un
eataltiscur à hase de palladitui] tel Glue par 111 ple le chlorure de
his(triphcnylphosphine)palladium. et d'une hase oreaniyue telle que la diéthv
lamine
ou la tricthvlamine, dans un ,o]varit copine par exemple le dimêthyl-
formamide. au
reflux, pendant 30 minutes à 8 heures, pour obtenir le composé de formule le :
R4
eR3COOR
R1 R2 N 5-0
0
R8 (le)
dans laquelle R1, R2, R3, R4, R5, R6, R8, R et Cy conservent la même
signification
que dans les composés de départ ;
b) faire réagir le composé de formule le ainsi obtenu avec l'hydroxyde de
lithium dans un solvant tel que le tctrahydrofurane, à température ambiante,
pendant
environ 2 ii 24 henres, de prof-crépue 1,~ heures, pour obtenir le composé de
formule
Id tel que défini préecdenulieut ;
R4 0
L
RI R3 -rCy OH
N .-R6
R2 RD
O
R8
(Id)
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
26
cii iiil~ cOlllilOtic~ >e1OII i 1I1\c11t10I1 ipcn\cnl ég,11ci11c111 cll'e
p)ICpd1 ticJOI] un
rin~luiémc OFoc(2jé COntii"iLlllt à
a) l airc rcacir le c()lnpo,éé de formule IV précit.c avec un dérivé
alclélryde de
formule XIII :
R4
R3 R7
Cy
H (XIII)
dans laquelle :
R3 et R4 représentent chacun, indépendamment l'un de l'autre, un atome
d'hydrogène,
un atome d'halogène, un groupe alkyle ayant 1 à 4 atomes de carbone, un groupe
hydroxy, un groupe alcoxy ayant 1 à 4 atomes de carbone ;
R7 représente un groupe -COOR dans lequel R représente un atome d'hydrogène ou
un groupe alkyle ayant 1 à 4 atomes de carbone, un groupe bioisostère d'acide
carboxylique ou un groupe -CN ; et
Cy représente un groupe phényle ou un groupe hétéroaromatique ayant 5 ou 6
chaînon, ;
en présence d'une base, comme en particulier le butyl-lithium (BuLi) ou
diisopropyle
amidure de lithium (LDA), et d'un solvant tel que le tétrahydrofurane ou
l'éther, à une
température d'environ -78 C à 0 C, de préférence à -8 C, pendant une durée
d'environ 1 à 24 hcurc;. (le préférenec 2 heures, pour obtenir le composé de
formule
Ij:
R4
R3 R7
R9
ti c
R1 _ y
OH
R' ~/ ! H
-s-0
R8 li
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
27
d~iu, laquelle
R1. R. R R-4. R7. RS, RI) ça Cy con,er~eut la nictne quc dans Iks
eon~po,c, tic dcpart;
h) ;i nccc~,air~ rédtiirc ou otidc r le conipo,é de formule Ij ,clon un
traitement
idcutigluc h celui décrit â Retape c) du second proccdé, pour ohtenir le
c'oiupo,,é rte
loruiulc l
R4
R3 R7
R1 R9 Cy
eN O 5 R6
R2
~.
R8 (I}
dans laquelle :
Rl, R2, R3, R4, R7, R8, R9 et Cy conservent la même signification que dans le
composé de départ ; et
R5 et R6 représentent chacun, indépendamment l'un de l'autre, un atome
d'hydrogène,
un atome d'halogène, un groupe hydroxy ;
ou R5 et R6 roi-ment ensemble avec l'atome de carbone auquel ils sont
rattachés un
groupe carbonyl (C-O) ;
et si ncce,saire, hydrolvscr la fonction ester du compo,1 de formule I, par
cycmplc par action diane lia,e mincralc telle yue 1a lithine ,eloii de, niodcs
opcr~itoirc, hicn connu, de l'honiumc du ructicr. pour ohtcnir,
aprc, Uaiirn~cnt ~icidc.
le coiup~~,c (le lormulc lk u~u, ,al surine d'cc ide lihr'c
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
28
R4 o7
R3
R1 R9 y OH
N R5 R6 2
R
~
fl'
R8 (Ilc)
dans laquelle R1, R2, R3, R4, R5, R6, R8, R9 et Cy conservent la même
signification
que dans le composé de départ.
Certains composés selon l'invention peuvent également être préparés selon un
sixième procédé consistant à :
a) faire réagir le composé de formule IV précité avec un dérivé aldéhyde de
formule XIV :
R4
R3 LG
Cy
0
H (XIV)
dans laquelle :
R3 et R4 repré~cntcut chacun, inck pc11damment l'un de l'autre, un atome
d'hydrogène,
un atome d'halo~~ène, un groupe alkyle ayant 1 à 4 atomes de carbonne, un
groupe
hydroxy ou un groupe alcoxv avant l J -1 atomes de carbone
Cv ieprc~ente un groupe phen le ou un groupe httéroaronrati(1ue ayant 5 ou 6
rhainon~ : et
11i rel)rc~ente un atour e d iode, (le brome ou uncroupe to~vlate (ii
lrilimu)ron:cth,ume-
yultonate
cil l~rc~enre c1 11 11C have. connuue en particulier le hutr l-lithium 113
I[i) ou di1HoTropv le
unidure ~1e lithium t Ll) \t. et d'un >oolvant tel pue le téuahvdmoluraue ou
l'éther. ) nue
Vit') cml~crature d'en ii011 C à U <', de hrPRRcreuee à pendant unie durée
d'env iro:~ 1 4 11cui~c~, de ~ülcrence _' lmeure=. pour obtenir le coml~~~~c
de formule
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
29
R4
R3 LG
Ri Fi9 Cy
R2 N OH
Qf \
R8 (XV)
dans laquelle :
R1, R2, R3, R4, R8, R9, Cy et LG conservent la même signification que dans les
composés de départ ;
b) si nécessaire, réduire ou oxyder le composé de formule XV selon un
traitement identique à celui décrit à l'étape c) du second procédé, pour
obtenir le
composé de formule XVI
R4
R3 LG
R1 R9
eN Cy
RO
O
R2 0
Omo`' \
R8 (XVI)
dans laquelle :
R1. R2, R3. RI. R.S. R. LG et C\ c:<oncrvcnt la mènic ~icnil'icutiorn que dans
le
c~,mh~~st: de ~iél>art : et
R5 et k( rehr~~~enicnt chu~~un, inc1cl)enduniment l'un de l'autre. un atcnuc
c1 11~c1r~.~~~cnc.
tnl atc~rnc (1,1l'il ioupc livdmy.\ :
cru Rs et RO inriuciit en<cn~hlc a~c~l uiciuc de carbone auduci ils mcn1
rattaclic= un
groupe carhunr (1<~=O~
> traiter le c~>nilu~,c (le ti,r>>>ulc \VI 1ru l'he~~ic~ul,un~1r de
n~~,l~h~l<~nc en
hr~,cncc <I u~~ ca~al~~eur u h~i~c de quc pur e~cmhle l ucetatc de
l~alla~liun~_ al un li_<in~( ~li~ I~l,c hl~n~hl~inc tci ~luc I,ur cren~hle 1u
lriicrhuir Ihl~~,~l~llinr.
~ti ~l'unc ha,e n~iurralc telle ~luc le rarlu,nute rte ~~xliun~. ~ian~ tau
,olv unl COMMc Par
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
c.ycn]hle le ~Iimd[hi~r~dthnnc. au rcrIuy. pcnclant [} i inutc, à 4,5 hcurL:,.
huer o111 t Il'
le ~.~~in1~c~,d (lc fo~rnnilc Ik
R4 O
R3
R1 R9 Gy OH
N R5 R6
R2 'S-
0
R8
(Ik)
5 dans laquelle R1, R2, R3, R4, R5, R6, R8, R9 et Cy conservent la même
signification
que dans le composé de départ.
Les composés de formule I selon l'invention dans laquelle R5, R6, et R9
représentent un atome d'hydrogène peuvent être préparés selon un septième
procédé
consistant à :
10 a) faire réagir le composé de formule VIII préparé selon l'étape a) du
deuxième procédé précité avec le prop-2-yn-1-ol en présence d'iodure cuivreux
et
d'un catalyseur à base de palladium, comme par exemple le chlorure de
bis(triphényl
phosphine) palladium (II), et d'une base organique comme par exemple la
diméthylamine ou la triéthylamine, dans un solvant convenable comme par
exemple
15 le N,N-diméthylformamide, à une température comprise entre la température
ambiante et la température de reflux du solvant, pendant une durée comprise
entre 30
minutes et 6 heures, pour obtenir le composé de formule XVII :
R1
R2 OH
O
R8 \~ll)
dci kRjucHc k1, k et k coI1 Lrvcut H mdn]c ,i~nili~~ati~~n kUC d tn Ic,
~~~nip~~=c
de ~1dlr,~rt
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
31
h) luire rhieir le conipo e de lormule XVIl precite avec une source (le brome.
conune par exemple le irihromure de phosphore, dan, un ,olv ont couv euahle.
conunre
par exeniple le dichlornrdthanc. à température amhiante, perndant une Llurec;
environ 1 à 6 heures, pour obtenir le eomposd de formule `VIII:
R1
R2 C:N~Br
R8 (XVIII)
dans laquelle R1, R2 et R8 conservent la même signification que dans les
composés
de départ
c) faire réagir le composé de formule XVIII précité avec un composé de
formule XIX
R4
R3
R7
cy
(OH)2 B (XIX)
dans laquelle
(Dy représente un croupe phényle ou un groupe lydtdroaroi urtique ayant cinq
ou six
chamans
R3 et RI ici dsentent chacun. in(idpeuduituI eut l'air (le l'autre, un a(ome
c1 h~ clro~~ ne
tin atotue rl haloueite. un croupe alkv le avant I ht 4 atomrua (le carbone.
un groupe.
hvclrosy un groupe ulcoyv ccctit 1 a,4 , sotties de carbone: et
R7 repie enic un croupe (COR. un croupe hioiso;tere d'acide curhoyy li(lue tel
quce
le croupe yullonanride ou un croupe -ON
Clams mil soli ar;t cons en~thle. comme par exemple un itt lance d'ethanol et
de dioranc.
en pic,etrce duo catctlvsetu à hase rte palladium. connue pci e.Nenrple le
conrpleye
hh lhhdl,pf O (11 (`I=- et d'tunr hase con~en~rhle. commue p<ir exemple le cc
hom~rte pie
olai>IlUr7, a un tetupdretu e eûiuprl~e cumin la leutpdratUle uuhicutc et la
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
32
tcmpéraLurc pic rcllu_y du ~~)1v anL pendant Zinc duréc (unv Trou 1 à 6
lhcurc,, pour
~)htcnir gai i le cujiipo c de I riuulc Il
R4
R1 R Cy R7
N
R2 -O
R8 {Il)
dans laquelle RI, R2, R3, R4, R7, R8 et Cy conservent la même signification
que
dans les composés de départ.
Les composés de formules I selon l'invention, dans laquelle R3, R4, R5, R6 et
R9 représentent un atome d'hydrogène, Cy représente un groupe thiazolyle et R7
représente un groupe COOH peuvent être préparés selon un huitième procédé
consistant â :
a) faire réagir le composé de formule XVIII précité avec du cyanure de
potassium dans un solvant convenable, comme par exemple le dichlorométhane, en
présence d'un catalyseur de transfert de phase, comme par exemple le bromure
de
tétrabut } 1aunmon i u m. à température ambiante pendant une durée de 8 à 24
heures,
pouf- obtenir ainsi le com po~,,é de foriuule
R1
CN~\CN
R2 k
"S
O'~
R8
~i ~Lii> layucllc J L 12 et R c~ul~crvcr)t Ici ménlc~ ~iciiilicalioii ~iuc
cl<<n, 1r,
c<~n1i~o c (le (lépalt ;
I)) Lare rceeir le ..oi lpo c (lc i~ onnIe .A\ en ~~)Inin)n il;IIIv un ~oIvuni
euii' cnal~le. connue pul cucn)l~lc un nléla)Ice de (dtru! drofuruiie et l
cau., a u du
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
33
lithiofho,hhute (le üiéthv lC à une temhératurc comi)ri,c entre cil iron SO C
et 120 C
pendant une durée iroit 1 â 0 heure;. pour i)htciiir le coll~}~o~d (le
1'brinulc XII
Rl S
NH2
N
R2 -o
0 ti
R8 (XXI)
dans laquelle RI, R2 et R8 conservent la même signification que dans les
composés
de départ ;
c) faire réagir le composé de formule XXI avec le bromopyruvate d'éthyle,
dans un solvant convenable, comme par exemple l'éthanol, à température
ambiante
pendant une durée d'environ 12 à 36 heures, pour obtenir ainsi le composé de
formule
Ih:
0
R1 S ~` C?
N
N
R2 S -O
-{
1
-
R8 f l ii)
clona layuellc M. R2 et RS con,rr~ent lu nicmc ~i0l1ili<<ition ~liir ~ian~ lc~
col>>hu~cs
de drl)urt
i) ,i ncecõnitr. h~~lrol~,cr la (onction c.tcr du c n1posé de lorrnille Th.
pur
c~~mhlc pu action donc ha~c iuincralc telle glue la lithine ;clou (le, mode
h~ratoirc~ tien conniiti de l'homme glu 11)01i0!, tour obtenir. traitement
acidc,
k compoP (le Iorinuie li ,a loriuc ci ao irlc libre
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
34
O
R1 S OH N N
R2 0
O' \
R8 (Ii)
dans laquelle R1, R2 et R5 con ervent la nmêmc ~i~unification que dans les
composés
de départ.
La fonction acide carboxylique des composés de formule lb, Id et Ik peut être
avantageusement remplacée par un groupe bioisostère d'acide carboxylique selon
des
méthodes bien connues par l'homme du métier telles que les méthodes décrites
ci-
après.
Les composés de formule I selon l'invention, dans laquelle R7 représente un
groupe bioisostère acylhydrazine, acyl-hydrazine carboxylate ou oxadiazolone
peuvent être préparés selon un procédé consistant à :
a) faire réagir le composé de formule lb, Id, Ii ou Ik sur un carbazate en
présence d'un agent de couplage tel que notamment le couple de réactifs 1-(3-
Lï i i " 'f H HH la.aminopropyl)-3-éthyl-c< rbodiimide (EDCI) / 1-hydroxy-7-
azabenzotriazole
(HOAT), dans un solvant organique tel que en particulier du toluène à
température
ambiante et pendant 2 à 24 heures pour conduire à facylhydrazine carboxylate
de
formule lm :
R3 R4 0
H
Ri R9 Gy N N OR
i i 'R6
R2 / N R5
R8 f1n~l
dans leu{ucllc RI. k2. R3. Ri. R . k(~. R . TZ~~ ~'t Ç c~~n>cr~cn( (.~ inJiuc
~i~ni(ic~ali~,il
c{<<c clam lc, C&)l1 0L de cicï~,ut : et
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
R reprc,entc 1111 atome d h~~lroncne ou. uin croupe ~tll ale ayant I à 4 a
lonncs de
carhone
Il '.t~ iS'~2[lll ~. In, lIl`~e ~~' =t'Is!il 1311'-~I~
~t i Lr !iiCu ~l!niun ile i l i111.iC'~.:_ Lu I' 2tlc~'i:iuuie par ~~ ~~'ill'
u r
_ ~` ~' llci.llll ~
5
~I !I... _'n i':!rideulier lt <li, iniii r~': 1', _'~ltni]li_'_ lli?l l]'
(='1~tc~1,1 une nn l-it'.dui/itttc
e) ,i néceõaire. e cliver l'acv1-hvdrazine en présence d'wi adent de
couden,ation (el que le carbonvlcliimidazole (CDI) dans un solvant organique
tel que
le diclilorométhane, à température ambiante et pendant 2 à 15 heures pour
obtenir
10 l'oxadiazolone de formule In:
O
R3 R4 C?~
.,, ,NH
R1 R9 Cy N
6
R5 R6
N
WR2 ~0
0 \
R8 (ln)
Les composés de formules I selon l'invention, dans laquelle R7 représente un
15 -groupe bioiso,tère sulfolnylcarbamoyl ou un groupe dérivé peuvent être
préparés
selon un procédc con,i,tant â coupler le compo,o: de Cornlule Ib, M. Ii ou Ih
avec un
,ulComuuidc en prc,encc d'un agent (le coupla~~c tel que en particulier le
couple do
4- un on g anicltle tel que le
di~hloromril~aue ,1 tempcratlur amhiante pendtull 12 à 74 heure,.
I e, eonlpo,~, de lHuniurle, 1 selon l'invention. dao laquelle R7 repré,ente
un,
groupe hioiu~,t~re i~o.~a~ole ou un ~cro~_lpe dcri~~ tel qu'un croupe
i>).yaiolone
peinent cire pr 'Clou uni proeddd eorl>i,laui à
a) aetiver Iii fonction acide du eonlpo~e de formule Ih. M. Ii otl Ik 11
l'aide du
25 u houe Idiimid,liole ('U1 i ci le faire rduetr ~u le el de n~<1_~nr~iunl du
nlonoul: l n lle d ctlly le
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
36
h~ cycli<cr en hr~;encc et }~~ciri~.~~1~u~tine et en nmilictt ba~iclue ~i
trn~hératurc
amhiaule pendant à 4 Plirs peur ehtenir le c<~mhr J de Cin-Im]nie in
a
R3 R4
0
Rl R9 Cy R1
eN R5 R5
R2 -0
a \
R8 (Io)
dans laquelle R1, R2, R3, R4, R5, R6, R8, R9 et Cy conservent la même
signification
que dans les composés de départ.
La fonction cyano représentée par R7 dans les composés de formule I ou Il peut
être avantageusement remplacée par un groupe bioisostère d'acide carboxylique
selon
des méthodes bien connues par l'homme du métier telles que les méthodes
décrites
ci-après.
Les composés de formules I selon l'invention, dans laquelle R7 représente un
groupe bioisostère tétrazole peuvent être préparés selon un procédé consistant
à coupler le composé de formule I ou de formule 11, dans laquelle R7
représente un
groupe cyano, avec de l'azidotriméthylétain dans un solvant tel que de l'ortho-
xylène,
pour former après 10 à 24 heures. au reflux du solvant, le tétrazole de
formule Ip
R3 R4 N-N
R9 N /N
Rl Cy
R5
R2` N
R81pi
(Lui', I<iqiic1le R1. R2. R3. RR4. R5_ R. k S, k) et Ç'~ m)u1 r~enl la niJme
que darne de dehiirt.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
37
Les eonipo;c, de loi-mule 1 selon 1 ' i ivCiition. clan; laquelle R7
represente un
groupe bioi,o,tère oxadiazole OU un groupe dérivé let qu'au groupC
uxadiazolone
peinent erre préparé, selon un procédé consistant ùi
u) udditioriner l'li dro:yvlamine sulfate 'me le groupe e}uino du composé cle
formule I ou de 1ormule Il. dan, lapuclle R7 représente un croupe evauc~, eit
prc,cnce
de Il iéthv uni me et dl'tun ,olv unt tel que de I'ethanol
b) l'aire réagir le composé obtenu avec du chlororernnue d'cth}le pendant 18 à
24 heures i re k7 u t du solvant pour obtenir après traitement acide. le
composé de
formule Iq
R3 R4 N -O
/
R9 N
R1 CY H
6
N R5 R6
R2 1 J~
1
R8 (Iq)
dans laquelle RI, R2, R3, R4, R5, R6, R8, R9 et Cy conservent la même
signification
que dans les composés de départ.
On peut encore citer les composés de formules 1 selon l'invention, dans
laquelle R7 représente un groupe bioisostère thiazolidine ou un groupe dérivé
tel que
le groupe thiuzcolidinedione ou le groupe thioxothiazolidiiioine qui peux eut
être
priptirés ,clou un procédé con,istant à réaliser une condcn,ution de
IVluevenugel
d'une thiazolidine sue le eotnpo;i de l,ornnile XXIII cru présence dVun ,olé
uni incite
tel que le tolueuc. d'un eatul"eurtel (lue lu piperidine et en pni enee
d'acide uicctiehie'.
R 3,, ,__ ,~ C H O
R1\ Cy )
P8 t \~Ilti
d.ui, lapuelle 1Z(. IZ IZ R 1. IZ et C~ eon,erveui lut munie ,iieuition prie
J,tn, le;
eniipo,c, de départ.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
38
Lc c~~mp<~~c tte ic~rnnile XXIII. putt ctrc ohtCnu selon uu proccdc cle rduli
udun
iclcnticluuc à I'ctapc c) du ycptu n)c pr<mcccic. CI) fai<<u~t rcc ;it' le
eokuupod de formule
X 1H prdcité u ccc le conipo de tcurnliilc XMMV
R4
R3 CHO
Cy
(OH)2 B (XXIV)
Les composés de l'invention ous forme de sels des acides de formule lb, Id,
Ik,
Ii avec une base minérale ou organique, peuvent être obtenus de façon
classique, en
utilisant les méthodes bien connues de l'homme de métier, par exemple en
mélangeant des quantités stoechiométriques de l'acide de formule lb, Id, Ik,
Ig,(Ii et
de la base dans un solvant, tel que par exemple l'eau ou un mélange
hydroalcoolique,
et en lyophilisant ensuite la solution obtenue.
Dans certaines des étapes réactionnelles décrites ci-dessus, il est possible
de
remplacer avantageusement les méthodes de chauffage traditionnelles par un
chauffage au moyen de micro-ondes en utilisant des réacteurs adaptés à ce mode
de
réaction. Dans ce cas, l'homme du métier comprendra que les durées de
"chauffage"
seront considérablement réduites, par comparaison aux durées nécessaires avec
un
chauffage classigiic.
Les excmplcs suivants de préparation de composés selon la formule I
permettront de mieux comprendre l'iu cation.
Dans ces exemple . qui ne sont pas liniitalif, de la portée de l'invention, on
dc~~i~Ync pur prcl~clration Icy Cyc111p1cs clcrii~ant la ,vntlië~c de coiiip
és
i iicrmccli~aires c'i par CW111p1C~ ccu dccri~~ult Ta ,~nthc~c clr u nipo>c
clc
loi nlulcrIi.cIoii l'invcntiOii.
1_C~ al~rc i itlOn~ 'UI~ ciiIC> nui CIC uuiuIi cc ;
-(_ TI:C~ : cuLnniirilu.
-DC\1 : duchl~~r~~nidtluinc.
- I)\I OP : cliIncll1v Icildi?npr riclinc
1)~II~: clin~~thov~ccllicinr.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
39
1)\IF : ,V'. -dimcth~ Morin iuidc.
I 1SO: di >cth~Lu1to.ry(lu.
- HOAt : 1 Hycituy 7 azahenrotriazolc.
- H-C
- LiOll ti(le (le lithium,
- %1uSOj : su t te de ma~ncsiuin,
NH C1 chlorure d'anln]unium,
NMP : N-méthylpyrrolidone,
- NaHCO3 : hydrogénocarbonate de sodium,
- NaC1 : chlorure de sodium,
- Pd2(dba)3 : tris(dibenzylidèneacétone) dipalladium(0),
- TFA : acide trifluoroacétique,
- THF : tétrahydrofurane.
Les points de fusion (F) ont été mesurés à l'aide d'un appareil automatique,
(Optimelt) et les valeurs spectrales de Résonance Magnétique Nucléaire ont été
caractérisées par le déplacement chimique (8) calculé par rapport au TMS
(tétraméthylsilane), par le nombre de protons associés au signal et par la
forme du
signal (s pour singulet, d pour doublet, t pour triplet, q pour quadruplez, m
pour
multiplet, sept pour septuplet, dd pour doublet de doublet). La fréquence de
travail
(en MégaHerz) et le solvant utilisés 'ont indiqués pour chaque composé.
La température ambiantc c t de 20 C 5 C.
P1RI31 RATION I
1-114-(1-méth~léth~I)phé~~~1(sulfony1} _(1rilluorométh~l)-III-in(lole
1.3 ( 33.-11 mil) ~i,llvclrurc de odiunl (à 6O dan" l,hnile) Hunt cle ap)ulc"
p~~rtion par portit>n >i_ir une yulu.ulion de 3.O (1f,. n:Al) tic
(rilluoroiullii~l III--
n~lolc 1an~ 3O n:L de (ctrah~~lrnftir.u~c. l_c 1lnllLIuuc r~~acti~~nncl a cté
a<uitd 30 minu(c,
~O 3l lcnipcrall ire puis -1.35 (P).-t-I ni~I) ale u1llor1u-c (Ic -I-( 1-
1113t1ivlcthvl)-
1~enzcne~ullonvIu en olIll ioii plan, mL LIc lcu1111v(IroIulaile nul dtd
ai~uitd~ Icntcn:cnt.
Ih30 (1' uuitation. le uiclanIuc r1actiunncl u été I~~clrol~=c lnu ~1c l c.~u
c't cluaii
1'cuItcm 4 cth3lu.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
La pha,c vr anipue a elr,,uitc cté 1avcc par uuc solution arltreu,e "aturéc en
~aCI, puis échée ur ,tillatc rie maLné,irunr et évaprorce ',ou pre~,ion
réduite. Le
ré,iclu obtenu a etc purifie par chromato~crahhie sur et de silice en é1tant
peur le
c~clohexane puis progres,ivenrcut par uu tnlélangc e et uhcyauc f acétate
(l'cthvle
5 (r)0/10 Le,, fraeliun; miitenaut le produit attendu ont été réunies et
concentrées
â ,ec sous pression 1 - cc1 r111e peur cl(}nmcr 6,36 g de l [~ l 1-
mcthvlcth1)phéii 11,ulfonyl]-5-(tril1 u0rométhyl)-1J1-indole sous la forme
d'un
solide orange (ren(lement = 69 lo).
'H RMN tif ISOdrõ 300 MHz)
10 6 = 1,14 (d, 611), 2,93 (sept, 1H), 6,98 (d, 1H), 7,49 (d, 2H), 6,68 (d,
1H), 7,96 (d,
2H), 8,01 (d, I H), 8,06 (s, I H), 8,17 (d, I H).
PREPARATION II
5-(chloro)-1-[[4-(1-méthyléthyl)phényl]sulfonyl]-1H-indole
15 En opérant de façon analogue à la préparation I au départ du 5-chloro-lH-
indole, on a obtenu le produit attendu sous forme d'un liquide jaune
(rendement
quantitatif).
'H RMN (DMSOd6, 250 MHz)
5 = 1,14 (d, 6H), 2,93 (sept, 1H), 6,82 (dd, 1H), 7,38 (dd, 1H), 7,47 (d, 2H),
7,70 (dd,
20 1H), 7,88 (d, 1H), 7,91 (d, 2H), 7,96 (m,1H).
PREPARATION III
1-[[3-(1,1-dimét h N let hy1)ph én~ 1 Is u I fors % l]-5-(t r-illuorométhyl)-
1H-indole
L.n ohéranl de tacon analogue à la préparation 1 aru (lcpart dlu chlorure ((e
3-
25 tertiuhut~ I heuzcnesuttun le, on u obtenu le produit attendu sous forme
d'un solide
jaune (rcnden~cnt = 98 %).
1 _ SAC.
1'Rh;I'ARATION IV
~(l :Acide 1 (~ 1 (I-méth~ Icih~ I )phén~ l ~sulfon~ l ] t t rit1uorométh~ I I
ll1 indr~lc ?
huronitlue
L cure solution de ~,5 r 14.1- rnM) du -111po=e cinenlu ,eInn la plepumratiron
I
fion; ~m)aiLde tetrrh~clrofurane re(roicli u -T (' ont etc adciiliunnc~
~~outtc ü soulte
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
41
14.03 nmL- (77.-I(i 11\I, c = l.O\t dLui~ hcyuule) (le hutvI-litimmi
(BtiL..i}. Le niél~in _l'
réactionnel a été réchauffé Ii tenipéruture uni)iante et usité 2( nlinitle;
upplénicntaire,.:Aprè; rclroi(li ciiicnt `i -78 C. 5.S7 nil. (25.-L nl~\I) de
borate (le
1rii;ohr()py le ont etc ta(lditionric',. I_c mclan'-'e réactionnel u etc uLité
u temhérattue
ambiante peul int 18 hcurc,. Fimlrul <é bar 150 niL (i'cau et cytrait p<u
l'acétulc
d*éthvlu. La pIm c or<auniyuc a été échec ,ur ;ullaie de niuunc~iuni et
é~ahrnée ;ous
preõion réduite pour donner 6,5 ~u (L'une huile verre. Le prochlit i été
utili,c brut (I(lns
la réaction ~uii ante.
PRÉPARATION V
Acide 5-(chloro)-1-[[4-(1-méthyléthyl)phényl]sulfonyl]-1H-indole-2-boronique
En opérant de façon analogue à la préparation IV au départ du composé obtenu
selon la préparation II, on a obtenu le produit attendu utilisé brut dans la
réaction
suivante.
PREPARATION VI
Acide 1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-indole-
2-
boronique
En opérant de façon analogue à la préparation IV au départ du composé obtenu
selon la préparation III, on a obtenu le produit attendu utilisé brut dans la
réaction
suivante.
EXE\1PLI21
;lcide 2-tluor-o-4-[[1-[1-4 -(l-méthvléth.I)pliênyl].,~ u1fon~ 1]-5-
(trifluoronuéthy1)-1H-
indo1-2-, I lméth~ IIhenzoï(Itie, méth~ I ester
l'u ii Lniur dé 0)Otl niu (7.11) 111NI) (lu co iupoé ohtcnu ~clon hl
prcharution IV,
1f1 mou t7.1L) niNI) 1 ~~,tcr ~ncth~li(luc du l uci(ie > lhr~~uioluuth~l) 2
inoio-
hcn~oi(Iuc. i_'().-l0 mou 11).11 111M) de
l.7O insu ((. O mllAi) (le carhoii ute (le )o(liuiil. iO uii. (beau et ~O nil_
(I éth~Iène
m) l~eol (liniéth~l aller a cté (li;nifIc ou, rcilu_~ prn~lant (Icuy heure;.
Le nu1lan'-,c
rcacti(+nncl u été (filme pull (ic l'eau et uytmiit dluUy Ioi, pur le
(Iicliloronléthanc. Lc,
pl1uvc t~mu umllllle~ 1ellllle, ont etu ,cclmuu, gui ~lillatc (le Ill<l~
Ile,lulll dAupoi1u ,oll,,
pr~'~~i(in RCli' c. l.u rc. lu -1blcu m a 1t1 parue par clirlllil~Ito~?rupluc
uni ,'ui clé ~tliL'c
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
42
en quant pur le cv~lohetane puis prt~~_rc~~ivcment har un nidJunuc cVeloheyane
/
~reciatc d eth~ le i~)~/ ~i~ ). Lei fractioio eontcnant le hrodt.ni1 aflcndu
cent cté rcunie~
et eonecntreey 9 ,Cu sous hrc"'ion réduite heur donner 290 mc d'e ter nnéthv
Iidue de
lucide 2 11uoio-4 [1-[;-I (I-nieth~lélhyI pliJriylJ nIft nyl] (trifI
oroniéih}l)-1H-
ud~~1 ? ylln~éth} I~henjn`i~~ue <ou~ la I<~rn~e d'un ~olide blanc (rendement =
?5 `'r
1 = 132 C.
EXEMPLE 2
Acide 2-fluoro-4-[[1-[[4-(1-méthvléthyl)phényllsulfonyl]-5-(trifluorométhyl)-
1H-
indol-2-yl]méthyl]benzd que
A une solution de 180 mg (0,34 mM) d'ester obtenu selon l'exemple 1 dans
16 mL de tétrahydrofurane et 4 rnL d'eau ont été additionnés 17 mg (0,40 mM)
d'hydroxyde de lithium. Le mélange réactionnel a été agité 7 heures à
température
ambiante puis acidifié par une solution d'acide chlorhydrique 1N. Après deux
extractions par le dichlorométhane, les phases organiques rassemblées ont été
séchées
sur sulfate de magnésium, et évaporées sous pression réduite pour donner 175
mg
d'acide 2-fluoro-4-[[1-[[4-(1-méthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-
1H-
indol-2-yl]méthyl]benzoïque sous la forme d'un solide blanc (rendement = 99
%).
F = 197 C.
EXE \ IPLE 3
Acide 2-méthoxy-4-[[1-[[4-(1-méthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-
1H-indol-2-yl]méthl I]benzoïque, méthvl ester
En el)énuu de façon in alo~ue â l'eyenlple 1, au départ de Lester méthylique
de
l'acide I II,r~~mnon c.th}I) ll~cthovv i,en~t~igtre et du ec~nrpo e obtenu
>elon la
hrch~u atiurl 1'~, on a obtenu le produit attendu pou, forme (hurile jaune
(rendement
'lIR11~tl9 rSO .25Uy1II~I
= 1 ,d .0 11 ) .1 t~eht. 111 t;. l1). ;.7S (;, :7I l~. -l.-I() (,,, 'l j).
6.5x i.. 1 [1).
(u 2 (dd. 11I). .O~ (d. 1Iii. 7..i~) id. 'I1 i. !.5 d. IIII, (k (dd. 11H Itl
~[{).
7,07 t~. lII~, .2 rd. "l11t.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
43
h:XFi\IP1.i; 4
Acide
? méthot~ i l k-{(3 11 tnéth~icth 1)ph n, I~sttlfonyl] (tritlur~rométh~I)-
111-i.ndol-2-yIméthyI]henzoïqLie
I II opCr nit de I~1~OI] allalO,Tuc à l'Cxcmp1C 2, <IU départ dtr. ~OIIlflO C
obtenu
c1nn l'e.rcn~ple 3. on a oNtcull le produit attendu (n mc (I'liuilc hci,ne
(rcndcinent = ~J~ r ).
HP. 1 (I~~ISOd,,.25i):1IE-ii)
1,15 (d, 011), 2,92 (sept. 1H), 3,73 (s, 311). 4,4,~ (s, 2H), 6,57 (s, 1H),
6,82 (dd,
1H), 7,00 (d, 11[), 7,41 (d, 2H), 7,58 (d, IH), 7,64(dd, 1H), 7,73 (d, 2H),
7,96 (s, 1H),
8,27 (d, 1H), 12,51 (s large, 1H).
EXEMPLE 5
Acide 4-[[5-chloro-l-[[4-(1-méthyléthyl)phényl]sulfonyl]-1H-indol-2-yl]méthyl]-
2-fluoro-benzoïque, méthyl ester
En opérant de façon analogue à l'exemple 1, au départ de l'ester méthylique de
l'acide 4-(bromométhyl)-2-fluoro-benzoïque et du composé obtenu selon la
préparation V, on a obtenu le produit attendu sous forme de cristaux jaunes
(rendement = 12 %).
F = 127 C.
EXEMPLE 6
Acide 4-[[5-chloro-l-[[4-(1-méthyléthyllhhényl]sulfonyl]-1H-indol-2-yl]méthyl]-
2-fluoro-benzoï(lue
EIn opérant de façon ai lonue à l'c.xciliple 2, au départ du composé obtenu
yc(~,n l'c.yempIc 5, on a obtenu le produit Rendu sous l'urine de eri~tatix
hlnnnc,
l rcndc uniit = 34
1 11)0 C.
h:lh: AII'LL; 7
Acide 3 l (3 (1,ldiméfh~léth~I)phény1 tsulfonv11-5-(tritluuroinéth~I,1-111-
inclol-2-v 1InIéth' I1henzoïque, méth~ 1
ester
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
44
En opérant (le fanon ;in~l1~~~ re ù l,cycmplc 1. atu (lchirt Je l cStcr ri li
ligIuc
de l'acide (bri~in~iln~th~l) hcuioi(luc ci (iu conlpu'é ohiernu "clou la
picpara iurr VI,
on a obtenu le produit Ittendu,ou, foruie dune huile orange (ren(lemcut = 15
1HR\1\ (1)\1_~Od,,. 25(1 N111
;
5 = 1,17 (s, 9H). 3. ~ 3 (,. 3I 1), 4,51 (, ^H), 6,55 (s, 1H), 7,50 (m, 3H),
7,68 (m. 41I),
7,81 (s, 1H), 7,86 (m. I H), 7,95 (,, 1 i l ). 5. (d. IH).
1,,X1?3'11'LE 8
Acide 3-[[1-[[3-(1,1-diméth)1éth)1lphényl]sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-yl]méthyl]benzoïque
En opérant de façon analogue à l'exemple 2, au départ du composé obtenu
selon l'exemple 7, on a obtenu le produit attendu sous forme d'une poudre
cristalline
beige (rendement = 95 %).
F = 146 C.
EXEMPLE 9
Acide 2-fluoro-4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-
(trifluorométhyl)-
1H-indol-2-yl]méthyl]benzoïque, méthyl ester
En opérant de façon analogue à l'exemple 1, au départ de l'ester méthylique
de l'acide 4-(bromométhyl)-2-fluoro-benzoïque et du composé obtenu selon la
préparation VI, on a obtenu le produit attendu sous forme d'une huile orange
(rendement = 22 %).
'H RMN (DMSOd6, 250 MHz)
= 1,16 (s, 9H), 3.85 (s, 3H), 4,53 (s. 2H), 6,67 (s, 1H), 7,18 (m, 2H), 7,47
(t, 1H),
r,(~5 (m, 4H), 2 , 3 (lu, 1H), 7,97 111), S,27 (d, 1H).
h;AF\ll'LE, 10
Acide 2 fluori~ l [{ 1-[[3 t 1,1 ~lin~éth~ Iéth~ llphcn~ l~st~lfon~if 5
tlri(luor~~mc~th~ l)
If/-indiil-2-%IIJ1H 1h~l~hcntoïgtic31) 1.11 opcr;int de fil~_,n analoelie ~i
l'e eniple tu départ du eoi ipo,e obtenu
selon l e\eIuplc (~. ou a obtenu le 1o di111 elteudll torr (ointe (I('
crkterl.A li(`ree
(rendement = ~~ , 1.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
t X1; A1PLL 11
Acide 4-j [1-[[3-11.1-diméthc1 éth% I )phénv 1jsu1fonv I ]-5-(t riIluoronnéth}
l)-111-
indoI-2-N I ]tnéthN I j-2-méthoxv -henzoüque, nléth~ l ester
lIn opc'rarnt de Maçon nnalogue à I'eycntple 1, au départ de l'ester
méthylique
5 de I'acide -1-(hronnuiii et hv l)-2-mctllo~xv-lie n/u'iq uc et du conih(),é
obtenu ;cloti la
préparation VI1 on a obtenu le produit attendu sous forme d'itne huile nnarron
(ren(Iement = 19 %).
'H RMN (Dy1SOdf., 250 MHz)
cS = 1,17 (s, 911), 3,76 (s, 3H), 3,78 (s, 3H), 4,48 (s, 2H), 6,54 (s, 1H),
6,83 (dd, III),
10 7,07 (d, 111), 7,49 (t, 1H), 7,60 (d, 1H), 7,70 (m, 4H), 7,94 (s, 1H), 8,28
(d, 1H).
PREPARATION VII
Acide 4-[[5-(trifluorométhyl)-IH-indol-2-yl]méthyl]benzoïque, méthyl ester
Dans trois réacteurs séparés adaptés pour un chauffage par micro-ondes, un
15 mélange de 9,44 g (32,88 mM) de 2-ioda-4-trifluorométhyl-aniline (ou 2-iodo-
4-
trifluorométhyl-benzèneamine), 6,3 g (36,17 mM) d'ester méthylique de l'acide
4-(2-
propynyl)-benzoïque 1,15 g (1,64 mM) de chlorure de bis-triphénylphosphine
palladium (11), 0,31 g (1,64 mM) de iodure de cuivre, 26,5 mL de triéthylamine
et
26,5 mL de diméthylformamide a été chauffé 1 fois 10 minutes à 120 C, puis 2
fois 3
20 minutes à 120 C dans un appareil à micro-onde. Les mélanges réactionnels
réunis ont
été évaporés sots pression réduite et le résidu obtenu a été purifié par
chromatographic sur gel de silice en élisant par un mélange cyclohexane 1
icétatc
d'étlty le (95/5 : /v) pui, cyclohexauc I acétate d'éthyle (90/10 ; v/v).
I_.es N actions
contenant le produit attendu ont etc rétmie, et concentrée, Ii ,cc ,ou,
prc,sion réduit=
25 pote donner 6,3 d'ester tncth~litlue de I <icicle 1 (~5 (trifluoron~elh~l)
111 iuclul 2
Flln~éth~ 1!henzoitluc ,ou, la forure d_'un ,olide jatutc pale (rendement = 61
1-= 12~ C.
l/XE\II'I,h: 12
1) Acide 4-(] 1.1-diil étfi tlpro pyI)pIl én.I]sulfo u% l1-5-(l ri
Iluormnéthvi)-lIl-
i udO1-2-v 11111 étt1 I Iheuzo que
On e prclparc une'olution viwk een ntél:ui_runt ~.) de I citer obtenu ,clou L1
prc'lruatiun \ 11 rrt ~oluti~>n _lan, 1 / 5 tu[ de \\1I' et ()90 ntc
d,Ihvdrurc (le ,oditut~
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
46
t,u,pen,ü~n Jt 0) '~ clan; l huile pendant '?O minute,. On a ajouté SOO LiL de
cette
,t~luliou ui une solution de 1J5 mea (le chlorure (lc I (1.1 ~lin~~th~
lhr~~hti'1)-
henzèneul1oîi le dan, -200 PI, de \\IP. et le mJlunce réactioiuncl a cté
ul,ité
I 'S lieurs, u ieinperature ambiante. Le ,oo1v auut a ensuite ; ré ev apuré
,ou, pre,i<~n
réduite. et on i ajouté ati résidu ainsi obtciiu 500 L d'uiic ,olution
agucu,e ,aluré<
en chlorure d'ammiulium et le in lanae réactionnel a été a~-itc 15 minute. mL
13 d'uiectate d'éthyle et 7 mL d'une ,olntion agucu,e ,attirée en Nul 1CO; ont
été
additionnés et le inélamee ainsi obtenu a été aeeité ~ tp)Lii*eu,enient. La
pt~a.~e agtteLi,e
a été extraite deux lai, uppI7iueiitaires par 1 mL d'acétate d'éthyle. Les
phases
organiques ont été raõcmblëc, et évaporées jet d'azote.
Le résidu ainsi formé a été dilué par 5,4 mL de tétrahydrofurane puis traité
par
1,2 mL d'une solution stock d'hydroxyde de lithium (préparée par dissolution
de
1,25 g de LiOH dans 34,8 mL d'eau) à température ambiante pendant 18 heures.
Le
solvant organique a été évaporé sous jet d'azote, et le résidu a été dilué par
1 mL
d'une solution aqueuse d'acide chlorhydrique 1N et extrait par un mélange
dichlorométhane/ méthanol (95/5 ; v/v). La phase organique a ensuite été
évaporée
sous jet d'azote et le produit a été purifié par HPLC serai préparative en
obtenant
ainsi 41 mg d'acide 4-[[1-[[4-(1,1-diméthylpropyl)phényl]sulfonyl]-5-
(trifluorométhyl)-1H-indol-2-yl]méthyl]benzoïque sous forme d'une pâte beige
(rendement = 25 %).
1H RMN (DMSOd6, 500 MHz)
cS = 0,52 (1, ~311 ), 1,18 (s, 6H), 1,55 (q, 2H), 4,51 (s, 2H), 6,60 (s, 1H),
7,29 (d, 111),
7,45 (d, 211). 7,65 (d, 1H), 7,69 (d, 2H), 7,85 (d, 2H), 7,98 (s, 1H), 8,27
(d, 111),
12.x)2 (, tarse. 1H).
Ln opérant de tacon analogue l'i l'exemple 12, au. départ du chlorure dit
dérivé
,ulIom lé currc,hi~n~l~int, otr a obtenu le, eoompoés des exemple 13 à 26 ci_
upre .
1:XLMI'Lli 13
Acide l [[I [(3 méth~~x~phcit~l)~ulfunxl] 5 i1 il1uori~ine1h I1 111 ind~il ?-
i) I jmc1h~ I J hcnzoïque
\~pecl : pale béké
Iy i( nerit : 3'
X11 1~11~ t U\ISOd,.. ~ii(i \Il li,)
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
47
= 3,74 (,. 31f). 211). (),(12 (,. 1H), 7,17 (m. 11I). 7.25 1I1). 7.3_1 (4i. -
Il[),
7,30 (m. 111), î. 16 u. 111i. 7.(>5 (d, 1H), 7,87 (4. 211), 7,9S 111), (d,
111),
I2.) 1H).
EXI7-N PLE 14
Acide 4-[[1-[(5 phén~1-2-thiénrI)sulfun~11-5-(trilluoroniéthNl)-Ill-iddol-2-
I1n1éthy111benzoïque
A,pcct : patc benne
Rcnaicincnt : 17 %
'H RMN (DMSOd6, 500 MHz)
5 = 4,54 (s, 2H), 6,70 (s, 1H), 7,42 (m, 5H), 7,53 (d, 1H), 7,61 (m, 2H), 7,68
(d, IH),
7,93 (m, 3H), 8,01 (s, 1H), 8,24 (d, 1H), 12,98 (s large, IH).
EXEMPLE 15
Acide 4-[[1-[(3-chloro-4-fluorophényl)sulfonyl]-5-(trifluorométhyl)-1H-indol-2-
yl]méthyl]benzoïque
Aspect : pâte beige
Rendement : 7 %
'H RMN (DMSOd6, 500 MHz)
S = 4,53 (s, 2H), 6,71 (s, 1H), 7,30 (d, 2H), 7,56 (t, IH), 7,66 (d, 1H), 7,87
(m, 4H),
8,01 (s, 1H), 8,26 (d, 1H), 12,89 (s large. 1H).
EII,\IPI.l! 16
<Acide 4-[[1-(3-thién} tsulfonyl)-5-E tr ltioronléthyl)-1H-indol-2-yl]méthyl]
benzoïque
: pü(c hric
'II R 1\ (D\1S(d . SnO ~1ifi)
= 1.5 I (,. X 11). (x.53 (,. 111 )_ 7.2L (cl. 111). 7. 3L (J. -'l 1). -03 (c1.
111). un. 1111.
7.H) (J. 11e 7.t)6 (,. III). 3.23( J. 111e H >L) H. 111). 12.x)1 (', lw'::. 1
FI).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
48
EXEMPLE,, 17
Acide 4-trl-!(3,4-dih~dro-2II-1,5-hcnzodioyehin-7-yljsulfou)l]-5-(trif1uoro-
meth~ l)-Ill-ind01-2-~ I!meth~l lhenzoïque
hîltc hei~~c
Rcfulcnlcnt : 2 î
11R\I (D~iSOr1,;.250.Atl-lz)
= 2,10 (q. 211), 4, 14 (t. 211). 4,21 (t, 2H), 4,50 2H), 6,65 (s, 1H), 7,01
(d, 1H),
7,10 (d, LOI), 7,31 (d, "-N). 7,40 (dd, 1H), 7,65 111), 7,87 (d, 2H), 7,98 (s,
1H),
8,23 (d, 1H), 12,88 (s 1ar~c. 1H).
EXEMPLE 18
Acide 4-[[1-[[3-(1-nléthyl-1H-pyrazol-3-yl)phényl]sulfonyl]-5-
(trifluorométhyl)-
1H-indol-2-yl]méthyl]benzoïque
Aspect : pâte beige
Rendement : 27 %
'H RMN (DMSOd6, 500 MHz)
S = 3,90 (s, 3H), 4,55 (s, 2H), 6,58 (s, 1H), 6,77 (d, 1H), 7,37 (d, 2H), 7,56
(t, 1H),
7,67 (m, 2H), 7,77 (d, 1H), 7,88 (d, 2H), 7,96 (s, 1H), 8,05 (m, 1H), 8,17 (m,
1H),
8,26 (d, 1H), 12,87 (s large, 1H).
EXEMPLE 19
Acide 4-[[1-[(5,6,7,S-tétrrahydro-5,5,8,8-tétraméthyl-2-naphthalényl)sulfonyl]-
5-
(trifluorornéth~ 1)-1H-indol-2-yl]méth%,I]Ibenzoïque
A pect : pütc hci<~c
Rendement : 1 (1
~I1R\IN (D11SOd .500\1lli)
011). 1.17 ('. 011), 1.S'~ t>_ 411). 1.5(? (~. ~TIn F,.~7 (~. 111). 20 (cl.
211).
7.-17 i m. 21 1). 7.0 I H. 111). 10n (el. 111), 7.50 L 711). 7.11; 111). S_',
l_ (J. W.
1~_`.)1HOr e,I11e
iO
l;XI1\IPI.h. 20
Acide 4-111-113-(1 -]lié( h1l-111-p) razo1-5-N I )phcn)1 ltiult'0nv 1 j-5-)
iri11u0rumét
111-indol-2-~1tnwIh~1tI) nz~iicltic
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
49
:A~pcct : pïrlc hci~rc
Rcridcnucnt : ~) `r
lI R\1\ (D\1SOd ,ZOO \11-[L~
= 3,6 S (s. 11), 4,56 (s, 2H), 6,42 (d, 1H), 6,65 (s. 1 T). 7.36 (d. 2H), 7,48
(d, 1 H),
7,66 (m, 2111, 7,86 (m, 5H), 7,98 (s, 1H), 8,30 (d, 1H), 1
EXEMIPLE 21
Acide 4-[[1-[[4-(1,1-diméthv létliy1)phényl]sulfonN I1-5-(trifluorométhyl)-1H-
indol-2-yl jmé t h. I ] benzoïque
Aspect : pâte hcige
Rendement : 27 %
zH RMN (DMSOd6, 500 MHz)
5 = 1,22 (s, 9H), 4,52 (s, 2H), 6,60 (s, 1H), 7,29 (d, 2H), 7,51 (d, 2H), 7,65
(d, 1H),
7,70 (d, 2H), 7,85 (d, 2H), 7,98 (s, 1H), 8,27 (d, 1H), 12,88 (s large, 1H).
EXEMPLE 22
Acîde 4-[[1-[(2,3-dihydro-1,4-benzodioxin-6-yl)sulfonyl]-5-(trifluorométhyl)-
lH-
indol-2-yllméthyl]benzoïque
Aspect : pâte beige
Rendement : 24 %
1H RMN (DMSOd6, 500 MHz)
5 = 4,23 (in, ?H), 4,27 (m, 2H), 4,50 (s, 2H), 6,61 (s, 1H), 6,96 (d, 1H),
7,12 (d, 1H),
7,32 (m, 3H), 7.64 (d, 1H), 7,88 (d, 2H), 7,97 (s, 1H), 8,24 (d, 1H), 12,90 (s
large,
1H).
E\F \ll'I,F. 23
cille ~t [~ 1 3-0,1 -(Iiméth1lélh%I)-4-(méthol~)phénvl~~ulfon~11-S-(trifluoro-
mélh~I)-III-indol-2-sJ~métIi Ijhenioï~Iue
\~pCCt : p<ltc I~ci~~c
2) I IRlCr77CI71
EI R\1\rC)\1SC)d . 5(u) IIIli)
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
6= 1,19 (s, 9H). 3.S4 (,. 311). 4.40 (,~.:I0). 6.~,6 (~. 111). 7.06 (d, 11f0.
7.20 1wL -Il)-
7,4k J. lff)_ I.00 (d. 1H), 7,70 (cf. 111). 7.S6 (~i. X11), 7.~)(~ (. 1N)_
y,'7 (d, 111),
12.1)() (-, lurõ~, 111).
5 F.YI:AIPLE 24
acide 4-111-(éthNlsui lfon3rilluoronméthy1)-1II indol 2-~I]méth%l]henzoïdue
hitc hci,Tc
Rcndcin nt : O k
11 RN F\ (DN1SOd6, 500 MHz)
10 d = 1,06 (t, 3H), 3,52 (q, 2H), 4,42 (s, 2H), 6,50 (s, 1H), 7,39 (d, 2H),
7,62 (d, 1H),
7,91 (d, 2H), 8,01 (s, 1H), 8,07 (d, 1H), 12,94 (s large, 1H).
EXEMPLE 25
Acide 4-[[1-(2-naphthalényisulfonyi)-5-(trifluorométhyi)-lH-indol-2-yl]méthyl]
15 benzdique
Aspect : pâte beige
Rendement : 30 %
'H RMN (DMSOd6, 250 MHz)
5 = 4,60 (s, 2H), 6,60 (s, 1H), 7,35 (d, 2H), 7,70 (m, 4H), 7,84 (d, 2H), 7,98
(m, 3H),
20 8,15 (d, 1H), 8,33 (d, 1H), 8,65 (s, 1H), 12,84 (s large, 1H).
EXEMPLE 26
Acide ~l-[[l [{2 méth~l 5-(l méth~léthyl)phényl]sulfonyl]-5-(trifluorométhyl)-
1H-indol-2-} 1lméthti I Jbenzoïque
H R\\ (I)1kOd 2~O \111
c = I . 1 ) 2 ( c l . ( B E I ) . s~, ( ~ . H ) . _'., ? ( > c p t . I l 1 ) ,
4.k ( ~ . 11). o, O (,. 111). (d. 11.1).
(~l. 11). x.31 (c1, 11[), ?.1 (~Id. JII). r.ti(1 (~Itf. l10. x.52 (ci. 210.
_O~ (~I. 111 .
l If). l'.V, Lir~~c. III).
I'Ri P:1R:~'I1U\ V III
Acide 4-1 '-chlorn-111-ind()l-2-~I)niéth.l)henzoïgtic. méth~Iester
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
51
E u ~>hcrant selon le n~r~de ~~hrral~~irc ale la hrch<iralic~ll `I!. au dcParC
de la k-
chl~ o-2-io lo-aniline. uu 0 Ohtcuu le 1iroduit aflemlu .v0U la Cutine d un
>olidc heiee
F= 11,~ C.
1.n opérant selon le mode <~l~cratoirc de l'eyenmple 12, an dépara ale la
hrcl~arati~~n VIII et du dcriti é soli n) le co respondant. oit a hr~paré Tes
exen~hles -77à
2t) ci-ahrè;.
F,XEMPLE 27
Acide 4-[[5-chloro-l-[(4-chlore-3-méthyl-phén~I)sulfonyl]-1H-indol-2-yl]-
méthyllbenzoïque
Aspect : pâte beige
Rendement : 8 %
'H RMN (DMSOd6, 250 MHz)
S = 2,27 (s, 3H), 4,49 (s, 2H), 6,50 (s,IH), 7,32 (m,3H), 7,57 (m, 2H), 7,62
(d,1H),
7,70 (m, 1H), 7,86 (d, 2H), 8,03 (d, 1H), 12,98 (s large, 1H).
EXEMPLE 28
Acide 4-[[5-chloro-1-[[3-(trifluorométhyl)phényl]sulfonyl]-lH-indol-2-yl]-
méthyl]benzoique
Aspect : pâte beige
Rendement : 14 %
11 R t 1N (DMSOd6, 250 MHz)
P = -1.50 (s, 2H), 6,55 (s, 1H). 7.32 (d, 2H). 7,37 (dd, 1H), 7,65 (d, 1H),
7,77 (t, 1H),
7.S(, (d. 2H), 7,90 (s, 1H), 3,U5 iii, 3H), 12.34 (~, large, 1H).
I X1I\IPLF. 29
Acide 4-11 ;-chlortu-I (3 1hién~ lsulfon I!-1I/-ind()I-2-~ Ilméthv 1
l)cnzoü(ltie
\shcc~ : pute Pei_ce
;1) kelldennnt 17 ' ~
11 ktil~ 1)\1SOd,. 25(} \1111)
~~= i. 1(, (.. ~}I).(,. 7 . IIIJ. 7,21 (dd. Ill) 7,52 l~l. lai . .~0(d. ~lli_
.(,tJ(d Ill).
'~) idd, ill. 7.0)) Id. ~I1). ,3.ti' td. 111). L.~ 3 dd. 111 ). 1 ~.ti~~ t=
largc_ III L
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
52
PR1;PAR_ATION Ix
N -J 2-iodo-4-1 trifluorométh~ l)-phénv l]-3-(1-méth % léth~ I)henzènesul
fonamide
A une olutiou tic 72 (250.80 m.M) de ~~il~~ 1 lI il'lUOum)mcth~ Il inc dans
216 mL cic p}ridine ou a ajoute ~coultc a courte Iuu une durée de ] O minute,
67.7S g
(309.92 m\I) de chlorure de 3-(1 -mcth} léth, I) hcniènc~ullt)nv le et Je
mdlanc>c
rcactionrtcl a cté acuité 21 heure,, ü ict hcraturc ci hiantc. 42,22 ~c
(752,57 nt1I) (le
pota c huis ?SU 1nlõ d'cau et 125 mL (le ciio. ane ont cn,tuitc etc ajoutés.
Après 5
heures ti'acitation au rczlu~. puis 64 heures à tempcraturc ambiante et 8
heures
supptdntentaires au reflux, le mélanne réactionnel a été tcmé sur 2L d'eau
glacée et
325 ml- d'acide chlorhydrique ION, et extrait trois fois par 500 mL d'acétate
d'éthyle.
Les phases organiques rassemblées ont été séchées sur sulfate de mngnésium et
évaporées sous pression réduite. Le résidu obtenu a été purifié par
chromatographie
sur gel de silice en éluant par un mélange cyclohexane / acétate d'éthyle
(90/10 ; v/v)
puis (80/20 ; v/v). Les fractions contenant le produit attendu ont été réunies
et
concentrées à sec sous pression réduite pour donner 128 g de N-[2-iodo-4-
(trifluorométhyl)-phényl]-3-(1-méthyléthyl)-benzènesulfonamide sous la forme
d'un
solide beige (rendement quantitatif).
'H RMN (DMSOd6, 300 MHz)
5 = 1,15 (d, 6H), 2,94 (sept, 1H), 7,30 (d, 1H), 7,54 (m, 4H), 7,73 (dd, 1H),
8,11 (d,
1H), 9,99 (s large, 1H).
EXEMPLE 30
Acide 4-[(RS)-hydrox%-[I-[[3-(1-méthy~létliN I )phényl]sulfonyl]-5-(trifluoro-
méthyl)-IH-indol-2-ylJméth~IJhenzoï(Iue. méthyl ester
Un mclan,,ic cle 117.72 c (25O.S( nrM) de \-J 2-iodo-4-(trifitoorontcthyl)-
phénvI1-3 (1-nictltvlctltvl)-hcciccc>c1ton,nnidc (préparation IX1. 52.-15 p
lit A]) d'c=lCF mcthv lit LItc de l acide -(1-11 11 1ti 1ut)p~ nv
1)1~cm17dLluc.
utAl) (le chlorure de hie -UFiphcrtvlphophine palladium t10. 2.7 r
(ld.lS in\t) d-ir,durc de cuire (cuirrei_nr 1~O mL de dicthvlamiuc ci ZOO rtiL
de
di m2iii llormantidc a cL clcccl1'c ,O minutes oc tc)'I11
~ . Lc ,or ant a cic c~ apt?rc auto
rdduitc ci le r2IidU ~t etc poil id pair chrontatt) raphic Iur pcl de ~ilicc
c[1
Muant par un ntclan~c c~clL)hc.~anc c(atc d'ctlty le (` 5 5 ~;~) pui,
l~rL),~r<~~i~ctttLnt leur un tn~ilttn~te ci oltc~ttnc ' ;icctate d Il k, t?u
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
53
Iictltln~ C(lIltCIuInf le produit ~11tc1ldl1 ont etc retlnlc,, et CO11CCI1ticc
11 ~cc ~Ou
prc~~inii réduite p(uu dtlnncr ION _~ d cnLr rnétIi lL1uc de l'acide 1-((h'.S)-
hvdm l
[[~ (I-nldlhv ldth~ l)phdnv lj- tllt~ln} I ~-5-(trilluu1 m1Lthv1) tif i11dol-2
}l)nldth~,lj_
heil/ oiduc ou', la 111rnic Ldurn huile ~?runcc ( rcndcriiciii = 82 i ).
1H R\1\ #1)\1SOd,, 300 1/Mz)
5 = 1,08 (d, 3H), 1,10 (d. 3I ), 2,85 111). 3,S0 3H), 6,50 (111. LI1), 6,80
(s,
1H), 7,53 (m, 7H), 7,95 (d, 2H), 8,01 (n1, 1H), 8,23 (s. 1H).
EXEMPLE 31
Acide 4-[[1-[[3-(1-méthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-indol-2-
yl]méthyl]benzoïque, inéthyl ester
A une solution de 102,7 g (193,21 mM) d'ester obtenu selon l'exemple 30
dans 1 L de dichlorométhane ont été additionnés successivement et goutte à
goutte
154,3 mL (966 mM) de triéthylsilane, 10 mL d'acide trifluoroacétique et 122,42
mL
(966 mM) de diéthyl éthérate de trifluorure de bore. Le mélange réactionnel a
été
agité 1 heure à température ambiante, puis versé lentement sur 1 L d'eau
glacée.
Après décantation, la phase organique a été lavée successivement par 0,5 L
d'eau,
0,5 L d'une solution aqueuse saturée en carbonate de potassium et 0,5 L d'eau,
puis
séchée sur sulfate de magnésium et évaporée sous pression réduite. Le résidu
obtenu
a été purifié par chromatographie sur gel de silice en éluant par un mélange
cyclohexane / acétate d'éthyle (95/5; v/v) puis progressivement jusqu'au
mélange
cycloheane / acétate d'éthyle (SO/20; v/v). Les, fractions contenant le
produit attendu
ont été réunies et concentrdcs à cc sot1~, pres,,iort réduite pour donner 7S g
d'ester
Illéthv11(uc de l'acide 4-[[1-[[3-(1-métllyldthvl)phénvl),,ulfonyl]-5-
(tril'Itlrlrométhyl)-
1// ind~ll 2 ~I ndth~l~hen~I1i11ue sous la fourre d'une. huile jaune pâle;
(rendeniciit =
11 W% P,, (D\1S(_)(_L,. 50O \11 P1
= I.OS id. (~(I). ~. ~~ t~cpt_ III(. ~_S~ (~. ~f[1. 1.~ Ifs. Jf). (~.h_' (,.
IlIc ,_~S (~l. ~[1).
7,45tt. III). 7.01)(ni.-III).7.,)l (d, ~I1)_i.~~~t~11.1[I)_5.~~(cr. J1f},
32
Acide 1 [ t 3 (I n éth~ ICIh~ I )phén~ l h,ulfiln~ 1(S t triflu~~rométh~ l)
l// ind(~1 2
vI~méth~Iji)e-l/tü(Iue
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
54
1`11 opérant de façon <<nalogc le Ii l eyemple au départ dlu coinpo c de
e~en~ple 31. ou a obtenu le produit attendu soufi tonne d'tun'olide blanc
(rendement
=5 0).
175 C.
l'REP:AR:A'I'ION V
N-(2-iodo-d-I tritluorométh~1)-phén~I)-4-(I-méth~létEivl)-benzènesulfonamide
A une solution de 0.5 e (1.74 mM) (le 2-iodo-4-(trifluuromcthyl)aniline dans
5 mL de pvridine ont été additionnés 370 Iall (2.00 mhl) de chlorure de 4-(1-
méthy1éthyl)henzènesulfon le. Le mélange réactiormel a été agité 18 heures à
teurpérature ambiante. puis versé sur 5 mL d'une solution aqueuse d'acide
chlorhydrique 1N. Le mélange a été extrait par 3 fois 10 mL d'acétate
d'éthyle. Les
phases or apiques rassemblées ont été séchées sur sulfate de magnésium et
concentrées sou: pression réduite. Le résidu obtenu a été purifié par
chromatographie
sur gel de silice en éluatnt par un mélange cyclohexane / acétate d'éthyle
(90/10 ; v/v).
Les fractions contenant le produit attendu ont été réunies et concentrées à
sec sous
pression réduite pour donner 430 mg de N-(2-iodo-4-trifluorométhyl-phényl)-4-
(1-
méthyléthyl)-benzénesulfonamide sous la forme d'un solide jaune (rendement =
55%).
F= 101 C.
En opérant de Façon analogue à la prépt~tation X au départ du chlorure du
Cléri~é , l1onv lé correspo_mdant, on a obtenu les composés des préparations
Xl et XII.
PREP:`,R; 'FION NI
\-(2 iodo-4-(tritluuromcthy I)-phényl)-3-(1,I-diméthsléth~Iehenzine-
sultonamide
\spect : solide Plane
Reiidenlent 42 c
1 R\1\ tD\15O 1- 300 11I1/1
I.~ t.. 011). (cl. ll[i. 7.~h (nl..~l{)_ u. 2Il), S.lt) tci. IH), 0.0 1 (ar
e.
III).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
PREPAR:AT1oN xiI
X-~ 2-iode-4-(trifluorométh~ l jphéns l1-3.4-dihv dro--I-méthvl-2I~-1,4-henzox
tzin+ -
6-sulfonamule
\~hcct : stdidc Oï IHHC
5 Rcndeincnt:S1 li
F= 1'7 C.
PREPARAT ION XIII
\ -(2-io(Io-4-(tritluorométhoxy)-phényl)-4-(1-méthyléthyl)-benzé
nesulfonamide.
10 En opérant de façon analogue à la préparation X au départ de la 2-ïodo-4-
(trifluorométhoxy)-aniline et du chlorure de 4-(1-méthyléthyl-)-
benzénesulfonamide,
on a obtenu le composé attendu sous forme d'un solide marron (rendement = 91
Io).
F = 72 C.
15 PREPARATION XIV
N -(4-chloro-2-iodo-phényl)-4-(1-méthyléthyl)-benzénesulfonamide.
En opérant de façon analogue à la préparation X au départ de 2-iodo-4-chloro-
aniline et du chlorure de 4-(1-méthyléthyl-)-benzénesulfonamide, on a obtenu
le
composé attendu sous forme d'un solide blanc (rendement = 75 %).
20 F = 149 C.
E.l"E MPPLE 33
Acide 4-[(RS)-hv droxy [ 1 [[ -(1-méthyléthyl)phényl]sulfonyl]-5-(trifluoro-
niéthoxy)-1H-indol-2-y I Jméth~ I Jhenzoüque. niéth.~ l ester
25 En repérant de fa~<~1~ an~il~~~t~le ~~ l'c.~c~nhle 30 ait dél rt du coiiipu
é de la
)~rélruaiion ` IIT. ~.~n a nI)tcnu le rwulu>~é attnrdu sous loiinc d'un
~~~liclc inunn
f I nndcillenl = 01) r ).
11 l l~ I)~1~Od,. '~U ,~I11/)
1.1 2 i2. (A I). ! 3I11. h.15 (an 2'I1).
30 III . 7,; d. 'l 1). 7.42 (<1. '11). 111). ~. 5 H. 21H. 7. )' t(1, '11).
2.l' iii, 111).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
56
E XE M 'LE 34
lcide I-(~4-(1-méth~léth~llphényl]suIIon 1]-5-(tritluorouuithoxy)-111-indol-2-
' ljméthy I]henzoïque, méth~ 1 ester
Lei cpLf lt de façon analo,ruc à l',- einlilc 31, tu ddp<irt de l'c~tcr (le
l'ctcmplc 3:), on a Obtenu le ct1mpoc attendu ou.~ (t~rmc d'un solide hl~uic
(tende ment= 1 `r 1.
F= 1t)3 C,
EXE\EPLE 35
Acide 1-[[4-(1-méthyléthyl)phényl]sulfonyl]-5-(trifiuorométhoxy)-1H-indol-2-
yl]méthyl]benzoïque
En opérant de façon analogue à l'exemple 2, au départ de l'ester de l'exemple
34, on a obtenu le composé attendu sous forme d'un solide blanc (rendement =
76 %).
F = 66 C.
EXEMPLE 36
Acide 4-[hydroxy[1-[[4-(1-méthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-yl]méthyl]benzoïque, méthyl ester
En opérant de façon analogue à l'exemple 30, au départ du composé de la
préparation X, on a obtenu le composé attendu sous forme d'un solide jaune
(rendement = 83 %).
F = 68 C.
EXEMPLE 37
Acide 4-~[1-;I(3.-1 dih~dro t-n~éthvl-2~I-1.4-henzr~xazin-6-tllsulfonyl]-5-
{trifluorométh~ l l-II/-indol-2-%I t1V drOyV mélhv I]henzoüque, mélhN I ester
I_~:n t~p~~r~u~t de Iiiçon ut tinene ~~ l'e~cn~ple ;O. au _]cpart glue iip~~~c
de la.
pr~paratiou \IL ()Il a oLtcuu le c_n~pi<c utte,ruiu honnie tin solide jaune
rendemeni =_ 3 r t,
I ti0 C.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
57
1f Xl \IPI,1f. 38
Acide l-[ I5-chlore I-[(1 1 1-nn 1h~ létha l )I hén} l]sulfonyl~ Ill indoi ?-~
1]hvdro
méthy111)enztüque, méthyl ester
Utn Opérant (le faeon ~1f bene à J 'e yemplc Y). -Ill (lfpart de l'ester
nlftlhv fichue
de l'acide l-i 1 h~dro hro~ ~ nv l)-lhenioiduc et du coinpo é (le 1a
préparation 1
on a obtenu le e nipo,é attendu lotis forme d'un solide jaune (rendement t3
F=71`C.
I'IlEI',tR'TIC7tN XV
Acide 4-[(1RS)-1-hydroxy-1-méthyl-2-propynyl]benzoïque, méthyl ester
Sous argon, 44,9 mL (22,45 mM) de bromure d'éthynylmagnésium ont été
additionnés sur une solution de 2 g (11,22 mol) d'ester méthylique de l'acide
4-
acétyl-benzoïque en solution dans 40 mL de tétrahydrofurane et le mélange a
été agité
une nuit à température ambiante. Le mélange réactionnel a été dilué par une
solution
aqueuse saturée en NH4C1 et extrait 3 fois à l'acétate d'éthyle. Les phases
organiques
réunies ont été séchées sur sulfate de magnésium et évaporées sous pression
réduite.
Le résidu a été purifié par chromatographie sur gel de silice en éluant par un
mélange
cyclohexane / acétate d'éthyle (80/20; v/v) et les fractions contenant le
produit
attendu ont été réunies et concentrées à sec sous pression réduite pour donner
2,3 g
d'ester nlcth\ lique de l'acide 4-(1-hydroxy-l-méthyl-2-propynyl)benzoïque
sous la
forme d'un solide blanc (rendement = 33%).
'H RMN (DMSOd6, 300 MHz)
1,62 (s, 3H), 3,57 (s, 1H), 3,84 (s, 3H), 6,2 .4 (s. 1H), 7,69 (d, 2H), 7,95
(d, 2H).
PLI': 39
Acide -I-11-f I-[F3-(1,1-diméth~léth~1)hhénI~ ICstiIfon~11-54tril1uororuéthv1)-
1H-
indol-2-y1]-1-IhIdrox. uthN 1Jhen/oïqlie, ntétIi I ester
1111 Ohélant de tacon analoeue à leyenuplc 0l), gui ~lé,~art ~1e l e~tcr de
LLL
hréhara iH~u .NV' ci du conih~~,é de la }?réh~~ration .NI_ on u oàteuu le
attendu
1 0 1 1 1 1 c d'ut1 ,011de hei e (reculement = ;1i)
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
58
EXL;A1PLh:40
Acide 4-j~~ chloro-l-[[4-(1-rnéth~Iéth~l)phcn~ I~sulfon~l)-1H-indol-2-yl]
tu.éthNIJhenzoïgue, rnéth.I ester
Lu opérant de t'~icon artalo ue à l'exemple 31, au dép.irt de l'c,,tcr (le
l'exemplc 38. on a obtenu le con~l~~ c attendu sous Corme tl un solide blanc
(]rudement = 74 ).
1' _ 9) C.
EXEM1P1,E 41
Acide 4-[[5-ehioro-l-[[4-(1-méthyléthyl)phényl]sulfonyl]-1H-indol-2-yl]
méthyl]benzdiq ue
En opérant de façon analogue à l'exemple 2, au départ de l'ester de l'exemple
40, on a obtenu le composé attendu sous forme d'un solide blanc (rendement =
79 lo).
F = 192 C.
EXEMPLE 42
Acide 4-[[1-[[4-(1-méthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-indol-2-
yl]méthyl]benzoique, méthyl ester
En opérant de façon analogue à l'exemple 31, au départ de l'ester de
l'exemple 36, on a obtenu le composé attendu sous forme d'un solide rose
(rendement
= 72 %).
F = 123 C.
EXEMPLE 43
Acide I-[[1-([!-(1-tncth~léthyl)phén~ ] ulfon~I1 * (tritluoroniéthyl)-1H-ïndol-
2-
1 I1méthv i Jbenzoïque
l'In ohénnnt d ):I ou ninilocuc ,`i I c~cmhlc "_. nu d~~lrut de 1c~ter de
1`c~crullc
-L. vii a ohtrnu le <~oin[~o~é nitciidu ~oii> t n ne Lun olidc blanc
(rendement 1? `; L
LX1E;111'1,1E, 44
Acide -l-J J 1-J 13.4-dihN dro l méthv 1-211- I,1-hcnzoxazin-ô-v I )sulfoné 11-
5-
~trilluorométhvl)-111-indoi-2-vIJméth~IJhcnz(üguC, méthyI e'.ICI
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
59
[ii ohcranl de iaçon analr~~uc 3 l'c.yc!llpIc 31, au dchart de l c,tcr de
I'ctemp(c ;?_ on a obtenu le c()Mho 3 attendu ,oui f~~rnrc d'ui~ solide blanc
(IC ndenient = /1 (.r ),
F=h3 C,
IE XI,\IPLE 45
Acide 4-[[1-[(3,4-dihydro-4-méth' l-211-1,4-henzoxazin-6-yl)sulfonyll-5-
(tri fl uorométhyl)-1H-indol-2-yl]méth} I] benzoïque
En opérant (le façon analogue à I'exelnple 2, au départ de l'ester de
l'exemple
44, on a obtenu le compose: attendu sous forme d'un solide blanc (rendement =
31 lc).
F = 206 C.
EXEMPLE 46
Acide 4-[(RS)-1-[1-[[3-(1,1-diméthyléthyl)phényllsuifonyll-5-(trifluorométhyi)-
1H-indol-2-ylléthyilbenzôique, méthyl ester
En opérant de façon analogue à l'exemple 31, au départ de l'ester de l'exemple
39, on a obtenu le composé attendu sous forme d'une pâte beige (rendement =
62%).
'H RMN (DMSOd6, 250 MHz)
6 = 1,13 (s, 9H), 1,62 (d, 3H), 3,83 (s, 3H), 5,03 (q, 1H), 7,01 (s, 1H), 7,28
(d, 2H),
7,43 (m, 2H), 7,54 (m, 1H), 7,67 (m, 2H), 7,83 (d, 2H), 7,99 (s, 1H), 8,25 (d,
1H).
EXEMPLE 47
Acide 4-[(RS)-1-[1-[[3-(1.1-(Iiméthy létliyl)phényllsulfonyll-5-
(trîfluorométhyl)-
1Ii-indol-2 -y I j é t h[ I,l b e n zd üd u e
Vii opérant de l~lc~,n arialogzne à l'exemple 2, au dcTart de J*c,,lcr de
l'exemple
46, on a obtenu le cc~ml~usc ttt~:ndtr ,ou, 1~~rnrc de cri,tauy hlanc~ (rendem
ent
65 %).
F= 717 C.
t xI:A1PL1148
Acide l ~ I 1 j ~ 3 t 1.1-di-néth~ léth, l )hhény I Jsulfonp I riflnorométh% I
l-1Il-
indol-2-y I~méthv II l enzoïgfuc, muéthN I ester
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
1'n u~éltnee cde 2>0 'ne (0.52 itnMl de A'-~?-ï~~ lo l itriilu~~iomctll~lt hh
nvIj
3 (1.1 diiiiéth~ (éth~~l) henièilc,uIloin mile obtenu la préparation XI. ()O
mg
fO.5 m\I) et ~ici~le (2 hropyn~It henioirlnc. lllélll\l 111L, )_()l 111M) de
ehlortlïe dcc hi,-trihhciu Ipho,phine pnll.uIhnn (Il). I2I)3 ing (0,03) m\I)
(le iodure de
5 enL ie, 2 mL de tricthv lamine et ' mL de diméth~ Iforinanlide a été ehanl
lé 2 (ois '0
minutes à 12() C Inn un appu ~il h niirro onde . Le inclance réactionnel a été
dilué
dnw, l'eau et extrait par l'acétate d'éthyle. La pha,e rir~~ani~{ue a été
séchée sur sull'ate
de ii~a ncsitiin et cL aporée sous pre,,ion réduite. Le résidu obtenu a été
purifié par
cln oinatographie sLir ccl (le silice en éluant par le c} eloltexane 1 acétate
d'éthyle puis
10 prcogresidvenient par un mélange cyclohexane / acétate d'éthyle (80/20
v/v). Les
fractions contenant le produit attendu ont été réunies et concentrées à sec
sous
pression réduite pour donner 83 mg d'ester méthylique de l'acide 4-[[1-[[3-
(1,1-
diméthyléthyl)phényl] sulfonyl]-5-(trifluorométhyl)-1 H-indol-2-yl]
méthyl]benzoïque
sous la forme d'un solide blanc (rendement = 38 %).
15 'H RMN (DMSOd6, 300 MHz)
8 = 1,17 (s, 9H), 3,85 (s, 3H), 4,52 (s, 2H), 6,59 (s, 1H), 7,36 (d, 2H), 7,47
(t, 1H),
7,67 (m, 4H), 7,90 (d, 2H), 7,95 (s, 1H), 8,25 (d, 1H).
EXEMPLE 49
20 Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-IH-
indol-2-yl]méthyi]benzoïque
En oplnnit de façon analogue à l'exemple 2, an départ de l'aster de l'exemple
41). on a obtenu le composé attendu sous forme d'un solide blanc: (rendement =
83 ).
F 128 C.
FIXE'\ IPLh: 49a
cille -l-1j 1-[(3-( 1,1-dimêth~iethvl)hhcnVI]sulfon I -5-( tri11uoi'oincth~II-
ll]-
indo1-2-~Ij mcihvl)benz~~ïque sel de sodium
\ une ~olutiou de 2OO nie ((), 31) n1,A1) d'acide 1.1-
linict]i~léth~1)plién~ll~ul~on~(I-(~-(tri(luori,niéth~l) 1H in~lol
Ijmcth~ljhenr~iiclue
i(1 nil, de tétrall~drolurane. on a I5,5 Inc fo_ rit\t) ~i h~ciro~mle de
,ocliiiin. I_c nii1 eu rcaetioin,el e éte aeitc nue nuit <i
~~apuré pou, v21e pour obtenir 105 nie de gel de ,oditi.m Ife Uaeide 1-~J I i -
(1.1
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
61
dune[hvlutin1)I)hdn}11]-6 (triIinoroIll dthvl)-1Il indol 2-~l?Il ucthyI
1)enlroi(luc
,ouI, la (orme <l'un ,oIuIu hlanc (rcndcnlunl = ~)! `t.
11 R1I\ (D\tSO. -d)U l1iz)
1,1 S (>, 1)11), t. 3 7 (,. -'11), 6,39 (s, I H), 7,10 (d, 2H), 7,48 (t, I H),
7,62 (m, 2H),
7,73 (m, 2H), 7,80 (d, X11), 7,91 (d, 1H), 8,27 (d, 1H).
EXEM1PLE 49b
Acide 4-((1-[[3-(1,1-diméthsléthyl)phény 11su1 f'ony1)-5-(trifluorotnéthyl)-1H-
indol-2-y1]méthAl11) enzoïque ; sel de tris(hydrox nié1h3l)aminométhaFi e
A unie solution de 200 mg (0,39 mM) d'acide 4-[[1-[[3-(1,1-
diméthyléthyl)phényl] sulfonyl]-6-(trifluorométhyl)-1H-indol-2-
yl]méthyl]benzoïque
dans 10 mL de tétrahydrofurane, on a ajouté 47 mg (0,39 mM) de
tris(hydroxyméthyl)aminométhane et 2 mL d'eau. Le milieu réactionnel a été
agité
une nuit à température ambiante, puis évaporé sous vide pour obtenir 110 mg de
sel
de tris(hydroxyméthyl)aminométhane de l'acide 4-[[1-[[3-(1,1-diméthyléthyl)-
phényl]sulfonyl]-6-(trifluorométhyl)-1H-indol-2-yl]méthyl]benzoïque sous la
forme
d'un solide blanc (rendement = 45 %).
'H RMN (DMSO, 400MHz)
6 = 1,17 (s, 9H), 4,45 (s, 2H), 6,49 (s, 1H), 7,23 (d, 2H), 7,48 (t, 1H), 7,62
(m, 2H),
7,72 (m, 2H), 7,84 (d, 2H), 7,92 (d, 1H), 8,25 (d, 1H).
EXEMPLE 49c
Acide 4 [[1-[[3-{1,1-din~éthyléfh~ I)phénj l]sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-yl]méthyI benzoïque : sel (le pipérazine
A nnc solution de L)O mng, (().17 mM) d' cidu 4 [[1 [[3 (1.1
dintdth, Idihy I )phunL J,ul(om l -0 t lH Iu uoundtlt~ I) 1//-indol-2-~ 1
~iudihv I )hcnzoï~luc
(l'In< 1O nmL de tutrahhvdrof urunu. on a u1jout7 15 mu ((1,1 î ni t) de
1)il)druziitu. Lc
Ili iIl cil rdactiunncl a dtS ~nLilé une heurt lïunntuu Il tcnih<niti_uc Ili
ihiaIll ~. 1Lui, Cv~~l)(rc
pou, idu. Lu nLi(iu a Cnntnitu dtc L 1\d
~ucecõi~cmcnt li l dthcr de Idtrolu. 1uti~ à
)) l'ddicr didtl~~litluc 1)ur oh(cnir inu du ,cl de I)i1~~razutu de l'acide ~~
1 j~.)
(Iiiudtlly Idtliv l ))hcnv 11,Ill1'onr l -0-t iritluoroindti 1) l // indl ~ I
JnlcThv I ihuntuitlnu
ou, la tnrn~c d'une huila hlalchu rcndci~u~~t = 4 ).
ll R\1N (1)~IS(), lt)O.Alllrt
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
62
v 1,1 r (,. ?li). -.,(~ (~. l): 445 k, `~f O, kSO (s. 11-i). 7._'A H. 'l 1_),
7,47 (t, IH), 7,63
(m. X11). 7,73 (In, 2H), 7,S4 d, 11), 7 ) ~1d, IH), 8,27 (d, 1H).
PRETAR_i1,10N XV T
\-(4-chloro-2-iodo-phémI)-3-(I-nmétlh3Iéth~1)-henzéne.sulfonani ide
l n opér,lnt de laÇOll analo uc n la préparation X. au clcpart de ch1oro ?-
iodo-anilïne et de chlorure (le 33 I mcthy I)tli l)henz ne~~~fonvIc. en a
obtenu le
composé attendu ,,ou, fornne d'un Solide bcicc (rendement = 51 1i).
iH RMN (DMSOd6. 250 MHr)
ô = 1,17 (d, 6H), 2,95 (sept, 1H), 7,05 (d, 1H), 7,46 (m, 5H), 7,88 (d, IH),
9,76 (s
large, 1H).
EXEMPLE 50
Acide 4-[[5-chloro-l-[[3-(l-méthyléthyl)phényl]su1çonyl]-1H-indol-2-
yl]méthyl]benzoique, méthyl ester
En opérant de façon analogue à l'exemple 48, au départ du composé de la
préparation XVI, on a obtenu le composé attendu sous forme d'un solide beige
(rendement = 19 %).
iH RMN (DMSOd6, 250 MHz)
5 = 1,10 (d, 6H), 2,87 (sept, 1H), 3,85 (s, 3H), 4,50 (s, 2H), 6,46 (s, IH),
7,47 (m, 8H),
7,91 (d, 2H), 8,03 (d, I H).
EXEMPLE 51
Acide 4-[[5-chloro-t-[[3-(1-méth~ léthyI)phényl]sulfonyl]-1H-indol-2-yl]-
niéth~l]benzoïque
Fn opérant de façon ,inaIOcuc n I'~~~em1~1c '. nu départ du couIpnHH de
1 c~cauple ~)O, on a oh(cuu le ~~~nnp~,é at(cndu oa, l'rni c d'un ~ )idc
LLcinnc
t r~~ndcn~cnt = 7')
I=1H C.
l'I(IE:P,1R:A-1-1O\ \\ il
-t2-ioda-5-(1ril1u~irométh~ I)-phén~ I )- 3-( ,1-rlinuéth~ Icih~ h-hcniëne-
"ulfonumidc
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
63
[--n <)pbnutt de leço I eietI e ie b Je préparation X. au ddepatt de la 2-iodo-
5-
(ttilluorométhyl)atililie et du 211101-111-C de on
a obtenu le cotnpo"é euclldu sous i craie d'un solide blanc t tetdemett = 74
).
F = 134 C.
I:XF.JIPI.I; 52
Acide 4-[[1-[[3-(1,1-diméth, létIr 1 phényl]sulFonyl]-6-(trilluorotnéth~i)-1H-
indo1-2-y IlméthylJbenzoïque, méthyl ester
En opérant de façon analogue à l'exemple 48, au départ du composé de la
préparation XVII, on a obtenu le composé attendu sous forme d'huile jaune
(rendement = 42 %).
'H RMN (DMSOd6,250 MHz)
5 = 1,19 (s, 9H), 3,85 (s, 3H), 4,55 (s, 2H), 6,60 (s, 1H), 7,39 (d, 2H), 7,50
(d, 1H),
7,59 (m, 2H), 7,73 (m, 3H), 7,92 (d, 2H), 8,29 (s, 1H).
EXEMPLE 53
Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-6-( trifluorométhyl)-1H-
indol-2-yl] méthyl]benzoïque
En opérant de façon analogue à l'exemple 2, au départ du composé de
l'exemple 52, on a obtenu le composé attendu sous forme d'un solide blanc
(rendement = 17 l),
F = 199 C.
PREP.IRATIt)N XVIII
~~ (3 chloro 2 iodophén~l)-3.4-dih~dro-4-niéthyl-2/1-1,4-1)enzoxazinle-6-
suI1onamide
L e Opérant de (<ioot a~~~1f e e la rrcpeintiioil X. en tapait de
3-
chlt~rnanilinc et (je elilorete de i. 1 clih~eir~~ IlletIl, l 2/! ï. t
heIl/~,~a~iue b ,ulft1tty le,
~~n e ~thtcnu le eonip~t,é atte dIl o1[~ Ct>t11]e d'uit',()li(le blair (tet~l~
Ilt~t( -0
'Il lZ\I\ l l)\ISO(l,. 00 \Illi)
_ o t;. ;[I). ) tnl. 1{e >.,S on. ~II).(~.-O H. III). (1.0$ (in. h1I). 7,hO
tt. III).
-.-lt 1 I d. 1 I I ). 0.h(, t 11-[ ).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
64
I: h;yll'C.h:54
Acide ! 114 chloro-1 J(3, l dihvdro t méth~l ?f1-1,1 henzo aziti 6- 1) ulf--
n}1]-
111 ind(~I 2 ~If méth%IJhenzciique, méth~i ester
Inn (point de IOC(-n anafloeue à l,cxcnupple 1~, au départ du con]po é Je la
préparation X\'III, on a obtenu le eourp()',é attendu ,On, munie (t'tln solide
blanc
~rendenient = I S 1, ).
111 R\IN (D\ISOdF, 250I`'`IIIi.)
F = -1,73 (,,. 3H), 3,22 (m, 2H), 3,85 (s, 3H), 4,22 (m, 2H), 4,52 (s, 2H),
6,51 (s, 1H),
6,72 (d, 1H), 6,82 (d, 1H), 6,98 (dd, 1H), 7,34 (m, 4H), 7,90 (d, 2H), 8,05
(m, 1H).
EXEMPLE 55
Acide 4-[[4-chloro-l-[(3,4-dihydro-4-méthyl-2H-1,4-benzoxazin-6-yl)sulfonyl]-
1H-indol-2-yl]méthyl]benzoïque
En opérant de façon analogue à l'exemple 2, au départ du composé de
l'exemple 54, on a obtenu le composé attendu sous forme d'un solide blanc
(rendement = 21 %).
F = 236 C.
EXEMPLE 56
Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-trifluorométhyl-lH-indol-
2-ylméthyl]-2-b y d ro xy-benzoïque
En opérant (le façon analogue à l'cxeniplc 2, au départ du compc),,é de
he.~cmple 11, con a obtenlu l'acide 4 [[1-[{ (1.l
diniéthvJdthyI)phényl]sulfonyl]-5-
triiluor(~méthvl 1H ind(?L _' }lmélh~f~ ? n~cth(~~~-benioigne.
A une ~o(ution de 200 inc (().37 111\I) (le Ce 10 1111- (IC
dir1~I(n(~n(~thune refr(~idi S ?S C (ont S C' ajoute Goutte S ~~(>utte t).7
1aL ((1.% n~~I)
l'une ~(~lutiou de irihonlure de bore (I Rr:) 1 \I daim le
dielil(~rnn~~tlrnle. L_e mc)ariue
i aeiioorinel a Sic ache 5 lleure~ il 7 C. ptli~ (i par 'il inL d ea(l. ,~prc;
decantatjoli et e~tructi(~n au diehlorun~ctlr ue. Ire pha~e; (~r~aaniyu
ra~~en~blce~ ont
éle ~Cellee~ lir yultate (le llla ne~l(lnl et eooeCniCee~ ~t?U~ p11`ti~ioo
réduite. La
cachou Siaiii nc(~Inplcie. le rS<i(lu a ('iC remi, en ~olnii(~n (faim IO mL de
lich((nnu~(ili<lne 1 ?S C. et O. nl_ (().7 ni A11 (Dune ollitioli (le 1381,
1\1 daim le
lielll(~r~Irn~tlioi]e 1 Cie ajour L~()utie à coolie. Le inSiance rcalcliolinel
a ctS a~~it~ h S
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
-,,S C, 1)ui, h~drolv~c par de l'eau. AI)res deu.~ c.rtractions aI dic111oroi
dthane, los
1)hascs (lucti ra,, ,cil 1hléc, ont cté séclice< sur subite de i Icnc~inin et
concentrées >ou~ pressio~r rccluïte. Lc résidu Ohtcnu a cté ln~rilié par
cllr(>>11atopral)hic
li(1ui(le l~rcirlrative en éluant par tin 0.1,( ITA.
5 c(Inlenant le produit attciidu Ollt été réunies et concentrées à sec ,Oui
pFd ion réduite
polir d(+nncr m~~ ~I .ICidc 4 (~ 1 ~ ~ (1.1 (liméttl~lcth~ l)1)llény l
);ult~)Iiti I J
trifluoronléthvl-111-in(fol-?-vlnidil1v1]- -l1ydroyy'-ben/oi(lue sotu la forme
d un solide
i)lanc (renrletr cot = 44 %).
F = 129 C.
EXEMPLE 57
Acide 4-[1-(3-bromo-benzènesulfonyl)-5-trifluorométhyl-1H-indol-2-ylméthyl]-
benzoïque, méthyl ester
A une solution de 83 mg (0,25 mM) d'acide 4-(5-trifluorométhyl-lH-indol-2-
ylméthyl)-benzoïque méthyl ester obtenu à la préparation VII dans 2 mL de DMF
refroidie à 0 C ont été additionnés 17 mg (0,71 mM) d'hydrure de sodium
(dispersion
à 60 % dans l'huile). Après 5 minutes d'agitation à 0 C, 140 mg (0,55 mM) de
chlorure de 3-bromobenzène sulfonyle ont été additionnés goutte à goutte. Le
mélange réactionnel a été agité 15 minutes à 0 C, puis hydrolysé par 100 mL
d'une
solution aqueuse de NH:Cl 10 %, puis extrait 3 fais par 50 mL d'acétate
d'éthyle. Les
phases or~~aniques ra~sclnblées ont été séchée star sulfate de magnésium et
concentrées ;ous 1)ression réduite. Le résidu obtenu a été purifié par
chromatographie
sur,-,el de silice en Gluant par un mctan~~e cycloherane / acétate di'ctllvle
(90/10; v/v).
Lc 1~ractiotis COlllen[t111; le produit attendu ont etc reunles et
concclltrdc,~ a ,ce sous
prc~sion réduite Doon donner 110 mg d'acide 4-J 1-t? hrOnIO l~en~cncsult~~nvl
)
trilllioro!ndt11v L I II-rodai-2-v lnl(:lhvI -henioi(luc n1ct11~ 1 esicr sous
la ligné Con
~(didc llranp (leude lleut = ~) ~r ).
~H R\1\ tl7\JSOJ,,. d(1O \lili)
311). 4.~5 t=. -'fi). 111). 7.dO, I(l. -1l). -/-_1S it. 111), -Aï tnl. 111).
H. P11). .t)I H. 111), S,~Ir(1. 11 i).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
66
EXI:~tP1 E 58
Acide 4-(1-(3-cyclopropNI-benièFie, ulfo-iyl) tritlt-uroniéth~l-1H indol-2-
y1111éth. lj-benzoïque nméthvl ester
une sol iiion de 11t) inc (0,20 mM) d'ncidc 4-[l-(3-bromo-
hcnzcncsul[on1l) tri(luori~nicth~ I 1 H itldol 2 ylnic~hyI~ hcii/oïquc
nictliyl c~tcr
obtenu à I cyemplc 57 et de 24 nun ((l.-'S m1M r1 acide cvclopropy le
horoinque Cians
1,38 iiil.L de tohiènc out été additionnés 101 nm (0.7h ' nA1) de potassium
phosphate
irïbasiyuc. 5.58 mg (0,02 mM) de ttricyclohcxyle phosphine, 2,24 nie (U,01 mM)
d'nc2tatc de paladium et 0,06 mL d'eau. Le mélange réactionnel a été chLiul'lè
1 heure
à 100 C dans un appareil à micro-onde, puis dilué dans l'eau et extrait deux
fois par
l'acétate d'éthyle. Les phases organiques réunies ont été séchées sur sulfate
de
magnésium et évaporées sous pression réduite. La réaction a alors été relancée
dans
les mêmes conditions que précédemment (même quantité de réactif). Le mélange
réactionnel a été chauffé 1 heure à 100 C dans un appareil à micro-onde puis
dilué
dans l'eau et extrait deux fois par l'acétate d'éthyle. Les phases organiques
réunies
ont été séchées sur sulfate de magnésium et évaporées sous pression réduite.
Le
résidu a été purifié par chromatographie sur gel de silice en éluant par un
mélange
cyclohexane / acétate d'éthyle (90/10 ; v/v). Les fractions contenant le
produit attendu
ont été réunies et concentrées à sec sous pression réduite pour donner 54 mg
d'acide
4-[1-(3-cyclopropyl-benénesulfonyl)-5-trifluorométhyl-lH-indol-2-ylméthyl]-
hcnr.oïque méthyl ester sous la forme d'un solide jaune (rendemcut = 53 Ici).
'H RMl : (DNISOd, 300 MHz)
5 = 0,60 (in, _'H). 0,9h (in, 2H), 1.C)2 (in, 1H), 3,85 (s, 3H), 4,55 (s, 2H),
6,64 (s, 1H),
7,31 (d, 1H), 7,35 7,54 (d, 1H), 7,65 (d, 1H), 7,90 (d. 2H), 7,97 (s, 1H),
8,23
(d, 1H).
11XEI\1I'I J; ~;9
Acide l 1 13 Cvcloprop%l-ben/ènesulfonvI)-5-tritluurométh.I 111 indol
~ Iméth~ I1-hciiioique
3t) 1;ri o ceint de iiii: ni miilo~uc 3 l c~crnl~lc '. <in Clclru t tic I'c
ter de l'cycrnlplc
~5. on u ohtcnu le coiuhü~c ,ittc ide ou,) ion nie d* H11 s~iliClc hl inc
(rcudcnicjil 7h J_
1 = 1 -1 7 C.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
67
XIX
I rifluorométhanesuffonatr de 1,2-diméth~1-3-(pipéridine-l-sulfonyl)-3H-
iniidazol-1-ium
A une solution de 0,25 2 (1,07 nmMM) de 1 ( T~~c~tllyl imidazc~le 1 ,ulfun~l}-
pipéridine dans 6 mL de dic~hl~nomdtliane rctroidic 3 -5 C a été additionnel
13-3 pL
(1,13 mM) de niéilivl trifluorotndthaite,ultunate. Lc mélange réactionnel a
été ni ité 1
heure à 0 C, pui, concentré soLU, vide. 100 ing de 1.2-dinmdthyl-3-(pipéridiue-
1-
sulfon~ I) FI i u i d a i ol 1 ium ont été obtenus sous forme d'une poudre
blanche
(rendement = 1)6 ~).
F = 169 C.
PREPARATION XX
N-(4-chloro-2-iodophényl)-1-pipéridinesulfonamide
0,23 g (0,90 mM) de 4-chloro-2-iodoaniline et 0,380 g (0,97 mM) de
trifluorométhanesulfonate de 1,2-diméthyl-3-(pipéridine-1-sulfonyl)-3H-
imidazol-1-
ium obtenu à la préparation XIX en solution dans 3,5 mL d'acétonitrile ont été
chauffés 30 minutes à 150 C dans un appareil à micro-onde. Le mélange
réactionnel
a été dilué par l'acétate d'éthyle et lavé avec de l'eau. La phase aqueuse a
été extraite
trois fois par de l'acétate d'éthyle et les phases organiques ont été
rassemblées et
lavées avec une solution aqueuse saturée en chlorure de sodium. La phase
organique
a été séchée sur sulfate de magnésium et évaporée sous pression réduite. Le
résidu a
été purifié par chromatographie sur gel de silice en éluant par un mélange
cvcluhcyaue / acétate d'éthyle (95/5 ; v/v). Le ré,itit> a été à nouveau
purifié par
rhroniatoerahhie .sur L''el de silice cii chiant par le toluène. Les fractions
contenant le
produit attendu ont dtd rcuuie, et eoueeutr1e,, I ,cc sous prrõinn réduite
pour donner
130 me de L1-t4-chlo ïo- iudol'Iici]vI) I-1~iheridinc ,ullc~trimide ,i~us lei
formé d,unc
htùlc io e (renderr]cut = ~5 ~(i.
Il RW\ (t)ZISC)d, . 300 ~Il lt)
= i.4 tm. (pli). 3.1 3 ou 41 l). 7.45 (ni. (d. 1H). 13 1H).
i;xi IPLh:61)
Aride h~dro~~ chloro 1 I1 piperidin~Isulfon~l) l// indol ? l~méth~lJ
I)cnz(iigUC, méth~l t.,(er
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
68
I.il ohérunt de tuçrm an al~~~u~ u l c~cn~hle ?(l, lit départ du corupo de la
prclr<uuti~~n \\. on u obtenu 1c c()nlposc attendu sou; I~,rnne d'un ~olicl~
juunc
(rcndcmcnt = ~~'~).
'H R 1N (1 \ISOd,,, 500 MH l
= 1,34 gym, 611), 3,11 (rl, 4311. 6.-1 5 (s lamé. 1H), 6,32 (s large, 1H),
6,72 (s, 1H), 7,3 1. (d(l. 111). 7.-17 W. 'H), 7,71 (d, 11-1), 7.57 (d, 1H),
7,93 (d, 2H).
I,:XF,:IPLL 61
Acide -t-[[5-chloro-l-(1-piperidinylsulfonyl)-1H-indol-2-yl]méthyl]benzoïque,
méthyl ester
En opérant de façon analogue à l'exemple 31, au départ du composé de
l'exemple 60, on a obtenu le composé attendu sous forme d'un solide blanc
(rendement = 17 %).
F = 133 C.
PREPARATION XXI
Acide 3-(1-hydroxy-2-propynyl)-benzoïque
Sous argon, 23 mL (0,0115 mol) de bromure d'éthynyl magnésium ont été
additionnés sur une solution de 0,7 g (0,0043 mol) de d'acide 3-formyl-
benzoïque
méthyl ester dans 25 mL de tétrahydrofurane et le mélange réactionnel a été
agité
une nuit à température ambiante. Le mélange réactionnel a été dilué par une
solution
aqueuse suturée en NH4C1 et lavé 3 fois à l'acétate d'éthyle. La phase aqueuse
a été
ensuite acidifiée pur de l'acide cltlorhydriquc (IICI) 1N, puis cxiruhhc 3
lois pur le
dich1oroi ncthuiic. Les phases organiqucs chl~~rce., réunies vnt été séchée;
ur sulfate,
de lnagné,iuni et é~ahurccs sous pression réduite. On a ainsi ohtcnu 563 In,`
d'ucidc
3 (1 hedro~~- hr~>h ~n~l) hcu/o yuc scu, la larme d'un ,ulidc hlunc
(rerulcrncnt
61) 1,
1 { R 1,N t I)\ISOd,.. ~5(> X111>>
111). -~.4s tt>u 1I1). (x.17 td. Il 1). 7P) (t. Il 1). -.6l) (di, 1111. ~. 6
(lit, 11-1),
;O S.Uî ((. lII). I 2O t: loioc. 11H.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
69
EXL\IPLF.62
\cide 3-j l 5-chloro-1 - 4-(l-mcthy Iéth~ l') phén%1].SUlfonI 1]-111-indoI-2-}
l
h. drory met1I I jhenzoïctue
11-e opéniiit de laçoii inalop ic ~ l'exemple 30, en utilisant l'acide 3-(1-
dro.~~ 2 hroh~ nv I hCn~oiyuc obtenu à la hrcparatiou XI et le eoniposc ohienn
la 1~rcharatioli yIV'. one obtenu le produit Iltcndu sous la forme d'un solide
blanc
(renndement = (L f 1 ).
F = 97 C.
EXEMPLE 63
Acide 3-[[5-chloro-l-[[4-(1-méthyléthyl)phényl]sulfonyl]-1H-indol-2-yl]
méthyl]benzoique
En opérant de façon analogue à l'exemple 31, au départ du composé de
l'exemple 62, on a obtenu le composé attendu sous forme d'un solide jaune
(rendement = 14 %).
F = 170 C.
EXEMPLE 64
Acide 6-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluorométhyI)-1H-
indol-2-yl]hydroxyméthyl]-3-pyridinecarboxylique, méthyt ester
Sous argon, on a ajouté lentement 2,46 mL (3,93 mM) d'une solution de n-
butyllithiiam (c = 1,6 M dans l'hexane) à une solution de 1g (2,62 n'<M) de 1-
(3-tert-
hu1yl hcnrèncsulfonyl) 5 trilluorométhyl IH indole (prcparation III) dans 10
mL de
tete ahy drolurane rci roidi à -8 C'. Le mclan(-,c réactionnel a été a~eir~ 1
h30 à 0 C, Puis
ajoute mentIc Si ~ac~uttc â -70 C sur tille solution de -133 nue (2.63 mM) de
0-
foi mv lnieutimite de ineIhv le dans 20 mL de tétrahvdrofuranC. Le inclanae
réactionnel
e été aLi1c 7 1mnre, il piii, dilué à l'eati et e~tiai[ à l'aeftate f ethLie.
La hhaye
orr~anifue u cté ~éehée ,ur ~ull,ite de uiucmié>iiiui puis Cvapoiée .uu~ pie
ion reluite.
Le résidu a etc puriiic par ~~hronrt[o~~raphic sur Lcl de ~iliee Cil fluant
pal lin nnclan,ce
evelohevumle i aeelate ~ eLLe (mL!)) : %1 I. h~ti= par un n~élance
~liehlnromfiliune l
aectale d'eth~le (ti(t 7O : r;'~ i. Lei 1iaetion~ euntenant le produit attendu
out été
cmtmmme e1 con eilllee~ a Lee ~(uH prC~~ll~n ieduile pouf donuCl ~~ iller d
acide 6 { -
~I 1 i. i-dinicISv léthal tphcn~ If. LilOnv I Ji- -iriiluOIOmncthv l l //-
iudul- I jhydro. -.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
méth~l}nic~,tinRluc. Inéth~l (,ter ,ou, la urine (l'une Ir,îte marroii
(ren(icnnent
11 R\1\ (3) \II Ii)
1,22 (s, Vll), 3,14 {s, 3H), 6,54 (s, 1H), 6,60 (d, 1H), 6,74 (d. l11), 7,51
(t, 1H),
5 7,66 (dd, 1H),7.73 (m, 1H), 7,80 (d, 1H),7,81 (m, 1H), 7,97 (nt, 2I1). 8.25
(d, 1H),
8,39 (dd, 1H), $, )S ((I(l, 1H).
1{ \liI'\ll'LF 05
Acide 6-[[1-[[3-(1,1-diméthyléthyl)phényljsulfonylj-5-(trifluorométhyl)-1H-
10 indol-2-ylj mcthylj-3-pyridineearboxylique, méthyl ester
A une solution de 140 mg (0,26 mM) d'acide obtenu selon l'exemple 64 dans
1 mL de dichlorométhane refroidie à 5 C ont été ajoutés 27,87 pL (0,38 mM) de
SOCI2, puis le mélange réactionnel a été agité 4 heures à température
ambiante. La
solution a été ensuite refroidie à 5 C, diluée à l'eau et le pH de cette
solution a été
15 ajusté à 8 par ajout d'une solution aqueuse saturé en hydrogénocarbonate de
sodium
(NaHCO3). Après extraction au dichlorométhane, la phase organique a été séchée
sur
sulfate de magnésium et évaporée sous pression réduite. Le brut a été repris
dans
1 mL d'acide acétique et 83,75 mg (1,28 mM) de zinc ont été ajoutés. Le
mélange
réactionnel a été agité 7h30 à température ambiante, et lh30 au reflux. Après
20 filtration pour éliminer le zinc et évaporation des solvants, le résidu a
été repri, dans
le dichlorométhane et lavé à l'eau. La phase organique a été séchée sur
sulfate de
ma`_>né,iurn et évaporée sous Ires aon réduite. Le résidu a cté purifié par
clhroniatograpllie ,ai- gel de silice en Gluant par un mélange cyc1()he,xane /
acétate
(I'etli~le (.1)5/5 et les fraction, contenant le produit attendu ont cté
réunies et
25 concentre cs â ,cc pou, hres,iun r-cdaite pour donner 46 m sous la forme
d'une lu-11c
~~ran_e (rru(lcn~ent =31
'O.
11 R\1\ (D'v1SOd,,. -100 11 IA
= 1.15 (". 1)1I), ;..tiS 4.70 (:. 21I). 111(. ((l. lII). '_ 1x (t, lll).
7! 3 ( 0 m . 1 I I ) e J.(~7 Id. I l l ) r 7.Cuu) ( t , I lie 7,!? (dm. 1 l 1
) . T u7 ( , . I l l i e x.23 (0d, 111).
30 8.,7 (el. 111). 5.O ((Id. 111e
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
71
h:Xh:11YLE: 66
_Lcideb-([1-([3-(1,1-dimetti léth~l)phényI]sulfimvt]- -(trifluorométh~I) 11!-
indol-2-v 1 ]h', droxv methv I J-3-pN ridineca-rhoxy tique
Lru opérant de façon analo<ue à l'excrrrple 2, au départ de 1'e~tcr cle
l'cxeirtple
65, on a ohtemi le eomlpo,é ~iticiu Iu sous forme d'un solide oran~ee
(rendement =
44%).
F = 200 C.
PREPARATION XXII
a-(4-bromo-2-fluorophényl)-1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-
(trifluorométhyl)-1H-indole-2-méthanol
En opérant de façon analogue à l'exemple 64 au départ du composé de la
préparation III et du 4-bromo-2-fluoro-benzaldehyde, on a obtenu le composé
attendu
sous forme d'un solide beige (rendement = 39 %).
rH RMN (DMSOd6, 300 MHz)
5 = 1,20 (s, 9H), 6,52 (s, 1H), 6,62 (s, 1H), 6,74 (s, 1H), 7,29 (t, 1H), 7,42
(dd, 1H),
7,49 (t, 1H), 7,57 (dd, 1H), 7,67 (m, 1H), 7,70 (m, 1H), 7,74 (dm, 1H), 7,88
(t, 1H),
8,02 (s, 1H), 8,26 (d, 1H).
PREPARATION XXIII
2-[(4-bromo-2-fluoro-phényl)méthyl]-1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-
5-(trifluoromét hyl)-1H-indole
1a7 Opérant de façon anuloguc â l'exemple 31, au départ du composé de la
prép~uation XXII, On a obtenu le Composé attendu SonS (orme d'une huile
incolore
(rendement = 71 e1r=).
il 1
I = 111) c)11), -IA 1 H. 2{1). (,,-;l (,. 111). ; it. 111i. 7.J!_) id(. 1H),
7.52 tt. 11-I),
T5 Si i l d . 1 1 1 . t i l l . - 1 1 1 ) . 7.c) t I i { ). ti., U r d. 11 [).
u E:xF:AIPI,h:67
Acide 4-111-113-(1 ,1-(fiméth~léth.I )pliény I f sulfoné l ~ trifluorométlt~ 1
1II indol
2-~ 1 jnréth% Il -3-Iluor()-henzoiqtic
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
72
Uii rnclaiinc (le] 36 nie (0,24 [11M) (le 2-PI hroi o LCut>rt~ph~tli lii>>cth~
U-1
[L? 1.1 dimctll~l~tlid)phcu~Ij ull<~ntil~ > trifluorométhvl Ill indole
(préparation
~ ` 111). 5,37 inc (l).O? 11I\11) de palladium acélatc. 6.0-1 me (0,Ü2 rra\t)
de
triterhut~lphosphoniuin te trafluorohorate. ~)~,7 nia (().36 m11) de mol)hd2ne
he~ucarhon~ le, Inc (0. 6 inAl) de carhonutc de odiiiiii dans 1,63 niL de D\IE
er O.5 1 mL d'eau a cté cLlauff2 1 heurt St 1 0 C dans un appareil St micro-
onde. Le
nnclun~rc i~éactlonncl a etc (111 é',ur papier et le fi trat a etc 2 aporc. Le
re~Cdti obtenu a
cté purifié par chroniatographie liquide préparative col Gluant par un
nlelance
H20/CFl C\/ 0,1% TFA. I_es fractions contenant le produit attendu ont été
réunies et
concentrées à sec sous pressions réduite pour donner 101 mg d'acide 4-[[1-[[3-
(1,1-
diméthyléthyl)phényl] s ulfonyl] -5-trifluorométhyl- l H-indol-2-yl] méthyl] -
3-fluoro-
benzoïque sous la forme d'un solide blanc (rendement = 79 ~lc).
F = 177 C.
EXEMPLE 68
Acide 2-hydroxy-4-[[1-[[4-(1-méthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-
1H-indol-2-yl]méthyl]-benzoïque
En opérant de façon analogue à l'exemple 56, au départ du composé de
l'exemple 3, on a obtenu le composé attendu sous forme d'un solide blanc
(rendement = 22%).
F = 150 C.
Les composés selon l'invention décrits ci-dessus ont été reportés dans le
tableau suivant
D'autres eyemples de prcpuratioir de composés selon la formule (I) sont
ncntionncs dais ce qui suit.
PRh;PAR.\'l'1O\ XXIV
Acide (~ méth~l 3,t dih~dro~ 1I bcnr,~~(1, J r'azin 6-~J1-stilfuni(Iuc(2-iodo-
4-
chlorométh~ l-phény l)-amide
En opéruul de Tacon analo~tic t la prcpa arion put départ de la
ellloro phcn~ larninc ci du clilorumc de '. dih,dro hcn~o~ 1. Idio~inc (~
~tillon~ 1. on a
chtcnu le produit attendUsuu ( mine d'un ,olidc blanc (rendement ~ Ou).
F- 1 O()-1 1 i 1 C.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
73
I'REP:1RA'FION XXV
[1-J(3-f1.1-diméthvk1h~l)-phen~lJsulfon l]- -trifluorométh)l-lH-indol-2-~if-
inéthanol
Vil mélauee de 19 e i >7,25 mNI) de 35 (trifl.uo~ronlé1hv1) hhc.1~1]
h(~mréme,ultonalnid~. '.61 m1L (44.7 ul\l) de hroh ? ~n 1
ol, 0,52 e, (0.7 1 m M) de chlorure de hie lrihhem111~ho~pllimc Irlltedium
(II). 0.35 g
(1,80 m 'I) de iodure de ctii' i-e, 100 mL (le licih~lamille et PU iii- (le
titi ucthvllonnamide a été chamffc une heure au reflux. L:: milieu réactionnel
a été
dilue pur de l'acétate d'éthyle et lavé successivement par de l'eau puis une
solution
.iqueuae saturée en NaC1. La phase organique a été séchée sur sulfate de
magnésium
et concentrée sous pression réduite pour donner 14.7 g de [1-[[3-(1,1-
diméthyléthyl)-
phényl]sulfonyl]-5-trifluorométhyl-1H-indol-2-yl]-méthanol sous la forme d'une
huile marron (rendement = 96 %).
1H RMN (300 MHz, DMSOd6)
5 = 8,26 (d, 1H), 8,00 (s, 1H), 7,93 (m, 1H), 7,80 (d, 1H), 7,75 (d, 1H), 7,64
(m, 1H),
7,54 (t, IH), 6,91 (s, 1H), 5,68 (t, 1H), 4,88 (d, 2H), 1,20 (s, 9H).
PREPARATION XXVI
[1-[[4-(l-méthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-indol-2-yl]-
méthanol
En opérant de façon analogue ,I la préparation XXV au départ du composé
ohtcrtu selon la préparation X, on a obtenu le produit attendu sous forme d'un
solide
beige (rendement 55 %).
F = 112 C.
PRLI'ARATIO\ XX\1t
J l-f f 4-niéthv l-3.-t-dil 11ro-21T-hcnto[1.4f nxaiin-6-~ I j-suIIonv I j-5-
tritluoro-
méth~l-III-indol-2-yIJ-méthanol
Lu opeiwlt ((e fu(~on ~lmuloemic u la piLiparalion \\\ au J5pert du eonipo é
;O obtenu clou le hr~h~lra(i-gym \1I. ()Il e1 oHH enu le hroLmut llttemdu -o
fonuc O nim ,o1irl~
lf L\I\ 1700 \If1/. D\ISOd )
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
74
8,23 i(1. i If), 7,`)`) H. 111). 7,01 (Id. 1H), 7,17 1 nu. 2l { ), G.5 (~. I1
I>. d. ~O (d. 1 I1).
{t, Il 1,t, (2. 2Ll ). -L2 (In. 2H 1, 3,25 (m; 211), 2.7e)
PRI/PARAT1ON XXVIII
(~-Chloro=l-[[2.3=dih~dro benzu[I,1]dio it~-i-~I] sulfon}I]-1H-iu(1oI méthanol
En opérant de façon. an~~logue Ià la hrcparatioit XXV au dépaut du composé
obtenu eloa la préparation XXI', on a obtenu le produit attendu sous forme
d'un
solide orange t rcndcinent S6 `é).
tH RMN (300 MHz, DMSOd6)
6 = 7,99 (d, 1H), 7,65 (d, 1H), 7,42 (m, 2H), 7,32 (dd, IH), 7,02 (d, IH),
6,74 (s, IH),
5,60 (t, IH), 4,83 (d, 2H), 4,27 (m, 4H).
PREPARATION XXIX
2-bromométhyl-1-[[3-(1,1-diméthyléthyl)-phényl]suifonyl]-5-trifluorométhyl-lH-
indole
A une solution de 4 g (9.72 mM) de [1-[[3-(1,1-diméthyléthyl)-
phényl]sulfonyl]-5-trifluorométhyl-1H-indol-2-yl]-méthanol (préparation XXV)
dans
15 mL de dichlorométhane refroidie à 0 C on a ajouté goutte à goutte 3.65 mL
(38.9 mM) de tribromure de phosphore. Le milieu réactionnel a été agité 1
heure à
température ambiante. 20 mL d'éthanol ont ensuite été additionnés lentement
puis le
milieu réactionnel a cté verse ,ur la glace. Après deux extractions au
dichlorométhane,
les pha cs oreani~lucs ra~semblces ont été ~éc1iées sur Ni l-,rSO: et
concentrées à ,ce
sous hrc~siou réduite. Le ré,idu a cté purifie par clirornato-raphie ,ur gel
de ,Ilice en
chiant par un ni1Lin~e c cl~~herane acétate (l'L(livIe O5/5 , v/v) huis
P101-11î, crnceu1 par un n]élanee c~cl_lle.yane / accl;itc d'ctllnle 91)/10;
v/v). Lel
Traction; contcnant~ le prodi_ut attendu ont etc rcunic. et conccIIlrce L ;c
soie;
prc~~Hon rédi_iite pour dourncr L de broruon~cth~ l I j (I . I din~cth~ lcth~
l}
pl~cn~IJ=u1Con~I trilluorou~cth~1 IIl indole oti" la b)rnle dVnn click blanc
endcn~cnt -S-17 I =SO C
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
PRF.P:IRATION XXX
2-(promi~méthv 1)-I-j 4-(1-méth~ léthy l)hhény I jsulfOI1% I j- -(trilluornnit
thy I) 1H-
iud~ile
En opérant de façon tnal~>ue ~i l,i pr~harati~>~1 XXIX agi départ duu cornpo,c
5 obtenu scion 1a préparatioiz 1 V1, on a obtenu le produit attendu sou> forme
d'un
tiolide hlune (rende nient i S
F = 10O"C.
PREPARATION XXXI
10 6[-[2-bromométhyl-5-trifluorométhyl-indol-1-y1]-sulfonyl]-4-méthyl-3,4-
dihydro-2H-benzo[ 1,4]oxazine
En opérant de façon analogue à la préparation XXIX au départ du composé
obtenu selon la préparation XXVII, on a obtenu le produit attendu sous forme
d'une
huile orange (rendement 58%).
15 'H RMN (300 MHz, DMSOd6)
8 = 8,21 (d, 1H), 8,05 (s, 1H), 7,69 (dd, 1H), 7,21 (m, 2H), 7,08 (d, 1H),
6,80 (d, 1H),
5,22 (s, 1H), 4,23 (m, 2H), 3,24 (m, 2H), 2,80 (s, 3H).
PREPARATION XXXII
20 2-bromométhyl-5-chloro-l-[[2,3-dihydro-benzo[1,4]dioxin-6-yl]-sulfony1]-1H-
indole
Ln opérant de façon analogue à la préparation XXIX au départ du composé
obtenu 'clou la préparation XXVIII, on a obtenu le produit attendu sous forme
d'un
solide blanc (rendement S1 Ela).
25 'Il R 1 N (300 Nil 1z,1),\ c1,;1
S = 7.x)9 fd. 1H), 7,70 (d. 111). 743 (m, 3H), 7.OS 7.01 M. 1I1). 5.16 L. -'l
1),
4,26' iii. 411 ).
h:XF:AIPLI 69
~O Acide j [ 1 1 3 t LI (Iiiuctl~~ léth~ 11 hhén~ l~tiulf~~n~ 11
trifluurc~méth~) 1H indol-
2-~ I jmethv I j-I'uran-2-cart)nx ligue
\ nne olution de t) n 11L, fil M) (Ic
2hrin~om~th~l l (_~ t 1.1
dinlethv lethv 0-hentcne~ul1oiiv l)-> (rH ]uoronictl~v L I l l iudole t
~Lparution \.AI `: )
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
76
dans 4 n11, d'cihanol et 1 mL de 1.-1-diotannc 01 a additionne <ucee~,i~cuncnt
i~.c) une (().SI nnA11 d,acidc fditltidr~>~~hoFvl) ltirc~ipuc. X4.4 tnp 0().04
111M) de
Pd(dppl )C~l_,.CI1 C 1~ coinplc cet 105-S n1~a (1.2 mNI) de carbonate de
potaõiuirt. Le
Milieu rcltctic111t iel a été chou ftd 'O nlinuic aus mima-ondes t 1 O"C_ uis
dilué à
l aeétate d éthyle et lavé ,ueces~i~en~enl par dc. l'eau pui, urne ,olulion
apucu,,e
saturée en aCl. La phase t~raaniclue a cté ,échée "ur ,ullate de nlaanésituin
et
cc~ncenlrce ,t~u~ pre;,icn réduite. Le rc~idtt ohteuu a été purifié par LC-UV
prcptutiti'm lsunlïre C1S) en Gluant par un nldlange H2O/CH3CN/ 0.1%TFA. Les
fractions contenants le produit attendu ont été réunies et concentrées à sec
sous
pression réduite pour donner 15 mg de l'acide 5-[1-(3-(1,1-diméthyléthyl)-
benzènesulfonyl)-5-trifluorométhyl-lH-indol-2-ylméthyl]-furan-2-carboxylique
sous
la forme d'une huile orange (rendement = 7 %).
'H RMN (400 MHz, DMSOd6)
5 = 12,9 (sl, 1H), 8,27 (d, 1H), 7,99 (s, 1H), 7,70 (m, 4H), 7,50 (t, 1H),
7,14 (m, 1H),
6,69 (s, 1H), 6,40 (m, 1H), 4,58 (s, 2H), 1,18 (s, 9H).
EXEMPLE 70
Acide 4-[[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyll-5-trifluorométhyl-lH-
indol-
2-yllméthyl]-thiophène-2-carboxylique
En opérant de façon analogue à l'exemple 69 au départ du composé obtenu
selon la préparation XXIX et de l'acide 4-(dihydroxyboryl)-2-thiophène
carboxylique,
on a obtenu Io produit attendu sous forme d'une huile orange (ren(Ie rrn e ttt
30 %).
11 RN P,, (4{) 0 MHz, DMSOd6)
S = 13.10 (d. 111), 8,26 (d, 1H), 7,95 (s, 1H), 7,72 (d, 1H), 7,68 (t, 1H),
7,73 (m, 3H),
7,54 (m, Il 1), 7,48 (t, 1H), 6,62 (s, 1H), 4,44 (s, 2H), 1,17 (s, 9H).
Ii;YF:AIPI.L:71
Acide -(11-I[4-t 1-nidlh.léthvl)-phdny1(sulf<onv11- -trit1uu-,t)nléthti1-111-
indtol-2-
' I f iuélh' I ]-thiophène-2-carhoyv Iidue
h.Iu opcraut de (t~~c~n aima! mue i1 I eveulple 01> au départ du cocu x,c
thtentt
clou la pruparatuon .`..A\ et de l ucide 5 (diluvilu yvIa uvI)- ihiopdduue ea
hoyvlipu ,
on a ~htenu le pr~uluit attcudu ~c~u, 1rn1e d un ~oIide heice t rcnclenleul
(`~ }.
f I O) ~ 10 C.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
77
EXEi\IPI,E 72
\cidc 4-((1-(f4-#1-méthIéthN I)-phén1)s111 fun1J- -triflu() r omé1h~l-lH-indo1-
2-
1]1néthc1J-thiophène-2-carhoXy lique
1:n upéraut de I~tcou an<ilo'nie à l'cydnnrplc 69 111 déi)art dit composé,
()t)tenu
,clou la préparatii~n \. et de I'acidlc -4-(dihn di-o\\ hors l) (hiui~hcnc
carboxylique,
oou a ohtcnu le produis attendu pou; i'ormc il titi ()lidc mari-oui
(rcndeincrit 39 %).
tH RM- (-I00 AI11/. D\1SO(1;,)
5 = 13,03 (s, 1H). S,25 (d, 1H), 7,97 (s, 1H), 7,75 (d, 2H), 7,64 (m, 2H),
7,55 (s, 1H),
7,47 (d, 1H), 6,62 (s, 1H), 4,46 (s, 2H), 2,93 (ru, 111), 1,14 (d, 6H).
EXEMPLE 73
Acide 5-[[1-[[4-méthyl-3,4-dihydro-2H-benzo[1,4]oxazin-6-yl]-sulfonyl]-5-
tri luorométhyl-lH-indol-2-yl]méthyl]-thiophène-2-carboxylique
En opérant de façon analogue à l'exemple 69 au départ du composé obtenu
selon la préparation XXXI et de l'acide 5-(dihydroxyboryl)-2-thiophène
carboxylique,
on a obtenu le produit attendu sous forme d'un solide beige (rendement 4 %).
F = 120-144 C.
EXEMPLE 74
Acide 4-[[1-[(4-méthyl-3,4-dihydro-2H-benzo[1,4]oxazin-6-yi)-sulfonyl]-5-
trifluorométhyt-lH-indol-2-yl]méthyl]-th iophène-2-carboxylique
En opérant de façon analogue) l'exemple 69 au départ du conrpo,é obtenu
scion la prélrtratit~n XXXI et de l'aride 4-(d ihydroxyboryl)-2-thiophène
carbo ylique,
on a obtenu le produit attendu ,ou, forme d'un solide marron (rendement 15 %).
'Il R\I\ (500 \1II/. D\ISOd,)
= 13. l () ( , . 1 1 1 ) . ~, 2 h ( d . 1 1 1 ) . 7.06 ( , . 11T). 7.0? (m.
21I1. 7.5`5 ( , , IIT). (t1d. 11 f ).
1 1 1 ) . 0. 1-T (ti. 111). O.()O (,. 11-1). -1. 1-t r~. 211). x.23 (i. 211(.
x,2 1 (t. 21I). 2.77
3O EXIEAIPt1[ 75
lcidc -5-111-1 (4-méthN l 3, l dih~ dru ZII henzoJ 1,4 Jotazin G ~ I) sulfoné
1 J-5-
trifluorométh,1-11 1 indol 2~ 1 JméthN 1 I4uran-2-ctu=hox liquC
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
78
I.u opérant de (açon aualouuc i l'e.ycrnpie (10 au départ du composé ohtcnu
~elou u i~répar~ttion \XXI et de 1 ucidc (di}l~ciror~hor~1 ftuoïduc, con
ohtcixule
produit atlcn~iu ;ou, Notule d'un solide inarrou (icn calent 4 ; ).
'II R\1\ (40U'NIlir. L~11S0d6)
= 12,60 (s, 1H), 8.21) (d, 1H), 8,19 (s. IH), 7,96 (,. 1H), 7,65 (dd, IH),
7,05 (dd,
IH), 6.0) I (d, IH), 6,75 (d, Il I). (x.61 (s, 1H), 6,44 (,. IH), 4,51 (~. 1
1), 4,23 (t, 2H),
3,2-4 (1 t. -'l 1), 2,78 (s, 3H).
EXEMPLE 76
Acide 5-[[1-[[4-méthyl-3,4-dihydro-2H-benzo[1,4]oxazin-6-yl)-sulfonyl]-5-
trifluorométhyl-IH-indol-2-yl]méthyl]-furan-3-carboxylique
En opérant de façon analogue à l'exemple 69 au départ du composé obtenu
selon la préparation XXXI et de l'acide 5-(dihydroxyboryl)-3-furoïque, on a
obtenu le
produit attendu sous forme d'un solide noir (rendement 6 %).
iH RMN (500 MHz, DMSOd6)
5 = 13,00 (s, 1H), 8,27 (d, 1H), 7,99 (s, 1H), 7,67 (dd, 1H), 7,17 (dd, 1H),
7,07 (dd,
1H), 6,92 (s, 1H), 6,78 (d, 1H), 6,63 (s, 1H), 6,40 (d, 1H), 4,56 (s, 2H),
4,23 (t, 2H),
3,24 (t, 2H), 2,78 (s, 3H).
EXEMPLE 77
Acide 5-[[5-chloro-l-[(2,3-dihydro-henz+[1,4]dioxin-6-yl)sulfonyl]-IH-indol-2-
yl]méthyl]-thiophene-2-carboxylique
En opérant de façon analogue à I'eyennple 69 ann départ du composé <,htentt
'clan 1.7 pnrcpar;ition XXXII et de l'acide 5-(dih}droxyborvi)-2_thic~hhrne
L~,rhoyv liq c, on a obtenu le produit attendu sous forme d'un solide blanc
(rcndeniunt
-4 ,
I. 1 <)(, C'.
1:`tF,~IPLI: 78
Acide 4-]]5-chloro-1-(2.3-dihydro-henr.oj1,4((liosiii -6-%I .~ult'onvIJ-111-
indol-2-
méth'l]-thiophént2 carhox~1i(j tic
l:u o1)érant pic 1~c ui ,inalocue u l'c~~n~lle t,9 ntu dcpurt dtt
el,n lu Inéi~arati_n \X.A11 et de l ucicie l <<li]~~dr<,~~hot~li tl~i~1>héne
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
79
~arhi~~)liclue_ on a ohtcuu le pri,diuit attendu ou, l'cunie d'un solide
iiufrron
f renrienient 24 ' , ).
'H R.A1\ (400 y111z. I)\ISOJ.)
6 = 13.01 (,, 1N>, S.(> (d, ll 1). 7,55 (m, 3H). 7,33 (dd, 1H), 7,29 (dd, 1H),
7,12 (d,
1H), 6M4 (d. I1] )e 1H), 4,38 (s, 2H). -1.26 (ni, 4H).
EXEMPLE 79
Acide 5-((-chlor=o-1-[(2,3-dihydro-benzo[1,4]dioxin-6-y-I)sulfonyl]-lH-indol-2-
yl]méthyl]-f iran-2-carboxylique
En opérant de façon analogue à l'exemple 69 au départ du composé obtenu
selon la préparation XXXII et de l'acide 5-(dihydroxyboryl)-2-furoïque, on a
obtenu
le produit attendu sous forme d'un solide beige (rendement 12 %).
'H RMN (400 MHz, DMSOd6)
5 = 12,95 (s, 1H), 8,02 (d, IH), 6,64 (d, 1H), 7,33-7,39 (m, 2H), 7,22 (d,
1H), 7,16 (d,
1H), 7,01 (d, 1H), 6,51 (s, 1H), 6,40 (d, 1H), 4,53 (s, 2H), 4,26 (m, 4H).
PREPARATION XXXIII
1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-3-méthyI-5-trifluorométhyl-lH-
indole
1,43 g (59,5 mM) d'hydrure de sodium ont été ajoutés portion par portion sur
une solution de 7,9 g (39,6 mM) de 3-méthyl-5-trifluorométhyl-IH-indole dans
79 mL de diméthyl l'oi t roide. Le milieu réactionnel a été agité 10 minutes à
0 C,
puis 10,15 g(43.63 niNI) de chlorure de 3-(1,l-diméthyléth,l)benzenesulfonyle
ont
été ai()uté, lentement. Fhrè, 1 heure d'agitation, le milieu a été h) di-oh sé
par 500 mL
d,cuu glacée et 100 mL d'acide chlorhydrique IN et filtré sur BJehner. Le a
été 1u par clé l'ami. hui, séeI pour donner 14.9 ~ clé 1 ((3 (1.1
~limct}i~lclh}l)
phénvIHultonvl~-;(-méthvl-~-triol_io1oln'1livI41I-indoIe ,on Iii Hune d iin
,oIide
l"<inL'e (rendement = )~ 'r ).
= ~)1) 1ON C.
I'KEI':>,R:1'TIO\ \\\I\
acide (4-fornivI-l-méth%I-11I-p'rroi-2-~It-carhut'liyue, (I,1-diméthvléthvl)
ester.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
Unie ~olutiorr de 71)0.0O nr_> (>.2O roll) de 1'acidc É 11~~rnivI 1 nidtlivI
111
pvrroL? ~Ij carhox licluc clam 20 n1 de tlluénc a cté portée à reflux ci mL
{ I1.~ in l) clc v.A din~ctIivIfc~riuuiui~Ic cli terl hut~] ,ucctal ont cté
aji~u(ds lcntctucitt
(le Inilieii dcvicilt IloilioLénc au t'uir et à rnc,urede l udciiüc~n). Le
milieu ré,lctionnel a
5 été a,,itc 2 parce, 1 rcilu.v. huis h}cho1v<c par de l'eau et extrait par
l'acétate d'élh;~le.
Lu phase or4uniclue a étc cu,uite lace ,ucce,si~en~ent par une ,olution
aducu,e
,aturéc en NAICO. lui, en NaCI, ,échec sur ,ulfate (le inu iné,ium et c~
aporée
prrõion réduite. Le rr,idu a été purifié par clirornatogruphie sur gel de
,ihce en
éluant par un mélange cyclcohcxarre / acétate d'éthyle (95/5 ; v/v) puis
10 progressivement jusqu'à cycloliexune / acétate d'éthyle 60/40, (v/v). Les
fractions
contenant le produit attendu ont été réunies et concentrées à sec sous
pression réduite
pour donner 515 mg de l'acide 4-formyl-1-méthyl-iH-pyrrole-2-carboxylique (1,1-
diméthyléthyl) ester sous la forme d'un solide beige (rendement = 47 %).
F = 92 C.
PREPARATION XXXV
1-[[3-(1,1-diméthyléthyl)-phényl]sulfonylj-5-trifluorométhyl-1H-indole
En opérant de façon analogue à la préparation XXXIII au départ du 5-
trifluorométhyl-1H-indole, on a obtenu le produit attendu sous forme d'un
solide
jaune pâle (rendement quantitatif).
F = 84-86 C.
EXI~:MPLE 80
;acide 5 [[1-[[3-(1,1 diméth~iêth~ll-phën~Ijsulfon~tj 3 méthvl-5-triflttc-
roméNt l-
1H-indol 2-~ Ij-Itydrox~ nwth~ I1 thir~phene Z carhox~ ligue, mëthvl ester
Soli', ar on. à uuc ,oIuliun de 1.1 Liu 13, >n\1) de 1-[j 3-1
1.1 din~cth~lctlr~l1-
phcn~ l ~,ullou~ 11 , méth~ l trillr_foroluctllc f l l1-indole (hrch~u atiou
\III J cl~ul,
12 ruL clc tctrahvclrofuranc retroiclic a t)C oui cté ajouté, lentement 2il
111M)
une ,ulution clc n hul~llit}lium rc = L(, ~I cian, IIlc~~ulei. Le milieu
rcactionncl a
'O Cté ~1~uIt2 1-S min a t) (, put, u cite 'ci ittic a "orne .l -S t vtli
tille ,olutmu de -1 7? iu
t 21h nuAl) cl ctcr rnctli~ licluc de I ~ ciclc loi 111\
l tlliohhcnc eurhox~ liyuc clan,
mL de lctrall~ clro(urane. L e milieu a etc a~itc 3O minutc,, u -7H C. hiui,
dilué par
ul ,olutirul acltlcu,c ~ati_uc~ en ~1i Ci tt curait tn!i, loi, par le
cli~lll~~roiucil~~lne. La
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
81
pha<c or~ani~luc a étc ~échcc ,tir pull 1 C (Ic tn~t~rt~~>iunl et Cva1P0rcc
,On, p c~~inn
reluite. I.c ré idu a cté purii,ic puur chronnitoLraphic ,w- ccCI clc ,Ilicc
Cn cluanl par un
nclan~c cvCP)hc~anc 1 ccclutc et ét}i~le (P5/5 ; v=/v). Puis c clohc~anc /
acctatc
d é111~ 1C ~~Oï1 l). ~ ~GI= Les fraction; ct)i cnumli le produit atlendlrt ont
été rPui c él
concentrée, It ,lcc sots prc~,ion réduite pour donner 1)2() nie clé l'acide
(1,1 (Ill néthvIéthyl)-phcnvI H[1lfonyt~-3-111étl1 y1-5-triiluoiométht'1-lH-
indot-2 yl]-
hydro~~ niétltyl] thiol>lt~ne--c~trboxylirfuc méthyl etcr mis la forme dune
huile
o1 niec (cndement = 6 ).
'H R:NIN (300 MHz, DMSOd6)
S = 8,34 (d, 1H), 7,69 (m, 5H), 7,6 (d, 1H), 7,46 (t, 1H), 6,95 (m, 2H), 6,78
(d, IH),
3,78 (s, 3H), 2,22 (s, 3H), 1,14 (s, 9H).
EXEMPLE 81
Acide 2-[[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-3-méthyl-5-
trifluorométhyl-
1H-indol-2-yl]-hydroxy-méthyl]-thiazole-4-carboxylique, éthyl ester
En opérant de façon analogue à l'exemple 80 au départ de l'ester méthylique
de l'acide 2-formyl-thiazole-4-carboxylique et du composé de la préparation
XXXIII,
on a obtenu le produit attendu sous forme d'une huile orange (rendement 40 %).
'H RMN (300 MHz, DMSOd6)
8 = 8,53 (s, 1H), 8,25 (d, 1H), 8,03 (d, 1H), 7,91 (s, 2H), 7,70 (m, 2H), 7,48
(m, 2H),
6,98 (m, 1H), 4,28 (m, 2H), 2,04 (s, 3H), 1,31 (t, 3H), 1,25 (s, 9H).
EXEMPLE 82
Acide I {(1 ((3-{ 1,1-di éth~ léth~ l t-ph nv1]sulfon~1 J-5-t ifluoroméiti} I-
1 i-fndol-
2 v I h~ drt~t~ méthyl}-1-méth~ I 1 -pyrrole 2 ~ I carho Ii ue, (1,1-din1éth)l-
étlavI) c'Ier
On opérant clé ia~on ~mai~~1uc à 1'é~~~nh(c Stl au ~lclarf Diu nmh~>>/ de I~
pr~~p~uati~>n ~ `~IV ét du c unpo,c de lu prcparatinnn yX\\ , on u ohténu le
produit
attendu ,ou, toi mue d une huile incoloic (rcndcmént u ).
0 1l R~I\ t_~OO \I11/. D\iSOd.
.h-I (ift. 41I). 7.40 (~I. 11I). 0.0)3 H. 111). 0.~5 (d. III),
l (l . 11 I ) . ~_7 I ( , . 3 l 1 ) . 1 . - 1 - ( : , P ) I l ) . 1.1 ï i,.
d)I I).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
82
h:tI:~II'1.h; 83
Acide 3 [~ 1 ([3 (1,1 ~limethvléth~I) phénvl~sulfonvl] 3-méthyl-5
trilluorometh~l-
111-inclol-2-% )niéthvl j=thiophène-2-carboxylique, )méthyl ester
A une ,olutirnt de 1,02 g (l.8 111,1) de l'acide 5 [[l jj (l.1
diniéthrlCtlt}I)
l~l~ nv I ~,nlfon~ I 3 nicth~ l 5 tri fiuoi'om thr I 1 E I inclol 2 yl] hy
dror~ mctli~ l]-
thiophénc-2-cJ1'boxv liclue rncthtil e,tcr (exemple 80) dan. 10,2 mL de
cl]chloronlcthanc on a ajout( ,ucce renient et ggouflc à goutte 1.05 g (9,02
n~~~l) cie
triclhvl~ilaue, 0,02 g d'acide irifluoroacétiquc et 1.2 g (9,02 riM) de
trifluonire
dicth}`l éther de bore. La réaction a cté instainance et le milieu rcaciionnel
a été
é~ aporé, puis purifié par chromatographie sur -cl de silice en éluant par un
mélange
cyclohexane / acétate d'éthyle (95/5 , v/v). Les fractions contenants le
produit attendu
ont été réunies et concentrées à sec sous pression réduite pour donner 490 mg
de
l'acide 5-[[ 1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-3-méthyl-5-
trifluorométhyl-
1H-indol-2-yl]méthyl]-thiophène-2-carboxylique méthyl ester sous la forme
d'une
huile jaune (rendement = 49 %).
'H RMN (300 MHz, DMSOd6)
S = 8,29 (d, 1H), 7,97 (s, 1H), 7,72 (d, 1H), 7,68 (d, 1H), 7,60 (d, 1H), 7,56
(m, 1H),
7,52 (m, 1H), 7,40 (t, 1H), 6,95 (d, 1H), 4,72 (s, 2H), 3,75 (s, 3H), 2,80 (s,
3H), 1,12
(s, 9H).
EX Eï_l1PLE 84
Acide 2-[[1-[[3-(1,1-diméthyléthyl)-phényl]-sulfonyi]-3-méthyl-5-trif"luoro-
niéthv 1-1H-inclol-2-yl]méthylj-thiazole-4-carboxylique, éthyl ester
A trot ,olutiou de 200 mg (0.34 mM) (le l'acide 2-[[1-[[3-(1.1-dimcth-Iéth}1)-
phcn~l~çt llr~n~l 3 nicthv1-5-trifluorc,tltcthv1-1II-inclol-2-yl]-hydroxti
niéthvlJ-
1100/o1c 1 ~ar(~ox~licliiu ClI1~'l cçtcr 1c.ycniplc Si clan, `' mL cie
cliclllor<~méthanc et
17 nu die rlinirtliv;f~~rnianiulu O). 17 niAl rclrr~iclic â (7 ('n a u uiiS
_'O1 11IL,
(1.72 111M) (lé .SO(I . pui, le milieu rcilc~tiouuul u cté auihd = 1 brume, ht
luipCralurc
iurilounle. Li rd i tiou Clilnt inuommipl~~te. 7O-l ing (1.72 nn,AI) d u SOCI
_ omit etc rajolltc,
~O ICIIV tOli u '-I IIuiII , et tllter~alla. Li olution a CIL rll,llllu d
uporuu ~(llf, preõlon
rCcluite. Lc brut ruuuiiouncl a c'tc place en u,puudon cl;ln; 10
ml- P)1),15 1.611iA1) ale troc uni été aioutr,. Lc milieu rcucti~~nnel
i utS amie toi, tl~ul, a tu iiperatwu umiibii ile. .Apre~ IFoiti eAti iuilOIi
Il l uuuiute
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
83
d'éthvIe. lc; hha~c, Ureanidtte, raõemhléc, ont été séchée, ,ur,ullale de
rnaL'né,ium
et e~ ahc~rce ,ou, pre ion réduite. Le résidu a Cie purifié par
chroiuato~~raphie sur '-'cl
de silice cil éluant par un mélance cvclohc.~ane acétate di'cthv(c (1)(/1O :
\/v ) puis
tti0i'O) et Ie, Traction contenant le produit attendu ont été réunie, et
concentrée, ii
sec ,ou, hreõion réduite pour donner u nia cle l'acide 2-I 1 (;-( 1.1-dinictli
léthyl)-
phénv l ~,nlfoIly I J- P-méthyl-5-trïfluoI'oIndthv 1-l H-rodai-2-ti'I f méth~l
I thiaiole--t-
carhov ~ l igue. éth.yl ester,ous la l*()rme d'un solide incolore (reneiemcnt
= 31 lc).
tH RMN 3O(3 MHz, DMSOd6)
5 = 8,37 :, 111), 8,30 (d, IH), 8,00 (s, IH), 7,64 (m, 3H), 7,58 (d, 1H), 7,43
(t, 1H),
4,88 (s, 2H), 4,28 (q, 2H), 2,29 (s, 3H), 1,29 (t, 3H), 1,15 (s, 9H).
EXEMPLE 85
Acide 5-[[1-[[3-(1,l-diméthyléthyl)-phényl]sulfonyl]-3-méthyl-5-
trifluorométhyl-
1H-indol-2-yl]méthyl]-thiophéne-2-carboxylique
A une solution de 490 mg (0,89 mM) de l'acide 5-[[1-[[3-(1,1-diméthyléthyl)-
phényl] sulfonyl]-3-méthyl-5-trifluorométhyl-1 H-indol-2-yl]méthyl]-thiophéne-
2-
carboxylique méthyl ester préparé à l'exemple 83 dans 10 mL de
tétrahydrofurane et
5 mL d'eau on a ajouté 192 mg (8,01 mM) d'hydroxyde de lithium. Le milieu a
été
agité 4 jours à température ambiante puis acidifié par une solution d'acide
chlorh) Brique IN. Après deux extractions par le dichlorométhane, les phases
orgatniques rassemblées ont été séchées sur sulfate de inugné,itun, et
évaporées sous
pression réduite. Le résidu a été purifié par chromatographie sur gel de
silice en
éluant par un mc(anpe cyclohcxane / acétate d'éthyle (80/20 ; v/v) puis
pro ressi~ etuent ju,clu'à csilohexane / acétate d'rthr le (50/50 ; v/v). Les
fractions
contenant> le produit attendu ont été réutdc,, et e iceiitréc, ü ,ec sorts
preõion réduite
haut donner ~~O u]- de lucide ï-~ (1 j t . l dniietlt~ léthti l) phcit~ l
~,ulli~n~ I) 3
nétli~ l triCluor~nnéth~ l l l i ïndul ~ I Iniéth~ l ~ tlii~plicne ça ho~~
ligue ou, la
Iurite d'mi solide plane tieudenient = )
F 1 C.
;O
1/:A1/\ll'l.h: 86
Acide 2-f (1-j j 3-( 1,1-dintéth~N léthp l)-phén,N I jsulft)n~ I j-3-mcthv I i
trifluorc~
mcth~ I 111 indttl 2 I ~ntcth~ I~ thia/ole 4 carh~~~~ liclue
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
84
FFF ohcraut (le t<(Con an~llc,~_tlc ii l'exe!np!e S5 au ci~hart lu eoinpu>é
obtenu
selon l excn~hle t con a obtenu le produit attendu ~~~t.ts forme d'un solide
blanc
(rendement 6- C).
il _6U C.
LXF\1PLE 87
:acide -4 -[[1-[[3-(1,1-diniéthyléthy l)-ph én)1jsu1 fonyll-5-trifluorométhyl-
lH-indol-
2-ylliiiétii~11-1-métli3l-I)Nt-t-oi-2-NI-cairbox% tique
Un opérant de 1'açun analo put à l'exemple 83 au départ du composé obtenu
selon l'exemple 82, on a obtenu le produit attendu sous forme d'un solide
beige
(rendement 58 %).
F = 160 C.
PREPARATION XXXVI
[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-indo1-2-yl]-
acétonitrile
A une solution de 520 mg (1,10 mM) de 2-bromométhyl-l-[[3-(1,1-
diméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-ll4-indole obtenu selon la
préparation XXIX dans 4 mL de dichlorométhane et 1 mL d'eau on a ajouté 35,34
mg
(0,11 mM) de bromure de tétrabutylamonium et 107 mg (1,64 nrM) de cyanure de
potassiu!i~, et le milieu réactionnel a été agité une nuit à température
ambiante. Le
milieu réactionnel a ensuite été hydrolysé par une s lutiori aqueuse saturée
en
Nat-C0, et extrait deux lois au cliclilo:orcomcthanc. Les phases ors=a~iiques
rassemhlces
out cté séchées sur sulfate rie ma~'nésiun , et c~ apc~rces sons pression
recloue. La
réaction étarnt inc~,n!hlète. le résiclll obtenu a été clé nouv eau placé en
,ohltiou clans 4
vil, (e clichl<,ronlcthanr et I uiL d,eau. en hré~eiiee de >>.3-i n!,e (().11
mNl) ale
broninrc de tctrahui~l,un~?niun! <t 10- !n,, (l.(,-l !n\I) de cnunn e (le
huta,~iun1
pendant 4 heUies à ten~hcrature un hiantc.:~pie h~clr~,ly e h~u une ~oluti~,n
a~lucu e
~aturee en a( O: et e.xt action dci!_x l,o,i. au ~liehlor~,n~etliane, le
phases or~r.u~iyue
iO LI~~CI111~ICC> Ont Cle secI1des sIII ~ullale de ILLtene"IUnl. et
rc~iuite heur cl~,nner tut) n e le I ; 3 t 1. I c11!netll% ICtl~~ l J hhen~ l
~~ul~~>u~ IJ
triiluor~~nnethvl-I11-nulul -~1 -~Iect!,nitrile ~.,u~ la l~,rine Tune huile
nnar1on1
I rendement P I ' ).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
11 REIN ;()() vI1Ir. D\1SOd,)
111). S,O( (,,,, 111). _11), 7,73 7,52 (t, 1H), 7,O (,~, 1H),
4.OO (<. 211). L 1O (,,. ')H).
5 l I hFP,',1ZA"11ON XXXVII
2-[1-[(3 -(1,1-dinréthvIét hyl)-phényl]srrlfon vf -5-tr-i l1 uorométhyi-lH-
indol-2-yl]-
thioacétamide
A une solution de 420 mg (1 mM) de [1 [[3 (1,1 di~néthyléthyl)
pI LiiylJ>rullonyl]-5-trifluorométhyl-lH-indol-2-yl]-acétonïtrile (prcp.u-
ation XXXVI)
10 dans 4 m L de tétrnihvdrofurane et 8 mL d'eau on a ajouté 0,75 mL (4 mM) de
dithiophosphatte de diéihyle. Le milieu réactionnel a été agité une nuit à 85
C.
La réaction étant incomplète, on a ajouté 744 mg (3,9 mM) de
dithiophosphate de diéthyle ont été ajouté, puis agité pendant 7 heures à 85
C. Le
milieu réactionnel a été hydrolysé par une solution aqueuse saturée en Na2CO3
et
15 extrait à l'acétate d'éthyle. Les phases organiques rassemblées ont été
séchées sur
sulfate de magnésium, et évaporées sous pression réduite. Le résidu a été
purifié par
chromatographie sur gel de silice en éluant par un mélange cyclohexane /
acétate
d'éthyle (90/10 ; v/v). Les fractions contenants le produit attendu ont été
réunies et
concentrées à sec sous pression réduite pour donner 320 mg de 2-[1-[[3-(1,1-
20 diméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-indol-2-yl]-
thioacétamide sous
forme d'une huile orange (rendement = 71 %).
'H RMN (300 \11-1z, D MSOd6)
cS = 9,70,( lar_~e. JH), 9,43 (s 1ar~e, 1H), 8,20 (d, 1H). S,01 (s, 1H), 7,75
(m, 3H),
7.03 (di, 111), 7,52 (t, 1H). 0,S3 (s. 111), 4,33 (s, 2H), 1.20 (". 1)1).
i xi1,1II'LE 88
Acide 2 ff 1 j(3 (1.1 din~éthcléth~I~ phcnvJJ ulfou~f~ 1rilluorométh%I 1H-
indol-
2 ~I]mcthvlj thiazole 1 ru Ix~s~li~tue, cthvl ester
unc ~~>lution (lc 5)) uiL, OU I 11iA1) pic -[I j5-(1.1 (ii11~ct11~1~1I1~I)
') 1,hcn~ll~ul~vn~l triilil~,r~nnci]~~1 1Il inc1~1 ~l thi~lcet~un ~1c
prclrzrlitloil
~.A\~11) 1a11, S ml. Lcihcmml ou a ajoute 2 .45 inc (t1.I 1 1n\11 de
hronlopvruvutc
1 etl~~lc. Lc n~ilicil rcnctiunncl n clé u,itc u1?c nuis ni t~1n1~~r,1tu1~
<tnahi~lntc. 1ui~ le
v~, ~ ~1nt u etc c', ~lporc h,ur (ionncr 111': ,ic . acyle [[1-lj 1.1-
1iuuuhlly lc)I1v I)-
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
86
hhrn~l ~~ IIh T1 11 trifluoronlcthv Lii i indOl-2 y Ijnlethy l ~-2 fatale--l-
cturhoxy ligue
étll~l citer vous la lamie d'une hnilejaune (rendenie it= 94 `~ j.
1f k\1\ (3OU Il 1/. D\ISOd6)
8 = S,42 (s, 1H), S,2 (d, 1H), 8,03 (s, 1H), 7,72 (m, 4H), 7,48 (t, 1H), 6,91
(s, 1H),
4,91 (s, 2H), 4,29 (q, 2H), 1,30 (t, 3H), 1,18 (s, 9H).
EXEMPLE 89
Acide 2-[[1-[[3-(1,1-(Iiméth~léthyl)-phén)I]sulfonyl]-5-tritluorométhyl-lH-
indol-
2-yl]méthylj-thiazole-4-ca rhoxylique
En opérant de façon analogue à l'exemple 85 au départ du composé obtenu
selon l'exemple 88, on a obtenu le produit attendu sous forme d'une huile
marron
(rendement 33 %).
'H RMN (400 MHz, DMSOd6)
6 = 12,95 (s large, 1H), 8,35 (s, 1H), 8,27 (d, 1H), 8,03 (s, 1H), 7,72 (m,
4H), 7,48 (t,
1H), 6,91 (s, 1H), 4,89 (d, 2H), 1,18 (s, 9H).
PREPARATION XXXVIII
Acide 5-(l-hydroxy-prop-2-ynyl)-thiophéne-2-carboxylique, méthyl ester
A une solution de 1,7 g (10 mM) d'ester méthylique l'acide 5-formyl-
thiophène-2-carboxylique dans 17 mL de tétrahydrofurane refroidie à 0 C on a
ajouté
goutte à goutte 40 niL, de bromure d'éthylnylmagnésin'u, puis le milieu a été
agité 30
minutes à 0 C. La solution a été v ci-,,ce sur 100 mL d'une solution aqueuse
saturée en
NH4CI et extrait trou pois par 1'ncétuie d*cthyle. Les phases or~aniqucs
rassemblées
ont été ~cchée~ sur sulfate de 1nuenésiurn et étapoi2e, sous pression réduite
pour
donner 2 e de l'acide 5 i 1 hlciri~.~~ prop 2 vny1) tlii~~p! hle 2
carho.rrlidue mcth~l
c,,ter Suu; la iuiine d un ~tlide i uiion (r~~ndcnlcnt rlu<intita(i1~.
F = (' ; C.
i xil:~il'i.i: 90
acide 1 I ~~3 (1.2 ditnélh~léth~l) phén~l~sulfon~lj 5 trifluorométh~l 111
ïndol
2-111-h~ (l rox~ -met l I)-1hiuhhène-2-carl)ox% Iiyii e. meth~ I ester
I11 t)per,ult de (acon eiialuei_e ii la hr~~l?~ilehlun `: ~ eu ~i~h,irt glu
cninh~>~~
k,hle11t1 ~eltnl la lu~~h,ir.~tit~n \\\\ Ill ci dn etniht~c uhien,t ,cliii la
;r<h.n,ttitln \[.
til a t?hteîiii le I)rodl.nt ~lttendhi ~çnH l(1r)ile ll une gille muiiee
{ieudeuient ,~ ' u
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
87
11-1 R\1\ OUO \1111, ll\1SOd6)
â= S_~ (d. 111), III), 7,7e) (in. 1H), 7,77 (ni. 511), 7,67 (d, 1H), 7,48 (t,
1H),
7,10 (d, 111), 6 9 (d, IF!, 6,95 (s, 111), 6,70 (d, 111), 3,SO (s, 3H), 1,17
(s, 9H),
EXEMPLE 91
Acide 5 [[1-[[3-(1,1-diméth~léthyl)-phénil]sulfon~tl]- tri(luoromt tlat'1 1H-
indole-2- `l]lt~drox~-rnéthyl]-thiophène-2-carboxy lidue
En opérant de façon aualoguc 7 l'exemple 55 au départ du composé obtenu
11e1on l'exemple 90, on <1 obtenu le produit attendu sous forme d'un solide
marron
(rendement 66
F = 90 C.
EXEMPLE 92
Acide 5-[[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indole-2-yl]-méthyl]-thiophène-2-carboxylique
En opérant de façon analogue à l'exemple 83 au départ du composé obtenu
selon l'exemple 91, on a obtenu le produit attendu sous forme d'un solide
blanc
(rendement 37 ~lc).
F = 110 C.
EXEMPLE 93
Acide 5-[[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyi]-5-trifluorométhyl-lH-
indol-
2-yl]-carbonyl]-thiophène-2-carboxylique, méthyl ester
A une ~olutic~n de 200,0 mg (0.36 mM) de l'acide 5 [[1 [[3 (1,1
dimcihylétiivl)-ph7ri 1 1,,lllf<1n~-1] 5 trit1noron7ctll~1-1H-indol-2-yIj-
hvdroxv-mctllv'1]-
111 phèrle- rurhox~ lillue ohtenu selon l'exemple 1)O dau, (10 n1L de
dichlotunieihane. 11u a ujoni7 1 ?6.-1 i11e (U.$6 111\U de tiic}uvluaie clc
h~rirliniun~. puis
le unllell rc~lctloi]Ilel a 7t7 a_'li~ 11110 111111 <I I 171[) r11ture
lllllhlalll~. Le milieu
reuetionnel a aie liltré .tir \~huimuii menllnune u 7 m et le solide rince pur
du
;1) di~hloiouiétliuue. Lc >l~lg ant du filtr,lt u été concentra ~t>u~ prc~~ion
réduite et le
IL Idu d eyupl>ratil~ll a été purifie pur ellrurnail~er~lplue .ur ,rl cie
~iliee ,1 l gicle ci,un
chiant eveJuliexune~aectute ci'cthvle Hi)/l1) : ~ O u Le, traetlnny contenant
le pnuiuit
attendu o111 S'IL' rt'11111e~ e1 ~l~ileeIit1'ie~ 1l tee ~(?1D l)Ie iOIl
rednue. Lacide I~ 1 l~
I.1 clinlétlly létlly 1 upllénv 1 OnlJon~ I uuiiluoroni7ihvl-l E1-indol _' I l
eul1n nv I L
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
88
thi~,hll~nc -carE~~~.t~ licltic 1>>éihv i c~t~r a élé ohtL~nut;<ou, la l'ouiuc
d*un
(1 f~.OO n~u : rcndciucut : o) i ; ).
X11 R\1\ (;OO \11 I/. D\1SC)(1,)
~ _ S.31 (d, 111), S,1S ts, 111), 7,96 (m, 1H), 7,86 (m, 5H), 7,59 (m, 2H),
3,91(s, 3H),
1.'5 9H).
1,tih:~11'LP 94
%cide 5-[[1-[[3-(1,1-diméthy1éthy I)-plié n%l]sulfonyl]-5-trifluorométhyl-1H-
indol-
2-yl]-carbonyl]-thiophë ne-2 -carboxylique
En opérant de façon analogue à l'exemple 85 au départ du composé obtenu
selon l'exemple 93, on a obtenu le produit attendu sous forme d'un solide
jaune
(rendement 41 %).
F = 217 C.
PREPARATION XXXIX
Acide 5-(1-hydroxy-1-méthyl-prop-2-ynyl)-thiophéne-2-carboxylique
En opérant de façon analogue à la préparation XXXVIII au départ de l'acide
5-Acétyl-thiophène-2-carboxylique, on a obtenu le produit attendu sous forme
d'un
solide beige (rendement 99 %).
'H RMN (300 MHz, DMSOd6)
5 = 7,56 (d, 1H), 7,12 (d, 1H), 6,65 (s, 1H), 3,64 (s, 1H), 1,72 (s, 3H).
EXEMPLE 95
Acide 5-[1-[l-[[3-(1,1-diméthvléthvl)-phénvIJsttlfonyl]-5-(trifluorométhyl)-1H-
indo1-2-yl]-1-hydrox éthyl]-thiophène-2-carboxv-ligue
lin opérant (le façon ai ilocu~~ à la hréh~~r~~iion V ,lu, cléhai't du conupo
t~hicnu ,clan la I~réharati~>n ?CXX[k et clu eoinho~é obtenu selon la
hréharation ,Al. on.
Il ohtcnu_i l e produis atlen(fil , o i i , larme d u1 ~olale jaune
(rcn~len~ent )5 ).
1 (L
I:lI~AIPLI:9(
Acide 5-1 1-1 1-j [3-t l l diméth~ Icth~ l) phéuyl ~5ult'on~ l ~
ttrilluor~~méth~ 11-III-
indo1-2-,11-1-éthen~ 1 ]-thiophcne-2-carbulN lique
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
89
1=111 opérant dC faÇOu] ~tnaloL'[Ie à l'Cyclllhl~ ~3 glu (lèhart (lit Cofl1pn
ohtcnltu
~Cl<u1 l cyct>>l,lc )~. tin a lhtcnu ]C hr~,~iuit attcnciu soin formC dlln
01](1C blanc
(rcncicnJCnt (~, ` ).
1= = 1 ~5 C.
1 XE\IPL 97
Acide 4.f 15 chloro-1-[[ -t 1-méth~léthyUphén~l~sulfonyl]-1H-indol 2-
1~méth~IC-
2-methoxv -benzoïque, méth% 1 ester
En opérant de façon analo-)Lue à l'exemple 1, au départ de l'c~tcc méthylique
de l'aci(ic -1-(hromométhyl)-2-méthoxy-benzoïque et du composé obtenu selon la
préparation V, on a obtenu le produit attendu sous forme d'une huile jaune
(rendement = 28 %).
'H RMN (DMSOd6, 250 MHz)
S = 1,13 (d, 6H), 2,91 (sept, 1H), 3,73 (s, 3H), 3,78 (s, 3H), 4,45 (s, 2H),
6,41 (s, 1H),
6,82 (dd, 1H), 7,02 (d, 1H), 7,33 (dol, 1H), 7,38 (d, 2H), 7,59 (dol, 1H),
7,62 (d, 1H),
7,70 (d, 2H), 8,06 (d, 1H).
EXEMPLE 98
Acide 4-[[S-chloro-l-[[4-(1-méthyléthy1)phényl]sulfonyl]-1H-indol-2-yl]méthyl]-
2-m2thoxy-benzoïque
En opérant de façon analogue à l'exemple 2, au départ du composé de
l'exemple 97, on a obtenu l'acide 2-methoxy-4-(isopropyl-phénylsulfonyl]-5-
(chloro)-lH-indol-2-v-1 Inléth.yl]benzoïque sous la forme d'un solide jaune
(rende:mcnt
F = h 7 C.
1
99
Acide l J 5 chlorer-1-[[4-il-mëth~letli~l)phén~l~,~ulf~im l] l/J ind~~l 2
~I~métlt~l]-
2-hN drox. -benzoïque
~O lai ~pérult clc Iuuoii unal~,uue â l'c~cn~plc 5(. agi ~li(hart du ~il~hc é
SIC
l cy~mplc I~. ou a odtcuu le Iunxiuit 1é.iré ~oiu l,i !oiinc Si un u Iidc uri~
OCnlrnicrit
1 = 13 Ç L .
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
1;~xEi\IPLE 100
_Wde -I-[1-[1[[-I-11-métfi vlétIl vl)plié n%IJsulfon'N I]- -(chloro)-1H-indol-
2-yl]-1-
hydror%éthNI]- benzoïque, méth' I ester
Lil opérant pie Caç~n ulnaloLiic à l'exemple 30 au départ du compo,ç de la
5 prcparatiun \IV et du c<,nipo,c (le la préparation XV, on a obtenu le
coulpo,é attendu
l'orme dune ii i5,c hlanelie lrcndciliuii 69
o).
F= 163C.
EXEMPLE 101
10 Acide 4-[1-[1[[4-(1-méthyléthyl)phényl]sulfonyl]-5-(chloro)-1H-indol-2-yl]-
1-
éthènyl]- benzoïque, niéthyl ester
En opérant de façon analogue à l'exemple 31 au départ du composé obtenu
selon l'exemple 100, on a obtenu le produit attendu sous forme d'une pâte
jaune
(rendement = 47 %).
15 'H RMN (DMSOd6, 250 MHz)
d = 1,13 (d, 6H), 2,88 (sept, 1H), 3,85 (s, 3H), 5.86 (s, 1H), 6,12 (s, 1H),
6,93 (d, 1H),
7,36 (m, 4H), 7,43 (dd, 1H), 7,53 (d, 2H), 7,71 (d, 1H), 7,88 (d, 2H), 8,07
(d, 1H).
EXEMPLE 102
20 Acide 4-[1-[1[[4-(1-méthyléthyl)phényl]sulfonyl]-5-(chloro)-1H-indol-2-
yl]-1-éthény1]-benzoïque
En opérant de façon analogue à l'exemple 2, au départ du composé de
l'eyuinple 101, on a obtenu l'acide désiré sous la forme d'une poudre beige
{rcnclcmcnt 34
25 I236 C.
Ln opérant de Luçon ~l~la(o tic i Iii hrcl~ar~itiou X au clchart (le l~inilin
corrc,pn~laute, 1111 a uhtrt~u lt ~~nlpo,c, dIc, prcpawIUOAs XL, XLI. XLII,
XLIII,
XLIV, et XL~,
,() PRLP:1R. TIO\ \l,
-] 2-iodo-4-I terbtit I -phén~ I1-3-1 I,1-di-néth~ Iéthv I1 benzène5ulfonamide
1,pec[ : huile lliua011
kulILlelllelll ;
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
91
~fi R11N (I)~1SOd,,. 3O() \IH/.)
1?O (., 911). l I)J 1). ($)7 (d, 11-11). T'(,(Id, 1H), 7, 1)) (1 1H), 7,51 (t,
1H),
7,58 J t, 111), 7,6') ( (1, 111), 3 (d, 1H), 9,5S 1H).
PREPARAATION XLI
\-12-iodo--I-1roni o-phényl]-3-(1,1-dinnéthy léth)1) henzènesultonamide
Aspect : ,olide noir
Rendement : quantitatif
F= 145 C
PREPARATION XLII
N-[2-iodo-4-(trifluoromethyl)-S-fluoro-phényl]-3-(1,1-diméthyléthyl)
benzènesulfonamide
Aspect : huile jaune
Rendement : 92%
'H RMN (DMSOd6, 300 MHz)
8 = 1,24 (s, 9H), 7,19 (d, 1H), 7,53 (t, 1H), 7,64 (dd, 2H), 7.72 (d, 1H),
8.11 (d, 1H).
PREPARATION XLIII
N-[2-iodo-4-methyl-phényl]-3-(1,1-diméthyléthyl) benzénesulfonamide
AA,pect : pâte jaune
Rendement : quantitatif
111 RMIN (DM Od6, 300 N1Ht)
8 = 1.24 (s, 9H), 2,21 (s, 311). 6,90 (d, 1H), 7,11 (dd, 1H), 7,50 (m, 3H),
7.64 (dd, 1H),
7,68 (td, 1H), 9,55 (s,1H).
PREP.1R;ATIO\
\-1 2-iodo-3-ch1 oro-4-chloro-phénol 3 (1,1-<liméth~ léth~ I nesulfonaIn ide
~~hcc~ : ,Iidc hci~rc
Rcn~Icn~cu~ ` (,5
i- 1 1S C
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
92
PREY_1RATIO1
N-[2-iodo-6-fluorn-phényl]-3-(1,1-diméthyféthy1) 1)efLènesnlf(lnarnide
~~hcct : >~~lid hl~ulc;
Rcndcmct~t ~ O~~r
l-= 1'33'C
F:XEI\[PLE 103
Acide 4-[~R.S)-hydroxy[1-[[3-(1,1-di niétliyléthyl)phényl]sulfonyl]-5-
(terbutyl)-
1H-indol-2-yl yméthyI]benzoïque, méthyl ester
En opérant de façon analogue à l'exemple 30 au départ du composé de la
préparation XL et de l'acide 4-(1-hydroxy-2-propynyl) benzoïque, on a obtenu
le
composé attendu sous la forme d'une huile marron (rendement = 40 %).
'H RMN (DMSOd6, 300 MHz)
6 = 1,15 (s, 9H), 1,26 (s, 9H), 3,85 (s, 3H), 6,34 (d, 1H), 6,44 (d, 1H), 6,56
(s, 1H),
7,39 (dd, 1H), 7,45 (t, 1H), 7,49 (m, 3H), 7,65 (m, 2H), 7,74 (t, 1H), 7,93
(m, 3H).
EXEMPLE 104
Acide 4-[(RS)-hydroxy[1-[[3-(1,1-diméthyléthyl)phényi]sulfonyl]-5-(bromo)-1H-
indol-2-yl]méthyl]benzoïque, méthyl ester
En opérant de façon analogue à l'exemple 30 au départ du composé de la
préparation XLI, on a obtenu le composé attendu sous la forme d'un solide
marron
(rendement = 77 %).
'H RMN (DMSOd,,. 300 MHz)
ô= 1,19 (s, 9I1). 3.S5 (,. 3tl), 6,48 (in. H), (1,60 (d, 1H), 7,46 (m, 2H),
7,50 (d, 2H),
7,66 (dt, 1H), 7,72 (dt, 111), 7,79 (d, I l-{ ), 7,83 (t, 1H), 7,94 (d, 2H),
7, )S (d, 1H).
F.li,"A1PI E; 1()
acide ! j R',) h~droz~[1 j3- 1,1 dinréth~léth~l)phén~ljsulfon~Ij -iIFilluorol
f1uoro lf1-indoI-2-~I jmétlrvIjhenzoïyue, méthyl ester
3O [ii dune du tauon ~uuduuuc u l'cycmhlc 3O au clch,ut du L inht?~c du di
lr~h<ir~~li<,u \I !I. cul a oI,icuu le uticuclu. Suu,, 1a f~rnlc d'une huile
Luiiiu
rcnclc~ucru = ~U'r ).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
93
6 = 1,21 H. OIli. 3.y(~ H. 3 tl), 0.47 (cl. 1H), 6,56 (d, 111), 6.0 (s, IH),
7,50 (nu. 31 {).
7,77 ((ri. 211). 7.9-1 (c1, 311), tif 1 in, 2H).
l"XE IPLF.106
Acide 4-1 (R.S)-h'droxN[1-[[3-(1.1-diméthyléth%l)phcnvl]sulft~nv11-5-(methv1)-
11I-
indol-2-yl]méthN l1henzoïytic, méthyl ester
En opénint de façon analogue 3 1'cyemple 30 au départ du c~~tnp<~~r de la
préparation XLIII, on a obtenu le composé attendu sous la forme d'une huile
jaune
(rendement = 38 %).
'H RMN (DMSOd6, 300 MHz)
6 = 1,17 (s, 9H), 2,31 (s, 3H), 3,85 (s, 3H), 6,37 (s large, IH), 6,45 (s
large, 1H), 6,52
(s, IH), 7,13 (dd, 1H), 7,30 (s, 1H), 7,44 (t, 1H), 7,50 (d, 2H), 7,61 (td,
IH), 7,67 (td,
1H), 7,78 (t, 1H), 7,88 (d, 1H), 7,93 (d, 2H).
EXEMPLE 107
Acide 4-[(RS)-hydroxy[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-4-(chloro)-5-
(chloro)-1H-indol-2-yl]méthyl]benzd que, méthyl ester
En opérant de façon analogue à l'exemple 30 au départ du composé de la
préparation XLIV, on a obtenu le composé attendu sous la forme d'une huile
jaune
(rendement = 85 %).
'H RMN (DMSOd6, 300 MHz)
5 = 1.20 (s, 9H), 3,86 (s, 3H), 6,48 (d, 1H), 6,57 (s, 1H), 6,62 (d, IH), 7,52
(m, 4H),
7.66 ('tai, 1 EI), 7,74 (td, 1H), 7,84 (t, IH), 7,94 (d, 2H), 8,04 (d, IH).
EXEMPLE 108
acide 3 ((l lf3 (1,1 diméth~léth~I)hhémIJsull'on~If ltcrhttt~l)-III indol2-
~I~mcth~l)henz~üyue, nHéthrI ester
L:u )I)él llll de (~iç~n anal,<~ue I I eyenmpple 31 au ((éhari glu comup tié
de
hcyemnl?Ic 103. (u a obtenu le r~~rn1~o é attendu ()tl" l'urine d'une Iulilc
ranime
3f) i rendement _ 73 `H ).
11 R~l\ (1)~1HOd,,. 41 (1 NI11/
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
94
S = 1,13 (,. 1)I-11. 1.77 t,. ")I 1). 7.x-1 (,,31l). 4.-15 N, 211). OAO s,
1H), 7,35 t1. 211),
7.71) t ( I é . I l l ) , 7.44 (t. 111 ). 7.-17 (d, 1H), 7,57 (td, 1H), 7,5~
(d, 1H), 7,67 (td, 1 H),
T S() (1. -11). 7.1)6 (d, 1H).
EXL\IPLE 109
Acide dimétl7~léthN I)phény 1]sulfonyl]-5-(bromo)-11l-indol-2-
[Jmét1i' I Ibenzoïyue, méthv l ester
En opérant de façon analogue ü 1'czcutp1e 31 au départ du composé de
l'exemple 104, on a obtenu le composé attendu sous forme d'une huile incolore
(rendement = 24 %).
'H RMN (DMSOd6, 300 MHz)
5 = 1,18 (s, 9H), 3,85 (s, 3H), 4,49 (s, 2H), 6,43 (s, 1H), 7,36 (d, 2H), 7,47
(m, 2H),
7,59 (dd, 1H), 7,66 (t, 1H), 7,72 (dd, 1H), 7,74 (d, 1H), 7,91 (d, 2H), 8,00
(d, 1H).
EXEMPLE 110
Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluoro)-6-fluoro-1H-
indol-2-yl]méthyl]benzoïque, méthyl ester
En opérant de façon analogue à l'exemple 31 au départ du composé de
l'exemple 105, on a obtenu le composé attendu sous forme d'une huile incolore
(rendement = 48 %).
'H RMN (DMSOd6, 400 MHz)
5 = 1,20 (s, 9H), 3,85 (s, 3H), 4.49 (s, 2H), 6,57 (s, 1H), 7,34 (d, 2H), 7,49
(t, 1H),
7,67 (d, 1H), 7,75 (m, 2H), 7,90 (d, 2H), 8,01 (d, 1H), 8,09 (d, 1H).
I2XEMMPI,E, 111
Acide 4-[[t-113-1,l-([iméttnléthNI)phényIl ulfon~l~ (m2th~[)-1// indu[
~ Ij-néthi 111)en/oï(lue, méth~ l ester
[:n (yér,u1t de I,tLon anal eu~ ïi l'c~cnihl< 31 mi d~2I),ui du conipo=c de
l e.~euihle 170. on a >htcnu le crn~hn~é attendu =oii. I~>rnie d'une huile
jaune
(rendement = 77
11 R\I\ tf)\i Od.. 7117 \1I1r)
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
1,16 (,. )II). 2.32 (,. 3H), 3.5 (.;. 311). -1.45 (,,'I1). 6,11 (>. 111), T13
((I(i. 111),
7,27 (s, 1H), 7.3( H. 211), 7,43 (t. 1h1,). 7,54 f t(i, 1 I1), 7,(i3 (t, 11U,
7,(>> (H, 1H),
(m. 3H).
5 EXEMPLE 112
Acide 4-[[1-1]3-(I,1-(Iiméth>létm 1)phényl]sulfon~1]--I-(chlor0)5-(chloro)-1H-
indol-2-yljniéth~l]henzcüquue, tnéth~l ester
En opérant de Maçon analoocue 1'eyernple 31 au départ du composé de
l'exemple 107, on a obtenu le composé attendu sous forme d'une huile incolore
10 (rendement = 65 %).
1H RMN (DMSOd6, 400 MHz)
S = 1,19 (s, 9H), 3,85 (s, 3H), 4,53 (s, 2H), 6,57 (s, 1H), 7,37 (d, 2H), 7,47
(t, 1H),
7,55 (d, IH), 7,59 (td, 1H), 7,69 (t, 1H), 7,74 (td, 1H), 7,90 (d, 2H), 8,06
(d, 1H).
15 EXEMPLE 113
Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-7-fluors-lH-indol-2-
yl]méthyl]benzoque, méthyl ester
En opérant de façon analogue à l'exemple 30 au départ du composé de la
préparation XLV, on a obtenu l'acide 4-[(RS)-hydroxy[1-[[3-(1,1-diméthyléthyl)-
20 phényl]sulfonyl]-6-(fluoro)-lH-indol-2-yl]méthyl]benzoïque, méthyl ester
qui est
engagé sans purification dans l'étape suit suite.
En opérant de façon analogue z l'crempple 31, on a obtenu le composé attendu
sous Carme d'une huile planche (rendement = 47 %).
Ill RHIN (D\ISOtI,,. 40() N1Ht)
25 6 = 1.1 i (,. 1)[1), 3,S5 4.55 (s, 2H), 6,61 (s 1 H), 7,06 (dd, 1H), 7,21
(i.
1 1 I ) . 7.')5 (d, 1H), 7,41 L 21 i ). 7,44 (t, 1H), 7,48 (d, 111), 7,62 (s,
1H), 7,70 (dt. 111).
7.t), H. 2H).
l:AF,1II'I.h; 114
30 :Acide t ] (1 ] ] 3 (1 nid h~ léth~ l )phén~ l ~sull'on~ l ]
(Irilluor~~mcth~ l l Ill indol
Ijméth~ I jhen/oï(lue
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
96
1)11 ~~hcrant de fucou ~inalocnc ~'t u 1L[ di1hart dui c<~n~17~~sé de
l'cycrnplc 1O~. con a o1)tcnu le produit nttcn(In pou; forme d un ~olidc hlnnc
F = 1() '.
l: l',11PLE 115
Acide 4-[[1-[[3-(1-méthyléthyl)phényl]sulfony`l]-5-(pyrrolidin)-1H-indol- 2-
' (jniéthy l jbenzo que, méthy l ester
A unu solution de 260 mg (0,48 mM) d'acide 4-[[1-[[3-(1,1-
dirncth} lcthyl)phényl]sulfonyl]-5-(bromo)-1H-indol-2-yl]méthyl]benzoïque
méthyl
ester obtenu à l'exemple 109 et de 200 mL (2,41 mM) de pyrrolidine dans 10 mL
de
toluène ont été additionnés 204,22 mg (0,96 mM) de potassium phosphate
tribasique,
14,36 mg (0,05 mM) de 2-(di-tert-butylphosphino)biphényl, 44,05 mg (0,05 mM)
de
Pd2(dba)3. Le mélange réactionnel a été chauffé 1 heure à 100 C dans un
appareil à
micro-onde, puis dilué dans 50 mL d'HCl (1N) et extrait deux fois par 100 mL
d'acétate d'éthyle. Les phases organiques réunies ont été séchées sur sulfate
de
magnésium et évaporées sous pression réduite. Le résidu a été purifié par
chromatographie sur gel de silice en éluant par un mélange cyclohexane /
acétate
d'éthyle (95/5 ; v/v) puis (80/20 ; v/v). Les fractions contenant le produit
attendu ont
été réunies et concentrées à sec sous pression réduite pour donner 40 mg
d'acide 4-
[[1-[[3-(1-méthyléthyl)phényl]sulfonyl]-5-( pyrrolidin)-1H-indol-2-yl]méthyl]
benzoïque, méthyl ester sous la forme d'une pâte incolore (rendement = 15 %).
'H RMN (DMSOd6, 300 ML{r_)
5 = 1,17 (. 1) l { ). 1793 (in, 411), 3,17 (m, 4H), 3,84 (s, 3H), 4,41 (s,
2H), 6,32 (s, I H),
6,50 (d, 1H), 6,59 (dd, 111). 7,36 (d, 2H), 7,42 (t, 1H), 7,50 (dd, 1H), 7,61
(t, 1H),
7,67 (d, 1H), 7,81 (d. 111). 7.x)0 (d, 2H).
h.,lh,I\IPLFI 1lô
Acide 1 ~ j 1-~ ( 3 t l-méth~ lcth~ l )phén~ l~suifon' I j (p~ rrolidin l 111-
indul 2-
2O ~ l )nréth~ l ben üyue
Lin ohcr~un pic iLicou analu1 cycinhlc Diu clupuit glu c0iuh~~,c de
I cycnnhlc 1 15. on u ohtci i le p[odL it aaciidu >ou~ Carine A une l)ondre
hcicc
(Iciiduiricn1 = 7 1. t ).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
97
F = 90 C.
hiEJIPI.F. 117
Acide 4-111- [1341.1-diméth léth~l)plié nJf sulfonyl]-5-(triflu0ro)-6-fluor0-
1H-
indol-2-yl]rnéth~ I Ibenzoique.
En opérant de thiçorr ~inat~ apte 3 l'exemple 2, aiu départ du co npo,,é de
l example 110, on a uhtenu le produit attendu wUS forme d'une poudre blanche
(rendcnlcnt =
F= 1-15-'C.
EXEMPLE 118
Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(méthyi)-1H-ïndol-2-
yl]méthyl]benzoïque
En opérant de façon analogue à l'exemple 2, au départ du composé de
l'exemple 111, on a obtenu le produit attendu sous forme d'une poudre beige
(rendement = 24 %).
F = 161 C.
EXEMPLE 119
Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-4-(chloro)-5-(chloro)-1H-
indol-2-yl] mé t hyl]benzoïque.
Fn opérant de façon analogue à l'exemple 2, au départ du composé de
l'exemple 1 l2, on a obtenu le produit attendu soin forme d'une poudre blanche
(rendement = 61
1- C.
En opérant de fny ni ,analocuc l'crcnnple 1.', Diu ([cp;ui Diu chlorure du
ddcr iv 2
sull~u~lé <rre pond~ult et du coinpo 6 de la prépar~itiou VII, on I ~hienu le
c~>mp(,c~ <le> exau plu . ci apr<
Ott hi\Fi\I111J; 120
Acide -1-I 1 (i (~ rnéthos~ -3 p. ridin~ l 15ulfon~ I t riiluorométh~ I i J Il
indol 2
~ I f mclhcI ~benz~~ïque
~~h~'el : pute h<i ae
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
98
Ren~lcmcnl = 13 `;
Il -1 R11\ (D\ISOJI,,. 251) Ml 1z)
~) = (,. 311 ). 4.54 (:, 2l {). 0.(2 (,. 111), 6.87 (d, 1H), 7,32 (d, 2H),
7,65 (dd, IH),
7,86 (d, 211), 7,9~ 1 s, 111), 7,99 (dd, 111), 8,27 (d, IH). S.6(6 (d, IH).
l~,~h,JII'i,1 121
Acide 4-[[ 1-[4-chloro-3-rnéth}1-phén)lsulf'on~11-5-(trifluoro miéttiyl)-1H-
indol-2-
~ 1]méthv1 [benzoïque
\,pect : Pâle I)CiuIc
Relldcineilt : 22 %
'H RMN (DMSOd6, 250 MHz)
8 = 2,25 (s, 3H), 4,53 (s, 2H), 6,67 (s, 1H), 7,31 (d, 2H), 7,55 (d, 1H), 7,63
(m, 2H),
7,72 (d, 1H), 7,87 (d, 2H), 7,98 (d, 1H), 8,24(d, IH).
EXEMPLE 122
Acide 4-[[1-[benzofuran-2-sulfonyl]-5-(trilluorométhyl)-1H-indol-2-
yl]méthyl]benzo7que
Aspect : pâte beige
Rendement : 10 %
'H RMN (DMSOd6, 250 MHz)
5 = 4,56 (s, 2H), 6,69 (s, IH), 7,35 (d, 2H), 7,39 (dd, 1H), 7,54 (t, 1H),
7,60 (d, 1H),
7,72 (t, 2H), 7,86 (d, 2H), 7,94(d, 1H), 8.01 (s,1H), 8.23 (d, 1H).
l;.l"F.1iPI,l{ 123
Acide 4-[[1-[4-propoxy-phénylsuilfond]-5-(triflhlnrométhyyl)-1H-indol-2-
~ 1)méthv 1 (benzoïque
A,h~c(: 1p<i(c hci~~e
Rend<ï lcnl
11 R\1~ i D\ISO~I,,, 25H ~111r1
(~ = U.~)3 (t. _ 111. 1.( I,~~ht. 211i. 3.~?6 (t. 2II I. (.fil ~,. 21 H. (,.55
(.. 1111. 7.()0 J. 2I{).
33 (cl. 2I1~. 2.(~3 J. Ili). 7,74 rai, 211). -.~M l. 211). 2,93 e 111), 8,2.-
1 ~d, 111),
12.201, lare. 1l13.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
99
EXI i1PLE 124
\ci(Ie -1-[(1-13-chIoro-4-difluorométhoxEv-phén.Isnlion,%l~ (trifluoruméth~l)-
1II-in(lol-2-yI Iméthy l Jbenzoïque
\,j cet : pile. hci`ne
Rciidcmcni: 10
'H 1\1.\ (D\ISOd,,. ?50 MHz)
6 = 4,54 (,,. 211), 6,70 N. 111), 7,32 (d, 2H), 7,38 (t, 1H), 7,43 (d, 1H),
7,66 (d, 111),
7,80 (d, 1H), 7,87 (d, 2H), 7.1)O (dd, 1H), 8,00 (s, 1H), 8,26(d, 1H), 12,82
(s 1ar~c,
1 H).
EXEMPLE 125
Acide 4-[[1-[4- éthyl-3-oxo-3,4-dihydro-2H-benzo[1,4]oxazine-6-sulfonyl]-5-
(trifluorométhyl)-1H-iindol-2-yl] méthyl]benzoïq ue
Aspect : pâte beige
Rendement : 23 %
'H RMN (DMSOd6, 250 MHz)
ô = 3,19 (s, 3H), 4,53 (s, 2H), 4,73 (s, 2H), 6,62 (s, 1H), 7,05 (d, 1H), 7,31
(m, 3H),
7,40 (dd, 1H), 7,65 (dd, 1H), 7,85 (d, 2H), 7,97 (s, 1H), 8,31 (d, 1H).
EXEMPLE 126
Acide 4-[[1-[3-difluorométhylsulfanyl-phénylsulfOnyl]-5-(trifluorométhyl)-1H-
indol-2-yl]méthyl I be nui i que
\ pcct : pâte hci tUle
Rcudcmcnt :
'I1 R\1\ (D11SOd,. 220 MI Ii)
cS = 1.51 (,. 211 ). 6,64 (s, 111), 7,31 (d, 2H), 7,63 (m, 211). 7.97 (m.
511), 7,65 (dd, 1H),
7,98 (s, 111). 1H).
EXIL 1P1.I; 127
~O Acide 4-111-14 -isol)utoxy -1) 11 é11 I1s 11fo n~ l~ triIltioronnéth%l)-III-
indOl-2-
~ I jméth~ I II)CIlzo,i(itie
\~1~cr(I ~ Il(C hcimc
Rcucirntcnt : 22 `
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
100
1IR,~i (D\15Odi,,. 25)) \1112)
i = 0.) (d. 6I l ). 15() î 1 II), 3,77 (d, 2H), 4,51 (s, 211), 6.55 (s, 1H),
7,00 (d, 2H),
7,33 (d, 2H), 7.O_3 (d, 1H), 7,75 (d, 2H), 7,88 (d, 2H), 1,95 (s, 1H), 8,24
(d, 1H),
12,87 (s large, 111).
I:l.III'I,1'. 128
Acide 4-[(I-(4-(3-méthy1-butNI)-plié nvlsulfnnvl1-5-{I rifluorométhyl)-1H-
indol-2-
yl]niéthvl Jhenzoïque
~pect : pâte hcille
Rendement : 33 `;
'Il RMN (DMSOd6, 250 MHz)
8 = 0,86 (d, 6H), 1,41 (m, 3H), 2,59 (m, 2H), 4,51 (s, 2H), 6,57 (s, 1H), 7,32
(d, 2H),
7,34 (d, 2H), 7,63 (d, 1H), 7,71 (d, 2H), 7,87 (d, 2H), 7,96 (s, 1H), 8,24 (d,
1H),
12,75 (s large, 1H).
EXEMPLE 129
Acide 4-[[1-[4-(morpholine-4-carbonyi)benzenesulfonyl]-5-(trifluorométhyl)-1H-
indol-2-yl]méthyl]benzoïque
Aspect : pâte beige
Rendement : 9 %
'H RMN (DMSOd6, 250 MHz)
d = 3,41 (m, 8H), 4,53 (s, 2H), 6,63 (s, I H), 7,35 (d, 2H), 7,54 (d, 2H),
7,65 (dd, 1H),
7,87 (m, 4H), 7,98 (s, 1H), 8,26 (d, 1H), 12,87 (s larrc, IH).
h; _l"1~;1IPf,h; 1311
_lcide -I-[(1-[(0-plie il ox%-3-hy ridinvl)sulfnntf]-5-)trifIuorométhvlI-lH-
indol-2-
vl [méthvI )henzuüque
~~p 'ct : (~St hct~ c
Il RW\ D 1 O~1,,. 5H) v1l1/)
5 _ 1.53 H, 2Il). (,.(,I ):. W. '.O5 tci. 1111, 7,1C? r(i. 21I). 7 )t. 11[).
T.)-f (d. 211).
(tel. , 1 I ) . '.C~.) < < l c i . 1 lit. 7.-~ ( ~ i . ' 11), 7,99 (s, 111).
b,19 (dd, 111). (ci. 1 i l ).
.(~ 15. III). L.WHIWH'. Ili).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
101
I;XEI\II'LF. 131
Acide 3 ~ ~ 1 J 1 (3.5-dieu the l pti rur~~l 1-y l) phénv1 titt~~n~ I -
(trifluor~~méth~ 1)-
lII-indo1-2-% I Jméthy 1]benzüque
\,hcct : hâte hcir~
Rcn(icnucnt : 21
'H R 1 {Dl1SOc1,,. '5O MZlz)
S = 2,16 (s, 3H), 2.34 (,,. 311), 4,53 (s, 2H), 6,13 (s, 1H), 6,58 (s, 1H),
7,36 (d, 2H),
7,66 (dd, 1H), 7,70 (d, i 11), 7,91 (m, 4H), 7,98 (s, 1H), 8,27 (d, 1H).
I'XI;`I1'LE 132
Acide 4-[[1-[(3,4-dihydro-2,2-diméthyl-2H-1-benzopyran-6-yl)sulfonyl]-5-
(trifluorométhyl)-1H-indol-2-yl]methyl] benzoïque
Aspect : pâte beige
Rendement : 19 %
tH RMN (DMSOd6, 250 MHz)
5 = 1,24 (s, 6H), 1,71 (t, 2H), 2,64 (t, 2H), 4,52 (s, 2H), 6,61 (s, IH), 6,76
(d, 1H),
7,29 (d, 2H), 7,45 (s, 1H), 7,49 (dd, 1H), 7,62 (dd, 1H), 7,86 (d, 2H), 7,97
(s, 1H),
8,24 (d, 1H), 12,63 (s large, 1H).
EXEMPLE 133
Acide 4-[[1-[4-éthyl-phénylsulfonyl]-5-(trifluorométhyl)-1H-indol-2-
yl]nméth~I]benz(îïque
~shert : hûtc hcinc
Rendement : ' 1 `~
'11R~IV'(1)L1S25ûMHz)
c = 1,12 (1. 311). '.6' i y. 2H). 1.51 (s, 2H). 6>6 (. 111), 7.3' (d. 211).
7.35 (d. 211).
7.6 3 (del. 111). 7.73 (d, '111. 7.5e (4. 2H), 7,95 (,. 111). S.'-1 H. 111).
1_'.(5
111).
3O I' N1:i\IYLh. 134
Acide 4 J J 1-(1 méth~ lphén~ I).tinlt'un~ 1 j 3 (t~ if1u~>r~~m~ l) 111 indol
_'
c~th
I J 11' h~ I Jbenz~üqu.t
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
102
Rcndcnicnt : ~Q 'r
'1[ R~1\ (D\1SOcl,,. 250 \ll1i)
2 21H), 7,33 (dd, 4H), 7,62 (dd, III), 7,72 (d, 2H),
7,88 (d. 2l1 7,94 (s, 1H), 8,23 (d, 1H), 12,60 (s 1 arec, 1H).
11XItMPLI 135
Acide -4-111-116-(4-morpholin'1)-3-pyridin~1
~sulfi~nyl]- -(trit1uortméthyl)-1I-
indol-2-y'1lméth% l]benzoique
Aspect : p2tc beige
Rendement : 20 %
'H RMN (DMSOd6, 250 MHz)
6 = 3,60 (m, 8H), 4,53 (s, 2H), 6,57 (s, 1H), 6,75 (d, 1H), 7,32 (d, 2H), 7,63
(dd, 1H),
7,74 (dd, 1H), 7,88 (d, 2H), 7,96 (s, 1H), 8,25 (d, 1H), 8,47 (d, 1H), 12,82
(s large,
1 H).
EXEMPLE 136
Acide 4-[[1-[4-chloro-phénylsulfonyl]-5-(trifluorométhyl)-1H-indol-2-
yl]méthyl]benzaïque
Aspect : pâte beige
Rendement : 22 %
'H RMN (DMSOd6, 250 MHz)
6 = 4,50 (s, 2H), 6,60 (s, 1H), 7,33 (d, 2H), 7.59 (d, 2H), 7,64 (dd, 1H),
7,83 (d, 2H),
7,87 (d, 2H), 7,98 (s, 1H), 8,23 (d, 1H), 12,86 (s laiL-c. III).
h.XFF~'Ail'LE 137
Acide [(1 f fltioro-phén~ lsulfon~ l] (trifluoromëth~ I1-1 Tl indol ?-
~I ~[néthy I ~hentOüduc
\~hcat : pSIc hci~~
Rcn~1c>>>crIt : ~ <
~'S .(,1t(1(1, 111), 7.~r~tn~. lllr. ;,97(x, lFli.
5.22 (2. 110. 12.x.> 1 H ]arec. 1 11.).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
103
EYE\IPLE 138
Acide 1 ([1 [ mélh~~x~ phény1s~iIton~1J (trifluor't~iuéth~l ll -indol-2-
~ 1jméth~ lJb(nzuïduÃ
A',j1cct : 1~[ilc h~i~~e
Rcn~ic ment : 10
'HR\l\ (1).%ism . 2 () \1111)
8 = 3, 79 (s. 3H), 4,51 t,,, -I1). 6.53 (s. 1H), 7,02 (d, 2H), 7,33 (d, 2H),
7.()3 ld, 1H),
7,77 (d, 2H), 7,88 (d, 2H), 7,94 (s. 1 H), 8,25 (d, 1H), 12,94 (s large, 1H).
EXEMPLE 139
Acide 4-[[1-[4-propyl-phénylsulfonyl]-5-(trifluorométhyl)-1H-indol-2-
yl]méthyl]benzoïque
Aspect : pâte beige
Rendement : 37 %
'H RMN (DMSOd6, 500 MHz)
S = 0,83 (t, 3H), 1,52 (m, 2H), 2,56 (t, 2H), 4,51 (s, 2H), 6,56 (s, 1H), 7,31
(d, 2H),
7,34 (d, 2H), 7,63 (dd, 1H), 7,72 (d, 2H), 7,88 (d, 2H), 7,96 (s, 1H), 8,24
(d, 1H).
EXEMPLE 140
Acide 4-[[1-[4-pentyl-benzeénesulfonyl]-5-(trifluorométhyl)-1H-indol-2-
yl]méthyl]benzoïque
Aspe t : pâte beige
Rciidcmcnt : 23 %
'H R \IN (DMSOd6, 500 TI-Ii)
8 = 0,82 (l. 3I1). 1,19 (ni. 7H), 1,25 (m, 2H), 1.50 (m, 2H), 2,58 (t, 2H),
4,51 (s. -'I1),
6.56 (s, 111). 7.37 (cl. 711). 7.34 (d, 2H), 7,6" r,1J. 1H), 7,72 (d, 2H).
71I),
7(J. 11 U.
I:XI:~IPLh: 1.11
Acide 1 ((1 j(3 nactli~lphén~llsult~~n~l(~ (tnu uOu t~éth~I) 1N ind~~l 2-
v1jnléthvIJh(fli I(IuC
~~[?ccl pale 1~C1~C
l~cndcmcut : 1 ` ri
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
104
lI R\1\ (D\ISO(d,,, 5O0 \III/)
)11). 2(>.(~_> (,,, 1H), 7.34 o l 711). 7,42 (t, 1H), 7,50 (dd, 2H),
7,63 (d, '11), 7,S (d, 2H), 7,97 (s, 111), S,23 (d, l 11
).
h;XEMPI E 142
Acide I (~ 1 [~ tr'illuorométhor~ htrén~ ls~ilhon~ 1]-5-(tri[luorométh~ I)-1~#-
indol 2-
~1]rnéth0]benzoïque
Aspect : hâte hL~i,1c
Rendement : 21 %
'H RMN (D;\,ISO&, 500 MHz)
6 = 4,51 (s, 21-1), 6,62 (s, 1H), 7,31 (d, 2H), 7,49 (d, 2H), 7,66 (dd, 1H),
7,86 (d, 2H),
7,96 (d, 2H), 7,99 (s, 1H), 8,25 (d, 1H).
EXEMPLE 143
Acide 4-[[1-[3-chloro-phénylsulfonyl]-5-(trifluorométhyl)-1H-indol-2-
yl]méthyl]
benzoïque
Aspect : pâte beige
Rendement : 20 %
'H RMN (DMSOd6, 500 MHz)
8 = 4,54 (s, 2H), 6,71 (s, 1H), 7,33 (d, 2H), 7,56 (t, 1H), 7,63 (t, 1H), 7,66
(dd, 1H),
7,75 (dd, 1H), 7,79 (dd, 1H), 7,89 (d, 2H), 8,00 (s, 1H), 8,24 (d, 1H).
EXEMPLE 144
Acide 4-ff1-[4-phénoxy-phénvlsurlfonyl]-5-( tr-illuorométhyl)-1H-indol-2-
3l1niéth~1) benz(ü(lue
A~hcct : hile 1 i~~c
1Zcn~len:~ nt : 1-1
I1 R\1N (D\ISC)~1,,. ~Ol) \111>>
t = ~.~O (~. 711). f,.~~ 111). H. 711). 7,17 H. 711). 7.75 (t. 111).
2O 7.45 i (1. 111). 7.47 (d. 111). I I I ). 7.7 5 (0 7I I ). 7.5,5 l. 7I1).
~.~) 7 (,. I [ 1).
5.71 H. 111).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
105
h;X1~:1IP1,1~ 145
acide l [[1 ~3 triflurrrométhOv,~ -phéFNlSulfofl l1-5-~trifluoron1éth%Ij-1H-
indol-2-
~1)méthy1]be11zrüduC
iZC11(1~l1TCNt : 22
'H R\1\ (DMSOd6, 500 MHz)
5 = 4,53 (s, 2H), 6,67 (s, 1H), 7-13 (d. 2H), 7,68 (m, 4H), 7,87 (d, 3H), 7,99
(,~. 11-1),
8,25 (d, 1H).
EXEMPLE 146
Acide 4-[[l-[4'-chloro-biphényl-3-sulfonyl]-5-(trifluorométhyl)-1H-indol-2-yl]
méthyl]benzoïque
Aspect : pâte beige
Rendement : 10 %
'H RMN (DMSOd6, 250 MHz)
6 = 4,56 (s, 2H), 6,65 (s, 1H), 7,33 (d, 2H), 7,53 (d, 2H), 7,62 (d, 2H), 7,65
(dd, 2H),
7,78 (dd, 1H), 7,85 (d, 2H), 7,98 (m, 3H), 8,28 (d, 1H).
EXEMPLE 147
Acide 4-[[l-[4-chloro-3-difluorométhoxy-phénylsulfonyl]-5-(trifluorométhyl)-
1H-indol-2-yl] méthyl]benzoïque
Aspect : pâte beige
Rendement : 9 %
'H RMN (D N I S Od6, 250 MHz)
6 = 4.50 (~. 1111. 6,63 (s, 1H). 7.32 (d, 2H), 7.38 (t. 1H), 7,65 (m, 2H),
7,79 (d, 2H),
7,87 t (l, 211). î,c)I) (s, 111). 8. ~ ~(d. } 1I). 1
PR1 PAR T1O\ 51.A 1
lcirie 1 ll3 tluuro 5-t ritluor~~mÉ~th~1) lll-inclut 2 ~l~mêth~f~henzoïrlue,
nréth~l
;i) etiter
1 nl~l i et c~~tcr ~ah(cnu ~Ci~~n la hrd~~arati~~i~ I Il chai, 50
n?I_ ~I ,iCdt<~nitLilC ~nt 1i2 <tdciitioiind~ à ti I . ~ ~.(Li (n A1(<1~ 1
Clil~~r~~n~dtl~~ l
tJc<<>>~>-L.-) cIi.,/~)niahiC~.c(~,l =.2,,j~~Clutlc hi~i:dtra)lu~,1Lih~,rutc).
Ld ~ndl,ulLL
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
106
réactïonncl a été .1<<itc nI tcinp2iattu~ anlhiw lie pendant 20 hclue;. huis
dilue clam de
l'eau et cstrnit par de l'ncélatc d'cthv le. 1_a pha,c organiyuc a cté lav éc
rtv cc rire
,olutiort dIIC~I (1 N) huis A~iC I. Lcs I~ha,e< oi a~tic}ue, rcur1ïcn oit été
,échecs sur
,ullate de I icnc,iul~ et cv apurées son, pic~ion réduite. I c résidu a cté
purifia par
chromatocraphie sur gel de silice en Gluant par un mélange cwloheMine /
acétate
(i'cthylc (`J5/15 ; vlv). Le, fraction; contenant le produit attendu ont été
réunies est
concentrées à sec sous hreõion rcduitc pour donner 310 nie ale produit dc,iré
sons la
forme d'une poudre orange (rendement = 29 )
'H RMN (DMSOd,. 30() \111 z)
8 = 3,83 (s, 3H), 4,23 (s, 211), 7,40 (m, 3H), 7,49 (d, 1H), 7,85 (s, 1H),
7,93(d, 2H),
11,45 (s large, IH).
EXEMPLE 148
Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-3-fluoro-5-
(trifluorométhyl)-
1H-indol-2-yl]méthyl]-benzoïque, méthyl ester
En opérant de façon analogue à la préparation I, au départ du composé de la
préparation XLVI et du 3-ter-butyl phénylsulfonyl chloride, on a obtenu le
produit
attendu sous forme d'une huile jaune (rendement = 72 %).
'H RMN (DMSOd6, 400 MHz)
d = 1,18 (s, 9H), 3.84 (s, 3H), 4,54 (s, 2H), 7,32 (d, 2H), 7,42 (t, 1H), 7,52
(d, 1H),
7,59 (t, IH), 7,70 (d, 1H), 7,82 (d, 1H), 7,87 (d, 2H), 8,03 (s, IH), 8,38 (d,
1H).
EXEMPLE 149
Acide 4-[11-[[3-(1,1-diméth)-léthv-1)phényl]sulfonyl]-3-fluoro-5-
(trifluoronméthvl)-
1 H-hidol-2-.Ijméthyl]-benzoïque
Vil opérant (le façon au<tlorne à (c~entple ~. au départ du conlpo,d de
l'eyen~ple 14S. on a obtenu le ~~rocluit attendu soit, borine de ciktauy
jatnne,
(rcrtdentent = .30
1 15,E(
I~:n opér.u~t .clan !e mode opératoire de l'eyemple l', nul dcl,lrt cIu
compose
de la préparation \ 111 ci du ddi o 2 st il u1v le corresponriaut. on a
picparé les e_~e1nplc,
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
107
h;Xh.AIPL1:150
Acide -4-111- [3-chloro-.4-fluor-o-phény l.5u1fon I I-5-(rhloro)-11I-iii dol-2-
y1]Jnéthy l]
benzoïque
\spect : pïi[c hci ~c
Rcnclcn icnt : 7 '1
111 RNI\ (1)~IS()cl;, 250 MUI)
ô = 4.49 (s, 2H), 6,55 (s, 111), 7,31 (d, 2H), 7,35 (dd, IH), 7,55 (t, 1H),
7,65 (d, 1H),
7,81 (d, 2H), 7,87 (d, 2H), 8,05(d, 1H), 12,65 1H).
1? X h:MPLE 151
Acide 4-[[1-[biphényl-4-sulfonyl]-5-(chloro)-1H-indol-2-yl]méthyl]benzdique
Aspect : pâte beige
Rendement : 7 %
'H RMN (DMSOd6, 250 MHz)
S = 4,51 (s, 2H), 6,44 (s, 1H), 7,35 (d, 3H), 7,47 (m, 3H), 7,63 (dd, 2H),
7,67 (dd, 1H),
7,81 (m, 2H), 7,82 (d, 2H), 7,89 (d, 2H), 8,05(d, 1H), 12,84 (s large, 1H).
EXEMPLE 152
Acide 4-[[1-[4-propyl-phénylsulfonyl]-5-(chloro)-1H-indol-2-yl]méthyl]
benzoïque
Aspect : pâte beige
Rcnclcmcnt : 26 %
'H RMN (DMSOd6, 250 MHz)
c = 0,83 (t, 3H), 1,52 (m, 2H), 2.57 (t. 2H). 4.47 (s, 2H), 6,40 (s, 1H), 7,33
(dd, 5H),
7,60 (dd, 1H), 7,68 (d, 2H), 7,87 (d, 2I 1), x.07 (d, 1H), 12,85 (s laT C.
1H),
h.lh:~IPI.h. 1~3
Acide 4 ! l ~3 Iluoro t fluoro-Itlié n~N lsulfom l j-5-((hforo)-1II-ind4)1-2-
I jméthv I Jhcnioïquc
~~pcrt : p:itc hci~c
Rrnclemcnt : l t>
1-1 R\l\ I)\l~(>cl.,. 2 ~111
z
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
108
O=4,49(,. 2l 1). 6.49 (s, 111), 7.34 (m, 7,50) ((Ici, 1H), 7,63 (d, 1H), 7,70
(m, 1H),
7,82 (dd, 1H). 7,87 (d, 211). S5)5 ~(1. Il f1). 12 50 (, l,irgc. 111).
h.Yh:~IPI,E 154
lcide 4-[[I-[3-fluoro-phén.Isulfonc1J-5-(chloro)-IH-indol-2-)I]nnéthyl]
benzoïque
\sl)cct : p3tc 11cige
Rendement: 1 S %
'H RMN (1) \lSO(l,,, 250 \iliz)
8 = 4,49 (s, 211), 6,49 (s, 111), 7,34 (m, 3H), 7,58 (m, 5H), 7,88 (d, 2H),
8,03 (d, 1H),
12,80 (s large, 1H).
EXEMPLE 155
Acide 4-[[1-[4-ter-butyl-phénylsulfonyll-5-(chloro)-lH-indol-2-yllméthyl]
benzoïque
Aspect : pâte beige
Rendement : 21 %
'H RMN (DMSOd6, 250 MHz)
6 = 1,22 (s, 9H), 4,47 (s, 2H), 6,43 (s, 1H), 7,29 (d, 2H), 7,34 (dd, 1H),
7,51 (d, 2H),
7,64 (m, 3H), 7,85 (d, 2H), 8,06 (d, 1H), 12,89 (s large, 1H).
EXEMPLE 156
Acide 4-[[1-[4-trifluoromethoxy-phénylsulfonyll-5-(chloro)-lH-indol-2-yl]
niéthy I Ibenzoïque
\,1pcct : 1pSUc hci-c
R(~n(lr ncnt : 1() '
tl-1 R\I\)1)~15Od,. 25O \1Ifi)
8 1,-IL (~. 211), 0.40 (,. 111 7 r J. 211). 7.35 ((1d. 111). ï'11) ((J' .'11),
7,63 (d, 1H),
211). 7.0)1 çd, 11), 5,) l (6, 11[ ). 1 55 t 1,11 'c. 1 [1).
I:\I;\IPLI~ 157
`,ride 1 i l [ 12,3 dih~ dr~~ henzn~ 1.l~dio~ine O 5u1['un~ l) t chloro)-lH
indol 2 ~ I ~
méth~ l Ibenroïytic
\~1m(a : 111) f~ci~~c
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
109
RCHdCH1e(lt : 2$ `~~
H R\1\ (D ISOd 2$O :AH/)
4,25 (ni, -111), 1,4S '11), 0,44 (s, IH), 6.1)5 (d. 1l1). 7.118 (dd, 1H), 7,30
(m, 4H),
7,61 (d, 1H), 7,87 (d, 2-H), 8,03 (d, IH), 12,88 (s Iatgc. 111).
EXEMPLE 158
Acide 4-[[1-[4-trifluoro-phénylsulfonyl]-5-(chloro)-lH-indol-2-yl]méthyI]
benzoïque
Aspect : h2itc beige
Rendement : 11 %
'H RMN (DMSOd6, 250 MHz)
6 = 4,48 (s, 2H), 6,50 (s, 1H), 7,31 (d, 2H), 7,36 (dd, 1H), 7,64 (d, IH),
7,84 (d, 2H),
7,87 (d, 2H), 7,96 (d, 2H), 8,05 (d, 1H), 12,87 (s large, 1H).
EXEMPLE 159
Acide 4-[[1-[4-ethyl-phénylsulfonyl]-5-(chloro)-1H-indol-2-yl]méthyl]benzdïque
Aspect : pâte beige
Rendement : 24 %
'H RMN (DMSOd6, 250 MHz)
6 = 1,12 (t, 3H), 2,62 (q, 2H), 4,48 (s, 2H), 6,40 (s, 1H), 7,34 (m, 5H), 7,60
(dd, 1H),
7,69 (d, 2H), 7,87 (d, 2H), 8,03 (d, IH), 12,89 (s large, 1H).
EN I?.1MIPLE 160
Acide 4-[[1-[4-chloro-phénylsulfonyl]-5-(chloro)-1H-indol-2-y1]méthy1]
benzoïque
Ree&Ieiiien(: I () ';
tIl R~1\ (1)`1SOJ . 2$O , 111/)
t5 4.-i0 (~. 211). 6.J4 t,. 111). 7.3-1 (n1. 11)_ î.5k) un. 21 h. ;.~~(~ (~_I,
'Ii). 7.~5 nui. 21h.
O S.O2 (cl, Ille l'. ,) ( Ç.jr e. 1I ).
1 \1:11P1.1~. 161
Acide 4-1l5-Chlore-1-~(3-mcth%I1)hénlI)sulfonv1)-1II-indol-2-
)ljméth~1]henzoiigtic
~~p~ct : 1 2lc hei2e
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
110
Ren0Icinent : 24 `.z
11 RAI (I)\ISOLi,,. >>t) MIII/)
S = 6 (,H 311), I,-I~) (~,, 2I P. 6.46 (s, 1H), 7,34 (m, 3H), 7,42 (d, 1H),
7,48 (m, 2H),
7,55 glu. 111). 7,61 (d, 1H), 7,~S (d, 2H), 8,01 (d, 1H).
EXEMPLE 162
Acide 4-[[1-[4-isopropoxy-plié nNIsulfonyI]-5-(chloro)-1H-indo1-2-JI]filé
thyl]
henzoique
A"1pect : bite hei.ge
Reudcmciit : 6 %
'H RMN (DMSOd6, 250 MHz)
5 = 1,22 (s, 3H), 1,25 (s, 3H), 4,46 (s, 2H), 4,67 (m, 1H), 6,39 (s, 1H), 6,97
(d, 2H),
7,33 (m, 3H), 7,60 (d, 1H), 7,68 (d, 2H), 7,88 (d, 2H), 8,03 (d, 1H), 12,89 (s
large,
I H).
EXEMPLE 163
Acide 4-[[5-chloro-l-(2-naphthalénylsulfonyl)-1H-indol-2-yl]méthyl]benzoïque
Aspect : pâte beige
Rendement : 9 %
'H RMN (DMSOd6, 250 MHz)
3 = 4,56 (s, 2H), 6,43 (s, 1H), 7,32 (dd, 1H), 7,35 (d, 2H), 7,58 (d, 1H),
7,69 (m, 3H),
7,85 (d, 2H), 8,01 (t, 2H), 8,13 (t, 2H), 8,61(d, 1H), 12,86 (s large, 1H).
EXEMPLE 164
Acide 4-[[1-13-chloro-phénylsulfonyl]-5-(chlorol 1T7 indoI-2 ~I]mélh~l]
benzoïque
~~}~cct : 1?ülc h~i~~c
Rcnclcn~cr~t : 10
I1 R\I\ )I)\ISO~I,,. O \ilt/)
11H. -.33 W. 21I). (L1(1_ IH), 7.H tt. 11I). .O() ((. 11I).
6 (d, 111), 7,7~ tin, 11), r,~7 (d, 2,1I). S.63 ~d. 1I I). 1 2.`;7 11I).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
111
EX1: A1PI.I: 165
Acide 4-[[1-[4-méthoxy-phénylsult'onvl]- -(chlore)-1H-indol-Z I~méthyll
benzoïque
>1cil:p2lclci,fc
Rcrlclement : 5
tHR\IN (I)N1S()ci,,,250MHz)
t = 3,7v) (,,. 311), 4,47 (~. 211), 637 (s, 1H), 7,01 (d, 2H), 7,32 (dei, 1H),
7,34 (cl. 211),
7,58 (t1, I H). 7,74 (d, 2H), 7.39 (d, 2H), 8,03 (d, 1H), 12,89 (s lai e.
111).
EXEMPLE 166
Acide 4-[[1-[3-méthoxy-phénylsulfonyl]-5-(chloro)-1H-indoi-2-yi]méthyl]
benzoïque
Aspect : pâte beige
Rendement : 27 %
'H RMN (DMSOd6, 250 MHz)
à = 3,74 (s, 3H), 4,47 (s, 2H), 6,46 (s, 1H), 7,14 (t, 1H), 7,24 (ddd, 1H),
7,33 (m, 4H),
7,45 (t, 1H), 7,61 (d, 1H), 7,87 (d, 2H), 8,03 (d, 1H), 12,89 (s large, 1H).
EXEMPLE 167
Acide 4-[[1-[4-fluoro-phénylsulfonyl]-5-(chloro)-1H-indol-2-yl]méthyl]
benzoïque
Aspect : pâte beige
Rendement : 19 %
'H RMM1 1(D~iS( 250 MI-H)
3 = 4.47 (11. 211). 6.-i2 (>. 11-1). 7.47 (m, 5H), 7,61 (d, 1H), 7,90 (m.
211), S.03 (d, 1H),
12.5k) (. l,u ~c. l Ii).
LXI ~IPI,I[; 168
Acide 4-t 1 -chloro-1-1 f 4-) 1.1 dintcth~ lpropy I )phén~ l]~ull'on~ l]-I Il
indol '-
~1) IJ111 é1hvIf1) enioïgtie
IZrn~lcn~cm : I ) `~
'I1 11\1\ t 1)\l Od . 2 H X111 )
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
112
6 = 0,53 (1. 2t1), 1,18 (s, 613). 1.5(; (cl, 211). 4.46 '1h. (,.-13 ~;. 111),
7,29 (d, 2H),
7,34 (dd, 11h. 7,45 (d, 2H), 7,01 (d, 1H)). 7.66 (ai. 21-1). S.05 (d, 1H),
12,87 1H).
EX L \11'LE 169
1 c i cte 4-[[5-chloro-l-[(6-niét hoxy-3-py ridinyl)sulfonyl]-1F7-i ndol-2-
yl]méthyllhenzoque
Aspect: p<ite loci e
Rendement : 19 `.c
'H RMN (DMSOd6, 500 MHz)
6 = 3,88 (s. 3H), 4,50 (s, 2H), 6,46 (s, 1H), 6,88 (d, 1H), 7,33 (d, 2H), 7,34
(dd, 1H),
7,62 (d, 1H), 7,88 (d, 2H), 7,97 (dd, 1H), 8,06 (d, 1H), 8,63 (d, 1H), 12,90
(s large,
I H).
EXEMPLE 170
Acide 4-[[1-[4-pentyl-phénylsulfonyl]-5-(chloro)-1H-indol-2-yl]méthyl]
benzoïque
Aspect : pâte beige
Rendement : 10 %
'H RMN (DMSOd6, 500 MHz)
S = 0,82 (t, 3H), 1,23 (m, 4H), 1,51 (m, 2H), 2,58 (t, 2H), 4,46 (s, 2H), 6,39
(s, 1H),
7,33 (m, 5H), 7,59 (dd, 1H), 7,68 (d, 2H), 7,87 (d, 2H), 8,03 (d, 1H), 12,89
(s large,
I H).
l'..l" I', `iPLE 171
,\cide 4-(( -chlore 1-(( méth~iphén~l)sulfori lj-11f-indol-2-
~J1méthvl]henzoï(gtic
~~hec~t : 1 5jc hcipc
Rcndcnicnl : I U
11 RJI~) f)~IS(_ d,. 2 ) \111/)
..;}1). 1.4 II1) ,33 tn1. 511), 7,5 (cl, 1H), 7,6 H. 'l1),
f. 4 +cl. ,11). S.()' td, 1H), 1.~> I ( I:tte, 1H).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
113
h,YF,~1PL1: 172
Acide l-]] 1-[3' 17uoro hiphényl- Sulfon~'11 (chlore) iJJ ïnûol 2 \Ilméth~l]
benzoïque
~,hcrl : p c hci~c
RcnW nicnt : _'3
'H R!1 \ (1)\1SOd,,, 500 I111U
6 = 4.5I (. 211). 6,45 (s, 1H), 7.-',~ (in, 1H), 7,36 (m, 3H), 7,54 (m, 3H),
7,62 (dd,
l H). 7.1 (T un. 6H), 8,09(4, 1H), 12,90 (s large, I H).
EXEMPLE 173
Acide 4-[[5-chloro-1-[(3,4-dihydro-2,2-diméthyl-2H-1-benzopyran-7-yl)sulfonyl]-
1H-indol-2-yl]méthyl] -benzoïque
Aspect : pâte beige
Rendement : 17 %
'H RMN (DMSOd6, 500 MHz)
6 = 1,24 (s, 6H), 1,71 (t, 2H), 2,64 (t, 2H), 4,48 (s, 2H), 6,45 (s, 1H), 6,76
(d, IH),
7,31 (d, 2H), 7,32 (dd, 1H), 7,43 (m, 1H), 7,46 (dd, 1H), 7,61 (d, 1H), 7,87
(d, 2H),
8,04 (d, 1H), 12,90 (s large, 1H).
EXEMPLE 174
Acide 4-[[1-(1,3-benzodioxol-5-ylsulfonyl)-5-chloro-lH-indol-2-
yl]méthyl]benzoïque
Aspect : pâte beige
Rcn(lcmcnt : )0
11 1R\1\ ([)1C>ci,,. 50(0,111/)
21-1). (x.13 (;. 211). (,.-)2 (>. 1H). 7.OO (cl. 111). 7,11) (J. 1H), 7.32
((M, 111),
1i,35 J. 'M. 7.43 ( ti(i. 111). 7.00 (J. 111). ?.SI) J. 21-1). 5,O3 (d. 111).
12.5
1111.
3O 1,:AL:A11'L1,:175
Acide 4-115 -Ch loro-1-1 ) 0-phé1]ox~ -3-p ridin' I )sulfonv 1 ]-1II-in(lol-2-
1]meth's1Ihcnzoïqtic
l'en~icrnen(: 0
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
114
11 R\I\ tD\1SOd,.. 5OO \11Ii)
c3 1.-1c) r,, k1), (.-15 (,. 111). 73)S (dcd, 111), 7,16 (d. 211). 7,2.7 (t,
1H), 7,33 (dld. 1H),
7.35 td, 211), 7,44 (:cl. 711). 7.(>3 (d, 1H), 7,88 (d, 211), 8,05 (d, 1H),
8,15 (dd, 1H),
$.(4 (d, 111), 12,90 f, iar~~c, 1.H).
IYI~III'Ll; 176
acide 4-1(5-cliloro-l-(éthylsulfony'I)-1L1-indol-2-N 1]niéthyl]benzoïque
A~l)ect : p3te. hcige
Rendcment : 24 %
'H RMN (DMSOd6, 500 MHz)
6 = 1,04 (t, 3H), 3,47 (q, 2H), 4,38 (s, 2H), 6,34 (s, 2H), 7,32 (dd, 1H),
7,41 (d, 2H),
7,66 (d, 1H), 7,87 (d, 1H), 7,92 (d, 2H), 12,92 (s large, 1H).
EXEMPLE 177
Acide 4-[[1-[benzofuran-2-sulfonyl]-5-(chloro)-1H-indol-2-yl]méthyl]benzoïque
Aspect : pâte beige
Rendement : 6 %
'H RMN (DMSOd6, 250 MHz)
6 = 4,52 (s, 2H), 6,51 (s, 1H), 7,35 (d, 2H), 7,39 (dd, 2H), 7,53 (m, 1H),
7,61 (d, 1H),
7,65 (d, 1H), 7,74 (td, 1H), 7,87 (d, 2H), 7,90 (d, 1H), 8,02 (d, 1H), 12,86
(s large,
1 H).
EXEMPLE 178
Acide 4-[[5-chloro-1-[I"3,4-dihydro-2H-1,5-benzodioxépin-7-yl)sulfonyl]-1H-
indol-2-N i Iméth.I ~-benzoïque
.~,hcct : h3i hci~>c
Rcii1c i nt : 25 `f
11 R\l\ r F 1SOdrõ 5t)t) \IH~)
2.1O r ni. 11). 4.1-1 (t. 711). -1., 1 (t. 7l 1). -1,4O (;, 711). (.-1ti (ç.
1H). 74) I (d. 11 I ).
7,08 icl. III). 7.31 (cl. 21I). 7.,-1 (dd. III;. 7.37 (~ld. III). 7.(3 (d,
lE). '.S~ d. 7I{).
8.(r7 (d. 11 h. I _'., ~ (, 1ar~_c. 1 I I ).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
115
F.M;,J1I'I.h; 179
Acide 4-[[l-[ '-fluoro-bipltén~I ~uffoii~l]-~ (chluroj ll~-indc~l-2-
11nethtiI]
hen1Oi(iue
\,pcct : p2ic hei ~c
Renclemdilt : O
H R\lN (1) 1SOd,,. '50 fN 111 I)
Fi = 4,-~0 (,. (i.4-[ (,, 111), 7,32 (m, 5H), L61 (d, IH), 7,80 (m, 8H), 8,09
(d, 111).
12,91 (, Tarse. ]H).
PRÉPARATION XLVII
N-[2- i odo-4-chloro-phényl]-méthanesulfonamide
En opérant de façon analogue à la préparation IX, au départ du 2-iodo-4-
chloroaniline et du chlorure de méthanesulfonyle, on a obtenu le produit
attendu sous
forme d'une huile jaune (rendement quantitatif).
tH RMN (DMSOd6, 300 MHz)
8 = 3,06 (s, 3H), 7,38 (d, 1H), 7,48 (dd, 1H), 7,97 (d, 1H), 9,34 (s, 1H).
EXEMPLE 180
Acide 4-[[5-chloro-l-(méthylsulfonyl)-1H-indol-2-yl]méthyl]benzdique, méthyl
ester
En opérant de façon analogue à l'exemple 48, au départ du composé de la
préparation XLVII, on a obtenu le composé attendu sous forme d'un solide blanc
(rcnclemnent = 48 c).
F=1-[3 7c
EM1111'I,E 18I
lcide 4-[l~-c11lo1 - 0-II-( niéth~LSUItoti I)-1Il-i`ndU1-2-
yIlméthr1[benzoiïque
Vil ~pcrant de I~iç~~n ~nr.il~r~uc à 1'd.ycnnple 111 clépmrt clc I ~,t~r ci~ I
c~cmp(c~
on a ~htcnn 1r c~~n~pn 2 attc>>clu ,~i_u lornlc ci'nnc I)ollclrC hl~in~h
r~ncl~m~~itt
1 = , 44 C.
l'Rh:P.AR:1TION XI.V III
Chlorure (le 3.3-dinuè1hv J-2.3-dih~dr~~ henz~~furan ,ulf~>nique
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
116
Mile siiluti~~n de 3.SO e (25.(~ t m~1; de 3 diniéth~I _',~ dili dro
hcn~,ofuran
dans S 1111, d'étlicr éthvliduc. x.41 mL (101.5( m\1) d'acide sulfurique cil
solution
dans -I1 mL d éther étliv liclue ont été <ijouté~ goutte à gouttc 3 O C, Le
milieu
réuetionriel ai. cté e,-~ilc à température enihiemite pciidemt 30 minutes hui;
"IL[ rcfluy
pculent ~O licume et e epore mus ~ilfe.
Le résidu ainsi formé e été dilué dons _'-SO mL de dicliloroiiiétliane phis
traité
avec 15,27 mL (177,S6 iu 1) de chlorai-c d-oyeMe et 1,28 mL de dimétllyl
forinainide. Le milieu réactionnel a été agité ii température ambiante
peudinit 16
hcuies, puis evaporé sous pression réduite et le résidu obtenu a été purifié
par
chromatographie sur gel de silice en éluant par du cyclohexane puis par un
mélange
cyclohexane 1 acétate d'éthyle (95/5 ; vIv). Les fractions contenant le
produit attendu
ont été réunies et concentrées à sec sous pression réduite pour donner 720 mg
de
chlorure de 3,3-diméthyl-2,3-dihydro-benzofuran-5-sulfonique sous forme d'une
huile jaune (rendement = 11 %).
'H RMN (DMSOd6, 300 MHz)
6 = 1,29 (s, 6H), 4,22 (s, 2H), 6,67 (dd, 1H), 7,37 (dd, 1H), 7,41 (dd, 1H).
PREPARATION XLIX
N-(2-iodo-4-t rifluoromethyl-phenyl)-3,3-diméthyl-2,3-dihydro-benzof cran-5-
sulfonamide
En opérant de façon analogue à la préparation X, au départ de 4-
trifluoroinethyl-2-iodo-aniline et du Jilonire de 3,3-diméthyl-2,3-dihydro-
bemofin-an-5-sulfonyl (composé de le préparation XLVIII) on a obtenu le
composé
attendu sous farine d'une huile jeune (i-endemellt = 63 %).
'111Z~1 1Dti15(~d,,. 30() \1H~)
5 = 1.23 i;. 01 l). 4,33 m. 2I I). 01)3 (d, 1H), 7,30 (d, 1H), 7,41 (d, 1H),
7,55 (Id. 111).
7,71 ( , 1 . I I I t. I.1O (\. 111 t. 1),74 K, 111),
I~AL\II'I.1; 182
3i1 acide 3 [~~1 X3,3 diinélh%l 2,3 ilih~(Iro henrof'cran sulfo-i~l~ Ichlociil
1JI-
in(lol-2-' 1)111 é1h~111) enzoï(luc, 11111h~Iester
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
117
1:n ohcrant (le loto ~ a a1o ~_ir à l'cvcmplc 4,S, au d~hart (in composé (le
la
l'rcparation XLIX. on ~1 ohicnu leu inpo d attendu "ou loi-111c, d'une poudre
hlanch.c
(rendement = ~O ).
F= 1 00 C2
EXE_AIPI E 183
Acide 4-[1[1-[3,3-dimetbyl-2,3-dihydro-benzofuran-5-sulfonyl]-5-(chloro)-1H-
indol-2-yl]méthyl]benzci ique
En Opérant de façon analogue à l'exemple 2, au dcpru-t de l'ester de l'exemple
1 8?, on a obtenu le composé attendu sous forme de cristaux blancs (rendement
=
99 %).
F= 190 C.
EXEMPLE 184
Acide 3-[[l-[[3-(1,l-diméthyléthyl)phényl]sulfonyl]-3-méthyl5-
(trifluorométhyl)-
1H-indol-2-yl]hydroxyméthyl]-benzoïque, méthyl ester
En opérant de façon analogue à l'exemple 64, au départ du composé de la
préparation XXXIII et du 3-carbométhoxybenzaldéhyde, on a obtenu le composé
attendu sous forme d'une pâte incolore (rendement = 37 %).
'H RMN (DMSOd6, 300 MHz)
8 = 1,14 (s, 9H), 2,03 (s, 3H), 3,82 (s, 3H), 6,51 (d, 1H), 6,80 (d, 1H), 7,21-
8,37 (m,
11 H).
F. I _l1NLF, 185
Acide 3 [I I [(3 l1.1 dimétb~léth~l>phén~l)sulfrsr-vI]-3-méthEl 5-
(trilluorométh~l) III indol ? ~1]méth~ij hcnzoïyue, méthNl ester
tLru (>hcrani de luron an~d~~unc dl I cyculplc 1, uli de part du coii pc,~c de
I`c\culhle 1 ~4. on u odicuu le con1huc atiendtl -ou, bouc d,unc hütc jaune
rendement ~d ~~ i.
Il R\IV )1d ISOd,,, 3Oi) \II1/)
_= I . I t y. X111). 11). ,.l (~. l i ). -1, (3(>. 11 ). ~.d0 (n~. 1I L. 7.d6
i t, IH),
16(3 (id, 111), "l.~ 111), x, 1 ~dd, 11l). 7,-,k 62. 11 1). 7.9(3 (. 1I1).
(3,31 (d, Ill).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
118
h;XF\LPLE 186
Acide 3-Ill -113-( 1.1-difil et Il léthvI)phényl]sull'on~lj 3-n~éthvI5
(trii1uorométh~li-
111 ind()1-2-vIJméthvl]-henzUügtic
Lnn (opérant clc Liçu i ~inat~~~t e à l'exemple 2. au départ de 1`c;tcr de
I'cyenlple
185, on a ohtcnu le cuinp ~;2 attendu sous forme d'une poudre blanche
(rcndcrncnt =
75()
F= 194 C.
EXEMPLE 187
Acide 4-[[1-[[3-(1,1-dinaéthyléthyl)phényl]sulfonyl]-3-méthyl-5-
(trifluorométhyl)-IH-indol-2-yljhydroxyméthylj-benzoïque, méthyl ester
En opérant de façon analogue à l'exemple 64 au départ du composé de la
préparation XXXIII et du méthyl 4-formylbenzoate, on a obtenu le produit
attendu
sous forme d'une poudre jaune (rendement 51 %).
F= 65 C
EXEMPLE 188
Acide 4-[[1-[[3-(1,1-dîméthyléthyl)phényljsulfonyll-3-méthyl-5-
(trifluorométhyl)-1H-indol-2-yljméthylj-benzoïque, méthyl ester
En opérant de façon analogue à l'exemple 31 au départ du composé de
l'exemple 187, on a obtenu le produit attendu sous forme d'une résine jaune
(rendement 87 %).
'H RMN (DMSOd6, 300 MHz)
ô = 1,12 (s, 9H), _1_16 K. ?H), 3,83 (s, 311), 4,56 (s, 2H), 7,21 (d, 2H),
7,40 (m, 2H),
7.50 (~. 1W ï.(,5 (td, 1H), 7,71 (dd, 1H), 7,83 (d, 2H), 7,97 (s, 1H), 8,30
(d, 1H),
EXI YIPLF 189
\c ide 4-111-113 -( 1.1-diméth I(th% 1)phéns I JSu1l'on IN 11-3-meth~ I-5-
(1rillunroniéthv 1)-1II-iii dol -2-~ IJnie th.I1-henioiique
E.n ~p~rani (lc tacon analoLuc 2 l eycunhlc 2 au (12pu1t de l`cLcr clc [
cycn~hlc
I . un a >htciln le hr.~dnit attendu ~~~~_~, forme dune 1,,ndic blanche
trcndeai ai
i t.
F=,J() C
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
119
EXE\IPLF, 190
Acide 5-Ji1-113-(1,1-diméth%létlnl)-phén%11sutfon~1!-5-tritluoroinéth1-111-
indol-
2-y1 J-méthv 1 J-thiophène-2-carboxy tique, méthvl ester
Lu Opérant de laç~~r~ analoLuc u l'excnnpJe lS5 au de,purt du eunrpo c Obtenu
,clon l'exemple 90, on a uhteuu le produit attendu sous forme d'une huile
jaune
(rendement 0 ~~ ).
'H F 11 \ (D ~ IS Od6, 400 MI-l i )
ô = 1,16 (.~. `}11), 3,78 (s, 3H), 4,73 (s, 2H), 6,83 (s, 1H), 7,05 (d, 1H),
7,47 (t, 1H),
7,66 (n1, 4117, 7,71 (dd, 1H), 7,99 (s, 1H), 8,27 (d, 1H).
EXEMPLE 191
Acide 4-{[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indol-
2-yl]-hydroxy-méthyl}-1-méthyl-1H-pyrrole-2-yl-carboxylique, méthyl ester
En opérant de façon analogue à l'exemple 64 au départ du composé de la
préparation III et du 4-formyl-1-méthyl-1H-pyrrole-2-carboxylate, on a obtenu
le
produit attendu sous forme d'une huile jaune (rendement 5 %).
'H RMN (DMSOd6, 300 MHz)
3 = 1,15 (s, 9H), 3,69 (s, 3H), 3,78 (s, 3H), 6,00 (d, 1H), 6,31 (d, 1H), 6,66
(d, 1H),
6,94 (s, 1H), 6,99 (d, 1H), 7,44 (t, IH),7,59 (m, 2H), 7,67 (dd, 1H), 7,70 (s,
1H), 8,02
(s, 1H), 8,23 (d, 1H).
EXEMPLE 192
Acide 4-f [l-[[3-(1,1-dimét1i léthyl)-phényl];,ulfonyl]-5-trilluorométhyl-lH-
indol-
2-yl]-méth~ t}-1-méthyl-lH-p}rrole-2-yl-carboxylique, méthyl ester
Ln opérant de Façon ~rnal<~_ue 1 l'exemple 3 1 aau ddparl (1c I'c~ter de
l'cxennhle
11)1. on u1 ohtenu le produit attendu Lnnie d une rc,ine urn'run (rendemiment
17 ).
11 R,\ 1.A (I)\ISOd,,. -tOO ti111/)
3 I.16 (x,')11)_ ;. 'O i;. )1). 3.?~) (~. off). 1.19 (~. 11P6.61 LI. 1TH. o.o7
LI, 1H),
6,971d, J11). 7.4`; (t. 111). .01 (ru. Ili. 7(d1. 111e 111). S.25 (d. Il 1).
fl
PIZI:P:1I2_A"IION L
1-J~3-(1,I-diméthyléthv1 )phé11%tJsulfo11~ Il- Ill-indule
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
120
Eau opénuit de façon analo~ue 33 lahrélu-atioil I au dclrut de 11/-indole et
du
chlorure de -(1.1-dimctl 1cth}I) hhén~l~ulf<n~le. OH a obtenu le l)r(xluil
attendu
l'orme d'une huile marron (rendellicin = 99
Il WMN 300 MI-1z)
6 = 1,22 (>, ')II), 6,84 (d, 1H), 7.25 (t, 1H), 7,35 (t, IH), 7,51 (t, IH),
7,60 (d, 1H),
7,72 (d, 1H), 7,78 (d, 1H), 7,x4( d. 111), 7,87 (i, I I1), 7,97 (d, 1H).
EXEMPLE 193
Acide 4-[[1-[[3-(1,1-diméthy léthr 1)phényl]sulfonyl]-1H-indol-2-yl]
h~ droxyméthyl]-benzoïque, méthv I ester
En opérant de façon analogue à l'exemple 64 au départ du composé de la
préparation L et du méthyl 4-formylbenzoate, on a obtenu le produit attendu
sous
forme d'une huile jaune (rendement 34 %).
'H RMN (DMSOd6, 300 MHz)
6 = 1,17 (s, 9H), 3,85 (s, 3H), 6,41 (d, 1H), 6,48 (d, 1H), 6,57 (s, 1H), 7,22
(t, 1H),
7,32 (td, 1H), 7,45 (t, IH), 7,52 (m, 3H), 7,67 (td, 2H), 7,81 (t, 1H), 7,94
(d, 2H),
8,02 (d, 1H).
EXEMPLE 194
Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]- IH-indol-2-yl]méthylj-
benzoïque, méthyl ester
En opérant de façon analogue à l'exemple 31 au départ dt eompo'é obtenu en
193, on a obtenu le produit attendu sous forme dune huile jaune (rendement 81
L ).
'I{ R\7 ,' (D,AISOd,,, -l00 11110
5 = 1,15 (s. x)11). _S5 ts, 311), 1,47 (s, 2H), 6,47 (d, 1H), 7.23 (td. 1H).
7.32 (td, 1H).
7.37 (d. 211). E.-I4 (t, 1H), 7,49 (d, 1H), 7,57 (dt, 1H). 7.0 ~ tL 111 ).
î.0,~ (1lt. 111 ). 7.I)O
(d. BEI ). 5.0 f d, 1H).
h.AL IPLE 195
tcidc 4 ~~ I-(I3-( 1.1-diuiéth~létI I)phén%II,UIf~)nvI~- Ifl-indh)I-2-
vtjméth~Ij-
hen/~~ïque
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
121
ENI opér<rnt de l~rçon an éeeue à 1'eyemple 7 atz départ (le l'e,ter de
l'czcmple
194, On a t,htenu le proxluit ~ittenLiu I01-me d'orle ipoedie blanche
(rerndlcnuernt
1U) `( ).
F= 17 5 C
PRÉP.&R:TTON LI
( I-hromo 2 fluoro-5-méth}1 plién~ l) 1 {[3-(1,1-cütvéth Iéth~ I)phénN
l]sulfonyl]-5-
(trifluo ro nnéth ~ l)-1H-indole-2-méthanol
En opérant de façon analogue à l'exemple 64 au départ du composé de la
préparation III et du 4-bromo-2-fluoro-5-méthylbenzaldéhyde, on a obtenu le
composé attendu sous forme d'une mousse orange (rendement = 65 %).
'H RMN (DMSOd6, 300 MHz)
5 = 1,19 (s, 9H), 2,26 (s, 3H), 6,48 (d, IH), 6,60 (d, 1H), 6,73 (s, 1H), 7,30
(d, 1H),
7,47 (t, 1H), 7,54 (d, 1H), 7,66 (td, 2H), 7,73 (dd, 1H), 7,88 (t, 1H), 8,02
(s, 1H), 8,27
(d, 1 H).
PREPARATION LII
2-[(4-bromo-2-fluoro-5-méthyl-benzyl]-1-[[3-(1,1-
diméthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-indole
En opérant de façon analogue à l'exemple 31, au départ du composé de la
préparation LI, on a obtenu le cornlpoé attendu sous forme d'une huile
incolore
(rendement = 50 %).
'H RMN (DMSOd6, 300 MHz)
5 = 1,19 (s, 9H). 2.25 (s, 3H), 4,37 (,, 2H), 6,40 (s, III). 7.23 (d, IH),
7,51 (t, 1H),
7,57 (d, 1H), 7,(;() (d, 2H), 7,73 (t, IH), 7,76 (d, 1H), 7,1)` IH), 8,30 (d,
1H).
EXIP\IP1.h~ 196
Acide 4-jj1-[j3-1
2-~ l [méthv I j-5-fluoro-2-méthv I-henz<iiyue
~U I.n _pérunt ale Lacan ~ul~rioeite ,r l cvcinple (7. uu _]éhart glu coillp
yé pie Li
l~r~ Irnatio!i I.II. 011 a obtenu le ooiill , tten~lu peu 1011 >e ~ldun ~oIidc
hlune
(renfement = 44'
I !17 C.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
122
PRh:PAR-A'fION LIII
(4-hron~o-2-méth~ l-phén~ t)-1-l 141.1-dinaéth~ Iéthyl}phénv 1]sulfonyi]-5-
(trifluorométh~l) 1II-indole-2-méthanol
F:n (point tic filcon analu,~uc ~r l'cxcmplc 6- au dcp,irt du coi )p(),3 de la
prep,iratII n 111 et du hr~~rnr~ iluoro 5 meth~lhen~aldchtidc. on a obtenu le
co iipo>é attendu lornrc (I nnc p<~udm blanche trendcmcnt = 32 `(
'H REIN tDM ISQd6, 30() NI1 li)
5 = 1,20 (s, 9H), 2,27 (s, 311), 6,30 (d, 1H), 6,50 (d, 1H), 6,64 (s, 1H),
7,13 (d, 1H),
7,34 (dd, 1H), 7,44 (d, 1H), 7,48 (t, IH), 7,68 (td, 2H), 7,74 (dd, 1H), 7,94
(t, 1H),
8,02 (s, 1H), 8,27 (d, IH).
PREPARATION LIV
2-[(4-bromo-2-méthyl-benzyl]-1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-
(trifluorométhyl)-1H-indole
En opérant de façon analogue à l'exemple 31, au départ du composé de la
préparation LIII, on a obtenu le composé attendu sous forme d'une résine
incolore
(rendement = 69 %).
'H RMN (DMSOd( , 300 MHz)
5 = 1,19 (s, 9H), 2,05 (s, 3H), 4,28 (s, 2H), 6,14 (s, 1H), 7,05 (d, 1H), 7,35
(dd, 1H),
7,46 (d, 1H), 7,54 (t, 1H), 7,67 (dd, 1H), 7,73 (dd, 1H), 7,74 (d, 1H),7,78
(td, 1H),
7,91 (s, 1H), 8,33 (d, 1H).
EXEMPLE 197
Acide 4-[[1-[[3-(1,1-diméthvléth~ I )phéuN I]suilfonyl] -5-trifluorométhyl-lH-
indol-
2-v I]méth~ 11-3-méth~ 1-benzoïque
Fil opcl-ant de fa~tm analociic it l'crcmplc 67, nu dlcpnrt dtr de l,i
pi pnrutiou L[\ on a ohtcnu le c~m po L nttcndi_r ,oi b ouc dLiuc pouidic
hlanchc
rendcmcnt = 3 [ ).
1== 133 C
f:n opcrant ~lc t,~con nn,rl>~uc à l c~en~plc ~~u. au ilep,rrt (lu c~nipu,c
pic (,r
prep o tion \\I\ et du 3cmn h~rtmi,luc c~rrc~pond,~nt. on n oLicnu Ic; cuiii
c,
dc~ mcrnp1m ci aprc .
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
123
Flh:~ll'i.l; 198
1 [[1 ~[3 (1,l-(liFil étIl NI éthNI)-phényI[Sulfone%lj- -trif7uorométhy1-111-
in(j t)l-2-
l]méthti I J-henzènesulfonanuïcle
\,hcct :huile lfl FI ik
Renu-lcmcm = 10
iIl R\1 (1~\15Cc1,,, 400111-1i)
5 = 1,18 (s. C) 11), 4,52 (s, 211), 6,60 (s, 1H), 7,33 (s, 2H), 7,41 (d, 2H),
7,48 (t, 1H),
7,60 (d, 1H), 7,66 (d, 1H), 7,72 (s, 2H), 7,77 (d, 2H), 7,96 (s, 1H), 8,27 (d,
1H).
EXEMPLE 199
Acide 3-[[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyi]-5-trifluorométhyl-lH-
indol-
2-yl]méthyl]-4-fluoro-benzoïque
Aspect : pâte beige
Rendement = 27 %
'H RMN (DMSOd6, 300 MHz)
5 = 1,19 (s, 9H), 4,50 (s, 2H), 6,46 (s, 1H), 7,36 (t, 1H), 7,50 (t, 1H), 7,67
(m, 2H),
7,74 (m, 2H), 7,82 (dd, 1H), 7,94 (m, 2H), 8,30 (d, 1H), 13,01 (s large, 1H).
EXEMPLE 200
Acide 3-[[l-[[3-(1,1-diméthyléthyi)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indol-
2-yl]méthyl]-5-fluoro-benzoïque
Aspect: pale bel, 'le
Rendement =21-1 (4
'H R\1Ni (D 1SO(( 300 MHz)
5 = 1,16 (s, 911), 4.54 6.65 (s. 1H), 7,36 (dt. 1H), 7,47 (t, 1111 7,54 l(1.
1T-1),
7.63 (lit, 2H), 7,67 (nt 213), 7.71 (d (i_ 1H), 7,97 (=. 11 7, 8,58 (c1, 111).
13.1 X )', 1
1 X1.~IPLF. 201
3O acide 3 111 113 (1.1 dlméth~ léthN I)-phén~ 1lsuIF )n.NI1-15-trifluon=ométh
1-1 11-ind0l-
2-v IJiucth~ I J- -11UW t)-I)Cnzoïclue .A~hc~t _ p3te hei c
Ilt~n~lcmen) _ ~0
3{ R\1~ )U\1 Od,. 300 MI l")
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
124
= 1,17 (. o)I P. -1.47 2I1). 0.5S (;. IH), 7,26 (dd, 1HI). 7.-1O (m. 7H), 7,67
(ni. 51-0,
71)5 (:. 1 H). x.27 td. 111). I ?,71 ~ ~ Iargc, 1 H).
FXILMP1,E 202
acide 3-111-113-(1,1-di methy1éth~1)-pli ényl]s[Ilfonvll-5-tr-illuru=oniéth~l-
111-indol-
2-y 1 ]met h% 11-6- iiiétlioxy-I)ur)Zoï(l lie
A pcct : hâte hcillc
Re11R1cnlcnt = 3))
'H R\1' (D~ISOd~õ 300 MHz)
cS = 1,17 (s, 911), 3,81 (s, 3H), 4,38 (s, 2H), 6,49 (s, 1H), 7,08 (d, 1H),
7,38 (dd, 1H),
7,48 (t, 1H), 7,51 (d, 1H), 7,64 (m, 2H), 7,69 (t, 1H), 7,73 (dd, IH), 7,94
(s, 1H), 8,26
(d, 1H), 12,54 (s large, 1H).
EXEMPLE 203
Acide 3-[[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indol-
2-yl]méthyl]-4-ehloro-6-fluoro-benzoïque
Aspect : pâte beige
Rendement = 9 %
rH RMN (DMSOd6, 300 MHz)
8 = 1,19 (s, 9H), 4,50 (s, 2H), 6,28 (s, 1H), 7,53 (t, IH), 7,67 (m, 3H), 7,79
(m, 3H),
7,92 (s, 1H), 8,33 (d, 1H), 13,43 (s large, 1H).
EXEMPLE 204
Acide 3-11 1 [[3 (1,1-diméthylêthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indol-
2-v1]méth~ I j- pN ridisie carbox ligue
1,hcci: IinTIC inuiruu
R~~nclcu~cnt -= 17
'11 k\Iti (1)ti1SOd . -(()U \111/)
6 1.16 (~. ~)1{). (.5 (;. -'Il), 6.67 (,. 1 W. 7.J;~ N. II1), f 5 ((. 310.
7.71 (32l. 11 U.
3O 7.L (~. I (I). ~,T )L (t. 11 I ). .77 NI. 1 Il ). ~. 73 (3d. 11 I ). ~_J5
(PLI. 1 E I ). 1 47 Llr~c.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
125
EXEMPLE 2105
acide 4-[(f-fl3-(1,1-dimétIl Iethyl)-phén%llsuIfon~l]-5-tri(luur~~méthyl-lH-
indol-
2-~ l ]mét1i l ]-3-chloro-henz(üque
\,hcct : hâic hcie
Rcnclcmcnt = -1-4 H R:A1\ (D~ISO<Iõ )()0 -111/)
3 = 1, 20 K. ')I l ), 454 (s, 211), 6,28 (s, 1H), 7,42 (d, 1H), 7,54 (t, 111),
7,70 (dd, 2H),
7,78 (d, 211), 7,56 (dd, 1H), 7,94 (d, 2H), 8,34 (d, IH), 13,30 (, 1au-ge.
111).
EXEMPLE 206
Acide 4-[[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indol-
2-yl]méthyl]-2-chloro-benzoïque
Aspect: huile orange
Rendement = 4 %
'H RMN (DMSOd6, 400 MHz)
6 = 1,17 (s, 9H), 4,49 (s, 2H), 6,64 (s, 1H), 7,25 (dd, 1H), 7,36 (d, 1H),
7,48 (t, 1H),
7,65 (m, 3H), 7,72 (d, 2H), 7,94 (s, 1H), 8,27 (d, 1H).
EXEMPLE 207
Acide 3-[[1-[[3-(1,1-diméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indol-
2-yl]nnéth3l]-2-méthoxy-benzoïque
Aspect : l1~itC hC! C
Rendcrmment = ,0 %
111 R \ 1 N (DMSOd6, 300 MHz)
5 = 1.20 (s, 9H), 3,53 (s, 3H), 1, 3 e) (s, 2H), 6.2 2 (~. 111), 7,16 (t, 1
H), 7,35 (dd, 1H),
7,57 < 1H). 7.617 (m, 2H), 7,71 (dd, 1H), 7,))`) 211), 7,92 (s, 1H), 8,33 (d,
1H),
l 2. 15 Ln c. 1 H ~.
F, _XE\IPI.L; 208
Acide 3 f I l (j3 i 1,1 din~éth~léth~I( hhén~l~sulfon~If 5 trilluorométh~I 1H
indol
2 ~ I jnnéth%
Ij 1 méth~ ~ henz~üque
>>l~cct : p îc hci~c
1tCnIC]IlClll = ~~ r
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
126
I I R\IN (I~~ ISOJ1.. 3UO \IH/)
= 1.21 (,. ')Il). 3,%9 (~. 311). 1.37 t,. 21h, (i.24 (. IH), 7,15 (Ji. J II).
7,54 (t, I lll),
7,67 (m, 311), 7.70 (n. 21-1)_ -1)1 (m. 211), S,3O (d. 111). 12.60 (s large.
111).
En ohcrant tic l acon analogue à l'exemple (i9, au dclrtrt de la hrélriration
\.A'X et du ücrivé lhororuquc corresponda t, on a obtenu 1c, co!] po c, de,
cxcnnl~lc~
2O9 et 210 ei~nprc~.
EXE ~IPLI 209
teille 4-[[I-[[4-(1-nié thyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-1H-indol-
2-
yl]méthyl]-2-chlorobenzoïque
Aspect : pâte beige
Rendement = 24 %
'H RMN (DMSOd6, 300 MHz)
S = 1,14 (d, 6H), 2,91 (sept, 1H), 4,51 (s, 2H), 6,65 (s, 1H), 7,26 (dd, 1H),
7,35 (d,
1H), 7,40 (d, 2H), 7,65 (dd, 1H), 7,72 (d, 2H), 7,74 (d, 1H), 7,98 (s, IH),
8,27 (d, 1H),
13,31 (s large, 1H).
EXEMPLE 210
Acide 3-[[1-[[3-(1,1-diiméthyléthyl)-phényl]sulfonyl]-5-trifluorométhyl-lH-
indol-
2-~l]niéthyl]-6-fluoro-benzoïque
A~hect : p3tc Neige
Rcildcment =37 %
'H RMN (D.NISOd,,, 300 MHz)
= 1,14 (d. (~11). 2$92 (,cht. 1H), 4,4 (,. 211), 6,~8 (,, 1H), 7,25 (dd, 1H),
7,40 (d,
211). 7.50 (m. 1H ). 7.61 (dd, 1H), 7.()9 (dd, 1H), 7,73 (d, 2H), 7,97 (s,
IH), 8,26 (d,
IW. 13,2C i, lem . IIi1.
1.11 ohcrant tie iacou ~uullocmic 'i 1 cyemnhic 09. glu kIéj)n 11t (lit t1c la
l~ré1?,tr~itin \\\1 et titi clcrivc h00nlique crre,l>onciant. on n ohicnu le',
conlho,c,
pic, cucmnhlc, 211 et 212 ~i ~~hrc,.
L\I~'AIPLh,211
Acide -3-I 1-11 4-nuct tir l 3,~ di}~~ dr~~ 211 hcnz~~l 1, l ~~i~~izin (~ ~ I
] sull'un~ J I
1ri11uoronnéth.l-111-indol-2-vI1méthN
l 2 chlore henz~üdue
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
127
\>hc~t :hâte hci~c
Renl1c171eI1t = 37 '~
H R\11 (D\1SO(1,,. 300 NIIIi)
8 = 2.,75 (;. 311). 3.2 (t. 211). -1,23 (t, 2H). 4.507 6,64 (,. 11 t ). 6,73
(d, 1H),
6,86 (d, Ili). 7.00 (LId. 111). 7,15 (ci(l. 1H), 7,34 (<d, IH), 7,64 (dd, 1H
), 7,75 (d, 1H),
7,97 (s. 111), ~? 7 (d, 111). 1.3.27 1H).
EXEWll'I,E 212
Acide 3-[[l-[[4-méthyi-3,4-dihydro-2H-benzo[1,4]oxazin-6-yl]-sulfonyl]-5-
trifluorométhyl-IH-indol-2-yl]méthyl]-6-fluoro-benzoique
Aspect : pâte beige
Rendement = 22 %
'H RMN (DMSOd6,300 MHz)
8 = 2,75 (s, 3H), 3,24 (t, 2H), 4,23 (t, 2H), 4,47 (s, 2H), 6,57 (s, IH), 6,73
(d, 1H),
6,86 (d, IH), 7,01 (dd, IH), 7,25 (dd, 1H), 7,49 (td, 1H), 7,63 (dd, 1H), 7,67
(dd, 1H),
7,96 (s, 1H), 8,27 (d, IH), 13,20 (s large, 1H).
En opérant de façon analogue à l'exemple 69, au départ du composé de la
préparation XXXII et du dérivé boronique correspondant, on a obtenu les
composés
des exemples 213 et 214 ci-après.
EXEMPLE 213
Acide 3-[[1-[(2,3-dih y-dro-benzo[1,4]dioxin-6-yl)sulfonyl]-5-chloro-lH-indol-
2-
3l]méthyl]-5-pyri(line carboxylique
,1"hcct : hâte I ciL~c
Rcnc[ement = ] cJ
'H R\1\ (D\ISOc1,,. 3OO \1Hzl
= 4.21 rn~. 211). 3.25 (in. 211). x.52 (.. 2I1). 11I). 6.005 (d, 1H), 7,12 (3.
111),
7.25 (c11. III . î. 5 rcicl. 11H. .03 (1. 11C). SJ)I (t. 11[). 5.0 (3. 11E),
x.73 H. 1[1).
S "')O
(c1. l I1 i. I ,35 t, I,u nc. 1 1[ ).
Llh:AIPI.I 214
Acide 3 jIi ~t2,3 dih~dro henzo(1. !di~~xin-(,-~I)SUlfon'I 51rif1tioruméth~I
1H-
Iudc,l-2-sI1 nnélh%lj-4-Iluor~~ hcnz~ügtic
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
128
~;hcet ; hàtc hcicc
RcnClcincnt = 3) '~
~Il R11N (1-)\ISOci,.. 3( \11IL)
4,23 (in. 211). 4.2S (in, 2H), 4.42 (s, 211). 0.47 (s. 111). 6,94 (d, IH),
7,06 (d, 1H),
7,27 (m. 111), 7,34 (dd, 1H), 7,4d) on, 1H), 7102 (d, 1H), s,64 (dd, 1H), 8,03
(d, I H),
13,20 (k larcc. 1H).
NIPLE 215
Acide 4-[(RS)-hydroxy[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-
(trifluoraméth~-1)-lH-indol-2-yl]méthyl]benzoïque, méthyl ester
Lit opérant de façon analogue à l'exemple 30 au départ du composé de la
préparation XI et de l'acide 4-(1-hydroxy-2-propynyl)benzoïque, on a obtenu le
produit désiré sous la forme d'une poudre orange (rendement = 89 %).
F= 60 C
EXEMPLE 216
Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-yl]fluoro-méthyl]benzdique, méthyl ester
A une solution de 0,3g (1,83 mM) de trifluorure de diéthylaminosulfure dans
3 mL de dichlorométhane refroidie à -78 C, 1 g (1,83 mM) d'acide 4-[(RS)-
hydroxy[ 1-[ [3-(1,1-diméthyléthyl)phényl] sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-
yl]méthvd]be 7oïquc. méthyl ester (exemple 215) en solution dans 16 mL de
dichloi'oniéthanc ont été ajoutés ,routtc à goutte à - 78 C. Le milieu
réactionnel a été
acné à - 78" C pendant 30 minute. Puiti. le mélan,~c réactionnel a été dilue
avec
5() niT, de di~-hloronicthanc. La hha.c or_aniquc a été lavéL2 avec 5O niL dé
\a,Cn;
huis dcny lois par 5O mL or'caniquc', rcuincs ont cté ~cnc~cs pur
~ullatc cic i tun<~itin~ Ci c~<ih~rcc~ ~~~ii. hrc=~ion rc~luitc. Le lé,idu a
cté hurilil hoir
luonlatoural~hic ,ur cet dé ~ilicc en éioun par un uicluiec e~clnlic.~anc /
acct<itc
~i etli~le (no:I)) : ~~~~. Lc: fraction e menant 1c hr~~~luit attendu ont Clé
ibunic, et
ci iccntrce a ~c ~oii lire mii reJlultC p oui donn'i :~~ mc lI e iei IIe nb
~Otlti la
lors c ~l nnc l~~u~lr~ orante (rcn~fcnicnt = ~ ~.
Li R11\ (D\1. OJ,.. 3()O \111i)
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
129
= 1,19 (,. 91l). 3.X~) 1-1). h.73 H. 11-i). 7.52 (1. IH). 7,33 (d, 1H), 7,65
(d, -l1),
7,75 H. 211}. 7,X1 (i(f, 111). 7,X 7 (.t, Il-1), S,OC, ~d, 3H), 8,33 (d, IH).
EXEMPLE 217
Acide l-[[ 1 J r3-(1,1 diméth~ léth}l)phért~llsulfon~ 1]- -(trifluorométh~ll-
1H-
indo1-2-V I]iluoro-mét1i~ Ijhenzoïclue
11H operatlt de lucou aualocue â l'e emple 2, au départ du conipoH de
Fcse nple 216. on a obtenu le produit attendu sous forme d'un solide orange
(reni(lement = 55 %).
F = 170 C.
EXEMPLE 218
Acide 4-[(RS)-hydroxy[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-
(trifluorométhyl)-1H-indol-2-yl]méthyl]benzoïque
En opérant de façon analogue à l'exemple 2, au départ du composé de
l'exemple 215, on a obtenu le produit attendu sous forme d'une poudre beige
(rendement = 94 %).
F = 110 C.
EXEMPLE 219
Acide 4-[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluoromethyl)-1H-
indol-
2-yl]carbonyl jbenzoïque
En op7runt de façon an)logie à l'exemple 93, au départ du composé de
l'e.~cmhle 2 (H, oIn a uhtcuu le produit attendu sous la forme d'une poudre
blanche
(rendement : ).
f = 1 XO (.
I;_l"I1 PJ.L 220
-l-j1-JJ3-)1.1-dimétlt~ICIh~I)phcnyIJ'.tilfon~l)- -(Irilluoromcth~1)-1II-indol-
2-
~i) ~I~méthvl]henzonitrile
I n <h<rant de Caçun ii~al~_>ue â I,eyenniple 01). au d~E~~irt dii >>l~i?~u7
J1e la
prclar~ltimi \ I\ et dL' l ucidc J-c~autplk'nvJ hoinniyue. nn U o('icnu le
prndwt
attendu ,gui, (mine dJun ,ulidc jdune pulc (rendement = ,;
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
130
F=47 C.
h:II:~IPf,I; 221
-t-I1-j3-I1,1-dimethyléthyl)phény1]sutfon ~l]-5-(trifluorométh~1)-1H-indol-2I1-
tétrazol-,5-yl-benzol
:A ruic ,()!ution (le 505 mg (1,14 iu\1) (lu beiitovitrilc obtenu ,elon
1'cycnlhle
220 (lai, l0.1)5 mL tl'or[}u) ~'lcnc, (m a ajouté Sl~).73 mg (3,98 inM)
d'azidotrirnélh~ létLdn, puis le milieu réactionnel a été nLJté une nuit au
reflux. Le
milieu réactionnel a été concentré sous pression réduite et le résidu
d'évaporation a
été purifié par chromatographie sur gel de silice à l'aide d'un éluant
cyclohexane
/acétate d'éthyle avec un gradient allant de (90/10 ; v/v) jusqu'à (20/80 ;
v/v) puis
avec de l'éluant dichlorométhane / méthanol de (100/0; v/v) à (90/10 ; v/v).
Les
fractions contenant le produit attendu ont été réunies et concentrées à sec
sous
pression réduite pour obtenir le produit désiré sous la forme d'une poudre
blanche
(rendement = 66 %).
F= 100 C
EXEMPLE 222
3-[[4-[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-
îndol-2-yl]méthyl]-phényl]-4H-[1,2,4]oxadiazol-5-one
A une solution de 444 mg (0,89 mM) du benzonitrile obtenu selon l'exemple
220 dans 1 mL d'cthanol et 1 mL de triéthylaminne:, 587,07 mg (3,58 mM)
d'hydroxylamine ~(llfntc ont été ajouta puis le milieu rcactiolmel a été
chauffé une
nuit à 80 C. Le milieu rcacti()nucl a clé conceil.tré sous prc,~i(~n réduite
puis dissout
dans du C'Ll. C l ,. 1_c, ,cl, ont cté éliminé, par filtration et 1u filtrat u
cté r upore.
1u rc,i(lu ainsi formé. (lis out (fans 1_ mI (]c p~ri(linc. on a ajoute ü 0-C
43 p1_ (~<) Ili M) de c}hl(~rut~uIll atc d'cthrlu. puis le Il Il 11,21l
rcacli(~nncl ~l Ctd a-itc
ante minute, . température alt~hiant(~ et une nuit au ruIIu_~. l.u lnilicu
lractiunncl a
étc (lilllc uvcc (l( l'cau puis extrait ;I l'indt 11c (i élh~In. La phase
(>r_ani(luc a étc laudu
av uc f IL (IN) puis uv cc Na(-I. l u hha,c, (,r~ani(luc, rcmlic, oui étc
c(~nurntrcc,
u, prc,~i(~n I~ cluitc rt le ru iclu (i r~,ll~urati~~n a cic l~urilié peu ul11-
omna1O'-l ploc ,uIr
_ul du oliuc d l'aide dun cluuut rvuIoImuyunu /ac hutc d iIt lu tuf)/1O : ~~~)
jn~clu'ù
{j,'\O _ A I, I_c, Ilclutl(~n, c(?111CIlaIll le produit allull(lu ()lit été
rclllllc, c1 c(>ncClltlce.~
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
131
à ,cc ,ous pres,ion rcciuite pour ohtenir le prtului( dcsiri ")u" la Dormie
(l'une pOi 1rc
Manche 1_rcndcnient
1 175 C
l'R11'.1R.ATTON LV
4-[ 1-113-I 1,1-(ti1 il étIlN1éthv1)phényl]su1 forl,l]-5-(tri11uorotnéth~1)-
IJI-indol-2-
i inéthN 1 Jbe11za1déh%(le
En opéraiit (le Maçon analogue â l'etcmlple 69, au départ du composé de la
Préparation XXfX et de l'acide 4-formylphényl boronique, on a obtenu le
produit
attendu sous forme d'une huile jaune (rendement = 22 %).
'H RMN (DMSOd6, 300 MHz)
d = 1,17 (s, 9H), 4,55 (s, 2H), 6,62 (s, 1H), 7,46 (m, 3H), 7,67 (m, 4H), 7,86
(d, 2H),
7,96 (s, 1H), 8,27 (d, 1H), 9,99(s, 1H).
EXEMPLE 223
5-[ l.-[4-[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-18-
ïndol-
2-yi] méthyl]-phényl]-méthylidène]-2-thioxo-thiazolïn-4-one
A une solution de 131 mg (0,26 mM) du benzaldéhyde obtenu selon la
préparation LV et 34,93 mg (0,26 mM) de rhodamine dans 1 mL de toluène, on a
ajouté une solution de 18,13 pL (0,18 mM) de pipéridine et 10,52 L (0,18 mM)
d'acide acétique dans 5 mL de toluène, puis le milieu réactionnel a été agité
2 heures
à 120 C. Le milieu réactionnel a été dilué avec de l'eau puis extrait à
l'ac)tate
d'cthy le. Les phases oig ijiiques rcunic ont été concei,tLes sous pression
réduite et le
rc"idu d'ctiaporatioii a etL puritié par chromatographie liquide préparatioe
et
dctection par spectrométrie de ina~se (LC SIS) en clnant par un rnélaiiue
l I-:A_ l.es tractions contenant le produit attendu prit etc réunies et
cuneeiiL es u sec ,oui pression rcduite peur obtenir le produit cic~irc pou
lai forme
d'une poudre jaune (rendement = 12
El K\I\ (D~ISC)d . 300 M1IL)
1,17 t;. )l I). LEU t~_ _11). 0.6O ( 11 1). 7.3(l J. 211;. 7_ I tin. -Il).
,5((el. 211).
(,O 1 i l l J . 1 1 I ). 7,C L 1, 11 I i, t d, l l i 1, 5~, 11 ie
(d, 1 1 1 ) . 1 ? .?1) l u Le , 11 1 }.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
132
h:F.~IPLh; 224
Acide \ -14-111-1[3-(L1-(liinéthNléth.1)phényl]sullon%1 ttritluorométh~1) UI-
indol 2 ~1]méth~IJbenzo%1]-h~cirarinecarhoz~lique, terhutNI ester
une >(~lutiuu de 400 w L, n 1) (le l'uci(le 4 [[I [j> l,1
dirnéilt~ léih~ l )phén~ ljsulfon l] (triCluurométh~ l) III inca(>1 ? ~ l
~méth~l~henzoi(luc
(exemple 49) (tain `' mL de tOiIIélle. on a iijouté 10-3.61 mg (0,,S5 mil) c1
L:DCI et
116.17 mg (077 nu~NI) d'HOAT, huis le milieu réuciionnlel a été agité 1 heure
à
Iempérature unthi iiitc. 0,12 mL (O.Ss m;N1) clc triéthv lainninc et 112,79 mg
(0,85 mM)
de curbaniate (le terbutyle ont eusuitc été ajouté et te milieu a été agité à
température
ambiante pendant 16 heures. Le milieu réactionnel a été été concentré sous
pression
réduite et le résidu d'évaporation a été purifié par chromatographie liquide
préparative et détection par spectrométrie de masse (LC-MS) en éluant par un
mélange H20/CH3CN/0,1% TFA. Les fractions contenant le produit attendu ont été
réunies et concentrées à sec sous pression réduite pour obtenir le produit
désiré sous
la forme d'une huile jaune (rendement = 75 %).
1H RMN (DMSOd6, 300 MHz)
5 = 1,18 (s, 9H), 1,43 (s, 9H), 4,49 (s, 2H), 6,52 (s, 1H), 7,34 (d, 2H), 7,48
(t, 1H),
7,64 (m, 2H), 7,73 (d, 2H), 7,82 (d, 2H), 7,94 (s, 1H), 8,27 (d, 1H), 8,90 (s
large, 1H).
EXEMPLE 225
Acide 4-[[1-[[3-(1,1-diméthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-yl]méthyl]benzoïque hydrazide
A mine ,olution de 360 mg (0.57 mM) d'ucidc N-[4-[[1-[[3-(l,1-
diméth~léihvl)phén'1jsuul loin 11-5-Cri lluoronictii l)-1H-indol-2-y1
~mdiii)l]benzoyl]-
h~(lra~inccarhoxtli(1uc terhut~l ester obtenu clon I-cxcinplc 224 dans 5 H. de
liehlorOmciiiunc. Ott a ajOllié d nil, d'acide triliuoroucétiquc pois le
milieu
réactionnel a die cuite 2 heure, ü Icn~hrrat(ue wulnante. Le milieu
ré~i~ti(~nnel u cté
eu) concentre ,oui prcõioo réduite et le rc,i(lu 7k uporatim i u été purifie
p:u'
rhronuutourupllie li(lui~le piepurali~e et (leteetiHn pur ,peetromcirie (le
mut e I LC-AIS)
en dimuini par un n~clant~e II,O!C'l l:Cti,' O.l `( 11 .x. Le, 1ra~tiOn,
ernten<uit le produit
atten(ltl ont die retln(e, et eoueenllee~ u Lee ~~~U, p]emoil réduite pour
(1hteui le
prO(luit (ié,ire ,(?u lu forme (urine huile incolore treu(ien~ent = St)
11 Ikl~ 11)\ISO(1,,. _ 00 \II171
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
1?5
= 1.1 (~. ~) 11). 1 2 t,. 2t 1). o. () t,. Ill). 7,")S (d, 2H), 7,49 (t, 1H),
7,61) nl, 1I i),
7,83 (d, 211). 7.0)5 (,. 1 tJ ). 5,27 (d, 111). 10-1)') (, lar~;c, 1H).
1l:xEM PLl': 226
[ l [ (1 I ~ 3 (1.1 diméth~ léth~ l )phéntillsulfunyl]- -(trifluoruméth~ 1)
111 indol-2-
1]méth~ l ]-phen' I l-3H-] 1,3,4]oxadiazol-2-one
A une ,olution de 150 m~, (0.47 mM) de l'acide hydrazide obtenu selon
lexenlple 225 dan, 9,5 rnL de dichloronléihuule, on a ajouté à 0 C 90 pL (0.61
mM)
de triér<hylaniine et 99,51 mg (0,61 mM) del-l'-carbonyldii idazole, puis le
milieu
réactionnel a été agité 3 heures à température ambiante. Le milieu réactionnel
a été
dilué avec de l'eau puis extrait au dichlorométhane. La phase organique a été
lavée
avec HCi (1N) puis NaHCO3. Les phases organiques réunies ont été concentrées
sous
pression réduite et le résidu d'évaporation a été purifié par chromatographie
liquide
préparative et détection par spectrométrie de masse (LC-MS) en éluant par un
mélange H2O/CH3CNI 0,1% TFA. Les fractions contenant le produit attendu ont
été
réunies et concentrées à sec sous pression réduite pour obtenir le produit
désiré sous
la forme d'un solide blanc (rendement = 28 %).
F= 92 C
EXEMPLE 227
N-[4-[ [1-[ [3-(1,1-dimêthyléthyl)phényl]sulfonyl]-5-(trifluorométhyl)-1H-
indol-2-
yi]naétlryl]be nzyl]-méthanesulfonamide
A une solution de 200 me (0,39 mM) de l'acide obtenu selon l'exemple 49
(an, ')10 mL de dichloronléthane. on a ajouté 74,37 mg ((). e) m\I) (I EDCI,
t7._;~) nl~ (0.3c)111AI) de 1 ~lirncilltilanlinc~lrtrrtline et 71.50? nie
(().75 mMI) de
nellmne,ullon~llllide. pui= le milieu reuctionuel a dté agité 2() iiewe', à
tenlhcralurc
Illlhlallle. I_e 11111Ice Icuctiollll~l été conc~'1111C ,oll, pIC,~loll
fedlllte et le Id,Idi
J 2~;lporat(oll a 'te purine par c1lrolllaloerahliic I1<llllde I?r~p~ll'~ii\c
et dltectloil par
pectrt>métrie cle rna,=c (IC'-M.5) e11 é luarnt par un nlcluece I { ~( )'C
11;C'V/ O. 1 ` r '1 1'.A.
il) l_e, iractlon, contI"nalll le plu lnit allelldll olll ele l'dllllle~ et
co(1Ce11llee, a ,e ,~11I,
preõiun rrdaite pour obtenir le produit ~i~ ,ir~~ ,~ u le 1or111.; d uii
solide Falune.
ciulcnlcllt = 55 r L
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
134
h;XFAIPLL, 228
3-J4-J[1-IL3-(1,1-diruéthvléth.N I )ph ri t]sulfon~lj-~ (trilauoromith}1)-llt-
indol2-
lIméth~II-phén%lI-4H-koxa/ul-5-one
[Ille ~olutiotl de ()O illg (1.12 m\l) clc l'acide obt nu selon l'csetmmple 49
dans 5 mL (le tétrah~drtilurane distillé ont été add1[1mwés _'_15-_'6 mg (1.41
nL\I) de
1.l'-carhom Idiinnidazole huis le milieu a été aL'itr b températttnre ambiante
-t heures.
A une solution de 17-1.26 mc (1,32 mil) de malonate d'éthv le dans 5JJ 1111 de
tétrah)droi'urane otrt été additionnés 75,46 mg (0,66 nA!) d'éthoxide de
tnaLnésiuin
puis la suspe~~,ton a été [Ignée 4 heures à température ambiante. Le soly ant
a été
évaporé p u i le solide blanc obtenu a été additionné par fractions au premier
milieu.
L'agitation a été poursuivie 24 heures à température ambiante et 100 mL de DCM
ont
été additionnés puis la phase organique a été lavée trois fois par 50 mL d'
HC1 M. La
phase organique a été séchée par MgSO4 et le solvant évaporé pour obtenir 700
mg
du produit désiré sous la forme d'un solide amorphe orange.
A une solution de 100 mg (0,17 mM) de l'ester obtenu ci-dessus dans 5,0 ml
de méthanol ont été additionnés 28,20 mg (0,85 mM) d'hydroxylamine puis 0,85
ml
(0,85 mM) de soude (IN). Le milieu a été agité 3 jours à température ambiante.
Le
milieu a été dilué avec 50 mL de glace et 5 mL d' HCI et agité 30 minutes. On
a filtré
sur une membrane Wathmann Autocup nylon, lavé par de l'eau et séché sous vide.
Le
solide a été purifié par chromatographie sur gel de silice à l'aide d'un
éluant
cyclohexane /acétate d'éthyle (80120 ; v/v) jusqu'à (50150 ; v/v). Les
fractions
contenant le produit attendu ont été réunies et concentrées à sec sous
pression réduiic
pour obtenir le produit désiré sous la forme d'une poudre blanche (rendement =
46 %),
F= 70 C
hi xlA IPLI: 229
-j-1-[ I 1-I [3-( 1.1-dimétIi léthv l )phin~ I Jsulfom l - -(tril1uoromét1i I
u-111-indol-2-
I [mit h~ I ihenioy I I-I)en/ènesulfonamide
une ~oluti~~n de ~(Jl) n e W.11) nAL de l aeide 1-'1 1-I13 -i l.l-
din]elhv ILI v l )phénv I lytill~,nv f!-~-t uitIIlon>n ejhv l n /I- indol-_-v
l Inléthv I beml/oïyue
eyemple 1~)) dans Ill m1. Je di~hloromeihane. on "t ajouté 7 mg tl).1 nAM)
~1 1:I)C l , fI. erg ((i.;t) nt~ll de -4 dinnétlty lamé uopvridille et 1I l.H
tng ((i _,~ nt\l)
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
135
de heittce ulConanli(ic. pui', le milieu rcaetiounel a été u ité une tallit ü
température
anlhiante. J-C milieu réa(tionnel a etc été concentré sous pre ion rc(Iuitc Ci
le résidu
d Cy uporalion a etc purifié 1 al elnonlalo~raphie lipuidc pJcparativc et
détection par
peetronlctrie (ie nui c tL,C-MS) en éluani par un nidlan,~e 11,0/C1I,CV'/().1
o TFA.
Les l uetlonti Conlenunt le produit attcialu olit été ieuiiie~, et
CouieeutrceS a sec sous
pres,iou1 rcduite pour obtenir le produit déruc ou~, la forme l'un solide
blanc
(reudcnnieuit = 53) F= 99 C
PREPARATION LVI
1-Bromo-3-(2-méthoxyméthoxy-1,1-diméthyl-éthyl)-benzène
A une solution de 5g (21,8 mM) de 2-(3-bromo-phényl)-2-méthyl-propan-1 -ol
dans 50 mL de DCM et 5 mL de diisopropylamine refroidie à 0 C, on a ajouté
goutte
à goutte 2,18 mL (24 mM) de bromo-méthoxy-méthane. Le milieu réactionnel a été
agité 3 heures à température ambiante, puis dilué au DCM et lavé à l'eau. La
phase
organique a été séchée sur MgSO4, concentré sous pression réduite et le résidu
a été
purifié par chromatographie sur gel de silice à l'aide d'un éluant heptane
/acétate
d'éthyle (100/0; v/v jusqu'à 65/35 ; v/v). Les fractions contenant le produit
attendu
ont été réunies et concentrées à sec sous pression réduite pour obtenir le
produit
desiré sous la forme d'une huile jaune (rendement = 41 %).
Le produit a été utilisé sans purification dans la réaction suivante.
PRÉPARATION LVII
Chlorure (le 3-(2-rnéthox,~lmnéthoxy-1,1-diméth%1-éthvl)-benzènesulfonvle
I' te s((Iuti(~n de 1.1)5<e (7.14 nivI) de 1 13 rorut5 (2 nlUtho~FUrlctho~ 1.1
dinlcthtil éth~1) heui/ene. ohtenu h la prcparation L\ I. clan, 1O n1L (Te TI-
1L uI cté
rclroi(lic ul -(,5 C. puis 3.~d mL (S..' nl,A1) de il 13111-1 (,(>lulion de \I
(lun" I'hexanel
ont Clé ~iioutcs ,cafte il nouille :Après 1 heure (l ~initation il h~ (' et 1
heure
(l,aL,iluttion à -h) C. le milieu reuetionnel a c,I ajour u une solution (iC
l( n11, (le
;U dioyvJe tie .(,aire e(,n(lcn,r pur ic IIII= refroidie a C. Le mcluune a C
rechuultd
piodre H~en1CI1t ~tu iju a IeuupCrature euihi iuic CI content e stLH \ lJe. LC
levidu a Cie
repris CI Filtre. Le sohdC (~htcnu a tic place en ~uspen~ion clans l'heptane h
O C et
U .(~( ~~ i , iX11) (le :hlorure (le ,ulCurvle ont été ajoute Goutte a
~(~ullc. Le mitait
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
136
i clc a,,itc 1 heure à 11C 1~ui, la >u~hcn~iun a 1 c liltrée et c~~ncenlrce à
~cc ou,
hre"inrn réduite. Lc uhloruie tic ,ulf,on}lc uhiccu a étc utilisé aii
purification Pain
l'étape ~ni~antc.
PREP:`yRA1iON LN III
cille 4-[[1-[3- -méthory métltoxv 1,1-diméthyl-éthyyl)-phényl]sulfonyl]-5-
trilluorométhyl-1H-indol-2-~I1 mèthNi)-benzoïque, méth% teste r
En opérant de façon ana(t~~ue <> I'e.~c~nple 12, au &lépart du chlorure de
sulfonyle de la préparation LVII et du conzpo' P de la préparation VII, on a
obtenu le
produit aticiidu sous forme d'une huile incolore (rendement = 13%). Le produit
obtenu a été utilisé sans purification dans l'étape suivante.
EXEMPLE 230
Acide 4-[[1-[3-(2-hydroxy-1,1-diméthyl-éthyl)-phénylsulfonyl]-5-
trifluorométhyl-
1H-indol-2-yl]méthyl]]- benzoïque, méthyl ester
A une solution de 12 mg (0,02 mM) d'acide 4-[[1-[3-(2-méthoxyméthoxy-
1,1-diméthyl-éthyl)-phényl] sulfonyl]-5-trifluorométhyl- lH-indol-2-yl]mèthyl
} -
benzoïque, méthyl ester obtenu à la préparation LVIII dans 3 ml- de DCM on a
ajouté
3 mL de TFA. Le milieu réactionnel a été agité 18 heures à température
ambiante,
puis concentré sous pression réduite (rendement quantitatif). Le produit
obtenu a été
utilisé sans purification dans l'étape suivante.
EXEMPLE 231
Acide 4-[[1-[[3-(2-hydroxy1-1,1-diméth vléthyl)phényl]sulfonyl]-5-
(triflut~rométhyl)-1fl indol-2- i]méth~11-brenzoï(Iue
[n ~hcrunt du Iaçvn ailliiLcuc u I c. cinl,lc _' uu déport glu conipo é obtenu
t
l'cycinhlc ? ~O. ou u ohtcnu le nInllx~,c aUcndu ~I)t_IS hormc d'une p uc
intolouc
rcndc nui t = I ~' ).
Il R\1\ WI)kl. ;l)O %lll")
?O = 1,~O t 11). 17 (=. 211 L -1. 211). (,.4(t (~. 111). 7,31 (d, '11 7,40 (t,
1H),
7,55 (m, -,1 l'). 7(f ,~ (J. 111}, 72) r rn. 711). 7.)-1 r rl. 711). 8.24 {d,
1H).
1u cUlll(~o u tiuToii 1 lnvcIut'(I1 dccilt~ ui (1c u1~ ont eU uj iî2 Juin 1C
tahlcau ~Ui~ ai
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
137
TABLEAU I
R4
R7
R1 n~W
R2 \ f0
S
R8 /
Ex R1 R2 R3 R4 R5 R6 R7 R8 R9 Cy
1 5-CF3 H 2-F H H H 4-COOMe H
2 5-CF3 H 2-F H H H 4-COOH H
3 5-CF3 H OMe H H H 4-COOMe
4 5-CF3 H H H H ! 00011 ~~
5 5-CI H 2-F H H H 4-( O4)~Mk H
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
138
6 5-Ci H 2-F H H H ~ Ctx)f [ H ~
7 5-CF3 H H H H H 3-COOMe H -''
8 5-CF3 H H H H H 3-COOH f l H
9 5-CF3 H 2-F H H H 4-COOMe H -~
5-CF3 H 2-F H H H 4-COOH {~ H
11 5-CF3 H OMe H H H 4-COOMe H
12 5-CF3 H H H H H 4-COOH H
13 5-C'F3 H H H H H 4-( cu>1 'tom H '
s` L I
14 i'tt H H H H H 4< ;)x)11 H
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
139
15 5-CF3 H H H H H {-('rï ;il f l H
~F
16 5-CF3 H H H H H 4-COOH H
s
17 5-CF3 H H H H H 4-COOH C R
18 5-CF3 H H H H H 4-COOH H 1
N"N
19 5-CF3 H H H H H 4-COOH H
20 5-CF3 H H H H H 4-COOH 1 f f H
NN /
21 5-CF3 H H H H H 4-COOH i f H
22 5-CF3 H H H H H 4-CC3t}H
23 5~1= H H H H H 4 1 H
~'I H E H H H ~. u)1 H É
f
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
140
25 5-CF3 H H H H H 4-COOH t f H
26 5-CF3 H H H H H 4-COOH H
27 5 -CI H H H H H 4-COOH 1 H
a
28 5-C1 H H H H H 4-COOH H /4
F
F p
29 5-C1 H H H H H 4-COOH H
S
30 5-CF3
H H H H OH 4-COOH H r
31 5-CF3 H H H H H 4-COOMe H
32 5-CF3 H H H H H 4-COOH H
33 5-( !C H H H H OH 4-COOMe H
34 1<.f H H H H H ct.-`.t H
i ILi1111fl(i t H l~ É
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
141
36 5 CF3 H H H H OH 4 Ctx)~1 H ?A
37 5-CF3 H H H H OH 4-COOMe iv r H f r
38 5-CI H H H H OH 4-CO0.ti1e H
39 5 CF3 H H H Me OH 4-COOMe H
40 5 -CI H H H H H 4-COOMe H
41 5-CI H H H H H 4-COOH H
42 5-CF3 H H H H OH 4-COOMe { H
43 5-CF3 H H H H H 4-COOH H
44 CV= H H H H H C >Ã le ~~ r H
45 H H H H H 1 Ct SOI { H
46 C I? H H H Me H 4 C vAt-
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
142
47 5-CF3 H H H Me H 4-COOH
48 5 CF3 H H H H H 4-COOMe H
49 5-CF3 H H H H H 4-COOH } ~. H
50 5-Cl H H H H H 4-COOMe H /
51 5 -ci H H H H H 4-COOH } H
52 H C3 H H H H 4COOMe } H
53 H CF3 H H H H 4-COOH } H
54 4-Cl H H H H H 4-COOMe j r H %
55 4-CI H H H H H 4-COOH H/
L,Q
56 (t_; H 2-OH H H HUC)1[ H
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
143
57 5-CF3 H H H H H 4-COOMe H
/ Br
58 5-CF3 H H H H H 4-COOMe
59 5-CF3 H H H H H 4-COOH
H
60 5-CI H H H H OH 4-COOMe H
61 5-CI H H H H H 4-COOMe l H
62 5-CI H H H H OH 3-COOH H
63 5-CI H H H H H 3-COOH i H C
64 5-CF3 H H H H OH 4-COOMe H r N
65 5-CF3 H H H H H C'Ot iie } f rN
H
1 ~
66 { C"i H H H H H C r i< i; I H
67 5-CF3 H 3-F H H H E I. 1[ C - 1
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
144
68 5-CF3 H 2-OH H H H 4-COOH H
-3
69 5-CF3 H H H H H 2-COOH H
70 5-CF3 H H H H H 2-COOH l H!
71 5-CF3 H H H H H 2-COOH H
lS1
/ l t
72 5-CF3 H H H H H 2-COOH
73 5-CF3 H H H H H 2-COOH H
N ~ * S
74 5-CF3 H H H H H ' Ç(>[)11 H
-No /S
75 5-CF 3 H H H H H 2-COOH
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
145
76 5-CF3 H H H H H 3-COOH H
N a * o
77 1
S C H H H H H 2-COOH .~ H
L,O
78 5-C1 H H H H H 2-COOH H
O
1 1
79 5-C1 H H H H H 2-COOH
a ~ p
80 5_CF3 H H H OH H 2-COOMe CH3
81 5-CF3 H H H OH H 4-COOEt CH3 N
82 5-CF3 H H H 4>}( H
H H H H H CH3
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
146
84 5-CF3 H H H H H 4-COOEt CH3 N
85 5-CF3 H H H H H 2-COOH CH3 ns
86 5-CF3 H H H H H 4-COOH CH3 S
N
87 5-CF3 H CH3 H H H 2-COOH H x I
88 5-CF3 H H H H H 4-COOEt H
N
89 5-CF3 H H H H H 4-COOH H S
N
90 5-CF; H H H OH H 2-COOMe H
91 1 H H H OH H 2-COOH H
s
92 Cf. H H H H 1I ç_nuil H
i ~
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
147
93 5-CF3 H H H O-(CU)~[e l H t
S
94 5-CF3 H H H O 2-COOH H
95 5-CF3 H H H CH3 OH 2-COOH H
96 5-CF3 H H H CH) 2-COOH H
2-
97 5-Cl H H OMe H H 4-COOMe H
4 a
98 5-Cl H H 2
- H H 4-COOH H
Ome
99 5-CI H H OH H H 4-COOH H
100 5-CI H H H 1i. JiZ } CU(JMe } ' H
5-CI H H H CHI H 1
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
148
102 5-CE H H H ( 1 - i l 4-COOH H
103 5-
H H H H OH 4-COOMe H Q
104 5-Br H H H H OH 4-COOMe H
105 5-CF3 6-F H H H OH 4-COOMe
106 5-CH3 H H H H OH 4-COOMe H r
107 4-CI 5-C] H H H OH 4-COOMe H r
108 C,CH H H H H H 4-COOMe H
5-Br H H H H 1.1 4-COOMe
110 --f I-F H H H Il H
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
149
H
111 5-CHI IIIt_4-COOMe
11
2 4-CI 5-CI H H H H 4-COOMe f H
C -..
113 H 7-F H H H H 4-COOMe H
114 C(CH H H H H H 4-COOH H
115 H H H H H 4-COOMe ,/ H C
116 UN H H H H H 4-COOH H C
k ` ~
117 5-CF; 6-F H H k H H 4-COOH H
r f /
118 clH H H H HH
~-ci 5-Cl H H H H
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
150
N
120 5-CF3 H H H H H 4-COOH / ..` H
c o
1 I
121 5-CF3 H H H H H 4-COOH l 1 H I
122 5-CF3 H H H Il H 4-COOH
123 5-CF3 H H H H H 4-COOH H C
I
124 5-CF3 H H H H H 4-COOH H
CII C3-CHF2
125 5-CF3 H H H H H 4-COOH a
H \ 'r
f O
126 5-CF3 H H H H' H 4-COOH H
CHF2
I 1 ! l ~ ~,
127 5-CF3 H H H H H ; 0 )1 gl
1 ~
128 5-CF3 H H H rr H >r,!f H
I
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
151
129 5-CF3 H H H H Ji 4-COOH 1 J' ~ H
I N~.J
'
130 5-CF3 H H H H H 4-COOH H
131 5-CF3 H H H H H 4-COOH N H
~
!E C
I 1
132 5-CF3 H H H H H 4-COOH
C H
133 5-CF3 H H H H H 4-COOH
H
134 5-CF3 H H H H H 4-COOH H
135 5-CF3 H H H H H 4-COOH H 0
136 5-CF3 H H H H H
H
I G!
f+.
137 H H H ~ H H Il H
F
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
152
I J ~ ~
13$ 5-CF; H H 1i H H I 4-COOH H
a ~ / I
139 5-CF3 H H H H 11 4-COOH H
1 ~
140 5-CF, H H H H H 4-COOH H
141 5-CF3 H H H H ,( H 4-COOH H
142 5-CF3 H H H H H 4-COOH H
0-CF3
143 5-CF3 H H H H H 4-COOH
H 144 5 CF3 H H H H H 4-COOH H
145 5-CF3 H H H H H C c , I: 4 CF, H
146 fi H H H H 1r ~)t~ll - r H
1
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
153
147 5-CF3 H H H H I{ -C Cii )l f / CHF H ( ~` 148 CFA H H H F
H H{ 4-COOMe
i / Cs 149 5-CFA H H H H H 4-COOH / F
3 f
E
150 5-C H H H H H 4-COOH ci H
i J =~
151 5-CI H H H H H 4-COOH H Q
I
1
152 5-Cl H H H H H 4-COOH H
153 5-CI H H H H H 4-COOH H
I ï
154 5-CI H H H l'I H H }-; H
155 5-Cl H H Il l i H )f 1. H
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
154
156 1 5-C( H H H H H 4-COOH H
ü-GFi I t
F î
157 5-CI H H H H H 4-COOH
158 5-Cl H H H H H 4 COOH H C
( CFA
159 5-CI H H H H H 4-COOH H
160 5-CI H H H H H 4-COOH l H
Ci
161 5-Cl H H H H H 4-COOH f H ( r
162 5-CI H H H H H 4-COOH H
Tç
163 5-C1 H H H H H 1 ()!)H
164 5-CI H H H H I H 4,~õ~1I J 1 GI H
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
155
165 5-Cl H H H I
H 1 4-COOH
H I
t 7
166 5-CI H H H H H 4-COOH f O~ H C
I ~
167 5-CI H H H H H 4-COOH H
F
168 5-Cl H H H H H 4-COOH H C
169 5-CI H H H H H 4-COOH / `N C
H
170 5-CI H H H H H 4-COOH H C
Q
171 5-Cl H H H H H 4-COOH H C
172 5-CI H H H H! H H il
173 5-CI H H H I H H H
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
156
174 5-C1 H H H H H CC~C~H / H f
s` s I,
175 5-CI H H H H H 4-COOH H C
176 5-CI H H H H H 4-COOH CH,CH3 H
177 5-Cl H H H H H 4-COOH (50 H 178 5-CI H H H H H 4-COOH f C H
p
179 5-CI H H H H H 4-COOH H
f .'
F
II I
180 5-CI H H H H H 4-COOMe CH3 H
181 5-CI H H Ii i[ H i--tE)<>i( CII, H
., r I H H H H H ç (~r )1ir (~ r` H I
0
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
157
E !
183 5-CF H H H
H H-t"C)() Ii H
}
184 5-CF3 H H H OH CH3-COOMe H 3
185 5-CF3 H H H j IT H 3-COOMe CH3
186 5-CF3 H H H H H 3-COOH CH3
187 5CF3 H H H OH H 4-COOMe CH3
188 5CF3 H H H H H 4-COOMe CH3
189 5-CF3 H H H H H 4-COOH J CH3 C
r
190 H (i
)(J`.lr ( H
S f s
f { +
[91 t[ H H H OH H I ~I
H I I
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
158
192 5-CF3 H H ii il Fi 4-COOMe H
193 H H H H} OH H 4-COOMe ! ti H
194 H H H H H H 4-COOMe H
195 H H H H H H 4-COOH H
196 5-CF3 H CH3 5-F H H 4-COOH H
197 5-CF 3- -
H H CHI H H 4 COOH H
198 5-CF3 H H H H H 4-SO2NH2 j H C
199 H H r t; H 3-C(i()i i H
H H 5-F H H I 1 H
LL-LLI-il LL ~'L
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
159
f j
201 5-CF3 H H 6-1 H 3-COOH H
202 5-CF3 H H o me H H 3-COOH H
203 5-CF3 H 4-CI 6-F H H 3-COOH H
204 5-CF3 H H H H H 3-COOH
205 5-CF3 H 3-CI H H H 4-COOH H
206 5-CF3 H 2-CI H
H H 4-COOH H
207 5-CF3 H 2
ome - H H H 3-COOH / H
208 5-CF3 H Il \IL , H I1 3-COOH f \ H (?
' ) ) 1 y-CF3 H 2-CI H H H I) ( H
f ç ~
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
160
210 5-CF H H 6-F H 11 3-COOH H
É I j /
211 5-CF3 H 2 -CI H H H 1 COOH H
1
212 5-CFi H H 6-F H H 3-COOH N H C
N t
213 5-Cl H H H H H 3-COOH I
H
o"J
214 5-Cl H H 4-F H H 3-COOH
f
215 5-CF3 H H H OH H 4-COOMe H -''
216 5-CF3 H H H F H 4-COOMe H
217 5-CF-3 H H H F il H
218 5-CFA H H H H
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
161
214 5-CF3 H H H O 4-COOH H C
r i
220 5-CF3 H H H H H 4-CN H
I NIN 1N
221 5-CP3 H H H H H N H
d
222 5-CF3 H H H H H N~-N H
4-'
H
223 5-CF3 H H H H H d H
4- ('.
O
224 5-CF3 H H H H H Nid H
I 4-d
N
N
225 5 CF3 H H H H H eNH, H
(ti i 3 4-
z
H H H H H I\
N -S-
-3 H H H H H H
j I I 4-
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
162
ë_ o a
228 5-CF1 H H Fi H H N
Il H
229 5-CF3 H H H H H fl 1 H
7 /'
230 5-CF3 H H H H H 4-COOMe / OH H
ï a
231 5-CF3 H H H H H 4-COOH oui H ( s
Activité pharmacologique
Les composés de l'invention ont été soumis à des tests biologiques de façon à
évaluer leur potentiel à traiter ou prévenir certaines pathologies
neurodégénératives.
Dans un premier temps, on a mesuré, par un test in vitro, l'aptitude des
composés selon l'invention à se comporter en activateur des hétérodimères
formés par
le récepteur nucléaire NURR- 1 et les récepteurs nucléaires RXR.
Un test de transactivation a été utilisé comme test de screening primaire. Des
cellules Cos-7 ont été co-transfectées avec un plaçmîde exprimant une chimère
du
-éc pteur humain NITRR-1-Gal4, un plasmide exprimant le récepteur humain RXR
+<réccpt~-irr RXR(r, oa R\R;) et un plrrinide rahlx~nrur `Ctrt4pGGL3-TK-Luc.
Les
ti i~'jccti~nls r)I1 érc r( r:i~~e~ à l'ai~1c LI',ul a~~cni chr nique (J~'t
Pl)I).
nnt cté d1 trih :c,:~ (l~ul> les j l,iyuc~ 384 puits et
:.ris,éc; .,~1 1 1rn hc.uinnt , l hctrc,.
~u terril>> --I Irrrir~ I~ milieu 11c culture a clé ~Ilaa~~. s p cul;rit~ 1
lester ont
été ij(?IIR (~U1i0001C1iU(~n I!IIaIC C~1R7{~1'i c :I111C 11) Cl 3. (( Mi
ll,çll~ ~~' I11 il~,r: tlt2
c11:tlliC. :~l~i'Cti I_ill: tllIi il 3r1Cllj-~ULt~n, l C\hi~ti~;t?it CIC ll1,
e_;1?~ :1 CtC ?ll~'~l'rcr ;.(II'C~
il(li ili 11 (k ~li'11LIV(iI l ~~'I~II1 lC:~ ill~ti,lLt[Olls lli:
f'l'~1'IC(,11I ~Pr~~'1 C I).
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
163
L'acide L métl~}I- -1l n~I z-l~ prc~pcri 1) pvriuiidintil~an~ino~
bcui~)icluc (rnonunc qui a été décrit dans l'article de w'allen \lac1 enl.ie
et al. publié dauls Genes L De clu pinciit 17, pactes (J)(> 3O47) à 2.10' stil
la~oni~1e
RXR) a été utilisé comme rclHreuce.
Le ni\ eaux (l induction (dc~i~né par I eshrc . ou "el'licacitc ) Ont été
calculé
par rappcri à I*activ lie basale tic ch aclue hétcr~xlimcre. Les ré;ullaN out
cté ezprinlés
en pourccnta~Ce (lu niveau d'inductiort par rapport au niveau (I iuductioon
obtcrnu avec
1a rdlcrence (le niveau d ' ïriduction de la rélcr-cuce est ru liitrairemertt
éLnal â 100 %).
Les composés selon l'invention présentent tn taux d'induction allant
jusqu'à 150 % (NURR1/RXR(x) et 152 c (NURR1/RXRy) et des EC50 allant
jusqu'à 0,2 nM (NURR1/RXR(x) et 8 nM (NURR1/RXRy).
A titre d'exemple, parmi les composés selon l'invention, on obtient les
résultats
comparatifs suivants exprimés en pourcentage par rapport à un composé de
référence
activateur NURR- 1 /RXR (XCTO 135908):
Exemple hNurrl_RXR7FL hNurrl_RXRaFL
EC50 (nM) Eff (%) EC50 (nM) Eff (%)
8 99 74 101 96
40 2108 75 560 96
56 417 51 1161 82
51 1130 69 801 74
49 110 71 48 73
43 616 79 29[ 73
45 201 50 97 70
59 297 31 274 l0
13 528 36 207 (u)
14 778 30 396 69
219 62 103
(;8
1 746 I 54 372 (,O
16 628 45 617 (16
1 71.8 60 -112 65
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
164
943 406 2 724 -13 637 03
18 668 34 407 60
12 148 45 113 54
617 44 293 54
68 553 43 343 51
864 33 496 47
21 240 35 121 46
22 346 43 207 45
28 443 67 332 78
66 110 79 71 80
67 91 75 28 73
85 115 73 53 87
69 15 72 9 79
70 8 91 5 94
73 66 89 37 94
89 611 62 265 77
86 1479 34 490 56
71 95 82 47 61
77 457 38 224 74
91 nd nd 72 10O
94 nd nd 1240 116
74 nd nd 40 150
nd ncl 66 11 i
nd nul 63 1
nd nd 331,
11(
d nd 724 147
nd nd 72 131
nd nd 209 99
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
165
57 id nd 30 1?3
00 nul nd 339 54
05 > 10 000 S 2122 64
)`) 989 47 569 50
2 676 2 7 363 49
lUS 646 77 157 110
110 63 95 15 92
114 145 76 63 109
116 1445 50 871 74
117 91 73 39 84
118 473 65 279 75
119 266 82 65 71
113 1862 97 > 10 000 103
120 661 49 202 68
121 433 56 192 65
122 680 54 353 62
123 646 36 217 60
124 697 44 349 59
125 724 101 808 61
126 141 32 122 44
177 575 45 263 48
125 .1585 36 337 44
1_0 nul nd 804 41
130 1698 22 347 30
1 1 1479 21 603 30
13_' 352 28 221
_~ 45
133 304 38 177 '19
511
134 552 36 212
1 917 19 643 3 L
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
166
136 > 1(1 000 25 275 35
137 730 18 529 37
138 583 28 344 41
139 344 4" 202 46
140 387 7? 368 46
141 364 30 285 41
142 816 19 459 38
143 425 18 339 33
144 > 10 000 19 839 30
145 638 21 359 44
146 1177 24 619 43
147 1095 30 825 49
148 121 101 62 119
149 225 80 94 98
150 501 96 299 103
151 > 10 000 17 427 80
152 858 75 269 87
153 1391 63 851 85
154 1365 66 472 68
155 468 59 262 69
156 130 3 43 638 69
157 838 64 267 67
1259 53
504 66
15f) 785 45 319 66
1 l;() 1391 55 462 59
101 584 40 460 59
lr~~ 1549 40 692 56
lrll 933 34 427 53
I 851 47 753 53
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
167
1( 2929 37 11-42 51
16(5 1072 27 681 50
167 2436 40 1138 48
1 501 52 -422 48
1 h~) 2493 28 1012 46
170 > 10 000 26 1738 42
171 944 31 510 40
172 567 47 117 82
173 498 73 145 78
174 813 37 593 47
175 > 10 000 14 331 38
176 > 10 000 21 3388 33
177 > 10 000 17 > 10 000 39
178 1196 36 1029 45
179 > 10 000 26 331 62
181 4074 152 1365 111
182 154 85 55 83
183 95 91 47 80
186 288 68 124 93
189 263 90 120 83
190 13 107 0,2 97
192 > 10 000 58 1122 85
194 316 36 344 42
1 1169 56 029 57
1'1(i 479 I 91 241)
1`) 392 52 278
1 10 (1()O 86 7943
nd 22 115
( d nd 92 93
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
168
~t)1 nd nd 3 00
202 nd nui 19 104
203 nd nui 85
?U 195 1); 107 102
2115 nd nd 98 75
206 363 85 174 71
207 nd nd 513 48
208 nd nd 240 31
209 741 51 333 69
210 81 68 69 70
211 465 56 385 83
212 40 81 19 80
213 > 10 000 31 3003 45
1-14 804 55 681 75
217 355 80 149 83
219 3199 32 1132 57
221 162 57 191 66
222 676 55 367 62
223 3388 30 1318 72
226 > 10 000 70 465 82
227 316 86 219 73
335 63 113 90
220 303 70 157 60
25 16-1 6 65 1
1Al ,intn ic : <,(Iicncit en p ti rahJ,~,rt à la reCSiciic (~ 1(ll 50O
~O ; non dcicI nl(nS
1110 5/01111010 ~0ri0 110 t0,t~ 0/ , r,, 11 OI SrntiulnS0 ~IvC yncipnc~ ni
ni51i~S
cl_in l invnnIloIl. clan, le 5111 Ll0 Jntnminer 10111 pioiil phiiiiu
noniucli5tin
S1n~Inatiplnc 0t 0c10hra1 0h0z la ~oii i~ (511310, 111010' et .r1i(icF nin~i
iluc I ~1>n~5u~c
Si Clet lu hn11i010 ICnr1IOOI1L~0=Shn115110.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
169
Lep tocole ,uiv ont a etc utilise.
1)o souris Male, C5 R10 (2> 0 -e) prévenant de,, etahlis,einonts Janvier, Le
C;enc,l St I,le. I ruice ont etc utilisées pour eeiie étude ( 1 2 ouri', par
do',(!).
Les eiiiiiieux ()lit été iaou.l_ris avec de le nourriture ,tandard pour
r~?n~retlrs
(Purine Mill.. Si. Louis, X10). placé,, dans dc, cave, et ,ouulis à de, cycles
lunii~re/oh,eu itc rie 1 h/12h. le température de piège étant maintenue à 22
`' C et le
taux d,liumiditc à 10 `;( .
Les ;oiiris mont pas etc à jeun évent l'edniiiüstreiiot>. L'eau a été
fournie à v olonté durant toute l'étude.
Le composé à tester a été administré par voie orale à 10 mg/kg.
Pour 1"administration orale à 10 mg/kg, les animaux ont été gavés avec
10 mLJkg d'une suspension du composé à tester, préparée dans de la
méthylcellulose
400cp1%.
Les animaux ont été sacrifiés sous anesthésie aux temps 15 mn, 30 Mn, 1 h,
3 h, 6 h et 8 h après gavage.
A chaque temps, et sur chaque animal sacrifié, le sang a été collecté et le
cerveau a été prélevé.
1 mL de sang collecté dans des tubes de 1,5 mL contenant 20 pL
d'anticoagulant évaporé (solution d'héparinate de sodium à 1000 UI/mL) a été
centrifugé à 4500 g pendant 3 min pour obtenir environ 400 pL de plasma. Le
plasma
a été réparti en 2 aliquotes de 200 pL qui ont été conscrvc, à -20 C jusqu'à
extraction
par précipitation protéique puis analyse par chromatographie liquide couplée
it la
,pcetrométric de niaõe teiidein (LC-NIS/ 1S) pour la quentlf'ication du
compo,0 tc,t:é.
Le,, ce~ ceux ont cté pJongés Taus I e/ote liquide directement apte,, le
~~ prclc~cnient_ puis eonscrrés à 'C pote- enelr~e. 1,(2-, cerveaux ont
ensuite été
iu'or e, en pre,cnee de inclenoc equcuxOol~ ont or conicine afin d obtenir Lui
Iloinoecnet. c 1li~Inoe1neK ont c rtlltc Cté eeni itned et le eonlpo c tevtd e
été
corail e partir du ,urnaeeeiii oàtenu. par lise e,~treetir>n liquide liquide,
pni', quentitid
par LC-NIS'AIS.
?(~ Lei pltrai ni'e plierni<Ie iuétique , ont etc dc~tc rniinc~ ~l Irtir d un<
epproeh~
non eoinperlimeiuele >ou, 1-xeel. L o ie ~Oui, le ciuuhe (:Al C', H e etc
déterminée par
la nictliode ilepe/oldele laide rc. (cttc nicthiulr p~rnict une: e~tinieti~~n
de l intdenile
de, eonec'nueilon> pend,, it 1111 ntei'v Mlle dl' (enip~ (AI CO i Cl ut ha>ee
tiin' le oiuiue
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
170
de, aires des trope/e dc'linlttcs par le, coi eutratiom nle~urés arly temps de
pr~lèvcmm~t (c~cmple t~LCO 5}1- :~L1CU p,"~h + .fil C it, p li 0.~h + 'M
'C0.511 t +
La pcnétïation des composes à travers la lru, fière h~ moto encephalipue est
évaluée par le rapport de FAUC mesurée dans le cerveau sur celle Inn u;'ee
dalis le
plasma.
titre d'cyclnple, avec les composés des exemples 32 et 49 on a obtenu les
résultats suivants
Données PK après administration
Composé orale : 10 mg/kg chez les souris
AUC cerveau Ratio
(n .h/mL) AUCcerveau/AUC Iasma
Exemple 32 3763 0,8
Exemple 49 10491 0,8
Les résultats obtenus montrent que ces deux composés pénètrent la barrière
hématoencéphalique de manière satisfaisante.
Une seconde série de tests in vivo a été pratiquée avec tes composés selon
l'invention. dans le but de vérifier que les molécules possèdent bien l'effet
neuroprotecteur attendu.
Les composés (les exemples 32 et 49, ont été testés sur un modèle de souris
trait<~e, par la I mcth;l d pllcmyl l.'.3.(~ ictralr~drop~ridine (\1P1P) afin
de
continuer leur, llctiv le pole tiellcs. T.a MPTP est une neurotoxine qui
provoque les
rnpil~n~es pcrnru~ent, de 1a maladie de Parkiii on en ~Ictrudant certains
ncllrl>ue,
lrl,uh,t~uttia niera du cerv au. Le protocole ,uiv~uu (l ètc utilisé.
l)e, sourk néim (~713L(~/J ü~uee~ de Il)-12 ,enriine au début des étude,. ont
cté r2parilc, par proUpe de allnllally. l,es Colnpo,', ollt ete adnlllllyire>
par vole
or;lle, tol, par lolll pendant I I jour, au tot,ll, l_ allllllnl~lrlllll)Il a
co111117encé ? WHm,
avant le traitement mec la toxine AlP1 P à 2é ne ke. l.a ~Il'I P a été
a~lmini,trée 1_1ne
foi, par Jour par injection illtra p~~ritoueale pendant jour;. 1_
~ldnlini,tration ale,
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
171
cumht>,é, à te,tcr a été horu,uivie henriaut ~~ 1out-~ thré, le traitement à
la :AIPTP. Un
1110ul)c (le ~c~uri, a reçu le vchiciil~ 'eut (',()lution de
mctllvIcclltil(),e 'i 0.51- ( ), Les
aniniaity ont été culhanusid ,y~rés le dernier L,av a,-ie et le ,tri itnin a
été hrélcv d. La
dolrrmine a été c.ytraite du ,trrltunl et la qutntité tic dlolrlnrinc (D:-A)
c.yhrimce en n
par g tic striatutn (moyenne SE\I) a été nic,urée par chroiuato,ra(~hie
linaire haute
hcrl'r>rinancc (CLHP) aycc détection élecuochinridue.
Le, 1 iiltat, obtenus ont été tcporté, dan, les figures 1 et 2 annexées.
Ccs rLno1i ats moritrettt clac l acinûni,tration de la MPTP provoque une
diminution caractéristique du niveau de dopamine dates le striatum et que les
contpo,és selon les exemples 32 et 49 diminuent de manière dose dépendante
l'action
de la MPTP, une toxine qui provoque un syndrome parkinsonien.
On observe ainsi un effet significatif aux doses de 10 et 30 mg /kg : les
composés de l'invention, administrés par voie orale, sont capables de rétablir
l'activité dopaminergique inhibée par la MPTP au niveau du cerveau.
De tels composés, qui traversent la barrière hématoencéphalique et possèdent
un effet favorable à la communication entre les neurones, peuvent
avantageusement
être utilisés en tant que principe actif d'un médicament destiné au traitement
de la
maladie de Parkinson.
Ces résultats in vitro et in vivo montrent que les composés de l'invention
sont
capables de modifier les mécanismes de la maladie sur certains modèles
cellulaires et
animaux et de stopper le processus dégénératif en générant des agents
neuroprotecteiirs permettant de lutter contre la mort cellulaire des neurones
dopaiinerciques. Ils continuent donc l'intérêt de ces composés pour leur
utilisation
en tant clac principe, actif, de niédicanrcnts destinés à la prévention c
i/oti au
traitement des maladie, nernridccdnérative,, Ctplus partictuliércmcnt, de la
maladie de
I. ln\cuhion concerne dciilcnicnt une e(>nlpo itiou phunnuecntiquc coutenuui.
cu tarai que principe actif. au nioin, nu c~~,nipo c ~Ic l,i formule i l). ou
l'un de
pliarinuccutiprenient acccptahlc.
Scion tin autre a,pcet. 1,1 pré,cnte clcnruuulc v i,c à couvrir l'utili~aiion
thune
elle c~~rnp~~,iti~~n pliarniaeeutiyue pour la prévcnti.>n cti'ou le
trtitcntcttt de, nialurlic,
l,tn, Ic=c{ricllc, le récepteur \I RR 1 c,t iinpliptlé. iiotuuuucnt Ir,
mtlarlic,
ncur<xlccfitdr,itivc,, et plu, puirtictiliercuieru lt maladie de P,irhin,on.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
172
Selon encore un autre a,pect, la prc,eilte clei~rulcie vise n couv rie une
nnetIlode
cle prcv ention et/ou de traitement pie, uunludie< dans le,quelles le
rceepteur NL1 R-1
ut impI flue. notamment les maladie, neurorlé,ecnér~tti~~ , et plus
particttlierement la
maladie (le Parkinon. lui coni,te ü a~iminktrer ü un patient en avant besoin
une
<luautitc thcrapeuti~luen~ent etficace d un e nipo;é (le formule I ou dune
composition
pilarmaceutiyne contenant un tel comp<~;é.
C'e, compo,ition, pharmaceutique, peuvent être préparées (le lacon elaõique,
à l'aide dexcipients pli rmaceutiquement acceptable:, afin d'obtenir de, fol-
mes
administrable, par voie parentérale ou, de préférence, par voie orale, par
exemple des
comprimés ou des gélules.
Dans le cas de formes injectables, on utilisera avantageusement les composés
de formule I sous forme de sels solubles dans un milieu aqueux. Comme indiqué
précédemment, les sels sont préférentiellement formés entre un composé de
formule
lb, Id ou Ik (acide) et une base non toxique pharmacologiquement acceptable.
La
formulation peut être soit une solution du composé dans un milieu aqueux
isotonique
en présence d'excipients solubles, soit un lyophilisai du composé auquel le
solvant de
dilution est ajouté de façon extemporanée. Ces préparations pourront être
injectées
sous forme de perfusion ou en bolus en fonction des besoins du patient.
De façon pratique, en cas d'administration du composé par voie parentérale, la
posologie quotidienne chez l'homme sera de préférence comprise entre 2 et 250
mg.
Les préparations administrables par voie orale seront de préférence présentées
sous forme d'une gélule ou d'un comprimé contenant le composé de l'invention
broyé
finement ou mieux, microni.,c, et nié fané atiec Lies excipients connus de
l'liozminie du
métier, tels que par exemple clu lacto,e, de l'amidon prégélatinisé et du
stéarate de
uiaenC,illnl.
:A titre rl'esemplc. on u Lraanulé un tuclauge con,tituc (le 51)0 u (Iu
comupo,é ide
Feven~pie 2 tincment I~ru~c. ~(ltt e et an~i~lou préeéini nié. 12h0 de
lac(n.e. 1 e (le
Iaun (sulfate de ,orli~nn et > >5 e (le p~d in~ Ilkrrolirlonc. Ce meJan~ce
~,raulllé Il
en.uile etc ail~liiionné ~I ~(1 e ale >menrate cle ~naenc,ium et t) (le
celli_tlo'e
/1) IIncrocr ti(allune et le nlel,lnee obtenu a été réparti apure l~r(~Vae et
tanll,~ ee dan, cleti
eélllle de FCO IltL. On n hindi obtenu (le, ~eéll_Ile sont riant chacune ~(~
üIg de
principe actif.
CA 02772697 2012-02-29
WO 2011/030068 PCT/FR2010/051884
173
De 1içoii pratique. CI] ca; (I Idmirli~ti tion du ComhO'c ]Tir vz~ie OTalc, la
hc~:~~l~~cie LIImil üenuC clle7 'homme "era de hrblhience ce~~>>hrise entre 5
et SOU m g.