Note: Descriptions are shown in the official language in which they were submitted.
WO 2011/064508 PCT/FR2010/052543
1
Utilisation d'un composé dipyridyl pour traiter la rosacée
La présente invention se rapporte à l'utilisation d'un composé de formule (I)
dans le
traitement de la rosacée.
La rosacée est une dermatose inflammatoire commune chronique et progressive
liée
à une relaxation vasculaire. Elle affecte principalement la partie centrale du
visage et
se caractérise par un rougissement du visage ou des bouffées de chaleur, un
érythème facial, des papules, des pustules, une télangiectasie et parfois des
lésions
io oculaires appelées rosacée oculaire. Dans des cas graves, particulièrement
chez
l'homme, le tissu mou du nez peut enfler et produire un gonflement bulbeux
appelé
rhinophyma. La rosacée évolue sur plusieurs années par poussées aggravées par
différents stimuli comme les variations de température, l'alcool, les épices,
l'exposition solaire ou les émotions.
La rosacée est classifiée en 4 sous-types en fonction de diverses
caractéristiques
cliniques (Wilkin J et al, JAAD, 2002, 46: 584-587).
Les caractéristiques primaires (bouffées vasomotrices, érythème persistant,
papules
et pustules, télangiectasies) et secondaires (sensation de brûlure ou de
piqûre,
plaques d'oedème, manifestations oculaires, changements phymateux) de la
rosacée sont souvent observées en association. Les modalités d'extériorisation
ou
combinaisons de signes les plus communes sont provisoirement regroupées en des
sous-types spécifiques, qui sont décrits ci-dessous. Chaque catégorie comprend
le
nombre minimal de signes suffisants pour poser un diagnostic du sous-type
correspondant (encore que les modalités d'extériorisation ne soient pas
nécessairement limitées à ces signes), et il est possible que des patients
présentent
simultanément des caractéristiques évocatrices de plus d'un sous-type de
rosacée.
Sous-type 1 : Rosacée érythématotélangiectasique
La rosacée érythématotélangiectasique se caractérise principalement par des
bouffées vasomotrices et un érythème facial central persistant. La présence de
télangiectasies est commune, mais non essentielle au diagnostic de ce sous-
type.
WO 2011/064508 PCT/FR2010/052543
2
Un oedème facial central, des sensations de brûlure et de piqûre et une
rugosité ou
desquamation sont également parfois observés. Des antécédents de bouffées
vasomotrices seulement sont communs chez les patients atteints de rosacée
érythématotélangiectasique.
Sous-type 2 : Rosacée papulo-pustuleuse
La rosacée papulo-pustuleuse se caractérise par un érythème facial central
persistant et par des papules et/ou pustules transitoires distribuées au
centre du
visage. Toutefois, les papules et pustules peuvent également toucher les
régions
io péri-orificielles (c.-à-d. les zones péribuccales, périnasales ou
périoculaires). Le
sous-type papulo-pustuleux rappelle l'acné vulgaire, mais les comédons sont
absents. La rosacée et l'acné peuvent coexister et, outre les papules et
pustules
évocatrices de rosacée, les patients concernés présenteront éventuellement
également des comédons. Les patients atteints de rosacée papulo-pustuleuse se
plaindront parfois de sensations de brûlure et de piqûre.
Ce sous-type est souvent observé avant ou en même temps que le sous-type 1 (y
compris la présence de télangiectasies). Les télangiectasies risquent d'être
masquées par l'érythème persistant et les papules ou pustules, et elles ont
tendance
à devenir plus manifestes après un traitement fructueux de ces composants à
l'effet
dissimulant.
Sous-type 3 : Rosacée phymateuse
La rosacée phymateuse se manifeste par un épaississement de la peau, des
nodules à la surface irrégulière et une tuméfaction. Le rhinophyma est la
présentation la plus commune, mais la rosacée phymateuse peut affecter
d'autres
territoires, y compris le menton, le front, les joues et les oreilles. Chez
les patients
atteints de ce sous-type, la présence d'ouvertures folliculaires grossies et
proéminentes est parfois rapportée dans la région affectée, ainsi que des
télangiectasies.
Ce sous-type est souvent observé avant ou en même temps que les sous-types 1
ou
2 (y compris la présence d'un érythème persistant, de télangiectasies, de
papules et
de pustules). En cas de rhinophyma, ces stigmates additionnels risquent d'être
particulièrement prononcés dans la région nasale.
WO 2011/064508 PCT/FR2010/052543
3
Sous-type 4 : Rosacée oculaire (ou rosacée ophtalmique)
Le diagnostic de rosacée oculaire doit être envisagé quand un patient présente
un ou
plusieurs des signes et symptômes oculaires suivants : aspect larmoyant ou
injecté
de sang (hyperémie conjonctivale interpalpébrale), sensation de corps
étranger, de
brûlure ou de piqûre, sécheresse, démangeaisons, photosensibilité, vision
floue,
télangiectasies de la conjonctive et du bord de la paupière ou érythème de la
paupière et périoculaire. Une blépharite, une conjonctivite et une
irrégularité des
bords de la paupière sont d'autres signes éventuellement détectés. Un
chalazion ou
io une infection staphyloccique chronique se manifestant par un orgelet et
dont la
cause est un dysfonctionnement des glandes de Meibomius est un signe fréquent
d'affection oculaire liée à une rosacée. Certains patients se plaindront d'une
baisse
de l'acuité visuelle, qui est due à des complications cornéennes (kératite
ponctuée,
infiltrats cornéens/ulcérations de la cornée ou kératite marginale). A lui
seul, le
traitement de la rosacée cutanée peut être sans effet sur le risque de baisse
de
l'acuité visuelle associée à la rosacée oculaire, et une approche
ophtalmologique
sera éventuellement requise.
Enfin, il existe d'autres formes plus rares de rosacée (variants), en
particuliers la
rosacée granulomateuse.
Le diagnostic de rosacée oculaire est le plus souvent posé quand des signes et
symptômes cutanés sont également détectés. Toutefois, il n'est pas nécessaire
que
des signes et symptômes cutanés soient présents pour poser le diagnostic, et
des
études de faible envergure suggèrent que jusqu'à 20 % des patients atteints de
rosacée oculaire peuvent développer des signes et symptômes oculaires avant
que
des manifestations cutanées ne soient manifestes. Des lésions cutanées sont
les
premières à apparaître chez la moitié environ de ces patients, et des
manifestations
des deux types surviennent simultanément chez une minorité d'entre eux.
La rosacée survient généralement entre l'âge de 25 et 70 ans, et elle est
beaucoup
plus commune chez les gens au teint clair. Elle touche plus particulièrement
les
femmes, bien que cette affection soit généralement plus sévère chez l'homme.
WO 2011/064508 PCT/FR2010/052543
4
Classiquement, la rosacée est traitée oralement ou par voie topique. Les trois
agents
approuvés par la FDA pour le traitement topique de la rosacée sont le
métronidazole, l'acide azélaïque et le sodium sulfacétamide-sulfure. Il
n'existe qu'un
seul traitement par voie orale approuvé par la FDA pour la rosacée, l'Oracea,
formulation à libération contrôlée à base de monohydrate de doxycycline (Nally
JB &
Berson DS, J Drug Dermatol, 2006, 5: 23-26; Baldwin HE, J Drug Dermatol, 2006,
5:
16-21; Baldwin HE, Skin Therapy Letter, 2007, 12: 1-9).
Toutefois, les thérapies disponibles sont uniquement suppressives et non
curatives.
En outre la rosacée est parfois résistante au traitement. Elle reste une
pathologie
chronique avec un profil typique de rémission et d'exacerbation, associée à un
impact psycho-social important.
La pathogenèse de la rosacée est mal connue, et peut impliquer plusieurs
facteurs.
Ce sont par exemple des facteurs vasculaires (réactivité vasculaire anormale),
immunitaires, ou encore des facteurs exogènes comme la présence de micro-
organismes folliculaires telles que les bactéries et les acariens Demodex
folliculorum
(Diamantis S & Waldorf HA, J Drug Dermatol, 2006, 5: 8-12; Wilkin JK, Arch
Dermatol, 1994, 130: 359-362; Buechner SA, Dermatology, 2005, 210: 100-108).
Par ailleurs, des recherches notamment cliniques tendent à suggérer que la
rosacée
est une pathologie inflammatoire.
Une sur-régulation des cytokines pro-inflammatoires et des métalloprotéinases
de la
matrice (MMPs) contribue à une vasodilatation chronique et à une dégradation
continue de la matrice dermique. De nombreuses études décrivent une expression
et
une activité accrues des MMPs, comme les MMP-8 et MMP-9, chez des patients
atteints de rosacée (Bonamigo et al, J Eur Acad Dermatol Venerol, 2005, 19:
646-
647; Mââttà M et al, Graefes Arch Clin Exp Ophthalmol, 2006, 244: 957-962;
Sobrin
3o L et al, Invest Ophthalmol Vis Sci, 2000, 41:1703-1709; Afonso AA et al,
Invest
Ophthalmol Vis Sci, 1999, 40:2506-2512).
Une diminution de l'expression et/ou de l'activité de certaines MMPs a été
associée à
un bénéfice thérapeutique dans le cas de la rosacée.
WO 2011/064508 PCT/FR2010/052543
Les dérivés de tétracycline, qui incluent la doxycycline, possèdent non
seulement
une activité antibiotique, mais également des propriétés anti-inflammatoires.
Ces
effets anti-inflammatoires dus à la doxycycline incluent une diminution de la
production de cytokines pro-inflammatoires, une inhibition de l'expression de
5 l'enzyme NO synthase, et une diminution de l'expression et/ou de l'activité
de
certaines MMPs, comme les MMP-1, MMP-2, MMP-8, MMP-9, MMP-12 et MMP-13
(Del Rosso JQ et al, JAAD, 2007, 56: 791-802; Webster G et al, Dermatol Clin,
2007,
25 :133-135 ; Weinberg JM, Cutis, 2005, 75 (suppl 4) : 6-11; Golub LM et al,
Adv
Dent Res, 1998; 12:12-26).
Cependant, les traitements oraux à long terme avec les dérivés de tétracycline
pourraient être problématiques pour de nombreuses raisons, en particulier pour
leurs
effets secondaires significatifs. L'administration orale de tétracyclines peut
induire
des désordres comme une vulvovaginite à Candida, des désordres gastro-
intestinaux, et même une hypertension intracrânienne idiopathique (ou
pseudotumeur cérébrale) (Del Rosso JQ, Cutis, 2000, 66 (suppl 4): 7-13;
Bikowski
JB, Cutis, 2000, 66 (suppl 4): 3-6; Rebora A, Am J Clin Dermatol, 2002, 3: 489-
496).
Les traitements actuels disponibles présentent des effets secondaires
désagréables
pour le patient. De plus, aucun des traitements existants ne permet de traiter
et/ou
prévenir efficacement l'ensemble des symptômes associés à la rosacée.
Considérant
la nature chronique de la rosacée, un traitement idéal nécessite un usage qui
peut
être prolongé et ceci d'une manière sûre et efficace.
L'un des avantages de la thérapie par voie topique est l'application directe
sur la
peau, ce qui évite les effets secondaires systémiques.
La présente invention a notamment pour but de proposer un traitement efficace
de la
rosacée, qui limite les effets. De préférence, ce traitement est effectué par
voie
topique, ce qui évite tout effet secondaire systémique.
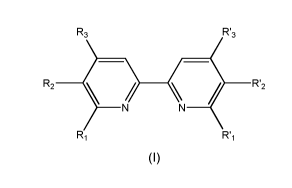
La présente invention a donc pour objet des composés de formule (I) suivante:
WO 2011/064508 PCT/FR2010/052543
6
R3 R'3
R2 \ / \ / z
R, R'1
(I)
dans laquelle R1, R2, R3, R'1, R'2 et R'3 représentent chacun indépendamment
un
atome d'hydrogène ou un radical alkyle linéaire ou ramifié ayant de 1 à 6
atomes de
carbone, ou leurs sels pharmaceutiquement acceptables,
pour leur utilisation dans le traitement de la rosacée.
De préférence, le composé de formule (I) ou ses sels est utilisé dans le
traitement
d'au moins un sous-type de rosacée choisi parmi la rosacée
1o érythématotélangiectasique, la rosacée papulo-pustuleuse, la rosacée
phymateuse
et la rosacée oculaire.
La présente invention a également pour objet l'utilisation d'au moins un
composé de
formule (I) pour préparer un médicament pour traiter la rosacée.
Les composés de formule (I) selon l'invention peuvent être utilisés en tant
que tels,
ou bien sous forme de sels pharmaceutiquement acceptables.
Par sel pharmaceutiquement aceptable , on entend notamment un sel avec un
acide inorganique pharmaceutiquement acceptable, comme les acides
chlorhydrique, sulfurique, phosphorique, nitrique, carbonique, borique,
sulfamique,
bromhydrique ; ou bien un sel avec un acide organique pharmaceutiquement
acceptable, comme les acides acétique, propionique, butyrique, tartarique,
maléique,
hydroxymaléique, fumarique, maléique, citrique, lactique, mucique, gluconique,
benzoïque, succinique, oxalique, phénylacétique, méthanesulfonique,
toluènesulfonique, benzènesulfonique, salicylique, sulfanilique, aspartique,
glutamique, édétique, stéarique, palmitique, oléique, (aurique, panthoténique,
tannique, ascorbique et valérique.
WO 2011/064508 PCT/FR2010/052543
7
Le terme traitement ou traiter la rosacée signifie diminuer et/ou
inhiber le
développement de la rosacée et/ou de ses symptômes.
Par radical alkyle linéaire ou ramifié ayant de 1 à 6 atomes de carbone ,
on
entend notamment un radical méthyle, éthyle, n-propyle, isopropyle, n-butyle,
isobutyle, n-pentyle, isopentyle ou n-hexyle.
De préférence, les radicaux R1, R2, R3, R'1, R'2 et R'3 des composés de
formule (I)
représentent chacun indépendamment un atome d'hydrogène ou un radical méthyle,
io éthyle, propyle, isopropyle, n-propyle, butyle, isobutyle et n-butyle.
De préférence, au moins un des radicaux R1, R2 et R3, et au moins un des
radicaux
R'1, R'2 et R'3, représentent chacun un radical méthyle.
Plus préférentiellement, le composé de formule (I) est choisi parmi le 6,6'-
diméthyl-
2,2'-dipyridyle, le 5,5'- diméthyl-2,2'-dipyridyle, le 4,4'-diméthyl-2,2'-
dipyridyle et leurs
sels pharmaceutiquement acceptables.
Aussi, la présente invention a de préférence pour objet l'utilisation d'au
moins un
composé choisi parmi le 6,6'-diméthyl-2,2'-dipyridyle, le 5,5'- diméthyl-2,2'-
dipyridyle,
le 4,4'-diméthyl-2,2'-dipyridyle et leurs sels pharmaceutiquement acceptables
pour
préparer un médicament pour traiter la rosacée. Le 6,6'-diméthyl-2,2'-
dipyridyle, le
5,5'- diméthyl-2,2'-dipyridyle, le 4,4'-diméthyl-2,2'-dipyridyle et leurs sels
pharmaceutiquement acceptables peuvent être utilisés pour le traitement de la
rosacée.
Le composé de formule (I), de préférence choisi parmi le 6,6'-diméthyl-2,2'-
dipyridyle, le 5,5'- diméthyl-2,2'-dipyridyle, le 4,4'-diméthyl-2,2'-
dipyridyle et leurs sels
pharmaceutiquement acceptables, peut ainsi être formulé dans des médicaments,
appelés indifféremment compositions pharmaceutiques par la suite, à usage
3o humain. Lesdites compositions comprennent, dans un milieu
pharmaceutiquement
acceptable, au moins un composé de formule (I).
Par milieu pharmaceutiquement acceptable, on entend un milieu compatible avec
la
peau, les muqueuses et les phanères.
WO 2011/064508 PCT/FR2010/052543
8
La composition pharmaceutique utilisable selon l'invention est administrée par
voie
topique.
De préférence, le composé de formule (I), de préférence choisi parmi le 6,6'-
diméthyl-2,2'-dipyridyle, le 5,5'- diméthyl-2,2'-dipyridyle, le 4,4'-diméthyl-
2,2'-
dipyridyle et leurs sels pharmaceutiquement acceptables, est présent dans une
composition pharmaceutique pour application topique.
Par application topique, on entend une application sur la peau, les muqueuses
et/ou
les phanères.
io La composition pharmaceutique selon l'invention comprend de 0,001 à 10% en
poids
de composé(s) de formule (I) ou ses sels par rapport au poids total de la
composition. De manière préférentielle, la composition pharmaceutique selon
l'invention contient de 0,1 à 5% en poids de composé(s) de formule (I) ou ses
sels
par rapport au poids total de la composition.
La composition pharmaceutique topique peut se présenter sous forme liquide,
pâteuse ou solide, et plus particulièrement sous forme d'onguent, de crème, de
lait,
de pommade, de poudre, de tampon imbibé, de syndet, de lingette, de solution,
de
gel, de spray, de mousse, de suspension, de lotion, de stick, de shampoing ou
de
base lavante. Elle peut également se présenter sous forme de suspension de
microsphères ou nanosphères ou de vésicules lipidiques ou polymériques ou de
patch polymérique et d'hydrogel permettant une libération contrôlée. Cette
composition pharmaceutique pour application topique peut se présenter sous
forme
anhydre, sous forme aqueuse ou sous forme d'émulsion.
Dans une variante préférée de l'invention, la composition pharmaceutique pour
application topique se présente sous forme de solution, de gel ou d'émulsion.
Lorsque la composition pharmaceutique selon l'invention est sous forme d'une
émulsion, elle comprend au moins un agent tensio-actif. Une émulsion comprend
un
mélange de deux liquides non miscibles dont l'un est dispersé dans l'autre
sous
forme de fines gouttelettes (micelles) ; la dispersion est stabilisée grâce à
l'action
d'agents tensio-actifs qui modifient la structure et le rapport des forces au
niveau de
WO 2011/064508 PCT/FR2010/052543
9
l'interface, et donc augmentent la stabilité de la dispersion en diminuant
l'énergie de
tension interfaciale.
Les tensio-actifs sont des composés amphiphiles qui possèdent une partie
hydrophobe ayant une affinité pour l'huile et une partie hydrophile ayant une
affinité
pour l'eau créant ainsi un lien entre les deux phases.
Les tensio-actifs stabilisent donc les émulsions huile/eau en s'adsorbant à
l'interface
et en formant des couches lamellaires de cristaux liquides. Le tensio-actif
peut être
ionique (anionique, cationique ou amphotère), ou non-ionique.
Parmi les tensio-actifs utilisables selon l'invention, on peut citer à titre
d'exemples le
io glyceryle / PEG100 stéarate vendu sous le nom de Arlacel 165FL par la
société
UNIQEMA ou sous le nom de Simulsol 165 par la société SEPPIC, des esters
d'acides gras polyoxyéthylénés tel que l'Arlatone 983 de la société UNIQEMA ou
l'alcool stéarylique polyoxyéthyléné (2) vendu sous le nom de Brij72 associé à
l'alcool
stéarylique polyéthyléné (21) vendu sous le nom de Brij721 par la société
UNIQEMA,
les esters de sorbitan tels que l'oléate de sorbitan vendu sous le nom de
Arlacel 80
par la société ICI ou vendu sous le nom de Crill 4 par la société Croda, le
sesquioleate de sorbitan vendu sous le nom de Arlacel 83 par la société ICI ou
vendu sous le nom de Montane 83 par la société SEPPIC, ou bien l'isostéarate
de
sorbitan; ou encore les éthers d'alcools gras.
La composition pharmaceutique selon l'invention comprend avantageusement
jusqu'à 15% en poids d'agent tensio-actif approprié, de préférence de 2 à 12%
en
poids, et plus particulièrement de 2 à 6% en poids par rapport au poids total
de la
composition.
De préférence, lorsque la composition pharmaceutique se présente sous forme
d'émulsion, elle est de type eau-dans-huile ou huile-dans-eau. Ce type
d'émulsion
comprend au moins une phase lipophile, une phase aqueuse comprenant de l'eau,
et
un agent tensio-actif.
La composition pharmaceutique sous forme d'émulsion comprend ainsi de
préférence :
a) une phase lipophile comprenant des corps gras ;
WO 2011/064508 PCT/FR2010/052543
b) au moins un agent tensio-actif ;
c) au moins un composé choisi parmi les composés de formule (I) et leurs sels
;
d) éventuellement un ou plusieurs solvants et/ou propénétrants du composé de
formule (I) ou ses sels
5 e) et de l'eau.
La phase lipophile de la composition pharmaceutique selon l'invention peut
comprendre par exemple, des huiles végétales, minérales, animales ou
synthétiques,
des huiles de silicones, des alcools de Guerbet ou autres corps gras et leurs
mélanges.
io Comme exemple d'huile minérale, on peut citer par exemple des huiles de
paraffine
de différentes viscosité telles que le Primol 352, le Marcol 82, Marcol 152
vendus par
la société Esso.
Comme huile végétale, on peut citer l'huile d'amande douce, l'huile de palme,
l'huile
de soja, l'huile de sésame, l'huile de tournesol.
Comme huile animale, on peut citer la lanoline, le squalène, l'huile de
poisson, l'huile
de vison.
Comme huile synthétique, on peut citer des esters, tel que le cetearyl
isononanoate
vendu sous le nom notamment de Cetiol SN par la société Cognis France, le
diisopropyl adipate comme le produit vendu sous le nom de Ceraphyl 230 par la
société ISF, le palmitate d'isopropyle comme le produit vendu sous le nom de
Crodamol IPP par la société Croda, le caprylique caprique triglyceride tel que
Miglyol
812 vendu par la société Huls / Lambert Rivière.
Comme huile de silicone, on peut citer une dimethicone comme le produit vendu
sous le nom de Dow Corning 200 fluid, une cyclomethicone comme le produit
vendu
sous le nom de Dow Corning 244 fluid par la société Dow Corning ou le produit
vendu sous le nom le Mirasil CM5 par la société SACI-CFPA.
Comme autres corps gras on peut citer des acides gras tel que l'acide
stéarique, les
alcools gras tels que l'alcool stearylique, l'alcool cetostéarylique et
l'alcool cétylique
WO 2011/064508 PCT/FR2010/052543
11
ou leurs dérivés, les cires telles que cire d'abeille, cire de carnauba, cire
de
candelilla, ainsi que des gommes, en particuliers des gommes de silicone.
Les ingrédients de la phase lipophile pourront être choisis de manière variée
par
l'homme du métier afin de préparer une composition ayant les propriétés
souhaitées,
par exemple en consistance ou en texture.
La phase lipophile de l'émulsion selon l'invention peut être présente à une
teneur
comprise entre 3 et 50 % en poids par rapport au poids total de la composition
et de
préférence comprise entre 5 et 20 % en poids.
A titre d'exemple de solvant et/ou propénétrant des composés de formule (I) ou
leurs
io sels, on citera préférentiellement le propylène glycol, les alcools du type
éthanol,
isopropanol, butanol, la N-methyl 2 pyrrolidone ou le DMSO, le polysorbate 80,
le
phénoxyéthanol et leurs mélanges.
La composition pharmaceutique sous forme d'émulsion selon l'invention comprend
de préférence de 0,1% à 20%, et préférentiellement de 1% à 10% en poids par
is rapport au poids total de la composition, d'un solvant et/ou propénétrant
des
composés de formule (I) ou leurs sels.
L'émulsion selon l'invention comprend également une phase aqueuse en quantité
comprise entre 30 et 95%, et préférentiellement comprise entre 60 et 80% en
poids
par rapport au poids total de la composition. Cette phase aqueuse comprend de
20 l'eau, de préférence de l'eau purifiée.
La composition pharmaceutique selon l'invention peut également se présenter
sous
forme de gel ; elle comprend alors un ou plusieurs composés gélifiants, en
quantité
allant de 0,01 à 5% en poids par rapport au poids total de la composition, de
préférence de 0,1 à 3%.
25 Parmi les gélifiants utilisables dans la composition pharmaceutique selon
l'invention,
on peut citer les polymères carboxyvinyliques (carbomers) et, à titre
d'exemples non
limitatifs de carbomer, le Carbopol 981, le Carbopol ETD 2020, le Carbopol
980, le
Carbopol Ultrez 10 NF, le Pemulen TR1 vendus par la société NOVEON. On peut
également citer les dérivés cellulosiques, comme par exemple
WO 2011/064508 PCT/FR2010/052543
12
l'hydroxypropylmethylcellulose, ou l'hydroxyethylcellulose; les gommes de
xanthane,
les silicates d'aluminium / magnesium comme le Veegum K ou le Veegum Ultra
revendues par Vanderbilt, les gommes guar et semblables, les polyacrylamides
tel
que le mélange polyacrylamide / isoparaffine C13-14 / laureth-7 comme par
exemple
celui vendu par la société SEPPIC sous le nom de Sepigel 305, le copolymère
acrylamide/AMPS en dispersion à 40% dans l'isohexadécane vendu sous le nom de
Simulgel 600PHA, ou la famille des amidons modifiés tel que Structure Solanace
revendu par National Starch ou leurs mélanges.
Lorsque la composition pharmaceutique se présente sous forme de solution, elle
io comprend, outre les composés de formule (I) ou leurs sels, une phase
aqueuse ou
une phase huileuse, et éventuellement un ou plusieurs solvants et/ou
propénétrants
des composés de formule (I) tels que décrits ci-dessus. Par solution , on
entend
une composition monophasique liquide à température ambiante (25 C), dans
laquelle le composé de formule (I) ou ses sels est solubilisé.
La composition pharmaceutique selon l'invention pourra en outre contenir des
additifs inertes ou des combinaisons de ces additifs, tels que
- des agents conservateurs;
- des agents stabilisants ;
- des agents régulateurs d'humidité ;
- des agents régulateurs de pH;
- des agents modificateurs de pression osmotique ;
- des filtres UV-A et UV-B;
- et des antioxydants.
Bien entendu, l'homme du métier veillera à choisir le ou les éventuels
composés à
ajouter à ces compositions pharmaceutiques de telle manière que les propriétés
avantageuses attachées intrinsèquement à la présente invention ne soient pas
ou
substantiellement pas altérées par l'addition envisagée.
Ces additifs peuvent être présents dans la composition pharmaceutique de 0,001
à
20% en poids par rapport au poids total de la composition.
WO 2011/064508 PCT/FR2010/052543
13
Il va être maintenant donné, à titre d'illustration et sans aucun caractère
limitatif, les
résultats d'activité sur les MMPs des composés (I) et leurs sels. :
L'activité des MMP de MMP-1, MMP-2, MMP-9, MMP-12, MMP-13 et TACE a été
mesurée en utilisant des protéines recombinantes humaines. L'activité de MMP-8
a
été mesurée dans les neutrophiles humains. Après incubation avec le substrat
correspondant, le produit de réaction de chaque MMP a été détecté par
fluorimétrie.
Les résultats sont exprimés en pourcentages de l'activité de contrôle
spécifiques
((activité spécifique mesurée/ activité de contrôle spécifique) x 100) obtenue
en
io présence des composés testés.
MMP activity (% of control values + SD)
4,4'-dimethyl-2,2'- 5,5'-dimethyl-2,2'- 6,6'-dimethyl-2,2'-
dipyridyle (lOpM) dipyridyle (lOpM) dipyridyle (10pM)
MMP-1 94.3 +0.1 96.1 +0.3 98.8+0.7
MMP-2 100.8 +6.0 86.4+2.2 95.9+7.5
MMP-8 86.5+7.4 88.3+6.7 95.0+6.5
MMP-9 88.5+3.4 86.0+3.4 101.0+3.3
MMP-12 96.3+ 1.0 93.4+0.4 96.3+ 1.0
MMP-13 90.0+4.1 89.4+ 1.2 96.2+2.6
MMP-14 90.8+4.7 90.2+4.1 84.3+3.0
TACE 106.4+ 1.2 100.8+2.1 100.3+0.2
Les résultats de cette étude indiquent que le 4,4 '-diméthyl-2, 2'-dipyridyle,
le 5,5'-
diméthyl-2, 2'-dipyridyle et le 6,6 '-diméthyl-2, 2'-dipyridyle ont pu inhiber
l'activité des
MMP. Les composés testés inhibent particulièrement les MMP-8 et MMP-9,
métalloprotéinases matricielles connues pour être régulées à la hausse chez
les
patients souffrant de rosacée. Ces composés ont été moins actifs sur certains
autres
MMP, comme la MMP-1, MMP-2, MMP-12, MMP-14 et MMP-13. Ces MMPs dont
l'inhibition par des dérivés de la tétracycline, comme la doxycycline, a été
démontré,
les tetracyclines étant connues pour être efficaces dans le traitement de la
rosacée.
D'autre part, les composés n'ont eu aucune activité sur TACE (enzyme de
conversion de TNF-alpha), la métalloprotéinase matricielle n'étant pas connue
pour
être impliquée dans la rosacée.