Note: Descriptions are shown in the official language in which they were submitted.
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
1
METHODE D'ANALYSE COMPARATIVE DE PREPARATIONS PROTEIQUES
PAR RESONANCE MAGNETIQUE NUCLEAIRE
La présente invention concerne une méthode d'analyse comparative et de
contrôle de la qualité
d'une préparation protéique par spectrométrie de résonance magnétique
nucléaire (RMN). Cette
méthode permet la comparaison de conformations tridimensionnelles de protéines
dans
différentes préparations protéiques sans qu'aucune préparation particulière
des échantillons ne
soit nécessaire. Cette méthode permet notamment de déterminer si une protéine
sélectionnée est
dans la même conformation tridimensionnelle dans différentes préparations
protéiques, ou si elle
est dégradée dans la formulation ou si elle est en interaction avec certains
des excipients présents.
Cette méthode permet en particulier l'analyse et le contrôle de la qualité de
composés
thérapeutiques, particulièrement de biomédicaments ou encore de biosimilaires,
dans différents
échantillons, et ce sans altérer lesdits échantillons.
Les protéines sont formées de chaînes polypeptidiques, ou successions
d'aminoacides, plus ou
moins longues dont on peut déterminer la séquence. Une telle succession
d'aminoacides liés par
des liaisons peptidiques constitue la structure primaire d'une protéine.
Cependant, chaque
protéine a également une structure tridimensionnelle, ou conformation, qui est
établie et
maintenue par d'autres types de liaisons que les liaisons peptidiques.
Lesdites liaisons sont
assurées en général par des ponts disulfures, des liaisons ioniques, des
liaisons hydrogène ou des
interactions hydrophobes. Ceci relève du domaine de la biochimie structurale,
domaine où l'on
parle alors de structure secondaire, tertiaire, voire quaternaire, qui confère
à chaque protéine ses
propriétés particulières.
Chaque protéine a donc une conformation protéique ou structure
tridimensionnelle qui lui est
propre. Cette conformation est susceptible d'être bouleversée ou désorganisée
sans qu'aucune
liaison peptidique ne soit rompue. Ce sont les autres liaisons qui sont
affectées et ceci aboutit à
une modification de la conformation protéique qu'on appelle également
dénaturation. La
dénaturation peut être réversible ou irréversible, complète ou partielle,
suivant la nature et le
nombre de liaisons déstabilisées ; ceci affecte inévitablement les propriétés
physiques et
biologiques de la protéine. Une telle dénaturation protéique peut être
provoquée par toute une
variété d'agents physiques et/ou chimiques comme la chaleur, le froid, la
congélation, les
radiations ultraviolettes et ionisantes, les variations de pH, les détergents,
les solvants organiques,
une solution d'urée ou de guanidine, mais également par une dilution ou
l'agitation d'une
préparation protéique. L'analyse des structures protéiques peut donc être très
délicate dans la
mesure où les conformations protéiques sont très sensibles, y compris à
l'agitation. De plus, une
préparation protéique peut contenir plusieurs protéines, il est donc souvent
nécessaire de procéder
en premier lieu à un isolement et à une purification de la protéine d'intérêt.
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
2
Les techniques permettant de déterminer ces structures primaires, secondaires,
etc. sont
maintenant bien connues de l'homme de l'art. L'analyse de la structure
primaire des protéines se
fait généralement par l'analyse de la composition en aminoacides par
chromatographie (par
échange d'ions, en phase gazeuse ou d'adsorption) ou par séquençage des
aminoacides en faisant
appel à des méthodes récurrentes chimiques ou enzymatiques libérant les acides
aminés un à un à
partir de l'extrémité C ou N terminale ou plus récemment en utilisant des
méthodes mettant en
oeuvre la spectrométrie de masse. Les structures secondaires, tertiaires et
quaternaires sont
déterminées par analyse des diagrammes de diffraction des rayons X ou par
résonance
magnétique nucléaire (RMN). Ces techniques nécessitent cependant souvent au
moins la
purification et la concentration des protéines sinon leur dénaturation et par
conséquent la perte de
l'échantillon, ou préparation protéique, à analyser. L'analyse d'échantillons
par résonance
magnétique nucléaire (RMN) présente l'avantage de permettre l'étude d'une
protéine d'intérêt
sans pour autant la dénaturer. Le principe de l'utilisation de la RMN dans
l'analyse protéique
consiste à placer une protéine d'intérêt en solution dans un champ magnétique
intense. Les spins
des noyaux atomiques composant la protéine d'intérêt vont alors s'orienter le
long de l'axe
principal du champ magnétique. Il est alors possible de perturber l'état
d'équilibre de ces spins
grâce à une série d'impulsions électromagnétiques et de mesurer le courant
induit lors du retour à
l'équilibre. Le signal RMN enregistré contient la combinaison de l'ensemble
des contributions
des différents atomes en solution ; ensemble également appelé spectre
(Cavanagh et al., Protein
NMR Spectroscopy: Principles and Practice, Academic Press, Dec. 1995). Suivant
la méthode de
RMN sélectionnée, on obtiendra un spectre à une dimension (RMN 1D), à deux
dimensions
(RMN 2D) ou à trois dimensions (RMN 3D). Le niveau d'informations divulgué par
chaque
spectre dépendra de la méthode de RMN choisie.
Plusieurs méthodes d'analyse applicables à l'étude de conformations protéiques
et mettant en
oeuvre la spectrométrie de RMN ont été décrites à ce jour. On citera notamment
la méthode
DOSY, les méthodes NOESY, SOFAST, COSY, TOCSY, HSQC, HNCA, HNCO, HNCOCA,
HCCH TOCSY, HCCH COSY améliorées ou non par la variante TROSY, ainsi que toute
séquence d'enregistrement RMN permettant d'établir des corrélations entre deux
ou plusieurs
noyaux de la protéine d'intérêt (Sattler et al., Prog Nue Mag Reson Spectro,
1999, vol. 34(2) p.
93-158). Les plus communément employées dans ce cadre particulier sont les
méthodes DOSY
iH (C.S. Johnson Jr., Diffusion ordered nuclear magnetic resonance
spectroscopy: principles and
applications, Prog. NMR Spectrosc. 34 (1999) 203-256 ; Balayssac S. et al., J.
Magn.
Reson. 2009, 196, 78-83) et SOFAST (Schanda et al. J Am Chem Soc (2005) vol.
127 (22) p.
8014-15).
L'application des méthodes de RMN à l'analyse de conformations protéiques
permet en
particulier l'analyse de biomédicaments. Les biomédicaments sont développés
depuis plus de
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
3
vingt ans et peuvent être classés en différentes catégories par exemple : les
produits hormonaux
(hormones de croissance, érythropoïétine, et insuline), les immunomodulateurs
(beta-interferon),
les anticorps monoclonaux, les modulateurs de coagulation sanguine (facteurs
VIII et IX), les
enzymes et les vaccins. Les biomédicaments peuvent être obtenus par des
méthodes variées et
sont sensibles à plusieurs facteurs externes. Il y a donc un intérêt tout
particulier à pouvoir les
analyser rapidement directement dans le milieu où ils se trouvent, notamment
pour déterminer si
leur conformation est fonctionnelle (Knâblein J., Modern Biopharmaceuticals:
Design,
Development and Optimization, Wiley VC, Feb. 2008). Parmi les médicaments
disponibles sur le
marché européen, plus d'une centaine répondent à la définition de
biomédicament ci-dessus. Il
existe par exemple plusieurs biomédicaments commercialisés ou ayant été
commercialisés en
Europe, qui sont dérivés de l'insuline : Actrapid (Boehringer Ingelheim),
Apidra Insuman
et Lantus (Sanofi-Aventis), Humalog et Umuline rapide (Eli Lilly),
Insulatard Levemir
Mixtard Monotard Novomix Novorapid Ultratard et Velosuline (Novo
Nordisk). Il
existe également plusieurs biomédicament dérivés de l'erythropoïetine : Eprex
(Janssen Cilag),
Neorecormon (Roche), et Aranesp (Amgen). Il existe aussi plusieurs
médicaments dérivés de
l'hormone de croissance : Humatrope (Eli Lilly), Norditropine (Novo Nordisk)
et
Genotonorm (Pfizer). Cette liste n'est pas exhaustive et n'est donnée qu'à
titre d'exemple.
Suite au développement des biomédicaments est apparue la notion de médicament
biosimilaire ou
de traitement par biosimilaire. Ces biosimilaires sont des composés à usage
thérapeutique qui
succèdent à un biomédicament dont le monopole légal d'exploitation s'est
éteint. La notion de
traitement par biosimilaires a été intégrée dans la législation européenne
en 2003 (voir
également Directive européenne CHMP/42832/05). Dans ce cas particulier, il y a
un intérêt
certain à disposer de moyens d'analyse pour déterminer si un biosimilaire est
identique au
biomédicament auquel il succède tant sur le plan de sa structure primaire que
de sa structure
tridimensionnelle. A ce jour, il existe plusieurs médicaments biosimilaires
disponibles sur le
marché européen dans quatre groupes : erythropoïetine, hormone de croissance,
insuline et G-
CSF (granulocyte-colony stimulating factor). On citera par exemple dans le
domaine des
somatotropines Omnitrope (Sandoz(k) et Valtropin (Biopartners(k) qui sont
des biosimilaires
de Genotropin ou Genotonorm (Pfizer(k), dans le domaine des
erythropoïétines alpha
Binocrit (Sandoz(k), Epoetin alfa Hexal (Hexal(k) et Abseamed (Medice
Arzneimittel Putter
GmbH&Co) qui sont des biosimilaires d'Eprex (Janssen Cilag) ou encore dans le
domaine de
filgrastim Biograstim (CT Arzneimittel GmbH), Filgrastim Ratiopharm
(Ratiopharm GmbH),
Ratiograstim (Ratiopharm GmbH), Tevagrastim (Teva Generics GmbH) qui sont
des
biosimilaires de Neupogen (Amgen(k).
De nombreuses études de conformations protéiques mettant en oeuvre la RMN ont
été décrites
dans l'art antérieur (Cavanagh et al., Protein NMR Spectroscopy: Principles
and Practice,
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
4
Academic Press, Dec. 1995). Ces expériences décrivent en général l'élucidation
ou la
confirmation de la conformation protéique d'une protéine d'intérêt par
utilisation de spectres de
RMN, une fois la séquence de la protéine connue, d'une protéine d'intérêt dans
ses différentes
conformations (active par opposition à inactive, stable par opposition à
instable, etc...). La RMN
permet également de déterminer quelle est la structure quaternaire d'une
protéine : dimère,
tetramère etc... En effet, l'activité biologique d'une protéine réside souvent
dans sa structure
oligomérique, à savoir la situation dans laquelle plusieurs chaînes
polypeptidiques s'associent de
manière spécifique. La mise en oeuvre de la RMN permet d'étudier cette
oligomérisation suivant
les contraintes physico-chimiques imposées à une protéine puisqu'elle n'impose
pas la
dénaturation de la protéine d'intérêt.
Le brevet européen EP0975954 décrit un procédé de criblage pour identifier la
présence de
composés qui se lient à une biomolécule cible déterminée. Ce procédé comprend
les étapes
suivantes: a) générer un premier spectre RMN monodimensionnel filtré T2 ou par
diffusion d'un
composé d'un mélange de composés chimiques; b) exposer le composé ou le
mélange de
composés chimiques à une molécule cible; c) générer un second spectre RMN
monodimensionnel
filtré T2 ou par diffusion dudit composé ou dudit mélange de composés
chimiques lorsqu'il est
exposé à la molécule cible dans l'étape b) ; et d) comparer lesdits premier et
deuxième spectres
RMN monodimensionnels filtré T2 ou par diffusion pour déterminer les
différences entre ledit
premier et ledit deuxième spectres RMN, les différences identifiant la
présence d'un ou plusieurs
composés parmi ledit premier composé ou ledit mélange de composés chimiques
respectivement,
qui sont des ligands qui se sont liés à la molécule cible. Ce procédé de
criblage mettant en oeuvre
la RMN permet d'identifier une liaison entre une biomolécule, potentiellement
une protéine, et un
ligand de cette biomolécule. La RMN est utilisée ici pour la réalisation de
campagnes de
criblage permettant d'identifier des ligands ; il n'est aucunement question
d'appliquer la RMN à
l'analyse qualitative des structures primaires, secondaires, tertiaires et
quaternaires de
biomolécules.
La demande internationale W02008/128219 décrit une méthode d'analyse
comparative de
conformations protéiques mettant en oeuvre des spectres RMN 'H-1H NOESY. Dans
cette
demande seule la méthode 1H-1H NOESY est décrite pour la caractérisation de
protéines dans
différentes formulations thérapeutiques. Seuls les déplacements de fréquence
des atomes
d'hydrogène sont détectés. Aucune autre expérience n'est réalisée pour
atteindre un niveau
d'information supplémentaire. Or il est bien connu de l'homme de l'art que
dans une formulation
thérapeutique, la protéine d'intérêt constituant généralement le principe
actif de la formulation,
est mélangée à des excipients de type tampons, liants, diluants, délitants,
édulcorants, etc... qu'on
retrouve en général en plus grande concentration que ladite protéine
d'intérêt. Il y a donc
plusieurs inconvénients à cette méthode d'analyse. En effet, dans les
conditions décrites, le signal
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
détecté par la méthode 1H-1H NOESY risque d'être masqué par le signal des
excipients. De plus,
en fonction du nombre d'aminoacides constituant la protéine d'intérêt, le
spectre 1H-1H NOESY
peut devenir si complexe qu'il ne pourra être aisément interprété. Enfin, le
pH de la formulation
thérapeutique à étudier aura également son importance dans la mesure où à
certains pH,
5 notamment ceux supérieurs à 7,5 , la protéine d'intérêt ne donnera aucun
signal détectable. Une
analyse directe sur un échantillon prélevé à partir d'une formulation
thérapeutique ne sera donc
pas possible. En effet, pour remédier à tous ces inconvénients, il faudra dans
un premier temps
purifier la protéine d'intérêt puis la concentrer, ou alors trouver un moyen
de filtrer les signaux
afin de pouvoir extraire le signal spécifique de la protéine d'intérêt. Par
ailleurs, il est préférable
que la protéine d'intérêt ne soit pas trop grande de façon à pouvoir
discriminer les contributions
individuelles dans le spectre utilisé. Enfin, il convient également de trouver
un moyen de
contrôler les paramètres externes de type pH de l'échantillon.
Les méthodes existantes mettant en oeuvre la spectrométrie de RMN pour
l'analyse de protéines
nécessitent donc plusieurs étapes de préparation des échantillons
(purification, concentration,
etc.). Elles permettent d'élucider la structure de certaines protéines et de
faire du criblage afin de
trouver de potentiels ligands de ces protéines. Comme évoqué ci-dessus, les
compositions
thérapeutiques contiennent un principe actif mais également d'autres
composants tels des
excipients ainsi que d'autres éléments de nature protéique ou non. Il ne
semble donc pas aisé
d'adapter ces méthodes mettant en oeuvre la RMN à une analyse comparative
rapide et un
contrôle de la qualité fiable de compositions thérapeutiques contenant des
biomédicaments et/ou
des biosimilaires.
La présente invention se propose de fournir une alternative fiable et rapide à
cette situation. La
méthode d'analyse comparative et de contrôle de la qualité de compositions
thérapeutiques objet
de la présente invention est très sensible et permet une analyse directe à
partir de la formulation
thérapeutique sélectionnée. En effet, cette nouvelle méthode d'analyse
comparative et de contrôle
de la qualité permet l'analyse de protéines non marquées, de protéines de
toutes tailles, le filtrage
spécifique du signal correspondant à la protéine d'intérêt, ainsi que
l'affranchissement du contrôle
des paramètres extérieurs tels le pH.
La présente invention consiste en une méthode d'analyse comparative et de
contrôle de la qualité
de compositions thérapeutiques, mettant en oeuvre la spectrométrie de
résonance magnétique
nucléaire (RMN), caractérisée en ce qu'elle comprend les étapes suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant un
biomédicament ;
b) établir la signature spectrale du biomédicament dans la première
préparation protéique à
partir d'au moins deux spectres RMN ;
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
6
c) établir la signature spectrale du biomédicament dans la seconde préparation
protéique à
partir d'au moins deux spectres RMN ;
d) comparer les signatures spectrales du biomédicament dans la première et
dans la seconde
préparation protéique ;
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si le
biomédicament est identique dans la première préparation protéique et dans la
seconde
préparation protéique.
Cette méthode innovante permet d'étudier, à partir de la détection et de
l'analyse de déplacements
de fréquence, la structure primaire de la protéine d'intérêt et notamment d'un
biomédicament,
dans les échantillons étudiés, son intégrité conformationnelle, son état
d'oligomérisation ainsi que
de détecter la présence ou l'absence d'excipients ou tout autre élément de
nature protéique ou
non-protéique. Le fait de cumuler les informations fournies par au moins deux
spectres réalisés à
partir d'un même échantillon protéique, mais selon des méthodes d'acquisition
différentes,
permet de déduire de façon certaine des informations quant à la conformation
du biomédicament,
des excipients ou de tout autre élément de nature protéique ou non-protéique.
Cette nouvelle méthode ne nécessite aucune étape de conditionnement préalable
de l'échantillon à
analyser. En effet, dans la mise en oeuvre de cette méthode, les compositions
thérapeutiques sont
utilisées directement, sans étape de purification ou de concentration du
biomédicament, et sans
marquage dudit biomédicament. La composition thérapeutique est mise en
solution puis placée
sur le support de lecture et d'analyse propre à l'appareil de RMN utilisé.
Cette méthode permet en
particulier de travailler directement sur la formule galénique des
compositions thérapeutiques
contenant une protéine d'intérêt et notamment un biomédicament.
Dans le cadre d'une analyse directe à partir d'une formulation commerciale de
médicament par
exemple, si ladite formule commerciale présentait une concentration du
biomédicament en
quantité insuffisante par rapport au seuil de détection du signal RMN, alors
il conviendrait
d'augmenter le champ (passer de 600 MHz à 800, 900 ou 1000 MHz) et/ou
d'utiliser la méthode
de polarisation nucléaire dynamique (comme celle commercialisée par Oxford
Instrument(k) ou
toute autre méthode d'augmentation de polarisation.
Les mots définis ci-dessous sont employés aussi bien au singulier qu'au
pluriel.
Par aminoacide on entend dans la présente invention un composé comportant
une fonction
acide carboxylique et une fonction amine sur un même atome de carbone. Ceci
inclut les vingt
aminoacides constitutifs de toutes les protéines ainsi que tous les autres
aminoacides se trouvant à
l'état libre et ayant un rôle métabolique important, et ceux constituant les
petits peptides de moins
de vingt aminoacides fabriqués par des micro-organismes ou des plantes
uniquement.
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
7
Par biomédicament on entend dans la présente invention un composé à usage
thérapeutique
dont la substance active est issue des biotechnologies comme les anticorps
monoclonaux, les
protéines recombinantes (par exemple les enzymes et les cytokines), les
composés de thérapie
génique et les cellules souches, mais aussi composés et traitements plus
anciens comme les
vaccins, les produits sanguins, les toxines et les antisera. Sont également
inclus dans cette
définition les peptides et les polynucléosides. La notion de biomédicament
s'entend par
opposition aux médicaments constitués de petites entités chimiques (ou small
chemical
entities en anglais).
Par biosimilaire on entend dans la présente invention un composé à usage
thérapeutique qui
succède à un biomédicament dont l'exploitation, et en particulier le procédé
de fabrication, ne fait
plus l'objet d'un monopole légal. Les biosimilaires sont également issus des
biotechnologies et
présentent des similarités en termes de qualité, de sécurité et d'efficacité
par rapport au
biomédicament auquel on les compare.
Par composition thérapeutique on entend dans la présente invention une
préparation
possédant des propriétés curatives ou préventives à l'égard des maladies
humaines ou animales,
qui peut être utilisée et/ou administrée en vue de restaurer, corriger ou
modifier les fonctions
physiologiques impliquées dans un état pathologique, en exerçant une action
pharmacologique,
immunologique ou métabolique.
Par conformation protéique ou conformation tridimensionnelle d'une
protéine on entend
la structure tridimensionnelle de la protéine d'intérêt, c'est-à-dire non
seulement la structure
primaire, secondaire et tertiaire de ladite protéine, mais également le cas
échéant, sa structure
quaternaire.
Par nucléoside on entend dans la présente invention la molécule composée
par la liaison
d'une base purique (comme l'adénine et la guanine) ou pyrimidique (comme
l'uracile, la
cytosine, la thymidine) avec le ribose ou le désoxyribose. Parmi les
principaux nucléosides on
citera l'adénosine et la désoxyadénosine, la guanosine et la désoxyguanosine,
l'uridine et la
désoxyuridine, la cytidine et la désoxycytidine, ainsi que la thymine
ribonucléoside et la
désoxythymidine (également appelée thymidine).
Par peptide on entend dans la présente invention un enchaînement d'au moins
deux
aminoacides liés entre eux par des liaisons peptidiques, ce qui comprend les
oligopeptides ou
dipeptides formés par l'union de deux aminoacides et les tripeptides, ainsi
que les polypeptides (à
partir des tétrapeptides). Les peptides naturels sont formés de différents
aminoacides mais on peut
synthétiser des homopeptides (tels la triglycine ou la polyphénylalanine,
etc...). Les peptides
peuvent avoir des structures diverses : peptides linéaires, peptides ramifiés
; peptides cycliques et
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
8
peptides semi-cycliques. Suivant leur structure, les peptides pourront
comporter d'autres liaisons
en plus des liaisons peptidiques.
Par préparation protéique on entend dans la présente invention un mélange
de protéines,
identiques ou différentes, obtenu selon une méthode de production donnée. Ceci
inclut les
formulations thérapeutiques telles que commercialisées par les laboratoires
pharmaceutiques
(susceptible de contenir également des excipients de type tampons, liants,
diluants, délitants,
édulcorants, etc...). Ceci englobe également toute préparation d'un mélange
protéique obtenu par
isolement, prélèvement ou tout procédé biotechnologique connu de l'homme de
l'art, à savoir
notamment la solubilisation, la concentration, la purification, etc...
Par protéine on entend dans la présente demande un polypeptide impliquant
une ou des
liaisons peptidiques unissant deux ou plusieurs aminoacides. Il est
communément admis que les
protéines sont des polypeptides de masse moléculaire supérieure à 10 000 et
qui ne dialysent pas
à travers une membrane de cellophane (Biochimie Générale, J.-H. WEIL, Dunod,
11ème édition,
Chapitre 1, page 17). Une protéine peut inclure une portion qui n'est pas
constituée par un ou des
aminoacides (ex. : glycoprotéines) et peut par ailleurs être tronquée ou
modifiée. Il est évident
pour l'homme de l'art qu'une protéine peut être une séquence polypeptidique sy
thétique ou
naturelle telle que sécrétée par une cellule, ou simplement une portion
fonctionnelle d'une telle
protéine.
Par RMN 1D on entend la résonance magnétique nucléaire à une seule
dimension ou
monodimensionnelle.
Par RMN 2D on entend la résonance magnétique nucléaire à deux dimensions
ou
bidimensionnelle (expérience de type COSY, DOSY, NOESY, HSQC, HMBC, etc...).
Par RMN 3D on entend la résonance magnétique nucléaire à trois dimensions
ou
tridimensionnelle (expérience de type HNCO, etc...).
Par signature spectrale on entend l'ensemble des résonances des noyaux
observés d'une
protéine d'intérêt dans des conditions données (par exemple champ, solvant,
température...).
Suivant la nature de la protéine d'intérêt et afin d'obtenir un niveau
d'information suffisant pour
réaliser une analyse comparative de conformations protéiques fiable, il est
parfois préférable de
disposer des informations fournies par au moins un spectre RMN bidimensionnel
(RMN 2D). En
effet, la présente invention est susceptible d'utiliser une grande variété de
spectres pour obtenir la
signature spectrale d'une protéine. Les deux critères essentiels pour le choix
du type d'expérience
de RMN à réaliser sont la sensibilité, qui doit être adaptée à la quantité de
protéine présente dans
la formulation, et le degré d'ambiguïté de la signature spectrale obtenue.
Pour atteindre la
sensibilité maximale, l'acquisition des informations se fera en enregistrant
les spectres à la
fréquence du proton, noyau le plus sensible en RMN. Il est ensuite possible de
gagner en
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
9
sensibilité en utilisant, d'une part, un spectromètre équipé d'une sonde
cryogénique, et d'autre
part, des méthodes d'acquisition permettant de tirer avantage des propriétés
de relaxation
particulières des macromolécules. De manière générale, afin de réduire le
degré d'ambiguïté de la
signature spectrale, on enregistrera des spectres bidimensionnels ou de
dimensionnalité plus
élevée. Par conséquent, dans un mode de réalisation préféré, la présente
invention décrit une
méthode d'analyse comparative et de contrôle de la qualité de compositions
thérapeutiques,
mettant en oeuvre la spectrométrie de résonance magnétique nucléaire (RMN),
caractérisée en ce
qu'elle comprend les étapes suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant un
biomédicament ;
b) établir la signature spectrale du biomédicament dans la première
préparation protéique à
partir d'au moins deux spectres RMN;
c) établir la signature spectrale du biomédicament dans la seconde préparation
protéique à
partir d'au moins deux spectres RMN;
d) comparer les signatures spectrales du biomédicament dans la première et
dans la seconde
préparation protéique ;
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si le
biomédicament est identique dans la première préparation protéique et dans la
seconde
préparation protéique.
dans laquelle au moins un spectre RMN réalisé durant l'étape b) à partir de
l'une des préparations
protéiques sélectionnées met en oeuvre une méthode de RMN bidimensionnelle
dite RMN 2D.
Dans un mode de réalisation différent, la présente invention décrit une
méthode d'analyse
comparative et de contrôle de la qualité de compositions thérapeutiques,
mettant en oeuvre la
spectrométrie de résonance magnétique nucléaire (RMN), caractérisée en ce
qu'elle comprend les
étapes suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant un
biomédicament ;
b) établir la signature spectrale du biomédicament dans la première
préparation protéique à
partir d'au moins deux spectres RMN;
c) établir la signature spectrale du biomédicament dans la seconde préparation
protéique à
partir d'au moins deux spectres RMN;
d) comparer les signatures spectrales de la protéine d'intérêt dans la
première et dans la
seconde préparation protéique ;
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si le
biomédicament est identique dans la première préparation protéique et dans la
seconde
préparation protéique.
dans laquelle au moins un spectre RMN réalisé durant l'étape c) à partir de
l'une des préparations
5 protéiques sélectionnées met en oeuvre une méthode de RMN bidimensionnelle
dite RMN 2D.
L'interprétation des informations fournies par les spectres obtenus suite à la
mise en oeuvre de la
méthode ci-dessus permet alors de détecter dans la composition thérapeutique
la présence ou
l'absence d'excipients, l'état du biomédicament et en particulier sa
conformation, ainsi que
d'éventuels déplacements de fréquence, même légers, si le biomédicament est
différent dans la
10 première préparation protéique et dans la seconde préparation protéique. Si
le biomédicament est
identique et dans le même état conformationnel dans les deux préparations
protéiques, aucun
déplacement de fréquence n'est observé.
Selon un mode de réalisation préféré, la méthode de comparaison met en oeuvre
la méthode
DOSY, les méthodes NOESY, SOFAST, COSY, TOCSY, HSQC, HNCA, HNCO, HNCOCA,
HCCH TOCSY, HCCH COSY améliorées ou non par la variante TROSY, ainsi que toute
séquence d'enregistrement RMN permettant d'établir des corrélations entre deux
ou plusieurs
noyaux du biomédicament.
Selon un autre mode de réalisation, la méthode d'analyse selon la présente
invention est
caractérisée en ce que ladite méthode de RMN 2D est sélectionnée parmi les
méthodes DOSY et
SOFAST, éventuellement en combinaison avec la variante TROSY. L'expérience de
RMN mise
en oeuvre durant l'étape b) et/ou durant l'étape c) est préférentiellement
sélectionnée parmi les
expériences suivantes : DOSY et SOFAST. Selon un autre mode de réalisation, la
méthode selon
l'invention est caractérisée en ce que la méthode de RMN 2D utilisée est la
méthode DOSY.
Enfin, selon un mode de réalisation préféré, la méthode d'analyse est
caractérisée en ce que la
méthode de RMN 2D utilisée est la méthode SOFAST, éventuellement en
combinaison avec la
variante TROSY.
Dans un mode de réalisation particulier, la méthode d'analyse comparative et
de contrôle de la
qualité de compositions thérapeutiques mettant en oeuvre la spectrométrie de
résonance
magnétique nucléaire (RMN) selon l'invention est caractérisée en ce qu'elle
comprend les étapes
suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant un
biomédicament ;
b) établir la signature spectrale du biomédicament dans la première
préparation protéique à
partir d'au moins deux spectres RMN;
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
11
c) établir la signature spectrale du biomédicament dans la seconde préparation
protéique à
partir d'au moins deux spectres RMN, lesdits spectres étant réalisés selon les
mêmes
méthodes de RMN que durant l'étape b) ;
d) comparer les signatures spectrales du biomédicament dans la première et
dans la seconde
préparation protéique par superposition des spectres réalisés durant les
étapes b) et c) ,
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si le
biomédicament est identique dans la première préparation protéique et dans la
seconde
préparation protéique.
En effet, la possibilité de superposer des spectres réalisés suite à la mise
en oeuvre des mêmes
méthodes de RMN permet une interprétation plus rapide des résultats. On
réalise par exemple une
expérience DOSY et une expérience SOFAST, soit deux spectres, durant l'étape
b) à partir d'un
échantillon contenant la protéine d'intérêt. On réalise alors les mêmes
expériences DOSY et
SOFAST, soit deux spectres, sur le second échantillon protéique durant l'étape
c). Un logiciel
d'exploitation des spectres RMN (par exemple NMRnotebook(k) permet alors la
superposition
desdits spectres, qui sont au nombre de quatre et qui seront comparés deux à
deux.
L'interprétation des informations ainsi fournies permet alors de détecter la
présence ou l'absence
d'excipients, l'état du biomédicament et en particulier sa conformation, ainsi
que d'éventuels
déplacements de fréquence, même légers, si le biomédicament est différent dans
la première
préparation protéique et dans la seconde préparation protéique. Si le
biomédicament est identique
et dans le même état conformationnel dans les deux préparations protéiques,
les spectres se
superposent totalement et aucun déplacement de fréquence n'est observé.
Dans un mode réalisation préféré, la méthode d'analyse et de contrôle de la
qualité d'une
composition thérapeutique, mettant en oeuvre la spectrométrie de résonance
magnétique nucléaire
(RMN) selon l'invention est caractérisée en ce qu'elle comprend les étapes
suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant un
même
biomédicament ;
b) établir la signature spectrale du biomédicament dans la première
préparation protéique à
partir d'au moins deux spectres RMN;
c) établir la signature spectrale du biomédicament dans la seconde préparation
protéique à
partir d'au moins deux spectres RMN, lesdits spectres étant réalisés selon les
mêmes
méthodes de RMN que durant l'étape b) ;
d) comparer les signatures spectrales du biomédicament dans la première et
dans la seconde
préparation protéique par superposition des spectres réalisés durant les
étapes b) et c) ,
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
12
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si le
biomédicament est identique dans la première préparation protéique et dans la
seconde
préparation protéique ;
dans laquelle au moins un spectre RMN réalisé à partir de l'une des
préparations protéiques
sélectionnées met en oeuvre une méthode de RMN bidimensionnelle dite RMN 2D.
Comme évoqué ci-dessus, la présente invention est susceptible d'utiliser une
grande variété de
spectres pour obtenir la signature spectrale d'un biomédicament. En
particulier, on utilisera dans
certains cas la possibilité d'affiner des largeurs des raies en utilisant le
phénomène de corrélation
croisée entre deux mécanismes de relaxation (expérience de type TROSY), ou la
possibilité
d'optimiser le taux de répétition des expériences en utilisant les propriétés
de relaxation
longitudinale spécifique de certains groupes de protons au sein de la protéine
(comme les protons
amides ou ceux des groupes méthyles). On pourra également utiliser des
spectres de corrélation
entre les protons de la protéine et des hétéro-noyaux comme l'azote 15 ou le
carbone 13.
L'abondance naturelle faible de ces isotopes de l'azote et du carbone réduit
la sensibilité des
expériences mais augmente la spécificité des signatures spectrales obtenues.
La balance entre
spécificité et sensibilité doit être adaptée à chaque famille de médicaments.
La structure
quaternaire (degré d'oligomérisation de la protéine d'intérêt) ainsi que la
composition du solvant
seront obtenues en enregistrant des spectres permettant de mettre en évidence
les vitesses de
diffusion translationnelle des molécules. Ces données peuvent, par exemple,
être obtenues à l'aide
de spectres DOSY. Selon un mode de réalisation particulier, la méthode
d'analyse ci-dessus est
caractérisée en ce que ladite méthode de RMN 2D est sélectionnée parmi la
méthode DOSY, les
méthodes NOESY, SOFAST, COSY, TOCSY, HSQC, HNCA, HNCO, HNCOCA, HCCH
TOCSY, HCCH COSY améliorées ou non par la variante TROSY, ainsi que toute
séquence
d'enregistrement RMN permettant d'établir des corrélations entre deux ou
plusieurs noyaux du
biomédicament. L'expérience de RMN mise en oeuvre est préférentiellement
sélectionnée parmi
les expériences suivantes : DOSY et SOFAST. Selon un autre mode de réalisation
particulier, la
méthode selon l'invention est caractérisée en ce que la méthode de RMN 2D
utilisée est la
méthode DOSY. Enfin, selon un mode de réalisation préféré, la méthode
d'analyse est
caractérisée en ce que la méthode de RMN 2D utilisée est la méthode SOFAST,
éventuellement
améliorée par la variante TROSY.
Afin d'obtenir un niveau d'information supplémentaire, la présente invention
prévoit une
méthode d'analyse et de contrôle de la qualité telle que détaillée ci-dessus,
dans laquelle les
étapes a) d) et e) sont inchangées par rapport à la méthode générale et qui
comprend les étapes
suivantes :
b) réaliser au moins deux spectres RMN 2D de la première préparation protéique
;
c) réaliser au moins deux spectres RMN 2D de la seconde préparation protéique
;
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
13
Dans un mode de réalisation particulier, la présente invention consiste en une
méthode d'analyse
comparative et de contrôle de la qualité de compositions thérapeutiques,
mettant en oeuvre la
spectrométrie de résonance magnétique nucléaire (RMN), caractérisée en ce
qu'elle comprend les
étapes suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant un
biomédicament ;
b) établir la signature spectrale du biomédicament dans la première
préparation protéique à
partir d'un spectre RMN DOSY et d'un spectre RMN SOFAST;
c) établir la signature spectrale du biomédicament dans la seconde préparation
protéique à
partir d'un spectre RMN DOSY et d'un spectre RMN SOFAST;
d) comparer les signatures spectrales du biomédicament dans la première et
dans la seconde
préparation protéique ;
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si le
biomédicament est identique dans la première préparation protéique et dans la
seconde
préparation protéique.
Comme ceci est décrit ci-dessus, la méthode innovante objet de la présente
invention revêt un
intérêt tout particulier dans le cas de l'étude de biomédicaments ou encore de
biosimilaires. Selon
un mode de réalisation particulier, la méthode d'analyse comparative et de
contrôle de la qualité
de compositions thérapeutiques mettant en oeuvre la spectrométrie de résonance
magnétique
nucléaire (RMN) selon l'invention est caractérisée en ce que l'analyse
comparative est basée sur
un biosimilaire. Dans ce mode de réalisation particulier la présente invention
porte sur une
méthode d'analyse comparative et de contrôle de la qualité de compositions
thérapeutiques,
mettant en oeuvre la spectrométrie de résonance magnétique nucléaire (RMN),
caractérisée en ce
qu'elle comprend les étapes suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant un
biosimilaire ;
b) établir la signature spectrale du biosimiaire dans la première préparation
protéique à
partir d'au moins deux spectres RMN;
c) établir la signature spectrale du biosimilaire dans la seconde préparation
protéique à partir
d'au moins deux spectres RMN;
d) comparer les signatures spectrales du biosimilaire dans la première et dans
la seconde
préparation protéique ;
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
14
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si le
biosimilaire est identique dans la première préparation protéique et dans la
seconde
préparation protéique.
Il peut également être envisagé d'étudier une préparation protéique contenant
un biomédicament
dérivé d'un composé donné par comparaison avec une préparation protéique
contenant un
biosimilaire dérivé de ce même composé. On pourra par exemple utiliser dans le
cadre d'une
étude portant sur le filgrastim : durant l'étape b) une préparation protéique
contenant le composé
thérapeutique Neupogen (Amgen) et durant l'étape c) une préparation protéique
contenant le
composé thérapeutique Tevagrastim(W (Teva Generics GmbH) ; dans le cadre d'une
étude portant
sur les somatotropines : durant l'étape b) une préparation protéique contenant
le composé
thérapeutique Genotropin(W (Pfizer) et durant l'étape c) une préparation
protéique contenant le
composé thérapeutique Omnitrope (Sandoz). La présente invention décrit
également une
méthode d'analyse comparative de conformations protéiques mettant en oeuvre la
spectrométrie
de résonance magnétique nucléaire (RMN) caractérisée en ce qu'elle comprend
les étapes
suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant
respectivement
un biomédicament et un biosimilaire ;
b) établir la signature spectrale du biomédicament dans la première
préparation
protéique contenant un biomédicament à partir d'au moins deux spectres RMN;
c) établir la signature spectrale du biosimilaire dans la seconde préparation
protéique
contenant un biosimilaire à partir d'au moins deux spectres RMN;
d) comparer les signatures spectrales du biomédicament et du biosimilaire dans
la première
et dans la seconde préparation protéique ;
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si le
biomédicament et le biosimilaire sont identiques dans la première préparation
protéique
et dans la seconde préparation protéique.
Dans un mode de réalisation particulier selon la méthode décrite ci-dessus le
biomédicament est
sélectionné parmi : les produits hormonaux (hormones de croissance,
érythropoïétine, et insuline),
les immunomodulateurs (beta-interferon), les anticorps monoclonaux, les
modulateurs de
coagulation sanguine (facteurs VIII et IX), les enzymes et les vaccins. De
façon préférée, le
biomédicament est sélectionné parmi les produits hormonaux : insuline, hormone
de croissance et
erythropoïetine. Dans un mode de réalisation préféré la protéine d'intérêt est
l'insuline.
La pertinence et l'efficacité de la méthode d'analyse comparative et de
contrôle de la qualité de
biomédicaments selon l'invention a été établie lors d'études comparatives sur
l'insuline est ses
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
biomédicaments. En conséquence, la présente invention décrit une méthode
d'analyse
comparative et de contrôle de la qualité de compositions thérapeutiques
contenant de l'insuline,
mettant en oeuvre la spectrométrie de résonance magnétique nucléaire (RMN),
caractérisée en ce
qu'elle comprend les étapes suivantes :
5 a) sélectionner au moins deux préparations protéiques différentes contenant
de l'insuline ;
b) établir la signature spectrale de l'insuline dans la première préparation
protéique à partir
d'au moins deux spectres RMN;
c) établir la signature spectrale de l'insuline dans la seconde préparation
protéique à partir
d'au moins deux spectres RMN;
10 d) comparer les signatures spectrales de l'insuline dans la première et
dans la seconde
préparation protéique ;
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si
l'insuline est identique dans la première préparation protéique et dans la
seconde
préparation protéique.
15 Si les spectres obtenus à partir de la première préparation protéique
durant l'étape b) et à partir de
la seconde préparation protéique durant l'étape c) montrent des déplacements
de fréquence jugés
significatifs au niveau de l'insuline, alors les insulines en présence sont
considérées comme
différentes. Si les spectres sont superposables, alors les insulines en
présence sont considérées
comme identiques. Par ailleurs, les spectres renseigneront également sur la
structure primaire de
l'insuline dans les échantillons étudiés, sa conformation protéique, sa
structure oligomérique,
ainsi que sur la présence ou l'absence d'excipients.
Dans un premier mode de réalisation, dans la méthode décrite ci-dessus dans
son application à
l'insuline, au moins un spectre RMN réalisé durant l'étape b), ou durant
l'étape c) à partir de
l'une des préparations protéiques sélectionnées, met en oeuvre une méthode de
RMN
bidimensionnelle dite RMN 2D.
Dans un autre mode de réalisation, dans la méthode décrite ci-dessus dans son
application à
l'insuline, au moins un spectre RMN réalisé durant les étapes b) et c) à
partir des deux
préparations protéiques sélectionnées, met en oeuvre une méthode de RMN
bidimensionnelle dite
RMN 2D.
Dans un mode de réalisation préféré, la méthode décrite ci-dessus dans son
application à
l'insuline, les expériences de RMN réalisées durant l'étape c) sont identiques
à celles réalisées
durant l'étape b). Par exemple, si des expériences de RMN DOSY et SOFAST sont
réalisées
durant l'étape b), alors des expériences de RMN DOSY et SOFAST seront
réalisées durant
l'étape c).
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
16
Dans un mode de réalisation particulier, la méthode décrite ci-dessus dans son
application à
l'insuline est caractérisée en ce qu'elle comprend les étapes suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant de
l'insuline;
b) établir la signature spectrale de l'insuline dans la première préparation
protéique à partir
de deux spectres RMN 2D;
c) établir la signature spectrale de l'insuline dans la seconde préparation
protéique à partir
de deux spectres RMN 2D;
d) comparer les signatures spectrales de l'insuline dans la première et dans
la seconde
préparation protéique ;
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si
l'insuline est identique dans la première préparation protéique et dans la
seconde
préparation protéique.
Dans une mode de réalisation préféré selon la méthode ci-dessus, ladite
méthode est caractérisée
en ce qu'elle comprend les étapes suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant de
l'insuline;
b) établir la signature spectrale de l'insuline dans la première préparation
protéique à partir
d'un spectre RMN DOSY et d'un spectre RMN SOFAST;
c) établir la signature spectrale de l'insuline dans la seconde préparation
protéique à partir
d'un spectre RMN DOSY et d'un spectre RMN SOFAST;
d) comparer les signatures spectrales de l'insuline dans la première et dans
la seconde
préparation protéique ;
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si
l'insuline est identique dans la première préparation protéique et dans la
seconde
préparation protéique.
La présente invention décrit également une méthode d'analyse comparative et de
contrôle de la
qualité de compositions thérapeutiques contenant de l'hormone de croissance,
mettant en oeuvre
la spectrométrie de résonance magnétique nucléaire (RMN), caractérisée en ce
qu'elle comprend
les étapes suivantes :
a) sélectionner au moins deux préparations protéiques différentes contenant de
l'hormone de
croissance ;
b) établir la signature spectrale de l'hormone de croissance dans la première
préparation
protéique à partir d'au moins deux spectres RMN;
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
17
c) établir la signature spectrale de l'hormone de croissance dans la seconde
préparation
protéique à partir d'au moins deux spectres RMN;
d) comparer les signatures spectrales de l'hormone de croissance dans la
première et dans la
seconde préparation protéique ;
e) déterminer à partir des signatures spectrales obtenues durant les étapes b)
et c) si
l'hormone de croissance est identique dans la première préparation protéique
et dans la
seconde préparation protéique.
Si les spectres obtenus à partir de la première préparation protéique durant
l'étape b) et à partir de
la seconde préparation protéique durant l'étape c) montrent des déplacements
de fréquence jugés
significatifs au niveau de l'hormone de croissance, alors les hormones de
croissance en présence
seront jugées différentes. Si les spectres sont superposables, alors les
hormones de croissance en
présence sont identiques. Par ailleurs, les spectres renseigneront également
sur la structure
primaire de l'hormone de croissance dans les échantillons étudiés, sa
conformation protéique , sa
structure oligomérique, ainsi que de la présence ou l'absence d'excipients ou
de tout autre
élément qui soit de nature protéique ou non-protéique.
La présente invention porte également sur une méthode d'analyse comparative de
conformations
protéiques mettant en oeuvre la spectrométrie de résonance magnétique
nucléaire (RMN) dans
laquelle la protéine d'intérêt est l'hormone de croissance.
Par ailleurs, toutes les applications décrites ci-dessus mettent en oeuvre une
comparaison entre au
moins deux échantillons, donc au moins deux compositions thérapeutiques. Il
peut cependant être
envisagé de procéder à des comparaisons entre plus de deux compositions
thérapeutiques.
La présente invention est illustrée par les exemples et figures ci-dessous :
La Fig. 1 présente la séquence en aminoacides de l'insuline humaine et de
l'insuline lispro. Les
traits gras représentent les trois ponts disulfures. Les différences entre les
deux séquences sont
soulignées et les aminoacides concernées (lysine et proline) présentés en
gras.
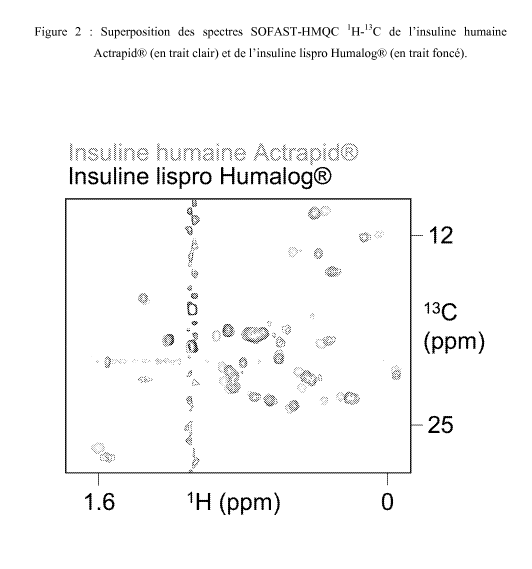
La Fig. 2 présente la superposition de spectres SOFAST-HMQC 1H-13C de
l'insuline humaine
Actrapid (en trait clair) et de l'insuline lispro Humalog (en trait foncé).
La Fig. 3 présente la superposition de spectres SOFAST-HMQC 1H-13C de
l'insuline humaine
Actrapid (en trait clair) et de l'insuline humaine Umuline rapide (en trait
foncé). Dans l'encart
est mis en évidence un léger déplacement de fréquence.
La Fig. 4 présente la superposition des cartes DOSY 1H de l'insuline humaine
Actrapid à pH 7
(en trait clair) et à pH 2 (en trait foncé). Les excipients détectables dans
ces conditions par RMN
sont le glycérol (C3H80) et le métacrésol (C7H80).
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
18
EXEMPLES
La présente méthode est utilisable pour toute formulation commerciale de
médicament, en
particulier pour les biomédicaments et les biosimilaires, dans les limites de
détection du signal
RMN. Ces limites sont notamment fixées par la concentration en composé
thérapeutique de
nature protéique. Comme vu précédemment cette méthode est notamment applicable
aux
produits hormonaux (hormones de croissance, érythropoïétine, et insuline), aux
immunomodulateurs (beta-interferon), aux anticorps monoclonaux, aux
modulateurs de
coagulation sanguine (facteurs VIII et IX), aux enzymes et aux vaccins ; cette
liste est donnée à
titre d'exemple et n'est en aucun cas limitative.
Si toutefois la formule commerciale présentait une concentration de la
protéine d'intérêt en
quantité insuffisante par rapport au seuil de détection du signal RMN, alors
il conviendrait
d'augmenter le champ (cet exemple est réalisé à 600 MHz mais on pourra passer
à 800, 900 ou
1000 MHz) et/ou d'utiliser la méthode de polarisation nucléaire dynamique
(comme celle
commercialisée par Oxford Instrument(k) ou toute autre méthode d'augmentation
de polarisation.
A. Insuline
Généralités
La structure en aminoacides de l'insuline a été la première structure
polypeptidique identifiée par
F. Sanger en 1955. L'insuline est une hormone peptidique qui comporte deux
chaînes
peptidiques : une chaîne A composée de 21 aminoacides et dépourvue
d'aminoacides basiques et
une chaîne B de 30 aminoacides comportant des aminoacides basiques. Ces deux
chaînes sont
liées entre elles par 3 ponts disulfure dont deux ponts interchaîne et un pont
intrachaîne au sein de
la chaîne A. Par ailleurs, la nature des aminoacides en position 8, 9 et 10
(dans la région du pont
intrachaîne) est variable selon les espèces animales.
L'insuline est une hormone hypoglycémiante secrétée par le pancréas. Sa masse
moléculaire
(MM) est d'environ 6000 et des dimères de MM 12000 se forment aisément. Ces
dimères sont
encore susceptibles de s'associer pour former des polymères de MM 24000 ou
48000. Ceci est la
forme oligomérique de l'insuline. C'est cette forme oligomérique de l'insuline
qui est active.
Formulations d'insulines commerciales
Les formulations commerciales d'insuline disponibles actuellement contiennent
en général du
métacrésol et des ions zinc qui permettent l'oligomérisation de la protéine
sous la forme d'un
héxamère stable dans le temps (Chang X. et al., Biochemistry, 1997, 36, 9409-
9422).
Historiquement isolée à partir de pancréas de mammifères (boeuf et porc),
l'insuline en tant que
composé thérapeutique est maintenant produite par des techniques dites de
génie génétique
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
19
utilisant la séquence d'ADN de la forme humaine de la protéine. Cette avancée
a permis le
développement d'analogues dits rapides ou retardés de l'insuline
humaine permettant
d'améliorer le confort des malades. Ces analogues ont une séquence en
aminoacides qui diffère
de la séquence humaine. Par exemple, l'insuline lispro commercialisée par Eli
Lilly sous le nom
commercial Humalog présente une séquence en aminoacides où les positions de
deux acides
aminés à l'extrémité de la chaîne B sont inversées (Figure 1).
Identification du type d'insuline
Les formulations commerciales d'insuline contiennent des concentrations
importantes de
protéines ce qui permet l'acquisition rapide de spectres de corrélation. Une
signature spectrale
non-ambigüe peut être obtenue rapidement en mesurant un spectre de corrélation
entre les protons
méthyles et le carbone correspondant. La Figure 2 montre une superposition des
spectres de
corrélation 1H-13C dans la région des méthyles mesurés pour l'insuline humaine
(Actrapid(k, Novo
Nordisk) et l'insuline lispro (Humalog(k, Eli Lilly). La comparaison des
spectres montre
clairement la conséquence de l'inversion des deux acides aminés sur la
fréquence de résonance
des groupes méthyles. Dans le cas de l'insuline, l'attribution des fréquences
est disponible ce qui
permet d'identifier les fréquences associées à l'isoleucine 2 de la chaîne A
comme étant les plus
perturbées par la mutation, ce qui est cohérent avec la structure
tridimensionnelle de l'insuline
(Chang X. et al., Biochemistry, 1997, 36, 9409-9422). Cet effet de déplacement
de fréquences
permet une identification non-ambigüe de ce variant d'insuline. On démontre
ainsi que
l'utilisation de ce type de spectre permet de distinguer deux molécules qui
ont la même
composition en aminoacides mais dont la séquence en aminoacides diffère.
Effet de la formulation galénique
Les fréquences de résonance des groupes méthyles sont également sensibles à
plusieurs
paramètres physicochimiques de leur environnement (température, pH,
composition du solvant).
Dans cet exemple, deux compositions thérapeutiques contenant de l'insuline
humaine provenant
de deux laboratoires pharmaceutiques différents sont comparées (Fig. 3). La
protéine est
identique, mais la formulation est légèrement différente : Actrapid contient
outre l'insuline
humaine, du chlorure de zinc, du glycérol, du métacrésol, de l'hydroxyde de
sodium, de l'acide
chlorhydrique et de l'eau pour préparations injectables ; Umuline rapide (k
contient, outre
l'insuline humaine, du glycérol, du métacrésol, de l'hydroxyde de sodium, de
l'acide
chlorhydrique, du phosphate disodique heptahydraté et de l'eau pour
préparations injectables. On
constate que les spectres de corrélation 1H-13C dans la région des méthyles
mesurés pour l'insuline
en provenance de Novo Nordisk et de Eli Lilly sont quasi superposables, ce qui
permet d'attester
l'identité des deux protéines. De faibles déplacements de fréquences (< 20 Hz)
sont cependant
observés sur certains pics de corrélation. Ce déplacement qui est lié à une
différence dans la
composition saline des deux formulations, permet de distinguer la provenance
du médicament. La
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
présente technique permet également de vérifier l'intégrité de la formulation
commerciale. Cette
intégrité peut être altérée lors du processus de fabrication ou lors d'étapes
telles le transport et le
stockage des formulations d'insulines. Ces dégradations conduiront
inévitablement à des
déplacements de fréquences de résonances qui seront détectés dans les spectres
de corrélation.
5 État oli og mérique et nature des excipients
Les spectres DOSY 1H permettent également de distinguer les signaux provenant
des excipients
des signaux provenant du composé thérapeutique de nature protéique. Les
excipients étant
généralement des petites molécules et possèdent un coefficient de diffusion
bien supérieur à celui
d'une protéine. La présente méthode permet donc de détecter la présence des
excipients listés
10 dans la composition du produit commercial. De plus, elle permet
d'identifier d'éventuels
contaminants de faible poids moléculaire et d'en déterminer éventuellement la
nature chimique.
De la même façon, il est possible d'estimer l'état d'oligomérisation de
l'insuline puisque le
coefficient de diffusion mesuré sur les signaux provenant de la protéine est
lié au nombre de
monomères qui s'associent (Figure 4). Ainsi, un hexamère aura un coefficient
de diffusion
15 inférieur à celui d'un dimère, la forme hexamèrique représentant la forme
stable de l'insuline. La
présente méthode est donc capable de déterminer si la formulation commerciale
étudiée présente
bien une forme stable d'insuline.
Méthode expérimentale :
Les échantillons utilisés contiennent de l'insuline humaine ou l'un de ses
analogues dans une
20 formulation commerciale. Les insulines disponibles sur le marché français
sont dosées à 100
UI/mL, ce qui correspond à une concentration en protéine de 3,5 mg/mL. A 500
LL de solution
directement prélevée dans l'échantillon 50 tL de D20 sont ajoutés. Ces 550 LL
sont placés dans
un tube RMN de diamètre égal à 5 millimètres. La première étape est la
réalisation d'un spectre
SOFAST-HMQC 1H-13C (Schanda P. et al. J. Biomol. NMR, 2005, 33, 199-211)
centré sur la
zone spectrale des groupements méthyles d'une protéine. La seconde étape est
la réalisation d'un
spectre DOSY 1H (Balayssac S. et al., J. Magn. Reson. 2009, 196, 78-83). Ces
deux spectres sont
enregistrés sur un spectromètre BRUKER opérant à 600 MHz (1H) équipé d'une
sonde
cryogénique. Le traitement des spectres est effectué avec le logiciel
NMRnotebook
(NMRTEC).
B. Hormone de croissance (somatropine)
Généralités
Cette protéine de 191 acides aminés se présente sous forme de poudre à
reconstituer ou
directement en solution. Les concentrations disponibles sont de l'ordre de 5-
10 mg/mL permettant
CA 02786170 2012-06-29
WO 2011/080492 PCT/FR2010/052936
21
d'envisager des expériences RMN basées sur l'abondance naturelle du 15N et du
13C. De plus, son
conditionnement sous forme de poudre est idéal pour les expériences d'échange
1H/2H. Enfin il
existe des versions biosimilaires de cette hormone, ce qui permet d'envisager
une étude
comparative avec le médicament originel ou biomédicament.
Formulations de somatropines commerciales
Les formulations commerciales de compositions thérapeutiques objet de la
présente étude sont
l'omnitrope (Sandoz(k) et le genotonorm (Pfizer(k).
Méthode expérimentale :
Les échantillons utilisés contiennent différentes formes de somatropine dans
deux compositions
thérapeutiques différentes. On place dans un tube RMN de diamètre égal à 5
millimètres un
échantillon de chaque composition. La première étape est la réalisation d'un
spectre SOFAST-
HMQC 1H-13C (Schanda P. et al. J. Biomol. NMR, 2005, 33, 199-211) centré sur
la zone
spectrale des groupements méthyles d'une protéine. La seconde étape est la
réalisation d'un
second spectre. Ces deux spectres sont enregistrés sur un spectromètre BRUKER
opérant à 600
MHz (1H) équipé d'une sonde cryogénique. Le traitement des spectres est
effectué avec le logiciel
NMRnotebook (NMRTEC).
Résultats
Suite à la mise en oeuvre de la méthode selon la présente invention, on peut
distinguer sans
aucune ambiguïté deux formulations différentes de la somatropine que sont
l'omnitrope et le
genotonorm.