Note: Descriptions are shown in the official language in which they were submitted.
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
1
PROCEDE DE FRACTIONNEMENT DES SOLUBLES DE POIS, FRACTIONS
OBTENUES ET LEUR VALORISATION
La présente invention est relative à un procédé original de fractionnement des
fractions
solubles de pois, comprenant une étape de microfiltration ou de
centrifugation, suivie d'une
étape d'ultrafiltration, et d'une éventuelle étape d'osmose inverse. On
parvient ainsi à
réduire la fuite de protéines vers les fractions solubles, à améliorer le
rendement de l'étape
unitaire de concentration par évaporation des fractions solubles, et on
réussit à isoler de
manière sélective les protéines d'intérêt. Il s'agit en outre d'un procédé
simple à mettre en
oeuvre, les dispositifs utilisés au niveau de chaque étape unitaire étant
classiques et bien
connus de l'homme du métier.
Depuis les années 70, le pois est la légumineuse à graines qui s'est le plus
développée et
Europe et majoritairement en France, notamment comme ressource protéique pour
l'alimentation animale mais aussi humaine. Le pois contient environ 27 % en
poids de
matières protéiques. Le terme pois est ici considéré dans son acception la
plus large et
inclut en particulier toutes les variétés sauvages de pois lisse ( smooth
pea ), et
toutes les variétés mutantes de pois lisse et de pois ridé ( wrinkled
pea ), et ce
quelles que soient les utilisations auxquelles on destine généralement
lesdites variétés
(alimentation humaine, nutrition animale et/ou autres utilisations).
Parmi les constituants du pois, les plus valorisés actuellement sont l'amidon,
les fibres et
les protéines, encore désignés sous l'expression de constituants nobles. Le
procédé de
valorisation correspondant consiste à réaliser initialement un lait d'amidon,
par mélange
dans un pétrin entre la farine de pois et de l'eau. Après avoir extrait de ce
lait l'amidon et
les fibres, on dispose d'un produit riche en protéines. On effectue alors une
opération de
floculation sur le lait, notamment par thermo coagulation, dont l'objectif est
d'insolubiliser la
ou les protéines d'intérêt. A ce stade du procédé, il est nécessaire de
réaliser une
séparation notamment par décantation centrifuge, de manière à isoler une
composition très
riche en protéines encore appelé floc . Le surnageant constitue ce que
l'homme du
métier désigne généralement sous l'expression de fractions solubles .
Il convient tout d'abord de préciser que le terme fractions solubles
constitue un abus de
langage en ce sens que ladite fraction contient un certain nombre de
particules insolubles,
comme des colloïdes divers et variés mais aussi et surtout des protéines. Ces
fractions
solubles doivent tout d'abord être concentrées par évaporation, de manière à
ce qu'on
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
2
puisse récupérer les insolubles (et notamment les protéines) qu'elles
contiennent. A ce jour,
les fractions solubles sont très peu exploitées ; elles sont utilisées de
manière quasi
exclusive comme source d'azote en fermentation et en tant qu'aliment nutritif
pour le bétail
une fois lesdites fractions enrichies en fibres.
La Demanderesse a récemment protégé, à travers les Demandes de Brevet français
n 09
51962 et n 12 57680, un procédé d'extraction de p-amylases à partir d'une
fraction soluble
de plante amidonnière dont le pois, ledit procédé comprenant une étape de
clarification par
microfiltration et une étape de concentration / purification par
ultrafiltration.
Or, force est de constater que le rendement du procédé global conduisant du
pois initial à
la composition riche en protéines (le floc) est loin d'atteindre les 100 %. On
estime qu'a un
échelon industriel, on retrouve au sein des fractions solubles entre 5 % et 25
%, mais plus
généralement autour de 20 A en poids des protéines initialement contenues
dans le pois
de départ. Cette fuite massive de protéines, via les fractions solubles, n'est
pas sans poser
un certain nombre d'inconvénients.
Le premier d'entre eux est une perte sèche en protéines d'intérêt, qui sont
actuellement
uniquement valorisées à travers le floc de protéines issu de l'étape de
décantation. Si on
parvenait à isoler de manière globale la part de protéines contenue dans les
fractions
solubles, celle-ci pourrait avantageusement être incorporée ou redirigée dans
le floc de
protéines, en vue de l'enrichir.
Le deuxième problème posé par le procédé tel qu'il existe actuellement est un
rendement
très médiocre au niveau de l'étape unitaire de concentration par évaporation
des fractions
solubles : la richesse en protéines y est telle que le phénomène
d'encrassement de
l'évaporateur est très important et nécessite de fréquents arrêts pour
nettoyage. En effet,
de par leur sensibilité thermique, les protéines coagulent et ont une
prédisposition à
encrasser les dispositifs d'évaporation.
Enfin et selon un troisième éclairage, de récents travaux ont montré qu'une
partie des
protéines issue de la fraction soluble (la fraction dite PA1b) peut être
avantageusement
utilisée dans la fabrication d'un insecticide : ceci résulte de l'enseignement
du document FR
2 778 407 Al. Il existe donc aussi un intérêt technique à isoler de manière
sélective une ou
des fractions protéiques, au sein-même des fractions solubles.
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
3
A la connaissance de la Demanderesse, cette problématique n'a jamais été
abordée dans
son ensemble, c'est-à-dire en vue de dégager des solutions visant à résoudre
le triple
problème technique tel qu'énoncé ci-dessus. Le document Pilot scale recovery
of prote ins
from a pea whey discharge by ultrafiltration (Lei (Leigh) Gao, Khai D.
Nguyen and
Alphonsus C. Utioh, Lebensm.-Wiss. u.-Technot, vol 34, pp. 149-158, 2001)
s'intéresse à
la récupération de protéines de pois par centrifugation suivie
d'ultrafiltration. La Demande
de Brevet WO 2006 / 052003 concerne quant à elle un procédé de préparation de
polypeptides solubles issus d'un effluent liquide de transformation de pois,
par filtration
membranaire puis séchage.
Travaillant à la recherche d'une solution globale pour optimiser le rendement
du procédé
d'extraction de protéines à partir du pois, la Demanderesse est parvenue à
mettre au point
un procédé qui résout le triple problème technique :
- de réduire la fuite de protéines vers les fractions solubles,
- d'améliorer le rendement de l'étape unitaire de concentration par
évaporation des
fractions solubles,
- d'isoler de manière sélective les protéines d'intérêt au sein des
fractions solubles.
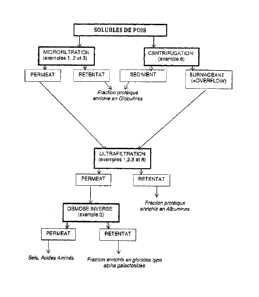
Ce procédé repose sur la succession de différentes étapes de séparation
desdites fractions
solubles, a) au moyen d'une centrifugation ou d'une microfiltration, b) puis
d'une
ultrafiltration, c) et enfin éventuellement d'une osmose inverse.
De manière tout à fait avantageuse, la mise en uvre de ces étapes de manière
séquencée permet, au niveau de chaque unité de filtration, d'isoler une
fraction protéique
d'intérêt. Typiquement, les globulines et de l'acide phytique sont récupérés
au niveau du
rétentat de microfiltration ou du culot (ou sédiment) de centrifugation. Le
perméat de
microfiltration ou le surnageant de centrifugation subit ensuite une étape
d'ultrafiltration : les
albumines constituent alors l'essentiel de la matière sèche du rétentat
d'ultrafiltration, le
perméat étant destiné à subir l'éventuelle étape d'osmose inverse. Cette
dernière permet
d'isoler d'une part une fraction riche en glucides du type a-galactosides au
niveau du
rétentat, et d'autre part les acides aminés, glucides et autres sels présents
dans le perméat.
On pourra se référer au schéma de principe de la figure n 1 de la présente
Demande.
Les autres figures 2 à 5 illustrent les résultats et un profil
électrophorétique obtenus dans
les essais exemplifiés dans la présente demande.
4
On parvient donc à isoler de manière très précise différentes catégories de
protéines d'intérêt,
qui peuvent être valorisées par la suite dans une application donnée. De
manière tout à fait
avantageuse, le rétentat de microfiltration et le sédiment résultant de la
centrifugation sont riches
en acide phytique. Or, cet acide inhibe l'absorption de divers cations (Zn,
Cu, Co, Mn, Ca, Fe) en
formant des sets insolubles (phytates). Cette propriété est exploitée en
oenologie : le traitement
au phytate de calcium est le seul qui soit autorisé (en France) pour déferrer
les vins rouges.
De manière avantageuse également, le rétentat issu de l'étape d'osmose inverse
est
particulièrement riche en a-galactoside, mais aussi en la fraction dite PA1 b
qui connaît une
application directe dans la fabrication d'insecticides d'origine entièrement
bio-sourcée (comme
divulgue dans le document FR 2 778 407 précité). De plus, tout ou partie des
fractions riches en
les différentes protéines d'intérêt, et obtenues au niveau de chaque étape
unitaire de filtration,
peut être redirigée au niveau du floc, en aval de l'étape de décantation
centrifuge. On augmente
de ce fait la richesse du floc en protéines.
Enfin, le perméat final issu de l'étape d'osmose inverse qui contient
avantageusement les acides
amines, glucides et autres sets, particules de très petites tailles, peut
facilement être concentre
au moyen d'un évaporateur, sans pour autant occasionner des problèmes de
colmatage, qui
nécessitent de fréquents arrêts de production pour des interventions de
nettoyage, voire de
changement des dispositifs.
Aussi, un objet de la présente invention consiste en un procédé de traitement
des fractions
solubles de pois comprenant :
a) une étape de microfiltration ou de centrifugation desdites fractions
solubles conduisant à
un perméat de microfiltration ou à un surnageant de centrifugation,
b) suivie d'une étape d'ultrafiltration du perméat de microfiltration ou du
surnageant de
centrifugation, conduisant à un perméat et à un rétentat d'ultrafiltration,
C) suivie d'une étape éventuelle d'osmose inverse du perméat d'ultrafiltration
conduisant à
un perméat et à un rétentat issu de l'osmose inverse.
Un autre objet de la présente invention consiste en un procédé de traitement
de fractions solubles
de pois comprenant :
a) une étape de préparation de fractions solubles comprenant
Date Reçue/Date Received 2021-02-15
4a
(i) la réalisation d'un lait d'amidon par mélange dans un pétrin entre la
farine de pois
et de l'eau,
(ii) réalisation d'un produit riche en protéine par extraction de l'amidon
et des fibres
du lait d'amidon de l'étape (i),
(iii) réalisation d'une floculation par thermo-coagulation sur le produit
riche en protéine
de l'étape (ii) ;
(iv) décantation centrifuge du produit issu de l'étape (iii) donnant lieu à
un floc et un
surnageant appelé fractions solubles,
b) une étape de microfiltration ou de centrifugation desdites fractions
solubles conduisant à
un perméat de microfiltration ou à un surnageant de centrifugation,
C) suivie d'une étape d'ultrafiltration du perméat de microfiltration ou du
surnageant de
centrifugation, conduisant à un perméat et à un rétentat d'ultrafiltration,
d) suivie d'une étape éventuelle d'osmose inverse du perméat d'ultrafiltration
conduisant à
un perméat et à un rétentat issu de l'osmose inverse.
Une des originalités de la présente invention consiste à faire subir aux
fractions solubles de pois,
compositions a priori non nobles, un certain nombre d'étapes de traitement en
vue de valoriser
leur contenu. Il convient de bien distinguer ce type de procédé ou des étapes
unitaires de
traitement sont appliquées directement aux fractions solubles, des procédés de
Date Reçue/Date Received 2021-02-15
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
l'art antérieur qui peuvent recourir à ces mêmes étapes individuelles, mais en
vue de
traiter :
- soit les protéines de pois exemptes des fractions solubles en vue de
purifier lesdites
protéines de pois,
- soit ces mêmes protéines de pois encore chargées en fractions solubles et
en vue
justement de réaliser une séparation entre protéines et fractions solubles.
La première étape du procédé selon l'invention est donc une étape a) de
microfiltration ou
de centrifugation qui a lieu directement sur les fractions solubles de pois,
telles qu'issues
de l'étape de décantation centrifuge. Cette étape a notamment pour objectif
d'isoler une
fraction protéique riche en globulines.
La microfiltration des fractions solubles de pois conduit à un perméat et à un
rétentat de
microfiltration. C'est le perméat qui est ensuite traitée dans l'étape
ultérieure b)
d'ultrafiltration. La centrifugation des solubles de pois conduit quant-à-elle
à un surnageant
et à un sédiment de centrifugation. C'est le surnageant qui est ensuite traité
dans l'étape
ultérieure b) d'ultrafiltration.
Lorsque la première étape est une microfiltration, celle-ci est
préférentiellement une
microfiltration tangentielle membranaire. Plus particulièrement, la
microfiltration tangentielle
est préférentiellement réalisée avec des membranes céramiques présentant une
porosité
de 0,01 pm à 1 pm, préférentiellement de 0,05 pm à 0,5 pm.
De manière facultative, cette première étape de microfiltration ou
centrifugation peut être
précédée d'une étape de floculation des particules insolubles contenues dans
la fraction
soluble de plantes amidonnières, par toute technique connue par ailleurs de
l'homme du
métier.
La deuxième étape du procédé selon l'invention consiste en une étape b)
d'ultrafiltration,
effectuée sur le perméat de microfiltration ou sur le surnageant de
centrifugation. Elle
permet d'obtenir d'une part un rétentat d'ultrafiltration riche en albumines,
et d'autre part un
perméat riche en la fraction dite PA1b dont il a déjà été mentionné qu'elle
peut être
valorisée dans la fabrication d'insecticide. Le perméat dans sa totalité peut
donc être
directement valorisé pour cette application insecticide ; il n'est pas
nécessaire de le
traiter/séparer outre mesure.
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
6
Plus particulièrement, il est recommandé de réaliser l'ultrafiltration à
l'aide de membranes
présentant un seuil de coupure compris entre 0.1 et 0.5 1.1M, la pression
transmembranaire
étant maintenue inférieure à 4 bars.
Enfin, le procédé selon la présente invention comprend une troisième étape c)
qui reste
éventuelle, mais qui est préférentiellement effectuée : il s'agit d'une osmose
inverse
réalisée sur le perméat d'ultrafiltration.
La Demanderesse recommande d'effectuer cette osmose avec des membranes
présentant
un seuil de coupure compris entre 100 Da et 500 Da.
Les exemples qui suivent permettent de mieux illustrer la Demande, sans
toutefois en
limiter la portée.
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
7
EXEMPLES
Exemple 1
Cet exemple illustre l'efficacité de combiner la microfiltration avec
l'ultrafiltration pour
obtenir dans un premier temps un rétentat de microfiltration riche en
globulines, et dans un
second temps un perméat d'ultrafiltration riche en glucides.
On commence tout d'abord par fabriquer la fraction soluble de pois.
De la farine de pois est initialement préparée par broyage de pois fourragers
décortiqués
sur broyeur à marteaux de type ALPINE équipé d'une grille de 100 pm. 300 kg de
farine à
87% de matière sèche sont ensuite mis à tremper dans de l'eau à la
concentration finale de
25% sur sec, à un pH de 6,5. 1044 kg de suspension de farine à 25% de matière
sèche
(soit donc 261 kg de farine sèche) sont alors introduits avec 500 kg d'eau
dans une batterie
d'hydrocyclones composée de 14 étages. Elle est alimentée par la suspension de
farine à
l'étage n 5. Cette séparation conduit à l'obtention d'une phase légère qui
correspond à la
sortie de l'étage n 1. Elle est constituée du mélange protéines, fibres
internes et solubles.
Cette phase légère en sortie d'hydrocyclones renferme en mélange (142 kg sur
sec au
total) les fibres (environ 14,8% en poids, soit 21 kg sec), les protéines
(environ 42,8% en
poids, soit 60,8 kg sec) et les solubles (environ 42,4% en poids, soit 60,2 kg
sec). Cette
fraction présente une matière sèche de 11,4 %. On procède à la séparation des
fibres sur
décanteurs centrifuges de type WESTFALIA employés dans une unité industrielle
féculière
de traitement de la pomme de terre. La phase légère en sortie de décanteur
centrifuge
renferme un mélange de protéines et de solubles, tandis que la phase lourde
renferme les
fibres de pois. La phase lourde renferme 105 kg de fibres à 20 % de matière
sèche. On
constate que la quasi- totalité des fibres est bien retrouvée dans cette
fraction.
Quant à la fraction protéines et solubles, elle renferme 1142 kg d'un mélange
en solution
de solubles et de protéines (fraction à 6 % de matière sèche). On procède à la
floculation
des protéines à leur point isoélectrique par ajustement de la phase légère en
sortie de
décanteur centrifuge à un pH de 4,5 et chauffage à 50 C.
Les protéines ainsi mises à floculer sont laissées 10 minutes en cuve de
maturation. Après
précipitation des protéines, on procède à une décantation centrifuge, qui
permet de
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
8
récupérer, après séchage, du sédiment renfermant 56 kg de protéines (86 % de
Nx6,25 sur
sec) à 93 A) de matière sèche.
On procède ainsi jusqu'à obtenir 2500 litres de solubles de pois dont le pH
est ajusté à 7.0
par ajout de soude à 50 %. La température de la suspension ainsi obtenue a été
amenée à
70 C. La composition de la suspension ainsi obtenue (SOLF_1) est donnée dans
le tableau
1.1.
SOLF_1
Teneur en matière sèche 2.5 g pour 100 g
Teneur en protéine (Nx6.25) 27 g pour 100 g de matière sèche
Teneur en cendres 16 g pour 100 g de matière sèche
Teneur en glucides totaux 47 g pour 100 g de matière sèche
Dont :
Raffinose 4.0 g pour 100 g de matière sèche
Stachyose 13.4 g pour 100 g de matière sèche
Verbacose 15.1 g pour 100 g de matière sèche
Autres 10 g pour 100 g de matière sèche
Tableau 1.1
La solution est pompée au travers d'une unité de microfiltration équipée de
membranes
céramiques type Inside Ceram ayant un seuil de coupure de 0.14 pm (19 canaux
de 4.5
mm). Tout au long de la filtration la température est régulée à 60 C et la
pression
transmembranaire maintenue à une valeur comprise entre 0.4 et 0.6 bar.
707 litres de perméat de microfiltration (P014_1) et 1768 litres de rétentat
de microfiltration
(R014_1) sont ainsi récupérés. Les compositions de chacune des fractions sont
données
dans le tableau 1.2.
P014_1 R014_1
Teneur en matière sèche 2.5 2.5
Teneur en protéine 26.5 27.2 g / 100 g de matière sèche
(Nx6.25)
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
9
Teneur en cendres 21.0 14.0
Teneur en glucides totaux 45.0 47.0 g / 100 g de matière
sèche
Autres 7.5 11.8 g / 100 g de matière sèche
g / 100 g de matière sèche
Tableau 1.2
550 litres du perméat (P014_1) sont pompés au travers d'une unité
d'ultrafiltration. L'unité
d'ultrafiltration est équipée de membranes céramiques type KERASERD BX
commercialisées par la société NOVASEP et ayant un seuil de coupure de 15 Kda
(7
canaux de 6 mm). Tout au long de la filtration la température est régulée à 60
C et la
pression transmembranaire maintenue à une valeur comprise entre 1 et 3 bars.
467 litres de perméat d'ultrafiltration (P15_1) et 33 litres de rétentat
(R15_1) sont ainsi
récupérés. Les compositions de chacune des fractions sont données dans le
tableau 1.3.
P15_1 R15_1
Teneur en matière sèche 2.2 7.2
Teneur en protéine 15.0 75.1 g / 100 g de matière sèche
(Nx6.25)
Teneur en cendres 23.6 10.3 g / 100 g de matière sèche
Teneur en glucides totaux 52.6 12.5 g / 100 g de matière
sèche
Autres 8.8 2.1 g / 100 g de matière sèche
Tableau 1.3
Exemple 2
En comparaison avec l'exemple précédent, celui-ci illustre le bénéfice de la
diafiltration
pour optimiser la richesse du rétentat.
600 litres de solubles de pois issus de procédé de coagulation isoélectrique
sont ajustés à
un pH de 7.0 par ajout de soude à 50%. La température de la suspension ainsi
obtenue a
été amenée à 60 C. La composition de la suspension est celle donnée dans le
tableau 1.1
précédent.
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
La solution est pompée au travers d'une unité de microfiltration équipée de
membranes
céramiques type Inside CeramC) ayant un seuil de coupure de 0.14 }lm (19
canaux de 4.5
mm). Tout au long de la filtration la température est régulée à 60 C et la
pression
transmembranaire maintenue à une valeur comprise entre 0.4 et 0.6 bar.
160 litres de perméat de microfiltration (P014_2) et 400 litres de rétentat de
microfiltration
(R014_2) sont ainsi récupérés.
110 litres du perméat (P014_2) sont pompés au travers d'une unité
d'ultrafiltration. L'unité
d'ultrafiltration est équipée de membranes céramiques type KERASEPO BX
commercialisées par la société NOVASEP et ayant un seuil de coupure de 15 Kda
(7
canaux de 6mm). La fraction rétentat est maintenue en recyclage total sur
l'alimentation et
le perméat évacué. L'alimentation est additionnée par un débit permanent d'eau
à raison
d'un volume d'eau pour 7 volumes de perméat évacué. Tout au long de la
filtration la
température est régulée à 60 C et la pression transmembranaire maintenue à une
valeur
comprise entre 2 et 3 bars.
107 litres de perméat d'ultrafiltration (P15_2) et 7 litres de rétentat
(R15_2) sont ainsi
récupérés. Le rétentat (R15_2) est atomisé. La composition des fractions
analysées est
donnée dans le tableau 2.1.
P15_2 R15_2
Teneur en matière sèche 3-3 11.0 `1/0
Teneur en protéine 15-8 81.7 g /100 g de matière sèche
(Nx6.25)
Teneur en cendres 20.4 10.3 g / 100 g de matière sèche
Teneur en glucides totaux 51.0 6.8 g / 100 g de matière sèche
Autres 12.8 1.2 g / 100 g de matière sèche
Tableau 2.1
Exemple 3
Cet exemple illustre l'effet bénéfique de l'osmose inverse pour déminéraliser
et augmenter
la concentration en glucides totaux d'intérêt du perméat d'ultrafiltration.
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
11
150 litres de solubles de pois sont traités selon le protocole décrit dans
l'exemple 2. 60
litres de perméat d'ultrafiltration (P15_3) sont ainsi obtenus puis pompés au
travers d'une
unité d'osmose inverse équipée de membranes organiques spiralées type OSMONICS
DESALC) commercialisées par la société General Electric Company et ayant un
seuil de
'coupure de 350 Da. La fraction rétentat est maintenue en recyclage total sur
l'alimentation
et le perméat évacué. Tout au long de la filtration la température est régulée
à 50 C et la
pression maintenue à une valeur de l'ordre de 20 bars.
litres de rétentat (R350_3) sont ainsi récupérés. La composition des
différentes fractions
est donnée dans le tableau 3.1.
P15_3 R350_3
Teneur en matière 2.2 14 g /100 g
sèche
Teneur en protéine 14.5 9 g / 100 g de matière sèche
(Nx6.25)
Teneur en cendres 20 6 g /100 g de matière sèche
Teneur en glucides 56 65 g / 100 g de matière sèche
totaux
Raffinose 4.5 6.0 g /100 g de matière sèche
Stachyose 18.0 19.1 g /100 g de matière sèche
Verbacose 16.9 21.0 g / 100 g de matière sèche
Autres 16.5 12.0 g / 100 g de matière sèche
Tableau 3.1
Exemple 4
La solubilité en fonction du pH de la fraction atomisée R15_2 obtenue dans
l'exemple 2 est
mesurée. Elle est comparée à celle d'un isolat de protéine de pois type
Nutralys0 F85M
commercialisé par la Demanderesse.
La solubilité est considérée comme étant égale à la matière sèche d'un
surnageant de
centrifugation (15 min à 3000 g) d'une suspension à un pH donné et préparée
par
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
12
homogéinisation de 5 g de produit dans 100 g d'eau. La figure 2 représente la
solubilité des
2 produits en fonction du pH. La fraction R15_2 a une meilleure solubilité que
le Nutralys
F85M. Cette meilleure solubilité est un avantage pour le secteur des
formulations
énergétiques dans le domaine du sport.
Exemple 5
La capacité émulsifiante en fonction du pH de la fraction atomisée R15_2
obtenue dans
l'exemple 2 est mesurée. Elle a été comparée à celle d'un isolat de protéine
de pois type
Nutralys F85M.
L'activité émulsifiante du produit est déterminée à partir du volume
d'émulsion subsistant
(en %), après dispersion dans un mélange eau-huile à un pH donné puis
centrifugation.
L'activité émulsifiante du produit est déterminée à partir du volume
d'émulsion subsistant
(en %), après dispersion dans un mélange eau-huile à un pH donné puis
centrifugation
selon la Méthode de YASUMATSU et al.(1972) décrite par : NACZK M., RUBIN L.J.,
SHAH IDI F., Functional properties and phytate content of pea protein
preparations. Journal
of Food Science, Volume 51 N 5, 1986, p 1245-1247.
La figure 3 montre qu'à pH 4,5 et 5,5, la fraction R15_2 présente la meilleure
capacité
émulsifiante, pH où le Nutralys F85M n'a aucune capacité émulsifiante. Ces
propriétés
émlusifiantes sont valorisables entre autres dans le domaine de la
charcuterie.
Exemple 6
La capacité moussante et la stabilité de mousse de la fraction atomisée R15_2
obtenue
dans l'exemple 2 est mesurée à différents pH. Elle est comparée à celle d'un
isolat de
protéine de pois type Nutralys F85M (voir figure 4).
La capacité moussante d'un échantillon de protéines est déterminée selon la
méthode
SUMNER A.K., NIELSEN M.A., YOUNGS C.G., Production and evaluation of pea
protein
isolate. Journal of Food Science, Volume 46, 1981, p 364-372. La perte de la
mousse
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
13
obtenue est calculée à partir du pourcentage de diminution du volume de mousse
après 30
minutes de repos.
La tenue de la mousse de la fraction R15_2 est bien meilleure que celle du
Nutralys
F85M. Dans les crèmes glacées, les meringues, les cakes, le pain ou les barres
hyperprotéinées, on cherchera effectivement une meilleure tenue en mousse.
Exemple 7
Les qualités organoleptiques de la fraction atomisée R15_2 obtenue dans
l'exemple 2 sont
évaluées par un groupe de 20 panélistes. Elles sont comparées à celle d'un
isolat de
protéine de pois type Nutralys F85M.
Pour chaque essai 5 g de produit sont délayés dans 150 ml d'eau et maintenus
au bain-
marie à 50 C.
La fraction R15_2 est plus neutre en odeur et en goût en comparaison au
Nutralys F85M.
Le tableau 7.1 énumère les descripteurs proposés par les panélistes lors de
l'analyse.
R15_2 Nutralys F85M
Odeur Neutre, quasi neutre Végétal, fermenté
Goût Neutre à presque Amer
neutre
Tableau 7.1
_
Exemple 8
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
14
Le flux industriel d'une partie des solubles de pois préconcentrés à 10 % de
matière sèche
(SOPPr) est détourné des étapes de concentrations finales destinées à l'amener
à 28 % de
matière sèche pour alimenter un circuit pilote composé :
= d'une unité de décantation centrifuge type Westfalia CA-505 réglée sur
une
accélération de 3600 g et alimentée à environ 12 m3/h. Celle-ci génère en
continu
11 m3/h d'une fraction overflow (OVF), réintroduits dans le circuit de
concentration
des solubles en aval du point de prélèvement de la fraction SOPPr, et 600 kg/h
de
sédiment (SED) mélangé à l'isolat de protéine avant séchage.
= d'une unité d'ultrafiltration équipée de membranes céramiques type
KERASEPO
BW commercialisées par la société NOVASEP et ayant un seuil de coupure de 5
KDa (19 canaux de 3.5 mm). Celle-ci est alimentée de manière discontinue par
une
fraction du volume d'overflow (OVF) généré par l'étape précédente.
La fraction rétentat est maintenue en recyclage total sur l'alimentation et le
perméat évacué.
L'alimentation est additionnée par un débit permanent d'eau à raison d'un
volume d'eau
pour 5 volumes de perméat évacué. Tout au long de la filtration la température
est régulée
à 60 C et la pression transmembranaire maintenue à une valeur comprise entre 2
et 3 bars.
2 fractions sont générées : rétentat (RET) et perméat (PERM).
La composition des différentes fractions est donnée dans les tableaux 8.1 et
8.2.
SOPPr OVF SED
Teneur en matière 10 8 25 g / 100 g
sèche
Teneur en protéine 30 29 72 g / 100 g de matière sèche
(Nx6.25)
Teneur en cendres 13 14 4 g / 100 g de matière sèche
Teneur en glucides 44 45 12 g /100 g de matière sèche
totaux
Raffinose 5 4 g / 100 g de matière sèche
Stachyose 14 13 g / 100 g de matière sèche
Verbacose 13 15 g / 100 g de matière sèche
Autres 13 12 12 g / 100 g de matière sèche
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
Tableau 8.1
RET PERM
Teneur en matière 14 5 g / 100 g
sèche
Teneur en protéine 84 3 g /100 g de matière sèche
(Nx6.25)
Teneur en cendres 5 19 g /100 g de matière sèche
Teneur en glucides 3 61 g /100 g de matière sèche
totaux
Raffinose 5 g /100 g de matière sèche
Stachyose 18 g / 100 g de matière sèche
Verbacose 20 g / 100 g de matière sèche
Autres 8 17 g /100 g de matière sèche
Tableau 8.2
Exemple 9
Un profil électrophorétique, présenté sur la figure 5, est déterminé sur la
fraction atomisée
R15_2 obtenue dans l'exemple 2, la fraction R014_1 obtenue dans l'exemple 1,
les
fractions SED et RET obtenues dans l'exemple 8. Le profil est effectué par
migration de
l'échantillon en conditions dénaturantes et réductrices au travers d'un gel de
polyacrylamide à 20 % suivie d'une coloration au bleu de Coomassie. Les
profils
correspondants apparaissent en figure 5.
Pour les fractions R15_2 et RET, on note la présence marquée de bandes aux
alentours de
14 kDa correspondant aux albumines PA1, la bande à 30 kDa correspondant aux
dimères
d'albumines PA2. Ceci en fait une fraction particulièrement intéressante pour
être valorisée
selon les indications du document FR 2 778 407 Al.
Pour les fractions R014_1 et RET, on constate une prédominance de bandes aux
alentours
des 50 kDa et au-delà, reflètent la présence importante de globulines, ce qui
lui permet
d'être valorisé entre autres en nutrition animale.
CA 02897516 2015-07-08
WO 2014/118449 PCT/FR2014/000023
16
Exemple 10
Cet exemple illustre l'effet bénéfique du prétraitement des solubles sur la
durée des cycles
et donc de la disponibilité de l'étape de concentration.
Le fonctionnement de l'unité de décantation centrifuge décrit dans l'exemple 8
est maintenu
constant de manière à observer l'impact sur la durée de cycle de
fonctionnement de l'étape
de concentration des solubles. Les données sont ainsi comparées à celles de
cette étape
de concentration sans prétraitement des solubles par l'unité de décantation.
Dans les 2 cas
de figure, les paramètres de conduite du système de concentration (débit
vapeur, vide,
température produit, matière sèches d'entrée et de sortie des solubles) sont
maintenus
constants. La durée de cycle est définie par l'intervalle de temps s'écoulant
entre 2 arrêts
du système d'évaporation pour lavage. Le lavage a été initié dès que le débit
de
condensats d'évaporation diminue de plus de 15 A par rapport à sa valeur
nominale
obtenue après nettoyage complet (> 40 m3/h pour un débit alimentation en
solubles de 55
m3/h).
Durée cycles (h)
Sans prétraitement Cycle 1 72
des solubles Cycle 2 65
concentrés Cycle 3 68
Avec prétraitement Cycle 1 86
des solubles Cycle 2 90
concentrés Cycle 3 89
=
Tableau 10.1