Note: Descriptions are shown in the official language in which they were submitted.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
1
COMPOSÉS DÉRIVÉS DE FLAVANOIDES ET PROCÉDÉ POUR LEUR
PRÉPARATION PAR DÉPOLYMÉRISATION DE TANINS CONDENSÉS
La présente invention concerne un composé aromatique dérivé de
flavonoïdes, un procédé d'obtention d'un tel composé, par dépolymérisation de
composés polyaromatiques polyfonctionnels issus de ressources
renouvelables, plus particulièrement de tanins condensés, ainsi que
l'utilisation
de composés dérivés du furane pour la dépolymérisation de tanins condensés.
Afin de résoudre le problème de dépendance vis-à-vis des énergies
fossiles, et de réduire la pollution associée à la mise en oeuvre de réactions
chimiques, il s'avère d'un intérêt croissant de développer des procédés de
production de composés chimiques d'intérêt à partir de ressources naturelles
renouvelables, qui soient respectueux de l'environnement. Ainsi, l'obtention
de
synthons, en particulier de synthons phénoliques, issus de la biomasse, en
tant
que molécules plateformes pour l'industrie chimique, est devenu un enjeu
important de cette industrie.
En particulier, de nombreux travaux ont été réalisés depuis quelques
années pour tirer profit des propriétés avantageuses de composés naturels, les
polyphénols végétaux, qui sont susceptibles de constituer des substituts aux
composés pétrochimiques phénoliques, tels que le bisphénol A. Parmi eux, les
tanins condensés, également nommés proanthocyanidines, sont les plus
abondants chez les végétaux, notamment les plantes terrestres, après la
lignine. Ces composés se retrouvent notamment dans de nombreuses
ressources naturelles disponibles et variées telles que les résidus agro-
industriels, par exemple dans les marcs fruitiers, et la biomasse non
exploitée,
en particulier dans l'écorce, les feuilles et les aiguilles d'arbres, la
vigne, les
fruits, etc.
Les tanins condensés sont des oligomères ou polymères de
monomères polyaromatiques polyfonctionnels. Ces monomères appartiennent
à la classe des flavan-3-ols, de formule générale :
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
2
Rx
OH
HO 8 0
s OH
6 le 3 0/RY
4
OH
où Rx représente un atome d'hydrogène ou un groupement hydroxyle,
et Ry représente un atome d'hydrogène ou un groupement gallate de formule :
OH
HO
0
HO 1$
Par dépolymérisation des tanins condensés, on obtient notamment les
monomères (+)catéchine et (-)épicatéchine, ainsi que des dérivés substitués
principalement en C4 et potentiellement en C2. Les atomes de carbone C2, C3
et C4 de ces dérivés sont asymétriques, et d'autres stéréoisomères que ceux
présents initialement dans les structures de tanins peuvent également être
formés au cours de la réaction de dépolymérisation. Le caractère aromatique
de ces monomères associé à la présence de fonctions hydroxyles libres leur
confère des propriétés qui en font des candidats privilégiés pour constituer
des
réactifs de départ pour la synthèse industrielle de produits actifs, pour des
applications nombreuses et variées.
Ainsi, il a été proposé par l'art antérieur divers procédés de
dépolymérisation des tanins condensés, visant à en obtenir les monomères
constitutifs, dits unités terminales, et/ou des monomères dérivés, dits unités
d'extension, essentiellement à des fins analytiques.
Il a notamment été montré que les tanins condensés peuvent être
dépolymérisés en milieu acide au moyen de nucléophiles soufrés. Un tel art
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
3
antérieur peut par exemple être illustré par les différentes publications de
Chen
et al., 2009 ; US 8 088 419 ; Roumeas et al., 2013 ; Selga et al., 2004, qui
décrivent la dépolymérisation de tanins condensés biosourcés par thiolyse. Un
tel procédé de dépolymérisation, dit analytique, permet d'obtenir, avec un
rendement élevé, des dérivés de flavonoïdes utiles pour une large gamme
d'applications, par exemple de formule générale :
OH
HO
gOl 0
. O
OH H
OH S
R
dans laquelle R représente (CH2)2-0H, CH2-COOMe, (CH2)2-NH2 ou
CH2-CH(NH2)-COOH.
Cependant, les dérivés de ce type sont instables en conditions
alcalines, c'est-à-dire typiquement à pH supérieur à 8,5, conditions dans
lesquelles le groupement soufré devient nucléofuge. Ainsi, il a été constaté
par
les présents inventeurs qu'à un pH égal à 9, les dérivés issus d'une
dépolymérisation réalisée au moyen de 2-mercaptoéthanol en tant que
nucléophile sont dégradés à plus de 95% au bout de 19 h à température
ambiante. Cette propriété a notamment été mise à profit pour créer de
nouveaux dérivés issus de la dépolymérisation des tanins par thiolyse (Chen et
al., 2009).
Toutefois, il a été constaté par les présents inventeurs que l'instabilité
des dérivés de dépolymérisation soufrés en conditions alcalines est
préjudiciable à la mise en oeuvre de certaines réactions ultérieures de
fonctionnalisation des groupements hydroxyles des noyaux phénoliques, qui
sont nécessaires pour certaines applications.
Un objectif de la présente invention est ainsi de proposer des
composés dérivés de flavonoïdes qui présentent une stabilité en milieu basique
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
4
supérieure à celle des composés proposés par l'art antérieur, de sorte à
élargir
le champ des applications de tels composés, et en particulier le type de
réactions de fonctionnalisation auxquelles ces composés peuvent être soumis
pour former des produits d'intérêt pour une large gamme d'applications.
Un objectif supplémentaire de l'invention est de proposer un procédé
d'obtention de tels composés à partir de substances biosourcées.
La présente invention vise notamment également à ce qu'un tel
procédé soit respectueux de l'environnement, qu'il soit simple et peu coûteux
de mise en oeuvre, et qu'il permette d'obtenir les composés selon l'invention
rapidement et avec un rendement élevé.
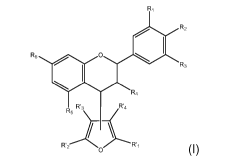
Ainsi, il est proposé par la présente invention un composé dérivé de
flavonoïdes, dit monomère furano-flavanique, dans lequel un résidu flavonoïde
est lié par liaison covalente, au niveau du cycle pyrane, à un dérivé du
furane,
de formule générale (I) :
R1
R2
R6 . 0
I.
R3
R4
R3 7 4
R5 \
.......................õ(
R'2
o (I)
dans laquelle :
R1, R2, R3 et R5, identiques ou différents, représentent chacun un
atome d'hydrogène ou un groupement hydroxyle, le cas échéant protégé par
un groupement protecteur d'une fonction hydroxyle,
R4 représente un atome d'hydrogène ou un groupement ¨0R7, dans
lequel R7 représente un atome d'hydrogène, un groupement protecteur de la
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
fonction hydroxyle ou un groupement de formule générale (II) :
O
gOl
R",o oR"i
OR-2 (Il)
dans laquelle R"1, R"2, et R"3, identiques ou différents,
représentent chacun un atome d'hydrogène ou un groupement
5 protecteur de la fonction hydroxyle,
R6 représente un groupement hydroxyle, le cas échéant protégé par
un groupement protecteur d'une fonction hydroxyle,
et R'1, R'2, R'3 et R'4, identiques ou différents, représentent chacun un
atome d'hydrogène ou un substituant ne comportant pas de groupement
électro-attracteur par effet mésomère conjugué au noyau furane,
un substituant parmi R'1, R'2, R'3 et R'4 représentant la liaison
covalente avec le cycle pyrane du résidu flavonoïde, illustrée par la liaison
à
attachement variable dans la formule générale (I),
ou un de ses sels.
Par groupement protecteur d'une fonction hydroxyle, on entend tout
groupement utilisé de manière classique en elle-même pour protéger une
fonction hydroxyle, plus particulièrement un hydroxyle phénolique, c'est-à-
dire
pour masquer sa réactivité en vue de réactions ultérieures. Chacun des
groupements protecteurs d'une fonction hydroxyle peut par exemple être choisi
parmi les groupements alkyle, acyle, notamment acétyle, benzyle, silyle,
sulfonyle, etc. Les groupements protecteurs d'une fonction hydroxyle portés
par le composé selon l'invention peuvent être tous identiques, ou être
différents
les uns des autres, les groupements protecteurs portés par les fonctions
hydroxyle d'un même noyau étant alors de préférence identiques les uns aux
autres.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
6
La formule générale (I) englobe toutes les combinaisons possibles de
formes isomères au niveau des carbones asymétriques, et tous les mélanges
de telles formes isomères. A partir d'un mélange d'isomères, chaque isomère
particulier peut être obtenu par des méthodes de purification classiques en
elles-mêmes pour l'homme du métier.
Par substituant ne comportant pas de groupement électro-attracteur
par effet mésomère conjugué au noyau furane, on entend tout substituant ne
comportant aucun groupement électro-attracteur par effet mésomère qui soit lié
directement, ou par conjugaison, au cycle furane du composé de formule
générale (I). Il est du ressort de l'homme du métier de déterminer, à partir
de
ses connaissances générales, quels substituants entrent ou n'entrent pas dans
une telle définition. Les connaissances générales de l'homme du métier en la
matière sont notamment illustrées par l'ouvrage de René Milcent, Chimie
organique: Stéréochimie, entités réactives et réactions, EDP Sciences ¨ 2007,
en particulier dans les chapitres 5.5 et 5.6.
A titre d'exemple, des substituants exclus de la définition de R'1, R'23
R'3 et R'4, sont des substituants comportant, lié directement ou par
conjugaison
au cycle furane, un radical électro-attracteur tel qu'un radical nitro,
carbonyle,
carboxylique ou sulfonique, éventuellement salifié ou estérifié, amide, cyano,
sulfonyle, etc.
Le composé selon l'invention peut en particulier être tel que dans la
formule générale (I), R'1, R'2, R'3 et R'4, identiques ou différents,
représentent
chacun, à l'exception du substituant formant la liaison covalente avec le
cycle
pyrane :
- un atome d'hydrogène,
- un atome d'halogène, tel qu'un atome de fluor, de chlore, de brome
ou d'iode,
- un groupement comportant un radical électro-donneur, par effet
inductif ou mésomère, lié directement ou par conjugaison au cycle furane, par
exemple choisi parmi un radical amino, oxy ou thio, éventuellement substitué,
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
7
ledit groupement ne comportant pas de groupement électro-attracteur par effet
mésomère conjugué au noyau furane,
- ou un radical carboné linéaire, ramifié et/ou cyclique, pouvant
comporter un seul cycle ou plusieurs cycles condensés, saturé et/ou insaturé,
le cas échéant aromatique, éventuellement substitué, comportant
éventuellement un ou plusieurs hétéroatomes et/ou un ou plusieurs
groupements comprenant un ou plusieurs hétéroatomes, chaque hétéroatome
étant notamment choisi parmi 0, N, P, Si et S, ledit radical carboné ne
comportant pas de groupement électro-attracteur par effet mésomère conjugué
au noyau furane.
Préférentiellement, dans la formule générale (I), au moins un
substituant parmi R'1, R'2, R'3 et R'4 représente un atome d'hydrogène.
La liaison covalente R'1, R'2, Fr3 OU R'4, reliant le résidu flavonoïde et le
dérivé du furane dans le composé de formule générale (I) selon l'invention,
est
notamment stable en milieu basique, et elle n'est pas encline à permettre une
re-polymérisation ou une dégradation dans un tel milieu, contrairement aux
liaisons des dérivés obtenus par dépolymérisation de tanins condensés par des
composés soufrés proposés par l'art antérieur. Il a notamment été démontré
par les présents inventeurs que le composé de formule générale (I) selon
l'invention demeure stable et inchangé aussi bien dans une solution aqueuse à
pH 9 et température ambiante, qu'en milieu organique contenant une base. Le
composé selon l'invention peut ainsi avantageusement être utilisé directement
en milieu basique pour la préparation de produits actifs impliquant une
fonctionnalisation des phénols qui comprend une étape de déprotonation.
Le composé selon l'invention peut ainsi être facilement fonctionnalisé,
aussi bien en conditions acides, que neutres ou alcalines, en vue de la
préparation de produits actifs tirant avantageusement profit des propriétés
liées
non seulement à la présence dans sa structure d'un squelette de type
flavanoïde, à structure benzopyrane, mais également d'un noyau furanique.
Notamment, des substituants comportant des groupements électro-attracteurs
tels que, par exemple, ceux exclus pour le noyau furanique du composé de
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
8
formule générale (I), pourront être introduits pour conférer à ce composé des
fonctionnalités supplémentaires.
Ainsi, les propriétés des noyaux phénoliques, combinées aux
propriétés physico-chimiques globales du composé découlant de sa structure,
confèrent à ce dernier de multiples propriétés, notamment antioxydantes,
antimicrobiennes, photochimiques, et sensorielles, qui, associées à sa
réactivité chimique, le rendent tout à fait avantageux pour un grand nombre
d'applications.
Le composé selon l'invention trouve ainsi application dans de
nombreux domaines, notamment, mais non limitativement, dans des domaines
tels que ceux des matériaux, de la cosmétique, de l'agroalimentaire, du
médical, du photovoltaïque, ou des polymères, par exemple pour le traitement
de surface.
Le composé selon l'invention peut en particulier consister en un dérivé
de la catéchine, de formule générale (la) :
OH
HO
I. 0 \
OH OH
...............( R'Ll
OH R'3\
R2 R'l
0 (la)
ou en un dérivé de l'épicatéchine, de formule générale (lb) :
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
9
OH
HO 0
µ\
=,,,,,,, OH
OR7
...............( R'Ll
R3
OH \
R2 R'i
0 (lb)
formules dans lesquelles R'1, R'2, R'3 et R'4, et R7, sont tels que décrits
ci-avant et ci-après en référence à la formule générale (1).
Le composé selon l'invention peut en particulier être tel que dans la
formule générale (1), R'1, R'2, R'3 et R'4, identiques ou différents,
représentent
chacun, lorsqu'ils ne forment pas la liaison covalente avec le résidu
flavonoïde,
un atome d'hydrogène ou un radical hydrocarboné linéaire ou ramifié,
éventuellement substitué, éventuellement interrompu par un ou plusieurs
hétéroatomes et/ou par un ou plusieurs groupements comprenant un ou
plusieurs hétéroatomes, chaque hétéroatome pouvant par exemple être choisi
parmi 0, N, P, Si et S, ledit radical hydrocarboné ne comportant pas de
groupement électro-attracteur par effet mésomère conjugué au noyau furane.
Des composés selon l'invention peuvent notamment répondre aux
formules générales (lc) et (Id) suivantes :
R1
R2
R6 . 0
el
R3
R4
R5
0
0 (1c)
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
R1
R2
R6 . 0
el
R3
R4
R5 IN )s.....s.
0 (Id)
formules dans lesquelles R1, R2, R3, R4, R5 et R6, sont tels que décrits
ci-avant en référence à la formule générale (I).
Dans des variantes de l'invention, dans la formule générale (I) ci-
5 dessus,
R'1, R'2, R'3 et R'4 répondent notamment à l'une ou plusieurs des
caractéristiques ci-après, prises seules ou en chacun de leurs combinaisons
possibles :
- R'1 représente la liaison covalente avec le cycle pyrane,
- R'3 et R'4 représentent chacun un atome d'hydrogène,
10 - R'2
représente un atome d'hydrogène ou R'2 représente un
groupement alkyle, notamment à chaîne linéaire, de préférence en
Cl -C18, de préférence encore en Cl -C10, et préférentiellement en
Cl -C4. En particulier R'2 peut représenter un radical méthyle.
En particulier, dans la formule générale (I), R'2, R'3 et R'4 peuvent
représenter tous trois un atome d'hydrogène, et R'1 peut représenter la
liaison
covalente avec le cycle pyrane, le composé selon l'invention répondant alors à
la formule générale (le) :
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
11
R1
R2
R6 go 0
I.
R3
R4
R5
0 N
¨ (le)
dans laquelle R1, R2, R3, R4, R5 et R6 sont tels que défini ci-avant en
référence à la formule générale (I).
On utilisera dans la présente description, pour désigner un tel
composé, l'expression unité d'extension furylée .
Dans des variantes de l'invention, R1, R2, R3, R4, R5 et R6, et R'1, R'2,
R'3 et R'4, sont tels que défini ci-avant en référence à la formule générale
(I), au
moins un groupement parmi R'1, R'2, R'3 et R'4 ne représentant cependant ni un
atome d'hydrogène ni la liaison covalente avec le cycle pyrane.
Le composé selon l'invention peut en particulier être tel que, dans la
formule générale (I), R'3 et R'4 représentent chacun un atome d'hydrogène, R'1
représente la liaison covalente avec le cycle pyrane, et R'2 représente un
groupement alkyle, notamment à chaîne linéaire, de préférence en Cl -Cl 8, de
préférence encore en Cl -C10, et préférentiellement en Cl -C4. En particulier,
R'2 représente alors un radical méthyle, le composé répondant alors à la
formule générale (If) ci-après, dans laquelle R1, R2, R3, R4, R5 et R6 sont
tels
que défini ci-dessus :
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
12
R1
R2
R6 Io 0
el
R3
R4
R5
0
-
(If)
On utilisera dans la présente description, pour désigner un tel
composé, l'expression unité d'extension sylvanylée .
Un composé répondant à une telle formule générale (If) est
notamment particulièrement compatible avec une utilisation dans le domaine
alimentaire.
Dans d'autres variantes de l'invention, dans la formule générale (I), R'1
et R'2 ne représentent ni un atome d'hydrogène, ni la liaison covalente avec
le
cycle pyrane, R'3 représente un atome d'hydrogène et R'4 représente la liaison
covalente avec le cycle pyrane. R'1 et R'2 peuvent par exemple représenter
chacun un groupement méthyle, le composé selon l'invention répondant alors à
la formule générale (Ig) :
R1
R2
R6 igo 0
ige
/ R3
R4
R5
V /
0
(Ig)
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
13
Des composés particuliers selon la présente invention répondent
respectivement aux formules ci-après :
OH OH
HO
. 0 el
OH HO 0 el
OH
OH OH
OH OH
0 N 0 N
- -
Un autre aspect de l'invention concerne un procédé d'obtention d'un
composé selon l'invention de formule générale (I), tel que défini ci-avant. Ce
procédé comporte une étape de dépolymérisation de tanins condensés en
présence d'un acide au moyen d'un nucléophile, dit dérivé furanique, de
formule générale (III) :
R'2 0
zi........... R
R'3 '1
R'4 (III)
dans laquelle R'1, R'2, R'3 et R'4, identiques ou différents, représentent
chacun un atome d'hydrogène ou un substituant ne comportant pas de
groupement électro-attracteur par effet mésomère conjugué au noyau furane.
Au moins un substituant parmi R'1, R'2, R'3 et R'4 représente un atome
d'hydrogène, de sorte à permettre la formation de la liaison covalente avec le
cycle pyrane du résidu flavonoïde d'une unité d'extension des tanins
condensés, menant à l'obtention d'un composé de formule générale (I) selon
l'invention.
En particulier, dans la formule générale (III), R'1, R'2, R'3 et R'4 peuvent
répondre à l'une des caractéristiques ci-après, ou à toute combinaison de
plusieurs de ces caractéristiques techniquement compatibles :
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
14
- R'1, R'2, R'3 et R'4, identiques ou différents, représentent chacun :
- un atome d'hydrogène,
- un atome d'halogène, tel qu'un atome de fluor, de chlore, de
brome ou d'iode,
- un groupement comportant un radical électro-donneur lié
directement ou par conjugaison au cycle furane, par exemple
choisi parmi un radical amino, oxy ou thio, éventuellement
substitué,
- ou un radical carboné linéaire, ramifié et/ou cyclique, pouvant
comporter un seul cycle ou plusieurs cycles condensés, saturé
et/ou insaturé, le cas échéant aromatique, éventuellement
substitué, comportant éventuellement un ou plusieurs
hétéroatomes et/ou un ou plusieurs groupements comprenant
un ou plusieurs hétéroatomes ;
- au moins deux substituants parmi R'1, R'2, R'3 et R'4 représentent un
atome d'hydrogène ;
- R'1, R'2, R'3 et R'4, identiques ou différents, représentent chacun un
atome d'hydrogène ou un radical hydrocarboné linéaire ou ramifié,
éventuellement substitué, éventuellement interrompu par un ou plusieurs
hétéroatomes et/ou par un ou plusieurs groupements comprenant un ou
plusieurs hétéroatomes, ledit radical hydrocarboné ne comportant pas de
groupement électro-attracteur par effet mésomère conjugué au noyau furane ;
- R'1, R'3 et R'4 représentent chacun un atome d'hydrogène ;
- R'2 représente un groupement alkyle, notamment à chaîne linéaire,
de préférence en Cl -Cl 8, de préférence encore en Cl-C-10, et
préférentiellement en Cl -C4 ; R'2 représentant par exemple un radical
méthyle ;
- R'2 représente un atome d'hydrogène ;
- au moins un groupement parmi R'1, R'2, R'3 et R'4 ne représente pas
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
un atome d'hydrogène.
En particulier, lorsque dans la formule générale (III) au moins un
substituant parmi R'1, R'2, R'3 et R'4 représente un groupement comportant un
radical électro-donneur lié directement ou par conjugaison au cycle furane,
par
5 exemple choisi parmi un radical amino, oxy ou thio, éventuellement
substitué,
ou un radical carboné linéaire, ramifié et/ou cyclique, pouvant comporter un
seul cycle ou plusieurs cycles condensés, saturé et/ou insaturé, le cas
échéant
aromatique, éventuellement substitué, comportant éventuellement un ou
plusieurs hétéroatomes et/ou un ou plusieurs groupements comprenant un ou
10 plusieurs hétéroatomes, la présence d'un tel substituant favorise
avantageusement la réaction de dépolymérisation, notamment
comparativement au furane non substitué.
Dans des modes de réalisation particuliers de l'invention, dans la
formule générale (III) :
15 - R'1 représente au atome d'hydrogène ;
- R'2 représente un atome d'hydrogène ou un groupement alkyle,
notamment à chaîne linéaire, de préférence en Cl -Cl 8, de préférence encore
en Cl -C-10, et préférentiellement en Cl -C4, par exemple un radical méthyle ;
- R'3 et R'4 représentent chacun un atome d'hydrogène.
La mise en présence, en milieu acide, de tanins condensés et d'un
nucléophile dérivé du furane de formule (III) ci-dessus induit la libération
d'une
part, des unités d'extension des tanins condensés, et d'autre part, des unités
terminales sous leur forme native, notamment d'unités catéchine/épicatéchine,
de formule :
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
16
R1
R2
R6 go 0
el
R3
R4
R5
Le nucléophile de formule générale (III) réagit avec les unités
d'extension ainsi libérées, pour former par furylation un monomère furano-
flavanique de formule générale (I), ou un mélange de tels monomères.
On ne préjugera pas ici du mécanisme sous-tendant l'obtention des
composés de formule générale (I) conformes à l'invention par une telle
réaction
de dépolymérisation. On peut cependant supposer que le nucléophile de
formule générale (III) présente des propriétés particulièrement avantageuses,
qui sont mises à profit au cours de la réaction pour stabiliser les
carbocations
issus du clivage de la liaison interflavanique, et déplacer l'équilibre de la
réaction vers les formes dépolymérisées, stables en conditions alcalines.
Le procédé selon l'invention est particulièrement simple à mettre en
oeuvre, et ce à faible coût.
Afin de répondre à un des objectifs que s'est fixés la présente
invention, à savoir que ce procédé soit le plus respectueux de l'environnement
possible, et permette la valorisation d'agro-ressources locales, le procédé
selon l'invention est préférentiellement mis en oeuvre à partir de tanins
condensés issus de ressources renouvelables telles les sous-produits et
coproduits d'industrie agricoles ou viticoles, par exemple les marcs
fruitiers, les
écorces de bois, etc., et les biomasses non exploitées, telles que les
aiguilles
de pins, les feuilles mortes, etc.
L'étape de dépolymérisation du procédé selon l'invention peut être
mise en oeuvre à partir de tanins condensés ayant été préalablement isolés de
la biomasse. Le procédé comporte alors une étape préalable d'extraction des
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
17
tanins condensés à partir de biomasse, par exemple de pépins de raisin. Une
telle extraction peut être réalisée par toute technique connue de l'homme du
métier, notamment les techniques illustrées par les publications de Prieur et
al.,
1994, et Rigaud et al., 1993.
L'étape de dépolymérisation peut en outre être précédée d'une étape
de protection d'une ou plusieurs des fonctions hydroxyle portées par les
tanins,
par tout groupement protecteur d'une fonction hydroxyle classique en lui-
même.
Autrement, l'étape de dépolymérisation peut être mise en oeuvre
directement à partir de biomasse, sans extraction préalable des tanins
condensés contenus dans cette biomasse, par exemple directement sur une
fraction d'écorces, telle qu'une fraction d'écorce de Pseudotsuga menziesil
(pin
Douglas).
Dans des modes de mise en oeuvre préférés de l'invention, le dérivé
furanique de formule générale (111), jouant le rôle de nucléophile pour la
réaction de dépolymérisation des tanins condensés, est également biosourcé.
Ainsi, les nucléophiles furaniques peuvent être issus de la biomasse,
en particulier à partir de produits hydrogénés du furaldéhyde, ce dernier
étant
issu de procédé de déshydratation de pentose (xylane), ou bien présents sous
forme de groupements furaniques dans certains lipides comme décrit par
exemple par Liengprayoon et al., 2011.
En particulier, dans la formule générale (111) ci-dessus, R'1, R'2, R'3 et
R'4 peuvent représenter tous quatre un atome d'hydrogène. Le nucléophile mis
en oeuvre pour la réaction de dépolymérisation des tanins condensés est alors
le furane, de formule générale (111a) :
o
U(111a)
Le furane peut notamment être produit industriellement à partir du
furfural (US 2 776 981), ce dernier étant lui-même d'origine agricole, et
obtenu
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
18
par déshydratation acide et distillation des pentoses végétaux (Adams et al.,
1921).
Un tel composé, de même que ses dérivés, s'inscrivent par
conséquent particulièrement bien dans un procédé répondant aux principes
d'une chimie verte et durable.
Lorsque le nucléophile est le furane, on désignera dans la présente
description le procédé de dépolymérisation selon l'invention par le terme
furanolyse . Une telle réaction mène à l'obtention de composés selon
l'invention répondant à la formule générale (le) ci-avant.
Dans d'autres modes de mise en oeuvre particuliers de l'invention,
dans la formule générale (111) ci-dessus, R'1, R'3 et R'4 représentent chacun
un
atome d'hydrogène et R'2 représente un radical méthyle. Le nucléophile mis en
oeuvre pour la réaction de dépolymérisation des tanins condensés est alors le
2-méthylfurane, autrement appelé sylvane, de formule générale (111b) :
,,,-o
U(111b)
Le sylvane, comme le furane, constitue une source de carbone
industrielle et renouvelable issue de la biomasse. Il peut notamment être
obtenu par un traitement hydrogénant de l'aldéhyde du furfural, catalysé
généralement par des catalyseurs cuivrique et/ou chromique (Burnett et al.,
1948), sa production faisant également l'objet du développement de procédés
d'hydrogénation catalytique (US 7 064 222) ou électrochimiques (Li et al.,
2012).
Le sylvane offre notamment l'avantage d'une compatibilité
particulièrement bonne avec une utilisation dans le domaine alimentaire. En
outre, il s'avère plus performant que le furane pour la dépolymérisation des
tanins condensés, notamment en termes de réactivité.
Lorsque le nucléophile est le sylvane, on désignera dans la présente
description le procédé de dépolymérisation selon l'invention par le terme
sylvanolyse . Une telle réaction mène à l'obtention de composés selon
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
19
l'invention répondant à la formule générale (If) ci-avant.
De manière générale, le furane et le sylvane présentent en outre
l'avantage d'être facilement recyclables par distillation, en raison de leur
faible
point d'ébullition qui, à pression atmosphérique, est inférieur à 32 C pour
le
furane, et inférieur à 66 C pour le sylvane.
Un exemple d'un autre nucléophile pouvant être mis en oeuvre pour la
réaction de dépolymérisation des tanins condensés est le 2,5-diméthylfurane,
de formule générale (111c) :
H3c
N,-.o
Uj _______________________________________ cH,
(111c)
dans laquelle R'1 et R'2 représentent chacun un radical méthyle, et R'3
et R'4 représentent chacun un atome d'hydrogène.
Une telle réaction mène à l'obtention de composés selon l'invention
répondant à la formule générale (Ig) ci-avant.
Les paramètres opératoires optimaux exacts du procédé selon
l'invention dépendent de la structure particulière du nucléophile de formule
générale (111) mis en oeuvre. Il est du ressort de l'homme du métier de
déterminer ces paramètres de manière appropriée, pour chaque nucléophile
particulier, sur la base des caractéristiques préférentielles plus générales
énoncées ci-après, afin d'obtenir, avec une vitesse de réaction la plus rapide
possible, des rendements de réaction élevés, notamment proches de 100 /0,
en limitant notamment la réaction compétitive de dégradation des produits de
la
réaction.
De manière générale, il a été observé par les présents inventeurs que
la réaction de dépolymérisation nécessite un excès de nucléophile de formule
générale (111) par rapport aux tanins, du fait de la force nucléophile
intrinsèque
de ces derniers et de leurs formes monomères, qui rentrent en compétition
avec le réactif nucléophile. Cet excès dépend de la nature du nucléophile mis
en jeu.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
Dans des modes de mise en oeuvre particuliers du procédé selon
l'invention, pour l'étape de dépolymérisation, le rapport molaire
nucléophile
de formule générale (III) / tanins condensés dépolymérisables est supérieur
ou égal au rapport molaire nucléophile de formule générale (III) / dimère B2
5 nécessaire pour obtenir au moins 2,5 %, de préférence au moins 5 %, de
préférence encore au moins 10 %, en particulier au moins 25%, et par
exemple au moins 40 %, de composés monomères furano-flavaniques de
formule générale (I), par rapport au total des composés (monomères furano-
flavaniques de formule générale (I) et unités terminales) formés lors d'une
10 réaction de dépolymérisation du dimère B2 par le nucléophile de formule
générale (III) en présence d'acide chlorhydrique à 0,1 N dans le méthanol, à
C et en un temps de réaction de 10 minutes.
La quantité de tanins condensés dépolymérisables dans un échantillon
de tanins condensés peut être déterminée par toute méthode connue de
15 l'homme du métier, par exemple en mettant en oeuvre, sur cet
échantillon, un
procédé de dépolymérisation au moyen d'un nucléophile tel que le
phloroglucinol ou le 2-mercaptoéthanol, connus pour être apte à dépolymériser
quantitativement les tanins condensés dépolymérisables, et en mesurant la
quantité de tanins condensés ainsi dépolymérisés, qui correspond
20 sensiblement à la quantité de tanins condensés dépolymérisables
initialement
présente dans l'échantillon. La molarité des tanins est classiquement exprimée
en équivalents de monomères simples non galloylés.
Par rapport à cette quantité de tanins condensés dépolymérisables, la
quantité molaire de nucléophile de formule générale (III) à mettre en oeuvre
25 dans le procédé selon l'invention est préférentiellement déterminée par
comparaison avec une réaction de dépolymérisation réalisée sur le dimère B2
au moyen dudit nucléophile de formule générale (III).
Le dimère B2, ou épicatéchine-(413¨>8)-épicatéchine, est un tanin
modèle bien connu de l'homme du métier, et disponible commercialement,
30 notamment auprès des fournisseurs Sigma-Aldrich ou ExtraSynthèse.
La mise en oeuvre d'une réaction de dépolymérisation du dimère B2 à
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
21
0,7 mmo1.111, par le nucléophile de formule générale (III) à une concentration
molaire donnée, en présence d'acide chlorhydrique à 0,1 N dans le méthanol et
à 30 C, permet d'établir, par exemple par analyse par chromatographie, en
particulier par chromatographie liquide ultra performance (UPLC), la quantité,
d'une part, de monomères furano-flavaniques de formule générale (I), et
d'autre part, d'unités terminales du dimère, obtenus en un temps de réaction
de
minutes. La mise en oeuvre d'une telle réaction pour différentes
concentrations en nucléophile de formule générale (III) permet de déterminer
quelles concentrations molaires de ce nucléophile permettent d'obtenir au
10 moins 2,5 %, de préférence au moins 5 %, de préférence encore au moins
10%, en particulier au moins 25%, et par exemple au moins 40%, de
monomères furano-flavaniques de formule générale (I), par rapport au total de
monomères furano-flavaniques de formule générale (I) et d'unités terminales
obtenus.
Il a été constaté par les présents inventeurs qu'un rapport molaire
nucléophile de formule générale (III) / tanins condensés dépolymérisables
supérieur ou égal à un rapport molaire nucléophile de formule générale (III)
/
dimère B2 ainsi déterminé, permet avantageusement d'obtenir des
rendements de la réaction de dépolymérisation élevés en un temps réduit, en
limitant notamment l'effet de compétition des formes monomères nucléophiles
des tanins avec le nucléophile de formule générale (III) conforme à la
présente
invention.
Le rapport molaire nucléophile de formule générale (III) / tanins
condensés dépolymérisables , pour lequel la molarité des tanins est exprimée
en équivalents de monomères simples non galloylés, est en particulier
préférentiellement supérieur ou égal à 133, par exemple supérieur ou égal à
200 pour le furane, et supérieur ou égal à 1,67, par exemple supérieur ou égal
à 20 pour le sylvane. De tels rapports molaires permettent d'obtenir des
rendements élevés de la réaction de dépolymérisation, notamment supérieurs
ou égaux à 85 %.
Dans des modes de mise en oeuvre particuliers de l'invention, pour la
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
22
mise en oeuvre de l'étape de dépolymérisation par le furane en tant que
nucléophile, le rapport initial exprimé en moles de nucléophile par gramme de
tanins condensés dépolymérisables est de préférence supérieur ou égal à
1,72, et préférentiellement supérieur ou égal à 3,44. Une telle
caractéristique
permet avantageusement d'obtenir un rendement de production du composé
de formule générale (I) selon l'invention supérieur ou égal à 90 /0. Dans
toute
la présente description, le rendement de la réaction de dépolymérisation selon
l'invention est exprimé en pourcentage des valeurs de référence obtenues par
une réaction de dépolymérisation standard, mettant en oeuvre le 2-
mercaptoéthanol en tant que réactif nucléophile, dite thiolyse, décrite
notamment dans la publication de Roumeas et al., 2013.
Lorsque le nucléophile de formule générale (III) est le sylvane, un
rapport minimal de 0,555 moles de sylvane par gramme de tanins condensés
dépolymérisables permet d'obtenir un rendement proche de 100 /0, et la valeur
de ce rapport peut être abaissée à 0,139 tout en conservant un rendement d'au
moins 90 /0.
Dans des modes de mise en oeuvre particuliers de l'invention,
particulièrement adaptés à l'utilisation du furane en tant que nucléophile
pour
l'étape de dépolymérisation des tanins condensés, la concentration de tanins
condensés dépolymérisables soumis à l'étape de dépolymérisation est
inférieure ou égale à 5 g/I. Des concentrations dans une telle plage s'avèrent
particulièrement avantageuses en termes d'absence de formation de produits
secondaires ainsi que de rendement quantitatif de la réaction.
Dans d'autres modes de mise en oeuvre particuliers de l'invention,
particulièrement adaptés à l'utilisation du sylvane en tant que nucléophile
pour
l'étape de dépolymérisation des tanins condensés, la concentration de tanins
condensés dépolymérisables soumis à l'étape de dépolymérisation est
inférieure ou égale à 80 g/I. Des concentrations dans une telle plage
s'avèrent
particulièrement avantageuses en termes d'absence de formation de produits
secondaires ainsi que de rendement quantitatif de la réaction
L'acide utilisé pour l'étape de dépolymérisation des tanins condensés
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
23
peut être de tout type. Il est notamment choisi parmi des acides couramment
mis en oeuvre dans le domaine industriel, tels que l'acide sulfurique (H2SO4),
l'acide chlorhydrique (HCI), l'acide méthanesulfonique (M50H), l'acide
formique
et l'acide acétique, ou un mélange de tels acides. Les acides fixés sur
support
solide, tels que de type Amberlyst 15, sont particulièrement préférés dans
des modes de mise en oeuvre du procédé en flux continu, pour des extraits de
tanins condensés solubles dans les conditions réactionnelles.
La concentration d'acide mise en oeuvre dans l'étape de
dépolymérisation des tanins condensés est de préférence équivalente à la
concentration de cet acide nécessaire pour conférer à une solution aqueuse un
pH compris entre -1 et 3,5. Il entre dans les compétences de l'homme du
métier de déterminer, pour chaque acide particulier, la plage de concentration
adéquate.
A titre d'exemple, lorsque l'acide est l'acide chlorhydrique, il peut être
introduit dans le milieu réactionnel, pour la mise en oeuvre de l'étape de
dépolymérisation, dans une concentration comprise entre 0,1 et 2,0 mol/L. Plus
généralement, pour cet acide comme pour l'acide méthanesulfonique, des
concentrations comprises entre 0,1 et 0,4 mol/L sont particulièrement
préférées.
Dans des modes de mise en oeuvre particuliers de l'invention, l'étape
de dépolymérisation est réalisée dans un solvant polaire, de préférence un
solvant protique, tel par exemple que le méthanol, l'éthanol, l'acide formique
ou
l'acide acétique, ou dans un mélange de solvants contenant au moins un
solvant polaire, de préférence protique. Dans ce dernier cas, les solvants mis
en oeuvre dans le mélange sont avantageusement choisis pour être inertes les
uns par rapport aux autres dans les conditions réactionnelles. Le cas échéant,
le ou les solvants polaires, le cas échéant protiques, peuvent se trouver en
mélange avec un ou des solvants d'autres types, y compris aprotiques ou
apolaires.
La proportion du nucléophile de formule générale (III) dans le solvant
peut alors être comprise entre 1 et 75 % en volume, de préférence comprise
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
24
entre 10 et 75% en volume, par rapport au volume de solvant,
préférentiellement être environ égale à 25 % en volume par rapport au volume
de solvant.
L'étape de dépolymérisation des tanins condensés est de préférence
réalisée à une température inférieure ou égale à la température d'ébullition
du
nucléophile de formule générale (111) à la pression appliquée dans le
réacteur,
et le cas échéant, lorsqu'un solvant est ajouté au milieu réactionnel, à une
température inférieure ou égale à la température d'ébullition de ce solvant à
cette même pression. A titre d'exemple, lorsque la réaction est mise en oeuvre
à pression atmosphérique, des températures comprises entre 30 C et 40 C
sont particulièrement préférées.
De manière générale, l'étape de dépolymérisation du procédé selon
l'invention peut avantageusement être réalisée avec un rendement élevé, d'au
moins 90 %, en un temps aussi réduit que 30 minutes, ou quelques heures
selon le nucléophile mis en oeuvre, et ceci à une température modérée,
notamment inférieure à 50 C.
A titre d'exemple, lorsque le nucléophile est le furane de formule (111a),
l'un ou plusieurs des paramètres opératoires suivants peuvent être appliqués :
- concentration initiale : 1 g/I de tanins condensés
- solvant : méthanol
- rapport volumique de furane dans le méthanol : 25 % v/v
- acide : acide chlorhydrique à 0,1 mol/1
- température : 30 C
De telles conditions opératoires s'avèrent tout à fait avantageuses en
termes de rendement et de vitesse de la réaction de dépolymérisation. Elles
permettent par exemple d'atteindre un rendement aussi élevé que 100% à
partir d'un extrait industriel de tanins de pépins de marcs vinifiés en blanc
ou
d'un tanin modèle, le dimère B2 (épicatéchine-(413¨*8)-épicatéchine).
Dans ces mêmes conditions, mais avec une concentration initiale de
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
0,2 g/I de dimère B2, le procédé selon l'invention permet en outre notamment
de dépolymériser le dimère B2 en un temps très court, de 10 minutes.
Le procédé selon l'invention peut comporter une étape finale de
séparation hors du milieu réactionnel du composé de formule générale (I) qu'il
5 permet d'obtenir. Cette séparation est notamment réalisée rapidement à
l'issue
de la réaction, de sorte à éviter tout phénomène de dégradation du composé
formé dans le milieu réactionnel acide. Elle peut être réalisée par toute
technique classique en elle-même. Par exemple, elle peut consister à ajouter
de l'eau dans le milieu, à évaporer les solvants et le nucléophile par
10 évaporation sous vide, puis à extraire les produits d'intérêt par
extraction
liquide/liquide grâce à un solvant organique non-miscible à l'eau, tel que
l'acétate d'éthyle, l'éther diéthylique, etc.
Le procédé selon l'invention peut être mis en oeuvre de manière
discontinue (par batch). Préférentiellement, pour la dépolymérisation d'un
15 extrait de tanins soluble dans le mélange réactionnel, il est mis en
oeuvre en
flux continu, au moyen d'une installation classique en elle-même dans le
domaine industriel.
Lorsque le procédé selon l'invention est mis en oeuvre en flux continu,
par exemple dans un réacteur thermostaté, l'acide est de préférence supporté,
20 de sorte à être facilement séparable par filtration.
Dans le cas du traitement direct de la biomasse, le procédé peut par
exemple être mis en oeuvre au moyen d'un extrudeur bi-vis à co-courant
solvant/réactif, classique en lui-même, comportant un premier segment
permettant le broyage de la matière première, et un deuxième segment
25 permettant l'ajout des solvants/réactifs, avec malaxage et imprégnation.
Le
temps de réaction est fixé par la vitesse de l'extrudeur. Dans un troisième
segment sont réalisés l'essorage et la filtration des produits d'intérêt. Un
exemple d'un tel extrudeur pour le traitement de la biomasse est notamment
décrit dans l'ouvrage de Maréchal, 2001.
L'acide peut alors être neutralisé et/ou lavé à l'eau, les solvants et
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
26
réactifs peuvent être évaporés sous vide ou distillés à pression
atmosphérique,
et les produits d'intérêt repris par un solvant organique tel que l'acétate
d'éthyle, l'éther diéthylique, etc.
Le composé de formule générale (I) selon l'invention peut autrement
être obtenu par tout autre procédé, notamment par furylation de monomères
flavaniques obtenus à partir de tanins condensés ou de tout autre type de
tanins par toute autre méthode, ou encore par furylation de composés obtenus
par voie chimique.
Par exemple, à partir de taxifoline de formule (IV) ci-après, il peut être
mis en oeuvre une première étape de réduction in situ de la fonction
carbonyle,
pour obtenir le dérivé 3-4-diols (V) correspondant, par exemple selon le
schéma réactionnel suivant :
OH OH
HO
. 0 el
OH HO 0
. OH
-)111e- .
OH NaBH4 OH
OH 0 OH OH
(IV) (V)
Dans une deuxième étape, le dérivé 3-4-diols (V) obtenu peut être mis
en présence d'un nucléophile de formule générale (III) selon l'invention, en
milieu acide, de la même manière que celle décrite ci-avant en référence au
procédé de dépolymérisation de tanins condensés, pour obtenir le composé de
formule générale (I) selon l'invention. Ce schéma réactionnel peut également
être appliqué à la taxifoline et/ou son produit de réduction, le dérivé 3-4
diols,
dont les groupements hydroxyle phénoliques auront été préalablement
protégés.
Un autre aspect de l'invention concerne l'utilisation, pour
dépolymériser des tanins condensés, d'un composé de formule générale (III) :
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
27
R'2NO
ziR __ R
R'3 '1
R'4 (III)
dans laquelle R'1, R'2, R'3 et R'4, identiques ou différents, représentent
chacun un atome d'hydrogène ou un substituant ne comportant pas de
groupement électro-attracteur par effet mésomère conjugué au noyau furane,
au moins un au moins un substituant parmi R'1, R'2, R'3 et R'4 représentant un
atome d'hydrogène.
R'1, R'2, R'3 et R'4, peuvent notamment répondre à l'une ou plusieurs
des caractéristiques énoncées ci-avant en référence à la formule générale
(III).
Les caractéristiques et avantages de l'invention apparaîtront plus
clairement à la lumière des exemples ci-après, fournis à simple titre
illustratif et
nullement limitatifs de l'invention, avec l'appui des figures 1 à 8, dans
lesquelles :
- la figure 1 montre un chromatogramme UPLC à 280 nm du brut
réactionnel obtenu à l'issue de la mise en oeuvre d'un procédé de
dépolymérisation de tanins condensés selon un mode de mise en oeuvre
particulier de la présente invention (furanolyse), utilisant en tant qu'acide
de
l'acide chlorhydrique (HCI) ;
- la figure 2 représente un graphe montrant les quantités de chacun
des produits de réaction, par gramme de tanins traités, pour des procédés de
dépolymérisation de tanins condensés selon des modes de mise en oeuvre
particuliers de la présente invention (furanolyse), utilisant en tant qu'acide
de
l'acide chlorhydrique (HCI) ou de l'acide méthanesulfonique (M50H), ainsi que
pour une réaction de dépolymérisation de tanins par un nucléophile soufré
proposée par l'art antérieur (thiolyse) ;
- la figure 3 représente un graphe montrant l'effet de la concentration
initiale en dimère B2 sur sa cinétique de disparition au cours d'un procédé
conforme à un mode de mise en oeuvre de l'invention de furanolyse d'une
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
28
préparation commerciale de dimère B2 en présence d'une solution
méthanolique de furane (25 % v/v) et d'HCI (0,1 mo1.111) ;
- la figure 4 représente un graphe montrant l'effet de la concentration
initiale en dimère B2 sur la cinétique d'apparition des produits de
dépolymérisation au cours du procédé de furanolyse ayant mené à l'obtention
de la figure 3 ;
- la figure 5 montre un chromatogramme UPLC à 280 nm du brut
réactionnel obtenu à l'issue de la mise en oeuvre d'un procédé de
dépolymérisation de tanins condensés selon un mode de mise en oeuvre
particulier de la présente invention (sylvanolyse), utilisant en tant qu'acide
de
l'acide chlorhydrique (HCI) ;
- la figure 6 montre des chromatogrammes UPLC, avec détection à
280 nm, réalisés sur une solution aqueuse des produits issus de la
dépolymérisation d'un extrait de tanins condensés par thiolyse, (a) avant, et
(b)
après, mise en contact pendant 19 h avec une solution tampon à pH 9 ;
- la figure 7 montre des chromatogrammes UPLC, avec détection à
280 nm, réalisés sur une solution aqueuse d'un produit brut issu de la
dépolymérisation d'un extrait de tanins condensés par le sylvane
conformément à un mode de mise en oeuvre particulier de l'invention, (a)
avant, et (b) après, mise en contact pendant 19 h avec une solution tampon à
pH 9 ;
- et la figure 8 montre les courbes sigmoïdes, établies à partir des
différents résultats expérimentaux, exprimant le rapport molaire entre les
dérivés issus des unités d'extension Uext et le total des unités d'extension
et
des unités terminales Uterm (Uexti(Uext+Uterm)), en fonction du rapport
molaire
initial nucléophile / dimère B2 , pour des expériences de dépolymérisation
du dimère B2 par les nucléophiles conformes à l'invention furane et sylvane,
pour des concentrations initiales en dimère B2 de 100, 200 ou 400 mg.111, et
différentes concentrations initiales de nucléophile.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
29
Matériel et méthodes
Pour les expériences ci-après, les solvants et réactifs ont été obtenus
chez Sigma-Aldrich pour le furane, le sylvane, le 2-mercaptoéthanol, l'acide
méthanesulfonique anhydre (M50H) et la catéchine ; chez Cari Roth pour
l'acide chlorhydrique fumant (HCI 37% aq.) ; et chez ProLabo pour le méthanol
(grade analytique) (Me0H) et l'éthanol absolu (Et0H). Les solutions dites
chlorhydriques et méthanesulfonique sont préparées respectivement
par dilution d'HCI fumant (37 % aq.) et de M50H dans le solvant concerné.
Les extraits de tanins condensés de pépins industriels produits à partir
de marcs provenant de vinifications en blanc ( tanins de pépins blanc )
(grade haute qualité) ont été obtenus auprès de l'Union des Distilleries de la
Méditerranée, et le dimère B2 auprès de la société Extrasynthèse.
Protocole général d'analyse des produits des réactions de
dépolymérisation (identification et quantification)
L'analyse consiste à réaliser une séparation des produits de la
réaction de dépolymérisation par chromatographie liquide ultra performance
(système UPLC Waters) couplée en série à un détecteur à barrettes de diodes
(DAD) et à un spectromètre de masse (modèle AmaZonX Brucker) (UPLC-
MS). Les échantillons issus de la dépolymérisation sont analysés
extemporanément, sans traitement préalable, le milieu réactionnel étant dilué
le
cas échéant pour une concentration finale de tanins à 1 gri (200 mg.111 pour
le dimère B2). Les échantillons (2 L) sont injectés sur une colonne Waters
Acquity Atlantis HSS T3 1,8 lm - 2,1x100 mm, et élués avec les solvants A
(H20:HCOOH 99:1) et B (H20:HCOOH:MeCN 19:1:80), selon le gradient A/B :
99,9 % à 60 % linéaire, 5 min ; 60 % à 1 % linéaire, 2 min ; 1 % isocratique,
1 min ; 1 % à 99,9 % linéaire, 1 min. Le chromatogramme UV enregistré à
280 nm permet l'analyse quantitative par intégration des pics correspondant à
chacun des produits, grâce à une calibration externe préalable des produits de
la réaction. Le chromatogramme MS(+) permet l'identification des produits, sur
la base des valeurs m/z.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
Une séparation préparative par chromatographie-flash sur colonne de
silice greffée DIOL
(Interchim), suivie le cas échéant d'une
chromatographie semi-préparative (silice greffée C18) permet d'isoler les
produits avec une grande pureté pour confirmer les structures par RMN et
5 déterminer leurs coefficients de réponse sur l'appareil UPLC-MS.
Pour chaque cinétique entreprise, la quantification des réactifs et des
produits est réalisée par analyse en UPLC-MS(+). A cet effet, dès que les
réactifs sont mis en présence, le mélange réactionnel est immédiatement
distribué par prélèvement d'un même volume dans plusieurs tubes. Tous les
10 échantillons sont placés dans un bain thermostaté et portés à la
température
choisie. Un échantillon est sacrifié pour chaque point de la cinétique
correspondant à un temps donné. Une fois sorti du bain, l'échantillon est
refroidi à 10 C, dilué si nécessaire et injecté eytemporanément dans le
chromatographe.
15 EXEMPLE
1 ¨ Etude comparative de procédés de thiolyse ou de
furanolyse de tanins de pépins blanc à 1 g/I
Il a été procédé à la dépolymérisation d'un extrait de tanins de pépins
blanc, en milieu acide, au moyen d'une part d'un nucléophile soufré comme
proposé par l'art antérieur (réaction de thiolyse analytique, exemple
20 comparatif), et d'autre part d'un nucléophile conforme à la présente
invention,
le furane (réaction de furanolyse), en présence respectivement de deux acides
différents, l'acide chlorhydrique et l'acide méthanesulfonique.
Thiolyse (exemple comparatif)
Une réaction de thiolyse optimisée, selon le protocole décrit dans la
25 publication de Roumeas et al., 2013, est réalisée de la manière
suivante.
Dans un tube de 10 mL, l'extrait de tanins (10 mg) est dissous dans le
méthanol (Me0H) (5 mL), puis sont ajoutés 5 mL de la solution de
dépolymérisation thiolytique (12 I_ de 2-mercaptoéthanol et 83 L d'HCI
fumant pour 5 mL de Me0H qsp). Le tube est fermé par un bouchon
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
31
phénolique muni d'un septum PTFE, et laissé sous agitation à 40 C durant
2 h.
Furanolyse - HCI
Une première réaction de furanolyse conforme à la présente invention
est réalisée comme suit.
Dans un tube de 10mL, l'extrait de tanins (10 mg) est dissous dans le
Me0H (5 mL), puis sont ajoutés le furane (2,5 mL) et une solution de Me0H
chlorhydrique (0,4 mo11-1). Le tube est fermé par un bouchon phénolique muni
d'un septum PTFE, et laissé sous agitation à 40 Cdurant 1 h.
Furanolyse - M50H
Une deuxième réaction de furanolyse conforme à la présente invention
est réalisée comme suit.
Dans un tube de 10 mL, l'extrait de tanins (10 mg) est dissous dans le
Me0H (5 mL), puis sont ajoutés le furane (2,5 mL) et la solution de M50H à
0,4 mo11-1 dans Me0H (5 mL). Le tube est fermé par un bouchon phénolique
muni d'un septum PTFE, et laissé sous agitation à 40 C durant 1 h.
Chez le raisin, une proportion des unités constitutives des chaînes
polymériques formant les tanins étant galloylée, c'est-à-dire estérifiée par
l'acide gallique au niveau du radical hydroxyle en C3, les réactions de
dépolymérisation conduisent à la formation des produits suivants :
- unités d'extension furylées répondant à la formule générale (I) selon
l'invention :
O . OH
HO 0 . OH
HO
* OH
le OH
OH OGal
OH OH
0 N 0 N
Dérivé Dérivé galloylé
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
32
- unités terminales :
*
O . OH
HO 0 . OH
HO OH
* OH
OH OGal
OH OH
Terminale Terminale galloylée
où Gal représente un groupement gallate de formule (II) définie ci-
avant.
Pour chacune des réactions de dépolymérisation, la quantité de
chacun des produits formés est déterminée par UPLC-MS, comme indiqué ci-
avant. Les produits de dépolymérisation sont référencés comme il suit : unités
terminales catéchine (Cat), épicatéchine (Ec), épicatéchine gallate (EcG), et
unités d'extension furylées de la catéchine (Cat-F), de l'épicatéchine (Ec-F)
et
de l'épicatéchine gallate (EcG-F).
A titre d'exemple, la figure 1 montre le chromatogramme UPLC à
280 nm du brut réactionnel obtenu à l'issue de la réaction de furanolyse ¨ HCI
décrite ci-avant.
Pour chacun des produits formés, le temps de rétention et la valeur
m/z observée en MS(+) est indiqué dans le tableau 1 ci-après.
Produit Temps de rétention (M + H+)
(min)
Cat 2,8 291
Ec 3,2 291
EcG 4,0 443
Cat-F 3,9 357
Ec-F 4,7 357
EcG-F 5,3 509
Tableau 1 - Temps de rétention UPLC et valeurs m/z observées en
MS(+) des produits de dépolymérisation obtenus par un procédé conforme à
l'invention de furanolyse - HCI
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
33
On déduit de cette analyse, pour chacun des procédés décrits ci-
avant, les quantités de chacun des produits de la réaction formés par gramme
de tanins. Les résultats obtenus sont montrés sur la figure 2.
On observe que les réactions réalisées avec le furane en tant que
nucléophile, conformément à la présente invention, donnent des résultats
semblables aux réactions de dépolymérisation de l'art antérieur par thiolyse
optimisée, et avec un rendement même meilleur concernant les unités
terminales.
Par ailleurs, aucune différence significative n'est observée entre
l'utilisation de HCI ou de M50H comme catalyseur acide.
EXEMPLE 2 ¨ Dépolymérisation par furanolyse de tanins de pin
Douglas
Les lipides de l'écorce de pin (5 g) sont extraits par 3 x 50 mL
d'hexane. Les tanins sont ensuite extraits par un mélange acétone/H20/TFA
70/30/0,05 v/v/v (3 x 50 mL). L'acétone est évaporée sous vide, et la phase
aqueuse est alors lyophilisée pour donner 900 mg d'extrait de tanins sous
forme d'une poudre brunâtre.
Un procédé de dépolymérisation des tanins ainsi obtenus conforme à
l'invention est mis en oeuvre comme suit.
Dans un tube, les tanins (100 mg) sont dissous dans le Me0H
(72,5 mL), puis sont ajoutés le furane (25 mL) et une solution de méthanol
chlorhydrique à 4,0 mo1.111 (2,5 mL). Le tube est fermé par un bouchon
phénolique muni d'un septum PTFE, et laissé sous agitation à 40 C durant
1 h.
Les rendements évalués sur la base d'une analyse par UPLC-MS,
comme indiqué ci-avant, sont supérieurs ou égaux à ceux obtenus par une
thiolyse analytique (soit 440 mol de dérivés furylés par gramme d'extrait).
EXEMPLE 3 ¨ Furanolyse du dimère B2
Le dimère B2 a été soumis à une étape de dépolymérisation conforme
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
34
à la présente invention, à plusieurs concentrations, selon les conditions
réactionnelles suivantes.
Pour chaque essai, la cinétique de la réaction de dépolymérisation est
suivie au cours du temps par détermination par UPLC-MS, comme décrit ci-
avant, des concentrations en dimère B2 n'ayant pas réagi et en produits de
réaction formés.
Q.L-1
mg de dimère B2 sont dissous dans Me0H (1,12 mL), puis sont
ajoutés le furane (375 L) puis du HCI fumant (12,5 L). La solution (180 L)
10 est
transférée dans des flacons de 300 .1_, qui sont scellés avec des capsules
en aluminium avec septum, et portés à 40 C. La ré tion est suivie par UPLC-
MS(+) pendant 8 h.
1 o.L-1
Il est préparé 1,5 mL de solution de dimère B2 à 1,0 g.L-1 dans un
15 mélange
de furane/Me0H 25 % v/v. L'acide chlorhydrique (12,5 L) est ajouté.
180 pl_ de solution sont transférés dans des flacons de 300 .1_, qui sont
scellés
avec des capsules en aluminium avec septum, et portés à 40 C. La réaction
est suivie par UPLC-MS(+) pendant 8 h.
0,2 g.L-1
Il est préparé 1,5 mL de solution de dimère B2 à 200 mg.L-1 dans un
mélange de furane/Me0H 25 % v/v. L'acide chlorhydrique (12,5 L) est ajouté.
180 pl_ de solution sont transférés dans des flacons de 300 .1_, qui sont
scellés
avec des capsules en aluminium avec septum, et portés à 40 C. La réaction
est suivie par UPLC-MS(+) pendant 180 min.
Pour chaque concentration initiale en dimère B2, les résultats obtenus
sont montrés sur la figure 3, pour la cinétique de disparition du dimère B2,
et
sur la figure 4, pour la cinétique d'apparition de produits de
dépolymérisation.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
On constate que la quantité maximale d'unités dépolymérisées
représente 90 % et 97 % de la quantité initiale de dimère B2, respectivement
pour des concentrations initiales de 0,2 g/L et 1,0 g/L. Ces quantités
maximales
sont obtenues en des temps très courts de réaction, respectivement de 10 min
5 et 20
min. En comparaison, des rendements plus faibles sont obtenus lorsque
la concentration initiale en dimère B2 est égale à 10 g/L, puisqu'alors la
quantité maximale d'unités dépolymérisées représente 55 % de la quantité
initiale de dimère B2. L'apparition des produits de dépolymérisation est en
outre d'autant plus rapide que la concentration initiale en dimère B2 est
faible.
10 Pour
une concentration à 10 g/L en dimère B2, la cinétique apparente
de disparition du dimère B2 est en outre plus lente que la vitesse apparente
d'apparition des unités dépolymérisées. La différence de cinétiques observées
entre l'apparition des produits de dépolymérisation et la disparition du
dimère
B2 suggère que les produits de dépolymérisation et le dimère B2 deviennent
15 des
nucléophiles compétitifs par rapport au furane à forte concentration
d'unités flavaniques dans le milieu, c'est-à-dire à fortes concentrations du
dimère lui-même et ses produits de dépolymérisation. Ces observations
semblent impliquer un schéma réactionnel faisant intervenir de nombreuses
réactions élémentaires, et démontrent l'avantage de procéder, lorsque le
20
nucléophile est le furane, et comme préconisé par la présente invention, en
conditions diluées, c'est-à-dire à de faibles concentrations initiales des
tanins
condensés dans le milieu réactionnel, inférieures à 10 g/L.
EXEMPLE 4 - Furanolyse de tanins de pépins blanc par le furane dans
l'éthanol
25 Un
procédé de dépolymérisation de tanins de pépins blanc est mis en
oeuvre conformément à la présente invention, au moyen de furane en tant que
nucléophile, dans l'éthanol en tant que solvant, selon le protocole opératoire
suivant.
Il est préparé une solution d'échantillon de tanins à 2 grl dans
30
l'éthanol (Et0H) absolu, et la solution de furanolyse (furane 50 % v/v dans
Et0H méthanesulfonique à 0,2 mo1.111). Le mélange réactionnel est préparé en
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
36
ajoutant 1,0 mL de chaque solution dans un tube Eppendorf, puis 200 L de
solution sont transférés dans des flacons de 300 L, qui sont scellés avec des
capsules en aluminium avec septum, et portés à 40 C. La réaction est suivie
par UPLC-MS(+) pendant 80 min. Le rendement maximal, obtenu au bout de
40 min de réaction, est de 510 mol de produits de dépolymérisation par
gramme d'extrait (soit 73 % de la valeur maximale estimée en thiolyse).
EXEMPLE 5 - Furanolyse de tanins de pépins blanc par le furane ¨
Influence du rapport furane / tanin
Des procédés de dépolymérisation de tanins de pépins blanc sont mis
en oeuvre conformément à la présente invention, au moyen de furane en tant
que nucléophile, avec plusieurs rapports moles de furane / masse de tanins
différents, selon le protocole opératoire suivant.
L'extrait de tanins de pépins blanc est dissous dans Me0H (12 mL). Il
est ajouté le furane (4 mL) puis l'acide chlorhydrique fumant (133 L). Cette
solution est répartie dans 8 tubes Eppendorf, à raison de 1,5 ml par tube.
Chaque tube est fermé avec du Parafilm et porté à 30 C. La cinétique
réactionnelle est suivie en UPLC-MS(+) pendant 8 h.
Les conditions opératoires et résultats obtenus sont montrés dans le
tableau 2 ci-après.
Concentration Rapport Rapport Rendement Rendement Temps
en tanins moles de moles de max. max.
(rapport d'obtention
(g/L) furane / g furane / ( rnol.g-1 à thiolyse du
de tanins moles de de tanins) analytique)
rendement
tanins éq. max.
monomères
1 3,44 1000 702 100% 1h30
- 6h
2 1,72 500 652 93% 1h30
- 8h
3 1,15 334 611 87% 1h30
- 8h
5 0,688 200 610 87% 4h30
10 0,344 100 461 66% 4 -
8h
Tableau 2 ¨ conditions opératoires et rendement d'une réaction de
furanolyse de tanins de pépins blanc par le furane conforme à l'invention
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
37
Ces essais montrent que, lorsque le nucléophile est le furane, des
rendements de réaction élevés peuvent être obtenus pour toutes les
concentrations en tanins testées. Ces rendements sont les plus élevés pour
des concentrations en tanins inférieures ou égales à 5 gr.
EXEMPLE 6 - Dépolymérisation de tanins de pépins blanc par le
sylvane ¨ Influence du rapport sylvane / tanins
Des procédés de dépolymérisation de tanins de pépins blanc sont mis
en oeuvre conformément à la présente invention, au moyen du sylvane en tant
que nucléophile, avec plusieurs rapports moles de sylvane / masse de
tanins différents, selon le protocole opératoire suivant.
L'extrait de tanins de pépins blanc est dissous dans Me0H (12 mL). Il
est ajouté le sylvane (4 mL) puis l'acide chlorhydrique fumant (133 L). Cette
solution est répartie dans 8 tubes Eppendorf, à raison de 1,5 ml par tube.
Chaque tube est fermé avec du Parafilm et porté à 30 C. La cinétique
réactionnelle est suivie en UPLC-MS(+) pendant 4 h.
Les produits de dépolymérisation sont référencés comme il suit :
unités terminales catéchine (Cat), épicatéchine (Ec), épicatéchine gallate
(EcG), et unités d'extension sylvanylées de la catéchine (Cat-S), de
l'épicatéchine (Ec-S) et de l'épicatéchine gallate (EcG-S).
La figure 5 montre le chromatogramme UPLC obtenu après 1 h de
réaction.
Pour chacun des produits formés, le temps de rétention et la valeur
m/z observée en MS(+) est indiqué dans le tableau 3 ci-après.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
38
Produit Temps de rétention (M + H+)
(min)
Cat 2,8 291
Ec 3,2 291
EcG 4,0 443
Cat-S 4,5 371
Ec-S 5,4 371
EcG-S 5,9 523
Tableau 3 - Temps de rétention UPLC et valeurs m/z observées en
MS(+) des produits de dépolymérisation obtenus par un procédé conforme à
l'invention de sylvanolyse - HCI
Les conditions opératoires et résultats obtenus, en termes de
rendement, sont indiqués dans le tableau 4 ci-après.
Concentration Rapport Rapport Rendement Rendement
Temps
en tanins moles moles de max. max.
d'obtention
(g/L) de sylvane / ( rnol.g-1 de
(rapport à du
sylvane / moles de tanins) thiolyse rendement
g de tanins éq. analytique) max.
tanins monomères
1 800 30min
-
2,77 720 103% 1h30
5 0,555 160 730 104%
30min - 2h
0,277 80 650 93% 60 min
40 45min -
0,139 662 95% 1h30
40 20 45min
-
0,069 626 89% 1h30
80 0,035 10 581 83% 90min
1 0,0035 1 329 47 % 4-6h
Tableau 4 ¨ conditions opératoires et rendement d'une réaction de
dépolymérisation de tanins de pépins blanc par le sylvane conforme à
l'invention
Ces essais montrent que, lorsque le nucléophile est le sylvane, des
10 rendements de réaction très élevés peuvent être obtenus pour toutes les
concentrations en tanins testées.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
39
EXEMPLE 7 - Dépolymérisation préparative de tanins de pépins
blanc par le furane
Un procédé de dépolymérisation conforme à l'invention est mis en
oeuvre de la façon suivante.
Dans une bouteille, l'extrait de tanins (5,0 g) est dissous dans Me0H
(200 mL), puis sont ajoutés le furane (108 mL), puis le méthanol chlorhydrique
(83 mL d'HCI fumant dans 108 mL de Me0H) sans agitation. Le mélange est
porté à 40 C, pendant 30 min, puis refroidi à 0 C Sont ensuite ajoutés
500 mL d'une solution aqueuse de Na2CO3 (106 g.111). Le mélange est extrait
avec de l'acétate d'éthyle (AcOEt) (3 x 400 mL), puis soumis à évaporation. On
obtient un solide brun-noir pâteux (3,34 g), qui est repris dans de l'éther
diéthylique (Et20) (200 mL), trituré et soniqué, puis lavé à la saumure
(300 mL). Ces opérations sont réitérées 2 fois, et les solutions obtenues sont
séchées (Na2504) puis évaporées pour obtenir un solide pâteux brunâtre
(2,40 g), qui consiste en un mélange d'unités terminales et d'unités
d'extension
furylées.
Le produit ainsi obtenu est purifié par chromatographie flash. Le
mélange (150 mg) est dissous dans Et20 (5 mL), puis il est injecté sur colonne
DIOL et élué par un gradient AcOEt/Et20 (de 0 à 50 /0). Les fractions
d'intérêt
(unités d'extension furylées) sont réunies et évaporées sous vide. On obtient
54 mg du monomère flavanique furylé suivant :
16
OH
15 21
17
6
HO 0
22 10518
1 19 OH
4 2
8
9 3 OH
24
cm 10
23 11 V 0
12 13
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
Les données RMN obtenues pour ce composé, indiquées dans le
tableau 5 ci-après, confirment la structure ci-dessus.
Attribution 130 (ppm) Type 1H (ppm) J (Hz)
1 74,4 CH 4,57 sl
2 68,4 CH 3,94 m
3 39,1 CH 4,07 m
4 98,2 Q -
5 155,9 Q - -
6 94,0 CH 5,78 d - 2,1 Hz
7 - 9 - 10 157,3-157,1 -157,0 Q
8 95,4 CH 5,92 d - 2,1 Hz
11 106,6 CH 5,80 d - 2,9 Hz
12 110,3 CH 6,34 dd - 1,7 / 2,9 Hz
13 141,4 CH 7,55 d - 1,7 Hz
14 130,1 Q
15 117,7 CH 6,51 dd - 1,7 / 8,1 Hz
16 114,9 CH 6,66 d - 8,1 Hz
17 - 18 144,7 - 144,6 Q
19 114,7 CH 6,81 d - 1,7 Hz
20 - 21 OH 8,72 - 8,82 s
22 OH 9,04 s
23 OH 9,15 s
24 OH 5,08 d - 4,7 Hz
Tableau 5 - caractérisation RMN du dérivé furylé obtenu par un
procédé de dépolymérisation selon l'invention
5 Les positions des groupements aromatiques sont par ailleurs
confirmées par RMN bidimensionnelle hétéronucléaire HMBC 13C-1H.
EXEMPLE 8 - Dépolymérisation préparative de tanins de pépins
blanc par le sylvane
Un procédé de dépolymérisation conforme à l'invention est mis en
10 oeuvre de la façon suivante.
Dans un ballon, l'extrait de tanins (8,0 g) est dissous dans Me0H
(300 mL), puis sont ajoutés le sylvane (100 mL), puis doucement du HCI
fumant (3,33 mL), sous agitation. Le mélange est porté à 30 C pendant
60 min. Il est ajouté 400 mL d'une solution aqueuse de Na2CO3 (5,3 g.111),
puis
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
41
réalisé une extraction avec AcOEt (3 x 400 mL). La solution est évaporée pour
donner un solide brunâtre pâteux (5,7 g), qui est repris avec Et20 (200 mL),
trituré et soniqué, puis lavé à la saumure (300 mL). Ces opérations sont
réitérées 2 fois, et les solutions résultantes sont combinées, et séchées avec
du Na2SO4. La solution est évaporée pour obtenir un solide bulleux beige
(2,40 g), consistant en un mélange d'unités terminales et d'unités d'extension
sylvanylées.
Le produit ainsi obtenu est purifié par chromatographie flash. Le
mélange (300 mg) est dissous dans Et20 (5 mL), puis il est injecté sur colonne
DIOL et élué par un gradient AcOEt/Et20 (de 0 à 50 /0). Les fractions
d'intérêt
(unités d'extension sylvanylées) sont réunies et évaporées sous vide. On
obtient 99 mg du monomère flavanique sylvanylé suivant :
16
OH
17 21
6
HO 0
22 8104 2 5
1 19 OH
9 3 OH
24
OH 10
23 117 0
12 13
14'
Les données RMN obtenues pour ce composé, indiquées dans le
15 tableau 6 ci-après, confirment la structure ci-dessus.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
42
Attribution 130 (ppm) Type 1H (ppm) J (Hz)
1 74,3 CH 4,61 sl
2 68,4 CH 3,92 m
3 39,1 CH 4,03 m
4 98,2 Q -
6 94,0 CH 5,77 d - 2,5 Hz
5- 7 - 9 - 10 157,3 -157,0 - 156,0 -155,3 Q
8 95,3 CH 5,92 d - 2,3 Hz
11 106,3 CH 5,92 d - 2,5 Hz
12 107,3 CH 5,62 d - 2,5 Hz
13 149,8 Q
14 130,1 Q - -
15 117,8 CH 6,52 dd -
1,9 / 7,9 Hz
16 114,9 CH 6,67 d - 8,1 Hz
17 - 18 144,7 - 144,6 Q
19 114,7 CH 6,81 d - 2,0 Hz
20 - 21 OH 8,72 - 8,82 s
22 - OH 9,03 s
23 - OH 9,13 s
24 - OH 5,05 d - 5,0 Hz
14' 15,2 CH 2,24 sl
Tableau 6 - caractérisation RMN du dérivé sylvanylé obtenu par un
procédé de dépolymérisation selon l'invention
Les positions des groupements aromatiques sont par ailleurs
confirmées par RMN bidimensionnelle hétéronucléaire HMBC 13C-1H.
EXEMPLE 9 - Stabilité en conditions basiques de dérivés obtenus par
thiolyse ou par sylvanolyse
Une solution tampon à pH 9 est préparée en ajoutant 50 mL d'une
solution à 0,2 mol/L de KCI et 0,2 mol/L de H3B03 à 21,4 mL d'une solution de
NaOH à 0,2 mol/L.
Thiolyse
Il est préparé une solution aqueuse à 2 g/L d'un produit brut issu de la
dépolymérisation d'un extrait de tanins de pépins blanc par thiolyse selon le
protocole de Roumeas et al., 2013. Cette solution contient les unités
terminales
catéchine (Cat) et épicatéchine (Ec), ainsi que les unités d'extension
sulfurées
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
43
dérivées de la catéchine (Cat-M) et de l'épicatéchine (Ec-M). Le
chromatogramme UPLC à 280 nm de cette solution est montré sur la
figure 6(a).
5001.1L de cette solution sont transférés dans un flacon dans lequel
sont ajoutées 5001.1L de la solution tampon à pH 9. Le flacon est purgé à
l'argon, scellé et laissé à l'abri de la lumière pendant 19 h. Le
chromatogramme
UPLC à 280 nm de la solution résultante est montré sur la figure 6(b). On y
observe la disparition des pics correspondant aux unités d'extension
sulfurées.
Une analyse par UPLC-MS(+) montre que ces unités d'extension sulfurées ont
été dégradées à plus de 95% en 19 h.
Sylvanolyse
Dans une première expérience, il est préparé une solution aqueuse à
2 g/L d'un produit brut issu de la dépolymérisation d'un extrait de tanins de
pépins blanc par le sylvane selon le protocole décrit dans l'Exemple 8. Cette
solution contient les unités terminales catéchine (Cat), épicatéchine (Ec) et
épicatéchine gallate (EcG), ainsi que les unités d'extension sylvanylées (2-
méthyl-furylées) dérivées de la catéchine (Cat-S), de l'épicatéchine (Ec-S) et
de l'épicatéchine gallate (EcG-S). Le chromatogramme UPLC à 280 nm de
cette solution est montré sur la figure 7(a).
5001.1L de cette solution sont transférés dans un flacon dans lequel
sont ajoutées 500 1.1L de la solution tampon. Le flacon est purgé à l'argon,
scellé et laissé à l'abri de la lumière pendant 19 h. Le chromatogramme UPLC
à 280 nm de la solution résultante est montré sur la figure 7(b). On y observe
que les pics correspondant aux unités d'extension sylvanylées sont toujours
présents. Une analyse par UPLC-MS(+) montre qu'il ne s'est produit aucune
dégradation du produit après 19 h.
Dans une seconde expérience, le même produit issu de
dépolymérisation de tanins de pépins blanc par sylvanolyse est dissous à une
concentration de 1 g/L dans une solution d'acétonitrile contenant de la
triéthylamine à deux concentrations, 0,02 ou 1,8 mM (à ces concentrations, la
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
44
triéthylamine en phase aqueuse formerait des solutions à pH 10 et à pH 11,
respectivement). Les 2 solutions sont laissées 4 jours sous argon à l'abri de
la
lumière dans des flacons scellés. Leur analyse par UPLC-MS(+) ne montre
aucune dégradation après 4 jours.
EXEMPLE 10 ¨ Détermination des rapports molaires nucléophile /
tanins condensés dépolymérisables pour le furane et le sylvane
Un test réalisé à partir d'un tanin modèle, le dimère B2, et soit le
sylvane soit le furane comme nucléophile, a été développé pour déterminer les
rapports molaires minimaux nucléophile / tanins
condensés
dépolymérisables à mettre en oeuvre dans les réactions de dépolymérisation
de tanins condensés. Pour obtenir un résultat discriminant, le test est basé
sur
la mesure du taux de conversion en unités de dérivés d'intérêt (dérivé furylé
ou
dérivé sylvanylé) sur un temps court de réaction, soit 10 min. Par conséquent,
le taux mesuré dans ce test sur des vitesses initiales de réaction, ne
correspond pas au taux de conversion obtenu en fin de réaction du fait de la
cinétique réactionnelle. Toutefois, la comparaison des résultats du test sur
le
dimère B2 avec ceux des expériences qui ont été réalisées en conditions
réelles sur l'extrait industriel de tanins de pépins blanc pour une durée
maximale de 8 h en conservant les mêmes conditions de température, d'acidité
et de rapport molaire nucléophile / tanins exprimé en équivalent monomères
en dehors de ce test et dont les résultats sont présentés dans les tableaux 2
et
4 de ce document, permet d'établir une corrélation entre le taux de conversion
du test et les rendements de production des composés d'intérêts obtenus en
conditions réelles. Ainsi, un seuil se situant aux environs de 2,5 % pour le
taux
de conversion dans le cadre du test permet d'obtenir, dans les conditions
réelles de production, des rendements en composés d'intérêt de l'ordre de
40 /0. La courbe qui est déterminée par le test présenté ci-après permet
alors
de déterminer les valeurs minimales des rapports molaires nucléophile /
dimère B2 en équivalent monomères qui correspondent aux rapports
molaires minimaux nucléophile / tanins dépolymérisables en équivalent
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
monomères qui devront être utilisés dans les réactions de dépolymérisation
en conditions réelles.
Ci-après est décrite la procédure utilisée pour déterminer le rapport
molaire nucléophile / tanins condensés dépolymérisables à partir d'un
5 extrait
de tanins donné, en prenant comme nucléophile soit le furane, soit le
sylvane.
Pour un extrait de tanins donnés, la quantité molaire de tanins
condensés dépolymérisables est déterminée par réaction de thiolyse
analytique, réalisée notamment comme décrit dans la publication de Roumeas
10 et al.,
2013, et quantification de la quantité de tanins ainsi dépolymérisés, par
UPLC-MS, comme indiqué ci-avant.
La quantité molaire de nucléophile de formule générale (III)
correspondante est déterminée de la manière suivante, pour le furane et le
sylvane.
15 Une
solution mère de dimère B2 est préparée à 100, 200 ou
400 mg.111 dans du Me0H (concentration de référence : 400 mg.111, soit
0,7 mM). Les solutions de dépolymérisation contiennent 200 mM d'HCI et
différentes concentrations en nucléophile comprises entre 0,7 et 70 mM pour le
sylvane, et 140 et 7000 mM pour le furane.
20 Pour
chaque expérience, un mélange de 500 ptt de solution mère de
dimère B2 et 500 ptt de solution de dépolymérisation est réalisé dans un tube
bouché et immédiatement porté à 30 C pendant 10 mh. Les échantillons sont
alors directement analysés par UPLC, selon le protocole décrit ci-avant, sans
traitement ni dilution préalable. La quantification des unités d'extension
Uext
25 (sous
forme de dérivé) et des unités terminales Uterm libérées au cours de la
réaction permet de calculer, pour chaque essai, le rapport molaire
Uext/(Uext+Uterm)=
Les résultats obtenus, pour chacun du furane et du sylvane, en
fonction des différents rapports molaires nucléophile / dimère B2 en
30 équivalents monomères , sont indiqués dans le tableau 7 ci-après.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
46
Rapport molaire Sylvane Furane
nucléophile / dimère Rapport molaire Rapport molaire
B2 Uext/(Uext+ Uterm) Uext/(Uext+ Uterm)
0,5 0,033* -
2,5 0,089* -
0,5 0,014** -
0,5 0,020* -
0,167* -
5 0,080*** -
5 0,140* -
0,170* -
50 0,420*** -
50 0,320* -
100 - 0,035*
250 - 0,070*
500 0,470** 0,135*
500 0,500* -
500 0,500*** -
3750 - 0,430***
5000 - 0,420*
Tableau 7 - Rapports molaires Uext/(Uext+ Uterm) obtenus par
dépolymérisation de dimère B2 par le furane et le sylvane conformément à la
présente invention
avec : * expériences réalisées en présence de 0,35 mM de dimère B2
5 ** expériences réalisées en présence de 0,087 mM de dimère B2
*** expériences réalisées en présence de 0,17 mM de dimère B2
A partir de ces résultats, il est tracé les courbes représentant le rapport
molaire Uext/(Uext+Uterm) en fonction du rapport molaire nucléophile /
dimère
B2 . Les courbes obtenues, pour le furane et le sylvane, sont montrées sur la
10 figure 8.
Les résultats obtenus mettent en évidence les réactions de
compétition qui ont lieu entre les nucléophiles et les composés flavonoïdes
présents dans le milieu. Ils permettent donc une comparaison de la puissance
des nucléophiles entre eux. Ainsi, la figure montre clairement que le sylvane
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
47
est un meilleur nucléophile que le furane, dans la mesure où des taux
similaires de conversion en unités d'extension (rapport molaire Uext/(Uext+
Lite")
sont atteints pour des rapports molaires Nucléophile / dimère B2 très
inférieurs dans le cas du sylvane.
Par exemple, en s'appuyant sur les courbes de lissage obtenues à
partir des points expérimentaux, montrées sur la figure 8, le rapport molaire
Nucléophile / dimère B2 nécessaire pour atteindre, dans les conditions du
test, un taux de conversion de 2,5 % en unités d'extension, par rapport au
total
des unités d'extension et des unités terminales, peut être établi à 0,79 pour
le
sylvane, et à 63 pour le furane. Le rapport molaire Nucléophile / dimère B2
nécessaire pour atteindre, dans les conditions du test, un taux de conversion
de 5 % en unités d'extension, par rapport au total des unités d'extension et
des
unités terminales, peut être établi à 1,67 pour le sylvane, et à 133 pour le
furane.
La même expérience peut être réalisée, dans des conditions
similaires, pour tout autre nucléophile de formule générale (III) selon
l'invention.
EXEMPLE 11 ¨ Dépolymérisation des tanins directement à partir
d'écorce de pin Douglas
Exemple comparatif - Thiolyse
Une réaction de thiolyse, selon le protocole décrit dans la publication
de Roumeas et al., 2013, est réalisée de la manière suivante.
Dans un ballon de 100 mL, l'écorce de pin Douglas (800 mg) est mise
en suspension dans 40 mL de solution de mercaptolyse (2,0 mL de 2-
mercaptoéthanol et 333 L d'HCI fumant pour 40 mL de Me0H qsp), et laissée
sous agitation 2 h à 40 C. Les résultats obtenus rar UPLC-MS montrent une
teneur maximale en unité d'extension de 129 mol.g-1 d'écorce initiale.
Procédé de dépolymérisation par le sylvane conforme à l'invention
Dans un ballon, l'écorce de pin Douglas broyée à 6 mm (10,0 g) est
mise en suspension dans Me0H (75 mL), puis sont ajoutés le sylvane (25 mL),
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
48
puis du HCI fumant (833 L), sous agitation. Le mélange est porté à 30 C, et
la réaction est suivie par UPLC-MS. Au bout de 2 h 30, le rendement en
dérivés sylvanylés atteint un maximum de 119 mol.g-1 d'écorce, soit 92 % de
la valeur obtenue par la réaction de thiolyse comparative.
On obtient ainsi les dérivés sylvanylés visés avec un rendement élevé,
directement à partir de l'écorce, sans extraction préalable des tanins.
Extraction préparative
Le mélange réactionnel obtenu par la réaction de sylvanolyse est filtré
sur Büchner pour éliminer les écorces, et 100 mL d'une solution aqueuse de
NaHCO3 (8,4 g.111) sont ajoutés. La solution obtenue est évaporée sous vide
pour éliminer le méthanol et le sylvane, et la suspension aqueuse est extraite
avec AcOEt (3 x 100 mL). La phase organique est séchée sur Na2SO4 et
évaporée sous vide pour donner solide orangeâtre huileux (1,25 g). Ce produit
est trituré dans l'éther de pétrole (3 x 50 mL) afin d'éliminer les lipides et
les
terpènes, puis repris dans Et20 (140 mL). La suspension est lavée à la
saumure (2 x 50 mL), puis séchée sur Na2SO4 et évaporée sous vide pour
donner un solide orangeâtre (920 mg) comprenant 291 mg de dérivés
sylvanylés.
CA 02957012 2017-02-01
WO 2016/020615 PCT/FR2015/052144
49
REFERENCES BIBLIOGRAPHIQUES
Adams et al.,1921. Furfural. Org. Synth. 1, 49
Burnett et al., 1948. Production of 2-Methylfuran by Vapor-Phase
Hydrogenation of Furfural. Ind. Eng. Chem. 40, 502-505
Chen et al., 2009. One-pot depolymerizative extraction of proanthocyanidins
from mangosteen pericarps. Food Chem. 114, 874-880
Li et al., 2012. Aqueous electrocatalytic hydrogenation of furfural using a
sacrificial anode. Electrochimica Acta 64, 87-93
Liengprayoon et al., 2011. Glycolipid composition of Hevea brasiliensis latex.
Phytochemistry 72, 1902-1913
Maréchal, 2001. Analyse des principaux facteurs impliqués dans le
fractionnement combiné de pailles et de sons de blé en extrudeur bi-vis :
obtention d'agro-matériaux. Thèse soutenue le 10 septembre 2001. Laboratoire
de Chimie Agro-Industrielle, UMR INRA / INP-Ensiacet. Toulouse
Prieur et al.,1994. Oligomeric and polymeric procyanidins from grape seeds.
Phytochemistry 36,781-784.
Rigaud et al., 1993. Normal-phase high-performance liquid chromatographic
separation of procyanidins from cacao beans and grape seeds. J. Chromatogr.
A 654, 255-260.
Roumeas et al., 2013. Depolymerisation of condensed tannins in ethanol as a
gateway to biosourced phenolic synthons. Green Chem. 15, 3268-3275
Selga et al., 2004. Efficient One Pot Extraction and Depolymerization of Grape
(Vitis vinifera) Pomace Procyanidins for the Preparation of Antioxidant Thio-
Conjugates. J. Agric. Food Chem. 52, 467-473