Note: Descriptions are shown in the official language in which they were submitted.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
1
ANALOGUES DE L'HYDROXYCHLOROQUINE (HCQ) DEPOURVUS DE TOXICITE
RETINIENNE
DOMAINE DE L'INVENTION
La présente invention concerne de nouveaux analogues de rhydroxychloroquine
(HCQ), leur utilisation dans le traitement des maladies inflammatoires et auto-
immunes, en
particulier dans le traitement du lupus érythémateux, et du cancer, ainsi que
le procédé de
préparation de ces composés.
Linvention concerne également une méthode de criblage de 1 âctivité de
composés
utiles pour le traitement du lupus érythémateux mais ne présentant pas de
toxicité rétinienne.
ETAT DE LA TECHNIQUE
Le lupus aussi appelé lupus érythémateux est une pathologie auto-immune
chronique
dans laquelle un dérèglement du système immunitaire est à 1 -origine de
lésions tissulaires.
Cette atteinte regroupe plusieurs formes dont le lupus érythémateux subaigu et
le lupus
érythémateux disséminé (LED). Elle peut toucher différents organes comme la
peau, les
articulations, les reins, le coeur, les poumons et parfois même le cerveau.
Les conséquences
à long terme de la pathologie sont graves et peuvent conduire à une
insuffisance rénale (30%
des cas) nécessitant une dialyse voire une transplantation. La maladie
progresse par
poussées, les crises étant entrecoupées de périodes de rémission plus ou moins
longues.
Selon les organes touchés par la maladie, le lupus peut s -exprimer de façon
très
différente d -un patient à l'autre. Des manifestations sévères peuvent être
observées chez
50% des patients comme une inflammation des reins (néphrite), des troubles
neurologiques
(avec psychoses, paralysie, amnésie, dépression, maux de tête etcû ), un
manque de
globules rouges (anémie) voire de plaquettes (thrombocytopénie). Des formes
extrêmement
sévères de lupus peuvent mettre en jeu le pronostic vital.
Les causes du lupus sont encore mal connues mais il est établi que 1-organisme
synthétise des auto-anticorps pathogènes qui vont attaquer certains tissus
sains. Les
antécédents familiaux démontrent que les facteurs génétiques sont réels mais
divers facteurs
environnementaux contribuent au déclenchement de la pathologie (exposition au
soleil,
tabac, infection par le virus Epstein Barr notamment). Un Lupus peut également
survenir
après une prise de médicaments en particulier les interférons alpha utilisées
pour le
traitement de certains cancers et des hépatites virales chroniques. Ce dernier
type d -affection
est < réversible car la pathologie disparaît dès lors que le traitement est
suspendu.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
2
Le diagnostic du Lupus est délicat car les symptômes se confondent avec ceux d-
autres
pathologies. Les atteintes articulaires le font parfois assimiler dans un
premier temps à une
Polyarthrite Rhumatoïde.
Les bases fondamentales de la pathologie n'étant pas établies, les solutions
thérapeutiques disponibles actuellement visent surtout à gérer au mieux les
symptômes
détectés sans en traiter les causes, prévenir les lésions aux organes et
minimiser les risques
de poussées pendant les périodes de relative stabilité.
Les thérapies actuelles reposent sur la prescription de médicaments
antipaludéens
(HCQ) et d ânti-inflammatoires non stéroïdiens (AINS) pour les formes surtout
cutanées et
articulaires du lupus, 1-utilisation de corticoïdes, souvent à fortes doses,
puis d -agents
cytotoxiques pour les formes sévères (persistance des symptômes articulaires
ou traitement
des formes viscérales) et la prescription d immunosuppresseurs pour les
patients insensibles
aux traitements antérieurs. Ces divers traitements présentent cependant
linconvénient de
conduire à des effets secondaires plus ou moins graves.
La prise en charge du patient combine généralement, au cours du temps,
différents
types de médicaments avec la plupart du temps un traitement de fond basé surl-
utilisation de
11-ICQ. Ces dernières décades, le seul nouveau médicament apparu sur le marché
est le
Benlysta0, un anticorps monoclonal administré sous forme de perfusion
intraveineuse qui
empêche la fixation de la protéine endogène BLyS, inhibant ainsi la survie de
cellules B et
leur différentiation.
Le Benlysta0 affiche des limites de performance évidentes et est toujours
utilisé en
association avec le traitement standard.
Conçus à l'origine pour traiter le paludisme (la malaria), les 4-
aminoquinolines se sont
avérées efficaces dans le traitement de certains des symptômes du LED,
notamment la
fatigue, les éruptions cutanées et les douleurs articulaires. La molécule de
référence est
rhydroxychloroquine (HCQ, Plaqueni10 et génériques) généralement employé à la
dose de
400 mg/j. Bien que le mode d âction soit encore mal connu, l'HCQ constitue le
traitement de
référence du lupus cutané chronique.
Ll-ICQ présente toutefois I inconvénient de conduire à des effets
indésirables. L -atteinte
la plus fréquente est une atteinte rétinienne liée à la prise prolongée de
fortes doses de ce
médicament. La molécule s'accumule dans la partie arrière (rétine) ou avant
(cornée) der il,
provoquant des troubles de l'accommodation pour plus de 10% des patients. Les
dépôts
rétiniens peuvent conduire à des rétinopathies potentiellement irréversibles
et capables
crévoluer malgré I ârrêt du traitement. Il n -existe actuellement aucun
traitement à cette
CA 02988342 2017-12-05
WO 2016/193503
PCT/EP2016/062816
3
rétinopathie toxique. Ces complications oculaires potentielles imposent une
surveillance
ophtalmique régulière, au moins annuelle.
Il existe donc un besoin pour de nouvelles petites molécules plus efficaces
que 11-ICQ
dans le traitement du LED dépourvues de toxicité rétinienne.
Malheureusement le mode d'action de 11-ICQ reste encore mal connu à ce jour,
notamment les cibles thérapeutiques et délétères, responsable de la
rétinopathie.
Les inventeurs de la présente invention ont identifié une cible thérapeutique
de 11-ICQ,
la myéloperoxidase (MPO) et une cible responsable de la rétinopathie qui est
la B-cristalline
( B-C). La mise en évidence de ces deux cibles a permis aux inventeurs de
mettre au point
de nouveaux analogues de 11-ICQ possédant une activité inhibitrice de la MPO
(cible
thérapeutique) supérieure à 11-ICQ et une activité anti-inflammatoire
supérieure à 11-ICQ mais
n'ayant pas d -affinité pour r- B-cristalline ( B-C). Ces analogues sont
notamment caractérisés
par la présence d -un substituant en position 3 du cycle quinoline de 11-ICQ.
Ainsi, les composés de la présente invention présentent, grâce à une affinité
réduite
pour r B-cristalline, une toxicité plus faible que 11-ICQ et par conséquent n
induisent pas de
lésion rétinienne.
Figures:
La figure 1 représente le taux de survie des souris ayant été traitées par HCQ
(10mg/kg) et le composé CB 137 (10 mg/kg).
La figure 2 représente le taux de souris traitées par HCQ (10mg/kg) ou CB137
(10nng/kg) présentant des dermatites.
La figure 3 représente deux photographies représentatives dune coupe
transversale de
rétine.
La figure 4 représente le pourcentage de souris traitées présentant des
lésions
rétiniennes en fonction du traitement.
La figure 5 représente le nombre de neutrophiles présents dans les poumons des
souris
traitées par HCQ (10 mg/kg) ou CB 137 (10, 30 et 100nng/kg).
La figure 6 représente des coupes de poumons colorés àl-éosine et
hématoxyline.
Composés :
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
4
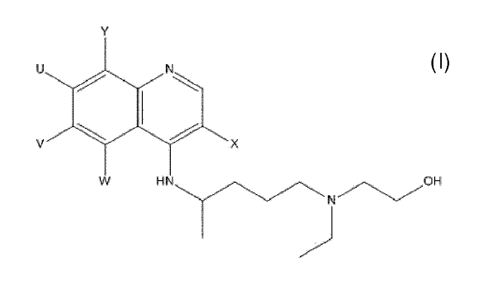
La présente invention concerne donc de nouveaux analogues de I FICQ de formule
(I),
leurs sels, solvates ou hydrates pharmaceutiquement acceptables, sous la forme
d-un
énantiomère ou d-un mélange d -énantiomères :
( I)
HN
H
dans laquelle U représente :
F, Cl, Br, CN, ou N3;
et V, W, X et Y représentent indépendamment:
H à condition que V, W, X et Y ne représentent pas tous simultanément H;
F, Cl, Br, CN ou N3 ;
Si(Ra)(Rb)(1=r), où
Ra, Rb et Fr, identiques ou différents, représentent un groupement alkyle en
C1 à C6,
de préférence en C1 à C3, ou aryle ;
R1, où
R1 représente un groupement alkyle en C1 à C6, de préférence en C1 à C¾, de
manière
préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de préférence en
C1 à
C¾, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ; cycloalkyle, de préférence
cyclopropyle ; aryle, de préférence phényle ; aralkyle, de préférence benzyle
; ou
hétéroaryle;
S(0)R, où
n = 0, 1 ou 2,
R2 représente un groupement alkyle en C1 à C6, de préférence en C1 à C4;
aryle, de
préférence phényle ou tolyle ; aralkyle, de préférence benzyle ; ou
hétéroaryle,
NR3R4, où
R3 représente H, un groupement alkyle en C1 à C6, de préférence en C1 à C¾
cycloalkyle, de préférence cyclopropyle ; aryle, de préférence phényle ;
aralkyle, de
préférence benzyle ; ou hétéroaryle,
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
R4 représente H; un groupement alkyle en C1 à C6, de préférence en C1 à C4;
cycloalkyle, de préférence cyclopropyle ; aryle, de préférence phényle ;
aralkyle, de
préférence benzyle ; hétéroaryle ; C(0)-alkyle en C1 à C6, de préférence en C1
à C4 ;
C(0)-cycloalkyle, de préférence cyclopropyle; C(0)-aryle, de préférence
phényle ;
5 C(0)-aralkyle, de préférence benzyle ; C(0)-hétéroaryle; S02-alkyle en
C1 à C6, de
préférence en C1 à C4; S02-cycloalkyle, de préférence cyclopropyle ; S02-
aryle, de
préférence phényle ; S02-hétéroaryle ; C(0)N(R5)2 ; où R5 est tel que défini
pour R3;
C(0)0R6, où R6 représente un groupement alkyle en C1 à C6, de préférence en C1
à
C4; ou aralkyle, de préférence benzyle ; ou R8 et R4 peuvent être liés
ensemble pour
former un cycle non aromatique de 5 à 8 atomes ou un imide cyclique de 5 à 8
chaînons ;
i SR5, où
R5 représente un groupement alkyle en C1 à C6, de préférence en C1 à C4, de
manière
préférée méthyle ; cycloalkyle, de préférence cyclopropyle ; aryle, de
préférence
phényle ; aralkyle, de préférence benzyle ; ou hétéroaryle,
i C(0)R6, où
R6 représente un groupement alkyle en C1 à C6, de préférence en C1 à C4, de
manière
préférée méthyle ; alkyle perfluoré, de préférence trifluorométhyle ;
cycloalkyle, de
préférence cyclopropyle ; aryle, de préférence phényle ; aralkyle, de
préférence
benzyle ; hétéroaryle ; 0-alkyle en C1 à C6, de préférence en C1 à C4; 0-
cycloalkyle,
de préférence cyclopropyle ; 0-aryle, de préférence phényle ; 0-aralkyle, de
préférence benzyle ; 0-hétéroaryle ; ou N(R7)(R8) ;
à condition que lorsque X représente C(0)R6, alors R6 représente un groupement
alkyle en C1 à C6, de préférence en C1 à C4, de manière préférée méthyle ;
alkyle
perfluoré, de préférence trifluoromethyle ; cycloalkyle, de préférence
cyclopropyle ;
aryle, de préférence phényle ; aralkyle, de préférence benzyle ; hétéroaryle;
ou
N(R7)(R8) ;
R7 et R8, identiques ou différents, représentent H ; un groupement alkyle en
C1
à C6, de préférence en C1 à C4, de manière préférée méthyle ; cycloalkyle, de
préférence cyclopropyle; aryle, de préférence phényle ; aralkyle, de
préférence benzyle ; ou hétéroaryle ;
i OR7, où
R7 représente : H ; un groupement alkyle en C1 à C6, de préférence en C1 à C4,
de
manière préférée méthyle ; cycloalkyle, de préférence cyclopropyle ; aryle, de
préférence phényle ; aralkyle, de préférence benzyle ; hétéroaryle ; C(0)-
alkyle en C1
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
6
à C6, de préférence en C1 à C4; C(0)-cycloalkyle, de préférence cyclopropyle
C(0)-aryle, de préférence phényle ; C(0)-aralkyle, de préférence benzyle
C(0)-hétéroaryle; C(0)0-alkyle en C1 à C6, de préférence en C1 à C4
C(0)0-cycloalkyle, de préférence cyclopropyle ; C(0)0-aryle, de préférence
phényle
C(0)0-aralkyle, de préférence benzyle ; C(0)0-hétéroaryle; (CH2),CCR8
(CH2)pCH=CR8 ;
où m = 1 à 6 et p = 1 à 6 ; ou
i CH2OR7 ; CH2SR5 ; CH2NR3R4 ; ou CH2N3.
Avantageusement U représente Cl et V, W, X et Y représentent indépendamment :
i H à condition que V, W, X et Y ne représentent pas tous simultanément H;
i F, Cl, Br, CN ou N3 ;
i Si(Ra)(Rb)(1=r), où
Ra, Rb et Fr, identiques ou différents, représentent un groupement alkyle en
C1 à C6,
de préférence en C1 à C3, ou aryle ;
i R1, où
R1 représente un groupement alkyle en C1 à C6, de préférence en C1 à C4, de
manière
préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de préférence en
C1 à
C4, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ; cycloalkyle, de préférence
cyclopropyle; aryle, de préférence phényle ; aralkyle, de préférence benzyle ;
ou
hétéroaryle ;
i
S(0)R, où
n = 0, 1 ou 2,
R2 représente un groupement alkyle en C1 à C6, de préférence en C1 à C4;
aryle, de
préférence phényle ou tolyle ; aralkyle, de préférence benzyle ; ou
hétéroaryle,
i NR3R4, où
R3 représente H, un groupement alkyle en C1 à C6, de préférence en C1 à C4;
cycloalkyle, de préférence cyclopropyle ; aryle, de préférence phényle ;
aralkyle, de
préférence benzyle ; ou hétéroaryle,
R4 représente H; un groupement alkyle en C1 à C6, de préférence en C1 à C4;
cycloalkyle, de préférence cyclopropyle ; aryle, de préférence phényle ;
aralkyle, de
préférence benzyle ; hétéroaryle ; C(0)-alkyle en C1 à C6, de préférence en C1
à C4 ;
C(0)-cycloalkyle, de préférence cyclopropyle; C(0)-aryle, de préférence
phényle ;
C(0)-aralkyle, de préférence benzyle ; C(0)-hétéroaryle; S02-alkyle en C1 à
C6, de
préférence en C1 à C4; S02-cycloalkyle, de préférence cyclopropyle; S02-aryle,
de
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
7
préférence phényle ; S02-hétéroaryle ; C(0)N(R6)2; où Fe est tel que défini
pour R3;
C(0)0R6, où R6 représente un groupement alkyle en C1 à C6, de préférence en C1
à
C4; ou aralkyle, de préférence benzyle ; ou R3 et R4 peuvent être liés
ensemble pour
former un cycle non aromatique de 5 à 8 atomes ou un imide cyclique de 5 à 8
chaînons ;
i SR5, où
R5 représente un groupement alkyle en C1 à C6, de préférence en Clà C4, de
manière
préférée méthyle ; cycloalkyle, de préférence cyclopropyle ; aryle, de
préférence
phényle ; aralkyle, de préférence benzyle ; ou hétéroaryle,
i C(0)R6, où
R6 représente un groupement alkyle en C1 à C6, de préférence en Clà C4, de
manière
préférée méthyle ; alkyle perfluoré, de préférence trifluorométhyle ;
cycloalkyle, de
préférence cyclopropyle ; aryle, de préférence phényle ; aralkyle, de
préférence
benzyle ; hétéroaryle ; 0-alkyle en C1 à C6, de préférence en C1 à C4; 0-
cycloalkyle,
de préférence cyclopropyle; 0-aryle, de préférence phényle ; 0-aralkyle, de
préférence benzyle ; 0-hétéroaryle ; ou N(R7)(F8) ;
à condition que lorsque X représente C(0)R6, alors R6 représente un groupement
alkyle en C1 à C6, de préférence en C1 à C4, de manière préférée méthyle ;
alkyle
perfluoré, de préférence trifluorométhyle ; cycloalkyle, de préférence
cyclopropyle ;
aryle, de préférence phényle ; aralkyle, de préférence benzyle ; hétéroaryle;
ou
N(R7)(R8) ;
R7 et Fr, identiques ou différents, représentent H ; un groupement alkyle en
C1
à C6, de préférence en C1 à C4, de manière préférée méthyle ; cycloalkyle, de
préférence cyclopropyle ; aryle, de préférence phényle ; aralkyle, de
préférence benzyle ; ou hétéroaryle;
i OR7, où
R7 représente : H ; un groupement alkyle en C1 à C6, de préférence en C1 à C4,
de
manière préférée méthyle ; cycloalkyle, de préférence cyclopropyle ; aryle, de
préférence phényle ; aralkyle, de préférence benzyle ; hétéroaryle ; C(0)-
alkyle en C1
à C6, de préférence en C1 à C4; C(0)-cycloalkyle, de préférence cyclopropyle =
C(0)-aryle, de préférence phényle ; C(0)-aralkyle, de préférence benzyle
C(0)-hétéroaryle; C(0)0-alkyle en C1 à C6, de préférence en C1 à C4
C(0)0-cycloalkyle, de préférence cyclopropyle ; C(0)0-aryle, de préférence
phényle
C(0)0-aralkyle, de préférence benzyle ; C(0)0-hétéroaryle; (CH2),,CCR8
(CH2)pCH=CR8;
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
8
où m = 1 à 6 et p = 1 à 6 ; ou
i CH2OR7 ; CH2SR5 ; CH2NR3R4 ; ou CH2N3.
Avantageusement U représente Cl,
V, W et Y représentent indépendamment H, F, Cl, Br, CN ou N3 avantageusement H
ou Cl,
et
X représente :
i H à condition que V, W, X et Y ne représentent pas tous simultanément H;
i F, Cl, Br, CN ou N3 ;
i Si(Ra)(Rb)(1=r), où
Ra, Rb et Fr, identiques ou différents, représentent un groupement alkyle en
C1 à C6,
de préférence en C1 à C3, ou aryle ;
i R1, où
R1 représente un groupement alkyle en C1 à C6, de préférence en C1 à C¾, de
manière
préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de préférence en
C1 à
C¾, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ; cycloalkyle, de préférence
cyclopropyle; aryle, de préférence phényle ; aralkyle, de préférence benzyle ;
ou
hétéroaryle ;
i
S(0)R, où
n = 0, 1 ou 2,
R2 représente un groupement alkyle en C1 à C6, de préférence en C1 à C4;
aryle, de
préférence phényle ou tolyle ; aralkyle, de préférence benzyle ; ou
hétéroaryle,
i NR3R4, où
R3 représente H, un groupement alkyle en C1 à C6, de préférence en C1 à C4;
cycloalkyle, de préférence cyclopropyle ; aryle, de préférence phényle ;
aralkyle, de
préférence benzyle ; ou hétéroaryle,
R4 représente H; un groupement alkyle en C1 à C6, de préférence en C1 à C4;
cycloalkyle, de préférence cyclopropyle ; aryle, de préférence phényle ;
aralkyle, de
préférence benzyle ; hétéroaryle ; C(0)-alkyle en C1 à C6, de préférence en C1
à C4 ;
C(0)-cycloalkyle, de préférence cyclopropyle; C(0)-aryle, de préférence
phényle ;
C(0)-aralkyle, de préférence benzyle ; C(0)-hétéroaryle; S02-alkyle en C1 à
C6, de
préférence en C1 à C4; S02-cycloalkyle, de préférence cyclopropyle ; S02-
aryle, de
préférence phényle ; S02-hétéroaryle ; C(0)N(R5)2 ; où Fe est tel que défini
pour R3;
C(0)0R6, où R6 représente un groupement alkyle en C1 à C6, de préférence en C1
à
C4; ou aralkyle, de préférence benzyle ; ou R3 et R4 peuvent être liés
ensemble pour
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
9
former un cycle non aromatique de 5 à 8 atomes ou un imide cyclique de 5 à 8
chaînons ;
i SR5, où
R5 représente un groupement alkyle en C1 à C6, de préférence en C1 à C4, de
manière
préférée méthyle ; cycloalkyle, de préférence cyclopropyle; aryle, de
préférence
phényle ; aralkyle, de préférence benzyle ; ou hétéroaryle,
i C(0)R6, où
R6 représente un groupement alkyle en C1 à C6, de préférence en C1 à C4, de
manière
préférée méthyle ; alkyle perfluoré, de préférence trifluorométhyle ;
cycloalkyle, de
préférence cyclopropyle; aryle, de préférence phényle ; aralkyle, de
préférence
benzyle ; hétéroaryle ; 0-alkyle en C1 à C6, de préférence en C1 à C4; 0-
cycloalkyle,
de préférence cyclopropyle ; 0-aryle, de préférence phényle ; 0-aralkyle, de
préférence benzyle ; 0-hétéroaryle ; ou N(R7)(F8) ;
à condition que lorsque X représente C(0)R6, alors R6 représente un groupement
alkyle en C1 à C6, de préférence en C1 à C4, de manière préférée méthyle ;
alkyle
perfluoré, de préférence trifluorométhyle ; cycloalkyle, de préférence
cyclopropyle ;
aryle, de préférence phényle ; aralkyle, de préférence benzyle ; hétéroaryle;
ou
N(R7)(R8) ;
R7 et Fr, identiques ou différents, représentent H ; un groupement alkyle en
C1
à C6, de préférence en C1 à C4, de manière préférée méthyle ; cycloalkyle, de
préférence cyclopropyle ; aryle, de préférence phényle ; aralkyle, de
préférence benzyle ; ou hétéroaryle ;
i OR7, où
R7 représente : H ; un groupement alkyle en C1 à C6, de préférence en C1 à C4,
de
manière préférée méthyle ; cycloalkyle, de préférence cyclopropyle; aryle, de
préférence phényle ; aralkyle, de préférence benzyle ; hétéroaryle ; C(0)-
alkyle en C1
à C6, de préférence en C1 à C4; C(0)-cycloalkyle, de préférence cyclopropyle =
C(0)-aryle, de préférence phényle ; C(0)-aralkyle, de préférence benzyle
C(0)-hétéroaryle; C(0)0-alkyle en C1 à C6, de préférence en C1 à C4
C(0)0-cycloalkyle, de préférence cyclopropyle ; C(0)0-aryle, de préférence
phényle
C(0)0-aralkyle, de préférence benzyle ; C(0)0-hétéroaryle; (CH2),,CCR8
(CH2)pCH=CR8;
où m = 1 à 6 et p = 1 à 6 ; ou
i CH2OR7; CH2SR5 ; CH2NR3R4; ou CH21\13.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
Avantageusement U représente Cl,
V, W et Y représentent indépendamment H, F, Cl, Br, CN ou N3, avantageusement
H ou
Cl, et
X représente :
5 i H à condition que V, W, X et Y ne représentent pas tous simultanément
H;
i F ; Cl ; Br ; ou CN ;
i R1, où
R1 représente avantageusement, avantageusement un groupement alkyle en C1 à
C65
de préférence en C1 à C4, de manière préférée méthyle ; un groupement
10 perfluoroalkyle en C1 à C6, de préférence en C1 à C4, de manière
préférée CF3,
CF2CF3 ou CH(CF3)2 ; ou cycloalkyle, de préférence cyclopropyle;
i
S(0)R, où n = 0, 1 ou 2 et où R2 représente avantageusement un groupement
alkyle
en C1 à C6, de préférence méthyle ;
i C(0)R6, où R6 représente un groupement alkyle perfluoré, de préférence
trifluoronnéthyle ; cycloalkyle, de préférence cyclopropyle ;
i OR', où R7 représente un groupement alkyle en C1 à C6, de préférence
en C1 à C4, de
manière préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de
préférence
en C1 à C4, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ; cycloalkyle, de
préférence cyclopropyle ;
i NR3R4; où R3 représente un groupement alkyle en C1 à C6, de préférence en
Clà C4;
cycloalkyle, de préférence cyclopropyle et R4 représente un groupement alkyle
en C1
à C6, de préférence en C1 à C4 ; cycloalkyle, de préférence cyclopropyle ; ou
R3 et R4
sont liés ensemble pour former un cycle non aromatique de 5 à 8 atomes ou un
imide
cyclique de 5 à 8 chaînons ; ou
i CH2OR7 où R7 représente un groupement alkyle en C1 à C6, de préférence en
Clà C4,
de manière préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de
préférence en C1 à C4, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ;
cycloalkyle,
de préférence cyclopropyle ; (CH2),,CCF8 ; (CH2)pCH=CF8 où Fr représente H,
ou R1 et m = 1 à 6 et p = 1 à 6.
De manière encore plus avantageuse, U représente Cl, V, W et Y représentent H
ou Cl et
X représente avantageusement : H, F, Cl, Br, CF3, CN, SO2CH3, CH3, CH2CH3,
cyclopropyle,
C(0)cPr, C(0)CF3, Si(CH3)3, N(CH3)2, ou CH2OCH2CCH à condition que V, W, X et
Y ne
représentent pas tous simultanément H.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
11
Typiquement, U et V représentent Cl, W et Y représentent H et X
représente avantageusement : H, F, Cl, Br, CF3, CN, SO2CH3, CH3, CH2CH3,
cyclopropyle,
C(0)cPr, C(0)CF3, Si(CH3)3, N(CH3)2, ou CH2OCH2CCH, avantageusement H.
Typiquement, U et W représentent Cl, V et Y représentent H et X
représente avantageusement : H, F, Cl, Br, CF3, CN, SO2CH3, CH3, CH2CH3,
cyclopropyle,
C(0)cPr, C(0)CF3, Si(CH3)3, N(CH3)2, ou CH2OCH2CCH avantageusement H.
Typiquement, U et Y représentent Cl, V et W représentent H et X
représente avantageusement : H, F, Cl, Br, CF3, CN, SO2CH3, CH3, CH2CH3,
cyclopropyle,
C(0)cPr, C(0)CF3, Si(CH3)3, N(CH3)2, ou CH2OCH2CCH avantageusement H.
Selon un mode de réalisation particulier, U représente Cl, V, W et Y
représentent H et X
représente :
i F, Cl, Br, CN, ou N3;
i Si(Ra)(Rb)(1=r), où
Ra, Rb et Fr, identiques ou différents, représentent un groupement alkyle en
C1 à C6,
de préférence en Clà C3, ou aryle ;
i R1, où
R1 représente un groupement alkyle en C1 à C6, de préférence en Clà C4, de
manière
préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de préférence en
C1 à
C4, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ; cycloalkyle, de préférence
cyclopropyle; aryle, de préférence phényle ; aralkyle, de préférence benzyle ;
ou
hétéroaryle ;
i S(0)R2, où
n = 0, 1 ou 2,
R2 représente un groupement alkyle en C1 à C6, de préférence en C1 à C4;
aryle, de
préférence phényle ou tolyle ; aralkyle, de préférence benzyle ; ou
hétéroaryle,
i NR3R4, où
R3 représente H, un groupement alkyle en C1 à C6, de préférence en C1 à C4;
cycloalkyle, de préférence cyclopropyle ; aryle, de préférence phényle ;
aralkyle, de
préférence benzyle ; ou hétéroaryle,
R4 représente H; un groupement alkyle en C1 à C6, de préférence en C1 à C4;
cycloalkyle, de préférence cyclopropyle ; aryle, de préférence phényle ;
aralkyle, de
préférence benzyle ; hétéroaryle ; C(0)-alkyle en C1 à C6, de préférence en C1
à C4;
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
12
C(0)-cycloalkyle, de préférence cyclopropyle; C(0)-aryle, de préférence
phényle ;
C(0)-aralkyle, de préférence benzyle ; C(0)-hétéroaryle; S02-alkyle en Cl à
C6, de
préférence en Cl à C4; S02-cycloalkyle, de préférence cyclopropyle ; S02-
aryle, de
préférence phényle ; S02-hétéroaryle ; C(0)N(R6)2 ; où Fe est tel que défini
pour R3;
C(0)01=6, où R6 représente un groupement alkyle en Cl à C6, de préférence en
Cl à
C4; ou aralkyle, de préférence benzyle ; ou R3 et R4 peuvent être liés
ensemble pour
former un cycle non aromatique de 5 à 8 atomes ou un imide cyclique de 5 à 8
chaînons ;
i SR5, où
R5 représente un groupement alkyle en Cl à C6, de préférence en Cl à C4, de
manière
préférée méthyle ; cycloalkyle, de préférence cyclopropyle ; aryle, de
préférence
phényle ; aralkyle, de préférence benzyle ; ou hétéroaryle,
i C(0)R6, où
R6 représente un groupement alkyle en Cl à C6, de préférence en Cl à C4, de
manière
préférée méthyle ; alkyle perfluoré, de préférence trifluorométhyle ;
cycloalkyle, de
préférence cyclopropyle ; aryle, de préférence phényle ; aralkyle, de
préférence
benzyle ; hétéroaryle ; ou N(R7)(F8)
R7 et Fr, identiques ou différents, représentent H ; un groupement alkyle en
Cl
à C6, de préférence en Cl à C4, de manière préférée méthyle ; cycloalkyle, de
préférence cyclopropyle; aryle, de préférence phényle ; aralkyle, de
préférence benzyle ; ou hétéroaryle ;
i OR', où
R7 représente : H ; un groupement alkyle en Cl à C6, de préférence en Cl à C4,
de
manière préférée méthyle ; cycloalkyle, de préférence cyclopropyle ; aryle, de
préférence phényle ; aralkyle, de préférence benzyle ; hétéroaryle ; C(0)-
alkyle en Ci
à C6, de préférence en Cl à C4; C(0)-cycloalkyle, de préférence cyclopropyle
C(0)-aryle, de préférence phényle ; C(0)-aralkyle, de préférence benzyle
C(0)-hétéroaryle; C(0)0-alkyle en Cl à C6, de préférence en Cl à C4
C(0)0-cycloalkyle, de préférence cyclopropyle ; C(0)0-aryle, de préférence
phényle
C(0)0-aralkyle, de préférence benzyle ; C(0)0-hétéroaryle; (CH2),,CCR8
(CH2)pCH=CR8 ;
où m = 1 à 6 et p = 1 à 6 ; ou
i CH2OR7 ; CH2SR5 ; CH2NR3R4 ; ou CH21\13.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
13
De manière avantageuse, U représente Cl, V, W et Y représentent H et X
représente avantageusement
i F ; Cl ; Br ; ou CN ;
i R1, où
R1 représente avantageusement, avantageusement un groupement alkyle en C1 à
C65
de préférence en C1 à C4, de manière préférée méthyle ; un groupement
perfluoroalkyle en C1 à C6, de préférence en C1 à C4, de manière préférée CF3,
CF2CF3 ou CH(CF3)2 ; ou cycloalkyle, de préférence cyclopropyle;
i
S(0)R, où n = 0, 1 ou 2 et où R2 représente avantageusement un groupement
alkyle
en C1 à C6, de préférence méthyle ;
i C(0)R6, où R6 représente un groupement alkyle perfluoré, de préférence
trifluoronnéthyle ; cycloalkyle, de préférence cyclopropyle ;
i OR', où R7 représente un groupement alkyle en C1 à C6, de préférence
en C1 à C4, de
manière préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de
préférence
en C1 à C4, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ; cycloalkyle, de
préférence cyclopropyle ;
i NR3R4; où R3 représente un groupement alkyle en C1 à C6, de
préférence en Clà C4;
cycloalkyle, de préférence cyclopropyle et R4 représente un groupement alkyle
en C1
à C6, de préférence en C1 à C4 ; cycloalkyle, de préférence cyclopropyle ; ou
R3 et R4
sont liés ensemble pour former un cycle non aromatique de 5 à 8 atomes ou un
imide
cyclique de 5 à 8 chaînons ; ou
i CH2OR7 où R7 représente un groupement alkyle en C1 à C6, de
préférence en Clà C4,
de manière préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de
préférence en C1 à C4, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ;
cycloalkyle,
de préférence cyclopropyle; (CH2),,CCF8 ; (CH2)pCH=CF8 où Fr représente H,
ou R1 et m = 1 à 6 et p = 1 à 6.
De manière encore plus avantageuse, U représente Cl, V, W et Y représentent H
et X
représente avantageusement :
i F ; Cl ; Br ; CN ;
i R1, avantageusement un groupement alkyle en C1 à C6, de préférence
en C1 à C4, ou
un groupement alkyle en C2 à C6, de préférence en C2 à C4, un groupement
perfluoroalkyle en C1 à C6, de préférence en C1 à C4, de manière préférée CF3,
CF2CF3 ou CH(CF3)2 ; cycloalkyle, de préférence cyclopropyle;
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
14
i
S(0)R, où n = 0, 1 ou 2 et où R2 représente avantageusement un groupement
alkyle
en C1 à C6, de préférence méthyle ;
i C(0)R6, où R6 représente un groupement alkyle perfluoré, de préférence
trifluoronnéthyle ; cycloalkyle, de préférence cyclopropyle ;
i OR', où
R7 représente un groupement alkyle en C1 à C6, de préférence en C1 à C4, de
manière préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de
préférence
en C1 à C4, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ; cycloalkyle, de
préférence cyclopropyle ;
i
NR3R4; où R3 représente un groupement alkyle en C1 à C6, de préférence en Clà
C4;
cycloalkyle, de préférence cyclopropyle et R4 représente un groupement alkyle
en C1
à C6, de préférence en C1 à C4 ; cycloalkyle, de préférence cyclopropyle ; ou
R3 et R4
sont liés ensemble pour former un cycle non aromatique de 5 à 8 atomes ou un
imide
cyclique de 5 à 8 chaînons ; ou
i
CH2OR7 où R7 représente un groupement alkyle en C1 à C6, de préférence en Clà
C4,
de manière préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de
préférence en C1 à C4, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ;
cycloalkyle,
de préférence cyclopropyle ; (CH2),,CCF8 ; (CH2)pCH=CF8 où Fr représente H,
ou R1 et m = 1 à 6 et p = 1 à 6.
De manière encore plus avantageuse, U représente Cl, V, W et Y représentent H
et X
représente avantageusement : F, Cl, Br, CF3, CN, SO2CH3, CH3, CH2CH3,
cyclopropyle,
C(0)cPr, C(0)CF3, Si(CH3)3, N(CH3)2, ou CH2OCH2CCH.
Selon une caractéristique particulière de I invention, dans le composé de
formule (I), U
représente Cl, V, W et Y représentent H et X représente F, Cl, Br, CF3, CN,
502CH3,
CH2CH3, cyclopropyle, C(0)cPr, C(0)CF3, Si(CH3)3, N(CH3)2, ou CH2OCH2CCH.
Selon un autre mode de réalisation particulier de linvention, dans le composé
de
formule (I), U représente Cl, V, W et Y représentent H et X représente :
i Cl ; Br ou CN ;
i R1, avantageusement un groupement un groupement perfluoroalkyle en C1
à C6, de
préférence en C1 à C4, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ;
cycloalkyle,
de préférence cyclopropyle ;
i C(0)R6, où R6 représente un groupement alkyle perfluoré, de préférence
trifluoronnethyle ; cycloalkyle, de préférence cyclopropyle ;
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
CH2OR7 où R7 représente un groupement alkyle en C1 à C6, de préférence en Clà
C4,
de manière préférée méthyle ; un groupement perfluoroalkyle en C1 à C6, de
préférence en C1 à C4, de manière préférée CF3, CF2CF3 ou CH(CF3)2 ;
cycloalkyle,
de préférence cyclopropyle ; (CH2),,CCF8 ; (CH2)pCH=CF8 où Fr représente H,
5 Si(Fr)(Rb)(1=r), ou R1 et m = 1 à 6 et p = 1 à 6.
De manière plus avantageuse, dans le composé de formule (1), U représente Cl,
V, W et
Y représentent H et X représente Cl, Br, CF3, CN, C(0)cPr, C(0)CF3 ou
CH2OCH2CCH.
De manière particulièrement avantageuse, dans le composé de formule (1), U
représente
Cl, V, W et Y représentent H et X représente Cl.
Selon un autre mode de réalisation particulier de linvention, dans le composé
de
formule (1), U représente Cl, X, W et Y représentent H et V représente Cl.
Selon un autre mode de réalisation particulier de linvention, dans le composé
de
formule (1), U représente Cl, X, V et Y représentent H et W représente Cl.
Selon un autre mode de réalisation particulier de linvention, dans le composé
de
formule (1), U représente Cl, X, V et W représentent H et Y représente Cl.
Selon un autre mode de réalisation particulier de linvention, le composé de
formule (1)
est choisi parmi les composés cités dans le tableau 1 à 1-exception de 11-1CQ
et de NT36F9
et/ou le composé de formule (1) est choisi parmi les composés cités dans le
tableau 2 à
1-exception de 11-1CQ.
Avantageusement, le composé de formule (1) est sous forme énantiomériquement
pure,
c -est-à-dire une pureté optique supérieure à 95%, de préférence supérieure à
98%. De
préférence, il sâgit del-énantiomère (R).
La présente invention concerne également un composé de formule (1) tel que
défini ci-
dessus pour son utilisation en tant que médicament.
La présente invention concerne avantageusement un composé de formule (1) tel
que
défini ci-dessus pour son utilisation en tant qu -agent anti-inflammatoire, de
préférence pour
son utilisation dans le traitement du lupus érythémateux, de manière préférée
pour son
utilisation dans le traitement du lupus érythémateux disséminé.
La présente invention concerne également un composé de formule (1) tel que
défini ci-
dessus pour son utilisation dans le traitement des vascularites.
La présente invention est particulièrement adaptée pour son utilisation dans
le
traitement del-arthrite rhumatoïde.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
16
Les composés de formule (1) possèdent des propriétés d inhibition de 1-
autophagie. La
présente invention concerne donc également un composé de formule (1) pour son
utilisation
dans le traitement du cancer en association avec un agent anticancéreux,
notamment le
cancer du poumon ou le cancer colorectal.
Définitions :
Dans la présente invention, on entend désigner par < pharmaceutiquement
acceptable ce qui est utile dans la préparation d'une composition
pharmaceutique qui est
généralement sûr, non toxique et ni biologiquement ni autrement non
souhaitable et qui est
acceptable pour une utilisation vétérinaire de même que pharmaceutique
humaine.
On entend désigner par < sels pharmaceutiquement acceptables d-un composé,
des
sels qui sont pharmaceutiquement acceptables, comme défini ici, et qui
possèdent 1-activité
pharmacologique souhaitée du composé parent. De tels sels comprennent :
(1) les hydrates et les solvates,
(2) les sels d'addition d âcide pharmaceutiquement acceptable formés avec des
acides
inorganiques pharmaceutiquement acceptables tels que I âcide chlorhydrique, I
âcide
bromhydrique, 1-acide sulfurique, 1-acide nitrique, 1-acide phosphorique et
similaires ; ou
formés avec des acides organiques pharmaceutiquement acceptables tels que 1-
acide
acétique, 1-acide benzènesulfonique, I âcide benzoïque, 1-acide
camphresulfonique, I âcide
citrique, 1-acide éthane-sulfonique, I âcide fumarique, 1-acide
glucoheptonique, 1-acide
gluconique, I âcide glutamique, 1-acide glycolique, 1-acide hydroxynaphtoïque,
l'acide 2-
hydroxyéthanesulfonique, I âcide lactique, 1-acide maléique, 1-acide malique,
1-acide
mandélique, 1-acide méthanesulfonique, 1-acide muconique, 1-acide 2-
naphtalènesulfonique,
I âcide propionique, I âcide salicylique, I âcide succinique, 1-acide
dibenzoyl-L-tartrique, 1-acide
tartrique, 1-acide p-toluènesulfonique, 1-acide triméthylacétique, 1-acide
trifluoroacétique et
similaires, ou
(3) les sels d âddition de base pharmaceutiquement acceptable formés lorsqu -
un proton
acide présent dans le composé parent est soit remplacé par un ion métallique,
par exemple
un ion de métal alcalin, un ion de métal alcalino-terreux ou un ion
d'aluminiunn ; soit
coordonné avec une base organique ou inorganique pharmaceutiquement
acceptable. Les
bases organiques acceptables comprennent la diéthanolannine, 1-éthanolannine,
N-nnéthylglucannine, la triéthanolannine, la trométhamine et similaires. Les
bases inorganiques
acceptables comprennent [hydroxyde d'aluminium, [hydroxyde de calcium,
[hydroxyde de
potassium, le carbonate de sodium et [hydroxyde de sodium.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
17
Par groupement < alkyle en C1 à C6 , on entend, au sens de la présente
invention, une
chaîne hydrocarbonée monovalente saturée, linéaire ou ramifiée, comportant 1 à
6, de
préférence 1 à 4, atomes de carbone. A titre d-exemple, on peut citer les
groupes méthyle,
éthyle, propyle, isopropyle, butyle, isobutyle, sec-butyle, tert-butyle,
pentyle ou encore hexyle.
Le groupement alkyle en C1 à C6 peut éventuellement être substitué par un ou
plusieurs
atomes d'halogène, notamment de fluor. Il peut sâgir en particulier d-un
groupe CF3.
Par groupement < cycloalkyle en C3 à C6 , on entend, au sens de la présente
invention, une chaîne hydrocarbonée saturée cyclique, comportant 3 à 6 atomes
de carbone
cycliques. A titre d-exemple, on peut citer les groupes cyclopropyle,
cyclopentyle et
cyclohexyle.
Par < aryle , on entend, au sens de la présente invention, un groupement
hydrocarboné aromatique, comportant de préférence de 6 à 10 atomes de carbone,
et
comprenant un ou plusieurs cycles accolés, comme par exemple un groupement
phényle ou
naphtyle. Avantageusement, il s âgit du phényle. L âryle peut éventuellement
substitué par un
ou plusieurs groupements, choisis par exemple parmi des groupements alkyles ou
0-alkyles
comprenant 1 à 4 atomes de carbones, tels que méthyle, éthyle, propyle ou
butyle, des
halogènes tels que F, ou Cl, des perfluoroalkyles tels que CF3, NO2 ou CN.
Par < hétéroaryle , on entend, au sens de la présente invention, un groupe
aromatique
comprenant 5 à 10 atomes cycliques dont un ou plusieurs hétéroatomes,
avantageusement 1
à 4 et encore plus avantageusement 1 ou 2, tels que par exemple des atomes de
soufre,
azote ou oxygène, les autres atomes cycliques étant des atomes de carbone. Des
exemples
de groupes hétéroaryle sont les groupes furyle, thiényle, pyrrolyle,
pyridinyle, pyrinnidinyle,
pyrazolyle, innidazolyle, triazolyle, tétrazolyle ou encore indyle.
Lfiétéroaryle peut
éventuellement substitué par un ou plusieurs groupements, choisis par exemple
parmi des
groupements alkyles ou 0-alkyles comprenant 1 à 4 atomes de carbones, tels que
méthyle,
éthyle, propyle ou butyle, des halogènes tels que F, ou Cl, NO2 ou CN.
Par < perfluoroalkyle , on entend au sens de la présente invention une
chaine alkyle
telle que définie ci-dessus dans laquelle un ou plusieurs atomes d'hydrogène
sont remplacés
par des atomes de fluor. On peut citer, à titre d -exemple, les groupements
CF3, CH2CF3 ou
CH(CF3)2.
Par < cycle non aromatique de 5 à 8 atomes , , on entend, au sens de la
présente
invention, un cycle de 5 à 8 chaînons, saturé ou non, mais non aromatique, et
contenant un
ou plusieurs, avantageusement 1 à 4, encore plus avantageusement 1 ou 2,
hétéroatomes,
tels que par exemple des atomes de soufre, azote ou oxygène. Il peut sâgir
notamment du
groupe pyrrolidinyle, pipéridinyle, pipérazinyle ou morpholinyle. Le cycle non
aromatique de 5
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
18
à 8 atomes peut éventuellement être substitué par un ou plusieurs groupements,
choisis par
exemple parmi des groupements alkyles ou 0-alkyles comprenant 1 à 4 atomes de
carbones,
tels que méthyle, éthyle, propyle ou butyle, des halogènes tels que F, ou Cl
ou des
perfluoroalkyles tels que CF3, NO2 ou CN.
Exemples d -< imide cyclique de 5 à 8 chaînons sont par exemple un
groupement
succinimide ou phthalinnide.
Par < aralkyle , on entend, au sens de la présente invention, un groupe
aryle, tel que
défini ci-dessus, lié à la molécule par I intermédiaire dune chaîne (C1-C6)
alkyle, telle que
définie ci-dessus. A titre d-exemple, on peut citer le groupe benzyle.
Composition pharmaceutique:
La présente invention concerne en outre une composition pharmaceutique
comprenant
au moins un composé de formule (1) tel que défini ci-dessus.
La composition pharmaceutique selon I invention peut être formulée pour une
administration orale ou sublinguale, destinée aux mammifères, y compris
[homme.
Lingrédient actif peut être administré sous formes unitaires d -
administration, en
mélange avec des supports pharmaceutiques classiques, aux animaux ou aux êtres
humains. Les formes unitaires d âdministration appropriées comprennent les
formes par voie
orale telles que les comprimés, les gélules, les poudres, les granules et les
solutions ou
suspensions orales, et les formes d -administration sublinguale et buccale.
Les composés de I invention en tant que principes actifs peuvent être utilisés
à des
doses comprises entre 0,01 mg et 1000 mg par jour, donnés en une seule dose
une fois par
jour ou administrés en plusieurs doses tout au long de la journée, par exemple
deux fois par
jour en doses égales. La dose administrée par jour est avantageusement
comprise entre
5 mg et 500 mg, encore plus avantageusement entre 10 mg et 200 mg. La
posologie varie
selon le traitement et selon I âffection en cause et peut être déterminée par
11-lomme du
Métier.
Utilisation des composés :
La présente invention concerne en outre des composés de formule (1), leurs
sels,
solvates ou hydrates pharmaceutiquement acceptables, sous la forme d -un
énantiomère ou
d -un mélange d -énantiomères :
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
19
V,
U,
4111 I N....,...
Xi
.= (r)
VI
Wi
)
dans laquelle U1 représente :
F, Cl, Br, CN, CF3, ou N3;
et V1, W1, X1 et Y1 représentent indépendamment I, NO2 ou H, à condition que
V1, W1, X1
et Y1 ne représentent pas tous simultanément H, pour son utilisation en tant
qu -agent anti-
inflammatoire, avantageusement pour son utilisation dans le traitement du
lupus
érythémateux, plus avantageusement dans le traitement du lupus érythémateux
disséminé.
De manière avantageuse dans le composé de formule (I), U1 représente Cl, V1,
W1, et Y1
représentent H et X1 représente I ou NO2, pour son utilisation en tant qu -
agent anti-
inflammatoire, avantageusement pour son utilisation dans le traitement du
lupus
érythémateux, plus avantageusement dans le traitement du lupus érythémateux
disséminé.
La présente invention concerne également des composés de formule (r) son sel,
solvate
ou hydrate pharmaceutiquement acceptable, sous la forme crun énantiomère ou d-
un
mélange d -énantiomères :
Y2
( r )
le
U2 Ns.,...,_
1
V2 X2
w2 I-IN N ''OH
..-j
dans laquelle U2 représente :
F, Cl, Br, CN, CF3, ou N3;
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
et V2, W2, X2 et Y2 représentent indépendamment H, à condition que V2, W2, X2
et Y2 ne
représentent pas tous simultanément H, ou C(0)R6, où R6 représente 0-alkyle en
C1 à C65
de préférence en C1 à C4; 0-cycloalkyle, de préférence cyclopropyle ; 0-aryle,
de
préférence phényle ; 0-aralkyle, de préférence benzyle ; ou 0-hétéroaryle ;
pour son
5
utilisation dans le traitement du lupus érythémateux, plus avantageusement
dans le
traitement du lupus érythémateux disséminé.
De manière avantageuse dans le composé de formule (r) U2 représente Cl, V25
W25 et Y2
représentent H et X2 représente C(0)R6, où R6 représente 0-alkyle en C1 à C6,
de préférence
10 en
C1 à C4; 0-cycloalkyle, de préférence cyclopropyle ; 0-aryle, de préférence
phényle ;
0-aralkyle, de préférence benzyle ; ou 0-hétéroaryle ; pour son utilisation
dans le traitement
du lupus érythémateux, plus avantageusement dans le traitement du lupus
érythémateux
disséminé.
15 De
manière avantageuse dans le composé de formule (r) U2 représente Cl, V25 W25
et Y2
représentent H et X2 représente C(0)R6, où R6 représente 0-alkyle en C1 à C6,
de préférence
en C1 à C4 pour son utilisation dans le traitement du lupus érythémateux, plus
avantageusement dans le traitement du lupus érythémateux disséminé.
20
Avantageusement, les composé de formule (I) ou (r) sont sous forme
énantiomériquement pure, c -est-à-dire une pureté optique supérieure à 95%, de
préférence
supérieure à 98%. De préférence, il s âgit de 1-énantiomère (R).
La présente invention concerne des composés de formule (I') ou (L), tels que
définis ci-
dessus, pour leur utilisation dans le traitement de diverses maladies auto-
immunes ou
inflammatoires, notamment dans le traitement du lupus érythémateux disséminé,
de la
polyarthrite rhumatoïde, d'autres formes de polyarthrites, du syndrome des
anti-phospholipides, de vascularites d-expression cutanée, ou pour leur
utilisation dans le
traitement des vascularites, notamment liées à la présence d'anticorps
cytoplasmique anti-30
neutrophile (ANCA), en particulier des anticorps anti-myéloperoxydase (anti-
MPO).
La présente invention concerne également des composés de formule (I) ou (r),
tels que
définis ci-dessus, pour leur utilisation dans le traitement de diverses
atteintes telles que les
maladies allergiques (notamment asthme, rhinite allergiques) les maladies auto-
immunes
(notamment scléroses multiples, arthrite rhumatoïde, Maladie de Crohn,
psoriasis), les
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
21
maladies dégénératives (notamment Maladie d-Alzheimer, DMLA, arthropathie
chronique
dégénérative) ; les maladies métaboliques, (notamment Stéatohépatite non
alcoolique,
diabète de type 11, syndrome métabolique, athéroscléroses, atteintes
cardiaques,
hypertension), les infections chroniques (notamment infection par le VIH, le
HCV, le HBV, le
CMV, la tuberculose ou toutes autres infections virales ou bactériennes).
La présente invention concerne également des composés de formule (I) ou 0-1
tels
que définis ci-dessus, pour leur utilisation dans le traitement de diverses
maladies
inflammatoires en association avec un agent anti-inflammatoire, notamment dans
le
traitement du lupus érythémateux.
La présente invention concerne également des composés de formule (I) ou 0-1
tels
que définis ci-dessus, pour leur utilisation dans le traitement du cancer
telle que le cancer du
côlon, du sein, du cerveau et des os (notamment ostéosarcome, chondrosarcome,
neuroblastome, adénocarcinome du colon), les leucémies, les cancers du c- ur
(notamment
sarcome, myxome, rhabdomyome), du poumon (notamment carcinome bronchique,
carcinome alvéolaire, sarcome, lymphome), cancer gastro-intestinal (notamment
cancer de
1- sophage, de 1-estomac, du pancréas, de I intestin), cancer urogénitale
(notamment cancer
du rein, de I-urètre, de la prostate, des testicules, du foie), cancer génital
(notamment cancer
de I -utérus, des ovaires, de la vulve, du vagin), cancer hématologique
(notamment maladie
d liodgkin, lymphome non-Hodgkinien), et cancer de la peau (notamment
mélanome,
carcinome épidermoïde, carcinome basocellulaire, carcinome spinocellulaire,
lipome,
angiome).
La présente invention concerne également des composés de formule (I) ou 0-1
tels
que définis ci-dessus, pour leur utilisation dans le traitement du cancer en
association avec
un agent anticancéreux, notamment dans le traitement du cancer du poumon ou du
cancer
colorectal.
Les composés de formule (I), (I') ou (r) peuvent également être utilisés en
tant que
traceurs ou sondes pour I imagerie. La présente invention concerne donc en
outre 1-utilisation
cl-un composé de formule (I), (I) ou (r) en tant que traceur ou sonde pour I
imagerie. Les
composés sont avantageusement utilisés dans le domaine de la protéomique ou en
tant que
sonde fluorescente.
Avantageusement, les composés de formule (I), (I) ou (r) utilisés en imagerie
sont
ceux contenant une fonction alcyne ou azoture N3.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
22
Préparation des composés :
Les inventeurs ont également développé une nouvelle méthode de synthèse
utilisant en
tant que réactif la 4-hydroxy-7-chloro-quinoline (CAS 86-99-7) selon le schéma
réactionnel
suivant :
CI. N CI N CI N CI N
. -11. ill ,... =
x
OH OH CI
NHR
(II) (III) (IV) (I)
õ
R= -......,---..,..õ---..N.---...õ-OH
La méthode comprend une première étape d'halogénation de la position 3 du
cycle quinoline
du composé (11). De telles méthodes sont connues de 11-lomme du Métier.
['halogénation est réalisée avec du N-bromo succinimide, du N-chloro
succinimide ou
du N-iodo succinimide. Plus avantageusement, [halogénation est réalisée dans 1-
acide
acétique à une température comprise entre 40 et 80 C, de préférence environ
60 C.
Dans une seconde étape, le groupement hydroxyle en position 4 du composé (111)
est
remplacé par un halogène, de préférence un atome de chlore. Avantageusement,
cette
réaction est réalisée avec du POCI3. Plus avantageusement, la réaction est
effectuée à
100 C.
L'atome de chlore en position 4 de la chloroquinoline (IV) est ensuite
remplacé par
I âmine. Cette réaction est de préférence réalisée dans un solvant polaire,
avantageusement
la
1-rnéthy1-2-pyrrolidone, à une température comprise entre 150 et 200 C,
avantageusement d-environ 160 C, en présence dune base, avantageusement une
amine
tertiaire telle que la diisopropylamine. De manière avantageuse, le chauffage
est réalisé par
micro-ondes.
[intermédiaire halogéné (IV) éventuellement protégé peut ensuite servir pour
1-obtention de certains des composés de formule (I) en utilisant des méthodes
classiques
pour 11-lomme du Métier. Un groupement R1, tel qu'aryle ou alkyle peut par
exemple être
introduit par une réaction de Suzuki avec un acide arylboronique ou la
réaction de Kumada
avec un réactif de Grignard. Les groupements perfluoroalkyles, tels que CF3
peuvent être
introduits par une réaction catalysée par le cuivre. Par exemple, le composé
dans lequel X =
CF3 est introduit par une réaction entre la quinoline iodée de formule (IV)
par une réaction
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
23
avec du (phen)CuCF3, dans un solvant polaire tel que le DMF à une température
d -environ
80 C.
C -est 1-ajout de la chaîne aromatique R telle que défini dans le schéma
réactionnel ci-
dessus lors de la dernière étape de synthèse des composés de la présente
invention à partir
du composé de formule (IV), qui permet d ôbtenir un mélange racémique ou un
mélange
sous forme énantiomériquement pure. De préférence, il s'agit del-énantiomère
(R).
Un groupement OR'; SR5 ou NR3R4 peut être introduit par la réaction du dérivé
avec
I âlcool, le sulfide ou 1-amine correspondante, éventuellement en présence d -
un métal de
transition en tant que catalyseur ou par voie thermique en présence dune base.
Les composés de formule (I) dans lesquels X représente S(0)R2, CN ou CO(R6)
peuvent être préparés selon le schéma réactionnel suivant :
H
CI NH2 Cl N
+ HC(OCH2CH3)3 le I
X
X 0
(V) (VI) (VII) (VIII)
Cl Cl
Cl
X
X
X
OH CI NHR
(IX) (X) (I)
R = W OH
Dans une première étape, on fait réagir les composés (V), (VI) et (VII) à une
température entre 110 et 150 C, avantageusement d-environ 130 C.
La cyclisation du composé (VIII) en le composé (IX) est ensuite réalisée dans
un
solvant aromatique à une température comprise entre 200 et 280 C,
avantageusement
environ 250 C. Avantageusement, le solvant est un mélange de biphényl
(C12H10) et de
diphényloxide (C121-1100), vendu sous la dénomination commerciale Dowtherma
Le groupement hydroxyle du composé (IX) est ensuite remplacé par un halogène,
de
préférence un atome de chlore. Avantageusement, cette réaction est réalisée
avec du POCI3.
Plus avantageusement, la réaction est réalisée à 100 C pendant 2 heures.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
24
L'atome de chlore en position 4 de la chloroquinoline (IV) est ensuite
remplacé par
I âmine. Cette réaction est de préférence réalisée dans un solvant polaire,
avantageusement
le diméthyl sulfoxyde, à une température comprise entre 150 et 200 C,
avantageusement
d -environ 160 C, en présence dune base, avantageusement une amine tertiaire
telle que la
diisopropylannine.
De manière avantageuse, le chauffage est réalisé par micro-ondes.
La préparation des composés de formule (I) dans lequel X = C(0)1=6 peuvent
également
être réalisée à partir de la 4,7-dichloroquinoline (IV) selon le schéma
réactionnel ci-dessous,
illustratif de la préparation du composé dans lequel 1=r= CE,:
Cl110 CI CI CI
C(0)CF3
C(0)CF3
CI NMe2 NMe2 NHR
(XI) (XII) (XIII) (I)
R =
Dans une première étape, I -atome de chlore du composé (XI) est substitué par
un
groupement N(CH3)2. La réaction est de préférence réalisée dans un solvant
polaire,
avantageusement I âcétonitrile, à une température comprise entre 40 et 60 C,
avantageusement 50 C.
Le composé obtenu dans la première étape (XII) est ensuite mis à réagir avec
un
chlorure d âcyle ou un anhydride de formule R6C(0)0C(0)F6. La réaction est
avantageusement réalisée en présence d -un catalyseur, par exemple
la
4-dinnéthylanninopyiridine (DMAP) dans un solvant apolaire, avantageusement le
xylène, à
une température comprise entre 100 et 180 C, avantageusement d-environ 150
C.
Dans une troisième étape, le groupement amine en position 4 du composé de
formule
(XIII) est substitué par I âmine de 11-ICQ. La réaction est réalisée dans un
solvant polaire,
avantageusement I âcétonitrile, à une température comprise entre 60 et 90 C,
avantageusement à environ 80 C.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
Méthode de criblage:
Dans un autre mode de réalisation, la présente invention concerne une méthode
d identification d-un composé utile pour le traitement du lupus érythémateux,
5
avantageusement lupus érythémateux disséminé ou le traitement du cancer, et
dépourvu de
toxicité rétinienne comprenant les étapes de :
(a) sélectionner un composé test inhibiteur de la MPO,
(b) déterminer la constante d âssociation KA du composé test avec la B-
cristalline, et
10 (c) sélectionner le composé test n âyant pas d-affinité pour la B-
cristalline.
La sélection des composés inhibiteurs de la MPO selon 1-étape (a) est réalisée
selon
une méthode comprenant les étapes de :
(al) mettre en contact un composé test avec la MPO,
(a2) déterminer I âctivité de la MPO en présence de ce composé test,
15 (a3) comparer 1-activité de la MPO en présence de ce composé test
avec
celle de la MPO en 1-absence de ce composé test, et
(a4) sélectionner le composé test réduisant I âctivité de la
MPO.
L'activité de la MPO est mesurée par des méthodes bien connues de 11-lomme du
Métier, en particulier celles présentées dans les exemples de la présente
demande.
20 La
détermination de la constante d -association KA du composé test avec la B-
cristalline de [étape (b) est réalisée selon une méthode comprenant les étapes
de:
(bl) mettre en contact un composé test avec la protéine B-
cristalline,
(b2) déterminer la constante d'association KA du composé test avec la B-
cristalline, et
25 (b3)
sélectionner le composé test n âyant pas d-affinité pour la B-cristalline.
Au sens de la présente invention, un composé n interagissant pas avec la B-
cristalline
est défini comme un composé dont la constante d association KA est égale à O.
Par < composé test , on entend, au sens de la présente invention, des
composés de
différentes natures et origines, en particulier les composés chimiques
synthétiques, qui sont
testés pour évaluer leur capacité d inhibition de la MPO et/ou leur affinité
pour la B-
cristalline.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
26
Exemples :
Synthèses des composés selon I invention :
1) Composé de formule (I) dans lequel X = CN
A une suspension de 4,7-dichloroquinoline-3-carbonitrile (53 mg, 0,23 mmol)
dans 1,2 nnL de
N,N-diméthylformamide sont ajoutés la 2-[(4-anninopentyl)(éthypannino]éthan-1-
ol (124 mg,
0,71 mmol) et la triéthylannine (0,12 nnL, 0,71 mmol). Le milieu réactionnel
est irradié aux
micro-ondes 20 min à 180 C puis dilué dans I âcétate d'éthyle et lavé trois
fois avec une
solution de NaCI saturée. La phase organique est séchée sur Mg504, filtrée et
concentrée
puis purifiée sur colonne de silice avec un gradient dichlorométhane/méthanol
10/0 à 80/20.
Rendement 57%. Huile incolore ; RMN 1H (DMSO, 400 MHz) d 1,17 (3H, t, J = 7,2
Hz) ; 1,38
(3H, d, J = 6,4 Hz) ; 1,64-1,87 (m, 4H) ; 3,08-3,18 (m, 6H) ; 3,69 (2H, dt, J
= 5,1, 1,5 Hz) ;
4,62 (1H, m) ; 7,71 (1H, dd, J= 9,1, 2,3 Hz) ; 7,90 (1H, d, J= 2,2 Hz) ; 8.18
(1H, dl, J= 8.1
Hz), 8,59 (1H, d, J = 9,1 Hz) ; 8,69 (s, 1H) ; 9,14 (sl, 1H). RMN 13C (DMSO,
100 MHz) : 8,3 ;
19,8; 20,9; 32,9; 47,5; 49,8; 51,5; 53,3; 55,1 ; 82,6; 116,8; 119,1 ; 125,1 ;
126,2; 137,0;
146,5; 151,9; 154,0.
HRMS calculée pour C19H25CIN40 :360,1707 ; masse trouvée :360,1717
HNN -OH
CN
\
gbi
Cl N
2) Composé de formule (I) dans lequel X = Cl
A une suspension de 7-chloroquinolin-4-ol (500 mg, 2,78 mmol) dans 20 mL
d'acide acétique
est ajouté le N-chlorosuccinimide (408 mg, 3,06 mmol). La réaction est
chauffée à 60 C
pendant 5 heures puis diluée dans Veau et filtrée. Le solide blanc est lavé à
Veau et séché
sous vide.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
27
Rendement 88%. Solide blanc ; RMN 1H (DMSO, 400 MHz) d 7,40 (1H, dd, J = 8,8,
2,0 Hz),
7,64 (1H, d, J = 2,0 Hz), 8,14 (1H, d, J = 8,8 Hz), 8,45 (1H, s), 12,24 (1H,
si) ; RMN 13C
(DMSO, 100 MHz) d 170,6; 139,9; 138,5; 136,5; 127,5; 124,2; 123,2; 117,7;
114,7.
OH
si Cl
Cl N
3,7-dichloroquinolin-4-ol
Une suspension de 3,7-dichloroquinolin-4-ol (500 mg, 2,33 mmol) dans 6,5 mL de
trichlorure
de phosphoryle est chauffée à 100 C pendant 2 heures. Une fois à température
ambiante, la
solution est versée dans un mélange eau/glace, filtrée et lavée avec une
solution de NaHCO3
saturée puis de l'eau. Le solide blanc obtenu est séché et utilisé sans
purification
supplémentaire.
Rendement 92%. Solide blanc ; RMN 1H (DMSO, 400 MHz) d 7,88 (1H, dd, J = 9,1,
2,2 Hz) ;
8,24 (1H, d, J = 2,2 Hz) ; 8,26 (1H, d, J = 9,1 Hz) ; 9,07 (1H, s) ; RMN 13C
(DMSO, 100 MHz)
d 124,8 ; 126,0 ; 127,0 ; 128,3 ; 129,7 ; 135,5 ; 138,3 ; 146,7 ; 151,0. SM
(ESI+) : nn/z = 232
[M+1].
Cl
Cl
0/
Cl N
3,4,7-trichlorquinoline
A une suspension de 3,4,7-trichlorquinoline (500 mg, 2,15 nnnnol) dans 5 nnL
de N-nnéthy1-2-
pyrrolidone sont ajoutés la 2-[(4-aminopentyl)(éthyhamino]éthan-1-ol (750 mg,
4,3 nnnnol) et
la triéthylannine (0,6 nnL, 4,3 nnnnol). Le milieu réactionnel est irradié aux
micro-ondes 20 min
à 160 C puis dilué dans 1-acétate d-éthyle et lavé trois fois avec une
solution de NaCI
saturée. La phase organique est séchée sur Mg504, filtrée et concentrée puis
purifiée sur
colonne de silice avec un gradient dichlorométhane/méthanol 10/0 à 80/20
Rendement 85%. Huile incolore ; RMN 1H (DMSO, 400 MHz) d 0,83 (3H, t, J = 7,2
Hz) ; 1,26
(3H, d, J= 6,4 Hz) ; 1,34-1,69 (4H, m) ; 2,29-2,38 (6H, m) ; 3,35 (1H, m) ;
4,21-4,31 (2H, m) ;
6,06 (1H, d, J = 9,5 Hz) ; 7,57 (1H, dd, J = 9,1, 2,3 Hz) ; 7,88 (1H, d, J =
2,3 Hz) ; 8,35 (1H, d,
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
28
J = 9,2 Hz) ; 8,49 (1H, s). RMN 13C (DMSO, 100 MHz) d 11,4 ; 21,8 ; 23,3 ;
35,2 ; 47,4 ; 51,7;
53,0 ; 55,3 ; 58,9 ; 111,2 ; 120,2 ; 124,9 ; 125,6 ; 127,7 ; 133,7 ; 147,1 ;
147,7 ; 151,8.
HRMS calculée pour C18H25C12N30 : 369,1369 ; masse trouvée : 369,1375
HN N -OH
CI
CI le
3) Composé de formule (I) dans lequel X = I
A une suspension de 7-chloroquinolin-4-ol (500 mg, 2,78 mmol) dans 16 mL
d'acide acétique
est ajouté le N-iodosuccinimide (626 mg, 2,78 mmol). La réaction est chauffée
à 60 C
pendant 5 heures puis diluée dans Veau et filtrée. Le solide blanc est lavé à
Veau et séché
sous vide.
Rendement 87%. Solide blanc ; RMN 1H (DMSO, 400 MHz) d 7,39 (1H, dd, J = 8,8,
2,2 Hz) ;
7,62 (1H, d, J = 2,2 Hz) ; 8,10 (1H, d, J = 8,8 Hz), 8,55 (s, 1H) ; 12,21 (sl,
1H) ; RMN 13C
(DMSO, 100 MHz) d81,3 ; 117,6; 120,9; 124,4; 127,3; 140,3; 145,3; 172,5. SM
(ESI+) :
m/z = 523 [M+1]
OH
I
gbi
CI N
7-chloro-3-iodoquinolin-4-ol
Une suspension de 7-chloro-3-iodoquinolin-4-ol (500 mg, 1,64 mmol) dans 4,5
nnL de
trichlorure de phosphoryle est chauffée à 100 C pendant 2 heures. Une fois à
température
ambiante, la solution est versée dans un mélange eau/glace, filtrée et lavée
avec une
solution de NaHCO3 saturée puis de Veau. Le solide blanc obtenu est séché et
utilisé sans
purification supplémentaire.
Rendement 48%. Solide blanc ; RMN 1H (DMSO, 400 MHz) d 7,78 (1H, dd, J = 9,1,
2,2 Hz) ;
8,15 (1H, d, J = 2,2 Hz) ; 8,23 (1H, d, J = 9,1 Hz), 9,18 (s, 1H) ; RMN 13C
(DMSO, 100 MHz) d
97,2 ; 125,2 ; 126,5; 128,1 ; 129,5 ; 144,9 ; 147,3; 158,0. SM (ESI+) : nn/z =
523 [M+1]
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
29
Cl
I
0/
Cl N
4,7-dichloro-3-iodoquinoline
A une solution de 4,7-dichloro-3-iodoquinoline (50 mg, 0,154 mmol) dans 1,5 mL
de DMF est
ajouté le (Phen)CuCF3 (62,8 mg, 0,201 mmol). Après une nuit à 50 C, 1 éq. de
(Phen)CuCF3 est ajouté et la réaction est poursuivie 6 heures à 80 C. Le
milieu réactionnel
est dilué dans l'éther et filtré sur de la Célite0. Le filtrat est
successivement lavé avec une
solution de HCI 1M, NaHCO3 et NaCI. La phase organique est séchée sur MgSO4,
filtrée et
concentrée. Le brut est purifié sur colonne de silice avec un gradient
cyclohexane/Et0Ac
10/0 à 50/50.
Rendement 83%. Solide blanc ; SM (ESI+) : m/z = 266 [M+1]
Cl
e CF3
Cl N
4,7-dichloro-3-(trifluoromethyl)quinoline
A une suspension de 4,7-dichloro-3-(trifluoronnéthyl)quinoline (34 mg, 0,127
mmol) dans
0,6 mL de N,N-diméthylformamide sont ajoutés le 2-[(4-
aminopentyl)(éthyhannino]éthan-1-ol
(66 mg, 0,38 mmol) et la diisopropyléthylamine (63 nt, 0,38 mmol). Le milieu
réactionnel est
irradié aux micro-ondes 20 min à 180 C puis dilué dans I âcétate d'éthyle et
lavé trois fois
avec une solution de NaCI saturée. La phase organique est séchée sur Mg504,
filtrée et
concentrée puis purifiée sur colonne de silice avec un gradient
dichlorométhane/méthanol
10/0 à 80/20.
Rendement 19%. Huile incolore ; HRMS calculée pour C19H25C1F3N30 : 403,1638 ;
masse
trouvée :403,1640
HN N -OH
Cl *
N CF3
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
4) Composé de formule (I) dans lequel X = C(0)cPr
Une solution de m-Chloroaniline (1,36 mL, 12,8 mmol), trinnéthyl orthofornnate
(15,37 mmol,
5 1,68 mL) et de méthyl 3-cyclopropy1-3-oxopropanoate (1,82 g, 12,8 mmol)
est chauffée à
130 C pendant 5 heures en présence d-un appareil de Dean-Stark. Le brut est
purifié sur
colonne de silice avec du dichlorométhane.
Rendement 49%. Solide blanc. RMN 1H (CDCI3, 400 MHz) d 0,90-0,94 (2H, m) ;
1,90-1,11
(2H, m) ; 3,19-3,25 (1H, m) ; 3,80 (1H, s) ; 7,01 (1H, dd, J= 8,1, 2,3 Hz) ;
7,11-7,13 (1H, m) ;
10 7,16 (1H, t, J= 2,3 Hz) ; 7,28 (1H, t, J= 8,1 Hz) ; 8,40 (1H, d, J= 12,9
Hz) ; 12,73 (1H, d, J=
12,9 Hz). 13C (CDCI3, 100 MHz) d 11,9 ; 18,9 ; 51,6 ; 103,7 ; 116,1 ; 117,8 ;
125,5 ; 131,0 ;
135,9 ; 140,6; 151,0 ; 167,6 ; 202,1. SM (ESI+) : nn/z = 294 [M+1]
0
go C
0
/
CI N
15 H
méthyl (Z/E)-3-((3-chlorophé nyl)amino)-2-
(cyclopropanecarbonyl)acrylate
Une suspension de méthyl (Z/E)-3-((3-chlorophényl)amino)-2-
(cyclopropanecarbonyl)acrylate
20 (500 mg, 1,7 mmol) dans 5 mL de Dowtherm0 est chauffé 3 heures à 250 C.
A température
ambiante, le milieu est dilué dans du cyclohexane et filtré. Le solide obtenu
est utilisé sans
purification supplémentaire.
Rendement 31%. Solide blanc ; RMN 1H (DMSO, 400 MHz) d 0,92-1,00 (4H, m) ;
3,55-3,62
(m, 1H) ; 7,46 (1H, dd, J = 8,7, 2,0 Hz) ; 7,68 (1H, d, J = 2,0 Hz) ; 8,23
(1H, d, J = 8,7 Hz) ;
25 8,49 (1H, s) ; RMN 13C (DMSO, 100 MHz) d 11,4; 19,0; 118,1 ; 125,1 ;
126,6; 128,0; 137,0
; 139,8 ; 144,6; 174,7; 198,9. SM (ESI+) : nn/z = 248 [M+1]
OH 0
gbi
V
CI N
7-chloro-3-cyclopropanecarbonylquinoline-4-ol
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
31
Une solution de 7-chloro-3-cyclopropanecarbonylquinoline-4-ol (50 mg, 0,218
mmol) et
N,N-4-trinnéthylaniline (59 mg, 0,436 mmol) dans 3 mL de toluène est chauffée
à reflux sous
argon. Le trichlorure de phosphoryle (37 mg, 0,239 mmol) est ajouté et la
réaction maintenue
à reflux 16 heures. Le milieu réactionnel est extrait au dichlorométhane et
lavé avec une
solution HCI 1N puis NaCI saturée. La phase organique est séchée sur MgSO4,
filtrée et
concentrée. Le produit est purifié par colonne de silice avec du
dichlorométhane.
Rendement 90%. Solide blanc. RMN 1H (DMSO, 400 MHz) d 1,22-1,24 (4H, m) ; 2,73-
2,67
(1H, m) ; 7,89 (1H, dd, J = 8,9, 2,2 Hz) ; 8,24 (1H, d, J = 2,2 Hz) ; 8,37
(1H, d, J = 8,9 Hz) ;
9,00 (s, 1H) ; RMN 13C (DMSO, 100 MHz) d 11,3; 19,0; 118,0; 125,0; 126,6;
128,0;
136,9; 139,8; 144,4; 174,7; 198,9. HRMS calculée pour C13H9C12N0 : 265,0061 ;
masse
trouvée : 265,0063
Cl 0
gbi
V
CI N
4,7-dichlor0-3-cyclopropanecarbonylquinoline
A une suspension de 4,7-dichloro-3-cyclopropanecarbonylquinoline (48 mg, 0,180
mmol)
dans 1,2 nnL de N,N-dinnéthylfornnamide sont ajoutés le 2-[(4-
aminopentyl)(éthyl)amino]éthan-
1-01 (94 mg, 0,540 mmol) et la triéthylannine (75 nt, 0,540 mmol). Le milieu
réactionnel est
irradié aux micro-ondes 20 min à 180 C puis dilué dans I âcétate d'éthyle et
lavé trois fois
avec une solution de NaCI saturée. La phase organique est séchée sur Mg504,
filtrée et
concentrée puis purifiée sur colonne de silice avec un gradient
dichlorométhane/méthanol
10/0 à 80/20.
Rendement 56%. Huile incolore ; RMN 1H (CDCI3, 400 MHz) d 1,0 (3H, t, J = 7,3
Hz) ; 1,03-
1,07 (2H, m) ; 1,21-1,24 (2H, m) ; 1,42 (3H, d, J= 6,5 Hz) ; 1,45-1,71 (4H, m)
; 2,48 (2H, t, J
= 7,2 Hz) ; 2,54-2,59 (4H, m) ; 2,65-2,71 (1H, m) ; 3,55 (2H, t, J = 5,4 Hz) ;
4,19-4,26 (1H,
m) ; 7,33 (1H, dd, J= 9,1 Hz, J= 2,1 Hz) ; 7,91 (1H, d, J = 2,1 Hz) ; 8,04
(1H, d, J= 9,1 Hz) ;
9,22 (1H, s) ; 10,60 (1H, d, J= 8,7 Hz) ; RMN 13C (CDCI3, 100 MHz) d 11,35;
11,45; 17,76;
22,40; 23,58; 36,62; 47,54; 53,01 ; 53,51 ; 55,32; 58,36; 111,70; 118,05;
125,11 ;
127,76; 129,00; 137,53; 151,66; 153,33; 155,85 ;201,44.
HRMS calculée pour C22H30CIN302 : 403,2026 ; masse trouvée : 403,2039
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
32
(
N --/--0 H
H N 0
CI
S '
N 114
5) Composé de formule (1) dans lequel X = C(0)CF3
Une solution de 147-ch loro-4-(dinnéthylannino)q uinolin-3-yI]-
2,2,2-trifluoroéthan-1-one
(100 mg, 0,33 mmol) et 4-aminopentyl)(éthyl)amino]méthanol (58,2 mg, 0,363
mmol) dans
4 mL d -acétonitrile est chauffée à 85 C pendant 16 heures. Le milieu est
concentré et le
résidu purifié sur colonne de silice avec un mélange dichlorométhane/méthanol
10/0 à 80/20.
Rendement 21%. Huile incolore. RMN 1H (DMSO, 400 MHz) d 0,89 (3H, t, J = 6,9
Hz) ; 1,43
(3H, d, J = 6,5 Hz) ; 1,39-1,51 (2H, m) ; 1,64-1,75 (2H, m) ; 2,42-2,54 (6H,
m) ; 3,41 (2H, t, J
= 6,4 Hz) ; 4,41-4,44 (1H, m) ; 7,60 (1H, dd, J = 9,1 Hz, 2,5 Hz) ; 7,91 (1H,
d, J = 2,5 Hz) ;
8,36 (1H, d, J = 9,1 Hz) ; 8,73 (1H, q, J = 2,3 Hz) ; 10,35 (1H, si) ; RMN 13C
(DMSO, 100
MHz) d 11,1 ; 20,9; 28,9; 30,3; 35,1 ; 47,3; 52,6; 53,1 ; 55,1 ; 103,9; 116,6
; 117,0; 125,9
; 128,2; 128,9; 137,9; 150,7; 151,7; 156,9; 178,2.
HRMS calculée pour C201-125CIF3N302: 431,1587 ; masse trouvée :431,1580
H N --'N '-OH
CI le : COCF3
6) Composé de formule (1) dans lequel X = Cl
A une suspension de 3,4,7-trichloroquinoline (50 mg, 0,21 mmol) dans 0,5 nnL
de N-nnéthy1-2-
pyrrolidone sont ajoutés la (S)-2-[(4-aminopentyl)(éthyl)annino]éthan-1-ol (75
mg, 0,43 mmol),
et la triéthylannine (60 pL, 0,43 mmol). Le milieu réactionnel est irradié aux
micro-ondes
45 min à 160 C puis dilué dans 1-acétate d -éthyle et lavé trois fois avec
une solution de NaCI
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
33
saturée. La phase organique est séchée sur MgSO4, filtrée, concentrée puis
purifiée sur
colonne de silice avec un gradient dichlorométhane/méthanol 10/0 à 80/20.
Rendement 94%. Huile incolore ; RMN 1H (CDC13, 400 MHz) d 1,07 (3H, t, J = 7,2
Hz) ; 1,27
(3H, d, J = 6,3 Hz) ; 1,56-1,73 (4H, m) ; 2,59-2,68 (6H, m) ; 3,61 (2H, t, J =
4,5 Hz) ; 4,00-
4,07 (1H, m) ;4,47 (1H, d, J= 9,8 Hz) ; 7,42 (1H, d, J= 9,1 Hz, 2,3 Hz) ; 7,91
(1H, d, J= 9,0
Hz) ; 7,96 (1H, d, J = 2,1 Hz) ; 8,57 (1H, s). RMN 13C (CDC13, 100 MHz) :
11,08; 22,49;
23,29; 36,38; 47,97; 51,08; 53,46; 54,40; 55,76; 58,10; 115,69; 120,59;
124,54;
126,71 ; 129,28; 135,32; 148,01 ; 148,96; 150,84. HRMS calculée pour
C18H25C12N30 :
369,13747 ; masse trouvée : 369,13797.
HN)\/\N OH
CI
el
CI N
7) Composé de formule (1) dans lequel X = Cl
A une suspension de 3,4,7-trichloroquinoline (50 mg, 0,21 nnnnol) dans 0,5 nnL
de N-nnéthy1-2-
pyrrolidone sont ajoutés la (R)-2-[(4-aminopentyl)(éthyl)annino]éthan-1-ol (75
mg, 0,43 nnnnol),
et la triéthylannine (60 pL, 0,43 mmol). Le milieu réactionnel est irradié aux
micro-ondes
45 min à 160 C puis dilué dans 1-acétate d -éthyle et lavé trois fois avec
une solution de NaC1
saturée. La phase organique est séchée sur MgSO4, filtrée, concentrée puis
purifiée sur
colonne de silice avec un gradient dichlorométhane/méthanol 10/0 à 80/20.
Rendement 85%. Huile incolore ; RMN 1H (CDC13, 400 MHz) d 1,08 (3H, t, J = 7,3
Hz) ; 1,29
(3H, d, J = 6,8 Hz) ; 1,59-1,73 (4H, m) ; 2,58-2,70 (6H, m) ; 3,62 (2H, t, J =
4,9 Hz) ; 4,02-
4,09 (1H, m) ; 4,49 (1H, d, J= 10Hz) ; 7,43 (1H, d, J= 9,1 Hz, 2,2 Hz) ; 7,93
(1H, d, J= 9,1
Hz) ; 7,98 (1H, d, J= 2,2 Hz) ; 8,59 (1H, s).; RMN 13C (CDC13, 100 MHz) :
11,84 ; 20,12;
23,95; 34,25; 47,47; 48,87; 53,23; 55,21 ; 58,51 ; 100,42; 115,03; 127,44;
129,06; 129,26; 133,66; 150,42; 151,67; 151,98; HRMS calculée pour
C18H25C12N30 :
369,13747 ; masse trouvée : 369,13792.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
34
HN N -OH
CI
el
CI N
Ainsi, de manière similaire aux exemples 6) et 7), la préparation de composés
selon la
présente invention sous forme d-un mélange énantiomériquement pure sera
réalisée par
I -ajout de la chaîne aromatique (R) ou (S)-2-[(4-
aminopentyl)(éthyDamino]éthan-1-ol lors de la
dernière étape de synthèse.
8) Composé de formule (1) dans lequel U et W = Cl
A une suspension de 4,5,7-trichloroquinoline (100 mg, 0,43 nnnnol) dans 1 nnL
de N-nnéthy1-2-
pyrrolidone sont ajoutés la 2-[(4-aminopentyl)(éthyDamino]éthan-1-ol (150 mg,
0,86 mmol), et
la triéthylannine (120 pL, 0,86 nnnnol). Le milieu réactionnel est irradié aux
micro-ondes 45 min
à 160 C puis dilué dans 1-acétate d'éthyle et lavé trois fois avec une
solution de NaCI
saturée. La phase organique est séchée sur MgSO4, filtrée, concentrée puis
purifiée sur
colonne de silice avec un gradient dichlorométhane/méthanol 10/0 à 80/20.
Rendement 60%. Huile incolore ; RMN 1H (CDCI3, 400 MHz) d 1,04 (3H, t, J = 7,2
Hz) ; 1,33
(3H, d, J = 6,4 Hz) ; 1,57-1,73 (4H, m) ; 2,52-2,66 (6H, m) ; 3,56 (2H, t, J =
5,3 Hz) ; 3,63-
3,66 (1H, m) ; 6,38 (1H, d, J = 5,6 Hz) ; 7,14 (1H, d, J = 7,4 Hz) ; 7,33 (1H,
d, J = 2,2 Hz) ;
7,84 (1H, d, J = 2,2 Hz) ; 8,43 (1H, d, J = 5,6 Hz) ; RMN 13C (CDCI3, 100 MHz)
d 11,84;
20,12; 23,95; 34,25; 47,47; 48,87; 53,23; 55,21 ; 58,51 ; 100,42; 115,03;
127,44;
129,06; 129,26; 133,66; 150,42; 151,67; 151,98 ; HRMS calculée pour
C18H25C12N30 :
369,13747 ; masse trouvée : 369,13776.
CI HN'NOH
O
Cl N
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
9) Composé de formule (1) dans lequel U et W = Cl
A une suspension de 4,5,7-trichloroquinoline (79 mg, 0,34 mmol) dans 0,5 nnL
de N-nnéthy1-2-
pyrrolidone sont ajoutés la (S)-2-[(4-aminopentyl)(éthyDamino]éthan-1-ol (89
mg, 0,51 mmol),
5 et la triéthylamine (95 pL, 0,68 mmol). Le milieu réactionnel est irradié
aux micro-ondes
min à 160 C puis dilué dans 1-acétate d -éthyle et lavé trois fois avec une
solution de NaCI
saturée. La phase organique est séchée sur MgSO4, filtrée, concentrée puis
purifiée sur
colonne de silice avec un gradient dichlorométhane/méthanol 10/0 à 80/20.
Rendement 60%. Huile incolore ; RMN 1H (CDCI3, 400 MHz) d 1,05 (3H, t, J = 7,2
Hz) ; 1,32
10 (3H, d, J = 6,4 Hz) ; 1,59-1,71 (4H, m) ; 2,54-2,65 (6H, m) ; 3,58 (2H,
t, J = 5,3 Hz) ; 3,62-
3,68 (1H, m) ; 6,37 (1H, d, J = 5,6 Hz) ; 7,13 (1H, d, J = 7,3 Hz) ; 7,31 (1H,
d, J = 2,2 Hz) ;
7,82 (1H, d, J = 2,2 Hz) ; 8,41 (1H, d, J = 5,6 Hz) ; RMN 13C (CDCI3, 100 MHz)
d 11,84;
20,12; 23,95; 34,25; 47,47; 48,87; 53,23; 55,21 ; 58,51 ; 100,42; 115,03;
127,44;
129,06; 129,26; 133,66; 150,42; 151,67; 151,98; HRMS calculée pour
C18H25C12N30 :
15 369,13747 ; masse trouvée : 369,13652.
CI HN N)\/\ OH
lel
Cl N
10) Composé de formule (1) dans lequel U et W = Cl
A une suspension de 4,5,7-trichloroquinoline (100 mg, 0,43 mmol) dans 1 nnL de
N-nnéthy1-2-
pyrrolidone sont ajoutés la (R)-2-[(4-aminopentyl)(éthypannino]éthan-1-ol (150
mg,
0,86 mmol), et la triéthylamine (120 pL, 0,86 mmol). Le milieu réactionnel est
irradié aux
micro-ondes 45 min à 160 C puis dilué dans I âcétate d'éthyle et lavé trois
fois avec une
solution de NaCI saturée. La phase organique est séchée sur MgSO4, filtrée,
concentrée puis
purifiée sur colonne de silice avec un gradient dichlorométhane/méthanol 10/0
à 80/20.
Rendement 60%. Huile incolore ; RMN 1H (CDCI3, 400 MHz) d 1,05 (3H, t, J = 7,2
Hz) ; 1,32
(3H, d, J = 6,4 Hz) ; 1,58-1,72 (4H, m) ; 2,53-2,67 (6H, m) ; 3,57 (2H, t, J =
5,3 Hz) ; 3,62-
3,67 (1H, m) ; 6,37 (1H, d, J = 5,6 Hz) ; 7,13 (1H, d, J = 7,3 Hz) ; 7,32 (1H,
d, J = 2,2 Hz) ;
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
36
7,83 (1H, d, J = 2,2 Hz) ; 8,42 (1H, d, J = 5,6 Hz) ; RMN 13C (CDCI3, 100 MHz)
d 11,84;
20,12; 23,95; 34,25; 47,47; 48,87; 53,23; 55,21 ; 58,51 ; 100,42; 115,03;
127,44;
129,06; 129,26; 133,66; 150,42; 151,67; 151,98; HRMS calculée pour
C18H25C12N30 :
369,13747 ; masse trouvée : 369,1365.
CI HN N -OH
O
Cl N
11) Composé de formule (1) dans lequel U et V = Cl
A une suspension de 4,6,7-trichloroquinoline (100 mg, 0,43 nnnnol) dans 1 nnL
de N-nnéthy1-2-
pyrrolidone sont ajoutés la 2-[(4-aminopentyl)(éthyDamino]éthan-1-ol (150 mg,
0,86 mmol), et
la triéthylannine (120 pL, 0,86 nnnnol). Le milieu réactionnel est irradié aux
micro-ondes 45 min
à 160 C puis dilué dans 1-acétate d'éthyle et lavé trois fois avec une
solution de NaCI
saturée. La phase organique est séchée sur MgSO4, filtrée, concentrée puis
purifiée sur
colonne de silice avec un gradient dichlorométhane/méthanol 10/0 à 80/20.
Rendement 50%. Huile incolore ; RMN 1H (CDCI3, 400 MHz) d 1,03 (3H, t, J = 7,2
Hz) ; 1,32
(3H, d, J = 6,4 Hz) ; 1,56-1,73 (4H, m) ; 2,47-2,62 (6H, m) ; 3,59 (2H, t, J =
5,6 Hz) ; 3,66-
3,72 (1H, m) ; 5,10 (1H, d, J = 7,4 Hz) ; 6,40 (1H, d, J = 5,6 Hz) ; 7,94 (1H,
s) ; 8,04 (1H, s) ;
8,49 (1H, d, J = 5,5 Hz). RMN 13C (CDCI3, 100 MHz) d 11,90 ; 20,51 ; 24,23 ;
34,45 ; 47,85;
48,67; 53,21 ; 55,01 ; 58,66 ; 99,71 ; 118,50; 121,49; 128,76; 131,03; 133,43;
147,92;
148,44; 152,33 ; HRMS calculée pour C18H25C12N30 : 369,13747 ; masse trouvée :
369,13648.
HNN '-OH
Cl
1.1
Cl N
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
37
12) Composé de formule (1) dans lequel U et Y = Cl
A une suspension de 4,7,8-trichloroquinoline (100 mg, 0,43 mmol) dans 1 nnL de
N-nnéthy1-2-
pyrrolidone sont ajoutés la 2-[(4-aminopentyl)(éthyDamino]éthan-1-ol (150 mg,
0,86 mmol), et
la triéthylannine (120 pL, 0,86 mmol). Le milieu réactionnel est irradié aux
micro-ondes 45 min
à 160 C puis dilué dans 1-acétate d'éthyle et lavé trois fois avec une
solution de NaCI
saturée. La phase organique est séchée sur MgSO4, filtrée, concentrée puis
purifiée sur
colonne de silice avec un gradient dichlorométhane/méthanol 10/0 à 80/20.
Rendement 51%. Huile incolore ; RMN 1H (CDCI3, 400 MHz) d 1,07 (3H, t, J = 7,2
Hz) ; 1,30
(3H, d, J = 6,4 Hz) ; 1,56-1,83 (4H, m) ; 2,58-2,69 (6H, m) ; 3,62 (2H, t, J =
5,4 Hz) ; 3,65-
3,73 (1H, m) ; 5,40 (1H, d, J = 7,7 Hz) ; 6,43 (1H, d, J = 5,5 Hz) ; 7,40 (1H,
d, J = 9,1 Hz) ;
7,80 (1H, d, J = 9,1 Hz) ; 8,58 (1H, d, J = 5,5 Hz) ; RMN 13C (CDCI3, 100 MHz)
d 11,15;
20,46 ; 23,72 ; 34,23 ; 48,05 ; 48,75 ; 53,40 ; 55,31 ; 58,29 ; 99,91 ; 118,42
; 119,56; 125,46;
131,76 ; 133,89 ; 146,38; 149,80; 152,22 ; HRMS calculée pour C18H25C12N30
:369,13747 ;
masse trouvée :369,13711.
HN----....õ,..--...,_,N....,.......--\,
OH
Cl \
lel N
CI
13) Composé de formule (1) dans lequel X=Br
A une suspension de 7-chloroquinolin-4-ol (500 mg, 2,78 mmol) dans 16 mL
d'acide acétique
est ajouté le N-iodosuccinimide (626 mg, 2,78 mmol). La réaction est chauffée
à 60 C
pendant 5 heures puis diluée dans Veau et filtrée. Le solide blanc est lavé à
Veau et séché
sous vide.
Rendement 88%. Solide blanc ; RMN 1H (CDCI3, 400 MHz) d 7,41 (1H, d, J = 8,7
Hz) ; 7,64
(1H, s) ; 8,13 (1H, d, J= 8,8 Hz) ; 8,53 (1H, s) ; 12,32 (1H, si); RMN 13C
(CDCI3, 100 MHz) d
104,75 ; 117,68 ; 122,78 ; 124,33 ; 127,62 ; 136,45 ; 140;04 ; 140,77 ; 170,84
; SM (ESI+) :
m/z = 257 [M+1].
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
38
OH
gbi Br
CI N
3-bromo-7-chloroquinolin-4-ol
Une suspension de 7-chloro-3-bromoquinolin-4-ol (500 mg, 1,64 nnnnol) dans 4,5
nnL de
trichlorure de phosphoryle est chauffée à 100 C pendant 2 heures. Une fois à
température
ambiante, la solution est versée dans un mélange eau/glace, filtrée et lavée
avec une
solution de NaHCO3 saturée puis de Veau. Le solide blanc obtenu est séché et
utilisé sans
purification supplémentaire.
Rendement 90%. Solide blanc ; RMN 1H (CDCI3, 400 MHz) d 7,86 (1H, dd, J = 9,1,
2,1 Hz) ;
8,22 (1H, d, J = 2,2 Hz) ; 8,27 (1H, d, J = 6,1 Hz) 9,12 (1H, s) ; RMN 13C
(CDCI3, 100 MHz) d
118,48; 126,08; 126,14; 129,12; 129,79; 136,74; 141,80; 147,75; 153,10 ; SM
(ESI+) :
nn/z = 275 [M+1].
CI
gbi Br
CI N
3-bromo-4,7-dichloroquinoline
A une suspension de 3-bromo-4,7-trichloroquinoline (200 mg, 0,72 nnnnol) dans
2 nnL de N-
méthy1-2-pyrrolidone sont ajoutés la 2-[(4-aminopentyl)(éthyhamino]éthan-1-ol
(188 mg, 1,08
nnnnol), et la triéthylannine (358 pL, 2,16 nnnnol). Le milieu réactionnel est
irradié aux micro-
ondes 45 min à 160 C puis dilué dans 1-acétate d'éthyle et lavé trois fois
avec une solution
de NaCI saturée. La phase organique est séchée sur Mg504, filtrée, concentrée
puis purifiée
sur colonne de silice avec un gradient dichlorométhane/méthanol 10/0 à 80/20.
Rendement 11%. Huile incolore ; RMN 1H (CDCI3, 400 MHz) d 1,04 (3H, t, J = 7,2
Hz) ; 1,28
(3H, d, J = 6,4 Hz) ; 1,55-1,66 (4H, m), 2,51-2,54 (2H, m) ; 2,59-2,64 (4H, m)
; 3,58 (t, J = 5,3
Hz, 2H) ; 3,96-4,04 (1H, m) ; 4,46 (1H, d, J = 10,3 Hz) ; 7,41 (1H, dd, J =
9,1, 2,3 Hz) ; 7,92
(1H, d, J = 9.1 Hz) ; 7,97 (1H, d, J = 2,2 Hz) ; 8,69 (1H, s) ; RMN 13C
(CDCI3, 100 MHz) d
11,42 ; 22,37 ; 23,59 ; 36,57 ; 47,68 ; 53,29 ; 55,04 ; 55,35 ; 58,28 ; 107,35
; 120,89; 124,89;
126,50 ; 129,13 ; 135,36 ; 149,42 ; 149,65 ; 152,69 ; HRMS calculée pour
C18H25BrCIN30 :
413,0869 ; masse trouvée : 413,0867.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
39
HN N -OH
elBr
CI N
14) Composé de formule (1) dans lequel X=cPr
La 4,7-dichloro-3-iodoquinoline (350 mg, 1,08 mmol) et I âcide
cyclopropylboronic (139 mg,
1,63 mmol) sont mis en solution dans une solution dégazée de THF/K3PO4 aqueux
0.5 M
(1/2 ; 4 nnI/8nnL). Le catalyseur XPhos Pd G2 (42 mg, 0,054 mmol) est ajouté
sous argon et la
réaction est chauffée 2 heures à 80 C. A température ambiante, Le milieu
réactionnel est
filtré sur Celite puis extrait deux fois au dichlorométhane. La phase
organique est lavée à
Veau et séchée sur MgSO4, filtrée, concentrée puis purifiée sur colonne de
silice avec un
gradient cyclohexane / dichlorométhane 5/5 à 2,5/7,5.
Rendement 26%. Huile incolore ; RMN 1H (CDCI3, 400 MHz) d 0,89-0,93 (2H, m) ;
1,16-1,21
(2H, m) ; 2,29-2,36 (1H, m) ; 7,56 (dd, J = 9,03, 1,76 Hz, 1H) ; 8,05 (1H, d,
J = 2,01 Hz, 1H),
4,62 (1H, m) ; 7,71 (1H, dd, J = 9,1,2,3 Hz) ; 7,9 (1H, d, J = 2,2 Hz) ; 8,18
(1H, d, J = 8,1 Hz)
; 8,59 (1H, d, J = 9,1 Hz) ; 8,69 (1H, s) ; 9,14 (1H, si) ; RMN 13C (CDCI3,
100 MHz) d 7,88 ;
12,07 ; 124,68 ; 125,31 ; 128,43 ; 128,52 ; 133,42 ; 135,15 ; 142,06 ; 147,59
; 149,85 ; SM
(ESI+) : nn/z = 238 [M+1].
CI
A
Cl N
4,7-dichloro-3-cyclopropylquinoline
A une suspension de 4,7dichloro-3-cyclopropylquinoline (69 mg, 0,29 mmol) dans
0,5 mL de
N-méthy1-2-pyrrolidone sont ajoutés la 2-[(4-anninopentyl)(éthyl)annino]éthan-
1-ol (75 mg,
0,43 mmol), et la diisopropyléthylannine (143 pL, 0,87 mmol). Le milieu
réactionnel est irradié
aux micro-ondes 45 min à 160 C puis dilué dans 1-acétate d'éthyle et lavé
trois fois avec une
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
solution de NaCI saturée. La phase organique est déchée sur MgSO4, filtrée,
concentrée puis
purifiée sur colonne de silice avec un gradient dichlorométhane/méthanol 10/0
à 80/20.
Rendement 21%. Huile incolore ; RMN 1H (CDCI3, 400 MHz) d 0,68-0,77 (2H, m) ;
1,07 (2H,
m) ; 1,17 (3H, t, J = 7,3 Hz) ; 1,26 (1H, m) ; 1,27 (3H, d, J = 6,27) ; 1,60-
1,82 (8H, m) ; 2,72
5 (2H, m) ; 2,79-2,82 (4H, m) ; 3,72 (2H, m) ; 4,12 (1H, si) ; 4,61 (1H,
si) ; 7,39 (1H, dd, J = 9,1,
2,0 Hz, 1H) ; 7,94 (1H, d, J = 9,1 Hz) ; 7,99 (1H, d, J = 2,0 Hz) ; 8,50 (1H,
s) ; RMN 13C
(CDCI3, 100 MHz) d 6,01 ; 6,06 ; 22,29 ; 30,94 ; 36,14 ; 48,17 ; 53,52 ; 53,64
; 55,93 ; 57,57;
119,03; 120,47; 124,39; 125,65; 128,19; 134,62; 151,83; 152,12; HRMS masse
calculée
pour C21 H30CIN30 : 375,20774 ; masse trouvée : 375,20701.
HNNOH
A
lel
Cl N
15) Composé de formule (1) dans lequel X= CH2OCH2CxCH
A une suspension de LiAIH4 (56 mg, 1,49 nnnnol) dans 30 mL de THF anhydre est
ajoutée, à
0 C, une solution d -éthy1-4,7-dichloroquinoline-3-carboxylate (270 mg, 1
nnnnol) dans 5 nnL de
THF anhydre. Après 3 heures d âgitation à température ambiante, la réaction
est neutralisée
avec une solution aqueuse de soude 1N et extraite 5 fois à 1-acétate d-éthyle.
La phase
organique est lavée avec une colonne de silice avec un gradient
dichlorométhane/méthanol
10/0 à 95/5.
Rendement 50%. Solide blanc ; RMN 1H (CDCI3, 400 MHz) d 5,05 (1H, d, J = 5,7
Hz) ; 7,62
(1H, dd, J = 9,0 Hz, 2,2 Hz) ; 8,14 (1H, d, J = 2,0 Hz) ; 8,21 (1H, d, J = 9,0
Hz) ; 9,02 (1H, s) ;
RMN 13C (CDCI3, 100 MHz) d 58,98; 123,91 ; 125,65; 127,94; 128,71 ; 132,68;
134,74;
138,55 ; 147,82; 151,53; SM (ESI+) : nn/z = 228 [M+1].
Cl
gbi OH
Cl N
(4,7-dichloroquinolin-3-yl)nnéthanol
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
41
A une solution de 4,7-dichloroquinolin-3-yl)nnéthanol (110 mg, 0,48 mmol) dans
8 nnL de THF
anhydre, à 0 C, est ajouté par petites portion du NaH (46 mg, 1,93 mmol)
après 10 min
d'agitation le 3-bromopropyne (430 mg, 2,9 mmol) est ajouté goutte à goutte.
Après une nuit
à température ambiante, le milieu est neutralisé avec de la glace, dilué à 1-
acétate d-éthyle et
lavé 4 fois avec une solution saturée de NaCI. La phase organique est séchée
sur MgSO4,
filtrée et concentré sous vide. Le résidue est purifié sur colonne de silice
avec un gradient
dichlorométhane/méthanol 10/0 à 90/10.
Rendement 62%. RMN 1H (CDCI3, 400 MHz) d 2,54 (1H, t, J = 2,3 Hz) ; 4,33 (2H,
d, J = 2,3
Hz) ; 4,92 (1H, s) ; 7,6 (1H, dd, J= 8,9 Hz, 2,1 Hz) ; 8,12 (1H, d, J= 2,3 Hz)
; 8,19 (1H, d, J=
8,8 Hz) ;8,95 (1H, s).
Cl
gbi CI
CI N
4 ,7-d ichloro-3-((prop-2-yn-1-yloxy)nnéthyl)quinoline
A une suspension de 4,7-dichloro-3-((prop-2-yn-1-yloxy)nnéthyl)quinoline (80
mg, 0,30 mmol)
dans 1 mL de N-méthy1-2-pyrrolidone sont ajoutés la 2-[(4-
aminopentyl)(éthyhannino]éthan-1-
ol (104 mg, 0,60 mmol), et la triéthylamine (83 pL, 0,60 mmol). Le milieu
réactionnel est
irradié aux micro-ondes 45 min à 160 C puis dilué dans 1-acétate d'éthyle et
lavé trois fois
avec une solution de NaCI saturée. La phase organique est séchée sur MgSO4,
filtrée,
concentrée puis purifiée sur colonne de silice avec un gradient
dichlorométhane/méthanol
10/0 à 80/20.
Rendement 31%. Huile jaune ; RMN 1H (CDCI3, 400 MHz) d 1,08 (3H, t, J = 7,1
Hz) ; 1,25-
1,28 (4H, m) ; 1,59-1,74 (4H, m) ; 2,63-2,57 (3H, m) ; 2,66-2,72 (4H, m) ;
3,63 (2H, t, J = 4,9
Hz) ; 3,98-4,05 (1H, m) ; 4,21 (2H, d, J = 2,3 Hz) ; 4,73 (2H, s) ; 4,92 (1H,
d, J = 9,7 Hz) ;
7,38 (1H, dd, J = 9,4, 2,3 Hz) ; 7,95-7,98 (2H, m) ; 8,48 (1H, s) ; RMN 13C
(CDCI3, 100 MHz) d
11,06; 22,59; 23,40; 36,53; 47,90; 53,39; 54,14; 55,53; 57,24; 58,01 ; 68,27;
75,92;
79,32; 114,89; 119,90; 125,18; 125,76; 128,86; 135,44; 150,76; 152,80; 152,95;
HRMS
masse calculée pour C22H30CIN302 : 403,20265 ; masse trouvée : 403,20029.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
42
HN \/\N OH
gbi 0
Cl N
Affinité des composés avec la MPO et r- B-C
A 1-aide de la technologie de résonance plasmonique de surface (Biacore 3000),
les
constantes d interactions entre les analogues de HCQ (HCQa) et les cibles
myéloperoxydase
(MPO) et r- B-cristalline ( B-C) ont été mesurées à 25 C selon 12 séries
différentes
d-expérimentation. Tout d'abord, des analogues dl-ICQ à cinq concentrations
différentes (10-6
à 10-8 M) ont été injectées à un débit de 10-6 l/min pendant 250 s sur les
cibles MPO et B-C
ainsi que sur les témoins ERK1 et ERK2, suivie dune phase de dissociation de
150 s.
Les paramètres cinétiques ont été mesurés en utilisant le logiciel
BlAevaluation 4.1.
L-ensemble des valeurs d-unité de résonnances obtenues avec les témoins ont
été
soustraites à celles obtenues avec MPO et B-C pour compenser les liaisons non
spécifiques. Les résultats de ces tests d-affinité sont présentés dans les
tableaux 1 et 2.
Les différences des valeurs de Kd pour les enzymes myéloperoxydase (MPO) et B-
cristalline ( B-C) dans les tableaux 1 et 2 sont dues à la variabilité des
lots commerciaux.
Néanmoins, 1-écart entre les Kd des composés HCQ et CB137 reste identique
selon ces deux
tests.
Tableau 1
Kd (M) Kd
(M)
Molécules Référence
sur MPO
sur crystallin
CI N
gW1 /
HCQ
7.1e-7
2.2e-8
FIN ,......,....,...===-....--,....,..õ,,OF1 commercial
H2SO4
CA 02988342 2017-12-05
WO 2016/193503
PCT/EP2016/062816
43
Cl
CI
CB137 6.59? 1.75e-7
HN H
.H2SO4.
Cl
CB133 7.11e-7 2.19e-9
HN (:)H
.T FA
CI
CI
CB072 1.1? 1.6e-7
HN H
.T FA
Cl
ON
CB029 7.1e-8 3.5e-8
H N N H
.T FA
Cl
CF3 CB108 1.4e-8 8.1e-7
FIN
.T FA
Cl
1.1 CF3
0 CB114 6.0e-8 2.2e-5
HN 1\10H
.T FA
Cl
0 CB103 3.6e-8 6.6e-7
FIN
.T FA
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
44
CI N
0 Kd
non
* /
mesurable car
7.5? situé
en
HN O NT36F9 dessous du
rN----NN ---N.,.-OH seuil
de
détection
.TFA
CI N
*Kd non
/ 0 H
mesurable car
NT69 HN 7.1? situé en
OH
dessous du N
seuil de
.TFA détection
Analyses des composés sous forme de sels de sulfate selon la méthode décrite
précédemment :
Tableau 2
Molécules Référence Kd (M) Kd
(M)
Sur MPO
sur crystallin
HN'N'-OH
HCQ
4x10-6 1x10-
6
commercial
gbi
CI N H2s04
HN'N'-OH
Cl CB137 6x10-8 3x10-
5
gbi
CI N H2s04
Cl HNF\j'-OH
CB300 4x10-6 2x10-
4
l
CI N H2s04
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
z
CI HNNOH CB321
7x10 1x10-5
Enantiomère R
gbi
CI H2SO4
7
HNNOH CB323
ci 9x10-8 2x10-4
Enantiomère R
CI N H2SO4
HN N OH
CB317 9x10-6 1x10-4
CI N H2SO4
CI
HN
N OH
CB341 5x10-6 2x10-5
CI N H2SO4
Efficacité de CB137 dans un modèle de lupus
Animaux
5 Les souris MRL/MPJ - Fas (Ipr) (MRL-Ipr) et C57131/6 pour les expériences
comportementales
proviennent du Laboratoire Jackson et sont distribuées au hasard en 5 groupes.
Tous les
animaux ont été maintenus à température contrôlée (23 C +/- 1 C) avec un
cycle de
12 heures de jour/nuit, eau et nourriture ad libitum.
10 Traitement avec HCQ ou CB137
Les souris ont reçu la dose indiquée dhydroxychloroquine (Tokyo Chemical
Industry), CB137
ou véhicule par voie intrapéritonéale (IP), toutes les 24 heures et pendant 5
jours sur une
période de 10 semaines. Pour les souris MRUIpr, le traitement a commencé à 7
semaines
d'âge, et s -est terminé à 23 semaines d'âge où une proportion importante des
souris non
15 traitées sont mortes. Pour les souris C5761/6, le même programme de
traitement a été
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
46
effectué et les souris ont été sacrifiées après 70 injections IP. HCQ et CB137
ont été à
chaque fois fraîchement préparés dans du sérum physiologique et injectés aux
souris dans
un volume final de 50 jiL. les souris MRL/Ipr ont été examinés quotidiennement
pour détecter
des lésions cutanées. Pour l'analyse histologique, les animaux ont été
sacrifiés et les tissus
ont été rapidement disséqués et post-fixés immédiatement.
Toutes les expériences animales ont été réalisées sous la supervision des
enquêteurs
autorisés et suivant les règlements actuels de l'UE. Les expériences ont été
approuvées par
le comité d'éthique local et national sous le numéro d'enregistrement
02.952,01.
Survie des souris MRL/Ipr (modèle de Lupus)
Les souris ayant reçu une injection i.p. de CB137 à 10 mg/kg ont une survie
significativement
augmentée par rapport aux souris traitées par HCQ à la même dose (figure 1).
Développement de la maladie
Les dermatites sont moins fréquentes chez les souris traitées par CB137 10
mg/kg comparée
aux souris contrôle (vehicle) et aux souris traitées par HCQ (10 ring/kg)
(figure 2).
Détermination de la rétinopathie
Afin de démontrer que 1-accumulation dl-ICQ dans la partie arrière (rétine)
peut conduire à
des rétinopathies, les tests ci-après ont été réalisés.
Test de la falaise visuelle : Des souris ont été placées sur une feuille de
verre horizontale
sous laquelle on retrouve d'un côté, une surface à texture régulière (un
quadrillage) collée
immédiatement en dessous du verre et de l'autre côté, la même surface texturée
se trouvant
beaucoup plus bas que le verre. Le score est basé sur le pourcentage de pas
sur la partie
élevée et sur la partie au-dessus du vide est calculé.
Test de placement visuel : Des souris sont soulevées par la queue à environ 15
cm de
haut puis redescendus de manière décélérée vers le sol. Le score est basé sur
la distance
entre le nez de la souris et la grille avant que 1-animal ne tende ses membres
antérieurs en
direction de la grille.
Histologie : Des souris de 7 semaines ont subi 5 fois par semaine des
injections de 10
mg/kg d 1-ICQ ou 5, 10 et 15 mg/kg de 1-analogue CB137 pendant une durée de 62
jours.
Après 1-attribution crun numéro, les souris ont été randomisées selon leur
poids et traitement.
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
47
Les souris ont été réparties par 5 dans des cages, une souris ayant été
traitée avec le
véhicule, une avec HCQ 10 mg/kg, une avec CB137 5 mg/kg, une avec CB137 10
mg/kg et
une avec CB137 15 mg/kg. Les souris sont hébergées dans un environnement
maintenu à
une température de 22 C, 35-55% d'humidité et avec des cycles de
lumière/obscurité de
12h.
A la fin de 1-expérience, les souris sont euthanasiées par dislocation
cervicale. Les globes
oculaires sont isolés et conservés dans une solution contenant 4% de
paraformaldéhyde, 5%
de glutaraldéhyde et 0,1 M de cacodylate de sodium pendant une nuit à 4 C.
Les
échantillons sont lavés, déshydratés et incrustés dans de la paraffine. Les
sections
rétiniennes de 4 rnm sont colorées avec du bleu de toluidine à 1% suivi par 1%
de bleu de
méthylène. La toxicité rétinienne des échantillons est ensuite déterminée par
analyse des
coupes au microscope.
L'analyse histologique des rétines de souris traitées par HCQ, CB137 montre
que HCQ induit
des lésions rétiniennes. CB137, quant à lui, n induit pas plus de lésion que
chez les souris
contrôles (véhicule) (figures 3 et 4). La figure 3 représente deux
photographies
représentatives d-une coupe transversale de rétine (coloration toluidine et
bleu de méthylène)
avec la photo de gauche représentant la rétine d-un souris traitée par 10mg/
kg d 1-1CQ
(dommages rétinien indiqués par les flèches), et la photo de droite
représentant la rétine
saine dune souris traitée par 10mg/kg de CB137.
Efficacité du composé CB137 dans un modèle vascularite
Souris
Des souris femelles de souche C57131/6 issues du laboratoire Jackson, âgées de
8 à 10
semaines et pesant environ 20 g, sont utilisées dans toutes les expériences.
Les souris sont
maintenues à une température de 23 C 1 C avec un cycle lumière/obscurité
de 12h. Les
souris ont accès à Veau et à la nourriture ad libitum et sont hébergées au
moins une semaine
avant le début de toutes expériences.
Préparation del-anticorps anti-albumine sérique bovine (BSA)
La fraction gamma-globuline d-un sérum hyperinnnnun provenant d-un lapin
immunisé avec de
lâlbumine issu de sérum bovin (BSA) a été obtenu par précipitation au sulfate
d âmmonium
puis la fraction obtenue est dialysée. La concentration en immunoglobulines a
été évaluée
par un dosage protéique à 1-aide de la méthode de l'acide bicinchoninique
(BCA)
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
48
(ThernnoFisher, Strasbourg, France). L-enrichissement de I ânticorps anti-BSA
a été vérifié
par ELISA direct.
Modèle de vascularite pulmonaire induite par des complexes immuns
Un prélèvement de sang rétro-orbital a été réalisé grâce à des capillaires
contenant de
[héparine sur des souris anesthésiées à I isoflurane la veille de la
manipulation. Le
lendemain, les souris sont anesthésiées avec un mélange de kétamine et de
xylasine (90
mg/kg et 125 mg/kg respectivement). Le complexe immun IgG est induit dans les
poumons
par instillation intratrachéale de 0,5 mg d ânticorps de lapin anti-BSA (MP
Biomedicals,
Strasbourg, France) et parl-administration de 0,5 mg par souris d ântigène BSA
dans la veine
caudale (Werner et al., 2001 and Warren et al.; 1989). Le traitement indiqué
(PF-1355,
CB137 ou le solvant seul) est administré par voie entérale. Les animaux sont
euthanasiés 4
heures après instillation intratrachéale.
Prélèvement du fluide broncho-alvéolaire et quantification des cellules.
Les animaux sont euthanasiés 4 heures après linstillation intratrachéale par
une injection
létale de pentobarbital. Un prélèvement sanguin sous-mandibulaire est
effectué. La cage
thoracique est ouverte de manière à révéler les poumons et la trachée. Pour
récupérer le
fluide broncho-alvéolaire, une sonde est placée dans la trachée et les poumons
sont lavés
trois fois avec 0,5 mL de solution saline supplémentée de 2,5 nnM EDTA à pH
7,4. Les
cellules sont centrifugées après chaque lavage. Le surnageant du premier
lavage est
conservé pour mesurer 1-activité de la MPO et les surnageants issus des
lavages suivants
sont éliminés. Les culots cellulaires, pour chaque souris, sont rassemblés et
resuspendus
dans 200 1.1L de PBS. Les globules rouges sont éliminés à 1-aide d-une
solution hypotonique
(Lonza, Basel, Switzerland) Le nombre total de cellules, à 1-exclusion d-
éventuels globules
rouges résiduels et des cellules mortes colorées par le bleu de trypan, est
déterminé au
microscope optique sur une cellule de Malassez.
Cytonnétrie en flux
Les cellules issus des lavages broncho-alvéolaires sont placées dans du PBS
supplémenté
de 2,5 mM EDTA et 2% de sérum de veau f - tal et marquées à 4 C pendant 20
minutes à
I âide d ânticorps monoclonaux directement couplés à un fluorochrome : Rat
anti-Mouse
F4/80-APC (clone BM8 ; concentration finale 2 pg/mL ; eBiosciences,
Switzerland) ; Rat Anti-
Mouse Gr-1-PE (clone RB6-8C5 ; concentration finale 2 pg/mL ; BD, USA) et Rat
Anti-Mouse
CD45-FITC (clone 30F11 ; concentration finale 5 pg/mL ; BD, USA). Les cellules
sont ensuite
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
49
centrifugées (deux minutes à 300g), puis resuspendues dans du PBS supplémenté
de 2,5
mM EDTA et 2% de sérum de veau f - tal, et le marqueur de mort cellulaire 7-
AAD
(concentration final 1,25 pg/mL ; BD, USA) est ajouté afin d identifier les
cellules mortes. Les
données expérimentales sont acquises à I bide du FACSCalibur (BD, USA).
L'analyse par le
logiciel FlowJo (Treestar, OR, USA) permet d'exclure les cellules mortes (7-
AAD++) et de
quantifier les proportions de pneumocytes (CD45-), macrophages (CD45++ F4/80+
Gr-l+) et
neutrophiles (CD45+ F4/80- Gr-1++) dans le lavage broncho-alvéolaire.
[induction du modèle de vascularite induit une augmentation des neutrophiles
présents dans
les lavages broncho-alvéolaires. HCQ, semble légèrement augmenter la quantité
de
neutrophiles par rapport au contrôle +. En revanche, CB137 diminue la quantité
de
neutrophiles présente dans les poumons (figure 5).
Préparation des coupes de poumons.
Les poumons sont prélevés puis fixés dans du PFA 4% (1h à température ambiante
puis une
nuit à 4 C). Ils sont ensuite lavés dans deux bains de PBS 1X pendant 10
minutes. Ils sont
déshydratés dans une série de bains d éthanol (2 bains de 15 minutes) de
concentration
croissante (25%, 50%, 75%, 95% et 100%). Une fois déshydratés, les poumons
sont plongés
dans deux bains de toluène de 4h puis inclus dans la paraffine. Les blocs de
paraffine sont
ensuite coupés en coupe de 4 lm d'épaisseur. Les coupes de poumons sont
colorées à
rhématoxyline et à [éosine. Les lames sont plongées dans 2 bains de toluène
pendant 5
minutes puis dans des bains d'alcool de concentrations décroissantes (100%,
95%, 75%,
50% et 25%) pendant 5 minutes chaque bain puis dans 2 bains d -eau pendants
minutes. Les
lames sont ensuite plongées dans une solution d liématoxyline pendant 2,5
minutes et
rincées sous un filet d -eau pendant 15 minutes. Elles sont ensuite immergées
dans un bain
d -éosine pendant 5 minutes, rincées dans 2 bains d -éthanol 100% pendant 30
secondes puis
plongées dans 2 bains de toluène pendant 10 minutes.
Une série de coupes a été récupérées pour être colorées au trichrome de Masson
à I âide du
kit de coloration au trichrome selon Masson de Roth (#7089). La première
partie du protocole
est la même (toluène, éthanol puis eau). Les lames sont ensuite plongées dans
un bain
d liénnatoxyline du kit (solution A + B ratio 1 : 1) pendant 2,5 minutes puis
rincées sous un
filet d -eau pendant 15 minutes. Les lames sont plongées successivement dans
la coloration
de Goldner n 1 (5 minutes) puis dans I -acide acétique 1% (30 secondes), la
coloration de
CA 02988342 2017-12-05
WO 2016/193503 PCT/EP2016/062816
Goldner n 2 (2 minutes), dans I âcide acétique 1% (30 secondes) la coloration
de Goldner
n 3 (3 minutes), dans 1-acide acétique 1% (2 minutes), dans 2 bains d-éthanol
100% (2 x 3
secondes) et dans 2 bains de toluène (2 x 10 minutes).
5 Analyse histologique des coupes de poumons
Les coupes de poumons sont examinées sous un microscope optique (Axio LabA1 de
marque Zeiss) pour évaluer lintensité de linflux de neutrophiles, le niveau
d'hémorragie, et
repérer les altérations structurales. Un minimum de 10 champs au grossissement
400x est
analysé par animal.
Le CB137 et 11-ICQ permettent dinhiber les vascularites pulmonaires induites
par les
complexes immuns. Les souris sont traitées au PBS, à 11-ICQ (10 mg/kg) ou au
CB137 (10,
30 ou 100 mg/kg) per os avant dinduire des vascularites pulmonaires.
Brièvement, ces
vascularites sont induites en instillant un anticorps anti-BSA (50 pg) dans
les poumons et
I ântigène respectif dans la veine de la queue. Les photos (figure 6)
représentent des coupes
de poumons colorés à [éosine et hématoxyline. (a) contrôle négatif (b)
Induction des
complexes immuns (ImmComp) avec le solvant (c) avec 10 mg/kg dl-ICQ (d) avec
10 mg/kg
de CB137 (e) avec 30 mg/kg de CB137 (f) avec 100 mg/kg de CB137. Sur la figure
6, les
flèches en trait plein indiquent les vaisseaux sanguins. Il faut également
noter 1-afflux
important de neutrophiles (identifié par des flèches en pointillé) et
[hémorragie dans (b).
Ces résultats indiquent que le composé CB137 limite linflannnnation pulmonaire
induite par
les complexes immuns.