Note: Descriptions are shown in the official language in which they were submitted.
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
COMPOSITION CATALYTIQUE A BASE DE NICKEL EN PRESENCE D'UN
ACTIVATEUR SPECIFIQUE ET SON
UTILISATION DANS UN PROCEDE D'OLIGOMERISATION DES OLEFINES
La présente invention concerne une nouvelle composition à base de nickel.
L'invention concerne également l'utilisation de ladite composition comme
catalyseur
de réactions de transformations chimiques.
Art antérieur
II est connu de préparer des compositions catalytiques à base de métaux de
transition pour leur application dans divers domaines de la chimie, notamment
dans
le domaine des transformations catalytiques tels que l'hydroformylation,
l'hydrogénation, le couplage croisé, l'oligomérisation des oléfines...
La préparation de telles compositions catalytiques passe par le choix du
métal, de
l'activateur et des ligands adaptés.
Le document EP 2 220 099 Bi décrit un système de complexes de coordination
comprenant des ligands multidentes ayant la formule: Ri-S02-NH-P(XR2)2; ou R1-
S02-N=PH(XR2)2, ou R1-SO(OH).NP(XR2)2, dans lesquels X est indépendamment
0, S, NH, ou une liaison; dans lequel R1 et R2 sont indépendamment choisis
parmi un
groupe alkyle substitué ou non et un groupe aryle, dans lequel au moins un
équivalent de ligand est complexé à un équivalent d'un métal choisi parmi le
rhodium, l'iridium, le platine, le palladium et les lanthanides. EP 2 220 099
Bi indique
que le système de complexe de coordination peut être utilisé en tant que
catalyseur
pour l'hydroformylation, l'hydrogénation, l'hydrogénation, la polymérisation,
l'isomérisation...Ce document ne décrit pas un système catalytique à base de
nickel
de degré d'oxydation (+II) et ne mentionne pas l'utilisation d'activateur
spécifique
selon l'invention, notamment dans un procédé d'oligomérisation des oléfines.
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
2
La demanderesse dans ses recherches a mis au point une nouvelle composition
comprenant un précurseur de nickel, un ligand sulfonamido-phosphine ou un
mélange de sulfonamides avec des halogénures de phosphine optionnellement en
présence d'une base de Lewis, et au moins un activateur spécifique. Il a été
constaté
de manière surprenante que de telles compositions présentent des propriétés
catalytiques intéressantes. En particulier, ces compositions présentent une
bonne
activité catalytique et une bonne sélectivité dans l'oligomerisation des
oléfines, en
particulier dans la dimérisation de l'éthylène en butène-1.
Un objectif de l'invention est de fournir une nouvelle composition à base de
nickel
(+11). Un autre objectif de l'invention est de proposer un nouveau système
catalytique
comprenant ladite composition pour des réactions de transformations chimiques,
en
particulier pour l'oligomerisation des oléfines.
Description détaillée de l'invention
Composition selon l'invention
La composition catalytique selon l'invention comprend:
- au moins un précurseur de nickel de degré d'oxydation (+11),
- au moins un activateur de formule [R3_mAIXm]n, le groupement X étant un
groupement alcoxy -OR ou un halogène, les groupements R étant identiques
ou différents entre eux et choisis parmi les groupements alkyles ou
aromatiques, n prend une valeur de 1 à 2, m prend une valeur de 1 à 3,
- et au moins un mélange d'un halogénure de phosphine YP(AR1a)(A'Rlb) et
d'un composé sulfonamide de formule R2S02NH2, optionnellement en
présence d'une base de Lewis notée Z,
dans laquelle
- A et A', identiques ou différents, sont indépendamment 0, S, NR3, ou une
liaison simple entre l'atome de phosphore et un atome de carbone,
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
3
- le groupement R3 est soit un atome d'hydrogène, soit un groupement alkyle
cyclique ou non, substitué ou non et contenant ou non des hétéroéléments, ou
un groupement aromatique, substitué ou non et contenant ou non des
hétéroéléments,
- les groupements R1, représentés par Ria et R1b, avec Ria et Rb étant
identiques ou différents entre eux, liés ou non entre eux, sont choisis parmi
les
groupements alkyles cycliques ou non, substitués ou non et contenant ou non
des hétéroéléments, et parmi les groupements aromatiques, substitués ou non
et contenant ou non des hétéroéléments,
- le groupement R2 est choisi parmi les groupements alkyles cycliques ou non,
substitués ou non et contenant ou non des hétéroéléments, les groupements
aromatiques substitués ou non et contenant ou non des hétéroéléments,
- le groupement Y étant un halogène, de préférence un chlore.
Selon une variante de l'invention, la composition catalytique selon
l'invention
comprend:
- au moins un précurseur de nickel de degré d'oxydation (+II),
- au moins un activateur de formule [R3_mAIXm]n, le groupement X étant un
groupement alcoxy -OR ou un halogène, les groupements R étant identiques
ou différents entre eux et choisis parmi les groupements alkyles ou
aromatiques, n prend une valeur de 1 à 2, m prend une valeur de 1 à 3,
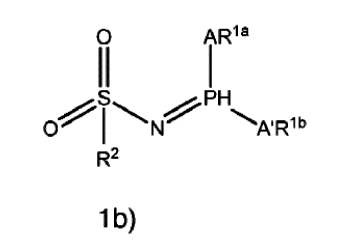
- et au moins un ligand répondant aux formes tautomériques de formule la),
lb) et/ou 1 c)
O 0 OH
Il
Il A1 Ria A1Ria
1 AI
Ria
S P S PH S P
OIN ARlb () 1 N A'Rlb (21N A'Rlb
R2 H R2 R2
la) lb) 1 c)
éventuellement en présence d'une base de Lewis notée Z,
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
4
composition dans laquelle
- A et A', identiques ou différents, sont indépendamment 0, S, NR3, ou une
liaison simple entre l'atome de phosphore et un atome de carbone,
- le groupement R3 est soit un atome d'hydrogène, soit un groupement alkyle
cyclique ou non, substitué ou non et contenant ou non des hétéroéléments, ou
un groupement aromatique, substitué ou non et contenant ou non des
hétéroéléments,
- les groupements Ri, représentés sur les formules la), lb) et 1c) par Ria
et
Rib, avec Ria et Rb étant identiques ou différents entre eux, liés ou non
entre
eux, sont choisis parmi les groupements alkyles cycliques ou non, substitués
ou non et contenant ou non des hétéroéléments, et parmi les groupements
aromatiques, substitués ou non et contenant ou non des hétéroéléments,
- le groupement R2 est choisi parmi les groupements alkyles cycliques ou
non,
substitués ou non et contenant ou non des hétéroéléments, les groupements
aromatiques substitués ou non et contenant ou non des hétéroéléments.
Au sens de la présente invention, on entend par alkyle une chaîne
hydrocarbonée linéaire ou ramifiée ayant de 1 à 15 atomes de carbone, de
préférence de 1 à 10. Des groupes alkyles préférés sont par exemple
avantageusement choisis parmi les groupes méthyle, éthyle, propyle,
isopropyle,
butyle, isobutyle et tertio-butyle. Ces groupements alkyles peuvent être
substitués
par des hétéroéléments ou des groupes contenant des hétéroéléments tels qu'un
halogénure, un alcoxy. On entend par un substituant alcoxy , un groupe
alky1-0-
dans lequel le terme alkyle a la signification donnée ci-dessus. Des exemples
préférés de substituants alcoxy sont les groupes méthoxy ou éthoxy.
Par alkyle cyclique , on entend un groupe hydrocarboné monocyclique ayant
un
nombre d'atomes de carbone supérieur à 3, de préférence entre 4 et 24, de
manière
plus préférée entre 5 et 12, de préférence un groupe cyclopentyle,
cyclohexyle,
cyclooctyle ou cyclododécyle, ou polycyclique (bi- ou tricyclique) ayant un
nombre
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
d'atomes de carbone supérieur à 3, de préférence entre 4 et 18, tels que par
exemple les groupes adamantyle ou norbornyle.
Par aromatique , on entend un groupe mono- ou polycyclique aromatique, de
5 préférence mono- ou bicyclique, ayant un nombre d'atomes de carbone entre
5
et 20. Lorsque le groupe est polycyclique, c'est-à-dire qu'il comprend plus
d'un noyau
cyclique, les noyaux cycliques peuvent avantageusement être condensés deux à
deux ou rattachés deux à deux par des liaisons a. Le groupe aromatique selon
l'invention peut contenir des hétéroéléments tels l'azote, l'oxygène ou le
soufre.
Lorsque les groupements alkyles ou aryles sont substitués par des
hétéroéléments
ou contiennent des hétéroéléments, ces hétéroéléments sont de préférence
choisis
parmi l'oxygène, l'azote, le soufre ou le phosphore.
Le terme ligand selon la présente invention est indifféremment utilisé pour
signifier
une ou plusieurs des formes tautomériques répondant à la formule la), lb), 1c)
utilisée(s) pour former la composition selon l'invention.
Avantageusement selon l'invention, les groupements Ri, soit Ria et Rib,
identiques
.. ou différents, liés ou non entre eux, sont indépendamment choisis parmi les
groupements alkyles cycliques ou non substitués ou non et contenant ou non des
hétéroéléments, de préférence parmi les groupements alkyles comprenant 1 à 15
atomes de carbones, de préférence 1 à 10 atomes de carbone et contenant ou non
des hétéroéléments; et parmi les groupements aromatiques, substitués ou non et
contenant ou non des hétéroéléments, de préférence les groupements aromatiques
comprenant 5 à 20 atomes de carbone; substitués ou non, contenant des
hétéroéléments ou non.
Les deux groupements Ri (Ria et Rb) peuvent être identiques ou différents
entre
eux. Ces deux groupements Ria et Rb peuvent également être liés entre eux.
Dans
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
6
un tel cas, les deux groupements Ria et Rib peuvent correspondre à des
groupements tels que le bis-phényle, le bis-naphthyle.
De préférence, les groupements Ri, soit Ria et Rib, identiques ou différents,
liés ou
non entre eux, sont indépendamment choisis parmi les groupements méthyle,
trifluorométhyle, éthyle, n-propyle, i-propyle, n-butyle, i-butyle, t-butyle,
pentyle,
cyclohexyle, adamantyle, substitués ou non, contenant ou non des
hétéroéléments;
les groupements phényle, o-tolyle, m-tolyle, p-tolyle, mésityle, 3,5-
diméthylphényle,
4-n-butylephényle, 4-méthoxyphényle, 2-méthoxyphényle, 3-méthoxyphényle, 4-
méthoxyphényle, 2-isopropoxyphényle, 4-méthoxy-3,5-diméthylphényle, 3,5-ditert-
buty1-4-méthoxyphényle, 4-chlorophenyle, 3,5-di(trifluorométhyl)phényle,
benzyle,
naphthyle, bisnaphthyle, pyridyle, bisphényle, furanyle, thiophényle,
substitués ou
non, contenant des hétéroéléments ou non. De préférence, les groupements Ri,
soit
Ria et Rib , identiques ou différents, liés ou non entre eux, sont
indépendamment
choisis parmi les groupements phényle, o-tolyle, m-tolyle, p-tolyle, mésityle,
3,5-
diméthylphényle, 4-n-butylephényle, 4-méthoxyphényle, 2-méthoxyphényle, 3-
méthoxyphényle, 4-méthoxyphényle, 2-isopropoxyphényle,
4-méthoxy-3,5-
diméthylphényle, 3,5-ditert-buty1-4-méthoxyphényle, 4-chlorophenyle,
3,5-
di(trifluorométhyl)phényle, benzyle, naphthyle, bisnaphthyle, pyridyle,
bisphényle,
furanyle, thiophényle, substitués ou non, contenant des hétéroéléments ou non.
De
préférence, les groupements Ri, soit Ria et Rib sont choisis parmi les
groupements
phényle ou o-tolyle.
Avantageusement selon l'invention, les groupements R2 sont choisis parmi les
groupements alkyles cycliques ou non, substitués ou non et contenant ou non
des
hétéroéléments, de préférence parmi les groupements alkyles comprenant 1 à 15
atomes de carbone, de préférence 1 à 10 atomes de carbone et contenant ou non
des hétéroéléments; et parmi les groupements aromatiques substitués ou non et
contenant ou non des hétéroéléments, de préférence les groupements aromatiques
comprenant 5 à 20 atomes de carbone; substitués ou non, contenant des
hétéroéléments ou non.
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
7
De préférence, les groupements R2 sont choisis parmi les groupements méthyle,
trifluorométhyle, éthyle, n-propyle, i-propyle, n-butyle, i-butyle, t-butyle,
pentyle,
cyclohexyle, adamantyle, substitués ou non, contenant des hétéroéléments ou
non ;
les groupements phényle, o-tolyle, m-tolyle, p-tolyle, mésityle, 3,5-
diméthylphényle,
4-n-butylephényle, 4-méthoxyphényle, 2-méthoxyphényle, 3-méthoxyphényle, 4-
méthoxyphényle, 2-isopropoxyphényle, 4-méthoxy-3,5-diméthylphényle, 3,5-ditert-
buty1-4-méthoxyphényle, 4-chlorophenyle, 3,5-bis(trifluorométhyl)phényle,
benzyle,
naphthyle, bisnaphthyle, pyridyle, bisphényle, furanyle, thiophényle,
substitués ou
non, contenant des hétéroéléments ou non. De préférence, le groupement R2 est
le
trifluorométhyle ou le 4-n-butylephényle.
Avantageusement selon l'invention, le groupement R3 est soit un atome
d'hydrogène,
soit un groupement alkyle cyclique ou non, substitué ou non et contenant ou
non des
hétéroéléments, de préférence un groupement alkyle comprenant 1 à 15 atomes de
carbone, de préférence 1 à 10 atomes de carbone et contenant ou non des
hétéroéléments; ou un groupement aromatique, substitué ou non et contenant ou
non des hétéroéléments, de préférence un groupement aromatique comprenant 5 à
atomes de carbone; substitués ou non, contenant des hétéroéléments ou non. De
préférence le groupement R3 est soit un atome d'hydrogène, soit un groupement
20 alkyle selon l'invention.
La composition selon l'invention comprend le mélange de l'halogénure de
phosphine
YP(AR1a)(A'Rlb) et du composé sulfonamide de formule R2S02NH2, en présence
d'une base de Lewis notée Z.
Ledit mélange, par une réaction de condensation de l'halogénure de phosphine
YP(AR1a)(A'Rlb) et du composé sulfonamide de formule R2S02NH2, en présence
d'une base de Lewis notée Z est susceptible de former le ligand répondant aux
formes tautomériques de formule la), 1b) et/ou 1c).
La composition selon l'invention comprend un activateur de formule [R3_mAIXAn,
le
groupement X étant un groupement alcoxy ¨OR ou un halogène, les groupements R
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
8
étant identiques ou différents entre eux et choisis parmi les groupements
alkyles ou
aromatiques, n prend une valeur de 1 à 2, m prend une valeur de 1 à 3. De
préférence, les indices m et n de l'activateur [R3_mAIXm],-, sont des entiers.
De
préférence m est compris entre 1 et 2.
De préférence, l'activateur est le chlorure de diéthylaluminium (Et2AICI)
et/ou l'éthoxy
diéthylaluminium (Et2A10Et). Les activateurs de formule [R3_,,A1Xm]i peuvent
être
générés à partir de l'association de trialkylaluminium AIR3 et d'au moins un
alcool de
type ROH.
La composition selon l'invention peut également comprendre une base de Lewis
notée Z. Cette base de Lewis Z selon l'invention peut être un éther 0(R4)2 ou
une
amine tertiaire N(R4)3, les groupements R4 identiques ou différents entre eux,
liés ou
non entre eux, sont indépendamment choisis parmi les groupements alkyles
cycliques ou non, substitués ou non et contenant ou non des hétéroéléments, de
préférence parmi les groupements alkyles comprenant 1 à 15 atomes de carbones,
de préférence 1 à 10 atomes de carbone et contenant ou non des hétéroéléments;
et
parmi les groupements aromatiques, substitués ou non et contenant ou non des
hétéroéléments, de préférence les groupements aromatiques comprenant 5 à 20
atomes de carbone; substitués ou non, contenant des hétéroéléments ou non.
L'éther est de préférence choisi parmi le diéthyléther, le méthyl tert-butyl
éther, le di-
tert-butyl éther, le tétrahydrofurane ou le dioxane, pris seul ou en mélange.
L'amine
tertiaire est de préférence choisie parmi la triéthylamine, la pyridine, le
1,4-
diazabicyclo[2.2.2]octane, le 1,8-diazabicyclo[5.4.0]undéc-7-ène ou la N-
méthylmorpholine, prise seule ou en mélange.
Lorsque la composition selon l'invention comprend la base de Lewis, celle-ci
peut
former avec le ligand de formes tautomériques la), lb) et/ou 1c) un adduit 1d)
répondant à la formule correspondant à la).Z, 1b).Z et/ou 1c).Z.
Dans une variante, dans le cas où la composition selon l'invention comprend la
base
de Lewis Z, la composition peut comprendre en plus des formes tautomériques
la),
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
9
lb) et/ou 1c) au moins un adduit 1d) formé entre lesdites formes tautomériques
et la
base de Lewis Z et répondant à la formule 1a).Z, 1b).Z et/ou 1c).Z. Dans un
tel cas,
ces adduits peuvent coexister avec les formes tautomériques la), 1b) et/ou
1c).
Dans le cas où la composition selon l'invention comprend le mélange d'un
halogénure de phosphine YP(AR1a)(A'Rlb) et d'un composé sulfonamide de formule
R2S02NH2, l' adduit 1d) est susceptible d'être formé en présence de la base de
Lewis Z.
De préférence, l'adduit 1d) est l'adduit formé avec l'amine tertiaire de
formule
1a).N(R4)3, R4 répondant aux spécifications selon l'invention. De manière plus
préférée, l'adduit 1d) est de formule 1a).NEt3.
Les compositions selon l'invention peuvent être en présence ou non de solvant.
On
peut utiliser un solvant choisi parmi les solvants organiques et en
particulier parmi les
éthers, les alcools, les solvants chlorés et les hydrocarbures saturés,
insaturés,
aromatiques ou non, cycliques ou non. De préférence, le solvant est choisi
parmi
l'hexane, le cyclohexane, le méthylecyclohexane, l'heptane, le butane ou
l'isobutane,
les monooléfines ou dioléfines comportant de préférence 4 à 20 atomes de
carbone,
le cycloocta-1,5-diène, le benzène, le toluène, l'orthoxylène, le mésitylène,
l'éthylbenzène, le dichlorométhane, le chlorobenzène, le méthanol, l'éthanol,
purs ou
en mélange, et les liquides ioniques. Dans le cas où le solvant est un liquide
ionique,
il est avantageusement choisi parmi les liquides ioniques décrits dans les
brevets US
6,951,831 B2 et FR 2895406 B1.
Avantageusement selon l'invention, le précurseur de nickel de degré
d'oxydation
(+11), est choisi parmi le chlorure de nickel(11), le chlorure de
nickel(II)(diméthoxyéthane), le bromure de nickel(11), le bromure de
nickel(II)(diméthoxyéthane), le fluorure de nickel(11), l'iodure de
nickel(11), le sulfate de
nickel(11), le carbonate de nickel(11), le dimethylglyoxime de nickel(11),
l'hydroxyde de
nickel(11), l'hydroxyacétate de nickel(11), l'oxalate de nickel(11), les
carboxylates de
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
nickel(11) tels que par exemple le 2-éthylhexanoate de nickel(11), l'acétate
de nickel(11),
le trifluoroacétate de nickel(11), le triflate de nickel(11),
l'acétylacétonate de nickel(11),
l'hexafluoroacétylacétonate de nickel(11), les phénates de nickel(11), le
chlorure de
allylnickel(11), le bromure de allylnickel(11), le dimère du chlorure de
methallylnickel(11),
5 l'hexafluorophosphate de allylnickel(11), l'hexafluorophosphate de
methallylnickel(11),
le biscyclopentadienyle de nickel(11), le bisallyl de nickel(11) et le
bisméthallyl
nickel(11); sous leur forme hydratée ou non, pris seul ou en mélange.
Selon l'invention, le rapport molaire entre le ligand de formule la), lb), 1c)
et/ou 1d)
10 et le précurseur de nickel est de préférence compris entre 0,05 et 10,
de préférence
entre 0,5 et 3.
Selon l'invention, le rapport molaire entre l'activateur et le précurseur de
nickel est de
préférence compris entre 1 et 500, de préférence compris entre 1 et 100, de
préférence de 1 à 30, de préférence compris entre 2 et 15.
Une liste non exhaustive de ligands pouvant convenir à la préparation des
compositions selon l'invention est représentée ci-dessous. Les ligands sont
représentés sous leurs formes limites la) et 1b).
CA 03002161 2018-04-16
WO 2017/072026 PCT/EP2016/075288
11
O o
% A21 Bu Bu
\
101 HN-PPh2 1
/01 \N-=-PHPh2 ilb H\ .
N.... * N--
--PH
Bu Bu
0 0 0/ o, o'S
% ,o % ,o
s s
lel IIN-PPh2 1$1 \N.---PHPh2
Br Br
0
% 0 0
e % 0
* H\N--
S
/
\ / P * N--
--PH
HN-PPh2
1.1 \N d
=PHPh2 S S
`o = o"o
o
o
o o
%,o %,o
s ,s
F3c' \ F3c \
HN-PPh2 N=--PHPh2
* H\ .
N--.. 4,* N--
0 0 0
/ P / --PH
% 0 % S S
0/ \O 0"O
\
. / Ille
lel HN-PPh2 101 \N=--PHPh2
Br Br ,0 0
0 ID .
* 1
\\S e o 0 = lib ,N
pH
s'N---. \\SeS/ .---..ePH
/ F3C' \ 1='H el 0/ \O 00
H lie, N
. .
0 0 0 0
% A21 % 0
e
\ \ gel \NPHEt2
-__
101 HN-PPr2 101 \N=PHPr2 101 HN-PEt2
Bu Bu Bu Bu
0 0 0 0
e
1.\ \
HN-PPr2 101 \N=PHPr2 HN-PEt2 101 \N=--PHEt2
0
% 0 0 0 0
e % 0
% 0
% 0
\ \
HN-PPr2 *I \N=--PHPr2 101 HN-PEt2 1. \N=--PHEt2
\
0 \
0 0
0
0 0 0
% 2C, % 0 0
% % 0
,S ,S
F3C" \ F3C \ F3C" \ F3C \
HN-PPr2 N=--PHPr2 HN-PEt2 N=PHEt2
0 0 0 0
% 0 % 0 % 0 %e0
e
gOl\ \
HN-PPr2 = \N=--PHPr2 101 HN-PEt2 101 \N-=-PHEt2
Br Br Br Br
CA 03002161 2018-04-16
WO 2017/072026 PCT/EP2016/075288
12
o o
o % ,o o
s' % o
s-
HN-PCy2
,o
0 \ (0> \N=PHCy2 ( e
HN-PCy2 11> \ = \N=PHBu2
Bu
IN-PBu2
Bu Bu Bu
0 0
\\s#0 0 0 0
S
11101 I \IN-PCy2 N=PHCy2 \
IIN-PBu2 N=PHBu2
0 0
% 0 0 0
S
HN-PCy2 1. \ ô \NPHCy2 I. = \HN-PBu le \N=PHBu 2
2
0 0 0 0
0 0
,S % #0 % 0
,S
F3C \ F3C" \ S
HN-PCy2 N=PHCy2 F3C \ F3C" \
N=PHBu2
HN-PBu2
0 0
% 0 %0 0 # 0
e S % 0 %0
le \ . \N=PHCy2 i HN-PCy2 \ .
\N=PHBu2
HN-PBu2
Br Br Br Br
0 0 0
% 1::)
S 0 S
0 \ f 1 1 . \N=P/H
Dok
Ph
P-NH
HN-P /
\ \Bu 0
Bu Bu Bu Bu
0 0
% #0 % 0
S
es \ /Ph Ph
HN-P 0
\ I. S\ Ph
0
\ / Bu Bu P-NH te
/
0 0 0
* IO \ f o 1 k 1 S\ ,Ph
/Ph =
HN-P
\ \
Br Bu Br Bu 0
o
o o \ /
P-NH
0
S /
0
ei \ Ph go \ ok /.. Br
HN-P Nr---PH\
\
0 Bu 0 Bu
0
0O
0, e
% o / o s
s
,S \ re
P-NH
F3C \ Ph Dk
F3C" \ /' " /
HN-P\ NPH 0 /
= 0
Bu \
Bu
OQ
(JN
o s,
\ / -
P-NH CF 3
/
0
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
13
Préparation de la composition selon l'invention
La composition selon l'invention peut être obtenue par un mélange entre
l'halogénure
de phosphine YP(ARia)(A'Rib) et le composé sulfonamide de formule R2S02NH2, en
présence de la base de Lewis notée Z, du précurseur de nickel de degré
d'oxydation
(+II), de l'activateur de formule [R3_mAIXm]n.
La composition selon l'invention peut également être obtenue par un mélange du
ligand répondant aux formes tautomériques de formule la), lb) et/ou 1c), du
précurseur de nickel de degré d'oxydation (+II) et de l'activateur de formule
[R3_
mAIXm]n.
Ces compositions peuvent comprendre en outre au moins l'adduit 1d).
Utilisation de la composition selon l'invention
Les compositions selon l'invention peuvent être utilisées comme catalyseur
dans une
réaction de transformation chimique, telle que la réaction d'hydrogénation,
d'hydroformylation, de couplage croisé ou d'oligomerisation des oléfines. En
particulier, ces compositions sont utilisées dans un procédé d'oligomérisation
d'une
charge d'oléfines ayant avantageusement 2 à 10 atomes de carbone.
De préférence, le procédé d'oligomerisation est un procédé de dimérisation de
l'éthylène en butène-1.
Le solvant du procédé d'oligomérisation peut être choisi parmi les solvants
organiques et de préférence parmi les éthers, les alcools, les solvants
chlorés et les
hydrocarbures saturés, insaturés, aromatiques ou non, cycliques ou non. En
particulier, ledit solvant est choisi parmi l'hexane, le cyclohexane, le
méthylecyclohexane, l'heptane, le butane ou l'isobutane, les monooléfines ou
dioléfines comportant de préférence 4 à 20 atomes de carbone, le benzène, le
toluène, l'orthoxylène, le mésitylène, l'éthylbenzène, le dichlorométhane, le
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
14
chlorobenzène, le méthanol, l'éthanol, purs ou en mélange, et les liquides
ioniques.
Dans le cas où ledit solvant de réaction est un liquide ionique, il est
avantageusement choisi parmi les liquides ioniques décrits dans les brevets US
6,951,831 B2 et FR 2895406 B1.
L'oligomérisation est définie comme la transformation d'une unité monomère en
un
composé ou mélange de composés de formule générale CpH2p avec 4 p 80, de
préférence avec 4 p 50, de manière préférée avec 4 p 26 et de manière plus
préférée avec 4 p 14.
Les oléfines utilisées dans le procédé d'oligomérisation sont des oléfines
comportant
de 2 à 10 atomes de carbone. De préférence, lesdites oléfines sont choisies
parmi
l'éthylène, le propylène, les n¨butènes et les n¨pentènes, seules ou en
mélange,
pures ou diluées. De manière préférée, l'oléfine utilisée dans le procédé
d'oligomérisation est l'éthylène.
Dans le cas où lesdites oléfines sont diluées, lesdites oléfines sont diluées
par un ou
plusieurs alcane(s), tels qu'on les trouve dans des coupes issues des
procédés
de raffinage du pétrole, comme le craquage catalytique ou le craquage à la
vapeur.
Lesdites oléfines de la charge peuvent provenir de ressources non fossiles
telles que
la biomasse. Par exemple, les oléfines utilisées dans le procédé
d'oligomérisation
selon l'invention peuvent être produites à partir d'alcools, et en particulier
par
déshydratation des alcools.
La concentration du nickel dans le réacteur est avantageusement comprise
entre 1.10-8 et 1 mol/L, et de préférence entre 1.10-6 et 1.10-2 mol/L.
Le procédé d'oligomérisation opère avantageusement à une pression totale
comprise
entre la pression atmosphérique et 20 MPa, de préférence entre 0,1 et 8 MPa,
et à
une température comprise entre -40 et +250 C, de préférence entre -20 C et 150
C.
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
La chaleur engendrée par la réaction peut être éliminée par tous les moyens
connus
de l'homme du métier.
Dans une mise en oeuvre particulière, le procédé d'oligomérisation selon
l'invention
5 comprend
a) une étape de condensation d'un halogénure de phosphine YP(AR1a)(A'Rlb) et
d'un composé sulfonamide de formule R2S02NH2, optionnellement en
présence de la base de Lewis selon l'invention,
b) optionnellement une étape de séparation du produit réactionnel issu de
10 l'étape a) pour obtenir le ligand répondant aux formes tautomériques
la), 1b)
et/ou 1c), et/ou
éventuellement l'adduit 1d),
c) une étape de mise en contact de la charge avec le produit réactionnel issu
de
l'étape a) ou le ligand répondant aux formes tautomériques la), 1b) et/ou 1c),
15 et/ou éventuellement l'adduit 1d) issu de l'étape b) de séparation,
le
précurseur de nickel et l'activateur.
On entend par étape de séparation toute étape de purification du produit
réactionnel
de l'étape a) permettant d'isoler des impuretés le ligand de formule la), lb),
1c)
ou 1d) ou leur mélange. L'étape de séparation peut être par exemple une étape
de
filtration.
L'étape a) est de préférence réalisée à une température comprise entre -80 et
120 C, avantageusement dans un solvant organique. La base de Lewis peut être
utilisée en excès par rapport aux réactifs de la réaction de condensation de
l'étape
a), par exemple entre 1,1 et 3 équivalents pour un équivalent de réactif. Les
réactifs
halogénure de phosphine YP(AR1a)(A'Rlb) et composé sulfonamide de formule
R2S02NH2 sont avantageusement mis à réagir en quantité stoechiométrique.
L'halogénure de phosphine YP(AR1a)(A'Rlb) peut être utilisé par rapport au
composé
sulfonamide de formule R2S02NH2 dans un ratio molaire compris entre 0,2 et 1.
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
16
Le procédé d'oligomérisation peut être conduit en système fermé, en système
semi-
ouvert ou en continu, avec un ou plusieurs étages de réaction. Une vigoureuse
agitation est avantageusement mise en oeuvre pour assurer un bon contact entre
le
ou les réactifs et le système catalytique.
Avantageusement, le procédé d'oligomérisation est mis en oeuvre par
l'introduction
d'un mélange du précurseur de nickel et du ligand et/ou éventuellement de
l'adduit
1d) issu de l'étape b) de séparation, ou d'un mélange du précurseur de nickel
et du
produit réactionnel issu de l'étape a) d'une part, et l'introduction de
l'activateur
d'autre part, dans un réacteur en présence de la charge muni des dispositifs
habituels d'agitation, de chauffage et de refroidissement.
Le procédé d'oligomérisation peut être mis en oeuvre en discontinu. Dans ce
cas, un
volume choisi de la solution comprenant la composition selon l'invention est
introduit
dans un réacteur muni des dispositifs habituels d'agitation, de chauffage et
de
refroidissement.
Le procédé d'oligomérisation peut également être mis en oeuvre en continu.
Dans ce
cas, les solutions comprenant les éléments de la composition selon l'invention
sont
injectées en même temps que l'oléfine dans un réacteur agité par les moyens
mécaniques classiques ou par une recirculation extérieure, et maintenue à la
température souhaitée.
La composition catalytique est détruite par tout moyen habituel connu par
l'homme
du métier, puis les produits de la réaction ainsi que le solvant sont séparés,
par
exemple par distillation. L'oléfine qui n'a pas été transformée peut être
recyclée dans
le réacteur.
Le procédé selon l'invention peut être mis en oeuvre dans un réacteur à un ou
plusieurs étages de réaction en série, la charge oléfinique et/ou la
composition
catalytique au préalable pré-conditionnée étant introduites en continu, soit
dans le
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
17
premier étage, soit dans le premier et un autre quelconque des étages. A la
sortie du
réacteur, la composition catalytique peut être désactivée, par exemple par
injection
d'ammoniac et/ou d'une solution aqueuse de soude et/ou d'une solution aqueuse
d'acide sulfurique. Les oléfines non converties et les alcanes éventuellement
.. présents dans la charge sont ensuite séparés des oligomères par
distillation.
Les produits du présent procédé peuvent trouver une application par exemple
comme composants de carburants pour automobiles, comme charges dans un
procédé d'hydroformylation pour la synthèse d'aldéhydes et d'alcools, comme
composants pour l'industrie chimique, pharmaceutique ou la parfumerie et/ou
comme
charges dans un procédé de métathèse pour la synthèse de propylène par
exemple.
Les exemples suivants illustrent l'invention sans en limiter la portée.
Exemple 1 :
Synthèse des ligands isolés
Synthèse du ligand SP1
Du trifluorométhane sulfonamide (2,4 g, 16 mmol, 1 eq.) et de la triéthylamine
Z
(4,2 g, 40 mmol, 2,6 eq., 6 mL) sont solubilisés dans 30 mL de
tétrahydrofurane
(THF). Dans un deuxième Schlenk, la di(o-tolyl)chlorophosphine est solubilisée
avec
10 mL de THF. La solution de chlorophosphine (4g, 16 mmol, 1 eq.) dans 10 mL
de
THF est ajoutée goutte-à-goutte à la solution de sulfonamide pour produire un
précipité blanc. Après 20 min, le mélange est filtré et le solide est rincé
deux fois
avec 10 mL de THF. La phase liquide est évaporée sous vide pour obtenir une
huile
incolore. 20 mL de diéthyléther sont rajoutés à ladite huile pour précipiter
une poudre
blanche. La poudre est rincée trois fois avec 5 mL de diéthyléther. Après
séchage
sous vide, on obtient 2,52 g de poudre soit un rendement de 68%.
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
18
Le produit SP1 majoritaire correspondant à la forme tautomérique 1d) = 1a).Z
avec Z
= NEt3 est caractérisé par spectroscopie 3113{1H} RMN (C6D6), 31P RMN (C6D6),
1H
RMN (C6D6) et 13C NMR (C6D6).
31P NMR (C6D6) :22,6.
oµ ho*
,\s/õP
F3C N *
rH
Spi
)
SP1
Synthèse du ligand SP2
Du trifluorométhane sulfonamide (2,4 g, 16 mmol, 1 eq.) et de la triéthylamine
Z
(4,2 g, 40 mmol, 2,6 eq., 6 mL) sont solubilisés dans 30 mL de de
tétrahydrofurane
(THF). Dans un deuxième Schlenk, la di(o-tolyl)chlorophosphine est solubilisée
avec 10 mL de THF. La solution de chlorophosphine (4 g, 16 mmol, 1 eq.) dans
10
mL de THF est ajoutée goutte-à-goutte à la solution de sulfonamide pour
produire un
précipité blanc. Après 20 min, le mélange est filtré et le solide est rincé
deux fois
avec 10 mL de THF. La triéthylamine est éliminée sous vide à 50 C. Le ligand
précipité est rincé trois fois avec 5 mL de diéthyléther. Après séchage sous
vide, on
obtient 3,46 g de poudre soit un rendement de 60%.
Le produit 5P2 majoritaire correspondant à la forme tautomérique 1b) est
caractérisé
par spectroscopie 3113{1H} RMN (C6D6), 31P RMN (C6D6), 1H RMN (C6D6) et 13C
NMR
(C6D6).
31P NMR (C6D6) : 15,8.
1101
oõ0
F3c-\si-NP1-1.
SP2
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
19
Synthèse du ligand SP3
La synthèse du ligand SP3 correspondant à la forme tautomérique la) a été
réalisée
selon la méthode décrite dans la littérature : F. G. Terrade, Eur. J. lnorg.
Chem.
2014, 1826-1835.
IO
0õ0
nBu ô \Sis P go
H
SP3
Synthèse du ligand L (comparatif)
La synthèse de L a été réalisée selon la méthode décrite dans la littérature :
M. S.
Balakrishna, J. Organomet. Chem. 1990, 203-216.
H
N p
IgOl
1.1
L
Mise en oeuvre du test d'oligomérisation de l'éthylène
La nature des composants (précurseur de nickel(11), ligand et activateur)
ainsi que
leur quantité dans les différents tests catalytiques sont décrites dans le
Tableau 1.
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
Le toluène (94 mL) est introduit dans le réacteur qui est chauffé à 40 C. 5 mL
de la
solution contenant le précurseur de nickel (avec nNi = 10 mol) et le ligand
sont alors
ajoutés. Le milieu réactionnel est agité 15 minutes sous environ 2 bars
d'éthylène. Le
réacteur est ensuite dégazé. 1 ml de solution contenant l'activateur est alors
ajouté.
5 Le réacteur est rapidement mis sous pression (30 bar d'éthylène). Le
réacteur est
alors chauffé à 40 C.
Le test est arrêté après 50 g d'éthylène introduits ou après le temps de
réaction
indiqué dans le tableau 1. Le réacteur est alors dépressurisé et la phase gaz
10 quantifiée et qualifiée par chromatographie en phase gazeuse. La phase
liquide est
pesée, neutralisée et analysée par chromatographie en phase gazeuse.
Tableau 1. Evaluation des ligands isolés
Ligand Activité C4a C6a C8+a
Précurseur Activateur
b
Entré Temps 1-
C4
e (ratio (103 (0/0 (0/0
(0/0
catalytique (ratio Al/Ni) (minutes)
Ligand/Ni) g/(gN,.h)) pds) pds) pds)
(%)
2
1 Ni(acac)2 SP1 (1) EtA10Et 30 216 79,4
15,9 4,7 97,4
(2,5)
2
2 Ni(2-EH)2 SP1 (1) EtA10Et 45 168 86,4
11,8 1,8 98,9
(2,5)
2
3 Ni(2-EH)2 SP1 (2) EtA10Et 90 53 89,4
9,6 1,0 99+
(2,5)
2
4 Ni(naph)2 SP1 (2) EtA10Et 30 115 88,1
10,7 1,1 99+
(2,5)
AIC I
5 Ni(2-EH)2 SP1 (2) Et2 90 45 96,5 3,5
0,0 94,7
(15)
2
6 Ni(2-EH)2 SP2 (2) EtA10Et 30 204 85,3
12,6 2,1 99+
(2,5)
2
7 Ni(2-EH)2 SP3 (2) EtA10Et 10 26 84,7
9,3 6,0 99+
(2,5)
A10Et
8 Ni(2-EH)2 L (2) Et2 90 0
(2,5)
Conditions opératoires : nN, = 10 mol, 40 C, 30 bar d'éthylène, toluène (100
mL). a% pds=
15 pourcentage poids par rapport aux produits formés. b 1-C4 (%)=
pourcentage butène-1 dans la coupe
C4. acac = acétylacétonate, naph = naphténate, 2-EH = 2-éthylehexanoate. Les
ratios Ligand/Ni et
Al/Ni sont exprimés en ratio molaire
La composition catalytique selon l'invention (entrée 1 à 7) présente une bonne
20 activité et une bonne sélectivité pour la dimérisation de l'éthylène en
butène-1
comparativement à la composition de l'entrée 8 non conforme à l'invention
comprenant un ligand L.
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
21
Formation du ligand à partir d'un sulfonamide (S) et d'une chlorophosphine (P)
et mise en oeuvre du test d'oligomérisation de l'éthylène :
00
\\ II
1.1 lei
F3C,\S,NH2 P P
ci-
La nature des composants (sulfonamide S, chlorophosphine P, triéthylamine Z,
précurseur catalytique, ligand et activateur) ainsi que leurs quantités
respectives,
considérées dans les différents tests catalytiques, sont décrites dans le
Tableau 2.
Du sulfonamide S (quantité voir tableau 2) et de la triéthylamine sont
solubilisés
dans 10 mL de toluène anhydre. Dans un deuxième Schlenk, la chlorophosphine P
(2 mmol) est solubilisée avec 10 mL de toluène anhydre, puis est ajoutée
goutte-à-
goutte à la solution de sulfonamide pour produire un précipité blanc. Après 10
minutes à 3 heures (l'avancement de la réaction est suivi par RMN 31P), le
mélange
est filtré. Il peut contenir un mélange de différents ligands et/ou adduits
répondant
aux formules la), lb), 1c) et/ou 1d). Une fraction de 20 mol d'équivalent
phosphore
est alors prélevée et ajoutée à une solution contenant 10 mol du précurseur
catalytique de nickel Ni(2-EH)2 dont le volume est ajusté pour obtenir un
volume total
de 5 mL.
Le toluène (94 mL) est introduit dans le réacteur qui est chauffé à 40 C. Les
5 mL de
la solution préparée ci-dessus, contenant le précurseur de nickel (avec nNi =
10
mol) sont alors ajoutés. Le milieu réactionnel est agité 15 minutes sous
environ 2
bars d'éthylène. Le réacteur est ensuite dégazé. 1 ml de solution contenant
l'activateur est alors ajouté. Le réacteur est rapidement mis sous pression
(30 bar
d'éthylène). Le réacteur est alors chauffé à 45 C.
CA 03002161 2018-04-16
WO 2017/072026
PCT/EP2016/075288
22
Le test est arrêté après 50 g d'éthylène introduits ou après le temps de
réaction
indiqué dans le tableau. Le réacteur est alors dépressurisé et la phase gaz
quantifiée
et qualifiée par chromatographie en phase gazeuse. La phase liquide est pesée,
neutralisée et analysée par chromatographie en phase gazeuse.
Tableau 2. Evaluation des compositions catalytiques à partir des mélanges de
sulfonamide
S et de chlorophosphine P.
Activité C4a C6a C8+a
Ratio Ratio TeMp.
Entrée M Temps
1-C4
b
élange (103
S/P/Ni NEt3/P ( C) (minutes)
(%)
g/(gN,.h)) pds) pds) pds)
1 S1 +P1 2/2/1 2,6 60 45 40 85,7 11,8
2,5 99+
2 S1 +P1 2/2/1 2,0 60 45 61 84,4 13,7
1,9 99+
3 S1 +P1 2/2/1 1,1 45 90 23 89,3 9,6
1,1 99+
4 S1 +P2 2,2/2/1 1,7 60 90 13 98,4 1,6
0,0 96,9
5 S1 +P2 4/2/1 1,4 60 90 20 98,1 1,8
0,1 96,0
Conditions opératoires : Précurseur catalytique : Ni(2-EH)2, nNi = 10 mol,
Et2A10Et (Al/Ni = 2,5), 30
bar C2, toluène (100 mL), 90 min. 2-EH= 2-éthylehexanoate. a% pds =
pourcentage poids par rapport
aux produits formés. b1-C4 ( /0) = pourcentage butène-1 dans la coupe C4. le
ratio S/P/Ni est exprimé
en ratio molaire, le ratio NEt3/P est exprimé en ratio molaire.
La composition catalytique selon l'invention (entrée 1 à 5) obtenue à partir
du
mélange sulfonamide S et chlorophosphine P selon l'invention présente une
bonne
activité et une bonne sélectivité pour la dimérisation de l'éthylène en butène-
1.