Note: Descriptions are shown in the official language in which they were submitted.
I
Procédé de détection etiou de caractérisation de cellules tumorales et
appareil
associé
La présente invention s'inscrit dans le domaine du diagnostic biologique en
cancérologie. Elle a pour objet un procédé et un appareil de détection et/ou
de
caractérisation de cellules tumorales par détection d'un ou plusieurs éléments
du
sécrétome de cellule tumorale, en particulier un ou plusieurs peptides ou
protéines, et
notamment un ou plusieurs marqueurs tumoraux. L'invention concerne également
des
gouttes de détection et/ou de caractérisation de cellules tumorales et leur
procédé de
préparation.
L'article Challenges in circulating tumeur cell research de la revue
Nature
Reviews Cancer publié en septembre 2014, volume 14, p 623 à 6131, décrit
différentes
technologies pour détecter des cellules tumorales circulantes.
Un procédé de détection de cellules tumorales circulantes communément désigné
par l'acronyme EPISPOT, pour l'anglais Epithélial Immunospot , est connu de
l'art
antérieur, notamment du document EP 1 506 407. Cette technique permet la
détection de
cellules tumorales circulantes dans un échantillon biologique d'un patient
atteint de cancer
solide, par détection de marqueurs tumoraux libérés par ces cellules. Elle met
en oeuvre
le dépôt de cellules sur une surface de culture solide, plus particulièrement
des plaques
de 96 puits, à raison de 2.105 cellules par puits, un anticorps spécifique
d'un marqueur
tumoral d'intérêt étant fixé sur cette surface de culture solide, suivi de la
culture de ces
cellules, puis de l'élimination des cellules par lavage et de la détection du
marqueur
tumoral d'intérêt par un anticorps spécifique marqué.
Cependant, la résolution obtenue par un tel procédé est limitée. En effet,
dans un
même puits, les protéines détectées proviennent de différentes cellules. Il
est difficile de
savoir quelle cellule a sécrété quoi. Le signal ne permet pas d'obtenir
d'information sur
l'hétérogénéité cellulaire. En outre, il est difficile de récupérer les
cellules pour analyser
leur génotype.
La présente invention vise à obtenir un procédé de détection plus précis et
plus
fiable.
Le document WO 2009/011808 Al décrit un procédé de détermination d'une
activité de fixation d'une protéine au sein d'une goutte.
La publication Single-cell analysis and sorting using droplet-based
microfluidics , de Mazutis et al. publiée en ligne, le 4 avril 2013 dans la
revue Nature
Protocols illustre ce principe.
Date reçue/Date received 2023-05-12
2
Un hybridome de souris est encapsulé dans une goutte avec une bille recouverte
d'anticorps anti-souris. L'hybridome sécrète des anticorps. Un anticorps
secondaire
couplé à un fluorophore permet de révéler la présence de l'anticorps sécrété.
La
distribution de l'anticorps secondaire est, en l'absence d'anticorps sécrété,
homogène
dans la goutte, mais elle se relocalise sur la bille en présence d'anticorps.
Ce procédé est
donc très sélectif pour déterminer l'activité d'une cellule particulière.
Par contre, un tel procédé présente divers inconvénients. Le procédé de
compartimentation des cellules et des billes est aléatoire. Le nombre de
billes dans les
gouttes peut être estimé par une loi de distribution de Poisson. De même, le
nombre de
cellules au sein des gouttes peut être estimé par une loi de distribution de
Poisson
indépendante. Les concentrations initiales en billes et en gouttes sont
ajustées pour avoir
en moyenne une cellule et une bille par goutte. Seule une partie des gouttes
présente
donc un intérêt pour l'analyse réalisée.
Par ailleurs, la présence d'une bille unique de taille significative par
goutte n'est
pas favorable à la résolution de la méthode. En effet, les anticorps
secondaires se
répartissent sur toute la surface de la bille. La gamme dynamique du procédé
est donc
limitée par la surface externe disponible par bille.
Un but de l'invention est de fournir un procédé d'analyse plus fiable et plus
sensible que les procédés existants permettant l'analyse du sécrétome de
cellules
vivantes, uniques ou sous forme d'un agrégat, pour détecter et/ou caractériser
des
cellules tumorales, et notamment les cellules tumorales uniques ou les
agrégats de
cellules tumorales.
A cet effet, l'invention a pour objet un procédé de détection et/ou de
caractérisation de cellules tumorales comprenant :
- la fourniture d'une pluralité de gouttes contenues dans un fluide porteur,
au
moins une des gouttes comprenant au moins un agrégat de particules définissant
un objet
allongé selon un axe principal, au moins certaines gouttes contenant une
cellule
susceptible de produire au moins un élément cible du sécrétome d'une cellule
tumorale
propre à se fixer sur l'agrégat ;
- la mesure d'au moins un paramètre physique caractéristique de la fixation
d'un
élément cible du sécrétome d'une cellule tumorale sur l'agrégat ; et
- la détection et/ou la caractérisation de cellules tumorales à partir de la
mesure
dudit au moins un paramètre physique.
Date reçue/Date received 2023-05-12
3
Plus spécifiquement, le procédé de détection et/ou de caractérisation de
cellules
tumorales selon l'invention comprend :
- la fourniture d'une pluralité de gouttes contenues dans un fluide porteur,
les
gouttes comprenant une pluralité de particules propre à former un agrégat de
particules
définissant un objet allongé selon un axe principal, au moins certaines
gouttes contenant
une cellule ;
- l'incubation de la pluralité de gouttes dans des conditions et pendant une
durée
suffisante pour que, dans les gouttes contenant une cellule, la cellule soit
susceptible de
produire au moins un élément cible du sécrétome d'une cellule tumorale, propre
à se fixer
sur l'agrégat ;
- la formation dans chaque goutte d'au moins un agrégat de particules
définissant
un objet allongé selon un axe principal ;
- la mesure d'au moins un paramètre physique, chaque paramètre physique étant
caractéristique de la fixation d'un élément cible distinct du sécrétome d'une
cellule
tumorale sur l'agrégat ; et
- la détection et/ou la caractérisation de cellules tumorales à partir de la
mesure
dudit au moins un paramètre physique.
Ladite cellule est une cellule unique ou un agrégat de cellules, notamment un
agrégat soupçonné d'être un agrégat de cellules tumorales.
Les agrégats de cellules tumorales sont d'origine oligoclonale et résultent de
l'adhésion, ou du regroupement, de plusieurs cellules tumorales primaires. Les
agrégats
de cellules tumorales peuvent contenir typiquement 2 à 15 cellules tumorales.
Ils sont
essentiellement constitués de cellules tumorales, mais peuvent aussi contenir
d'autres
types de cellules, telles que des leucocytes, des plaquettes, en nombre
limité.
Le procédé selon l'invention concerne donc en particulier un procédé de
détection
et/ou de caractérisation de cellules tumorales uniques comprenant :
- la fourniture d'une pluralité de gouttes contenues dans un fluide porteur,
au
moins une des gouttes comprenant au moins un agrégat de particules définissant
un objet
allongé selon un axe principal, au moins certaines gouttes contenant une
cellule unique ;
- l'incubation des gouttes contenant une cellule unique dans des conditions et
pendant une durée suffisante pour que la cellule unique soit susceptible de
produire au
moins un élément cible du sécrétome d'une cellule tumorale, propre à se fixer
sur
l'agrégat ;
Date reçue/Date received 2023-05-12
4
- la mesure d'au moins un paramètre physique, chaque paramètre physique étant
caractéristique de la fixation d'un élément cible distinct du sécrétome d'une
cellule
tumorale sur l'agrégat ; et
- la détection et/ou la caractérisation de cellules tumorales uniques à partir
de la
mesure dudit au moins un paramètre physique.
Par goutte contenant une cellule unique on entend que la goutte comprend
une seule cellule.
Par goutte contenant une cellule tumorale unique on entend que la goutte
comprend une seule cellule qui est une cellule tumorale.
Au sens de l'invention, une cellule tumorale n'est pas une cellule créée par
fusion
artificielle d'une cellule tumorale avec une autre cellule, telle qu'un
hybridome.
En particulier, le procédé est destiné à déterminer la présence de gouttes,
voire à
sélectionner des gouttes, comprenant une cellule unique dont le sécrétome
comprend un
élément cible particulier, cet élément cible étant une molécule du sécrétome
d'une cellule
tumorale, et en particulier un marqueur tumoral.
Le sécrétome d'une cellule est l'ensemble des éléments (molécules organiques
ou
inorganiques, telles que les protéines, peptides, glucides, lipides, ou acides
nucléiques,
ou encore vésicules) présents dans le milieu conditionné d'une cellule en
culture. Le
terme 'sécrétome' désigne dans un sens particulier la partie du protéome
(c'est-à-dire
l'ensemble des protéines et peptides exprimés par la cellule) qui est présente
dans le
milieu conditionné d'une cellule en culture.
Ces molécules, et en particulier protéines ou peptides sont :
- sécrétées (par la voie dite 'classique' impliquant le réticulum
endoplasmique et
l'appareil de Golgi, ou par des voies dites 'non classiques' telles que le
transport actif à
travers une protéine membranaire transporteur, ou la sécrétion via des
endosomes de
recyclage ou des vacuoles d'exocytose). C'est le cas par exemple de la
protéine PSA
(Prostate Specific Antigen), de la mammaglobine, de la kallikréine 3 humaine
(hK3), de
l' human glandular kallikrein (hK2), de la la thyroglobuline, des protéines
CA19-9,
CA15-3, CA 125 ( CA étant l'abréviation de cancer antigen ), de l'enzyme
de
conversion de l'angiotensine (ACE), de la Cathepsine D, de
l'alphafoetoprotéine, de la
protéine S100, du FGF-2 ou de l'EGF ;
- clivées dans leur domaine extracellulaire, lorsqu'il s'agit de protéines
membranaires dont le domaine extracellulaire est clivé enzymatiquement et
relâché dans
le milieu extracellulaire ( shed protein en anglais). Par exemple, les
marqueurs HER2,
EGFR (Epithelial Growth Factor Receptor) ou MUC 1 sont des protéines clivées ;
ou
Date reçue/Date received 2023-05-12
5
- relargués par la cellule. Les molécules relarguées sont par exemple des
protéines non membranaires sécrétées par la cellule par des voies différentes
des voies
de sécrétion, par exemple par bourgeonnement, comme la protéine CK 19
(Cytokeratin
19).
Les exosomes font aussi partie du sécrétome des cellules tumorales. Il s'agit
de
vésicules constituées d'une membrane de bicouche lipidique entourant un petit
cytosol.
Le cytosol des exosomes peut comprendre des protéines, de l'ADN double brin,
mais
aussi de l'ARN (en particulier ARNm, miRNA). Les exosomes permettraient aux
cellules
tumorales de transférer des protéines et/ou des acides nucléiques oncogéniques
pour
moduler l'activité de cellules receveuses, jouant ainsi un rôle dans la
tumorigénicité, la
croissance tumorale, les processus métastatiques et la résistance aux
médicaments.
Le procédé selon l'invention peut comprendre l'une ou plusieurs des
caractéristiques suivantes, prises isolément ou suivant toutes combinaisons
techniquement possibles :
i) les particules sont des particules magnétiques, avantageusement
paramagnétiques, de préférence superparamagnétiques ;
ii) l'étape de fourniture des gouttes comprend :
- la dispersion des particules dans une masse de fluide destinée à former
les gouttes, puis
- la dispersion de la masse de fluide sous forme de gouttes,
- la formation dans chaque goutte d'au moins un agrégat de particules
définissant un objet allongé selon un axe principal, l'agrégat de particules
étant
formé dans chaque goutte après la dispersion ;
iii) l'élément cible est un élément du sécrétome d'une cellule tumorale,
iv) l'élément cible est un peptide ou une protéine du sécrétome d'une cellule
tumorale ;
V) l'élément cible est un acide nucléique (ADN ou ARN), en particulier un
miRNA
d'une cellule tumorale ;
vi) l'élément cible est un exosome d'une cellule tumorale ;
vii) au moins certains gouttes comprennent une entité productrice susceptible
de
produire l'élément cible, l'entité productrice étant une cellule tumorale
unique ou un
agrégat de cellules tumorales, et en particulier une cellule tumorale
circulante (CTC)
unique, une cellule tumorale disséminée (DTC) unique, ou un agrégat de CTCs ou
DTCs;
viii) le procédé comprend avant l'étape de mesure, une étape d'orientation de
l'axe
principal de l'agrégat selon un axe de détection ;
Date reçue/Date received 2023-05-12
6
ix) le procédé comprend de multiples étapes de mesure, avec une étape
d'orientation de l'axe principal de l'agrégat selon un axe de détection
différent pour
chacune des mesures ;
X) le procédé comprend :
- la fourniture d'un dispositif comprenant un ensemble de mise en
circulation de la goutte et une zone de détection ;
- le transport de la goutte vers la zone de détection, la mesure au sein de la
goutte étant effectuée dans la zone de détection ;
xi) le procédé comprend :
- la fourniture d'un dispositif comprenant un ensemble de mise en
circulation de la goutte et une pluralité de zones de classement, et un moyen
de
direction de la goutte ou d'une partie de la goutte sélectivement vers une
zone de
classement,
- la décision de classement de la goutte ou d'une partie de la goutte, la
décision consistant à choisir sélectivement une zone de classement parmi la
pluralité des zones de classement,
- le transport de la goutte, respectivement d'une partie de la goutte, vers
la
zone de classement de la goutte choisie lors de l'étape de décision ;
xii) au moins une goutte comprend au moins un élément cible, au moins un
élément de capture apte à capturer l'élément cible et au moins une entité de
signalisation
apte à former un complexe avec l'élément cible, éventuellement capturé par
l'élément de
capture, le procédé comprenant la mesure d'un signal indiquant la
relocalisation ou la
concentration de ladite au moins une entité de signalisation sur l'agrégat ;
xiii) au moins une goutte comprend au moins un élément cible, au moins une
première entité de signalisation apte à former un complexe avec l'élément
cible et au
moins une seconde entité de signalisation distincte apte à former un complexe
avec
l'élément cible, le procédé comprenant la mesure d'un signal indiquant la
concentration de
chacune des entités de signalisation relocalisées sur l'agrégat ;
xiv) au moins une goutte comprend au moins un élément cible, au moins une
entité de signalisation apte à former un complexe avec l'élément cible et au
moins une
entité de quantification apte à former un complexe avec l'élément cible, le
procédé
comprenant :
- la mesure d'un signal représentatif de la concentration de l'entité de
signalisation relocalisée sur l'agrégat,
- la mesure d'un signal représentatif de la concentration de l'entité de
quantification relocalisée sur l'agrégat,
Date reçue/Date received 2023-05-12
7
- la détermination de la constante de dissociation de l'élément cible avec
l'entité de signalisation à partir du rapport du signal de l'entité de
signalisation
relocalisée sur le signal de l'entité de quantification relocalisée;
xv) au moins une goutte comprend au moins deux entités de signalisation
distinctes, chacune des deux entités de signalisation étant apte à former un
complexe
avec un élément cible distinct sur l'agrégat, le procédé comprenant la mesure
d'un signal
indiquant la concentration de chacune des entités de signalisation
relocalisée;
xvi) au moins certaines gouttes comprennent une entité productrice, l'entité
productrice étant une cellule susceptible de produire un élément du sécrétome
d'une
cellule tumorale, chaque élément du sécrétome d'une cellule tumorale étant un
élément
cible distinct, la mesure du signal indiquant la concentration de chacune des
entités de
signalisation relocalisée permettant une quantification du ou des élément(s)
du
sécrétome;
xvii) la mesure d'un paramètre physique est une mesure de radioactivité, de
colorimétrie ou de fluorescence ;
xviii) au moins une des gouttes comprend une cellule apte à sécréter l'élément
cible et le procédé comprend une étape d'incubation au cours de laquelle
l'élément cible
est sécrété dans la goutte par la cellule ;
xix) le procédé comprend une étape de mesure d'un paramètre physique,
localement en un premier point situé à l'écart de l'agrégat dans au moins une
des gouttes
et du même paramètre physique, localement en un deuxième point au voisinage de
l'agrégat dans la même goutte ;
xx) la dimension maximale des particules est inférieure à 50 % du diamètre de
la
goutte ;
ni) la goutte contient au moins une entité de signalisation, et la mesure du
paramètre physique dépend de la position de l'entité de signalisation au sein
de la goutte
ou par rapport à l'agrégat ;
nii) l'entité productrice produit plusieurs éléments cibles choisis dans le
groupe
constitué par les éléments, et en particulier les protéines et peptides, du
sécrétome d'une
cellule tumorale ;
xxiii) le procédé comporte une étape de détermination d'au moins une
caractéristique de l'entité productrice ;
)ociv) l'étape de décision de classement a lieu après l'étape de mesure ;
xxv) la goutte contient des particules superparamagnétiques, la goutte ou la
partie
de la goutte est dirigée vers la zone de classement par un moyen de direction
choisi
Date reçue/Date received 2023-05-12
8
parmi un champ magnétique, un champ électrique, une diélectrophorèse, une
électrocoalescence ou une onde acoustique de surface ;
xxvi) une partie de la goutte est extraite au moyen de la force magnétique, la
partie
extraite formant une goutte auxiliaire et contenant l'agrégat ;
xxvii) les particules sont fonctionnalisées avec un élément de capture propre
à
fixer l'élément cible et chaque goutte comprend une entité de signalisation
propre à fixer
l'élément cible ;
xxviii) l'entité de signalisation est fluorescente, radioactive ou colorée ;
)ocix) la mesure d'un paramètre physique est une mesure de chromométrie, de
fluorescence ou de radioactivité ;
xxx) la mesure du paramètre physique comprend la localisation d'un signal de
fluorescence, de chromométrie ou de radioactivité au sein de la goutte ;
xxxi) la mesure du paramètre physique comprend la localisation d'un signal de
fluorescence de chromométrie ou de radioactivité par rapport à l'agrégat, au
sein de la
goutte ;
xxxii) la mesure du paramètre physique comprend la mesure de l'intensité d'un
signal de fluorescence, de chromométrie ou de radioactivité au sein de la
goutte, de
préférence au niveau de l'agrégat ;
xxxiii) la mesure du paramètre physique comprend la variation au cours du
temps
de la localisation et/ou de l'intensité d'un signal de fluorescence, de
chromométrie ou de
radioactivité au sein de la goutte, de préférence au niveau de l'agrégat ;
xxxiv) chaque goutte comprend au moins deux entités de signalisation
distinctes,
chacune des deux entités de signalisation étant apte à former un complexe avec
un
élément cible distinct sur l'agrégat, chaque entité de signalisation étant
fluorescente dans
un canal de fluorescence distinct ;
xxxv) la cellule est une cellule tumorale, en particulier une cellule tumorale
unique
ou un agrégat de cellules tumorales ;
xxxvi) la cellule, en particulier la cellule unique ou l'agrégat de cellules,
est issue
d'un fluide biologique et est choisie dans le groupe constrtué par une cellule
tumorale
circulante et une cellule tumorale disséminée ;
xxxvii) l'étape de mesure comporte la mesure dudit au moins un paramètre
physique localement en une pluralrté de points situés dans la goutte, l'étape
de mesure
comportant de préférence la détermination de l'intégrale des valeurs mesurées
au sein de
la goutte ;
mviii) l'étape de mesure est effectuée dans une chambre microfluidique sans
circulation des gouttes ;
Date reçue/Date received 2023-05-12
9
)xix) le procédé comprend :
- la fourniture d'un dispositif comprenant un ensemble de mise en
circulation de la goutte et une pluralité de zones de classement, et un moyen
de
direction de la goutte ou d'une partie de la goutte sélectivement vers une
zone de
classement,
- la décision de classement de la goutte ou d'une partie de la goutte, la
décision consistant à choisir sélectivement une zone de classement parmi la
pluralité des zones de classement,
- le transport de la goutte, respectivement d'une partie de la goutte, vers la
zone de classement de la goutte choisie lors de l'étape de décision,
et éventuellement en outre la récolte de la goutte triée par transport vers la
zone de classement, la lyse de la goutte triée et récoltée, puis la lyse de la
goutte
et la récolte de la cellule tumorale vivante contenue dans la goutte triée et
lysée.
xl) au moins une goutte comprend au moins deux entités de signalisation
distinctes, chacune des deux entités de signalisation étant apte à former un
complexe
avec un élément cible distinct sur l'agrégat, le procédé comprenant la mesure
d'un signal
indiquant la concentration de chacune des entités de signalisation
relocalisées ;
xli) au moins certaines gouttes comprennent une cellule, unique ou sous forme
d'un agrégat, susceptible de sécréter, cliver ou relarguer un ou plusieurs
éléments du
sécrétome de cellule tumorale, chaque élément du sécrétome de cellule tumorale
étant un
élément cible distinct, la mesure du signal indiquant la concentration de
chacune des
entités de signalisation relocalisées permettant une quantification du ou des
éléments du
sécrétome de cellule tumorale.
L'invention a également pour objet un appareil de détection et/ou de
caractérisation de cellules tumorales, uniques ou sous forme d'un agrégat de
cellules
tumorales, comprenant :
- un ensemble de fourniture d'une pluralité de gouttes contenues dans un
fluide
porteur, au moins une des gouttes comprenant au moins un agrégat de particules
définissant un objet allongé selon un axe principal, au moins certaines
gouttes contenant
une cellule tumorale, unique ou sous forme d'un agrégat de cellules,
susceptible de
produire un élément cible propre à se fixer sur l'agrégat,
caractérisé en ce que l'appareil comprend un ensemble de mesure d'un paramètre
physique caractéristique de la fixation d'un élément cible sur l'agrégat,
l'appareil comprenant éventuellement en outre:
- un ensemble de mise en circulation de la goutte,
Date reçue/Date received 2023-05-12
10
- un ensemble de décision de classement de la goutte,
- un ensemble de tri de la goutte selon la décision de classement.
L'invention a également pour objet une goutte de détection et/ou de
caractérisation
de cellules tumorales, uniques ou sous forme d'un agrégat de cellules
tumorales,
comprenant une pluralité de particules propre à former un agrégat de
particules définissant
un objet allongé selon un axe principal, et une cellule tumorale, unique ou
sous forme d'un
agrégat de cellules tumorales, et éventuellement au moins un élément cible du
sécrétome de
la cellule tumorale, unique sous forme d'un agrégat de cellules tumorales,
propre à se fixer
sur l'agrégat.
L'invention a également pour objet un procédé de préparation de gouttes de
détection
et/ou de caractérisation de cellules tumorales, uniques ou sous forme d'un
agrégat de
cellules tumorales, comprenant :
- la dispersion, dans une masse de fluide destinée à former des gouttes, de
particules
propres à former un agrégat définissant un objet allongé selon un axe
principal, et d'une
pluralité de cellules, au moins certaines cellules étant des cellules
tumorales susceptibles de
produire un élément cible du sécrétome d'une cellule tumorale, puis
- la dispersion de la masse de fluide sous forme de gouttes, de sorte que
chaque
goutte comprenne une pluralité de particules et qu'au moins certaines gouttes
comprennent,
en outre, une cellule, unique ou sous forme d'un agrégat, et
- éventuellement la formation dans chaque goutte d'au moins un agrégat de
particules définissant un objet allongé selon un axe principal, l'agrégat de
particules étant
formé dans chaque goutte après la dispersion.
L'invention, en particulier selon le mode 'cellule unique', sera mieux
comprise à la
lecture de la description qui va suivre, donnée uniquement à titre d'exemple,
et faite en se
référant aux dessins annexés, sur lesquels :
la figure 1 est une représentation schématique des éléments principaux d'un
premier appareil d'analyse selon l'invention,
la figure 2 et la figure 3 sont des représentations schématiques d'une étape
de
procédé avec le premier appareil,
les figures 4 à 7 sont des photographies d'une partie d'un deuxième appareil
suivant l'invention lors de différentes étapes de procédé suivant l'invention,
la figure 8 est une représentation schématique d'un troisième appareil selon
l'invention,
Date Reçue/Date Received 2023-12-01
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
11
- les figures 9 et 10 représentent des ensembles d'espacement
de gouttes et
de lecture,
- les figures 11 et 12 représentent des dispositifs de générations de
gouttes,
- la figure 13 est une représentation schématique d'une goutte lors d'une
étape de mise en oeuvre d'un procédé,
- les figures 14 à 26 illustrent des exemples d'application du procédé.
Premier appareil
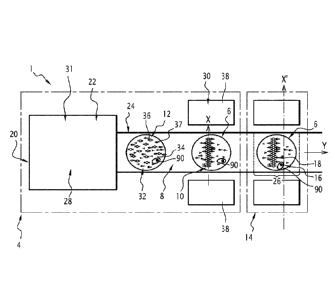
Un premier appareil d'analyse 1 du contenu de gouttes et de détection et/ou de
caractérisation de cellules tumorales, uniques ou sous forme d'un agrégat de
cellules
tumorales, suivant l'invention est représenté sur la figure 1.
L'appareil 1 comprend un ensemble de fourniture 4 d'une pluralité de gouttes 6
contenues dans un fluide porteur 8, au moins une partie des gouttes 6
comprenant au
moins un agrégat 10 de particules 12 définissant un objet allongé selon un axe
principal
X.
Un objet allongé est un objet présentant une forme allongée. Une forme
allongée
présente selon l'axe principal, une longueur supérieure à sa longueur suivant
une
direction perpendiculaire à l'axe principale. Ainsi, une sphère n'est pas
allongée. Par
exemple, un objet oblong, un cône, une tige ou un ovoïde non sphérique
présentent des
formes allongées.
L'appareil 1 comprend, en outre, un ensemble de mesure 14 d'un paramètre
physique dans la goutte.
L'ensemble de mesure 14 est, par exemple, propre à effectuer la mesure d'un
paramètre physique, localement en un premier point 16 situé à l'écart de
l'agrégat 10
dans au moins une des gouttes et du même paramètre physique localement en un
deuxième point 18 au voisinage de l'agrégat 10 dans la même goutte.
L'appareil 1 comporte également un dispositif 20 comprenant un ensemble de
mise en circulation 22, un conduit de circulation 24 et une zone de détection
26.
L'ensemble de mise en circulation 22 est apte à faire circuler chaque goutte 6
dans le fluide porteur 8 dans le conduit 24 sous forme d'un train de gouttes
successives.
L'ensemble de fourniture 4 comprend un ensemble de chargement 28 et un
ensemble d'agrégation 30. L'ensemble de fourniture 4 comprend en outre un
ensemble
d'espacement 31.
L'ensemble de chargement 28 est apte à fournir une pluralité de gouttes
initiales
32 comprenant une dispersion de particules 12, au moins une des gouttes
initiales 32
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
12
comprenant en outre au moins un élément cible 37 du sécrétome d'une cellule
tumorale
90.
L'ensemble d'espacement 31 est apte à espacer deux gouttes successives 6 du
train de goutte, c'est-à-dire à augmenter la distance entre deux gouttes
successives. Par
exemple, l'ensemble d'espacement 31 comporte une entrée de fluide porteur 8.
Des
exemples d'ensemble d'espacements sont représentés sur les figures 9 et 10.
Le fluide porteur 8 est apte à séparer deux gouttes successives 6 du train de
gouttes pour empêcher leur contact. En variante, la séparation des gouttes 6
est effectuée
par un dispositif mécanique.
Le fluide formant la phase interne des gouttes 6 et le fluide porteur 8 sont
sensiblement immiscibles. Par exemple, les gouttes 6 comprennent une phase
interne
aqueuse et le fluide porteur 8 est une phase organique ou huileuse.
Le fluide porteur 8 est avantageusement une huile fluorée.
Le fluide porteur 8 ou le fluide formant la phase interne des gouttes comprend
avantageusement un tensio-actif apte à empêcher la fusion de deux gouttes 6 en
contact,
comme par exemple tel que décrit dans le brevet US 2010/0105112 ou encore le
surfactant EA de la société RainDance Technologies.
Par sensiblement immiscibles > , on entend généralement que la solubilité du
fluide formant les gouttes dans le fluide porteur 8, mesurée à 25 C et à
pression
ambiante, est inférieure à 1 %.
La taille des gouttes 6 est, par exemple, comprise entre 1 m et 1000 m. Le
volume des gouttes 6 est compris avantageusement entre 0.1 picolitre et 1
microlitre.
Les gouttes 6 fournies sont sensiblement monodisperses. Ceci signifie que la
polydispersité des gouttes 6 est inférieure à 5 %.
Dans l'exemple représenté, les gouttes 6 sont sphériques. En variante, les
gouttes
6 sont de forme allongée selon l'axe de circulation Y du conduit 24. En
variante, les
gouttes 6 sont de forme de palet aplati selon un axe perpendiculaire à l'axe
de circulation
Y.
Composition des gouttes
Chaque goutte initiale 32 comprend un fluide de base, une dispersion de
particules
12 solides dans le fluide de base et une pluralité d'entités de signalisation
34. En outre au
moins une goutte initiale 32 comprend une cellule 90, de préférence une
cellule tumorale
unique ou un agrégat de cellules tumorales, et éventuellement au moins un
élément cible
37 du sécrétome de cellule tumorale.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
13
Comme indiqué ci-dessus, le volume d'une goutte 6 est compris avantageusement
entre 0.1 picolitre et 1 microlitre. Le volume d'une cellule est d'environ 1
picolitre. Pour
encapsuler une cellule unique ou un agrégat de cellule tumorale, on choisira
avantageusement un volume de goutte compris entre 20 et 150 picolitres, par
exemple de
20 à 50 picolitres, ou encore de 30 à 40 picolitres, notamment pour les
cellules uniques,
ou encore de 60 à 150 picolitres, ou encore de 80 à 120 picolitres, notamment
pour les
agrégats de cellules.
L'analyse des cellules uniques et des agrégats peut être fait simultanément ou
séquentiellement. Pour l'analyse simultanée, on utilise avantageusement des
volumes de
gouttes adaptés pour pouvoir encapsuler les agrégats de cellules (par exemple
de 60 à
150 picolitres, typiquement environ 100 pl). Pour l'analyse séquentielle, un
système de
séparation intégré (avec des techniques telles que décrites dans Sajeesh and
Sen,
Microfluidics and Nanofluidics 2014, 17, 1-52) peut être utilisé pour séparer
cellules
uniques et agrégats de cellules, suivi par une encapsulation séparée des
cellules uniques
d'une part, et des agrégats de cellules d'autre part. Alternativement, les
cellules uniques
et les agrégats de cellules sont encapsulés dans des gouttes de petit volumes
(par
exemple de 20 à 50 picolitres), et les agrégats de cellules sont triés, et du
volume est
ajouté aux gouttes contenant les agrégats de cellules dans un deuxième temps.
La
séparation des cellules uniques et agrégats de cellules peut aussi être faite
préalablement
à la mise en oeuvre de l'invention, et les cellules uniques et agrégats de
cellules sont alors
analysés séquentiellement et séparément.
La goutte comprend initialement la cellule dans le fluide de base, typiquement
un
milieu adapté à la culture de cellules de mammifère (et en particulier de
cellules
humaines) tel que le DMEM ou RPMI, le fluide de base étant alors dépourvu
d'éléments
du sécrétome de la cellule. Les éléments du sécrétome s'accumulent au cours du
temps,
dans le fluide de base, par sécrétion, clivage ou relargage à partir de la
cellule unique.
Le fluide de base est adapté pour qu'une cellule unique ou un agrégat de
cellules
dans la goutte soit susceptible de produire au moins un élément cible du
sécrétome d'une
cellule tumorale, propre à se fixer sur l'agrégat, en particulier lorsque la
cellule unique est
une cellule tumorale ou lorsque l'agrégat de cellules contient ou consiste en
des cellules
tumorales.
Par exemple, chaque cellule tumorale 90, unique ou sous forme d'un agrégat de
cellules, encapsulée dans une goutte est apte à produire un élément cible 37.
En
particulier, les cellules tumorales 90 sécrétent, clivent ou relarguent des
éléments du
sécrétome tels que des protéines ou des peptides, en particulier des protéines
ou des
peptides marqueurs de la tumeur. Les cellules tumorales, uniques ou sous forme
d'un
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
14
agrégat de cellules, sont notamment des cellules tumorales circulantes ou des
cellules
tumorales disséminées.
Les particules 12 sont destinées à former l'agrégat 10 de forme allongée. Par
exemple, les particules 12 sont des particules superparamagnétiques qui
acquièrent un
moment magnétique à l'application d'un champ magnétique. Le
superparamagnétisme est
un comportement des matériaux ferromagnétiques ou ferrimagnétiques qui
apparaît
lorsqu'ils sont sous la forme de petits grains ou nanoparticules. Dans des
grains de taille
suffisamment petite, l'aimantation peut se renverser spontanément sous
l'influence de la
température. Le terme particules magnétiques dans le texte désigne des
particules
superparamagnétiques.
Les particules magnétiques 12 sont, par exemple, choisies parmi les particules
fournies par la société Dynal (Life Technologies) ou Ademtech ou Miltenyi.
Les particules 12 sont par exemple nanométriques. Ainsi, leur dimension
maximale est inférieure à 1 lm et est par exemple comprise entre 50 nm et 1000
nm. Les
particules 12 sont avantageusement sensiblement monodisperses. Par exemple, la
variation entre les dimensions maximales des particules 12 est strictement
inférieure à 10
%. La taille et le nombre de particules 12 par gouttes 6 sont choisies pour
former le
nombre désiré d'agrégats. La dimension maximale des particules 12 est
inférieure à 50 `)/0
du diamètre de la goutte 6.
La concentration de particules 12 permet une stabilité colloïdale.
La concentration de particules 12 par gouttes 6 est telle que les particules
12
occupent entre 0,1 % et 5 % du volume de la goutte 6, par exemple 1,7 %.
Dans un exemple, chaque goutte 6 de 33 picolitres contient en moyenne 500
particules 12 de 300 nm de diamètre.
Les particules 12 forment initialement une dispersion homogène dans les
gouttes
initiales 32. Elles sont réparties sensiblement uniformément dans le volume de
la goutte
initiale 32. Ainsi, la concentration en particules 12 est homogène sur
l'ensemble de la
goutte initiale 32.
Les particules 12 possèdent avantageusement une surface permettant le couplage
de molécules biologiques, constituée d'un matériau de surface. Par exemple les
particules
12 sont couvertes d'un polymère présentant des fonctions COOH ou NH2.
Avantageusement, ce matériau de surface permet également de limiter
l'agrégation spontanée des particules 12 dans la goutte.
De manière additionnelle, il peut avantageusement favoriser la stabilité de
l'agrégat 10, par exemple, via des liaisons non spécifiques entre le matériau
d'une bille et
de sa voisine dans l'agrégat.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
Les particules 12 sont avantageusement fonctionnalisées. Ceci signifie
notamment
que le matériau de surface des particules 12 comporte des éléments
fonctionnels.
Dans l'exemple représenté, les éléments fonctionnels comportent un élément de
capture 36. L'élément de capture 36 est, par exemple, apte à capturer
l'élément cible 37.
5 L'élément de capture 36 est apte à se lier indirectement à l'entité de
signalisation 34 par
l'intermédiaire de l'élément cible 37.
L'élément cible 37 secrété ou relargué par la cellule tumorale, unique ou sous
forme d'un agrégat, ou bien clivé de la cellule tumorale, unique ou sous forme
d'un
agrégat, est reconnu à la fois par les éléments de capture 36 des particules
12 et par les
10 entités de signalisation 34.
Lorsque l'élément cible 37 est une protéine, un peptide, un lipide, un glucide
ou un
exosome du sécrétome, les éléments de capture 36 sont avantageusement
constitués par
un anticorps polyclonal ou un anticorps monoclonal (en multiples copies)
dirigés contre,
ou spécifiques de l'élément cible 37.
15 Lorsque l'élément cible 37 est un acide nucléique cible, tel qu'un
miRNA, du
sécrétome, les éléments de capture 36 sont avantageusement constitués par un
acide
nucléique (en multiples copies) s'hybridant à l'acide nucléique cible, de
préférence un
acide nucléique comprenant ou constitué d'une séquence complémentaire à la
séquence
de l'acide nucléique cible. L'acide nucléique de capture est typiquement une
séquence
d'ADN, constituée par exemple de 10 à 200, 10 à 100, 10 à 50, ou 10 à 30
nucléotides.
Lorsque l'élément cible 37 est un exosome, les éléments de capture 36 sont
avantageusement constitués par des anticorps dirigés contre une protéine
présente dans
la membrane, ou par des lipides ou stérols immobilisés sur une surface solide,
par
exemple des particules, comme décrit dans Kuhn et al. (Integr. Biol, 2012,4,
1550-1555).
De la même manière, selon la nature de l'élément cible, les entités de
signalisation
34 sont avantageusement constituées par (i) un anticorps polyclonal ou un
anticorps
monoclonal (en multiples copies) dirigés contre, ou spécifiques de l'élément
cible 37,
l'anticorps monoclonal ou polyclonal étant marqué de manière détectable, ou
(ii) un acide
nucléique de signalisation (en multiples copies) s'hybridant à l'acide
nucléique cible, de
préférence un acide nucléique comprenant ou constitué d'une séquence
complémentaire
à la séquence de l'acide nucléique cible, l'acide nucléique de signalisation
étant marqué
de manière détectable.
Le marqueur peut être typiquement un radioélément, un composé chromophore,
un fluorophore, ou une enzyme couplée de manière directe ou indirecte à
l'anticorps ou à
l'acide nucléique.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
16
La présence de ces éléments cibles 37 dans la goutte 6 permet la
relocalisation
des entités de signalisation 34 sur l'agrégat 10, comme cela sera décrit par
la suite.
En revanche, lorsque la cellule unique n'est pas une cellule tumorale, lorsque
l'agrégat de cellules ne contient pas de cellule tumorale, ou lorsque la
cellule unique ou
l'agrégat de cellules ne produit pas, ou pas en quantité suffisante, l'élément
cible 37 du
sécrétome de cellule tumorale, les entités de signalisation 34 ne se
relocalisent pas sur
l'agrégat 10.
La relocalisation des entités de signalisation 34 sur l'agrégat permet ainsi
de
détecter que la cellule, unique ou sous forme d'un agrégat, sécrète, clive ou
relargue
l'élément cible 37 et donc:
- de caractériser que la cellule est une cellule tumorale si l'élément
cible est un
marqueur spécifique des cellules tumorales ou d'un type de cellule tumorale,
et/ou
- de caractériser que l'élément cible 37 fait partie du sécrétome de la
cellule.
Lorsque plusieurs éléments cibles 37 distincts sont recherchés, des entités de
signalisations différentes et des éléments de captures différents distincts
sont associés.
Leur relocalisation est détectée indépendamment par des entités de
signalisations
différentes et des éléments de captures différents, par exemple sur des canaux
de
fluorescence différents.
Chaque relocalisation d'une entité de signalisation 34 distinctes associées à
un
élément cible distinct permet de détecter que la cellule sécrète, clive ou
relargue l'élément
cible 37 associé.
L'ensemble d'agrégation 30 est apte à engendrer une agrégation des particules
12
selon un axe principal X.
L'ensemble d'agrégation 30 comporte, par exemple, deux aimants 38 situés de
part et d'autre du conduit 24. Le champ magnétique est non parallèle à l'axe
de circulation
Y et avantageusement perpendiculaire à l'axe de circulation Y. L'ensemble
d'agrégation
permet la formation d'un agrégat allongé dans chaque goutte 6.
Dans un mode de réalisation les aimants 38 sont permanents.
30 En variante, l'ensemble d'agrégation 30 comporte un aimant non-
permanent.
En variante, l'ensemble d'agrégation 30 est apte à basculer d'un mode actif à
un
mode inactif afin de générer des agrégats 10 allongés dans certaines gouttes
seulement.
Chaque agrégat 10 de particules 12 comporte par exemple une colonne orientée
suivant un axe principal X. La hauteur de la colonne est avantageusement
comprise entre
50 % et 100 % du diamètre de la goutte 6. Sa largeur est, par exemple,
inférieure à 60 %
de sa hauteur.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
17
De plus, l'ensemble d'agrégation 30 est, par exemple, apte à orienter
l'agrégat
suivant un axe préférentiel. Dans l'exemple représenté, l'axe X de l'agrégat
12 est
perpendiculaire à l'axe de circulation Y des gouttes 6 dans le conduit de
circulation 24.
L'ensemble de mesure 14 comprend par exemple une ligne laser apte à mesurer
de manière optique l'intensité de la fluorescence selon une ligne s'étendant
selon un axe
X' perpendiculaire ou incliné par rapport à l'axe de circulation Y.
L'ensemble de mesure 14 est apte à effectuer la mesure au sein de la goutte
dans
la zone de détection 26.
L'axe X' de la ligne laser est avantageusement parallèle à l'axe de l'agrégat
X
dans la zone de détection 26.
Lorsque le débit du fluide porteur 8 est constant, la mesure en fonction du
temps
du signal obtenu par la ligne laser correspond à un balayage spatial de la
goutte 6
passant devant la ligne laser. Ceci permet de prendre successivement plusieurs
points de
mesure et en particulier au moins un premier point 16 de mesure situé à
l'écart de
l'agrégat 10 et un deuxième point 18 de mesure situé plus proche de l'agrégat
10, au
voisinage de l'agrégat 10.
En pratique, une pluralité de points de mesure successifs sont pris sur toute
la
dimension longitudinale de la goute 6 lors de son passage progressif en regard
de
l'ensemble de mesure 14.
Dans l'exemple représenté sur les figures 1 à 3, l'entité de signalisation 34
est
fluorescente.
Le conduit de circulation 24 est destiné à permettre la circulation des
gouttes 6, 32
suivant l'axe de circulation Y dans un sens de circulation allant de
l'ensemble de
fourniture 4 vers l'ensemble de mesure 14.
Le conduit de circulation 24 présente avantageusement un diamètre intérieur
inférieur ou égal à 1 mm.
Le conduit de circulation 24 est allongé selon l'axe de circulation Y. Le
conduit de
circulation 24 présente une section transversale intérieure de contour arrondi
tel que
circulaire ou elliptique, ou de contour polygonal tel que rectangulaire.
Le conduit de circulation 24 est par exemple défini dans un matériau
translucide
permettant la mesure de paramètres optiques par l'ensemble de mesure 14. En
variante,
le conduit de circulation 24 définit au moins une fenêtre de mesure
transparente dans la
zone de détection 26.
Les parois du conduit de circulation 24 sont étanches au fluide porteur 8.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
18
Par exemple, le conduit de circulation 24 est défini dans un tube capillaire
de
dimension interne avantageusement inférieure à 1 mm. En variante, le conduit
de
circulation 24 est défini dans une puce microfluidique.
L'ensemble de mise en circulation des gouttes 22 est destiné à déplacer une à
une
les gouttes 6, 32 dans le conduit 24 dans le sens de circulation.
L'ensemble de mise en circulation 22 comprend par exemple un pousse-seringue
permettant d'appliquer des débits contrôlés au fluide porteur 8. En variante
l'ensemble de
mise en circulation 22 comprend un contrôleur de pression.
Procédé d'analyse avec le premier appareil
Un premier procédé d'analyse suivant l'invention mis en oeuvre dans le premier
appareil 1 va maintenant être décrit.
Un appareil 1 tel que précédemment décrit est fourni. Des gouttes initiales 32
telles que décrites plus haut sont préparées dans un fluide porteur 8.
De préférence, les particules 12 sont dispersées de manière homogène dans
chaque goutte initiale 32. Compte tenu de la faible taille des particules 12
individuelles par
rapport aux gouttes initiales 32, chaque goutte initiale 32 contient un nombre
élevé de
particules individuelles 12 par exemple supérieur à 10. La probabilité
d'obtenir une goutte
initiale 32 dépourvue de particules 12 est très faible, voire nulle.
Certaines gouttes 6 comprennent une cellule tumorale unique 90 sécrétant,
relargant ou clivant l'élément cible 37.
De préférence, les entités de signalisation 34 sont dispersées de manière
homogène dans chaque goutte initiale 32.
Au sein de la goutte initiale 32, des liaisons se forment entre les éléments
ayant
des affinités particulières.
Dans un exemple, chaque élément cible 37 se lie à une entité de signalisation
34
et à un élément de capture 36. L'entité de signalisation 34 est ainsi
relocalisée sur une
particule 12.
Dans la suite, on entend par entités relocalisées , les entités liées à
l'agrégat 10.
Les gouttes initiales 32 sont mises en circulation conjointement avec le
fluide
porteur 8 dans le conduit 24 par l'ensemble de mise en circulation 22.
Au moins une goutte initiale 32 est conduite vers l'ensemble d'agrégation 30.
Un
agrégat 10 de particules 12 définissant un objet allongé selon un axe
principal X est formé
par l'ensemble d'agrégation 30 dans la goutte initiale 32.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
19
De préférence, lorsque les particules 12 sont des particules magnétiques,
elles
s'alignent le long de l'axe principal X lors de leur passage en regard de
chaque aimant 38
de l'ensemble d'agrégation 30.
La goutte 6 comprenant l'objet allongé est conduite vers la zone de détection
26.
Un paramètre physique est mesuré localement par l'ensemble de mesure 14 en au
moins
un premier point 16 dans au moins une des gouttes 6.
Dans une mise en oeuvre particulière, un paramètre physique est mesuré
localement par l'ensemble de mesure 14 en au moins un premier point 16 dans au
moins
une des gouttes 6 et le même paramètre physique est mesuré localement en au
moins un
deuxième point 18 au voisinage de l'agrégat 10 dans la même goutte 6 par
l'ensemble de
mesure 14.
Mesure
La figure 2 représente à titre illustratif différentes mesures obtenues pour
différentes gouttes 6. Le graphique représente l'intensité de fluorescence
mesurée par la
ligne laser en fonction du temps.
L'intensité de fluorescence est mesurée dans une gamme de longueur d'onde
caractéristique de l'entité de signalisation 34. Dans l'exemple, l'intensité
de fluorescence
est, en outre, mesurée dans une gamme de longueur d'onde caractéristique des
particules 12, les particules 12 étant fluorescentes. L'agrégat 10 est ainsi
plus facilement
repérable.
L'intensité de fluorescence 40 correspondant à la fluorescence de l'entité de
signalisation 34 mesurée sur la ligne laser est présentée en pointillés sur la
figure 2 pour
différentes gouttes 6.
L'intensité de fluorescence 41 correspondant à la fluorescence des particules
12
est présentée en traits pleins sur la figure 2 pour différentes gouttes 6.
L'étape de mesure comporte la détermination du paramètre physique localement
en une pluralité de points situés dans la goutte. Elle comprend en outre
avantageusement
un cumul des valeurs mesurées en une pluralité de points, par exemple la
détermination
de l'intégrale des valeurs mesurées au sein de la goutte 6.
La première goutte 42 représentée est une goutte 6 dans laquelle les
différentes
entités de signalisation 34 n'ont pas été relocalisées sur les particules 12.
La répartition
des entités de signalisation 34 est homogène au sein de la goutte 6. Un signal
d'intensité
de fluorescence sous forme d'un plateau 44 est mesuré.
La deuxième goutte 48 représentée est une goutte 6 dans laquelle une partie
des
entités de signalisation 34 a été relocalisé sur les particules 12. En effet,
ces entités de
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
signalisation 34 sont liées à un élément cible 37 capturé par l'élément de
capture 36.
L'intensité de fluorescence au voisinage de l'agrégat 10 est donc plus
importante que
dans le reste de la goutte 6. Un signal d'intensité de fluorescence présentant
un pic 50 en
plus d'un plateau 52 est mesuré.
5 La hauteur du plateau 52 de la deuxième goutte 48 est plus faible que
la hauteur
du plateau 44 de la première goutte 42 car moins d'entités de signalisations
34 sont libres
à l'écart de l'agrégat 10.
La troisième goutte 56 représentée est une goutte 6 dans laquelle une
proportion
plus importante des entités de signalisation 34 a été relocalisée sur
l'agrégat. Un signal
10 d'intensité de fluorescence présentant un pic 58 et un plateau 59. La
hauteur du pic 58
mesurée est plus importante que la hauteur du pic 50 mesurée dans la deuxième
goutte
48 car plus d'entités de signalisation 34 sont capturées par les particules 12
et sont donc
situées au voisinage de l'agrégat 10.
15 La figure 3 illustre le choix des paramètres utiles pour estimer la
concentration
d'entités de signalisation 34 relocalisées.
Sur la figure 3 qui représente le signal S au cours du temps t, on voit trois
gouttes
contenant un (à gauche et à droite) ou deux agrégats (au centre) qui
présentent un pic
plus élevé de signal. Le paramètre utile peut-être le maximum du signal
(indiqué Max) ou
20 l'intégrale du signal par rapport à un seuil donné (kit).
Une première méthode consiste à estimer cette concentration par la valeur
maximale du signal (Max) dans chaque goutte 6, c'est-à-dire la hauteur des
pics de signal
relocalisés sur l'agrégat.
Une seconde méthode, plus précise, consiste à calculer l'intégrale des signaux
(Int) pour chaque goutte 6 au-delà d'un seuil fixé par l'utilisateur, comme
représenté par
exemple sur la figure 3. Cette méthode peut s'avérer plus intéressante pour
limiter la
dispersion du signal.
Ces deux méthodes de traitement du signal peuvent être effectuées en temps
réel.
D'autres méthodes, par exemple combinant ces approches, pourraient être
appliquées, par exemple pour mesurer à la fois l'entité de signalisation 34
relocalisée et
non relocalisée.
L'invention permet, en outre, de mesurer la concentration de l'élément cible
37
dans la goutte 6.
Un cas simple pour ce faire est de se placer dans le cas où :
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
21
- l'élément de capture 36 est en quantité suffisante et d'affinité suffisante
pour
l'élément cible 37 pour capturer au moins plus de 90 % de l'élément cible sur
l'agrégat,
avantageusement la totalité ;
- la concentration de l'entité de signalisation 34 est supérieure à celle de
l'élément cible
37 et la constante de dissociation Kd entre l'entité de signalisation 34 et
l'élément cible 37
est inférieure à la concentration de l'élément cible 37, avantageusement d'un
facteur
supérieur à 10. Ceci est typiquement le cas quand on utilise des réactifs de
dosage
optimisés comme des anticorps monoclonaux de Kd subnanomolaires, et qu'on veut
détecter des concentrations d'élément cible 37 supérieures au nanomolaire.
On entend par c< nanomolaire égal à 1 nanomole/L.
Dans ces conditions particulière, la présence de chaque élément cible 37 donne
lieu à la formation d'un complexe élément de capture 36 - élément cible 37 -
entité de
signalisation 34. La concentration de l'élément cible 37 est donc
proportionnelle au signal
de l'entité de signalisation 34 relocalisé sur l'agrégat 10. D'autres
conditions permettent
de réaliser cette quantification et seront évidentes à l'homme de l'art en
modifiant les
concentrations et les affinités des éléments de capture 36, ou des entités de
signalisation
34 pour l'élément cible 37.
Application : détection de cellule tumorale
Si l'élément cible est un marqueur spécifique du sécrétome d'une cellule
tumorale,
sa détection peut suffire à détecter les cellules tumorales, uniques ou sous
forme d'un
agrégat, encapsulées.
Si l'élément cible est un marqueur caractéristique du sécrétome d'une cellule
tumorale, mais non spécifique des cellules tumorales, sa détection en
combinaison avec
un ou plusieurs autres éléments cibles constituant des marqueurs
caractéristiques du
sécrétome d'une cellule tumorale peut permettre de détecter que la cellule
unique
encapsulée est une cellule tumorale.
A la suite de l'étape de mesure, une information sur la nature tumorale de la
cellule encapsulée dans la goutte, sous forme de cellule unique ou dans un
agrégat de
cellules, est obtenue.
Cette information permet de savoir quelles gouttes doivent être récupérées en
aval
pour d'autres mesures ou utilisations.
Le procédé permet ainsi de détecter des cellules tumorales isolées à partir
d'un
échantillon biologique comprenant des cellules hétérogènes. Les cellules non
tumorales
ou les cellules tumorales ne produisant pas l'élément cible sont repérées car
leur goutte
ne contient pas l'élément cible et les entités de signalisation n'auront pas
été relocalisées.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
22
Ce procédé permet ainsi d'effectuer une détection voire un comptage de
cellules
tumorales dans une population de cellules provenant d'un échantillon
biologique.
Application : caractérisation de cellule tumorale
Si les cellules uniques encapsulées sont uniquement des cellules tumorales, la
mesure de l'élément cible peut permettre d'obtenir des informations relatives
à la
production de l'élément cible par la cellule tumorale unique, par exemple à sa
concentration.
Si l'agrégat de cellules encapsulées contient une ou des cellules tumorales,
la
mesure de l'élément cible peut permettre d'obtenir des informations relatives
à la
production de l'élément cible par l'agrégat de cellules, par exemple à sa
concentration.
A la suite de l'étape de mesure, une information est obtenue sur une ou des
caractéristiques de chaque cellule tumorale encapsulée dans la goutte, ou de
chaque
agrégat contenant une ou des cellules tumorales encapsulé(es) dans la goutte.
Cette information permet d'obtenir des informations sur l'hétérogénéité ou les
propriétés des cellules tumorales.
Application : détection et caractérisation de cellule tumorale
Au cours de la mesure, on peut obtenir à la fois des informations sur la
nature
tumorale de la cellule et sur des caractéristiques de la cellule tumorale, par
exemple en
détectant l'élément cible et en mesurant sa concentration.
En outre, en détectant plusieurs éléments cibles, on peut obtenir un grand
nombre
d'informations simultanément. Par exemple certains éléments cibles sont des
marqueurs
tumoraux et d'autres éléments du sécrétome, tels que des protéines ou
peptides, qui ne
sont pas spécifiquement des marqueurs tumoraux.
A la suite de l'étape de mesure, une information sur des caractéristiques de
chaque cellule tumorale encapsulée dans la goutte est obtenue.
Cette information permet d'obtenir des informations sur l'hétérogénéité des
cellules tumorales et différents mécanismes.
Deuxième appareil
Les figures 4 à 7 illustrent une partie d'un deuxième appareil 60 suivant
l'invention.
Ce deuxième appareil 60 diffère du premier appareil 1 en ce que le dispositif
20
comporte une chambre 62. La chambre 62 comporte une pluralité de passages de
circulation 64 et une pluralité de plots de séparation 66.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
23
D'autres chambres sont possibles. Dans une variante, des chambres ne
comprennent pas de plots de séparation tels que décrits dans le document
PCT/FR2009/051396.
La chambre 62 est destinée à stocker une pluralité de gouttes 6 dans un fluide
porteur 8 pendant une étape d'agrégation ou une étape d'orientation et pendant
l'étape de
mesure.
L'ensemble de mesure du deuxième appareil 60 diffère de l'ensemble de mesure
14 du premier appareil 1 en ce qu'il est apte à mesurer le paramètre physique
simultanément sur plusieurs gouttes 6 présentes dans la chambre 62.
La figure 4 présente la chambre 62 contenant des gouttes initiales 32 dans un
fluide porteur 8. La dispersion des particules 12 magnétique est visible. La
figure 5
présente la même chambre 62 après la formation des agrégats 10 dans les
gouttes. Une
pluralité d'agrégats allongés est formée dans chaque goutte 6. La figure 6
présente dans
un même dispositif 60 une pluralité de gouttes 6 présentant des agrégats 10
allongés. La
nature et la quantité de gouttes 6 ont été ajustées pour qu'un seul agrégat 10
allongé soit
présent par goutte. La présence d'un unique agrégat 10 par goutte 6 facilite
la mesure. La
figure 7 présente la même chambre 62 après une étape d'orientation des
agrégats selon
un même axe de détection D.
Procédé d'analyse avec le deuxième appareil
Le procédé d'analyse suivant l'invention à partir de ce deuxième appareil 60
diffère
du procédé précédemment décrit en ce que la mesure est effectuée sur la
pluralité de
gouttes 6 simultanément, par exemple par mesure dans toute la chambre 62 en
même
temps, et non par circulation des gouttes 6 devant un détecteur.
Un avantage de ce procédé est qu'il est possible de répéter la mesure du
paramètre physique sur une même gouttelette au cours du temps, puisque les
gouttes
sont stationnaires, et de pouvoir ainsi déterminer la cinétique de sécrétion
d'un élément
du sécrétome.
Le procédé diffère également en ce qu'il comprend avant l'étape de mesure, une
étape d'orientation de l'axe principal X de l'agrégat 10 selon un axe de
détection D.
Avantageusement, on pourra multiplier les axes de détection, en appliquant des
champs magnétiques d'orientation variable. Cette approche à l'avantage de
permettre de
discriminer l'agrégat 10 d'autres objets de la goutte non magnétiques, ou
réduire les
signaux parasites. Par exemple, le bruit de fond en fluorescence peut être
réduit. Par
exemple, la détection selon différents axes permet de distinguer une
relocalisation de
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
24
l'entité de signalisation 34 sur un agrégat 10 d'une relocalisation de
l'entité de
signalisation 34 sur un autre objet de la goutte 6, par exemple sur une
cellule.
Une implémentation de cette idée consiste à appliquer un champ magnétique B1
pour aligner l'axe principal X de l'agrégat 10 selon une première orientation
Dl, puis à
appliquer un champ magnétique B2 perpendiculaire à B1 pour aligner l'axe
principal X de
l'agrégat 10 selon une deuxième orientation D2 perpendiculaire à Dl.
Troisième appareil
Un troisième appareil 70 suivant l'invention est représenté sur la figure 8.
Ce
troisième appareil 70 diffère du premier appareil 1 en ce qu'il comporte en
outre un
ensemble de classement 72.
De plus, le troisième appareil 70 diffère du premier appareil 1 en ce que
l'ensemble de chargement 28 comprend une zone d'entrée 74 de la phase interne
et une
zone d'entrée du fluide porteur 76 et une zone de jonction 78. L'ensemble de
chargement
28 comprend en outre une zone d'incubation 79.
La zone d'entrée de la phase interne 74 comporte un premier conduit d'entrée
80,
un deuxième conduit d'entrée 82 et un conduit de co-écoulement 84.
Le premier conduit d'entrée 80 est destiné à l'introduction de la première
masse de
fluide 86 destinée à former une partie de la phase interne des gouttes. Dans
l'exemple, la
première masse de fluide interne comporte les particules 12 et une pluralité
d'entités de
signalisation 34.
Le deuxième conduit d'entrée 82 est destiné à l'entrée de la deuxième masse de
fluide 88 destinée à former une partie de la phase interne des gouttes. Dans
l'exemple, la
deuxième masse de fluide interne comporte une suspension de cellules
susceptible de
contenir des cellules tumorales productrices 90 de l'élément cible 37.
La concentration des cellules 90 dans la deuxième masse de fluide est
avantageusement telle qu'une proportion importante de gouttes contiennent une
cellule
90 seulement, par exemple plus de 10 c1/0 des gouttes contient une cellule 90.
Le conduit de co-écoulement 84 permet une répartition des deux masses de
fluide
86, 88 destinée à former la phase interne.
La zone d'entrée du fluide porteur 76 est destinée à l'entrée du fluide
porteur 8.
Dans l'exemple représenté, le fluide porteur 8 entre par deux conduits
d'entrées 92.
La zone de jonction 78 joint la zone d'entrée du fluide porteur 76 et la zone
d'entrée de la phase interne 74. En particulier, la zone de jonction joint le
conduit de co-
écoulement 84 aux conduits d'entrées 92 du fluide porteur.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
La zone de jonction 78 est apte à former les gouttes initiales 32. La zone de
jonction 78 représentée ici est une jonction de focalisation hydrodynamique.
Des
exemples de jonctions de focalisation hydrodynamique sont illustrés sur les
figures 11 et
12. En variante les gouttes initiales 32 sont formées dans une jonction T.
5 Les gouttes initiales 32 comprenant un mélange des deux masses de
fluides 86,
88 sont formées. Les gouttes initiales 32 comprennent une dispersion de
particules 12 et
des entités de signalisation 34.
Au moins certaines gouttes initiales 32 comprennent en outre une cellule 90,
unique ou sous forme d'un agrégat de cellules.
10 La zone d'incubation 79 est située en aval de la zone de jonction 78.
La zone
d'incubation est destinée à permettre la sécrétion de l'élément cible 37 par
les cellules 90,
uniques ou sous forme d'agrégats de cellules.
Avantageusement, la puce comprend un moyen d'apport ou d'échange d'oxygène
dans la zone d'incubation 79.
15 En variante, l'incubation est effectuée hors du dispositif 20.
Le troisième appareil 70 diffère également en ce que le dispositif 20 comprend
en
outre une pluralité de zones de classement 94, 96 et un moyen de direction 98
de la
goutte ou une partie de la goutte sélectivement vers une zone de classement
94, 96.
Les zones de classement 94, 96 sont situées en aval de la zone de détection
26.
20 Le conduit 24 comporte une bifurcation 100 en deux conduits de sorties
102, 104. La
première zone de classement 94 comporte le premier conduit de sortie 102
destiné à
recevoir un premier groupe de gouttes 106. La deuxième zone de classement 96
comporte le deuxième conduit de sortie 104 destiné à recevoir un deuxième
groupe de
gouttes 108. En variante, le dispositif 20 comporte un nombre plus important
de zones de
25 classement 94, 96 suivant le nombre de critères de tri.
Le moyen de direction 98 des gouttes sélectivement est par exemple apte à
diriger
une goutte 6 vers une zone de classement 94, 96 au moyen d'une force
magnétique.
En variante les gouttes 6 sont dirigées au moyen d'électrodes.
Par exemple, les gouttes sont dirigées vers une zone de classement, par
diélectrophorèse, par électrocoalescence avec un courant ou par des ondes
acoustiques
de surface (SAW).
Procédé d'analyse avec le troisième appareil
Le procédé d'analyse avec le troisième appareil 70 suivant l'invention va
maintenant être décrit.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
26
Un appareil 70 tel que précédemment décrit est fourni. Une suspension de
particules 12 magnétiques et d'entités de signalisation 34 est préparée et
injectée dans le
premier conduit d'entrée 80.
Une suspension de cellules 90 susceptible de contenir des cellules tumorales
est
préparée et injectée dans le deuxième conduit d'entrée 82.
Un fluide porteur 8 est fourni et injecté dans les conduits d'entrées de
fluide
porteur 92.
Les fluides 86, 88 sont mis en mouvement au moyen des ensembles de mise en
circulation 22. Les gouttes initiales 32 sont formées dans la zone de jonction
78.
Le procédé comporte, en outre, une étape d'incubation au cours de laquelle la
cellule 90, unique ou sous forme d'un agrégat de cellules, compartimentée est
susceptible
de sécréter, cliver ou relarguer, l'élément cible 37 du sécrétome de cellule
tumorale à
analyser, par exemple la protéine ou peptide du sécrétome de cellule tumorale.
L'incubation est ainsi réalisée dans des conditions et pendant une durée
suffisante pour
que la cellule 90, en particulier lorsqu'elle est sous forme de cellule
unique, soit
susceptible de produire au moins un élément cible 37 du sécrétome d'une
cellule
tumorale.
Typiquement, l'étape d'incubation dure 5 minutes à 32 heures, par exemple
environ 1 à 24 heures, ou encore 2 à 9 heures, notamment pour l'analyse de
cellules
fraîchement récupérées d'un fluide biologique d'un patient. En variante,
l'étape
d'incubation dure 32 à 72 heures, par exemple environ 32 à 48 heures, par
exemple
environ 36 heures, notamment pour l'analyse de cellules décongelées.
L'incubation est en général réalisée à 37 1 C, avec 5% de CO2. L'incubation
est
typiquement réalisée en présence d'un tampon ou milieu approprié.
Un avantage du procédé selon l'invention est que, par rapport au procédé
d'analyse EPISPOT tel que décrit dans la demande de brevet EP 1 506 407, la
durée de
l'étape d'incubation peut être raccourcie du fait de la sensibilité du procédé
selon
l'invention. Du fait de l'accumulation des éléments du sécrétome dans le
volume restreint
de la goutte, à durée d'incubation équivalente, la concentration des éléments
du
sécrétome à détecter sera plus élevée dans le procédé selon l'invention
comparativement
au procédé EPISPOT. La mise en oeuvre du procédé selon l'invention est donc
plus
rapide et plus sensible.
Les gouttes 6 comprennent avantageusement un milieu de culture permettant le
maintien en vie des cellules 90 dans la goutte pendant trois jours ou plus. Il
s'agit
typiquement d'un milieu de culture de cellules mammifères, notamment de
cellules
humaines, avec ou sans sérum.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
27
L'étape d'incubation est réalisée dans la zone d'incubation 79 du dispositif
20.
En variante, cette étape est réalisée hors du dispositif 20.
Les étapes de formation de l'agrégat 10 et de mesure sont les mêmes que pour
le
procédé d'analyse avec le premier appareil 1.
Le procédé diffère en ce que l'étape de mesure est suivie d'une étape
d'analyse.
L'étape d'analyse permet de déterminer à quel groupe 106, 108 appartient une
goutte 6
suivant des critères prédéterminée et de générer une décision de classement
par goutte 6
après l'étape de mesure.
Suivant la décision de classement, la goutte 6 est dirigée vers l'une des
zones de
classement 94, 96 par le moyen de direction 98.
Dans l'exemple représenté sur la figure 8, les gouttes 106 dans lequel le
signal de
forte intensité de fluorescence est localisé majoritairement au voisinage de
l'agrégat 10
sont dirigées dans la première zone de classement 94. Les gouttes du premier
groupe
106 correspondent par exemple aux troisièmes gouttes 56 de la figure 2.
Ces gouttes 106 contiennent par exemple les cellules tumorales 90, uniques ou
sous formes d'agrégats de cellules tumorales, dont le sécrétome comprend
l'élément cible
37. Les gouttes 106 sont éventuellement récupérées pour que leur contenu, et
notamment la ou les cellules tumorales contenues, soit analysé par d'autres
techniques,
ou pour que les cellules tumorales 90, uniques ou sous formes d'agrégats de
cellules
tumorales, soient remises en culture.
Les gouttes 108 dans lequel un signal différent, notamment un signal
sensiblement
homogène sur la goutte 108, a été mesuré sont dirigées vers une autre zone de
classement 96. Le deuxième groupe de gouttes 108 comporte par exemple des
gouttes
ne comprenant pas de cellule 90 et des gouttes contenant une cellule unique 90
ne
produisant pas l'élément cible 37 du sécrétome de cellule tumorale en quantité
ou en
qualité suffisante.
Une fois les cellules tumorales 90 vivantes identifiées par leur sécrétome et
triées,
de nombreuses analyses ultérieures peuvent être réalisées, éventuellement
après lyse
des gouttes et ré-encapsulation des cellules tumorales 90 vivantes dans des
gouttes,
comme par exemple l'analyse du transcriptome (ARN messagers pour l'expression
des
gènes, et microARNs), du génome, de l'épigénome, ou du protéome (Alix-
Panabières C,
Pantel K. Clinical Applications of Circulating Tumor Cells and Circulating
Tumor DNA as
Liquid Biopsy. Cancer Discov. 2016).
L'analyse du transcriptome, en particulier l'analyse des ARNm, des cellules
tumorales (notamment des CTCs) peut révéler des informations très importantes
sur la
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
28
sensibilité à un médicament et sa résistance. Par exemple, dans le cancer de
la prostate
métastatique et résistant à la castration, l'expression de l'ARNm ARV7, une
forme
tronquée du récepteur aux androgènes qui n'a plus de domaine de liaison à son
ligand
mais qui persiste actif, dans les CTCs pourrait prédire l'échec des thérapies
anti-
androgène (notamment des thérapies utilisant Enzalutamide et/ou abiraterone).
Des
patients dont les CTCs expriment cet ARNm ARV7 peuvent cependant rester
sensibles
aux taxanes et la détection de ce variant d'épissage ARV7 dans les CTCs
pourrait devenir
un marqueur de sélection d'un traitement approprié chez ces patients.
Les microARNs (miARNs) sont des régulateurs clés de l'expression des gènes et
sont devenus de potentiels marqueurs diagnostiques et des cibles importantes
pour les
thérapies anti-cancéreuses. Grâce à une technique d'hybridation in situ, il
est possible
d'analyser d'importants miRNAs (par exemple miR-10b) à l'échelle de la cellule
unique.
En ce qui concerne l'analyse du génome, des mutations au sein même de gènes
codent pour des cibles thérapeutiques ou des protéines de signalisation en
aval de cibles
qui affectent l'efficacité de thérapies ciblées. A titre d'exemple, les
mutations d'EGFR
affectent les thérapies anti-EGFR dans le cancer du poumon, et les mutations
KRAS ¨
une protéine en aval d'EGFR ¨ bloquent l'efficacité des thérapies anti-EGFR
dans le
cancer du colon. Récemment, l'analyse de centaines de CTCs obtenues à partir
de
patients avec un cancer colorectal a montré une forte hétérogénéité intra- et
inter-patients
pour la mutation KRAS. Les CTCs portant les gènes KRAS mutés échapperont à la
thérapie anti-EGFR et leur détection précoce peut être importante pour guider
le choix du
traitement patient par patient.
Les cellules analysées dans les gouttes peuvent être décapsulées de
l'émulsion.
Une méthode appropriée pour décapsuler l'émulsion comprend l'ajout de 5 % v/v
1H,1H,2H,2H-Perfluoro-1-octanol (Sigma-Aldrich), suivi par une incubation
d'une heure.
Les phases sont séparées par centrifugation (par exemple 300 g, pendant 5
min), et les
cellules sont collectées à l'interface des deux phases, aqueuse et fluorée.
Pour faciliter la collecte des cellules, la méthode peut comprendre
l'introduction
d'une troisième couche, d'une densité comprise entre celle de la phase aqueuse
et de la
phase fluorée (par exemple 1,10 g/m1), avant la centrifugation entre les deux
phases. La
troisième couche est généralement une solution aqueuse d'osmolarité adaptée
pour le
contact avec les cellules. Une solution adaptée est par exemple préparée par
exemple
dissolution de 27,6 g de Nycodenz (Progen) dans 100 ml d'une solution
consistant en
TrisHCI 5 mM, KCL 3 mM, CaNa2EDTA 0.3 mM, pH 7.5. Les cellules sont alors
récoltées
dans ladite troisième couche, positionnée à l'interface de la phase aqueuse et
de la phase
fluorée, évitant ainsi de prélever de la phase fluorée avec les cellules.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
29
Avantages de l'invention
L'utilisation d'une dispersion de particules 12 de faibles tailles par rapport
à la taille
des gouttes assure une distribution homogène des particules 12 dans les
gouttes 6, et
donc la formation quasi certaine d'un agrégat 10 de taille significative dans
chaque goutte
6.
Globalement, ce procédé permet de doser/quantifier un élément du sécrétome de
cellule tumorale, tel qu'une protéine ou peptide du sécrétome de cellule
tumorale dans la
goutte contenant la cellule unique ou l'agrégat de cellules.
La formation d'un agrégat allongé 10 permet d'obtenir un meilleur rapport
signal
sur bruit et un intervalle dynamique plus important par rapport à l'essai
décrit dans
Mazutis et al. (Nat prot 2013) où une seule bille est encapsulée. En effet le
signal généré
par l'entité de signalisation 34 sera concentré sur une largeur plus petite
que celle d'une
sphère de surface égale. La hauteur du pic ainsi que présenté sur la Figure 2
sera donc
plus élevée que dans le cas d'une seule bille pour un même nombre d'entité de
signalisation 34 relocalisées.
Ce procédé est utilisable dans de nombreux procédés d'analyse biologique. Le
procédé selon l'invention peut s'appliquer à de nombreux types d'éléments du
sécrétome,
notamment de protéines ou peptides du sécrétome.
Cette invention permet notamment d'analyser de manière très complète la
biopsie
liquide du cancer en temps réel par un phénotypage, une analyse du sécrétome
et
analyse moléculaire de cellules tumorales, uniques ou sous formes d'agrégats
de cellules
tumorales.
L'appareil selon l'invention peut être intégré comme une brique technologique
dans des dispositifs plus complexes en particulier dans un dispositif de
criblage à haut
débit, dans un laboratoire sur puce, dans un dispositif de 6< point of care
dans des
instruments de laboratoires, des robots, ou autres.
En outre, le procédé selon l'invention peut être intégré dans des protocoles
complexes permettant le diagnostic, la découverte de médicaments, la
découverte de
cibles, l'évaluation d'un médicament.
De plus les systèmes microfluidiques selon l'invention et les procédés selon
l'invention peuvent être combinés ou inclus dans d'autres types de composants
micro
fluidiques ou pour d'autres fonctions micro fluidiques connues dans l'état de
l'art.
L'invention peut, en outre, être particulièrement utile en combinaison avec
des
méthodes optiques diverses, notamment des méthodes de détection optique.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
Le procédé est applicable par exemple pour déterminer la présence d'un élément
cible 37 dans le sécrétome, la concentration d'un élément cible 37 sécrété,
relargué ou
clivé, ce qui permet d'établir des caractéristiques de la cellule tumorale
produisant
l'élément cible 37 dans la goutte 6.
5
Le procédé permet de plus le tri, la capture et l'extraction des gouttes
présentant
des caractéristiques intéressantes, et notamment contenant une cellule
tumorale unique
ou un agrégat de cellules tumorales.
Dans un exemple, le procédé comprend la formation d'un sandwich, l'élément
cible 37 étant d'une part lié à l'élément de capture 36 de la particule 12 et
d'autre part à
10 l'entité de signalisation 34, l'entité de signalisation 34 étant
fluorescente.
Dans un exemple, l'élément de capture 36 est un anticorps, polyclonal ou
monoclonal. Dans un exemple, l'entité de signalisation 34 est un anticorps,
polyclonal ou
monoclonal. Dans un exemple, l'élément cible 37 est un peptide ou une protéine
du
sécrétome.
15
Dans un exemple, l'élément de capture 36 est un acide nucléique, notamment une
sonde d'ADN ou un aptamère. Dans un exemple, l'entité de signalisation 34 est
un acide
nucléique, notamment une sonde d'ADN. Dans un exemple, l'élément cible 37 est
un
acide nucléique du sécrétome, notamment un ADN double brin, ARNm ou miRNA.
Dans un exemple, l'élément de capture 36 est un anticorps polyclonal ou
20
monoclonal ou nanocorps, ou un aptamère dirigé contre une protéine présente
dans la
membrane ou accrochée à la membrane, ou contre des lipides ou stérols. Dans un
exemple, l'entité de signalisation 34 est un anticorps, polyclonal ou
monoclonal. Dans un
exemple, l'élément cible 37 est un exosome. Dans un autre exemple, plusieurs
paires
élément de capture 36 ¨ élément cible 37 ou triplets élément de capture 36 ¨
élément
25
cible 37 ¨entité de signalisation 34 peuvent être analysé simultanément, pour
détecter la
présence de plusieurs éléments cibles 37 de nature différente.
Par exemple, tel que représentée dans la goutte sur la figure 13, une goutte
comprend plusieurs éléments cibles 37a, 37b de nature différente et plusieurs
entités de
signalisations 34a, 34b chacune étant apte à former un complexe avec un des
éléments
30
cibles 37a, 37b. Certaines particules 12 de l'agrégat 10 comprennent un
élément de
capture 36a adapté à la capture d'un premier élément cible 37a, d'autres
particules
comprennent un autre élément de capture 36b adapté à la capture d'un deuxième
élément cible 37b.
Dans certaines applications, l'agrégation des particules 12 est réversible.
Dans certains cas, la présence de l'élément cible 37 rend l'agrégation non
réversible et consolide l'agrégat 10 lors de sa formation dans l'ensemble
d'agrégation 30.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
31
L'agrégat 10 pré-existe donc de manière stable uniquement dans les gouttes 6
contenant
l'élément cible 37. Dans les gouttes ne contenant pas l'élément cible 37, la
réversibilité de
l'agrégation des particules 12 dissous l'agrégat 10 tant qu'il ne rentre pas
dans la zone de
lecture 26. Dans un régime choisi d'aimantation et de fluidique, l'agrégat 10
ne peut se
former et s'orienter qu'en présence de cette pré-agrégation, ce qui limite
l'acquisition de
pic selon la figure 2 aux gouttes contenant l'élément cible 37 par une autre
méthode que
via l'entité de signalisation 34.
La présente invention trouve en particulier application pour la détection
et/ou la
caractérisation de cellules tumorales isolées à partir de fluides biologiques.
Chaque
cellule peut relarguer, sécréter, ou cliver in vitro un certains nombres
d'éléments du
sécrétome de cellule tumorale, notamment un certains nombres de protéines ou
peptides,
dont un ou plusieurs marqueurs tumoraux permettant d'identifier une cellule
tumorale. La
présente invention permet également d'étudier ou caractériser le sécrétome de
cellules,
uniques ou sous forme d'un agrégat de cellules, qui auront, préalablement ou
simultanément à leur caractérisation, été identifiées comme étant des cellules
tumorales,
en particulier par le procédé de détection de cellules tumorales selon
l'invention.
Les cellules tumorales sont, par exemple, des cellules tumorales circulantes
vivantes, ci-après désignées par le sigle `CTCs', isolées du sang, ou des
cellules
tumorales disséminées vivantes, ci-après désignées par le sigle 'DTC', isolées
à partir de
la moelle osseuse, ou encore de cellules tumorales vivantes issues de
n'importe quel
autre liquide biologique, par exemple l'urine ou le liquide céphalo rachidien
(LCR).
Les cellules tumorales métastatiques agressives, qui sont capables de donner
des
métastases à distance, font notamment partie des cellules auxquelles
s'applique la
présente invention. En particulier, les CTCs regroupées en agrégat dans la
circulation
sanguine pourraient avoir un potentiel métastatique beaucoup plus élevé que
les CTCs
isolées.
La présente invention a l'avantage de permettre une analyse de CTCs vivantes,
et
donc d'étudier la fonctionnalité de ces cellules, alors que les techniques de
l'art antérieur
impliquent l'isolation et la fixation des CTCs, avant analyse.
Les cellules tumorales peuvent être des cellules tumorales de cancer solide ou
de
cancer liquide (leucémie, lymphome).
Par exemple, les cellules tumorales sont isolées à partir de fluides
biologiques de
patients ayant un cancer solide, par exemple un cancer du sein, de la
prostate, du colon,
du rectum, de la thyroïde, de la peau, du foie, du testicule, de l'ovaire,
etc.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
32
Les cellules tumorales sont en particulier des cellules humaines ou animales,
telles que des cellules de rongeur (par exemple de rat ou souris), de primate
(par exemple
de singe), de canin (par exemple de chien) ou félin (par exemple de chat).
Avantageusement les cellules auront été marquées préalablement à leur
encapsulation. Les cellules peuvent en effet être pré-marquées, par exemple
avec un ou
des anticorps marqués (par exemple avec un fluorochrome) dirigés contre un ou
des
marqueurs tumoraux membranaires, pour identifier la nature tumorale de la
cellule
encapsulée, ou de l'agrégat de cellules encapsulé, par détection du signal
émis par le ou
les anticorps marqués au niveau de la cellule ou de l'agrégat de cellules.
Cette détection
peut être réalisée sur les gouttes en circulation comme en mode statique.
A titre d'exemples, le ou les éléments cibles sont des cytokératines comme
CK19.
En variante, le ou les éléments cibles sont des marqueurs de tissu comme la
mammaglobine (pour le sein), le 'prostate-specific antigen' (PSA) ou la
kallikréine 3
humaine (hK3) (pour la prostate).
En variante, le ou les éléments cibles sont des marqueurs mésenchymateux
comme l' human glandular kallikrein >, (hK2), Her2-neu, la thyroglobuline,
CA19-9, CA15-
3 ACE (enzyme de conversion de l'angiotensine), CA-125, la Cathepsine D,
l'alphafoetoprotéine, la protéine S100, le (< fibroblast growth factor-2 ,,
(FGF-2), l'
epithelial growth factor (EGF) ,,, etc.
Dans un exemple, la cellule tumorale unique 90 est une cellule de tumeur de la
prostate, et au moins un élément cible 37 est le PSA (prostate-specific
antigen). Ce
marqueur est spécifique du cancer de la prostate. L'élément de capture 36
greffé sur les
particules 10 est un premier anticorps anti-PSA. L'élément de signalisation 34
est un
second anticorps anti-PSA qui est marqué, notamment par un fluorochrome tel
que Alexa
555. Ce marqueur est très spécifique des cancers de la prostate, sa présence
permet à
elle seule de caractériser les cellules comme des cellules tumorales provenant
d'un
cancer de la prostate.
Dans un autre exemple, plusieurs marqueurs sont détectés en combinaison pour
caractériser les cellules tumorales. Par exemple, certains marqueurs ne sont
pas
spécifiques à un type de cancer mais la présence combinée de deux marqueurs
différents
permet d'identifier le type de cancer. Le choix de combinaisons de marqueurs
appropriées
pour identifier un type de cancer est à la portée de l'homme du métier.
Ainsi, le marqueur VEGF existe dans le sécrétome de nombreuses cellules
tumorales. Cependant, sa présence avec d'autres marqueurs permet de
caractériser un
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
33
cancer. De même, la présence du marqueur FGF2 seul ne suffit pas à elle seule
à
caractériser un cancer.
Dans l'exemple illustré sur la figure 13, il est ainsi possible d'analyser la
présence
de plusieurs types d'éléments cibles secrétés. Chaque immunoessai de type
sandwich
détecte un élément cible distinct 37a, 37b sécrété par la cellule tumorale
unique 90.
La mesure de chaque signal de fluorescence permet donc d'avoir une information
sur la nature ou le phénotype de la cellule. De préférence, les entités de
signalisation 36
comprennent des fluorochromes. Un fluorochrome différent est de préférence
associé à
chaque partenaire de liaison spécifique d'un élément cible différent, et
notamment d'un
marqueur tumoral différent.
Ainsi, dans ses modes de réalisation particulièrement avantageux, le procédé
selon l'invention permet la détection des CTCs ou DTCs grâce à un procédé de
type
EPISPOT fluorescent multiparamétrique, qui utilise différents couples
d'anticorps et
différents fluorochromes. A titre d'exemple de fluorochromes, on peut citer
Alexa488, pour
le vert, Alexa555 pour le rouge, Alexa350 pour le bleu, etc.
Le nombre d'éléments cibles 37 pouvant être analysés pour une cellule tumorale
unique est choisi en amont de l'expérience, en choisissant les couples de
particules
fonctionnalisés avec des éléments de capture et d'entités de signalisation. Il
est par
exemple possible d'effectuer des mesures sur plus de neufs canaux de
fluorescence
différents. Ceci permet, par exemple de faire plus de neuf mesures simultanées
d'éléments du sécrétome d'une cellule tumorale unique.
Obtention des cellules tumorales
Selon des caractéristiques avantageuses de l'invention, le procédé de
détection
comprend une étape préliminaire d'enrichissement des CTCs ou DTCs présentes
dans
l'échantillon biologique.
L'enrichissement des cellules de l'échantillon biologique peut être basé sur
l'expression de marqueurs exprimés à la surface des cellules, la taille, la
densité ou les
charges électriques des cellules. Par exemple, les CTCs peuvent être isolées à
partir du
sang par déplétion des leucocytes ou par filtration.
L'enrichissement des cellules de l'échantillon biologique peut par exemple
consister soit en un tri positif des cellules, basé sur l'expression de
protéines spécifiques
membranaires des cellules épithéliales, comme par exemple, Epithelial Cell
Adhesion
Molecule ou EpCAM, soit sur un tri négatif des cellules basé sur l'expression
de
marqueurs spécifiques sur la surface des cellules hématopoïétiques non
voulues, comme
à titre d'exemple CD45, CD4, CD8, CD19, CD56.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
34
Les cellules peuvent être triées selon leur taille grâce à l'utilisation d'une
membrane-filtre qui retiendra les cellules de grosse taille et laissera passer
les cellules
hématopoïétiques de taille inférieure. Les cellules peuvent être triées selon
leur densité,
par des centrifugations sur des gradients spécifiques.
Les cellules peuvent être triées selon leur charge électrique par
diélectrophorèse
car les CTCs/DTCs, présentent une charge différente de celles des cellules
hématopoïétiques, par l'utilisation de la diélectrophorèse.
Toute autre méthode d'enrichissement permettant d'obtenir des cellules viables
connue de l'homme du métier convient aux fins de l'invention. Il s'agira donc
de méthode
ne mettant pas en oeuvre de fixation ou de perméabilisation des CTCs/DTCs afin
de
conserver leur fonctionnalité (Alix-Panabières et Pantel, Expert Rev Mol
Diagn.
2015;15(11):1411-7).
Les cellules obtenues après l'étape d'enrichissement peuvent être également
identifiées comme étant tumorales dans les gouttes. Selon un mode de
réalisation, les
cellules enrichies sont marquées avec un anticorps marqué (notamment par
fluorescence)
dirigé contre un ou des marqueurs de surface de cellule tumorale. Les cellules
tumorales
deviennent alors marquées, notamment par fluorescence, à leur membrane. A
titre
d'exemple, les cellules peuvent être marquées avec (1) un anticorps
fluorescent anti-
EpCAM et/ou un anticorps fluorescent anti-E-Cadhérine pour détecter
l'expression
d'EpCAM et/ou d'E-Cadhérine à la surface des cellules afin d'identifier toute
cellule
épithéliale, et/ou (2) un anticorps fluorescent anti-PSMA (Prostate specific
membrane
antigen) afin d'identifier des cellules tumorales de la prostate, et/ou (3) un
anticorps
fluorescent anti-N-Cadhérine afin d'identifier des cellules mésenchymateuses
qui auraient
subi une transition épithéliale-mésenchymateuse (EMT), et/ou (4) un anticorps
anti-
plastine 3 qui cible un nouveau marqueur, la plastine 3, qui n'est pas sous-
exprimé lors de
l'EMT et qui permet la détection des cellules tumorales épithéliales et
mésenchymales,
Cette étape qui précède l'encapsulation des cellules de l'échantillon et
permet de
déterminer le phénotype des CTCs ou DTCs.
La présente invention est particulièrement avantageuse car le nombre de
gouttes
n'est en théorie pas limité et peut atteindre en pratique, par exemple,
jusqu'à 100 000 et
même jusqu'à 1 000 000 gouttes. Il est ainsi possible d'avoir des gouttes ne
comprenant
pas de cellules ou des cellules non enrichies. Si la cellule encapsulée n'est
pas tumorale,
le signal sera différent et la goutte pourra être écartée. Le système permet
ainsi d'affiner
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
la purification. Il est donc adapté pour travailler à partir d'échantillons
biologiques peu
enrichis en CTCs.
Ceci est particulièrement avantageux pour détecter des cellules tumorales
rares
dans le sang, telles que les CTCs.
5
Exemples :
Des exemples de mise en oeuvre du procédé vont maintenant être décrits.
Le protocole des exemples suivants comprend :
- la préparation de plusieurs solutions aqueuses, contenant les particules
12,
10 l'entité de signalisation 34 et l'élément cible ou une cellule
susceptible de le sécréter, le
relarguer ou le cliver dans la goutte,
- l'injection des solutions aqueuses en entrée d'une puce de génération de
gouttes,
- la génération de gouttes comprenant tous les réactifs de l'essai
15 - l'incubation de la solution contenant les gouttes,
- l'injection des gouttes dans un appareil selon l'invention
(les exemples 1 et
2 correspondent respectivement au premier appareil 1 ou au deuxième appareil
60),
- la mesure des résultats de l'essai
- éventuellement un tri des gouttes en fonction de la mesure.
Exemple 1: dispositif de génération de gouttes et de mesure des gouttes de
type 1
La production des gouttes, autrement appelée compartimentation est réalisée
après avoir mélangé une solution de réactifs et une solution d'échantillon sur
puce.
Les solutions sont gardées sur la glace jusqu'à la compartimentation afin
d'éviter
toute dégradation des réactifs et échantillons.
La solution de réactifs est aspirée dans un réservoir connecté à une seringue
Hamilton d'1 mL remplie d'huile minérale (Sigma Aldrich, #330760) juste avant
le
démarrage de la compartimentation.
Les échantillons à cribler sont mélangés à la solution de travail juste avant
la
compartimentation puis transférés dans une fiole en verre préalablement
remplis d'huile
fluorée (3M, NOVEC HFE-7500) et la fiole est maintenue à 4 C sur glace.
Des capillaires, avantageusement en PTFE de diamètre interne 0.3mm (vendu par
Fischer, #11919445) permettent de relier la fiole et le réservoir de la
solution de réactifs
au dispositif de formation de gouttes.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
36
Ces deux solutions sont injectées sur une puce de formation de gouttes qui
permet de générer des gouttes comprenant un volume égal de chacune des deux
solutions.
Le volume des gouttes est choisi par l'utilisateur à partir du débit de
l'huile fluorée.
Avantageusement le volume des gouttes est de 33 picolitres. L'huile fluorée
est le fluide
porteur 8. Elle constitue la phase continue de l'émulsion comprenant les
gouttes.
Les solutions de réactifs d'essais et d'échantillons à cribler sont injectées
dans la
puce au même débit, avantageusement à 200 microlitres/heure pour chaque
solution. Le
débit est imposé par un système standard de pompe de seringue par exemple une
pompe
neMESYS de Cetoni ou par une pompe contrôlant la pression par exemple le
système
commercialisé par Fluigent.
Les gouttes sont générées à une jonction de focalisation hydrodynamique telle
qu'illustrée sur les figures 11 et 12. La phase externe est ici une huile
fluorée (3M,
NOVEC HFE-7500) à laquelle a été ajouté deux % poids/volume de tensioactifs
(par
exemple un copolymère tribloc comprenant deux queues perfluoropolyether (PFPE)
(de
poids moléculaire environ -6,000 g/mol) et une tête PEG (-600 gmol).
La figure 11 et la figure 12 représentent des dispositifs de flow-focusing
permettant
de mélanger un flux contenant les billes magnétiques mélangées aux autres
réactifs et un
flux contenant les échantillons avant la formation de gouttes au niveau de la
jonction de
focalisation hydrodynamique située à droite. Sur la figure 11, les particules
magnétiques
mesurent 500 nm de diamètre et sur la figure 12 les particules magnétiques
mesurent 200
nm de diamètre.
Une deuxième étape est l'étape de collection. Une fiole maintenue à 40 sous le
champ magnétique, avantageusement généré par un aimant en anneau (Amazing
magnet
H250H-DM), permet la collection des gouttes. Un capillaire court permet de
connecter la
fiole à la puce. Dans l'idéal, le capillaire de sortie mesure moins de 20 cm,
avantageusement 10 cm.
Les gouttes sont mises à incuber avantageusement à 37 C pendant 20 à 90
minutes et sous champs magnétique, le temps et la température d'incubation
dépendant
de l'analyse effectuée et du type d'entité productrice 90 et d'élément cible
37 étudiés.
A la suite de l'incubation, la fiole contenant l'émulsion est transférée à 4 C
toujours
maintenue sous champ magnétique.
Le premier type de dispositif est un dispositif suivant l'invention tel que
décrit sur la
Figure 1.
La fiole contenant les gouttes est connectée à une puce pour une réinjection,
la
fiole est d'une part connectée à la puce et d'autre part à un système de
pression, une
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
37
pompe de pression ou une seringue et sa pompe, constituant l'ensemble de mise
en
circulation 22.
L'ensemble d'espacement 31 comprend deux entrées d'huiles connectées à la
puce. Ces entrées sont destinées à injecter de l'huile avantageusement de
l'huile fluorée
permettant d'espacer les gouttes de l'émulsion telle qu'illustrée sur la
figure 9.
Les débits de l'huile d'espacement sont avantageusement fixés chacun à 300
microlitres/heure ainsi que le débit de l'ensemble de mise en circulation est
avantageusement fixé à 50 microlitres/heure et permettent d'ajuster le débit
et la
fréquence de réinjection de gouttes de façon à obtenir une fréquence comprise
entre 250
et 1000 Hz.
Une paire d'aimants permanents 38 avantageusement fournie par K&J Magnetics,
# BC 14-N52, est placée de part et d'autre de la puce autour du canal
principal 24. Ces
aimants 38 sont destinés à générer et à orienter les agrégats de billes
pendant la
réinjection des gouttes.
Un logiciel de contrôle de l'équipement, par exemple des lasers ou des
photomultiplicateurs, est créé pour analyser et trier les gouttes. Le système
de tri
nécessite une carte FPGA pour réaliser une analyse en temps réel du signal.
La mesure est effectuée dans les gouttes une à une après leur passage dans
l'ensemble d'espacement et ces gouttes peuvent être triées vers une sortie
désirée après
la zone de lecture illustrée sur la figure 10.
Lorsqu'un tri et une récupération sont désirés, les gouttes triées et les
émulsions
non triées sont recueillies sur glace et le contenu des gouttes est récupéré à
partir de
protocoles standards.
Exemple 2 : dispositif de mesure de gouttes de type 2 (deuxième appareil 60)
Le deuxième type de dispositif de mesure est une chambre de stockage des
gouttes produite dans un plan à 2 dimensions. Cet exemple présente deux
alternatives
possibles pour réaliser de telles chambres.
La première est une chambre fabriquée par microfabrication classique en PDMS,
comprenant avantageusement des piliers positionnés de manière régulière pour
éviter
l'effondrement de la chambre telle qu'illustrée sur les figures 4 à 7.
La seconde est une chambre en verre selon l'invention PCT/FR2009/051396.
Avantageusement, cette approche permet de réaliser une incubation des gouttes
sur de
longues durées (>1 H) sans déplacement des gouttes. Les gouttes peuvent donc
être
collectées directement dans une telle chambre après leur formation.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
38
Dans un exemple, le dispositif de mesure est un dispositif de lecture à deux
dimensions, par exemple dans une chambre en verre. Le champ magnétique est
généré
par une paire d'aimants permanents 38 avantageusement fournie par K&J
Magnetics, #
BY042 , placée de part et d'autre de la chambre de stockage. Ces aimants 38
sont
destinés à générer et à orienter les agrégats de billes dans des gouttes
stockées dans la
chambre.
Le signal fluorescent de l'entité de signalisation 34 relocalisé sur la ligne
de billes
magnétiques est mesuré par microscopie en épifluorescence.
Exemple 3: Quantification d'un marqueur tumoral dans un dispositif de
mesure de type 1
Le but de cet exemple est de démontrer la quantification d'un marqueur
tumoral.
Dans cet exemple, l'élément cible 37 est un marqueur tumoral et plus
particulièrement un marqueur d'angiogénèse (le VEGF [vascular epithelial
growth factor])
qui est déjà contenu dans la solution à cribler, cet exemple ne mettant pas en
oeuvre des
cellules.
Dans cet exemple les gouttes mesurent 33 picolitres.
La préparation des gouttes comprend :
- la préparation de deux solutions aqueuses, appelées solution de réactifs
contenant les particules 12, l'entité de signalisation 34 et solution
d'échantillon à cribler >> contenant l'élément cible dans les exemples ci-
dessous,
- l'injection des deux solutions aqueuses en entrée de la puce de génération
de
gouttes,
- la génération de gouttes comprenant un volume égale de chacune des deux
solutions,
- la mesure des gouttes dans un dispositif de type 1.
La Solution de réactifs contient :
- des particules 12 qui sont ici des particules magnétiques colloïdales, comme
des
particules conjuguées avec la steptavidine (par exemple des particules
Ademtech
streptavidin plus), qui sont fonctionnalisées avec un élément de capture 36,
par exemple
un anticorps spécifique du VEGF conjugé à la biotine (par exemple l'anticorps
Ref 500-
P10GBt, Peprotech). D'autres méthodes d'immobilisation sont possibles et sont
connues
de l'homme du métier, comme l'utilisation de particules carboxyle et 1-éthy1-3-
[3-
(diméthylamino)propyl]carbodiimide (EDC), par exemple,
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
39
- une entité de signalisation 34 qui est ici un anticorps contre VEGF
fonctionnalisé
avec une molécule fluorescente, comme le bevacizumab (fourni par le CHU de
Montpellier) qui est fonctionnalisé avec un N-Hydroxysuccinimide (NHS ester)
de l'Alexa
Fluor 647 ou similaire. D'autres combinaisons de fluorophores ou méthodes de
fonctionnalisation sont possibles ; et
- un colorant permettant la détection des gouttes 6, par exemple la
sulforhodamine
B.
Ces réactifs sont dilués dans une solution appelée solution de travail ,,.
La
solution de travail comprend :
- RPMI 1640 (Eurobio, Ref CM1RPM00-01),
- L-Glutamine 200mM/100X (Eurobio, Ref CSTGLU00): 1% final,
- Insulin-Transferin-Selenium (ITS) 100X (GIBCO, Ref 51300-044): 1% final,
- Sérum de veau foetal décomplémenté 10% (Eurobio, Ref CVFSVF00-01),
- EGF Human (Epidermal Growth Factor) ¨ Miltenyi (Ref 130093564): 20 ng/mL
final,
- bFGF (Basic Fibroblast Growth Factor) ¨ Miltneyi (Ref 130097750): 10 ng/mL
final,
- Antibiotiques (Penicilline G à 10 000 UI/500 mL + Gentamicine à 1 mg/500
mL),
- 25 mM de tampon HEPES à ph 7,4,
- 0,1% v/v Pluronic F-68 fourni par Life Technologies.
Les particules 12 colloïdales magnétiques sont traitées avant usage. Les
particules 12 sont des particules fournies par Chemicell (ScreenMAG) ou
Ademtech (Bio
Adembeads) dans une solution de stockage. Avantageusement, la streptavidine
(ou
similaire) est déjà immobilisée sur les particules par les fournisseurs (comme
les billes
streptavidine plus de Ademtech). Elles sont retenues sur un support magnétique
afin de
supprimer la solution de stockage puis elles sont mises en suspension dans un
excès de
pluronic F-127 à 10% poids/poids (ThermoFisher), avantageusement 10x le volume
initiale de particules, et incubées pendant quinze minutes dans un bain
d'ultra-son à 4 C.
Après ce traitement, les particules 12 colloïdales magnétiques sont lavées
deux
fois dans du PBS et mises en suspension dans la solution de travail. Dans
cette solution,
la version biotinylée de la molécule de capture est ajoutée en excès pour 1
heure
(température ambiante).
Avantageusement, les particules 12 sont lavées deux fois et mises en
suspension
dans la solution de travail.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
Les réactifs fluorescents sont centrifugés pendant cinq minutes à au moins 12
000
g et à 4 C avant usage, afin de supprimer les traces d'agrégats de réactifs.
La solution d'échantillon à cribler comprend :
- un élément cible 37, ici VEGF, propre à être capturé par l'élément de
capture
5 36 ; et
- la solution de travail.
La solution d'échantillon à cribler contient différentes concentrations de
l'élément
cible 37 (VEGF) (fournis par exemple par Genscript) dilués dans la solution du
travail (cf
ci-dessus).
10
Les concentrations de l'élément cible 37 (VEGF) dans la solution d'échantillon
à
cribler sont les suivantes : 0 nM, 5 nM, 20 nM ou 50 nM.
La solution de réactifs contient les réactifs suivants :
- 0.16 % p/v de particules magnétiques fonctionnalisées avec un élément de
capture 36, ici un anticorps spécifique à VEGF décris ci-dessus,
15 -
50 nM de l' entité de signalisation 34 appropriée, ici un autre anticorps
spécifique
à VEGF conjugué avec une molécule fluorescente,
- 1 pM de sulforhodamine B (pour le marquage des gouttes).
Cette solution est complétée de la solution du travail (cf ci-dessus).
Cela permet d'obtenir quatre émulsions différentes avec, respectivement 0 nM,
2,5
20 nM, 10 nM ou 25 nM d'élément cible 37 (VEGF).
Les gouttes sont ensuite analysées au moyen d'un dispositif de type 1 mesurant
la
fluorescence du fluorophore de l'entité de signalisation 34, comme le
Alexafluor488 ou
647.
25
Exemple 4: Quantification de deux marqueurs tumoraux simultanément
dans un dispositif de mesure de type 1
Le but de cet exemple est de démontrer la quantification de deux entités de
signalisation (deux marqueurs tumoraux) simultanément. Cet exemple est
similaire en
tout point à l'exemple 3 à la différence que deux éléments cibles 37 distincts
sont
30
mesurés simultanément. Les deux entités cibles sont les marqueurs tumoraux
VEGF et
CK19 [Cytokératine 19].
La Solution de réactifs contient :
- des particules 12 qui sont ici des particules magnétiques colloïdales,
fonctionnalisées avec deux éléments de capture 36, ici des anticorps
spécifiques de
35
VEGF (Ref 500-PiOGBt, Peprotech) et des anticorps spécifiques de CK19 (KS19.2
de
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
41
Progen) qui sont immobilisés sur les particules par une méthode appropriée,
comme par
le couple biotine-streptavidine,
- une première entité de signalisation 34 qui est ici un anticorps
spécifique du
VEGF marqué en fluorescence par un fluorophore approprié, comme une
conjugaison de
bevacizumab avec AlexaFluor647,
- une deuxième entité de signalisation 34 qui est ici un anticorps
spécifique de
CK19, comme le (KS19.1 de Progen), marqué en fluorescence par le fluorophore
Alexa
Fluor 488,
- un colorant permettant la détection des gouttes 6, tel que la
sulforhodamine B,
Ces réactifs sont dilués dans une solution appelée solution de travail
identique à
celle utilisée dans l'exemple 2.
La solution d'échantillon à cribler comprend :
- un premier élément cible 37, ici VEGF, propre à être capturé par le premier
l'élément de capture 36,
- un deuxième élément cible 37, ici CK19, propre à être capturé par le
deuxième
élément de capture 36,
- la solution de travail.
La solution d'échantillon à cribler contient différentes concentrations du
premier
élément cible 37 (VEGF), par exemple fournis par Genscript, et du deuxième
élément
cible 37 (CK19), par exemple fournis par MyBioSource) dilués la solution du
travail (cf ci-
dessus).
Les concentrations du premier élément cible 37 (VEGF) dans la solution
d'échantillon à cribler sont les suivantes : 0 nM, 2,5 nM, 10 nM ou 25 nM. Les
concentrations du deuxième élément cible 37 (CK19) dans la solution
d'échantillon à
cribler sont les suivantes : 0 nM, 2,5 nM, 10 nM ou 25 nM. Au total 16
combinaisons de
concentrations des deux éléments cibles sont préparées.
Les gouttes sont analysées au moyen d'un dispositif de type 1 mesurant
simultanément la fluorescence des fluorophores, comme l'AlexaFluor488 et 647,
sur les
deux entités de signalisation 34.
Exemple 5: Quantification d'un marqueur tumoral secrété à l'échelle de la
cellule unique dans un dispositif de mesure de type 1.
Le but de cet exemple est de démontrer la possibilité de détecter et
quantifier un
marqueur tumoral secrété à l'échelle de la cellule unique. Cet exemple est
similaire en
tout point à l'exemple 3 à la différence que l'élément cible 37 (VEGF) est
sécrété par une
entité productrice 90 (une cellule) dans la goutte pendant une phase
d'incubation. Les
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
42
cellules sont soit une lignée CTC de cancer du colon (CTC-MCC-41.4 obtenue au
sein du
laboratoire LCCRH), soit une population de cellules de patients atteints de
cancer du
colon enrichie en CTCs. Dans le deuxième cas, les CTCs sont enrichis avec le
protocole
des RosetteSep (procédure StemCell Technology) via une déplétion des
leucocytes.
Le protocole d'enrichissement des CTCs par la technique des RosetteSep est la
suivante :
- Transférer le sang (15 mL) du tube EDTA dans un falcon 50 de mL;
- Ajouter 20 pl de Rosette StemCell (Human circulating Epithelial Tumor
Cell
Enrichment ¨ Ref 15167) par mL de sang total ;
- Mélanger et mettre à tourner lentement sur le MACS mix au minimum 20mn ;
- Dans un falcon, déposer le volume adéquat de Ficoll (Milieu de séparation
des
lymphocytes) en fonction du volume de sang selon les recommandations du
fournisseur ;
- Diluer le sang au 1/2 avec du PBS 1x/2 /0SVF ;
- Déposer la solution [sang+rosettes+PBS] délicatement à la surface du
Ficoll et
centrifuger 20 min à 1200g sans frein.
- Récupérer toute la partie supérieure du Ficoll avec l'anneau cellulaire (où
se
trouvent les cellules tumorales circulantes) ;
- Laver 2X avec du PBS/SVF 2% qsp 50m I.
Le culot cellulaire obtenu contient les cellules tumorales circulantes et est
prêt à
être utilisé pour l'EPISPOT à cellule unique selon l'invention.
La solution d'échantillon à cribler contient des cellules mises en suspension
dans
la solution de travail décrite dans l'exemple 3. Avantageusement, la
concentration de
cellules par goutte est de 0,3 cellule par goutte. Une émulsion avec des
gouttes de 33
picolitres, comme ici, contient, plus de 30.106 gouttes par millitres. Pour
avoir 0,3 cellule
par goutte, il faut environ 18.106 cellules par millilitre dans la solution
d'échantillon à
cribler (qui est concentrée deux fois par rapport aux gouttes). Il convient de
noter que la
concentration en cellules dans la solution d'échantillon à cribler est deux
fois plus
importante que la concentration finale puisque les deux solutions aqueuses
seront mixées
dans une goutte avec un ratio 50/50.
Exemple 6: Quantification de deux marqueurs tumoraux simultanément
secrété à l'échelle de la cellule unique dans un dispositif de mesure de type
1.
Le but de cet exemple est de démontrer la possibilité de détecter et
quantifier
simultanément deux marqueurs tumoraux secrétés à l'échelle de la cellule
unique. Cet
exemple est similaire en tout point à l'exemple 5 à la différence que deux
éléments cibles
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
43
37 distincts, sont mesurés simultanément. Les deux éléments cibles sont les
marqueurs
tumoraux VEGF et CK19, qui sont mesurés comme dans l'exemple 4.
Exemple 7 : Tri de cellules en fonction d'un marqueur tumoral secrété.
Le but de cette expérience est de démontrer le criblage de cellules en
fonction
d'un marqueur tumoral secrété. Cet exemple est similaire en tout point à
l'exemple 5 à la
différence que les gouttelettes avec un signal de fluorescence important
correspondant à
la fluorescence du fluorophore sur l'entité de signalisation 34 sont triées
par
fluorescence activated dielectrophoresis (FADS) tel que décrit dans Baret et
al. (Lab
Chip 2009, 9, 1850-1858). Les gouttes triées et recueillies sont brisées et
les cellules sont
récupérées tel que décrit dans Mazutis et al. (Nat. Prot. 2013, 8, 870-891).
Exemple 8: Tri de cellules en fonction de deux marqueurs tumoraux
sécrétés.
Le but de cette expérience est de démontrer le criblage de cellules en
fonction de
deux marqueurs tumoraux sécrétés. Cet exemple est similaire en tout point à
l'exemple 7
à la différence que deux éléments cibles 37 distincts, sont mesurés
simultanément. Les
deux éléments cibles 37 sont les marqueurs tumoraux VEGF et CK19, qui sont
mesurés
comme dans l'exemple 4. Les gouttelettes avec un signal de fluorescence
important
correspondant à la fluorescence du fluorophore comme le Alexafluor488 sur la
première
entité de signalisation 34, et Alexafluor647sur la deuxième entité de
signalisation 34 sont
triées par ,< fluorescence activated dielectrophoresis (FADS) tel que décrit
dans Baret et
al. (Lab Chip 2009 , 9, 1850-1858). Les gouttes triées et recueillies sont
brisées et les
cellules sont récupérées tel que décrit dans Mazutis et al. (Nat Prot 2013).
Exemple 9: Quantification d'un marqueur tumoral dans un dispositif de
mesure de type 2 (deuxième appareil 60)
Le but de cet exemple est de démontrer la quantification d'un marqueur tumoral
dans un dispositif de type 2, c'est-à-dire une chambre dans laquelle les
gouttes sont
réparties en deux dimensions dans une couche unique. Cet exemple est similaire
en tout
point à l'exemple 3 à la différence que les gouttes mesurent 40 picolitres et
sont
analysées dans un dispositif de mesure de type 2. Une chambre de 38 pm de
hauteur est
créée entre deux lames de verre. Une entrée et une sortie sont réalisées dans
la lame de
verre supérieur et munis chacun de connecteur standard pour y connecter les
capillaires
de connexion.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
44
Exemple 10: Quantification de deux marqueurs tumoraux simultanément
dans un dispositif de mesure de type 2 (deuxième appareil 60)
Le but de cet exemple est de démontrer la quantification de deux entités de
signalisation (deux marqueurs tumoraux) simultanément dans un dispositif de
type 2, Cet
exemple est similaire en tout point à l'exemple 4 à la différence que les
gouttes mesurent
40 picolitres et sont analysées dans un dispositif de mesure de type 2, comme
dans
l'exemple 9.
Exemple 11: Mesure cinétique et quantitative d'un marqueur tumoral secrété
à l'échelle de la cellule unique dans un dispositif de mesure de type 2
(deuxième
appareil 60).
Le but de cet exemple est de démontrer la mesure cinétique et quantitative
d'un
marqueur tumoral secrété à l'échelle de la cellule unique dans un dispositif
de type 2. Cet
exemple est similaire en tout point à l'exemple 5 à la différence que les
gouttes mesurent
40 picolitres et sont analysées dans un dispositif de mesure de type 2, comme
dans
l'exemple 9. En mesurant l'évolution, à l'échelle de la cellule unique, du
signal fluorescent
de l'entité de signalisation 34 relocalisé sur la ligne de billes magnétiques
le taux de
sécrétion de l'élément cible 37 (le marqueur tumoral VEGF) est déterminé.
Exemple 12: Mesure cinétique et quantitative de deux marqueurs tumoraux
simultanément secrétés à l'échelle de la cellule unique dans un dispositif de
mesure de type 2 (deuxième appareil 60).
Le but de cet exemple est de démontrer la mesure cinétique et quantitative
simultanément de deux marqueurs tumoraux secrétés à l'échelle de la cellule
unique dans
un dispositif de type 2, Cet exemple est similaire en tout point à l'exemple 6
à la différence
que les gouttes mesurent 40 picolitres et sont analysées dans un dispositif de
mesure de
type 2, comme dans l'exemple 9 à la différence que deux éléments cibles 37
distincts,
sont mesurés simultanément. Les deux entités cibles sont les marqueurs
tumoraux VEGF
et CK19, qui sont détectés comme dans l'exemple 10.
En mesurant l'évolution, à l'échelle de la cellule unique, les signaux
fluorescents
des deux entités de signalisation 34 relocalisés sur la ligne de billes
magnétiques le taux
de sécrétion des deux éléments cibles 37 (les marqueurs tumoraux VEGF et CK19)
sont
déterminés.
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
Exemples de mise en oeuvre
La figure 14 illustre la quantification d'un marqueur tumoral dans un
dispositif de
type 1. Le graphique montre la valeur du pic d'intensité maximale obtenue pour
le canal
5 mesurant la fluorescence verte. Les gouttes comprennent des billes
recouvertes avec un
anticorps anti-PSA biotinylé. Les billes sont alignées pour former une
colonne. Avec 25
nM de PSA, la fluorescence de l'anticorps secondaire anti-PSA est relocalisée
sur la
colonne de billes magnétiques, ce qui augmente la valeur du pic d'intensité
(n=200,000).
La barre d'erreurs montre la déviation standard. On effectue la même mesure
pour des
10 gouttes contenant des cellules LnCAP ayant été incubées pendant 1 heure
à 37 C dans
les gouttes. Les LnCAP sont des cellules issues d'une lignée cellulaire
épithéliale dérivée
à partir d'un carcinome de prostate humaine.
La figure 15 illustre un tri de gouttes dans un dispositif de type 1. Ce
graphique
montre la possibilité de mesurer les cellules secrétant la PSA dans un
dispositif de type 1.
15 Trois différentes populations de gouttes peuvent être distinguées en
raison de leurs codes
de gouttes différents (représenté selon l'axe des abscisses, correspondant à
la
fluorescence du marqueur Sulforhodamine B). De gauche à droite, on observe
l'émulsion
de cellules à trier, le contrôle positif et le contrôle négatif. Dans le canal
de fluorescence
représenté en ordonné, la relocalisation de l'anti-PSA sur la colonne de
billes est illustrée.
20 Les gouttes comprises dans le rectangle noir sont des gouttes positives
pour la sécrétion
de PSA et contenant une cellule.
La figure 16 illustre un tri de gouttes dans un dispositif de type 1. Ce
graphique
montre une fenêtre de sélection pour le tri de gouttes positive à l'EpCAM à
partir d'une
émulsion de gouttes contenant des cellules. Le chargement est d'environ 5%.
Ceci
25 montre une bonne corrélation entre la positivité EpCAM dans la fenêtre
de sélection et le
chargement en cellules. L'axe des ordonnées représente la valeur maximale
mesurée au
sein de la goutte (c'est-à-dire le pic correspondant à la cellule). L'axe des
abscisses
représente l'intégrale du signal sous le pic.
Les figures 17 à 20 illustrent un tri sur la base de deux critères dans un
dispositif
30 de type 1. La figure 17 représente une fenêtre de sélection c, gate 5
pour le tri des
cellules positives à l'EpCAM. La figure 18 représente une fenêtre de sélection
gate 6
pour des cellules secrétant PSA. Pour être sélectionnés, les deux critères
doivent être
sastisfaits, les gouttes sélectionnées correspondent aux gouttes dont les
mesures dont
dans les fenêtres c< gate 5 et gate 6 .
35 Les images des figures 19 et 20 représentent des gouttes triées avec
succès selon
deux critères : la sécrétion de PSA (figure 19), et l'expression d'EpCAM.
(figure 20). Des
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
46
gouttes vides (contrôle négatif) ont également été triées pour faciliter le
transfert des
gouttes d'intérêts dans la chambre de visualisation. En partant d'une émulsion
avec 0,2%
de gouttes d'intérêt, il est obtenu un enrichissement à 20% de gouttes
d'intérêt. En
comptant les gouttes contrôle négatif conservées pour le transfert des gouttes
on obtient
un transfert des gouttes efficace à environ 99%.
Les figure 21 à 23 illustrent une quantification d'un marqueur tumoral dans un
dispositif de type 2. Les figures 21 (en champ clair) et 22 (dans un canal de
fluorescence)
montrent la sécrétion de PSA par des cellules LNCAP. Ces cellules sont
incubées
pendant une heure dans les gouttes et la sécrétion de PSA aboutit à la
relocalisation de la
fluorescence sur l'agrégat de particules en colonne.
La figure 23 illustre une courbe de calibration pour la quantification du PSA
obtenue à partir du tableau de gouttes. La courbe présente une forme
généralement
observée pour les expériences d'immunoessais sans lavage. Après une phase
d'augmentation brusque (jusqu' à 60nM) dans laquelle la protéine se lie aux
billes, on
observe une diminution de la relocalisation de fluorescence due à la
saturation sur les
billes et une augmentation de la concentration de PSA libre. Les données sont
présentées
en moyenne et erreur ¨type de la moyenne (SEM).
Nous avons réalisé cette courbe de calibration à partir de la forme soluble de
la
protéine de PSA, à différente concentration avec deux anticorps respectifs.
Les
concentrations des réactifs, billes et agents de détection sont ajustées pour
que la
capacité de PSA soit à environ 70nM. Le système est très sensible aux
concentrations les
plus faibles en dessous de 70nM. Nous avons déterminé que la limite de blanc
(correspondant au plus fort signal attendue dans une goutte vide) est de
1,047. Il faut
comparer cette valeur à la valeur moyenne de 1,031 obtenue pour une
concentration de
OnM. La limite de détection, c'est-à-dire la plus petite quantité distinguable
du bruit de
fond, est de 2,5 nM PSA, correspondant à seulement 60000 molécules. En
incubant des
cellules pendant une heure, on peut détecter toutes les cellules qui sécrètent
plus de 16
molécules par secondes. En prolongeant le temps d'incubation à 2 heures, on
peut
diminuer cette limite aux cellules sécrétant 8 molécules par secondes, etc.
Les taux de
sécrétions rapportés dans la littérature pour d'autres molécules peuvent
varier entre 10 et
10000 molécules par secondes selon le type cellulaire et la fraction sécrétée.
Ceci montre
que l'ordre de grandeur obtenu est satisfaisant.
En outre, la courbe de calibration montre une augmentation de signal à des
concentrations plus élevées. Par exemple à environ 500nM de PSA le signal peut
être
significativement distingué du bruit de fond. Ceci est avantageux pour des
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
47
développements d'expérience car même les cellules avec de très haut taux de
sécrétion
peuvent être détectées.
Les figure 24 et 25 illustrent une quantification d'un marqueur tumoral dans
un
dispositif de type 2. Les figures 24 (en champ clair) et 25 (dans un canal de
fluorescence)
représente la sécrétion de la protéine CK19 par une cellule SK-BR-3. SK-BR3
est une
lignée cellulaire provenant d'une tumeur d'un cancer du sein humain.
CK19 est habituellement une protéine intégrée dans la membrane cellulaire.
Cependant, elle peut être détachée et se relocaliser sur l'agrégat allongé.
Une lignée cellulaire épithéliale dérivée à partir d'un carcinome de prostate
humaine (LnCAP) est utilisée pour les expériences afin d'observer la sécrétion
cellulaire
de PSA.
Nous avons trouvé que la température est un facteur important puisque la
sécrétion de protéine a seulement pu être observée autour des températures
physiologiques et pas à des températures inférieure telle que 25 C. Aux
températures
inférieures, les signaux relocalisés sur les cellules et non sur les
particules, montrant que
la PSA était liée à la membrane ou qu'un phénomène similaire avait lieu.
Nous avons en outre utilisé la cellule de la lignée LnCAP pour déterminer le
pourcentage de sécrétion de PSA de ces cellules. En considérant la littérature
et des
expériences précédentes, nous savons que toutes les cellules ne vont pas
produire en
permanence de la PSA. L'idée de cette expérience est de prélever le
pourcentage de
cellules qui sécrètent de la PSA au sein de la population de LnCAP. Cette
expérience est
effectuée à 37 C et les signaux de sécrétions sont mesurés à 0, 30 et 60
minutes.
Le tableau suivant représente les conditions et résultats de l'expérience sur
la
sécrétion de PSA en utilisant des cellules LnCAP comme modèle.
Temps d'incubation à 37 C (min) 0 30 60
Nombre de gouttes 5860 6352 5745
Nombre de cellules 53 57 52
Relocalisation de fluorescence sur l'agrégat 0 - 16 27
allongé
Relocalisation de fluorescence sur les 19 11 6
cellules
Pas de relocalisation trouvée 34 30 19
% de cellules sécrétant le marqueur 0 27.9 52.25
% d'anticorps relocalisé sur les cellules 36 19.2 11.6
CA 03020964 2018-10-12
WO 2017/178662
PCT/EP2017/059209
48
A 0 minute, aucune relocalisation de fluorescence n'est trouvée au niveau de
l'agrégat allongé. Cependant, nous avons remarqué que l'agent de détection
était
relocalisé sur la membrane de certaines cellules. Ce phénomène est sans doute
lié aux
conditions de culture et à une centrifugation à température ambiante. Nous
avons fait le
même constat pour les mesures à 30 minutes ou 60 minutes mais le nombre de
cellules
avec l'agent de détection relocalisé sur la membrane a diminué régulièrement
tandis que
le pourcentage de cellules sécrétant le marqueur augmente.
Ensuite, nous pouvons analyser le profil de sécrétion des cellules LnCAP
encapsulée individuellement.
La figure 26 illustre la mesure de la cinétique d'un marqueur sécrété dans un
dispositif de type 2 La figure 26 représente un profil de sécrétion de PSA
pour des cellules
LnCAP individuelles encapsulées dans des gouttes pendant une heure puis
mesurées par
intervalles de dix minutes.
Ici, nous montrons que le taux de sécrétion des cellules individuelles est
varié,
même si des distributions similaires ont été trouvées pour d'autres lignées
cellulaires.
Nous montrons également que la sécrétion suit plutôt une cinétique brusque
qu'une
libération régulière.
On observe que quelques cellules sécrètent plus de 800 molécules de PSA tandis
que la majorité des cellules sécrète très peu de molécules de PSA (environs 10
molécules
par cellules) ou aucune (ces cellules n'ont pas été représentées.
Pour simuler les détections de cellules tumorales circulantes (CTCs) dans le
sang,
nous avons mélangé des cellules LnCAP avec des cellules Jurkat. Les cellules
Jurkat
proviennent d'une lignée immortalisée de Lymphocite T humain. Les deux lignées
cellulaires ont été mises en culture dans un milieu RPMI avec 10% de FBS et
encapsulée
dans des gouttes. Ces expériences montrent qu'on est en effet capable de
détécter de
faibles quantités de cellules. Nous avons réalisé l'expérience pour
différentes
concentrations de LnCAP dans les cellules Jurkat. Pour la détection, nous
avons utilisé la
taille de la cellule avec un marqueur de fluorescence.
Le tableau suivant présente dans les résultats de l'expérience.
Taux de Testé Nombre de Nombre
de Nombre total de
Dilution de (correspondants LnCAP LNCAP cellules
LnCAP dans les au taux de attendues trouvées
Jurkat dilution trouvé)
0.0001 0.0001 3 4 30284
0.001 0.001 31 32 31612
0.001 0.0004 8 4 8184
49
0.001 0.001 2 2 1701
0.01 0.0093 45 42 4498
0.1 0.07 198 138 1975
L'étude préliminaire montre que le minimum de détection de LnCAP peut être de
0.0001.
Nous avons construit cette expérience pour détecter la PSA dans les gouttes et
montrer que les cellules LnCAP sécrètent le PSA à un taux détectable. Les
expériences
montrent la sensibilité de détection dans des cellules mélangées
artificiellement avec
d'autres cellules.
***
Selon certains aspects, une ou plusieurs des réalisations suivantes sont
décrites :
1.- Un procédé de détection et/ou de caractérisation de cellules tumorales
vivantes
issues d'un fluide biologique d'un patient ayant un cancer solide, comprenant
:
- la fourniture d'une pluralité de gouttes contenues dans un fluide porteur,
au moins
une des gouttes comprenant au moins un agrégat de particules définissant un
objet allongé
selon un axe principal, au moins certaines gouttes contenant une cellule
susceptible de
produire au moins un élément cible du sécrétome d'une cellule tumorale propre
à se fixer sur
l'agrégat ;
- la mesure d'au moins un paramètre physique caractéristique de la fixation
d'un
élément cible du sécrétome d'une cellule tumorale sur l'agrégat ; et
- la détection et/ou la caractérisation de cellules tumorales à partir de la
mesure dudit
au moins un paramètre physique,
dans lequel la cellule tumorale vivante est choisie dans le groupe constitué
par une
cellule tumorale circulante (CTC) et une cellule tumorale disséminée (DTC).
2.- Le procédé selon la réalisation 1, ledit procédé étant un procédé de
détection
et/ou de caractérisation de cellules tumorales vivantes uniques issues d'un
fluide biologique
d'un patient ayant un cancer solide comprenant :
- la fourniture d'une pluralité de gouttes contenues dans un fluide porteur,
au moins
une des gouttes comprenant au moins un agrégat de particules définissant un
objet allongé
selon un axe principal, au moins certaines gouttes contenant une cellule
unique ;
Date Reçue/Date Received 2023-12-01
50
- l'incubation des gouttes contenant une cellule unique dans des conditions
et
pendant une durée suffisante pour que la cellule unique soit susceptible de
produire au
moins un élément cible du sécrétome d'une cellule tumorale, propre à se fixer
sur l'agrégat ;
- la mesure d'au moins un paramètre physique, chaque paramètre physique
étant
caractéristique de la fixation d'un élément cible distinct du sécrétome d'une
cellule tumorale
sur l'agrégat ; et
- la détection et/ou la caractérisation de cellules tumorales uniques à
partir de la
mesure dudit au moins un paramètre physique.
3.- Le procédé selon la réalisation 1 ou 2, dans lequel l'étape de mesure
comporte la
mesure dudit au moins un paramètre physique localement en une pluralité de
points situés
dans la goutte.
4.- Le procédé selon la réalisation 3, dans lequel l'étape de mesure comporte
la
détermination de l'intégrale des valeurs mesurées au sein de la goutte.
5.- Le procédé selon l'une quelconque des réalisations 1 à 4, dans lequel
les cellules tumorales vivantes sont issues d'un patient ayant un cancer
solide choisi
dans le groupe constitué par le cancer du sein, de la prostate, du colon, du
rectum, de la
thyroïde, de la peau, du foie, du testicule, et de l'ovaire.
6.- Le procédé selon l'une quelconque des réalisations 1 à 5, dans lequel
l'élément
cible du sécrétome d'une cellule tumorale propre à se fixer sur l'agrégat est
un marqueur
spécifique du sécrétome d'une cellule tumorale.
7.- Le procédé selon la réalisation 6, dans lequel le marqueur spécifique du
sécrétome d'une cellule tumorale est choisi dans le groupe constitué par les
cytokératines,
les marqueurs de tissu et les marqueurs mésenchymateux.
8.- Le procédé selon la réalisation 7, dans lequel le marqueur spécifique
sécrétome
d'une cellule tumorale est choisi dans le groupe constitué par la protéine PSA
(Prostate
Specific Antigen), la mammaglobine, la kallikréine 3 humaine (hK3), l' human
glandular
kallikrein (hK2), la thyroglobuline, les protéines Caner antigen CA19-9,
CA15-3, CA 125,
l'enzyme de conversion de l'angiotensine (ACE), la Cathepsine D,
l'alphafoetoprotéine, la
protéine S100, le FGF-2, l'EGF, HER2, EGFR (Epithelial Growth Factor
Receptor), MUC 1,
et la Cytokeratin 19.
Date Reçue/Date Received 2023-12-01
51
9.- Le procédé selon l'une quelconque des réalisations 1 à 8, dans lequel
l'étape de
mesure est effectuée dans une chambre microfluidique sans circulation des
gouttes.
10.- Le procédé selon l'une quelconque des réalisations 1 à 9, comprenant :
- la fourniture d'un dispositif comprenant un ensemble de mise en
circulation de la
goutte et une pluralité de zones de classement, et un moyen de direction de la
goutte ou
d'une partie de la goutte sélectivement vers une zone de classement,
- la décision de classement de la goutte ou d'une partie de la goutte, la
décision
.. consistant à choisir sélectivement une zone de classement parmi la
pluralité des zones de
classement,
- le transport de la goutte, respectivement d'une partie de la goutte, vers
la zone de
classement de la goutte choisie lors de l'étape de décision.
11.- Le procédé selon l'une quelconque des réalisations 1 à 10, dans lequel au
moins
une goutte comprend au moins deux entités de signalisation distinctes, chacune
des deux
entités de signalisation étant apte à former un complexe avec un élément cible
distinct sur
l'agrégat, le procédé comprenant la mesure d'un signal indiquant la
concentration de
chacune des entités de signalisation relocalisée.
12.- Le procédé selon la réalisation 11, dans lequel au moins certaines
gouttes
comprennent une cellule tumorale susceptible de sécréter, cliver ou relarguer
un ou
plusieurs éléments du sécrétome de cellule tumorale, chaque élément du
sécrétome de
cellule tumorale étant un élément cible distinct, la mesure du signal
indiquant la
concentration de chacune des entités de signalisation relocalisées permettant
une
quantification du ou des éléments du sécrétome de cellule tumorale.
13.- Un appareil de détection et/ou de caractérisation de cellules tumorales
vivantes
issues d'un fluide biologique d'un patient ayant un cancer solide comprenant :
- un ensemble de fourniture d'une pluralité de gouttes contenues dans un
fluide
porteur, au moins une des gouttes comprenant au moins un agrégat de particules
définissant
un objet allongé selon un axe principal, au moins certaines gouttes contenant
une cellule
tumorale susceptible de produire un élément cible propre à se fixer sur
l'agrégat, ladite
cellule tumorale vivante étant choisie dans le groupe constitué par une
cellule tumorale
circulante (CTC) et une cellule tumorale disséminée (DTC)
Date Reçue/Date Received 2023-12-01
52
dans lequel l'appareil comprend un ensemble de mesure d'un paramètre physique
caractéristique de la fixation d'un élément cible sur l'agrégat.
14.- L'appareil selon la réalisation 13, dans lequel l'appareil comprend, en
outre :
- un ensemble mise en circulation de la goutte,
- un ensemble de décision de classement de la goutte, et
- un ensemble de tri de la goutte selon la décision de classement.
15.- Une goutte de détection et/ou de caractérisation de cellules tumorales
vivantes
issues d'un fluide biologique d'un patient ayant un cancer solide, comprenant
une pluralité de
particules propre à former un agrégat de particules définissant un objet
allongé selon un axe
principal, et une cellule tumorale, ladite cellule tumorale étant choisie dans
le groupe
constitué par une cellule tumorale circulante (CTC) et une cellule tumorale
disséminée
(DTC).
16.- La goutte selon la réalisation 15, dans laquelle la goutte comprend en
outre au
moins un élément cible du sécrétome de la cellule tumorale propre à se fixer
sur l'agrégat.
17.- Un procédé de préparation de gouttes de détection et/ou de
caractérisation de
cellules tumorales vivantes issues d'un fluide biologique d'un patient ayant
un cancer solide
comprenant :
- la dispersion, dans une masse de fluide destinée à former des gouttes, de
particules
propres à former un agrégat définissant un objet allongé selon un axe
principal, et d'une
pluralité de cellules, au moins certaines cellules étant des cellules
tumorales susceptibles de
produire un élément cible du sécrétome d'une cellule tumorale, lesdites
cellules tumorales
étant choisies dans le groupe constitué par une cellule tumorale circulante
(CTC) et une
cellule tumorale disséminée (DTC), puis
- la dispersion de la masse de fluide sous forme de gouttes, de sorte que
chaque
goutte comprenne une pluralité de particules et qu'au moins certaines gouttes
comprennent,
en outre, une cellule.
18.- Le procédé selon la réalisation 17, comprenant en outre une étape de
formation
dans chaque goutte d'au moins un agrégat de particules définissant un objet
allongé selon
un axe principal, l'agrégat de particules étant formé dans chaque goutte après
la dispersion.
Date Reçue/Date Received 2023-12-01