Note: Descriptions are shown in the official language in which they were submitted.
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
1
SYSTEME FLUIDIQUE DE PRODUCTION DE VESICU LES EXTRACELLULAIRES
ET PROCEDE ASSOCIE
DOMAINE DE L'INVENTION
L'invention concerne un système de production de vésicules
extracellulaires à partir de cellules productrices, un procédé de production
et de récupération de telles vésicules et des vésicules produites par un tel
système, par exemple utilisées dans la thérapie cellulaire et dans la
médecine régénérative.
ETAT DE LA TECHNIQUE
Les cellules sont connues pour libérer des vésicules extracellulaires
dans leur environnement, par exemple, in vivo, dans les fluides biologiques
d'un organisme. Les vésicules extracellulaires ont été identifiées comme
des moyens efficaces pour administrer des médicaments, de manière
personnalisée ou ciblée, dans le corps humain. Elles présentent d'abord une
biocornpatibilité native et une tolérance immunitaire. Elles peuvent
également comprendre des nanoparticules théranostiques, permettant à la
fois d'imager certaines parties du corps et de délivrer des principes actifs
ayant des fonctions thérapeutiques. Les vésicules extracellulaires ont
également une fonction de communication intercellulaire : elles
permettent, par exemple, de transporter des lipides, des protéines
rnernbranaires et cytoplasmiques et/ou des nucléotides du cytoplasme
cellulaire, tels que des ARNrn, des rnicroARN ou des ARN longs non-codants,
entre différentes cellules.
En particulier, l'utilisation de vésicules extracellulaires peut
permettre de résoudre des problèmes connus lors de l'utilisation
thérapeutique de cellules, tels que la réplication cellulaire, la
différentiation, les occlusions vasculaires, les risques de rejet et les
difficultés de stockage et congélation. Il existe en conséquent un besoin
industriel pour la production de vésicules cellulaires en quantités
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
2
suffisantes pour une utilisation thérapeutique, notamment en
remplacement ou en complément de thérapies cellulaires.
A cet effet, Piffoux et al. (Piffoux, M., Silva, A. K., Lugagne, J. B.,
Hersen, P., Wilhelrn, C., 8c Gazeau, F., 2017, Extracellular Vesicle
Production Loaded with Nanoparticles and Drues in a Trade-off between
Loading, Yield and Purity: Towards a Personalized Drue Delivery System,
Advanced Biosysterns) décrivent la comparaison de différentes méthodes de
production de vésicules extracellulaires.
Une première méthode consiste à produire des vésicules
extracellulaires à partir de cellules endothéliales de la veine du cordon
ombilical (HUVEC), en soumettant ces cellules à des contraintes
hydrodynamiques mimant les contraintes exercées dans des conditions
physiologiques au sein des capillaires sanguins ou dans des conditions
pathologiques lors de sténose des vaisseaux sanguins. Ces contraintes sont
entraînées par le passage des cellules productrices dans des canaux
rnicrofluidiques, pendant quatre heures. Une puce rnicrofluidique comprend
deux cents canaux dans lesquels les cellules sont transportées dans un
écoulement laminaire, pour produire des vésicules de manière parallélisée.
Toutefois, cette méthode présente des problèmes de
dirnensionnernent : les quantités de vésicules produites par une puce
rnicrofluidique ne sont pas adaptées aux quantités requises pour les
applications susmentionnées. De plus, le rendement de vésicules
extracellulaires produites par cellule introduite dans une telle puce
(environ 2.104 vésicules par cellule) est très inférieur au rendement
théorique maximum de vésicules produites par une cellule, par exemple de
l'ordre de 3,5.106 vésicules par cellule pour une cellule de type MSC
(acronyme de cellule souche rnésenchyrnateuse en anglais). Enfin, cette
méthode nécessite une conformité aux normes dite G.M.P. (acronyme
anglais de Bonnes Pratiques de Fabrication), nécessaires à la fabrication de
médicaments.
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
3
Une deuxième méthode couramment utilisée dans la littérature et
décrite par Piffoux et al. consiste à cultiver des HUVEC dans un milieu de
culture de type DMEM (acronyme anglais de Dulbecco's Modified Eagle's
Medium) sans sérum, pendant trois jours (technique dite de starvation en
anglais, ou carence en sérum). L'absence de sérum entraîne un stress
cellulaire déclenchant une libération de vésicules par les cellules
productrices. Cette méthode présente un rendement plus élevé et permet
de produire une plus grande quantité de vésicules que la méthode utilisant
une puce rnicrofluidique (environ 4.104 vésicules par cellule productrice).
Toutefois, le rendement calculé correspond à une durée de production
beaucoup plus longue que la durée de production de la méthode
précédente. Cette méthode ne permet pas de produire une quantité de
vésicules extracellulaires suffisante pour les applications susmentionnées.
Enfin, cette méthode ne permet pas de produire des vésicules de manière
continue car elle induit la mort des cellules.
Watson et al. (Watson, D. C., Bayik, D., Srivatsan, A., Bergarnaschi,
C., Valentin, A., Niu, G., ... ec Jones, J. C., 2016, Efficient production and
enhanced tumor delivery of ensineered extracellular vesicles,
Biornaterials, 105, 195-205) décrivent une méthode de production des
vésicules permettant d'augmenter la quantité de vésicules produites. Cette
méthode consiste à cultiver des cellules de type HEK293 dans des flasques
de culture, puis dans des membranes à fibres creuses (Hollow Fiber
Membrane en anglais). Le passage central des fibres creuses permet
d'acheminer le milieu de culture aux cellules productrices. Les cellules
productrices sont au préalable ensemencées autour de ce passage, où elles
produisent des vésicules dans un espace inter-fibre. Le milieu liquide
compris dans l'espace inter-fibre est collecté trois fois par semaine,
permettant de produire environ 3.1012 vésicules en plusieurs semaines, pour
des quantités de cellules ensemencées très grandes, par exemple de l'ordre
de 5.108 cellules, entraînant un rendement d'environ 6000 vésicules
extracellulaires par cellule et un ratio de pureté très bas (par exemple
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
4
1,09.109 particules par micrograrnrne de protéines). Cette production n'est
toutefois pas assez élevée et trop lente au regard des applications
susmentionnées. De plus, cette méthode est décrite en utilisant des cellules
productrices correspondant à une lignée cellulaire particulièrement
résistante à la culture en milieu dépourvu en sérum : cette méthode peut
ne pas être transposable à une production de vésicules par des cellules
productrices telles que des cellules souches, par exemple humaines, moins
résistantes et particulièrement appropriées aux applications thérapeutiques
visées.
RESUME DE L'INVENTION
Un but de l'invention est de proposer une solution pour produire des
vésicules extracellulaires en grande quantité à partir de cellules
productrices, plus rapidement qu'avec les méthodes connues, dans des
conditions conformes aux normes G.M.P. Un autre but de l'invention est de
proposer une solution permettant d'augmenter le rendement du système de
production de vésicules, c'est-à-dire le rapport entre le nombre de
vésicules produites et le nombre de cellules productrices introduites dans
le système de production. Un autre but de l'invention est de proposer un
système adapté à produire des vésicules extracellulaires à partir d'une large
gamme de cellules productrices adhérentes, quelle que soit la résistance du
type de cellule introduite dans le système de production et résistante ou
non à une carence en sérum. Un autre but de l'invention est de proposer
une solution pour produire et récupérer des vésicules extracellulaires en
continu. Enfin, un autre but de l'invention est de simplifier la structure du
système fluidique pour la production de vésicules et de réduire son coût de
fabrication.
En particulier, un objet de l'invention est un système fluidique de
production de vésicules extracellulaires à partir de cellules productrices,
comprenant au moins un récipient, un milieu liquide contenu par le
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
récipient et des cellules productrices, caractérisé en ce qu'il comprend
également des rnicroporteurs en suspension dans le milieu liquide, la
majorité des cellules productrices étant adhérentes à la surface des
rnicroporteurs, et un agitateur de milieu liquide, l'agitateur et la forme et
5 les dimensions du récipient étant adaptés à la génération d'un écoulement
turbulent du milieu liquide dans le récipient.
On comprend qu'avec un tel système, il est possible de produire des
vésicules en grande quantité, et dans un système adapté aux normes G.M.P.
On comprend également qu'un tel système est plus simple et moins couteux
à fabriquer que les systèmes connus pour produire des vésicules
extracellulaires.
L'invention est avantageusement complétée par les caractéristiques
suivantes, prises individuellement ou en l'une quelconque de leurs
combinaisons techniquement possibles :
- l'agitateur du milieu liquide et les dimensions du récipient sont adaptés
à commander un écoulement du milieu liquide, la longueur de
Kolmogorov de l'écoulement étant inférieure ou égale 75 prn, et
préférentiellement à 50 prn ;
- le système fluidique comprend une sortie et une connectique reliée à la
sortie, la connectique étant susceptible de comprendre du milieu liquide
et des vésicules extracellulaires ;
- l'agitateur est un agitateur rotatif dont la ou les vitesses de rotation, la
forme, la taille sont adaptés, avec la forme et les dimensions du
récipient, à la génération d'un écoulement turbulent du milieu liquide
dans le récipient ;
- les rnicroporteurs sont des rnicrobilles, le diamètre des rnicrobilles étant
compris entre 100 prn et 300 prn ;
- le système fluidique comprend un séparateur de vésicules
extracellulaires, relié fluidiquernent au récipient de manière à être
susceptible de réintroduire dans le récipient un milieu liquide appauvri
en vésicules.
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
6
Un autre objet de l'invention est un procédé de production ex vivo
de vésicules extracellulaires à partir de cellules productrices, comprenant :
- une commande d'un agitateur entraînant un écoulement turbulent d'un
milieu liquide dans un récipient, le récipient comprenant une sortie, le
milieu liquide comprenant des cellules productrices adhérentes sur la
surface de rnicroporteurs, les rnicroporteurs étant en suspension dans le
milieu liquide, et
- une collecte du milieu liquide comprenant des vésicules extracellulaires
en sortie du récipient.
Le procédé est avantageusement complété par les caractéristiques
suivantes, prises individuellement ou en l'une quelconque de leurs
combinaisons techniquement possibles :
- on agite le milieu liquide pendant plus de trente minutes ;
- on commande l'agitateur pour entraîner un écoulement du milieu
liquide, la longueur de Kolmogorov de l'écoulement étant inférieure ou
égale à 75 prn et préférentiellement à 50 prn ;
- un séparateur appauvrit une partie du milieu liquide collecté en sortie
du récipient en vésicules extracellulaires, et on réintroduit la partie du
milieu liquide dans le récipient.
L'invention a également pour objet des vésicules extracellulaires
susceptibles d'être obtenus par le procédé de production de vésicules
extracellulaires objet de l'invention.
L'invention a également pour objet une composition
pharmaceutique comprenant des vésicules extracellulaires susceptibles
d'être obtenues par le procédé de production de vésicules extracellulaires
objet de l'invention.
Avantageusement, la composition pharmaceutique comprenant des
vésicules extracellulaires peut être utilisée en médecine régénérative.
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
7
DEFINITIONS
Le terme - vésicule extracellulaire désigne de manière générale
une vésicule libérée de manière endogène par une cellule productrice, dont
le diamètre est compris entre 30 nrn et 5000 nrn. Une vésicule
extracellulaire correspond en particulier à un exosorne et/ou une
rnicrovésicule et/ou un corps apoptotique cellulaire.
Les termes - rnicroporteur et - rnicrosupport désignent une
matrice sphérique permettant la croissance de cellules productrices
adhérentes à sa surface ou à l'intérieur et dont la taille maximum est
comprise entre 50 prn et 500 prn, et préférentiellement entre 100 prn et
300 prn. Les rnicroporteurs sont généralement des billes dont la densité est
choisie sensiblement proche de celle du milieu liquide de culture des
cellules productrices. Ainsi, un mélange doux permet aux billes de rester
en suspension dans le milieu liquide de culture.
PRESENTATION DES FIGURES
D'autres caractéristiques et avantages ressortiront encore de la
description qui suit, laquelle est purement illustrative et non limitative, et
doit être lue en regard des figures annexées, parmi lesquelles :
- la figure 1 illustre schématiquement un système fluidique pour la
production de vésicules extracellulaires ;
- la figure 2 illustre le nombre de vésicules extracellulaires produites par
des cellules HUVEC dans un système fluidique pour différentes agitations ;
- la figure 3 illustre le nombre de vésicules extracellulaires produites par
des cellules HUVEC dans un système fluidique pour différentes agitations ;
- la figure 4 illustre le nombre de vésicules extracellulaires produites par
des cellules MSC dans un système fluidique pour différentes agitations ;
- la figure 5 illustre l'influence de la longueur de Kolmogorov sur le nombre
de vésicules extracellulaires produites par des cellules HUVEC et MSC ;
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
8
- la figure 6 illustre des cellules productrices adhérentes sur la surface de
microporteurs ;
- la figure 7 illustre des cellules productrices adhérentes sur la surface de
microporteurs ;
- la figure 8 illustre le rendement de la production de vésicules
extracellulaires pour différentes durées d'agitation, pour différentes
cellules productrices et pour différentes conditions d'agitations ;
- la figure 9 illustre le rendement de la production de vésicules
extracellulaires pour différentes cellules productrices, et pour différentes
conditions d'agitations, après 240 minutes d'agitation en comparaison avec
la méthode de privation de sérum pendant 72 h ;
- la figure 10 illustre la concentration de cellules productrices adhérentes
sur les microporteurs avant et après agitation, pour différentes conditions
d'agitation ;
- la figure 11 illustre le métabolisme des cellules productrices de type
HUVEC dans des conditions d'agitation pour la production de vésicules
extracellulaires ;
- la figure 12 illustre le métabolisme des cellules productrices de type
HUVEC dans des conditions d'agitation pour la production de vésicules
extracellulaires;
- la figure 13 illustre le métabolisme des cellules productrices de type MSC
murines dans des conditions d'agitation pour la production de vésicules
extracellulaires EV ;
- la figure 14 illustre le métabolisme des cellules productrices de type MSC
murines dans des conditions d'agitation pour la production de vésicules
extracellulaires ;
- la figure 15 est une microphotographie en cryo-microscopie électronique
de vésicules extracellulaires produites par un système fluidique ;
- la figure 16 illustre la distribution du diamètre de vésicules
extracellulaires produites par le système fluidique ;
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
9
- la figure 17 illustre la pureté en vésicules extracellulaires donnée par le
rapport entre le nombre de particules et la masse de protéines, produites
par le système fluidique dans le milieu liquide en comparaison avec la
méthode de privation de sérum pendant 72 h ;
- la figure 18 illustre les propriétés pro-angiogéniques d'un milieu liquide
comprenant des vésicules extracellulaires produites par le système
fluidique ;
- la figure 19 illustre les propriétés pro-angiogéniques d'un milieu liquide
comprenant des vésicules extracellulaires produites par le système
fluidique, la méthode de privation de sérum ou la méthode de libération
spontanée de vésicules ;
- la figure 20 illustre l'activité métabolique de cardiornyocytes (lignée
H9C2) après une journée d'incubation dans des milieux de culture
comprenant des vésicules extracellulaires produites par le système
fluidique ;
- la figure 21 illustre l'activité métabolique de cardiornyocytes (lignée
H9C2) après deux journées d'incubation dans différents milieux de culture
comprenant des vésicules extracellulaires produites par le système
fluidique ;
- la figure 22 illustre l'effet dose d'une incubation d'un milieu de culture
liquide comprenant une concentration variable de vésicules extracellulaires
produites par un système fluidique sur la prolifération de cardiornyocytes ;
- la figure 23 illustre la prolifération de cardiornyocytes (lignée H9C2)
après
deux journées d'incubation en présence d'un milieu de culture liquide
comprenant des vésicules extracellulaires;
- la figure 24 illustre l'utilisation d'une composition de vésicules
extracellulaires produites par le système fluidique comme composition
pharmaceutique dans un gel de poloxarner pour le traitement des fistules
entre le peux et le caecum chez le rat ;
- la figure 25 illustre l'utilisation d'une composition de vésicules
extracellulaires produites par le système fluidique comme composition
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
pharmaceutique dans un gel de poloxarner pour le traitement des fistules
entre le peux et le caecum chez le rat.
La figure 26 illustre le profil protéornique de vésicules
extracellulaires produites par la méthode selon l'invention comparé au
5 profil de vésicules extracellulaires produites par les méthodes de
production classique selon l'art antérieur.
10 DESCRITPION DETAILLEE
Elements théoriques
La longueur de Kolmogorov (ou dimension de Kolmogorov ou
longueur d'eddy) est la longueur à partir de laquelle la viscosité d'un fluide
permet de dissiper l'énergie cinétique d'un écoulement de ce fluide. En
pratique, la longueur de Kolmogorov correspond à la taille des plus petits
tourbillons dans un écoulement turbulent. Cette longueur LK est calculée
dans la publication de Kolmogorov (Kolmogorov, A. N., 1941, January, The
local structure of turbulence in incompressible viscous fluid for very large
Reynolds numbers, In Dokl. Akad. Nauk, SSSR, Vol. 30, No. 4, pp. 301-305)
et décrite par la formule (1) suivante :
Lk = v3/4. E.-1/4 (1)
dans laquelle y est la viscosité cinématique du milieu liquide en écoulement
et est l'énergie dissipée dans le fluide par unité de masse (ou taux
d'injection d'énergie dans le fluide).
Zhou et al. (Zhou, G., Kresta, S. M., 1996, Impact of tank geometry
on the maximum turbulence energy dissipation rate for impellers, AlChE
journal, 42(9), 2476-2490) décrivent la relation entre et la géométrie d'un
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
11
récipient dans lequel un milieu liquide est agité par agitateur de type roue
à aubes. Cette relation est donnée par la formule (2) suivante :
NP=D 5'N 3
E = (2)
V
dans laquelle Np est le nombre de puissance (ou nombre de Newton)
adirnensionné de l'agitateur dans le milieu liquide, D est le diamètre de
l'agitateur (en mètre), N est la vitesse de rotation (en nombre de tours par
seconde) et V est le volume de milieu liquide (en mètre cube). Cette
relation est utilisée pour le calcul de correspondant à la géométrie d'un
récipient et d'un agitateur utilisés pour la mise en oeuvre de l'invention. Le
nombre de puissance Np est donné de manière connue par la formule (3) :
P
IVõ, = ________________________________________________________ (3)
e' N3D5p
dans laquelle P est la puissance apportée par l'agitateur, et p est la densité
du milieu liquide. La formule (3) peut être ajustée comme décrit dans
Nienow et al. (Nienow, A. W., ec Miles, D., 1971, Impeller power numbers
in closed vessels, Industrial ec Engineering Chemistry Process Design and
Development, 10(1), 41-43) ou Zhou et al. (Zhou, G., Kresta, S. M., 1996,
Impact of tank geometry on the maximum turbulence energy dissipation
rate for impellers, AlChE journal, 42(9), 2476-2490) en fonction du nombre
de Reynolds de l'écoulement du milieu liquide. Il est également possible de
calculer le nombre de Reynolds du système par la formule (4) suivante :
N.D2
Re = ¨ (4)
-1/
Architecture générale du système fluidique
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
12
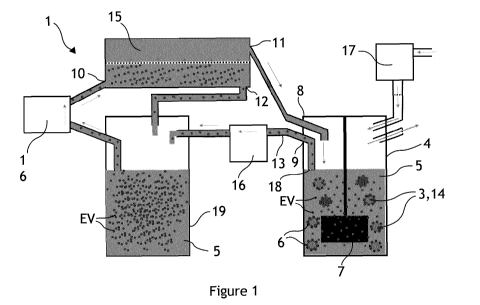
La figure 1 illustre schématiquement un système fluidique 1 pour la
production de vésicules extracellulaires EV. Le système fluidique 1 de
production de vésicules extracellulaires EV vise à la production en grande
quantité de vésicules extracellulaires EV dans un récipient 4. Toutefois,
l'invention n'est pas limitée à ce mode de réalisation et peut comprendre
une série de récipients 4 reliés fluidiquernent en parallèle ou en série.
Le récipient 4 contient un milieu liquide 5. Le récipient 4 peut être
une cuve, une flasque, par exemple en verre ou en matière plastique, ou
tout autre récipient adapté à contenir un milieu liquide 5. Le volume du
récipient 4 est l'un des facteurs permettant de produire des vésicules
extracellulaires EV en grande quantité : ce volume peut être compris entre
50 rnL et 500 L, préférentiellement entre 100 rnL et 100 L, et
préférentiellement entre 500 rnL et 10 L. Le volume du récipient 4 illustré
schématiquement dans la figure 1 est de 1 L. Le récipient 4 comprend
typiquement une entrée gazeuse et une sortie gazeuse, par lesquels peut
s'écouler une atmosphère comprenant des concentrations en 02 et en CO2
adaptées à la culture cellulaire, par exemple comprenant 5% de CO2. Cette
atmosphère peut provenir d'un injecteur/mélangeur de gaz adapté ou
d'une étuve à atmosphère contrôlée en CO2. Une deuxième pompe 17
permet de commander cet écoulement gazeux dans le récipient 4. Le
récipient 4 comprend également une sortie 9 susceptible de comprendre du
milieu liquide 5 et des vésicules extracellulaires EV. Cette sortie est
complétée d'un moyen de séparation et/ou de filtration des rnicroporteurs
3 permettant de ne pas récupérer des rnicroporteurs 3 en dehors du
récipient 4. Cette sortie 9 permet d'extraire hors du récipient 4 les
vésicules
extracellulaires EV produites. Le récipient 4 peut également comprendre au
moins une entrée 8 adaptée à introduire le milieu liquide 5 dans le récipient
4.
Le milieu liquide 5 peut être de manière générale une solution saline,
par exemple isotonique. Préférentiellement, le milieu liquide 5 est un
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
13
milieu liquide de culture avec ou adjonction de composés permettant la
culture des cellules d'intérêt, ou un milieu cornplérnenté en sérum
préalablement purifié des vésicules extracellulaires ou un milieu sans
sérum, permettant de ne pas contaminer les vésicules extracellulaires EV
produites par le système fluidique 1 par des protéines ou des d'autres
vésicules provenant d'un sérum. Un milieu liquide 5 de type DMEM sans
sérum peut être utilisé. Le volume maximum de milieu liquide 5 est
déterminé en partie par le récipient 4. Ce volume maximum peut également
être compris entre 50 rnL et 500 L, préférentiellement entre 100 rnL et 100
L, et plus préférentiellement entre 500 rnL et 10 L. Le volume minimum de
milieu liquide 5 contenu par la récipient 4 est en partie déterminé par le
choix de l'agitateur 7 permettant d'agiter de milieu liquide 5.
Le système fluidique 1 comprend également des rnicroporteurs 3 en
suspension dans le milieu liquide 5. Les rnicroporteurs 3 peuvent être des
rnicrobilles 14, par exemple en Dextran, chaque rnicrobille 14 pouvant être
recouverte d'une couche de collagène ou autre matériau nécessaire à la
culture de cellules. D'autres matériaux peuvent être utilisés pour la
fabrication des rnicroporteurs 3, tels que le verre, le polystyrène, le
polyacrylarnide, le collagène et/ou l'alginate. De manière générale,
l'ensemble des rnicroporteurs adaptés pour la culture cellulaire est adapté
à la production de vésicules extracellulaires EV. La densité des
rnicroporteurs 3 peut être par exemple légèrement supérieure à celle du
milieu liquide 5. La densité des rnicrobilles 14 en Dextran est par exemple
de 1,04. Cette densité permet aux rnicrobilles 14 d'être suspendues dans le
milieu liquide 5 en agitant faiblement le milieu liquide 5, la traînée de
chaque rnicroporteur 3 dans le milieu liquide 5 étant dépendante de la
densité du rnicroporteur 3. La taille maximale des rnicroporteurs 3 peut être
comprise entre 50 prn et 500 prn, préférentiellement entre 100 prn et 300
prn, et préférentiellement entre 130 prn et 210 prn.
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
14
Les rnicroporteurs 3 peuvent par exemple être des rnicrobilles 14 de
type Cytodex 1 (marque déposée). On peut réhydrater et stériliser une
poudre formée par ces rnicrobilles 14 avant utilisation. On peut utiliser 5g
du PBS, puis dans un milieu de culture (par exemple du DMEM) sans sérum,
à 4 C avant une utilisation.
Le système fluidique 1 comprend également des cellules
productrices 6. Les vésicules extracellulaires EV sont produites par le
système fluidique 1 à partir de ces cellules productrices 6. Les cellules
productrices 6 peuvent être cultivées, avant la production de vésicules
extracellulaires EV par le système fluidique 1, sur la surface des
rnicroporteurs 3 dans un milieu de culture cellulaire adapté. Ainsi, aucun
transfert de cellules n'est nécessaire entre la culture des cellules
productrices 6 et la production des vésicules extracellulaires EV, ce qui
permet d'éviter toute contamination et de simplifier le procédé dans son
ensemble. La majorité des cellules productrices 6 sont adhérentes à la
surface des rnicroporteurs 3, même si une proportion minoritaire de cellules
productrices 6 peuvent être décollées, par exemple par l'agitation du
milieu liquide 5. Les autres cellules productrices sont alors et en suspension
dans le milieu liquide 5 ou sédirnentées au fond du récipient 4. De manière
générale, tout type de cellules productrices 6 peut être utilisé, y compris
des cellules productrices non adhérentes, et de préférence des cellules
productrices 6 adhérentes. Les cellules productrices 6 peuvent être par
exemple des cellules rnultipotentes, ou des cellules souches pluripotentes
induites (IPS ou IPSCs, Induced Pluripotent Stem Cells en anglais). Elles
peuvent être également des cellules génétiquement modifiées et/ou des
lignées tumorales.
Le récipient 4 comprend également un agitateur 7 permettant
d'agiter le milieu liquide 5. L'agitateur 7 peut être une roue à aubes, dont
les aubes sont au moins en partie plongées dans le milieu liquide 5, et mise
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
en mouvement par une transmission de forces magnétiques. L'agitateur 7
peut également être un système de perfusion de milieu liquide 5 à un débit
suffisant pour agiter le milieu liquide 5 contenu par le récipient, ou un
système à murs rotatifs (par exemple agencés sur des rouleaux). L'agitateur
5 7 et les dimensions du récipient 4 sont adaptés à commander un écoulement
turbulent du milieu liquide 5 dans le récipient 4. Par écoulement turbulent,
on entend un écoulement dont le nombre de Reynolds est supérieur à 2000.
Le nombre de Reynolds peut par exemple être calculé par la formule (4).
Préférentiellement, le nombre de Reynolds Re de l'écoulement de milieu
10 liquide 5 est supérieur à 7000, préférentiellement à 10 000 et
préférentiellement à 12 000.
L'agitateur 7 utilisé dans les exemples de réalisation de l'invention
comprend une roue à aube agencée dans un récipient 4 et mise en
15 mouvement par un système de transmission de forces magnétiques. La
vitesse de la roue à aube dans le milieu liquide 5 entraine un écoulement
du milieu liquide S. L'agitateur est adapté à commander un écoulement,
qui, compte-tenu des dimensions du récipient 4, est turbulent. Dans le cas
de l'agitateur 7 illustré en figure 1, plusieurs paramètres permettent de
calculer une valeur représentative de la turbulence du milieu liquide 5, en
particulier la viscosité cinématique y du milieu liquide 5, les dimensions du
récipient 4 et en particulier le volume V de milieu liquide 5 contenu dans le
récipient 4, le nombre de puissance Np correspondant à la partie immergée
de la roue à aube, le diamètre D de l'agitateur et en particulier de la roue,
la vitesse N de rotation de la roue. L'utilisateur peut ainsi calculer, en
fonction de ces paramètres, des valeurs représentatives de la turbulence
de l'écoulement, et en particulier la longueur de Kolmogorov LK, telle que
donnée par les équations (1), (2) et (3). En particulier, l'agitateur 7 est
adapté à commander un écoulement dans lequel la longueur LK est
inférieure ou égale à 75 prn et préférentiellement à 50 prn.
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
16
Dans un exemple de réalisation du système fluidique 1, la vitesse de
rotation de l'agitateur 7 est susceptible d'être commandée à 100 rprn
(rotations par minute), le diamètre d'une roue à aube est de 10,8 cm et le
volume de milieu liquide contenu par le récipient 4 est de 400 nr1L. Le
nombre de puissance Np mesuré de la roue à aube dans le milieu liquide 5,
par la formule (3), est sensiblement égal à 3,2. L'énergie dissipée par unité
de masse E, calculée, par la formule (2), est égale à 5,44.10-1 J.kg-1. La
longueur de Kolmogorov LK calculée par la formule (1) est ainsi égale à 41,
8 pm.
Préparation des microporteurs et des cellules productrices
Le récipient 4 peut être à usage unique ou bien stérilisé avant toute
introduction de milieu liquide 5, de nnicroporteurs 3 et de cellules
productrices 6. Les nnicroporteurs 3, en l'occurrence des nnicrobilles 14,
sont également stérilisés. Les nnicrobilles 14 sont incubées dans le milieu de
culture des cellules productrices 6, comprenant du sérum, dans le récipient
4. Cette incubation permet d'oxygéner le milieu de culture et de recouvrir
la surface des nnicrobilles 14 d'une couche, au moins partielle, de protéines,
favorisant l'adhésion des cellules productrices 6 à la surface des
rnicrobilles
14.
Les cellules productrices 6, avant d'être introduites dans le système
fluidique 1, sont mises en suspension au moyen d'un milieu comprenant de
la trypsine. Elles peuvent être ensuite centrifugées à 300 G pendant cinq
minutes pour être concentrées dans le culot d'un tube, de manière à
remplacer le milieu comprenant de la trypsine par un milieu DMEM. Les
cellules productrices 6 ensuite sont introduites dans le récipient 5,
comprenant du milieu de culture et les rnicrobilles 14, dans une quantité
correspondant sensiblement à 5 à 20 cellules productrices 6 par rnicrobille
14. Les cellules productrices 6 et les rnicrobilles 14 sont ensuite agitées
puis
sédirnentées, de manière à mettre en contact les rnicrobilles 14 et les
cellules productrices 6, et favoriser l'adhésion des cellules productrices 6
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
17
sur la surface des rnicrobilles 14. L'agitation peut reprendre
périodiquement, de manière à favoriser l'homogénéité de l'adhésion des
cellules productrices 6 à la surface des rnicrobilles 14, par exemple toutes
les 45 minutes pendant 5 à 24 heures. La culture des cellules productrices
est ensuite réalisée avec une faible agitation du milieu de culture (par
exemple la rotation d'une roue à aube à une vitesse de 20 rprn), ainsi qu'un
remplacement régulier du milieu de culture (par exemple un remplacement
de 5% à 40% du milieu de culture chaque jour).
Exemple de production des vésicules extracellulaires EV
Les vésicules extracellulaires EV sont produites dans un récipient 4
contenant un milieu liquide 5, par exemple sans sérum, des rnicroporteurs
3 et des cellules productrices 6 adhérentes à la surface des rnicroporteurs
3. Le milieu utilisé avant la production pour la culture des cellules
productrices 6 sur les rnicroporteurs 3 comprenant du sérum, on lave trois
à quatre fois le récipient 4 avec du milieu liquide 5 DMEM sans sérum,
chaque lavage correspondant par exemple à un volume d'environ 400 nnL.
On commande ensuite l'agitation du milieu liquide 5 par l'agitateur 7 de
manière à entraîner un écoulement turbulent dans le récipient 4.
L'agitation est préférentiellement réglée de manière à commander un
écoulement du milieu liquide 5 dans lequel la longueur de Kolmogorov LK
est inférieure ou égale à 75 prn et préférentiellement à 50 prn. L'agitation
du milieu liquide 5 est commandée au moins pendant une demi-heure,
préférentiellement pendant plus d'une heure, et préférentiellement
pendant plus de deux heures. La production de vésicules extracellulaires EV
peut être mesurée pendant la production. A cet effet, l'agitation peut être
momentanément interrompue. On laisse sédirnenter les rnicrobilles 14 au
fond du récipient 4, puis on prélève un échantillon de milieu liquide 5
comprenant des vésicules extracellulaires EV. On réalise une centrifugation
de l'échantillon à 2000 G pendant 10 minutes, de manière à éliminer les
débris cellulaires. Le surnageant est analysé par une méthode de suivi
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
18
individuel de particules (ou NTA, acronyme anglais de Nanoparticle Tracking
Analysis) de manière à compter le nombre de vésicules extracellulaires EV
et d'en déduire la concentration en vésicules extracellulaires EV des
échantillons. On peut vérifier que la concentration en vésicules
extracellulaires EV au début de l'agitation est proche de zéro ou
négligeable.
Les vésicules extracellulaires EV produites peuvent également être
observées et/ou comptées par cryo-microscopie électronique à
transmission. A cet effet, une goutte de 2,7 pL de solution comprenant des
vésicules extracellulaires EV est déposée sur une grille adaptée à la cryo-
microscopie, puis plongée dans l'éthane liquide, entraînant une congélation
quasi-instantanée de ladite goutte, évitant la formation de cristaux de
glace. La grille supportant les vésicules extracellulaires EV est introduite
dans le microscope et les vésicules extracellulaires EV sont observées à une
température de l'ordre de -170 C.
Séparation des vésicules extracellulaires
Les vésicules extracellulaires EV produites dans le récipient 4 sont
susceptibles d'être extraites du récipient 4 par la sortie 9 du récipient 4,
suspendues dans du milieu liquide 5. Un filtre 18 peut être agencé à la sortie
9 de manière à filtrer les rnicroporteurs 3 et les cellules productrices 6
adhérentes aux rnicroporteurs 3 lors de l'extraction de vésicules
extracellulaires EV du récipient 4. Une connectique 13 est fluidiquernent
reliée à la sortie 9, permettant le transport du milieu liquide 5 comprenant
les vésicules extracellulaires EV produites.
Le système fluidique 1 peut comprendre un séparateur 15
de vésicules extracellulaires EV. Le séparateur 15 comprend une entrée du
séparateur 10, dans laquelle le milieu liquide 5 comprenant des vésicules
extracellulaires EV issu du récipient 4 peut être acheminé de manière
directe ou indirecte. Le séparateur 15 peut également comprendre une
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
19
première sortie 11 du séparateur, par laquelle le milieu liquide 5 est
susceptible de sortir du séparateur 15 avec une concentration en vésicules
extracellulaires EV plus petite qu'en entrée 10 du séparateur 15, voire
sensiblement nulle. Le séparateur 15 peut également comprendre une
deuxième sortie 12 du séparateur 15, par laquelle le milieu liquide 5 est
susceptible de sortir du séparateur 15 avec une concentration en vésicules
extracellulaires EV plus élevée qu'en entrée 10 du séparateur 15.
De manière générale, le séparateur 15 de vésicules extracellulaires
EV peut être relié fluidiquement au récipient 4 de manière à être
susceptible de réintroduire un milieu liquide 5 appauvri en vésicules EV dans
le récipient 4, par exemple par l'entrée 8 du récipient 4. Ainsi, la
production et/ou l'extraction de vésicules extracellulaires EV peut être
réalisée de manière continue, à volume de milieu liquide 5 sensiblement
constant dans le récipient 4.
Dans l'exemple de réalisation d'un système fluidique 1 illustré dans
la figure 1, le milieu liquide 5 peut être extrait du récipient 4 par une
première pompe 16, via une connectique 13, de manière à transporter le
milieu liquides dans un collecteur 19. Une autre première pompe 16 permet
d'acheminer le milieu liquide 5 contenu dans le collecteur 19 à l'entrée 10
du séparateur 15, via une autre connectique. La première sortie 11 du
séparateur 15 est reliée au récipient 4 via une connectique, de manière à
réintroduire du milieu liquide 5 appauvri en vésicules extracellulaires EV
dans le récipient 4. La deuxième sortie 12 du séparateur 15 est reliée au
collecteur 19 via une connectique, de manière à enrichir le milieu liquide 5
contenu dans le collecteur 19 en vésicules extracellulaires EV. Dans une
variante, l'entrée 10 du séparateur 15 peut être directement reliée à la
sortie 9 du récipient 4 (ou par l'intermédiaire d'une première pompe 16).
La première sortie 11 du séparateur 15 est reliée au récipient 4 et la
deuxième sortie 12 du séparateur 15 est reliée au collecteur 19. Plusieurs
séparateurs peuvent également être disposés en série pour faire varier le
degré de séparation en vésicules extracellulaires EV dans le milieu liquide
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
5, et/ou en parallèle pour adapter le débit de milieu liquide 5 dans chaque
séparateur 15 au débit d'une première pompe 16.
Influence de l'agitation sur la production des vésicules extracellulaires EV
5 La figure 2 illustre le nombre de vésicules extracellulaires EV
produites dans un système fluidique 1 pour différentes agitations
commandées par l'agitateur 7. L'ordonnée de gauche correspond aux
nombres de vésicules extracellulaires EV produites dans le récipient 4.
Chaque colonne correspond à une production de vésicules extracellulaires
10 EV pour différentes vitesses de rotation de l'agitateur 7 dans le
récipient 4.
L'ordonnée de droite correspond à la longueur LK entraînée par l'agitateur
7 pendant la production de vésicules extracellulaires EV, calculée par les
formules (1), (2) et (3). Les vésicules extracellulaires EV sont produites à
partir de cellules productrices 6 de type HUVEC dans le récipient 4 en
15 utilisant une concentration de 3 g.L-1 de rnicroporteurs 3 dans 50
rnL de
milieu liquide 5 dans une flasque à agitation (spinner flask en anglais) de
100 ml. Une production significativement élevée de vésicules
extracellulaires EV est observable en commandant un écoulement de milieu
liquide 5 dans lequel la longueur LK est égale à 35 prn (production
20 correspondant à la colonne 300 RPM) par rapport à la production en
vésicules extracellulaires EV dans des conditions d'agitation plus faible dans
lequel la longueur LK est égale à 75 prn et préférentiellement à 50 prn
(production correspondant à la colonne 150 RPM).
La figure 3 illustre le nombre de vésicules extracellulaires EV
produites dans un système fluidique 1 pour différentes agitations
commandées par l'agitateur 7. Vingt millions de cellules productrices 6 de
type HUVEC sont utilisées, en utilisant une concentration de 3 g.L-1 de
rnicroporteurs 3 dans 350 rnL de milieu liquide 5 dans une spinner flask de
1000 ml. L'ordonnée de gauche correspond aux nombres de vésicules
extracellulaires EV produits dans le récipient 4. Chaque colonne correspond
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
21
à une production de vésicules extracellulaires EV pour différentes vitesses
de rotation de l'agitateur 7 dans le récipient 4. L'ordonnée de droite
correspond à la longueur LK entraînée pendant la production de vésicules
extracellulaires EV, calculée par les formules (1), (2) et (3). Une production
significativement élevée de vésicules extracellulaires EV est observable en
commandant un écoulement de milieu liquide 5 dans lequel la longueur LK
est inférieure à 40 prn par rapport à la production en vésicules
extracellulaires EV dans des conditions d'agitation plus faible (production
correspondant aux colonnes 125 RPM, 150 RPM et 175 RPM).
La figure 4 illustre le nombre de vésicules extracellulaires EV produits
dans un système fluidique 1 pour différentes agitations commandées par
l'agitateur 7. Des cellules productrices 6 de type MSC (acronyme de cellule
souche rnésenchyrnateuse en anglais) sont utilisées, et les rnicroporteurs 3
sont introduits à une concentration de 3 g.L-1 dans 200 rnL de milieu liquide
5 dans une spinner flask de 500 ml. L'ordonnée de gauche correspond aux
nombres de vésicules extracellulaires EV produits dans le récipient 4.
Chaque colonne correspond à une production de vésicules extracellulaires
EV pour différentes vitesses de rotation de l'agitateur 7 dans le récipient 4.
L'ordonnée de droite correspond à la longueur LK entraînée pendant la
production de vésicules extracellulaires EV, calculée par les formules (1),
(2) et (3). Une production significativement élevée de vésicules
extracellulaires EV est observable en commandant un écoulement de milieu
liquide 5 dans lequel la longueur LK est égale à 35 prn (production
correspondant à la colonne 175 RPM), par rapport à la production en
vésicules extracellulaires EV dans des conditions d'agitation plus faible dans
lequel la longueur LK est égale à 50 prn.
La figure 5 illustre l'influence de la longueur de Kolmogorov LK sur le
nombre de vésicules extracellulaires EV produites. La longueur LK est un
paramètre d'échelle concernant la production des vésicules extracellulaires
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
22
EV. Les carrés (a) correspondent aux productions de vésicules
extracellulaires EV illustrées dans la figure 2 pour différentes longueurs LK,
les losanges (b) correspondent aux productions de vésicules extracellulaires
EV illustrées dans la figure 3 pour différentes longueurs LK et les triangles
(c) correspondent aux productions de vésicules extracellulaires EV illustrées
dans la figure 4 pour différentes longueurs LK. Une valeur caractéristique
de LK caractérisant le changement de pente de la production de vésicules
extracellulaires EV en fonction de LK peut être extraite du diagramme de la
figure 5, sensiblement égale à LK = 50 prn. Ainsi, pour des valeurs de LK
inférieure ou égale à 50 prn, la production de vésicules extracellulaires EV
augmente de manière significative.
La figure 6 illustre des cellules productrices 6 adhérentes sur la
surface de rnicroporteurs 3, en l'occurrence des rnicrobilles 14, suspendus
dans le milieu liquide 5, avant l'agitation correspondant à une production
de vésicules extracellulaires EV. Des cellules productrices 6 adhérentes à la
surface des rnicroporteurs 3 sont visibles et quantifiables.
La figure 7 illustre des cellules productrices 6 adhérentes sur la
surface de rnicroporteurs 3, en l'occurrence des rnicrobilles 14, suspendus
dans le milieu liquide 5, après l'agitation correspondant à une production
de vésicules extracellulaires EV. Des cellules productrices 6 adhérentes à la
surface des rnicroporteurs 3 sont visibles et quantifiables. La comparaison
entre le nombre de cellules productrices adhérentes à la surface des
rnicroporteurs 3 avant et après l'agitation pour la production de vésicules
extracellulaires EV permet de vérifier que les conditions d'agitation décrite
précédemment, par exemple une agitation entraînant un écoulement dans
lequel la longueur LK est inférieure à 75 prn et préférentiellement à 50 prn,
n'entraînent pas le détachement des cellules productrices 6 des
rnicroporteurs 3.
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
23
La figure 8 illustre le rendement de la production de vésicules
extracellulaires EV pour différentes durées d'agitation, pour différentes
cellules productrices, et pour différentes conditions d'agitations,
correspondant à différentes longueurs LK de l'écoulement commandé par
l'agitateur 7. La courbe (a) illustre l'évolution, au cours de l'agitation, du
rapport entre le nombre de particules produites (dont des vésicules
extracellulaires EV) et entre le nombre de cellules productrices 6
introduites dans le récipient 4, les cellules productrices 6 étant de type MSC
rnurines, et l'écoulement du milieu liquide 5 étant caractérisé par une
longueur LK sensiblement égale à 35 prn. La courbe (b) illustre la même
évolution, les cellules productrices 6 étant de type MSC humaines, et
l'écoulement du milieu liquide 5 étant caractérisé par une longueur LK
sensiblement égale à 33 prn. La courbe (c) illustre la même évolution, les
cellules productrices 6 étant de type HUVEC, et l'écoulement du milieu
liquide 5 étant caractérisé par une longueur LK sensiblement égale à 35 prn.
La courbe (d) illustre la même évolution, les cellules productrices 6 étant
de type MSC humaines, et l'écoulement du milieu liquide 5 étant caractérisé
par une longueur LK sensiblement égale à 35 prn. La courbe (e) illustre la
même évolution, les cellules productrices étant de type HUVEC, et
l'écoulement du milieu liquide 5 étant caractérisé par une longueur LK
sensiblement égale à 50 prn. La courbe (f) illustre la même évolution, les
cellules productrices étant de type MSC rnurines, et l'écoulement du milieu
liquide 5 étant caractérisé par une longueur LK sensiblement égale à 50 prn.
La courbe (g) illustre la même évolution, les cellules productrices 6 étant
de type MSC humaines, et l'écoulement du milieu liquide 5 étant caractérisé
par une longueur LK sensiblement égale à 50 prn. La courbe (h) illustre la
même évolution, les cellules productrices étant de type MSC rnurines, et
l'écoulement du milieu liquide 5 étant caractérisé par une longueur LK
sensiblement égale à 53 prn. Ainsi, des vésicules extracellulaires EV sont
produites à des rendement supérieurs à ceux connus, pour une durée de
l'agitation supérieure à une demi-heure.
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
24
La figure 9 illustre le rendement de la production de vésicules
extracellulaires EV pour différentes cellules productrices 6, et pour
différentes conditions d'agitations, après 240 minutes d'agitation. Les
quatre colonnes de gauche illustrent le rendement de la production de
vésicules extracellulaires EV en utilisant des cellules productrices 6 de type
MSC rnurines. Le rendement de production pour trois conditions d'agitation,
correspondant à une agitation entraînant une longueur LK de 50 prn
(première colonne), 47 prn (deuxième colonne) et 35 prn (troisième
colonne) est comparé au rendement de production selon la méthode de
carence en sérum (ou méthode de starvation ou serum deprivation en
anglais). Le rendement de production de vésicules extracellulaires EV dans
les conditions LK = 47 prn et LK = 35 prn est significativement plus élevé que
dans les conditions LK = 50 prn et de carence en sérum. Trois colonnes
illustrent le rendement de la production de vésicules extracellulaires EV en
utilisant des cellules productrices 6 de type HUVEC. Le rendement de
production pour deux conditions d'agitation, correspondant à une agitation
entraînant une longueur LK de 50 prn (quatrième colonne) et 47 prn
(cinquième colonne) est comparé au rendement de production selon la
méthode de carence en sérum. Le rendement de production de vésicules
extracellulaires EV dans la condition LK = 35 prn est plus élevé que dans les
conditions LK = 50 prn et de carence en sérum. Les quatre colonnes les plus
à droite de la figure illustrent le rendement de la production de vésicules
extracellulaires EV en utilisant des cellules productrices 6 de type MSC
humaines. Le rendement de production pour trois conditions d'agitation,
correspondant à une agitation entraînant une longueur LK de 50 prn
(huitième colonne), 35 prn (neuvième colonne) et 33 prn (dixième colonne)
est comparé au rendement de production selon la méthode de carence en
sérum. Le rendement de production de vésicules extracellulaires EV dans
les conditions LK = 35 prn et LK = 33 prn est significativement plus élevé que
dans les conditions LK = 50 prn et de carence en sérum.
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
La figure 10 illustre la concentration de cellules productrices 6
adhérentes sur les nnicroporteurs 3 avant et après agitation, pour
différentes conditions d'agitation. Les colonnes (a) correspondent à la
5 concentration des cellules productrices 6 avant une agitation (JO) pour
la
production de vésicules extracellulaires EV et une journée après l'agitation
(J1), dans des conditions d'agitation dites - fortes , c'est-à-dire lorsqu'on
commande l'agitateur 7 pour entraîner un écoulement caractérisé par une
longueur LK = 35 pm. Les colonnes (b) correspondent à la concentration des
10 cellules productrices 6 avant une agitation (JO) pour la production de
vésicules extracellulaires EV et une journée après l'agitation (J1), dans des
conditions d'agitation dites - faibles , c'est-à-dire lorsqu'on commande
l'agitateur 7 pour entraîner un écoulement caractérisé par une longueur LK
= 50 pm. Aucune diminution significative de la concentration en cellules
15 productrices 6 n'est observable après l'agitation du milieu liquide 5
pour la
production de vésicules extracellulaires EV.
La figure 11 illustre l'activité métabolique des cellules productrices
6 de type HUVEC dans des conditions d'agitation pour la production de
20 vésicules extracellulaires EV. L'agitation du milieu liquide 5 est
commandé
par un agitateur 7 en rotation à 75 RPM, dans une spinner flask de 1 L,
entraînant un écoulement caractérisé par une longueur LK sensiblement
égale à 50 pm, pendant 240 minutes. Le métabolisme est mesuré en
observant la variation de la longueur d'onde émise par le réactif Alamar
25 blue dans le milieu liquide 5. Aucune baisse significative du
métabolisme
des cellules productrices 6 n'est observable dans ces conditions d'agitation.
La figure 12 illustre le métabolisme des cellules productrices 6 de
type HUVEC dans des conditions d'agitation pour la production de vésicules
extracellulaires EV. L'agitation du milieu liquide 5 est commandé par un
agitateur 7 en rotation à 125 RPM dans une spinner flask de 1 L, entraînant
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
26
un écoulement caractérisé par une longueur LK sensiblement égale à 35 pm
pendant 240 minutes. Le métabolisme est mesuré en observant la variation
de la longueur d'onde émise par le réactif Alamar blue dans le milieu liquide
5. Une baisse, voire une disparition du métabolisme des cellules productrice
6 est observable au bout de 250 minutes d'agitation. Cette diminution du
métabolisme cellulaire n'empêche cependant pas la production de vésicules
extracellulaires EV au cours de l'agitation.
La figure 13 illustre le métabolisme des cellules productrices 6 de
type MSC dans des conditions d'agitation pour la production de vésicules
extracellulaires EV. L'agitation du milieu liquide 5 est commandé par un
agitateur 7 en rotation à 75 RPM dans une spinner flask de 1 L, entraînant
un écoulement caractérisé par une longueur LK sensiblement égale à 50 pm,
pendant 240 minutes. Le métabolisme est mesuré en observant la variation
de longueur d'onde émise par le réactif Alamar blue dans le milieu liquide
5. Aucune baisse significative du métabolisme des cellules productrices 6
n'est observable dans ces conditions d'agitation.
La figure 14 illustre le métabolisme des cellules productrices 6 de
type MSC dans des conditions d'agitation pour la production de vésicules
extracellulaires EV. L'agitation du milieu liquide 5 est commandé par un
agitateur 7 en rotation à 125 RPM dans une spinner flask de 1 L, entraînant
un écoulement caractérisé par une longueur LK sensiblement égale à 35 pm
pendant 240 minutes. Le métabolisme est mesuré en observant la variation
de longueur d'onde émise par le réactif Alamar blue dans le milieu liquide
5. Aucune baisse significative du métabolisme des cellules productrices 6
n'est observable dans ces conditions d'agitation.
Ainsi, les conditions de faible agitation, correspondant à une
agitation entraînant un écoulement caractérisé par une longueur LK
sensiblement égale à 50 pm, permettent de réutiliser les cellules
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
27
productrices 6 pour des productions de vésicules extracellulaires EV
ultérieures.
La figure 15 est une microphotographie de vésicules extracellulaires
EV produites par des cellules MSC rnurines par un système fluidique 1. La
barre d'échelle correspond à une longueur de 200 nrn. La
microphotographie est réalisée en utilisant la technique de cryo-
microscopie électronique à transmission (cryo-TEM).
La figure 16 illustre la distribution du diamètre des vésicules
extracellulaires EV produites par le système fluidique 1 mesurée par cryo
TEM. La distribution (a) correspond à des vésicules extracellulaires EV
produites par des cellules MSC rnurines avec une agitation entraînant un
écoulement caractérisé par une longueur LK sensiblement égale à 35 prn
(condition de forte agitation). La distribution (b) correspond à des vésicules
extracellulaires EV produites avec une agitation entraînant un écoulement
caractérisé par une longueur LK sensiblement égale à 50 prn (condition de
faible agitation). Le diamètre médian des vésicules extracellulaires EV
produites dans des conditions de faible agitation est supérieure au diamètre
médian des vésicules extracellulaires EV produites dans des conditions de
forte agitation. La taille des vésicules extracellulaires EV peut être
sensiblement comprise entre 30 et 500 nrn.
La figure 17 illustre la pureté des vésicules extracellulaires EV
produites par le système fluidique 1 dans le milieu liquide 5 indiqués par le
rapport entre le nombre de particules et la masse de protéines en
rnicrograrnrne. Lors de la production de vésicules extracellulaires EV,
différentes entités peuvent être produites par les cellules productrices 6,
en l'occurrence des vésicules extracellulaires EV mais aussi des agrégats de
protéines. La quantification des particules par analyse du suivi individuel de
particules (ou NTA pour Nanoparticle Tracking Analysis) ne permet pas de
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
28
différencier ces différentes entités : aussi, il est avantageux de quantifier
le rapport entre le nombre de particules mesurées par NTA et la masse de
protéines produites, définissant la pureté en vésicules extracellulaires EV.
Les colonnes (a) illustrée dans la figure 17 correspondent à une production
de vésicules extracellulaires EV à partir de cellules productrices 6 de type
MSC rnurines, et les colonnes (b) correspondent à une production de
vésicules extracellulaires EV à partir de cellules productrices 6 de type MSC
humaines. Les deux colonnes de gauche correspondent à une production de
vésicules extracellulaires EV dans des conditions de forte agitation, et les
deux colonnes de droite correspondent à une production de vésicules
extracellulaires EV selon la méthode de carence en sérum. La pureté en
vésicules extracellulaires EV du milieu obtenu après la production est
comparable dans les deux méthodes.
La figure 18 illustre les propriétés pro-angiogéniques d'un milieu
liquide sans sérum 5 comprenant des vésicules extracellulaires EV produites
par des cellules MSC rnurines par le système fluidique 1. Le panneau A de la
figure 18 est une photographie d'une surface sur laquelle de cellules de
type HUVEC sont adhérentes. Des cellules ont été enlevées d'une partie de
la surface (zone sans cellules au milieu de la photographie). Cette
photographie est prise au début d'une expérience, au temps t = 0 h,
pendant de laquelle les cellules sont recouvertes d'un milieu liquide 5
comprenant des vésicules extracellulaires EV produites par le système
fluidique 1. Le panneau B de la figure 18 est une photographie de la même
surface, après 4h d'incubation dans le milieu liquide 5 comprenant les
vésicules extracellulaires EV. Le panneau C de la figure 18 est une
photographie de la même surface, après 9h d'incubation dans le milieu
liquide 5 comprenant les vésicules extracellulaires EV. Au cours de
l'expérience, les cellules de types HUVEC recouvrent la partie de la surface
sur laquelle aucune cellule n'est présente au début de l'expérience. Ainsi,
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
29
le milieu liquide 5 comprenant les vésicules extracellulaires EV présente des
propriétés pro-angiogéniques et/ou pro-prolifératives.
La figure 19 illustre les propriétés pro-angiogéniques d'un milieu
liquide 5 comprenant des vésicules extracellulaires EV produites par des
cellules MSC rnurines par le système fluidique 1 dans différentes conditions.
Chaque colonne illustre le pourcentage normalisé de fermeture des berges
entre Oh (correspondant au panneau A de la figure 18) et 9 h (correspondant
au panneau C de la figure 18) pour chaque condition d'incubation. La
première colonne (- milieu complet ) correspond à une incubation dans un
milieu de culture des cellules HUVEC (correspondant à un contrôle positif).
La deuxième colonne (- ctrl neg ) correspond à une incubation dans un
milieu liquide 5 (milieu de culture) sans vésicules extracellulaires EV, sans
sérum où un volume donné de PBS a été ajouté. La troisième colonne
(- forte agitation 10/1 ) correspond à une incubation dans un milieu
liquide 5 de culture où le même volume donné de PBS a été ajouté
comprenant des vésicules extracellulaires EV produites par un système
fluidique 1 dans des conditions de forte agitation, dans lequel la quantité
de cellules productrices 6 introduites correspond à 10 cellules productrices
6 MSC rnurines pour une cellule HUVEC réceptrice. La quatrième colonne
(- faible agitation 10/1 ) correspond à une incubation dans un milieu 5 de
culture où le même volume donné de PBS a été ajouté comprenant des
vésicules extracellulaires EV produites par un système fluidique 1 dans des
conditions de faible agitation, dans lequel la quantité de cellules
productrices 6 introduites correspond à 10 cellules productrices 6 MSC
rnurines pour une cellule HUVEC réceptrice La cinquième colonne (- lib
10/1 ) correspond à une incubation dans un milieu de culture des cellules
HUVEC, déplété en exosornes, la quantité de cellules productrices 6
introduites correspondant à 10 cellules productrices 6 pour une cellule
HUVEC réceptrice. La sixième colonne (- stress 10/1 ) correspond à une
incubation dans un milieu liquide 5 de culture où le même volume donné de
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
PBS a été ajouté comprenant des vésicules extracellulaires EV produites par
carence en sérum, la quantité de cellules productrices 6 introduites
correspondant à 10 cellules productrices 6 MSC nrwrines pour une cellule
HUVEC réceptrice. Une incubation dans un milieu liquide 5 comprenant des
5 vésicules extracellulaires EV produites dans des conditions de forte
agitation (- forte agitation 10/1 ) permet de recouvrir significativement la
partie initialement dépourvue de cellules.
La figure 20 illustre la prolifération de cardionnocytes après une
10 journée d'incubation dans différents milieux liquides, mesurée par du
bleu
de alannar compris dans le milieu d'incubation. La première colonne
correspond à une incubation dans un milieu adapté à la culture des
cardionnocytes H9C2 (- milieu complet , contrôle positif). La deuxième
colonne correspond à une incubation dans du PBS. La troisième colonne
15 correspond à une incubation dans un milieu liquide 5 comprenant des
vésicules extracellulaires EV produites par un système fluidique 1 dans des
conditions de forte agitation (- forte agitation 10/1 ), la quantité de
cellules productrices 6 introduites correspondant à 10 cellules productrices
6 pour une cellule réceptrice. La quatrième colonne correspond à une
20 incubation dans un milieu liquide 5 comprenant des vésicules
extracellulaires EV produites par un système fluidique 1 dans des conditions
de faible agitation (- faible agitation 10/1 ), la quantité de cellules
productrices 6 introduites correspondant à 10 cellules productrices 6 pour
une cellule réceptrice. La cinquième colonne correspond à une incubation
25 dans un milieu de culture des cardionnocytes, déplété en exosonnes (- lib
10/1 ), la quantité de cellules productrices 6 introduites correspondant à
10 cellules productrices 6 pour une cellule réceptrice. La sixième colonne
correspond à une incubation dans un milieu liquide 5 comprenant des
vésicules extracellulaires EV produites par une méthode de production dans
30 un milieu sans sérum - stress , la quantité de cellules productrices 6
introduites correspondant à 10 cellules productrices 6 pour une cellule
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
31
réceptrice. Les conditions d'incubation dans un milieu liquide 5 comprenant
des vésicules extracellulaires EV produites dans un système fluidique 1 dans
des conditions de forte agitation et/ou de faible agitation entraînent une
prolifération significativement plus élevée des cardiornyocytes par rapport
aux conditions d'incubation dans du PBS, et dans les conditions - exo et
- stress .
La figure 21 illustre la prolifération de cardiornyocytes H9C2 après
deux journées d'incubation. Les cardiornyocytes incubés dans un milieu
liquide 5 comprenant des vésicules extracellulaires EV produites à partir de
cellules productrices 6 de type MSC rnurines par un système fluidique 1 dans
des conditions de faible agitation, dans des conditions de forte agitation,
ainsi que par libération spontanée dans un milieu complet déplété en
exosornes, prolifèrent significativement plus que des cardiornyocytes
incubés dans un milieu présentant une carence en sérum. Les
cardiornyocytes incubés dans un milieu liquide 5 comprenant des vésicules
extracellulaires EV produites dans des conditions de faible agitation et dans
des conditions de forte agitation prolifèrent significativement plus que des
cardiornyocytes incubés dans un milieu présentant une carence en sérum.
La figure 22 illustre l'effet dose sur la prolifération de
cardiornyocytes H9C2 d'une incubation d'un milieu liquide 5 comprenant
une concentration variable de vésicules extracellulaires EV produites par un
système fluidique 1. L'activité métabolique des cardiornyocytes est
mesurée après deux jours d'incubation dans un milieu liquide par bleu de
alarnar. Le métabolisme des cardiornyocytes est mesuré pour trois
conditions d'incubation : dans un milieu liquide 5 comprenant des vésicules
extracellulaires EV produites dans des conditions de faible agitation en (a),
dans des conditions de faible agitation en (b) et dans un milieu liquide
présentant une carence en sérum en (c). La mesure du métabolisme des
cardiornyocytes est réalisée, dans les courbes (a) et (b), pour différents
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
32
rapports entre la concentration de vésicules extracellulaires EV et la
concentration de cardionnyocytes, affichés en abscisse. La courbe (a)
illustre l'effet dose de la prolifération en présence de vésicules
extracellulaires EV : le métabolisme des cardionnyocytes croît lorsque le
rapport des concentrations entre vésicules extracellulaires EV et
cardionnyocytes croît.
La figure 23 illustre la prolifération de cardionnyocytes après deux
journées d'incubation en présence d'un milieu liquide 5 comprenant des
vésicules extracellulaires EV des cellules MSC nnurines à une concentration
de 100 000 vésicules extracellulaires EV par cardionnyocyte. La prolifération
des cardionnyocytes après deux jours est significativement plus élevée
quand le milieu liquide 5 d'incubation comprend des vésicules
extracellulaires EV produites par un système fluidique 1 dans des conditions
de forte agitation ou de faible agitation, par rapport à un milieu liquide
comprenant des vésicules extracellulaires EV obtenues par carence en
sérum et/ou à un milieu de culture des cardionnyocytes contenant des
vésicules extracellulaires EV obtenues libération spontanée dans un milieu
complet déplété en exosonnes.
La figure 24 illustre l'utilisation d'une composition de vésicules
extracellulaires EV produites par le système fluidique 1 comme composition
pharmaceutique. Une c costonnie est réalisée sur chaque rat d'un groupe
de rats. La présence d'excréments est observée à l'orifice d'une fistule
formée par la c costonnie, dans trois conditions : une condition de
contrôle, une condition correspondant à un traitement par l'application
d'un gel comprenant du poloxannère 407 sur l'orifice de la fistule de chaque
souris (- gel ) et une condition correspondant à l'application de ce gel
comprenant des vésicules extracellulaires EV produites par un système
fluidique 1 selon un procédé objet de l'invention, par exemple dans des
conditions de forte agitation (- gel + vésicules ). Les colonnes en gris
clair
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
33
correspondent aux orifices de fistules présentant des excréments et les
colonnes en gris foncé correspondent aux orifices de fistules ne présentant
pas d'excréments. L'application d'un gel comprenant des vésicules
extracellulaires EV permet de diminuer significativement la présence
d'excréments à l'orifice de la fistule dans ces conditions et entraîne une
diminution des cas de fistules productives (qui libèrent des sécrétions
intestinales) par rapports aux groupes contrôle et gel sans vésicules. Ainsi,
la composition de vésicules extracellulaires EV produite par le système
fluidique 1 peut être utilisée en médecine régénérative.
La figure 25 illustre l'utilisation d'une composition de vésicules
extracellulaires EV produites par le système fluidique 1 comme composition
pharmaceutique. Un score est calculé à partir des observations présentées
dans la figure 24. Un score égal à 1 est attribué lorsque l'orifice d'une
fistule présente des excréments et un score égale à zéro est attribué lorsque
l'orifice d'une fistule ne présente pas d'excréments. La figure 25 illustre le
score moyen, pour l'ensemble des c costonnies et pour chacune des
conditions : contrôle, - gel et - gel + vésicules . L'application d'un gel
comprenant des vésicules extracellulaires EV entraîne une diminution du
score moyen de productivité des fistules par rapports aux groupes contrôle
et gel sans vésicules et permet de diminuer significativement la présence
d'excréments à l'orifice de la fistule dans ces conditions. Ainsi, la
composition de vésicules extracellulaires EV produite par le système
fluidique 1 peut être utilisée en médecine régénérative.
La figure 26 illustre le profil protéonnique de vésicules
extracellulaires produites par la méthode selon l'invention comparé aux
vésicules extracellulaires produites par les méthodes de production
classiques selon l'art antérieur, plus particulièrement le profil protéonnique
de marqueurs classiquement utilisés pour caractériser les vésicules
extracellulaires.
CA 03068614 2019-12-30
WO 2019/002608 PCT/EP2018/067704
34
Le profil protéornique des vésicules extracellulaires obtenu par quatre
méthodes de production différente ont été comparé. Une méthode de
production en flasque par privation de sérum pendant une durée de 72
heures (2D), une méthode de production en bioréacteurs par privation de
sérum pendant une durée de 72 heures (3D), une méthode de production en
bioréacteur à moyenne vitesse caractérisé par une longueur de Kolmogorov
égale à 50 prn pendant une durée de 4 heures (MS) et une méthode de
production en bioréacteur à haute vitesse caractérisé par une longueur de
Kolmogorov égale à 35 prn pendant une durée de 4 heures (HS).
La présence de marqueurs biologiques classiquement utilisés pour
caractériser les vésicules extracellulaires est ainsi observée. La présence et
la quantité des marqueurs communs (CD63, CD9, CD81, 1arnp2 et TSG101)
entre les vésicules extracellulaires produites selon la méthode de
l'invention ou les méthodes de production classiques sont similaires.
En conclusion, les vésicules extracellulaires produites par la méthode selon
l'invention ont un profil protéornique similaire aux vésicules
extracellulaires produites par les méthodes de l'art antérieur. S'entend
comme profil protéornique similaire, un profil protéornique caractérisé par
la présence et la quantité de marqueurs classiquement utilisés pour
caractériser des vésicules extracellulaires.