Note: Descriptions are shown in the official language in which they were submitted.
CA 03118469 2021-04-28
WO 2020/099590 1 PCT/EP2019/081386
DISPOSITIF DE PRODUCTION DE MICROALGUES
La présente invention se rapporte à un dispositif et un procédé pour la
production de
microalgues.
Les microalgues sont des micro-organismes unicellulaires phototrophes
procaryotes et
eucaryotes. Les microalgues sont capables de tirer leur énergie à partir de la
lumière, par la
photosynthèse.
Les microalgues procaryotes sont représentées par les cyanobactéries (parfois
appelées algues
bleu-vert ). Les microalgues eucaryotes sont diversifiées et représentées par
une multitude de
classes parmi lesquelles on peut citer les chlorophycées, les diatomées, les
chrysophycées, les
coccolithophycées, les euglénophycées et les rhodopycées.
On estime aujourd'hui qu'il existe plus d'un million d'espèces de microalgues
dont quelques
dizaines de milliers d'espèces sont référencées. Les microalgues sont
ubiquistes et on les trouve
aussi bien dans les eaux douces et que dans les eaux saumâtres et marines. La
taille d'une cellule
de microalgue est généralement comprise entre 1 um et 100 um.
Le secteur de la production de microalgues est aujourd'hui en pleine
croissance. Les microalgues
sont en effet capables de synthétiser des produits d'intérêt économique et
écologique. Parmi
ces produits on peut notamment citer les protéines, les antioxydants, les
pigments, les acides
gras polyinsaturés à longues chaînes DHA (acide docosahexaénoïque) et EPA
(acide
eicosapentaénoïque).
Les microalgues trouvent ainsi une application dans plusieurs domaines
technologiques et en
particulier dans l'industrie cosmétique, l'industrie pharmaceutique,
l'aquaculture, l'industrie
des alicaments ou des compléments alimentaires.
Les microalgues sont en outre utilisées dans la production de bioénergie.
Elles ont une capacité
à capter l'énergie lumineuse pour fixer et métaboliser le carbone inorganique
à partir du dioxyde
de carbone (CO2) dans des molécules énergétiques. Les microalgues présentent
donc des
capacités épuratoires importantes. De plus, le couplage des microalgues avec
le CO2 et le fait
que les microalgues sont souvent riches en sucres ou en huiles ont pour
conséquence que les
microalgues présentent un grand intérêt dans la production de biocarburants.
CA 03118469 2021-04-28
WO 2020/099590 2 PCT/EP2019/081386
Pour la production de microalgues on utilise des systèmes de culture basés sur
une croissance
en lumière. Ainsi, les microalgues peuvent être cultivées en utilisant de la
lumière naturelle
(lumière solaire) ou de la lumière artificielle.
Il existe des systèmes de culture ouverts de type bassin de culture (aussi
appelé bassin raceway
) et des systèmes de culture fermés de type photobioréacteur. Généralement,
les systèmes de
culture ouverts utilisent la lumière solaire, tandis que les systèmes de
culture fermés utilisent
de la lumière artificielle.
Mais les systèmes connus sont limités en performances. Le rendement de la
production en
biomasse n'est pas satisfaisant.
L'invention vient améliorer la situation.
A cet effet, l'invention vient introduire un dispositif de production de
microalgues comportant
un bassin contenant un milieu aqueux et un support mobile apte à recevoir une
culture cellulaire
constituée de cellules d'algues, lequel support mobile est plongé au moins
partiellement dans
le milieu aqueux et présente au moins deux portions, caractérisé en ce que le
support mobile
est agencé dans le bassin de sorte que la première portion est exposée
directement à une source
de lumière principale et forme un tronçon d'exposition, et la deuxième portion
n'est pas
exposée directement à la source de lumière principale et forme un tronçon
d'inhibition, le
dispositif comprenant en outre une source de lumière secondaire agencée pour
émettre une
lumière actinique en direction du tronçon d'inhibition de manière à inhiber la
synthèse de
pigment de certaines au moins desdites cellules d'algues.
Les variantes de réalisation et les modes de réalisation préférentiels ont
pour objet ce dispositif,
dans lequel :
- La source de lumière secondaire est agencée pour émettre une lumière
d'intensité lumineuse
inférieure ou égale à 30% de l'intensité lumineuse moyenne reçue par le
tronçon d'exposition.
Cette énergie lumineuse est optimale pour une bonne production.
- La source de lumière secondaire est agencée pour émettre une lumière
d'intensité lumineuse
inférieure ou égale à 300 umol/m2/s. Cette énergie lumineuse permet une bonne
production
tout en gardant les dépenses énergétiques et les coûts faibles.
CA 03118469 2021-04-28
WO 2020/099590 3 PCT/EP2019/081386
- La source de lumière secondaire est agencée pour émettre une lumière
d'intensité lumineuse
comprise entre 5 umol/m2/s et 300 umol/m2/s, préférentiellement entre 30
umol/m2/s et
120 umol/m2/s, et plus préférentiellement d'environ 50 umol/m2/s. Ces plages
d'énergie
lumineuse permettent une bonne production tout en abaissant davantage les
dépenses
énergétiques et les coûts.
- La source de lumière principale est choisie parmi la lumière solaire
filtrée ou non et une source
artificielle présentant une longueur d'onde comprise entre environ 400 nm et
environ 800 nm.
Cette lumière est optimale pour la photosynthèse. De préférence, la source de
lumière
principale est une source artificielle présentant une longueur d'onde comprise
entre environ
400 nm et environ 800 nm d'intensité lumineuse supérieure ou égale à 400
umol/m2/s.
- La source de lumière secondaire est choisie parmi des diodes
électroluminescentes et des
fibres optiques. Ce type de source offre une grande flexibilité pour le
montage dans le bassin.
- La source de lumière secondaire émet une lumière de longueur d'onde
comprise entre 400 nm
et 550 nm. Ceci permet notamment une production en biomasse à fort rendement
de cellules
d'algues choisies parmi le genre Tetraselmis, le genre Chlorelle' et le genre
Emiliania de
préférence l'espèce Emiliania huxleyi. En pratique, on utilise de LED dont
environ 90% des
photons ont une longueur d'onde comprise entre 400 nm et 550 nm.
- La source de lumière secondaire émet une lumière de longueur d'onde
comprise entre 590 nm
et 750 nm. Ceci permet notamment une production en biomasse à fort rendement
de cellules
d'algues choisies parmi le genre Dunaliella de préférence l'espèce Dunaliella
saline', le genre
Synechococcus et le genre Euglena.
L'invention a également pour objet un procédé de production de microalgues
comprenant
l'exposition successive d'une culture cellulaire constituée de cellules
d'algues à des phases
d'exposition directe à une lumière incidente principale et des phases à l'abri
de ladite lumière
incidente principale, caractérisé en ce que la culture cellulaire est exposée
en outre à une
lumière actinique lors de certaines au moins des phases à l'abri de ladite
lumière incidente
principale de manière à inhiber la synthèse de pigment de certaines au moins
desdites cellules
d'algues. Ce procédé rend certaines au moins des cellules d'algues
transparentes.
Dans un mode de réalisation, la lumière actinique est une lumière de longueur
d'onde comprise
entre 400 nm et 550 nm. Ceci permet d'agir sur la pigmentation de certaines
espèces cellules
CA 03118469 2021-04-28
WO 2020/099590 4 PCT/EP2019/081386
d'algues, et notamment sur les microalgues choisies parmi le genre
Tetraselmis, le genre
Chlorella et le genre Emiliania de préférence l'espèce Emiliania huxleyi.
Dans un autre mode de réalisation la lumière actinique est une lumière de
longueur d'onde
comprise entre 590 nm et 750 nm. Ceci permet d'agir sur la pigmentation de
certaines espèces
cellules d'algues, et notamment sur les microalgues choisies parmi le genre
Dunaliella de
préférence l'espèce Dunaliella satina, le genre Synechococcus et le genre
Euglena.
De préférence, l'intensité lumineuse de la lumière actinique est inférieure ou
égale à 30% de
l'intensité lumineuse moyenne reçue par la culture cellulaire lors des phases
d'exposition. Ceci
réduit les dépenses énergétiques ainsi que les coûts du procédé de production.
D'autres avantages et caractéristiques de l'invention apparaîtront à la
lecture de la description
détaillée ci-après et sur les dessins annexés sur lesquels :
- la figure 1 montre un diagramme de la teneur en chlorophylle a de
cellules d'algues de
Emiliania huxleyi exposées à des lumières de couleurs différentes ;
- la figure 2 montre un diagramme de la teneur en chlorophylle a par unité
de carbone
cellulaire de Dunaliella satina exposé à des lumières de couleurs différentes
;
- la figure 3 montre un graphique de rapports pigmentaires en fonction du
taux de
variation PUR (%) chez Dunaliella satina exposées à des lumières de couleurs
différentes ;
- la figure 4 montre un dispositif conforme à l'invention ;
- la figure 5 montre un diagramme de productivité de biomasse ;
- la figure 6 montre un diagramme d'épaisseur de biofilms ;
- les figures 7, 8 et 9 montrent des variantes de réalisation du dispositif
de l'invention ; et
- la figure 10 montre un diagramme comparatif de productivité de biomasse.
Les dessins et la description ci-après contiennent, pour l'essentiel, des
éléments de caractère
certain. Ils font partie intégrante de la description, et pourront donc non
seulement servir à
mieux faire comprendre la présente invention, mais aussi contribuer à sa
définition, le cas
échéant.
Dans tous les systèmes de culture on retrouve généralement une cuve ou un
bassin empli d'un
milieu de culture. Il s'agit classiquement d'un milieu aqueux. Les microalgues
sont soit
dispersées dans le milieu de culture, soit fixées sur un support qui est au
moins partiellement
CA 03118469 2021-04-28
WO 2020/099590 5 PCT/EP2019/081386
immergé dans le milieu de culture. Les microalgues peuvent être qualifiées de
culture cellulaire
constituée de cellules d'algues.
Dans les systèmes comprenant un support on connaît notamment le système décrit
dans
W02015007724, déposé sous PCT/EP2014/065126 par la Demanderesse le 15.07.2014
et
bénéficiant de la priorité française (FR) n 13 56955 du 15.07.2013. Les
microalgues se
développent sur un support mobile refermé en boucle, circulant sur des
rouleaux partiellement
ou totalement plongés dans le milieu aqueux. Ce système prévoit une succession
de phases des
microalgues dans la lumière solaire et à l'ombre, tout en limitant le temps
d'exposition à la
lumière solaire. Ainsi, le système est conçu de manière à ce que les
microalgues demeurent
davantage à l'ombre qu'a la lumière solaire. Plus particulièrement,
W02015007724 divulgue un
procédé dans lequel la durée totale des phases à l'ombre est supérieure de 50%
à la durée totale
des phases d'exposition à la lumière solaire.
La Demanderesse a découvert un moyen de modifier ce système de manière
surprenante et
d'augmenter ainsi le rendement de la production en biomasse.
Pour cela la Demanderesse est parti du principe selon lequel l'obtention d'une
bonne
productivité est liée au profil d'éclairage de lumière auquel les microalgues
sont soumises. En
effet, les microalgues sont des espèces photosynthétiques. Les cellules de
microalgues ont
besoin de la lumière pour proliférer. D'une manière générale, une lumière à
longueur d'onde
fortement absorbée par les microalgues est nécessaire pour obtenir un taux de
croissance élevé.
En pratique, il s'agit de la lumière solaire ou de lumières contenant au moins
des longueurs
d'onde dans le bleu et dans le rouge.
Les publications Light requirements in microalgal photobioreactors: an
overview of biophotonic
aspects ¨ Carvalho et al., Appl Microbiology and Biotechnology, 2011, vol. 89,
no. 5: 1275-1288
et Light emitting diodes (LEDs) applied to microalgal production ¨ Schulze et
al., Trends in
Biotechnology, 2014, vol. 32, no. 8: 422-430 décrivent l'utilisation de la
lumière dans les
systèmes de culture des microalgues.
Bien évidemment, pour une bonne production de microalgues en condition
phototrophe, il faut
fournir, au-delà de la lumière, des nutriments tels que de l'azote, du
phosphore, du souffre ou
de la silice pour les diatomées notamment, des oligo-éléments et des
vitamines. En présence
des nutriments nécessaires dans le milieu de culture, les microalgues peuvent
alors engager la
CA 03118469 2021-04-28
WO 2020/099590 6 PCT/EP2019/081386
photosynthèse, qui consiste essentiellement à convertir l'énergie lumineuse en
métabolisant le
CO2 et ainsi produire de l'oxygène et de la biomasse algale (matière organique
de microalgues).
Dans un système de production de type comportant un support tel que décrit
dans
W02015007724, les microalgues forment un amas de cellules régulièrement
distribuées sur le
support. Par exemple, sur un support de type tapis ou de type disque
(Algaedisk), cf. Blanken,
W., Janssen, M., Cuaresma, M., Libor, Z., Bhaiji, T., & Wijffels, R. H.
(2014), Biofilm growth of
Chlorella sorokiniana in a rotating biological contactor based photobioreactor
¨ Biotechnology
and bioengineering, 111(12), 2436-2445. Les microalgues forment un biofilm en
surface du
support. L'épaisseur du biofilm augmente avec la croissance de la culture
cellulaire, c'est-à-dire
plus particulièrement avec la division cellulaire des cellules d'algues.
De manière imagée, le biofilm peut être vu comme une pluralité de couches
cellulaires
superposées. Les couches sont enchâssées dans une structure polymérique
complexe. De
manière simplifiée, on peut considérer que la première couche de cellules est
formée par les
cellules d'algues sur le support et en contact direct de celui-ci. Les
cellules de microalgues
constituant cette première couche se multiplient par division cellulaire et
forment alors une
deuxième couche de cellules d'algues au-dessus de la première couche. La
deuxième couche se
divise à son tour et génère ainsi une troisième couche au-dessus de la
deuxième couche, et ainsi
de suite. Au fur et à mesure des divisions cellulaires, l'épaisseur du biofilm
augmente.
Mais lorsque le biofilm atteint une certaine épaisseur, un phénomène appelé
phénomène
d'auto-ombrage s'installe. L'auto-ombrage a une influence négative sur la
croissance de la
culture cellulaire. Il se caractérise par le fait que les cellules en surface,
c'est-à-dire des couches
supérieures, font de l'ombre aux cellules situées dans des couches inférieures
vis-à-vis de la
source de lumière. Les cellules des couches inférieures ne reçoivent alors pas
suffisamment de
lumière pour proliférer. La productivité diminue drastiquement.
II s'ensuit que la récolte de biomasse dans les systèmes à support doit se
faire dès que le biofilm
a atteint une certaine épaisseur, de préférence entre 100 et 200 m. Ceci
augmente le nombre
d'étapes et les coûts dans le procédé de production.
Les systèmes de production à support comportent une source de lumière
principale pour fournir
la lumière nécessaire à la photosynthèse. Cette source peut-être par exemple
le soleil ou une
lampe générant une lumière artificielle. Les cellules de microalgues proches
de la source
principale sont exposées à un excès de photons par rapport à la quantité de
photons nécessaire
CA 03118469 2021-04-28
WO 2020/099590 7 PCT/EP2019/081386
pour réaliser la photosynthèse. Cet excès de photons entraîne une baisse de
l'efficacité
photosynthétique. Il s'agit d'une dissipation de l'énergie appelée dissipation
non-
photochimique (en anglais : non-photochemical quenching). Le phénomène de la
dissipation
non-photochimique est notamment décrit dans la publication Non-Photochemical
Quenching. A
Response to Excess Light Energy ¨ Müller et al., Plant Physiol, 2001, vol.
125, no. 4: 1558-1566.
Un excès de photons peut également provoquer une dégradation de l'appareil
photosynthétique, appelée photoinhibition.
Dans les systèmes à support, les cellules de la ou des couches supérieures du
biofilm absorbent
la majorité des photons provenant de la source de lumière principale. Une
grande partie des
photons de la lumière incidente ne parvient alors pas à pénétrer en profondeur
du biofilm pour
alimenter en lumière les cellules des couches inférieures. Il se crée en
conséquence un gradient
de lumière ayant un effet néfaste sur la production de biomasse. En effet, les
cellules des
couches inférieures se retrouvent plus ou moins dans l'obscurité du fait que
la lumière ne
pénètre pas en profondeur du biofilm. La fixation du carbone par photosynthèse
ne compense
alors plus les pertes d'énergie par la respiration cellulaire, laquelle est
basée sur la dégradation
de sucres qui ont été synthétisés lors de la photosynthèse.
Pour résumer, les systèmes de production de microalgues comportant un support
présentent
un problème de surexposition lumineuse des cellules en surface du biofilm
(proches de la source
lumineuse principale), et un problème de sous-exposition des cellules situées
en profondeur du
biofilm.
La Demanderesse a développé un dispositif de production de microalgue lequel
résout cette
problématique. Pour cela Elle a étudié l'absorption par les microalgues de
lumières à diverses
longueurs d'ondes. Elle s'est aperçue, non sans surprise, que certaines de ces
lumières ont un
effet actinique sur les cellules d'algues, c'est-à-dire un effet qui agit sur
la chimie métabolique
des cellules.
Plus particulièrement, certaines longueurs d'ondes de la lumière agissent sur
la pigmentation
des microalgues. Ainsi, en augmentant l'intensité lumineuse dans une bande de
longueur
d'ondes, une dépigmentation a été observée sur plusieurs souches de
microalgues. Il s'ensuit
une décoloration des cellules d'algues qui a pour conséquence que les cellules
deviennent
transparentes.
CA 03118469 2021-04-28
WO 2020/099590 8 PCT/EP2019/081386
On entend par cellules transparentes des cellules ayant perdu au moins 20 % de
pigments
appartenant au groupe des chlorophylles ou au groupe des caroténoïdes.
La figure 1 montre un diagramme de la teneur (attomoles par cellule : 10-18
moles/cellule) en
chlorophylle a de cellules d'algues de la classe des prymnésiophycées (espèce
Emiliania huxleyi)
exposées à des lumières de longueurs d'ondes correspondantes à une lumière
bleue, une
lumière blanche, une lumière verte et une lumière rouge ¨ Garrido, J. L.,
Brunet, C., & Rodriguez,
F. (2016), Pigment variations in Emiliania huxleyi (CCMP370) as a response to
changes in light
intensity or quality, Environmental microbiology, 18(12), 4412-4425.
L'exposition de cellules de Emiliania huxleyi a été réalisée pour chaque
lumière à deux intensités
distinctes :
- l'une forte (HL) à 426 60 iimoi.m-2s4 ;
- l'autre faible (LL) à 16 2 iimoi.m-2s4.
La longueur d'onde pour la lumière bleue est de 455 nm, pour la lumière rouge
de 617 nm et
pour la lumière verte de 537 nm. L'intensité lumineuse était entre 250 et 450
umol/m2/s en
lumière continue.
L'exposition à la lumière bleue permet de réduire la teneur en pigments
chlorophylle a des
cellules d'algues de l'espèce Emiliania huxleyi.
La figure 2 montre un diagramme de la teneur en chlorophylle a (grammes de
chlorophylle a /
grammes de carbone) de cellules d'algues de la classe des Chlorophycées
(espèce Dunaliella
satina) exposées à des lumières de longueurs d'ondes correspondantes à une
lumière bleue, une
lumière blanche, une lumière rouge et une lumière verte pour des expériences
réalisées à
lumière absorbée (PUR) constante ¨ Combe C., Effets quantitatifs et
qualitatifs de la lumière sur
la croissance des microalgues en culture dense et sur leur production de
molécules d'intérêt : vers
l'optimisation des procédés de production de microalgues, thèse de doctorat,
Université Pierre
et Marie Curie, 2016.
La longueur d'onde pour la lumière bleue est de 455 nm, pour la lumière rouge
de 617 nm et
pour la lumière verte de 537 nm. L'intensité lumineuse était entre 250 et 450
umol/m2/s en
lumière continue.
CA 03118469 2021-04-28
WO 2020/099590 9 PCT/EP2019/081386
L'exposition à la lumière rouge ou à la bleue permet de réduire la teneur en
pigments
chlorophylle a des cellules d'algues de l'espèce Dunaliella satina. La figure
3 montre le
pourcentage d'augmentation des rapports carotène/chlorophylle a (A) et
chlorophylle
a/carbone (B) en fonction du taux de variation PUR (%) chez Dunaliella satina
cultivée sous des
lumières de longueurs d'ondes correspondantes à une lumière bleue (noté B),
une lumière
blanche (noté W), une lumière verte (noté V) et une lumière rouge (noté R).
Le PUR (photosynthetic usable radiation), se calcule à partir du spectre
solaire PARõ-,(M et du
spectre d'absorption caractérisant la microalgue
700
PUR = 1 PARin(A)A /1. n(A)d
400
L'exposition aux lumières rouge et bleue permet de réduire la teneur en
pigments des cellules
d'algues de l'espèce Dunaliella satina.
Dans ce cas, l'exposition à la lumière rouge permet de réduire de manière
substantielle la teneur
en pigments chlorophylle des cellules d'algues de l'espèce Dunaliella satina.
L'ajout de lumière actinique bleue et/ou rouge modifie la teneur en pigment
des cellules avec
un effet plus marqué pour la lumière rouge.
La Demanderesse a formulé le postulat selon lequel un biofilm constitué au
moins partiellement
de cellules d'algues à pigmentation réduite (ou transparentes selon la
définition ci-dessus)
ne présente plus, ou quasi plus, les désavantages de l'auto-ombrage. Ceci
provient du fait que
les cellules d'algues à pigmentation réduite laissent passer au moins en
partie les photons
provenant de la lumière incidente principale. Chaque couche de cellules, y
compris les couches
inférieures du biofilm, reçoivent alors de la lumière provenant de la source
de lumière
principale.
Dans les cultures de type biofilm décrit plus haut, il s'ensuit que la
dépigmentation s'effectue
principalement dans la ou les couches supérieures, c'est-à-dire la ou les
couches de cellules les
plus proches de la lumière actinique.
Selon la longueur d'onde d'absorption des phytochromes d'une espèce de micro-
algue donnée,
et donc de la sensation de lumière forte de la cellule, on choisira la
lumière bleue ou rouge
pour dépigmenter les cellules. Ces phytochromes varient en fonction des
espèces.
CA 03118469 2021-04-28
WO 2020/099590 10 PCT/EP2019/081386
Pour dépigmenter de manière systémique la culture cellulaire de microalgues,
la Demanderesse
tire profit des phases dites à l'ombre telles que décrites dans
W02015007724. C'est-à-dire
les phases durant lesquelles les cellules ne sont pas directement exposées à
la source de lumière
principale. Plus particulièrement, il s'agit des phases durant lesquelles les
cellules sont localisées
dans des zones dans lesquelles la lumière reçue par les cellules est d'une
intensité lumineuse
inférieure ou égale à 50% de l'intensité lumineuse globale provenant de la
source de lumière
principale. Ceci s'applique au flux de photon global, quelle que soit la
nature de la lumière
principale (donc indépendamment du spectre incident).
Toutefois, contrairement à l'ensemble des modes de réalisation objets de
W02015007724, dans
la présente invention le temps pendant lequel des cellules demeurent à l'ombre
n'est pas
nécessairement supérieur au temps pendant lequel les cellules sont exposées à
la lumière
principale. Dans des modes de réalisations de la présente invention le temps
des phases des
cellules à l'ombre peut être égal au temps des phases de l'exposition des
cellules à la lumière
principale. Dans d'autres modes de réalisation le temps des phases des
cellules à l'ombre peut
être inférieur au temps des phases de l'exposition à la lumière principale.
Ainsi, le dispositif de l'invention comporte un support mobile qui présente au
moins deux
portions. Le support mobile est agencé dans un bassin comportant un milieu de
culture. Et le
support est en outre agencé de sorte que la première des deux portions est
exposée directement
à une source de lumière principale et forme un tronçon d'exposition, et la
deuxième des deux
portions n'est pas exposée directement à la source de lumière principale.
On entend par portion directement exposées à la source de lumière principale
une portion
exposée aux photons émis par la source de lumière principale. Cette portion
est généralement
en vis-à-vis de la source de lumière principale et reçoit la lumière
nécessaire pour la
photosynthèse. Autrement dit, durant le tronçon d'exposition les microalgues
captent l'énergie
lumineuse nécessaire à la réalisation de la photosynthèse.
On entend par une portion qui n'est pas exposée directement à la source de
lumière une portion
au moins partiellement à l'abri des photons provenant de la lumière de lumière
principale. Les
cellules traversant ce tronçon ne reçoivent donc pas ou très peu de photons
provenant
directement de la source de lumière principale.
Dans un mode de réalisation, sur cette portion à l'abri, l'intensité lumineuse
provenant de la
source de lumière principale est inférieure ou égale à 50% de l'intensité
lumineuse globale
CA 03118469 2021-04-28
WO 2020/099590 11 PCT/EP2019/081386
provenant de cette source. De préférence sur cette portion à l'abri,
l'intensité lumineuse
provenant de la source de lumière principale est proche de 01imo1/m2/s ou
nulle.
Toutefois, le dispositif est agencé de manière à ce que la deuxième portion se
trouve exposée à
une lumière capable d'induire une dépigmentation des cellules d'algues. Il
s'agit d'une lumière
actinique qui agit sur la chimie métabolique (ou voies de régulation) de sorte
à inhiber la
production pigmentaire. La deuxième portion du support mobile forme ainsi un
tronçon
d'inhibition.
L'inhibition de la production pigmentaire peut être partielle ou totale. Une
inhibition partielle
se traduit par une régulation vers le bas de la synthèse de pigments. Par
exemple en bloquant,
diminuant ou ralentissant la transcription des gènes qui sont à l'origine de
la synthèse de
pigments. La quantité de pigments produite dans les cellules est donc
diminuée.
Pour exposer les cellules à cette lumière actinique, le dispositif comporte
une source de lumière
autre que la source de lumière principale. Cette source est ici qualifiée de
source de lumière
secondaire. La source de lumière secondaire est agencée pour émettre la
lumière actinique en
direction du tronçon d'inhibition de manière à inhiber la synthèse de pigment
et rendre
certaines au moins des cellules d'algues transparentes.
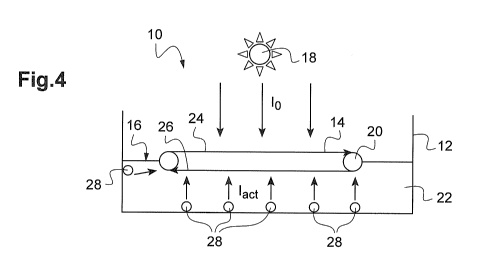
La figure 4 montre un dispositif 10 conforme à l'invention. Le dispositif
comporte un bassin 12
et un support 14 circulant dans le bassin 12 et sur lequel se développent des
cellules de
microalgues formant un biofilm.
Le bassin 12 comporte un milieu de culture aqueux 22. Le bassin 12 est ouvert
dans sa partie
supérieure de sorte que la surface 16 du milieu aqueux 22 est exposée à la
source de lumière
principale 18 (ici le soleil). La source de lumière principale 18 émet une
lumière d'intensité
lumineuse lo d'environ 400 à 2000 umol/m2/s selon les conditions
météorologiques. La surface
16 s'étend sur toute la partie ouverte du bassin 12.
Dans le présent mode de réalisation le bassin 12 est une cuve maçonnée. Dans
d'autres modes
de réalisation le bassin peut-être une étendue d'eau naturelle telle qu'un
lac, étang, ou baie
marine notamment. Le bassin 12 peut également être une cuve d'un bioréacteur.
Le dispositif comporte en outre un support mobile 14. Le support mobile 14 est
formé d'une
bande renfermée en boucle sur elle-même. Il est guidé par un ensemble de
rouleaux de
retournement et de guidage 20. Ici, les rouleaux sont au nombre de deux et
disposés
CA 03118469 2021-04-28
WO 2020/099590 12 PCT/EP2019/081386
respectivement à proximité des bords du bassin 12. L'un au moins des rouleaux
est motorisé
pour assurer l'entraînement du support 14.
Le support mobile 14 est formé par un tapis présentant une résistance
mécanique. La surface
du support 14 sur laquelle viennent se fixer les cellules d'algues de la
première couche du biofilm
est de préférence un support hydrophobe et rugueux présentant des cavités
et/ou microcavités.
Le support 14 présente une flexibilité suffisante pour supporter le passage
sur les rouleaux. Il
est en outre résistant à la lumière notamment aux rayons ultra-violets. Le
matériau du support
14 est choisi pour que son éventuelle détérioration n'affecte pas le
métabolisme des cellules.
Le support mobile comprend, dans l'exemple décrit ici, deux portions : une
première portion 24
et une deuxième portion 26. En variante, le support peut comprendre une
pluralité de portions.
Les rouleaux 20 sont montés de sorte que leurs axes principaux respectifs
soient sensiblement
parallèles à la surface 16 du milieu aqueux 22. De cette manière, la première
portion du support
mobile 14 circule de sorte à former un plan généralement horizontal entre le
premier rouleau
et le deuxième rouleau du bord opposé. La première portion est disposée au-
dessus de la
15 surface 16 du milieu aqueux. Dans le présent mode de réalisation la
première portion circule
dans l'air atmosphérique (ou le cas échéant dans l'air contrôlé lorsque le
dispositif 10 est placé
dans une serre). Dans d'autres modes de réalisation la première portion est
immergée dans le
milieu aqueux 22 par exemple à quelques centimètres en-dessous de la surface
16.
Le support mobile est l'objet d'un retournement par chaque rouleau de sorte
que la deuxième
20 portion 26 du support mobile 14 circule également selon un plan
généralement horizontal entre
le premier rouleau et le deuxième rouleau du bord opposé. La deuxième portion
est disposée
en-dessous de la surface 16 du milieu aqueux. La deuxième portion est donc
immergée dans le
milieu aqueux 22.
La première portion 24 est directement exposée à la lumière provenant de la
source de lumière
principale 18. La deuxième portion 26 n'est pas directement exposée à la
lumière provenant de
la source de lumière principale 18. Ainsi, la première portion 24 forme un
tronçon d'exposition
à la source de lumière principale 18 et la deuxième portion 26 forme un
tronçon à l'abri de la
source de lumière principale 18.
Le dispositif comporte une ou plusieurs sources de lumière secondaires 28.
Chaque source de
lumière secondaire 28 est agencée pour émettre une lumière actinique en
direction du tronçon
CA 03118469 2021-04-28
WO 2020/099590 13 PCT/EP2019/081386
qui est à l'abri de la source de lumière principale 18. De cette manière, les
cellules se trouvant
sur le support mobile 14 et parcourant le tronçon à l'abri de la source
principale sont exposées
à la lumière actinique provenant de la ou des sources de lumière secondaires
28. La lumière
actinique agit sur le métabolisme des cellules et inhibe la synthèse de
pigment. Certaines au
moins des cellules d'algues deviennent au moins partiellement transparentes.
Le tronçon à l'abri
de la source de lumière principale 18 est donc qualifié de tronçon
d'inhibition. La ou les sources
de lumière secondaires 28 peuvent être en particulier des diodes
électroluminescentes ou des
fibres optiques.
Dans les modes de réalisation comportant une pluralité de portions, une au
moins des portions
est directement exposée à la lumière provenant de la source de lumière
principale et une au
moins des portions est exposée à la lumière actinique provenant de la source
de lumière
secondaire.
Dans le mode de réalisation de la figure 4, la source de lumière secondaire 28
est agencée pour
émettre une lumière d'intensité lumineuse inférieure ou égale à 30% de
l'intensité lumineuse
moyenne reçue par le ou les tronçons d'exposition. Lorsque la source de
lumière principale est
solaire et émet une intensité lumineuse lo de 2000 umol/m2/s la source de
lumière secondaire
28 émet une lumière d'intensité lumineuse lac inférieure ou égale à 600
umol/m2/s. De
préférence, la source de lumière secondaire 28 est agencée pour émettre une
lumière
d'intensité lumineuse lac inférieure ou égale à 300 umol/m2/s. Ceci diminue
fortement les
dépenses énergétiques.
Dans un autre mode de réalisation comprenant un bassin 12 de type cuve de
bioréacteur, pour
minimiser les dépenses énergétiques la source de lumière secondaire 28 est
agencée pour
émettre une lumière d'intensité lumineuse lac comprise entre 5 et 300
umol/m2/s et
préférentiellement entre 30 umol/m2/s et 120 umol/m2/s, et préférentiellement
d'environ
50 umol/m2/s. Dans ce mode de réalisation la source de lumière principale 18
est de préférence
une source naturelle présentant une longueur d'onde comprise entre environ 400
nm et environ
800 nm d'intensité lumineuse supérieure à 400 umol/m2/s. De cette façon les
dépenses
énergétiques sont baissées davantage. Ce mode de réalisation est
particulièrement adapté pour
la production de biomasse de cellules d'algues choisies parmi le genre
Tetraselmis, le genre
Chlorella et le genre Emiliania de préférence l'espèce Emiliania huxleyi.
CA 03118469 2021-04-28
WO 2020/099590 14 PCT/EP2019/081386
Dans encore un autre mode de réalisation le dispositif 10 comporte une source
de lumière
secondaire laquelle émet une lumière de longueur d'onde comprise entre 590 nm
et 750 nm.
Ce mode de réalisation est particulièrement adapté pour la production de
biomasse de cellules
d'algues choisies parmi le genre Dunaliella de préférence l'espèce Dunaliella
satina, le genre
Synechococcus et le genre Euglena.
EXEMPLES DE RÉALISATION
Exemple 1: Le support mobile 14 d'un dispositif 10 tel que décrit ci-dessus
est inoculé avec une
culture cellulaire constituée de cellules d'algues du genre Tetraselmis. La
vitesse de rotation des
rouleaux 20 est comprise entre 0,01 et 0,9 m/s. De préférence on a trois fois
plus de zones non
directement exposées à la lumière incidente que de zones exposées. La source
de lumière
principale 18 est une lumière artificielle d'intensité lumineuse de 400
umol/m2/s.
Dans une première expérience (I) la source de lumière secondaire 28 est
inactive, c'est à dire
éteinte. Dans une deuxième expérience (II) la source de lumière secondaire 28
émet une lumière
.. de longueur d'onde comprise entre 400 nm et 550 nm au même endroit que la
source de lumière
principale (tronçon d'exposition). Et, dans une troisième expérience (III) la
source de lumière
secondaire 28 émet une lumière de longueur d'onde comprise entre 400 nm et 550
nm au
niveau du tronçon d'inhibition.
La température est constante à environ 22 C 1 C.
La figure 5 montre le diagramme de productivité de chaque expérience. Le fait
de soumettre les
cellules d'algues à une lumière actinique bleue sur les tronçons à l'abri de
la source de lumière
principale a un effet positif sur la productivité. La productivité dans
l'expérience III est quasiment
doublée par rapport à l'expérience I.
La figure 6 montre un diagramme des épaisseurs des biofilms des trois
expériences I, Il et III. Le
.. biofilm obtenu dans l'expérience III est plus épais que ceux obtenus dans
les expériences I et II.
La production en biomasse est accrue en soumettant des cellules d'algues à une
lumière
actinique bleue sur des tronçons à l'abri de la source de lumière principale.
CA 03118469 2021-04-28
WO 2020/099590 15 PCT/EP2019/081386
Exemple 2 : Dans les mêmes conditions expérimentales, des cellules d'algues du
genre Chlorella
ont été cultivées. Les résultats ci-avant sur la productivité ont été
confirmés.
Exemple 3 : Dans un autre exemple de réalisation, le support mobile 14 d'un
dispositif 10 est
inoculé avec une culture cellulaire constituée de cellules d'algues du genre
Dunaliella. Les
conditions expérimentales sont analogues à l'exemple 1, à la différence que la
source de lumière
secondaire 28 émet une lumière de longueur d'onde comprise entre 590 nm et 750
nm.
Le fait de soumettre les cellules d'algues à une lumière actinique rouge sur
les tronçons à l'abri
de la source de lumière principale a un effet positif sur la productivité. En
l'espèce, la
productivité est augmentée drastiquement.
Les exemples démontrent l'augmentation du rendement en biomasse lorsque les
cellules sont
exposées successivement à une lumière blanche provenant d'une source de
lumière principale
et à une lumière actinique provenant d'une source de lumière secondaire.
Le fait que les photons puissent pénétrer au fond du biofilm a pour
conséquence que le
phénomène d'auto-ombrage ne se manifeste plus, ou quasi plus. L'épaisseur du
biofilm peut
ainsi augmenter sans que l'on soit contraint à récolter les cellules d'algues
régulièrement. Les
étapes du procédé de production sont diminuées, ainsi que les coûts.
Les figures 7 à 9 montrent d'autres modes de réalisation du dispositif 10 de
l'invention.
Le support mobile 14 de la figure 7 est entièrement immergé dans le milieu
aqueux. La première
portion 24 est donc disposée dans le milieu aqueux en dessous de la surface
16.
La figure 8 montre un support mobile 14 de type disque. Ce type de support est
parfois qualifié
de Algoedisk. Une première portion 24 du support mobile 14 émerge du milieu
aqueux 22, tandis
qu'une deuxième portion 26 est immergée dans le milieu aqueux 22. De cette
manière la
.. première portion 24 est exposée directement à une source de lumière
principale 18 et forme un
tronçon d'exposition, et la deuxième portion 26 n'est pas exposée directement
à la source de
lumière principale et forme un tronçon d'inhibition de par son exposition à la
lumière actinique
émise par une source de lumière secondaire disposée au fond du bassin 12. Le
disque tourne
CA 03118469 2021-04-28
WO 2020/099590 16 PCT/EP2019/081386
sur lui-même pour alterner les phases d'exposition à la lumière provenant de
la source principale
et les phases d'exposition à la lumière actinique provenant de la source de
lumière secondaire.
La figure 9 montre une installation décrite en détail dans W02015007724. Au-
delà de ce qui est
décrit dans ce document, l'installation comporte en outre une source de
lumière actinique 28
disposée au fond du bassin 12 et sur les parois de celui-ci.
L'invention peut également être définie comme un dispositif de production de
microalgues
comportant un bassin contenant un milieu aqueux et un support mobile apte à
recevoir une
culture cellulaire constituée de cellules d'algues, lequel support mobile est
plongé au moins
partiellement dans le milieu aqueux et présente au moins deux portions,
caractérisé en ce que
le support mobile est agencé dans le bassin de sorte que la première des deux
portions est
exposée à une lumière solaire ou une lumière artificielle blanche provenant de
l'extérieur du
bassin et forme un tronçon d'exposition, et la deuxième des deux portions
n'est pas exposée
directement à ladite lumière solaire ou ladite lumière artificielle blanche et
forme un tronçon
d'inhibition, le dispositif comprenant en outre une source de lumière
actinique agencée pour
émettre une lumière actinique en direction du tronçon d'inhibition de manière
à inhiber la
synthèse de pigment et rendre certaines au moins des cellules d'algues
transparentes.
L'invention peut encore être définie comme un dispositif de production de
microalgues
comportant un bassin contenant un milieu aqueux et un support mobile apte à
recevoir une
culture cellulaire constituée de cellules d'algues, lequel support mobile est
plongé au moins
partiellement dans le milieu aqueux et présente au moins une première portion
et une
deuxième portion, caractérisé en ce que le support mobile est agencé dans le
bassin de sorte
que la première portion est exposée directement à une source de lumière
principale et forme
un tronçon d'exposition, et la deuxième portion n'est pas exposée directement
à la source de
lumière principale et forme un tronçon d'inhibition, le dispositif comprenant
en outre une
source de lumière secondaire agencée pour émettre une lumière actinique en
direction du
tronçon d'inhibition de manière à inhiber la synthèse de pigment des cellules
de la culture
cellulaire exposées directement à ladite lumière actinique.
Tel que décrit plus haut, dans la présente description et conformément à
l'invention, une
lumière actinique est une lumière non-photosynthétique. C'est-à-dire une
lumière actinique
selon l'invention est une lumière qui n'est pas capable de déclencher le
processus de la
CA 03118469 2021-04-28
WO 2020/099590 17 PCT/EP2019/081386
photosynthèse dans l'ensemble d'une culture de cellules de microalgue. La
lumière actinique
seule ne permet pas de déclencher la croissance cellulaire et/ou la production
de biomasse de
microalgues. Plus particulièrement ici, une lumière actinique est une lumière
dont l'intensité
moyenne est inférieure ou égale à l'intensité de compensation de la
photosynthèse.
.. Plus particulièrement encore, au sens de la présente invention une lumière
actinique est une
lumière déclenchant l'inhibition de la synthèse de pigments. On notera
toutefois que cette
lumière actinique peu, dans de rares cas, déclencher le processus de la
photosynthèse dans des
cellules isolées d'une culture de microalgues. Ce phénomène isolé de
photosynthèse n'a
toutefois pas pour effet sur l'augmentation en biomasse ou la croissance
cellulaire en général.
De façon générale, le dispositif est agencé de sorte que la lumière moyenne
(ou éclairage
moyen) est sensiblement au niveau de l'optimum de photosynthèse, et de sorte
que la lumière
actinique est sensiblement sous le seuil de compensation. On entend ici par
lumière
moyenne , la lumière moyenne reçue par les cellules, ou encore la lumière
moyenne reçue par
unité de biofilm. L'Homme du métier sait identifier l'optimum de photosynthèse
et le seuil de
compensation. Davantage de précisions sont données dans les publications
Modeling of
photosynthesis and respiration rate for Isochrysis galbana (T-Iso) and its
influence on the
production of this strain, Ippoliti et al., Biosource Technology 203 (2016) 71-
79, et Effects of
organic carbon sources on growth, photosynthesis, and respiration of
Phaeodactylum
tricomutum, Xiaojuan Liu et al., J. Appl. Phycol. (2009) 21:239-246,
auxquelles le lecteur est
invité à se référer.
Dans un mode de réalisation particulier, la Demanderesse a davantage étudié le
paramétrage
de la lumière actinique de l'invention en vue d'obtenir une inhibition
satisfaisante, voir une
inhibition totale, de la synthèse de pigments de microalgues.
Pour cela, la Demanderesse est partie d'un mode de réalisation proche de celui
décrit plus haut.
Plus particulièrement, il s'agit d'un mode dans lequel le dispositif comporte
un support mobile
présentant une première portion et une deuxième portion. La première portion
forme le
tronçon d'exposition sur lequel les cellules de microalgues sont exposées
directement à la
lumière principale, c'est-à-dire à la lumière photosynthétique capable de
déclencher la
photosynthèse dans les cellules d'algues. En revanche, sur la deuxième portion
du support
mobile les cellules de microalgues ne sont pas exposées directement à la
lumière principale. Plus
CA 03118469 2021-04-28
WO 2020/099590 18 PCT/EP2019/081386
précisément, sur la deuxième portion les cellules d'algues se trouvent
essentiellement dans
l'obscurité.
Sur l'ensemble du support mobile on peut définir une surface S (m2) et une
intensité I
(umol/m2/s) de lumière déclenchant la photosynthèse. Logiquement, cette
surface S correspond
.. quasi totalement à la surface de la première portion du support mobile
exposé à la lumière
principale. En pratique, il n'est toutefois pas impossible que certains
photons soient reflétés sur
des bords du dispositif et atteignent des cellules isolées sur la deuxième
portion qui est à l'abri
de ladite lumière principale. Il est donc possible, bien qu'improbable, que
dans certaines cellules
isolées de la deuxième portion soit déclenché le processus de la
photosynthèse. Toutefois, ces
cellules isolées et/ou photons isolés sont généralement négligeables.
Il est donc possible de mesurer et/ou définir une lumière totale reçu par les
microalgues et/ou
émis par le dispositif de l'invention. Plus globalement, on peut mesurer et/ou
définir la lumière
totale dans le système de l'invention.
Sur cette base, le flux de photons de lumière photosynthétique (QI) apporté au
support mobile
est défini comme suit :
Q=IxS
En parallèle, la Demanderesse s'est intéressée à une intensité de lumière
bleue lb* sur une
surface Sb*. La lumière bleue lb* présente une longueur d'onde comprise entre
400 nm et
800 nm, de préférence de environ 460 nm +/- 50 nm. La surface Sb* est une
surface à l'abri de la
source de lumière principale. En d'autres termes, surface Sb* n'est pas
exposée directement à la
source de lumière principale. Cette surface est donc définie sur la deuxième
portion telle que
décrite plus haut. Il s'agit d'une sous-portion de la deuxième portion. Dans
ce mode de
réalisation, la surface Sb* forme le tronçon d'inhibition.
Le flux de photons de lumière non-photosynthétique (Qb) apporté sur la surface
Sb* par la
lumière bleue lb* est défini comme suit :
Qb = lb* X Sb*
CA 03118469 2021-04-28
WO 2020/099590 19 PCT/EP2019/081386
Lorsque l'on tient compte de la surface totale du support mobile ST, le flux
de photons moyen
ou éclairage moyen (Qb-moyEN) apporté sur la surface Sb* par la lumière bleue
non-
photosynthétique lb* est défini comme suit :
Qb-MOYEN = lb* X Sb* / ST
Et, le flux de photons moyen ou éclairage moyen (0
,¨.1-MOYEN) apporté sur la surface ST par la lumière
photosynthétique I est défini comme suit :
QI-MOYEN = I X S / ST
Le rapport (P) entre :
- la lumière non-photosynthétique, c'est-à-dire la lumière actinique
provenant de la
source de lumière secondaire, et
- la lumière photosynthétique, c'est à dire la lumière provenant de la
source principale et
éventuellement de la source de lumière secondaire (cellules isolées), est
défini comme
suit :
P = Qb / (Qb + QI)
Autrement dit, au sens de la présente invention P est le rapport entre la
lumière actinique et la
lumière totale.
Ainsi, la Demanderesse a réalisé des exemples de réalisation supplémentaire.
Exemple 4:
Dans cet exemple, le support mobile est constitué d'un tapis roulant de 6 m de
long et 1 m de
large (ST = 6x1 m2). La vitesse de rotation du tapis est de 0,07 m/s.
L'éclairage avec la lumière photosynthétique (au moyen de la source de lumière
principale) se
fait sur une longueur de 2 m et sur toute la largeur du tapis.
= I = 200 umol/m2/s
= S = 2x1 m2
CA 03118469 2021-04-28
WO 2020/099590 20 PCT/EP2019/081386
= ¨> QI = 400 umol/s
= ¨> QI-MOYEN = 66,7 umol/s
L'éclairage avec la lumière actinique (au moyen de la source de lumière
secondaire) se fait sur
une longueur de 0,1 m et sur toute la largeur du tapis.
= lb = 20 umol/m2/s
= Sb = 0.1x1 m2
= ¨> Qb = 2 umol/s
= ¨> Qb-MOYEN = 0,33 umol/s
En conséquence : P = 1 %
Exemple 5:
Dans cet exemple, le support mobile est constitué d'un tapis roulant de 80 m
de long et 5 m de
large (ST = 80x5 m2). La vitesse de rotation du tapis est de 0,2 m/s.
L'éclairage avec la lumière photosynthétique (au moyen de la source de lumière
principale) se
fait sur une longueur de 20 m et sur toute la largeur du tapis.
= I = 150 umol/m2/s
= S = 20x5 m2
= ¨> QI = 15000 umol/s
= ¨> QI-MOYEN = 37,5 umol/s
L'éclairage avec la lumière actinique (au moyen de la source de lumière
secondaire) se fait sur
une longueur de 2 m et sur toute la largeur du tapis.
= lb = 50 umol/m2/s
= Sb = 2x5 m2
= ¨> Qb = 500 umol/s
= ¨> Qb-MOYEN = 1,25 umol/s
En conséquence : P = 3,3 %
Exemple 6:
Dans cet exemple, le support mobile est constitué d'un tapis roulant de 8 m de
long et 1 m de
large (ST = 8x1 m2). La vitesse de rotation du tapis est de 0,02 m/s.
CA 03118469 2021-04-28
WO 2020/099590 21 PCT/EP2019/081386
L'éclairage avec la lumière photosynthétique (au moyen de la source de lumière
principale) se
fait sur une longueur de 2 m et sur toute la largeur du tapis.
= I = 150 umol/m2/s
= S = 2x1 m2
= ¨> QI = 300 umol/s
= ¨> QI-MOYEN = 31,25 umol/s
L'éclairage avec la lumière actinique (au moyen de la source de lumière
secondaire) se fait sur
une longueur de 0,5 m et sur toute la largeur du tapis.
= lb = 50 umol/m2/s
= Sb = 0,5x1 m2
= ¨> Qb = 25 umol/s
= ¨> Qb-MOYEN = 3,25 umol/s
En conséquence : P = 7,7 %
Il s'ensuit que dans un mode de réalisation particulier, le dispositif de
l'invention est agencé de
sorte que le rapport (P) entre la lumière actinique (non-photosynthétique) et
la lumière
provenant de la source principale de lumière (lumière photosynthétique) est
inférieur ou égale
à 8 % :
P 8%
Dans un autre mode de réalisation préféré, le rapport P est compris entre 3 %
et 7%. Et, dans un
mode de réalisation particulièrement préféré le rapport P est d'environ 3 % à
environ 3,5 %. Ceci
augmente drastiquement la production en biomasse.
Dans ces modes de réalisation particuliers, la présente invention peut être
définie comme suit :
Dispositif de production de microalgues comportant un bassin contenant un
milieu aqueux et
un support mobile apte à recevoir une culture cellulaire constituée de
cellules d'algues, lequel
support mobile est plongé au moins partiellement dans le milieu aqueux et
présente au moins
une première portion et une deuxième portion, dans lequel le support mobile
est agencé dans
le bassin de sorte que la première portion est exposée directement à une
source de lumière
principale et forme un tronçon d'exposition, et la deuxième portion n'est pas
exposée
directement à la source de lumière principale et forme un tronçon
d'inhibition, le dispositif
comprenant en outre une source de lumière secondaire agencée pour émettre une
lumière
actinique en direction du tronçon d'inhibition de manière à inhiber la
synthèse de pigment de
certaines au moins desdites cellules d'algues, et dans lequel le rapport P
entre la lumière
actinique et la lumière totale est inférieur ou égale à 8 %,
préférentiellement compris entre 3 %
et 7 %, et plus préférentiellement compris entre environ 3 % et environ 3,5 %.
CA 03118469 2021-04-28
WO 2020/099590 22 PCT/EP2019/081386
Ainsi, dans ce mode de réalisation le procédé de l'invention peut être défini
comme suit :
Procédé de production de microalgues comprenant l'exposition successive d'une
culture
cellulaire constituée de cellules d'algues à des phases d'exposition directe à
une lumière
incidente principale et des phases à l'abri de ladite lumière incidente
principale, caractérisé en
ce que la culture cellulaire est exposée en outre à une lumière actinique lors
de certaines au
moins des phases à l'abri de ladite lumière incidente principale de manière à
inhiber la synthèse
de pigment et rendre certaines au moins des cellules d'algues transparentes,
dans lequel le
rapport P entre la lumière actinique et la lumière totale est inférieur ou
égale à 8 %,
préférentiellement compris entre 3 % et 7 %, et plus préférentiellement
compris entre environ
3 % et environ 3,5 %.
Exemple 7:
Une culture de microalgues est réalisée avec le dispositif de l'invention dans
les conditions
suivantes :
= Source de lumière principale : système de culture positionné en extérieur,
sous serre,
en conditions réelles de culture ;
= Durée de l'expérience : 70 jours ;
= Convoyeur triangulaire de dimension 2m x 2m x 3m;
= Source de lumière secondaire : système d'éclairage installé à 10 cm du
biofilm ;
= Longueur d'onde de la lumière actinique : max. 463 nm +1- 70 nm ;
= Intensité lumineuse de la lumière actinique : < 100 umol/m2/s à 10 cm;
= Surface éclairée <3% de la surface totale ;
= Souche de microalgues : Tetraselmis suecica ;
= Récolte tous les 15 jours environ ;
En parallèle une culture de microalgues est réalisée sans lumière actinique,
Le restant des
conditions étant les mêmes que ci-dessus.
La figure 10 montre les résultats. La récolte en biomasse est supérieure en
utilisant la lumière
actinique (lumière bleue). Le dispositif de l'invention augmente
considérablement la croissance
cellulaire et ainsi le rendement en biomasse. La productivité est mesurée en
g/m2biofilm/jour
sur une période de 70 jours au total.