Note: Descriptions are shown in the official language in which they were submitted.
CA 03129642 2021-08-10
WO 2020/165444 1
PCT/EP2020/053979
PROCEDE D'ASSISTANCE A LA PRISE OU A L'ACTE D'UN TRAITEMENT
TH EFtAPEUTIQUE
La présente invention se rapporte à l'assistance à la prise ou à
l'acte d'un traitement thérapeutique pour un individu i, à un système et à un
produit de programme d'ordinateur pour sa mise en oeuvre.
Par les termes prise ou acte d'un traitement thérapeutique, on
entend au sens de la présente invention, la réalisation par un individu h d'un
ensemble d'agissements prescrits par un professionnel de santé à cet individu
vis-à-vis d'une maladie, afin de l'aider à en guérir, de soulager ses
symptômes,
ou encore d'en prévenir l'apparition.
Plus particulièrement, la prise d'un traitement thérapeutique
peut être la prise d'une substance active, par exemple un médicament curatif,
palliatif ou préventif. On envisage également la prise d'une substance active
comme un aliment, un nutriment, un oligoélément, un glucide, une vitamine
dans la mesure où l'effet et/ou l'efficacité de la substance active est
mesurable.
Plus particulièrement, l'acte d'un traitement thérapeutique peut
être un acte physique, un acte physiologique ou l'utilisation d'un dispositif
medical associé par analogie à la prise d'un médicament dans la mesure où
l'effet et/ou l'efficacité de l'acte est mesurable. Un exemple d'acte
thérapeutique réside par exemple dans une exposition à la lumière dans le
cadre d'une luminothérapie dans le cas des lésions cutanées, dans la mesure
où le taux de mélanine, la taille des lésions cutanées peuvent être suivies
pour
mesurer l'efficacité ou d'effet du traitement.
Par prise de médicament, on entend par exemple la prise
d'insuline dans le cadre d'un traitement du diabète dont l'effet peut être
suivi
par mesure de la glycémie dans le sang.
CA 03129642 2021-08-10
WO 2020/165444 2
PCT/EP2020/053979
Par prise d'un aliment, d'un nutriment, d'un oligoélément, d'un
glucide, d'une vitamine, on entend par exemple la prise de fer dans le cadre
d'un traitement contre l'anémie dont l'effet peut être suivi par la mesure du
taux d'hémoglobine dans le sang.
L'adhésion d'un patient à un schéma posologique d'un
traitement revêt de nos jours un intérêt croissant. Le schéma posologique,
également appelé posologie, d'un traitement prescrit à un patient se définit à
la fois par la dose recommandée par prise ou acte et par la fréquence des
prises
ou actes.
Sachant qu'à la prise du traitement, dans le cas de médicaments,
d'aliments, de nutriments, d'oligoéléments, de glucides, de vitamines, le ou
les
ingrédient(s) actif(s) est/sont absorbé(s), distribué(s), métabolisé(s) et
éliminé(s) par le patient, la concentration (plasmatique, salivaire, urinaire,
tissulaire, sanguine, capilaire...) en ingrédient(s) actif(s) augmente et
décroit
ensuite au cours du temps en fonction des prises succesives du traitement.
Le schéma posologique vise en général à maintenir les
concentrations (plasmatique, salivaire, urinaire, tissulaire, sanguine,
capilaire...) en le ou les ingrédients actifs dans l'intervalle thérapeutique,
autrement appelé la fenêtre thérapeutique, c'est-à-dire dans la zone de
concentrations en ingrédient(s) actif(s) assurant l'effet thérapeutique, par
exemple curatif, palliatif ou préventif optimal tout en minimisant le risque
d'effets indésirables. Le schéma posologique vise à ne pas descendre en
dessous de la concentration minimale correspondant à un sous-dosage pour le
patient, lequel entrainerait un risque accru d'échec thérapeutique ou
préventif,
et vise à ne pas dépasser une concentration maximale en ingrédients actifs
pour
le patient, lequel correspondrait à un surdosage qui entrainerait un risque de
toxicité accru.
Aussi, dans certains cas, le schéma posologique vise à avoir une
concentration (plasmatique, salivaire, urinaire, tissulaire, sanguine,
capilaire...)
en le ou les ingrédients actifs très haute pendant un temps court, c'est-à-
dire
CA 03129642 2021-08-10
WO 2020/165444 3
PCT/EP2020/053979
un pic, afin soit de grouper les effets secondaires ressentis par le patient
sur un
temps plus restreint, soit de pour avoir un effet déterminé sur l'organisme
tel
que le blocage de certains transmetteurs ou inhibiteurs par exemple.
Ainsi, la fenêtre thérapeutique peut varier au cours du temps,
notamment pour atteindre des pics temporaires de concentrations élevées ou
des périodes de repos après chaque cycle de traitement.
Il est estimé que plus de 50% des patients adhèrent mal ou peu
à leur traitement, entrainant de problèmes récurrent de sous et sur dosages.
Ces chiffres augmentent avec le vieillissement de la population, avec
l'augmentation mondiale du nombre de maladies chroniques, et avec la
combinaison de multi-morbidités pour un même patient entrainant sa
polymedication qui souvent présente des schémas posologiques différents.
Dans le cas d'un traitement comportant un ou plusieurs actes
thérapeutiques, l'effet du traitement peut varier au cours du temps en
fonction
du mode d'action du traitement.
La fréquence des actes thérapeutiques vise à maintenir l'effet du
traitement thérapeutique dans la fenêtre d'efficacité du traitement comme par
exemple entre une sous-exposition à l'acte qui rend le traitement inefficace
et
une surexposition à l'acte qui rend le traitement potentiellement dangereux.
Il est important pour le patient de pouvoir visualiser l'effet du
traitement thérapeutique. En effet, pour chaque prise ou acte d'un traitement
thérapeutique il y a un effet associé qui est directement identifiable pour le
patient, par exemple un ressenti de douleur, ou qui n'est pas directement
identifiable, par exemple la concentration en substance active du traitement
thérapeutique.
L'effet associé à chaque prise ou acte d'un traitement
thérapeutique est mesurable et/ou identifiable par une concentration
(plasmatique, salivaire, urinaire, tissulaire, sanguine, capilaire...), un
CA 03129642 2021-08-10
WO 2020/165444 4
PCT/EP2020/053979
biomarqueur, un effet thérapeutique mesurable ou étaloné comme par
exemple l'étalonnage d'un seuil de douleur.
Par exemple, lorsqu'un patient est traité par la luminothérapie,
l'effet associé directement identifiable du patient est l'amélioration de son
humeur ou la diminution des lésions cutanées. Dans le cas des lésions cutanées
l'effet associé qui n'est pas directement accessible au patient est la
régulation
de la quantité de mélanine dans l'organisme à la suite de l'acte du traitement
thérapeutique par luminothérapie. Dans le cas de l'amélioration de son
humeur, l'effet associé qui n'est pas directement accessible au patient est la
régulation de la quantité de mélatonine dans l'organisme à la suite de l'acte
du
traitement thérapeutique par luminothérapie.
Aussi, lorsqu'un patient est traité avec un traitement
thérapeutique antidouleur, l'effet associé directement identifiable du patient
est la diminution de ses douleurs, ces dernières pouvant alors être étalonnées
selon un seuil de douleur. En outre, l'effet associé qui n'est pas directement
accessible au patient est l'augmentation de la quantité de substances actives
permettant d'inhiber la douleur dans l'organisme à la suite de la prise du
traitement thérapeutique.
Par adhésion thérapeutique, on entend au sens de la présente
invention, d'une part la persistance qui permet de définir la durée pendant
laquelle le patient continue à prendre son traitement et d'autre part
l'implémentation qui permet de caractériser la façon dont le patient
persistant
gère et s'administre son traitement jour après jour.
Il est par exemple possible que le patient suive son traitement
sans omission avec régularité, c'est-à-dire avec une implémentation maximale.
Mais le patient peut omettre des doses, retarder/avancer des doses, prendre
des doses supplémentaires, ou interrompre son traitement de façon
prématurée, qui correspond dans ce dernier cas à une non persistance.
CA 03129642 2021-08-10
WO 2020/165444 5
PCT/EP2020/053979
Aussi, il est possible, par exemple dans le cas d'une maladie
chronique, que le patient prenne son traitement depuis plusieurs années, c'est-
à-dire qu'il est persistant au traitement. Mais, compte tenu de son quotidien,
le patient s'autorise une implémentation non optimale, c'est-à-dire qu'il
s'autorise, intentionnellement ou pas, de décaller son heure de prise par
rapport à la posologie, quelques non prises isolées, quelques non prises
consécutives, ou une période de non prise correspondantes à des vacances
thérapeutiques.
Il est également possible que le patient ne suive pas la posologie
en terme de dose, soit parce qu'il ne prend qu'une partie de la dose prévue
pour le traitement, soit parce qu'il prend plus de dose que prévue pour le
traitement.
En outre, l'adhésion thérapeutique est influencée par de
nombreux paramètres tels que ceux cités dans l'article : Adhésion
thérapeutique du patient chronique : des concepts à la prise en charge
ambulatoire, Rev Med Suisse 2013 ; volume 9. 1032 ¨ 1036:
- le sentiment d'efficacité personnelle,
- la connaissance et compréhension des risques de la maladie,
- les attentes du patient quant au traitement,
- les bénéfices perçus d'un traitement,
- les barrières et facilitateurs.
Dans tous les cas, en théorie, les avantages d'une adhésion
thérapeutique optimale à un traitement thérapeutique curatif, palliatif ou
préventif semblent évidents pour la santé de l'individu, du patient ainsi que
pour maintenir l'équilibre économique des soins de santé.
En réalité, il est facile de se rendre compte que le respect du
schéma posologique pour le patient dépend de nombreux facteurs, qu'ils soient
intentionnels ou pas.
CA 03129642 2021-08-10
WO 2020/165444 6
PCT/EP2020/053979
Aussi, il est facilement observable et identifiable que les patients
ne sont pas des robots ayant des journées types dont le déroulement est
identique jours après jours. Au contraire, les patients sont sujets à de
nombreux
aléas de la vie tels que le besoin de sommeil, de se nourrir, des activités
professionnelles ou extra professionnelles. De plus, si des obstacles tels que
des
effets secondaires surviennent, la réticence du patient à prendre le
traitement
thérapeutique prescrit a pour résultat qu'il peut retarder l'une ou l'autre de
ses
prises ou acte d'un traitement thérapeutique par confort afin de subir les
effets
secondaires à un endroit ou à un moment plus opportun qu'un autre. En outre,
cela est d'autant plus valable lorsqu'on considère que les patients sont des
individus malades, parfois dans le cadre d'une thérapie lourde, et qu'ils sont
d'autant plus sujets aux aléas de la vie tels que le besoin de se reposer ou
d'éviter les effets secondaires pour se donner un peu de confort.
En outre, de nombreux individus rencontrent des difficilutés à
construire une habitude de prise et en particulier lorsqu'ils présentent des
problèmes cognitifs.
Les patients sous traitement dévient fréquemment du schéma
posologique prescrit non seulement dans la pratique de tous les jours mais
également dans le cas de traitements thérapeutiques testés lors d'études
cliniques. Plus particulièrement, pour les traitements avec une fenêtre
thérapeutique étroite comme par exemple les traitements antirejet ou les
anticoagulants, il est important de prendre le médicament à intervalle
régulier,
ce qui implique de se souvenir du temps écoulé depuis la dose précédente, la
régularité des prises étant un facteur clé dans la réussite du traitement. Il
existe
d'ailleurs de nombreux dispositifs de rappels qui aident théoriquement le
patient à se rappeler qu'il doit prendre son traitement thérapeutique.
Néanmoins, il est important de pouvoir identifier le lien causal
entre la prise ou de l'acte d'un traitement thérapeutique, la non régularité
de
la prise ou de l'acte, et par exemple la réussite ou non du traitement ou
l'occurence d'effets secondaires. Le lien causal identifié devrait alors
permettre
CA 03129642 2021-08-10
WO 2020/165444 7
PCT/EP2020/053979
d'adapter ou non la posologie du patient dans le cas de traitement ou
d'adapter
ou non la posologie à prescrire lorsque le médicament à l'étude sera mis sur
le
marché ou d'agir ou non afin de modifier le comportement du patient.
Il existe des dispositifs qui donnent un niveau d'adhésion au
traitement prescrit et qui fournissent une assistance à la prise
thérapeutique.
La présente invention s'inscrit dans ce contexte et se rapporte à
un procédé d'assistance à la prise ou l'acte d'un traitement thérapeutique
pour
un individu 14 comprenant :
- l'obtention, par un premier dispositif, à partir d'une base
de
données, de données du traitement thérapeutique, telles
qu'une série de modèles pharmacométriques pour au moins
une indication prédéterminée, et une fenêtre cible pour
chaque traitement thérapeutique prédéterminé ;
- l'obtention, par le premier dispositif, des données
spécifiques de l'individu 14 comprenant :
a) les données variables de l'individu I choisies dans le
groupe du dosage, de la posologie, du temps de prise
théorique de chaque traitement thérapeutique
prédéterminé ;
- le calcul, par le premier dispositif, d'un modèle de données
projeté de l'individu li à partir de ladite série de modèles
pharmacométriques et desdites données variables de
l'individu ;
Le but du document W02015/006033 est un procédé
d'assistance à la sélection de la posologie pour un individu donné.
Dans le procédé tel que décrit ci-dessus, le système obtient un
modèle pharmacométrique, plus particulièrement pharmacocinétique d'un
médicament en guise de traitement et la fenêtre cible du traitement, plus
particulièrement la fenêtre thérapeutique.
CA 03129642 2021-08-10
WO 2020/165444 8
PCT/EP2020/053979
Les personnels de santé choississent alors parmi un ensemble de
profils pharmacocinétiques d'un échantillon de patients, celui qui se
rapproche le plus de l'individu l sur base de ses données spécifiques (données
variables de l'individu, du dosage prescrit, de la posologie prescrite, temps
de
prise théorique).
Le procédé selon ce document est à destination des personnels
de santé tel que le médecin et permet au médecin d'ajuster la posologie,
l'intervalle de dosage et la concentration minimale acceptable de la protéine
plasmatique chez l'individu I. En effet, le procédé selon ce document n'est
pas
à destination du patient, l'individu I qui n'a alors pas d'impact sur son
traitement thérapeutique et qui n'a pas la possibilité de se gérer directement
sans l'intervention des personnels de santé.
US2004/193446 décrit le suivi d'un individu par un dispositif
électronique pour la prise d'un médicament. Le dispositif électronique envoie
un signal à l'individu quand il a oublié de prendre son médicament.
Malheureusement, les dispositifs actuels fournissent une
information statique, estimée sur un effet passé tenant compte de l'effet du
traitement thérapeutique qui a eu lieu et l'information est basée sur un
comportement théorique tel que prescrit par un professionnel de la santé, par
exemple un modèle selon la prescription corrigé avec des informations et
paramètres sur le patient. Aussi, les dispositifs actuels fournissent une
information aux personnels de santé permettant de redéfinir une posologie
mieux adaptée au patient.
Il est donc constaté que ce modèle ne correspond parfois pas à
la réalité, en effet dans la pratique il n'est pas possible de repositionner
le
modèle obtenu sur base de mesure de concentration sanguine obtenue sur le
patient. Ce modèle, ne tenant pas compte de la variabilité des concentrations
résultant d'une adhérence imparfaite, même après correction obtenue via
translation du modèle, il ne sera pas possible de faire correspondre les
données
CA 03129642 2021-08-10
WO 2020/165444 9
PCT/EP2020/053979
de concentration calculées à partir du modèle aux concentrations
observées/mesurées.
Il existe un besoin de fournir un dispositif qui fournit une
information à chaque instant t, présent ou futur, qui prend en compte les
évènements de la vie d'un individu donné, mais également qui fournit une
information sur l'amélioration de l'adhésion thérapeutique du patient, à
savoir
la régularité du traitement mais aussi l'implication, la conscientisation du
patient sur les conséquences des déviations du schéma posologique.
L'invention a pour but de résoudre les problèmes mentionnés ci-
avant en procurant un premier procédé d'assistance à la prise ou à l'acte d'un
traitement thérapeutique pour un individu tel que mentionné au début
caractérisé en ce qu'il comprend en outre :
-
l'obtention, par un premier dispositif, à partir d'une base de
données, d'un modèle de données du traitement
thérapeutique, telles qu'une série de modèles
pharmacométriques pour au moins une indication
prédéterminée, et une fenêtre cible pour le traitement
thérapeutique;
-
l'enregistrement, par un dispositif électronique de suivi, de
données indicatives liées à la prise ou à l'acte dudit
traitement thérapeutique de l'individu incluant notamment
l'horodatage de l'individu;
- la réception, par le premier dispositif, du dispositif
électronique de suivi desdites données indicatives liées à la
prise ou à l'acte dudit traitement thérapeutique de l'individu
Ii;
- le calcul, par le premier dispositif, d'un modèle des données
corrigé de l'individu à partir dudit modèle de données du
traitement thérapeutique et desdites données indicatives
liées à la prise ou à l'acte dudit traitement thérapeutique;
CA 03129642 2021-08-10
WO 2020/165444 10
PCT/EP2020/053979
- le calcul, par le premier dispositif, de données de
positionnement de l'individu dans ladite fenêtre cible dudit
traitement thérapeutique prédéterminé, à partir dudit
modèle corrigé de l'individu et desdites données indicatives
de la prise ou de l'acte et/ou le calcul et/ou l'indication, par
le premier dispositif, d'une information temporelle pour la
prochaine prise ou le prochain acte dudit traitement
thérapeutique.
Le positionnement de l'individu l dans ladite fenêtre cible dudit
traitement thérapeutique ou l'information temporelle pour la prochaine prise
ou le prochain acte dudit traitement thérapeutique permet l'individu de
planifier mieux la prochaine prise ou le prochain acte du traitement
thérapeutique. Ce qui rend plus simple et souple l'adhérence au traitement
thérapeutique et par conséquent le rend plus efficace.
L'invention a également pour but de résoudre les problèmes
mentionnés ci-avant en procurant un deuxième procédé d'assistance à la prise
ou à l'acte d'un traitement thérapeutique pour un individu litel que mentionné
au début caractérisé 'en ce qu'il comprend en outre :
- la réception, par le premier dispositif, des données
indicatives liées à la prise ou à l'acte dudit traitement
thérapeutique prédéterminé incluant notamment
l'horodatage, le dosage et l'historique de prises ou d'acte,
d'un dispositif électronique de suivi ;
- le calcul, par le premier dispositif, d'un modèle de données
corrigé de l'individu 1 à partir dudit modèle de données
projeté de l'individu 11et desdites données indicatives liées à
la prise ou à l'acte dudit traitement thérapeutique
prédéterminé ;
- le calcul, par le premier dispositif, à chaque instant t, d'un
modèle de données individualisé de l'individu l à partir dudit
CA 03129642 2021-08-10
WO 2020/165444 11
PCT/EP2020/053979
modèle de données corrigé de l'individu I et desdites
données indicatives liées à la prise ou à l'acte dudit
traitement thérapeutique prédéterminé, ledit modèle
individualisé prenant en compte la valeur de l'effet à chaque
instant t, de la totalité ou d'une partie des précédentes prises
ou actes d'un traitement thérapeutique prédéterminé pour
l'individu l, l'horodatage de la prise ou de l'acte et le dosage
de la prise ou de l'acte précédent ;
- le calcul, par le premier dispositif, des données de
positionnement de l'individu 1 dans ladite fenêtre cible dudit
traitement thérapeutique prédéterminé à partir dudit
modèle individualisé de l'individu l et desdites données
indicatives de la prise ou de l'acte dudit traitement
thérapeutique, ladite fenêtre cible comprenant un seuil
minimum et/ou maximum, par exemple un seuil de perte
d'efficacité prédéterminé et/ou un seuil de toxicité
prédéterminé.
Selon la présente invention, le procédé transforme la statistique
passée pour expliquer les écarts de l'effet thérapeutique par rapport aux
modèles pharmacocinétiques de l'art antérieur et tient compte des écarts par
rapport au traitement/régime posologique prescrit. En effet, le modèle
individualisé de l'individu l correspond à la réalité car il tient compte des
données indicatives liées à la prise ou à l'acte dudit traitement
thérapeutique
incluant l'horodatage, le dosage réel ou supposé, et l'historique de prises ou
d'acte mais également en tenant compte de la valeur de la teneur résiduelle du
traitement thérapeutique prédéterminé pour l'individu l.
Selon la présente invention la base de données comprend des
données du traitement thérapeutique, telles qu'une série de modèles
pharmacométriques (par exemple pharmacocinétique et/ou
pharmacodynamique et/ou pharmacoéconomique et/ou tout autre modèle
pharmacométrique disponible) pour au moins une indication prédéterminée,
CA 03129642 2021-08-10
WO 2020/165444 12
PCT/EP2020/053979
et une fenêtre cible (par exemple une fenêtre thérapeutique et/ou un seuil
d'efficacité à atteindre et/ou un seuil de toxicité à ne pas dépasser et/ou
une
fenêtre coût/bénéfice et/ou tout autre fenêtre cible, aussi la fenêtre cible
peut
varier au cours du temps) pour chaque traitement thérapeutique prédéterminé
qui sont stockés, enregistrés dans la base de données, éventuellement les
paramètres de l'individu I; sont enregistrés dans la base de données,
éventuellement les données de concentrations de l'individu l sont enregistrées
dans la base de données, plus particulièrement les données variables de
l'individu h sont enregistrées dans la base de données.
En outre, le procédé selon la présente invention comprend
l'obtention, par le premier dispositif, des données spécifiques de l'individu
comprenant les paramètres du modèle pharmacométrique pour l'individu
choisis dans le groupe physiologique (par exemple, du poids, de l'age, du
sexe),
d'un marqueur génétique, d'un marqueur biologique.
Le procédé selon la présente invention comprend en outre
l'obtention, par le premier dispositif, des données spécifiques de l'individu
h
comprenant les données médicales de l'individu I; choisies dans le groupe d'un
effet mesuré du traitement, d'une concentration mesurée, d'un effet
secondaire, d'une demi-vie estimée, d'une durée d'action estimée, d'un
rapport coût efficacité.
Le procédé selon la présente invention comprend en outre le
calcul, par le premier dispositif, du modèle de données projeté de l'individu
h
ou du modèle de données corrigé de l'individu l ou du modèle de données
individualisé de l'individu 14 à partir desdits paramètres du modèle
pharmacométrique pour l'individu h et/ou desdites données médicales de
l'individu I.
Il est en effet apparu particulièrement avantageux que le
premier dispositif selon la présente invention, avec l'obtention des
paramètres
du modèle pharmacométrique pour l'individu h et/ou les données médicales
de l'individu I permet de calculer un modèle de données projeté ou un modèle
CA 03129642 2021-08-10
WO 2020/165444 13
PCT/EP2020/053979
de données corrigé ou un modèle de données individualisé se rapprochant de
la réalité. En effet, plus le premier dispositif selon la présente invention
obtient
des données spécifiques de l'individu l, plus le modèle de données projeté ou
le modèle de données corrigé ou le modèle de données individualisé de
l'individu lisera précis et complet.
En outre, le premier dispositif, peut comprendre une ou
plusieurs base de données. En effet, il peut comprendre une première base de
données qui comprend des données du traitement thérapeutique, telles
qu'une série de modèles pharmacométriques, par exemple pharmacocinétique
et/ou pharmacodynamique et/ou pharmacoéconomique pour au moins une
indication prédéterminée, et une fenêtre cible (qui peut varier au cours du
temps) pour chaque traitement thérapeutique prédéterminé.
Le premier dispositif, peut comprendre une deuxième base de
données qui comprend des données spécifiques de l'individu l telles que : a)
les
paramètres du modèle pharmacométrique pour l'individu I choisis dans le
groupe physiologique (par exemple, du poids, de l'age, du sexe), d'un marqueur
génétique, d'un marqueur biologique; b) les données médicales de l'individu
choisies dans le groupe d'un effet mesuré du traitement, d'une concentration
mesurée, d'un effet secondaire, d'une demi-vie estimée, d'une durée d'action
estimée, d'un rapport coût efficacité ; et c) les données variables de
l'individu li
choisies dans le groupe du dosage, de la posologie, du temps de prise
théorique
de chaque traitement thérapeutique prédéterminé.
Le premier dispositif, peut comprendre une troisième base de
données qui comprend à la fois des données du traitement thérapeutique,
telles qu'une série de modèles pharmacométrique, par exemple
pharmacocinétique et/ou pharmacodynamique et/ou pharmacoéconomique
pour au moins une indication prédéterminée, et une fenêtre cible pour chaque
traitement thérapeutique prédéterminé et à la fois des données spécifiques de
l'individu I telles que: a) les paramètres du modèle pharmacométrique pour
l'individu l choisis dans le groupe physiologique (par exemple, du poids, de
CA 03129642 2021-08-10
WO 2020/165444 14
PCT/EP2020/053979
l'age, du sexe), d'un marqueur génétique, d'un marqueur biologique ; b) les
données médicales de l'individu II choisies dans le groupe d'un effet mesuré
du
traitement, d'une concentration mesurée, d'un effet secondaire, d'une demi-
vie estimée, d'une durée d'action estimée, d'un rapport coût efficacité ; et
c)
les données variables de l'individu b choisies dans le groupe du dosage, de la
posologie, du temps de prise théorique de chaque traitement thérapeutique
prédéterminé.
Selon la présente invention, le premier dispositif reçoit, d'un
dispositif électronique de suivi, des données indicatives liées à la prise ou
à
l'acte du traitement thérapeutique prédéterminé, ces données indicatives
incluent notamment l'horodatage, le dosage par exemple réel ou supposé, et
l'historique de prise ou d'acte du traitement.
Le premier dispositif calcule ensuite, à partir du modèle de
données projeté de l'individu I; et des donnés indicatives liées à la prise du
traitement thérapeutique, un modèle de données corrigé de l'individu b qui est
représentatif de l'effet du traitement thérapeutique en fonction du temps pour
le patient car les données médicales relatives à l'assimilation, la
distribution, la
métabolisation , et/ou l'élimination et/ou l'effet mesuré du traitement et/ou
une concentration mesurée et/ou un effet secondaire et/ou une demi-vie
estimée et/ou une durée d'action estimée de l'individu fi sont prises en
compte
ainsi que la date, l'heure, la dose de la prise ou de l'acte et l'historique
de prise
ou d'acte du traitement thérapeutique.
Le calcul d'un modèle de données corrigé de l'individu I; permet
de fournir un modèle qui tient compte des écarts par rapport aux modèles
pharmacométriques classiques et tient compte des écarts dans les prises ou
actes par rapport au traitement prescrit. Il prend en compte l'historique des
prises ou des actes réels du traitement thérapeutique.
En effet, avec les modèles pharmacocinétiques classiques de
l'art antérieur, un pic ou un creux de l'effet thérapeutique mesuré ne peut
s'expliquer que par les paramètres pharmacocinétiques du patient, par
CA 03129642 2021-08-10
WO 2020/165444 15
PCT/EP2020/053979
exemple une variation dans l'absorption, la distribution, la métabolisation ,
et/ou élimination.
Selon la présente invention, lorsque l'on observe un pic de l'effet
thérapeutique dans le modèle, par exemple un pic de la concentration en
substance active d'un traitement thérapeutique, s'il coincide avec un
évènement de prise ou d'acte du traitement thérapeutique, il ne sera pas
attribué à une assimilation rapide mais peut s'expliquer comme résultant de la
prise ou de l'acte du traitement. Un creux de l'effet thérapeutique dans le
modèle, par exemple un creux de la concentration, s'il coincide avec une
absence d'évènement de prise ou d'acte du traitement thérapeutique sur une
période de temps, peut s'expliquer par l'omission de la prise ou de l'acte du
traitement thérapeutique et non pas par une élimination rapide.
Par conséquent, parce que le modèle de données corrigé de
l'individu prend en compte les données indicatives liées à la prise du
traitement
thérapeutique, il permet d'expliquer les écarts et non pas d'attribuer des
variations de l'effet à de fausses causes.
Grâce à cela, on peut directement attribuer un écart d'effet
thérapeutique ou encore un effet secondaire de l'effet thérapeutique, à un
problème d'adhésion thérapeutique du patient et pas seulement à un
problème physiologique lié au patient, par exemple un changement
d'absorption, de distribution, de métabolisation, ou d'élimination, ou à un
problème lié au traitement thérapeutique.
Le dispositif électronique de suivi comprend une source
d'alimentation, un capteur, un processeur, une unité de communication, une
horloge et une mémoire. Les éléments susdits peuvent être contenu dans un
ou plusieurs dispositifs électroniques. Lorsque l'individu h réalise une prise
ou
un acte d'un traitement thérapeutique, le capteur du dispositif électronique
de
suivi est actionné automatiquement ou pas, par exemple dans le cas d'un
bouton poussoir, l'action de l'individu h sur le capteur est enregistré comme
un
évènement de prise ou d'acte de traitement thérapeutique. Le processeur est
CA 03129642 2021-08-10
WO 2020/165444 16
PCT/EP2020/053979
agencé pour traiter un évènement de prise ou d'acte de traitement
thérapeutique et pour générer un signal comprenant les données indicatives
liées à la prise ou à l'acte du traitement thérapeutique. Ces données
indicatives
comprennent l'horodatage, le dosage réel ou supposé, et l'historique de prise
ou d'acte thérapeutique. En effet, le processeur enregistre les données
indicatives liées à la prise ou à l'acte du traitement thérapeutique dans la
mémoire du dispositif électronique de suivi, il enregistre également les
données indicatives liées à la distribution du médicament ou de l'acte du
traitement thérapeutique par un distributeur.
Par dispositif électronique de suivi, on etend au sens de la
présente invention par exemple un emballage, un étui, un récipient pour
médicament, un distributeur embarqué ou non, comprenant un dispositif
électronique de suivi, on entend également un emballage, un étui, un récipient
pour médicament, un distributeur embarqué ou non, connecté via une
application à un téléphone intelligent, une tablette ou une montre connectée
ou encore tout autre dispositif électronique d'enregistrement agencé pour
générer un signal comprenant les données indicatives liées à la prise ou à
l'acte
du traitement thérapeutique. On entend également tout autre moyen
d'enregistrement permettant au patient de déclarer qu'il a réalisé sa prise ou
son acte d'un traitement thérapeutique, par exemple un registre.
Selon la présente invention, le premier dispositif calcule à
chaque instant t, présent ou futur, sur base du modèle de données corrigé de
l'individu l et des données indicatives liées à la prise ou à l'acte du
traitement
thérapeutique, un modèle de données individualisé de l'individu l.
En effet, selon la présente invention, le modèle de données
individualisé de l'individu b prend en compte la valeur de l'effet à chaque
instant t, de la totalité ou d'une partie des précédentes prises ou actes d'un
traitement thérapeutique prédéterminé pour l'individu l, c'est-à-dire la
proportion du traitement thérapeutique, par exemple la proportion de
substance active du traitement thérapeutique pour l'individu, n'ayant pas
CA 03129642 2021-08-10
WO 2020/165444 17
PCT/EP2020/053979
encore été éliminé. ,Sur base du modèle de données corrigé de l'individu
prenant en compte la valeur de la teneur résiduelle et le dosage de la prise
ou
de l'acte précédent, le premier dispositif selon l'invention, calcule à chaque
instant t, présent ou futur, avec les données liées à la prise ou à l'acte du
traitement thérapeutique et l'horodatage, un modèle de données individualisé
de l'individu h.
Selon la présente invention, le premier dispositif calcule, sur
base du modèle individualisé de l'individu et des données indicatives liées à
la
prise ou à l'acte du traitement thérapeutique, à chaque instant, des données
de positionnement de l'individu l dans la fenêtre cible du traitement
thérapeutique prédéterminé.
En effet, le premier dispositif permet de calculer de façon
prédictive l'évolution dans le temps de la concentration et/ou de l'effet
suite à
une nouvelle prise ou acte du traitement thérapeutique et ce, tenant compte
de l'estimation de la valeur de l'effet à chaque instant t, de la totalité ou
d'une
partie des précédentes prises ou actes d'un traitement thérapeutique
prédéterminé pour l'individu li,.
La fenêtre cible, qui peut varier au cours du temps, comprend à
tout moment, un seuil minimum et/ou maximum, par exemple un seuil de perte
d'efficacité et/ou un seuil de toxicité tous deux prédéterminés.
Il est apparu de manière particulièrement avantageuse, qu'il est
possible selon la présente invention, de calculer, au moyen du premier
dispositif, des données de positionnement de l'individu 1 dans cette fenêtre
cible (fenêtre thérapeutique et/ou seuil d'efficacité à atteindre et/ou seuil
de
toxicité à ne pas dépasser et/ou une fenêtre coût/bénéfice et/ou tout autre
fenêtre cible). Ces données de positionnement prennent en compte le modèle
individualisé de l'individu h et les données indicatives liées à la prise ou à
l'acte
du traitement thérapeutique et sont individualisées pour l'individu l tout en
prenant en compte les écarts dans l'adhésion thérapeutique, grâce aux
données indicatives liées à la prise ou à l'acte du traitement thérapeutique.
CA 03129642 2021-08-10
WO 2020/165444 18
PCT/EP2020/053979
En effet, le premier dispositif selon la présente invention, par la
mise en oeuvre du procédé d'assistance à la prise ou à l'acte de traitement
thérapeutique permet avantageusement de conscientiser l'individu donné 14 le
patient, à l'importance de la régularité du traitement thérapeutique, c'est-à-
dire une adhésion thérapeutique optimale en positionnant à chaque instant t,
présent ou futur son effet thérapeutique dans la fenêtre cible. L'individu l
peut
ainsi à chaque instant t, présent ou futur identifier s'il est proche du seuil
de
toxicité et/ou du seuil de perte d'efficacité et/ou d'un seuil d'efficacité à
atteindre et/ou son positionnement dans une fenêtre coût/bénéfice ou tout
autre fenêtre cible.
Le dispositif selon la présente invention permet également de
conscientiser l'individu 14 le patient, à l'impact de l'adhésion thérapeutique
sur
l'effet thérapeutique du traitement en matérialisant l'effet thérapeutique de
son traitement à chaque instant t, présent ou futur dans la fenêtre cible. En
.. effet, il est important pour le patient de visualiser la relation entre
l'adhésion
thérapeutique, l'effet thérapeutique et l'efficacité du traitement
thérapeutique.
Lorsque cette information est rendue disponible pour les
professionnels de santé, il est dès lors identifiable que le patient,
l'individu
n'est pas face à un problème d'assimilation, de distribution, de
métabolisation,
et/ou d'élimination mais face à un problème d'adhésion thérapeutique. Dans
ce cas, la solution n'est pas de surdoser le traitement thérapeutique, par
exemple le médicament, au risque de créer des toxicités agravées ou de
changer de molécule de traitement thérapeutique mais de comprendre les
causes de ce comportement et d'éduquer le patient à une bonne adhésion
thérapeutique.
Dans un mode de réalisation préféré de la présente invention, le
procédé comprend en outre le calcul, par le premier dispositif, d'un
intervalle
de temps Tmin à respecter avant la prochaine prise ou acte du traitement
CA 03129642 2021-08-10
WO 2020/165444 19
PCT/EP2020/053979
thérapeutique, à partir desdites données de positionnement de l'individu h
dans ladite fenêtre cible dudit traitement thérapeutique prédéterminé.
Dans un autre mode de réalisation préféré de la présente
invention, le procédé comprend en outre le calcul, par le premier dispositif,
d'un intervalle de temps Tmax à respecter pour la prochaine prise ou acte du
traitement thérapeutique, à partir desdites données de positionnement de
l'individu h dans ladite fenêtre cible dudit traitement thérapeutique
prédéterminé.
Il est apparu de manière particulièrement avantageuse que,
.. calculer, par le premier dispositif, un intervalle de temps Tmin à
respecter avant
la prochaine prise du traitement thérapeutique et/ou un intervalle de temps
Tmax à respecter pour la prochaine prise du traitement thérapeutique, permet
de fournir au patient une information précise et simple à comprendre sur le
futur de son régime thérapeutique, à savoir l'intervalle de temps entre Tmin
et
Tmax endeans lequel la prochaine prise, le prochain acte du traitement
thérapeutique doit avoir lieu.
Le calcul, par le premier dispositif, d'un intervalle de temps Tmin
à respecter avant la prochaine prise du traitement thérapeutique permet de
fournir une information sur le temps minimum avant lequel le patient,
l'individu
lb ne doit pas réaliser une prise ou un acte du traitement thérapeutique pour
que l'effet thérapeutique, par exemple la concentration en substance active
pour l'individu ne passe pas au dessus du seuil maximum, par exemple du
seuil de toxicité prédéterminé.
Le calcul, par le premier dispositif, d'un intervalle de temps Tmax
à respecter pour la prochaine prise du traitement thérapeutique permet de
fournir une information sur le temps maximum avant lequel le patient,
l'individu lb doit réaliser une prise ou un acte du traitement thérapeutique
pour
que l'effet thérapeutique, par exemple la concentration en substance active
dans l'organisme ne passe pas en dessous du seuil minimum, par exemple du
seuil de perte d'efficacité prédéterminé.
CA 03129642 2021-08-10
WO 2020/165444 20
PCT/EP2020/053979
En effet, dans les deux cas, le passage de l'effet thérapeutique,
par exemple de la concentration en substance active, au dessus du seuil de
toxicité ou en dessous du seuil de perte d'efficacité n'est pas souhaitable,
il est
important pour la réussite du traitement thérapeutique que la concentration
en substance active pour l'individu lise situe dans la fenêtre cible, en
limitant
le plus possible les passages dans les seuils critiques.
A la différence de donner une information sur le passé ou un
score sur l'historique de l'adhésion thérapeutique du patient, selon la
présente
invention, le premier dispositif donne un nombre d'heures et/ou minutes (un
nombre entier ou non) à respecter, dans le futur :
- avant la prochaine prise ou le prochain acte de traitement
thérapeutique pour que l'effet thérapeutique, par exemple
la concentration en substance active pour l'individu l ne
passe pas au dessus du seuil de toxicité prédéterminé,
l'intervalle de temps Tmin,
- pour la prochaine prise ou le prochain acte de traitement
thérapeutique pour que l'effet thérapeutique, par exemple
la concentration en substance active pour l'individu h ne
passe pas en dessous du seuil de perte d'efficacité
prédéterminé, l'intervalle de temps Tmax.
Le procédé selon la présente invention assiste donc l'individu h
pour qu'il optimise l'effet de son traitement thérapeutique en le guidant pour
les prises ou pour les actes du traitement thérapeutique futurs et non pas en
lui fournissant une indication unique sur les effets passés pour lesquels il
est
dans tous les cas trop tard pour agir.
A titre d'exemple, cela permet à un patient traité par
luminothérapie pour l'amélioration de son état d'humeur de savoir qu'il lui
reste par exemple 20 heures, 18 heures, 15 heures, 12 heures, 10 heures, 8
heures, 5 heures, 2 heures avant que le taux de mélatonine dans son organisme
CA 03129642 2021-08-10
WO 2020/165444 21
PCT/EP2020/053979
ne passe sous un seuil de perte d'efficacité et que son état d'humeur se
détériore.
Aussi, pour un patient traité par une substance active anti
douleur, cela lui permet de savoir qu'il lui reste par exemple 5 heures avant
que
le taux de substance active qui inhibe la douleur dans son organisme ne passe
sous un seuil de perte d'efficacité et que ses douleurs réapparaissent.
Avantageusement, le procédé selon la présente invention,
comprend en outre le calcul, par le premier dispositif, d'au moins un
intervalle
de temps Tmin tampon avant la prochaine prise ou acte thérapeutique à
partir desdites données de positionnement de l'individu h dans ladite fenêtre
cible dudit traitement thérapeutique prédéterminé.
Avantageusement, le procédé selon la présente invention,
comprend en outre le calcul, par le premier dispositif, d'au moins un
intervalle
de temps Tmax tampon pour la prochaine prise ou acte thérapeutique à
.. partir desdites données de positionnement de l'individu l dans ladite
fenêtre
cible dudit traitement thérapeutique prédéterminé.
Une fenêtre cible classique, par exemple une fenêtre
thérapeutique comprend trois zones, une zone optimale dans laquelle l'effet
thérapeutique, par exemple la concentration en substance active pour
l'individu l doit se trouver pour que le traitement thérapeutique produise
l'effet
désiré, curatif, palliatif, préventif ; une zone de toxicité délimitée de la
zone
optimale par un seuil de toxicité prédéterminé ; une zone de perte
d'efficacité
délimitée de la zone optimale par un seuil de perte d'efficacité.
Il est apparu particulièrement avantageux selon la présente
.. invention de fournir une fenêtre cible, par exemple une fenêtre
thérapeutique
à cinq zones, incluant les trois zones précédentes et incluant en outre, une
zone
tampon minimum, par exemple de perte d'efficacité et une zone tampon
maximum, par exemple de toxicité.
CA 03129642 2021-08-10
WO 2020/165444 22
PCT/EP2020/053979
Une zone tampon de perte d'efficacité, typiquement basée sur
le notion de forgiveness d'un traitement, permet d'anticiper le passage de
l'effet thérapeutique, par exemple de la concentration en substance active
pour l'individu dans la zone de perte d'efficacité.
Une zone tampon de toxicité permet d'anticiper le passage de
l'effet thérapeutique, par exemple de la concentration en substance active
pour l'individu dans la zone de toxicité.
Selon la présente invention, il est apparu avantageusement que,
calculer, par le premier dispositif, un intervalle de temps Tmin tampon et/ou
un intervalle de temps Tmax tampon permet de donner au patient davantage
de flexibilité et de confort dans la gestion de son traitement thérapeutique.
En outre, les zones tampon de perte d'efficacité et de toxicité
peuvent être d'une part modifiées et d'autre part dynamiques.
En effet, ces zones tampon peuvent être modifiées en fonction
du ressenti du patient, par exemple un patient ressentant des effets
secondaires importants à la suite d'une prise ou acte d'un traitement
thérapeutique peut décider lui-même ou via un professionnel de santé, de
modifier la zone tampon de toxicité pour diminuer le ressenti d'effets
secondaires.
Aussi, il est important pour le patient de construire une habitude
de prise ou d'acte d'un traitement thérapeutique, pour ce faire il est
nécessaire
d'avoir des zones tampon dynamiques. Le but étant d'initier le patient avec
une
zone optimale étroite, c'est-à-dire avec une zone tampon de toxicité et une
zone tampon de perte d'efficacité importantes dans le but de contraindre le
patient à créer une habitude de prise ou d'acte de traitement thérapeutique
régulière. Une fois que le patient a crée son habitude de prise ou d'acte d'un
traitement thérapeutique, les zones tampon de toxicité et de perte
d'efficacité
peuvent diminuer, se restreindre et la zone optimale devient plus importante
CA 03129642 2021-08-10
WO 2020/165444 23
PCT/EP2020/053979
offrant plus de confort et de flexibilité dans la gestion de son traitement
thérapeutique.
Dans un autre mode de réalisation, le procédé selon la présente
invention comprend en outre le calcul, par le premier dispositif, d'au moins
un
deuxième intervalle de temps Tmin tampon avant la prochaine prise ou acte
thérapeutique à partir desdites données de positionnement de l'individu I1
dans
ladite fenêtre cible dudit traitement thérapeutique prédéterminé et/ou d'au
moins un deuxième intervalle de temps Tmax tampon pour la prochaine prise
ou acte thérapeutique à partir desdites données de positionnement de
l'individu fi dans ladite fenêtre cible dudit traitement thérapeutique
prédéterminé.
En outre, les zones tampon existent quelque que soit le patient
et comprennent des caractéristiques du médicament. Ces zones tampon
peuvent être adaptées par le patient ou par le professionnel de santé,
modifiées préventivement ou pas, et elles permettent d'agir sur le conseil de
prise ou d'acte du traitement thérapeutique donné par le professionnel de
santé.
Avantageusement, les données de positionnement de l'individu
dans ladite fenêtre cible indiquent au moins une information choisie dans le
groupe constitué :
- du temps
de la prise, de l'acte du traitement thérapeutique
précédent(e),
- de la réponse du modèle pharmacométrique du traitement
thérapeutique prédéterminé de l'individu
- du temps, Tmax, avant que la réponse du traitement
thérapeutique prédéterminé tombe en dessous dudit seuil
minimum de la fenêtre cible prédéterminée,
- du temps, Tmin, pour que la réponse du traitement
thérapeutique prédéterminé ne passe pas au dessus dudit
seuil maximum de la fenêtre cible prédéterminée,
CA 03129642 2021-08-10
WO 2020/165444 24
PCT/EP2020/053979
Avantageusement, les données de positionnement indiquent en
outre au moins un intervalle de temps Tmax tampon avant que la réponse du
traitement thérapeutique prédéterminé tombe en dessous d'un seuil tampon
minimum de la fenêtre cible.
Avantageusement les données de positionnement indiquent en
outre au moins un intervalle de temps Tmin tampon pour que la réponse du
traitement thérapeutique prédéterminé ne passe pas au dessus d'un seuil
tampon maximum de la fenêtre cible.
En effet, les données de positionnement qui indiquent :
Le temps de la prise, de l'acte du traitement thérapeutique
précédent(e) permet de fournir au patient une indication sur son historique de
prise, d'acte de traitement thérapeutique, d'autant plus important pour un
patient malade, âgé ou souffrant de troubles de la mémoire.
L'effet du traitement thérapeutique prédéterminé pour
l'individu l permet de fournir au patient une information sur son
positionnement dans la fenêtre cible. Cela lui permet en outre d'anticiper des
aléas, des évènements de la vie de tous les jours d'un patient, par exemple en
cas d'effet secondaire ou de fatigue accrue. Le patient a l'opportunité de
savoir
où l'effet thérapeutique, par exemple la concentration en substance active
dans son organisme se situe dans la fenêtre cible et de pouvoir se reposer,
réaliser une activité quelconque sans crainte pour la réussite de son
traitement
thérapeutique.
Le temps, Tmax, avant que la réponse du traitement
thérapeutique prédéterminé tombe en dessous du seuil minimum de la fenêtre
cible, et le temps, Tmin, pour que la réponse du traitement thérapeutique
prédéterminé ne passe pas au dessus du seuil maximum de la fenêtre cible. Ces
deux informations permettent également au patient, à l'individu b, de manière
très avantageuse de mieux anticiper les évènements de la vie tels que le
CA 03129642 2021-08-10
WO 2020/165444 25
PCT/EP2020/053979
sommeil, les effets secondaires, un déplacement professionnel, une activité
extra professionnelle par exemple.
En effet, fournir au patient l'intervalle de temps Tmax tampon
et/ou l'intervalle de temps Tmin tampon permet au patient de mieux
comprendre son traitement thérapeutique, de se rassurer sur le bon dosage et
d'avoir davantage de flexibilité et de confort dans la gestion de son
traitement
thérapeutique tout en maintenant une balance efficacité/toxicité optimale.
A terme, on peut supposer que le système proposé puisse
permettre au patient, en collaboration avec le prescripteur, de gérer sa
médication tant en terme de doses que d'espace entre les prises tout en
contrôlant de façon optimale les effets de son traitement; ce qui revient à
avoir
une posologie individualisée et variable dans le temps.
Ces informations permettent au patient de savoir combien de
temps il dispose avant que sa réponse thérapeutique, par exemple sa
concentration en substance active du traitement thérapeutique dans son
organisme tombe en dessous du seuil tampon de perte d'efficacité, dans la
zone tampon de perte d'efficacité mais encore au dessus de la zone critique de
perte d'efficacité. Il est en effet avantageux de pouvoir informer le patient,
via
la zone tampon de perte d'efficacité, qu'il lui reste par exemple deux heures
avant de tomber dans la zone critique de perte d'efficacité s'il ne réalise
pas de
prise ou d'acte du traitement thérapeutique dans ce délai.
En outre, ces informations permettent également au patient de
savoir combien de temps il dispose pour que son effet thérapeutique, par
exemple sa concentration en substance active du traitement thérapeutique ne
passe pas au dessus du seuil tampon de toxicité, ou dans la zone tampon de
toxicité. Il est en effet avantageux de pouvoir informer le patient, via la
zone
tampon de toxicité, qu'il doit attendre par exemple deux heures pour réaliser
une prise ou action thérapeutique pour ne pas passer dans la zone critique de
toxicité en cas de prise ou d'acte du traitement thérapeutique dans ce délai.
CA 03129642 2021-08-10
WO 2020/165444 26
PCT/EP2020/053979
Ceci est particulièrement avantageux pour le patient qui désire
adapter ses prises ou ses actes de traitement thérapeutiques en cas d'imprévu
ou d'évènement de la vie courante. Par exemple, le patient se situe dans la
zone
optimale de la fenêtre cible, avec les données selon la présente invention, le
patient à l'opportunité de réaliser une prise, par exemple la prise d'un demi
comprimé, ou de réaliser l'acte de traitement thérapeutique au moment idéal
pour rester en dessous du seuil critique de toxicité et le patient sait
ensuite le
temps restant avant de tomber dans la zone critique de perte d'efficacité.
Cela
permet de fournir au patient de l'autonomie et du confort pour leur traitement
thérapeutique et leur permet d'anticiper les évènements de la vie courante
comme un déplacement professionnel, une activité quelconque, un temps de
sommeil nécessaire.
En outre, les professionnels de santé ont également
l'opportunité d'adapter éventuellement la posologie du traitement
thérapeutique ou de prendre des décisions thérapeutiques.
Dans un autre mode de réalisation, le procédé selon la présente
invention comprend en outre l'indication d'au moins une donnée, de
préférence par un dispositif d'information, par exemple d'affichage.
En effet, l'indication d'au moins une donnée est
particulièrement avantageux car cela permet de fournir au patient, à
l'individu
h, une information claire, précise et directement accessible et
compréhensible.
En outre, en ayant accès à une information claire, précise et
compréhensible représentative de son positionnement dans la fenêtre cible, le
patient peut alors optimiser sa prise ou acte de traitement thérapeutique par
exemple pour réduire les effets secondaires d'un traitement lourd. En effet le
patient peut choisir de prendre une demie prise de traitement thérapeutique,
par exemple un demi comprimé, toutes les 12 heures plutôt que de prendre
une prise de traitement thérapeutique complète, par exemple un comprimé
entier, toutes les 24 heures.
CA 03129642 2021-08-10
WO 2020/165444 27
PCT/EP2020/053979
Avantageusement, le procédé selon la présente invention
comprend en outre l'émission, par le premier dispositif et/ou par le
dispositif
électronique de suivi et/ou par le dispositif d'affichage, et/ou un appareil
connecté (tablette, montre, smart phone, etc.) d'un signal d'alerte, de
préférence visuel ou sonore, en cas de passage, à chaque instant t, présent ou
futur, de l'effet thérapeutique en dessous du seuil minimum, par exemple de
perte d'efficacité, au dessus du seuil maximum, par exemple de toxicité, en
dessous du seuil tampon minimum, par exemple de perte d'efficacité, au
dessus du seuil tampon maximum, par exemple de toxicité. =
En outre, il est particulièrement avantageux selon la présente
invention que le dispositif d'information permettant l'indication d'au moins
une donnée, et/ou le premier dispositif, et/ou le dispositif électronique de
suivi,
et/ou le dispositif d'affichage, et/ou l'appareil connecté permettant
l'émission
d'un signal d'alerte, soient équipés d'une interface, et plus particulièrement
équipés d'un système d'assistance personnelle intelligente, plus
communément dit un assistant personnel intelligent, aussi appelé assitant
personnel virtuel. Cela permettant en outre d'effectuer des tâches ou des
services pour l'individu, en lui signalant une information, une alerte, un
rappel
etc. L'interface, plus particulièrement l'assitant personnel intelligent peut
interagir avec le patient, émettre un signal, donner une information, au moyen
d'une communication écrite et/ou d'une communication vocale. On cite à titre
d'exemple Alexa, Google Assistant, Google Now, Cortana, BlackBerry Assistant,
Bixby, Siri, Viv etc.
En effet, il est particulièrement avantageux selon la présente
invention, de pouvoir fournir au patient un signal d'alerte, à chaque instant
t,
présent ou futur, lorsque l'effet thérapeutique du traitement thérapeutique
passe l'un des seuils mentionnés.
Avantageusement, le procédé selon la présente invention
comprend en outre le calcul, par le premier dispositif, après réception de
minimum une donnée liée à la prise ou à l'acte dudit traitement thérapeutique,
CA 03129642 2021-08-10
WO 2020/165444 28
PCT/EP2020/053979
d'un modèle de données individualisé de l'individu i à partir dudit modèle de
données projeté de l'individu b et desdites données indicatives, de préférence
après réception pendant une durée d'au moins 2 demi-vie du traitement
thérapeutique, préférentiellement d'au moins 2,5 demi-vie du traitement
thérapeutique, de manière avantageuse d'au moins 3 demi-vie du traitement
thérapeutique, avantageusement d'au moins 4 demi-vie du traitement
thérapeutique, préférentiellement d'au moins 5 demi-vie du traitement
thérapeutique.
En effet, plus le premier dispositif reçoit lesdites données
.. indicatives de la prise ou de l'acte du traitement thérapeutique plus le
modèle
de données individualisé de l'individu l gagne en précision et devient le
reflet
de la réalité.
Par exemple, la réception desdites données indicatives pendant
une durée de 1 demi-vie du traitement thérapeutique permet de calculer un
modèle de données individualisé de l'individu I, la réception desdites données
indicatives pendant une durée de 2 demi-vie du traitement thérapeutique
permet de calculer un meilleur modèle de données individualisé de l'individu
lb
la réception desdites données indicatives pendant une durée de 3 demi-vie du
traitement thérapeutique permet de calculer un modèle de données
individualisé de l'individu h au plus proche de la réalité.
Avantageusement, le procédé comprend en outre l'exclusion,
par le premier dispositif, des premières données indicatives reçues dans un
ensemble de données indicatives de la prise ou de l'acte d'un traitement
thérapeutique.
Il est apparu de manière particulièrement avantageuse que,
exclure, par le premier dispositif, les premières données indicatives reçues
dans
un ensemble de données indicatives permet au modèle individualisé de
l'individu I de ne pas significativement perdre en précision et de devenir le
reflet de la réalité à chaque instant t tout en optimisant le temps de calcul
nécessaire et l'espace de stockage requis.
CA 03129642 2021-08-10
WO 2020/165444 29
PCT/EP2020/053979
En effet, un nombre prédéterminé de premières données
indicatives, par exemple 1 donnée indicative, 2 données indicatives, 3 données
indicatives, 4 données indicatives, sont exlues, par le premier dispositif, à
partir
de la réception de par exemple 10 données indicatives, 9 données indicatives,
8 données indicatives, 7 données indicatives etc.
Cela permet avantageusement de conserver les données
indicatives de la prise ou de l'acte d'un traitement thérapeutique les plus
récentes et les plus représentatives du comportement de l'adhésion du patient
à un instant t pour calculer le modèle individualisé l'individu l.
D'autres formes de réalisation du procédé d'assistance à la prise
ou à l'acte d'un traitement thérapeutique pour un individu I selon la présente
invention sont indiquées dans les revendications annexées.
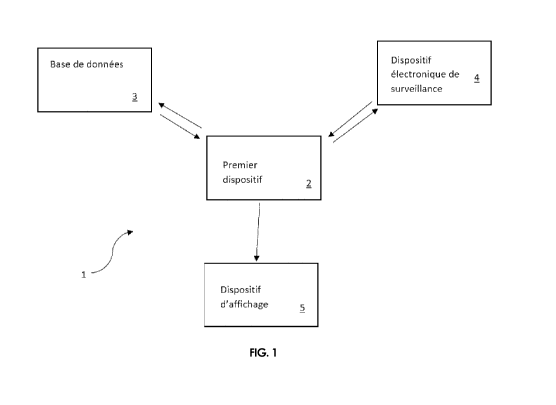
La présente invention se rapporte aussi à un système destiné à
assister la prise ou l'acte d'un traitement thérapeutique pour un individu h,
ledit
système comprenant :
- un premier dispositif,
- une base de données,
- un dispositif d'affichage,
- un dispositif électronique de suivi,
lequel est configuré pour mettre en oeuvre les étapes du procédé
selon la présente invention.
Il est en effet apparu qu'il est possible de mettre en oeuvre les
étapes du procédé selon la présente invention avec un système destiné à
assister la prise ou l'acte d'un traitement thérapeutique pour un individu
comprenant un premier dispositif, une base de données, un dispositif
d'affichage et un dispositif électronique de suivi.
En effet, la base de données comprend des données sur les
médicaments, ces données comprennent une série de modèles
CA 03129642 2021-08-10
WO 2020/165444 30
PCT/EP2020/053979
pharmacocinétique et/ou pharmacodynamique d'au moins un traitement
thérapeutique prédéterminé pour au moins une indication prédéterminée, et
une fenêtre cible pour chaque traitement thérapeutique prédéterminé. La base
de données comprend une unité de communication. En outre, dans cette base
de données ou une autre, les données a), b) et c) sont aussi stockées,
enregistrées.
Le dispositif électronique de suivi comprend une source
d'alimentation, un capteur, un processeur, une unité de communication, une
horloge et une mémoire. Les éléments susdits peuvent être contenu dans un
ou plusieurs dispositifs électroniques. Lorsque l'individu l réalise une prise
ou
un acte d'un traitement thérapeutique, le capteur du dispositif électronique
de
suivi est actionné automatiquement ou pas, par exemple dans le cas d'un
bouton poussoir, l'action de l'individu I sur le capteur est enregistré comme
un
évènement de prise ou d'acte de traitement thérapeutique. Le processeur est
agencé pour traiter un évènement de prise ou d'acte de traitement
thérapeutique et pour générer un signal comprenant les données indicatives
liées à la prise ou à l'acte du traitement thérapeutique. Ces données
indicatives
comprennent l'horodatage, le dosage et l'historique de prise ou d'acte
thérapeutique. En effet, le processeur enregistre les données indicatives
liées
à la prise ou à l'acte du traitement thérapeutique dans la mémoire du
dispositif
électronique de suivi.
Le premier dispositif du système selon la présente invention
comprend une source d'alimentation, un processeur, une unité de
communication et une mémoire et est configuré pour mettre en oeuvre les
étapes de calcul du procédé selon l'invention sur base des données de la base
de données et des données reçues du dispositif électronique de suivi.
Le dispositif d'affichage, éventuellement intégré au dispositif,
comprend une source d'alimentation, une unité de communication et un
processeur et est configuré pour fournir à l'individu l une information
claire,
précise, simple et directement accessible et compréhensible.
CA 03129642 2021-08-10
WO 2020/165444 31
PCT/EP2020/053979
Dans un mode de réalisation préféré du système selon la
présente invention, le premier dispositif, le dispositif d'affichage et le
dispositif
électronique de suivi sont intégrés dans un boitier unique.
Dans un autre mode de réalisation du système selon la présente
invention, le premier dispositif et le dispositif d'affichage sont intégrés
dans un
boitier, séparé du dispositif électronique de suivi.
Dans un autre mode de réalisation du système selon la présente
invention, le dispositif électronique de suivi et le dispositif d'affichage
sont
intégrés dans un boitier, séparé du premier dispositif.
Dans un autre mode de réalisation du système selon la présente
invention, le premier dispositif et le dispositif électronique de suivi sont
intégrés dans un boitier, séparé du dispositif d'affichage.
Dans un autre mode de réalisation du système selon la présente
invention, le dispositif électronique de suivi, le dispositif d'affichage et
le
premier dispositif sont intégrés dans des boitiers séparés.
Avantageusement, le système selon la présente invention est
caractérisé en ce que le premier dispositif, la base de données, le dispositif
d'affichage et le dispositif électronique de suivi comprennent une unité de
communication et sont reliés de manière communicante par communication
sans fil ou pour l'échange de données peuvent être connectés physiquement.
Avantageusement, le dispositif électronique de suivi du système
selon la présente invention comprend en outre au moins une source
d'alimentation, au moins un capteur, au moins un processeur, au moins une
horloge, au moins une unité de communication et au moins une mémoire. Les
éléments susdits peuvent être contenu dans un ou plusieurs dispositifs
électroniques. Le dispositif électronique de suivi est configuré pour générer
des
données indicatives liées à la prise ou à l'acte du traitement thérapeutique
prédéterminé incluant l'horodatage, le dosage et l'historique de prise ou
d'acte
du traitement thérapeutique.
CA 03129642 2021-08-10
WO 2020/165444 32 PCT/EP2020/053979
D'autres formes de réalisation du système selon la présente
invention sont indiquées dans les revendications annexées.
La présente invention se rapport en outre à un produit de
programme d'ordinateur, lequel comprend un programme pour un premier
dispositif, comprenant des parties de code de logiciel pour mettre en oeuvre
les
étapes du procédé selon la présente invention lorsque le programme est
exécuté sur ledit premier dispositif.
Dans un mode de réalisation avantageux, le produit de
programme d'ordinateur selon la présente invention comprend un support
lisible par ordinateur, sur lequel les parties de code de logiciel sont
stockées,
dans lequel le programme peut être chargé directement dans une mémoire
interne du premier dispositif.
D'autres formes de réalisation du produit de programme
d'ordinateur selon la présente invention sont indiquées dans les
revendications
annexées.
La présente invention se rapporte en outre à un deuxième
procédé d'assistance à la prise ou à l'acte d'un traitement thérapeutique pour
un individu l, comprenant :
-
l'obtention, par un premier dispositif (2), à partir d'une base
de données (3), de données du traitement thérapeutique,
telles qu'une série de modèles pharmacométriques pour au
moins une indication prédéterminée, et une fenêtre cible
pour chaque traitement thérapeutique prédéterminé ;
- l'obtention, par le premier dispositif (2), des données
spécifiques de l'individu l, comprenant :
a) les données variables de l'individu l choisies dans le
groupe du dosage, de la posologie, du temps de prise
théorique de chaque traitement thérapeutique
prédéterminé ;
CA 03129642 2021-08-10
WO 2020/165444 33
PCT/EP2020/053979
- le calcul, par le premier dispositif (2), d'un modèle de
données projeté de l'individu l à partir de ladite série de
modèles pharmacométriques et desdites données variables
de l'individu l.
Ce deuxième procédé d'assistance à la prise ou à l'acte d'un
traitement thérapeutique est caractérisé en ce qu'il comprend en outre :
- la réception, par le premier dispositif (2), des données
indicatives liées à la prise ou à l'acte dudit traitement
thérapeutique prédéterminé incluant notamment
l'horodatage, le dosage et l'historique de prise ou d'acte du
traitement thérapeutique, d'un dispositif électronique de
suivi (4) ;
- le calcul, par le premier dispositif (2), après réception de
minimum une donnée liée à la prise ou à l'acte dudit
traitement thérapeutique prédéterminé, d'un modèle de
données individualisé de l'individu I à partir dudit modèle de
données projeté de l'individu k et desdites données
indicatives ;
- le
calcul, par le premier dispositif (2), à chaque instant t, du
modèle de données individualisé de l'individu I1 sur base des
données indicatives liées à la prise ou à l'acte dudit
traitement thérapeutique prédéterminé, ledit modèle
individualisé prenant en compte la valeur de l'effet à chaque
instant t, de la totalité ou d'une partie des précédentes prises
ou actes d'un traitement thérapeutique prédéterminé pour
l'individu 14 l'horodatage de la prise ou de l'acte et le dosage
de la prise ou de l'acte du traitement thérapeutique
précédent.
Lorsque l'individu initie son traitement thérapeutique, il effectue
sa première prise ou acte du traitement thérapeutique et enregistre cet
CA 03129642 2021-08-10
WO 2020/165444 34
PCT/EP2020/053979
évènement de prise ou d'acte thérapeutique dans le dispositif électronique de
suivi. Ensuite le patient continue son traitement thérapeutique et continue
d'enregistrer les évènements de prise ou d'acte thérapeutique dans le
dispositif
électronique de suivi à chaque prise ou acte du traitement thérapeutique.
Le premier dispositif reçoit les données indicatives liées à la prise
ou à l'acte du traitement thérapeutique prédéterminé et ensuite calcule un
modèle données individualisé de l'individu h.
Il a été montré qu'il était possible, selon la présente invention,
de calculer, par le premier dispositif, un modèle de données individualisé de
l'individu l avec la réception de minimum une donnée liée à la prise ou à
l'acte
dudit traitement thérapeutique prédéterminé.
Le premier dispositif calcule le modèle individualisé de l'individu
à chaque instant t, présent ou futur, et le meilleur modèle individualisé de
l'individu h est obtenu après réception desdites données indicatives pendant
une durée d'au minimum de 1 demi-vie du traitement thérapeutique, d'un
modèle de données individualisé de l'individu h à partir dudit modèle de
données projeté de l'individu fi et desdites données indicatives, de
préférence
pendant une durée d'au moins 2 demi-vie du traitement thérapeutique,
préférentiellement d'au moins 2,5 demi-vie du traitement thérapeutique, de
manière avantageuse d'au moins 3 demi-vie du traitement thérapeutique,
avantageusement d'au moins 4 demi-vie du traitement thérapeutique,
préférentiellement d'au moins 5 demi-vie du traitement thérapeutique.
Par demi-vie du traitement thérapeutique, on entend au sens de
la présente invention, le temps mis par une substance active, par exemple une
molécule, un médicament, un ingrédient actif, pour perdre la moitié de son
activité pharmacologique ou physiologique.
En effet, plus le premier dispositif reçoit lesdites données
indicatives de la prise ou de l'acte du traitement thérapeutique plus le
modèle
CA 03129642 2021-08-10
WO 2020/165444 35
PCT/EP2020/053979
de données individualisé de l'individu b gagne en précision et devient le
reflet
de la réalité.
Par exemple, la réception desdites données indicatives pendant
une durée de 1 demi-vie du traitement thérapeutique permet de calculer un
modèle de données individualisé de l'individu 14 la réception desdites données
indicatives pendant une durée de 2 demi-vie du traitement thérapeutique
permet de calculer un meilleur modèle de données individualisé de l'individu
14
la réception desdites données indicatives pendant une durée de 3 demi-vie du
traitement thérapeutique permet de calculer un modèle de données
individualisé de l'individu 'lui plus proche de la réalité.
Avantageusement, le deuxième procédé comprend en outre
l'exclusion, par le premier dispositif, des premières données indicatives
reçues
dans un ensemble de données indicatives de la prise ou de l'acte d'un
traitement thérapeutique.
Il est apparu de manière particulièrement avantageuse que,
exclure, par le premier dispositif, les premières données indicatives reçues
dans
un ensemble de données indicatives permet au modèle individualisé de
l'individu b de ne pas significativement perdre en précision et de devenir le
reflet de la réalité à chaque instant t tout en optimisant le temps de calcul
nécessaire et l'espace de stockage requis.
En effet, un nombre prédéterminé de premières données
indicatives, par exemple 1 donnée indicative, 2 données indicatives, 3 données
indicatives, 4 données indicatives, sont exlues, par le premier dispositif, à
partir
de la réception de par exemple 10 données indicatives, 9 données indicatives,
8 données indicatives, 7 données indicatives etc.
Cela permet avantageusement de conserver les données
indicatives de la prise ou de l'acte d'un traitement thérapeutique les plus
récentes et les plus représentatives du comportement de l'adhésion du patient
à un instant t pour calculer le modèle individualisé l'individu 14
CA 03129642 2021-08-10
WO 2020/165444 36
PCT/EP2020/053979
En outre, le deuxième procédé selon la présente invention
comprend l'obtention, par le premier dispositif, des données spécifiques de
l'individu 1; comprenant les paramètres du modèle pharmacométrique pour
l'individu 1; choisis dans le groupe physiologique (par exemple, du poids, de
l'age, du sexe), d'un marqueur génétique, d'un marqueur biologique.
Le deuxième procédé selon la présente invention comprend en
outre l'obtention, par le premier dispositif , des données spécifiques de
l'individu I; comprenant les données médicales de l'individu I; choisies dans
le
groupe d'un effet mesuré du traitement, d'une concentration mesurée, d'un
effet secondaire, d'une demi-vie estimée, d'une durée d'action estimée, d'un
rapport coût efficacité.
Le deuxième procédé selon la présente invention comprend en
outre le calcul, par le premier dispositif, du modèle de données projeté de
l'individu I; ou du modèle de données corrigé de l'individu 1; ou du modèle de
données individualisé de l'individu 14 à partir desdits paramètres du modèle
pharmacométrique pour l'individu I; et/ou desdites données médicales de
l'individu 14
Il est en effet apparu particulièrement avantageux que le
premier dispositif selon la présente invention, avec l'obtention des
paramètres
du modèle pharmacométrique pour l'individu let/ou les données médicales de
l'individu 1; permet de calculer un modèle de données projeté se rapprochant
de la réalité. En effet, plus le premier dispositif selon la présente
invention
obtient des données spécifiques de l'individu 14 plus le modèle de données
projeté de l'individu I; sera précis et complet.
Avantageusement, le deuxième procédé comprend en outre le
calcul, par le premier dispositif, des données de positionnement de l'individu
I;
dans ladite fenêtre cible dudit traitement thérapeutique prédéterminé à partir
dudit modèle individualisé de l'individu I; et desdites données indicatives de
la
prise dudit traitement thérapeutique, ladite fenêtre cible comprenant un seuil
CA 03129642 2021-08-10
WO 2020/165444 37
PCT/EP2020/053979
minimum et/ou maximum, par exemple un seuil de perte d'efficacité
prédéterminé et/ou un seuil de toxicité prédéterminé.
Dans un mode de réalisation préféré, le deuxième procédé
comprend en outre le calcul, par le premier dispositif, d'un intervalle de
temps
Tmin à respecter avant la prochaine prise ou acte dudit traitement
thérapeutique, à partir desdites données de positionnement de l'individu
dans ladite fenêtre cible dudit traitement thérapeutique prédéterminé.
Dans un autre mode de réalisation préféré du deuxième procédé
selon la présente invention, le deuxième procédé comprend en outre le calcul,
par le premier dispositif, d'un intervalle de temps Tmax à respecter pour la
prochaine prise ou acte dudit traitement thérapeutique, à partir desdites
données de positionnement de l'individu l dans ladite fenêtre cible dudit
traitement thérapeutique prédéterminé.
Il est apparu de manière particulièrement avantageuse que,
calculer, par le premier dispositif, un intervalle de temps Tmin à respecter
avant
la prochaine prise du traitement thérapeutique et/ou un intervalle de temps
Tmax à respecter pour la prochaine prise du traitement thérapeutique, permet
de fournir au patient une information précise et simple à comprendre sur le
futur de son régime thérapeutique, à savoir l'intervalle de temps entre Tmin
et
Tmax endeans lequel la prochaine prise, le prochain acte du traitement
thérapeutique doit avoir lieu.
Le calcul, par le premier dispositif, d'un intervalle de temps Tmin
à respecter avant la prochaine prise du traitement thérapeutique permet de
fournir une information sur le temps minimum avant lequel le patient,
l'individu
14 ne doit pas réaliser une prise ou un acte du traitement thérapeutique pour
que l'effet thérapeutique, par exemple la concentration en substance active
pour l'individu ne passe pas au dessus du seuil de toxicité prédéterminé.
Le calcul, par le premier dispositif, d'un intervalle de temps Tmax
à respecter pour la prochaine prise du traitement thérapeutique permet de
CA 03129642 2021-08-10
WO 2020/165444 38
PCT/EP2020/053979
fournir une information sur le temps maximum avant lequel le patient,
l'individu h, doit réaliser une prise ou un acte du traitement thérapeutique
pour
que l'effet thérapeutique, par exemple la concentration en substance active
dans l'organisme ne passe pas en dessous du seuil de perte d'efficacité
prédéterminé.
En effet, dans les deux cas, le passage de l'effet thérapeutique,
par exemple de la concentration en substance active, au dessus du seuil de
toxicité ou en dessus du seuil de perte d'efficacité n'est pas souhaitable, il
est
important pour la réussite du traitement thérapeutique que la concentration
en substance active pour l'individu lise situe dans la fenêtre cible, en
limitant
le plus possible les passages dans les seuils critiques.
A la différence de donner une information sur le passé ou un
score sur l'historique de l'adhésion thérapeutique du patient, selon la
présente
invention, le premier dispositif donne une consigne temporelle qui peut par
exemple être exprimée en nombre d'heures et/ou minutes (un nombre entier
ou non) à respecter, dans le futur :
- avant la prochaine prise ou le prochain acte de traitement
thérapeutique pour que la réponse thérapeutique, par
exemple la concentration en substance active pour l'individu
I ne passe pas au dessus du seuil maximum, par exemple de
toxicité prédéterminé, l'intervalle de temps Tmin,
- pour la prochaine prise ou le prochain acte de traitement
thérapeutique pour que la réponse thérapeutique, par
exemple la concentration en substance active pour l'individu
l ne passe pas en dessous du seuil minimum, par exemple de
perte d'efficacité prédéterminé, l'intervalle de temps Tmax.
Le deuxième procédé selon la présente invention assiste donc
l'individu l pour qu'il optimise l'effet de son traitement thérapeutique en le
guidant pour les prises ou pour les actes du traitement thérapeutique futurs
en
CA 03129642 2021-08-10
WO 2020/165444 39
PCT/EP2020/053979
non pas en lui fournissant une indication unique sur les effets passés pour
lesquels il est dans tous les cas trop tard pour agir.
Aussi, pour un patient traité par une substance active anti
douleur, cela lui permet de savoir qu'il lui reste par exemple 5 heures avant
que
le taux de substance active anti douleur dans son organisme ne passe sous un
seuil de perte d'efficacité et que ses douleurs réapparaissent.
Avantageusement, le deuxième procédé selon la présente
invention, comprend en outre le calcul, par le premier dispositif, d'au moins
un
intervalle de temps Tmin tampon avant la prochaine prise ou acte dudit
traitement thérapeutique à partir desdites données de positionnement de
l'individu li dans ladite fenêtre cible dudit traitement thérapeutique
prédéterminé.
Avantageusement, le deuxième procédé selon la présente
invention, comprend en outre le calcul, par le premier dispositif, d'au moins
un
intervalle de temps Tmax tampon pour la prochaine prise ou acte dudit
traitement thérapeutique à partir desdites données de positionnement de
l'individu I dans ladite fenêtre cible dudit traitement thérapeutique
prédéterminé.
Une fenêtre cible classique, par exemple une fenêtre
thérapeutique comprend trois zones, une zone optimale dans laquelle l'effet
thérapeutique, par exemple la concentration en substance active pour
l'individu lj doit se trouver pour que le traitement thérapeutique produise
l'effet
désiré, curatif, palliatif, préventif ; une zone de toxicité délimitée de la
zone
optimale par un seuil de toxicité prédéterminé ; une zone de perte
d'efficacité
délimitée de la zone optimale par un seuil de perte d'efficacité.
Il est apparu particulièrement avantageux selon la présente
invention de fournir une fenêtre cible, par exemple une fenêtre thérapeutique
à cinq zones, incluant les trois zones précédentes et incluant en outre, une
zone
tampon de perte d'efficacité et une zone tampon de toxicité.
CA 03129642 2021-08-10
WO 2020/165444 40
PCT/EP2020/053979
Une zone tampon de perte d'efficacité permet d'anticiper le
passage de l'effet thérapeutique, par exemple de la concentration en substance
active pour l'individu dans la zone de perte d'efficacité.
Une zone tampon de toxicité permet d'anticiper le passage de
l'effet thérapeutique, par exemple de la concentration en substance active
pour l'individu dans la zone de toxicité.
Selon la présente invention, il est apparu avantageusement que,
calculer, par le premier dispositif, un intervalle de temps Tmin tampon et/ou
un intervalle de temps Tmax tampon permet de donner au patient davantage
de flexibilité et de confort dans la gestion de son traitement thérapeutique.
En outre, les zones tampon de perte d'efficacité et de toxicité
peuvent être d'une part modifiées et d'autre part dynamiques.
En effet, ces zones tampon peuvent être modifiées en fonction
du ressenti du patient, par exemple un patient ressentant des effets
secondaires importants à la suite d'une prise ou acte d'un traitement
thérapeutique peut décider lui-même ou via un professionnel de santé,
d'abaisser la zone tampon de toxicité pour diminuer le ressenti d'effets
secondaires.
Aussi, il est important pour le patient de construire une habitude
de prise ou d'acte d'un traitement thérapeutique, pour ce faire il est
nécessaire
d'avoir des zones tampon dynamiques. Le but étant d'initier le patient avec
une
zone optimale étroite, c'est-à-dire avec une zone tampon de toxicité et une
zone tampon de perte d'efficacité importantes dans le but de contraindre le
patient à créer une habitude de prise ou d'acte de traitement thérapeutique
régulière. Une fois que le patient a crée son habitude de prise ou d'acte d'un
traitement thérapeutique, les zones tampon de toxicité et de perte
d'efficacité
peuvent diminuer, se restreindre et la zone optimale devient plus importante
offrant plus de confort et de flexibilité dans la gestion de son traitement
thérapeutique.
CA 03129642 2021-08-10
WO 2020/165444 41
PCT/EP2020/053979
Dans un autre mode de réalisation, le procédé selon la présente
invention comprend en outre le calcul, par le premier dispositif, d'au moins
un
deuxième intervalle de temps Tmin tampon avant la prochaine prise ou acte
thérapeutique à partir desdites données de positionnement de l'individu l dans
ladite fenêtre cible dudit traitement thérapeutique prédéterminé et/ou d'au
moins un deuxième intervalle de temps Tmax tampon pour la prochaine prise
ou acte thérapeutique à partir desdites données de positionnement de
l'individu h dans ladite fenêtre cible dudit traitement thérapeutique
prédéterminé.
En outre, les zones tampon existent quelque que soit le patient
et comprennent des caractéristiques du médicament. Ces zones tampon
peuvent être adaptées par le patient ou par le professionnel de santé,
modifiées préventivement ou pas, et elles permettent d'agir sur le conseil de
prise ou d'acte du traitement thérapeutique donné par le professionnel de
santé.
Avantageusement, les données de positionnement de l'individu
lidans ladite fenêtre cible indiquent au moins une donnée choisie dans le
groupe constitué :
- du temps de la prise, de l'acte du traitement thérapeutique
précédent(e),
- de la réponse du modèle pharmacométrique du traitement
thérapeutique prédéterminé de l'individu
- du temps, Tmax, avant que la réponse du traitement
thérapeutique prédéterminé tombe en dessous dudit seuil
minimum de la fenêtre cible prédéterminée,
- du temps, Tmin, pour que la réponse du traitement
thérapeutique prédéterminé ne passe pas au dessus dudit
seuil maximum de la fenêtre cible prédéterminée.
Avantageusement, les données de positionnement indiquent en
outre au moins un intervalle de temps Tmax tampon avant que la réponse du
CA 03129642 2021-08-10
WO 2020/165444 42
PCT/EP2020/053979
traitement thérapeutique prédéterminé tombe en dessous d'un seuil tampon
minimum de la fenêtre cible.
Avantageusement les données de positionnement indiquent en
outre au moins un intervalle de temps Tmin tampon pour que la réponse du
traitement thérapeutique prédéterminé ne passe pas au dessus d'un seuil
tampon maximum de la fenêtre cible.
En effet, les données de positionnement qui indiquent :
Le temps de la prise, de l'acte du traitement thérapeutique
précédent(e) permet de fournir au patient une indication sur son historique de
prise, d'acte de traitement thérapeutique, d'autant plus important pour un
patient malade, âgé ou souffrant de troubles de la mémoire. En effet,
l'indication du temps de la prise, de l'acte du traitement thérapeutique
précédent(e), donne une indication sur la ou les dernière(s) prise(s) ou
acte(s)
du traitement thérapeutique.
La réponse du traitement thérapeutique prédéterminé pour
l'individu permet de
fournir au patient une information sur son
positionnement dans la fenêtre cible. Cela lui permet en outre d'anticiper des
aléas, des évènements de la vie de tous les jours d'un patient, par exemple en
cas d'effet secondaire ou de fatigue accrue. Le patient a l'opportunité de
savoir
où l'effet thérapeutique, par exemple la concentration en substance active
d'ans son organisme se situe dans la fenêtre cible et de pouvoir se reposer,
réaliser une activité quelconque sans crainte pour la réussite de son
traitement
thérapeutique.
Le temps, Tnnax, avant que la réponse du traitement
thérapeutique prédéterminé tombe en dessous du seuil minimum, par exemple
du seuil de perte d'efficacité prédéterminé, et le temps, Tmin, pour que la
réponse du traitement thérapeutique prédéterminé ne passe pas au dessus du
seuil maximum, par exemple du seuil de toxicité prédéterminé. Ces deux
informations permettent également au patient, à l'individu I, de manière très
CA 03129642 2021-08-10
WO 2020/165444 43
PCT/EP2020/053979
avantageuse de mieux anticiper les évènements de la vie tels que le sommeil,
les effets secondaires, un déplacement professionnel, une activité extra
professionnelle par exemple.
Avantageusement, les données de positionnement indiquent en
outre au moins un intervalle de temps Tmax tampon avant que l'effet du
traitement thérapeutique prédéterminé tombe en dessous d'un seuil tampon
de perte d'efficacité.
Avantageusement, les données de positionnement indiquent en
outre au moins un intervalle de temps Tmin tampon pour que l'effet du
.. traitement thérapeutique prédéterminé ne passe pas au dessus d'un seuil
tampon de toxicité.
En effet, fournir au patient l'intervalle de temps Tmax tampon
et/ou l'intervalle de temps Tmin tampon permet au patient de mieux
comprendre son traitement thérapeutique, de se rassurer sur le bon dosage et
d'avoir davantage de flexibilité et de confort dans la gestion de son
traitement
thérapeutique.
Cela permet au patient de savoir combien de temps il dispose
avant que sa réponse thérapeutique, par exemple sa concentration en
substance active du traitement thérapeutique dans son organisme tombe en
.. dessous du seuil tampon de perte d'efficacité, dans la zone tampon de perte
d'efficacité mais encore au dessus de la zone critique de perte d'efficacité.
Il est
en effet avantageux de pouvoir informer le patient, via la zone tampon de
perte
d'efficacité, qu'il lui reste par exemple deux heures avant de tomber dans la
zone critique de perte d'efficacité s'il ne réalise pas de prise ou d'acte du
traitement thérapeutique dans ce délai.
Cela permet également au patient de savoir combien de temps
il dispose pour que son effet thérapeutique, par exemple sa concentration en
substance active du traitement thérapeutique ne passe pas au dessus du seuil
tampon de toxicité, dans la zone tampon de toxicité mais encore au dessous de
CA 03129642 2021-08-10
WO 2020/165444 44
PCT/EP2020/053979
la zone critique de toxicité. Il est en effet avantageux de pouvoir informer
le
patient, via la zone tampon de toxicité, qu'il doit attendre par exemple deux
heures pour réaliser une prise ou action thérapeutique pour ne pas passer dans
la zone critique de toxicité en cas de prise ou d'acte du traitement
thérapeutique dans ce délai.
Ceci est particulièrement avantageux pour le patient qui désire
adapter ses prises ou ses actes de traitement thérapeutiques en cas d'imprévu
ou d'évènement de la vie courante. Par exemple, le patient se situe dans la
zone
optimale de la fenêtre cible, avec les données selon la présente invention, le
patient à l'opportunité de réaliser une prise, par exemple la prise d'un demi
comprimé, ou de réaliser l'acte de traitement thérapeutique au moment idéal
pour rester en dessous du seuil critique de toxicité et le patient sait
ensuite le
temps restant avant de tomber dans la zone critique de perte d'efficacité.
Cela
permet de fournir au patient de l'autonomie et du confort pour leur traitement
thérapeutique et leur permet d'anticiper les évènements de la vie courant
comme un déplacement professionnel, une activité quelconque, un temps de
sommeil nécessaire.
En outre, les professionnels de santé ont également
l'opportunité d'adapter éventuellement la posologie du traitement
thérapeutique ou de prendre des décisions thérapeutiques.
Dans un autre mode de réalisation, le procédé selon la présente
invention comprend en outre l'indication d'au moins une donnée, de
préférence par un dispositif d'information, par exemple d'affichage.
En effet, l'indication d'au moins une donnée est
particulièrement avantageux car cela permet de fournir au patient, à
l'individu
14 une information claire, précise et directement accessible et
compréhensible.
En outre, en ayant accès à une information claire, précise et
compréhensible représentative de son positionnement dans la fenêtre cible, le
patient peut alors optimiser sa prise ou acte de traitement thérapeutique par
CA 03129642 2021-08-10
WO 2020/165444 45
PCT/EP2020/053979
exemple pour réduire les effets secondaires d'un traitement lourd. En effet le
patient peut choisir de prendre une demie prise de traitement thérapeutique,
par exemple un demi comprimé, toutes les 4 heures plutôt que de prendre une
prise de traitement thérapeutique complète, par exemple un comprimé entier,
toutes les 8 heures.
Avantageusement, le procédé selon la présente invention
comprend en outre l'émission, par le premier dispositif et/ou par le
dispositif
électronique de suivi et/ou par le dispositif d'affichage, d'un signal
d'alerte, de
préférence visuel ou sonore, en cas de passage, à chaque instant t, présent ou
futur, de l'effet thérapeutique en dessous du seuil de perte d'efficacité, au
dessus du seuil de toxicité, en dessous du seuil tampon de perte d'efficacité,
au
dessus du seuil tampon de toxicité.
En effet, il est particulièrement avantageux selon la présente
invention, de pouvoir fournir au patient un signal d'alerte, à chaque instant
t,
présent ou futur, lorsque l'effet thérapeutique du traitement thérapeutique
passe l'un des seuils mentionnés.
Avantageusement, le procédé selon la présente invention
comprend en outre le calcul, par le premier dispositif, d'un modèle de données
corrigé de l'individu i à partir dudit modèle de données projeté de l'individu
et desdites données indicatives liées à la prise ou à l'acte dudit traitement
thérapeutique prédéterminé.
D'autres formes de réalisation du deuxième procédé selon la
présente invention sont indiquées dans les revendications annexées.
L'invention va maintenant être décrite de façon plus détaillée,
en faisant référence aux figures annexées.
La figure 1 représente un système destiné à assister à la prise ou
à l'acte d'un traitement thérapeutique selon la présente invention.
CA 03129642 2021-08-10
WO 2020/165444 46
PCT/EP2020/053979
La figure 2 représente un modèle pharmacocinétique projeté
théorique pour un individu robot .
La figure 3 représente un modèle pharmacocinétique corrigé
pour un individu prenant en compte l'historique de prise ou d'acte
thérapeutique.
La figure 4 représente un modèle pharmacocinétique
individualisé pour un individu adapté à un évènement type week-end .
Les figures 5A et 5B représentent un modèle pharmacocinétique
individualisé pour un individu adapté à un évènement type forte variabilité
.
Les figures 6A, 6B et 6C représente un modèle
pharmacocinétique individualisé pour un individu comprenant les intervalles de
temps Tmin et Tmin tampon pour la prochaine dose et les intervalles de temps
Tmax et Tmax tampon avant la prochaine dose.
Les figures 7A et 7B représentent un modèle
pharmacodynamique projeté théorique pour un individu robot .
Les figures 8A et 8B représentent un modèle
pharmacodynamique projeté corrigé pour un individu prenant en compte
l'historique de prise ou d'acte thérapeutique.
Les figures 9A à 9E représentent des exemples de jauges de
temps représentatives des données de positionnement de l'individu dans la
fenêtre cible pour la prise ou l'acte d'un traitement thérapeutique.
La figure 1 illustre un système 1 selon la présente invention.
Le système 1 selon la présente invention comprend un premier
dispositif 2, une base de données 3, un dispositif électronique de suivi 4 et
un
.. dispositif d'affichage 5.
CA 03129642 2021-08-10
WO 2020/165444 47
PCT/EP2020/053979
Le premier dispositif 2 comprend de préférence une source
d'alimentation, un processeur, une unité de communication et une mémoire.
Le fonctionnement sera décrit par les figures 2 à 9.
La source d'alimentation est par exemple une batterie ou une
pile et est agencée pour alimenter un circuit électrique reliant les
différents
éléments du premier dispositif 2.
L'unité de communication du premier dispositif 2 est agencée
pour communiquer avec l'unité de communication de la base de données 3,
l'unité de communication du dispositif électronique de suivi 4 et l'unité de
communication du dispositif d'affichage 5 du système 1 selon la présente
invention.
Le processeur du premier dispositif 2 est relié à la source
d'alimentation, à l'unité de communication et à la mémoire. Le processeur est
agencé pour communiquer avec l'unité de communication du premier dispositif
2, pour communiquer avec les unités de communication de la base de données
3, du dispositif électronique de suivi 4 et du dispositif d'affichage 5. Le
processeur du premier dispositif 2 est configuré pour envoyer un signal à la
mémoire du premier dispositif 2, plus particulièrement pour enregistrer les
modèles de données calculés.
La base de données 3 du système 1 selon la présente invention
comprend une unité de communication agencée pour communiquer avec
l'unité de communication du premier dispositif 2. En outre, la base de données
3 comprend un modèle de données du traitement thérapeutique (aussi appelé
en abrégé: donnés du traitement thérapeutique). Le modèle de données du
traitement thérapeutique peut être un modèle pharmacocinétique et/ou
pharmacodynamique pour au moins une indication prédéterminée. Le modèle
pharmacocinétique et/ou pharmacodynamique peut comprendre une série de
modèles pharmacocinétique et/ou pharmacodynamique pour au moins une
indication prédéterminée. Le modèle de données du traitement thérapeutique
peut être une fonction f1(t) du temps donnant en résultat la concentration
CA 03129642 2021-08-10
WO 2020/165444 48
PCT/EP2020/053979
d'une substance, l'assimilation d'une substance dans le corps après une prise
ou après un acte dudit traitement thérapeutique (par exemple un modèle
pharmacocinétique) ou une fonction f1(t) du temps donnant en résultat l'effet
sur ou dans le corps après une prise ou après un acte dudit traitement
thérapeutique (e.g. un modèle pharmacodynamique). Le modèle de données
du traitement thérapeutique peut avoir, en plus du temps, un ou plusieurs
paramètres supplémentaires tel qu'un paramètre de l'individu h (ou des
données spécifiques de l'individu Id tel que le dosage, l'age, le sexe, le
poids, un
biomarqueur, etc. Le modèle de données du traitement thérapeutique peut
comprendre un modèle analytique (avec les paramètres de cette fonction) ou
numérique (avec un série de données dans le temps). Le modèle de données
du traitement thérapeutique peut comprendre une fonction continue avec un
déroulement pharmacocinétique ou pharmacodynamique dans le temps.
Toutefois, il est aussi possible que le modèle de données du traitement
thérapeutique soit simplifié, par example avec une fonction f1(t) binaire qui
définit pour une première période apres la prise ou l'acte dudit traitement
thérapeutique une première valeur indiquant que le traitement est effectif ou
actif et qui définit pour une deuxiéme période après la première période un
deuxième valeur indiquant que le traitement n'est plus effectif ou actif.
Le modèle de données du traitement thérapeutique peut aussi
être une fonction f1(t,
determinée par une série des mesures Mi comme
expliqué en detail ci-dessous. Le modèle de données du traitement
thérapeutique est exprimé par une fonction f1(t). La fonction f1(t) peut être
paramétrisée (paramètres de l'individu tel que le dosage, l'age, le sexe, le
poids, un biomarqueur, etc.) ou ajustée (avec une série de données) sur base
de données de la réponse mesurée sur l'individu ( tel que la concentration, la
mesure de l'effet). Le dosage peut être le dosage réel ou supposé.
De préférence, la base de données 3 comprend une fenêtre
cible (par exemple une fenêtre thérapeutique et/ou un seuil d'efficacité à
atteindre et/ou un seuil de toxicité à ne pas dépasser et/ou une fenêtre
coût/bénéfice et/ou tout autre fenêtre cible, aussi la fenêtre cible peut
varier
CA 03129642 2021-08-10
WO 2020/165444 49
PCT/EP2020/053979
au cours du temps) pour chaque traitement thérapeutique prédéterminé qui
sont stockés, enregistrés dans la base de données 3 du système 1 selon la
présente invention. Eventuellement les paramètres de l'individu h sont
enregistrés dans la base de données 3, éventuellement les données médicales
de l'individu I sont enregistrées dans la base de données 3, plus
particulièrement les données variables de l'individu h sont enregistrées dans
la
base de données 3. La base de données 3 peut être agencée dans le premier
dispositif 2 ou ailleurs, comme par exemple stockée sur un serveur dans un
réseau sur internet.
Par example, la base de données 3 peut comprendre une ou
plusieurs base(s) de données. Lesdites plusieurs bases de données peuvent être
toutes dans le premier dispositif 2 ou dans d'autres dispositifs ailleurs ou
encore distribuées dans dans le premier dispositif 2 et dans plusieurs autres
dispositifs, ailleurs. Par les termes ailleurs , on entend par exemple un
serveur dans un réseau internet. En effet, la base de données 3 peut
comprendre une première base de données qui comprend des données du
traitement thérapeutique et/ou une fenêtre cible pour chaque traitement
thérapeutique prédéterminé.
La base de données 3 peut comprendre une deuxième base de
données qui comprend des données spécifiques de l'individu li telles que : a)
les
paramètres de l'individu h choisis dans le groupe du poids, age, sexe ou un
marqueur génétique ou biologique ; b) les données médicales de l'individu h
incluant l'assimilation et/ou l'élimination de chaque traitement thérapeutique
prédéterminé ; et c) les données variables de l'individu b choisi dans le
groupe
du dosage, de la posologie, du temps de prise théorique de chaque traitement
thérapeutique prédéterminé.
La base de données 3 peut comprendre une troisième base de
données qui comprend à la fois des données du traitement thérapeutique,
telles qu'une série de modèles pharmacocinétique et/ou pharmacodynamique
pour au moins une indication prédéterminée, et une fenêtre cible pour chaque
CA 03129642 2021-08-10
WO 2020/165444 50
PCT/EP2020/053979
traitement thérapeutique prédéterminé et à la fois des données spécifiques de
l'individu 1 telles que: a) les paramètres de l'individu I choisis dans le
groupe
du poids, age, sexe ou un marqueur génétique ou biologique ; b) les données
médicales de l'individu l incluant l'assimilation et/ou l'élimination de
chaque
traitement thérapeutique prédéterminé ; et c) les données variables de
l'individu I choisi dans le groupe du dosage, de la posologie, du temps de
prise
théorique de chaque traitement thérapeutique prédéterminé.
Dans l'exemple décrit ci-dessous, toutes les bases des données
sont stockées dans le premier dispositif 2 sans pour cela limiter la présente
invention. Dans une variante, la ou les base(s) de données pourrai(en)t être
stockées ailleurs.
Le premier dispositif 2 ou la deuxième base de données obtient
des données spécifiques de l'individu h, à savoir les paramètres de l'individu
choisi dans le groupe du poids, de l'âge, du sexe ou d'un marqueur génétique
ou biologique. Ces paramètres de l'individu h sont introduits dans la mémoire
du premier dispositif 2 par exemple par le médecin, par le pharmacien, ou le
patient lui même.
Le processeur du premier dispositif 2 récupère ces paramètres
et calcule un modèle de données de l'individu 1 à partir du modèle
pharmacocinétique et/ou pharmacodynamiques.
Le premier dispositif 2 obtient des données spécifiques de
l'individu, à savoir des données médicales de l'individu h comme l'effet
résultant par exemple l'assimilation et/ou l'élimination de chaque traitement
thérapeutique prédéterminé. Ces données médicales de l'individu l sont
introduites dans la mémoire du premier dispositif 2 par exemple par le
médecin, par le pharmacien, ou le patient lui même.
Le processeur du premier dispositif 2 calcule, à partir des
données médicales de l'individu l et du modèle de données de l'individu 1, un
modèle de données spécifique de l'individu l.
CA 03129642 2021-08-10
WO 2020/165444 51
PCT/EP2020/053979
Le premier dispositif 2 obtient des données variables de
l'individu i, à savoir la posologie, le temps de prise théorique de chaque
traitement thérapeutique prédéterminé. Ces données variables de l'individu
sont introduites dans la mémoire du premier dispositif 2 par exemple par le
médecin, par le pharmacien, ou le patient lui même.
Le processeur du premier dispositif 2 calcule, à partir des
données variables de l'individu l et du modèle de données spécifique de
l'individu l, un modèle de données projeté de l'individu l. L'étape de calcul
d'un
modèle de données projeté de l'individu Il est optionelle.
Le modèle de données du traitement thérapeutique s'applique
en général pour tous les individus ou à un groupe d'individus partageant
certains paramètres, alors que modèle de données projeté de l'individu
s'applique surtout à l'individu li. Lorsque le modèle de données du traitement
thérapeutique ne peut etre individualisé à l'individu I, l'invention envisage
de
poursuivre directement avec le modèle de données du traitement
thérapeutique. Aussi quand une individualisation n'est pas nécessaire,
l'invention envisage de poursuivre directement avec le modèle de données du
traitement thérapeutique.Le modèle de données projeté de l'individu l est de
préférence un fonction f2(t) dans le temps (fonction projetée f2(t)). Le
modèle
de données du traitement thérapeutique pourrait être la série des fonctions
f1(t, P) du temps avec ledit au moins un paramètre du modèle P qui n'est pas
défini. Le modèle de données projeté de l'individu l pourrait être la même
fonction f1(t, P1)=f2(t) définie avec les paramètres Pi de l'individu l. Le
modèle
de données projeté de l'individu h pourrait être aussi une fonction f(t, Mi)
définie par les mesures Mi relatives au corps de l'individu l. Les mesures
pourraient être les mesures de la concentration d'une substance dans le sang
ou un autre fluide corporel, des radiographies, des mesures électriques, etc.
pour adapter le modèle de données du traitement thérapeutique à l'individu I.
La fonction projetée f2(t, Mi) pourrait être déterminée par une série de
mesures M. La fonction projetée f2(t, P, Mi) pourrait être déterminée par une
série de mesures Mi et/ou définie avec les paramètres Pi de l'individu l.
CA 03129642 2021-08-10
WO 2020/165444 52
PCT/EP2020/053979
Dans tous les cas, le procédé utilise le modèle de données du
traitement thérapeutique. Dans un exemple, le procédé selon l'invention
utilise
le modèle de données du traitement thérapeutique pour le calcul décrit ci-
dessous. Dans un exemple préféré, le procédé calcule le modèle de données
projeté de l'individu i à partir du modèle de données du traitement
thérapeutique et utilise, ensuite, le modèle de données projeté de l'individu
l.
Le procédé ci-dessous est décrit en utilisant le modèle de données projeté de
l'individu l pour les calculs, mais il est également possible d'utiliser le
modèle
de données du traitement thérapeutique en remplacant en suite le modèle de
données projeté de l'individu 1.
Le premier dispositif 2 reçoit d'un dispositif électronique de suivi
4, des données indicatives liées à la prise ou à l'acte du traitement
thérapeutique. Les données indicatives incluent notamment l'horodatage de
prise ou d'acte du traitement thérapeutique et optionellement aussi le dosage
de prise ou d'acte du traitement thérapeutique. Le horodatage de prise ou
d'acte du traitement thérapeutique est l'instant auquel la prise ou l'acte a
lieu.
Le dosage, par exemple réel ou supposé pourrait aussi être une intensité (par
example pour un acte). Le processeur du premier dispositif 2 calcule, à partir
des données indicatives liées à la prise ou à l'acte du traitement
thérapeutique
et à partir du modèle de données projeté de l'individu li(ou à partir du
modèle
de données du traitement thérapeutique) un modèle de données corrigé de
l'individu l. Le modèle de données corrigé de l'individu l est un indicateur
de la
prise ou de l'acte du traitement thérapeutique actuel et futur. De préférence,
le modèle de données corrigé de l'individu h est ou comprend un fonction f3(t)
du temps (fonction corrigée). De préférence, la fonction corrigée f3(t) est
actualisée avec chaque horodatage de prise ou d'acte, lequel est reçu du
dispositif de suivi 4. Les horodatages de prise ou d'acte sont définis comme
t1,
t2, tj. Le
dernier horodatage tj représente l'horodatage de la dernière prise
ou du dernier acte (par rapport à l'instant présent). Le prochaine horodatage
tj+1 est le moment (prévu) pour la prochaine prise ou pour le prochain acte
(par
rapport à l'instant présent). De préférence, la fonction corrigée f3(t) et/ou
le
CA 03129642 2021-08-10
WO 2020/165444 53
PCT/EP2020/053979
modèle de données corrigé de l'individu l est determiné d'une manière
iterative avec chaque horodatage de la prise ou de l'acte reçu du dispositif
de
suivi 4. Une manière iterative peut comprendre aussi un manière récursive. De
préférence, chaque horodatage tj de la prise ou de l'acte reçu du dispositif
de
.. suivi 4 correspond a une nouvelle iteration j+1. De préférence, pour chaque
iteration j+1, un nouveau modèle de données corrigé de l'individu I est
déterminé sur la base du modèle de données corrigé de l'individu I de la
dernière itération j au moment/horodatage tj de la dernière prise ou du
dernier
acte (la valeur residuelle de l'itération j+1) et du modèle de données projeté
de
.. l'individu h (ou du modèle de données du traitement thérapeutique). De
préférence, dans chaque iteration j+1, une nouvelle fonction corrigée f3+1(t)
est determinée sur la base de la fonction corrigée f3(tj) de la dernière
itération
j au moment/horodatage tj de la dernière prise ou du dernier acte (la valeur
residuelle de l'itération j+1) et la fonction projetée f2(t) du temps (ou la
fonction f1(t) du temps). De préférence, pour chaque cycle de recursion j+1,
une nouvelle fonction corrigée f3141(t) est determinée sur la base de la
fonction
projetée f2(t, xj+1) du temps basé sur la valeur residuelle xj+1 de
l'itération j+1
(ou de la fonction f1(t, xj+1) du temps basée sur la valeur residuelle xj+1 de
l'itération j+1). De préférence, la fonction projetée f2(t, xj+1) du temps
basé sur
la valeur residuelle xj+1 de l'itération j+1 (ou de la fonction f1(t, xj+1) du
temps
basée sur la addition de la valeur residuelle xj+1 de l'itération j+1) est
determinée sur la base de l'addition de la valeur residuelle de l'itération
j+1 et
la fonction projetée f2(t) du temps (ou la fonction f1(t) du temps).
Les données indicatives liées à la prise ou à l'acte du traitement
thérapeutique peuvent inclure aussi le dosage Dj de la dernière prise ou du
dernier acte j, le processeur du premier dispositif 2 calcule, à partir du
temps
de la prise ou de l'acte du traitement thérapeutique (préférablement du
moment tj de la dernière prise ou du dernier acte), à partir du dosage de la
prise
ou à l'acte du traitement thérapeutique (préférablement le dosage Dj de la
dernière prise ou du dernier acte) et à partir du modèle de données projeté de
l'individu h (ou à partir du modèle de données du traitement thérapeutique) un
CA 03129642 2021-08-10
WO 2020/165444 54
PCT/EP2020/053979
modèle de données corrigé de l'individu l. De préférence, pour chaque
iteration j+1, un nouveau modèle de données corrigé de l'individu l est
determiné sur la base de la valeur résiduelle de l'itération j+1, du modèle de
données projeté de l'individu h (ou du modèle de données du traitement
thérapeutique) et du dosage Dj. De préférence, pour chaque cycle de recursion
j+1, une nouvelle fonction corrigée f341(t) est determinée sur la base de la
valeur résiduelle ducycle de l'itération j+1 et la fonction projetée f2(t, Dj)
du
temps et en fonction du dosage Dj (ou la fonction f1(t, Dj) du temps et en
fonction du dosage Dj).
Entre le temps tj de la dernière prise ou du dernier acte et le
temps tj+1 de la prochaine prise ou du prochain acte le cours/déroulement
actuel
ou futur du traitement thérapeutique dans le temps peut être décrit par le
modèle de données corrigé de l'individu I (de l'itération j+1) et/ou par la
fonction corrigée f31+1.(t).
Le processeur du premier dispositif 2 calcule à chaque instant t,
présent ou futur, à partir du modèle de données corrigé de l'individu h et des
données indicatives liées à la prise ou à l'acte du traitement thérapeutique
prédéterminé, un modèle de données individualisé de l'individu I. Le modèle
de données individualisé de l'individu l est un autre nom pour le modèle de
données corrigé de l'individu l qui décrit le cours/déroulement futur du
traitement thérapeutique et n'est plus distingué de celui-ci ci-dessous. Dans
la
divulgation ci-dessous, le modèle de données individualisé de l'individu I et
le
modèle de données corrigé de l'individu lsont interchangeable.
Le processeur du premier dispositif 2 calcule, de préférence une
information temporelle pour la prochaine prise ou le prochain acte dudit
traitement thérapeutique. Cette information est dans le futur et correspond à
une information valable entre le moment présent et le moment calculé pour la
prochaine prise ou le prochain acte (ce n'est pas simplement un alarme). Cette
information peut comprendre le temps prévu qui peut s'écouler jusqu'àla
prochaine prise ou le prochain acte dudit traitement thérapeutique. Cette
CA 03129642 2021-08-10
WO 2020/165444 55
PCT/EP2020/053979
information peut comprendre le temps maximum prévu pour la prochaine prise
ou le prochain acte dudit traitement thérapeutique, le temps maximum
tampon prévu pour la prochaine prise ou le prochain acte dudit traitement
thérapeutique, le temps minimum prévu pour la prochaine prise ou le prochain
acte dudit traitement thérapeutique, le temps minimum tampon prévu pour la
prochaine prise ou le prochain acte dudit traitement thérapeutique ou une
combination de ces temps. Chaque temps pourrait être exprimé dans un temps
absolu (heure, date, ...) ou un intervalle du temps (de maintenant à la
prochaine
prise par exemple endéans 6 heures).
Le temps minimum est le temps qu'il faut attendre au minimum
avant de prendre ou faire le prochaine traitement therapeutique. Le temps
minimum est plus petit que le temps minimum tampon, le temps maximum
tampon ou le temps maximum. Quand l'individu h reprend ou re-fait le prochain
traitement thérapeutique avant le temps minimum qui est censé s'écoulé, le
traitement thérapeutique peut avoir des effets indesirables, comme un
surdosage et/ou le individu l entre dans la zone indésirable, ou le individu
entre dans une zone de toxicité du traitement thérapeutique.
Le temps minimum tampon est le temps qu'il faut attendre au
minimum avant de prendre ou faire le prochain traitement therapeutique pour
avoir un effet optimisé. Le temps minimum tampon est plus petit que le temps
maximum tampon ou du temps maximum et est plus grand que le temps
minimum. Quand l'individu l reprend ou re-fait le prochain traitement
thérapeutique, entre le temps minimum et le temps minimum tampon, le
traitement thérapeutique n'a pas d'effet indesirable, mais n'est pas non plus
optimal ou bien l'individu l entre dans une zone de toxicité tampon du
traitement thérapeutique.
Le temps maximum est le temps avant lequel il faut prendre ou
faire le prochain traitement thérapeutique au plus tard. Le temps maximum est
plus grand que le temps minimum tampon, le temps maximum tampon ou le
temps minimum. Quand l'individu h reprend ou re-fait le prochain traitement
CA 03129642 2021-08-10
WO 2020/165444 56
PCT/EP2020/053979
thérapeutique après que le temps maximum se soit écoulé, le traitement
thérapeutique perd son effet et/ou le individu l entre dans la zone de perte
d'efficacité.
Le temps maximum tampon est le temps après lequel on peut
déjà prendre ou faire le prochain traitement thérapeutique pour avoir un effet
non discontinu, sans toxicité ou effet secondaire. Le temps maximum tampon
est plus petit que le temps maximum et est plus que le temps minimum ou le
temps minimum tampon. Quand l'individu I reprend ou re-fait le prochain
traitement thérapeutique entre le temps minimum tampon et entre le temps
maximum tampon, le traitement thérapeutique est optimal et/ou le individu
est dans la mine optimale (fenêtre thérapeutique) dans laquelle il n'y a pas
de
perte d'efficacité, ni d'effet secondaire tout en gardant une continuité dans
le
traitement thérapeutique. Quand le individu li reprend ou re-fait le prochaine
traitement thérapeutique entre le temps maximum tampon et le temps
maximum, le traitement thérapeutique commence a perdre son effet (d'une
manière acceptable) et/ou le individu h entre dans la zone tampon de perte
d'efficacité.
L'information temporelle est calculée de préférence avec la
fenêtre cible comme décrit ci-dessous. Toutefois, il est aussi possible de
calculer l'information temporelle d'une autre maniére.
L'information temporelle calculée est de préférence affichée
avec le dispositif d'affichage 5, par exemple comme illustré dans les Fig. 9A
à
9D.
De préférence, le processeur du premier dispositif 2 reçoit une
fenêtre cible dudit traitement thérapeutique et calcule des données de
positionnement de l'individu l dans ladite fenêtre cible dudit traitement
thérapeutique à partir dudit modèle corrigé de l'individu IL
La fenêtre cible comprend de préférence un premier seuil et un
deuxième seuil avec une zone optimale entre le premier seuil et le deuxième
CA 03129642 2021-08-10
WO 2020/165444 57
PCT/EP2020/053979
seuil. Le premier seuil est une seuil de perte d'efficacité, normalement un
seuil
minimum. Le seuil de perte d'efficacité limite la zone de perte d'efficacité.
Le
deuxième seuil est un seuil de toxicité, normalement un seuil maximum. Le
seuil de toxicité limite la zone de toxicité. De préférence, la fenêtre cible
comprend de préférence un premier seuil tampon et un deuxième seuil,
tampon. Le premier seuil tampon est un seuil tampon de perte d'efficacité,
normalement un seuil minimum tampon. Le seuil tampon de perte d'efficacité
limite la zone tampon de perte d'efficacité et la zone optimale. Le deuxième
seuil tampon est un seuil tampon de toxicité, normalement un seuil tampon
maximum. Lac seuil tampon de toxicité limite la zone tampon de toxicité et la
zone optimale. La fenêtre cible et/ou les seuils de celle-ci et le modèle de
données du traitement thérapeutique, le modèle de données projeté de
l'individu et/ou le modèle de données corrigé de l'individu l sont représenté
avec la même parameter (ou variable) physique (par example une
concentration). Normalement, ce paramètre n'est pas un parameter (ou
variable) du temps. Mais, pour certain cas, ça pourrait aussi être le temps
directement.
Le processeur du premier dispositif 2 calcule de préférence une
valeur actuelle dudit modèle corrigé de l'individu l (valeur actuelle) et
calcule
le positionnement des données de positionnement de l'individu l dans ladite
fenêtre cible sur la base de la valeur actuelle.
De préférence, le positionnement des données de
positionnement de l'individu h dans ladite fenêtre cible est traduit dans des
données de positionnement temporel de l'individu li dans une fenêtre cible
temporelle. Les données de positionnement temporel de l'individu l dans une
fenêtre cible temporelle comprennent de préférence un ou ou plusieurs parmi :
un temps minimum, un temps minimum tampon, un temps maximum tampon,
un temps maximum. Le temps minimum est de préférence calculé sur la base
dudit modèle corrigé de l'individu 1 et du deuxième seuil, de préférence sur
la
base du temps auquel la prochaine re-prise ou acte du traitement
thérapeutique fait correspondre le modèle corrigé de l'individu I au deuxième
CA 03129642 2021-08-10
WO 2020/165444 58
PCT/EP2020/053979
seuil. Le temps minimum tampon est de préférence calculé sur la base dudit
modèle corrigé de l'individu l et du deuxième seuil tampon, de préférence sur
la base du temps auquel la prochaine re-prise ou le prochain acte réeffectué
du
traitement thérapeutique fait correspondre le modèle corrigé de l'individu l
au
deuxième seuil tampon. Le temps maximum est de préférence calculé sur la
base dudit modèle corrigé de l'individu I et du premier seuil, de préférence
sur
la base du temps auquel le modèle corrigé de l'individu h correspond au ou est
en intersection avec le premier seuil. Le temps maximum tampon est de
préférence calculé sur la base dudit modèle corrigé de l'individu h et du
premier
seuil, de préférence sur la base du temps auquel le modèle corrigé de
l'individu
correspond au ou entre en intersection avec le premier seuil tampon.
Les données de positionnement temporel de l'individu l dans
une fenêtre cible temporelle sont de préférence affichés avec le dispositif de
affichage 5.
Toutefois, il est aussi possible de ne pas traduire les données de
positionnement de l'individu l dans la fenêtre cible avec les données de
positionnement temporel de l'individu 1 dans la fenêtre cible temporelle. Par
exemple, parce que le modèle corrigé de l'individu I correspond déjà à une
grandeur temporelle. Dans un autre example, pour afficher le positionnement
de l'individu l dans la fenêtre cible exprimé dans lea grandeur physique du
modèle corrigé de l'individu l.
Le dispositif électronique de suivi 4 est agencé pour détecter un
temps d'une prise ou d'un acte d'un traitement thérapeutique de l'individu 1.
De préférence, le dispositif électronique de suivi 4 comprend une unité de
communication agencée pour communiquer avec l'unité de communication du
premier dispositif 2. De préférence, le dispositif électronique de suivi 4
comprend un capteur agencé pour détecter automatiquement la prise ou la
réalisation de l'acte du traitement thérapeutique de l'individu l. Dans un
example, le capteur ou le dispositif électronique de suivi 4 est agencé pour
détecter automatiquement le dosage de la prise ou de l'acte du traitement
CA 03129642 2021-08-10
WO 2020/165444 59
PCT/EP2020/053979
thérapeutique de l'individu l. Pour un médicament, le dispositif électronique
de suivi 4 pourrait être un dispositif qui détecte la sortie de médicament de
son
emballage ou la réalisation d'un acte de traitement thérapeutique comme le
déclenchement d'un appareil de luminothérapie. Mais, le dispositif
électronique de suivi 4 pourrait détecter le temps de la prise ou de l'acte du
traitement thérapeutique de l'individu l d'une manière non-automatique. Par
example le dispositif électronique de suivi 4 pourrait recevoir un input d'un
utilisateur (par example de l'individu) qui marque le moment ou le temps de la
prise ou de l'acte du traitement thérapeutique de l'individu l. Le dispositif
électronique de suivi 4 pourrait être aussi une application sur un téléphone
intelligent, une horloge intelligente, des lunettes intelligentes, une montre
connectée ou une tablette tactile.
De préférence, le dispositif électronique de suivi 4 communique
le temps de la prise ou de l'acte du traitement thérapeutique de l'individu
(parfois appelé en abregé: temps de la prise ou de l'acte) en temps réel au
premier dispositif 2. Dans un cas plus simple, le dispositif 4 pourrait juste
envoyer un signal et le dispositif 2 pourrait comprendre le temps de la prise
ou
de l'acte sur la base du temps de la réception du signal. Dans ce cas, les
données
liées à la prise ou l'acte correspond simplement à ce signal. Mais de
préférence,
le dispositif 4 envoie un signal qui contient des données indicatives du temps
de la prise ou de l'acte au dispositif 2. Au sens de la présente invention,
Temps
réel signifie que les données du temps (horodatage) de la dernière prise ou
du dernier acte sont envoyées au premier dispositif 2, permettant une
prédiction du temps ou moment endéans lequel la prochaine prise ou le
prochain acte du traitement therapeutique doit avoir lieu. Temps réel veut
dire
que les donnés du temps (horodatage) de la dernière prise ou du dernier acte
sont envoyés au premier dispositif 2 avant la prochaine prise ou le prochain
acte du traitement thérapeutique. L'intervalle du traitement est l'intervalle
en
moyenne ou prévu (e.g. du regime de dosage) entre deux prises ou actes
consécutifs du traitement therapeutique. De préférence, temps réel veut dire
que les donnés du temps (horodatage) de la dernière prise ou du dernier acte
CA 03129642 2021-08-10
WO 2020/165444 60
PCT/EP2020/053979
sont envoyées au premier dispositif 2 au maximum endéans correspondant à
50% de l'intervalle du traitement, de préférence au maximum endéans le temps
correspondant à 40% de l'intervalle du traitement, de préférence au maximum
endéans le temps correspondant à 30% de l'intervalle du traitement, de
préférence au maximum le temps du 20% de l'intervalle du traitement, de
preference au maximum le temps du 10% de l'intervalle du traitement, de
preference au maximum endéns le temps correspondant à 5% de l'intervalle du
traitement du horodatage du dernier prise ou de la dernière acte.
De préférence, le dispositif électronique de suivi 4 comprend
une source d'alimentation, un capteur, un processeur, une horloge et une
mémoire.
Lorsque l'individu fi réalise une prise ou un acte d'un traitement
thérapeutique, le capteur du dispositif électronique de suivi 4 est actionné
automatiquement ou pas, par exemple dans le cas d'un bouton poussoir,
l'action de l'individu fi sur le capteur est enregistré comme un évènement de
prise ou d'acte de traitement thérapeutique. Le processeur du dispositif
électronique de suivi 4 est agencé pour traiter un évènement de prise ou
d'acte
de traitement thérapeutique et pour générer un signal comprenant les données
indicatives liées à la prise ou à l'acte du traitement thérapeutique. Ces
données
indicatives comprennent l'horodatage, le dosage et l'historique de prise ou
d'acte thérapeutique. En effet, le processeur du dispositif électronique de
suivi
4 enregistre les données indicatives liées à la prise ou à l'acte du
traitement
thérapeutique dans la mémoire du dispositif électronique de suivi 4 pendant
une durée allant jusqu'à trois années.
Le dispositif d'affichage 5 comprend une unité de
communication agencée pour communiquer avec l'unité de communication du
premier dispositif 2. En outre, le dispositif d'affichage 5 comprend une
source
d'alimentation et un processeur et est configuré pour fournir à l'individu l
une
information claire, simple, précise et directement accessible et
compréhensible.
CA 03129642 2021-08-10
WO 2020/165444 61
PCT/EP2020/053979
Au lieu d'un dispositif d'affichage 5, on pourrait aussi utiliser un
dispositif de sortie pour seulement transmettre les données calculés dans le
premier dispositif 2 à un autre dispositif ou un dispositif audio pour
transmettre
un signal audio avec les données calculés dans le premier dispositif 2. Les
dispositifs audio pourraient être seulement un sortie audio ou un haut-
parleur.
De préférence, le système 1 comprend un dispositif d'information pour
informer un utilisateur des données calculées dans le premier dispositif 2. Le
dispositif d'information peut être les dispositif d'affichage 5, dispositif de
sortie,
dispositif audio ou un autre dispositif d'information.
Dans un mode de réalisation du système 1 selon la présente
invention, le premier dispositif 2, le dispositif électronique de suivi 4 et
le
dispositif d'affichage 5 sont intégrés dans un boitier unique. Cela permet à
l'individu d'avoir le système 1 selon l'invention intégré dans un seul et
unique
boitier.
Dans un autre mode de réalisation du système 1 selon la
présente invention, le premier dispositif 2 et le dispositif d'affichage 5
sont
intégrés dans un boitier, séparé du dispositif électronique de suivi 4.
Dans un autre mode de réalisation du système 1 selon la
présente invention, le premier dispositif 2 est intégré dans un premier
boitier
et le dispositif électronique de suivi 4 et le dispositif d'affichage 5 sont
intégrés
dans un deuxième boitier, séparé du premier boitier.
Dans un autre mode de réalisation du système 1 selon la
présente invention, le premier dispositif 2 est intégré dans un premier
boitier,
le dispositif électronique de suivi 4 est intégré dans un deuxième boitier et
le
dispositif d'affichage 5 est intégré dans un troisième boitier séparés les uns
des
autres.
Dans un autre mode de réalisation du système 1 selon la
présente invention, le premier dispositif 2 et le dispositif électronique de
suivi
4 sont intégrés dans un premier boitier, séparé du dispositif d'affichage 5.
CA 03129642 2021-08-10
WO 2020/165444 62
PCT/EP2020/053979
Dans un autre mode de réalisation du système 1 selon la
présente invention, le dispositif électronique de suivi 4 est intégré dans un
premier boitier, le premier dispositif 2 et le dispositif d'affichage 5 sont
intégrés
dans un deuxième boitier, séparé du premier boitier.
En outre, le premier dispositif 2, la base de données 3, le
dispositif électronique de suivi 4 et le dispositif d'affichages du système 1
selon
la présente invention sont reliés de manière communicante par communication
sans fil ou pour l'échange de données peuvent être connectés physiquement.
La figure 2 illustre un modèle pharmacocinétique projeté
.. théorique pour un individu robot .
Le modèle pharmacocinétique projeté peut comprendre les
données variables de l'individu h choisies dans le groupe du dosage, de la
posologie, du temps de prise théorique de chaque traitement thérapeutique
prédéterminé, il peut aussi comprendre les paramètres du modèle
pharmacométrique pour l'individu l choisis dans le groupe physiologique (par
exemple, du poids, de l'age, du sexe), d'un marqueur génétique, d'un marqueur
biologique. Le modèle pharmacocinétique projeté peut comprendre en outre
les données médicales de l'individu I choisies dans le groupe d'un effet
mesuré
du traitement, d'une concentration mesurée, d'un effet secondaire, d'une
demi-vie estimée, d'une durée d'action estimée, d'un rapport coût efficacité.
En effet, le premier dispositif 2 obtient les données variables de
l'individu, les paramètres du modèle pour l'individu et les données médicales
de l'individu. Ces données/paramètres sont enregistrés dans la mémoire du
premier dispositif 2.
Sur base de ces données/paramètres et de la série de modèle
pharmacométrique, dans le cas présent pharmacocinétique, le premier
dispositif 2 calcule le modèle pharmacocinétique projeté illustré qui consiste
en
une ou plusieurs équations représentant la concentration en substance active
CA 03129642 2021-08-10
WO 2020/165444 63
PCT/EP2020/053979
pour l'individu, en fonction du temps, d'un traitment thérapeutique donné
pour une indication prédéterminée.
Ce modèle pharmacocinétique projeté est théorique car
représentatif d'un individu parfait, un individu robot>) qui réalise une
prise
ou un acte thérapeutique de manière systématique tous les jours à la même
heure.
La concentration en substance active pour l'individu augmente
et diminue de manière identifique en fonction des prises dans la fenêtre
cible,
par exemple une fenêtre thérapeutique.
La figure 3 illustre un modèle pharmacocinétique corrigé de
l'individu l prenant en compte l'historique de prise ou d'acte thérapeutique.
Le premier dispositif 2 reçoit d'un dispositif électronique de suivi
4, des données indicatives liées à la prise ou à l'acte du traitement
thérapeutique prédéterminé. Les données indicatives incluent notamment
l'horodatage et optionellement le dosage de prise ou d'acte du traitement
thérapeutique.
Le processeur du dispositif électronique de suivi 4 enregistre les
données indicatives liées à la prise ou à l'acte du traitement thérapeutique
dans
la mémoire du dispositif électronique de suivi 4.
En fonctionnement, le processeur du premier dispositif 2 envoie
une requête à l'unité de communication du premier dispositif 2. La requête est
envoyé par l'unité de communication du premier dispositif 2 à l'unité de
communication du dispositif électronique de suivi 4. La requête reçue par
l'unité de communication du dispositif électronique de suivi 4 est analysée
par
le processeur du dispositif électronique de suivi 4 qui extrait les données
indicatives de la mémoire du dispositif électronique de suivi, plus
particulièrement les données indicatives extraites comprennent l'horodatage,
le dosage et l'historique de prise ou d'acte du traitement thérapeutique. Le
processeur du dispositif électronique de suivi 4 envoie les données
indicatives
CA 03129642 2021-08-10
WO 2020/165444 64
PCT/EP2020/053979
extraites à l'unité de communication du dispositif électronique de suivi 4.
Les
données indicatives sont envoyées de l'unité de communication du dispositif
électronique de suivi 4 à l'unité de communication du premier dispositif 2. Le
processeur du premier dispositif 2 enregistre les données indicatives reçues
par
l'unité de communication du premier dispositif 2 dans la mémoire du premier
dispositif 2.
Le processeur du premier dispositif 2 calcule, à partir des
données indicatives liées à la prise ou à l'acte du traitement thérapeutique
prédéterminé et du modèle de données projeté de l'individu l (figure 2), un
modèle de données corrigé de l'individu l.
Le modèle de données corrigé de l'individu II obtenu par le
procédé selon la présente invention représente la concentration en substance
active pour de l'individu h corrigée en fonction du temps et comprend la
fenêtre
cible, par exemple la fenêtre thérapeutique pour le traitement thérapeutique
prédéterminé de l'individu l. Le modèle de données corrigé prend en compte
les données indicatives liées à la prise ou à l'acte du traitement
thérapeutique
et est particulièrement avantageux car il permet de fournir un modèle de
données qui tient compte des écarts par rapport aux modèles
pharmacocinétiques classiques et qui tient compte des écarts par rapport au
traitement prescrit.
En effet, le modèle pharmacocinétique corrigé de l'individu
selon la présente invention permet d'expliquer que, lorsque l'on observe un
pic
de la réponse dans le modèle, par exemple un pic de la concentration en
substance active d'un traitement thérapeutique, s'il coincide avec un
évènement de prise ou d'acte du traitement thérapeutique, il ne sera pas
attribué à une assimilation rapide mais sera expliqué comme résultant de la
prise ou de l'acte du traitement. Un creux de la réponse thérapeutique dans le
modèle, par exemple un creux de la concentration, s'il coincide avec une
absence d'évènement de prise ou d'acte du traitement thérapeutique sur une
CA 03129642 2021-08-10
WO 2020/165444 65
PCT/EP2020/053979
période de temps, sera expliqué par l'oubli de la prise ou de l'acte du
traitement
thérapeutique et non pas par une élimination rapide.
Par conséquent, parce que le modèle de données corrigé de
l'individu prend en compte les données indicatives liées à la prise du
traitement
thérapeutique, il permet d'expliquer les écarts et non pas d'attribuer des
variations de l'effet à de fausses causes.
La figure 4 illustre un modèle pharmacocinétique individualisé
pour un individu adapté à un évènement type week-end .
Le modèle pharmacocinétique individualisé de l'individu
obtenu par le procédé selon la présente invention représente la concentration
en substance active pour l'individu l en fonction du temps et comprend la
fenêtre cible, par exemple la fenêtre thérapeutique pour le traitement
thérapeutique prédéterminé de l'individu h. Le modèle pharmacocinétique
individualisé prend en compte les données indicatives liées à la prise ou à
l'acte
du traitement thérapeutique.
Le modèle pharmacocinétique individualisé illustré comprend en
outre un premier seuil minimum correspondant à un seuil de perte d'efficacité,
plus particulièrement un seuil minimum critique de perte d'efficacité et un
premier seuil maximum correspondant à un seuil de toxicité, plus
particulièrement un seuil maximum critique de toxicité.
La modèle pharmacocinétique individualisé illustré comprend en
outre un deuxième seuil minimum correspondant à un seuil tampon de perte
d'efficacité et un deuxième seuil maximum correspondant à un seuil tampon
de toxicité.
En outre, le modèle pharmacocinétique individualisé permet de
positionner à chaque instant t, présent ou futur, la concentration en
substance
active pour l'individu dans la fenêtre cible, par exemple la fenêtre
thérapeutique permettant à l'individu à chaque instant t, présent ou futur,
CA 03129642 2021-08-10
WO 2020/165444 66
PCT/EP2020/053979
d'identifier s'il est proche du premier seuil minimum, du premier seuil
maximum, du deuxième seuil minimum, du deuxième seuil maximum.
La fenêtre cible, qui peut varier au cours du temps, notamment
en cas de détection d'un évènement et avec la nécessité pour le patient ou les
personnels de comprendre les causes de ce comportement et d'éduquer le
patient à une bonne adhésion thérapeutique.
En effet, on observe que la concentration en substance active
passe en dessous du deuxième seuil minium correspondant à un seuil tampon
de perte d'efficacité. Ceci est expliqué dans le cas présent par le fait qu'il
s'agit
des prises ayant lieu pendant le week end et que le patient s'accordant un
évènement tel qu'une grasse matinée, n'a pas pris son traitement
thérapeutique à 8h du matin comme tous les jours de la semaine mais à 11h.
La fenêtre cible étant dynamique et ajustable, pour anticiper cet
évènement de type week-end , le patient ou les personnels de santé ont la
possibilité d'ajuster les seuils tampon pour contraindre et éduquer le patient
à
une meilleur adhésion thérapeutique, dans le but de garder la concentration
en substance active dans l'organisme du patient entre les seuils tampon de la
fenêtre cible.
Les figures 5A et 5B illustrent un modèle pharmacocinétique
individualisé pour un individu adapté à un évènement type forte variabilité
.
Le modèle pharmacocinétique individualisé de l'individu
= représente la concentration en substance active pour l'individu, en
fonction du
temps et comprend la fenêtre cible, elle-même comprenant les seuils tels que
mentionnés à la figure 4.
Lorsque le patient ou les personnels de santé détectent une
forte variabilité de la concentration en substance active pour l'individu, ce
qui
entrain plusieurs passages au dessus du seuil tampon de toxicité voire au
dessus du seuil critique de toxicité et un passage au dessous du seuil tampon
de perte d'efficacité. La forte variabilité est expliquée, compte tenu de
CA 03129642 2021-08-10
WO 2020/165444 67
PCT/EP2020/053979
l'obtention des données indicatives de la prise ou de l'acte thérapeutique
d'un
dispositif électronique de suivi 4, à un défaut d'adhésion thérapeutique, plus
particulièrement à des prises ou actes thérapeutiques irrégulières.
En cas de détection d'une forte variabilité dûe à l'adhésion
thérapeutique, le but est pour le patient ou les personnels de santé, de créer
une fenêtre cible, avec des seuils tampon plus étroits afin de contraindre le
patient à prendre sa prise ou réaliser son acte thérapeutique avec une
meilleure adhésion (Fig. 5A).
Lorsque le patient ou les personnels de santé observent une
meilleure régularité dans l'adhésion thérapeutique en réaction à la forte
variabilité, cela est représentatif du fait que le patient a été correctement
prise
en charge dans l'éducation à un bon comportement d'adhésion thérapeutique.
Dans ce cas, il est possible d'adapter une nouvelle fois la fenêtre cible en
réaugmentant l'espace entre les seuils tampon (Fig. 5B) dans le but de donner
davantage de flexibilité et de confort au patient qui est désormais conscient
et
éduqué à l'importance d'une bonne adhésion thérapeutique.
Les figures 6A, 6B et 6C illustrent un modèle pharmacocinétique
individualisé pour un individu comprenant les intervalles de temps Tmin et
Tmin tampon pour la prochaine dose et les intervalles de temps Tmax et Tmax
tampon avant la prochaine dose.
Le processeur du premier dispositif 2 calcule, de préférence à
chaque instant t, présent ou futur, à partir du modèle de données
individualisé
de l'individu l et des données indicatives de la prise ou de l'acte du
traitement
thérapeutique, des données de positionnement de l'individu h dans la fenêtre
cible l'individu l du traitement thérapeutique prédéterminé. La fenêtre cible
comprenant en outre un seuil maximum de perte d'efficacité prédéterminé et
un seuil de toxicité prédéterminé.
En effet, partant du modèle de données individualisé de
l'individu l et des données indicatives, les données de positionnement de
CA 03129642 2021-08-10
WO 2020/165444 68
PCT/EP2020/053979
l'individu 1 sont individualisées et prennent en considération les écarts dans
l'adhésion thérapeutique.
En pratique, sur base de la courbe de concentration connue sur
base du modèle de données individualisé de l'individu h tenant compte des
données indicatives de la prise ou de l'acte du traitement thérapeutique, il
est
possible de déterminer à chaque instant t, présent ou futur, quel sera le
profil
de la courbe de concentration dans le temps suite à une prise ou à un acte
thérapeutique à un instant t.
Le Tmin (Fig. 6A) est calculé comme étant le temps entre le
moment présent et le moment où une prise ou un acte d'un traitement
thérapeutique donnera lieu à un pic de concentration à la limite de la zone de
toxicité. En outre, si quelque soit le moment de prise ou d'acte d'un
traitement
thérapeutique, le pic de concentration reste en dessous de la zone de toxicité
alors Tmin est égal à 0. Tout comme le calcul de Tmin est déterminé sur base
du temps d'ici la prochaine prise ou acte d'un traitement thérapeutique, il
est
également possible de calculer le Tmin pour une dose différente, par exemple
une demie prise d'un traitement thérapeutique.
Le Tmin tampon (Fig. 6B) est calculé comme étant le temps entre
le moment présent et le moment où une prise ou un acte d'un traitement
thérapeutique donnera lieu à un pic de concentration à la limite de la zone
tampon de toxicité. En outre, si quelque soit le moment de prise ou d'acte
d'un
traitement thérapeutique, le pic de concentration reste en dessous de la zone
tampon de toxicité alors Tmin tampon est égal à 0.
Il est particulièrement avantageux pour le patient et/ou pour les
professionnels de santé d'avoir accès à la fois à l'intervalle de temps Tmin
et à
l'intervalle de temps Tmin tampon car cela permet de pouvoir anticiper un
évènement quelconque, par exemple le patient sachant qu'il doit prévoir un
déplacementide plusieurs heures peut prendre une prise ou un acte d'un
thérapeutique sachant qu'il va dépasser le seuil tampon de toxicité mais
sachant également qu'il ne dépassera pas le seuil critique de toxicité.
CA 03129642 2021-08-10
WO 2020/165444 69
PCT/EP2020/053979
Le Tmax (Fig. 6C) est calculé comme étant le temps entre le
moment présent et le moment où la concentration passera sous la limite de la
zone de perte d'efficacité si aucune prise ou un acte d'un traitement
thérapeutique n'est effectué dans cet intervalle de temps Tmax.
Le Tmax tampon (Fig. 6C) est calculé comme étant le temps entre
le moment présent et le moment où la concentration passera sous la limite de
la zone tampon de perte d'efficacité si aucune prise ou acte d'un traitement
thérapeutique n'est effectué dans cet intervalle de temps Tmax tampon.
Il est particulièrement avantageux pour le patient et/ou pour les
professionnels de santé d'avoir accès à la fois à l'intervalle de temps Tmax
et à
l'intervalle de temps Tmax tampon car cela permet de pouvoir anticiper un
évènement, par exemple le patient sachant qu'il doit prendre sa prise ou son
acte d'un traitement thérapeutique dans 4 heures (Tmax tampon) mais que s'il
est dans l'incapacité de pouvoir réaliser cette prise ou cet acte dans les 4
heures, il possède encore par exemple 2 heures supplémentaires avant de
passer dans la zone critique de perte d'efficacité.
En outre, le Tmin/Tmax tampon peuvent être ajusté par le
patient ou le professionel de santé en fonction d'un ressenti tel qu'un effet
secondaire ressenti de manière trop forte. De plus, pour mieux coller à une
habitude définie, qui peut notamment être connue au travers de l'historique
de prise, les zones tampons peuvent être adaptées/modifiées. En effet, le
Tmin/Tmax tampon peuvent être recalculés dynamiquement en fonction de
l'historique de prises afin de mieux correspondre à un comportement réel (par
exemple une adaptation pour un comportement particlier présent uniquement
le weekend tel que grassee matinée).
Aussi, il est important pour le patient de construire une habitude
de prise ou d'acte d'un traitement thérapeutique, pour ce faire il est
nécessaire
d'avoir des zones tampon dynamiques. Le but étant d'initier le patient avec
une
zone optimale étroite, c'est-à-dire avec une zone tampon de toxicité et une
zone tampon de perte d'efficacité importantes dans le but de contraindre le
CA 03129642 2021-08-10
WO 2020/165444 70
PCT/EP2020/053979
patient à créer une habitude de prise ou d'acte de traitement thérapeutique
régulière. Une fois que le patient a crée son habitude de prise ou d'acte d'un
traitement thérapeutique, les zones tampon de toxicité et de perte
d'efficacité
peuvent diminuer, se restreindre et la zone optimale devient plus importante
offrant plus de confort et de flexibilité dans la gestion de son traitement
thérapeutique.
Cela permet avantageusement de conscientiser le patient à
l'important d'une régularité dans son traitement thérapeutique, c'est-à-dire
avec une adhésion thérapeutique optimale afin de rester dans la zone optimale
de l'effet thérapeutique dans la fenêtre cible. Cela est rendu possible par
les
données de positionnement du patient, de l'individu l et ce, à chaque instant
t.
Il est important pour le patient de pouvoir mettre une relation
entre son régime thérapeutique, c'est-à-dire son traitement thérapeutique,
l'efficacité du traitement thérapeutique et les données d'adhésion
thérapeutique. Les données de positionnement de l'individu l permettent
d'une part au patient, à l'individu h, d'adapter son régime thérapeutique et
au
personnel de santé d'individualiser la thérapie d'un patient, d'un individu
présentant une bonne adhésion thérapeutique afin d'éviter de fournir un
traitement thérapeutique surdosé censé anticiper les écarts.
Le seuil de perte d'efficacité et le seuil de toxicité de la fenêtre
cible peuvent être ajustés en fonction de la bonne ou mauvaise adhésion
thérapeutique de l'individu.
En outre, les données de positionnement de l'individu h dans la
fenêtre cible indiquent au moins une donnée choisie dans le groupe :
- du temps de la prise, de l'acte du traitement thérapeutique
précédent(e),
- de la réponse du modèle pharmacométrique du traitement
thérapeutique prédéterminé pour l'individu
CA 03129642 2021-08-10
WO 2020/165444 71
PCT/EP2020/053979
- du temps, Tmax, avant que la réponse du traitement
thérapeutique prédéterminé tombe en dessous dudit seuil
minimum de la fenêtre cible prédéterminée,
- du temps, Tmin, pour que la réponse du traitement
thérapeutique prédéterminé ne passe pas au dessus dudit
seuil maximum de la fenêtre cible prédéterminée.
Les figures 7A et 7B illustrent un modèle pharmacodynamique
projeté théorique pour un individu robot .
Le modèle pharmacodynamique projeté peut comprendre les
données variables de l'individu h choisies dans le groupe du dosage, de la
posologie, du temps de prise théorique de chaque traitement thérapeutique
prédéterminé, il peut aussi comprendre les paramètres du modèle
pharmacométrique pour l'individu I1 choisis dans le groupe du poids, de l'age,
du sexe, d'un marqueur génétique, d'un marqueur biologique. Le modèle
pharmacodynamique projeté peut comprendre en outre les données médicales
de l'individu l choisies dans le groupe d'un effet mesuré du traitement, d'une
concentration mesurée, d'un effet secondaire, d'une demi-vie estimée, d'une
durée d'action estimée.
En effet, le premier dispositif 2 obtient les données variables de
l'individu, les paramètres du modèle pour l'individu et les données médicales
de l'individu. Ces données/paramètres sont enregistrés dans la mémoire du
premier dispositif 2.
Sur base de ces données/paramètres et de la série de modèle
pharmacométrique, dans le cas présent pharmacodynamique, le premier
dispositif 2 calcule le modèle pharmacodynamique projeté illustré qui consiste
en une ou plusieurs équations représentant l'effet du traitement
thérapeutique, en fonction du temps, d'un traitement thérapeutique donné
pour une indication prédéterminée. L'effet du traitement peut varier au cours
du temps en fonction du mode d'action du traitement.
CA 03129642 2021-08-10
WO 2020/165444 72
PCT/EP2020/053979
Le modèle pharmacodynamique projeté illustré (Fig. 7A)
comprend en outre un premier seuil minimum correspondant à un seuil de
perte d'efficacité, plus particulièrement un seuil minimum critique de perte
d'efficacité et un deuxième seuil minimum correspondant à un seuil tampon de
perte d'efficacité.
Le modèle pharmacodynamique projeté illustré (Fig. 7B)
comprend en outre un premier seuil maximum correspondant à un seuil de
toxicité, plus particulièrement un seuil maximum critique de toxicité et un
deuxième seuil maximum correspondant à un seuil tampon de toxicité.
La fréquence des actes thérapeutiques vise à maintenir l'effet du
traitement thérapeutique dans la fenêtre d'efficacité du traitement comme par
exemple entre une sous-exposition à l'acte qui rend le traitement inefficace
(seuil de perte d'efficacité) et une surexposition à l'acte qui rend le
traitement
potentiellement dangereux (seuil de toxicité).
Il est important pour le patient de pouvoir visualiser l'effet du
traitement thérapeutique. En effet, pour chaque prise ou acte d'un traitement
thérapeutique il y a un effet associé qui est directement identifiable pour le
patient, par exemple un ressenti de douleur, ou qui n'est pas directement
identifiable, par exemple la concentration en substance active du traitement
thérapeutique.
L'effet associé à chaque prise ou acte d'un traitement
thérapeutique est mesurable et/ou identifiable par une concentration
(plasmatique, salivaire, urinaire, tissulaire, sanguine, capilaire...), un
biomarqueur, un effet thérapeutique mesurable ou étaloné comme par
exemple l'étalonnage d'un seuil de douleur.
Ce modèle pharmacodynamique projeté est théorique car
représentatif d'un individu parfait, un individu robot qui réalise une
prise
ou un acte thérapeutique de manière systématique tous les jours à la même
heure. L'effet du traitement pour l'individu augmente et diminue de manière
CA 03129642 2021-08-10
WO 2020/165444 73
PCT/EP2020/053979
identifique en fonction des prises dans la fenêtre cible, par exemple une
fenêtre
thérapeutique.
Les figures 8A et 8I3 illustrent un modèle pharmacodynamique
projeté corrigé pour un individu prenant en compte l'historique de prise ou
d'acte thérapeutique.
Le premier dispositif 2 reçoit d'un dispositif électronique de suivi
4, des données indicatives liées à la prise ou à l'acte du traitement
thérapeutique prédéterminé. Les données indicatives incluent notamment
l'horodatage, le dosage et l'historique de prise ou d'acte du traitement
thérapeutique.
Le processeur du dispositif électronique de suivi 4 enregistre les
données indicatives liées à la prise ou à l'acte du traitement thérapeutique
dans
la mémoire du dispositif électronique de suivi 4.
En fonctionnement, le processeur du premier dispositif 2 envoie
une requête à l'unité de communication du premier dispositif 2. La requête est
envoyé par l'unité de communication du premier dispositif 2 à l'unité de
communication du dispositif électronique de suivi 4. La requête reçue par
l'unité de communication du dispositif électronique de suivi 4 est analysée
par
le processeur du dispositif électronique de suivi 4 qui extrait les données
indicatives de la mémoire du dispositif électronique de suivi, plus
particulièrement les données indicatives extraites comprennent l'horodatage,
le dosage et l'historique de prise ou d'acte du traitement thérapeutique. Le
processeur du dispositif électronique de suivi 4 envoie les données
indicatives
extraites à l'unité de communication du dispositif électronique de suivi 4.
Les
données indicatives sont envoyées de l'unité de communication du dispositif
électronique de suivi 4 à l'unité de communication du premier dispositif 2. Le
processeur du premier dispositif 2 enregistre les données indicatives reçues
par
l'unité de communication du premier dispositif 2 dans la mémoire du premier
dispositif 2.
CA 03129642 2021-08-10
WO 2020/165444 74
PCT/EP2020/053979
Le processeur du premier dispositif 2 calcule, à partir des
données indicatives liées à la prise ou à l'acte du traitement thérapeutique
prédéterminé et du modèle de données, pharmacodynamique projeté de
l'individu I (Fig. 7A et 7B), un modèle de données, pharmacodynamique corrigé
de l'individu h (Fig. 8A et 8B).
Le modèle pharmacodynamique corrigé de l'individu l obtenu
par le procédé selon la présente invention représente l'effet du traitement
thérapeutique corrigée en fonction du temps et comprend la fenêtre cible.
Le modèle pharmacodynamique corrigé prenant en compte
l'historique de prise ou d'acte thérapeutique illustré (Fig. 8A) comprend en
outre un premier seuil minimum correspondant à un seuil de perte d'efficacité,
plus particulièrement un seuil minimum critique de perte d'efficacité et un
deuxième seuil minimum correspondant à un seuil tampon de perte
d'efficacité.
Le modèle pharmacodynamique corrigé prenant en compte
l'historique de prise ou d'acte thérapeutique illustré (Fig. 8B) comprend en
outre un premier seuil maximum correspondant à un seuil de toxicité, plus
particulièrement un seuil maximum critique de toxicité et un deuxième seuil
maximum correspondant à un seuil tampon de toxicité.
La fréquence des actes thérapeutiques vise à maintenir l'effet du
traitement thérapeutique dans la fenêtre d'efficacité du traitement comme par
exemple entre une sous-exposition à l'acte qui rend le traitement inefficace
(seuil de perte d'efficacité) et une surexposition à l'acte qui rend le
traitement
potentiellement dangereux (seuil de toxicité).
Le modèle pharmacodynamique corrigé prend en compte les
données indicatives liées à la prise ou à l'acte du traitement thérapeutique
et
est particulièrement avantageux car il permet de fournir un modèle
pharmacodynamique qui tient compte des écarts par rapport aux modèles
classiques et qui tient compte des écarts par rapport au traitement prescrit.
CA 03129642 2021-08-10
WO 2020/165444 75
PCT/EP2020/053979
En effet, le modèle pharmacodynamique corrigé de l'individu
selon la présente invention permet d'expliquer que, lorsque l'on observe un
pic
de la réponse dans le modèle, par exemple un pic de l'effet du traitement
thérapeutique, s'il coincide avec un évènement de prise ou d'acte du
traitement thérapeutique sera expliqué comme résultant de la prise ou de
l'acte du traitement. Un creux de la réponse thérapeutique dans le modèle, par
exemple un creux de l'effet du traitement thérapeutique, s'il coincide avec
une
absence d'évènement de prise ou d'acte du traitement thérapeutique sur une
période de temps, sera expliqué par l'oubli de la prise ou de l'acte du
traitement
thérapeutique.
Par conséquent, parce que le modèle de données corrigé de
l'individu prend en compte les données indicatives liées à la prise du
traitement
thérapeutique, il permet d'expliquer les écarts et non pas d'attribuer des
variations de l'effet à de fausses causes.
Les figures 9A, 9B, 9C, 90 et 9E illustrent un exemple de jauges
de temps représentatives des données de positionnement de l'individu dans la
fenêtre cible pour la prise ou action thérapeutique dans lesquelles chaque
portion est représentative d'une heure.
La figure 9A représente une jauge de temps représentative d'un
.. individu venant de prendre une prise ou action thérapeutique.
La jauge de temps est remplie à 100%, toutes les portions sont
pleines, l'individu se situe dans la zone tampon supérieure entre le seuil
maximum et le seuil maximum tampon et ne doit pas reprendre de prise ou
action thérapeutique sous peine de passer au dessus du seuil maximum
.. correspondant au seuil critique de toxicité.
La figure 9B représente une jaune de temps représentative d'un
individu deux heures après la dernière prise ou action thérapeutique.
La jauge est remplie à 77%, les deux portions entre le seuil
maximum et le seuil maximum tampon sont vides, l'individu se situe dans la
CA 03129642 2021-08-10
WO 2020/165444 76
PCT/EP2020/053979
zone optimale en dessous du seuil maximum tampon correspondant au seuil
tampon de toxicité. L'individu ne doit pas reprendre de prise ou action
thérapeutique sous peine de passer au dessus du seuil maximum
correspondant au seuil critique de toxicité.
Cependant, l'individu peut reprendre un quart de prise ou action
thérapeutique, par exemple un quart d'un comprimé, sans passer dans la zone
de toxicité, par exemple pour anticiper un évènement de la vie de tous les
jours.
La figure 9C représente une jauge de temps représentative d'un
individu quatre heures après la dernière prise ou action thérapeutique.
La jauge est remplie à 55%, les deux portions entre le seuil
maximum et le seuil maximum tampon sont vides, deux portions de la zone
optimale sont vides, l'individu se situe dans la zone optimale, sous le seuil
pour
une prise complète. L'individu peut reprendre une prise ou action
thérapeutique sans risque de passer au dessus du seuil maximum
correspondant au seuil critique de toxicité.
La figure 9D représente une jauge de temps représentative d'un
individu six heures après la dernière prise ou action thérapeutique.
La jauge est remplie à 33%, les deux portions entre le seuil
maximum et le seuil maximum tampon sont vides, les quatres portions de la
zone optimale sont vides, l'individu se situe dans la zone tampon inférieure
entre le seuil minimum tampon et le seuil minimum. Les trois portions de la
zone tampon de perte d'efficacité, entre le seuil minimum tampon et le seuil
minimum sont pleines, le patient sait qu'il lui reste trois heures
d'efficacité du
traitement thérapeutique. L'individu doit reprendre une prise ou action
thérapeutique dans les trois heures à venir sous peine de passer en dessous du
seuil minimum correspondant au seuil critique de perte d'efficacité.
La figure 9E représente une jauge de temps représentative d'un
individu neuf heures après la dernière prise ou action thérapeutique.
CA 03129642 2021-08-10
WO 2020/165444 77
PCT/EP2020/053979
La jauge est remplie à 0%, les deux portions entre le seuil
maximum et le seuil maximum tampon, les quatre portions de la zone optimale
et les trois portions entre le seuil minimum tampon et le seuil minimum sont
vides. Le traitement thérapeutique n'a plus d'effet thérapeutique chez
l'individu. Il doit absolument reprendre une prise ou action thérapeutique.
Il est bien entendu que la présente invention n'est en aucune
façon limitée aux formes de réalisations décrites ci-dessus et que bien des
modifications peuvent y être apportées sans sortir du cadre des revendications
annexées.