Note: Descriptions are shown in the official language in which they were submitted.
WO 2023/021201
PCT/EP2022/073240
DESCRIPTION
TITRE : Méthode de détermination d'un indicateur représentatif
d'une altération du cerveau d'un individu causée par une
pathologie démyélinisante ou apparentée, affectant l'état de la
myéline du cerveau
DOMAINE TECHNIQUE DE L'INVENTION
[0001] Le domaine technique de l'invention est celui de l'imagerie
par résonnance
magnétique (IRM) et plus particulièrement de l'IRM du tenseur de diffusion
pour
évaluer le degré d'altération du cerveau d'un individu atteint d'une
pathologie
démyélinisante ou apparentée
[0002] La présente invention concerne notamment une méthode de
détermination
d'un indicateur représentatif d'une altération du cerveau d'un individu causée
par une
pathologie démyélinisante. L'invention concerne également un système pour
mettre
en uvre cette méthode de détermination.
ARRIERE-PLAN TECHNOLOGIQUE DE L'INVENTION
[0003] Les pathologies démyélinisantes regroupent entre autres la
sclérose en
plaque (SEP), les leucodystrophies et l'adrénomyéloneuropathie (AMN). On parle
pour
ce genre de pathologie de démyélinisation primaire. La plus fréquente, la SEP,
touche
zo presque 3 millions de personnes dans le monde.
[0004] La sclérose en plaque (SEP) est une maladie auto-immune
inflammatoire
qui provoque, par une attaque de la gaine de myéline par le système
immunitaire, une
dégénérescence axonale. Bien que les causes de cette maladie soient encore
incertaines, certains facteurs, comme l'association de plusieurs variants
génétiques,
l'environnement ou une infection, semblent être des facteurs à risque quant au
développement de cette maladie. Les symptômes de la SEP sont très variés :
troubles
moteurs, sensitifs, visuels, de l'équilibre, urinaires, sexuels ou cognitifs,
et sont tous la
conséquence directe de la dénnyélinisation du système nerveux.
[0005] L'adrénonnyéloneuropathie (AMN) est le trouble peroxysomal
le plus
courant. Elle est causée par des variants pathogènes ABCD1 sur le chromosome
X,
qui entraînent une altération de la bêta-oxydation peroxysomale et une
accumulation
d'acides gras à très longue chaîne dans le plasma ainsi que dans les tissus,
notamment dans la matière blanche du cerveau, la moelle épinière et le cortex
1
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
surrénalien, provoquant la démyélinisation du système nerveux. L'AMN se
traduit par
des phénotypes cliniquement hétérogènes, dont le plus fréquent est une
myéloneuropathie invalidante caractérisée par une paraparésie spastique
progressive
avec troubles vésicaux, ataxie sensorielle et douleurs dans les jambes.
[0006] Il existe d'autres pathologies qui ont pour conséquence la
démyélinisation
des axones. C'est par exemple le cas de la sclérose latérale amyotrophique
(SLA).
Pour ces pathologies, on parle de démyélinisation secondaire.
[0007] La sclérose latérale amyotrophique (SLA) est une maladie
dégénérative qui
atteint les motoneurones et dont les causes et mécanismes sont encore mal
connus.
Les premiers symptômes de cette maladie sont majoritairement des troubles
moteurs
qui touchent principalement, en fonction des zones du cerveau primo-atteintes,
les
bras, les mains, les jambes ou la bouche, avec des difficultés à articuler ou
à déglutir.
Avec la progression de la maladie, les troubles s'étendent aux muscles du
reste du
corps, entrainant une fonte musculaire et des troubles de la coordination,
jusqu'à
l'atteinte des muscles respiratoires. Il a été également relevé, pour
certaines formes
de SLA, des troubles d'ordre cognitif. Comme pour la SEP et l'AMN, la SLA a
pour
conséquence la démyélinisation des axones, associée à la mort des neurones
moteurs.
[0008] Ces types de maladies avec démyélinisation primaire ou
secondaire,
zo souvent très invalidantes, touchent de nombreuses personnes et il existe
un besoin
pressant de traitements plus efficaces que les traitements actuels. Pour la
SEP et
l'AMN, il n'existe que des traitements dont le but est de ralentir l'évolution
et prévenir
les poussées de dégénérescence. Par exemple, dans le cas de l'AMN, les
traitements
actuels sont symptomatiques : la greffe de cellules souches hématopoïétiques
qui est
réalisée pour stopper les lésions démyélinisantes et inflammatoires ne semble
pas
empêcher la progression de la myélopathie dans l'AMN.
[0009] Afin d'évaluer efficacement des lésions résultant de ces
pathologies ainsi
que les effets de traitements potentiels (pour permettre la mise au point et
la validation
de nouveaux traitements), il y a un réel besoin de biomarqueurs, avec des
tailles d'effet
élevées, représentatifs d'un degré d'altération du cerveau liée à une
pathologie
démyélinisante évolutive.
[0010] Pour ces affections, la sévérité des lésions sur la matière
blanche ainsi que
leur aggravation sont difficiles à évaluer avec les moyens d'examens usuels :
par
exemple, les biomarqueurs fournis par imagerie par résonnance magnétique (IRM)
2
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
conventionnelle ne sont pas suffisamment robustes car ils engendrent souvent
la
détection de faux-positifs chez des patients sains ou de faux-négatifs chez
des patients
atteints de pathologies démyélinisantes.
[0011] Parmi les techniques d'IRM du cerveau, on connait aussi le
document
W02014060695A2. Ce dernier décrit une méthode pour déterminer la probabilité
qu'a
un patient de sortir d'un état de coma. Pour cela, des valeurs régionales de
diffusion
radiale, de diffusion axiale et de fraction d'anisotropie sont déterminées
pour
différentes régions du cerveau. L'ensemble de ces valeurs, préalablement
normalisées, est fourni en entrée d'un classificateur qui délivre en sortie
une probabilité
1.0 de sortir du coma. Ce classificateur est préalablement entrainé sur la
base d'images
IRM correspondant à des patients sains ainsi qu'à des patients atteints (une
centaine
de patients en tout, suivis sur plus d'une année). Mais le classificateur
décrit dans ce
document est paramétré pour déterminer une probabilité de sortie du coma, et
non
pour détecter ou suivre l'évolution d'une maladie démyélinisante telle que
mentionnée
ci-dessus (autrement formulé, les valeurs de paramètres ajustables du
classificateur,
fournies dans ce document, sont adaptés pour déterminer la probabilité de
sortie de
coma, mais a priori pas pour détecter l'une des maladies en question). En
outre,
l'utilisation d'un tel classificateur est contraignante, à cause de la phase
d'apprentissage en question qui nécessite un suivi de nombreux patients de
référence,
servant seulement pour cet apprentissage.
[0012] L'invention décrite dans le document W02014060695A2
instruit l'utilisation
de biomarqueurs avec des tailles d'effet élevées qui sont robustes et
représentatifs de
lésions cérébrales ayant provoqué l'état de coma. En l'occurrence, ces
biomarqueurs
sont la diffusion radiale, la diffusion axiale et la fraction d'anisotropie.
[0013] Cependant, la méthode décrite dans W02014060695A2 se base sur des
outils d'apprentissage pour réaliser la prédiction de la probabilité de sortie
de l'état de
coma. Ces outils nécessitent une phase d'apprentissage chronophage qui n'est
pas
compatible avec un besoin d'évaluation rapide du degré d'altération du cerveau
d'un
patient sujet à de l'AMN.
[0014] Ainsi, il existe un besoin de biomarqueurs représentatifs du degré
d'altération du cerveau liée à l'AMN, avec des tailles d'effet élevées, qui
soient
robustes, rapides à obtenir, concis et faciles à appréhender pour le
professionnel de
santé.
3
CA 03229337 2024-2- 16
WO 2023/021201 PCT/EP2022/073240
RESUME DE L'INVENTION
[0015]
L'invention offre une solution aux problèmes évoqués précédemment, en
permettant une détermination simple et rapide d'un indicateur robuste et
représentatif
d'un degré d'altération du cerveau causée par une pathologie démyélinisante de
sorte
que ledit indicateur soit concis et facile à appréhender pour un professionnel
de santé.
[0016] On
considère comme pathologies démyélinisantes toutes les pathologies
conduisant à une démyélinisation primaire, telles que la sclérose en plaque
(SEP), les
leucodystrophies ou l'adrénomyéloneuropathie (AMN), ou secondaire, telles que
la
sclérose latérale amyotrophique (SLA).
1.0 [0017]
Plus précisément, la présente invention a pour objet une méthode, et un
système pour mettre en oeuvre la méthode, afin de déterminer ledit indicateur.
[0018] Un
premier aspect de l'invention concerne une méthode de détermination
d'un indicateur, représentatif d'une altération du cerveau d'un individu
causée par une
pathologie démyélinisante, comprenant les étapes suivantes :
- Une
première étape, pour chaque région d'intérêt d'un ensemble
regroupant plusieurs régions d'intérêt du cerveau, détermination d'un
coefficient régional de diffusion correspondant à une moyenne, sur ladite
région d'intérêt, de l'un des coefficients de diffusion suivant : la diffusion
radiale, la diffusion axiale, la diffusion moyenne, la fraction d'anisotropie
ou
une combinaison de plusieurs de ces coefficients, les coefficients régionaux
associés respectivement à ces différentes régions étant déterminés à partir
d'une image du cerveau de l'individu à examiner préalablement obtenue par
I RM de diffusion ;
- Une
deuxième étape de détermination d'un nombre de régions altérées, en
comptant le nombre de régions d'intérêt pour lesquelles une condition
donnée est satisfaite, ladite condition portant sur la valeur du coefficient
régional de diffusion associé à la région considérée, par rapport à un
coefficient régional de référence qui est égal à une moyenne du coefficient
régional de diffusion pour cette région pour une cohorte de patients sains ;
- Une
troisième étape de détermination dudit indicateur en fonction du
nombre de régions altérées.
[0019] Grâce à
l'invention, un professionnel de santé dispose d'un indicateur
représentatif de l'altération du cerveau causée par une pathologie
démyélinisante, et
4
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
en particulier représentatif d'une altération de la myéline. En effet, les
coefficients de
diffusion, obtenus à partir d'images par IRM du tenseur de diffusions, tels
que la
diffusion radiale, la diffusion axiale, la diffusion moyenne, la fraction
d'anisotropie ou
une combinaison de plusieurs de ces coefficients, sont sensibles aux
altérations de la
myéline. De plus, l'indicateur est déterminé pour plusieurs régions d'intérêt,
ce qui le
rend représentatif de l'altération du cerveau à l'échelle de l'individu. En
outre,
l'indicateur est représentatif de l'état d'altération du cerveau car il est
déterminé à partir
des coefficients de diffusions moyennés et est donc peu sensible aux
incertitudes et
variabilités de mesures.
w [0020] L'indicateur est également simple, concis, quantitatif et
facile à appréhender
par le professionnel de santé, puisqu'il est avantageusement déterminé en
fonction du
nombre de régions d'intérêt altérées.
[0021] L'indicateur permet en sus au professionnel de santé
d'évaluer un degré de
sévérité des altérations, notamment par comparaison avec des coefficients de
diffusion extraits d'images acquises pour la cohorte de patients sains.
[0022] L'indicateur est en sus représentatif d'une évolution de
l'altération du
cerveau et permet au professionnel de santé d'évaluer une modification de
l'altération
dans le temps et dans l'espace, d'autant plus que les maladies concernées se
démarquent d'autres atteintes myélopathiques notamment par leur caractère
zo dégénératif.
[0023] Enfin, l'indicateur est représentatif de l'état
d'altération du cerveau en ce
qu'il est corrélé à d'autres indicateurs comme l'EDSS (Expanded Disability
Status
Scale) qui permet d'évaluer le handicap sur une échelle de gravité et le
SSPROM
(Severity Score System for Progressive Myelopathy) qui permet d'évaluer la
sévérité
d'une atteinte en fonction de symptômes associés à une myélopathie tels que
des
troubles moteurs, dysfonction des sphincters, spasticité et diminutions
sensorielles.
[0024] Outre les caractéristiques qui viennent d'être évoquées
dans les
paragraphes précédents, la méthode selon le premier aspect de l'invention peut
présenter une ou plusieurs caractéristiques complémentaires parmi les
suivantes,
considérées individuellement ou selon toutes les combinaisons techniquement
possibles.
5
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[0025]
Une première variante de réalisation concerne la méthode selon
l'invention
dans laquelle ledit indicateur est représentatif d'un caractère évolutif de
ladite
altération, et dans laquelle :
- l'image du cerveau de l'individu employée à la première étape est une
image relevée par IRM de diffusion à une date t2,
- la méthode comportant en outre une étape : pour chacune desdites régions
d'intérêt, détermination d'un coefficient régional initial correspondant à une
moyenne du coefficient de diffusion sur la région d'intérêt, lesdits
coefficients régionaux initiaux étant déterminés à partir d'une image initiale
Io
du cerveau de l'individu, relevée par IRM de diffusion à une date tl
antérieure à la date t2,
- à la deuxième étape le nombre de régions altérées correspond au nombre
de régions avec progression de l'altération, une région d'intérêt étant
considérée comme une région avec progression de l'altération lorsque la
condition est définie comme suit : le coefficient régional de diffusion s'est
éloigné du coefficient régional de référence, par rapport au coefficient
régional initial.
[0026]
Pour chaque région d'intérêt, on peut considérer par exemple que le
coefficient régional de diffusion s'est éloigné du coefficient régional de
référence
zo
lorsque l'écart entre la valeur dudit coefficient régional, correspondant à
t2, et la valeur
du coefficient régional de référence est plus grand que l'écart entre la
valeur du
coefficient régional initial, correspondant à tl , et la valeur du coefficient
régional de
référence.
[0027]
Grâce à cette première variante de réalisation, il est possible de
déterminer
la progression de la démyélinisation du cerveau pour chaque région d'intérêt
par
comparaison du coefficient régional initial obtenu à une première date tl avec
le
coefficient régional obtenu à une seconde date t2, et par comparaison du
coefficient
régional avec le coefficient de référence obtenu à partir de la cohorte de
patents sains.
Ainsi la méthode permet de détecter si l'altération d'une région d'intérêt
altérée s'est
dégradée et si une région d'intérêt non altérée est devenue altérée.
L'indicateur
déterminé par la méthode est donc représentatif du caractère dégénératif d'une
pathologie démyélinisante, y compris dans le cas d'une forte atteinte.
6
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[0028] L'indicateur est en outre simple et concis puisqu'il
exprime à lui seul s'il y a
évolution de l'altération du cerveau et si l'évolution est causée par une
progression de
l'altération.
[0029] Une sous-variante de réalisation de la première variante de
réalisation,
concerne la méthode selon l'invention, dans laquelle, à la deuxième étape, le
coefficient régional de diffusion s'est éloigné du coefficient régional de
référence, par
rapport au coefficient régional initial lorsqu'un écart entre le coefficient
régional et le
coefficient régional initial est supérieur à Ze-Gi, OU G] est représentatif
d'une dispersion
dudit coefficient de diffusion régional, pour la région considérée, pour
ladite cohorte de
patients sains, et où ze est un coefficient minimal d'évolution, compris entre
0,5 et 4.
[0030] Grâce à cette sous-variante, les régions du cerveau sont
compatibilisées
par l'indicateur uniquement si la progression de leur altération est
significative, c'est-
à-dire si l'évolution de leur coefficient régional est supérieure à une valeur
représentative d'une dispersion dudit coefficient régional obtenue pour la
cohorte de
patients sains.
[0031] Une variante de la première variante de réalisation,
concerne la méthode
de l'invention, dans laquelle ledit indicateur est représentatif d'un
caractère évolutif de
zo ladite altération, et dans laquelle ledit indicateur est représentatif
d'un caractère
évolutif de ladite altération, et dans laquelle à la deuxième étape le nombre
de régions
altérées est le nombre de régions avec régression de l'altération, une région
d'intérêt
étant considérée comme une région avec régression de l'altération lorsque
ladite
condition est que le coefficient régional de diffusion s'est rapproché du
coefficient
régional de référence, par rapport au coefficient régional initial.
[0032] Pour chaque région d'intérêt, on peut considérer par
exemple que le
coefficient régional de diffusion s'est rapproché du coefficient régional de
référence
lorsque l'écart entre la valeur dudit coefficient régional, correspondant à
t2, et la valeur
du coefficient régional de référence est plus petit que l'écart entre la
valeur du
coefficient régional initial, correspondant à t1, et la valeur du coefficient
régional de
référence.
[0033] Une sous-variante de réalisation de la variante de
réalisation précédente,
concerne la méthode selon l'invention, dans laquelle ledit indicateur est
représentatif
d'un caractère évolutif de ladite altération, et dans laquelle, à la deuxième
étape, le
7
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
coefficient régional de diffusion s'est rapproché du coefficient régional de
référence,
par rapport au coefficient régional initial lorsqu'un écart entre le
coefficient régional et
le coefficient régional initial est supérieur à ze.q, où O est représentatif
d'une
dispersion dudit coefficient de diffusion régional, pour la région considérée,
pour ladite
cohorte de patients sains, et où ze est un coefficient minimal d'évolution,
compris entre
0,5 et 4.
[0034] Grâce à cette sous-variante, il est possible de déterminer
la régression de
la démyélinisation du cerveau pour chaque région d'intérêt par comparaison du
coefficient régional initial obtenu à une première date avec le coefficient
régional
obtenu à une seconde date, et par comparaison du coefficient régional avec le
coefficient de référence obtenu à partir de la cohorte de patents sains. Ainsi
la méthode
permet de détecter si l'altération d'une région d'intérêt altérée s'est
améliorée et si une
région d'intérêt altérée est devenue non-altérée. En outre, les régions du
cerveau sont
compatibilisées par l'indicateur uniquement si la régression de leur
altération est
significative, c'est-à-dire si l'évolution de leur coefficient régional est
supérieure à la
valeur représentative d'une dispersion dudit coefficient régional obtenue pour
la
cohorte de patients sains
[0035] L'indicateur déterminé par la méthode exprime alors s'il y
a évolution de
l'altération du cerveau et si l'évolution est causée par une régression de
l'altération.
zo Une sous-variante de réalisation compatible avec les sous-variantes de
réalisation
précédentes, concerne la méthode de l'invention dans laquelle l'indicateur
représentatif d'un caractère évolutif de ladite altération est d'autant plus
grand qu'une
différence entre le nombre de région avec progression de l'altération et le
nombre de
régions avec régression de l'altération est grande.
[0036] L'indicateur est donc facile à appréhender pour le professionnel de
santé
puisqu'il est simple, concis, quantitatif et représentatif de l'altération du
cerveau
causée par une pathologie démyélinisante.
[0037] Une alternative de réalisation concerne la méthode selon
l'invention pour
laquelle la date t2 est postérieure à une date d'administration d'un
traitement de
l'altération du cerveau liées à une atteinte de type pathologie
démyélinisante, et que
la date tl est antérieure à ladite date d'administration dudit traitement.
8
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[0038] Grâce à cette alternative, l'indicateur déterminé par la
méthode permet
d'évaluer l'évolution de l'altération du cerveau après administration d'un
traitement
contre la démyélinisation.
[0039] Une deuxième variante de réalisation décrit la méthode selon
l'invention
dans laquelle ledit indicateur est un indicateur statique de niveau d'atteinte
du cerveau,
et dans laquelle, à la deuxième étape, ladite condition est qu'un écart entre
le
coefficient régional de diffusion et le coefficient régional de référence est
supérieur à
Zs.ti, OU ti est représentatif d'une dispersion dudit coefficient de diffusion
régional, pour
la région considérée, pour ladite cohorte de patients sains, et où zs est un
coefficient
d'écartement minimal, compris entre 0,5 et 4.
[0040] Cette deuxième variante permet d'obtenir un indicateur
représentatif de
l'état d'altération du cerveau à un instant donné et qui instruit sur un degré
de sévérité
de la démyélinisation du cerveau à l'échelle de l'individu.
[0041] Cet indicateur statique est en outre, simple, concis, quantitatif et
facile à
appréhender pour le professionnel de santé, puisqu'il s'agit d'une unique
scalaire
exprimant le nombre de régions d'intérêt dont l'altération est significative
par rapport à
une cohorte de patient sains.
zo [0042] Une alternative de réalisation de la méthode selon l'invention
décrit que la
pluralité de régions d'intérêt est choisie parmi tout ou partie des régions
suivantes :
tronc cérébral antérieur, tronc cérébral antérieur, pédoncule droit, pédoncule
gauche,
genou du corps calleux, tronc du corps calleux, splenium du corps calleux,
bras
antérieur de la capsule interne droite, bras antérieur de la capsule interne
gauche, bras
postérieur de la capsule interne droite, bras postérieur de la capsule interne
gauche,
stratum sagittal droit, stratum sagittal gauche, faisceau longitudinal
supérieur droit,
faisceau longitudinal supérieur gauche, capsule externe droite, capsule
externe
gauche, couronne radiée droite et couronne radiée gauche.
[0043] Une alternative de réalisation concerne la méthode selon l'invention
en ce
que la cohorte d'individus sains comprend au moins deux individus sains pour
chaque
région d'intérêt.
9
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[0044] Une
alternative de réalisation décrit la méthode selon l'invention en ce que
au moins un des au moins deux individus sains est le même ou est différent
pour
chaque région d'intérêt.
[0045] En
d'autres termes, pour chaque région d'intérêt, le coefficient régional de
référence peut être déterminé à partir d'une même cohorte d'individus sains ou
à partir
d'une cohorte différente d'individus sains.
[0046] Un
deuxième aspect de l'invention concerne un système pour la mise en
oeuvre de la méthode selon l'une quelconque des réalisations précédentes,
comportant un module de traitement configuré pour effectuer les étapes
suivantes :
- Une
première étape, pour chaque région d'intérêt d'un ensemble
regroupant plusieurs régions d'intérêt du cerveau, détermination d'un
coefficient régional de diffusion correspondant à une moyenne, sur ladite
région d'intérêt, de l'un des coefficients de diffusion suivant : la diffusion
radiale, la diffusion axiale, la diffusion moyenne, la fraction d'anisotropie
ou
une combinaison de plusieurs de ces coefficients, les coefficients régionaux
associés respectivement à ces différentes régions étant déterminés à partir
d'une image du cerveau de l'individu à examiner préalablement obtenue par
I RM de diffusion ;
- Une
deuxième étape de détermination d'un nombre de régions altérées, en
comptant le nombre de régions d'intérêt pour lesquelles une condition
donnée est satisfaite, ladite condition portant sur la valeur du coefficient
régional de diffusion associé à la région considérée, par rapport à un
coefficient régional de référence qui est égal à une moyenne du coefficient
régional de diffusion pour cette région pour une cohorte de patients sains ;
- Une
troisième étape de détermination dudit indicateur en fonction du
nombre de régions altérées.
[0047] Un
dernier aspect de l'invention concerne un produit-programme
d'ordinateur comprenant des instructions qui, lorsque le programme est exécuté
par
un ordinateur, conduisent celui-ci à mettre en uvre les étapes de la méthode
selon
l'une quelconque des réalisations précédentes.
lo
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[0048] L'invention et ses différentes applications seront mieux
comprises à la
lecture de la description qui suit et à l'examen des figures qui
l'accompagnent.
BREVE DESCRIPTION DES FIGURES
[0049] Les figures sont présentées à titre indicatif et nullement limitatif
de
l'invention.
[0050] La [Fig. 1] illustre un mode de réalisation du système
selon l'invention.
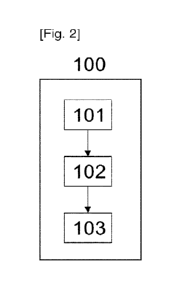
[0051] La [Fig. 2] décrit de façon générale la méthode selon
l'invention.
[0052] La [Fig. 3] est un schéma synoptique illustrant un premier
mode de
1.0 réalisation du de la méthode selon l'invention.
[0053] La [Fig. 4] est un schéma synoptique illustrant un deuxième
mode de
réalisation de la méthode selon l'invention.
[0054] La [Fig. 5] illustre un second mode de réalisation du
système selon
l'invention.
[0055] La [Fig. 6] compare des résultats expérimentaux de l'indicateur,
déterminé
par le deuxième mode de réalisation de la méthode de la figure 4 pour une
pluralité
d'individus atteints d'adrénomyéloneuropathie, avec les indicateurs EDSS et
SSPROM.
[0056] La [Fig. 7] regroupe des résultats expérimentaux de
l'indicateur déterminé
zo par les deux modes de réalisation de la méthode des figures 3 et 4 pour
une pluralité
d'individus atteints d'adrénomyéloneuropathie.
DESCRIPTION DETAILLEE
[0057] Sauf précision contraire, un même élément apparaissant sur
des figures
différentes présente une référence unique.
[0058] La présente invention concerne un système et une méthode
mise en oeuvre
par le système. Cette méthode est employée afin de déterminer un indicateur
qui est
représentatif d'une altération du cerveau d'un individu causée par une
démyélinisation
du système nerveux du fait d'une pathologie engendrant une démyélinisation
primaire
ou secondaire primaire. Le système comportant trois sous-systèmes distincts
est décrit
à l'appui de la figure 1. La méthode de l'invention est ensuite détaillée à
partir des
figures 2 et 3. Deux variantes de la méthode sont proposées, l'une permettant
de
déterminer l'altération de la gaine de myéline à un instant donné, et l'autre
permettant
de suivre l'évolution de la démyélinisation du cerveau dans le temps. Cette
méthode
11
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
s'appuie sur des coefficients de diffusion calculés à partir des variations
anisotropes
du champ magnétique mesurées par IRM du tenseur de diffusion du cerveau d'un
patient, et compare ces coefficients à des données issues d'une cohorte de
patient
sains.
[0059] Présentation du système
[0060] Un premier aspect de l'invention concerne un système pour
déterminer une
altération du cerveau d'un individu causée par une pathologie démyélinisante.
[0061] La figure 1 montre une représentation schématique du
système 10 selon
l'invention.
[0062] Le système 10 comprend :
- Un système d'acquisition 20, comprenant :
o Un module de commande 21 ; et
o Un module d'imagerie 22 par IRM (Imagerie par Résonance
Magnétique) du tenseur de diffusion ;
- Un système de traitement 30, comprenant :
o Une mémoire volatile 31 ;
o Un module de traitement 32;
o Une mémoire non-volatile 33;
- Un système d'information 40, comprenant :
o Un module d'affichage 41
- Une connexion 50 reliant le système d'acquisition 20 et le système de
traitement 30;
- Une connexion 60 reliant le système d'acquisition 20 et le système
d'information 40;
- Une connexion 70 reliant le système de traitement 30 et le système
d'information 40.
[0063] Le système d'acquisition 20 est configuré pour procéder à
l'acquisition des
images du cerveau par IRM du tenseur de diffusion pour un individu. Plus
précisément,
le module de commande 21 est configuré pour piloter le module d'imagerie 22 de
façon
à réaliser une acquisition par IRM du tenseur de diffusion d'une image du
cerveau de
l'individu, et à acquérir cette image.
12
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[0064] Par IRM du tenseur de diffusion, on entend toute technique
de mesure par
IRM de la distribution des directions de diffusion des molécules d'eau qui est
sensible
à l'anisotropie de la structure fibreuse du cerveau.
[0065] Le module de commande 21 peut être un ordinateur, un
appareil mobile, un
processeur, ou tout autre appareil en mesure d'exécuter des instructions pour
piloter
le module d'imagerie 22 ainsi que d'acquérir et conserver en mémoire l'image
du
cerveau par IRM du tenseur de diffusion.
[0066] Le module d'imagerie peut par exemple être un appareil IRM
1,5 Teslas,
3,0 Tesla ou 7,0 Tesla, par exemple de la marque PhilipsTM, General ElectricTM
(GE)
1.0 ou SiemensTM.
[0067] L'image du cerveau peut être n'importe quel type d'image
obtenue par un
appareil IRM. Il peut s'agir par exemple d'une image non-pondérée ou d'une
image
pondérée en diffusion.
[0068] Le module de commande 21 peut être contrôlé par un
praticien qui réalise
l'imagerie ou être autonome et suivre des instructions pré-enregistrées.
[0069] Le système d'acquisition 20 est configuré pour transmettre,
via la connexion
50, au système de traitement 30 une donnée concernant l'image du cerveau
acquise,
cette donnée pouvant par exemple être tout ou une partie de l'image du cerveau
ou
une donnée issue de l'image du cerveau après un traitement, par exemple après
un
zo filtrage, une segmentation, un moyennage, une classification.
[0070] La connexion 50 entre le système d'acquisition 20 et le
système de
traitement 30 peut être de nature filaire (par exemple : Ethernet, USB, SATA,
PCI) ou
non-filaire (par exemple : VVifi, Bluetooth).
[0071] Le système de traitement 30 est configuré pour recevoir la
donnée reçue
par le système de traitement 30 via la connexion 50 depuis le système
d'acquisition
20.
[0072] Le système de traitement 30 est en outre configuré pour
traiter la donnée.
[0073] Le système de traitement 30 peut être n'importe quel
système permettant
l'exécution d'instructions. Le système de traitement 30 peut par exemple être
un
ordinateur ou un serveur. Le système de traitement 30 peut également être
localisé ou
délocalisé, par exemple sous forme de service de type cloud .
[0074] Présentation de la méthode
13
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[0075]
Le système de traitement 30 est configuré pour mettre en oeuvre une
méthode selon l'invention.100 telle qu'illustrée sur la figure 2. La méthode
100 permet
la détermination d'un indicateur, représentatif d'une altération du cerveau
d'un individu
causée par une maladie de type pathologie démyélinisante, affectant l'état de
la
myéline du cerveau.
[0076]
La méthode 100 comprend une étape 101 durant laquelle, pour chaque
région d'intérêt ROI, d'un ensemble regroupant plusieurs régions d'intérêt
ROli
R01,,... ROIN du cerveau, un coefficient régional C, de diffusion est
déterminé. Ce
coefficient régional Ci correspond à une moyenne, sur ladite région d'intérêt
ROI], de
1.0 l'un des coefficients de diffusion suivant : la diffusion radiale, la
diffusion axiale, la
diffusion moyenne, la fraction d'anisotropie ou une combinaison de plusieurs
de ces
coefficients. Les coefficients régionaux associés respectivement à ces
différentes
régions ROli,..
ROIN sont déterminés à partir d'une image du cerveau de
l'individu à examiner préalablement obtenue par IRM de diffusion. On entend
par
préalablement que l'image du cerveau est acquise avant la mise en oeuvre de
la
méthode ci-décrite, par exemple lors d'un examen médical de l'individu. La
méthode
ne requiert donc pas la présence de l'individu pour être mise en oeuvre, seule
l'image
est nécessaire.
[0077] Les régions d'intérêt R011,...
ROIN sont les régions du cerveau, et
zo en particulier les régions de matière blanche, telles que définie par
l'atlas ICBM-DTI-
81 doté de 48 régions de matière blanche construites à partir de données de
diffusion
de 81 sujets sains (Mon i et al. 2005). Par sujets sains, on entend des êtres
vivants
cérébrés, animaux ou humains, ne présentant aucun trouble ni atteinte
cérébrale de
quelque nature.
[0078] Les
régions d'intérêt R011, ROI], ROIN peuvent être choisie parmi les
régions suivantes : le tronc cérébral antérieur (ICBM 2, 7 et 8), tronc
cérébral
postérieur (ICBM 9 à 14), pédoncule cérébral droit (ICBM 15), pédoncule
cérébral
gauche (ICBM 16), genou du corps calleux (ICBM 3), tronc du corps calleux
(ICBM 4),
splenium du corps calleux (ICBM 5), bras antérieur de la capsule interne
droite (ICBM
17), bras antérieur de la capsule interne gauche (ICBM 18), bras postérieur de
la
capsule interne droite (ICBM 19), bras postérieur de la capsule interne gauche
(ICBM
20), stratum sagittal droit (ICBM 21, 29, 31 et 47), stratum sagittal gauche
(ICBM 22,
30, 32 et 48), faisceau longitudinal supérieur droit (ICBM 41), faisceau
longitudinal
supérieur gauche (ICBM 42), capsule externe droite (ICBM 33), capsule externe
14
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
gauche (ICBM 34), couronne radiée droite (ICBM 23, 25 et 27) et couronne
radiée
gauche (ICBM 24, 26 et 28).
[0079] La notation ICBM n fait référence à la n-ième région de
l'atlas ICBM-
DT1-81.
[0080] Il est possible d'utiliser d'autres régions de l'atlas ICBM-DTI-81
que celles
susmentionnées, tout comme il est possible d'arranger différemment les régions
de
façon à les combiner ou les scinder différemment de l'arrangement proposé par
l'atlas
ICBM-DTI-81.
[0081] Il est également possible d'utiliser d'autres atlas comme
l'atlas Catani-
w Thiebaut de Schotten.
[0082] Par ailleurs, il est possible de s'appuyer sur des
techniques de
segmentation pour identifier et délimiter les régions d'intérêt dans l'image.
Par
exemple, il est possible d'appliquer une segmentation par détection de
contours ou
reconnaissance de formes. Il est en outre possible de s'appuyer sur des outils
d'apprentissage machine pour identifier les régions d'intérêt.
[0083] Ainsi, pour chacune des régions d'intérêt R011,... R01],...
ROIN, le
coefficient régional Ci de diffusion est déterminé par la moyenne d'au moins
un
coefficient de diffusion de ladite région d'intérêt ROI].
[0084] La moyenne peut-être, mais n'est pas restreinte à, une
moyenne spatiale,
zo calculée en prenant les valeurs du coefficient de diffusion mesuré sur
chaque voxel de
l'image du cerveau. Il peut aussi s'agir d'une moyenne pondérée, par exemple
par la
surface de la région d'intérêt ROI] ou par une fonction de régularisation.
[0085] La méthode 100 comprend une deuxième étape 102 de
détermination d'un
nombre de régions altérées Na, en comptant le nombre de régions d'intérêt
R011,...
ROli,... ROIN pour lesquelles une condition donnée est satisfaite, ladite
condition
portant sur la valeur du coefficient régional C; de diffusion associé à la
région
considérée, par rapport à un coefficient régional de référence Cj,ref qui est
égal à une
moyenne du coefficient régional de diffusion pour cette région pour une
cohorte de
patients sains.
[0086] Pour chaque région d'intérêt ROI] du cerveau, est déterminé
un coefficient
régional de référence Cj,ref. Ce coefficient régional de référence Cj,ref
indique une valeur
de référence pour le coefficient de diffusion concerné. Cette valeur de
référence
indique une valeur normale moyenne du coefficient de diffusion pour un
individu non
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
atteint d'une pathologie démyélinisante. Le coefficient régional de référence
Guet est
obtenu en moyennant les valeurs du coefficient régional de diffusion
déterminées sur
une cohorte de patients sains. Cette moyenne peut éventuellement être
pondérée.
[0087] La détermination des coefficients régionaux de référence
nécessite de
disposer d'une cohorte de patients. Il est requis a minima deux patients sains
par
région d'intérêt ROI,. Il est en sus possible que les coefficients régionaux
de référence
soient déterminés avec une cohorte totalement ou partiellement différente de
patients
sains pour chaque région d'intérêt ROI, du cerveau. L'enjeu d'une telle
cohorte est
d'avoir une estimation robuste des coefficients régionaux de référence.
1.0 [0088] Une région d'intérêt ROI, est donc dite altérée lorsqu'elle
remplit ladite
condition portant sur la valeur du coefficient régional C, et la valeur du
coefficient
régional de référence Cgef de la région d'intérêt concernée.
[0089] Pour chaque région d'intérêt R01,, le coefficient régional
C, peut être
prétraité. Par exemple, chaque coefficient régional C, peut être normalisé ou
adimensionné par le coefficient régional de référence Ci,ret de ladite région
d'intérêt
R01,, ou être centré et réduit en lui retranchant la moyenne des valeurs du
coefficient
régional obtenues à partir de la cohorte de patients sains puis en le divisant
par l'écart-
type des valeurs du coefficient régional obtenues pour la cohorte de patients
sains.
[0090] La méthode 100 comprend une troisième étape 103 de
détermination dudit
zo indicateur en fonction du nombre de régions altérées Na.
[0091] Mode de réalisation pour déterminer un indicateur évolutif
[0092] La méthode 100 peut être mise en oeuvre suivant deux modes
de réalisation
complémentaires et indépendants. Dans un premier mode de réalisation, est
obtenu
un indicateur représentatif d'un caractère évolutif de ladite altération. Dans
un second
mode de réalisation, est obtenu un indicateur statique du niveau d'atteinte du
cerveau.
Ainsi que pourra l'apprécier l'homme du métier, ces modes de réalisation
pourraient
être réalisés indépendamment l'un de l'autre ou simultanément ou être combinés
ou
n'être réalisés que partiellement.
[0093] La figure 3 illustre schématiquement le fonctionnement de la méthode
100,
à laquelle est ajoutée une étape supplémentaire 201, pour déterminer
l'indicateur
représentatif du caractère évolutif de l'altération.
[0094] Dans ce premier mode de réalisation, la méthode 100 pour
déterminer
l'indicateur représentatif d'un caractère évolutif de l'altération reprend les
trois étapes
16
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
101, 102 et 103 de la méthode 100 précédemment décrite, à laquelle est
adjointe des
caractéristiques suivantes :
l'image du cerveau de l'individu employée à la première étape 101 est une
image relevée par IRM de diffusion à une date t2,
la méthode comportant en outre une étape 201 : pour chacune desdites
régions d'intérêt ROli
R01,,... ROIN, détermination d'un coefficient
régional initial C,,0 correspondant à une moyenne du coefficient de diffusion
sur la région d'intérêt R01,, lesdits coefficients régionaux initiaux étant
déterminés à partir d'une image initiale du cerveau de l'individu, relevée par
IRM de diffusion à une date t1 antérieure à la date t2,
à la deuxième étape 102, le nombre de régions altérées Na correspond au
nombre de régions avec progression Np de l'altération, une région d'intérêt
ROI, étant considérée comme une région avec progression de l'altération
lorsque la condition est définie comme suit : le coefficient régional Ci de
diffusion s'est éloigné du coefficient régional de référence Cbref, par
rapport
au coefficient régional initial Ci,o.
[0095]
En d'autres termes, une première acquisition d'images par IRM du tenseur
de diffusion est réalisée à une date t1 par le système d'acquisition 20. Une
deuxième
acquisition est ensuite réalisée à une date t2 ultérieure à t1 par le système
d'acquisition
zo
20. L'intervalle de temps entre t1 et t2 dépend du contexte de l'examen et
peut par
exemple être de un jour, un mois ou un an.
[0096]
L'intérêt de disposer d'images du cerveau à deux temps successifs plus
ou
moins distants est d'être en mesure d'évaluer l'évolution de l'altération de
la myéline.
Il peut s'agir de suivre la progression ou la régression de l'altération par
l'évolution
naturelle de la maladie. Il peut également s'agir de suivre l'évolution de
l'altération
après administration d'un traitement ayant un effet sur la myéline. La méthode
100
permet alors d'évaluer l'efficacité du traitement en évaluant la progression
ou la
régression de l'altération du cerveau.
[0097]
Les images acquises aux dates t1 et t2 sont transmises au système de
traitement 30 pour réaliser les étapes de la méthode 100. Ainsi, le système de
traitement exécute la première étape 101 de la méthode 100 qui concerne la
détermination de coefficients régionaux pour l'image acquise au temps t2, et
exécute
l'étape 201 de la méthode 100 qui concerne la détermination de coefficients
régionaux
initiaux pour l'image acquise au temps t1.
17
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[0098] Les coefficients régionaux et les coefficients régionaux
initiaux sont ensuite
comparés aux coefficients régionaux de référence afin d'établir si, pour
chaque région
d'intérêt R01,, la valeur du coefficient régional C, s'est éloignée ou
rapprochée de la
valeur du coefficient régional de référence Cbref par rapport à la valeur du
coefficient
régional initial Ci,o.
[0099] L'objectif est de déterminer les régions d'intérêt R011,...
R01,,... ROIN pour
lesquelles l'évolution du coefficient régional Cj entre les instants t1 et t2
correspond à
une progression de l'altération et celles pour lesquelles l'évolution
correspond à une
régression de l'altération.
1.0 [00100] Il est alors possible de déterminer l'indicateur
représentatif d'un caractère
évolutif de ladite altération en dénombrant le nombre de régions d'intérêt
R011,...
R01,,... ROIN pour lesquelles l'évolution correspond à une progression ou une
régression de l'altération. Ce dénombrement peut également être pondéré en
fonction
de chaque région d'intérêt R01,, par exemple en fonction de leur localisation
ou de leur
pertinence vis-à-vis de la maladie ou de l'examen clinique.
[00101] Pour chaque région d'intérêt R01,, il est en outre
possible, à la deuxième
étape 102, d'évaluer si l'évolution de l'altération est significative en
quantifiant l'écart
entre le coefficient régional initial C,,c, et le coefficient régional C, dans
le cas où la
progression ou la régression de l'altération du cerveau est avérée. Cet écart
est par
zo exemple égal ou proportionnel à la différence entre le coefficient
régional C, et le
coefficient régional initial Ci,0.
[00102] A cette fin, il est possible, à la deuxième étape 102, de
déterminer si, pour
chaque région, l'écart entre le coefficient régional C, et le coefficient
régional initial C,,0
est supérieur à Ze.G], OU :
[00103] G, est par exemple l'écart-type des valeurs du coefficient régional
C, de la
région d'intérêt ROI, déterminées pour la cohorte de patients sains, ou de
toute autre
grandeur représentative de la dispersion des valeurs du coefficient régional
déterminé
pour la cohorte de patients sains pour la région d'intérêt ROI,. G, peut
éventuellement
être différent si les régions d'intérêt R01-1,... R01,,... ROIN sont avec
progression de
l'altération ou régression de l'altération. u, peut éventuellement être
différent pour
chaque région d'intérêt ROI, ;
[00104] ze est un coefficient minimal d'évolution, par exemple compris entre
0,5 et
4, qui a pour utilité de définir une fraction de G, à partir de laquelle il
est considéré que
18
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
l'évolution est significative, ze peut éventuellement être différent si les
régions d'intérêt
ROIN sont avec progression de l'altération ou régression de l'altération.
ze peut éventuellement être différent pour chaque région d'intérêt ROI].
[00105] Il est par exemple possible de définir que l'évolution de
l'altération est
significative dans la région d'intérêt ROli lorsque l'écart entre le
coefficient régional Ci
et le coefficient régional initial CL est supérieur à une fois l'écart-type
calculé à partir
des valeurs du coefficient régional obtenues pour la cohorte de patients
sains.
[00106] Il est alors possible, à la troisième étape 103, de
déterminer l'indicateur
représentatif d'un caractère évolutif de ladite altération comme étant égal ou
w proportionnel au nombre de régions d'intérêt ROli,... ROli,... ROIN pour
lesquelles
l'évolution correspond à une progression ou à une régression de l'altération
et pour
lesquelles la progression ou la régression de l'altération est significative.
[00107] Par ailleurs, il est envisageable que l'indicateur
représentatif d'un caractère
évolutif de ladite altération, déterminé à la troisième étape 103, soit
déterminé en
calculant un écart, proportionnel à une différence, entre le nombre de régions
d'intérêt
ROIN pour lesquelles il y a progression avérée et significative de
l'altération et celles pour lesquelles il y a régression avérée et
significative de
l'altération.
[00108] En outre, si la date t1 est antérieure à une administration
d'un traitement et
que la date t2 est postérieur à l'administration dudit traitement,
l'indicateur également
est représentatif de l'effet de ce traitement sur l'évolution de l'altération
du cerveau.
[00109] Mode de réalisation pour déterminer un indicateur statique
[00110] Dans le deuxième mode de réalisation, l'indicateur
déterminé par la
méthode 300 est un indicateur statique de niveau d'atteinte du cerveau.
[00111] La figure 4 illustre schématiquement le fonctionnement de
la méthode 100
selon le deuxième mode de réalisation.
[00112] Dans ce premier mode de réalisation, la méthode 100 pour déterminer
l'indicateur statique de niveau d'atteinte du cerveau reprend les trois étapes
101, 102
et 103 de la méthode 100 précédemment décrite. La méthode est adjointe de la
caractéristique suivante à la deuxième étape 102, ladite condition est qu'un
écart
entre le coefficient régional Cj de diffusion et le coefficient régional de
référence Cbref
est supérieur à ze.Ti. Ti est représentatif d'une dispersion dudit coefficient
de diffusion
19
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
régional, pour la région considérée, pour ladite cohorte de patients sains, et
zs est un
coefficient d'écartement minimal, compris entre 0,5 et 4.
[00113] L'indicateur statique permet de déterminer, à partir de
l'image du cerveau,
le niveau d'atteinte du cerveau à un instant donné.
[00114] En d'autres termes, pour chaque région d'intérêt R01,, l'écart
entre le
coefficient régional C, et le coefficient régional de référence Ci,ref est
déterminé. Cet
écart est par exemple égal ou proportionnel à la différence entre le
coefficient régional
C, et le coefficient régional de référence Cbref.
[00115] Il est alors possible d'évaluer si l'altération est
significative en déterminant,
lo pour chaque région R01,, si ledit écart est supérieur à zs. T,, où :
[00116] T, est par exemple l'écart-type des valeurs du coefficient régional de
la
région d'intérêt ROI, déterminées pour la cohorte de patients sains, ou de
toute autre
grandeur représentative de la dispersion des valeurs du coefficient régional
déterminé
pour la cohorte de patients sains pour la région d'intérêt ROI,. T, peut
éventuellement
être différent pour chaque région d'intérêt ROI,. T, peut éventuellement être
égale à G, ;
[00117] zs est un coefficient d'écartement minimal, par exemple compris entre
0,5
et 4, qui a pour utilité de définir une fraction de T, à partir de laquelle
l'altération est
considérée comme significative. zs peut éventuellement être différent pour
chaque
région d'intérêt ROI,.
[00118] Il est par exemple possible de définir que l'altération est
significative dans
la région d'intérêt ROI, lorsque l'écart entre le coefficient régional C, et
le coefficient
régional de référence Cbref est supérieur à deux fois l'écart-type calculé à
partir des
valeurs du coefficient régional obtenues pour la cohorte de patients sains.
[00119] Il est alors possible de déterminer l'indicateur statique
de niveau d'atteinte
du cerveau comme étant égal ou proportionnel au nombre de régions d'intérêt
ROli
R01,,... ROIN pour lesquelles l'altération est significative.
[00120] Présentation du système d'affichage
[00121] Le système d'affichage est configuré pour recevoir du système de
traitement 30, via la connexion 70, l'indicateur représentatif d'une
altération du cerveau
d'un individu causée par une maladie de type pathologie démyélinisante
affectant l'état
de la myéline du cerveau. Cet indicateur pouvant être déterminé suivant l'un
des deux
modes de réalisation décrits plus haut.
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[00122] Le système d'affichage 40 est en outre configuré pour permettre à un
professionnel de santé de recevoir l'indicateur déterminé par la méthode 100.
[00123] La connexion 70 peut être de nature filaire (par exemple :
Ethernet, USB,
SATA, PCI) ou non-filaire (par exemple : Wifi, Bluetooth).
[00124] Le système d'affichage 40 peut également être configuré afin de
recevoir
du système d'acquisition 20, via la connexion 60, une donnée concernant
l'image du
cerveau acquise, qui peut être une donnée différente de celle transmise depuis
le
système d'acquisition 20 au système de traitement 30 via la connexion 50.
[00125] La connexion 60 peut être de nature filaire (par exemple :
Ethernet, USB,
1.0 SATA, PCI) ou non-filaire (par exemple : Wifi, Bluetooth).
[00126] Le professionnel de santé peut alors avoir accès à la donnée issue de
l'acquisition, par exemple l'image du cerveau, et au résultat de la méthode
100.
[00127] Le système d'acquisition 20 peut donc également être configuré pour
transmettre la donnée de l'acquisition au système d'affichage 40.
[00128] Le système d'acquisition 40 peut donc être configuré pour afficher
la
donnée de l'acquisition transmise par le système d'acquisition 20.
[00129] Le module d'affichage 41, qui permet au système de recevoir et
d'afficher
l'indicateur de la méthode 100 et éventuellement la donnée de l'acquisition,
peut être
n'importe quel appareil en mesure de recevoir et d'afficher une donnée (par
exemple
zo une tablette, un téléphone portable, un ordinateur portable ou fixe, un
objet connecté,
etc.).
[00130] Le système d'affichage 40 peut éventuellement être destiné au patient
afin
qu'il puisse avoir accès à des résultats de son examen, par exemple pour
recevoir
l'indicateur de la méthode 100 et éventuellement l'image de son cerveau.
[00131] Alternativement, le module d'affichage 41 peut être un module
d'information
qui fournit une information concernant l'indicateur de la méthode 100. Par
exemple le
module d'information peut informer de façon oral le patient qui accède au
système
d'affichage 40 pour recevoir son indicateur de la méthode 100, dans le cas où
ce
patient a une déficience visuelle. Par un autre exemple, le module
d'information peut
afficher un commentaire concernant l'altération du cerveau et ne pas afficher
l'indicateur de la méthode 100 tel quel. Par ces exemples, l'homme du métier
pourra
comprendre que le module d'affichage 41 peut renseigner de plusieurs manières
la
patient ou le professionnel de santé souhaitant accéder à l'indicateur de la
méthode
100.
21
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[00132] Système pour l'imagerie d'une cohorte de patients sains
[00133] La méthode 100 repose sur la disponibilité des coefficients
régionaux de
référence obtenus à partir d'une cohorte d'individus sains.
[00134] Aussi, la figure 5 illustre un système pour obtenir les
coefficients régionaux
de référence à partir d'une cohorte d'individus sains.
[00135] Le système 80 comporte :
- Un module de commande 81 ; et
- Un module d'imagerie 82 par IRM du tenseur de diffusion.
1.0 [00136] Le système d'acquisition 80 est configuré pour procéder à
l'acquisition des
images du cerveau par IRM du tenseur de diffusion pour la cohorte de patients
sains.
Plus précisément, le module de commande 81 est configuré pour piloter le
module
d'imagerie 82 de façon à réaliser une acquisition par IRM du tenseur de
diffusion d'une
image du cerveau de chaque individu de la cohorte de patients sains, et
d'acquérir
cette image.
[00137] Par IRM du tenseur de diffusion est entendu toute technique de mesure
par
IRM de la distribution des directions de diffusion des molécules d'eau qui est
sensible
à l'anisotropie de la structure fibreuse du cerveau.
[00138] Le module de commande 81 peut être un ordinateur, un appareil mobile,
un
zo processeur, ou tout autre appareil en mesure d'exécuter des instructions
pour piloter
le module d'imagerie 82 ainsi que d'acquérir et conserver en mémoire l'image
du
cerveau par IRM du tenseur de diffusion.
[00139] Le module d'imagerie peut par exemple être un appareil IRM 1,5 Teslas,
3,0 Tesla ou 7,0 Tesla, par exemple de la marque Philips, General Electric
(GE) ou
Siemens.
[00140] L'image du cerveau est de préférence une image pondérée en diffusion.
[00141] Le module de commande 81 peut être contrôlé par un praticien qui
réalise
l'imagerie ou être autonome et suivre des instructions pré-enregistrées.
[00142] Le module de commande 81 peut être identique ou différent de celui
utilisé
par le système 20.
[00143] De même, le module d'imagerie 82 peut être identique ou différent de
celui
utilisé par le système 20.
[00144] II est possible que, une fois acquises toutes les images de
cerveau de la
cohorte de patients sains, le module de commande 81 détermine pour chaque
région
22
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
d'intérêt ROli le coefficient régional de référence à partir des images de
cerveau
collectées sur la cohorte de patients sains.
[00145] Il est également possible que la détermination des
coefficients régionaux
de référence soit réalisée par le module de traitement 30 ou par un autre
module
externe aux systèmes 10 et 80.
[00146] Pour chaque région d'intérêt ROli, la valeur du coefficient
régional de
référence Ctref peut être égale ou proportionnelle à une moyenne des valeurs
des
coefficients régionaux obtenues pour chaque individu de la cohorte de patients
sains
pour ladite région ROli. Cette moyenne peut être réalisée différemment en
fonction de
1.0 la région d'intérêt ROli considérée.
[00147] Une fois déterminés, il est envisageable que les
coefficients régionaux de
référence soient stockés en mémoire dans l'un des systèmes 20, 30, 40 ou 80,
ou un
autre système externe aux systèmes 10 et 80. Si les coefficients régionaux
sont
stockés sur le système de traitement 30, ils peuvent être stockés dans la
mémoire non-
volatile 31 ou dans la mémoire volatile 33. Si les coefficients régionaux sont
stockés
sur le système d'acquisition 20 ou le système d'affichage 40, le système de
traitement
30 peut avoir accès à ces coefficients via l'une des connexion 50 ou 70. Si
ces
coefficients sont stockés sur le système d'acquisition 80 ou un autre système
que les
systèmes 10 et 80, ces coefficients sont accessibles pour le système de
traitement 30
zo via une connexion filaire ou non-filaire.
[00148] Par connexion filaire est entendu une connexion matérielle
entre deux
systèmes ou modules, par exemple une connexion Ethernet, USB, PCI ou SATA. Par
connexion non-filaire est entendu une connexion non matérielle entre deux
systèmes
ou modules, par exemple une connexion VVifi ou Bluetooth.
[00149] Exemple d'application
[00150] Un exemple d'application de la méthode 100 est proposé ci-dessous.
[00151] L'objectif de cette étude est de mettre en avant l'effet
d'un traitement sur la
démyélinisation du cerveau.
[00152] Pour cet exemple, la méthode est appliquée pour une cohorte de
patients
atteints d'adrénomyéloneuropathie (AMN). Cette cohorte est par la suite
scindée en
deux groupes : le groupe AMN qui recevra le traitement et le groupe Placebo
qui
recevra un placebo de ce traitement.
23
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[00153] Cet exemple ne traite que de coefficients régionaux déterminés à
partir des
valeurs régionales de diffusion radiale.
[00154] D'une part, les coefficients régionaux de référence sont
déterminés à partir
d'une cohorte de patients sains, ainsi que défini par la méthode ci-dessus.
[00155] Les régions d'intérêt ROli,... ROli,... ROIrg du cerveaux
considérées sont au
nombre de 19 et sont : le tronc cérébral antérieur (ICBM 2, 7 et 8), tronc
cérébral
postérieur (ICBM 9 à 14), pédoncule cérébral droit (ICBM 15), pédoncule
cérébral
gauche (ICBM 16), genou du corps calleux (ICBM 3), tronc du corps calleux
(ICBM 4),
1.0 splenium du corps calleux (ICBM 5), bras antérieur de la capsule
interne droite (ICBM
17), bras antérieur de la capsule interne gauche (ICBM 18), bras postérieur de
la
capsule interne droite (ICBM 19), bras postérieur de la capsule interne gauche
(ICBM
20), stratum sagittal droit (ICBM 21, 29, 31 et 47), stratum sagittal gauche
(ICBM 22,
30, 32 et 48), faisceau longitudinal supérieur droit (ICBM 41), faisceau
longitudinal
supérieur gauche (ICBM 42), capsule externe droite (ICBM 33), capsule externe
gauche (ICBM 34), couronne radiée droite (ICBM 23, 25 et 27) et couronne
radiée
gauche (ICBM 24, 26 et 28).
[00156] D'autre part, pour chaque région d'intérêt ROI] pour une
cohorte de patients
atteints d'AMN est déterminé un coefficient régional C. Le groupe AMN et le
groupe
zo placebo sont traités séparément.
[00157] Ces coefficients régionaux sont réduits et centrés par la moyenne et
l'écart-
type des valeurs du coefficient régional de référence Cj,ref pour chaque
région. Ainsi
chaque coefficient régional C; est exprimé comme une fraction de l'écart-type
des
valeurs du coefficient régional de référence Cj,ref de la région considérée.
[00158] Dans un premier temps est déterminé l'indicateur statique, pour chaque
patient atteint d'AMN, à partir de ces 19 régions d'intérêt ROli
ROli,... ROIN . C'est-
à-dire que le nombre de régions d'intérêt altérées est comptabilisé. Les
régions
d'intérêt altérées étant celles dont l'écart entre le coefficient régional Ci
réduit centré
et la valeur nulle est supérieur à deux fois l'écart-type des valeurs du
coefficient
régional de référence Cj,ref. L'indicateur statique est alors le nombre total
de régions
d'intérêt altérées. Cet indicateur est par la suite nommé index-19
[00159] Dans un second temps est déterminé l'indicateur
d'évolution.
[00160] Les coefficients régionaux obtenus pour l'index-19 deviennent les
coefficients régionaux initiaux.
24
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[00161] A une date ultérieure à l'acquisition des images pour
déterminer l'index-19,
qui correspond à la date t2 de la méthode, est réalisée une nouvelle
acquisition
d'images, pour chaque patient de la cohorte de patients atteints d'AMN. De ces
images
sont extraits les coefficients régionaux. Ces coefficients régionaux sont
également
centrés et réduits par la moyenne et l'écart-type des valeurs du coefficient
régional de
référence Cj,ref pour chaque région.
[00162] La date t2 est ultérieure à l'administration d'un
traitement pour le groupe
AM N et d'un placebo de ce traitement pour le groupe placebo.
[00163] Les coefficients régionaux sont comparés aux coefficients régionaux
1.0 initiaux pour identifier les régions pour lesquelles il y a une
évolution de l'altération.
[00164] Il est alors possible de déterminer les régions pour
lesquelles il y a une
progression de l'altération, c'est-à-dire les régions où la valeur du
coefficient régional
C; s'est éloignée du coefficient régional de référence Ciref (en l'occurrence
ici de valeur
nulle) depuis le coefficient régional initial Cj,o.
[00165] Il est également possible de déterminer les régions pour lesquelles
il y a
une régression de l'altération, c'est-à-dire les régions où la valeur du
coefficient
régional Ci s'est rapprochée du coefficient régional de référence Clret (en
l'occurrence
ici de valeur nulle) depuis le coefficient régional initial Cbo.
[00166] La quantification de l'écart entre la valeur du coefficient
régional Ci et celle
zo du coefficient régional initial Ci,o, pour chaque région d'intérêt ROli,
permet d'identifier
les régions pour lesquelles l'évolution de l'altération est significative. En
l'occurrence,
l'évolution est considérée significative lorsque la différence entre les deux
valeurs est
supérieure à une fois l'écart-type des valeurs du coefficient régional de
référence Ci,ref
pour chaque région d'intérêt ROli.
[00167] L'indicateur d'évolution est ensuite déterminé en fonction du
nombre de
régions d'intérêt R011,... RO1j,... ROIN pour lesquelles il y a progression de
l'altération
et le nombre de régions d'intérêt R011,... RO1j,... ROIN pour lesquelles il y
a
régression de l'altération. L'indicateur d'évolution est ici la différence
entre ces deux
nombres. L'indicateur d'évolution est par la suite nommé index-var t1-t2 .
[00168] Dans un troisième temps, la méthode est réitérée pour une date t3
ultérieure
à t2. Sont alors déterminés l'index-var t1-t3, qui exprime l'évolution de
l'altération du
cerveau entre la date t1 et la date t3, et l'index-var t2-t3 qui l'évolution
de l'altération
du cerveau entre la date t2 et la date t3.
CA 03229337 2024-2- 16
WO 2023/021201
PCT/EP2022/073240
[00169] Sur la figure 5 est présenté l'index-19 en fonction des scores EDSS et
SSPROM mentionnés plus haut. La figure montre la corrélation existante entre
les
indicateurs EDFF et SSPROM pour les groupes AMN et les groupes placebo. La
ligne
noire indique la courbe de régression entre les indicateurs respectifs pour
tous les
patients.
[00170] Sur la figure 6 est présentée la répartition des valeurs
d'index-19 pour la
cohorte de patients sains (ici indiquée par le groupe Ref) et pour les groupes
AMN et
placebo. Sont également présentés les index-var t1-t2, index-var t1-t3 et
index-var t2-
t3 pour les groupes AMN et placebo. La figure montre les différences notables
des
1.0 valeurs de l'index et de l'index-var entre les différents groupes. En
particulier, après
administration du traitement, l'évolution de l'altération est bien moins
importante chez
le groupe AMN que chez le groupe placebo. Ceci implique, outre que le
traitement a
un effet sur la démyélinisation, que le biomarqueur utilisé ici, en
l'occurrence la
diffusion radiale, est sensible à l'état d'altération de la myéline. Cette
sensibilité est en
outre remarquable sur l'indicateur statique où la répartition des valeurs de
l'index
montre une nette différence entre un patient sains et un patient atteint
d'AMN.
26
CA 03229337 2024-2- 16