Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
i30064~
La présente demande est une division de la demande
canadienne No. 551.349, deposee le 9 novembre 1987 et
relative à un nouveau procédé de préparation de 5,6-dihy-
droxyindoles.
Le 5,6-dihydroxyindole est bien connu dans l'état
de la technique pour jouer un rôle prépondérant dans la
mélanogénèse. Il interviendrait dans le processus de la
formation des eumélanines à partir de la 3,4-dihydroxy-
phénylalanine [J. Biol. Chem. 172,83 (1948); Nature 276,627
(1978)].
Le 5,6-dihydroxyindole a éte decrit et utilise
dans des compositions tinctoriaies pour la teinture des
fibres keratiniques et en particulier des cheveux humains.
Ceci fait notamment l'objet des brevets français Nos.
1.133.594, 1.264.707, 2,390.158 au nom de la Demanderesse et
No. 2.536.993.
Les procedes de preparation connus ne permettent
pas de preparer ce composé de manière satisfaisante, tout au
moins à une echelle industrielle à partir de matières
20 premières peu chères.
Les procédes de preparation du 5,6-dihydroxyindole
couramment cites mettent en oeuvre le 2,~ -dinitrostyrène
disubstitue en position 4 et 5, et repondant à la formule:
R ~ CH=CH-NO2
R ~ NO2 ~I)
13006~3
dans laquelle R désigne un groupement acetoxy, benzyloxy ou
hydroxy.
Le 5,6-dihydroxyindo]e est prepare à partir de ces
composés par des procedes comportant une ou deux etapes.
Les procedes en une etape mettent en oeuvre une
reduction cyclisante par l'hydrogène en presence d'un
catalyseur tel que le palladium sur charbon dans le cas où R
designe un groupement hydroxy.
Les procedes connus à deux etapes sont essen-
tiellement les suivants:
Dans un premier temps, par reduction cyclisante,on prepare le 5,6- diacetoxyindole et le 5,6-dibenzyl-
oxyindole. Dans le cas du 5,6-dibenzyloxyindole la reduction
cyclisante est effectuee par le fer en presence d'acide
acetique. Dans un deuxième temps, le 5,6-dihydroxyindole est
obtenu:
- soit par desacetylation du 5,6-diacetoxyindole.
Cette operation effectuee en milieu alcalin ne permet pas
d'obtenir le compose attendu dans de bonnes conditions,
compte tenu de son oxydabilite et ceci malgre la presence
d'antioxydant tel que : Na2S2O4,
- soit par debenzylation du 5,6-dibenzyloxindole
sous pression d'hydrogène en presence de catalyseur tel que
le palladium sur charbon. J.C.S. 2223 (1948); J. of
heterocyclic compounds 2, 387 (1965).
L'ordre des etapes peut être inverse, on peut en
effet dans un premier temps preparer le 4,5-dihydroxy 2, ~ -
dinitrostyrène:
- soit par desacetylation du 4,5-diacetoxy 2, ~ -
dinitrostyrène,
13~0643
- soit par débenzylation du 4,5-dibenzyloxy 2, ~ -
dinitrostyrène, dans ce cas la débenzylation est effectuée
par l'acide trifluoroacétique. Dans un deuxième temps le
5,6-dihydroxyindole est obtenu à partir du 4,5-dihydroxy 2,~-
dinitrostyrène comme indiqué ci-dessus (brevet américain No.
4.595.765).
L'utilisation des composes de formule (I) à titre
de produit de depart, presente cependant d'autres problèmes.
Les préparations de ces composés sont, soit longues et
délicates à mettre en oeuvre, sur des quantités importantes,
à partir du pipéronal qui est le composé industriel le plus
couramment envisagé, soit effectuées à partir d'un composé
industriel plus onereux, le 4,5-dihydroxybenzaldehyde.
On peut citer à ce sujet les procédés décrits dans
J.C.S. 2223 (1948); Chem. Ber. 93,1318 (1960); J. of
heterocycl. Compounds 2,387 (1965); J.O.C. 45,2750 (1980); le
brevet américain No. 4.595.765; Synthetic Communications 15,
321-329 (1985).
Les différents procédes de l'état de la technique
de préparation du 5,6-dihydroxyindole mettent en oeuvre sept
à huit etapes lorsque le compose est prepare à partir du
pipéronal, soit cinq étapes lorsqu'il est préparé à partir du
4,5-dihydroxybenzaldéhyde.
La Demanderesse a découvert un procédé de
préparation du 5,6-dihydroxyindole et de son dérive 3-alkyle
à partir d'un composé chimique nouveau, répondant à la
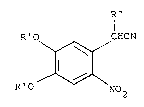
formule: R"
I
R'O ~ CHCN (II)
~
R'O No2
~006~3
dans laquelle R' désigne un atome d'hydrogène ou un
groupement benzyle, et R" désigne un atome d'hydrogène ou un
groupement alkyle, de préférence en Cl-C4. Dans le cas où le
groupement R' est un groupement benzyle, il n'est pas
nécessaire d'opérer en deux étapes comme dans le cas du
composé (I) dans lequel R désigne un groupement benzyloxy.
La presente lnvention vise les intermediaires de
synthèse permettant de préparer le 5,6-dihydroxyindole ou son
derive 3-alkylé et répondant en particulier à la formule (II)
ci-dessus.
L'invention a également pour objet un procédé de
préparation des composés de formule (II).
La preparation du 5,6-dihydroxyindole ou de son
derive 3-alkylé à partir du composé de formule (II) est
realisee en soumettant le compose de formule (II) à l'action
de l'hydrogène sous pression, ou à une operation de transfert
d'hydrogène, en milieu solvant et en presence d'un catalyseur
d'hydrogenation.
L'action de l'hydrogène est effectuee sous une
20pression comprise de preférence entre 105 et 106 Pascals et
plus preferablement entre 4x105 et 6x105 Pascals.
Le catalyseur d'hydrogenation peut être constitue
par exemple par du palladium ou du rhodium sur un support tel
que du charbon.
Les solvants ou melanges de solvants utilises ne
participent pas à la reaction et sont choisis par exemple
parmi les alcools tels que le methanol, l'ethanol, l'isopro-
panol; les esters tels que l'acetate d'ethyle ou d'isopro-
1~'3006'~3
pyle, ou bien encore parmi le dimethylformamide, le
tetrahydrofuranne, le dioxanne, ie diglyme. On peut egalement
utiliser ces solvants en melange avec de l'eau.
La température de reaction est de preference
comprise entre 50 et 150~, et en particulier entre ~0 et
100~.
La reaction par transfert d'hydrogene met en
oeuvre un agent de transfert tel que du cyclohexène, en
presence d'un catalyseur d'hydrogenation comme par exemple du
10 palladium ou du rhodium sur un support inerteet de preference
sur charbon contenant 3 à 10~ de metal, en presence d'un
solvant ou d'un melange de solvants tels que definis
ci-dessus.
Grâce à ce procédé, il est possible de preparer le
5,6-dihydroxyindole suivant un procedé en une etape de
debenzylation et de cyclisation, en partant plus particuliè-
rement du 4,5-dibenzyloxy 2-nitrophenylacetonitrile couver~
par la formule (II).
La mise en oeuvre de la reduction catalytique
20 debenzylante ou non, permet l'obtention de quantites
importantes de produit et la reaction par transfert
d'hydrogène ne necessite pas l'utilisation d'un materiel
particulier.
Au cours de la mise en oeuvre du procede de
preparation du 5,6-dihydroxyindole ou de son derive 3-alkyle,
la Demanderesse a constate la formation d'un autre interme-
diaire nouveau, le 2-amino 4,5-dihydroxyphenylacetonitrile de
formule (III):
1300~43
HO ~ CHCN
HO ~ NH2 (III)
dans laquelle R" désigne un atome d'hydrogène ou un
groupement alkyle.
Le 2-amino 4,5-dihydroxyphénylacétonitrile de
formule (III) peut être isolé si au cours de la mise en
oeuvre du procédé, on opère à une temperature comprise entre
20 et 50~C au cours de l'hydrogenation catalytique du compose
de formule (II).
Le prbcédé de préparation des composés de formule
(II), conforme à l'invention, est essentiellement caractéri-
sée par le fait que:
a) pour la préparation d'un composé de formule
(II) dans laquelle R' désigne un radical benzyle et R"
désigne un atome d'hydrogène, on fait réagir sur le
4,5-dihydroxyphénylacétonitrile de formule:
HO ~ CH2CN
~ (V)
HO
un halogénure de benzyle en présence d'un solvant et d'un
milieu alcalin pour obtenir le 4,5-dibenzyloxyphénylacétoni-
trile de formule:
Bz O ~
~ 11 (VI)
BzO ~
.
130064;3
que l'on soumet à une réaction de nitration;
b) pour la preparation d'un composé de formule(II) dans laquelle R' et R" représentent chacun un atome
d'hydrogène, on soumet le composé obtenu à l'étape (a) à une
réaction de débenzylation par transfert d'hydrogène; ou
c) pour la préparation d'un composé de formule
(II) dans laquelle R" désigne un groupement alkyle, on fait
réagir sur le composé obtenu à l'étape (a) un halogénure
d'alkyle en milieu solvant et en présence d'un agent alcalin
pour obtenir un composé de for~ule (II) dans laquelle R'
désigne un radical benzyle et R" désigne un groupement
alkyle, que l'on soumet le cas échéant à une réaction de
débenzylation par transfert d'hydrogène pour obtenir un
composé de formule (II) dans laquelle R' désigne un atome
d'hydrogène et R" désigne un radical alkyle.
Le schéma réactionnel est le suivant:
CH30~f H2CN HO~ CH2CN BzO~CH2CN
CH3 ~ EtaDe 1~ ~ EtaDe 2
(IV) (V)(VI)
~0
BzO ~CH2CN HO ~,CH2CN
Etape 3> ~ Eta~e 4~
BzO N~2 Ho ~ ~02
II - R' = Benzyle(Bz)II - R ' = H
R~ = H/ R" = H
/
R " "
XR / BzO ~ CH-CNHO ~ r ~ CRH-CN
Etape 5) BzO N~2Eta~e 6~ HO'' N~2
I I - R" = alXyleII - R" = alkyle
R' = 3z . R' = H
--7--
i3(~0~;43
Il est à noter que le composé intermédiaire de
formule (II) est préparé, conformément à l'invention, à
partir de l'homovératronitrile qui est un produit industriel
peu onéreux, ce qui constitue un autre avantage de l'in-
vention.
Etape 1: Le 4,5-dihydroxyphénylacétonitrile de formule (V)
peut être préparé par déméthylation de l'homovératronitrile
au moyen de chlorhydrate de pyridine. Le rendement de cet-te
réaction est particulièrement amélioré en préparant in situ
10 le chlorhydrate de pyridine et en le régénérant au fur et à
mesure de l'avancement de la réaction par ajout d'acide
chlorhydrique gazeux au milieu réactionnel constitué
initialement par un mélange d'homovératronitrile et de
pyridine dans les proportions d'environ 2 moles de pyridine
pour 1 mole d'homovératronitrile. Cette facon de procéder
permet notamment d'éviter une manipulation du chlorhydrate de
pyridine (hygroscopique et onéreux) et permet une économie en
quantité de moles de chlorhydrate de pyridine par mole
d'homovératronitrile. L'extraction du composé de formule (V)
20 par un solvant organique nécessite, à rendement égal, une
quantité inférieure de solvant d'extraction.
Etapes 2 et 3: On fait réagir sur le 4,5-dihydroxy-phenyl-
acétonitrile de formule (V), un halogénure de benzyle en
présence d'un solvant comme par exemple le diméthylformamide
et d'un agent alcalin tel que du carbonate de potassium, pour
obtenir le 4,5-dibenzyl-oxyphénylacétonitrile répondant à la
formule (VI). Ce composé est ensuite nitré, scit par de
l'acide nitrique concentré dans l'acide acétique, soit par de
13()0643
l'acide nltrique dilué pour obtenir le 4,5-dibenzyloxy
2-nitro phénylacétonitrile de formule (II) dans laquelle R'
désigne benzyle et R" désigne hydrogène.
Etape 4: Le 4,5-dihydroxy 2-nitrophénylacétonitrile peut
etre préparé par débenzyla-tion du 4,5-dibenzyloxy 2-nitro-
phenylacétonitrile en milieu alcoolique ou hydroalcoolique,
par transfert d'hydrogène. On utilise de préférence le
cyclohexène comme agent de transfert en présence d'un
catalyseur tel que le palladium sur charbon.
Le temps de réaction est d'environ 1 heure à 1
heure 30.
Etape 5: On soumet le composé de formule (II) (R'= benzyl et
R" = hydrogène) à un traitement par un halogenure d'alkyle et
de preference un iodure d'alkyle en Cl-C4, en presence d'un
agent alcalin tel que le carbonate de potassium et d'un
solvant comme le dimethylformamide, le formamide ou la
N-methylpyrrolidone. On obtient le compose de for~ule (II),
dans lequel R" désigne alkyle en Cl-C4.
Etape 6: On procède comme decrit à l'étape 4 par débenzyla-
tion du composé de formule (II) dans laquelle R' désigne
benzyle et R" un groupement alkyle. On obtient le composé de
formule tII) dans laquelle R' désigne hydrogène et R" désigne
alkyle.
Le procédé conforme à l'invention permet ainsi de
préparer avec un bon rendement (60 à 75~) le composé de
formule (II) à partir de l'homoveratronitrile par des
operations chimiques simples.
_g_
1300643
Le 5,6-dihydroxyindole ou son derive 3-alkyle
prepare à partir du compose de formule (II) est particulière-
ment approprie pour etre utilisé dans des compositi,ons
tinctoriales pour fibres keratiniques humaines et plus
particulièrement pour la teinture des cheveux humains.
Les exemples suivants sont destlnes à illustrer
l'invention sans pour autant presenter un caractère
limitatif.
EXEMPLES DE PREPARATION
EXEMPLE 1
Preparation du 4,5 dihydroxyphenylacetonitrile (V)
On fait barboter de l'acide chlorhydrique gazeux
dans une suspension de 2 moles (354 g) d'homoveratronitrile
dans 161 ml de pyridine sous agitation et atmosphère d'azote.
Dès que la temperature atteint 115 C et se stabilise, on
arrête le barbotagei le milieu reactionel est chau~fe à 170~C
pendant 3 heures. Pendant cette periode, on fait barboter de
l'acide chlorhydrique pendant 5 à 10 minutes toutes les
demi-heures environ. La reaction terminee, le milieu
reactionnel est verse dans un melange glace/eau (1,2 kg).
Le compose attendu est extrait à l'acetate
' d'ethyle. Les phases acetate d'ethyle sont rassemblees lavees
a l'eau et sechees sur sulfate de soude. Après evapora-tion
de l'acetate d'ethyle sous vide, on obtient 292 g du produit
attendu. Il fond à 125 C.
L'extrait sec ainsi obtenu est directement
utilisable pour l'etape suivante.
--10--
~3()0643
EXEMPLE 2
Préparation du 4,5-dibenzyloxyphénylacétonitrile (VI)
On porte à 105-110~C pendant 30 minutes envircn,
le mélange cons-titué d'une mole (149 g) de 4,5-dihydroxyphé-
nylacétonitrile préparé à l'étape 1, de deux moles de
carbonate de potassium (276 g) et de 2,2 moles (278,5 g) de
chlo~re de benzyle dans 745 ml de diméthylformamide. A la
fin de la réaction, le mélange réactionnel est dilué par 2,5
kg d'un mélange glace/eau, neutralisé à l'acide chlor-
hydrique, sous vive agitation. Le produit attendu, qui aprécipité, est essoré, lavé à l'eau, réempâté dans l'éthanol
puis dans l'éther isopropylique.
Après séchage, on obtient 270 g du produit
attendu. Il fond à 58~C.
Le produit ainsi obtenu est directement utilisable
pour l'étape suivante:
L'analyse d'un échantillon recristallisé de
l'ether isopropylique donne les résultats suivants:
Analyse Calculé pour Trouvé
22 19 2
C 80,22 80,26
H 5,81 5,81
N 4,25 4,20
O 9,72 9,80
EXEMPLE 3
Preparation du 2-nitro 4,5-dibenzyloxyphenylacétonitrile
(composé de formule (II) avec R' = benzyle)
A/ par nitration dans l'acide acétique
On prépare une solution de 0,22 mole (72,4 g) de 4,5-dibenzy-
loxyphénylacétonitrile dans 300 ml d'acide acétique.
130~)643
On ajoute goutte à goutte 22 ml d'acide nitrique (d = 1,52).
La température atteint 31 C. Après la fin de l'exother-
micité, on agite 15 minutes supplementaires. Après
refroidissement du milieu réactionnel, le produit attendu
précipite. On obtient après essorage, lavage à l'acide
acétique, à l'é-ther isopropylique, puis séchage, 65,8 g du
produit attendu, qui fond à 124~C.
B/ par nitration à l'acide nitrique dilué
A 40 ml d'acide nitrique (d = 1,40) et 40 ml d'eau, on ajoute
par portion, sous agitation 0,05 mole (16,45 g) de 4,5-
dibenzyloxyphénylacétonitrile à une température de 63~C-65~C.
Le produit precipite au fur et à mesure de l'ajout. Après 10
minutes d'agitation supplémentaire à 60~C, le milieu
réactionnel est refroidi. Le précipite est essore, lavé à
l'eau puis séché sous vide en présence de pentaoxyde de
phosphore. On obtient 18,3 g de produit attendu qui fond à
-; 124~C.
Le composé peut être avantageusement recristallisé
de l'acide acetique ou de l'acetate d'ethyle.
L'analyse d'un echantillon recristallise de
l'ethanol donne les resultats suivants:
AnalyseCalcule pour Trouve
C22H18N2~4
C 70,58 70,50
H 4,85 4,82
N 7,48 7,35
O 17,09 17,05
-12-
1~006~3
EXEMPLE 4
Préparation du 2-nitro 4,5-dihydroxyphénylacétonitrile
A 30 ml d'éthanol à 96 additionnes de 15 ml de
cyclohexène, on ajoute sous agitation 0,75 g de palladium à
10~ sur charbon additionne de 3 g de charbon, puis 0,02 mole
(7,5 g) de 2-nitro 4,5-dibenzyloxyphenylacetonitrile; le
melange réactionnel est chauffé 1 heure au reflux.
On élimine le catalyseur par filtration. Après
evaporation au 1/4 du filtrat, puis dilution par l'eau, le
produit attendu précipite. On obtient apres essorage, lavage
a l'eau puis séchage, 3 g du produit attendu; il fond à
186~C.
Après recristallisation d'un mélange ethanol-eau,
-~ puis eau, l'analyse élementaire donne les resultats suivants:
Analyse Calcule pour Trouve
C8H6N204
C 49,48 49,33
H 3,09 3,11
N 14,43 14,42
20 O 32,99 32,80
EXEMPLE 5
Préparation du 5,6-dihydroxyindole
A/ par transfert d'hydrogene
A 300 ml d'isopropanol additionnés de 200 ml de cyclohexène
et de 30 ml d'eau, on ajoute sous agitation 0,2 mole (74,8 g)
de 2-nitro 4,5-dibenzyloxyphénylacétonitrile preparé a
l'exemple 3 et 44,6 g de palladium à 10~ sur charbon; le
melange reactionnel est chauffe 4 heures au reflux.
-13-
~3001643
On élimine le catalyseur par filtration. On
évapore à sec le filtrat; l'extrait sec ainsi obtenu est
dissout à chaud dans 500 ml d'éther isopropylique additionné
de charbon. On filtre à chaud; le filtrat est évaporé à sec;
l'extrait sec ainsi obtenu (24 g) est constitué par le
produit attendu. Il fond à 142~C.
B/ par réduction catalytique
On prepare dans un autoclave le milieu reactionnel en
ajoutant à 120 ml d'ethanol additionnés de 3 ml d'eau, 0,04
mole (15 g) de 2-nitro 4,5-dibenzyloxyphénylacétonitrile, 1,5
g de palladium à 10% sur charbon et 1,5 g de charbon. On
chauffe pendant 2 heures sous agitation à 80 C sous une
pression de 4.105 Pa d'hydrogène. Après refroidissement, le
mélange reactionnel, traité de la même manière que ci-dessus,
conduit avec un rendement equivalent, au 5,6-dihydroxyindole.
EXEMPLE 6
On opère de la même manière qu'indique à l'exemple
SB en remplaçant le 4,5-dibenzyloxyphenylacëtonitrile, par le
4,5-dihydroxyphenylacétonitrile.
EXEMPLE 7
Préparation du 2-amino 4,5-dihydroxyphenylacetonitrile
On opère de la même manière qu'au cours de la
préparation du 5,6-dihydroxyindole (exemple 5B), la
temperature de la reaction etant de 35~-40~C. La reaction
est arrêtee lorsque l'on n'observe plus de consommation
d'hydrogène. Après elimination du catalyseur, par filtration
à chaud, le filtrat est evaporé à sec. Il est repris par de
l'acetate d'ethyle bouillant; par filtration à chaud on
elimine un insoluble. Le filtrat ainsi obtenu est dilue par
-14-
1300643
environ 2 fois son volume d'éther de pétrole. Le produit
attendu précipite. Après essorage, puis lavage à ]'alcool
chaud, il se décompose à 200~C.
- Spectre de masse m/Z = 164 (M+)
- RMN H solvant : DMSO d6; référence : TMS
déplacements chimique ~Cn)
3,61 ppm 2H (singulet)
6,20 ppm lH (singulet)
6,SS ppm lH (singulet)
massif vers 7 ppm NH2,OH
- RMN C solvant : DMSO d6; référence TMS
déplacements chimiques (ppm)
18, 13 ppm (C7), 103,98 ppm (CS), 104,74 (Cl); 116,32 ppm
(C2); 119,24 ppm (C8); 136,S2 ppm (C3); 138,70 ppm (C6);
14S,S7 ppm (C4).
correspondant à la formule:
HO ~ CH - CN
HO ~ \NH2
EXEMPLE 8
Préparation du 2'-(2-nitro 4,S dibenzyloxy)phényl propio-
nitrile
A 0,27 mole (100 g) de 2-nitro-4,S dibenzyloxy
acétonitrile et 44,3 g de carbonate de potassium dans S00 ml
30 de diméthylformamide, porté à 35 C, on ajoute goutte à goutte
1300643
en 2 heures, 45,5 g d'iodure de méthyle la température étant
maintenue entre 38 C et 40 C. Le chauffage est maintenu une
heure après la fin de l'addition. Le melange réactionnel est
refroidi puis dilue, avec précaution, par un mélange
glace-eau. Le produit attendu precipite. Après essorage,
lavage à l'eau jusqu'à neutralite, puis séchage sous vide en
présence de P2O5, il est cristallisé dans l'acide acétique.
Il fond à 145 C.
L'analyse du produit obtenu donne les résultats
10 suivants:
Analyse Calculé pour Trouve
C23H20N2~4 '
C 71,12 71,16
H 5,19 5,17
N 7,21 7,16
16,48 16,46
EXEMPLE 9
Preparation du _-méthyl 5,6-dihydroxyindole
On porte sous une pression de 7 bars d'hydrogène
le milieu reactionnel préparé par ajout à 300 ml de méthanol
de 0,77 mole (300 g) de 2'-(2-nitro-4,5-diben~yloxy)phenyl-
propionitrile et de 60 g de palladium à 10~ sur charbon et
50% humide. L'exothermicité est très vive et la température
est maintenue à 100 C par refroidissement. Après 1 h 30 à
90~C, la consommation d'hydrogène cesse. Le milieu
réactionnel refroidi est filtré sous azote afin d'éliminer le
catalyseur. Le filtrat évapore à sec est partiellement
dissout à chaud en présence de noir animal dans l'éther
~300Ç;43
isopropylique. Après filtration, le filtrat est evapore à
sec. L'extrait sec ainsi obtenu après sechage sous vide, puis
cristallisation, fond à 152~C.
L'analyse du produit obtenu donne ]es resultats
suivants:
AnalyseCalculé pour Trouvé
9 9 2
C 66,25 66,23
H 5,52 5,53
N 8,58 8,65
0 19,63 19,48