Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
1338ol5
CETTE DEMANDE EST UNE DIVISION DE
LA DEMANDE CANADIENNE NO 577.078
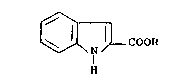
- La présente invention concerne un procédé de
synthèse industrielle du perindopril de formule (I):
~(S)
~ (S~ ~L(S)
\~ N COOH
I (S) (S)
~C - CH - NH - C H - CO OC2H~ (I)
Cl13 Cl12CH2CH~
ou acide {[(éthoxy carbonyl) - l butylamine - (S)] -
2 propionyl - (S)} - l octahydroindole carboxylique
- 2 (2S, 3aS, 7aS) et son sel de tert.butylamine.
Le composé de formule (I) ainsi que ses sels
d'addition et plus particulièrement, son sel de
tert.butylamine possèdent des propriétés
pharmacologiques intéressantes. Ils exercent une
activité inhibitrice sur certaines enzymes, comme
les carboxypeptidases, les enképhalinases ou la
kininase II. Ils inhibent notamment, la
transformation du décapeptide angiotensine I en
l'octapeptide angiotensine II, responsable dans
certains cas de l'hypertension artérielle, en
agissant sur l'enzyme de conversion.
L'emploi en thérapeutique de ces composés
permet donc de réduire ou même supprimer l'activité
de ces enzymes responsables de la maladie
hypertensive ou de l'insuffisance cardiaque.
En particulier, le composé de formule (I) se
distingue des autres inhibiteurs d'enzyme de
conversion par l'intensitë et la durée de son
action.
1 3380 1 5
i
Le composé de formule (I), sa préparation et son utillsation en
thérapeutique ont ~té décrlts dans le brevet européen n 0 049 658. ~,t,'
'''.
Toutefols, la préparation industrlelle d'un dérlvé tel que le d~rlvé de
formule (I) nécesslte une étude approfondie de toutes les' étapes
réactlonnelles, du cholx des matières premières, des réactifs, et des
~olvants permettant d'obtenir les rendements optima.
La demanderesse a découvert un procédé de synthèse du dériv~ de formule
(I) dans lequel 'ces condltions ont été réunles par l'utilisation d'un
ensemble de techniques et procédés particullèrement intéressants.
o En particulier, une des matières premlères utilisables pour la
préparatlon des composés de formule (I) est l'aclde perhydroindole
carboxyllque - 2, décrlt dans la demande de brevet européen n 0 037 231
ou l'un de ses esters, de ~ormule (II) : ;
6 ~ ~ '
7 N ~COOR (Il)
où R signifie un atome d'hydrogène, un groupement alcoyle inf~rieur ou
benzyle.
Le composé de formule (II) existe sous forme de quatre paires de
racémiques :
les deux épimères cis IIa et IIb,
les deux épimères trans IIc et IId,
3 1 33801 5
~ 11
N ~ COOR
H H COOR H H H
(~) IIa (~) IIb
cis, endo cis, exo
2S, 3aS, 7aS ou 2S, 3aR, 7aR ou
2R, 3aR, 7aR 2R, 3aS, 7aS
H H
H ~ N ~ H
H H 5 H
(~) IIc (~) IId
trans a trans ~
2S, 3aS, 7aR ou 2R, 3aS, 7aR ou
2R, 3aR, 7aS 2S, 3aR, 7aS
La préparation d'un composé de formule (II)
peut être réalisée par des techniques bien connues
de l'art antérieur (EP 0.037.231 du 28 janvier 1987,
titulaire Warner-Lambert Company, EP 0.084.164 du 27
juillet 1983, Hoechst Aktiengesellschaft,
EP 0.115.345 du 8 août 1984, Hoechst
Aktiengesellschaft, EP 0.173.199 du 5 mars 1986,
Hoechst Aktiengesellschaft, EP 0.132.580 du
13 février 1985, Hoechst Aktiengesellschaft).
Toutefois, l'isomère spécifiquement utilisé
dans la synthèse du composé de formule (I), eu égard
à sa structure est l'acide perhydroindole
carboxylique - 2 (2S, 3aS, 7aS) de formule (IIaS):
H
~ 'S (IIaS)
¦ ~ H
" ~` N ~
S I ~ COOH
1 3380 1 5
La préparation de l'acide perhydroindole
carboxyllque - 2 (2S, 3aS, 7aS) peut etre réalisee
selon des techniques décrites dans l'art anterieur
(EP 0.037.231, EP 0.115.345, EP 0.173.199, EP
0.13Z.580).
Certa;nes d'entre ell es utilise~t comme
matiere premiere l'acide indole c3~0xylique - 2 qui
a l'avantage d'etre une matiere premiere facilement
disponible et relativement peu onereuse (EP 0.037.231
du 28 janvier 1987, titulaire Warner-Lambert
Company), lequel est soumis a reduction catalytique
sur rhodium pour donner un melange des deux isomeres
cis endo de configuration respective (2S, 3aS, 7aS)
et (2R, 3aR, 7aR).
Cependant, la separation de l'isomere (2S,
3aS, 7aS) utile dans la synthese du derive de formule
(I) de l'isomère (2R, 3aR, 7aR), necessite generale-
ment l'emploi de methodes dont la mise en oeuvre est
particulierement laborieuse.
Ainsi, le brevet n 0.037.231, pour
réaliser cette séparation des isomeres (2S, 3aS, 7aS)
et 2R, 3aR, 7aR) (cis, endo racemique) utilise de
nombreuses etapes necessitant la synthese du derive N
- benzoyle, la cristall~sation fractionnee du sel du
diastereoisomere avec la S ~ phenyl-ethylamine, la
liberation des deux dérivés SSS et RRR N benzoylés,
puis l'élimination du groupement benzoyle suivi d'un
passage sur colonne échangeuse d'ions et d'une
recristallisation.
La demande de brevet européen n 0.115.345
publiée le 8 août 1984, Hoechst Aktiengesellschaft
pour cette même separation, utilise plusieurs etapes
nécessitant l'esterification de la fonction acide
carboxylique par l'alcool benzylique, la salification
de l'amino ester par la N benzyloxycarbonyl - (S)
phenylalanine, la separation par cristallisation
4a
. 1 3380 ~
fractionnee de l'isomère S,S,S, 1a liberation de la
fonction aminée optionnellement suivie de la.libera-
tion du groupement ac;de carboxylique.
La demanderesse pour synthétiser indus-
5 triellement le derive de formule (I), utilise un
procede original de synthese de l'acide perhydro-
indole carboxylique - 2 (2S, 3aS, 7aS) presentant
egalement l'avantage d'utiliser comme matiere premie-
re l'acide indole carboxy.lique - 2, mais qui n'offre
pas l'inconvenient de cette laborieuse separation des
deux isomeres (2S, 3aS, 7aS) et (2R, 3aR, 7aR)
puisque l'acide indole carboxylique - 2 est, dans un
premier temps réduit en acide indoline carboxylique -
2, pour donner un mélange d'acide indoline carboxyli-
que 2R et 2S lesquels sont aisément sépares en uneseule etape, par cr;stallisation fractionnee. L'iso-
mere 2S est ensuite soumis a hydrogenation catalyti-
que pour conduire
,
~ 5 1 33801 5
stéréosélectivement à l'acide perhydroindole
carboxylique - 2 (2S, 3aS, 7aS).
Plus particulièrement, la synthèse industrielle
de l'acide perhydroindole carboxylique - 2 (2S, 3aS,
7aS) utilisée pour la synthèse industrielle du
dérivé de formule (I) par la demanderesse met en
oeuvre comme matière première l'acide indole
carboxylique - 2, ou l'un de ses esters de formule
(III):
~ COOR (III)
dans laquelle R représente un atome d'hydrogène, un
groupement alcoyle inférieur,
lequel est soumis à réduction par un procédé tel que
l'utilisation du couple étain/acide chlorhydrique,
préférentiellement en milieu d'alcool aliphatique
inférieur, préférentiellement à température ambiante
en acide indoline carboxylique - 2 (R, S) ou l'un de
ses esters de formule (IV):
~ ~ (R,S) (IV)
COOR
dans laquelle R a la même signification que dans la
formule (III),
qui lorsque R = H, est l'acide indoline carboxylique
- 2 de formule (V),
qui lorsque R est différent de H est transformé par
hydrolyse alcaline en acide indoline carboxylique
- 2 de formule (V):
~,~
'~
6 '..
1 33~01 5
~ ~ ~? 5) (V)
constitu~ en fait, par un mélange de deux lsorn~res qelon que le carbone
porteur du carboxyle se trouve : .
- dans la configuration R (isomère R),
- dans la configuration S (isomère S),
m~lange dont on isole l'isomère S par addltlon du dlt mélange à une
solution de ( + ) ~ méthyl benzylamine dans un alcool aliphatlque
inférieur, pour obtenir un précipité du sel de l'acide indoline
carboxylique - 2 (S) avec 1' a méthyl benzylamine,
qui, après filtration, est dissous dans l'eau, la solutlon obtenue étant
alors acldifiée pour permettre la libératLon de l'acide indoline - 2 (S)
carboxylique,
lequel après filtratlon et lavage, est soumis à hydrogénation catalytique,
sous une pression d'hydrogène comprise entre 10 et 150 bars,
préférentiellement choisie entre 20 et 60 bars,
en chauffant à une température comprise entre 30 et 100 C,
préférentiellement comprise entre 40 et 80 C,
.
le catalyseur étant choisi parmi le rhodium, le palladium, le platine ou
le nickel en mélange à un support tel que le charbon, de façon à permettre
l'obtention d'un taux maximal d'acide perhydroindole carboxylique - 2 (2S,
3aS, 7aS), celui-ci étant séparé de l'isomère (2S, 3aR, 7aR) obtenu en
faible proportion par une cristallisation unique dans un solvant polaire
rigoureusement sélectionné parmi alcool aliphatique inférieur,
,, , . . . .. . . . . . . , .. ~ . . . .. . . " . . ~ . . ..... . . . . ... .. . . . . . .
.
7 1 3380 1 5
acétonitrlle, acétate d'éthyle, dioxanne seul ou en mélange à l'eau, ou en
mélange entre eux et à l'eau, à condltion que le mélange obtenu soit
monophasique
La seaonde matlère première utilisée pour la synthèse du o~ro~ de
formule (I), selon l'inventlon est le dérivé de formule (VI) :
(~,S) (R,S)
* ~ CH2Cf~2CH3
~0 - OC - CH - NH - ~H - CO - OC2Hs (YI)
C113
Le composé de formule (VI) existe sous forme de quatre stéréoisomères
que l'on peut désigner par (R,R) ; (R,S) ; (S,R) ou (S,S) selon la
oonflguration des deux carbones dlts asymétriques
Or, le composé de formule (I) le plus actif est celui pour lequel les
deux carbones de la chaîne latérale ont tous deux la oonfiguration S.
C'e-~t la raison pour laquelle le procédé de synthèse industrielle du
dérivé de formule (I) selon l'invention s'intéresse exclusivement à la
synthèse industrlelle du composé de formule (VI) dans lequel les deux
carbones asymétriques O11t tous deux la configuration S.
Aucun procédé de synthèse industrielle spécifique du dérivé de formule
(VI) n'a été décrit. On connaît la demande de brevet européen n 0 117
488, très générale, qui utilise des trifluorométhane sulfonates a
carboxylés Toutefois, la stéréochimie des deux produits de départ doit
être rigoureusement choisie afin d'obtenir le diastéréoisomère voulu duproduit de formule (I)
Il est par ailleurs connu de l'homme de l'Art que, de façon très
générale, pour permettre la séparation de diastéréoisomères obtenus au
cours de synthèses où la stéréochimie des mc1tières pren.1.ères n'est pas
préalablement fixée, on a recours à des techniques classiques telles que
cristallisation fractionnée ou chromatographie ~ur colonne de silice.
t :r ~ . r ~
1 33801 5
.. -,
La demanderesse utllise pour la synthèse industrielle du dérivé de
formule (I), un procédé de synthèse industrielle du dérivé de formule (VI)
très intéressant car d'une part particulièrement simple à mettre en
oeuvre, et qui d'autre part permet par un choix Judicieux des réacti~s
(catalyseur3 et solvants) utllisés l'obtention directe du diastéréoisomère
(S, S) avec de~ rendements lndustriellement très intéressants.
En outre, la synthèse selon le procédé de l'invention présente
l'avantage d'utiliser comme matières premières des dérivés peu coûteux, ce
qui, industriellement est d'importance.
Plus particulièrement, le procédé utilisé par la demanderesse pour la
synthèse industrielle du dérivé de formule (I) utilise comme produit de
départ un dérivé d'acide aminé naturel, de formule (VII) :
~112CI12CH3
1-l2N - CH - C0 - Oll (VII)
( ) ''
dans lequel le carbone asymétrlque a la configuration S puisqu'il est blen
connu de l'homme de l'Art que le carbone porteur du carboxyle des amino
acides naturels a la configuration S (cystéine exceptée),
que l'on traite, en présence d'un catalyseur d'estérLfication acide, et
préférentiellement de chlorure de thionyle, par l'éthanol,
industriellement dlsponible à bas prix,
pour donner l' ester de ~ormule (VIII) :
CH2CH2CH3
H2N - CH - C0 - 0C2H5 (VIII)
(S)
lequel est condensé sous hydrogénation catalytique,
- 1338015
~OU8 une pression d'hydrogène comprise entre 10 et 150 bars,
préf~rentiellement choisie entre 20 et 60 bars, préférentiellement à
temp~rature ambiante,
le catalyseur étant cholsi parmi le rhodium, le palladium, le platlne ou
le nickel en mélange à un support tel que le charbon, catalyseur
soigneusement sélectionné de ~açon à orienter la sélectivité de la
réaction, permettant ainsi l'obtention d'un taux maxlmal du
diastéréoisomère (S, S),
,
avec l'acide pyruvique CH3 - CO - COOH, produit naturel, peu couteux,
LO industriellement disponible, pour conduire directement, après simple
cristalllsation dans un solvant soigneusement choisi parmi alcool
aliphatique inférieur, acétonitrile, acétate d'éthyle, dioxanne seul ou en
mélange à l'eau, ou en mélange entre eux et à l'eau, à condition que le
mélange obtenu soit monophasique, refroidissement et filtration,
au seul diastéréoisomère (S, S~ du dérivé de formule (~I).
L'étape finale de synthèse industrielle du dérivé de formule (I) selon
l'invention consiste en la condensatlon du dérivé de formule (IIaS), dont
on a protégé préalablement la fonction acide carboxylique par
estérification par un alcool EOH ou E représente préférentiellement un
groupement alcoyle inférieur linéaire ou ramifié ou benzylique en présence
d'un catalyseur d'estérlfication acide, pour donner un ester de l'acide
perhydroindole carboxylique - 2 (2S, 3aS, 7aS) de ~ormule (IX) :
S
, ~ H (IX)
~5 1 S Coo
H H
1 33801 5
`_ ~s
lequel eQt directement condensé au d~riv~ de formule (VI) en milieu
aloal~n en pr~sence d'un catalyseur de synthèse peptidlque oomme la ;~
dlcyolohexylcarbodi~mide pour conduire au dériv~ de formule (X) : ;
~(S)
~ ~L(S) . ,,
(S) (S) (X)
, C--C H--I`J H--C H--C O O C2 H ,~
CH, CH j!CH ICH3 .
dans laquclle E a la m~me sLgnirication que dans la formuel ~IX),
. ,
qui est soumis à déprotection du groupement carboxylique de l'hétérocycle,
pour conduire au d~rivé de formule (I) sous forme de base, .
laquelle est dis~oute dans un solvant ohoisi parmi alcool allphatique
inférieur, scétonitrlle, acétate d'~thyle, dioxanne seul, ou en r~lAnge
entre eux, avant add~tlon de tert.butylamine,
le sel ainsi obtenu étant cristallis~ par chauffage du milieu réactionnel,
filtration à chaud, refroidissement et essorage final.
L'exemple suivant illustre l'invention, mais ne la limite en aucune
façon.
EXEMPLE : SYNrIIESE INDUSTnT~ DU SEL DE TE~T.BUTYr-A~T~-F DE
L'ACIDE [(ETHOXYCARBONYL) - 1 (S) BUTYLAMINO - 2 (S)
PROPIONYL] - 1 OCTAHYDROINDOECE CARRox~-TQuE - 2 (2S,
3aS,7aS)
STADE 1 : ACIDE OCTAIIYD~OINDOLE CARRoxyLlQlJE - 2 (2S, 3aS, 7aS)
STADE lA : Ethoxycarbonyl - 2 indole
Chauffer à ébullition 5 kg de carboxy - 2 indole, mis en sUspenSion
dans l'éthanol en présence d'acide sulfurique durant 8 heures. Evaporer
~ . . . . . . . . . . .. ..
1 1
1 3380 1 5
Evaporer l'acétate d'éthyle, reprendre la masse crLstalllne par
l'hexane. Apres essorage et séchage, on obtient 5,3 kg de cristaux.
Point de fusion : 123 - 125 C
MicroanalYse :
Calculé : C ~ 69,83 H % 5,86 N % 7,40
Trouvé : C % 69,56 H % 5,74 N % 7,30
'':
Soectrométrle dans l'in~ra-rou~e :
2150 cm~1 (NH)
1680 cm~1 (acide carboxylique)
0 STADE 1B : Ethoxycarbonyl - 2 (R, S) indoline
Dans un réacteur mettre en suspension 10 kg d'éthoxycarbonyl - 2
indoline obtenue précédemment dans 110 lltres d'éthanol chlorhydrique.
AJouter ensuite, 20 kg d'étaln en grenaille. Maintenir sous agitation à
température ambiante pendant 2 Jours environ.
L5 Evaporer l'éthanol, reprendre le résidu par l'eau et aJouter 110 litresde toluène. Agiter 20 mlnutes environ. Alcaliniser par l'ammoniaque.
Décanter la phase aqueuse et l'extraire une nouYelle fois par 150 litres
de toluène.
Réunir les phases toluéniques et les laver à l'eau. Décanter les phases
toluéniques, filtrer. Eliminer l'eau par distiLlation de l'azéotrope eau
toluène Refroidir et faire passer un couran-t d'HCl gazeux anhydre.
Refroidir. Evaporer, et laver par du toluène pur.
1 33 8 o l 5
Polds obtenu : 10,11 kg ;~
Rendement : 84
Chromato~raphle sur couche mince :
Solvant : toluène : 10
acétate d'éthyle : 5 i
Support : silice 60 F 254 MERCK
Révélateur : UV
Rf.: 0,55
STADE 1C : Carboxy - 2 (R, S) indollne
;
0 2,15 kg d'éthoxy carbonyl - 2 (R, S) indoline en solution dans
l'éthanol sont saponifiés par 12,5 litres de soude N, sous agitation
pendant 24 heures. Après lavage de la solution alcaline, neutraliser par
l'acide chlorhydrlque concentré. Après essorage, lavage, séchage, on
obtient 1,57 kg de cristaux blancs du produit attendu.
Rendement : 86 %.
Point de fusion : 188 - 189 C
SDectrométrie dans l'in~ra-rou~e :
NH2+ : 2500 - 2000 cm~l
COO~ : 1620 cm~1
STADE lD : Carboxy - 2 (S) indoline
6,05 kg de (R, S) carboxy - 2 indoline sont a~outés à une solution de
4,49 kg de ( + ) ~méthyl benzylamine dans l'éthanol anhydre. On obtient
un produit précipité blanc qui, après essorage est digéré dans l'isopropa-
1 33801 5
t
nol chauff~ au reflux. Apr~s rerroidissement, on essore, lave aveo un peud'lsopropanol ; les cristaux blancs obtenus sont séchés : 3,68 kg.
Pouvoir rotatoire : -
l~2l= - 5,3(c= 1 %é~hanon
La (S) carboxy - 2 indoline est préparée avec un rendement quantitatif
par dissolution de .l kg du sel précédent dans 5 litres d'eau et
neutralisation par une solution aqueuse d'aclde chlorhydrique. Ce
précipité est essoré, lavé à l'eau et séché.
,
STADE 1E : Acide octahydroindole carboxylique - 2 (2S, 3aS, 7aS)
o Dans une cuve, placer 25 kg d'acide lndollne carboxyllque - 2 (S),
précédemment obtenus dans llO litres de méthanol. Maintenlr sous
agltation. Dans un mélangeur, charger le catalyc3ellr au rhodlum (5 % sec).
Dans un hydrogénateur, mettre l'agitation en route, charger la
suspension méthanollque d'aclde indoline carboxylique - 2 (S) en la
faisant translter par le mélangeur et rincer l'ensemble à l'eau. Chauffer
à 60C et mettre en presslon d'hydrogène (30 bars).
Flltrer le catalyseur sur flltre monoplaque. Recuellllr les Jus
hydroalcoollques dans un réacteur, et évaporer le méthanol sous vlde.
Après concentration, charger 300 kg environ de dioxanne. Porter à
ébullition et ajouter de d'eau Jusqu'à l'obtention d'une solution. Laisser
refroidir. Essorer et sécher.
On obtient 22,3 kg de cristaux.
Rendement : 86,l %.
14
~ 3380 1 5
STADE 2 : N - ~(S) c~nBerl~oxy - 1 B~rYL] (S)
STADE 2A : Chlorhydrate de L - Norvalinate d'éthyle
.
Dans un réacteur, plaoer 35 kg de L - Norvaline dans 300 kg. environ
d'éthanol dénaturé. Introduire lentement et progressivement 60 kg environ
de chlorure de thlonyle.
Après un quart d'heure d'agitation, ohauffer au rePlux pendant 3
heures, puis évaporer l'éthanol sous vide. j,
Reprendre le résidu par 300 litres de cyolohexane, et porter à
ébullition. Laisser refroidir, filtrer, laver au cy¢lohexane et sécher. On
obtient 52,9 kg de chlorhydrate de L - Norvalinate d'éthyle, soit un
rendement de 97,6 ~.
Le produit ainsi obtenu est utilisé tel quel au stade suivant.
STADE 2B : N - [(S) carbéthoxy - 1 butyl] (S) alanine
Dans une cuve équipée d'un agitateur placer 4,5 kg de chlorhydrate de
L - Norvalinate d'éthyle obtenu au stade précédent, et environ 110 litres
d'eau.
Alcaliniser, verser ensuite trè~ progressivement 23 kg d'acide
pyruvique dans la solution précédemment obtenue et agiter le milieu
réactionnel pendant 30 minutes.
Placer dans un appareil à hydrogéner du charbon palladié à 5~ en
suspension dans l'eau et la solution alcaline de L - Norvalinate d'éthyle
précédemment obtenue.
Hydrogéner sous pression (30 bars) à température ambiante pendant une
~ournée environ.
1 3380 t 5
_ , .
Filtrer sou~ vlde, et évaporer le filtrat sou~ pression réduite,
e~orer et ~éoher. rraiter le rés~du obtenu p~r de l'éthanol ; éliminer
l'insoluble, constLtué de chlorure de sodium, par filtratlon et le rincer
à l'~thanol. Réunir les solutlons éthanoliques ; évaporer l'éthanol sous
pression réduite et, cristalliser le résidu clans l'acétonitrile.
On obtient 34,3 kg de N - [(S) carbéthoxy - 1 butyl] - (S) alanine,
soit un rendement de 63,9~.
S~ADE 3 : SEL ~E TEIIT.BUTYL~MINE DE L'ACIDE {[(ETHOXYCARBONYL) - 1
B~rYLAMlNO - (S)] - 2 PROPIONYL - (S)} - 1 OCTAHYDROINDOLE
CARBOXYLIQUE - 2 (2S, 3aS, 7aS)
STADE 3A : Para toluène sulfonate de l'ester benzylique de l'acide
octahydroindole carboxylique - 2 - (2S, 3aS, 7aS)
Dans un réacteur de 30 litres, chauffer à reflux 12,5 kg d'a¢ide
perhydroindole carboxylique - 2 (2S, 3aS, 7aS), 50 kg d'acide para toluène
~ulfonique et 14,2 kg d'alcool benzylique et 38,4 kg de toluène en
éliminant l'eau formée à l'aide d'un décanteur en continu. Lorsqu'il ne
d~cante plus d'eau, refroidir, essorer le précipité formé, et aécher.
Rendement : 91,3 ~
STADE 3B : Ester benzylique de l'acide ~[(~thoxyoarbonyl) - 1
butylamino - (S)] - 2 propionyl (S)} - 1 octahydroindole
carboxylique - 2 (ZS, 3aS, 7aS)
Dans une suspension de 5 kg environ de para toluène sulfonate de
l'ester benzylique de l'acide octahydroindole carboxylique - 2 (2S, 3aS,
7aS) dans 60 kg environ d'acétate d'éthyle, a~outer 3,5 kg environ de
triéthylamine puis 6 kg environ d'hydroxy - 1 benzotriazole, 7,5 kg
environ de N - [(S) carbéthoxy - 1 butyl~ - (S) alanine obtenue au stade 2
et 7,0 kg environ de dicyclohexyl carbodiimide.
16
1 33 8 0 1 5
Agiter, en refroidissant légèrement pendant 3 heure-~ environ, pu$s
flltrer la dicyclohexylurée formée par f$1tration et laver la phase
organique par l'eau. La phase organique séchée est évaporée à sec.
Rendement : 92,3 ~
STADE 3C : Acide ~[(éthoxycarbonyl) - 1 butylamino - (S)] - 2
propionyl (S)} - 1 octahydroindole carboxyllque - 2 (2S,
3aS, 7aS)
DanQ un hydrog~nateur, dissoudre 14 kg d'ester benzyl~que de l'aclde
([(éthoxycarbonyl) - 1 butylamino - (S)] - 2 propionyl (S)}
octahydroindole carboxylique - 2 (2S, 3aS, 7aS), obtenu au stade précédent
dans le cyclohexane.
A~outer le charbon palladié à 5 ~, et 50 litres d'eau environ.
Hydrogéner à température et pression ordinaires ~usqu'à absorption du
volume théorique d'hydrogène. Filtrer, laver l'insoluble au cyclohexane,
décanter la phase organique, et laver la phase aqueuse à nouveau au
cyclohexane. Isoler le produit par lyophilisation de la phase aqueuse.
STADE 3D : Sel de tert.butylamine de l'acide ~[(éthoxycarbonyl) - 1
butylamino - (S)] - 2 propionyl (S)~ - 1 octahydroindole
carboxylique - 2 (2S, 3aS, 7aS)
Dans un r~a¢teur placer 140 litres environ d'a¢étate d'éthyle et 10 kg
d'acide {[(éthoxycarbonyl) - 1 butylamino - (S)] - 2 propionyl (S)} - 1 de
l'acide octahydroindole carboxylique - 2 (2S, 3aS, 7aS) obtenu
précédemment. Additionner progressivement 2,20 kg environ de
tert.butylamine, porter à reflux ~usqu'à dissolution totale ; filtrer.
Refroidir, filtrer et sécher~
Rendement : 95 %