Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
La présente invat~tion est relative à l'utilisation
de dérivés de pyrimidine ~-oxyde pour freiner la chute des
cheveux et aux composition: contenant ces dérivés, destinées
à être appliquées de façon topique sur le cuir chevelu.
On recherche depuis de nombreuses années des
composés efficaces au niveau du traitement de la chute des
cheveux sans présenter cependant d'effets secondaires qui
pourraient être gênants lors d'une application prolongée.
On connaît en particulier des compositions à base
de mucopolysaccharides utilisées pour freiner la chute des
cheveux.
La Demanderesse a découvert de nouve,ux dérivés de
pyrimidine 3-oxyde particulièrement efficaces pour freiner la
chute des cheveux. Elle a constaté en particulier une
augmentation du nombre de cheveux en phase anagène ou en
phase de croissance et une diminution du nombre de cheveux en
phase telogène ou en phase terminale du cheveu.
L'augmentation du rapport de nombre de cheveux en phase
anagène par rapport au nombre de cheveux en phase telogène
est une indication de l'effet de ces composés sur le
traitement de la chute des cheveux. Ces composés ont par
ailleurs l'avantage de ne pas présenter d'effets secondaires
pouvant être gênants lors d'une application prolongée.
La présente invention a donc pour objet
l'utilisation de dérivés de pyrimidine 3-oxyde pour freiner
la chute des cheveux.
L'invention a également pour objet de nouvelles
compositions topiques destinées à être utilisées pour freiner
la chute des cheveux.
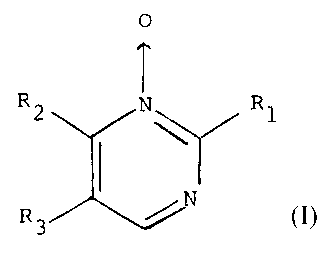
Les composés utilisés conformément à l'invention
pour freiner la chute des cheveux répondent à la formule
générale
- 1 -
E°:.
'~Q~7~ 91
l.)
w...
R2 tJ R1
(I)
R3
dans laquelle
R1 désigne un groupement méthyle ou NHRq dans
lequel R4 désigne un atome d'hydrogène ou un groupement
alkyle en C1-Cq;
R2 désigne un atome d'hydrogène ou t~_z groupement
NHRq dans lequel Rq a la méme signification que ci-dessus, R2
pouvant également désigner un groupement méthyle lorsque R1
désigne un groupement méthyle, sous réserve que R2 ne peut
désigner un atome d'hydrogène lorsque R1 désigne NH2; et
R3 désigne un atome d'hydrogène ou d'halogène, un
groupement nitro ou amino, ou un groupement alkyle en C1-Cq
pouvant porter éventuellement:
- un groupement OR5 dans lequel R5 désigne un
groupement alkyle en C1-Cq, ou
- un noyau benzénique éventuellement substitué par
un ou plusieurs groupements alcoxy en C1-Cq
et leur sels d'addition d'acides physiologiquement
acceptables.
Un groupement alkyle désigne de préférence,
conformément à l'invention, un groupèment méthyle ou éthyle,
le groupement alcoxy désigne de préférence méthoxy ou éthoxy,
les atomes d'halogène désignent de préférence chlore ou
brome.
Les composés préférés utilisables conformément à
l'invention sont les composés répondant à la formule (I) dans
' - 2 -
~~~7~ 1
laquelle R1 et R2 désignent des groupements amino, et R3
désigne un atome d'hydrogène ou de chlore.
Les composés répo~,<iant à la formule générale (I)
peuvent être obtenus par exemple, par hydrogénolyse, en
présence de palladium sur charbon, de composés répondant à la
formule (II) définie ci-dessous dans laquelle Z désigne un
atome d'halogène et de préférence chlore ou brome.
La réduction est effectuée suivant la méthode
classique décrite dans la littérature (D.J. BROWN, The
pyrimidines, supplement II, Vol. 16, chapitre X, page 360,
Interscience Pub. 1985; COWDEN and WARING, Aust. J. Chem.
34, 1539 (1981)) selon le schéma réactionnel suivant
0
0
R
N' R1 R2 N R1
Pd / C
N
R3 ~ H~ R3 / N
Z
(II) (I)
Les composés de formule (I) peuvent également être
utilisés sous forme de leurs sels d'addition d'acides
physiologiquement acceptables tels que les sels d'acide
sulfurique, chlorhydrique, phosphorique, acétique, benzoïque,
salicylique, glycolique, acéturique, succinique, nicotinique,
tartrique, maléïque, pamoïque, méthane'sulfonique, picrique,
lactique, d'aminoacides et plus particulièrement d'acide
acéturique.
Ces composés sont généralement utilisés pour le
traitement de la chute du cheveu dans des compositions
pouvant se présenter sous forme de lotion, de shampooing, de
gel, de mousse, d'émulsion, de dispersion vésiculaire, de
savon, de spray ou de mousse aérosol.
_ _ 3 _
Les composition: destinées à une application
topique sont essentiellement caractérisées par le fait
qu'elles contiennent, dans un milieu physiologiquement
acceptable approprié pour une application topique, au moins
un composé répondant à la formule (I) ci-dessus ou l'un de
ses sels d'addition d'acides physiologiquement acceptables.
Le composé de formule (I) est présent dans des
proportions comprises de préférence entre 0,1 et 10 $ en
poids, et plus préférablement entre 0,2 et 5 ~ en poids, par
rapport au poids total de la composition.
Le milieu physiologiquement acceptable peut être
constitué par tout milieu approprié pour une application
topique soit en cosmétique, soit en pharmacie qui soit
compatible avec la substance active. Les composés conformes à
l'invention peuvent se trouver dans ce milieu soit à l'état
dissous, soit à l'état dispersés, notamment sous forme
micronisée.
Le milieu physiologiquement acceptable peut être
constitué par de l'eau ou un mélange d'eau et d'un solvant ou
un mélange de solvants. Les solvants sont choisis parmi les
solvants organiques acceptables sur le plan cosmétique ou
pharmaceutique et choisis plus particulièrement parmi les
alcools inférieurs en C1-C4 comme l'alcool éthylique,
l'alcool isopropylique, l'alcool , tertiobutylique,~ les
alkylèneglycols, les alkyléthers d'alkylèneglycols et de
dialkylèneglycols tels que ' le monoéthyléther
d'éthylèneglycol, le monométhyléther de propylèneglycol, le
monoéthyléther de diéthylèneglycol. Les solvants, lorsqu'ils
sont présents le sont dans des proportions comprises entre 1
et 80 ~ en poids, par rapport au poids total de la
composition.
~'::~, _
'~~~~'~ 91
Le milieu peut être épaissi à l'aide d'agents
épaississants habituellemnt utilisés en cosmétique ou en
pharmacie.
Les épaississants sont présents de préférence dans
des proportions comprises entre 0,1 et 5 ~ en poids, et en
particulier entre 0,4 et 3 ~ en poids, par rapport au poids
total de la composition.
Ces compositions peuvent également renfermer
- des oligosaccharides estérifiés tels que ceux
décrits dans les demandes européennes publiées sous les Nos.
64 012 et 211 610;
- des dérivés d'acide hexosaccharique tels que ceux
décrits dans la demande européenne publiée sous le
. N° 375 388, en particulier l'acide glucosaccharique;
- des inhibiteurs de glycosidase tels que ceux
décrits dans la demande européenne publiée sous le
N° 334 586, en particulier le D-glucaro 1,5-lactame;
- des inhibiteurs de glycosaminoglycanase et
protéoglycanase tels que ceux cités dans la demande
européenne publiée sous le N° 277 428, en particulier la L
galactono 1,4-lactone;
- des inhibiteurs de tyrosine kinase tels que ceux
décrits dans la demande européenne publiée sous le
N° 403 238, en particulier le 1-amido 1-cyano-(3,4-
dihydroxyphényl)éthylène; ,
- des hyperémiants tels que
. les esters d'acide nicotinique dont plus
particulièrement les nicotinates de benzyle et d'alkyle en
Cl-C6 et notamment le nicotinate de méthyle, de benzyle,
ainsi que le nicotinate de tocophérol;
. les bases de xanthine dont plus
particulièrement la caféine et la théophylline;
_ 5 - e
. la capsicine;
- des filtres W-A et UV-B comme les
méthoxycinnamates, les dérivés de benzophénone;
- des inhibiteurs de la phosphodiestérase tels que
la VISNADINE~;
- des activateurs de l'adénine cyclase tels que le
Forskolin;
- des antioxydants et capteurs de rs;ücaux libres,
en particulier
. des radicaux OH tels que le DMSO;
. l'a-tocophérol, BHA, BHT;
la superoxyde dismutase (SOD);
- des agents antipelliculaires tels que l'omadine,
l'octopirox;
- des agents hydratants tels que l'urée, la
glycérine, l'acide lactique, les a-hydroxyacides, la
thiamorpholinone et ses dérivés, des lactones;
- les agents antiséborrhéiques tels que la S
carboxyméthylcystéine, la S-benzylcystéamine et leurs
dérivés, la thioxolone;
- les anti-inflammatoires stéroïdiens et non
stéroïdiens tels que l'hydrocortisone, la bétaméthasone, la
dexaméthasone, l'acide niflumique;
- les antiandrogènes e~ hormones tels que
l'estriol, l'estradiol, la thyroxine, l'oxendolone, le
diéthylstilbestrol;
- les rétinoïdes dont plus particulièrement l'acide
t-trans rétinoïque appelé encore trétinoïne, l'isotrétinoïne,
le rétinol ou vitamine A et ses dérivés, tels que l'acétate,
le palmitate ou le propionate, le motretinide, l'étretinate,
le t-trans rétinoate de zinc;
- 6 -
~o~~~ 9
- les antibactériens choisis plus particulièrement
parmi les macrolides, les pyranosides et les tétracyclines,
et notamment l'érythromycine;
- les antagonistes de calcium dont on pe t citer la
Cinnarizine et le Diltiazem à titre d'exe pies non
limitatifs;
- des phospholipides tels que la lécithi._e;
- le diazoxyde (3-méthyl 7-chloro[2H]benzothia-
diazine-1,2,4 dioxyde-1,1);
- les acides linoléïque et linolénique;
- l'anthraline et ses dérivés;
- l'acide 5-alkanoyl salicylique et ses dérivés
tels que décrits dans le brevet français N° 2 581 542;
. - des activateurs de pénétration tels que le THF,
le 1,4-dioxane, l'alcool oléique, la 2-pyrrolidone, le
salicylate de benzyle, etc.;
- des vitamines ou provitamines telles que la (3-
carotène, la biotine, le panthénol et ses dérivés, la
vitamine C, les vitamines B2, B4, B6.
Ces compositions peuvent également contenir de
l'AMP cyclique, le MPS.
Ces compositions peuvent également contenir des
agnts conservateurs, des agents stabilisants, des agents
régulateurs de pH, des agents modificateurs de pression
osmotique, des agents émulsifiants et des parfums.
Les composés conformes à l'invention peuvent
également être associés à des agents tensio-actifs dont
notamment ceux choisis parmi les agents tensio-actifs non
ioniques et amphotères.
Parmi les tensio-actifs non ioniques, on citera les
polyhydroxypropyléthers décrits notamment dans les brevets
français Nos. 1 477 048; 2 091 516; 2 169 787; 2 328 763 et
- 7 _
2 574 786; les alkyl(Cg-C9)phénoloxyéthylénés comportant de 1
à 100 moles d'oxyde d'éthylène et de préférence 5 à 35 moles
d'oxyde d'éthylène; les alkylpolyglycosides de formule
CnH2n+1(C6H1005)xH (III)
dans laquelle n varie de 8 à 15 inclus et x de 1 à 10 inclus.
Parmi les agents tensio-actifs amp~.otères, on
citera plus particulièrement les amphocarboxyglycinates et
les amphocarboxypropionates définis dans le dictionnaire
CTFA, Sème édition, 1982, et vendus, notamment, sous la
marque de commerce MIRANOL par la Société MLR.ANOL.
Les composés selon l'invention peuvent être
introduits dans des supports qui améliorent encore l'activité
au niveau de la repousse, en présentant à la fois des
propriétés avantageuses sur le plan cosmétique, telles que
des mélanges volatils ternaires d'alkyléther
d'alkylèneglycols, en particulier d'alkyle en C1-C4,
d'alkylène en C1-C4 gycol ou de dialkylèneglycol, de
préférence de dialkylène en C1-C4 glycol, d'alcool éthylique
et d'eau; les alkyléthers d'alkylène glycols préférés sont
les monoéthyléthers de l'éthylène glycol, le monométhyléther
du propylèneglycol, le monométhyléther du diéthylèneglycol.
On peut également utiliser des tensio-actifs
cationiques et/ou anioniques.
Les composés conformes à l'invention peuvent
également être introduits dans des supports gélifiés ou
épaissis, tels que des supports essentiellement aqueux
gélifiés par des hétérobiopolysaccharides, tels que la gomme
de xanthane, les scléroglucanes ou les dérivés de cellulose,
en particulier les éthers de cellulose, des supports
hydroalcooliques gélifiés par des polyhydroxyéthylacrylates
ou méthacrylates ou des supports essentiellement aqueux
épaissis en particulier par des acides polyacryliques
i~. - 8
.~-:.
réticulés par un agent polyfonctionnel, tel que les CARBOPOL
(marque de commerce) vendus par la Société GOODRICH.
L'invention vise également un procédé de traitement
cosmétique des cheveux ou du cuir chevelu, consistant à leur
appliquer au moins une composition telle que définie ci-
dessus, en vue d'améliorer l'esthétique de la chevelure.
Le traitement consiste principalement à appliquer
sur les zones alopéciques du cuir chevelu d'un individu, la
composition telle que définie ci-dessus.
Le mode d'application préféré consiste à appliquer
1 à 2 g de la composition sur la zone alopécique, à une
fréquence de une à deux applications par jour, pendant 1 à 7
jours par semaine et ceci pendant une durée de 1 à 6 mois.
L'invention a également pour objet une composition
destinée au traitement thérapeutique de la chute des cheveux,
notamment de l'alopécie, cette composition correspondant à la
définition des compositions à application topique définies
ci-dessus.
Les exemples suivants sont destinés à illustrer
l'invention sans pour autant présenter un carâctère
limitatif.
EXEMPLES DE COMPOSITION
EXEMPLE 1
On prépare la composition suivante
- 2,4-diamino pyrimidine 3-oxyde 3 g
- Propylène glycol 20 g
- Éthanol à 95° 30 g
- Eau
qsp 100 g
Cette composition se présente sous forme de lotion.
EXEMPLE 2
On prépare la composition suivante
- 2,4-diamino pyrimidine 3-oxyde 1,05 g
- g -
- Nicotinate de méthyle 0,105 g
- Parfum 0,26 g
- Éthanol absolu 29,5 g
- Eau
qsp 100 g
Cette composition se présente sous forme de lotion.
1 à 2 g des compositions décrites aux exemples 1 et
2 sont appliqués sur les zones alopéciques du cuir chevelu,
l'application étant éventuellement accompagnée d'un massage
pour favoriser la pénétration, à raison d'une à deux
applications par jour, pendant trois mois de traitement.
On constate une diminution de la chute des cheveux.
EXEMPLE 3
On prépare la composition suivante
- 2,4-diamino pyrimidine 3-oxyde 1,05 g
- Parfum 0, 26 g
- $thanol absolu 29,5 g
- Eau
qsp 100 g
Cette composition se présente sous forme de lotion.
EXEMPLE 4
On prpare les lotions (A) et (B) suivantes
.
LOTION (A)
- 2,4-diamino 5-chloropyrimidine 3-oxyde 1,5 g
- Propylneglycol 20 g
- thanol 30 g
- Eau purifie qsp 100 g
LOTION (B)
- Visnadine 3 g
- Propylneglycol 5 g
- thanol absolu qsp 100 g
La lotion (A) est applique le zones
matin sur les
alopciques du cuir chevelu en procdant souhait un
si
massage, suivi par l'application de la lotion(B) le
soir.
On
- 10 -
t~~
constate au bout de quelques mois de traitementune
diminution de la chute des cheveux.
EXEMPLE 5
On prpare les lotions (A) et (B) suivantes
LOTION (A)
- Acide 5-octanoyl salicylique 0,5 g
- thanol 50 g
- Eau purifie
qsp 100 g
LOTION (B)
- 2,4-diamino pyrimidine 3-oxyde 2 g
- Propylneglycol 20 g
- thanol 50 g
- Eau purifie qsp 100 g
La lotion (A) est applique le mati n sur les
zones
alopciques du cuir chevelu en procdant si souhait un
massage, suivi par l'application de la lotion(B) le
soir.
On
constate au bout de quelques mois de traitementune
diminution de la chute des cheveux.
EXEMPLE 6
On prpare les solutions (A) et (B) suivantes
SOLUTION (A)
- 2,4-diamino pyrimidine 3-oxyde 2,5 g
- Propylneglycol ~ g
- thanol absolu qsp 100 g
SOLUTION (B)
- Acide rtinoque (tout-trans) 0,05 g
- Propylneglycol ~ g
- thanol absolu qsp 100 g
Les solutions (A) et (B) sont stockes dans kit
un
deux compartiments.
- 11 -
Le mélange 50/50 des composantes (A) et (B) conduit
à 1,25 $ de 2,4-diamino pyrimidine 3-oxyde + 0,025 $ d'acide
rtinoque.
On applique ce mlange sur les zones alopciques du
cuir chevelu, sans rincer la composition aprs application.
EXEMPLE 7
On prpare la lotion suivante
- 2,4-diamino pyrimidine 3-oxyde 2,5 g
- Diltiazem 1 g
- Propylneglycol 20 g
- thanol 55 g
- Eau purifie qsp 100 g
Cette lotion est applique sur les zones
alopciques du cuir chevelu sans procder un rinage
subsquent.
EXEMPLE 8
On prpare la lotion suivante
- 2,4-diamino pyrimidine 3-oxyde 2 . g
- Hydrocortisone , 0,5 g
- Propylneglycol ~ g
- thanol absolu qsp 100 g
Cette lotion est applique sur les zones
alopciques du cuir chevelu sans procder un rinage
subsquent.
EXEMPLE 9
On prpare la composition suivante
GEL L'ANTHRALINE
- Anthraline 0,1 g
- Silice vendue sous la marque de commerce
SILICA HDK N 20 par la Socit WACKER CHEMIE 3 g
- Starate de butyle qsp 100 g
- 12 -
~~b~~~ ~ ~
On applique cette composition sur les zones
alopéciques du cuir chevelu. On laisse poser 1/2 heure le
produit.
On applique le shampooing ayant la composition
suivante
- 2,4-diamino pyrimidine 3-oxyde 1 g
- Tensio-actif non-ionique préparé par
condensation de 3,5 moles de glycidol sur
un a-diol en C11 à C14 selon le brevet
français N° 2 091 516 26 g MA
- Hydroxypropylcellulose vendue sous la
marque de commerce KLUCEL G par la
Société HERCULES 2 g
- Conservateurs qs
- Éthanol 50 g
- Eau purifiée qsp 100 g
On rince le cuir chevelu ainsi traité.
On prépare la lotion suivante
- 2,4-diamino pyrimidine 3-oxyde 1,5 g
- Biotine éthylester 1 g
- Propylèneglycol 20 g
- Éthanol
qsp 100 g
Cette lotion est appliquée sur les zones
alopéciques du cuir chevelu, sans rinçage subséquent.
On prépare le gel niosomé suivant
- 2,4-diamino pyrimidine 3-oxyde 0,5 g
- Huile essentielle d'eucalyptus 1 g
- 13 -
c ï
é0~75 9 ~
- Tensio-actif non-ionique de formule : 1,9 g
R'
R-O-CH2-CH-0-(i2H3-0)6-H
CH20H
avec R = C12H22
R'= C14H29~C16H33
selon le brevet français N° 2 465 780.
- Na-glutamate de suif hydrogéné, vendu sous
la marque de commerce ACYLGLUTAMATE HS 110
par la Société AJINOMOTO 0,1 g
- CARBOPOL (marque de commerce) 934 P vendu
par la Société B.F. GOODRICH CORPORATION 0,3 g MA
- Conservateurs qs
- Agent de neutralisation qs pH=7
- Eau purifiée
qsp 100 g
On prépare la lotion suivante
- 2,4-diamino pyrimidine 3-oxyde . 1,5 g
- Octopirox 0,2 g
- Éthanol 45 g
- Eau purifiée
qsp 100 g
Cette lotion est appliquée sur les zones
alopéciques du cuir chevelu, sans rinçage subséquent.
EXEMPLE 13
On prépare la composition suivante
- 2,4-diamino pyrimidine 3-oxyde 1 g
- Filtre solaire vendu sous la marque de
commerce UVINUL MS 40 par la Société BASF 1 g
- Vitamine F 0, 1 g
- BHA
0, 0258
- BHT 0,0258
.. - 14 -
~~~~~s~
- Tensio-actif non-ionique vendu sous la
marque de commerce POLAWAX A 31 CRODA
par la Société CRODA 0,5 g
- Éthanol 50 g
- Eau purifiée
qsp 100 g
Cette composition est introduite dans un récipient
sous pression, à raison de 95 ~ de composition pour 5 ~ de
propulseur hydrocarboné.
I1 se forme à la sortie du récipient une mousse qui
est appliquée sur les parties alopéciques du cuir chevelu.
EXEMPLE DE PRÉPARATION 1
2,4-diamino rimidine 3-oxyde
0 0
H2N ~/ N NH2 H2N N NH2
H Pd/C
2
/ N ~ / N
EtOH
C1
Ce dérivé est préparé par hydrogénolyse du 2,4-
diamino 6-chloro pyrimidine 3-oxyde.
Mode opératoire
15 g de 2,4-diamino 6-chloro pyrimidine 3-oxyde
sont dissous dans une solution contenant 5,9 g de potasse
dans 1000 cm3 d'éthanol absolu.
Après addition de 2,3 g de palladium sur charbon à
10 ~, le mélange est agité sous atmosphère d'hydrogène
pendant 2 heures.
Le catalyseur est filtré, lavé avec de l'éthanol et
la phase organique est évaporée.
Le résidu obtenu est recristallisé dans l'eau.
15 -
l.:.~di -
--°l..
On obtient 9 g de précipité blanc (67 ~ de
rendement).
F = 192°C
Analyse élémentaire : C4H6N40 H20 ; PM = 144
C H N O
Calcul 33,33 5,56 38,89 22,22
Trouv 33, 46 5, 60 39, 02 22, 50
Les spectres RMN 1H et de masse sont conformes à la
structure attendue.
EXEMPLE DE PRÉPARATION 2
2,4-diamino 5-chloro yrimidine 3-ox de
0
H2N N NH2.
/N
C1
Mode opératoire
10 g de 2,4-diamino pyrimidine 3-oxyde sont dissous
dans 600 ml de méthanol, dans un tricol de 11 muni d'un
réfrigérant, d'un thermomètre et d'une agitation mécanique.
On additionne, à température ambiante, 13,9 g de N-
chloro succinimide. On agite 3 heures à 55°C.
Le milieu rëactionnel est évaporé à sec puis repris
dans 50 ml d'eau. Le pH est ajusté à 8 par addition de soude
concentrée.
Le produit est filtré, lavé par 50 ml d'eau glacée
et recristallisé dans 50 ml d'eau.
On obtient 4,5 g de 2,4-diamino 5-chloro pyrimidine
3-oxyde.
- 16 -
~~'~~ 9 ~
Rendement = 40
F = 220°C
Analyse élémentaire : C4H5N40 Cl
C H N O C1
Calcul 28,93 3,37 33,75 12,53 21,40
Trouv 28,94 3,46 33,62 12,47 21,53
Les spectres RMN 1H et 13C ainsi que le spectre de
masse sont conformes à la structure attendue.
EXEMPLE DE PRÉPARATION 3
2,4-diamino 5-éthyl pyrimidine 3-ox de
H2N H2N
.-- H2/Pd/C ~ _ N
0 f-N \ ~ C 1 -------~ 0 E-N \
KOH/Méthanol
H2N H2N
Dans une bouteille à hydrogéner de l'appareil de
Parr, on place : .
- 1,15 g d'hydroxyde de potassium dissous dans
300 ml de méthanol
- 0,42 g de palladium sur charbon à 10
- 3 g de 2,4-diamino 5-éthyl 6-chloro pyrimidine 3-
oxyde.
On charge la bouteille à 30 psi d'hydrogène. Après
3 heures d'agitation, on purge la bouteille par de l'azote.
Le milieu réactionnel est filtré sur papier. Les filtrats
sont évaporés à sec. Le résidu est recristallisé dans l'eau
puis dans un mélange isopropanol/eau.
On obtient 800 mg de 2,4-diamino 5-éthyl pyrimidine
3-oxyde.
_ 17 _
Rendement = 33
Analyse élémentaire : C6H1pN40 ; M = 154
C H N O
Calcul 46, 75 6, 49 36, 36 10, 39
Trouv 46, 80 6, 55 36, 45 10, 47
Les spectres RMN 1H et de masse sont conformes à la
structure attendue.
EXEMPLE DE PRÉPARATION 4
2-méthyl 4-amino 5-chloro pyrimidine 3-oxyde
CH3 CH3
N N
NCS. lvf~ chanol .
-O ~-Tr ~ ~ ----~ O
H:N HZ I
On dissout 6,3 g de 2-méthyl 4-amino pyrimidine
3-oxyde dans 150 ml de méthanol. On ajoute 7,05 g de N-
chlorosuccinimide. Le milieu réactionnel est agité pendant 24
heures à température ambiante. On évapore à sec. Le résidu
est repris dans 50 ml d'acétone. Le précipité est filtré puis
repris dans 15 ml d'eau. On ajuste le pH à 8 par addition de
soude concentrée. Après 1/2 heure d'agitation, on filtre le
précipité. On recristallise dans un mélange acétonitrile/eau
(70/30) .
On obtient 1,208 de 2-méthyl 4-amino 5-chloro
pyrimidine 3-oxyde.
Rendement = 15 $
Point de fusion = 209°C
Analyse élémentaire : C5H6C1N30 ; M = 159,5
- 18 -
::.
C
H
N
O
Cl
Calcul 37, 62 3, 76 26, 33 10, 03 22, 25
Trouv 37,54 3,79 26,23 10,02 22,20
Les spectres RMN 1H et de masse sont conformes à la
structure attendue.
EXEMPLE DE PRÉPARATION 5
2,4-diamino 5-bromo pyrimidine 3-oxyde
HZN HzN
NBS, Méthanol
O ~--N ~ ~ O ~-- N
_N~
H2N H2N Br
On dissout 1 g de 2,4-diamino pyrimidine 3-oxyde
dans 60 ml de méthanol.- On ajoute 1,55 g de N
bromosuccinimide. Le milieu réactionnel est agité pendant 2
heures à 60°C. On évapore à sec. Le résidu est repris dans
5 ml d'eau. On ajuste le pH à 8 par addition de soude
concentrée. Après 1/2 heure d'agitation, le précipité est
filtré sur verre fritté, rincé par 5 ml d'eau puis par
2 x 25 ml d'acétone. On recristallise dans un mélange
éthanol/eau (50/50).
On obtient 700 mg de 2,4-diamino 5-bromo pyrimidine
3-oxyde.
Rendement = 50 $
Point de fusion : décomposition à partir de 245°C
Analyse élémentaire : C4H5BrN40 ; M = 205
C H N 0 Br
Calcul 23,41 2,44 27,32 7,80 39,02
Trouv 23,36 2,45 27,38 ~t,01 38,84
- 19 -
zr~~v5~~
Les spectres RMN 1H et de masse sont conformes à la
structure attendue.
EXEMPLE DE PRÉPARATION 6
2-méthyl 4-amino pyrimidine 3-oxyde
H2N CH3
H2/Pd/C
N
O ~--N ~ NaC03/M~hanol O~'-
CH3 H,N
Dans une bouteille à hydrogéner de l'appareil de
Parr, on place
- 3,65 g de carbonate de sodium
- 335 ml de méthanol
- 0,8 g de palladium sur charbon à 10 ~
- 5 g de 2-méthyl 4-amino 6-chloro pyrimidine 3-
oxyde.
On charge la bouteille à 30 psi d'hydrogène. Après
3 heures d'agitation, le système est purgé par de l'argon. On
filtre le milieu réactionnel sur papier filtre. Les filtrats
sont évaporés à sec. Le précipité obtenu est repris dans
50 ml d'acétonitrile bouillant. L'insoluble est filtré sur
verre fritté puis recristallisé dans 60 ml d'éthanol. On
recueille 1,l g de 2-méthyl 4-amino pyrimidine 3-oxyde.
Rendement = 28 $
Point de fusion = 246°C
Analyse élémentaire : C5H7N30 ; M = 125
C H N 0
Calcul 48, 00 5, 60 33, 60 12, 80
Trouv 47, 62 5, ~~9 33, '75 13, 00
- ~0 -
â
'~l~ï~~~'!
Les spectres RMN 1H et de masse sont conformes à la
structure attendue.
EXEMPLE DE PRÉPARATION 7
Préparation du sel de 2,4-diamino pyrimidine 3-oxyde avec
l'acide nicotinique
0
T
H2N N NH2 N
\ N.
~I
,
COOH
On recristallise dans 20 ml d'éthanol un mélange de
2 g de 2,4-diamino pyrimidine 3-oxyde et 1,71 g d'acide
nicotinique. On récupère un solide blanc que l'on sèche pour
obtenir 2,90 g de sel de 2,4-diamino pyrimidine 3-oxyde et
d'acide nicotinique.
Rendement = 78
Point de fusion = 173-176°C
Analyse élémentaire : C1pH11N503 + 0,36 H20
C H N 0
Calcul 46,93 4,55 27,34 21,02
Trouv 47, 07 4, 56 27, 49 21, 08
- 21 -
~0~~591
EXEMPLE DE PRÉPARATION 8
Préparation de l'acéturate de 2,4-diamino pyrimidine 3-oxyde
O
H2 N
'' N H,
\ , CH3CONHCHZCOOH
On recristallise dans 20 ml d'éthanol un mélange de
2 g de 2,4-diamino pyrimidine 3-oxyde et 1,62 g d'acide
acéturique. On récupère un solide blanc que l'on sèche pour
obtenir 3,5 g de sel d'acéturate de 2,4-diamino pyrimidine 3-
oxyde.
Rendement = 96 $
Point de fusion = 133--134°C
Analyse élémentaire : C8H13N504 + 0,75 H20
C H N O
Calcul 37, 42 5, 65 27, 29 29, 63
Trouv 37, 42 5, 63 27, 45 29, 92
EXEMPLE DE PRÉPARATION 9
Préparation du sel de 2,4-diamino pyrimidine 3-oxyde avec
l'acide 5-octanoyl salicylique
O
H
H2N N H
2
/ (CH~6~CH3
O
.. _ 22 _
On recristallise dans 50 ml d'éthanol un mélange de
1 g de 2,4-diamino pyrimidine 3-oxyde et 1,83 g d'acide 5-
octanoyl salicylique. On récupère un solide blanc que l'on
sèche pour obtenir 2,25 g de sel de 2,4-diamino pyrimidine 3-
oxyde et d'acide 5-octanoyl salicylique.
Rendement = 79
Point de fusion = 177°C
Analyse élémentaire : C1gH26N4p5
C H N O
Calcul 58,45 6,71 14,35 20,49
Trouv 58, 50 6, 67 14, 27 20, 63
EXEMPLE DE PRÉPARATION 10
Préparation de la 2,4-diamino 5-nitro pyrimidine 3-oxyde
O
HAN ~ HN03 (léq) O NH
HZN ~ 2
I~ NH~ H2SOe
\ N
90°C, 2h 40 41N
Mode opératoire
On dissout 2 g de 2,4-diamino pyrimidine 3-oxyde
dans 10 ml d'acide sulfurique concentré, puis on additionne
goutte à goutte et à température ambiante 5 ml d'un mélange
HN03 à 65 $ et H2S04 concentré dans les proportions HN03 .
H2S04 = 1:4. On porte la réaction à 90°C pendant 2 heures 40
minutes.
On verse le milieu réactionne:: sur 250 g de glace
pilée et on neutralise par addition de 25 g de KOH en
pastilles, puis avec 12 g de NaHC03 que l'on introduit par
petites portions à 0°C. Après filtration, le gâteau est lavé
' - 23
~Qt~'~''~ 9~
avec 3 x 100 ml d' eau et on le porte au reflux d' un mélange
EtOH/H20 (1:1). Après filtration, on sèche le solide jaune
isolé pour obtenir 1,4 g de 2,4-diamino 5-vitro pyrimidine 3-
oxyde.
Rendement = 57 $
Point de fusion supérieur à 300°C
Analyse élémentaire : C4H5N503 ; M = 171
C H N 0
Calcul 28, 08 2, 95 40, 93 28, 05
Trouv 28,28 2,91 40,92 27,86 -
J
Les spectres RMN 1H et de masse sont conformes à la
structure attendue.
- 24 -