Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
WO 93/24479 p~/FR93/oo5Q5
21~ R 13 ~ "~
, .,~ . ~ .
:
NOUVELLES QUINOLONES FLUOREES,
LEUR PROCEDE DE PREPA RATION ET
LES COM[POSITIONS PHARI~IACEUTIQUES EN RENFERMANT
:: .
La présente invention a pour objet de nouvelles quinolones et plus particulièrement des
~uinolones substituées par un cycle pipéridinique
. .
Elle a plus par~iculièremena pour objet de nouveaux acides pipéridinyl quinolone3-carboxyliques doués de propriétés antibactériennes in~eressantes ! ``
~. . ;"~,
Elle a spécifiquement pour obiel de nouveaux acides 6-fluoro 7-pipéridine quinolone
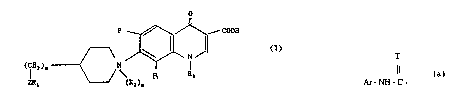
3-carboxyli~ues de formule générale I
O ,, - ,,
dans 1ayuelle
R est de l'hydrogène ou du fluor
Z est ~un radical~ amino
R1 reF~sente de l'hydrogène, un radical ~alcoyle inférieur éventuelIemen~ hydroxylé~
un radical ~acyle dériv~ d'un ~acide ~ organique carboxylique, d'un acide alcoylcarborlique~ ou d'un aclde~aryl sulfonique, ou un radical arylamino carbonyle de la
forme
Ar - N H -~C -
dans laqucllc
Ar repr~sente un radical aroma~ique7 mono ou bicyclique, éventuellement su~siitué par
un, deux ou trois substituants choisis parmi les alcoyle inférieur, les halogènes et le `
l~EUII~ 1;~ R~tlPl~EMEN~ ~`
.....
: :,
,
WO 93/24479 PCr/FR93~00505 ~:
~,~ t .!~ ~ 3 ~. !
trifluorométhyle
T représente de l'oxygène ou du soufre
m est égal à 1
X représente de l'hydrogène ou du fluor
Y représente de l'hydrogène ou du fluor
et R3 est choisi dans le groupe constitué par un radical isopropyle. un radical ~erbutyle7
un radical cyclopropyle, un radical (cyclopropyl) alcoyle, un radical phényle ou un
radical pbényle subs~itué par un, deux ou trois substituan~s définis comme
préc~demrnent
R2 représente un atome d'oxygène lié par une liaison semi-polaire
etnes~égalàOouà 1 ~ ~
,':
Parrni les composés de l'invention, on dis~ingue cinq sous-~roupes: :
- les dérivés aminé de fonnule IA
COOI~ (IA) ~;~
R~ (Cj~2) {~ \ ) R R3
:
dans laquelle ~ ~ ;
Rl représente de l'hydrog~ne, un radical alcoyle inférieur lineaire ou ramifilé, i ~-
éventuellement substitu& par un hydroxyle ou un radical acyle défini comme ci-dessus
R, R2 et n sont:définis comme pr~c~demmen~
et R3 est un radical cyclopropyle ~;
- les dérivés amin~s de ~ormule IB O
C
(CIR2) {~ \ R R3 ~
NE~1 ~R2~D ~ ~
: FEUILL~ RE~QP~CE~N~
:~
WO 93/24479 P~/FR93/OOSOS : -
2 ~ 3 2 :;
- 3 - :.
~ ' '
dans laquelle
Rl représente de l'hydrogène, un radical alcoyle inférieur, linéaire ou ramifié,éYentuellement substitué par un hydroxyle ou un radical acyle dérivé d'un acide
carboxylique, carbonique QU arylsulfonique ~:
R3 est un radical terbutyle
e~ les subs~ituants R, R2 et n sont définis comme précédemment :
- les derivés amin~s de fo~nule IC
o ..
COo~
~ NJ~I (IC)
(C~2 ) --~ N\ I ~-
R1 / (R2 )~ R~ ;
'" '~ '`
' :;`
dans laquelle
R3 repr~sente un radical isopropyle
: ~ et les substituants R, R1, R2 et n ont les significations fournies prec~emment
- les dérivés amin~s de folmule ID ~;
(ID) ~'
R1--{~ (R~)A
dans~laquelle :
R3 représente un ra~cal ph~nyle, éYentuellement subsdtu~ par un, deux ou trois
substi~uants :`
e~ Ies substiluants Rl, R2. R et n ont les si~nif~ca~ions fournics pr~c~dcmmcnl ~
~;,
~EUI~ L 1~ DE RE~IF'LACE~!~I~T
: ''~":~
~ .
WO 93~24~t79 P~/FR93/00505
3 ~
- 4 - ;
- et les dériv~s ~ninés de forznule IE
o
F ~\J~_I00~
(IE)
~CE~2 ) N
~J (R2 )n R3 : ~
dans laquelle ~ ;:
R3 représente un radical (cyclopropyl~ alcoyle d~s leqwel le reste alcoyle a de 1 à 3
atomes de carbone
et les substituants R 1, R2, R et n ont les significa~ions fournies préc~demment ~ ~
~,
Parmi les compos~s dc formulc g~nc~lc 1, lcs compos~s pour Ics4ucls ZRI CSI unc : -;
fonction ureido sont ceux 4ui sont actuellement préfér~s. :
On mettra auæi un ac~ent par~iculier sur les composés uréidiques de formule IF ^~
o
;~ ~ F
2 C N ~
R3
C ~ U ~ "
B ~ :
dans laquelle
R et R3 on~ les significations foun~ies antérieurement :;
T repr~ente de l'oxygène ou du scu~re :
W cs~ un ~ruupc ~C-H ou ~N
B es~de l'hydrogène ou une structure ar~ma~i~ue à S ou 6 chaînons ^ i
est de l'hydrogène. un radical alcoyle in~érieur, un }adical i;
,;
~UILLE DE R~MF~I~CEM~
'`'~
:` . .^
WO 93/24479 P~/FR93/00505 :~;
~. ~
2 1 1 ~
.. .
s .... .
,. ,
~ifluorométhyle ou un halogène
etpestégalà1,2ou3. ;:
Panni les composés de formule gén~rale I, les composés pour lesquels 2;R~ est une ~:
fonction ureido sont ~ux qui sont actuellement préférés.
;',',','"
Les composés selon l'mvention peuvent être salifiés par addition d'une base minérale ou
organique. I~s principaux sels utilisables sont ceux de métaux alcalins, de métaux
alcalinoterreux, d'ammonium, de fer, d'alurniniu~n, les sels d'a~eoylamines, les sels
d'hydroxyalcoylamines, les sels de phénylalcoylamines, les sels de pyridylalcoylamines,
les sels de cyclanylamines, les sels de dicyclanylalcoylan~ines ...
. .
Panni les sels, les sels de sodium, de lithium, d'ammozlium, de N.m~ylglucamine et de
trométhanol soni ceux pr~sentement préf~rés. ~ . `
Ces composés peuvent également etre salifiés par un acide minéral ou organique fort,
lo~sque Rl repr~sente de l'hydrogène, un radical alcoyle inférieur ou un raclical
~hydroxyalcoyle) inf~rieur. Panni~cellx-ci, les chlorhydrates~ les méthane sul~onate~s, les
lactates ou les acélates sont des exemples préféres. ~::
, ..
P~i les composés de formule g~nérale 1, on citera tout par~iculiè~menL ~
- I'a~cide 6.8-difluoro: 1 cyclopropyl 7-~4-~ninom~thyl p-péridinyl-l~ quinolone3-carboxyllque et s:es sels d'addidon aYec un aeide minéral ou organ~que ~ ~;
- l'acide ~f~uoro l~yclopropyl 7-(~aminom~thyl pipéridinyl-ll quinolone
3-carboxyliquG et ses seis d'addid~n aYec Ul~ acide minéral ou organique.
Les compos~s sélon l'invendon poæ~dent des p~opri~tés anubactëriennes tr~s marquées,
: : notammPnt contre les bac~éries Gram posi~if.
. . .
: , . .
~ ~., " .
l~UILLE DE ~EMPL~~ NT ~ -
.
,~ -
, ~
WO 93/24479 PCrJFR93/00505
~s~ ~ r
~s possedent, en outre, le propriété d'ê~re modérément résorbés par voie générale de
sone que leur élimination est essentiellement fécale.
lls peuvent donc être utilisés eff~cacement comme médicamen~s des infections
bactériennes du tube digestff, pour le traitement des dysenteries bactériennes, de la
diarrhée des voyageurs, ou des infections intestinales. Ils peuvent également servir par
voie topique pour le traitement des infections oculaires ou des infec~ions du condui~ ;
auditif.
,:'.'.`'
A cette fin, les composés selon l'invention seront ulilisés sous forme de compositions ;~
phiaImaceutiques dans lesquelles le principe ac~if de formule générale I ou un de ses
sels, est additionné ou mélangé avec un excipient ou un véhicule inene non-toxique
pharmaceutiquement-accept~ble.
: ~.
I~s ~ormes pharmaceutiques les plus appropri~es sonL celles destinées ià l'administration
par voie digestive comme les solutés ou suspensions buvables, les ~ranulés, les gélules,
les comprim~es nus ou enrobés, les drag~es, les sachets de poudre iaromatisée ou non,
~dulcorés ou non, les pilules ou les cache~s. ~ ~
On peu~ également utihser des solutions, des crèmes, des pommades, des sels pour ~-`
I'applica~on topique en~ qu'agen~ an~ibastérien externe.
La posologle moyenne dépend principalement de la sévérité de l'infection et de la
sensibilit~ du germe microbien à l'agent antibactérien. La posologie unitaire
~., .
s'~cheloMe de 100 i~ 600 mg par prise. La posologie journali~re s'échelonne de 200 à
120~ mg repa en 2 à 4~p~ises.
L'inven~ion conceme~ égialemena un procédé d'o~tention des composés de formule
générale I qui consiste en ce que l~on fait réagir un acide 6-fluoro 7-halogéno 1-R3
4-oxo 1,4~ihydroquinoleine 3-ciarboxylique~de formule II
::
:
.
FEUILL I~E REMPL~GEMES~
:: ;.
WO 93/2~179
PCI /FR93/01)505
?~
o
F~J~ C~0~ .,
/~N Jl (II)
~al ¦ ~`
R R3 :
dans laquelle
Hal représen~e un atome d'halogène facilement échangeable
et les sllbsdtuants E~ el R3 ont les significa~ions foumies précédemmen~
avec ia ~aminométhyl pipéndine de formule III :~
2HN - ~CEI~
~ ,
pour ~o~ner un acide 6-fluoro 1-R3 7-l4-aminométhyl pipéridinyl-1) 4-oxo
1,4-dihydroql~inoleine 3-carboxylique de formule IV
F ~J~ cooi~
2) { )~ R
. .
.~
dans !aquelle
R3 et ~ ont les significa~ions fournies précédemmerlt
: ~ que l'on:peut:si d~siré ~
. ~
- ` salifier p~r addition~d'une base min6rale ou organi~ue :
- conver~ir en sel d7addi~ion par adjonc~ion~d'un acide min~ral ou organique : ;:
N-oxyder par ae~ion d'un hydropéroxyde minéral ou organique
- alcoyler par acdon d'un halog~nure d'alcoyle en milieu basique
- ou acyler par réac~ion avec un d~iv~ ~ Ic~ionnel d'acide carboxylique ou sulfonique
ou bien encore, avec un halo~nofo~mi~lc d'alcoyl~
.~. .
~ILLE 13E ~EMPLACE~M~INT ~` ~
.,,
Wo 93/2~479
PCI~/lFRg3/00505
c;~
- a - ~.
L'invention concerne aussi un procedé pour conver~ir le composé aminé de fo~nule IV
en urée ou thiourée gui consiste à soumenre le composé de forrnule IV à l'ac~ion d'lln
isocyanate ou isothiocy~a~e de formule
Ar-N=C=T :
dans laquelle
Ar et T ont les définitiorls fournies pr~cédemmen~
en solu~ion dans un solvant inerte, pour obtenir le d~riv~ r~ inllp ~IP fnrm~ V
R3
C --- NB Ar
11 .~, .
dans la~uelle T
R, R3, T et Ar sont définis comme pr~édemment.
Les exernples suivants illustren~ l'invention sans toutefois la lirni~er
XE~PlL~
ude 6,8~difluoro 7~[4~ninométhyl) pipéridinyl~ cyclopropyl 1) 4-oxo
4-dihydroqwnoleinyl:3-carboxylique (Composé 1)
~ ~ , . . .
On chauf~e~ S heu~es au: 4~flux une solution de 3 g (0,02M) d'acide 6,8-diQuoro 7-chloro
l~ycl~p~opyl ~oxo 1,4 dihyd~quinoleine 3-carboxylique et de 3,6 g (0,03M) de
4~rninométhyl pip~ridine dans 30 ml de pyl~dine.
Au bout de cette penGde de chauffage, on reprend les ciistaux formés par 50 cm3 ` -~
d'éthanol et l'on essore le pr~ipit~ . ":.
l,e pr~cipitéi es~ mis en susper,lsîon dans 50 cm3 d'eau pendan~ 30 mn puis essoréi, laYé
I'eau, ~ thanol et s~hé. On recueille a~i 2 g de c~istaux fondant (au bloc KnMer3 :
FE~UILLE DE IREI~PLACEM T
`: ~
W~ 93/2447~ PCr/FR93/~0505
21 i ~i~ 1 3 '~ :
` . !
_ 9 _
au-dessus de 260C ~le rende~nent es~ de 50% de la ~héorie). Le specLre IR e~ lamicro-analyse sont en accord avec un produi~ anhydre. Le chlorhydrate formé par
reprise par de l'acide chlorhydrique IN (30 cm3) fon~ égalemenl au-dessus de 260C ~;
(rendemen~ 76%). Le chlorhydrate se présente sous forme de cristaux jaune pâle, ~ .
modérément solubles dasls l'eau.
'.":
De la même fa~on, on a préparé:
- l'acide ~fluoro 1-cyclopropyl 7-~4-aminométhyl pipéridinyl-l) quinolone . :~
3-carboxyli~ue (composé 5) - (F = 2~6C) avec un rendement de 75%
Le chlorhydrate ob~enu avec un rendement de 55% fond au-dessus de 260C
: : "- ~
- l'acide 6,8-difluoro 1-(2,4-difluorophényl) 7-(4-aminométhyl pipéridinyl- 1,~
quinolone 3-carboxylique - (F > 260C) avec un rendemenL de 48%
Le chlorhydrate obtenu avec un rendement de 55% fond ~ 250C
~,. :,:
- l'acide 6,8-difluoro 1-(cyclopropylméthyl) 7-(4-alminomé~hyl pipéridinyl-l) quinolone
3-carboxylique - ~F = 265C) avec un rendement de 72% ~;
Le chlorhydrate obtenu avec un rendement de 85% fond au-dessus de 260C
. . .
l'acide 6-fluoro 1-ter~utyl 7-(4-aminométhyl piperidinyl-l) 4uinolone 3-carboxyli~ue
F > 260C) avec un rendement de 24% ~ -
Le chlo hydrate obtenu avec un~rendemenl de 66% fond au-dessus de 260C
- l'aeide 6,8-fluoro ~ l-hopropyl 7-(4-aminom~thyl pi~e~idinyl~1) quinolone
3 -carboxylique (compo~ 7) - ~F = 250C) avec un rendement de 68%
chlorhydrate obtenu avec un rendement de 85% fond au-dessus de ~60C.
Les autres acides (aminomélhyl-4 pip~ridinyl)-7 quinolosle carboxyliques sont préparés -~
par ac~ion de l'aminom~thyl~ ~ pip~ridine sur les acides fluor~7 quinolone
carboxy)iques correspondan~
Ils sont isolés et ~estés sous forme de~chlorhydrates Oll de méth?ne sulfonale. - .;
','
.... ...
, .
~UILLE DE RE~PI~CEM~T
Wos3/2447s PCr/~93/00505
i 4~
- 10 -
EXEMPLE TI
Etude bactériologique des composés selon l'inven~on
Ma~riel et Méthv~es ~
Les produits ont été teslés vis-a-YiS de 7 souches de référencc
'':'
* 4 espèces à grarn positif:
~ .
- Bacillus subtilis AT(~C 9372
- Straphylococcus aureus ~TCC 25923
- Streptococcus faecalis ATCC ~043
- Staphylococcus auseus CB 951
* 3 espe~ à granl négatdf:
~ ,;
- Escherichia coli ATCC 2~922 : '
Pseudomonas aeruginosa ATCC 22853
Acinetobactercalcoaceticlls valiétéanitraturn ATCC 17903
* ~ microplaques et inoclllateur Dynatech)
; ~ ,
La mesure des concentra~ions minimales inhibitrices a été ~aile par une technique de
microdiluuon (~) ~n milieu liquide (bouillon de Mueller-Hinton~ sous un volume de 100 :
,ul et pour une gamme~de conccntrador~l allant de 128 ~ 0,06 mglL, pr~paré à partir d'une
solu~ion m~ d'antibiotique~dtrant 5~12 m~/L. La préparation de ces solutions mères
effe~tu~ea:variéselon:les~mol~culesen:~onctionde c~tères:desolubili~. :
L'inoculation se fait en aJoutant dans~ch~ue cupule 10 ~LI d'une dilu~on en eau
:physiologiqDe id'un bouillon de 18 H en~ bouillon coeur/cervelle telle que chaque cupule ``
contient environ lO6 bactérie~/mL
La concentration minimale inhlbltrice~ ~ est lue comme là première concen~rationd'an~ibio~ique ne donnant pas de culture, macroscopiquement visible après 18 H :.
d~incuba~i~n ~ 37~ ~
: ';"'
EUILLE~DEREMPLACEM~I~IT ~`
. ~ i
W~ 93/24479 PCr/FR~3~00505
21141,3~'
, - 11 - ~ ,;
lExEMpLE
Comp~imés de chlorhydrate d l'acide 7-(4-aminomethyl pipéridinyl-1~
6,8-dif1uoro 1-éthyl 4-oxo 1,4-dihydroquinoleinyl-3 c~rboxyli~ue a 250 m~ :
:,
. ~nlorhydrate de l'acide 7^(4-amillométhyl piperidinyl-l) ~:
6,8-difluoro l~cyclopropyl 4-oxo I,4-dihydroquinoleinyl-3
carboxy~que 250 g ~:
. Amidon de mais 40 g
. Amidon de blé 40 g
. Carboxyméthyl amidon 20 g ;
. Polyvidone excipient 10 g
. Cellulose micro~ristalline 30 g
. Stéarate de Magnésium 10 g
pour 1.000 comprimés fims ~u poids moyen de 0,400 g
. ~;~'";
~: Gouttes ophtalmiques à base de lactate de l'acide 7-(4~2minométhyi pipéridinyl~
6,8-difluoro I-cyclopropyl 4-oxo l,4 dihydroquinoleinyl-3 carboxylique -
:: . Lac. ^?~ de l'acide 7-(4-amLnom~hyl pipéridinyl~
.,
6,~ ~luoro 1~yclopropyl 4~xo l ~.4 dihydroquinoleinyl-3
carboxyli~ue 3 ~ .:
. Tétracémate disodique :~ 0,l g
: : . Phosphate disodiique: 0,OS g ~ ~
. Phsphate monosodique ~ 0,04 g ~::
.:Hypophosphitedesodium: 0,02g
. Méthyl paraben~ 0,015 g :
: ~ . Eau di~111~e q.s.p 100 ml ::-
: ~ :
Unè goutte con~ent 0,005 g de p~ipe ac~if.
:;
, ~
FEUILLE DE REMPLR C5~MENT `
WOg3/24479 PCr/FR93/00505
S~! j !
, '~'
a) ~ o 1 ~
1.~ ~ ~
~ ~ ~n ~ ~ -'. ~
¦ _~ 1--( C`l O _ ' ',' ~ !, ,'
U~ t ~ O O u-~ ~J ~ ~ .'~
~ .. ___ . _. .__ _ ___ - ~
A ~ O ~ ¦ O ¦ O ¦ ¦ ~ l l ¦ ¦ O ¦ O
--~ I~ . . ~
~o~ ~ lo I : l 'o I I I I ~^ I ô I ~
~1 o ~ I ~ I ¦ N ~ N ¦ ~,
a, ~ #~ L ~ ~1 A L U~
, ~ . . .. _ .____.~ I __ , r _ ~ ~ .__ ____ _ ~; i
~ ~_ ~ C~ C~ ~ ~O O ~ ', .',~
v c~l :~: ~ e~l ~ O O O _ O O " ,,
3 ~ ~ ¦ N ¦ ~ ¦ C~ t ¦ ~ ¦ ~ ¦ O ¦ C~
~ ~ ," I ~ : ~ I ô~ : A¦ ~ o I ¦ ~ I ~ I O I I C ~ ~ ,
: ~ ~ ~
~ ~ 0 A ô o -- ¦ ~ ¦ ~ ¦ ~ ¦ ~ C
1~ 1 1 I I I ~ s~
~ ~ -~ ~`~ ~ ~ I ~ I r~ I X 1 ~ I ; '~
L~ 1 ~ 1 IU~
I ~UILLE: DE IF~E~NlPL~CE~ilE~
' ~.:,`,
.,