Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
~ 94/205~ 2 1 ~ 7 7 6 -~ PCTA~V4/00256
BISTRAMIDES BIOLOGIQUEMENT ACTIFS, LEUR OBTENTION ET
LEURS APPLICATIONS EN THERAPEUTIQUE
L'invention a pour objet de nouveaux dérivés de
bistramides, leur obtention et leurs applications en
thérapeutique.
Les bistramides sont ainsi appelés par analogie
avec un organisme marin à partir duquel ils peuvent être
extraits, à savoir l'ascidie T.; ~r,r.l i nllm h;s~r~tllm qui
vit en symbiose avec ses prochlorons.
Plusieurs bistramides ont déjà été décrits. Il
s'agit en particulier des bistramides A, B et C.
Leur structure chimique, complexe, n'a été
élucidée que récemment (voir article de Foster et al.
dans J.A.C.S. 1992, 114). Elle correspond à la formule
(A) suivante:
W O 94noso3 2 15 7 7 6 ~ PCTAFR94/0025C ~
Formule A
R
R ~ ~ ~ i
19
avec Rl et R~ représentant, respectivement,
pou- le '~is._G~ide ~ L ~ 40~36
pcur le b-s~-a.mice 3
pou~ le ~is~ramlde C
~ 94/20503 2 1 ~ 7 7 6 ~ PCT~94/00~6
L'intérêt pour ces produits résulte, d'une
manière générale, de la forte activité cytostatique
qu'ils présentent en particulier ;n vi tro. Cependant,
leur cytotoxicité et leur toxicité élevées ;n vivo ne
permettent pas d'envisager la mise à profit de leurs
propriétés pour des utilisations comme médicaments.
La DLso de ces bistramides est en effet de
l'ordre de 1,7 mg/kg (mesure sur la souris, après
injection du produit par voie intraveineuse en dose
unique).
Les travaux des inventeurs sur les invertébrés
marins, en particulier sur l~ascidie T.; ~so~l i nl~m
hi ~tr~t~,m Sluiter, accompagnée ou non de ses prochlorons
symbiotes, les ont conduits à mettre au point des
conditions d'extraction spécifiques permettant d'isoler
de nouveaux bistramides présentant diverses activités
biologiques de grand intérêt.
De manière surprenante, l'étude de ces nouveaux
bistramides a montré qu'ils étaient dotés d'un effet
cytostatique in vi~ro et d'effets thérapeutiques in v;vo,
mais que, contrairement aux bistramides évoqués plus
haut, leur cytotoxicité et leur toxicité in vivo étaient
beaucoup plus faibles, voire inexistantes autorisant leur
utilisation en thérapeutique.
L'invention a donc pour but de fournir de
nouveaux dérivés présentant un squelette structural du
type des bistramides.
Elle a également pour but de fournir un procédé
d'obtention de ces produits par extraction à partir de
30 Thi ~tr~t~m et/ou de ses prochlorons.
L'invention vise également les applications
biologiques et biochimiques de ces nouveaux bistramides,
en particulier pour la thérapie de c~nc~rs, notamment, de
tumeurs h~ ~m~ ine~ solides, ou le traitement de maladies
parasitaires.
W094/20503 ; PCT~94/00~6 ~
215776~
Les bistramides de l'invention sont
caractérisés en ce que
- ils sont capables d'exercer ;n v;vo une
activité antitumorale entrainant la différenciation des
cellules tumorales, avec inhibition ~n vitro de
l'expression de l'oncogène erb-2 normalement exprimé par
les cellules des lignées bronchopl~lmon~lres non a petites
cellules,
- leur DLso est supérieure à 30 mg/kg, voire
160 mg/kg ou plus, et
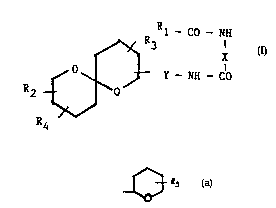
- ils répondent à la formule (I)
R 1 - C0 - NX
lS ~ Y - NN - C0 (I)
R
dans laquelle
-Rl, X, Y et R2, identiques ou différents les uns des
autres, représentent une chaîne hydrocar~onée de 1 a 20
atomes de carbone, saturée ou insaturee, substituée par
au moins un groupe -OH et/ou une fonction cétone,
comportant,
le cas échéant, au moins un cycle ~ 5 , ce cycle
pouvant comporter une ou plusieurs insaturations,
-R3, R1 et Rs, identi~ues ou différents les uns des
autres, sont choisis parmi l'hydrogène, les radicaux
alcoyle ou alcoxy de 1 a 4 atomes de carbone, un groupe
-COOH, -OH, -NH2 ou -NO2, ou un atome d'halogène, étant
entendu que, lorsque R3 et R4 représentent chacun un
~ 94,205~ ~ ~ 5 7 7 6 O PCTA~94/002~6
atome d'hydrogène, Rl et R2 ne représentent pas
respectivement de ch~;ne~
~3
CH3-CH=CH - CO - CH7 ~ol et (CH3, OH) CH - C(CH3)=
. ~ C~3
ou, CH3 - (CH ~) ~ - CO - CH~ et (CH3, OH) CH - C (CH3) =
ou encore,
~ C~3
CH3 - CH = CH - CO - CH~ ol et CH3 - CO - C (CH3) =-
On rappellera que les composés correspondant à
ces 3 exclusions sont les bistramides A, B et C de l'état
de la technique évoqué ci-dessus.
L'expression "activité antitumorale ~n v; vn"
telle qu'utilisée ci-dessus signifie qu'une inhibition de
la prolifération tumorale des cA~c~rs bronchopulmonaires
non ~ petites cellules (80% des tumeurs pulmonaires) a
été mise en évidence, sans toxicité aigue pour 1~ ~ni ~
Ces propriétés autorisent l'obtention d'un plateau
thérapeutique permettant l'accès aux normes du National
CA~cer Institute pour les produits
avec T 42 %.
C
La "DLso" des produits de l'invention a été
mesurée sur la souris après in;ection des produits par
voie intraveineuse.
Compte tenu de la valeur de la DLso des
bistramides ainsi définis, les bistramides A, B, et C
mentionnés plus haut se trouvent exclus du champ de
l'invention. On notera de plus qu'en raison de leur forte
toxicité ces bistramides A, B et C ne pourraient
conduire, pendant la durée d'un traitement, à l'obtention
des effets avantageux observés avec les produits de
l'invention.
W094/20503 215 7 7 G 0 6 PCT~94/00256 ~
L'index thérapeutique atteint une valeur de 5,0
pour certains des bistramides de l'invention.
Les bistr~mides de l'invention sont également
caractérisés en ce ~u'ils sont capables d'exercer une
activité cytostatigue vis-à-vis de parasites.
Selon une disposition préférée de l'invention,
dans la formule I ci-dessus, Rl comporte de l à 15 atomes
de carbone.
Selon une autre disposition préférée, R1
comporte une ou deux doubles liaisons éthyléniques.
R2 comprend de préférence de 6 à 10 atomes de
carbone, notAr~?nt 8 ou 9, et comporte avantageusement
une double liaison éthylénique.
Dans encore une autre disposition préférée, X
et Y comportent de 2 à 8 atomes de carbone, notamment de
2 ~ 6 atomes de carbone, en particulier de 3 à 5.
R3 et Rs représentent avantageusement, dans
l'une quelconque des dispositions qui préc~dent, un
radical alcoyle ou alcoxy, notamment de 1 ~ 4 atomes de
carbone, et R4 un atome d'hydrogène.
L'invention vise également les dérivés des
bistramides de formule I, plus particulièrement ceux
permettant leur utilisation comme prodrogues. On citera
comme exemples les esters et les éthers, notamment les
éthers d'alcoyle de 1 à 4 atomes de carbone, ou les
dérivés glycosylés.
Des bistramides particulièrement préférés,
co...~e tenu de l'intérêt de leurs propriétés
thérapeutiques in v~vo qui seront exposées dans la suite
de la description, sont choisis parmi
- le bistramide D, de formule (II)
~ H
¦ H (II)
~H ~
~ g4,20503 ~ 1 ~ 7 7 6 ~ ~ ~/FRg4/002S6
- le bistramide L de formule (III)
10 1 1 ~
~ ~ (III)
- et tout spécialement le bistramide K de formule (IV)
~0 ,~
~y
OH ~
Les formes enantiomères ou diastéréoisomeres,
seules ou en mélanges, des bistramides définis ci-dessus
font également partie de l'invention.
On notera que ces bistramides peuvent exister
sous une forme déshydratée.
La ~o~n~icsance de la formule chimique de ces
produits permet de recourir aux proc~c de synthese
chimique pour leur obtention.
wo g4/205~ 2 i ~ 7 7 6 ~ PCT~4/00256 ~
Il est également possible d'obtenir le
bistramide D par hémisynthèse à partir du bistramide A
dont la fonction cétone a, ~-insaturée en position 4 est
particulièrement réactive et peut être hydroxylée par
réaction avec un agent réducteur. Des modifications des
chaînes de substitution peuvent être ensuite apportées en
op~rant selon des mé~ho~c connues.
On remarquera que la transformation par
hémisynthèses du bistramide A toxique en bistramide D
moins toxique représente une étape essentielle de la
présente invention qui correspond au schéma suivant :
0~
1 5 ~J
OH
Bistrarnide A
age~lt
réducteur
~f~
0
H OH
Ri ~tr~mi~ n
De plus, le rendement d'extraction du
bistramide A à partir de l'ascidie est de l'ordre de
0,1 %, alors qu'il n'est que de 0,021 % pour le
bistramide D. La réaction de réduction conduit, en
proportion équivalente, aux deux épimères du carbone 4,
dont l'un correspond au bistramide D. Cette étape
s'effectue avec un rendement moyen de 70 %, ce qui
revient donc à multiplier la quantité de bistramide D
g4,20503 2 ~ ~ 7 7 ~ ~ ~ 4/00256
disponible par un facteur d'environ 1,7 (soit 3,5 pour
les 2 épimères).
L'invention vlse également les bistramides tels
qu'obtenus par extraction à partir de T, h; ~tr~tllm et/ou
de ses prochlorons, et les dérivés de ces bistramides.
Ce procédé d'extraction comprend des
fractionnements successifs par chromatographie à partir
d'un extrait organique de r. hi str~t1~m et/ou de ses
prochlorons. Ces fractionnements sont réalisés en mettant
en oeuvre les opérations suivantes :
- chromatographie liquide basse pression de
l'extrait organique sec pour éliminer au moins la majeure
partie des impuretés ayant une polarité supérieure ou
inférieure à celles des produits recherchés,
- chromatographie liquide haute pression des
fractions riches en bistramides, de manière à obtenir des
fractions enrichies en un bistramide donné, et
avantageusement,
- purification de ces fractions par
chromatographie liquide haute pression pour isoler
sélectivement un bistramide donné.
La nature du support des colonnes de
chromatographie et sa granulométrie, ainsi que le ou les
mélanges de solvants utilisés sont choisis de manière à
séparer sélectivement en peu d'étapes les bistramides
biologiquement actifs. Les deux premiers fractionnements
sont avantageusement réalisés sur des colonnes de silice
en utilisant des solvants du type de l'acétate d'éthyle,
dichlorom~thane, avantagell e~ent additionnés de méthanol.
Dans l'étape de purification finale des
fractions, on utilise de l'eau avec des solvants du type
du méthanol, du dichlorom~thane ou de l'acétonitrile.
L'élution peut être réalisée selon un gradient,
ou en variante de manière isocratique.
Les fractions telles qu'isolées à chaque étape
sont également visées par l'invention.
W094/20503 PCT~R94/00256 ~
~, _
~1~77~ lo
L'extrait organique auquel est appliquée cette
succession d'étapes de fractionn~?nts est obtenu par le
traitement de poudre lyophilisée de T.. h 7 ~tr~tl~7n et/ou de
ses prochlorons avec du dichlorométhane.
Les prochlorons sont obtenus à partir de
colonies de T,. h; ~tr;7tl7m par tamisage d'une suspension
formée par compression des ascidies dans de l'eau de mer.
L'obtention de bistramides selon le procédé
décrit ci-dessus est appliquée à un extrait tel qu'obtenu
après congélation, lyophilisation et extraction au
dichlorométhane du résidu séparé par tamisage.
L'étude des propriétés pharmacologiques des
produits de l'invention a montré qu'ils exercent un effet
cytostatique ;n v;tro.
Sur des cellules tumorales, on constate que cet
effet s'exerce selon un mécanisme différent de celui
observé avec les agents antitumoraux utilisés
habituellement en chimiothérapie des cancers.
Il apparaît en effet que les bistramides
induisent une différenciation terminale atypique
irréversible des cellules tumorales, se concrétisant par
un arrêt du développement de la tumeur.
Ce mode d'action, qui avait été envisagé pour
le bistramide A, ne pouvait toutefois être mis à profit,
étant donné la toxicité aigue de ce produit. Son
~r7.777; n; stration pendant la durée d'un traitement
répétitif, entraînerait obligatoirement l'intoxication de
l'organisme traité.
Tout au contraire, le caractère faiblement
toxique des produits de l'invention pour l'organisme
permet à l'effet différenciateur de se manifester sur les
cellules souches du tissu tumoral, sans effets
défavorables sur les cellules saines, autorisant ainsi
l'établissement d'un plateau thérapeutique en vue d'un
traitement.
~ 94/20503 2 1 ~ 7 7 6 ~ PCT~V4/00256
De plus, selon un aspect présentant un intérêt
majeur, l'effet cytostatique des bistramides de
l'invention s'exerce également vis-à-vis de parasites.
D'une manière inattendue, les bistramides
provoquent un arrêt de la prolifération parasitaire
durant la phase G1 du cycle cellulaire.
En particulier, une activité antipaludique a
été mise en évidence chez ces bistramides.
On mesurera l'intérêt de cette activité en
rappelant que le paludisme humain représente l'une des
toutes premières endémies mondiales, responsable d'une
importante morbidité et d'une mortalité estimée
actuellement à 1 ou 2 millions d'individus pour la très
grande majorité des enfants vivant en zone tropicale.
L'intérêt de fournir de nouvelles molécules
actives est d'autant plus grand que les phénomènes de
résistance de souches de Pla~mn~i~ f~lc;p~rl7m, l'espèce
mortelle, vis-à-vis des médicaments antimalariques usuels
se developpent et que, de plus, la protection vaccinale,
pour laquelle d'importantes recherches sont effectuées,
ne pourra atre effectuée avant plusieurs ~nne~.
Parmi les autres activités anti-parasitaires de
ces bistramides, on citera leur activité anti-
lei~hm-nienne.
Ainsi, à la dose de 500 7~g/ml, le bistramide D
présente in vitro une activité anti-leishmanienne sur
T.. ( r) r7.onov~ni.
L'invention vise donc la mise à profit des
propriétés de ces bistramides pour l'élaboration de
compositions pharmaceutiques.
Les compositions pharmaceutiques de l'invention
sont caractérisées en ce qu'elles renferment une quantité
efficace d'au moins un bistramide tel que défini ci-
dessus, en association avec un véhicule pharmaceutique
inerte. Le bistramide utilisé constitue avantageusement,
wo g4,20503 2 ~ ~ 7 7 6 ~ PCTn~4/00256 ~
12
grâce à la nature de ses substituants, tels qu'éthers ou
esters, une prodrogue.
Ces compositions renferment le cas ~héAnt des
principes actifs d'autres médicaments. On citera
notamment leur association avec des médicaments anti-
mitotiques poisons de fuseau, tels que la vincristine, la
vinblastine ou la vinorelbine dans le cadre
d'applications anti-tumorales, ou avec la chloroquine
pour le traitement de maladies parasitaires.
On les utilisera également avec avantage en
association avec des composés facilitant leur
assimilation tels que des sucres comme le glucose.
Les compositions de l'invention sont
particulièrement appropriées pour la chimiothérapie des
c~nc~rs dans lesquels peu de cellules se trouvent en état
de prolifération. Elles sont ainsi avantageusement
utilisables pour le traitement des tumeurs hllm~inec
solides à évolution lente, donc très chimiorésistantes,
comme 80~ des tumeurs bronchoplll~o~lres et certaines
tumeurs coliques, tumeurs du sein et mélanomes pour
lesquels la thérapeutique actuelle ne dispose d'aucun
médicament réellement efficace.
Ces compositions sont également utilisables
pour le traitement de maladies parasitaires, comme le
paludisme ou les leishmanioses.
L'invention vise donc également l'application
des bistramides définis plus haut pour obtenir un
médicament destiné à une utilisation comme anti-
parasitaire.
Elle vise en particulier l'utilisation de ces
bistramides et notA ?nt de ceux répondant aux formules
(II) à (IV), pour élaborer des médicaments pour le
traitement du paludisme, ou encore de lei~m~nioses.
Les conditio~nem~nts en vue de la vente, en particulier
l'éti~uetage et les notices d'emploi, et avantagell~Am?nt
94/20503 ~ 7 ~ ~ PCT~R94/00256
13
l'emballage sont élaborés en fonction de l'application
thérapeutique prévue.
Les compositions pharmaceutiques de l'invention
sont administrables sous différentes formes, plus
spécialement par voie orale ou injectable.
Pour l'administration par voie orale, on a
recours en particulier à des comprimés, pilules,
tablettes, gélules, gouttes. Ces compositions renferment
avantageusement de lO à lO0 mg de principe actif par
unité de prise, de préférence de 40 à 60 mg.
D'autres formes d'administration comprennent
des solutions injectables par voie intra-veineuse, sous-
cutanée ou intra-musculaire, élaborées à partir de
solutions stériles ou stérilisables. Il peut s'agir
également de suspensions ou d'émulsions.
Ces formes injectables renferment par unité de
prise de lO à 50 mg de principe actif, de préférence de
15 à 30 mg.
A titre indicatif, la posologie utilisable chez
l'homme correspond aux doses suivantes : ainsi on
administre par exemple au patient lO à 30 à mg/jour, en
une ou plusieurs prises pour le traitement de tumeurs
bronchopl~lmon~ires.
L'invention vise encore les réactifs
biologiques dont les principes actifs sont constitués par
les dérivés de bistramides définis plus haut.
Ces réactifs peuvent ~tre utilisés comme
références ou étalons dans des études d'éventuelles
activités antitumorales ou anti-parasitaires.
D'autres caractéristiques et avantages de
l'invention apparaîtront dans les exemples qui suivent
relatifs à l'obtention de dérivés de bistramides et à
l'étude de leur activité antitumorale et anti-parasitaire
et en se référant à la figure unique qui représente une
courbe de croissance en fonction du temps de xénogreffes
WO 94nos~ 5 7 7 6 J ~41~0156 ~
tumorales pl~lm~n~;res chez la souris nude après
traitement avec des bistramides de l'invention.
F~XF~MPT.F~ 1 : Isolement des bistramides D, K et L par
extraction à partir de r; .c~:or.l; nllm h; ~:tr~tllm.
On rapporte un exemple d'extraction à partir
d'échantillons de T-; ~!:orl; nllm h; ~:tr~tllm, accompagnée de
ses prochlorons symbiotes, provenant des îles de Ua et de
N'Do, Nouvelle Calédonie. Ces échantillons ont éte
débarassés des débris apparents, broyés, puis lyophilisés
quelques heures après la récolte.
PROCEDE D'EXTRACTION
Lissoclinum bistratum (5900 g) est traité 3
fois par le dichlorométhane, à raison de 3500 ml de
solvant par kilo de matière première lyophilisée, à
température ambiante, et sous agitation. Les solutions
organiques sont filtrées, rassemblées, puis évaporées à
sec à l'évaporateur rotatif (température 40 C). Le poids
d'extrait brut obtenu est de 44,2 g.
Cet extrait brut est fractionn~ par
chromatographie liquide basse pression (silice 60-200 ~m
900 g ; acétate d'éthyle:méthanol 93:7 en élution
isocratique, 20 ml/min). Il en résulte 11 fractions, dont
la fraction 9 qui contient les bistramides en référence
(6000 au 8000ml, 22.3 g) (tous les volumes d'élution
mentionnés dans ce procédé comprennent le volume mort de
la colonne).
La fraction 9 est traitée par chromatographie
liquide à haute pression (colonne Jones Chromatography 52
x 300 mm, silice 8 ~m, dichlorom~thane:m~thanol 95:5 en
élution isocratique à 90 ml/min, détection UV 254 nm et
RI, masse injectée 3g par cycle). Parmi les fractions
obtenues, trois fractions sont ret~nl~es : n 1 (521 au
720ml, 1004 mg), n 2 (1261 au 2520 ml, 2992 mg) et n
3 (2521 au 3780 ml, 532 mg). La fraction intermédiaire
94/20503 ~1 ~ 7 7 6 0 PCTA~4/00~6
non retenue (721 au 1260 ml) correspond au bistramide
A.
Le lot n 1 est purifié par CLHP (colonne
Interchim 22 x 250 mm, silice lO ~m
dichlorométhane:méthanol eau 96:3,9:0,1 à 10 ml/min,
détection W 254 nm, bistramide L Tr=9min, puis colonne
Biochrom 8 x 250 mm, C18 8 ~m ; acétonitrile: eau 60:40 à
4 ml/min, bistramide L Tr = 16 min), ce qui conduit à
171 mg de bistramide L.
Le lot n 2 est purifié par CLHP (colonne CEDI
52 x 300 mm, C18 15-25 ~m ; méthanol:eau 85:15 à 85
ml/min, détection RI, bistramide D Tr = 22 min) et
fournit 1262 mg de bistramide D.
Le lot n 3 est purifié par CLHP (colonne
Interchim 22 x 250 mm, C18 lO~m, méthanol:eau 85:15 à 10
ml/min, d~tection RI, bistramide K Tr = 19 min), ce qui
conduit à 218 mg de bistramide K.
Les trois produits se présentent comme des
solides amorphes non colorés. Ils peuvent être
chromatographiés sur couche mince (silice,
dichlorométhane:méthanol 90:10) et révélés par un réactif
à base de vanilline (vanilline lg, acide sulfurigue pur
100 ml, pulvérisés sur la chromatographie, puis celle-ci
est chauffée 10 minutes à 110C, bistramide L:bande brune
à Rf = 0,45, bistramide D:bande mauve à Rf = 0,41,
bistramide K:bande mauve à Rf = 0,28).
Les rendements, par rapport au poids de poudre sèche,
sont de:bistramide D: 21,4.10-3%,bistramide K: 3,7.10-3%,
bistramide L : 2,9.10-3%.
.
FORMULES BRUTES ET POIDS MOLECULAIRES
Bistramide D : C4oH7oN2o8~ PM 706 ; ion C40H68N27,
PM = 688,5006
W094/20503 PCT~V4/00256 ~
~776~
16
Bistramide K : C40H70N2og~ PM 706 ; ion C4oH68N2o7
PM = 688,5022
5Bistramide L : C40H68N2o8~ PM 704,4968
FORMULES DEVELOPPEES
Les formules développées données plus haut ont
lOété établies sur la base des données spectrales
habituelles ( W, IR, RMN et spectrométrie de masse), et
par comparaison avec celle du bistramide A comme décrit
par Foster et al dans la référence précit~e.
On rapporte dans les tableaux 1 et 2 qui
15suivent les résultats de l'analyse par spe~Lc ~trie de
masse concernant les bistramides D et K et par RMN pour
les bistramides D, K et L.
Les mesures de ei (electronic impact) et de
hrms (high resolution mass spe~L~- ?try) sont
20enregistrées sur un spectomètre Varian MAT 311 à 70 keV,
avec un pouvoir de résolution de 1500.
Les mesures de fab (fast atomic bombardment)
sont obtenues sur un appareil Kratos Concept II HH. Les
échantillons sont dissous dans un thioglycérol et une
25petite goutte de la solution d'échantillon est placée sur
la cible en cuivre de la sonde d'insertion directe fab.
L'échantillon est bombardé avec des atomes de xénon de 7
keV. Les ions produits sont accélérés sous 8 kV et les
94t20503 ~ 6 0 PCT~V4/00256
Tableau 1
Bistramide M+ ( expérimental) Formule M+ ( théorique)
D 705 ( M-l, fab) C40H7oN2o8 706
K 705 (M-l, fab) C40H7oN2o8 706
D-H20 688,5006 C40H68N2o7688,5026
(ei-hrms,fab)
K-H20 688,5022 C40H68N207688,5026
(ei-hrms,fab)
15 Les ions de masses les plus élevées observés pour le
bistramide D et pour le bistramide K en spectrométrie de
masse ei et fab positive représentent l'ion moléculaire
moins H20. Toutefois les ions M-H sont observés pour les
deux métabolites dans les spectres fab négatifs.
Les résultats obtenus pour le bistramide K
montrent qu'il s'agit d'un isomère du bistramide D.
Dans le tableau 2, on indique pour les
bistramides D, K et L, les ~o~n~ec de l'analyse RMN. Les
spectres sont obtenus en utilisant une sonde C-5 double
lH et 13C dans un spectromètre Bruker AM 400 WB. Les
bistramides purs sont dissous dans CDCl3 et les
déplacements chimiques sont appréciés par rapport au
tétraméthylsilane (TMS).
Pour les expérimentations sur lH~ les
paramètres suivants ont été retenus : largeur spectrale
2994 Hz, largeur de l'impulsion 3,5 ~s (45), 16
balayages, et pour celles sur 13C : largeur spectrale
23809,5 Hz, largeur de l'impulsion 2,4 ~s (45), 1200
balayages.
Tableau 2
C Bistramide D Bis~l- Ide K Bistramide L
13C lH 13C 1H 13C 1H
(mult.) (JHH~Hz) (mult.) (J HH'HZ) (mult.) (JHH~ Hz)
1 17,59 1,65 17,62 1,65 16,04 2,05 ~
(q) (dd, 6,3; 1,4) (q)(dd, 6,4; 1,4) (q) (dd, 1,6; 7,1) ~.
2134,02 5,72 133,53 6,80 144,37 6,31
(d)(dqd, 15,7; 6,3; 1,0) (d)(15,3; 6,4; 1,0) (d) (dq, 11,4: 7,1)
3125,75 5,58 126,26 5,46 127,58 6,09
(d)(dd, 15,7; 6,3; 1,4) (d)(15,3; 6,4; 1,4) (d) (dq, 11,4; 1,5)
4 71,95 4,12 71,90 4,04 200,05 (s) -
(d) (t, 6,3) (d) (6,4)
5 42,86 1,70 (m) 40,64 2,20 (m) 49,38 (t)2,47 (dd, 3,3; 17,2)
(t) 1,55 (m) (t) 2,14 (m) 2,72 (dd, 8,5; 17,2)
6 69,39 3,87 127,68 5,43 64,70 (d) 4,10 (m) (d) (m) (d) (14,0; 7,0)
7 31,07 1,63 (m) 131,73 5,47 30,31 (t)1,30 (m), 1,63 (m)
(t) 1,30 (m) (d) (14,0; 7,0)
8 26,43 1,64 (m) 36,662,13 (13,5; 1,65) 26,35 (t)1,26 (m), 1,55 (m)
(t) 1,30 (m) (t)1,94 (13,5; 1,65)
9 32,96 1,93 (m) 38,40 1,58 33,16 (d) 1,72 (m)(d) (d) (m) o
10 16,85 0,83 14,40 0,88 16,92 (q)0,80 (d, 7, 0)
(q) (d, 7,0) (q) (d, 6,9)
_ _, . _ , . . . . . . ..
1174,22 4,22 (~) 71,43 3,88 74,60 (d) 4,02
(d) (d) (dt, 8,8; 4,2) (ddd, 1,8; 4,75; 11,7)
1233,12 2,68 36,66 2,31 (m) 32,40 (t) 2,70
(dd, 15,0; 11,8) (dd, 11,45; 15,1)
(t) 2,18 (t) 2,30 (m) 2,09
(dd, 15,0; 0,5) (dd, 2,0; 15,1)
13172,33 - 173,64 - 173,42 (s)
( s )
1443,80 3,48 (m) 43,39 3,32 44,51 (t) 3,44
(t) 3,29 (m) (t) (t, 5,6) 3,16
(dt, 5,9; 14,0)
1573,11 3,75 72,57 3,68 73,64 (d) 3,40 (m)(d, 1,9) (m) (d) (dt, 5,4, 5,6)
1643,19 2,35 (m) 43,31 2,33 43,29 (d) 2,31
(d) (d) (m) (dq 5,0; 7,1) ; c~
1715,76 1,21 15,45 1,18 15,34 (q) 1,18 (d, 7,1) . _~
(d, 8,0) (d, 7,0) (q) (d, 7,0) cn
18175,60 - 175,72 - 175,10 (s)
(s) (s)
1939,36 3,25 (m) 39,40 3,24 (m) 39,39 (t) 3,21 (q, 6,8)
(t) 3,15 (m) (t) 3,19 (m)
2025,59 1,70 (m) 25,56 1,78 (m) 25,68 (t) 1,47 (m), 1,74 (m)
(t) 1,50 (m) (t) 1,50 (m)
2130,24 1,64 (m) 30,22 1,65 (m) 30,50 (t) 1,33 (m), 1,63 (m)
(t) 1,27 (m)- (t) 1,31 (m)
22 74,17 3,13 74,16 3,12 74,17 (d) 3,08 (dt, 2,3: 9,6) ~o
(d) (dt, 6,9; 2,0) (dt, 9,6; 2,1)
23 34,84 1,20 (m) 34,76 1,26 34,72 (d) 1,24 (m)
(d) (d) (m)
24 17,95 0,78 17,91 0,78 17,87 (q) 0,74 (d, 6,5)
(q) (d, 6,5) (q) (d, 6,5)
25 27,85 1,58 (m) 27,75 1,56 (m) 27,79 (t) 1,37 (m)
(t) 1,45 (m) (t) 1,42 (m)
26 36,09 1,61 (m) 35,98 1,60 (m) 35,98 (t) 1,44 (m), 1,56 (m) ~~
(t) 1,47 (m) (t) 1,43 (m)
27 95,50 - 95,48 - 95,36 (s)
( s) (s)
28 35,41 1,53 (m) 35,30 1,53 (m) 35,35 (t) 1,31 (m), 1,52 (m) o
(t) 1,31 (m) (t) 1,35 (m)
29 19,22 1,75 (m) 19,14 1,76 (m) 19,09 (t) 1,48 (m), 1,74 (m)
(t) 1,50 (m) (t) 1,52 (m)
30 31,24 1,55 (m) 31,17 1,49 (m) 31,22 (t) 1,05 (m), 1,47 (m)
(d) 1,12 (m) (t) 1,22 (m)
31 69,13 3,35 (m) 68,98 3,40 68,96 (d) 3,37 (m)
(d) (d) (bt)
32 34,01 1,29 (m) 33,87 1,40 (m) 33,96 (t) 1,23 (m), 1,36 (m)
(t) 1,42 (m) (t) 1,25 (m)
33 33,48 1,40 (m) 33,35 1,35 (m) 33,37 (t) 1,28 (m) 8
(t) 1,30 (m) (t) 1,30 (m)
34 31,82 2,32 (m) 31,65 2,31 31,73 (d) 2,31 (m)
(d) (m)
. _ . . . .
.
20,89 0,95 20,83 0,91 20,85 (q) 0,88 (d, 6,6) ~o
(q) (d, 6,8) (q) (d, 4,7)
36 131,14 5,20 131,13 5,15 131,17 (d) 5,11
(d) (d, 9,3) (d) (d, 9,40) (d quint, 9,4, 1,1)
37 137,15 - 137,04 - 137,11 (s)
(s) (s)
3U 11,95 1,57 11,81 1,58 11,66 (q) 1,55 (d, 1,4)
(q) (fd, 1,3) (q) (fd, 1,3)
39 73,224,16 (m) 73,03 4,15 73,09 (d) 4,05 (m)
(d) (d) (q, 6,4)
21,78 1,25 21,74 1,21 21,69 (q) 1,18 (d, 6,5)
(q) (d, 6,3) (q) (d, 6,3)
Nll 7,05 7,12 7,44 (bt, 6,1)
l3ll~ (bt, 5,9) (bt, 6,5) _~
NH 6,75 6,80 6,89 (bt, 5,8) ~
I~/l9 (bt, 5,5) (bt, 5,6) -
Ol~ n.o n.o n.o.
OH - n.o
11
OH 4,62 4,88 4,60 (large)
OH n.o. 2,85 3,65 (lar~e) o
W094/20503 PCT~V4/00~6 ~
~577~ 22
~x~pl~ ? : Obtention de prochlorons à partir de colonies
de T., h; ~:tr~tll~
Les ascidies sont détachées de leur support,
soigneusement lavées à grande eau pour les débarasser de
la vase et des autres débris. Elles sont égouttées,
ouvertes une à une au couteau, pressées à la main, puis
m~C~n; quement dans un bain d'eau de mer. La suspension
dans l'eau de mer est filtrée sur des tamis de plus en
plus fins (123, 63, 40, lO et 5 ~m). Les prochlorons sont
retenus par le tamis de lO ,um. Le résidu d'algues est
congelé, lyophilisé et extrait au dichlorométhane.
L'obtention des bistramides à partir de cet extrait se
fait selon le même procédé qu'à partir de l'extrait des
ascidies entières.
~xP~pl e 3 : Préparation du bistramide D par réduction du
bistramide A.
Une solution de 50 mg (0,07 mmoles) de
bistramide A dans 3 ml de THF est refroidie dans un bain
de glace. Le bistramide A est obtenu en opérant selon
Gouiffes et al. dans Toxicon, 1988, tome 26, pages 1129-
1136.
On ajoute 13 mg (0,35 mmoles) de borohydrure de
sodium. Après 2 heures d'agitation à température
ambiante, le brut réactionnel est versé dans 5 ml d'eau +
glace, puis extrait par deux fois avec 5 ml d'acétate
d'éthyle. Après sèchage sur MgSO4, le solvant est évaporé
et le résidu est purifié par chromatographie sur colonne
de silice éluée par un mélange de dichlorométhane
méthanol (95 : 5).
Les premières fractions contiennent l'épimère
du bistramide D (16 mg ; 32 ~). Le bistramide D (18 mg ;
36 ~) est ensuite récupéré. Le rendement total en
produits réduits est de 68 ~.
~ 94/20503 215 7 7 6 ~ PCTn~V4/00256
En variante, on opère comme indiqué ci-dessus,
mais en remplaçant le borohydure de sodium par du
borohydure de potassium. Le rendement total en produits
réduits est de 72 %.
Selon encore une autre variante, on dissout 53
mg (0,07 mmoles) de bistramide A dans 3 ml de méthanol
contenant 10 % d'acide acétique. Après refroidissement de
la solution dans un bain de glace, on ajoute 13 mg (0,21
mmoles) de cyanoborohydure de potassium. Après 4 heures
d'agitation sous atmosphère inerte, le melange
réactionnel est versé dans 5 ml d'eau + glace, puis
extrait par deux fois avec 5 ml d'acétate d'éthyle. Après
séchage sur MgSO4, le solvant est évaporé et le résidu
est purifié par chromatographie sur colonne de silice
éluée par un mélange de dichlorométhane : méthanol
(95:5)-
L'épimère du bistramide D est élué le premier
(18 mg , 34 %), puis le bistramide D est récupéré (21 mg
; 39 %). Le rendement total en produits réduits est de
78 %.
~xempl~ 4 : Etude des effets pharmacodynamiques des
bistramides D, K, et L in v;tro et ;n vivo
. Effets ;n v;tro
On rapporte ci-après les résultats des
cytoxicités exprimées en CIso en ~g/ml (concentration
correspondant à une inhibition de 50 % de la croissance
des cellules) sur 6 lignées tumorales à savoir KB, P388,
P388/dox (résistant à la doxorubicine), B16 et H429 et
NSCLC-N6, qui sont des cellules humaines de carcinome
broncho-pl~lmonA;re du type "non à petites cellules".
Les déterminations ont été effectuées selon le
protocole donné dans CAnc~r Chemother. Pharmacol. (1991)
28:283-292 par Roussakis et al.
W094/20503 PCT~4/00256 ~
2157760 24
Bistramide D Bistramide K Bistramide L
KB lO,OO > lO 0,72
P388s 0,36 0,57 0,48
p388r 5,82 > lO 0,12
B16 O,lO 1,9O 2,4
HT 29 2,76 5,60 0,29
NSCLC.N6-L16 3,43 3,23 0,12
L'effet cytostatique des produits au niveau du
cycle cellulaire a été également étudié par
cytofluorimétrie.
La technique utilisée correspond à celle
rapportée par Roussakis et al. dans la référence ci-
dessus.
On constate un effet antiprolifératif des
produits lié à un blocage irréversible en phase G1,
entraînant la mort des cellules tumorales
bronchopulmonaires "non à petites cellules" (NSCLC-N6).
Ce blocage en phase Gl est suivi d'un passage
en phase GlDT, qui caractérise l'état de la
différenciation terminale. Les cellules qui atteignent
cette phase GlDT produisent une substance
intracytoplasmique, antiproliférative, de nature
protéique, qui est le produit de l'expression d'un gène
spécifique, lequel joue probablement le role d'un anti-
oncogène.
Lorsque les cellules NSCLC-N6 sont induites à
la différenciation terminale sous l'effet des bistramides
de l'invention, on observe en effet, in vitro,
l'inhibition de l'expression de l'oncogène erb-b2,
habituellement exprimé par le modèle expérimental
utilisé, et de son produit d'expression, l'oncoprotéine
c-erb-b2.
94/20503 ~ 5 ~ ~ ~ Q PCTn~94/00256
. Effets ;n v;vo
L'activité antitumorale des produits de
l'invention a été étudiée à l'encontre de tumeurs solides
de type NSCLC greffées chez la souris nude (D. Riou, C.
Roussakis, J.F. Biard, J.F. Verbist : "Comparative study
of antitumor activity of bistramides A, D and K against a
non-small cell bronchopulmonary car~;no~", Antir.Anc~r
Research, 1993, 13, 2321-2334). Chaque souris a recu 0,2
ml d'une solution cellulaire obtenue par dispersion
mécanique d'environ 1 g de tumeur de souris excisée dans
4,8 ml d'une solution saline stérile. Les tumeurs
greffées en sous-cutanée ont été mesurées sur leur grande
longueur L et leur petite longueur 1. Le volume tumoral a
été évalué d'après la formule Vt=Lx12/2. La croissance
tumorale au jour j a été calculée par la formule Vtj/Vtjo
pour chaque souris, Vt~o étant le volume tumoral au début
du traitement. La figure unique montre les courbes de
croissance tumorale en fonction du temps (jours) obt~n~l~s
avec ou sans traitement par les bistramides.
La courbe " ~ se rapporte à
l'expérience témoin, les courbes "---~---", " --~ --" et
" --~--" aux expériences avec respectivement lO, 20 et 5
mg/kg de bistramide D et la courbe "----*----" à une
expérience avec lO mg/kg de bistramide K. Chaque point
est la moyenne des croissances tumorales de 6 souris.
Dans ces expériences, le bistramide K est
injecté à raison de lO mg/kg par voie intrapéritonéale,
pendant 16 jours, et le bistramide D à raison de 5 mg/kg
par voie intrapéritonéale quotidi~n~nt pendant 16
jours ; à lO mg/ kg par voie intraveineuse aux jours 1,
5, 9, 14, et à 20 mg/kg par voie intraveineuse aux jours
1, 5, 9, 14.
W094/20503 PCT~4/00256 ~
2~7~ 26
L'~x~m~n de ces courbes montre que par rapport
aux témoins (100 %), la croissance tumorale s'établi-c, au
bout de 30 jours, pour les animaux traités, à :
bistramide D (5 mg/kg, IP) :100 %
(10 mg/kg, IV) :76 %
(20 mg/kg, IV) :53 %
bistramide K (10 mg/kg, IP) :49
On notera que le bistramide A, utilisé dans les
conditions rapportées ci-dessus, est trop toxique pour
qu'un effet anti-tumoral puisse être observé.
~x~mple 5 : Prépraration d'une solution injectable de
bistramide D.
On dissout 2 g de bistramide D dans lOOO ml de
soluté physiologique apyrogène. La solution obtenue est
répartie, dans des conditions aseptiques, dans des
ampoules de lO ml, contenant 20 mg de produit par
ampoule.
Ex~mp~e 6 : Activité anti-parasitaire des
bistramides de l'invention.
On rapporte les résultats d'expériences
réalisés sur un modèle in v;vo en utilisant pl ~m~ m
v~ncke; petter;, espèce plasmodiale de rongeur entretenue
sur souris blanches femelles, qui présente l'intérêt
d'une synchronisation parfaite du cycle endo-
érythrocytaire.
1. les rongeurs
les animaux utilisés sont des souris bl~nche~
femelles, SWISS (IFFA CREDO) pesant environ 30 grammes.
Le nombre de souris, réparties par lot est de cinq.
~ g4~20s03 2 1 ~ 7 7 ~ ~ ~/FR94/00256
27
2. la souche
L'espèce Pl~ ~ vinrk~i p~tt~ri utilisée
provient de la souche 279 BY, (voir article Cambie G et
al dans CR.Acad.Sci.PARIS 310,série III,183-188). Ce
plasmodie réalise un cycle schizogonique en 24h, de façon
synchrone. Par la technique de congélation-décongélation
de sang infecté, seul le stade mérozoïte résiste, les
autres formes étant détruites.
Si l'injection des mérozoites a lieu à Oh, on
observe sucessivement comme stade pr~o~inant :
- A 3h le stade anneau (A)
- A 6h le stade trophozoïte jeune (TJ)
- A 12h le stade trophozoïte moyen (TM)
- A 18h le stade trophozoite âgé (TA)
La maturation du parasite dans l'hématie, du
stade anneau au stade trophozoite âgé correspond à la
phase Gl du cycle cellulaire.
Cette phase est suivie par la multiplication du
parasite, phases S et M du cycle cellulaire.
Le stade schizonte correspond à l'éclatement et
à la libération des mérozoites.
L'observation des parasites sanguins se fait
sur frottis colorés réalisés en prélevant une goutte de
sang à la queue. Les frottis sont ensuite colorés au May-
Grumwald-Giemsa. Le calcul de la parasitémie (nombre de
parasites pour lOO hématies) se fait sur frottis.
Les études entreprises nécessitent la
constitution d'un stock de sang parasité conservé à -
70C dans l'azote liquide. Les souris infestées sont
prélevées au sinus rétro-orbitaire à l'aide d'une pipette
pasteur héparinée. Une solution de glycérol à lO~ est
ajoutée volume à volume au sang parasité. Le sang est
ensuite réparti dans des tubes à congélation à raison de
0,5 ml par tube.
W094/20503 PCT~94/00256 ~
2~776~
28
3. injection du bistramide
On utilise, dans ces essais, le bistramide D
dans de l'eau physiologique stérile contenant 5% de DMSO.
Ce produit est injecté par voie sous-cutanée au
niveau de la cuisse.
4. Mise en évidence de l'activité
A/ Te~t ~ P~T~R~ ;
Pour vérifier l'activité du composé étudié, on
applique le test de PETERS qui constitue la référence
pour le criblage de molécules à activité antimalarique.
(PETERS W..1980. Chemoterapy and Drug resistance in
Malaria vol II Academic Press).
Après 4 jours de traitement, on compare le
pourcentage d'hématies parasitées sur frottis mince entre
le lot témoin et le lot traité. On établit de cette façon
un pourcentage d'inhibition.
- M~tho~olo~; e
a) injection de 107 hématies parasitées par
voie I.P. (Jo)
b) injection du Bistramide D à 15 mg/kg/jour,
pendant 4 jours en sous-cutané (JO,Jl,J2,J3)
c) contrôle sur frottis de la parasitémie à J4
~t~ :
. essai A :
- témoins à J4 : parasitémie 4%
- lot traité à J4 : parasitémie 0,64%
soit 84% d'inhibition
. essai B :
- témoins à J4 : parasitémie 4%
- lot traité à J4 : parasitémie 0,50%
soit 87% d'inhibition
. essai C :
~ 94/20503 2 1 5 7 7 6 3 PCT~4/00~6
,:
29
- témoins à J4 : parasitémie 1,20~
- lot traité à J4 : parasitémie 0,~3%
soit 81% d'inhibition
L'ex~ ~n des résultats obtenus dans les trois
essals ci-dessus, montre une inhibition moyenne de 84
lorsqu'on administre un bistramide selon l'invention.
B/ RTU~ DU sTAn~ PA~A~TTAT~ TRr~ AUX
RT~::TRAMTDF~;
Pour apprécier le ou les stades parasitaires
les plus sensibles à l'action des bistramides de
l'invention, on a étudié l'effet de ces bistramides sur
chaque stade parasitaire pr~s~inAnt durant le cycle
cellulaire d'une espèce de Plasmodium donné.
Les résultats donnés ci-après concernent
l'effet du bistramide D sur les stades parasitaires de
pl ~cm~ m v; n~.k~; p~tt~r1.
- ~IP,tho~lol O~J; ~0,
Après infestation des souris, on constitue cinq
lots de cinq souris. Chaque lot est traité par une dose
de 15 mg/kg de bistramide D au moment où pr~o~;nPnt l'un
des stades.
On dispose donc, en plus, du lot témoin, d'un
lot mérozoïtes, d'un lot anneaux, d'un lot trophozoites
jeunes, d'un lot trophozoïtes moyens et d'un lot
trophozoïtes âgés.
On évalue le retard de parasitémie ou période
patente comme le temps en jours nécessaire pour que la
parasitémie atteigne 1%.
~t~ :
. lot témoin 5 J
. lot mérozoïtes 5 J
. lot anneaux 5,4 J
. lot trophozoïtes jeunes 5,6 J
W094/20503 PCT~4l00256 _ i
2~57;760^
. lot trophozo~tes moyens 6,25 J
. lot trophozoïtes âgés 6,2 J
Le test statistique de KRUSKAL-WALLIS
unilatéral (BMDP, Statistical software manual 1990,
vol.1, Ed WJ DIXON U. of Californy Press) met en évidence
une différence significative (p<O,OO1) entre le lot
témoin et les lots trophozo~tes moyens et âgés.
On observe donc une activité sélective du
bistramide D sur les stades trophozoïtes moyens et âgés.
D'après une étude préliminaire en cytométrie en
flux, des hématies murines parasitées par l'espèce
p~ lm v;nck~; petter; montrent, en présence de
bistramide D, un blocage partiel du parasite au stade de
sa maturation. Ceci a pour conséquence un arrêt de la
prolifération parasitaire au stade trophozoïte moyen et
âgé.
Ce blocage, qui correspond à la phase Gl du
cycle cellulaire, est dose-dépendant, et est probablement
lié à une maturation atypique du parasite.
C/ COI~lPp~l~ATSON ~F.!~:; SC~F.~ THFF<ApFuTIouF!:;
MONODO!:;F FT MuT TTnO~F
L'objectif est de suivre au quotidien la
parasitémie et d'évaluer l'inhibition de la parasitémie
selon le schéma thérapeutique adopté pour un traitement.
On met en évidence les modifications morphologiques du
parasite par la formule parasitaire, le calcul de la
formule parasitaire se fait également sur frottis et
permet d'évaluer la proportion de chaque stade : anneau,
trophozoïte jeune, trophozo~te moyen, trophozo~te âgé
pour 100 hématies.
La méthodologie appliquée est la suivante :
a) après infestation, on constitue trois lots
de cinq souris, à savoir
- un lot témoin, à JO,
~ 94/205~ 2 1 5 7 ~ ~ 3 ~ PCT~R94/00256
- un lot dit monodose, pour lequel une seule
injection de bistramide D (15mg/kg), à JO, est effectuée
sur la souris
- un lot dit multidose, ou l'injection de
bistramide D est effectuée en ~m;n;strant cinq doses
respectivement à JO,Jl,J2,J3,J4 (dose totale 15mg/kg)
b) la confection et la lecture des frottis sont
effectuées tous les jours pendant 21 jours.
On a déterminé pour chaque lot le pourcentage
de parasitémie et le pourcentage d'inhibition du
développement du parasite.
Les résultats obtenus sont donnés dans les
tableaux 1 et 2.
W094/20503 ;- PCT~4/00256 ~
21~77'~0
32
Tableau 1
Jour Témoins Monodose Multidoses
J0 - _ _
J1 - _ _
J3 0,33 0,16 0,12
J4 1,2 0,80 0,2
J5 5,5 3,5 1,6
J7 50 64 7,4
J8 67 56 74
J9 48 42 67
J10 1 1 30
Tableau 2
Jour Monodose Multidoses
J3 51,5 63,6
J4 33,3 83,3
J5 36,3 70,9
J7 0 85,2
J8 16,4 0
J9 12,5 0
J10 0 0
Les formules parasitaires dans chacun des lots
sont données à J5 et à J7 dans le tableau 3.
~ 94/20503 2 1 ~ 7 7 ~ ~ PCTn~94/002S6
33
Tableau 3
Stade Témoin MonodoseMultidose
J5 J7 J5 J7 J5 J7
A 72,5% 58% 40%47% 25~ 7%
TJ 17,5% 17% 37~31% 28% O~
TM 7% 15~ 14%14% 40% O%
TA 3~ 10% 9% 6% 7% 93%
L'ensemble de ces résultats met en évidence une
différence très notable à J7 où la parasitémie du lot
multidose est dix fois moins élevé par rapport au lot
témoin (le pourcentage d'inhibition est de 85%).
Le parasite se trouve essentiellement sous
forme trophozoïte âgé (93%) dans le lot multidose et sous
forme anneau dans le lot témoin.
Le parasite apparait donc bloqué au stade
trophozoïte âgé.
A partir de J8, la parasitémie entre les deux
lots est comparable, le Plasmodium n'étant appare~ment
plus sous l'effet du bistramide D.
La dernière injection de la drogue dans ce lot
multidose a été effectué à J4, la durée d'action du
bistramide D est d'environ 3 jours. Cela semble être
confirmé avec le lot monodose : A J4 (trois jours après
l'injection de bistramide D) on n'observe pas de
différence entre la parasitémie du lot témoin et celle du
lot monodose.