Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
~16793~
WO 95/32200 I PCT/FR95/00683
OXATHIOLANES, LEUR PROCEDE DE PREPARATION
ET LES COMPOSITIONS PHARMACEUTIQUES QUI EN RENFERMENT
La présente invention se rapporte au domaine de la chimie organique et plus
précisément à celui de la chimie thérapeutique.
Elle a pius particulièrement pour objet des 2',3'-didesoxynucléosides substitués en
o position 2 par un cycle 1,3-oxathiolane.
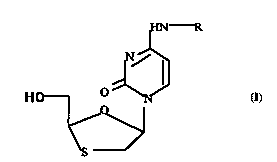
Elle a spécifiquement pour objet les 5-(cytosinyl-1) 1,3-oxathiolanes de configuration
cis (2R-5S ou 2S-5R) répGndanl à la formule générale
IE~ R
HCt---- O ~ ~
~Y
S
que l'on peut représenter sous l'une des deux représentations spatiales
~0
~S
5~ HO--CH ~ ~
S NE~ R
dans laquelle R est un radical acyle ou aralcoyle, dérivés d'un hétérocycle mono- ou
bicyclique azoté
et le groupe hydroxyméthyle en position 2 est en position cis par rapport au plan
déterminé par les positions 2 et 5.
WO 95/32200 ; 2 PCT~R95100683
- 2 ~ 6 ~
Parmi les dfflérentes définitions prises par le substituant R, on dfflérenciera:
a) les dérivés nicotiniques où l'hétérocycle est une structure pyridique et le
5 groupement acyle est en position 2, 3 ou 4, de formule la
(X)n CO-- ( Ia )
,~
dans laquelle X représente de l'hydrogène, un atome d'halogène, un groupe nitro,o un alcoxy inférieur ou un radical trifluoro".ell"~le
et n est un nombre entier variant de 1 à 3
b) les dérivés dihydropyridiques où l'hétérocycle est une 1,4-dihydropyridine et le
radical acyle est en position 2, 3 ou 4, de formule ~b
(X)n CO_ (~b)
I
R 1
dans laquelle R1 est un radical alcoyle ayant de 1 à 10 atomes de carbone
X et n sont définis comme précédem",e"l
c) les dérivés nicotiniques quaternisés où l'atome d'azote porte un substituant
alcoyle et le radical acyle est en position 2, 3 ou 4, ayant la formule générale Ic
O
_11 ~(X)~ ~>
~ A (Ic)
dans laquelle A est un anion minéral ou organique
R1, X et n sont définis comme précédemment
WO 95/32200 ~ I ~ 7 9 3 ~ PCT~5/o~ 683
d) les dérivés quinoléiques où l'hétérocycle est une structure bicyclique ayant la
formule générale Id
(X)n, ~ C-- (Id)
dans laquelle le radical carbonyle peut être en position 2, 3 ou 4
X représente de l'hydrogène, un halogène, un radical trifluorométhyle, un alcoxyinférieur ou un groupe nitro
et n' représente un nombre entier variant de 1 à 6.
e) les dihydroquinoleines de formule générale Ie
(X)nl ~ C-- (le)
N
I
R
dans laquelle R1 et X sont définis comme précédemment
et n' est un nombre entier variant de 1 à 6
fl les quinoléines quaternisées de formule générale If
(X)nl ~ C-- A~) (If)
R I
20 dans laquelle R1, X et n' sont définis comme précédemment
le radical acyle se trouve en position 2, 3 ou 4
et A est un anion minéral ou organique
g) les (dihydropyridyl) alcoyles de formule générale Ig
WO95/32200 21~ 7 ~ 3 0 4 PCT/~R9SJ'~
(X)n ¢~ (CE~! ) m-- (Ig)
N
Rl
dans laquelle R1, X et n sont définis com",e précédemment
et m est un nombre variant de 1 à 6
ainsi que leurs sels d'addition avec un acide minéral ou organique.
Les composés de formule I peuvent etre dédoublés en leurs isomères optiques. On
obtient ainsi l'isomère (+) et l'isomère (-).
o Les infections rétrovirales sont la cause de maladies graves, en particulier du
syndrome d'immunodéficience acquise (SIDA) qui est une affection virale souvent
fatale, et à un degré moindre les hépatites. Plusieurs composés de type
nucléosidiques ou hétéro-nucléosidiques, sont actuellement cliniquement utiliséspour le traitement de ces affections rétrovirales. Ceux-ci sont les dérivés AZT (3'-
azido-2',3'-didesoxythymidine) (Proc. Natl. Acad. Sci. 82, 7096-7100, 1985), ddC(2',3'-didesoxycytidine) (Proc. Natl. Acad. Sci. 86, 1911 -15, 1986), d4T (2',3'-
didéhydro-3'-désoxythymidine) (Biochem. Biophys. Res. Comm. 142, 128--34, 1987),ddl (2',3'-didésoxyinosine) (Antiviral. Chem. Chemother 2, 221, 1991), BCH-189 ou
3TC (2',3'-dideoxy 3'-thiacytidine) décrit dans la demande de brevet européen 90301335.7 et suivants. Le nombre restreint de ces composés a"li~et,oviraux à la
disposition du praticien, et leur efficacité thérapeutique limitée appelle la recherche
de nouveaux composés dont les vertus thérapeutiques seraient accrues et les effets
secondaires diminués.
On connalt déjà des dérivés de 2-[(1-hydroxyméthyl) 1,3-oxathiolan 5-yl] cytosine et
notar"r"e"~ les esters de la fonction hydroxyméthyle (demande de brevet européen0.382.526) ou les dérivés halogénés en position 5' du noyau pyrimidique (R.F
SCHINAZI et al. Antimicrob Agents and Chemotherapy 36 (1992) 2423-2431).
Les composés de l'invention possèdent la propriété d'inhiber la réplication de
rétrovirus humains, en particulier le VIH et le virus de l'hépatite B (\/HB). Ces
composés, dérivés du BCH-189 ou 3TC, incluent dans leur structure une entité 1,4-
dihydro-1-méthyl-3-quinoleylcarbonyl fixée sur le groupement amine exocyclique de
la cytidine. Cette entité structurale particulière confère en pharmacologie
2~ ~793~
WO 95t32200 5 PCT/FRg~,/00~
. ~ ... ..............................................:
expérimentale la propriété d'augmenter et de faciliter le passage de la barrièrehémato-encéphalique (Pharmacol. Ther 19, 337-396, 1983 - Methods Enzymol.
112, 381-396, 1985 - Drug. Des. Del, 1, 51~4, (1986) - J. Med. Chem. 31, 244-249,
1988 - J . Med. Chem. 32, 1782-1788, 1989 - J. Med. Chem. 32, 1774-1781, 1989) .
1.
La synthèse chimique de ces composés a été effectuée à partir de protocoles
expe,i",ei)taux classiques. La mise au point de ces nouveaux hétéronucléosides
nécessite comme composé de départ le dérivé 2',3'-didéoxy-3'-thiacytidine dont
plusieurs méthodes de synthèse sont décrites dans la littérature chimique (J. Org.
o Chem. 56, 6503, 1991 - J. Org. Chem. 57, 2217, 1992 - Tet. Lett. 33, 4625, 1992 -
N-~cleosicles and Nucleotides 12, 225, 1993). A partir de ce dérivé, la synthèse des
composés faisant l'objet de la présente invention et celle des intermédiaires qui s'y
ra~.po,le"t, sont décrites dans la présente de",ande de brevet.
L'invention se rapporte aussi au procédé d'obtel)lion des composés de formule
générale I qui consiste à soumettre un 5-(cytosinyl-1) 1,3-oxathiolane cis à l'action
d'un dérivé fonctionnel d'acide carboxylique de formule ROH où R est un radical
acyle dérivé d'un hétérocycle a~ o"~alique ou dihydroaromatique, mono- ou
bicyclique azoté ou à l'action d'un dérivé actif aralcoylé de formule R'Z où R' est un
radical aralcoyle dérivé d'un héterocycle aromatique ou dihydroaromatique, mono-ou bicyclique, azoté et Z est un radical labile facilement clivable.
D'une manière plus précise, le dérivé fonctionnel d'acide ROH est un halogénure, un
anhydride, un anhydride mixte formé avec un carbGdiilnide ou un ester réactif
cGm"~e un ester de phénol.
Dans le cas d'un dérivé aralcoylé, Z est un atome d'halogène ou un radical alcoyl-ou
aryl sulfonyle.
L'invention a également pour objet les compositions pharmaceutiques à action
antivirale caractérisées en ce qu'elles re"ren,)el,t à titre de principe actif au moins
un composé de formule générale I ou un de ses sels d'addition avec un acide
minéral ou organique. en association ou en mélange avec un excipient ou un
véhicule inerte, non-toxique, pharmaceutiquement compatible, notamment pour
I'usage topique ou général.
Dans ces compositions, la teneur en principe actif de forme générale I s'échelonne
de 0,1 mg à 100 mg par prise unitaire en fonction de la voie d'administration.
wo 95,32200 ~ ~ ~ 7 ~ 3 ~ 6 PCT/I~ Ç~3
EXEMPLE I
Isomères du Cis 2~diphénylterbuty1silyloxyméthyl)-5 tN4-(3"-
pyridinylcarbonyl) cytosine-1'-yl]-1,3-oxathiolane 1
A température ambiante, sous atmosphère d'azote, on additionne dans un mélange
de dichlorométhane (7 ml) et de diméthytfolmalllide (2 ml), 1 eq d'acide nicotinique
(27 mg, 0,21 mmol) 1,1 eq. de BOP (93 mg, 0,23 mmol), 1,1 eq. de HOBT (31 mg,
0,23 mmol), 1 eq. de 5'-terbutyldiphénylsilyl-2',3'didesoxy-3'-thiacytidine (39 mg,
o 0,23 mmol), 4 eq. de DIEA (146 1~l, 0,84 mmol). Le mélange est agité pendant une
nuit à température ambiante, lavé par une solution d'acide citrique à 5% (10 ml),
puis par une solution aqueuse de bicarbonate de sodium à 5% (10 ml). Le mélange
résultant est extrait à l'acétate d'éthyle (3x10 ml), séché sur Na2SO4, et évaporé. Le
résidu est purifié sur plaque de gel de silice. On obtient 48 mg de composé pur.
[1H] RMN: ~ (CDCI3) = 1.1 (s,9H,tBu); 3.1-3.6 (m,2H,CH2-O); 3.7-4.2 (m,2H,C4H2);5.25 (t,1H,Cs-H); 3.1-3.6 (m,2H,CH2-O); 5.5 (d,1H,Cs~-H); 6.35 (q,1H,C2-H); 7.4-7.8
(m,1H,aromatique); 8.0 (d,1H,C6'-H); 8.3 (d,1H,nicotinyl); 8.8 (d,1H,nicotinyl); 8.8
(d,1H,nicotinyl); 9.1 (d,1H,nicotinyl).
EXEMPLE ll
Isomères du Cis 2~hydroxymethyl)-5 tN4~3"-pyridinylcarbonyl) cytosine-1'-yl] -
1,3-oxathiolane 2
Le composé 1 (25 mg, 0,05 mmol) est dissout dans 3 ml de tétrahydrofurane
anhydre. A cette solution, on ajoute 3 eq (135 1~1, 0,15 mmol) de fluorure de
tétrabutyla""nonium. La solution est agitée à température ambiante pendant 3 h.
Après évaporation du solvant, le produit résultant est chromatographié sur plaque de
silice préparative (éluant : toluène/CH30H 15%). On isole 13 mg de composé
désiré.
[1H] RMN: ~ (CDCI3) = 3.1-3.6 (m,2H,CH2-O); 3.7-4.2 (m,2H,C4H2); 5.25 (t,1H,Cs-
H); 5.5 (d,H,Cs~-H); 6.35 (q,1H,C2-H); 7.4-7.8 (m,1H,aromatique); 8.0 (d,1H,C6'-H);
8.3 (d,1 H,nicotinyl); 8.8 (d,1 H,nicotinyl); 9.1 (s,1 H,nicotinyl).
EXEMPLE lll
Isomères du Cis 2~terbutyl cliphenyl-silyloxyméthyl)-5-[N4~3"-tosyl) cytosine-
1 '-yll-1,3~xathiolane 4
WO 9S/32200 2 ~ 6 7 9 ~ ~ PCT/FR951C~3
. ~
A une solution de dérivé 5 (56 mg, 0,12 mmol) dans la pyridine (3 ml), on additionne
à 60C sous atmosphère d'azote 2 eq. de chlorure d'acide paratoluène sulfonique
(46 mg, 0,24 mmol). Après 20 h d'agitation à température ambiante, le mélange est
5 évaporé à sec, lavé par une solution d'acide citrique à 5% (10 ml), puis extrait à
l'acétate cl'éthyle (3x10 ml). Les phases organiques réunies sont séchées sur
Na2SO4 et évaporées. On isole 48 mg de produit désiré.
[1H] RMN: (CDCI3) = 1.1 (s,9H,tbu); 2,45 (s,3H,CH3 tosyl); 3.15-3.55 (m,2H,C2-
CH2-O); 3.85-4.2 (m,2H,C4H2); 5.25 (t,1H,Cs-H); 6.3 (t,1H,C2-H); 7.3-7.7
(m,14H,ArH); 8.05 (d,1H,C6'-H);
EXEMPLE IV
Isomères du Cis 2~diphénylterbutylsilyloxyméthyl)-5-[N4(3"-pyridinyl carbonyl)
s cytosine-1 '-yl]-1,3-oxathiolane 3
A une solution de dérivé 4 (47 mg, 0,075 mmol) dans la lutidine (2 ml) sous
atmosphère d'azote à 90C, on ajoute 6 eq. (46 ~I, 0,45 mmol) de
pyridinylmethylamine. Le chauffage est maintenu pendant 48 h sous agitation. Après
20 refroidissement, le mélange est évaporé, lavé par une solution d'acide citrique à 5%
(10 ml), puis extrait à l'~céPte d'éthyle (3x10 ml), séché sur Na2SO4. Après
évaporation, le résidu est purifié par cl,romalographie sur plaque de gel de silice.
(éluant: EtOAC/MeOH, 10/1)
2s EXEMPLE~ V
Isomères du Cis 2~terbutyl~iphényl-silyloxyméthyl)-5-(cytosine-1'-yl)-1,3-
oxathiolane 5
Une solution de 2',3'-didéoxy-3'-thiacytidine (105 mg, 0,45 mmole) dans la pyridine
30 (6 ml) est traitée sous almosphère d'azote par du chlorure de diphénylterbutylsilyle
(140 ,ul, 0,5 mmole). Le mélange réactionnel est agité pendant 24 heures à
température ambiante. Après conce"l,dliG" sous vide, on ajoute 30 ml d'eau et on extrait à l'acétate d'éthyl (3x20 ml). Les phases organiques réunies sont alors
séchées sur Na2SO4 et concentrées à sec pour donner le composé 5 (210 mg, Rdt
35 qualllildlil) sous forme d'un solide blanc.
wo 95/32200 2 ~ ~ 7 3 3 ~ 8 PCT/FR95/00683
Rf (AcOEVMeOH 2/1) = 0,62
[1H] RMN (CDCI3) ~: 1,1 (s,9H,tbu); 3,1-3,6 (m,2H,C2-CH2-0); 3,7-4,2 (m,2H,C4-
H2); 5,25 (t,1H,Cs-H); 5,5 (d,H,Cs~-H); 6,35 (q,1H,C2-H) 7,4-7,8 (m,10H,2Ph); 8,0
(d,1 H,C6~-H)
EXEMPLE Vl
Isomères du Cis iodure de 2~hydroxyméthyl)-5-tN4-(1"-méthyl-3~-
pyridinylcarbonyl) cytosine-1 '-yl]-1,3~xathiolane 6
Sous atmosphère d'azote à 1 eq (46 mg, 0,14 mmol) de composé 2 dissous dans 4
ml d'acétonitrile anhydre, on ajoute 9 eq. (1,25 mmol, 77 ,ul) d'iodure de méthyle. La
solution résultante est chauffée à 50C pendant 48 h. Après évaporation des
solvants, le résidu est purifié par flash ol,ro,,,atoyl~ e~ éluant BuOH/H20/acide
acétique [5:2,5:2,5]. On obtient un solide jaune (55 mg).
[1H] RMN: (DMSO d6) ~ = 3.25 (t,2H,CH24); 3~90 (dd,2H,C2-CH2); 4.45 (s,3H,N+-
CH3); 5.25 (t,1H,CH-5); 6.30 (t,1H,CH-2); 6.92 (d,1H,CH~'); 7.30 (d,1H,nicotinyl);
7.85 (d,1H,nicotinyl); 8.05 (d,1H,CH-5'); 8.20 (d,1H,nicotinyl); 7.85 (d,1H,nicotinyl);
9.01 (d,1H,nicotinyl).
20 Spectre de masse: (FAB+) 349 (M-1)+
EXEMPLE Vll
Isomères du Cis 2~hydroxyméthyl)-5-tN4~ néhtyl-1",4"-dihydro-3"-pyridinyl
carbonyl) c~losi-,e 1'-yl]-1,3-oxathiolane 7
Dans 3 ml d'une solution dégazée de méthanol contenant 10% d'eau, on dissout 30
mg (0,06 mM) de composé 6. A cette solution, on ajoute 15 mg de bicarbonate de
sodium et 60 mg de dithionite de sodium. Le mélange réactionnel est agité sous
.azote pendant 3 h. La solution devient ora.,gée. On évapore le solvant puis on
resuspend les sels dans un minimum de méthanol; on filtre. Le filtrat est purifié par
cl~ro",alog~a~,hie sur couche mince préparative (1 mm). (Eluant: Toluène/méthanol
1: 1) pour donner 6 mg d'un solide blancjaune SM: (FAB+) 349 (M-1)+
EXEMPLE Vlll
Isomères du Cis 2-hydroxyméthyl 5-[N4-3"~uinolinylcarbonyl) cytosin-1'-yl]
1,3~xathiolane 8
WO9513220~ 7 ~ ~ ~ PCT/~ c~3
A 2 ml de diméthylrormamide anhydre, on ajoute 74,4 mg (0,43 mmol) d'acide 3-
quinoline carboxylique puis 96 mg (0,47 mmol) de 1,3-dicyclohexyl carbodiimide et
63,4 mg (0,47 mmol) d'hydrate d'hydroxybenzotriazole. Le mélange est agité
pendant 1 h à température ambiante sous azote. Un précipité blanc de
s dicyclohexylurée apparaît et on ajoute alors 100 mg (0,43 mmol) de 2,3'-dideoxy 31-
thiacytidine. Le mélange est agité pendant une nuit. Ensuite, on évapore le
cJi"~ell,ylformamide sous pression réduite, et le résidu est hydrolysé par une solution
aqueuse saturée en NaCI (10 ml). On extrait le résidu à deux reprises par de
l'acétate d'éthyle (2x10 ml). Les phases organiques sont combinées, séchées sur
10 sulfate de magnésium puis filtrées. Le solvant est évaporé. Le produit est purifié par
fflash) chro,nalographie. (Eluant: acétate d'éthyle/ méthanol 98:2) pour donner 78
mg d'un solide blanc (0,2 mmol) soit un rendement de 46,5 %
PF = 116-118C - IR =1656 cm~1 (carbonyle de la fonction amide)
15 l1H] NMR (DMSO d6) ~ = 11,75 (s,1H,NH); 9,40 (d,1H,CH-2"); 9,15 (d,1H,CH4");
8,65 (d,1Hl,CH-5'); 8,20 (m,2H,CH-8" et-CH-5"); 8,0 (m,1H,CH-6"); 7,80 (m,1H,CH-7"); 7,45 (d,1H,CH-6'); 6,35 (t,1H,CH-2); 5,55 (t,1H,CH-5); 3,98 (t,2H,C2-CH2-4)l13C]NMR: (DMSO d6 ) ~ = 37,14 (C-4); 61,95 (CH20-C2); 87,28 (C-2); 88,29 (C-
5); 95,85 (C-5'); 122,21 (C-3"); 126,28 (C-6"); 127,71 (C-5"); 129,63 (C-10"); 129,87
20 (C-7"); 132,08 (C-8"); 137,65 (C~"); 138,89 (C-6'); 148,91 (C-9"); 149,29 (C-2");
163,16 (C 2'); 164,51 (C4')
Spectre de masse: (Fab+) 385 (M+1)+. 769 (2M+1)+
EXEMPLE IX
Isomères du Cis iodure de 2-hydroxyméthyl 5-tN4~1"-methyl 3"-
quinolinylcarbonyl) cytosin-1'yl3-1,3-oxathiolane 9
On prépare une solution de composé 8 (78 mg soit0,20 mmol) dans 4 ml
d'acétonitrile. On ajoute 112 ,ul (1,8 mmol) d'iodure de méthyle et le mélange est
30 chauffé à 40C sous azote pendant 24 h. Le solvant est chassé et le résidu brut est
alors dissout dans le minimum d'acétonitrile. On le reprécipite par addition d'éther.
On obtienl: ainsi un solide orangé (60 mg soit un rendement de 55%.
PF = 156-159C
[1H] NMR: (CD30D) ~ = 3,32 (t,2H,CH2-4); 3,99 (dd,2H,C2-CH2); 4,80 (s,3H,+N-
35 CH3); 5,313 (t,1H,CH-5); 6,0 (d,1H,CH-6'); 6,33 (t,1H,CH-2); 8,13 (m,1H,CH-7"); 8,39
(m,1H,CH-6"); 8,60 (m,2H,CH-8"); 8,72 (d,1H,CH-5'); 9,79 (d,1H,CH-4"); 9,95
(d,1H,CH-2").
Spectre de masse: (Fab+) 399 [M-l]+, 799 12(M-I)]+.
WO 95/32200 lo PCT/FR95/~ 3
2~7~3~ --
EXEMPLE X
Isomères du Cis 2-hydroxymethyl 5-[N4~1"-méthyl 1",4"-dihydro 3"-
quinolinylcarbonyl) cytosin-1'-yl]-1,3~xathiolane 10
On ajoute à une solution de 30 mg (0,057 mmol) du composé 9 dans 3 ml de
",éll.anol aqueux dégazé (3 ml contenant 10% d'eau), 15 mg de bicarbonate de
sodium et 60 mg de dithionite de sodium. Le mélange est agité pendant une heure
sous azote. Le solvant est évaporé et le résidu brut est purifié par chromatographie
o préparative. (Eluant: acétate d'éthyle/méthanol 1:1). On obtient finalement 10 mg
d'un solide vitreux jaune soit un rendement de 46%.
[1 H] NMR : (D2O) ~ = 3,24 (m,3+2H,NCH3+CH2-4"); 3,48 (m,2H,CH24); 3,93
(m,2H,C2H2); 5,29 (t,1H,CH-5); 6,96 (d,1H,CH-6'); 7,13 (m,2H,CH-6"+CH-7"); 7,27
15 (m,2H,CH-5"+CH-8"); 7,45 (d,1H,CH-2"); 8,23 (d,1H,CH-5')
Spectre de masse: (Fab+) 399 (M-1)+
EXEMPLE Xl
Isomères cis du 2-hydroxymethyl-5-tN4~2~a,a,a-brifluoro rn-toluidino)
20 nicotinyl)-cytosine-l'yl]-1,3~xathiolane 11
A une solution de 2',3'-didéoxy-3'-thiacytidine (50 mg, 0,2 mmol) dans 5 ml de DMF
anhydre, on additionne 1 1 eq. de BOP (93 mg, 0,23 mmol), 1 eq. d'acide niflumique
(acide 2-(a,a,a-trifloro-m-toluidino) nicotinique) et 4 eq. de DIEA (146 ,ul, 0.84 mmol).
~s Le mélange est agité une nuit à température ambiante, lavé par une solution d'acide
citrique à 5% (10 ml), puis par une solution aqueuse de bicarbonate de sodium à 5%
(10 ml). Le mélange résultant est extrait de l'acétate d'éthyle (3 x 10 ml), séché sur
sulfate de sodium, puis évaporé. Le résidu est puriFié par chromalographie sur
colonne de gel de silice (éluant: acétate d'éthyle/toluène 1 :9). On obtient un solide
30 blanc (49 mg, rendement 48%).
TEST D'EVALUATION DES PROPRIETES ANTIVIRALES
TESTS ANTI-HIV - Protocole expérimental
WO 9S/32200 ~ ~ 2 ~ fi 7 ~ 3 ~ PCT/~h~S o^c83
a) généralités
Appareillage: I'ull,~ce"l,irugeuse utilisée est de type Beckman TL 100. Le comptage
des particules radioactives a été effectué sur un appareil Hewlett Packard Tri-Carb
Modèle 1600. Les syncitia sont observées d'un microscope inversé Labovert.
Composition du tampon de Iyse NTE: Tris-hydroxyméthylaminométhane (10 mM);
NaCI (100 mM); EDTA (1 mM)
b) tests d'évaluation des propriétés antivirales en culture cellulaire
L'évaluation de l'effet antiviral est basée sur l'étude de l'effet cytopathogène du virus
o VIH-1 sur la lignée cellulaire MT4. La lignée MT4 a pour origine des cellules T
isolées à partir d'un patient transformées par le virus VTLH-1. L'effet cytopathogène
du virus VIH-1 se traduit par la for~ liGn de cellules géantes multinuclées appelées
"syncitia" visibles au microscope. Cet effet du VIH-1 est observé 4 à 5 jours après
l'infection; il est suivi par la mort des cellules
15 L'effet cytopathog.ène est directement correlé à l'infection des cellules par le virus à
sa réplication intracellulaire et à l'expression des antigènes viraux par les cellules.
Une inhibition de cet effet correspond donc à une inhibition de la multiplication du
virus VIH-1
Les cellules MT4 sont e"L,etenues à 3105 cellules/ml dans du milieu RPMI 1640:
20 10% de sérum de veau foetal décomplémenté pendant 30 mn à 56C (hormones
facteurs de croissance sériques ...) 1% glutamine 1% pénicilline streptomycine et
2 l~g/ml de polyrène qui favorise l'adhésion du virus sur les cellules.
L'action du traitement par l'antiviral est permanent. En effet celui-ci est présent
avant pendant et après l'infection virale. Des dilutions s~lccessives sont effectuées
25 dans le sérum de veau foetal à 10% afin de pouvoir cultiver les MT4 pendant 8 jours
et observer la for",dlion des syncitia
Test MT4:
Avant l'in~ection: 3.106 cellules/1001 1 sont distribuées dans une microplaque 96
30 puits et centrifugées 3 mn à 2000 tpm (tours par minutes). Le culot est alorspréincubé 1 h à 37C avec 100 ~I de dfflérentes concel-l,dlions d'antiviral à tester.
Infection: I'infection est réalisée en micropuits en rajoutant 100 TCIU (unités
infectieuses) du virus VIH-1 (ce titre du virus VIH-1 est déterminé pour induire la
formation de syncitia en 4 ou 5 jours). L'antiviral est toujours présent lors de35 I'infection et la dilution du virus à 100 TCIU.
Après l'infection: après une incubation de 1 h à 37C les MT4 sont lavées 3 foisavec du RPMI 1640 et mises en culture à raison de 3105 cellules par millilitre de
chacune des concentrations des composés à tester en plaques de 24 puits. Lors du
WO95/32200 ~ ~ ~ 7 ~ 3 ~ 12 PCT/FR95~C'~3
passage effectué au jour J3, les celluies MT4 sont diluées au 1/3. La concentration
de l'antiviral est maintenue. Chaque jour, I'apparition de syncitia est observée au
microscope afin de détecter un éventuel retard par rapport au témoin VIH-1. A J8, Ie
dosage de la transcriptase inverse est effectué. Si les cellules ne sont pas infectées,
c'est donc qu'il y a protection par l'antiviral testé.
Dosaqe de la lldr~cril~tase inverse:
La transcriptase inverse est une ADN polymérase ARN dépendante. Cet enzyme
permet la réplication des rétrovirus. Grâce à celui-ci, I'ARN du virus, copié en ADN,
o s'intègre dans le génome cellulaire. L'ADN proviral est transcrit par les enzymes de
la cellule en ARN viral. Pour le dosage de l'activité tra"s.;, i~lase inverse, on
concentre 100 fois 1 ml de surnageant de culture par ultracentrifugation pendantmn à 95000 tpm; le culot viral obtenu après ultracentrifugation est remis en
suspension dans 10 ~ul de tampon NTE + TRITON 0.1% (éther de polyoxyéthylène);
15 celui-ci sert à Iyser le virus et à libérer la transcriptase inverse. In vitro, c'est l'activité
transcriptase inverse qui est mise en évidence. Cet enzyme utilise une matrice
synthétique poly A possérl~nt une amorce oligo dT ayant de 12 à 18 résidus. Le
substrat radioactif de cette réaction est le [3H]dl~P (thyrnidine triphosphatée
radioactive à 1mGi/ml); les macromolécules tritiées néoformées, sont précipitées par
20 de l'acide trichloroacétique et séparées du [3H]l~P libre par filtration. L'activité
enzymatique de la transcriptase inverse est mesurée par la radioactivité incorporée
dans les complexes poly-rA/poly-dT. Cette radioactivité est déter"linée dans un
con,pteur de particules, après addition du liquide scintillant tenant fonction
d'amplificateur
TEST ANTI-HBV- Protocole e~a~érimental
Parmi les dfflérentes méthodologies employées pour évaluer l'activité de composés
sur le virus de l'hépatite B (\/HB), le modèle du virus de l'hépatite B du canard (Duck
30 HBV) a été utilisé (J.Med. Virology 1990, 31, 82-89; Viral Hepatitis and Liver
Disease, 1988, 506-509; Hepatology, 1989, 10, 186-191). Le matériel de culture
pour tester "in vitro" I'activité anti-VHB de composés est constitué d'hépatocytes de
canard, infectés par le virus de l'hépatite B du canard (DHB\/), (Antimicrob. Agents
Chemother. 1989, 33, 336-339; J. Med. Virology, 40, 59~4; Antivir. Res. 1993, 21,
35 155-171; Antimicrob. Agents Chemother. 1993, 37, 1539-1542). En effet, le virus de
l'hépatite B du canard est reconnu comme étant très proche du virus de l'hépatite B
humain (Viral Hepatitis and Liver Disease, 1988, 526-529; Antiviral Research, 1987,
8, 189-199). Dans des conditions standardisées (\/irology, 1989, 171, 564-572), la
WO 9~/3220~ 1 3 ~ 3 ~ PCT/FR95/00683
culture d'hépatocytes de canard permet la réplication complète du DHBV. L'activité
antivirale des composés testés est mesurée en fonction de la quantité d'ADN viral
produit pendant 10 jours de culture des hépatocytes infectés.
5 Protocoleexpérimenl~
Un caneton de 3 semaines, atteint par le DHBV, est utilisé pour la préparation des
hépatocytes. Le canard est tué sous anesthésie et l'isolement des hépatocytes est
effectué selon la méthodologie de Guillouzou (Research in isolated and cultured
hepatocytes, J. Libbey Eurotex Ltd/lNSERM, 1986). Les cellules sont mises en
suspension dans le milieu de Leibowitz et 5 l~g/ml d'insuline bovine, 7.10-5 mole
d'hémisuccinate d'hy-llocorlisone et 1.5% de DMSO sont ajoutés. La densité des
cellules est de 8.106 cellules, étalées dans des boîtes de culture de 100x20 mm.Les composés testés sont ajoutés à la culture après l'étalement des cellules. Lemilieu est changé tous les jours, pendant 10 jours. La production d'ADN viral du15 virus de l'hépatite B de canard dans le surnageant des cellules est estimée par la
méthode cl'hybridation "Dot Blot", selon Fourel et al. (\/iral Hepatitis and Liver
Disease, 1988, 506-509; Hepatology, 1989, 10, 186-191) L'inhibition est expriméeen pourcentage de la quantité d'ADN présent dans le surnageant des cellules, parrapport à une culture infectée par le DHBV non traitée avec un dérivé nucléosidique.
RESULTATS VIROLOGIQUES
Tests I IIV:
Les composés dont la synthèse est décrite dans la présente demande de brevet, et25 les structures données dans la description de l'art antérieur, ont un effet sur
l'inhibition de la replication du virus HIV-1 BRU (BRU:souche virale expérimentée)
dans le cas où les cellules infectées sont du type MT4.
Dans le tableau I ont a décrit les résultats des tests. La colonne 1 donne le nom des
composés étudiés les plus représenlalirs, et dans la colonne 2 sont reportées les
30 valeurs dites IC50 (concentration de composant donnant 50% d'inhibition de laréplication du virus HIV dans des cellules MT4 infectées, mesurée au jour J7 après
l'infection). Par observation et comptage du nombre de syncitia formés par rapport à
celui compté dans le cas de cellules MT4 infectées mais non traitées par le composé
antiviral, la valeur du IC50 est déterminée.
WO 9S/32200 ~4 PCT/FR95/00683
., ",,, ~
Tests DBHV:
Les composés décrits les plus représe~talir~, ont été testés pour leur effet sur la
replication du virus Duck HBV (DHB\/) selon le protocole exposé dans la partie
expérimentale de ce document.
Dans le tableau 2 sont décrits les résultats des tests.
Abréviations:
AcOEt: acétate d'éthyle
ADN: acide désoxyribonucléique
APTS: acide para-toluène sulfonique
ARN: acide ribonucléique
AZT: 3'-azido-2'-3'-dideoxy-thymidine ou Zidovudine
BOP: hexafluorophosphate de be"~ul,i~olyloxytrisdiméthyl-aminophos phonium
CCM: chromatographie sur couche mince
15 DCC: N,N'-dicyclohexylcarbodiimide
DCU: N,N'-dicyclohexylurée
DIEA: N,N-diisopropyl N-éthylamine
DMF: N,N-diméthylro""a",ide
DHBV: Duck hepatitis B Virus
20 FAB+: "Fast positiv Atomic Bombardment"
3HdTTP: Thymidine triphosphatée ~.lio~.live à 1 mCUml
HOBT: 1-hydroxybenzotriazole
IR: infra-rouge
PF: point de fusion
25 RMN: resonnance magnétique nucléaire
SIDA: syndrome de l'immunodéfil,ience ~cq~ise
SM: spe~;l,ur"t:l,ie de masse
TBAF: fluorure de tétrabutyla",mo~ fn
TBDPSCI: chlorure de tétrabutyldiphénylsilyle
30 3-TC: (-)-(2R,3S)-2-hydroxyméthyl-5-(cytosine-1'-yl)-1.3-oxdll~iolane ou Lamivudine
TCIU: unités infectieuses
THF: tétrahydrofuranne
TPM: tours par minute
TsCI: chlorure de tosyle
35 UV: ultra-violet
VIH: Virus de l'immunodeficience humaine
VHB: Virus de l'hepatite B
VTLH: Virus des cel' lles T Iymphotropiques humaines
WO9~it32200 ~ ~ 6 7 9 3 0 PCT/FR9~1/OOC83
Tab5 Effet des nucléosides selon l'invention sur l'inhibition de la replication
du virus HIV-1, exprimés sous la somme de ICso
Composés COMPOSES IC50
N
9 ~100 ,uM
1 0 1 -1 0 ~M
8 1 0 ,uM
W095/32200 2~ 6 7~ 3 (1 16 PCT/~R95100683
Composés COMPOSES IC50
N
2 0.1~ M
11 ~100 ,uM
BCH-189 1 ~uM
(produit de
référence)
WO 95/32200 ~ 7 2 1 6 7 9 3 ~ PCT/FR95/00683
Tableau ll
Effet des nucléosides selon l'invention sur l'inhibition de la replication
du virus DHBV
Composés COMPOSES IC50
N
BCH-189 1 10.5 I M
(composé de
référence)
210.5 ,uM
8 2~M
9 2~uM
WO 9S/32200 2 ~ ~ ~
11) ~ 9 3-~ 18 PCT/FR95100683
Composés COMPOSES IC50
1 0 2 ,uM