Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
~ WO 95/2580~ 2 1 ~ ~ 2 ~
I
ADENOVIRUS RECOM9INANT5 CODANT POUR LE FACTEUR NEUROTROPHIQUE DERIVE DU
CERVEAU (BDNF)
La présente invention concerne des vecteurs l~ d'origine virale et
leur utilisation pour le traitement et/ou la prévention des maladies r~ vu~ el~iL;vc O.
s Plus ~f~lLi.,ul;èlellleliL, elle concerne des adénovirus r~PfntnhinAntc comportant une
séquence d'ADN codant pour le facteur ~ ulvLI~lli lue dérivé du cerveau (BDNF,
"brain-derived r~ivLlvpll;c factor"). L'invention concerne egalement la préparation de
ces vecteurs, les ~ Af~ ` les contenant et leur utilisation
Lllél,lpeuL~uè, notamment en thérapie génique.
0 Les maladies l~ulvdc~ aL;veo le~ lLel,L une large part des dépenses de
santé dans les pays orf~iflf~nt~ Y, pa~t qui ne cesse de s'accroitre suite au v;~
de la population. Au titre de ces affe.~,tions, on peut citer notamment la maladiê
d`Alzheimer, le maladie de Parkinson, la chorée de ~ ntingtnn, la sclérose latérale
fllll.rULlv~lui~e~-. etc. Les signes ~ et l'étiologie de ces maladies sont fort
variés, mais toutes ces maladies résultent d'une pe~te l,lv,i leOO;~ de ceriulesneuronales dans le systeme nerveu~.~ central, patfois au sein de structure très localisées
comme la substance noire dans la maladie de Parkinson Bien que certains traitements
rhorm~r~f~ln~if~ PC palliatifs soient déjà disponibles, leurs effets sont li,1,3L~..,~.L
limités La présente invention décrit une approche Ill.~Al~..l;rl~,f~ nouverie,
20 r^-tirll~iPtPmPnt avantageuse pour le traitement de ces maladies. Plus ~O.I;.~"':.` ~,.,I
la présente invention décrit des vecteurs permettant de IJlull~uuvv;l d;i`éeLelll~llL la
su.~vie des ceriules nenales impliquées dans ces rAthnlngiPc, par expression efficace
et localisée de cerLains facteurs lrophiques.
Les facteurs trophiques sont une classe de molécules ayant des propriétés de
2s stimu'iation de la croissance neuritique ou de la survie des cel1iules nerveuses. Le
premier facteur possédant des propriétés ll~uuvLiu,ul,iq~_O, le NGF ("Nerve Gro vth
Factor"), a été caractérisé i'i y a une quarantaine d'années (pour revue, voir Levi-
Montalcini et Angelleti, Physiol. Rev. 48 (1968) 534). Ce n'est que récemment que
d`autres facteurs lleuiuLiul,l,;q~,~O ont été identifiés, et notamment le facteur
I.~ vLru~ll; Lue dérivé du cerveau (BDNF) ~'Thoenen, Trends in NeSci. 14 (199I)165). Le BDNF est ume protéine de 118 acides aminés et de poids molécu'iaite 13,5
kD. Tin vitro, le BDNF stimule la fotmation de neurites et la survie en cu'iture des
neutvneS v ~' eO de la rétine, des muLvlleuuvllf~ de la moelle épiniète, des
~ 8~2QO
w095/25804 r~l/r~C
neurones ,' ' ~ . du septum ainsi que des neurones I I .. i du
- (revue par Lindsay in N~ UULIUI~I~;C Factors, Ed, (1993) 257, Academic
Press). Toutefois, bien que ses prûpriétés soient i...~., I'application
11,. .,.~,. ..1;.1...~ du BDNF se heurte à différents obstacles. En particulier, I'absence de
S ~ du BDNF limite toute utilisatiûn Ill~ A~ Par ailleu~s, il n'existe
pas de moyens efficaces permettant de délivrer le BDNF de manière durable et
localisée à certaines régions desirées de l'organisme. Enfin, il est essentiel que le
BDNF délivré soit actif et puisse exercer une activité l~ in vivo.
La présente invention appotte une solution IJal Liculi~ lcl.L avantageuse à ces
problèmes. La présente invention réside en effet dans la mise au point de vecteurs
,a.~i~ul;~le.,.e.l~ efficaces pour délivrer in vivo et de manière localisée, des quantités
actives de BDNF. Dans la demande copendante n
PCTIEP93/02519, il a été montré que les adenovirus pouvaient etre utilisés pour le
5 transfett de gènes in vivo dans le système nerveux. La présente invention concerne des
~;VIIsLluc~iul~s nouvelles, ~a~ ,uli~ L adaptées et efficaces pour le transfert d'un
gène spécifique dans le système nerveux. Plus I L~ uli~ ll~,lll, la présente invention
concerne lm adénovirus l~col~birlal-L ~:VIII~II ' une séquence d'ADN codant pour le
facteur nèulVLIUI lli.l..s dérivé du cerveau (BDNF), sa préparation, et son utilisation
20 pour le traitement etlou la prévention des maladies r..~vd~ aLvc:~.
La d~lllàl~ a maintenant montré qu'il est possible de construire des
adénovirus ~ contenant une séquence codant rour le BDNF, d'ddllliul;i~L~
ces adénovirus ~ in vivo, et que cette ' ~ l rermet une
expression stable et localisée de quantités al~ actives de BDNF in vivo,
2s et en particulier dans le systeme nerveux, et sans effet cyt~lrS~ iq~ Les
propriétés particulièrement avantageuses des vecteurs de l'invention découlent
notamment de la consttuction utilisée (adénovirus défectif, délété de certaines régions
virales), du promoteur utilisé pour l'exrression de la séquence codant pour le BDNF
(promoteur viral ou tissu-spécifique de préférence), et des méthodes d'~
30 dudit vecteur, permettant l'exrtession erficace et dans les tissus appropriés du BDNF.
La présente invention foutnit ainsi des vecteurs viraux utilisables di e~t~ .lL en
thérapie génique, particulièrement adaptés et efficaces pour diriger l'expression du
BDNF in vivo. La présente invention offre ainsi une nouvelle approche
particulièrement avantageuse pour le traitement et/ou la prévention des maladies35 I~uuvd~ aLv~.
2 1 8~2~
wo ss/2s804 . ~ ~
Un premier objet de l'invention réside donc dans un adénovirus "~. "~
défectif ;ul}lp~ llL une séquence d'ADN codant pour le facteur l-., u-,L-~l~ uedérivé du cerveau (BDNF) ou un dérivé de celui-ci.
L'invention a également pour objet l'utilisation d'un tel adénovirus
s e ' ~ défectif pour la préparation d'ume ~:o~ ~s;[io~ P~ -^ destinée
au traitement ou à la prévention des maladies llèu ud~ .dLive~.
Le facteur rl~uLIu~ ue dérivé du cerveau (BDNF) produit dans le cadre
de la présente invention peut être le BDNF humain ou un BDNF animal. La séquenced'ADN codant pour le BDNF humain et pour le BDNF de rat a été clonée et
0 séquencée (l\l~;~u,~ ,e et al., Genomics 10 (1991) 558), ainsi que notamment la
séquence codant pour le BDNF de porc (Leibrock et al., Nature 341 (1989) 149).
Prpr~ sment à leur illcul~Julaliull dans un vecteur adénovirus ælon l'invention, ces
séquences sont d~ modifiées, par exemple par m~lf9~n9~P dirigée, en
particulier pour l'insertion de sites de restriction appropriés. Les séquences décrites
dans l'art antérieur ne sont en effet pas construites pour une utilisation selonl'invention, et des adaptations préalables peuvent s'avérer nécessaires, pour obtenir des
e,.~l eS .;UI~S illl~UI Lall~e~ (voir exemple 1.2.) . Dans le cadre de la présente invention, on
préfère utiliser ume séquence d'ADN codant pour le facteur ~ UL-u~ dérivé du
cerveau humain (hBDNF). Par ailleurs, comme indiqué ci-avant, il est également
possible d'utiliser ume :u-~LIue~iull codant pour un dérivé du BDNF, en particulier un
dérivé du BDNF humain. Un tel dérivé comprend par exemple toute séquence obtenuepar mutation, délétion et/ou addition par rapport à la séquence native, et codant pour
un produit conservant l'une au moins des propriétés biologiques du BDNF (effet
trophique et/ou di~él, ). Ces ".~ ;ri.~ peuvent être réalisées par les
2s techniques connues de l'homme du métier (voir techniques générales de biologie
moléculaire ci-apres et exemple 2). L'activité biologique des dérivés ainsi obtenus peut
ensuite être aisément ~PfP minPP, comme indiqué notamment dans l'exemple 3.. Lesdérivés au sens de l'invention peuvent également être obtenus par hybridation à pattir
de banques d'acides nucléiques, en utilisant comme sonde la sequence native ou un
30 fragment de celle-ci.
Ces dérivés sont notamment des molécules ayant une plus grande affinité
pour leurs sites de fixation, des séquénces permettant une expression améliorée rn
vivo, des molécules présentant une plus grande résistance aux protéases, des molécules
Wo 9s/2s804 A _ I Ir ~ t r
ayant une efficacité ~ plus grande ou des effets secondaires moirldres, ou
év~nh~ m~nt de nouvelles propriétés hi~ giq-
~
Parrni les dérivés préférés, on peut citer plus particulièrement les variantsnah~rels, les molécules dans lesquelles un ou plusieurs résidus ont été substitués, les
s dérivés obtenus par délétion de régions 1l' ul~el ~ ~.lalll pas ou peu dans l'interaction avec
les sites de liaison considérés ou exprimant une activité indésirable, et les dérivés
comportant par rapport a la séquence native des résidus su~ e:~, tels que par
exemple un signal de sécrétion et/ou un peptide de jonction. De manière
pà~ie~l;è~elllcll~ d~a..Lav~e, la séquence de la préænte invention code pour le
lo BDNFprécédé de la région pro native (proBDNF).
Par ailleurs, il est ~alLi~ .èl~ lL important pour une meilleure mise en
oeuvre de la présente invention que la séquence utilisée contienne également un signal
de sécrétion permettant de diriger le BDNF synthétisé dans les voies de sécrétion des
oellules infectées, de manière à ce que le BDNF synthétisé soit libéré dans les
15 Culll~al Li~ A " ~ et puisse activer ses récepteurs. Le signal de sécrétion
est av ' V ' le propre signal du BDNF. Mais il peut également s'agir d'un
signal de secrétion hétérologue ou meme artificiel.
La séquence d'ADN codant pour le facteur ll~,uuL u~l-iu~.~ dérivé du cerveau
20 utilisée dans le cadre de la présente invention peut être un ADNc, un ADN génomique
(ADNg), ou une ~:u--~L~ucLiu~l hybride consistant par exemple en un ADNc dans lequel
seraient insérés un ou plusieurs introns. Il peut également s'agir de séquences
.Ll.éLi-iu~ ou ~el.li~y--Ll,éLi-l..w. Il est à noter que dans la séquence génomique
codant pour le BDNF, les introns sont localisw dans lw régions non codantes. De
25 manière ~a~ ,ul;è.ell,~..L avanhageuse, on utilise un ADNc ou un ADNg. En
particulier, I'utilisation d'un ADNg peut permettre une meilleure expression dans les
cellules humaines.
Dans un premier mode de réalisation de l'invention, I'ddel-UY;-us comprend
donc une séquence d'ADNc codant pour le facteur llèuluLlu~ , dérivé du cerveau
30 (BDNF). Dans un autre mode de réalisation préféré de l'invention, I'd~é..uv;.u~
comprend une séquence d'ADNg codant pour le facteur llèuuuLLulJIl;~ue dérivé du
cerveau (BDNF). AY~ - l la séquence d'ADN code pour le proBDNF et, de
preférence, le préproBDNF.
Wo 95/25804 2 ~ 8 ~ r~ c t
s
Av l~y~r.~rll.. - 1 la séquence codant pour le BDNF est plac~e sous le
contrôle de signauA permettant son expression dans les cellules nerveuses.
Préférr^~iPIlPmPnt il s'agit de signaux l'eA~ ;U~ élélulog.l~,:" c'est-à-dire de
si~naux différents de ceuA naturellement lP~ de l'expression du BDNF. Il
5 peut s'agir en particulier de séquences " ~ de l'expression d'autres protéines,
ou de séquences byilalr~ ... Notamment, il peut s'agir de séquences ~ vlli~eS degènes eucaryotes ou viraux. Par exemple, il peut s'agir de séquences ,c,ulllul;cèb
issues du génome de la cellule que l'on désire infecter. De même, il peut s'agir de
séquences 1~ r5 issues du génome d'un virus, y compris l'adc~.uv;lus utilisé. A
l o cet égard, on peut citer par exemple les promoteurs ElA, MLP, CMV, LTR-RSV, etc.
En outre, ces séquences d'~Aplr,D~;vll peuYent être modifiées par addition de séquenoes
d'activation, de régulation, ou permettant une expression tissu-spécifique. Il peut en
effet être 1~ lir~ . ll intéressant d'utiliser des signaux dl~,AI.IL.,.~.. JII actifs
r;~l - - -- -1 OU llaj~liLall~ dans les oellules nerveuses, de manière à ce que la
5 séquence d'ADN ne soit exprimée et ne produise son effet que lorsque le virus a
err~Lv~ infecté une cellule nerveuse. A cet égard, on peut citer par exemple lespromoteurs de l'énolase neurone-spécifique, de la GFAP, etc.
Dans un premier mode de réalisation particulier, I'rnvention concerne un
adénovirus ~ CUIIIb;~ défectif ~u---~". une séquence d'ADNc codant pour le
20 facteur ,,~ullù~ll;que dérivé du cerveau humain (hBDNF) sous le contrôle du
promoteur LTR-RSV.
Dans un autre mode de réalisation particulier, I'invention conceme un
adénovirus ., - défectif comprenant une séquence d'ADNg codant pour le
facteur rl~u~lv~ u~ dérivé du cerveau humain (hBDNF) sous le contrôle du
2s promoteur LTR-RSV.
La Irll~ - a en effet montre que le promoteur LTR du virus du
sarcome de rous (RSV) permettait une expression durable et importante du BDNF
dans les cellules du système nerveux, notamment central.
Toujours dans un mode préféré, I'invention concerne un adénovirus
30 ~r~ = ' défectif culll~lcllal-i une séquence d'ADN codamt pour le facteur
n~ullu~ dêrivé du cerveau humain (hBDNF) sous le contrôle d'un promoteur
permettant une expression majoritaire dans le système nerveux. Un mode
IJal~;cUl;èlel~ ll préféré de mise en oeuvre de la présente invention réside dans un
adénovirus recombinant défectif comprenant les séquences ITR, une séquence
35 permettant l'- ~ . une séquence d'ADN codant pour le &cteur
2~ 8~2~
Wo 95/25804 P~llr~, ~v O
AeV1~ dérivé du cerveau humain (hBDNF) ou un dérivé de celui-ci sous lecontrôle d'uA promoteur permettant uAe expression majoritaire dans le système
nerveux, et dans lequel le gène E1 et au moins un des gènes E2, E4, L1-L5 est non
s Les adénovirus défectifs selon l'invention sont des adénovirus iAcapables de se
répliquer de façon autonome dans la cellule cible. G, ' t, le génome des
adénovirus défectifs utilisés dans le cadre de la présente invention est donc dépourvu
au moins des séquences nécessaires à la réplication dudit virus dans la cellule infectée.
Ces régions peuvent être soit éliminées (en tout ou en partie), soit rendues non-
" " soit substituées par d'autres séquences et notamment par la séquence
d'ADN codant pour le BDNF.
PréfPrPntipllpmpnt~ le virus défectif de l'invention conserve les séquences de
son génome qui sont nécessaires à 1'~ des particules virales. Encore plus
préférPntiPIlPmPnt comme indiqué ci-avant, le génome du virus ~ défectif
selon l'invention comprend les séquences rrR, une séquence permettant
r. ~ . Ie gène El non fonctionAel et au moins un des gènes E2, E4, L,1-L5
non r~
Il existe différents sérotypes d'adenovirus, dont la structure et les propriétésvarient quelque peu. Parmi ces sérotypes, on préfère utiliser dans le cadre de la
présente invention les adénovirus humains de type 2 ou 5 (Ad 2 ou Ad 5) ou les
adénovirus d'origine animale (voir demande FR 93 05954). Parmi les adénovirus
d'origine animale utilisables dans le cadre de la presente invention on peut citer les
adénovirus d'origine canine, bovine, murine, (exemple: Mavl, Beard et al., Virology
75 (1990) 81), ovine, porcine, aviaire ou eAcore simienAe (exemple: SAV). De
2s préférence, I';ldé,~ ;.vs d`origine aAimale est un adénovirus canin, plus
UA adénovirus CAV2 [souche manhattan ou A26/61 (ATCC VR-
800) par exemple]. De préférence, on utilise daAs le cadre de l'invention des
adénovirus d'origine humaine ou canine ou mixte.
Les adénovirus ~ défectifs selon l'invention peuvent être préparés
par toute technique cormue de l'homme du métier (Levrero et al., Gene 101 (1991)195, EP 185 573; Graham, EMBO J. 3 (1984) 2917). En particulier, ils peuvent être
préparés par l~ "- homologue entre un adénovirus et un plasmide portant
entre autre la séquence d'ADN codant pour le BDNF. La ~ homologue se
produit après co-transfection desdits adénovirus et plasmide dans une lignée cellulaire
W095/~5804 2 ~ Q~ /r~ -
appropriée. La lignée cellulaire utilisée doit de preférence (i) être ~ r~"ll.~ par
lesdits éléments, et (ii), comporter les séquences capables de ~ Ia pa~tie
du génome de l'Gdéll.,virus défectif, de préférence sous forme intégrée pour éviter les
risques de ~ A titre d'exemple de lignée, on peut mentionner la lignee de
rein, ' ~IUIGil>a humain 293 (Graham et al., J. Gen. Virol. 36 (19~.7) 59) qui
contient nrf~ nPnt. intégrée dans son génome, la partie gauche du génome d'un
adénovirus Ad5 (12 %). Des stratégies de uvl~L u~ de vecteur~ dérivés des
adénovirus ont également été décrites dans les demandes n FR 93 05954 et
F'R 93 08596 qui sont illc~ à la présente par référence.
Ensuite, les adénovirus qui se sont multipliés sont récupérés et purifiés selon
les techniques classiques de biologie moléculaire, comme illustré dans les exemples.
Comme indiqué ci-avant, la présente invention concerne également toute
utilisation d'un adénovirus tel que décrit ci-dessus pour la préparation d'une
destinée au traitement etlou à la prévention des maladies
~ ;V~. Plus }~G-Li~uli~ ,l.L, elle conceme toute utilisation de ces
adénovirus pour la préparation d'une ~ 1-1, "~ q~p destinée au
traitement et/ou à la prévention de la maladie de Parkinson, de la maladie d'Alzheimer,
de la sclérose latérale Glll~ LIu~lliu,~.., (ALS), de ia nialadie d'T~ntin~t--n de répilepsie
et de la démence vasculaire.
La présente invention concerne également une e~mrt~e*if,n l~
uulll~ alll un ou plusieurs adénovirus IPf~ dé&cti& tels que décrits
pl~ I Ces ~ l ", P~ peuvent être formulées en vue
d'h~LIluli~Ll~lliw~ par voie topique, orale, parentérale, intranasale, vciu.~,~,; I "" ,~, ,,l..: ~, sous-cutanée, illll~10CUlailt~ U . etc. De préférence, les
25 e~ P~ -. de l'invention contiennent un véhicule ,vl-a..l.a~
tiquement acceptable pour une formulation injectable, notamment pour une injection
directe dans le système nerveux du patient. Il peut s'agir en particulier de solutions
stériles, i~t~niq -P~. ou de ~:O~I.p~a;liO.~S sèches, notamment Iyophilisf~es, qui, par
addition selon le cas d'eau stérilisée ou de sérum IuI.~iulogiqu~, permettent la30 ~ 4,lilulic..l de solutes injectables. L'injection directe dans le système nerveux du
patient est dVa~ . car elle permet de concentrer l'effet ll~PI,~ IJ au niveau
des tissus affectés. L'injection directe dans !e système nerveux central du patient est
1 réalisée au moyen d'un appareil d'injection ~L~ Ld~ u~:. L'emploi
d'un tel appareil permet en effet de cibler avec une grande précision le site d'injection.
wos5/2580s ~ 2~ rl ~
A cet égard, I'invention concerne également une méthode de traitement des
maladies lleuL~ n~.dliv~ comprenant 1'~ l a un patient d'un adénovirus
,~.",.1,;..~"1 tel que défini ci-avant. Plus pG LiCu]i,:.el..~, l'invention concerne une
méthode de traitement des maladies l.~ UU ~ ldliV~ comprenamt 1'~
s ~L~L~. ~ique d'un adénovirus recombinant tel que défini ci-avant.
Les doses .I'~ )ViLU~ le~,blll~ GIlL défectif utilisées pour l'injection peuventêtrê adaptées en fonction de différents paramètres, et notammênt en fonction du mode
II utilisé, de la pathologie concernée ou encore dê la durée du traitement
recherchée. D'une manière générale, les adénovirus le~ selon l'invention sont
formulés et administrés sous forme de doses comprises ent~e 104 et 1014 pfulml, et de
préférence 106 à 1010 pfu/ml. Le terme pfu ("plaque forming unit") correspond aupouvoir infectieux d'une solution de virus, et est déterminé par infection d'unê culture
cellulaire appropriée, puis mêsure, c~ l après 48 heures, du nombre de plages
de cellules infectées. Les techniques de ~ 1 du titre pfu d'une solution virale
sont bien .~. u ".. ~f.'.: dans la littérature.
Un autre objet de rinvention conoerne toute cellule de mammifère mfectée par
un ou plusieurs adénovirus IP.~ defectifs tels que décrits ci-dessus. Plus
i~,UIi~L~ ll, I'invention concerne toute population de cellules humaines infectée
par ces adénovirus. Il peut s'agir en particulier de fihn~hlo~fPc myoblastes,
20 hépatocytes, I~t ld~inO~ , cellules Pn~ thPliAIPi cellules gliales, etc.
Les cellules selon l'invention peuvent etre issues de cultures primaires. Celles-
ci peuvent être prélevées par toute technique connue de rhomme du métier, puis mises
en culture dans des conditions permettant leur prolifération. S'agissant plus
particulièrement de fihn~h~o~tP~, ceux-ci peuvent être aisément obtenus à partir de
2s biopsies, par exemple selon la technique decrite par Ham [Methods Cerl.Biol. 21a
(1980) 255]. Ces cellules peuvent être utilisées diLe~Lt~ llL pour l'infection par les
adénovirus, ou conservees, par exemple par ~ n~PiAtifm, pour 1'~ de
banques autologues, en vue d'une utilisation ultérieure. Les cellules selon l'invention
peuvent également être des cultures secondaires, obtenues par exemple à partir de
30 banques préétablies.
Les cellules en culture sont ensuite inffflées par des adénovrrus
,.~.,,,11~;.,~."~, pour leur conférer la capacité de produire du BDNF. L'infection est
réalisee in vitro selon des techniques connues de l'homme du métier. En particulier,
selon le type de cellules utilisé et le nombre de copies de virus par cellule désiré,
3s rhomme du métier peut adapter la multiplicité d'infection et i,.~ I fl'~ Ie nombre
wossl2s8o~ 2 1 842GO ~l/r~
de cycles d'infection réalisé. Il est bien entendu que ces étapes doivent être effectuées
dans des conditions de stérilite appropriées lorsque les cerlules sont destinées a une
r ' ~Li~ in vivo. Les doses d'adénovirus rèc~lllbindlll utilisées pour l'infection
des ceLules peuvent être adaptées par l'homme du métier selon le but recherché. Les
s conditions décrites ci-avant pour l'r~ in vivo peuvent être appliquées à
l'infection in vitro.
Un autre objet de rinvention concerne un implant ~:O~ lell~L des cellules
mammifère infectées par un ou plusieurs adénovirus ~ défectifs telles que
décrites ci-dessus, et une matrice ~ ^ e. Préfén~nt~ m~ t, les implants selon I'invention ~,ollllJI~,l~nC.~L 105 à lol cellules. Plus préfér~ lPm~nt, ils en
106 à 108.
Plus ~ lelllell~, dans les implants de rinvention, la matrice
extracellulaire comprend un compose gélifiant et év~nt~ ml~nt un support
permettant l'ancrage des ceriules.
Pour la préparation des implants selon l'invention, différents t,vpes de
gélifiants peuvent être employés. Les gélifiants sont utilises pour l'inclusion des cellules
dans une matrice ayant la cnn~titl-tinn d'un gel, et pour favoriser l'ancrage des cellules
sur le support, le cas échéant. Différents agents d'a&ésion cellulaire peuvent donc être
utilisés comme gélifiants, tels que notamment le collagène, la gélatine, les
20 ~Iy~ll~ o~ly~ , la ~il,.wle~ e, les lectines, etc. De préférence, on utilise dans le
cadre de la présente invention du collagène. Il peut s'agir de collagène d'origine
humaine, bovine ou murine. Plus prefér~n~ m~nt on utilise du collagène de type 1.
Comme indiqué ci-avant, les l~ kl~ - selon l'invention ~ lelul~
AvA~ r,.- ~ un support permettant l'ancrage des cellules. Le terme ancrage
2s désigne toute forme d'illt~.d~ biologique et/ou chimique et/ou physique entrdînant
l'a&ésion et/ou la fixation des cellules sur le support. Par ailleurs, les cellules peuvent
soit recouvrir le support utilisé, soit pénétrer à l'intérieur de ce support, soit les deux.
On préfère utiliser dans le cadre de l'invention un support solide, non toxique et/ou
bio-compatible. En particulier, on peut utiliser des fibres de ~ n~ eLllylèl~e
30 (PI~E) ou un support d'origine biologique.
Les implants selon l'invention peuvent étre implantés en différents sites de
l'organisme. En particulier, 1';",l,' A~ ll peut être effectuée au niveau de la cavité
r-~ritnn~, dans le tissu sous-cutané (région sus-pubienne, fosses iliaques ou
inguinales, etc), dans un organe, un muscle, une tumeur, le système nerveux central,
wog5n5804 2~ ;8~2~ P l/r~
ou encore sous une muqueuse. Les implants selon l'invention sont pd Li~,uliè.~ lt
avantageux en ce æns qu'ils permettent de controler la libération du produit
ll,f~ dans l'organisme: Celle-ci est tout d'abord déterrninée par la multiplicité
d'infecuon et par le nombre de cellules implantées. Ensuite, la libération peut être
s contrôlée soit par le retrait de l'implant, ce qui arrête .i~rti~ ,.,t le traitement, soit
par l'utilisation de systèmes d'~)-~;v-- régulable, permettant d'induire ou de réprimer
l'expression des gènes 1~
La présente invention offre ainsi un moyen très efficace pour le traitement ou
la prévention des maladies .-eulu~ éld~iv~. Elle est tout particulièrement adaptée
au traitement des maladies d'Alzheimer, de Parkinson, de ~--nfln~ffm et de rALS. Les
vecteurs d~ v~ilfJu,~ ælon l'invention présentent en outre des avantages importants,
lies notamment à leur très haute efficacité d'infection des cellules nerveuæs,
permettant de réaliær des infections à partir de faibles volumes de suspension virale.
De plus, I'infection par les adénovirus de l'invention est très localisée au site d'injection,
ce qui évite les risques de diffusion aux structures cérébrales voisines.
En outre, ce traitement peut concerner aussi bien l'homme que tout animal tel
que les ovins, les bovins, les animaux ~ (chiens, chats, etc), les chevaux, les
poissons, etc.
La présente invention sera plus c .~ décrite à l'aide des exemples
qui suivent, qui doivent être considérés comme illustratifs et non limitatifs.
Lf~ende des f~ res
hgure 1: Rt l..~s~..i< ii~JI~ du vecteur pXL2244
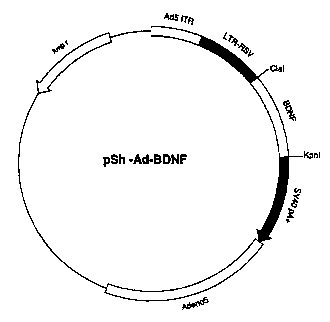
Figure 2: Représentation du vecteur pSh-Ad-BDNF
2s Techni~les ~énérales de biolo~ie ~
Les méthodes l'~ lf~ utiliæes en biologie moléculaire telles que les
extractions yl~fll~Lv~ d'ADN 1~ , la f f~ntrif~ finn d'ADN 1~ ;fll~f en
gradient de chlorure de césium, l~ JIIUI~ sur gels d'agarose ou d'acrylamide, lapufification de fragments d'ADN par f I~,L uéluLioll~ les extraction de protéines au
30 phénol ou au phénol-~ ,-vru--l-e, la précipitation d'ADN en milieu salin par de
l'éthanol ou de l'isopropanol, la L~ ru~ ALiull dans Escherichia coli, etc ... sont bien
connues de l'homme de métier et sont ill ( .. " 1~, . ~ 1 l décrites dans la littérature [Maniatis
T. et al., "Molecular Cloning. a Laboratory Manual", Cold Spring Harbor Laboratory,
woss/2s80.1 2 ~ /r~_~
Cold Spring Harbor, N.Y., 1982; Ausubel F.M. et al. (eds), "Current Protocols inMolecular Biology", John Wiley & Sons, New York, 1987].
- Les plasmides de type pBR322, pUC et les phages de la sêrie M13 sont
d'origine W~ iC (Bethesda Research 1.~ . " ;~
s Pour les ligatures, les fragments d'ADN peuvent être séparés selon leur taille
par ~lF.l~v~ vl~e en gels d'agarose ou d'~ ld~lu i~, extraits au phénol ou par un
mélange phénoVchloroforme, précipités à l'éthanol puis incubés en présence de l'ADN
ligase du phage T4 (Biolabs) selon les -~ du fournisseur.
Le ~r~ ;r- des extrémités 5' IJIV~ Ul.. ~ peut être effectué par le
10 frdgment de Klenow de l'ADN Polymérase I d'E. coli (Biolabs) selon les ~ ,r;- ~
du fil -~;c~ . La destruction des extrémités 3' lulvèl~ est effectuée en prêsence
de l'ADN Polymérase du phage T4 (Biolabs) utilisée selon les .~ - du
fabricant. La destruction dês extrémités 5' ~JIvélll-....l-~., est effectuée par un traitement
ménagé par la nucléase Sl.
Ld ~u F~ dirigée in vitro par oli~odév~llu~levLdè~ ~lltl.éLi~ue~ peut
être effectuée selon la méthode développée par Taylor et al. [Nucleic Acids Res-(1985) 8749-8764] en utilisant le kit distribué par Amersham.
L'~ ,l,r;. ~ ;que de fragments d'ADN par la technique dite de PCR
Lolymérase-catalyzed Chain _eaction, Saiki R.K. et al., Science ~Q (1985) 1350^
1354; Muliis K.B. et Faloona F.A., Meth. Enzym. 1~ (1987) 335^350] peut être
effectuée en utilisant un "DNA thermai cycler" (Perkin Elmer Cetus) selon les
du fabricant.
La vérification des séquences '~ ' . peut etre effectuée par la méthode
développée par Sûnger et al. [Proc. Natl. Acad. Sci. USA, 74 (1977) 5463-5467] en
utiiisant le kit distribué par Amersham.
ExemDles
Exemple 1: Col.,~, . du vecteur pSll-Ad-BDNF.
Cet exemple décrit la :vlliflucl;vll d'un vecteur ,Vl~ une séquence
d'ADN codant pour le BDNF sous le contrôle d'un promoteur constitué par le LTR du
virus du sarcome de rous (LTR^RSV).
1.1. Vecteur de départ (pXL2244): Lê piasmide pXL2244 contient l'ADNc de
l'ApoAI sous le contrôle du promoteur LTR du virus RSV, ainsi que des séquences de
rlvv;.us Ad5 (figure 1). D a été construit par insertion d'un fragment Clal^EcoRV
Wo 9s/25804 l ~/r~: .'t ~
12
contenant l'ADNc codant pour la préproApoAI dans le vecteur pLTR RSV-~gal
(Stratford-Perricaudet et al., J. Clin. Invest. 90 (1992) 626), digéré par les même
enzym~es.
1~ Clonage d'un ADNc codant pour le prepro-BDNF. L'ADNc complet
5 codant pour le prepro-BDNF de rat (790 pb) a été cloné à partir d'une banque d'ADN
génomique de rat par la technique de PCR, en utilisant comme amorce les
..1;~;...~". lf~ , suivants:
O~ f lf~ 5': 5'-TTCATCGAATTCCACCAGGTGAGAAG-3' (SEQ lD nl)
Oli ~ tiflf~ 3': 5'-AATATAATCTAGACAACATAAATCC-3' (SEQ ID n"2)
O La région 5' de la séquence obtenue a ensuite été mf~difiée par insertion d'un
site de restriction Clal, 25 bases en amont de l'ATG. Ce site a été introduit par PCR au
moyen des ~ ,..1.5,.1;.1, suivants:
o~ .5~ 5': 5'-TAGCTTCATCGATTTCCACCAG-3' (SEQ ID n3)
O~i~,. ,.~, ., lf~"L;~ l~ 3': 'i'-AATATAATCTAGACAACATAAATCC-3' (SEQ ID n4)
La séquence ainsi obtenue a ensLIite été sous-clonée dans le plasmide pCRlI
(Invitrogen) pour générer le plasmide pCRII-BDNF.
1.3. Construction du vecteur pSh-Ad-BDNF
Cet exemple décrit la Cu.l~LIu.:Liwl du vecteur pSh-Ad-BDNF contenant la
20 sequence codant pour le prepro-BDNF sous controle du LTR du virus RSV, ainsi que
des séquences de l'~dé-luvi-us Ad'i perrnettant la ~ ",~ "-- in vivo.
Le vecteur pCRII-BDNF a eté digére par les enzymes ClaI et Kpnl, et le
fragment de 0,85 kb résultant, contenant la séquence codant pour le prépro-BDNF a
ensuite été isolé et purifié par éle,L.-, ' ~ae sur un gel d'agarose LMP ("Low Melting
2s Point"). PArAll"~ t, le vecteur pXL2244 a été digéré par les mêmes enzyrnes de
reStriction Clal et Kpnl, puis précipité après inactivation de ces dernières. Le vecteur
linéaire résultant, prf~Al~lllf~mf-nt isolé et purifie par ele-,L u,~,',v,~: sur un gel d'agarose,
et le fragment de 0,85 kb ont ensuite été ligaturés pour générer le vecteur pSh-Ad-
BDNF (figure 2).
30 Exemple 2 ~ du Yecteur pSll-Ad-BDNFtag.
Cet exemple décril la Cu.~LIu~Liù-l d'un second vecteur ~ "~"t une
séquence d'ADN de fusion codant pour le BDNF sous le contrôle d'un promoteur
constitué par le LTR du virus du sarcome de rous (LTR-RSV).
Woss/2s80~ 21 8 4 2 0 0 ~l/r~
13
2.1. Géneration de l'ADN de fusion: Dans cet exemple, une forme alternative
- ~ de la séquence d'ADN codant pour le prépro-BDNF a été const~uite. Cette forme a été
obtenue par insertion, à l'extrémité 3' terminale de la séquence décrite dans l'exemple
s 1.2., d'une séquence codant pour un épitope de sept acides aminés (tag) reconnu par
un anticorps disponible ~:u~ h,.l.~ (IBI, Integra Flincci~on~c~ Eaubonne,
France). La séquence de la région ainsi fusionnée est la suivante (SEQ ID n5):
Arg Gly Asp Tyr Lys Asp Asp Asp Asp ***
0 AGA GGC GAC TAC AAG GAC GAC GAT GAC TAG
C-t er Seg, ~ nn,
BDNF
5 La séquence ainsi obtenue a ensuite été sous-clonée dans le plasmide pCRII
(Invitrogen) pour générer le plasmide pCRII-BDNFtag.
2.2. Construction du vecteur pSh-Ad-BDNFtag
Cet exemple décrit la cu~lsl~ uCliull du vecteur pSh-Ad-BDNFtag contenant la
séquence de fusion codant pour le prepro-BDNF sous contrôle du LTR du virus RSV,20 ainsi que des séguences de l'adénovirus Ad5 permettant la ~ l. in vivo.
Le vecteur pCRlI-BDNFtag a été digéré par les enzymes ClaI et Kpnl, et le
fragment de 0,87 kb résultant, contenant la séquence codant pour le prépro-BDNFtag
a ensuite été isolé et purifié par ~ r ~ sur un gel d'agarose LMP ("Low
Melt;ng Point"). r ~ t, le vecteur pXL2244 (exemple 1.1.) a été digéré par les
25 mêrnes enz~vmes de restriction ClaI et Kpnl, puis précipité après inactivation de ces
dernières. Le vecteur linéaire résultant, pr~ m~nt isolé et purifié par
lu~llulè~: sur un gel d'agarose, et le fragment de 0,87 kb ont ensuite été ligaturés
pour générer le vecteur pSh-Ad-BDNFtag.
30 Exemple 3. Fo~ ~;on:~l;t~ des vecteurs pSh-Ad-BDNF et pSh-Ad-BDNFtag
La capacité des vecteurs pSh-Ad-BDNF et pSh-Ad-BDNFtag à exprimer sur
culture cellulaire une forme hi~iq Pml~nt active du BDNF a été démontrée par
lla-l:,rt:~liull transitoire de cellules COS1. Pour cela, les cellules (2.106 cellules par
~1 ~42~
Wo 95/25804 ~ rJvS,'~
14
boite de 10 cm de diamètre) ont été l~ are~éea (8 ,ug de vecteur) en présence deTransfectam. Après 48 heures, le surnageant de culture des cellules a été récolté. Des
dilutions sérielles (1/200 et 1/50) de ce surnageant ont ensuite été ajoutées à des
cultures primaires de neurones du septum (Hefti et al. In Dissection and Tissue
cultures: Manual of the Nervous System (1989) 172, Alan R. Liss, Inc). L'effet
trophique (survie cellulaire et pousse neuritique) sur ces cultures a été observé après
coloration, et l'effet di~réle..L;~ u par dosage de l'expression de l'enzyme choline
acétyl transférase (ChAT), selon la technique décrite par Fonnum (J. Neurochem. 24
(1975) 407).
10 Exemple 4. CO.L~Ll . dec ~d~..v.;. ua ~ tc contenant une âéquence
codant pour le BDNF
4.1. Construction de l'adénovirus Ad-BDNF
Le vecteur pSh-Ad-BDNF a été linéarisé et ~:uLIc~arecL~ avec un vecteur
adénoviral déficient, dans les cellules helper (lignée 293) apportant en trars les
15 fonctions codées par les régions E1 (E1 A et ElB) d'du~.~v v u uS.
Plus ~.éc;.,émcl.L, I'adénovirus Ad-BDNF a été obtenu par ..
homologue in vivo entre l'~ r.uv;-ua mutant Ad-dll324 (Ilu~ d~a~d et al., Cell 31
(1982) 543) et le vecteur pSh-Ad-BDNF, selon le protocole suivant: le plasmide pSh-
Ad-BDNF et l'~é..vvi-us Ad-dll324, linéarisé par l'enzyme Clal, ont été co-
0 transfectés dans la lignée 293 en présence de phosphate de calcium, pour permettre la. ,. . h~m~ g~ Les adénovirus ~ " ~ ainsi générés ont été
'~ ' par purification sur plaque. Après isolement, I'ADN de l'adénovirus
.. ' a éte amplifié dans la lignee cellulaire 293, ce qui conduit à un surnageant
de culture contenant l';~d~ ,v;-u~ défectif ~culllvlll~l~L non purifié ayant un titre5 d'environ 101 pfu/ml.
Les particules virales sont ensuite purifiées par centrifugation sur gradient de. chlorure de césium selon les techniques connues (voir notamment Graham et al.,Virology 52 (1973) 456). L'adénovirus Ad-BDNF peut être conservé à -80C dans 20% de glycérol.
4.2. Construction de l'l~delluviu ua Ad-BDNFtag
wo 9s~25804 2 7 8 4 2 0 0
L'adénovirus Ad-BDNFtag a éte construit selon le meme protocole que
rd~ uvilus Ad-BDNF, mais en utilisant comme vecteur de départ le vecteur pSh-Ad-- BDNFtag.
Exemple 5. Ii~ .o de l'ad,..~, . ;. ~ Ad-BDNF
s La capacité de l'adénovirus Ad-BDNF à infecter des cellules en culture et àexprimer dans le milieu de culture une forme biologiquemeM active du BDNF a été
démontrée par infection des lignées 293 humaine et PC12 de rat. La préænce de
BDNF actif dans le surnageant de culture a ensuite été déterminée dans les mêmesconditions que dans l'exemple 3.
Ces études permenent de montrer que lI~d~ V;LUS exprime bien une forme
.; active du BDNF en culture cellulaire.
Exemple 6: Transfert in YiVo du gène BDNF par un ad,.-~,v;.~ ~c ' à
des rats prcsentant une lésion du fimbria-fornix
Cet exemple décrit le transfert du gène BDNF in vivo au moyen d'un vecteur
adénoviral selon l'invention. Il montre sur un modèle animal de la lésion du fimbria-
fornix, que les vecteurs de l'invention permettent d'induire l'expression in vivo de
quantités ~ de BDNF.
Sur des rats pr~ h~ nt anesthésiés, la voie septo-l~ l ,.a, ~ " 'l);' l- ~ (fimbria-
forrlix) a été sectionnée au niveau de l'l~ c gauche. Cette lésion mécanique a
été réalisée à l'aide d'un couteau chirurgical rétractable. Les :w-dulnJlé~
~Li~ ~iuu~ utilisées à cet effet sont, par rapport au bregma: AP: -1,7; ML: +1,5;
V: -5,5 à -0,5.
L'adénovirus recombinant BDNF a été injecté ' ' après la lésion,
dans le noyau médian du septum et dans la partie dorsale de l'ili~ a.l-l,e déafférenté
(~ ~ du coté de la lésion). Plus IJI~ uliè~ ,.LL, I'adénovirus injecté est
r;~&~ vilu~ Ad-BDNF préparé dans l'exemple 4.1., utilisé sous forme purifiée
,5 106 pfu/~l), dans une solution saline phosphate (PBS).
Les inje~tions sont réalisées à l'aide d'une canule (diamètre extérieur 280 ~lm)connectée à une pompe. La vitesse d'injection est fixée à 0,5 Ill/min, après quoi, la
canule reste en place pendant 4 minutes ~ ,Y-~ S avant d'être remontée. Les
Wo 95/2580~ 2 1 ~ 4 2 ~ J/r~ . 01
16
volumes d'injection dans l'~ et le septum sont le~e~ive~ L 3 ,ul et 2 ~LI.
La ~ .ILii~ l d'adénovirus injectée est de 3,5. 106 pfu/~
Pour l'injection dans l'hirr~nr~, les ~8~ éle~ ue~ sont les
suivantes: AP=4; Ml,=3,5; V--3,1 (les l:WII' ' AP et ML sont .l~ .,... par
s rapport au bre~ma, la CWI~ V par rapport à la surface de l'os crânien au niveau
du bregma.
Pour rinjection dans le septum, les :wld~ Léli' , sont les
suivantes: AP=1; Ml,=1; V=-6 (les cwrdonnées AP et Ml, sont ~ par
rapport au bregma, la coordonnée V par rapport à la surface de l'os crânien au niveau
~o du brêgma. Dans cette condition, la canule présente un angle de 9 degrés par rapport à
la verticale (dans le sens médio-latéral) afin d'éviter le sinus veineux médian.
Les effets ~ de l'hl~ de l'_.l~ ,v;~us selon l'invention
ont été mis en évidence par trois types d'analyse: une analyse 1 ~I.~T~ et
. une analyse quantitative et une analyse C~ elll~ lle.
5 Anh¦~vsehicfolo~ic--.oeti.. "".. ,h .l~
-~! wo 95/25804 2 ~ 8 ~ P l~r~.
17
La lésion mécanique du fimbria-fornix induit une perte de neurones
~ vliu.~ Luw (révélée en ;" ~ ~iP par un anticorps anti-choline acetyl
transférase, ChAT) dans le septum médian, ainsi que la dénenation ~llol;n~;qhe dans
~ (détectée en histochimie par l'activité de l'acétyl choline estérase, AChE~.
s L'analyse hi~f~ll~iq~P des ceneaux injectés est réalisée 3 semaines après
l'injection iu.Lld~él~:b-dle de l'adénovirus Ad-BDNF. Pour cela, les animaux sont
sacrifiés, sous anesthésie, par perfusion il.ud~ud;d.lu~ de 4% paraformaldéhyde, Après
~ ,L,~ C.IL, po6t-fixation et ~.r.,~ iion, le ceneau est coupé au cryomat selon le
plan coronal: des coupes sériées coronales de 30 ,um d'épaisseur sonf. réalisées sur
toute la longueur du septum médian et aux niveaux antérieur, médian et postérieur de
~'hirr~mrP Pour le septum médian, des coupes espacées de 180 llm (1 coupe sur 6)sont colorées au cr~wyl violet (rour évaluer la densité neuronale) et
par un anticorps anti ChAT (Biochem) (pour identifier les neurones ~
La méthode ~' ' . est celle de la 6h~Ldvih~ -biotine peroxydase
révélée par la DAB. Pour l';-:~ e, des coupes espacées de 180 ,um sont colorées
selon la méthode ~ :q~P pour l'AChE (acétyl choline estérase) afin de détecter
l'innervation ~ vli~ ;iqu~. Les coupes sont montées sur lames de verre.
An~lyse ql~ntit~tive
Le nombre de neurones I~ . (ChAT positifs) dans le septum
median est le paramètre d'évaluation des effets de l'd~ V;lhS Ad-BDNF. Le
~.l~nlllJil est réalisé sur un échantillon (1 coupe sur 6 sur toute la longueur du
septum médian). Pour chaque coupe, les neurones ChAT positifs sont dénombrés
séparément des 2 cotés du septum. Les résultats cumulés pour toutes les coupes sont
exprimés par le rapport du nombre de neurones ChAT rositifs du coté lésé sur le
2s nombre de neurones ChAT positifs du coté non lésé.
Ans~jyse~l"",~ ",~"' le
Il est connu qu'une lésion bilatérale de la voie septo-l~ conduit à
des déficits mnésiques. Afin d'évaluer les effets r ,l~. L~"u-els protecteurs d'une injection
d'ad~llvYilus Ad-BDNF sur ce type de lésion, les ~lroll"dll~ mnésiques des animaux
sont analysées au cours de 2 tests ~:V~I}JOI~ IILhh~ le test de la piscine de Morris
(mémoire de référence visuo-spatiale) et le test TMTT ("two-trials memory task";"mémoire à court-terme d'un ~IIV;IUIh..,.ll~llL nouveau").
wo ss/2s80~ 2 1 8 4 2 0 0 r~l~rlvs~
18
Exemple 7: Transfert in vivo du gène BDNF par un ad;.luv;. ~: ~ ' à
des rats présenhnt une lésion de la voie nigro-striée
Cet exemple décrit le transfert du gène BDNF in vivo au moyen d'um vecteur
adénoviral ælon l'invention. Il montre sur un modèle animal de la lésion de la voie
nigro-striée, que les vecteurs de l'invention permenent d'induire l'expression in vivo de
quantités ~ P~ --, de BDNF.
Sur des rats prP:lh~ pnlpnt ~m~h.oei~ la voie nigro-striée a été lésée au
niveau du faisoeau ~ - PlJ~;q ~ médian (MFB) par injection de la toxine 6-
hydroxy dopamine (60H-DA). Cene lésion chimique par injection a été unilatérale,0 suivant les CWld~llu~ .Lel~:UI~lid~U~ suivantes: AP: O et -1; ML: +1,6; V: -8,6 et
-9 (les c~ ' AP et ML sont ~If'l.'' I I I I I~PP~ pa~ rapport au bregma, la coordonnée
V parrapport à la dure-mère). La barre d'incisive est fixée au ni~eau +5 mm.
L'adénovirus leculllLl~ BDNF a été injecté r ~' ' ' après la lésion,
dans la substance noire et le striatum, du coté de la lésion. Plus ~ uli~ llle~
r~dé--~v;- uS injecté est l'adéno~ irus Ad-BDNF préparé dans l'exemple 4.1, utilisé sous
forme purifiée (3,5 106 pfu/lll), dans une solution saline phosphate (PBS).
Les injections ont été réalisées à l'aide d'une canule (diamètre extérieur 280
llm) connectée à une pompe. La vitesse d'injection est fixée à 0,5 ~lmin, après quoi, la
canule reste en place pendant 4 minutes ~ ~,.l,lP,~ 5 avant d'être remontée. Lesvolumes d'injection dans le striatum et la substance noire sont lPs~,Puli~ 2x3 111 et
2 ,ul. La ~ - l d'~ l;, lu v ;~ u~ inj ectée est de 3,5. l 06 pfu/~
Pour l'injection dans la substance noire, les ~w~ ul~ u~s sont
les suivantes: AP--5,8; ML=+2; V--7,5 (les -)U-du..ll~r,:3 AP et ML sont
25 pat rapport au bregma, la ~:U~J~dU.~.~O~ V par r8pport à la dure~mère).
Pour les rnjections dans le striatum, les ~:ou-dO~Ul~s ~ éUId~ U~ sont les
suivantes: AP=+0,5 et -0,5; ML=3; V=-5,5 Oes ~U-dUn~ S AP et ML sont
,l~l~,l,...~Pp~parrapportaubregma~lacoordonnéevparrapportàladure-mère)~
Les effets ~ iap~uli~u~s de l'i~ de l'adenovirus selon l'invention
30 ont eté mis en évidence par trois types d'an81yse: une analyse hi~lneiT-P et
,.. ,.. ,1.,~l. ~ 1,;.. ;.1.. ~ une analyse quantitative et une analyse col--~-l~
~ Woss/2s804 2 l ~3 4 2 0 0 ~ r~ h~ ~
19
A~A~lvse l.: ~t~ et i"""",~
La lésion chimique de la voie nigro-striée induit une perte neuronale dans la
substance noire ainsi que la dénervation ~ Ar.~ dans le striatum trévélées en
" ", ~ .. ~'. ' ~. ,l~if~ par un anticorps anti-tyrosine l,y~uAyl~, TH),
s L'analyse ~ i"~ des cerveaux injectés est réalisée 3 semaines après
l'injection ;,.~ .5.,'il...,1r de l'~lé~lu.;.us Ad-BDNF dans les conditions décrites dans
l'exemple 6. Les coupes sériées coronales de 30 llm d'épaisseur sont réalisées dans la
substance noire et le striatum. Des coupes espacées de 180 llm (1 coupe sur 6) sont
colorées au crésyl violet (pour évaluer la densité neuronale) et ;...." ~ q- ' - par
lo un anticorps anti tyrosine ~J~ yl~ (TH) (pour détecter les neurones
, A.' . ~;q; ~ dans la substance noire et leur innervation dans le striatum).
Analvse ql~ntitAfive
Le nombre de neurones ~ (TH positifs), dans la substance
noire est le paramètre d'évaluation des effets de rd~ièlluvi~uS Ad-BDNF. Le
s dénombrement est réalisé sur un échantillon (1 coupe sur 6 sur toute la longueur de la
substance noire). Pour chaque coupe, les neurones TH positi& sont dénombres
séparément des 2 cotés de la substance noire. Les résultats cumulés pour toutes les
coupes sont exprimés en proportion: nombre de neurones TH positifs du coté lésé par
rapport au nombre de neurones TH positifs du cote non lésé.
20 An~lyse~u,,l~,u,~..,....lAlf~
Afrn d'évaluer les effets fonctionnels protecteurs d'une injection d'~dé l~vl. uS
Ad-BDNF sur la lésion de la voie nigro-striée, les ~ r~" ~ ~ ~e~ sensori-motrices des
animaux sont analysées au cours de 2 tests cu..,~t~ .,u,u~: le test de la rotation
induite par des agonistes '~ ,u,-~u ph;.-e, rll~ et lévodopa~,
2s et le test de préhension ("paw-reaching").
Exemple 8: Transfert in vivo du gène BDNF par un ad;.,~ ' ' à
des rats présentant une lésion de la voie perforante
Cet exemple décrit le transfert du gène BDNF in vivo au moyen d'un Yecteur
adénoviral selon l'invention 11 montre sur un modèle animal de la lésion de la voie
30 perforante, que les vecteurs de l'rnvention permettent d'induire l'expression in vivo de
quantitéS th., ~ ; de BDNF.
WOgs/25804 21 84200 r~llr~s~
Sur des rats prPolohlPmpnt anesthésiés, la voie entor~hino ~
(voie perforante) a été sectionnée lmil ~~-alPmPnt à l'aide d'un couteau chirurgical. Les
wuld~u)l~OeS ~Lélé~ ueS utilisées à cet effet sont, par rapport au lambda: AP:
+0,75; ML: +4,1 à 6,6; V: -7,7 (coordonnée V déterminée par rapport à la dure-
s mère).
L'adénovirus ~ecoll~ BDNF est injecté ' ' après la lésion,
soit au niveau de la lésion, soit au niveau de ~ P at du cortex entorhinal. Plusl~alLic~Jlie~ ell~ vilus injecté est l'~ léllov;lus Ad-BDNF préparé dans
l'exemple 4.1., utilisé sous forme purifiée (3,5106 pfu/lll), dans une solution saline
0 phosphate (PBS).
Les injections ont été réalisées à l'aide d'une canule (diamètre extérieur 280
m) connectée à une pompe. La vitesse d'injection est fixée à 0,5 lli/min, après quoi, la
canule reste en place pendant 4 minutes s~ ;,ès avant d'être remontée. Les
15 volumes d'injection dans 1'1,;l,1,~ le cortex entorhinal et le site de lésion de la
voie perforante sont l~elivelllellL 3 111, 2 111 et 2 ,ul. La - "~ d`d ;léll~,vi, us
injectée est de 3,5. 106 pfu/~JI.
Les effets l1~P~"I.. I;q~r; de l'r,~ ;"" de l'dd~ lVilU~ selon l'invention
peuvent être mis en évidence par une analyse cu~l~,u~ e~lle l~le dans les conditions de
20 I'exemple 6.
~ WO95l25804 2 ~ 84~ r~
21
T.TC~B DF ~Fn1TT~NoT~
(1 ) INFORMATION GENERALE:
( i ) DEPOSANT:
A,l NOM: RHONE-POULENC RORER S.A.
~ C VILLE20ANTovNyue RaVmond ARON
1 0 E PAYS: FRANCE
Fl CODE POSTAL: 92165
(ii) TITRE DE L' INVENTION: Virus rP, ' ;nAntc, préparation et
15 ut~l~cAt1nn en thérapie qénique
(iii) NOMBRE DE SEQUENCES: S
(iv) FORME LISIBLE PAR OPDINATEUR:
I B) nRnTN~ATT~rlR - IBM PC ~ f ~ hl P
C) SYSTEME D ' EXPLOITATION: PC-DOS/MS-DOS
D) LOGICIEL: PatentIn Release #1.0, Version #1.25 (OEB)
(2~ TNFoRMATTnN POTJR T~A sT~n In NO: 1:
ARA-~TRRTc~IQUES DE LA SEQUENCE:
(A~ LONGUEUR: 26 pa~res de bases
(B) TYPE: acide r,ucléique
(D) CONFIGURATIQN linéaire
(ii) TYPE DE MOLECULE: ADNc
(iii) ~Y~U~ lUU~:~ NON
(iii) ANTI-SENS: NON
(Xi) L)li:~U~l~llUN DE LA SEQUENCE: SEQ ID NO: 1:
TTCATCGMT TCCACCAGGT GAGMG 26
~Z) INFnR~A~IQN Ptl[IR A ,~T~n TD NO
L . 2.
(i) t~AR~ UU~:~ DE LA SEQUENCE:
(A. LONGUEUR: 25 paires de bases
(Bl TYPE: acids nucléique
(D CONFIGURATION lineaire
(ii) TYPE DE MOLECU1E: ADNc
(iii) ~lYI:~ULII~ UU~. NON
(iii) ANTI-SENS: NON
(xi) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 2:
MTATMTCT A~A('AA~'ATA MTCC. 25
~2~ 1NFnRMAq'I(7N PnrlR T.A sFn Tr~ NO: 8:
ARA~TT~RT.STIQUE5 DE LA SEQUENCE:
(A) LONGUEUR: 22 paires de bases
(B) TYPE: acide nucléique
(C) NOMBRE DE BRINS: Aimple
WO 95/2580~ /rl t
22
(D) CONFIGURATION: lineaire
(ii) TYPE DE MOLBCULE: ADNc
(iii) HYPOTHETIQUE: NON
(ili) ANTI-SENS: NON
(xi~ D~ c~lN~ N DE LA SEQUENCE: SEQ ID NO: 3:
TAGCTTCATC GATTTCCACC AG 22
(2~ TN~)RMATION POUR T.A ST~-l Tn NO: 4:
(i) ~'AR ~ U~!;S DE LA SEQUENCE:
(A, LONGUEUR: 25 paires de bases
(B' TYP-: acide nucléigue
(C' NOM3RE DE BRINS: simple
(Dl CON-IGURATION: linéaire
(ii) TYPE DE MOLECULE: ADNc
(iii) ~Y~O ~ Uu~:: NON
(iii) ANTI-SENS: NON
(xi) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 4:
AATATAATCT R~ArAAf~A~A AATCC 25
25 ( 2 ~ ~ORMATION POUR LA SEO In NO: S:
(i) t'ARA~ Lll~Ul:i~ DE LA SEQUENCE:
(A) LONGUEUR: 30 paires de bases
(B) TYPE: acide nucléique
(C) NOMBRE DE BRINS: double
(D) CONFIGURATION: linéaire
(ii) TYPE DE MOLECULE: ADNc
( i i i ) HYPOTHETIQUE: NON
(iii) ANTI-SENS: NON
(xi) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 5:
AGA GGC GAC TAC AAG GAC GAC GAT GAC TAG , 30
40 Arg Gly Asp Tyr Lys Asp Asp Asp Asp ***