Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
21 84408
wo 9512s802 pcTlFR9sloo248
ADENOVIRUS RECOMBINANTS POUR LE FACTEUR DE MATURATION DES CELLULES GLIALES
DE TYPE BETA (GMF-~)
La présente invention conç.orne des vecteurs recombin~ntc d'origine virale et
leur utilisation pour le traitement et/ou la prevelllion des m~ liec neuro~é~nératives.
5 Plus particulièrement, elle concerne des adénovirus recombinants comportant une
séquence d'ADN codant pour le facteur de maturation des cellules gliales type béta
(GMF-~, "glial maturation factor"). L'invention concerne ég~l~ment la préparation de
ces vecteurs, les compositions pharmaceutiques les contenant et leur utilic~tionthérapeutique, notamment en thérapie génique.
o Les m~ ies neurodégénératives représçntçnt une large part des dépenses de
santé dans les pays ocrirlent~llx~ part qui ne cesse de s'accroitre suite au viçini.~
de la population. Au titre de ces affections, on peut citer notamment la maladied'~l7heim~r, le maladie de Parkinson, la chorée de Hllntington, la sclérose latérale
an-yol~vphique, etc. Les signes pathologiques et l'étiologie de ces m~ içs sont fort
variés, mais toutes résultent d'une perte progles~ive de cellules neuronales dans le
système nerveux central, parfois au sein de structure très loc~ c comme la
subst~n-~e noire dans la maladie de p~rkincon Bien que certains tr~it~om~nt.c
ph~rm~cologiques p~ tifc soient déjà disponibles, leurs effets sont relalive,llelimités. La p,ése"Le invention décrit une approche thé,apeulique nouvelle,
particulièrement avantageuse pour le tr~itement de ces m~ liçs. Plus particulie~,ne,lt,
la présente invention décrit des vecteurs permettant de promouvoir directçmçnt la
survie des cellules neuronales impliquées dans ces pathologies, par e~ ssion efficace
et localisée de certains facteurs trophiques.
Les facteurs trophiques sont une classe de molécules ayant des propriétés de
stim~ tion de la croissance neuritique ou de la survie des cellules nerveuses. Le
premier facteur possédant des propriétés ne~u~,uphiques, le NGF ("Nerve Growth
Factor"), a été caractérisé il y a une qual~ aille d'années (pour revue, voir Levi-
Mont~l~ ini et Angelleti, Physiol. Rev. 48 (1968) 534). Ce n'est que réc~mm~nt que
d'autres facteurs neurotrophiques ont été i~l~ntifi.os, tel que notamment le facteur
neuro~luphique dérivé du cerveau (BDNF) (Thoenen, Trends in NeuroSci. 14 (1991)
165), le CNTF, etc. La dem~n~çresse s'est intéressée plus particulièrement à un facteur
trophique désigné facteur de maturation des cellules gliales, possél~nt certaines
propriétés avantageuses. Le GMF-13 est un facteur trophique isolé en premier lieu à
40~
wo 95/25802 PCr/FR95100248
partir du cerveau bovin (Lim et al., PNAS 86 (1989) 3901). Le GMF-~ possède un
poids moléculaire de 17 kD, et est synthétisé essenti~llçmPnt dans les astrocytes, bien
qu'une présence au niveau des neurones ait été détectée récemm~nt (Zaheer et al., J.
Neurochem. 60 (1993) 914). Conllai~e-llent à la plupart des facteurs trophiques, le
5 GMF-13 est présent essentiellement dans le cytosol des cçll~ s, et seul un faible
po~,rcenlage est sécrété et exposé à l'extérieur des c~ le~ sur la membrane
plasmique. Le GMF-~ stimule la croissance de neurites dans le test classique desganglions de la racine dorsale (DRG). Par ailleurs, il est capable de promouvoir la
dirr~l~nciation de certaines lignées cellulaires telles que des gliomes (C6) ou des
lo neuroblastomes (N18) (Kaplan et al., J. Neurochem. 57 (1991) 483). Cette activité se
traduit par un effet antiprolifératif sur lesdites lignées tumorales, activité qui n'existe
pas v;s-à-vis des cellules normales (Lim et al., Cell Regulat. 1 (1990) 741).
Le GMF-~ possèdent donc in vitro certaines propriétés particulièrement
intér~os.~nt~s Toutefois, l'application thérapeutique du GMF-J3 se heurte à différents
obst~ es En particulier, l'absence de biodisponibilité du GMF-13 limite toute utili~tion
thérapeutique. Par ailleurs, il n'existe pas de moyens effi~ces permettant de délivrer le
GMF-13 de manière durable et localisée à certaines régions désirées de l'organisme.
Enfin, il est essentiel que le GMF-~ délivré soit actif et puisse exercer une activité
thérapeutique in vivo.
La présente invention apporte une solution particulièrement avantageuse à ces
problèmes. La présente invention réside en effet dans la mise au point de vecteurs
particulièrement effi~c~s pour délivrer in vivo et de manière localisée, des quantités
thérapeutiquement actives de GMF-~. Dans la dem~nde co~-nd~nte n
PCT/EP93/02519, il a été montré que les adénovirus pouvaient être utilisés pour le
ll~nsre,l de gènes in vivo dans le système nerveux. La présente invention concerne des
constructions nouvelles, particulièrement adaptées et ~ffit~c~ pour le transfert d'un
gène spécifique dans le système nerveux. Plus particulièrement, la présente invention
concerne un adénovirus recombinant comprenant une séquence d'ADN codant pour le
facteur de maturation des cellules gliales (GMF-13), sa pr~paralion, et son utilisation
pour le traitement et/ou la prévention des maladies neurodégénératives ou de certaines
tumeurs, notamment des tumeurs centrales.
La dem~n~leresse a m~inten~nt montré qu'il est possible de construire des
adénovirus recombinants contenant une séquence codant pour le GMF-~, d'arlmini~trer
2 1 ~4408
wo gs/25802 Pcr/FRs5/00248
ces adénovirus recomhin~nts in vivo, et que cette ~lmini~ration permet une
expression stable et localisée de quantités thérapeutiquement actives de GMF-~ in
vivo, et en particulier dans le système nerveux, et sans effet cy~opaLllologique. Les
propriétés particulièrement avantageuses des vecteurs de l'invention découlent
5 nol~n~.. ont de la construction utilisée (adénovirus défectif, délété de certaines régions
virales), du promoteur utilisé pour l'e~cs~ion de la séquence codant pour le GMF-~
(promoteur viral ou tissu-spécifique de préférence), et des méthodes d'~mini~ation
dudit vecteur, permettant l'e,~p~e~ion efficace et dans les tissus app-.)p.iés du GMF-~.
La présente invention fournit ainsi des vecteurs viraux utili.~hles directement en
o thérapie génique, particulièrement adaptés et ~fficaces pour diriger l'expression du
GMF-J3 in vivo. La présente invention offre ainsi une nouvelle approche
particulièr~mc"t avantageuse pour le traitement et/ou la p eve-lLion des m~ c
neurodégénératives ou des tumeurs centrales.
Un p.c~llier objet de l'invention réside donc dans un adénovirus recombinant
5 défectif co,llp.ellant une séquence d'ADN codant pour le facteur de maturation des
cellules gliales type 13(GMF-B)ou un dérivé de celui-ci.
L'invention a égAlem~nt pour objet l'utilisation d'un tel adénovirus
recombin~nt défectif pour la p-~pal~lion d'une col"~silion pharm~ceutique destinée
au traitement ou à la plcvention des maladies neurodégéné-dlives.
Le facteur de maturation des cellules gliales type ~ (GMF-~ produit dans le
cadre de la présente invention peut être le GMF-13 humain ou un GMF-~ animal. Enparticulier, la séquence d'ADN codant pour le GMF-~ humain a été clonée et
séquencée (Kaplan et al., J. Neurochem. 57 (1991) 483). Préalablement à leur
inco~o.~lion dans un vecteur adénovirus selon l'invention, ces séquences sont
25 avantaget~s~ment modifiées, par exemple par mllt~èse dirigée, en particulier pour
l'insertion de sites de restriction appr~ iés. Les séquences décrites dans l'art antérieur
ne sont en effet pas construites pour une utilisation selon l'invention, et des adaptations
préalables peuvent s'avérer n~ces.s~ires, pour obtenir des e~ressions illlpOI ~antes (voir
exemple 1.2.). Dans le cadre de la présente invention, on préfère utiliser une séquence
30 d'ADN codant pour le facteur de maturation des cellules gliales type ~ humain(hGMF-~). Par aill~ll~, comme indiqué ci-avant, il est également possible d'utiliser une
construction codant pour un dérivé du GMF-~, en particulier un dérivé du GMF-13
hl1m~in. Un tel dérivé comprend par exemple toute séquence obtenue par mutation,délétion et/ou addition par rapport à la séquence native, et codant pour un produit
- 21 84408
wo 95t25802 Pcr~Rs5loo248
conservant l'une au moins des propriétés biologiques du GMF-J3 (effet trophique et/ou
dirrérl~nl;~tellr et/ou antiprolifératif des cellules tumorales). Ces modifications peuvent
être réalisées par les techniques connues de l'homme du métier (voir techniques
générales de biologie moléculaire ci-après et exemple 2). L'activité biologique des
5 dérivés ainsi obtenus peut ensuite être ~i~ém~nt ~lét~rmin~e, comme indiqué
nol~.n...~nt dans l'exemple 3. Les dérivés au sens de l'invention peuvent également être
obtenus par hy~ri~tiQn à partir de banques d'acides nucléiques, en utilisant comme
sonde la séquence native ou un fra~ment de celle-ci.
Ces dérivés sont notamment des molécules ayant une plus grande affinité
pour leurs sites de fixation, des séquences permettant une e~ ion améliorée in
vivo, des molécules pr~sent~nt une plus grande rési~t~n~e aux protéases, des molé,cules
ayant une efficacité thérapeutique plus grande ou des effets secon~l~ires moindres, ou
éventt~ellement de nouvelles propriétés biologiques.
Parmi les dérivés préférés, on peut citer plus particulièrement les variants
naturels, les molécules dans lesquelles un ou plusieurs résidus ont été substitués, les
dérivés obtenus par délétion de régions n'inle, venanl pas ou peu dans l'interaction avec
les sites de liaison c-)n~i(lerés ou exprimant une activité indésirable, et les dérivés
comportant par rapport à la séquence native des résidus supplémentaires, tels que par
exemple un signal de sécrétion et/ou un peptide de jonction.
De ,lla~ particulièrement avantageuse, la séquence de la présente
invention co..l;e~.l un signal de sécrétion permettant de diriger le GMF-~ synthétisé
dans les voies de sécrétion des cellules infectées, de manière à ce que le GMF-J3
synthétisé soit libéré dans les colllpa~ lents extracell~ ires et puisse activer ses
réce~leuls. Le signal de sécrétion utilisé peut être tout signal de sécrétion hétérologue
25 ou même artificiel. Avantageusement, il s'agit d'un signal de sécrétion actif dans les
cellules hllm~in~s, notamment nerveuses. De manière préférée, on utilise le signal de
sécrétion d'une cytokine, et notamment de l'i.lle,rer~n de fibroblastes hllm~in, qui
permet des niveaux de sécrétion élevés de GMFJ3.
La séquence d'ADN codant pour le facteur de maturation des cellules gliales
utilisée dans le cadre de la présente invention peut être un ADNc, un ADN génomique
(ADNg), ou une construction hybride consistant par exemple en un ADNc dans lequel
seraient insérés un ou plusieurs introns. Il peut également s'agir de séquences
synthétiques ou s~lni~yl,Lhétiques. De manière particulièrement avantageuse, on utilise
21 ~4~08
wo 95/25802 PCTtFR95tOo248
un ADNc ou un ADNg. En particulier, I'utilisation d'un ADNg peut permettre une
meilleure expression dans les cellules hllm~ines.
Dans un premier mode de réalisation de l'invention, l'adénovirus co"lprend
donc une séquence d'ADNc codant pour le facteur de maturation des cellules gliales
5 (GMF-~). Dans un autre mode de réalisation préféré de l'invention, l'adénovirus
comprend une séquence d'ADNg codant pour le facteur de maturation des cellules
gliales (GMF-~). Avantageusement, la séquence d'ADN code pour le GMF-13 précédé
d'un signal de sécrétion et, de préférence, du signal de sécrétion efficace dans les
cellules humaines nerveuses.
Avantageusement, la séquence codant pour le GMF-J3 est placée sous le
contrôle de signaux permettant son expression dans les cellules nerveuses.
P'lerén:n~iPllp~rnpnt~ il s'agit de signaux d'expression hétérologues, c'est-à-dire de
signaux différents de ceux naturellement responsables de l'expression du GMF-~. Il
15 peut s'agir en particulier de séquences responsables de l'expression d'autres protéines,
ou de séquences synthétiques. Notamment, il peut s'agir de séquences promotrices de
gènes eucaryotes ou viraux. Par exemple, il peut s'agir de séquences promotricesissues du génome de la cellule que l'on désire infecter. De même, il peut s'agir de
séquences promotrices issues du génome d'un virus, y compris l'adénovirus utilisé. A
20 cet égard, on peut citer par exemple les promoteurs ElA, MLP, CMV, LTR-RSV, etc.
En outre, ces séquences d'expression peuvent être modifiées par addition de séquences
d'activation, de régulation, ou permettant une eA~ ion tissu-spécifique. Il peut en
effet être particulièrement il,lé~ssallt d'utiliser des signaux d'~Ap,~ion actifs
spécifiquement ou majoritairement dans les cellules nerveuses, de manière à ce que la
25 séquence d'ADN ne soit exprimée et ne produise son effet que lorsque le virus a
effectivement infecté une cellule nerveuse. A cet égard, on peut citer par exemple les
promoteurs de l'énolase neurone-spécifique, de la GFAP, etc.
Dans un premier mode de réalisation particulier, l'invention concerne un
adénovirus recombinant défectif comprenant une séquence d'ADNc codant pour le
30 facteur de maturation des cellules gliales type ~ humain (hGMF-~) sous le contrôle du
promoteur LTR-RSV.
Dans un autre mode de réalisation particulier, l'invention conceme un
adénovirus recombinant défectif comprenant une séquence d'ADNg codant pour le
facteur de maturation des cellules gliales type ~ humain (hGMF-~) sous le contrôle du
35 promoteur LTR-RSV.
21 84408
wo gs/25802 PCT/~k951~248
La d~-m~n~l~oresse a en effet montré que le promoteur LTR du virus du
sarcome de rous (RSV) permettait une e~l,ression durable et importante du GMF-~
dans les cellules du système nerveux, not~mment central.
Toujours dans un mode préféré, l'invention ccincern~ un adénovirus
recombinant défectif comprenant une séquence d'ADN codant pour le facteur de
maturation des cellules gliales type ~ humain (hGMF-13) sous le contrôle d'un
promoteur permettant une e~p1e~sion majoritaire dans le système nerveux.
Un mode particulièrement préféré de mise en oeuvre de la présente ~llv~lllion
réside dans un adénovirus recornbin~nt défectif comprenant les séquences ITR, une
séquence permettant l'~n~p~ tiQn, une séquence d'ADN codant pour le facteur de
maturation des cellules gliales type 13 humain (hGMF-~) ou un dérivé de celui-ci sous
le contrôle d'un promoteur permettant une expression majoritaire dans le systèmenerveux, et dans lequel le gène E1 et au moins un des gènes E2, E4, L1-L5 est non
fonctionnel.
Les adénovirus défectifs selon l'invention sont des adénovirus inc~r~hles de se
répliquer de façon autonome dans la cellule cible. Généralement, le génome des
adénovirus défectifs utilisés dans le cadre de la pr~sen~e invention est donc dépourvu
au moins des séquences necç~ires à la réplic~ti-~n dudit virus dans la cellule infectée.
Ces régions peuvent être soit eliminPes (en tout ou en partie), soit rendues non-
fonctionnelles, soit substituées par d'autres séquences et not~mm~nt par la séquence
d'ADN codant pour le GMF-J3.
Préférenti~ m~nt, le virus défectif de l'invention conserve les séquences de
son génome qui sont nécessaires à l'~n-~psifl~tion des particules virales. Encore plus
p1~ré,e1,liellement, comme indiqué ci-avant, le génome du virus recomhin~nt défectif
selon l'invention co,~,~re,ld les séquences ITR, une séquence permettant
l'encapsidation, le gène E1 non fonctionnel et au moins un des gènes E2, E4, L1-L5
non fonctionnel.
Il existe dirré1~nts sérotypes d'adénovirus, dont la structure et les propriétésvarient quelque peu. Parmi ces sérotypes, on préfère utiliser dans le cadre de la
présente invention les adénovirus lli1"~ de type 2 ou 5 (Ad 2 ou Ad 5) ou les
adénovirus d'origine animale (voir clem~n(le FR 93 05954). Parmi les adénovirus
d'origine animale utilisables dans le cadre de la présente invention on peut citer les
adénovirus d'origine canine, bovine, murine, (exemple: Mavl, Beard et al., Virology
75 (1990) 81), ovine, porcine, aviaire ou encore simienne (exemple: SAV). De
préférence, l'adénovirus d'origine animale est un adénovirus canin, plus
WO 95/25802 2 1 8 4 4 0 ~3 PCT~5100248
plerél~ iellement un adénovirus CAV2 [souche m~nh~ n ou A26/61 (ATCC VR-
800) par exemple]. De préférence, on utilise dans le cadre de l'invention des
adénovirus d'origine humaine ou canine ou mixte.
5 Les adénovirus recombinants défectifs selon l'invention peuvent être plepales
par toute technique connue de l'homme du métier (Levrero et al., Gene 101 (1991)195, EP 185 573; Graham, EMBO J. 3 (1984) 2917). En particulier, ils peuvent être
pr~pales par recombinaison homologue entre un adénovirus et un plasmide portant
entre autre la séquence d'ADN codant pour le GMF-13. La recombinaison homologue
10 se produit après co-transfection desdits adénovirus et pl~mi~le dans une lignée
cellulaire appropliée. La lignée cellulaire utilisée doit de préférence (i) êtresro~n~able par lesdits éléments, et (ii), comporter les séquences capables de
complémenter la partie du génome de l'adénovirus défectif, de préférence sous forme
intégrée pour éviter les risques de recombinaison. A titre d'exemple de lignée, on peut
15 m~ntionner la lignée de rein embryonnaire humain 293 (Graham et al., J. Gen. Virol.
36 (1977) 59) qui contiçnt notamment, intégrée dans son génome, la partie gauche du
génome d'un adénovirus Ad5 (12 '3~o). Des stratégies de construction de vecteursdérivés des adénovirus ont également été décrites dans les clem~n~es n FR 93 05954
et FR 93 08596 qui sont incorporées à la présente par référence.
F.n~l-ite, les adénovirus qui se sont multipliés sont récupérés et purifiés ælonles techniques classiques de biologie moléculaire, comme illustré dans les exemples.
Comme indiqué ci-avant, la présente invention concerne égalem~nt toute
utili~tion d'un adénovirus tel que décrit ci-dessus pour la préparation d'une
composition pharm~eutique destinée au traitement et/ou à la prévention des maladies
25 neurodégénératives. Plus particulièrement, elle concerne toute utilisation de ces
adénovirus pour la préparation d'une composition pharmaceutique destinée au
traitement et/ou à la plevelllion de la maladie de Parkinson, de la maladie d'Alzheimer,
de la sclérose latérale amyc)l,~phique (ALS), de la maladie d'Huntington, de l'épilepsie
et de la démence vasculaire. Elle concerne également l'utilisation de ces adénovirus
30 pour le traitement des tumeurs du système nerveux, not~mm~ns central. En particulier,
on peut citer les médulloblastomes, les neuroblastomes, les gliomes, etc.
La présente invention concerne également une composition pharm~celltique
comprenant un ou plusieurs adénovirus recombinants défectifs tels que décrits
précédemm~nt Ces compositions pharmaceutiques peuvent être formulees en vue
21 84408
wo 95125802 PCT/FR95/00248
d'~lmini.~trations par voie topique, orale, parentérale, intranasale, i~lldveineuse,
intramusculaire, sous-cutanée, intraoculaire, transdermique, etc. De ~neré~ ce, les
co,nposilions pharmareuti(lues de l'invention conti~nn~nt un véhicule ph~rm~ceu
tiquement acceptable pour une formulation injectable, n~ nt pour une injection
5 directe dans le système nerveux du patient. Il peut s'agir en particulier de solution.c
stériles, isotoniques, ou de compositions sèches, not~mm~nt lyophili~s, qui, paraddition selon le cas d'eau stérilisée ou de sérum physiologique, p~rmett~nt la
con~titution de solutés injectables. L'injection directe dans le système ne.v~:~ du
patient est avantageuse car elle permet de concentrer l'effet thérapeutique au niveau
10 des tissus affectés. L'injection directe dans le système nerveux central du patient est
av~nt~ em~nt réalisée au moyen d'un appareil d'injection stéréotaxique. L'emploid'un tel appareil permet en effet de cibler avec une grande précision le site d'injection.
A cet égard, l'invention concerne ég~lement une méthode de tr~item~nt des
m~ s neurodégénératives comprenant l'administration à un patient d'un adénovirus15 recombin~nt tel que défini ci-avant. Plus particulièrement, l'invention conc~ e une
méthode de traitement des maladies neurodégénératives comprenant l'a~ .;n;~.dlion
stéréotaxique d'un adénovirus recombinant tel que défini ci-avant.
Les doses d'adénovirus recombinant défectif utili~é~os pour l'injection pellvenlêtre adaptées en fonction de di~réle,-~ paramètres, et notamment en fonction du mode
20 d'atimini~tration utilisé, de la pathologie concernée ou encore de la durée du tr~it~m~nt
recherchée. D'une manière générale, les adénovirus recombin~nt~ selon l'invention sont
formulés et a~ ;n;~LIes sous forme de doses comprises entre 104 et 10l4 pfu/ml, et de
pler~rence 106 à 101 pfu/ml. Le terme pfu ("plaque forming unit") co-lespond aupouvoir infectieux d'une solution de virus, et est déterminé par infection d'une culture
25 cellulaire apl,lupriée, puis mesure, généralement après 48 heures, du nombre de plages
de cellules infectées. Les techniques de détermination du titre pfu d'une solution virale
sont bien documentées dans la littérature.
Un autre objet de l'invention concerne toute cellule de m~.n.-~;rèle infectée par
un ou plusieurs adénovirus recombinants défectifs tels que décrits ci-dessus. Plus
30 particulièrement, l'invention concerne toute population de cellules ht1m~in~s infectée
par ces adénovirus. Il peut s'agir en particulier de fibroblastes, myoblastes,
hépatocytes, kératinocytes, cellules endothéliales, cellules gliales, etc.
Les cellules selon l'invention peuvent être issues de cultures pli",ai~es. Celles-
ci peuvent être prélevées par toute technique connue de l'homme du métier, puis mises
2 1 844Q8
wo ss/2s802 Pcr/FRs5/00248
en culture dans des conditions permettant leur prolifération. S'agj~s~nS plus
particulièr~me"l de fibroblastes, ceux-ci peuvent être aisément obtenus à partir de
biopsies, par exemple selon la technique décrite par Ham [Methods Cell.Biol. 21a
(1980) 255]. Ces cellules peuvent être utili.cé~,~ directement-pour l'infection par les
5 adénovirus, ou conselvees, par exemple par congélation, pour l'ét~bli~cem~nt de
banques autologues, en vue d'une utilisation ultérieure. Les cellules selon l'invention
peuv~l-l également être des cultures secondaires, obtenues par exemple à partir de
banques préétablies.
Les cellules en culture sont ensuite infectées par des adénovirus
lO recombinants, pour leur conférer la c~p~it de produire du GMF-~. L'infection est
réalisée in vitro selon des techniques connues de l'homme du métier. En particulier,
selon le type de cellules utilisé et le nombre de copies de virus par cellule désiré,
l'homme du métier peut adapter la multiplicité d'infection et événtuellement le nombre
de cycles d'infection réalisé. Il est bien entendu que ces étapes doivent être effectuées
15 dans des conditions de stérilité appr.~p~iées lorsque les cellules sont ~lestin~s à une
~imini~tration in vivo. Les doses d'adénovirus recombinant~lltili~é~s pour l'infection
des cellules peuvent être adaptées par l'homme du métier selon le but recherché. Les
conditions décrites ci-avant pour l'~-in~;n;~ lion in vivo peuvent être appliquées à
l'infection in vitro.
Un autre objet de l'invention concerne un implant co,l,p~ellant des cellules
n~.. ;~ infectées par un ou plusieurs adénovirus recombinants défectifs telles que
décrites ci-dessus, et une matrice extracellulaire. ~lerére,lliellement, les impl~nt.~ selon
l'invention co",p-~mlent 105 à 101 cellules. Plus ple~él~nliellement, ils en
co,l.~u~ennellt 106 à 108.
Plus particulièrement, dans les impl~nts de l'invention, la matrice
ex~-ell~ ire comprend un composé ~lifi~nt et éventuellement un support
permettant l'ancrage des cellules.
Pour la préparation des implants selon l'invention, dirréle,.L~ types de
gélifiants peuvent être employés. Les gélifiants sont utilisés pour l'inclusion des cellules
dans une matrice ayant la constitution d'un gel, et pour favoriser l'ancrage des cellules
sur le support, le cas échéant. Différents agents d'adhésion cellulaire peuvent donc être
utilisés comme gélifiants, tels que notamment le collagène, la ~l~tine, les
glycos~minoglycans, la fibronectine, les lectines, etc. De préférence, on utilise dans le
2 1 84408
wo 9s/25802 PCT/~h95~248
cadre de la présente invention du collagène. Il peut s'agir de collagène d'origine
humaine, bovine ou murine. Plus p,~fé~nciellement, on utilise du collagène de type I.
Comme indiqué ci-avant, les compositions selon l'invention colllp,eimenL
avantag~ucement un support permettant l'ancrage des c'~ PS. Le terme ancrage
5 désigne toute forrne d'interaction biologique et/ou chimique et/ou physique e,ll,dî~
l'adhésion et/ou la fixation des cellules sur le support. Par ailleurs, les cellules peuvent
soit recouvrir le support utilisé, soit pénétrer à l'intérieur de ce support, soit les deux.
On préfère utiliser dans le cadre de l'invention un support solide, non toxique et/ou
bio-compatible. En particulier, on peut utiliser des fibres de polytétrafluoroéthylène
0 (PTFE) ou un support d'origine biologique.
Les impla~t~ selon l'invention peuvent hre impl~nt~o~ en dirfé,e,lls sites de
l'organisme. En particulier, I'implantation peut être effectuée au niveau de la cavité
péritonéale, dans le tissu sous-cutané (région sus-pubienne, fosses iliaques ou
inguinales, etc), dans un organe, un muscle, une tumeur, le système ne,v~:~x central,
15 ou encore sous une muqueuse. Les impl~nts selon l'invention sont particulièrement
avantageux en ce sens qu'ils permettent de contrôler la libération du produit
~e,~peutique dans l'organisme: Celle-ci est tout d'abord déterminée par la ml-hirlicité
d'infection et par le nombre de cellules ;...pl~ es Ensuite, la libération peut être
contrôlée soit par le retrait de l'implant, ce qui arrête d~rinilivement le traitement, soit
20 par l'utilisation de systèmes d'expression régulable, permettant d'induire ou de ,~li,ner
l'e~pression des gènes thérapeutiques.
La présente invention offre ainsi un moyen très efficace pour le traitement ou
la p~venlion des maladies neurodégénératives et des tumeurs du système nerveux,
25 notamment central. Elle est tout particulièrement adaptée au traitement des mal~ s
d'~ h~im~r, de Parkinson, de Huntington, de l'ALS et des m~dlllloblastomes,
neurobl~ctomes ou gliomes. Les vecteurs adénoviraux selon l'invention présentent en
outre des avantages importants, liés notamment à leur très haute efficacité d'infection
des cellules nerveuses, perrnettant de réaliser des infections à partir de faibles volumes
30 de suspension virale. De plus, I'infection par les adénovirus de l'invention est très
localisée au site d'injection, ce qui évite les risques de diffusion aux structures
cérébrales voisines.
En outre, ce traitement peut concerner aussi bien l'homme que tout animal tel
que les ovins, les bovins, les animaux domestiques (chiens, chats, etc), les chevaux, les
35 poissons, etc.
2 1 84408
wo 95/2~802 PcrlFRs5/00248
La présente invention sera plus complètemçnt décrite à l'aide des exemples
qui suivent, qui doivent être considérés comme illustratifs et non l;n.;l~l;
I,~ende d~ f~ur~
Figure 1: Repræs~nl~tiQn du vecteur pXL2244
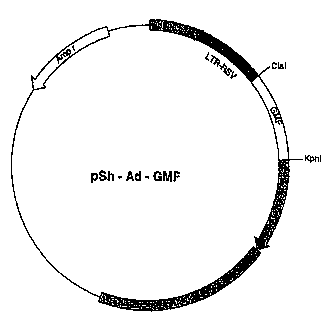
5 Figure 2: Replese.l~a~ion du vecteur pSh-Ad-GMF-
~
Techni~ues ~énérales de biolo~ie moléculaire
Les méthodes classiquement utilisées en biologie moléculaire telles que lesextractions præpaldlives d'ADN pl~miflique, la centrifugation d'ADN pl~cmillique en
gradient de chlorure de césium, l'électrophorèse sur gels d'agarose ou d'acrylamide, la
10 purification de fr~gm~nt.~ d'ADN par électroélution, les extraction de protéines au
phénol ou au phénol-chlc,l.,~-,.,e, la précipitation d'ADN en milieu salin par de
l'éthanol ou de l'isopropanol, la tran~orn alion dans Escherichia coli, etc ... sont bien
connues de l'homme de métier et sont abondament décrites dans la li~el~ e [Maniatis
T. et al., "Molecular Cloning, a Laboratory Manual", Cold Spring Harbor Laboratory,
5 Cold Spring Harbor, N.Y., 1982; Ausubel F.M. et al. (eds), "Current Protocols in
Molecular Biology", John Wiley & Sons, New York, 1987].
Les pl~cmirhs de type pBR322, pUC et les phages de la série M13 sont
d'origine cQrnm~rciale (Reth~sda Research Laboratories).
Pour les ligatures, les fr~gmçntc d'ADN peuvent être séparés selon leur taille
20 par électrophorèse en gels d'agarose ou d'acrylamide, extraits au phénol ou par un
mélange phénoVchlon~ol..,e, précipités à l'éthanol puis incubés en présence de l'ADN
ligase du phage T4 (Biolabs) selon les recomm~nd~tions du fo1lrni~ellr.
Le r~mpli~ge des extrémités 5' proémin~nt~s peut être effectué par le
fragment de Klenow de l'ADN Polymérase I d'E. coli (Biolabs) selon les spécifications
2s du fol-rni~ellr. La destruction des extræ,.,ilés 3' pro~min~nt-?~ est effectuée en présence
de l'ADN Polymérase du phage T4 (Biolabs) utilisée selon les recomm~nd~tions du
fabricant. La destruction des extrémités 5' proéminentes est effectuée par un traitement
ménagé par la nucléase S1.
La mutagénèse dirigée in vitro par oligodéoxynucléotides synthétiques peut
30 être effectuée selon la méthode développée par Taylor et al. [Nucleic Acids Res. 13
- (1985) 8749-8764] en utili~nt le kit distribué par Amersham.
L'~mplifi~ation enzymatique de fragments d'ADN par la technique dite de PCR
[~olymérase-catalyzed Chain Beaction, Saiki R.K. et al., Science ~ (1985) 1350-
2 1 84408
WO gs/25802 PCr/1~95,'~248
1354; Mullis K.B. et Faloona F.A., Meth. Enzym. 155 (1987) 335-350] peut être
effectuée en utilisant un "DNA thermal cycler" (Perkin Elmer Cetus) selon les
spécifications du fabricant.
La vérification des séquences nucléotidiques peut être cffectuée par la metho~ledéveloppée par Sanger et al. [Proc. Natl. Acad. Sci. USA, 74 (1977) 5463-5467] en
utili.c~nt le kit distribué par Arnçr~h~m
E
xemp ~x;
Exemple 1: Construction du vecteur pSh-Ad-GMF-13.
Cet exemple décrit la construction d'un vecteur co.llplenant une séquence
10 d'ADI~' codant pour le GMF-B sous le contrôle d'un promoteur con.~ é par le LTR
du virus du sarcome de rous (LTR-RSV).
1.1. Vecteur de départ (pXL2244): Le plasmide pXL2244 contient l'ADNc de
l'ApoAI sous le contrôle du promoteur LTR du virus RSV, ainsi que des séq.lences de
l'adénovirus Ad5 (figure 1). Il a été construit par insertion d'un fragment ClaI-EcoRV
15 cont~n~nt l'ADNc codant pour la préproApoAI dans le vecteur pLTR RSV-Bgal
(Stratford-Perricaudet et al., J. Clin. Invest. 90 (1992) 626), digéré par les même
enzymes.
1.2. Construction d'une séquence d'ADN codant pour le GMF-B humain
Pour permettre la construction de vecteurs selon l'invention, la séquence
20 d'ADNc codant pour le GMF-B humain présente dans le pl~mide pET-3a-hGMF-
~(Kaplan et al., J. Neurochem. 57 (1991) 483) a été modifiée de différentes manières.
Dans une première construction, cette séquence a été modifiée par la technique
de PCR, en ut~ nt comme amorce les oligonucléotides suivants:
Oligonucléotide 5': 5'-GCGATCGATAAAATGAGTGAGTCTTTG-3' (SEQ ID n 1)
2s Oligonucléotide 3':5'-GCGGTACCTTCACATTAGTGAAAAAATCC-3' (SEQ ID n2)
Les étapes d'amplification permettent d'introduire de part et d'autre de la
séquence codante des sites de restriction app~.~priés. Plus précisément, ces étapes
permettent l'incorporation d'un site ClaI à l~exlle.l~ilé 5' (séquence soulignée en simple
dans l'oligonucléotide 5', qui indique sa position par rapport au codon start souligné en
30 double) et d'un site KpnI à l'extrémité 3' (souligné en simple dans l'oligonucléotide 3').
Le fragment de PCR ainsi obtenu a été sous cloné dans le vecteur pCRII (Invitrogen).
Le vecteur résultant a été désigné pCR-hGMF-13. Les sites créés permettent l'insertion
de la séquences dans des conditions d'expression dans les vecteurs de l'invention. Ils
21 8~4~
wo ss/2s802 pcT~ 9s~n248
permettent également d'insérer en phase de lecture, d'autres séquences particulières, et
notamment une région promotrice et/ou une séquence de sécrétion (Cf exemple 2).
1.3. Construction du vecteur pSh-Ad-GMF-13
Cet exemple décrit la construction du vecteur pSh-Ad-GMF-~3 con~
5 sous contrôle du LTR du virus RSV, la séquence codant pour le GMF-J3 humain ainsi
que des séquences de l'adénovirus Ad5 permettant la recomhin~i~on in vivo.
Le vecteur pCR-hGMF-J3 a été digéré par les enzymes ClaI et KpnI, et le
fragment de 0,5 kb résultant, contenant la séquence codant pour le GMF-~ a ensuite
été isolé et purifié par électrophorèse sur un gel d'agarose LMP ("Low Melting
lo Point"). Par~ lem~nt, le vecteur pXL2244 a été digéré par les mêmes enzymes de
restriction ClaI et KpnI, puis précipité après inactivation de ces dernières. Le vecteur
linéaire r~ lt~nt, préalablement isolé et purifié par électrophorèse sur un gel d'agarose,
et le fragment de 0,5 kb ont ensuite été ligaturés pour générer le vecteur pSh-Ad-
GMF-~ (figure 2). L'ensemble de la séquence nucléotidique de l'insert GMF-~ a été
5 vérifiée par séquençage didéoxynucléotides.
Exemple 2: Construction du vecteur pSh-Ad-lNF/GMF-~.
Cet exemple décrit la construction d'un second vecteur comprellant, sous le
contrôle d'un promoteur constitué par le LTR du virus du sarcome de rous (LTR-
RSV), une séquence d'ADNc codant pour le GMF-13 précédée d'une séquence de
20 sécrhion.
2.1. Insertion d'une séquence de sécrétion: La séquence d'ADNc présente dans
le pl~mitle pET-3a-hGMF-~ a été mo-lifiée par insertion, à l'eAI,é,nilé 5' et en phase
de la séquence codante du GMF-J3, de la séquence de sécrétion de l'i.~e.~r~il de25 fibroblastes h1-m~in.~ L'introduction de cette séquence est particulièrement
avantageuse puisqu'elle permet la libération extracçl~ ire du GMF-13 synthétisé par
les cellules infectées par les vecteurs de l'invention. La séquence de sécrétion utilisée à
été synthétisée artificiellement sur la base de la séquence publiée par Taniguchi et al.
(Gene 10 (1980) 11). Plus précisément, la séquence de sécrétion synthéti~ée comprend
30 l'enchaînement des 63 pb suivantes (SEQ ID n 3):
ATG ACC AAC AAG TGT CTC CTC CAA ATT GCT CTC CTG TTG TGC
Met Thr Asn Lys Cys Leu Leu Gln Ile Ala Leu Leu Leu Cys
21 84408
W095/25802 PCTlrh9S;ua248
TTC TCC ACT ACA GCT CTT TCC
Phe Ser Thr Thr Ala Leu Ser
Cette séquence a été insérée en amont de la séquence codante du GMFJ3 par
amplification génique par la technique de PCR sur le plasmide pET-3a-hGMF-~, en
ili~nt les deux oligonucléotides suivants:
Oligonucléotide 5': 5'-GCGATCGATGAGATGACCAACAAGTGTCTCCTC
CAAATTGCTCTCCTGTTGTGCTTCTCCACTACAGCTCTTTCCATGAGTGAGT
CTTTGGTT-3' (SEQ ID n 4)
0 Oligonllcléotide 3':5'-GCGGTACCTTCACATTAGTGAAAAAATCC-3' (SEQ ID n5)
2.2. Construction du vecteur pSh-Ad-INF/GMF-~
Cet exemple décrit la construction du vecteur pSh-Ad-INF/GMF-~3 cont~n~nt
la séquence codant pour le GMF-~ précédée de la séquence de sécrétion de l'interféron
de fibroblaste hum~in, sous contrôle du LTR du virus RSV, ainsi que des séquences de
I'adénovirus Ad5 pe~ e~ l la recombinaison in vivo.
La séquence construite en 2.1. a été digéré par les enzymes ClaI et KpnI, et le
fragment de 0,6 kb résl~lt~nt, contenant la séquence codant pour le GMF-~ précédée
de la séquence de sécrétion de l'il,te,r~ de fibroblaste humain a ensuite été isolé et
purifié par électrophorèse sur un gel d'agarose LMP ("Low Melting Point").
Parallèlement, le vecteur pXL2244 (exemple 1.1.) a été digéré par les mêmes enzymes
de restriction ClaI et KpnI, puis précipité après inactivation de ces dernières. Le
vecteur linéaire r~sult~nt préalablement isolé et purifié par électrophorèse sur un gel
d'agarose, et le fragment de 0,6 kb ont ensuite été ligaturés pour générer le vecteur
pSh-Ad-INF/GMF-13.
Exemple 3. Fonctionalité des vecteurs pSh-Ad-GMF-13 et pSh-Ad-lNF/GMF-~
La capacité des vecteurs pSh-Ad-GMF-J3 et pSh-Ad-INF/GMF-13 à exprimer
sur culture cellulaire une forme biologiquement active du GMF-~ a été démontrée par
transfection transitoire de cellules COS1. Pour cela, les cellules (2.106 cellules par
boite de 10 cm de diamètrê) ont été transfectées (8 llg de vecteur) en présence de
Transfectam. Après 48 heures, la présence de GMF-13 a été démontrée par
wo 9sl25802 2 1 & 4 4 0 ~ PCT~R95/00248
immtlno~lçtçction à l'aide de l'anticorps monoclonal G2-09 dans le sllrn~nt de
culture des cellules transfectées ainsi qu'intracellulai~ ,enl.
F.YemP1C 4. Construction des adénovirus recombinants contenant une séquence
codant pour le GMF~
s 4.1. Construction de l'adénovirus Ad-GMF-~
Le vecteur pSh-Ad-GMF-~ a été linéarisé et cotransfecté avec un vecteur
adénoviral déficient, dans les cellules helper (lignée 293) appo,lan~ en t7ans les
f~nctiQn~ codées par les régions E1 (ElA et ElB) d'adénovirus.
Plus preci~çmçnt, l'adénovirus Ad-GMF-J3 a hé obtenu par recomhin~i~n
homologue in vivo entre l'adénovirus mutant Ad-dll324 (Thimm~ppaya et al., Cell 31
(1982) ~43) et le vecteur pSh-Ad-GMF-13, selon le protocole suivant: le pl~cmidepSh-Ad-GMF-J3 et l'adénovirus Ad-dll324, linéarisé par l'enzyme ClaI, ont été co-
transfectés dans la lignée 293 en présence de phosphate de c~lcillm, pour permettre la
recombinaison homologue. Les adénovirus recombin~nt~ ainsi générés ont été
sélectionnés par purification sur plaque. Après isolement, l'ADN de l'adénovirusrecombinant a été amplifié dans la lignée cellulaire 293, ce qui conduit à un surnageant
de culture contçn~nt l'adénovirus défectif recombinant non purifié ayant un titre
d'environ 10l pfu/ml.
Les particules virales sont ensuite purifiées par centrifugation sur gradient dechlorure de césium selon les techniques connues (voir not~mmçnt Graham et al.,
Virology 52 (1973) 456). L'adénovirus Ad-GMF-~ peut être conservé à -80C dans 20
% de glycérol.
4.2. Construction de l'adénovirus Ad-INF/GMF-~
2s
L'adénovirus Ad-INF/GMF-~ a été construit selon le même protocole que
l'adénovirus Ad-GMF-13, mais en utilisant comme vecteur de départ le vecteur pSh-
Ad-INF/GMF-~.
Exemple 5. Fonctionalité de l'adénovirus Ad-GMF-13
La c~paçitç de l'adénovirus Ad-GMF-13 à infecter des cellules en culture et à
exprimer dans le milieu de culture une forme biologiquement active du GMF-13 a été
démontrée par infection des lignées 293 h~ ine et PC12 de rat. La présence de
W O 95/25802 2 1 8 4 4 0 8 P~li~h9S~'~D248
16
GMF-13 actif dans le surnageant de culture a ensuite été déterminée dans les mêmes
conditions que dans l'exemple 3.
Ces études permettent de montrer que l'adénovirus exprime bien une forme
biologiquement active du GMF-J3 en culture cellulaire.
5 Exemple 6: Transfert in vivo du gène GMF-i3 par un adénovirus recombinant à
des rats ~ .,~nt une lésion du fimbria-fornix
Cet exemple décrit le tlansfe" du gène GMF-~ in vivo au moyen d'un vecteur
adénoviral selon l'invention. Il montre sur un modèle animal de la lésion du fimbria-
fornix, que les vecteurs de l'invention permettent d'induire l'expression in vivo de
l O quantités thé~a~u~iques de GMF-~.
Sur des rats préalablement anesthésiés, la voie septo-hippocampique (fimbria-
fornix) a été sectionnée au niveau de l'he---;cl,here gauche. Cette lésion mec~ni~lue a
été réalisée à l'aide d'un couteau chirurgical rétractable. Les coordonnées
stéréotaxiques utilisées à cet effet sont, par rapport au bregma: AP: -1,7; ML: +1,5;
5 V: -5,5 à -0,5.
L'adénovirus recombinant GMF-13 a été injecté immé~ia~e...en~ après la lésion,
dans le noyau médian du septum et dans la partie dorsale de l'hippocampe déafférenté
(hippocampe du coté de la lésion). Plus particulièrement, l'adénovirus injecté est
l'adéno~/irus Ad-GMF-~ préparé dans l'exemple 4.1., utilisé sous forme purifiée
(3,5 106 pfu/~l), dans une solution saline phosphate (PBS).
Les injections sont réalisées à l'aide d'une canule (diamètre extérieur 280 ~m)
connectée à une pompe. La vitesse d'injection est fixée à 0,5 ~l/min, après quoi, la
canule reste en place pendant 4 minutes supplément~ires avant d'être remontée Les
25 volumes d'injection dans l'hippocampe et le septum sont respectivement 3 ~l et 2 ~l.
La concentration d'adénovirus injectée est de 3,5. 106 pfu/~l.
Pour l'injection dans l'hippocampe, les coordonnées stéréotaxiques sont les
suivantes: AP=-4; ML=3,5; V=-3,1 (les coordonnées AP et ML sont déterminées par
rapport au bregma, la coordonnée V par rapport à la surface de l'os crânien au niveau
30 du bregma.
21 ~4~0~
wo 95/2s802 PCrlFR95/00248
Pour l'injection dans le septum, les coordonnées stéréotaxiques sont les
suivantes: AP=1; ML=1; V=-6 (les coordonnées AP et ML sont déterminées par
rapport au bregma, la coordonnée V par rapport à la surface de l'os crânien au niveau
du bregma. Dans cette condition, la canule plesellle un angle de 9 degrés par rapport à
5 la verticale (dans le sens médio-latéral) afin d'éviter le sinus veineux me~i~n
Les effets thérapeutiques de l'a~ ;ni~ tion de l'adénovirus selon l'illv~nLioll
ont été mis en évidence par trois types d'analyse: une analyse histologique et
immunc hi~tochimique, une analyse quanlilalive et une analyse co,~ol le.n~ e
Analyse histolo~ique et immunohistochimique
lo La lésion méc~nique du fimbria-fornix induit une perte de neurones
cholinergiques (révélée en immunohistologie par un anticorps anti-choline acétyltransférase, ChAT) dans le septum médian, ainsi que la dénervation ~holinergique dans
l'hippocampe (detectee en hi~tochimie par l'activité de l'acétyl choline estérase, AChE).
L'analyse histologique des cerveaux injectés est réalisée 3 st.~ s après
15 I'injection intracérébrale de l'adénovirus Ad-GMF-~. Pour cela, les anillla~,c sont
sacrifiés, sous anesthésie, par perfusion intracardiaque de 4% paraformaldéhyde. Après
prélèvement, post-fixation et c~yoproleclion, le cerveau est coupé au cryomat selon le
plan coronal: des coupes sériées coronales de 30 ~m d'épaisseur sont réalisées sur
toute la longueur du septum médian et aux niveaux antérieur, médian et postérieur de
I'hippocampe. Pour le septum médian, des coupes espacées de 180 ~m (1 coupe sur 6)
sont colorées au crésyl violet (pour évaluer la densité neuronale) et ;~llmLInoll~a~l~ées
par un anticorps anti ChAT (Biochem) (pour identifier les neurones cholinergiques).
La métnode immllnohicto~himillue est celle de la ~e~avidine-biotine pelo~yiase
révélée par la DAB. Pour l'hippocampe, des coupes espacées de 180 ,um sont colorées
2s selon la méthode histochimique pour l'AChE (acétyl choline estérase) afin de détecter
détecter l'innervation cholinergique. Les coupes sont montées sur lames de verre.
Analyse qua"lil~liv~
Le nombre de neurones cholinergiques (ChAT positifs), dans le septum
médian est le paramètre d'évaluation des effets de l'adénovirus Ad-GMF-B. Le
~enombrement est réalisé sur un échantillon (1 coupe sur 6 sur toute la longueur du
septum médian). Pour chaque coupe, les neurones ChAT positifs sont dénombrés
sépali:,llent des 2 cotés du septum. Les résultats cumulés pour toutes les coupes sont
21 84408
wo 95/25802 Pcr/FR95/00248
18
exprimés par le rapport du nombre de neurones ChAT positifs du coté lésé sur le
nombre de neurones ChAT positifs du coté non lésé.
Analyse co"~orle~"entale
Il est connu qu'une lésion bilatérale de la voie septo-hippocampique conduit à
5 des déficits mnésiques. Les effets fonctionnels protecteurs de l'injection d'adénovirus
Ad-GMF-~3 sur ce type de lésion ont été mis en évidence par analyse des perfol,nances
mnésiques des anim~ au cours de 2 tests co",po,le~ ntal~x: le test de la piscine de
Morris (mémoire de référence visuo-spatiale) et le test TMTT ("two-trials memorytask"; "mémoire à court-terme d'un envin),ulement nouveau").
10 Exempie 7: Transfert in vivo du gène GMF-I~ par un adénovirus r ecombinant à
des rats p. ~e..l~nt une lésion de la voie nigro-striée
2 1 ~4408
WO 9S/25802 PCT/FR9S/00248
Cet exemple décrit le transfert du gène GMF-B in vivo au moyen d'un vecteur
adénoviral selon l'invention. Il montre sur un modèle animal de la lésion de la voie
nigro-striée, que les vecteurs de l'invention permettent d'induire l'eApr~ioll in vivo de
quantités thélape~.liques de GMF-13.
Sur des rats préalablement anesthésiés, la voie nigro-striée a été lésée au
niveau du faisceau mPsPncéphalique médian (MFB) par injection de la toxine 6-
hydluAy dopamine (60H-DA). Cette lésion chimique par injçction a été unilatçrale,
suivant les coordc-nnPes stéréotaxiques suiv~n~s: AP: 0 et -1; ML: +1,6; V: -8,6 et
-9 (les coordonnçPs AP et ML sont déterrninées par rapport au bregma, la coordonnée
0 V par rapport à la dure-mère). La barre d'incisive est fixée au niveau +5 mm.
L'adénovirus recombinant GMF-B a été injecté immPf~ après la lésion,
dans la substance noire et le striatum, du coté de la lésion. Plus particulièrement,
I'adénovirus injecté est l'adénovirus Ad-GMF-B préparé dans l'PxPmple 4.1., utilisé
sous forme purifiée (3,5 106 pfu/~l), dans une solution saline phosph~te (PBS).
Les injections ont été réalisées à l'aide d'une canule (rli~mptre extérieur 280
,um) connçctée à une pompe. La vitesse d'injection est fixée à 0,5 ~Il/min, après quoi, la
canule reste en place pendant 4 minutes supplémPnt~ires avant d'être remontée Les
volumes d'injection dans le striatum et la subst~nce noire sont respeclivel,.enL 2x3 ,ul et
20 2 IlL La concentration d'adénovirus injectée est de 3,5. 106 pfu/,ul.
Pour l'injection dans la substance noire, les coordonnées stéréotaxiques sont
les suivantes: AP=-5,8; ML=+2; V=-7,5 (les coordonnées AP et ML sont ~Pt.orrninçes
par rapport au bregma, la coordonnée V par rapport à la dure-mère).
Pour les injections dans le stri~tl~m, les coordonnées stéréotaxiques sont les
25 suiv~les: AP=+0,5 et -0,5; ML=3; V=-5,5 (les coor~o~nPes AP et ML sont
déterminées par rapport au bregma, la coordonnée V par rapport à la dure-mère).
Les effets thérapeutiques de l'a-lminictration de l'adénovirus selon l'inventionont été mis en évidence par trois types d'analyse: une analyse histologique et
immunohistochimique, une analyse quantitative et une analyse cu"lporle-..~ .lP
2184408
WO 95/2s802 P~ l/rn9~ 248
Analyse histolo~ique et immunoh;stochimique
La lésion chimique de la voie nigro-striée induit une perte neuronale dans la
substance noire ainsi que la dénervation dopaminergique dans le striatum (révélées en
immunohistologie par un anticorps anti-tyrosine hydroxylase, TH).
L'analyse histologique des cerveaux injectés est réalisée 3 s~m~in~s après
l'injection intracérébrale de l'adénovirus Ad-GMF-J3 dans les conditions décrites dans
l'exemple 6. Les coupes sériées coronales de 30 ~lm d'ép~i~sellr sont réalisées dans la
substance noire et le striatum. Des coupes espacées de 180 ,um (1 coupe sur 6) sont
colorées au crésyl violet (pour évaluer la densité neuronale) et immunomarquées par
10 un anticorps anti tyrosine llydloxylase (TH) (pour détecter les neurones
dop~min~rgiques dans la sl)bst~nce noire et leur innervation dans le striatum).
Analyse qual,lilalive
Le nombre de neurones dopa~ e~giques (TH positifs), dans la subst~nce
noire est le paramètre d'évaluation des effets de l'adénovirus Ad-GMF-~. Le
15 dénombrement est réalisé sur un éch~ntillon (1 coupe sur 6 sur toute la longueur de la
substance noire). Pour chaque coupe, les neurones TH positifs sont dénombrés
sépale,nent des 2 cotés de la subst~n~e noire. Les résultats cumulés pour toutes les
coupes sont exprimés en proportion: nombre de neurones TH positifs du coté lésé par
rapport au nombre de neurones TH positifs du coté non lésé.
20 Analyse colnpol lell~entale
Les effets fonctionnels protecteurs de l'injection d'adénovirus Ad-GMF-J3 sur
la lésion de la voie nigro-striée ont été mis en évidence par analyse des performances
sensori-motrices des animaux au cours de 2 tests comportementaux: le test de la
rotation induite par des agonistes dopaminergiques (apomorphine, ~mph~t~mine et
25 lévodopa), et le test de préhension ("paw-reaching").
Exemple 8: Transfert in vivo du gène GMF-~ par un adénovirus recombinant à
des rats présentant une lésion de la voie perforante
Cet exemple décrit le transfert du gène GMF-13 in vivo au moyen d'un vecteur
adénoviral selon l'invention. Il montre sur un modèle animal de la lésion de la voie
30 perforante, que les vecteurs de l'invention permettent d'induire l'expres~ion in vivo de
quantités thérapeutiques de GMF-13.
wo ssl2s802 2 1 8 4 4 0 8 PCT/FRgS/00248
Sur des rats préalablement anesthésiés, la voie e-l~o.}uno-hippocampique
(voie pelro-allle) a été sectionnée unilatéralement à l'aide d'un couteau chirurgical. Les
coor~onnçes stéréotaxiques lltili.~é~s à cet effet sont, par rapport au lambda: AP:
+0,75; ML: +4,1 à 6,6; V: -7,7 (coordonnée V déterminée~par rapport à la dure-
s mère).
L'adénovirus recombinant GMF-~ est injecté immé~i~tem~nt après la lésion,
soit au niveau de la lésion, soit au niveau de l'hippocampe et du cortex enlo hillal. Plus
particulièrement, l'adénovirus injecté est l'adénovirus Ad-GMF-~ préparé dans
l'exemple 4.1., utilisé sous forme purifiée (3,5106 pfu/,ul), dans une solution saline
lo phosph~te (PBS).
Les injections ont été réalisées à l'aide d'une canule (diamètre extérieur 280
~m) conn~ctee à une pompe. La vitesse d'injection est fixée à 0,5 IIUmin, après quoi, la
canule reste en place pendant 4 minutes supplé...e..l~ s avant d'être remontée. Les
5 volumes d'injection dans l'hippocampe, le cortex entorhinal et le site de lésion de la
voie pe-rc,-~-"e sont respectivement 3 ,ul, 2 ~l et 2 ,ul. La concentration d'adénovirus
injectée est de 3,5. 106 pfu/~
Les effets thérapeutiques de l'~-I...;ni~ lion de l'adénovirus selon l'inventionpeuve.-l être mis en évidence par une analyse co,~,po-le,nentale dans les conditions de
20 l'exemple 6.
2 1 84408
W O95/25802 PCT/rn55/~-248
T.TSTE DE SEOUEN~E~
(1) INFORMATION GENERALE:
~i) DEPOSANT:
(A) NOM: RHONE-POULENC RORER S.A.
(B) RUE: 20, avenue Raymond ARON
(C) VILLE: ANTONY
(E) PAYS: FRANCE
(F) CODE POSTAL: 92165
(ii) TITRE DE L' INVENTION: Virus recomhln~nts, préparation et
utilisation en thérapie génique
(iii) NOMBRE DE SEQUENCES: 5
~iv) FORME LISIBLE PAR ORDINATEUR:
(A) TYPE DE SUPPORT: Tape
- 20 (B) ORDINATEUR: IBM PC compatible
(C) SYSTEME D' EXPLOITATION: PC-DOS/MS-DOS
~D) LOGICIEL: PatentIn Release #1.0, Version #1.25 ~OEB)
~2l INFORMATION POUR T.~ SF~O Tn NO: 1:
(i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 27 paires de bases
(B) TYPE: acide nucléique
(C) NOMBRE DE BRINS: simple
(D) CONFIGURATION: linéaire
(ii) TYPE DE MOLECULE: ADNc
(iii) nY~Orn~llQUE: NON
(iii) ANTI-SENS: NON
~ xi) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 1:
GCGATCGATA AAATGAGTGA GTCTTTG 27
~2) INFORMATION POUR T.~ SEO In NO: 2:
~i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 29 paires de bases
(B) TYPE: acide nucléique
(C) NOMBRE DE BRINS: simple
(D) CONFIGURATION: linéaire
(ii) TYPE DE MOLECULE: ADNc
(iii) HYPOTHETIQUE: NON
(iii) ANTI-SENS: NON
(xi) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 2:
GCGGTACCTT CACATTAGTG AAAAAATCC 29
(2) INFORMATION POUR T ~ SEO ID NO: 3:
(i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 63 paires de bases
(B) TYPE: acide nucléique
(C) NOMBRE DE BRINS: double
WO95l25802 2 1 8 4 4 0 ~ PCT~R95/00248
(D) CONFIGURATION: linéaire
(ii) TYPE DE MOLECULE: ADNc
(iii) HYPOTHETIQUE: NON
(iii) ANTI-SENS: NON
(xi) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 3: _
ATG ACC AAC AAG TGT CTC CTC CAA ATT GCT CTC CTG TTG TGC TTC TCC 48
Met Thr Asn Lys Cys Leu Leu Gln Ile Ala Leu Leu Leu Cys Phe Ser
1 5 10 15
ACT ACA GCT CTT TCC 63
Thr Thr Ala Leu Ser
(2) INFORMATION POUR T.~ S~O I~ NO: 4:
(i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 93 paires de bases
(B) TYPE: acide nucléique
(C) NOMBRE DE BRINS: simple
(D) CONFIGURATION: 1i néA i-e
(ii) TYPE DE MOLECULE: ADNc
~iii) HYPOTHETIQUE: NON
(iii) ANTI-SENS: NON
(xi) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 4:
GCGATCGATG AGATGACCAA CAAGTGTCTC CTCCAAATTG CTCTCCTGTT GTGCTTCTCC 60
ACTACAGCTC TTTCCATGAG TGAGTCTTTG GTT 93
~2) TNFORMATION POUR T-~ S~ In NO: 5:
(i) CARACTERISTIQUES DE LA SEQUENCE:
(A) LONGUEUR: 29 paires de bases
(B) TYPE: acide nucléique
(C) NOMBRE DE BRINS: simple
(D) CONFIGURATION: li n~ ire
~ii) TYPE DE MOLECULE: ADNc
(iii) HYPOTHETIQUE: NON
(iii) ANTI-SENS: NON
(xi) DESCRIPTION DE LA SEQUENCE: SEQ ID NO: 5:
GCGGTACCTT CACATTAGTG AAAAAATCC 29