Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
W096~00~05 2 ~ 927 t I r~ r~ 4
.
NOUVER T .F.S SIJRSTAN(IF,S ANTITUMORAT.F.S ET ANTlT F.Ut'FMTQUES
T .FUR PRFPARATION ET LFAS COMPOSITIONS PHARMAcEuTlQl ~S
OUI I FS CONTIFNNFNT
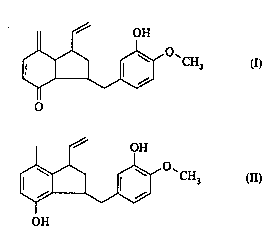
La présente invention conceme la 3-(3-hydroxy-4méthoxy-benzy1)-7-méthy-
lène-1-vinyl-2,3,3a,4,7,7a '- ' /Lv-indène-4-one de formule:
et le 3-(3-hydroxy 1 méthoxy-benzyl)-4-hydroxy-7-méthyl-1-vinyl-indane de formule:
J~ 'O'CH3 (II),
OH
ainsi que leurs fommes _'6.,' ~ ' , leur procédé d'obtention à partir de la plante
10 Ottelia alismoïdes et les ,~ 1 ' . qui les
Plus ~ icul;~"l,~.t, la présente invention conceme le produit de formule (I)
qui présente les . ' ' ~ , suivantes:
- pouvoir rotatoire: [a]20(Na 589) = -20,8 i 1,0 (rii~h~ ' '' . C = 0,5)
[a]20(Hg 436) = -32 i 1,2 (di~ lV~ , C = 0,5)
- spectre infra-rouge: principales bandes d'~l~vllJliv~ à 3400, 3070,
2925, 2840, 1660, 1580,1500, 1435, 1270, 1125 et 1025 cm~l.
- spectre de masse (DCI NH3): 328 (M + NH4)+
(El): 311 (M + NH4 - OH)+
- spectre de résonance ,.-.~ '';q ~ nucléaire du proton (600 MHz; CDC13; o en
ppm):6,99(d,J=9Hz,lH);6,80(d,J=2Hz,lH);6,77(d,J=8Hz,lH),6.69
(dd, J = 2 et 8 Hz, lH); 5,94 (d, J = 9 Hz, lH); 5,78 (m, lH); 5053 (s, lH); 5,32
(m, 2H); 4,98 (d, J = 10 Hz, lH); 4,95 (d, J = 17 Hz, lH); 3,88 (s, 3H); 3,07 (m,
lH); 2,88 (dd, J = 6 et 8 Hz, lH); 2,80 (t, J = 8 et 8 Hz, lH); 2,62 (m, lH); 2,51
(m,2H);1,74(m,1H);1,58(m,1H).
W096/00205 2 1 9 2 7 1 I r~ llrl~7 cr 14
o
Plus ~ ,ul;c~ c.~l, la présente invention concerne le produit de formule
(II) qui présente les . ' . suivantes:
- pouvoir rotatoire: [a]20(Na 589) = +32,3 i 1,3 (~" ' ' , ' ; c = 0.5)
[~]20(Hg 436) ~ +75,0 i 1,8 (~ lvlul~ ,; c = 0,5~
- spectre infra-rouge: principales bandes d'absorption . .. ~ à 3419, 3074,
1635, 1592, 1495, 1271, 1126 et 1029 cm~l.
- spectre de masse (DCI NH3): 328 (M + NH4)+
(EI): 310 (M)+
- spectre de résonance ., IA~ ''' nucléaire du proton (600 MHz; CDC13; o en ppm;constante de couplage J en Hz): 1,95 (m, lH); 2,05 (m, lH); 2,18 (s, 3H); 2,62 (d,
J = 8 et 13, lH); 3,16 (dd, J = 6 et 13, lH); 3,58 (m, lH); 3,83 (m, lH); 3,88 (m,
lH); 4,25 (s, lH); 4,98 (d, J = 8, lH); 5,01 (d, J = 16, lH); 5,58 (s, lH); 5,78 (dd,
J=8etl6,1~);6,53(d,J=7,1H);6,69(dd,J=7etl,1H);6,79(d,J=7,1H);
6,82 (dd,J = 1, lH); 6,85 (d,J = 7, lH)
- spectre ultra-violet:
A max = 282 nm (E = 4650); 225 nm (~ ); 207 (~ = 48800) (c =
10,1 g/cm3; méthanol)
A max = 282 nm; 225 nm (~I, .IG~ S); 206 nm (c = 10,1 mg/cm3;
méthanol-acide ~l.lufl.r.Liq.,c)
A max = 297 nm (~l, L~,n; ,l); 288 nm; 243 nm (~PA~ 1); 214 nm (c=
10,1 mg/cm3; méthanol-potasse)
La 3-(3-hydroxyA4-méthoxy-benzyl)-7-méthylène-1-vinyl-2,3,3a,4,7,7a-
hex hydro-indène-4-one et le 3-(3-hydroxy-4-méthoxy-benzyl) 1 hydroxy-7-méthyl-1-
vinyl-indane peuvent être obtenus à partir de la plante Ottelia alismoïdes par
extraction au moyen d'un solvant convenable suivie de la séparation de la 3-(3-
hydroxy~méthoxy-benzyl)-7-méthylène-1-vinyl-2,3,3a,4,7,7a-hexahydro-indène~
one ou du 3-(3-hydroxyA4-méthoxy-benzyl)-4-hydroxy-7-méthyl-1-vinyl-mdane de
re~ctrait obtenu.
Ottelia alismoii1es, qui appartient à la farnille des l.ylL~ est une
plante aquatique submergée ou partiellement flottante. Les feuilles d'Ottelia alismoides
sont radicales formant, pour la partie immergée, une couronne rétrécie. La longue
partie flottante est pétiolée, ovale et lancéolée, oblongue ou cordée. Les fleurs sont
l~clllla~Lvdil~ et solitaires, sessiles avec une longue spate p~nAlll~. et sont
constituées de trois sépales linéaires et oblongues et de trois pétales larges ovoides ou
Vll/;~,Ul~lil~.
VV096/W2/)5 2 1 927 1 ~ F~l/r. '~ ~4
Selon l'invention, Ostelia ~ " : ' , sous forme de la plante entière,
O' ' ' séchée et finement broyée, est traitée une ou plusieurs fois par un solvant
choisi parmi les alcools A1;~ contenant 1 à 4 atomes de carbone et les éthers
A~ l"- contenant 1 à 6 atomes de carbone pour fournir, après ~ un
5 extrait sec qui est repris par un L~u~,~blllc aliphatique contenant 5 à 8 atomes de
carbone ou un Ly~L~ ' c ~"~.1., I;l,l _llq"~ contenant 5 à 7 atomes de carbone pour
obtenir une solution dont les insolubles sont separes par filtration et qui, après
~r- ' ' fournit un extrait sec dont on sépare la 3-(3-hydroxy4-méthoxy-
benzyl)-7-méthylène-1-vinyl-2,3,3a,4,7,7a 1 ' ylLu-indène4-one ou le 3-(3-
10 hydroxy-4méthoxy-benzyl) ~ hJ~Lu~.y-7-méthyl-l-vinyl-indane par application de
techniques I ' O ,' ,_
Pour la mise en oeuvre du procédé selon l'invention pour l'obtention du
produit de formule (I), il est I ' ' ~.Il~.; avantageux d'effectuer l'extraction de la
plante entière au moyen d'éthanol et de traiter rextrait sec obtenu par un }..y~u~l,~..e
15 aliphatique tel que l~exane.
Pour la mise en oeuvre du procédé selon l'invention pour l'obtention du
produit de formule (II), il est I ' ~,...~.t avantageux d'effectuer l'extraction de la
plante entière au moyen de méthyl tert-butyl éther et de traiter l'extrait sec obtenu par
un hy~Lu~l~c aliphatique tel que rheptane associé à un nitrile tel que l'ArPtn~
20La séparation de la 3-(3-hydroxy-4-méthoxy-benzyl)-7-méthylène-1-vinyl-
2,3,3a,4,7,7a-hexahydro-indène 1 one ou du 3-(3-hydroxy-4-méthoxy-benzyl)~
hydroxy-7-méthyl-1-vinyl-indane à partir de l'extrait issu du traitement par un
h.~Lu~bu c aliphatique évrnt~ - associé à un nitrile est g ' effectuée
par .,1~ I,I..e Iiquide à haute l~ ou par .,LI. ~, ' de partage
25centrifuge.
La 3-(3-hydroxy-4-méthoxy-benzyl)-7-méthylène-1-vinyl-2,3,3a,4,7,7a-hexa-
hydro-indène-4-one et le 3-(3-hydroxy 1 méthoxy-benzyl) 1 hydroxy-7-méthyl-1-
vinyl-indane présentent des propriétés I ,;. ~lnO;~ Iclll~u4uablc~
In vi~ro, la 3-(3-hydroxy4-méthoxy-benzyl)-7-méthylène-1-vinyl-
302,3,3a,4,7,7a-hexahydro-indène4-one et le 3- (3-hydroxy4-méthoxy-benzyl)4-
hydroxy-7-méthyl-1-vinyl-indane présentent la propriété d'inhiber la pul~ uoll de
la tubuline.
La tubuline, issue de cervelles de porcs, est purifiée par trois cycles de
poly---~ iu~-dcpul~l-.l,.;i,.,~iol selon la methode de M.L. SHELANSKI et coll.,
Proc. Natl. Acad. Sci. USA, 70, 765-768 (1973) suivie d'une .,I.I.. -S.~ r sur
wo s6/0020s 2 1 9 2 7 1 1 r~llr~s ~ ~ 1
~ selon la méthode de M.D. WEINGARTEN et coll., Proc. Natl.
Acad. Sci. USA, ~, 1858-1862 (1975).
La tubuline, à une ~ 1.=. .e~, 1;. ..- de 8,511M dans un tampon Mes 0,05 M
(pH = 6,8), MgC12 0,25 mM, EGTA 0,5 mM, glycérol 3,4 M, GTP 1 mM est
Iwly~ , à 37~C pendant 30 minutes apres addition de MgC12 (6 mM) et de
;n _ croissantes de 0,8 à 16 IlM de 3-(3-hydroxy-4-méthoxy-benzyl)-7-
méthylène-1-vinyl-2,3,3a,4,7,7a h~ yd~indène-4-one ou de 3-(3-hydroxy-4-
methoxy-benzyl) 1 h~v~y-7-méthyl-1-vinyl-indane en solution à 1 mg/cm3 dans
réthanol absolu.
r.~. "~ ," de la tubuline en microtubules se traduit par une
de la turbidité observée à 350 nm à l'aide d'un ~h~ vl~....e~
La 3- (3-hydroxy 1 -méthoxy-benzyl) -7-méthylène- 1 -vinyl-2,3,3a,4,7,7a-
hexahydro-indène-4-one et le 3-(3-hydroxy-4-méthoxy-benzyl)-4-hydroxy-7-méthyl-1-
v~ v~ I une inhibition de la ~lyll~l~alioll de la tubuline qui se
15 traduit par une ~ ~, ,.-- - '-';.~.- du temps de latence, une diminution de la vitesse de
~lylll~llaa~iwl ainsi qu'une turbidité plus faible à l'état statiomnaire. La .~
de produit de formule (I) qui inhibe de 50 % la ~lylll~ a~ n de la tubuline à une
........ ,~ ,n,.~.~ inférieure à 5 !lM et même inférieure à 1 IlM pour la 3-(3-hydroxy-4-
méthoxy-benzyl) -7-méthylène- 1 -vinyl-2,3,3a,4,7,7a-hexahydro-indène4-one.
In vitro, la 3-(3-hydroxy4-méthoxy-ben~yl)-7-méthylène-1-vinyl-2,3,3a,
4,7,7a-hexahydro-indène4-one et le 3-(3-hydroxy-4-méthoxy-benzyl)4-hydroxy-7-
méthyl-1-vinyl-indane ..- f~ une cytotoxicité inférieure à 1 1lg/cm3 sur les
lignées ceLulaires de la leucémie murine P388, ainsi que sur les lignées résistantes
P388/DOX et même inférieure à lng/cm3 pour la 3-(3-hydroxy-4-méthoxy-benzyl)-7-
méthylène-1-vinyl-2,3,3a,4,7,7a-hexahydro-indène4-one
Les exemples suivants illustrent la présente invention.
F~FMpLE 1
On agite 8,8 kg d'Ottelia alismo~es, sous forme de plante entière sechée et
finement broyée, sont agités dans un filtre a~ p1~qui~ garni d'une toile Tergal~ED avec
60 litres d'éthanol à 99,9 ~o, dénaturé au ~:y~lol~ e~ pendant 1 heure. Après
filtration sous un pression d'azote de 2 bars, la plante est à nouveau extraite par
60 litres d'éthanol pendant 1 heure, puis par 30 litres d'éthanol pendant 12 heures. La
plante est alors lavée par 30 litres d'éthanol.
Wo 96100205 2 1 9 2 7 1 1 . ~l~r~_J ~4
La solution ' ' . ainsi obtenue est concentrée jusqu'à um volume de
15 litres dans un C~, l à i' , ' puis concentrée à sec sous pression
réduite à 40~C.
On obtient ainsi 80 g d'extrait mou de couleur verte q~u est repris par 3 litres5 d'hexane. Après filtration d'un insoluble (7 g), le filtrat est concentré à sec. On obtient
ainsi 73 g d'un produit (extrait A) dont l'activité inhibitrice sur la puly~l~c~aliu~l de la
tubuline (CIso) est de 75 ~1g/cm3.
On reprend 9,4 g d'extrait A par 200 cm3 de ~ e. Après filtration
d'un insoluble inactif (2 g), la solution ~ l. J. .~ ..r est déposée sur une colonne de
200 g de silice Merck (0,040-0,063 mm) pour laquelle le rapport ~:Lal~cL~ .aut., u est
égal à 15. L'élution est réalisée avec un mélange !~ ull~ ' ' ' UIIICIL. ~e avec un
gradient croissant de 5 % en di~.:lv~ul~.6~lalle en recueillant des fractions de 500 cm3.
Les fractions qui cvllc,,~vlid~ a l'élution par les mélanges ~:yclvllc~ul~,-
d;~,}~Jl~ 45-55, 40-60 et 35-65 en volumes sont réunies et ~:vAcellLlccs à sec
sous pression réduite à une i . ' c voisine de 20~C. On obtient ainsi 1,2 g d'unproduit dont l'activité est de 2,5 1lg/cm3.
On reprend le produit ainsi obtenu par 5 cm3 d'un melange dicLlvlu~l0iL~lc
méthanol (99-1 en volumes) et ~ ' ulllalv~h.e sur une colonne de 50 g silice Merck
60H, pour laquelle le rapport rl;~rnf'~ ' est égal à 15, préparée avec le meme
solvant. On élue avec un mélange li~llvlulll~lal~ métLnol (99-1 en volumes) en
recueillant des fractions de 2 cm3. Les fractions 41 à 68 sont réunies et concentrées à
sec sous pression réduite. On obtient ainsi 70 mg d'un produit, dont l'activité est de
1 ,uglcm3, qui est purifié par ~ liquide à haute l~ r~ sur une
colonne BIORAD C18 HL-90-10 en éluant avec un mélange acétonitrile-eau au débit
de 3 cm3/minute et en effectuant la détection par absorption U.V. à 254 nm. La
collecte du pic cu~ ulll:lall~ au pic de rétention de 19 minutes fournit 14 mg de 3- (3-
hydroxy l méthoxy-benzyl)-7-méthylène-1-vinyl-2,3,3a,4,7,7a-hexahydro-indène-4
one pure sous forme d'un ~mi solide jaune pâle dont les ,~ sont les
suivantes:
- pouvoir rotatoire: [a]20(Na 589) = -20,8 _ 1,0 (dichlulw~lcLLàllc~ c = 0,5)
[c~]20(Hg 436) = -32 i 1,2 (dichlulu...~ la,~e, c = 0,5)
- spectre infra-rouge: principales bandes d'absorption . ~ r~ Ir~ u ~ à 3400, 3070,
2925, 2840, 1660, 1580, 1500, 1435, 1270, 1125 et 1025 cm~1.
- spectre de mas~ (DCI NH3): 328 (M + NH4)+
(EI): 311 (M + NH4 - OH)+
w096/00205 2 ~ 927 I l r~llr~s~c 14 o
- spectre de résonance ~ . nucléaire du proton (600 MHz; CDC13; o en
ppm): 6,99 (d, J = 9 Hz, lH); 6,80 (d, J = 2 Hz, lH); 6,77 (d, J = 8 Hz, lH), 6.69
(dd, J = 2 et 8 Hz, lH); 5,94 (d, J = 9 Hz, lH); 5,78 (m, lH); 5053 (s, lH); 5,32
(m, 2H); 4,98 (d, J = 10 Hz, lH); 4,95 (d, J = 17 Hz, lH); 3,88 ~s, 3H); 3,07 (m,
lH);2,88(dd,J=6et8Hz,lH);2,80(t,J=8et8Hz,lH);2,62(m,1H);2,51
(m, 2H); 1,74 (m, lH); 1,58 (m, lH).
Le produit obtenu peut être visualisé par ~lu( " ,..a~ .v, ~I,ll l.~ sur couche mince
de silice Merck F254 en éluant avec un mélange ~ ,llvLuIlll,Lhane-méthanol (99-1 en
volumes) et révélation, après chauffage de la plaque à 100~C, avec du sulfate cérique à
10 0,1 % dans l'éthanol. Ie produit apparaît sous forme d'un spot de Rf = 0,5 avec une
couleur rouge-violet.
~X~.MPJ F: 2
On reprend 2 g d'extrait A obtenu à l'exemple 1 par 10 cm3 d'un mélange
acétate d'éthyle-heptane- ' ' eau (1-2-2-1 en volumes) puis ~ par
15 .1.,. ~ , ' de partage à conffl-courant sur un appareil CPC SANKI ayant une
colomne de 245 cm3 en opérant dans les conditions suivantes:
- phase e : pha~ lourde
- phase mobile : phase légère
- sens : ascendant
- vitesse de rotation : 1000 Luul~/
- débit : 3 cm3/minute
- retention : 80 ~o
- inversion du sens : à 170 minutes
L'injection est réalisée à réquilibre des 2 phases. On recueille les fractions
25 toutes les 2 minutes. La ' ~ v . ' ~ sur couche mince et le dosage monfflnt que
les fractions 56 à 85 f Ia (3-hydroxy 1-méthoxy-benzyl)-7-méthylène-1-
vinyl-2,3,3a,4,7,7a-hexahydro-indène-4One. La ~iri~,~Liwl du produit obtenu par
HPLC dans les conditions décrites dans l'exemple 1 fournit 2 mg de 3-(3-hydroxy-4-
méthoxy-benzyl)-7-méthylène-1-vinyl-2,3,3a,4,7,7a-hexahydro-indène-4-one pure.
30 F.XF.MPl .F.3
85 kg d'Ottelia allsmo~es, sous forme de plante entière séchée et finement
broyée, sont agités dans un filffl ,.~..r ",1~ 1 garni d'une toile Tergal(~9 avec 400 uffls
de méthyl tert-butyl éther pendant 1 heure puis on laisse en contact pendant 12 heures.
-
w096100205 2 1 927 ~ I r~l~rl~- 14
Après filtration sous un pression d'azote de 2 bars, la plante est à nouveau extraite par
400 litres de méthyl tert-butyl éther pendant 1 heure. On laisse en contact pendant
12 heures. La plante est alors lavée par 200 litres de méthyl tert-butyl éther.
La solution éthérée ainsi obtenue est concentrée jusqu'à un volume de
5 15 litres dans un ~v_~ à i , ' 1, puis concentrée à sec sous pression
réduite à 40~C.
On obtient ainsi 754 g d'extrait mou de couleur verte qui est repris par
30 litres d'un mélange heptane-acétonitrile (1-1 en volumes). Après filtration d'un
insoluble inactif, le filttat est concentré à sec. On obtient ainsi 270 g d'un produit
10 huileux de couleur marron verL
On reprend 10 g de l'extrait obtenu par 150 cm3 d'un mélange acétate
d'éthyle-heptane- ' ' -l cau (2-3-3-2 en volumes) p~us on ~.}u.,, -~ lh-. par
~}~ "Apt ~ de partage à contre-courant sur um appareil SFCC 800 type rlAo~
ayant un volume de 2500 c n3 répatti en 3 bobines en opérant dans les conditions suivantes:
-phase ~ r phase lourde
- phase mobile : phase légère
- mode : ascendant
vitesse de rotation: 380 i l
- débit : 8 cm3/minute
-rétention : 46 %
L'injection est réalisée à l'équilibre des 2 phases. On recueille les fractions
toutes les 8 minutes. La séparation est arretée après avoir récupéré 30 fractions. Les
fractions 19 à 26 sont réunies et ~:U~ L6~ à sec. On obtient ainsi 3,5 g d'un extrait
huileux dont on separe le 3-(3-hydroxy-4-méthoxy-benzyl)4-hydroxy-7-méthyl-1-
vinyl-indane pur par ~Iu, ~ sur une colonne de silice AMICON (0,030-
0,070 mm) de 3 cm de hauteur et de 1,2 cm de diamètre. On élue avec de l'heptane en
utilisant un gradient croissant en méthyl tert-butyl éther et en recueillant des fractions
de 5 cm3. Les fractions 22 et 23 qui ~:ull.-r ~ à l'élution par un mélange heptane-
méthyl tert-butyl éther (8-2 en volumes) sont réunies et cur~c~ à sec sous
presSion réduite. On obtient ainsi 0,5 mg de 3-(3-hydroxy4-méthoxy-oenzyl) 4-
hydroxy-7-méthyl-1-vinyl-indane sous forme d'um solide jaune pale dont les
r, ;,~ sont les suivantes:
- pouvoir rotatoire: [a]20(Na 589) = +32,3 i 1,3 (dichlu.u...1l~.ane; c = 0.5)
[a]20(Hg 436) = +75,0 + 1,8 (diChlu~wll~ le; c = 0,5)
_ ~ . . _ , . _ _ . . . .. .... . .. _ . .. _ .
~19271 1
wo s6/0020s r~llrh~ s . 14 0
- spectre infra-rouge: principales bandes d'absorption . ~- r.'. ;~ .. _ à 3419, 3074,
1635, 1592, 1495, 1271, 1126 et 1029 cm~l.
- spectre de masse (DCI NH3): 328 (M + NH4)+
(El): 310 (M)+
5 - spectre de résonance ~ nucléaire du proton (600 MHz; CDCl3; ô en
ppm; constante de couplage J en Hz): 1,95 (m, lH); 2,05 (m, lH); 2,18 (s, 3H);
2,62 (d, J = 8 et 13, lH); 3,16 (dd, J = 6 et 13, lH); 3,58 (m, IH); 3,83 (m, lH);
3,88 (m, lEI); 4,25 (s, lH); 4,98 (d, J = 8, lH); 5,01 (d, J = 16, lH); 5,58 (s, lH);
5,78(dd,J=8etl6,1H);6,53(d,J=7,1H);6,69(dd,J=7etl,1H);6,79(d,J=
7, lH); 6,82 (dd, J = 1, lH); 6,85 (d, J = 7, lH)
- spectre ultra-violet:
A max = 282 nm (~ = 4650); 225 nm (5i ' '~; 207 (E = 48800) (c =
10,1 glcm3; méthanol)
A max = 282 nm; ~5 mm (5,, ' ~'; 206 nm (c = 10,1 mg/cm3;
15 méthanol-acide ~
A max = 297 nm ( l ' t'; 288 nm; 243 nm (5; ' ''; 214 nm (c=
10,1 mg/cm3; méthanol-potasse).
Le produit obtenu peut être visualisé par 1Lu ,, ,' - sur couche mince
de silice Merck F254 en éluant avec un mélange ~' ' ' , ' méthanol (99-1 en
20 volumes) et révélation par le réactif de GIBBS spécifique des phénols. Le produit
apparaît sous forme d'un spot de Rf = 0,48 de couleur bleue.
La 3- (3 -hydroxy-4mé~hûxy-benzyl) -7-méthylène- 1 -vinyl-2,3,3a,4,7,7a-hexa-
hydro-indène 1 one et le 3-(3-hydroxy-4méthoxy-benzyl)-4-hydroxy-7-méthyl-1-
vinyl-indane ~r ' ' une activit~ t~hibitrice sig.~;~li~c de la ~JIuliri~ liull
25 ceDulaire anormale et possède des propriétés 11~6-~ . permettant le traitement
de malades ayant des conditions I ' ~ g;,l..~c associées à une ~ulif~laliull oellulaire
anormale. Les conditions p ~~hr.l~git~ c incluent la p.ulir~.~liuli ceDulaire anormale de
oeDules malignes ou non malignes de divers tissus et/ou organes, ~:o.r.~.l, t, de
manière non limitative, les tissus musculaires, osseux ou ~; -r, la peau, le
30 cerveau, les poumons, les organes sexuels, les systèmes lr .' . ou rénaux, les
ceDules 111~1111.~ ~., ou sanguines, le foie, l'appareil digestif, le pancréas et les glandes
thyroides ou adrénales. Ces conditions 1 h~ ; peuvent inclure également le
psoriasis, les tumeurs solides, les cancers de l'ovaire, du sein, du cerveau, de la
prostate, du colon, de l'estomac, du rein ou des testicules, le sarcome de Kaposi, le
wos6~0020~ 2 ~ 927 1 I P~."J~. 1
' 6 ~ le ~,IIVI;~ le n.,~ubl~Luln6, la tumeur de Wilms, la
maladie de Hodgkin, les ' les myélomes multiples, les leucémies Iymphocy-
taires ~,h.. , les Iymphomes ~ '~ aigus ou chroniques. Le nouveau
produit selon l'invention est ~uL~ w.L utile pour le traitement du cancer du
5 sein, de l'ovaire, du colon ou du rein. Le produit selon l'invention peut être utilisé pour
prévenir ou retarder l'apparition ou la l~app,il;oll des conditions poth~ .ae oupour traiter ces conditions ~ giq, r;
Les produits selon l'invention peuvent être administrés à un malade selon
différentesformesadaptéesàlavoied'~.l.; ;~hAI;...,choisiequi,depréférence,estla
voie l,gl, ~ L~ par voie parentérale comprend les _'
C OU sous-cutanée. Plus l-lLi~u1;2.
préféréeestl' ' ~ ~ illLId~éli '-ouilt~gv~:ine~:.
La présente invention comprend également les ~ -~ u~ e
I' , qui ,..,.1;.., I la 3-(3-hydroxy-4méthoxy-henzyl)-7-méthylène-1-
vinyl-2,3,3a,4, 7,7a h~ .Lu-imdène-40ne ou le 3-(3-hydroxy-4méthoxy-benzyl)-
4hydroxy-7-méthyl-1-vinyl-mdane en une quantité suffisante adaptée à l'emploi en' qu~ humaine ou vétérinaire. Les ~ p.1~ peuvent être préparées selon
les méthodes habituelles en utilisant un ou plusieurs adjuvants, supports ou excipients
~~ lse Les supports w,.. ~ ' incluent les diluants, les
20 milieux aqueux stériles et divers solvants non toxiques. De préférence les
~:ul~.ru~iLiul~s se présentent sous forme de solutions ou de . ~ aqueuses, de
solutions mjectables qui peuvent contenir des agents ~ ' ' des colorants, des
ple~lvaLirq oudes ~~ts1.ili~q~tc
Le choix des adjuvants ou excipients peut être déterminé par la solubilité et
25 les propriétés chimiques du produit, le mode paniculier d~d~ . et les bonnes
pratiques l~ - ti.
Pour 1' ' ~ ~ parentérale, on utilise des solutions ou des s ~ c;~
stériles aqueuses ou non aqueuses. Pour la préparation de solutions ou de s s;~
non aqueuses peuvent être utilisés des huiles vegétales naturelles telle que rhuile
30 d'olive, I'huile de sésame ou l'huile de paraffine ou les esters organiques injectables tels
que l'oléate d'éthyle. Les solutions aqueuses ~ullvi~ lL pour l'a' ~
iulhd~,.ne~ dans la mesure où le pH est ~;UII~. ' '~-.~~.~t ajusté et où l'isotonicité est
réalisee, par exemple, par une quantité suffisante de chlorure de sodium ou de
glucose. La ~ dLiull peut être réalisée par chauffage ou par tout autre moyen qui
35 n'altère pas la ~~
wo96/00~05 2 1 927 1 1 r~llr~ 14
n est bien entendu que tous les produits entrant dans les ~ . selon
l'invention doivent être purs et non toxiques pour les quantités utilisées.
Les l~f. ~ A ~ peuvent contenir au moins 0,001 ~o de produit
actif. La quantité de produit actif dans une ~ est telle
5 qu'une posologie convenable p usse être prescrite. De préférence, les ~
sont préparées de telle façon qu'une dose unitaire contienne de 0,01 à 100 mg environ
deproduitactifpourl'~.l,..:."~l.~l,""parvoieparentérale.
Le traitement ll~,.p.~~ peut être effectué cur~ avec d'autres
traitements 11..~,~p~ .U.I~ ~ incluant des " r ~ ' '-, , des anticorps
10 ~ ... rl.~ , des thérapies ~. i ou des ~ lh.'.,.l~ OU des
"' des réponses hirlogitl..Pc Les ~-r- ' des réponses incluent, de
manière non limitative, les Iy~ JLvl~ul~ et les cytokines telles que les ~ ' ' les
interférons (c~, 13 ou ô) et le TNF. D'autres agents, ' ' I , utiles dans le
traitement des désordres dus à la ~-~vlirelalivll anormale des cellules incluent, de
15 manière non limitative, les agents alkylants tels que les moutardes à l'azote comme la
me~,lllv,~:La~ ., le ~:y~ . Ie melphalan et le, l~ ~ 1, des sulfonates
d'alkyle comme le busulfan, les ll;h~ ~,..., comme la, la lomustine, la
sémustine et la sh~ , les triazènes comme la ~ ~ , les ~nrimPtr~h~litPc
comme les analogues de l'acide folique tel que le Il~ iluh~ les analogues de
20 pyrinudine comme le fluorouracil et la cytarabine, des analogues de purines comme la
lv~. ;... et la thi~-gl.rninP des produits naturels tels que les alcaloides de vinca
comme la vinblas1ine, la vincristine et la vendésine, des i,~J;~lu~hylluLu~w comme
l'étoposide et le teniposide, des l:, comme la da.,h..JIll.~,ule, la
~ ~' ulvi~;nc, la du;w,, ' ~ la bléomycine, la ~ et la IIUIVIII,~.,UI~', des
25 en~ymes comme la L-a;~Jal~,~la~,~, des agents divers comme les complexes de
Cwldi,aL;ull du platine tel que le cisplatine, les urées substituées tel que
l'lly~Lu~yulé~, les dérivés de lI~O;II.YIII.TL~UIe comme la l-lU~ flJ~U.." les
SU~ , U~ a.L;..~ulLi~ , comme le mitotane et ~ .yllude~ les
hormones et les gnnictPc comme les a~ nucul L~u~t~,Luid~:~ comme la prednisone,
30 les ~IuL~.i~es comme le caproate d'lly~Lu~y~)lu~ vne~ I'acétate de
ll,éaw~y~.u~ lull~, et l'~étate de megestrol, les ~ ~U,5~ comme le
diéthylstilbestrol et l'élllyllyl~ adiOI, les u,S~ ., comme le Irm~ifPnP les
androgènes comme le propionate de I~LU~i~.V.IC et la r~ y,ll~" ,,
Les doses utilisées pour mettre en oeuvre les métbodes selon l'invention sont
35 celles qui permettent un traitement ~Iu~ a.,L;.~ue ou un maximum de réponse
WO 96/00205 2 1 9 2 7 1 1 F~l~r~ ~ t
11
Les doses varient selon la forme d'h. 1. ~ et les . ~ "
propres du sujet à traiter. En général, les doses sont celles qui sont ih -l .
efficaces pour le traitement des désordres dus à une ~lvLrcL<:lioll cellulaire anormale.
Le produit selon l'invention peut être administré aussi souvent que nécessaire pour
5 obtenir l'effet lh .,.~ désiré. Certains malades peuvent répondre rapidement à
des doses lel...l~,...~.l fortes ou faibles puis avoir besoin de doses d'entretien faibles
ou nulles. G~n~r~lr~m~nt de faibles doses seront utilisées au début du traitement et, si
nécessaire, des doses de plus en plus fortes seront a~L...nl,~Lcc~ jusqu'à l'obtention d'un
effet optimum. Pour d'autres malades il peut être nécessaire d'L~ mll~lLcl des doses
10 d'entretien 1 à 8 fois par jour, de préférence 1 à 4 fois, selon les besoins
physiologiques du malade considéré. n est aussi possible que pour cerrains malades il
soit nécessaire de n'utiliser qu'une à deux r ' ~ ~ ' journalières.
Chez l'homme, par voie ~ ~ , Ies doses sont g~n~Srr~l ' comprises
entre 0,05 et 50 mg~cg et, de préférence entre 0,01 et 5 mg~cg et, encore plus
15 ~l~ r;q, - ~ entre 0,1 et 2 mg/kg. n est entendu que, pour choisir le dosage le plus
approprié, devront être pris en compte la voie d'hl~ le poids du malade,son état de santé général, son âge et tous les facteurs qui peuvent irlfluer surrefficacité du traitement.
L'exemple suivant illustre une ~ .p~ selon l'invention.
20 F~Fl\~pLF
On dissout 40 mg du produit obtenu à l'exemple 1 dans 1 cm3 d'E~ Lvl
EL 620 et 1 cm3 d'éthanol puis la solution est diluée par addition de 18 cm3 de sérum
Iu~uc.
La ~ ' est r ' ~ ~ ' ~,~, par perfusion pendant 1 heure par introduc-
25 tion dans du soluté physiologique.