Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02307134 2000-04-20
WO 99/20422 PCT/CA98/00987
NANOCOMPOSITES Ä INTERFACES ACTIVÉES PRÉPARÉS
PAR BROYAGE MÉCANIQUE D'HYDRURES DE MAGNÉSIUM ET
USAGE DE CEUX-CI POUR LE STOCKAGE D'HYDROG~NE
pomaine techniaue de l'invention
La présente invention a pour objet de nouveaux nanocomposites à
interfaces activées à base de magnésium (Mg) et d'un autre élément ou composé
chimique connu pour être capable d'absorber (hydrogène et être peu miscible
par
broyage avec le magnésium ou son hydrure; tel que par exemple le vanadium (V),
le titane (Ti) ou le nobium (Nb).
L'invention a également pour objet un procédé de préparation de ces
nouveaux nanocomposites par broyage mécanique intense d'hydrures de
magnésium et de l'autre élément ou composé.
L'invention a enfin pour objet l'usage de ces nouveaux
nanocomposites pour le stockage et/ou le transport de l'hydrogène.
Brève description des dessins
De façon à faciliter la lecture et la compréhension de la description
qui va suivre de l'état de la technique dans ce domaine, et, de là, permettre
de
mieux apprécier les caractéristiques originales distinguant la présente
invention de
cet état de la technique, on se référera ci-après aux dessins annexés dans
lesquels:
la figure 1 est une courbe donnant le taux d'absorption en hydrogène
mesuré en fonction du temps fors d'un premier cycle d'absorption et de
désorption
effectués à 350°C sous une pression de 150 psi sur une poudre
nanocristalline de
Mg préparée par broyage mécanique intense pendant 20 heures d'une poudre de
Mg pur (325 mesh);
la figure 2 est une courbe similaire à celle de la figure 1 mais à une
échelle de temps différente, cette courbe ayant été obtenue fors d'un
troisième
cycle d'absorption et de désorption effectué sur la même poudre
nanocristalline de
Mg dans les mêmes conditions;
FEUILLE DE REMPLACEMENT (REGLE 26)
CA 02307134 2000-04-20
- WO 99/20422 PCT/CA98/00987
2
la figure 3 est une courbe de diffraction au rayon X montrant les pics
associés à la présence de Mg (~) et ceux associés à la présence de V(°)
dans un
nanocomposite à base de Mg contenant 5% at. de V, ce nanocomposite ayant été
préparé par broyage mécanique intense de poudres de Mg pur (325 mesh) et de
V pendant 20 heures;
la figure 4 et 5 sont des courbes donnant le taux d'absorption en
hydrogène mesuré en fonction du temps lors d'un premier et d'un second cycles
d'absorption et de désorption effectués à 350°C sous une pression de
150 psi sur
le nanocomposite dont la courbe de diffraction au rayon X est illustré sur la
figure
3;
la figure 6 est une courbe donnant le taux d'absorption en hydrogène
mesuré en fonction du temps lors d'un premier cycle d'absorption effectué à
différentes températures et pressions sur une poudre de Mg obtenues par
désorption d'une poudre polycristalline de MgH2 de type commercial;
la figure 7 est une courbe analogue à celle de la figure 6 mais à une
écheile de temps différente, cette courbe donnant le taux d'absorption en
hydrogène mesuré en fonction du temps lors d'un premier cycle d'absorption
effectué à différentes températures mais sous une même pression de 150 psi sur
une poudre nanocristalline de Mg obtenue par broyage mécanique intense durant
20 heures puis désorption d'une poudre polycristalline commerciale de MgH2;
la figure 8 est une courbe analogue à celle de la figure 7, donnant le
taux d'absorption en hydrogène mesuré en fonction du temps lors d'un premier
cycle d'absorption effectué à différentes températures mais sous une même
pression de 150 psi sur une poudre nanocristalline d'un composite de Mg et Ni
préparée par broyage mécanique intense durant 20 heures puis désorption d'un
mélange de la poudre polycristalline commerciale de MgH2 précédemment
mentionnée avec 5% at. d'une poudre de Ni;
la figure 9 est une courbe analogue à celle de la figure 7, donnant
le taux d'absorption en hydrogène mesuré en fonction du temps lors d'une
premier
cycle d'absorption effectué à différentes températures mats sous une même
pression de 150 psi sur une poudre nanocristalüne d'un composite de Mg et AI -
préparée par broyage mécanique intense durant 20 heures puis désorption d'un
mélange d'une poudre polycristalline commerciale de MgHz avec 5% at. d'une
CA 02307134 2000-04-20
3
poudre d'AI;
les figures 10 et 11 sont des courbes donnant le taux d'absorption en
hydrogène mesuré en fonction du temps lors d'un premier et d'un second cycles
d'absorption effectués à différentes températures mais sous une méme pression
de 150 psi sur une poudre d'un nanocomposite selon l'invention préparée par
broyage mécanique intense durant 20 heures puis désorption d'un mélange d'une
poudre polycristalline commerciale de MgHz avec 5% at. d'une poudre de V;
la figure 12 est une courbe analogue à celle de la figure 7, donnant
le taux d'absorption en hydrogène mesuré en fonction du temps lors d'un
premier
cycle d'absorption effectué à différentes températures mais sous une même
w pression de 150 psi sur une poudre d'un nanocomposite de Mg et V selon
l'invention préparée par broyage mécanique intense durant 20 heures puis
désorption d'un mélange d'une poudre polycristalline commerciale de MgH2 avec
10% at. d'une poudre de V;
la figure 13 est une courbe de diffraction au rayon X montrant des
pics associés à la présence simultanée de MgH2, de VH et d'une nouvelle phase
(y MgH2) dans une poudre nanocristalline obtenue après broyage mécanique
intense pendant 20 heures d'un mélange d'une poudre polycristalline
commerciale
de MgH2 avec 5% at. d'une poudre de V;
la figure 14 est une courbe de diffraction similaire à celle de la figure
13, cette courbe montrant les pics associés à la présence de Mg et de V dans
la
poudre nanocristalline utilisée lors des essais d'absorption reportées sur la
figure
13, après désorption;
la figure 15 est une courbe donnant le taux de désorption en
hydrogène mesuré en fonction du temps lors d'un premier cycle de désorption
effectué à des températures différentes mais sous une même pression de 0 psi
sur une poudre d'un nanocomposite selon l'invention préparée par broyage
mécanique intense durant 20 heures puis désorption d'un mélange d'une poudre
polycristalline commerciale de MgHz avec 5% at. d'une poudre de V;
la figure 16 est une courbe analogue à celle de la figure 10 si ce n'est
que le nanocomposite préparé et utilisé pour les mesures contenait 3% at. de V
uniquement;
FEUIL~.E MOU~~~
CA 02307134 2000-04-20
WO 99/20422 PCT/CA98/00987
4
les figures 17 et 18 sont des courbes donnant le taux d'absorption et
de désorption en hydrogène mesuré en fonction du temps fors d'une première
absorption et désorption effectuées à 300°C et 100°C,
respectivement, sous une
même pression de 150 psi, sur une poudre d'un nanocomposite selon l'invention
préparée par broyage mécanique intense durant 20 heures puis désorption d'un
mélange d'une poudre polycristalline commerciale de MgH2 avec 5% at. d'une
poudre de Nb;
la figure 19 est une courbe de diffraction au rayon-X montrant des
pics associés à la présence simultanée de MgHz, de NbH et d'une nouvelle phase
(y MgH2) dans une poudre nanocristalline obtenue après broyage mécanique
intense pendant 20 heures d'un mélange d'une poudre polycristalline
commerciale
de MgH2 avec 5% at. d'une poudre de Nb;
la figure 20 est une courbe donnant les taux d'absorption et de
désorption en hydrogène mesurés en fonction du temps lors d'un second cycle
d'absorption effectué à 250°C sous une pression de 150 psi et
désorption à la
même température sous une pression de 0 psi, les mesures ayant été effectuées
sur une poudre d'un nanocomposite selon l'invention préparée par broyage
mécanique intense durant 20 heures puis désorption d'une poudre
polycrystalline
commerciale de MgHz avec 5% at. d'une poudre de Pd, et, à titre comparatif,
une
poudre nanocristalline de MgH2 préparée par broyage mécanique intense durant
20 heures de la même poudre polycristalline de MgH2, mais sans Pd;
la figure 21 est une courbe donnant, à titre comparatif, les taux
d'absorption en hydrogène mesurés en fonction du temps lors d'un premier cycle
d'absorption effectué à 100°C sous une pression de 150 psi sur des
poudres de
nanocomposites selon (invention préparée par broyage mécanique intense durant
20 heures puis désorption d'une poudre polycristalline commerciale de MgH2
avec,
respectivement, 5% at. d'une poudre de V et 22% at. d'une poudre de MgZNi;
la figure 22 est une courbe analogue à celle de la figure 21, si ce
n'est que les nanocomposites selon l'invention ont été préparés par mélange à
partir d'une poudre polycristalline commerciale de MgHz avec respectivement
22%
at. d'une poudre de Mg2Ni et 22% at. d'une poudre de MgZNiH4;
la figure 23 est une courbe donnant les taux d'absorption en
hydrogène mesurés en fonction du temps lors d'un premier cycle d'absorption à
CA 02307134 2000-04-20
S
différentes températures mais sous une mëme pression de 150 psi sur des
poudres
d'un nanocomposite selon l'invention préparée par broyage intense durant 20
heures puis désorption d'un mélange d'une poudre de MgZNiH4 avec 10% de V;
la figure 24 est une courbe analogue à celle de la figure 23 et donnée
à titre comparatif, pour laquelle les mesures ont été effectuées dans les
mêmes
conditions mais en utilisant une poudre nanocristalline obtenue par broyage
intense
durant 20 heures puis désorption d'une poudre de MgZNiH4 sans ajout de V;
la figure 25 est une courbe donnant les taux d'absorption en
hydrogène mesurés en fonction du temps lors de cycles d'absorption effectués à
différentes températures sous une pression de 150 psi sur une poudre d'ûn
nanocomposite selon l'invention préparée par broyage mécanique intense durant
heures puis désorption et exposition à l'air pendant deux jours, d'un mélange
de
MgHz avec 5% at. de V;
la figure 26 est une courbe isotherme de pression-concentration
15 obtenue à une température de 563°K avec un nanocomposite selon
l'invention
préparé par broyage mécanique intense durant 20 heures d'un mélange d'une
poudre de MgH2 avec 10% at. de V;
la figure 27 est une courbe donnant les taux d'absorption en
hydrogène mesurés en fonction du temps lors de premiers cycles d'absorption
20 effectués à 302°K sous une pression de 150 psi sur les poudres de
nanocomposites
selon l'invention préparées par broyage intense durant 20 heures puis
désorption
d'un mélange d'une poudre de MgHz avec 5% at. d'un métal de transition Tm
choisi
parmi Ti, V, Mn, Fe, Ni, cette même courbe donnant également à titre de
référence
la mesure d'absorption obtenue sur une poudre nanocristalline de MgHz sans
aucun additif;
les figures 28 et 29 sont des courbes identiques à celles illustrées sur
la figure 27, si ce n'est les températures d'absorption qui ont été de
373°K et 423°K,
respectivement;
la figure 30 est une courbe donnant les taux de désorption
d'hydrogène mesurés à 0 psi et 508°K sur des poudres nanocristallines
selon
(invention obtenues par broyage mécanique intense durant 20 heures d'un
mélange
d'une poudre de MgH2 avec 5% at. d'un métal transition Tm choisi parmi Ti, V,
Mn
et Fe;
fEUILI~E MODIFIÉE
CA 02307134 2000-04-20
6
la figure 31 est une courbe identique à celle de la figure 30 dans
laquelle la désorption a été effectuée à 573°K, cette même courbe
donnant
également la désorption obtenue sur une poudre nanocristalline constituée de
MgH2
uniquement à titre de référence;
la figure 32 est une courbe donnant le taux d'absorption d'hydrogène
mesuré en fonction du temps lors d'un premier cycle d'absorption effectué à
différentes températures sous une pression de 150 psi sur une poudre d'un
nanocomposite selon l'invention préparée par broyage mécanique intense durant
20 heures et désorption d'un mélange de MgH2 avec 5% at. de Cr;
la figure 33 est une courbe donnant le taux d'absorption d'hydrogène
mesuré en fonction du temps lors d'un premier cycle d'absorption effectué à
différentes températures sous une pression de 150 psi sur une poudre d'un
nanocomposite selon l'invention préparée par broyage mécanique intense durant
heures et désorption d'un mélange de MgHz avec 5% at. de Ca;
15 la figure 34 est une courbe donnant le taux d'absorption d'hydrogène
mesuré en fonction du temps lors d'un premier cycle d'absorption effectué à
différentes températures sous une pression de 150 psi sur une poudre d'un
nanocomposite selon l'invention préparée par broyage mécanique intense durant
20 heures et désorption d'un mélange de MgH2 avec 5% at. de Ce;
20 la figure 35 est une courbe donnant le taux d'absorption d'hydrogène
mesuré en fonction du temps lors d'un premier cycle d'absorption effectué à
différentes températures sous une pression de 150 psi sur une poudre d'un
nanocomposite selon (invention préparée par broyage mécanique intense durant
20 heures et désorption d'un mélange de MgH2 avec 5% at. de Y;
la figure 36 est une courbe donnant les taux d'absorption d'hydrogène
mesuré en fonction du temps tors d'un premier cycle d'absorption effectué à
différentes températures sous une pression de 150 psi sur une poudre d'un
nanocomposite selon l'invention préparée par broyage mécanique intense durant
20 heures et désorption d'un mélange de MgHZ avec 5% at. de La;
la figure 37 est une courbe donnant les taux d'absorption d'hydrogène
mesurés en fonction du temps lors du premier cycle d'absorption effectué à
différentes températures sous une pression de 150°C d'un nanocomposite
selon
l'invention préparé par broyage mécanique intense durant 20 heures puis
FEUILLE MODIFIEt
CA 02307134 2003-O1-15
désorption d'!m mélange d'une poudre',rlgl-1~ avec ~°,ô at, de ~e et
5°,'o at. de La;
fa figure ~8 est une courbe donnant fes taux d'absorption d'hydroçène
mesurés en fonction du temps lors du premier cycle d'absorption effectué à
difTérentes températures sous une pression de 1 ~0 psi d'un nanocomposite
selon
''invention préparé par bro~~aae mécanique intense- durant 20 heures nuis
déscrption _d'un mélange d'une coudre fU1gH_ avec 5% at. de C:~ et ~°!,
at. dP L a et
5°~~ at. de L';
la figure 39 est une ccurbe donnant les taux d'absor ption d'hydrogène
mesurés en fonction du temps lors du premier cycle d'absorption effectué à
différentes températures sous une pression de 150 Psi sur un nanoccmposite
selon
1
l'invention préparé par broyage mécanique intense durant 20 heures puis
désorption d'un mélange d'une poudre MgHZ avec i % en poids de V et
30°ô en
poids de LaNia; et
la figure 40 est une courbe donnant le taux de désorption en
hydrogène mesuré en fonction du temps fors d'un premier cycle de désorption
effectué à une pression de 0.015 MPa à une température de 523°K sur des
poudres nanocristallines selon (invention préparées par broyage intense durant
20
heures puis désorption d'un mélange d'une poudre de MgHz avec 5% at. de Ni;
MgH2 avec 5% at. de La; MgHZ avec 5% at. de V; MgH2 avec 30% en poids de
LaNis: et MgHZavec 7sen poids de V et 30% en poids de LaNis, respectivement.
Description de l'état de la technigue
La demande de brevet internationaïe publiée Le 3 aoüt 1996 sous te
numéro WO 96123906 décrit de nouveaux composés capables d'absorber de
l'hydrogène avec une très bonne cinétique. Ces nouveaux composés se présentent
sous la forme de poudres de particules nanocristallines de formule:
n n..
lVi f. ~_~%~~X
dans laquelle A peut représenter divers métaux dont le
vanadium (V) et le nobium (1'lbi- et ~. est une fraction
3~ atomique comprise entre 0 et C),-~. _='ar "particule:=;
CA 02307134 2003-O1-15
8
nanocristallines", on entend des dont les grains ont une
taille moyenne comprise entre 3 et 100 nm.
Dans la demande ~NO 96123906, il est également décr it que les
composés en question peuvent étre préparés en soumettant un rnélanqe de
particules de Mg et du métal A à un broyage mécanique intense pendant
plusieurs
heures. II est enfin décrit que des essais d'absorption effectués sur un
composé de
formule Mg~,9EV~,~~ (voir exemple 2) se sont avérés très positifs.
Les figures 1 à '' des dessins annexés sont
illustratifs des caractéristiques d'adsorption et
désorption des composés décrits dans cette demande
internationa:Le WO 96/23906. Les figures 1 et 2 illustrent
le cas où le composé est une poudre nanocristalline de Mg
pur dont la taille des cristallites est de l'ordre de
30 nm. On voit que dès 1e troisième cyclE: d'absorption/
désorption, de très bons résultats sont obtenus, notamment
au niveau de la cinétique. Les figures 4 et. 5 qui ont une
échelle de temps beaucoup plus courte que les figures 1 et
2, montrent que des résultats sont encore meilleurs dans le
cas où le composé utilisé est une poudre nanocristalline de
Mg contenant 5'~at. de V(Mg0.~5V0.05)~ La courbe de
diffraction illustrée sur la figure 3 montre que le composé
nanocristallin de formule Mg0_~5Vg.05 n'est pas un alliage
mais un composite, ~:ar on distingue très clairement les
pics associés à Mg (~) de ceux, associés à V (~). Par contre
avec certains autres métaux (tels que, par exemple, iIi ou
A1), un véritable alliage peut être obtenu avec Mg.
La demande de brevet int~ernati.cmale publiée 1e 29
juillet 1997 sous le numéro WO 97/26214 décrit des
composites se présentant sous la forme d'un mélange d'une
poudre nanccrist;alline d'un métal ou al_I_iage capable
d'absorber l'hydrogène à haute température, tels que IMg ou
CA 02307134 2003-O1-15
8a
Mg2Ni, avec une poudre nanocristalline d'un autre métal ou
alliage capable d'absorber l'hydrogène à basse température
tels que V, Nb, Mn, Pd, LaNiS ou FeTi. L'exemple 7 de cette
demande décrit la préparati~.~n d'un tel composite par
broyage d' une poudre nanocristalline de Mg avec ume poudre
nanocristalline de FeTi et montre la très bonne efficacité
d'absorption du composite ainsi préparé.
Enfin, la demande de brevet internationale no PCTlCA97100324
déposée le 13 mai 1997 décrit une méthode pour induire la désorption de
1 v l'hydrogène contenu dans un hydrure de métal, consistant entre-a~.arPs à
soumette
l'hydrure en question à un traitement mécanique capable de générer
suffisamment
d'énergie pour obtenir la désorption voulue. l_e traitement mécanique suggérë
est
un traitement mécanique intense (bail milling) capable de produire un très
grand
nombre de défauts dans la structure qui facilite grandement la désorption
thermique
CA 02307134 2000-04-20
WO 99/20422 PCT/CA98/009$7
g
ultérieure de (hydrogène (voir page 5, lignes 12 à 15).
Sur la base de cette dernière prémisse, la Demanderesse a poursuivi
ses travaux de recherche en étudiant l'importance qu'il pourrait y avoir à
utiliser un
hydrure de magnésium (MgHZ) plutôt que du magnésium pur comme produit de
départ pour la préparation d'un composé tel que décrit dans la demande
internationale WO 96/23906. En effet, si le broyage mécanique intense d'un
hydrure
de métal introduit un si grand nombre de défauts dans ta structure qu'if
facilite une
désorption thermique de (hydrogène, on peut raisonnablement penser que le
produit obtenu après désorption, du fait de son grand nombre de défauts,
continuera d'avoir des propriétés d'absorption et de désorption améliorées.
Les figure 6 à 9 sont illustratives des résultats des travaux qui ont
ainsi été effectués.
Comme on peut tout d'abord le constater en comparant les figures
6 et 7 dont les échelles de temps sont différentes, la cinétique d'absorption
d'une
poudre nanocristalline de Mg obtenue par broyage mécanique intense d'une
poudre
commerciale de MgH2 est très supérieure à celle d'une poudre de Mg obtenue à
partir du même hydrure, mais sans broyage, et ce à toutes les températures.
Ceci
vient confirmer l'importance que présente le broyage mécanique intense sur la
cinétique d'absorption d'hydrogène d'une poudre de Mg.
Comme on .peut aussi le constater en comparant la figure 7 aux
figures 1 et 2, la cinétique et la capacité d'absorption d'une poudre
nanocristalline
de Mg obtenue par broyage mécanique intense d'une poudre commerciale de MgH2
sont supérieures à celles d'une poudre nanocristalline de Mg obtenue par
broyage
mécanique intense d'une poudre commerciale de Mg. Ceci vient confirmer que
l'utilisation d'hydrure de magnésium plutôt que de magnésium pur comme produit
de départ lors du broyage permet d'obtenir une amélioration des propriétés
d'absorption d'hydrogène, comme on pouvait le présumer au vu des résultats
déjà
rapportés dans la demande internationale WO 96123906.
Les figures 8 et 9 montrent les résultats obtenus sur des poudres
nanocristallines obtenue par broyage mécanique intense d'une poudre
commerciale
de MgH2 en mélange avec, respectivement, 5% at. d'une poudre de Ni et 5% at.
d'une poudre d'AI. Comme on peut le constater, le broyage du MgH2 avec le Ni
améliore la cinétique d'absorption à haute température par rapport au broyage
du
CA 02307134 2003-O1-15
1~ ..
MgN~ mais ia cinétique à basse température (302°K) est à peu près la
même. Par
centre, dans le cas du broyage du N9gHz avec AI, les cinétiques sont moins
bonnes a
toutes les températures.
Un article de FUJII H. et al publié darls le JOURNAL OF ALLOYS AND
OOMPOUNDS, ~,~ol. 232 ("9961, L16-L 19, décrit la fabrication d'une poudre de
MgzNiH~,e ayant une taille de grain de quelques manomètres par broyage
mécanique
intense de P.~g~Ni sous une atmosphère d'hydrogène. La poudre de Mg~~liH~,e
obtenue
est décrite comme étant un « composite » dans la mesure où les grains obtenus
sont
composés d'une matrice cristalline et d'une phase d'interface désordonnée qui
constitue des joints de grain. II ne s'agit dcnc pas d'un composite au sens où
l'on
entend dans le cadre de la présente invention, c'est-à-dire d'une poudre
constituée de
deux types de grains dort les compositions chimiques sont différentes. L'une
et l'autre
de ces deux phases sont constituées du mémo produit Mg2Ni qui est pur dans la
matrice et hydrogéné dans l'interface, ce qui explique le taux d'hydrogénation
mesuré
de 1.8 qui est très inférieur à celui des nanocomposites selon l'invention où
le taux
d'hydrogénation du magnésium ou du composé à base de magnésium se doit d'être
celui de l'hydrure correspondant (Mg2NiH4 dans le cas de Mg2Ni). Ä ce sujet,
l'article
2 0 précise dans son paragraphe 3 qu'on ne trouve aucune trace de Mg2NiN4
.même après
80 h de broyage. En outre, les résultats rapportés sont très différents de
ceux obtenus
ans le cadre de (a présente invention.
F~ésumë de l'invention
2 5 En poursuivant !es travaux de recherches ci-dessus rapportés. il a été
découvert; de façon surprenante, que si f1) on utilise comme produit de départ
un
hydrure de magnésium ou un hydrure d'un alliage à base de magnésium en
combinaison avec un autre élément ou composé connu pour absorber l'hydrogène
mais
pour ne pas former lors du broyage intense un alliage avec le magnésium, et
(2) cn
?: n soumet un mélange de poudres de ces produits de départ à un broyage
mécanique
°--~~ 1~~~~~~ ~-~~np~~to da ~irN,~+yrrn nann~riçfallina lri-anrl?~
annFlF?
i f IICI tJC, ~~I vUUCI W u; i :~.m i yr r .. . . . ,
<; nanoccmposite ») ayant des performances ares supérieures à tout cF lace
l'on pouvait
prévoir des résultats des travaux déjà effectués et précédemment rapportés.
Sur 'a buse dE ~;e',oe ciccuuvertP ~ présente invention a donc pour premier
obier un procédé de préparation d'un nanecomposite à base cie magnésium e:
I_i'un
aorte élément ou ccmposé connu cour absorber l'hydrogène or Gtre peu miscible
au
bre~.;age avec le magnésium ou son hydn!re, caractérisé en ce I~ue
CA 02307134 2003-O1-15
Zr~a
a1 ~n sournet du r~.,a;nésiurn ~~u un cc~mpcsé a :case ~~e rnancsiurn connu
,c~u. absorber .'',ny drocère ~ ;~r~.e i-.~~drcg~nat~;cn en rue 'obter;ir
''h~ydru. e
~orresponâant sous la 'orme d'une poudre
b) on mélange la poudre c'hycrur~e ainsi obtenue avec I a~,~tre élément ou
~c,rn;,nsé ou un :",~,drure iJe cet autre ~'érnent cu ccr,~p,~sé;
c) on soumet Ie mélange ainsi obtenu d !_m bro~,~age mécanique intense
iusc,u à obtention du nanocomposite correspondant sous la forme d'un
f,y~drure; e't, si
requis,
d) on soumet le nanocomposite obtenu à l'étape (c) à
une désorption d'hydrogène, étant entendu que l'autre
élément ou composé ou son hydrure n'est pas Mg2NiHq.
II est à noter que les étapes (a), (b), et (cj pourraient aussi être combinées
en broyant mécaniquement un mélange àe poudre sous une pression d'hydrogène en
vue d'effectuer simultanément l'hydrogénation des ccmposés.
CA 02307134 2000-04-20
WO 99/20422 PCT/CA98/00987
11 _
L'invention a également pour second objet le nanocomposite à base
de Mg ainsi préparé, qui a l'avantage d'être peu coûteux et d'avoir des
performances inégalées pour le stockage de (hydrogène grâce à sa
microstructure
(c'est-à-dire à la nature des interfaces et à la distribution spatiale de ses
composantes), qui est extrêmement fine et donne lieu à un effet de synergie
incroyable entre le Mg et l'autre élément ou composé.
L'invention a enfin pour troisième objet l'usage du nanocomposite à
base de Mg ainsi préparé pour le stockage et le transport de l'hydrogène,
notamment à bord de véhicules, dans des batteries à hydrures métalliques ou
pour
alimenter une génératrice ou une pile à combustible.
DESCRIPTION DÉTAILLÉE DE L'INVENTION
Tel que précédemment résumé, le procédé selon l'invention consiste
essentiellement à broyer intensément un hydrure de Mg ou d'un composé à base
de Mg avec un élément ou composé qui a la capacité d'absorber l'hydrogène et
est
peu miscible au broyage avec le Mg ou son hydrure.
On peut utiliser comme produit de départ une poudre commerciale
d'hydrure de magnésium pur (MgHz) ou une poudre d'un hydrure d'un composé à
base de magnésium de formule:
Mg,_,~Ax
dans laquelle A est au moins un élément choisi dans le groupe constitué par
Li, Ca,
Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, AI, Y, Zr, Nb, Mo, In, Sn, O, Si, B, C, F
et Be, et
x est un nombre inférieur ou égal à 0,3.
On peut aussi utiliser comme produit de départ un hydrure d'un
composé à base de Mg de formule:
(Mgz-=Nit+Z),-~
dans lequel A et x sont définis comme précédemment et z est un nombre compris
entre -0.3 et +0.3.
L'autre produit de départ utilisé doit, selon l'invention, être un ou
plusieurs autres éléments ou composés qui, d'une part, soient capables
d'absorber
l'hydrogène et, d'autre part et surtout, soient peu ou non miscibles au
broyage avec
le Mg ou son hydrure. Cet autre produit peut être constitué par une poudre
d'un des
éléments suivants: V, Ti, Fe, Co, Nb, Na, Cs, Mn, Ni, Ca, Ce, Y, La, Pd, Hf,
K, Rb,
CA 02307134 2003-O1-15
12
,gin, Ru, Zr, Be, Cr, Ge, ~i, Li ou leurs hydrures. Parmi ceux-ci, 'J, T i et
Nb se sent
a~uérés étre exrêmement peri'orrnants. Piutdt que d'utiliser du vanadium (V)
de
haute pureté dont !e coùt est élevé, il peut étre avan'tage!~x d'utiliser du
ferr :~
vanadium tel que ceux de JAP,A.N INDUSTRIAL STANDARD no 1 dont la
composition en pourcentage exerimée en poids est la suivante:
1) Vg~,,G; Fel~~g; P1~.19% ~i0.64% 50.10% F0.02
'~'~'~"~ .3~ Fe; 4 ~, ; A13,',-, Sig.51 ~ X0.51 ~ i~10.G7
L'autre produit peut aussi être cbnstitué par une
poudre d'un ou plusieurs composés choisi dans le groupe
constitué par Lar~iS, MmNiS, 2rMn2, ~rVG, TiMn~, Mg2Ni et
leur hydrures à l'exception de Mg2NiH4, les solutions
solides de formules Vl_yTiy où y varie entre 0 et l,
W0,9T10.1~0.95Fe0.05 et les alliages amorphes de Mg-Ni.
La poudre de cet autre produit peut être utilisée telle quelle, à savoir
être mélangée en quantité adéquate avec la poudre de l'hydrure de Mg ou du
composé à base du magnésium puis broyer simultanément avec celle-ci. La poudre
cet autre produit peut toutefois, elle aussi, être soumise à une hydrogénation
préliminaire en vue de la convertir en hydrure avant son mélange et son
broyage
avec l'hydrure de magnésium ou d'hydrure d'un composé à base de magnésium.
De préférence, â l'étape (b) du procédé selon l'invention, on utilise
l'autre élément ou composé en quantité telle que le pourcentage atomique ou
molaire de cet autre élément ou composé dans le mélange soit inférieur ou égal
à
10%. Plus préférentiellement encore, de pourcentage atomique choisi est de 3
ou
5%.
Ln ~,rn~~gn m6C~niqme in+en~o peut 'cy.tr4 p~o~tUe de n'iiiipo~e qWiie
v. a u m. a m. ü n u n n ï
fa~nn ~nnnyrr. /1, rrP ~tl¿r?t~ nr1 pP!It ~F rPfPrPf ~(_I ~Ç111tPn11 llP.i
CIPrI'larlÇ'IC?S CjP_ brevet
internationales ci-dessus mentionnées. De préférence, on peut prccéder au
broyage mécanique intense des poudres dans un broyeur à barre ou à billes de
t~,~pe commercialisés sous les rnarques FRl T CH et ZOZ pendant une période de
!'ordre de 5 à 20 heures ou Nlus. Ce prÉférence aussi, cn effiectuera ce
broyage
CA 02307134 2003-O1-15
_L~a
sous atmosphère inerte. Le broyage peut être effectué en une seule étape ou en
deux (broyage initial de chacune des poudres puis broyage de celles-ci
ensemble).
Dans tous les cas, il est essentiel que le composite obtenu soit
nanocristallin.
Tel que précédemment indiqué, il est aussi possible de combiner les
étapes Via), ~b) et (c) en broyant le mélange de poudre sous une atmosphère
CA 02307134 2000-04-20
13
d'hydrogène de façon à hydrogéner simultanément les composés.
Le produit final ainsi préparé est un nanocomposite dont les
composantes sont extrêmement fines et intimement connectées. Ce
nanocomposite contient un grand nombre de défauts de structure qui facilitent
la
désorption de l'hydrogène. II n'y a pas ou pratiquement pas de formation
d'alliage
puisque les composantes Mg ou son hydrure et l'autre élément ou composé, tel
V,
Ti, Fe ou Nb sont non ou peu miscibles l'une dans l'autre lors du broyage.
Les nanocomposites selon l'invention surclassent tous les matériaux
de stockage de l'hydrogène connus de la Demanderesse, incluant ceux décrits
dans les demandes de brevet internationales ci-dessus mentionnées. Les
problèmes de cinétique d'absorption du Mg sont pour ainsi dire résolus puisque
les
nanocomposites selon l'invention absorbent plus de 3% en poids d'hydrogène
pratiquement à la température de la pièce, en quelques minutes. Quant à la
désorption, la cinétique est extrêmement élevée aussi, même à des températures
aussi basses que 200, 225 et 250°C (voir la figure 15). Enfin, le coût
de ces
nanocomposites est faible, surtout dans le cas du composite obtenu à partir de
MgHz et 5% V, vu la faible quantité de V requise pour obtenir de bonnes
performances.
Les figures 10 et 11 montrent les courbes d'absorption obtenues sur
un nanocomposite préparé par broyage mécanique intense pendant 20 heures
d'une poudre commerciale de MgHZ (325 mesh) avec 5% at. d'une poudre de V pur.
Ces courbes sont à comparer avec celles des Figures 7 à 9, qui rapportent des
essais efFectués aux mêmes températures et sous la même pression d'absorption
(150 psi).
Comme on peut le constater, les nanocomposites selon l'invention
ont une cinétique d'absorption beaucoup plus rapide que celles du magnésium ou
des alliages de Mg et AI préparés selon une technique analogue (à savoir à
partir
d'une poudre d'hydrure de Mg). En fait, même à 29°C (302°K), les
nanocomposites
selon l'invention sont capables d'absorber de l'hydrogène alors que les
produits
illustrés sur les Figures 7 à 9 ne le sont pas. Ä des températures aussi
basses
que 150°C (423°K), ils sont également capables d'absorber
l'hydrogène de façon
quasi instantanée, alors que l'absorption est extrêmement lente dans le cas
des
produits des figures ~ ~ 9-
FEUILLE MODIFIEE.
CA 02307134 2000-04-20
WO 99/20422 PCT/CA98/00987
14 .-
Pour ce qui a trait à la comparaison entre le MgH2 + V (figure 10) et
MgH2 + Ni (figure 8), les cinétiques sont comparables à haute température mais
par
contre à basse température le MgH2 + V est beaucoup plus performant.
Cette surprenante augmentation de la cinétique d'absorption peut
peut-être s'expliquer par le fait que le broyage de l'hydrure de Mg avec un
autre
élément ou composé connu pour absorber (hydrogène et être peu miscible avec
MgH2, cause une déstabilisation de l'hydrure de magnésium et crée de grandes
surfaces et des interfaces particulières °activées" entre les grains du
composite,
qui permettent le transport facile et rapide de l'hydrogène.
Une comparaison entre les figures 10 et 12 montre qu'il n'y a pas
d'intérêt à augmenter ind~1ment la quantité de V dans le nanocomposite. En
fait,
avec 10% at. de V, les résultats sont pratiquement identiques à ceux obtenus
avec
5% at. de V. Le nanocomposite étant plus lourd dans le premier cas à cause
d'un
plus grand pourcentage de V, le pourcentage en poids d'hydrogène absorbé,
exprimé par rapport au poids du nanocomposite, est inférieur mais la quantité
d'hydrogène absorbée reste en pratique sensiblement la même.
Les courbes de diffraction illustrées sur les figures 13 et 14 montrent
que lors du broyage d'une poudre de MgHz avec une poudre de V, il y a
génération
de pics de VH°.e, et donc un transfert d'une partie de l'hydrogène
stocké dans le
MgH2 au vanadium (voir figure 13). De plus, le spectre de diffraction-X donné
dans
la figure 13 montre qu'il y a aussi formation d'une nouvelle phase métastabie
(y MgH2) qui n'a jamais auparavant été observée lors des broyages mécaniques
des matériaux de stockage de l'hydrogène et qui pourrait être à l'origine des
performances exceptionnelles de ces nouveaux composites nanocristallins de
stockage de l'hydrogène. Après désorption, la courbe de diffraction obtenue
(voir
figure 14) est semblable à celle illustrée sur la figure 3, mais le transfert
d'hydrogène intervenu lors du broyage en utilisant un hydrure de Mg plutôt que
du
Mg pur comme produit de départ, conduit de toute évidence à la génération
d'interfaces activées, comme (attestent les courbes d'absorption obtenues.
Une comparaison entre les figures 10 et 11 montre également que
les résultats obtenus dès la première absorption sont très comparables à ceux
obtenus à la seconde absorption, quelles que soient les températures. Ceci est
à
comparer aux résultats rapportés sur les figures 1 et 2, où la troisième
absorption
CA 02307134 2000-04-20
_: _
était beaucoup plus rapide et efficace que la première. Ceci confirme à
nouveau
que le procédé selon l'invention conduit à une activation immédiate des
interfaces
du nanocomposite et, de là, à une meilleure capacité d'absorber.
La figure 15 montre les courbes de désorption obtenues lors d'un
5 premier cycle de désorption à différentes températures de nanocomposite
préparé
à partir de MgHz et 5% at. V (à savoir même que celui utilisé pour les essais
rapportés sur les figures 10 et 11). Comme on peut le constater, cette courbe
montre que la désorption commence à s'effectuer à partir de 473K
(200°C).Cette
courbe montre aussi que la désorption est presque complète après 1000 secondes
10 à 523° K (250°C) ce qui est extraordinaire pour un composé
qui est pratiquement
du Mg pur. II convient en effet de rappeler que le Mg pur (c'est-à-dire le
MgH2
polycristallin) nécessite des températures de l'ordre de 350°C pour
désorber
l'hydrogène en 1500 secondes (voir figure 2).
La figure 16 est analogue à la figure 10 si ce n'est que le
15 nanocomposite utilisé a été préparé par broyage mécanique intense de MgH2
avec
3% at. seulement de V. Comme on peut le constater, les résultats sont, là
encore,
excellents. II semble donc que ce ne soit pas la quantité de V qui importe,
mais
plutôt sa présence en quantité suffisante pour activer les surfaces et
interfaces
entre les grains.
Les figures 17 et 18 montrent les courbes d'absorption obtenues à
300°C et 100°C respectivement sous une pression de 150 psi avec
un
nanocomposite selon l'invention préparée par broyage mécanique intense de MgHz
avec 5% at. de Nb, élément connu lui aussi pour absorber l'hydrogène et être
peu
miscible au broyage avec Mg. Comme on peut le constater, les résultats obtenus
sont très comparables à ceux rapportés pour les nanocomposites contenant du V.
On peut donc généraliser l'invention à l'usage d'autres éléments ou composés
ayant les mêmes propriétés, tels à ceux que précédemment mentionnés.
La figure 19 est une courbe de diffraction effectuée sur le produit de
broyage obtenu pour les essais reportés sur les figures 17 et 18. Comme on
peut
le constater, cette courbe montre encore qu'il y a eu transfert d'hydrogène de
MgH2
à Nb. On identifie aussi la présence d'une nouvelle phase métastable (y MgH2).
La figure 20 montre les courbes d'absorption et désorption obtenues
à 250°C sous une pression de 150 psi avec un nanocomposite selon
l'invention
FEUILLE MODiFIE~
CA 02307134 2000-04-20
16
préparé par broyage mécanique intense de MgH2 avec 5% at. de Pd, élément
connu pour catalyser l'absorption d'hydrogène. Comme on peut le constater, il
y a
un effet bénéfique (viz. une absorption beaucoup plus rapide) lorsque l'on
utilise Pd.
L'effet est moindre qu'avec V ou Nb~mais il est néanmoins notable.
La figure 21 montre qu'un nanocomposite selon l'invention préparé
par broyage mécanique intense de MgHZ avec un composé connu pour absorber
l'hydrogène tel que MgZNi, offre une bonne performance aussi. Cette
perforrnance
est moins bonne que celle obtenue avec un mélange de MgH2 et V mais elle est
néanmoins là. En fait, le résultat obtenu est dans tous les cas meilleur que
celui
obtenu à 100°C pour le MgHz pur broyé.
La figure 22 est à comparer à la figure 21. Elle montre qu'un
nanocomposite selon l'invention préparé par broyage mécanique intense de MgHz
avec MgZNiH, est très légèrement meilleur que celui obtenu avec Mg2Ni. La
différence est toutefois mineure.
La figure 23 montre les courbes d'absorption obtenues à différentes
températures sous une pression de 150 psi avec un nanocomposite selon
l'invention
préparé par broyage mécanique intense pendant 5 heures de Mg2NiHq, avec 10% en
poids de V. On remarque que ce nanocomposite absorbe presque 1.75% en poids
2 0 d'hydrogène en 3000 secondes à la température de la pièce (302°K)
ce qui est
remarquable bien que légèrement moins performant que le MgH2 + 5 at. % V qui
absorbe environ 2.75% en poids d'hydrogène au voisir~a,~e de la te~érature de'
la pièce durant cette rte période de tetQs (voir figure 10). Par contré,
ce résultat est tes supér~..eur ~à celui obtenu avec une poudre nâno-
cristall~ne de Mg2NiH4 obtenue après un broyage de 20 heures (voir
figure 24 ) .
La figure 25 qui est à comparer à la figure 10 montre qu'une poudre
nanocomposite selon l'invention à base de MgH2 et 5% at. de V peut âtre
exposée
à l'air pendant deux jours sans perdre ses propriétés. Ceci est très important
d'un
point de vue pratique.
La figure 26 est une courbe isotherme pression-concentration
obtenue sur un nanocomposite selon (invention préparé par broyage mécanique
intense de MgHz avec 10% at. de V. Cette courbe montre qu'à une température de
563°K (290°C~, l'absorption et la désorption sont pratiquement
immédiates sous
une pression aussi basse qu'une atmosphère.
FEL~I~nE ~~~GI~IFEE
CA 02307134 2000-04-20
r --
17
La figure 27 montre les courbes d'absorption obtenues avec des
nanocomposites selon l'invention préparés par broyage mécanique intense de
MgH2
avec 5% at. de divers éléments de transition. Comme on peut le constater, les
résultats
obtenus avec le titane sont supérieurs à ceux obtenus avec le vanadium. Les
résultats
obtenus avec le fer et le manganèse sont légèrement inférieurs mais très
supérieurs à
ceux obtenus àvec l'ajout de nickel ou sans aucun ajout.
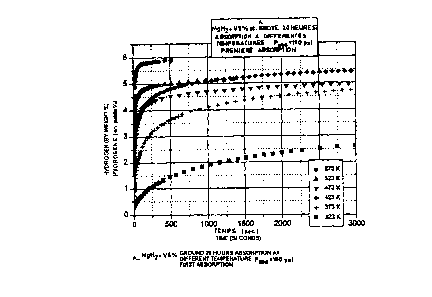
Les figures 28 et 29 sont des courbes analogues à celles illustrées
sur la figure 27, à des températures très supérïeures
(373°x/100°C et
423°x/150°C). Comme on peut le constater, les différences
associées à la
présence des divers addüifs s'estompent au fur et à mesure que les
températures
d'absorption s'élèvent.
La figure 30 montre des courbes de désorption obtenues sous une
pression de 0 psi à 508°K (225°C) sur des nanocomposites selon
l'invention
incluant 5% at. d'un métal de transition choisi parmi Ti, V,Mnet Fe. Ces
courbes
montrent que la désorption lorsque le nanocomposite contient du titane, du
vanadium et même du fer est très supérieure à celle obtenue lorsque (additif
est du
manganèse.
La figure 31 est identique à la figure 30 , si ce n'est que la
2 0 température de désorption est de 573°K (300°C). Là encore,
on peut constater qu'à
haute température, les différences s'atténuent. Par contré, daris tous les
cas, les
résultats obtenus sont très supérieurs à ceux obtenus avec MgH2 pur.
Les figures 32 à 37 sont des courbes d'absorption obtenues à
différentes températures sous une même pression avec des nanocomposites selon
(invention préparés par broyage mécanique intense de MgH2 avec respectivement
5% at. de Cr, Ca, Ce, Y et La. Ces métaux sont connus pour être capables
d'absorber l'hydrogène et d'être peu ou non miscibles au broyage avec le Mg ou
son équivalent. Comme on peut à nouveau le constater, d'excellents résultats
sont
obtenus.
Les figures 37 à 39 sont des courbes identiques, montrant
(absorption obtenue à diverses températures sous une même pression de 150 psi
avec des nanocomposites selon (invention préparés par broyage mécanique
intense de MgHz avec plus d'un élément ou composé additionnel. Là encore, ces
FEUILLE MdDiFIEE
CA 02307134 2000-04-20
18
courbes montrent que d'excellents résultats sont obtenus.
La figure 40 montre les courbes de désorption obtenues à 523°K
(250°C) sous une pression de 0.015 MPa avec divers nanocomposites selon
l'invention. Comme on peut le constater, ceux à base de vanadium, LaNiS, ou
d'un
mélange de vanadium et de LaNis sont extrêmement performants.
Ä titre d'information, le tableau I ci-dessous indique les
transformations de phase au broyage après désorption d'hydrogène pour les
différents types de nanocomposites exemplifiés, dont l'élément ajouté est un
métal
de transition choisi parmi Ti, V, Mn, Fe et Ni. Le tableau II ci-dessous
indique
l'énergie d'activation correspondante pour leur désorption. Comme on peut le
constater, il est plus facile de désorber (hydrogène des systèmes MgH2 V,
MgHz.
Fe et MgHz Ti que des systèmes MgH2 Ni et MgHz Mn. Par contre, dans tous les
cas, la désorption est beaucoup plus facile qu'avec MgHz broyé seul ou, mieux
encore, MgHz non broyé seul.
TABLEAU I
Transformation de phase durant le broyage et la déshydrogénation
broyage mécanique désorption
~3_MgHz+Ti~Y_MgHz+~3 MgHz+TiHz+Mg~TiHz+Mg
(3-MgHz+V.»Y-MgHz+(3 MgHz+VHx+Mg~Mg+V
(3_MgHz+Mn~y-MgHz+(3 MgHz+Mn-»Mg+Mn
(3-MgHz+Fe-»y-MgHz+~3 MgHz+MgzFeHs~»Mg+Fe
[3-MgHz+Ni~y-MgHz+(3 MgHz+MgzNiH4~Mg+MgzNi
TABLEAU II
Énergie d'activation pour la désorption (KJlmol)
i
Mg-Ti Mg-V Mg-Mn Mg-Fe Mg-Ni MgHz MgHz
broy non
broy
71.1 62.34 104.59 67.6 88.1 120 156
FEUILLE MJDIFIEE
CA 02307134 2000-04-20
WO 99/20422 PCT/CA98/00987
19 -
II va de soi que de nombreuses modifications pourraient être
apportées à ce qui vient d'être décrit sans sortir du cadre de l'invention
telle que
définie dans les revendications annexées.