Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02315914 2000-06-19
WO 99/35177
PCT/FR98/02867
1
PROCÉDÉ DE SYNTHESE DE POLYMERES A BLOCS
PAR POLYMÉRISATION RADICALAIRE CONTROLEE
A PARTIR DE COMPOSES DITHIOCARBAMATES
La présente invention concerne un nouveau procédé de polymérisation
radicalaire
donnant accès à des copolymères à blocs.
Les copolymères à blocs sont habituellement préparés par polymérisation
ionique.
Ce type de polymérisation présente plusieurs inconvénients
- elle ne permet la polymérisation que de certains types de monomères
apolaires,
notamment le styrène et le butadiène,
- elle requiert un milieu réactionnel particulièrement pur et des températures
souvent inférieures à l'ambiante de manière à minimiser les réactions
parasites.
Les contraintes de mise en oeuvre sont donc sévères.
La polymérisation radicalaire présente l'avantage d'être mise en oeuvre
facilement
sans que des conditions de pureté excessives soient respectées et à des
températures
égales ou supérieures à l'ambiante. Au cours de cette polymérisation, les
macroradicaux,
dotés d'un temps de vie très faible, se recombinent de façon irréversible par
couplage ou
dismutation. Lorsque la polymérisation se déroule en présence de plusieurs
comonomères, la variation de composition du mélange est infiniment faible
devant le
temps de vie du macroradical de sorte que les chaînes présentent un
enchaînement des
unités monomères statistique et non un enchaînement séquencé.
Par conséquent, jusqu'à récemment il n'existait pas de procédé de
polymérisation
radicalaire permettant d'obtenir des polymères à blocs.
Depuis, un nouveau procédé de polymérisation radicalaire s'est développé : il
s'agit
de la polymérisation radicalaire dite "contrôlée" ou "vivante". Cette
polymérisation
radicalaire contrôlée procède par croissance par propapagation de
macroradicaux.
Plusieurs techniques de polymérisation radicalaire contrôlée sont à présent
connues, dans lesquelles les extrémités de chaïnes de polymères peuvent être
réactivées sous forme de radical par scission homolytique de liaison (par
exemple C-O,
ou C-Halogène).
La polymérisation radicalaire contrôlée présente donc ies aspects distinctifs
suivants
1. le nombre de chaînes est fixe pendant toute la durée de la réaction,
2. les chaînes croissent toutes à la même vitesse, ce qui se traduit par
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
2
~ une augmentation linéaire des masses moléculaires avec la conversion,
~ une distribution des masses resserrée,
3. la masse moléculaire moyenne est contrôlée par le rapport molaire monomère
/
précurseur de chaîne,
4. la possibilité de préparer des copolymères à blocs.
Le caractère contrôlé est d'autant plus marqué que la vitesse de consommation
du
précurseur de chaîne est très grande devant la vitesse de croissance des
chaînes
(propagation). II existe des cas où ce n'est pas toujours vrai et les
conditions 1 et 2 ne
sont pas observées, néanmoins, il est toujours possible de préparer des
copolymères à
blocs.
Plusieurs approches ont été décrites pour contrôler la polymérisation
radicalaire. La
plus couramment citée consiste à introduire dans le milieu des contre-radicaux
qui se
combinent de façon réversible avec les macroradicaux en croissance, comme par
exemple les radicaux nitroxyles (Georges et al., Macromolecules, 26,
2987,(1993)).
Cette technique est caractérisée par des température élevées pour labiliser la
liaison C-
O.
Une autre méthode appelée Atom Transfer Radical Polymerization fait appel à
des
sels de métaux de transition associés à des ligands organiques et un amorçeur
constitué
généralement d'un halogènure organique ; le contrôle de la polymérisation est
rendu
possible par l'activation réversible de la liaison C-Halogène (Matyjaszewski
K., PCT INO
96/30421). Un inconvénient de cette polymérisation est qu'elle nécessite une
quantité
stoechiométrique de métal par chaîne précurseur.
Otsu (Otsu et al., Makromol. Chem. Rapid Comm., 3,127-132, (1982), Otsu et al.
ibid, 3,123-140,(1982), Otsu et al., Polymer BuIC, 7,45,(1984), ibid,
11,135,(1984), Otsu
et al, J. MacromoL Sci. Chem., A21, 961, ( 1984), Ots u et al. ,
Macromolecules,
19,2087,(1989)), a montré que certains sulfures organiques, particulièrement
les
dithiocarbamates, permettaient sous irradiation UV de faire croître des
chaînes de façon
contrôlée, selon le principe
Et
s-C-N ~ Et ~ ~ CHz° +
~ Et S Et
CHz° + n+1 --~ --s ~ CHz CHz-CH CH,-CH°
R
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
3
Et
CH2 CH2-CH CH2-CH° °S-C-N
~ Et
Et
CHz CHZ-ÇH CH2~-ë-N\
R R S
Réaction 1
Le principe repose sur la photolyse de la liaison C-S qui régénère le
macroradical
carboné, d'une part, et le radical dithiocarbamyl, d'autre part. Le caractère
contrôlé de la
réaction est dû à la réversibilité de la liaison C-S sous irriadiation UV. II
est ainsi possible
d'obtenir des copolymères à blocs. En revanche la vitesse d'échange en espèces
propageantes et espèces "dormantes" de la réaction 1 ci-dessus n'est pas très
grande
par rapport à la vitesse de propagation ce qui a pour conséquence de générer
des
distributions en masses moléculaires relativement larges. Ainsi, l'indice de
polydispersité
(Ip = Mw/Mn) est compris entre 2 et 5 (Otsu et al., 25,7/8,643-650,(1989)).
Les Bisulfures de xanthates et de dithiocarbamates sont eux-mêmes bien connus
comme agents de transferts en polymérisation radicalaire conventionnelle en
mode
thermique et en présence d'amorçeur, mais aucun n'a permis à ce jour de
contrôler la
polymérisation, encore moins de produire des copolymères à blocs.
Jusqu'à présent il était connu que les Bisulfures (tetra-alkylthiurame
Bisulfure, di-
isopropylxanthate Bisulfure, mercaptobenzothiazole Bisulfure) étaient
activables
thermiquement ou sous irradiation UV, alors que les monosulfures
(dithiocarbamates,
xanthates substitués) étaient activables uniquement sous irradiation UV (Roha
et al.,
Macromol. Symp., 91, 81-92, (1995), Okawara et al., Bull. of the Tokyo Inst.
of Techn., n°
78, 1966).
La polymérisation radicalaire contrôlée faisant appel à une source
d'irradiation UV
est cependant très difficile à mettre en oeuvre, particulièrement d'un point
de vue
industriel, car la pénétration des photons UV dans le milieu de polymérisation
est limitée,
tant par des phénomènes d'absorption (la plupart des monomères éthyléniques
absorbent dans ~la plage 210-280 nm), que par les phénomènes de diffusion dans
les
milieux dispersés (suspension, émulsion).
D'autre part, il a été montré (Turner et al., Macromolecules, ,23,1856-1859,
(1990)) que la photopolymérisation en présence de dithiocarbamate génère du
Bisulfure
de carbone et peut s'accompagner d'une perte de contrôle de la polymérisation.
CA 02315914 2000-06-19
WO 99/35177
PGT/FR98/02867
4
Pour ces raisons, on cherche donc à développer une technique permettant
d'accéder à des copolymères à blocs par un procédé sans irradiation UV, die
préférence
par amorçage thermique. Or, à ce jour, aucun système de polymérisation
radicalaire
contrôlé n'a pu être mis en évidence avec des composés dithiocarbamates en
l'absence
de source UV.
Le document WO 98/01478 décrit un procédé de préparation de polymères à blocs
par polymérisation radicalaire controlée. Selon ce document, un tel procédé ne
peut être
mis en oeuvre à l'aide de composés, dits agents de transferts de chaîne,
choisis parmi
les dithiocarbamates, de formule générale
R2N
S
\\
C-S-R'
La polymérisation radicalaire contrôlée présente un avantage sur la
polymérisation
radicalaire conventionnelle lorsqu'il s'agit de préparer des chaînes de bas
poids
moléculaires et fonctionnalisées (télomères réactifs). De tels polymères sont
recherchés
pour des applications spécifiques telles que, par exemple, revêtements et
adhésifs.
Ainsi, lorsque l'on cherche à synthétiser des chaînes greffées avec en moyenne
2
comonoméres fonctionnels, la fraction de chaînes avec au plus un site
fonctionnel
devient importante quand le degré de polymérisation moyen est inférieur à une
valeur
seuil (e.g. 20 ou 30). La polymérisation radicalaire contrôlée permet, elle,
de réduire,
voire inhiber, la formation de ces oligomères à zéro ou un site fonctionnel
qui dégradent
ies performances en application.
Un but de la présente invention est de proposer un nouveau procédé de
polymérisation radicalaire contrôlée pour la synthèse de polymères à blocs à
partir de
dithiocarbamates.
Un autre but de la présente invention est de proposer un nouveau procédé de
polymérisation radicalaire contrôlée pour la synthèse de polymères à blocs à
partir de
dithiocarbamates en l'absence de source UV.
Un autre but est de proposer un procédé de polymérisation radicalaire
contrôlée
pour la synthèse de polymères à blocs à partir de tous types de monomères.
Un autre but est de proposer un procédé de polymérisation radicalaire
contrôlée
pour la synthèse de polymères à blocs ne contenant pas d'impuretés métalliques
néfastes à leur utilisation.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
Un autre but est de proposer un procédé de polymérisation radicalaire
contr6lée
pour la synthèse de copolymères à blocs, lesdits polymères étant
fonctionnalisés en
bout de chaîne.
Un autre but est de proposer un procédé de polymérisation radicalaire
contrôlée
5 pour la synthèse de polymères et de copolymères à blocs présentant un indice
de
polydispersité faible.
Un autre but est de proposer un procédé de polymérisation radicalaire
contrôlée
pour la synthèse d'oligomères présentant un taux de fonctions constant de
chaîne à
chaîne.
Dans ces buts, l'invention concerne un procédé de préparation de polymères à
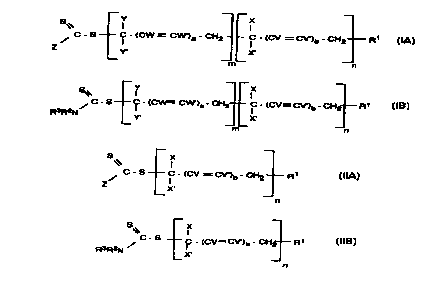
blocs de formule générale (IA) ou (IB)
Y
I
C - S C - (CW = CW')a - CH2 i - (CV -CV')b _ CH2 R~ (IA)
I
Y. X.
m
n
¿ x
I
C - S Ç - (CW= CW')a - CH2 Ç - (CV= CV')b - CH2 R~ (IB)
R3R2N
Y, X.
m n
dans lesquelles
- Rt représente
~ un groupe (i) alkyle, acyle, aryle, alcéne ou alcyne éventuellement
substitué, ou
~ un cycle (ü) carboné, saturé ou non, éventuellement substitué ou aromatique,
ou
~ un hétérocycle (iii), saturé ou non, éventuellement substitué ou aromatique,
ces groupes et cycles (i), (ü) et (iii) pouvant être substitués par des
groupes
phényles substitués, des groupes aromatiques substitués ou des groupes
alkoxycarbonyle ou aryloxycarbonyle (-COOR), carboxy (-COOH), acyloxy (-
02CR), carbamoyle (-CONR2), cyano (-CN), alkylcarbonyle, alkylarylcarbonyle,
arylcarbonyle, arylalkylcarbonyle, phtalimido, male'imido, succinimido,
amidino,
guanidimo, hydroxy (-OH), amino (-NR2), halogène, allyle, époxy, alkoxy (-OR),
S-
alkyle, S-aryle, organosilyle, des groupes présentant un caractère hydrophile
ou
ionique tels que les sels alcalins d'acides carboxyliques, les sels alcalins
d'acide
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
6
sulfonique, les chaînes polyoxyde d'alkylène (POE, POP), les substituants
cationiques (sels d'ammonium quaternaires),
R représentant un groupe alkyle ou aryle,
- Z est un cycle éventuellement substitué comprenant un atome d'azote par
lequel Z est
lié au groupe C(=S)-S- de la formule (IA), les autres atomes dudit cycle
induisant un
effet de délocalisation ou électro-attracteur vis-à-vis de la densité
électronique de
l'atome d'azote,
- R2 et R3, identiques ou différents, représentent
~ un groupe (i) alkyle, acyle, aryle, alcéne ou alcyne éventuellement
substitué, ou
~ un cycle (ü) carboné, saturé ou non, éventuellement substitué ou aromatique,
ou
~ un hétérocycle (iii), saturé ou non, éventuellement substitué,
ces groupes et cycles (i), (ü) et (iii) pouvant être substitués par
. des groupes phényles substitués ou des groupes aromatiques substitués,
. des groupes : alkoxycarbonyle ou aryloxycarbonyle (-COOR), carboxy (-COOH),
acyloxy (-02CR), carbamoyle (-CONR2), cyano (-CN), alkylcarbonyle,
alkylarylcarbonyle, arylcarbonyle, arylalkylcarbonyle, phtalimido, maleïmido,
succinimido, amidino, guanidimo, hydroxy (-OH), amino (-NR2), halogène,
allyle,
époxy, alkoxy (-OR), S-alkyle, S-aryle,
. des groupes présentant un caractère hydrophile ou ionique tels que les sels
alcalins d'acides carboxyliques, les sels alcalins d'acide sulfonique, les
chaînes
polyoxyde d'alkylène (POE, POP), les substituants cationiques (sels d'ammonium
quaternaires),
R représentant un groupe alkyle ou aryle,
et, pour au moins R2 ou R3, ces groupes et cycles (i), (ü) et (iii) induisent
un effet
de délocalisation ou électro-attracteur vis-à-vis de la densité électronique
de !'atome
d'azote auquel R2 et R3 sont liés,
- V, V', W et W', identiques ou différents, représentent : H, un groupe alkyle
ou un
halogène,
- X, X', Y et Y', identiques ou différents, représentent H, un halogène ou un
groupe
choisi parmi R', OR', OCOR', NHCOH, OH, NH2, NHR', N(R')2, (R')2N+O-, NHCOR',
C02H, C02R', CN, CONH2, CONHR' ou CONR'2, dans lesquels R' est choisi parmi
les
groupes alkyle, aryle, aralkyle, alkaryle, alcène ou organosilyle,
éventuellement
perfluorés et éventuellement substitués par un ou plusieurs groupes carboxyle,
époxy,
hydroxyle, alkoxy, amino, halogène ou sulfonique,
CA 02315914 2000-06-19
WO 99/35177
PCT/FR98/02867
7
- a et b, identiques ou différents, valent 0 ou 1,
- m et n, identiques ou différents, sont supérieurs ou égaux à 1, et lorsque
l'un ou l'autre
est supérieur à 1, les motifs unitaires répétitifs sont ïdentiques ou
différents,
procédé dans lequel on met en contact
- un monomère éthyléniquement insaturé de formule : CYY' (= CW - C~)a = CH2,
- un composé précurseur de formule générale (IIA) ou (IIB) :
S X
I
Z/ C - S C - (CV = C~)b _ CH2
I (I IA)
X'
n
S\\ X
I
C-S
- (CV=CV')b - CH2 R~ (IIB)
X'
n
dans laquelle Z, X, X', V, V', R~, R2 et R3 ont la même signification, et, b
et n la
même valeur, que précédemment,
- un initiateur de polymérisation radicalaire.
Le procédé selon l'invention consiste donc à mettre en contact un initiateur
de
polymérisation radicalaire, un monomère éthyléniquement insaturé et un
précurseur de
formule générale (IIA) ou (IIB).
2b L'initiateur de polymérisation radicalaire peut être choisi parmi les
initiateurs
classiquement utilisés en polymérisation radicalaire. II peut s'agir par
exemple d'un des
initiateurs suivants
- les peroxydes d'hydrogène tell que : fhydroperoxyde de butyle tertiaire,
fhydroperoxyde de cumène, le t-butyl-peroxyacétate, le t-butylperoxybenzoate,
le t
butylperoxyoctoate, le t-butylperoxynéodécanoate, le t-butylperoxyisobutyrate,
le
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
8
peroxyde de lauroyle, le t-amylperoxypivalate, le t-butylperoxypivalate, le
peroxyde de
dicumyl, le peroxyde de benzoyle, le persulfate de potassium, le persulfate
d'ammonium,
- les composés azoïques tels que : le 2-2'-azobis(isobutyronitrile), le 2,2'-
azobis(2
butanenitrile), le 4,4'-azobis(4-acide pentanoïque), le 1,1'-
azobis(cyclohexane
carbonitrile), le 2-(t-butylazo)-2-cyanopropane, le 2,2'-azobis[2-méthyl-N-
(1,1 )
bis(hydroxyméthyl}-2-hydroxyéthyl) propionamide, le 2,2'-azobis(2-méthyl-N-
hydroxyéthyi)-propionamide, le dichlorure de 2,2'-azobis(N,N'-
diméthylèneisobutyramidine), le dichlorure de 2,2'-azobis (2-amidinopropane),
le 2,2'-
azobis (N,N'-diméthylèneisobutyramide), ie 2,2'-azobis(2-méthyl-N-[1,1-bis
(hydroxyméthyl)-2-hydroxyéthyl] propionamide), le 2,2'-azobis(2-méthyl-N-[1,1-
bis
(hydroxyméthyl)éthyl) propionamide}, le 2,2'-azobis[2-méthyl-N-(2-
hydroxyéthyl)
propionamide), le 2,2'-azobis(isobutyramide) dihydrate,
- les systèmes redox comportant des combinaisons telles que
. les mélanges de peroxyde d'hydrogène, d'alkyle, peresters, percarbonates et
similaires et de n'importe lequel des sels de fer, de sels titaneux,
formaldéhyde
sulfoxylate de zinc ou formaldéhyde sulfoxylate de sodium, et des sucres
réducteurs,
. les persulfates, perborates ou perchlorates de métaux alcalins ou d'ammonium
en
association avec un bisulfite de métal alcalin, tel que le métabisulfite de
sodium, et des
sucres réducteurs;
. les persulfates de métal alcalin en association avec un acide
arylphosphinique, tel
que l'acide benzène phosphonique et autres similaires, et des sucres
réducteurs.
De préférence, la quantité d'initiateur à utiliser est déterminée de manière à
ce que
la quantité de radicaux générés soit d'au plus 25 % en mole par rapport à la
quantité de
composé (IIA) ou (IIB), encore plus préférentiellement d'au plus 15 % en mole.
Comme monomère éthyléniquement insaturé, on utilise plus spécifiquement
selon l'invention les monomères choisis parmi le styrène ou ses dérivés, le
butadiène, le
chloroprène, les esters (méth)acryliques, les esters vinyliques et les
nitriles vinyliques.
Le butadiène et le chloroprène correspondent au cas où a et b = 1 dans les
formules (IA), (IB), (IIA) ou (IIB) et la formule du monomère précédemment
donnée.
Par esters (méth)acryliques, on désigne les esters de l'acide acrylique et de
l'acide
méthacrylique avec les alcools en C~-C~2 hydrogénés ou fluorés, de préférence
en C~-
C8. Parmi les composés de ce type, on peut citer : l'acrylate de méthyle,
l'acrylate
d'éthyle, facrylate de propyle, l'acrylate de n-butyle, l'acrylate
d'isobutyle, l'acrylate de 2-
éthylhexyle, facrylate de t-butyle, le méthacrylate de méthyle, le
méthacrylate d'éthyle, le
méthacrylate de n-butyle, le méthacrylate d'isobutyle.
Les nitriles vinyliques incluent plus particulièrement ceux ayant de 3 à 12
atomes
de carbone, comme en particulier l'acrylonitrile et le méthacrylonitrile.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
9
II est à noter que le styrène peut être remplacé en totalité ou en partie par
des
dérivés tels que l'alphamèthylstyrène ou le vinyltoluène.
Les autres monomères éthyléniquement insaturés, utilisables seuls ou en
mélanges, ou copolymérisables avec les monomères ci-dessus sont notamment
- les esters vinyliques d'acide carboxylique comme l'acétate de vinyle, le
Versatate~ de vinyle, le propionate de vinyle,
- les halogénures de vinyle,
- les acides mono- et di- carboxyliques insaturés éthyléniques comme l'acide
acrylique, l'acide méthacrylique, l'acide itaconique, l'acide maléfique,
l'acide fumarique et
les mono-alkylesters des acides dicarboxyliques du type cité avec les alcanols
ayant de
préférence 1 à 4 atomes de carbone et leurs dérivés N-substitués,
- les amides des acides carboxyliques insaturés comme l'acrylamide, le
méthacrylamide, le N-méthylolacrylamide ou méthacrylamide, les N-
alkylacrylamides.
- les monomères éthyléniques comportant un groupe acide suffonique et ses sels
alcalins ou d'ammonium par exemple l'acide vinylsulfonique, l'acide
vinylbenzène
sulfonique, l'acide a-acrylamidomèthylpropanesulfonique, le 2-
sulfoéthylèneméthacrylate,
les amides de la vinylamine, notamment le vinylformamide ou le vinylacétamide,
- les monomères éthyléniques insaturés comportant un groupe amino secondaire,
tertiaire ou quaternaire, ou un groupe hétérocyclique contenant de l'azote tel
que par
exemple les vinylpyridines, le vinylimidazole, les (méth)acrylates
d'aminoalkyle et les
(méth)acrylamides d'aminoalkyle comme le diméthylaminoéthyl(meth)acrylate, le
ditertiobutylaminoéthyl(meth)acrylate, le diméthylamino(meth)acrylamide. II
est de même
possible d'utiliser des monomères zwitterioniques comme par exemple l'acrylate
de
sulfopropyl(diméthyl)aminopropyle.
Pour fia préparation des copolymères de formule (IA) ou (IB) pour lesquels Y =
H et
Y' = NH2, on utilise de préférence à titre de monomères éthyléniquement
insaturés les
amides de la vinylamine, par exemple le vinylformamide ou le vinylacétamide.
Puis le
copolymère obtenu est hydrolysé à pH acide ou basique.
Pour la préparation des copolymères de formule (IA) ou (IB) pour lesquels Y =
H et
Y' = OH, on utilise de préférence à titre de monomères éthyléniquement
insaturés les
esters vinyliques d'acide carboxylique, comme par exemple l'acétate de vinyle.
Puis le
copolymère obtenu est hydrolysé à pH acide ou basique.
Les types et quantités de monomères copolymérisables mis en oeuvre selon la
présente invention varient en fonction de l'application finale particulière à
laquelle est
destiné le polymère à blocs. Ces variations sont bien connues et peuvent être
facilement
déterminées par l'homme du métier.
CA 02315914 2000-06-19
WO 99/35177
PCT/F'R98/02867
Pour que le polymère de formule générale (IA) ou (IB) soit un polymère à
blocs, le
composé "précurseur" de formule générale (IIA) ou (IIB) doit ëtre un polymère.
Donc, n est supérieur ou égal à 1, de préférence supérieur à 5. Les unités
monomères
de ce polymère peuvent être identiques ou différentes.
La caractéristique essentielle de l'invention tient à la nature de ce
précurseur de
formule générale (IIA) ou (iIB). Ce précurseur (IIA) ou (IIB) fait partie de
ia famille des
dithiocarbamates dont la fonction est
S
\\
C-S
10 N
Dans le cas des copolymères de la formule (IA) ou des polymères précurseurs de
formule (IIA), l'atome d'azote de la fonction dithiocarbamate doit faire
partie d'un cycle et
tes autres atomes dudit cycle doivent présenter un effet électro-attracteur
sur le doublet
de l'azote de la fonction dithiocarbamate.
Ce cycle Z comprenant l'azote de la fonction dithiocarbamate
peut etre de
différentes natures du moment qu'il existe un effet électro-aftracteur sur le
doublet de
l'azote.
Compte-tenu du procédé, les polymères multi-bloc de formule (IA) présentent
les
mêmes caractéristiques pour ce qui concerne le cycle Z.
Dans les composés de formule (IA) et (IIA), le cycle Z est un cycle à base
d'atomes
de carbone.
Ce cycle carboné peut comprendre au moins un autre hétéroatome que l'azote qui
lie le cycle à -C(=S)-S- ; cet hétéroatome peut être choïsi parmi O, S, N
et/ou P. II s'agit
de préférence de O ou N.
Le cycle Z peut être un cycle aromatique ou hétéroaromatique.
Le cycle Z peut être fonctionnalisé et comprendre au moins un des groupes
fonctionnels suivants : carbonyle (C=O), S02, POR", R" représentant un groupe
alkyl,
aryl, OR, SR, NR2 avec R représentant un groupe alkyle ou aryle, identiques ou
différents. De préférence, le groupe fonctionnalisé est carbonyle.
ll est également préférable que le groupe fonctionnalisé soit directement lié
à
l'azote de la fonction dithiocarbamate.
Le cycle Z peut être substitué par au moins l'un des groupes suivants :
alkyie,
aryle, alkoxycarbonyle ou aryloxycarbonyle (-COOR), carboxy (-COOH), acyloxy (-
02CR), carbamoyle (-CONRZ), cyano (-CN), alkylcarbonyle, alkylarylcarbonyle,
arylcarbonyle, arylalkylcarbonyle, phtalimido, maleïmido, succinimido,
amidino,
guanidimo, hydroxy (-OH), amino (-NRZ), halogène, allyle, époxy, alkoxy (-OR),
S-alkyle,
CA 02315914 2000-06-19
WO 99/35177
11
PCT/FR98/02867
S-aryle, des groupes présentant un caractère hydrophile ou ionique tels que
les sels
alcalins d'acides carboxyliques ou les sels alcalins d'acide sulfonique, les
chaînes
polyoxyde d'alkylène (POE, POP), les substituants cationiques (sels d'ammonium
quaternaires), R représentant un groupe alkyle ou aryle.
Le cycle Z peut également être substitué par au moins un cycle carboné ou un
hétérocycle, éventuellement aromatique et/ou substitué par l'un des groupes
précédents. Dans ce dernier cas, et selon une variante préférée, le cycle Z et
son
substituant cyclique ont deux atomes communs.
Le cycle Z est de préférence choisi parmi l'un des cycles suivants
N
~O
O
N
~O
O
~ N
O N
O
~N
De même, dans le cas des copolymères de la formule (tB) ou des polymères
précurseurs de formule (IIB), l'atome d'azote de la fonction dithiocarbamate
doit être lié
à des groupes R2 et R3 dont l'un au moins induit un effet de délocalisation ou
électro
attracteur vis-à-vis de la densité électronique de l'atome d'azote de la
fonction
dithiocarbamate.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/OZ867
12
Selon une première variante, RZ et/ou R3 exercent un effet n attrateur. A cet
effet,
R2 et/ou R3 peuvent représenter un groupe carbonyle ou (hétéro)aromatique.
Selon une deuxième variante, R2 et/ou R3 exercent un effet E attrateur. A cet
effet,
R2 et/ou R3 peuvent représenter un groupe alkyle substitué par des groupes
électro
attrateurs.
En ce qui concerne le substituant R~ des composés de formule (IA), (IB), (IIA)
et
(IIB), il représente de préférence
un groupe de formule CR~~R~2R~3, dans laquelle
. R~~, R~2 et R~3 représentent des groupes (i), (ü) ou (iii) tels que définis
ci-
dessus, ou
. R~~ = R~2 = H et R~3 est un groupe aryle, alcène ou alcyne,
- ou un groupe -COR~4 dans lequel R~4 représente un groupe (i), (ü) ou (iii)
tels
que définis ci-dessus.
II peut notamment être choisi parmi les groupes suivants
H
I
- C - CH3
I
C02Et
H
I
- C - CH3
I
phényl
H
I
- C - C02Et
I
C02Et
CH3
I
- C - S - phényl
I
C02Et
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
13
H O
t II
'- C- C- Ph
I
O N O
\ /
Le polymère précurseur de formuie (IIA) peut être issu de la polymérisation
radicalaire d'un monomère éthyléniquement insaturé de formule : CXX' (= CV -
CV')b =
CH2 par mise en contact dudit monomère avec un initiateur de polymérisation
radicalaire
et un composé de formule générale (IIIA) ou (IVA)
S
C - S - R~ (IIIA)
Z
R1-f-.S - C - 2}p (IVA)
I l
S
p étant compris entre 2 et 10, de préférence entre 2 et 5.
Dans les formules générales (IIIA) ou (IVA), les symboles Z et R~ ont la mëme
signification que précédemment. Les préférences quant à ses symboles sont les
mêmes
que ci-dessus.
Parmi les composés de formule (IVA), lorsque p = 2, Rt peut être choisi parmi
les
groupes - CH2 - phényl - CH2 - ou - (CH2)q -, avec q compris entre 2 et 10.
Selon les variantes préférées, le composé de formule (IIIA) est choisi parmi
ceux
de formules (A) à (E) suivantes
S
S - CH(COOEt)2
N
O (A)
O
CA 02315914 2000-06-19
WO 99/35177
i4
S
S - CH(COOEt)2
N
O (B)
O
S
O~ ~ S - CH(COOEt)2
w
N N
(C)
S
S - CH(COOEt)2
(D)
S
S - CH(COOEt)2
O N
(E)
CN S~N ~ (F)
O
PCT/FR98/02867
CA 02315914 2000-06-19
WO 99/35177
C02Et
S ~N (G)
C02Et g ~ O
O
5
C02CH3
C02Et
S~N (H)
C02Et S ~-O
O
PCT/FR98/02867
De même, le composé précurseur de formule générale (IIB) peut être issu de la
polymérisation radicalaire d'un monomère éthyléniquement insaturé de formule :
CXX' (_
10 CV - CV')b = CHZ au cours de laquelle ledit monomère est mis en contact
avec un
initiateur de polymérisation radicalaire et un composé de formule générale
(IIIB), (IVB)
ou (VB)
S~~
C- S- R~ (IIIB)
RsR2N ~
S\~
/ C-S - R~ ~p (IVB)
15 R2~N
S~~
C-N - R2 ) p (VB)
R~'f'S
p étant compris entre 2 et 10
CA 02315914 2000-06-19
WO 99/35177
PCT/FR98/02867
16
Dans les formules générales (1118), (IVB) ou (VB), les symboles R~, R2 et R3
ont la
même signification que précédemment. Les préférences quant à ses symboles sont
les
mëmes que ci-dessus.
Selon les variantes préférées, le composé de formule (iIIB) est choisi parmi
les
composés de formules suivantes
S
S - CH(Me)(C02Et)
N
Me02C
S
S - CH(Me)(C02Et)
,N
tBu02C - (J)
S
S - CH(C02Et)2
N
(K)
\ /
s
S - CH(C02Et)2
N
CH3~ (L)
\ /
Les composés de formule (IIIA) ou (1118) sont obtenus en général par réaction
de
l'amine correspondante sur CS2 de manière à obtenir les sels de formules
Z - C- S ,M+
I I
S
CA 02315914 2000-06-19
WO 99/35177
PCT/FR98/02867
ou
17
R2R3N_ C _ S- , M+
I I
S
dans lesquelles M représente le sodium, le potassium ou le lithium.
Ce sel est ensuite mis en contact avec un dérivé halogéné Hal-R~ (Hal
représente
CI, Br, ou I) pour donner le précurseur de formule (IIIA) ou (1118).
Lors de la synthèse du polymère précurseur de formule (IiA) ou (I!B), les
initiateurs
de polymérisation radicalaire et les monomères éthyléniquement insaturés sont
du type
de ceux précédemment cités.
Le procédé complet dé synthèse d'un polymère à blocs de formule (IA) ou (IB)
selon l'invention peut donc consister à
(1) synthétiser un polymère par mise en contact d'un monomère éthyléniquement
insaturé de formule : CXX' (= CV - CV')b = CH2, d'un initiateur de
polymérisation
radicalaire et d'un composé de formule (IIIA), (1118), (IVA), (IVB) ou (VB),
(2) utiliser ce polymère obtenu à l'étape (1 ) en tant que précurseur de
formule
générale (IIA) ou (IIB) pour préparer un polymère dibloc par mise en contact
avec un
nouveau monomère éthyléniquement insaturé de formule : CYY' (= CW - CW')a =
CH2
et un initiateur de polymérisation radicalaire,
Cette étape (2) peut être répétée autant de fois que voulu avec de nouveaux
monomères pour synthétiser de nouveaux blocs et obtenir un polymère multibloc.
Comme indiqué précédemment, pour la préparation des précurseurs de formule
(IIA) ou (IIB) pour lesquels X = H et X' = NH2, on utilise de préférence à
titre de
monomères éthyléniquement insaturés les amides de la vinylamine, par exemple
le
vinylformamide ou le vinylacétamide. Puis le polymère obtenu est hydrolysé à
pH acide
ou basique.
De même, pour la préparation des précurseurs de formule (IIA} ou (IIB) pour
lesquels X = H et X' = OH, on utilise de préférence à titre de monomères
éthyléniquement insaturés les esters vinyliques d'acide carboxylique, comme
par
exemple l'acétate de vinyle. Puis le polymère obtenu est hydrolysé à pH acide
ou
basique.
Selon ce principe, l'invention concerne donc également un procédé de
préparation
de polymères multiblocs, dans lequel on répète au moins une fois la mise en
oeuvre du
procédé précédemment décrit en utilisant
- des monomères différents de la mise en oeuvre précédente, et
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/OZ8b7
18
- à la place du composé précurseur de formule (IIA) ou (IfB) le polymère à
blocs
issu de la mise en oeuvre précédente.
Si on répète la mise en oeuvre une fois, on obtiendra un polymère tribloc, si
on le
répète une deuxième fois, on obtiendra un polymère "quadribloc", et ainsi de
suite. De
cette manière, à chaque nouvelle mise en oeuvre, le produit obtenu est un
polymère à
blocs présentant un bloc polymère supplémentaire.
Donc, pour la préparation de polymères multiblocs, le procédé consiste à
répéter
plusieurs fois la mise en oeuvre du procédé précédent sur le polymère à blocs
issu de
chaque mise en oeuvre précédente avec des monomères différents.
Sefon ce procédé de préparation de polymères multiblocs, lorsque l'on souhaite
obtenir des polymères à blocs homogènes et non à gradient de composition, et
si toutes
les polymérisations successives sont réalisées dans le même réacteur, il est
essentiel
que tous les monomères utilisés lors d'une étape aient été consommés avant que
la
polymérisation de l'étape suivante ne commence, donc avant que les nouveaux
monomères ne soient introduits.
Les composés de formule (IVA) et (IVB) sont particulièrement intéressants car
ils
permettent de faire croître une chaîne polymère sur au moins deux sites
actifs. Avec ce
type de composé, il est possible d'économiser des étapes de polymérisation
pour obtenir
un copolymère à n blocs.
Ainsi, si p vaut 2, le premier bloc est obtenu par polymérisation d'un
monomère M1
en présence du composé de formule (IVA) ou (IVB). Ce premier bloc peut ensuite
croître
à chacune de ses extrémités par polymérisation d'un deuxième monomère M2. Un
copolymère tribloc est obtenu. Ce copolymère tribloc peut, lui-même, croître à
chacune
de ses extrémités par polymérisation d'un troisième monomère M3. Ainsi, un
copolymère
"pentabloc" est obtenu en seulement trois étapes.
Si p est supérieur à 2, le procédé permet d'obtenir des homopolymères ou des
copolymères à blocs dont la structure est "multi-bras" ou hyperbranchée.
La polymérisation est mise en oeuvre selon toute méthode connue de l'homme du
métier. Elle peut être réalisée en masse, en solution ou en émulsion. La
température
peut varier entre la température ambiante et 150°C selon la nature des
monomères
utilisés. Le procédé est mis en oeuvre en l'absence de source UV.
Le procédé selon l'invention présente l'avantage de conduire à des polymères à
blocs présentant un indice de polydispersité faible.
II permet également de contrôler la masse moléculaire des polymères.
CA 02315914 2000-06-19
WO 99/35177
19
PCT/FR98/02867
L'invention concerne donc aussi les polymères à blocs susceptibles d'être
obtenus
par le procédé précédent.
Ces polymères présentent, en général, un indice de polydispersité (Ip) d'au
plus 2,
de préférence d'au plus 1,5.
Les polymères à blocs préférés sont ceux présentant au moins deux blocs
polymères choisis parmi les associations suivantes
- polystyrène/polyacrylate de méthyle
- polystyrène/polyacrylate d'éthyle,
- polystyrène/polyacrylate de tertiobutyle,
- polyacrylate d'éthyle/poiyacétate de vinyle,
polyacrylate de butyle/polyacétate de vinyle
- polyacrylate de tertiobutyle/polyacétate de vinyle.
Enfin, le procédé de synthèse des polymères précurseurs de formule générale
(IIA)
ou (IIB) permet également de synthétiser des polymères présentant un faible
indice de
polydispersité. Ces polymères précurseurs présentent, en général, un indice de
polydispersité d'au plus 2, de préférence d'au plus 1,5.
De préférence, pour ces polymères précurseurs de formule générale (ilA) ou
(IIB),
n est supérieur ou égal à 6.
Les exemples suivants illustrent l'invention sans toutefois en limiter la
portée.
EXEMPLES
Exemple 1.1 : Synthèse du dithiocarbamate de formule (A)
Dans un ballon, on dissout 17,8 g de 2-amino-2-méthyl-1-propanol dans 100 ml
d'une solution 0,1 M d'éthanolate de sodium dans l'éthanol. On ajoute ensuite
24 ml de
diéthylcarbonate et la solution obtenue est agitée pendant 24 heures. Le
solvant est alors
est évaporé. Après séchage, on obtient 17,26 g de 5,5-diméthyl-2-oxazolidone
avec un
rendement de 75 %.
On lave 5,28 g d'hydrure de sodium à 50 % par du pentane. On l'ajoute à un
mélange THF/DMSO (100 ml THF/100 ml DMSO). Cette solution est refroidie à
0°C. On
y ajoute 11,5 g de 5,5-diméthyl-2-oxazolidone obtenue à l'issue de la première
étape. Le
système de refroidissement est interrompu et le milieu réactionnel est agité
pendant
1h30, il apparaît alors un précipité blanc. La température est de nouveau
portée à 0°C et
CA 02315914 2000-06-19
WO 99/35177
PCT/FR98/02867
1 équivalent de CS2 (7,6 g) est ajouté. La solution se colore en rouge et
l'agitation est
maintenue jusqu'à ce que le milieu réactionnel soit partaitement limpide
(environ 3
heures). La solution est alors reprise par de l'eau et extraite au
dichlorométhane.
La phase aqueuse est récupérée et additionnée par 50 ml d'éthanol et 16,2 ml
de
5 chloromalonate de diéthyle. L'agitation est maintenue toute la nuit à
température
ambiante et la solution jaune obtenue est concentrée sous vide avant d'être
reprise par
une solution aqueuse saturée en chlorure de sodium. Enfin, elle est extraite
par de
l'éther.
On isole 7,9 g de dithiocarbamate de formule (A) par chromatographie sur
colonne.
10 Le rendement est de 23 %.
Exemple 1.2 : Synthèse du dithiocarbamate de formule (B)
On lave 2,6 g d'hydrure de sodium à 50 % par du pentane. II est ensuite
introduit
15 dans un mélange THF/DMSO (200 ml THF / 200 ml DMSO). On ajoute ensuite 4,35
g
d'oxazolidone et la solution est agitée une heure à température ambiante. Un
précipité
blanc apparaît.
Le milieu réactiohnel est alors refroidi à -20°C et on ajoute 3,6 ml de
CS2. La
solution se colore en orange. Elle est agitée 10 min à -20°C puis 2
heures à 0°C. Le
20 milieu réactionnel est de nouveau refroidi à -20°C et on ajoute 4 ml
de chloromalonate de
diéthyle. La solution est agitée 10 min à -20°C, 1 heure à 0°C
et 1 heure à température
ambiante.
Le milieu réactionnel est repris par de l'éther et la phase organique est
lavée par de
l'eau, puis par une solution saturée en chlorure de sodium.
On isole 2,6 g de dithiocarbamate de formule (B) par chromatographie sur
colonne.
Le rendement est de 23 %.
Exemple 1.3 : Synthèse du dithiocarbamate de formule (C)
On mélange 66 g d'éphédrine à 72 g d'urée. Le mélange est chauffé à
170°C
pendant 30 minutes puis à 200°C pendant 2 heures. Après refroidissement
à
température ambiante, on ajoute 200 ml d'eau. Le précipité blanc qui se forme
est filtré
et lavé avec une solution aqueuse à 5 % d'acide chlorhydrique, puis
recristallisé dans
l'éthanol. On obtient 28 g de 1,5-diméthyl-4-phényl-2-imidazolidone avec un
rendement
de 37 %.
On lave 2,6 g d'hydrure de sodium à 50 % avec du pentane et on ajoute un
mélange THF/DMSO ( 200 ml THF / 200 ml DMSO). On ajoute 9,5 g de 1,5-diméthyl-
4-
phényl-2-imidazolidone précédemment obtenue et la solution est agitée une
heure à
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/OZ867
21
température ambiante. Le milieu réactionnel est alors refroidi à 0°C et
on y ajoute 3 ml
de CS2. La solution devient orange. Elle est agitée à 0°C pendant 2
heures. Le milieu
réactionnel est repris par 100 ml d'eau et extrait par du dichlorométhane.
La phase aqueuse est récupérée et on ajoute 100 ml d'éthanol, puis 4 ml de
chloromalonate de diéthyle. L'agitation est maintenue pendant 2 heures et le
milieu
réactionnel est repris par de l'acétate d'éthyle. La phase organique ainsi
obtenue est
lavée par de l'eau puis par une solution saturée en chlorure de sodium avant
d'être
concentrée sous vide.
On isole 4,5 g de dithiocarbamate de formule (C) par chromatographie sur
colonne. Le rendement est de 42 %.
Exemple 1.4 : Synthèse du dithiocarbamate de formule (D)
On lave 2,6 g d'hydrure de sodium à 50 % avec du pentane, puis on ajoute un
mélange THF/DMSO (50 ml THF / 50 ml DMSO). On ajoute ensuite 5,5 ml d'indoline
au
mélange et la solution est agitée 1 heure à température ambiante.
Elle est ensuite refroidie à 0°C et on y ajoute 3,6 ml de CS2. La
solution devient
orange. Elle est agitée à 0°C pendant 2 heures. Le milieu réactionnel
est repris par 100
ml d'eau et lavé au dichlorométhane.
La phase aqueuse est récupérée et on ajoute 100 ml d'éthanol et 6,4 ml de
chloromalonate de diéthyle. La solution est agitée pendant 2 heures, puis
reprise par de
l'éther. La phase organique ainsi obtenue est lavée par de l'eau, puis par une
solution
saturée en chlorure de sodium avant d'être concentrée.
On isole 11 g de dithiocarbamate de formule (D) par chromatographie sur
colonne
sous forme de cristaux jaunes Le rendement est de 79 %.
Exemple 1.5 : Synthèse du dithiocarbamate de formule (E)
On ajoute 1 g de 5-méthyl-2-pyrrolidinone dans 20 ml d'un mélange 1/1
THF/DMSO. On y ajoute 0,56 g de potasse, puis 1 ml d'eau et 0,6 ml de CS2. Le
milieu
réactionnel est agité pendant 1 heure ; la solution devient rouge-noir.
Elle est refroidie à 0°C et on ajoute 1 ml de chloromalonate de
diéthyle. L'agitation
est maintenue pendant 30 minutes à 0°C puis pendant 2 heures à
température ambiante.
Le milieu réactionnel est repris par de l'eau et extrait à l'acétate d'éthyle.
La phase
organique est récupérée et lavée par de l'eau, puis par une solution
concentrée en
chlorure de sodium avant d'être concentrée sous vide.
On isole 0,86 g de dithiocarbamate de formule (E) par chromatographie sur
colonne sous forme d'huile jaune. Le rendement est de 26 %.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
22
Exemple 1.6 : Synthèse du dithiocarbamate de formule (F)
On lave 1,76 g de NaH à 50 % (30 mmol) par du pentane, puis on ajoute 50 ml de
THF et 50 ml de DMSO. On refroidit cette solution à 0°C, puis on
ajoute 3,8 g
d'imidazolidinone (30 mmol). On enlève le bain froid.
Après 1 h30, un précipité blanc s'est formé. On refroidit à 0°C, puis
on ajoute CS2.
La solution se colore en rouge et l'agitation est prolongée jusqu'à ce que la
solution soit
limpide (3 heures).
La solution est alors hydrolysée par de l'eau et extraite au dichlorométhane.
On
ajoute 200 ml d'acétone à la phase aqueuse puis 4,2 g d'iode.
Après 2 heures d'agitation à température ambiante, la solution obtenue est
jaune ;
elle est concentrée sous vide avant d'être diluée par une solution saturée en
NaCI et
extraite par de l'éther.
La purification du brut réactionnel par chromatographie sur colonne
(heptane/acétate d'éthyle dans un rapport 9/1 ) permet d'isoler 4,2 g de
dimère. Le
rendement est de 67 %.
On met 2 g de dimère (5,2 mmol) en solution dans 10 ml de 1,2-dichloroéthane.
On
ajoute 1,12 g (6,8 mmol) d'AIBN et fa solution est chauffée à reflux sous
argon pendant 6
heures. Le solvant est ensuite évaporé et le brut réactionnel est purifié par
chromatographie sur colonne (dichlorométhane/heptane dabs un rapport 9/1 puis
7/3).
On obtient 2,34 g de dithiocarbamate de formule (F), soit un rendement de 33
%.
Exemple 1.7 : Synthèse du dithiocarbamate de formule (G)
Dans un ballon, on met en solution 6,8 g de phénylglycinol (50 mmol) dans 50
ml
d'une solution 0,2 M de EtONa dans féthanol (préparée par addition de 10 mmol
de NaH
à 50 ml d'éthanol). On ajoute à cette solution 6 ml de diéthyl carbonate (50
mmol). La
solution est agitée pendant 24 heures, le solvant est ensuite évaporé. Le
résidu est dilué
par une solution aqueuse saturée de NaCI et extrait à l'acétate d'éthyle.
Après séchage et évaporation, le brut réactionnel est purifié par
chromatographie
sur colonne {dichlorométhane/acétate d'éthyle dans un rapport 95/5). On
obtient 4,6 g
d'oxazolidinone, soit une redement de 56 %.
On lave 0,53 g de NaH à 50 % (11 mmol) par du pentane puis on ajoute 20 ml de
THF et 20 ml de DMSO. On ajoute ensuite 1,6 g d'oxazolidinone (10 mmol). Après
30
minutes de réaction, 200 ml d'éther sont ajoutés provoquant la formation de
deux phases.
La phase surnageante est éliminée et le résidu est repris par de l'acétone,
puis précipité
par ajout d'éther. La phase surnageante est de nouveau éliminée.
CA 02315914 2000-06-19
WO 99/35177
PCT/FR98/02867
23
On ajoute 100 ml d'acétone au résidu, puis 1,12 ml (7 mmol) de chloromalonate
de
diéthyle. Après 3 heures d'agitation à température ambiante, la solution jaune
obtenue est
concentrée sous vide. Elle est ensuite diluée par une solution saturée saturée
en NaCI,
puis extraite par de l'éther.
Le brut réactionnel est purifié par chromatographie sur colonne
(heptane/acétate
d'éthyle dans un rapport 7/3) ; on isole 0,94 g de dithiocarbamate de formule
(G). Le
rendement est de 33 %.
Exemple 1.8 : Synthèse du dithiocarbamate de formule (H)
Dans un ballon, on met en solution 15,5 g de sérine méthylesterchlorhydrate
(100
mmol) dans 140 ml d'eau. On ajoute 10,5 g de KHC03 (105 mmol). Après 10
minutes,
14,6 g de K2C03 sont ajoutés. La solution est refroidie à 0°C, puis 70
ml de phosgène
(133 mmol d'une solution de 1,9 M dans toluène) sont ajoutés lentement pendant
20
minutes. La solution est agitée toute la nuit à température ambiante. On
obtient deux
phases qui sont séparées ; la phase aqueuse est évaporée et le résidu est
repris par de
l'acétate d'éthyle. La phase organique est concentrée pour donner 14,3 g
d'oxazolidinone
intermédiaire, soit un rendement de 99 %.
On met en solution 1,45 g d'oxazolidinone (10 mmol) dans 20 ml de DMF, puis on
ajoute 1,2 ml (20 mmol) de CS2. La solution est refroïdie à 0°C, puis
on ajoute 0,48 g (10
mmol) de NaH. La solution est agitée 30 minutes à 0°C, puis 30 minutes
à température
ambiante. Elle est de nouveau refroidie à 0°C et on y ajoute 0,8 ml (5
mmol) de
chloromalonate de diéthyle. Après 30 minutes d'agitation à 0°C, puis 30
minutes à
températureambiante, la solution est diluée par de l'acétate d'éthyle. Elle
est ensuite
lavée à l'eau, puis à la saumure. La phase organique est concentrée sous vide.
Le brut
réactionnel est purifié par chromatographie sur colonne (heptane/acétate
d'éthyle dans un
rapport 7/3) ; on isole 1,2 g de dithiocarbamate de formule (H). Le rendement
est de 64
%.
Exemple 1.9 : Synthèse du dithiocarbamate de formule (I)
On introduit dans un ballon 4,6 ml de cyclohexylamine (40 mmol) en solution
dans
ml d'éther éthylique, puis on ajoute 5,5 ml de triéthylamine (40 mmol) et 3,5
ml (45
mmol} de chloroformate de méthyle. Après trois heures de réaction, la solution
est
35 hydrolysée par ajout d'eau. La phase organique est lavée par une solution
d'HCI 1 N, de
NaHC03 saturée, puis par de la saumure. La phase organique est séchée sur
sulfate de
magnésium et concentrée sous vide pour donner 5,9 g (94 %) de carbamate
intermédiaire.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
24
On met en solution 1,57 g (10 mmol) de ce carbamate intermédiaire dans 20 ml
de
DMF, puis on ajoute 1,2 ml (20 mmol) de CS2. La solution est refroidie à
0°C et on ajoute
0,48 g (10 mmol) de NaH à 50 %. Après une heure à 0°C, on ajoute la
solution contenant
le sel de sodium à une solution de 1,24 ml (9,5 mmol) de 2-bromopropionate
d'éthyle
dans 20 ml de DMF à 0°C.
Après deux heures d'agitation à température ambiante, on obtient uen solution
jaune qui est diluée par ajout d'éther éthylique et hydrolysée par ajout
d'eau. La phase
organique est lavée par de l'eau, puis par de la saumure avant d'être séchée
et
concentrée sous vide.
Le brut réactionnel est purifié par chromatographie sur colonne
(heptane/acétate
d'éthyle dans un rapport 9/1) : on isole 1,6 g de dithiocarbamate de formule
(I). Le
rendement est de 50 %.
Exemple 1.10 : Synthèse du dithiocarbamate de formule (J)
On met en solution 0,58 g (3 mmol) de carbamate intermédiaire (préparé à
partir de
l'o-toluidine et le (Boc)20 (ditertbutyldicarbonate) dans 10 ml de DMF, puis
on ajoute 0,35
ml (6mmol) de CS2. La solution est refroidie à 0°C et on ajoute 0,144 g
(3 mmol) de NaH
à 50 %. Après une heure à 0°C, la solution contenant le sel de sodium
est ajoutée
lentement sur une solution de 0,39 ml (3 mmol) de 2-bromopropionate d'éthyle
dans 10
ml de DMF à 0°C.
Après 2 heures d'agitation à température ambiante, la solution jaune obtenur
est
diluée par ajout d'éther éthylique et hydrolysée par ajout d'eau. La phase
organique est
lavée par de l'eau puis par de la saumure avant d'être séchée et concentrée
sous vide.
Le brut réactionnel est purifié par colonne (heptane/acétate d'éthyle dans un
rapport
9/1) : on isole 0,68 g de dithiocarbamate de formule (J). Le rendement est de
61 %.
Exemple 1.11 : Synthèse du dithiocarbamate de formule (K)
Dans un ballon placé sous argon, on met en suspension 1,3 équivalent de NaH
(1,24g ; 26 mmol) dans 10 ml de THF. On ajoute à 0°C 1 équivalent de
diphényle amine
(3,38 g ; 20 mmol) en solution dans un mélange de 18 ml de DMSO et 9 ml de
THF. La
couleur vire au vert clair.
Après une heure d'agitation, on ajoute 2,36 équivalents de CS2 (2,84 ml ; 47,2
mmol), la solution devient orange-jaune. Après agitation pendant 30 minutes,
la solution
est refroidie à -20°C et 1 équivalent d'agent chloré (3,20 ml ; 20
mmol) est ajouté. La
solution est agitée pendant deux heures à température ambiante. Elle est
ensuite
CA 02315914 2000-06-19
WO 99/35177
PCT/FR98/02867
hydrolysée, et extraite à l'éther éthylique, puis séchée sur sulfate de
magnésium et
concentrée sous vide.
Le produit est isolé. II se présente sous forme d'un solide beige (point de
fusion
65°C). Le rendement est de 85 ~° sans purification.
5
Exemple 1.12 : Synthèse du dithiocarbamate de formule (L)
Dans un ballon sous argon, on met en suspension 1,3 équivalent de NaH (1,24 g
;
26 mmol) dans 10 ml de THF. On ajoute au goutte à goutte, à température
ambiante, 1
10 équivalent de méthylphénylamine (2,16 ml ; 20 mmol) en solution dans un
mélange de
20 ml de DMSO et 10 ml de THF. Le mélange est chauffé à reflux du THF pendant
10
minutes. La couleur vire au jaune-vert.
Après une heure d'agitation, 2,36 équivalents de CS2 (2,84 m ; 47,2 mmol) sont
additionnés à 0°C. La solution devient alors marron-rouge. Aprè s
agitation pendant 30
15 minutes, la solution est refroidie à -15°C et 1 équivalent d'agent
chloré (3,20 ml ; 20
mmol) est ajouté. La solution devient marron-jaune ; elle est agitée pendant
deux heures
à température ambiante. Elle est ensuite hydrolysée, et extraite à l'éther
éthylique, puis
séchée sur sulfate de magnésium et concentrée sous vide.
Après purification par chromatographie sur colonne (heptane/acétate d'éthyle
20 9/1), on isole 4,42 g de produit. fl se présente sous forme d'une huile
jaune. Le
rendement est de 70 %.
2. PREPARATION DES HOMOPO vn~~RES de formWP (nos r,. ~ nm
25 Ces exemples démontrent que la polymérisation radicalaire est contrblée
grâce à
l'utilisation de précurseurs de formule générale (III). Le caractère de
contrôle de la
réaction apparaît au travers des valeurs des indices de polymolécularité
Ip=Mw/Mn ,
inférieurs à 1,5, et des valeurs de masse moléculaire en nombre Mn, proches
des
valeurs théoriques et exprimées par la formule suivante
Mn = Mp 100 Mmol
avec : Mn : mole de monomère
Mp : mole de précurseur de formule (III)
x : conversion du monomère (%)
Mmol : masse moléculaire du monomère (g/mol)
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
26
Exemple 2.1 : homopolymère de styrène
On introduit dans un ballon de 10 m!
- 1 mmol de dithiocarbamate de formule (A) (0,35 g), et
- 40 mmol de styrène (4,16 g).
La température est portée à 95°C et on ajoute 0,03 mmol de peroxyde de
lauroyle
(12,8 mg). La polymérisation dure 12 heures au cours desquelles on additionne
0,02
mmol de peroxyde de lauroyle toutes les deux heures.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C. en milieu THF et en équivalents polystyrène.
L'analyse par G.P.C. de l'homopolymère précédemment obtenu permet de
mesurer sa masse moyenne en nombre Mn. Elle permet également de mesurer sa
masse moyenne en poids (Mw) et donc l'indice de polydispersité Ip,
correspondant au
rapport de Mw sur Mn.
Les résultats sont les suivants
- taux de conversion : 43 %,
- masse moléculaire moyenne Mn = 3500 ,
- indice de polydispersité Ip = 1,1.
Exemple 2.2 : homopolymère d'acrylate de méthyle
On introduit dans un ballon
- 1 mmol de dithiocarbamate de formule (A) (0,35 g), et
- 40 mmol d'acrylate de méthyle (3,44 g).
La température est portée à 80°C et on ajoute 0,03 mmol de peroxyde de
lauroyle
(12,8 mg). La polymérisation dure 6 heures au cours desquelles on ajoute 0,02
mmol de
peroxyde de lauroyle toutes les deux heures.
Le polymère est récupéré par évaporation sous vide des traces de monomère
résiduel et analysé par G.P.C. en milieu THF et en équivalents polystyrène
- taux de conversion : 77 %,
- masse moléculaire moyenne Mn = 3000 ,
- indice de polydispersité Ip - 1,1.
CA 02315914 2000-06-19
WO 99/35177 PCT1P'R98/02867
27
Exemple 2.3 : homopolymère de styrène/cinétique de polymérisation
Une solution mère est préparée en mélangeant
- 5,504 g de styrène,
- 0,231 g de dithiocarbamate de formule (A), et
- 11,4 mg d'azo-bis-isobutyronitrile (AIBN).
Des aliquotes d'environ 0,9 g de cette solution sont répartis dans des tubes
et
portés à 70°C. La polymérisation dans les différents tubes est arrétée
à des temps
différents par refroidissement et introduction de 4 ml de toluène contenant 25
mg
d'hydroquinone.
Pour chaque tube, le polymère est récupéré par évaporation du toluène et du
monomère résiduel ; i! est analysé par GPC en milieu THF. Les masses sont
données
en équivalents polystyrène. Les résultats obtenus sont rassemblés dans le
tableau 1.
Tableau 1
Tem s (min) Conversion Mn I
(~)
63 6, 6 _
770
126 14, 4 1260
240 27,4 1700 1 2
359 37 2 2200 1 2
1443 80,0 4400 1,2
(*) : une partie de la distribution de masses est hors calibration ; le calcul
de
l'indice de polydispersité n'est donc pas possible pour ces échantillons.
Exemple 2.4 : homopolymère d'acrylate d'éthyle/cinétique de polymérisation
Une solution mère est préparée en mélangeant
- 5,533 g d'acrylate d'éthyle,
- 0,241 g de dithiocarbamate de formule (A), et
- 11,3 mg d'azo-bis-isobutyronitrile (AIBN).
Des aliquotes d'environ 10 g de cette solution sont répartis dans des tubés et
portés à 70°C. Les polymérisations dans les tubes sont arrêtées à des
temps différents
par refroidissement et introduction de 4 ml de toluène contenant 25 mg
d'hydroquinone.
CA 02315914 2000-06-19
WO 99/351?? PCT/FR98/0286?
28
Pour chaque tube, le polymère est récupéré par évaporation du toluène et du
monomère résiduel ; il est analysé par GPC en milieu THF. Les masses sont
données
en équivalents polystyrène. Les résultats obtenus sont rassemblés dans le
tableau 2.
Tableau 2
Tem s (min) Conversion Mn 1
(%)
31 1,9 323
49 15,6 2f 00 1,7
101 50, 6 4300 1, 6
150 63,5 5300 1,5
211 77,2 5900 1,6
(*) : une partie de la distribution de masses est hors calibration ; 'e calcul
de
l'indice de polydispersité n'est donc pas possible pour cet échantillon.
Exemple 2.5 : homopolymère de styrène
On introduit dans un ballon
- 2,23 g de styrène,
84,5 mg de dithiocarbamate de formule (B), et
- 4,2 mg de peroxyde de lauroyle.
La température est portée à 110°C. La réaction dure 24 heures au
cours
desquelles plusieurs ajouts de peroxyde de lauroyle sont réalisés
- 4,7 mg après 2 heures,
- 4,1 mg après 4 heures.
Le polymère est récupéré par évaporation sous vide des traces de monomère
résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 98,1 %,
- masse moléculaire moyenne Mn = 8500 ,
- indice de polydispersité Ip = 1,3.
Exemple 2.6 : homopolymère d'acrylate d'éthyle
On introduit dans un ballon
- 2,13 g d'acrylate d'éthyle,
- 84,5 mg de dithiocarbamate de formule (B), et
4,5 mg de peroxyde de lauroyle.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/0286?
29
La température est portée à 80°C. La réaction dure 24 heures au cours
desquelles
plusieurs ajouts de peroxyde de lauroyle sont réalisés
- 5,0 mg après 2 heures,
- 3,8 mg après 4 heures.
Le polymère est récupéré par évaporation sous vide des traces de monomére
résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 97,5 ~o,
- masse moléculaire moyenne Mn = 10 700 ,
- indice de polydispersité Ip = 1,2.
Exemple 2.7 : homopolymère d'acétate de vinyle
On introduit dans un ballon
- 1,82 g d'acétate de vinyle,
- 85,1 mg de dithiocarbamate de formule (B), et
- 8,8 mg de peroxyde de lauroyle.
La température est portée à 80°C. La réaction dure 24 heures au cours
desquelles
plusieurs ajouts de peroxyde de lauroyle sont réalisés :
- 8,1 mg après 2 heures,
- 8,0 mg après 4 heures.
Le polymère est récupéré par évaporation sous vide des traces de monomère
résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 59,2 %,
masse moléculaire moyenne Mn - 4600 ,
indice de polydispersité Ip = 2,0.
Exemple 2.8 : homopolymère de styrène
On introduit dans un ballon
- 2,24 g de styrène,
- 0,113 g de dithiocarbamate de formule (C), et
- 4,5 mg de peroxyde de lauroyle. La température est portée à 110°C. La
réaction
dure 24 heures au cours desquelles plusieurs ajouts de peroxyde de lauroyle
sont
réalisés
- 4,7 mg après 2 heures,
- 3,6 mg après 4 heures.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
Le polymère est récupéré par évaporation sous vide des traces de monomère
résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 98,0 °~,
5 - masse moléculaire moyenne Mn = 7600 ,
- indice de polydispersité Ip = 1,6.
Exemple 2.9 : homopolymère d'acrylate d'éthyle
10 On introduit dans un ballon
- 2,13 g d'acrylate d'éthyle,
- 0,115 g de dithiocarbamate de formule (C), et
- 4,3 mg de peroxyde de lauroyle.
La température est portée à 80°C. La réaction dure 24 heures au cours
desquelles
15 plusieurs ajouts de peroxyde de lauroyle sont réalisés
- 4,6 mg après 2 heures,
- 4,9 mg après 4 heures.
Le polymère est récupéré par évaporation sous vide des traces de monomère
20 résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 95,2 °~,
- masse moléculaire moyenne Mn = 8600 ,
- indice de polydispersité Ip = 1,4.
25 Exemple 2.10 : homopolymère d'acétate de vinyle
On introduit dans un ballon
- 1,84 g d'acétate de vinyle,
- 0,112 g de dithiocarbamate de formule (C), et
30 - 8,3 mg de peroxyde de lauroyle.
La température est portée à 80°C. La réaction dure 24 heures au cours
desquelles
plusieurs ajouts de peroxyde de lauroyle sont réalisés
- 8,8 mg après 2 heures,
- 8,0 mg après 4 heures.
Le polymère est récupéré par évaporation sous vide des traces de monomère
résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 33 %,
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
31
- masse moléculaire moyenne Mn = 2500 ,
- indice de polydispersité Ip = 1,4.
Exemple 2.11 : homopolymère de styrène
On introduit dans un ballon
- 2,23 g de styrène,
- 95,1 mg de dithiocarbamate de formule (D), et
- 4,1 mg de peroxyde de lauroyle.
La température est portée à 110°C. La réaction dure 24 heures au
cours
desquelles plusieurs ajouts de peroxyde de lauroyle sont réalisés
- 4,2 mg après 2 heures,
- 3,9 mg après 4 heures.
Le polymère est récupéré par évaporation sous vide des traces de monomère
résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 97,6 ~,
- masse moléculaire moyenne Mn = 6800 ,
indice de polydispersité Ip = 2,0.
Exemple 2.12 : homopolymère d'acrylate d'éthyle
On introduit dans un ballon
- 2,15 g d'acrylate d'éthyle,
- 98,7 mg de dithiocarbamate de formule (D), et
4,1 mg de peroxyde de lauroyle.
La température est portée à 80°C. La réaction dure 24 heures au cours
desquelles
plusieurs ajouts de peroxyde de lauroyle sont réalisés
- 4,5 mg après 2 heures,
- 4,1 mg après 4 heures.
Le polymère est récupéré par évaporation sous vide des traces de monomère
résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 91,8 °~,
- masse moléculaire moyenne Mn = 7900 ,
- indice de polydispersité Ip - 1,6.
CA 02315914 2000-06-19
WO 99135177 PCT/FR98/02867
3z
Exemple 2.13 : homopolymère de styrène
On introduit dans un ballon
- 2,23 g de styrène,
- 87 mg de dithiocarbamate de formule (E), et
- 4,0 mg de peroxyde de lauroyle.
La température est portée à 110°C. La réaction dure 24 heures au
cours
desquelles plusieurs ajouts de peroxyde de lauroyle sont réalisés
- 4,6 mg après 2 heures,
- 4,6 mg après 4 heures.
Le polymère est récupéré par évaporation sous vide des traces de monomère
résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 97,1 %,
- masse moléculaire moyenne Mn = 8300 ,
- indice de polydispersité Ip = 1,4.
Exemple 2.14 : homopolymère d'acrylate d'éthyle
On introduit dans un ballon
- 2,13 g d'acrylate d'éthyle,
- 88,5 mg de dithiocarbamate de formule (E), et
- 4,0 mg de peroxyde de lauroyle.
La température est portée à 80°C. La réaction dure 24 heures au cours
desquelles
plusieurs ajouts de peroxyde de lauroyle sont réalisés :
- 4,5 mg après 2 heures,
- 4,5 mg après 4 heures.
Le polymère est récupéré par évaporation sous vide des traces de monomère
résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 94,4 %,
masse moléculaire moyenne Mn = 9700 ,
- indice de polydispersité Ip = 1,2.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
33
Exemple 2.15 : homopolymère d'acétate de vinyle
On introduit dans un ballon
- 1,83 g d'acétate de vinyle,
- 97,4 mg de dithiocarbamate de formule (E), et
- 8,1 mg de peroxyde de lauroyle.
La température est portée à 80°C. La réaction dure 24 heures au cours
desquelles
plusieurs ajouts de peroxyde de lauroyle sont réalisés
- 8,5 mg après 2 heures,
- 8,3 mg après 4 heures.
Le polymère est récupéré par évaporation sous vide des traces de monomère
résiduel et analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 23,4 %,
- masse moléculaire moyenne Mn = 2100 ,
- indice de polydispersité Ip = 1,35.
Exemple 2.16 : homopolymère d'acétate de vinyle
On introduit dans un tube de verre:
- 0,015 mmol d'AIBN (2,4 mg),
- 10 mmol d'acrylate d'éthyle (1 g), et
- 0,13 mmol de dithiocarbamate de formule (F) (33,8 mg)
Le tube est fermé par un bouchon à vis et est ensuite immergé dans un bain
d'huile
préchauffé à 80°C. La polymérisation dure 24 heures.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
obtenus
sont les suivants
- taux de conversion : 61 %,
- masse molaire moyenne en nombre Mn = 5600,
- indice de polydispersité Ip = 1,4.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
34
Exemple 2.17 : homopolymère du styrène
On introduit dans un tube de verre
- 0,014 mmol d'AIBN (2,3 mg),
- 10 mmol de styrène (1,03 g), et
- 0,12 mmol de dithiocarbamate de formule (F) (32 mg).
Le tube est fermé par un bouchon à vis et est ensuite immergé dans un bain
d'huile
préchauffé à 115°C. La polymérisation dure 24 heures.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
obtenus
sont les suivants
- taux de conversion : 95 %,
- masse molaire moyenne en nombre Mn = 7200,
- indice de polydispersité Ip = 1,19.
Exemple 2.18 : homopolymère du mèthacrylate de méthyle
On introduit dans un tube de verre
- 0,012 mmol d'AIBN (2 mg).
- 10 mmol d'acrylate d'éthyle (1 g),
- 0,12 mmol de dithiocarbamate de formule (F) (31,7 mg) et
- 1 g de méthyléthyl cétone.
Le tube est fermé par un bouchon à vis et est ensuite immergé dans un bain
d'huile
préchauffé à 80°C. La polymérisation dure 24 heures.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
obtenus
sont les suivants
- taux de conversion : 96 %,
- masse molaire moyenne en nombre : Mn = 13900,
- indice de polydispersité Ip = 1,64.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
Exemple 2.19 : homopolymère de l'acétate de vinyle
On introduit dans un tube de verre:
- 0,026 mmol d'AIBN (2 mg),
5 - 10 mmol d'acétate de vinyle (0,86 g), et
- 0,12 mmol de dithiocarbamate de formule (G) (48 mg).
Le tube est fermé par un robinet à vis et est ensuite immergé dans un bain
d'huile
préchauffé à 80°C. La polymérisation dure 24 heures.
10 Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 21 %,
- masse molaire moyenne en nombre Mn = 1140,
15 - indice de polydispersité Ip = 2,32.
Exemple 2.20 : homopolymère de l'acrylate d'éthyle
On introduit dans un tube de verre:
20 - 0,013 mmol d'AIBN (2,1 mg),
- 10 mmol d'acrylate d'éthyle (1 g), et
- 0,12 mmol de dithiocarbamate de formule (G} (48 mg).
Le tube est fermé par un bouchon à vis et est ensuite immergé dans un bain
d'huile
25 préchauffé à 80°C. La polymérisation dure 24 heures.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résulats
sont les
suivants
- taux de conversion : 62 %,
30 - masse molaire moyenne en nombre Mn= 7500,
- indice de polydispersité Ip = 1,39.
Exemple 2.21 : homopolymère du styrène
35 On introduit dans un tube de verre
- 0,013 mmol d'AIBN (2,1 mg),
- 10 mmol de styrène (1,04 g), et
- 0,12 mmol de dithiocarbamate de formule (G) (48 mg).
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/OZ867
36
Le tube est fermé par un bouchon à vis et est ensuite immergé dans un bain
d'huile
préchauffé à 115°C. La polymérisation dure 24 heures.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène.
- taux de conversion : 95 %,
- masse molaire moyenne en nombre Mn = 5300,
- indice de polydispersité Ip = 1,28.
Exemple 2.22 : homopolymère de l'acétate de vinyle
On introduit dans un tube de verre:
- 0,026 mmol d'AIBN (4,2 mg),
- 10 mmol d'acétate de vinyle (0,86 g), et
- 0,13 mmol de dithiocarbamate de formule (H) (48 mg).
Le tube est fermé par un bouchon à vis et est ensuite immergé dans un bain
d'huile
préchauffé à 80°C. La polymérisation dure 24 heures.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 60 %,
- masse molaire moyenne en nombre Mn = 4700,
- indice de polydispersité Ip = 1,91.
Exemple 2.23 : homopolymère de l'acrylate d'éthyle
On introduit dans un tube de verre:
- 0,013 mmol d'AIBN (2,1 mg),
- 10 mmol d'acrylate d'éthyle (1 g), et
- 0,13 mmol de dithiocarbamate de formule (H) (48 mg).
Le tube est fermé par un bouchon à vis et est ensuite immergé dans un bain
d'huile
préchauffé à 80°C. La polymérisation dure 24 heures.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 72 %,
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
37
- masse molaire moyenne en nombre Mn = 6000,
- indice de polydispersité Ip =1,48.
Exemple 2.24 : homopotymère du styrène
On introduit dans un tube de verre:
- 0,013 mmoi d'AIBN (2,1 mg),
- 10 mmol de styrène (1,04 g), et
- 0,12 mmol de dithiocarbamate de formule (H) (48 mg).
Le tube est fermé par un bouchon à vis et est ensuite immergé dans un bain
d'huile
préchauffé à 110°C. La polymérisation dure 24 heures.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 87 %,
- masse molaire moyenne en nombre Mn = 8200,
- indice de polydispersité Ip = 1,23.
Exemple 2.25 : homopolymère de l'acétate de vinyle
On introduit dans un tube de verre:
- 0,003 mmol d'AIBN (0,6 mg),
- 10 mmol d'acétate de vinyle (1 g), et
- 0,14 mmol de dithiocarbamate de formule (I) (48 mg).
Le tube est connecté à une rampe à vide, plongé dans l'azote liquide, puis
trois
cycles "congélation I vide I retour à l'ambiante" sont effectués sur le
contenu du tube afin
de le dégazer. Celui-ci est ensuite scellé sous vide. Après retour à
l'ambiante, il est
immergé dans un bain d'huile préchauffé à 80°C. La polymérisation dure
28 heures.
Le polymère est récupéré par ouverture du tube puis évaporation des traces de
monomère résiduel. II est analysé par G.P.C en milieu THF et en équivalents
polystyrène.
Les résultats sont les suivants
- taux de conversion : 6,6
- masse molaire moyenne en nombre Mn = 890
- indice de polydispersité Ip = 1,24
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
38
Exemple 2.26 : homopolymère de l'acrylate d'éthyle
On introduit dans un tube de verre:
- 0,003 mmol d'AIBN (0,6 mg),
- 10 mmol d'acrylate d'éthyle (1 g), et
- 0,13 mmol de dithiocarbamate de formule (I) (42 mg).
Après remplissage, le tube est dégazé et scellé sous vide de manière analogue
à
l'exemple 2.25. La polymérisation dure 64 heures à 80°C.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 69 %.
- masse molaire moyenne en nombre Mn = 9500
- indice de polydispersité Ip = 1,2.
Exemple 2.27 : homopolymère du styrène
On introduit dans un tube de verre
- 9,6 mmol de styrène (1 g) et
- 0,12 mmol de dithiocarbamate de formule (!) (40,2 mg)
Après remplissage, le tube est dégazé et scellé sous vide de manière analogue
à
l'exemple 2.25. La polymérisation dure 72 heures à 110°C.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyréne. Les résultats
sont les
suivants
- taux de conversion : 70
- masse molaire moyenne en nombre Mn = 6200
- indice de polydispersité fp = 1,14
Exemple 2.28 : homopolymère de l'acétate de vinyle
On introduit dans un tube de verre
- 0,003 mmol d'AIBN (0,6 mg),
- 10 mmol d'acétate de vinyle (1 g), et
- 0,15 mmol de dithiocarbamate de formule (J) (56 mg).
CA 02315914 2000-06-19
WO 99/35177
39
PCT/FR98/02867
Après remplissage, le tube est dégazé et scellé sous vide de manière analogue
à
l'exemple 2.25. La polymérisation dure 27 heures à 80°C.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 25,7
- masse molaire moyenne en nombre Mn = 2200
- indice de polydispersité ip = 1,66
Exemple 2.29: homopolymère de l'acrylate d'éthyle
On introduit dans un tube de verre
- 0,003 mmol d'AIBN (0,6 mg},
- 10 mmol d'acrylate d'éthyle (1 g) et
- 0,13 mmol de dithiocarbamate de formule (J) (48 mg).
Après remplissage, le tube est dégazé et scellé sous vide de manière analogue
à
l'exemple 10. La polymérisation dure 64 heures à 80°C.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 76
- masse molaire moyenne en nombre Mn = 6700
- indice de polydispersité Ip = 1_,2.
Exemple 2.30 : homopolymère de l'acétate de vinyle
On introduit dans un tube de verre:
- 0,016 mmol d'AIBN (2,7 mg),
- 50 mmol d'acétate de vinyle (4,3 g), et
- 0,62 mmol de dithiocarbamate de formule (K) (251 mg).
Après remplissage, le tube est dégazé et scellé sous vide de manière analogue
à
l'exemple 2.25. La polymérisation dure 41 heures à 80°C.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 47,8
CA 02315914 2000-06-19
WO 99/35177
- masse molaire moyenne en nombre Mn = 5000
- indice de poiydispersité Ip = 1,43
Exemple 2.31 : homopolymère de l'acrylate d'éthyle
5
On introduit dans un tube de verre
- 0,003 mmol d'AIBN (0,56 mg),
- 10 mmol d'acrylate d'éthyle (1 g), et
- 0,12 mmol de dithiocarbamate de formule (K) (50 mg).
PCT/FR98/OZ867
Après remplissage, le tube est dégazé et scellé sous vide de manière analogue
à
!'exemple 2.25. La polymérisation dure 21 heures à 80°C
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 67 %.
- masse molaire moyenne en nombre Mn = 5900
- indice de polydispersité Ip = 1,22.
Exemple 2.32 : homopolymère du styrène
On introduit dans un ballon
- 0,026 mmol de peroxyde de lauroyle (4,3 mg),
- 21,3 mmol de styrène (2,22 g), et
- 0,27 mmol de dithiocarbamate de formule (K) (108 mg).
Le ballon est surmonté d'un réfrigérant, placé sous courant d'azote et immergé
dans un bain d'huile préchauffé à 115°C. Deux nouveaux ajouts de
peroxyde de lauroyle
sont effectués au bout de deux et quatre heures de réaction (0,026 mmol à
chaque fois).
La réaction est stoppée au bout de 24 heures.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 98
- masse molaire moyenne en nombre Mn = 6700
- indice de polydispersité Ip=1,7.
CA 02315914 2000-06-19
WO 99/35177
41
Exemple 2.33 : homopoiymère de l'acétate de vinyle
On introduit dans un tube de verre
- 0,004 mmol d'AIBN (0,6 mg),
- 11,6 mmol d'acétate de vinyle (1 g), et
- 0,146 mmol de dithiocarbamate de formule (K) (49,8 mg).
PCT/FR98/02867
Après remplissage, le tube est dégazé et scellé sous vide de manière analogue
à
l'exemple 2.25. La polymérisation dure 100 heures à 60°C.
Le polymère est récupéré par évaporation des traces de monomère résiduel et
analysé par G.P.C en milieu THF et en équivalents polystyrène. Les résultats
sont les
suivants
- taux de conversion : 71,4
- masse molaire moyenne en nombre Mn = 5400
- indice de polydispersité ip= 1,29
3 - SYNTHESE DE COPOLYMERES A BLOCS DE FORMULE IA
Exemple 3.1 : copolymère à blocs p(AEt-b-St)
On prépare une solution mère à partir de
- 4,01 g d'acrylate d'éthyle,
- 0,176 g de dithiocarbamate de formule (A), et
- 8,8 mg d'AIBN.
On introduit 1,06 g de cette solution dans un ballon. La température est
portée à
70°C. La polymérisation dure 24 heures au bout desquelles les traces de
monomère
résiduel sont éliminées par évaporation.
Une petite fraction du polymère obtenu est prélevée et analysée en GPC en
milieu
THF et en équivalents polystyrène
- taux de conversion : 81,5 %,
- masse moléculaire moyenne Mn = 7300 ,
- indice de polydispersité Ip = 1,4.
On introduit dans le ballon
- 2,08 g de styrène, et
- 4,4 mg d'AIBN.
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/02867
42
La température est portée à 70°C. La polymérisation dure 40
heures.
Les traces de monomère résiduel sont éliminées par évaporation et le
copolymère
est analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 93,8 %,
- masse moléculaire moyenne Mn = 20 100 ,
- indice de poiydispersité Ip = 1,2.
Exemple 3.2 : copolymère à blocs p(AEt-b-AVM)
On introduit 1,38 g de la solution mère préparée pour l'exemple 3.1 dans un
ballon.
La température est portée à 70°C. La polymérisation dure 24 heures au
bout desquelles
les traces de monomère résiduel sont éliminées par évaporation.
Une petite fraction du polymère obtenu est prélevée et analysée en GPC en
milieu
THF et en équivalents polystyrène
- taux de conversion : 72,4 %,
- masse moléculaire moyenne Mn = 5100 ,
- indice de polydispersité Ip = 1,4.
On introduit dans le ballon
- 1,72 g d'acétate de vinyle, et
- 4,2 mg d'AIBN.
La température est portée à 70°C. La polymérisation dure 40
heures.
Les traces de monomère résiduel sont éliminées par évaporation et le
copolymère
est analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 15,6 %,
- masse moléculaire moyenne Mn = 7200 ,
- indice de polydispersité Ip = 1,5.
Exemple 3.3 : copolymère à blocs p(St-b-AEt)
On prépare une solution mère à partir de
- 4,01 g de styrène,
- 0,168 g de dithiocarbamate de formule (A), et
- 8,3 mg d'AIBN.
CA 02315914 2000-06-19
WO 99/35177 PC'T/FR98/02867
43
1,00 g de cette solution est prélevé et introduit dans un ballon. La
température est
portée à 70°C. La polymérisation dure 24 heures au bout desquelles les
traces de
monomère résiduel sont éliminées par évaporation.
On prélève une petite fraction du polymère obtenu on l'analyse en GPC en
milieu
THF et en équivalents polystyrène
taux de conversion : 86,9 %,
- masse moléculaire moyenne Mn = 4500 ,
- indice de polydispersité Ip = 1,3.
On introduit dans le ballon
- 1,92 g d'acrylate d'éthyle, et
- 3,7 mg d'AIBN.
La température est portée à 70°C. La polymérisation dure 40
heures.
Les traces de monomère résiduel sont éliminées par évaporation et le
copolymère
est analysé par GPC en milieu THF et en équivalents polystyrène
- taux de conversion : 94.8 %.
- masse moléculaire moyenne Mn = 14 100 ,
- indice de polydispersité Ip = 1,7.
Exemple 3.4 : copolymère à blocs p(AEt-b-St)
On prépare une solution mère de
- 7,5 ml d'acrylate d'éthyle,
- 3,9 mg d'AIBN (2,4.10 5 mole).
On introduit 1,08 ml de cette solution dans un tube en verre. Puis, on ajoute
50,5
mg (1,25.10 mole) de précurseur de formule K. Le contenu du tube est dégazé
par
trois cycles "congélation-vide-retour à l'ambiante", puis scellé sous vide. Le
tube est alors
placé pendant 21 heures dans un bain d'huile maintenu à 80°C. A la fin
de la réaction, le
tube est ouvert et les résidus de monomère sont éliminés par évaporation sous
vide.
Les caractéristiques du polymère obtenu sont les suivantes
- taux de conversion : 67,4
- masse molaire moyenne Mn : 5500
- indice de polydispersit é: Ip=1,22
On introduit dans un tube en verre
CA 02315914 2000-06-19
WO 99/35177 PCT/FR98/OZ867
44
- 0,75 g de styrène,
- 1 ml de toluène,
- 1,65 mg d'AIBN,
- 0,5 g de polyacrylate d'éthyle obtenu ci-dessus.
Après un dégazeage identique à celui décrit ci-dessus, le tube est scellé sous
vide.
Après 72 heures à 110°C, le tube est ouvert et les résidus de monomère
sont éliminés
par évaporation sous vide.
Les caractéristiques du copolymère obtenu sont les suivantes
- taux de conversion : 49,4
- masse molaire moyenne Mn : 8500
- indice de polydispersité : Ip=1,34
Exemple 3.5 : copolymère à blocs p(AEt-b-St)
On prépare une solution mère de
- 5,4 ml d'acrylate d'éthyle,
- 3 mg d'AIBN (2,4.10 5 mole).
On introduit 1,08 ml de cette solution dans un tube en verre. Puis, on ajoute
41,8
mg (1,1.10 mole) de précurseur de formule I. Le contenu du tube est dégazé par
trois
cycles "congélation-vide-retour à l'ambiante", puis scellé sous vide. Le tube
est alors
placé pendant 21 heures dans un bain d'huile maintenu à 80°C. A la fin
de la réaction, le
tube est ouvert et les résidus de monomère sont éliminés par évaporation sous
vide.
Les caractéristiques du polymère obtenu sont les suivantes
- taux de conversion : 69,7
- masse molaire moyenne Mn : 7050
- indice de polydispersité : Ip=1,2
On introduit dans un tube en verre
- 1 g de styrène,
- 1 ml de toluène,
- 2 mg d'AIBN,
- 0,72 g de polyacrylate d'éthyle obtenu ci-dessus.
Après un dégazeage identique au précédent, le tube est scellé sous vide. Après
72
heures à 110°C, le tube est ouvert et les résidus de monomère sont
éliminés par
évaporation sous vide.
CA 02315914 2000-06-19
WO 99/35177
Les caractéristiques du copolymère obtenu sont les suivantes
- taux de conversion : 26,1 %,
- masse molaire moyenne Mn : 12900,
- indice de polydispersité : Ip=1,29.
PCT/FR98/02867
5