Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02349918 2001-05-03
Wb 00/27778 PCT/FR99/02700
- 1 -
PROCÉDÉ DE DEBOUBLEMENT D'UN MÉLANGE RACÉMIQUE D'ALDÉHYDES
La présente inventian concerne un procédé de dédoublement d'un
mélange racémique d'aldéhydes utilisables, sous leurs formes optiquement
pures dans la préparation de catalyseurs utiles dans les réactions
d'hydroformylation des oléfines.
On connaît dans 1a technique quelques catalyseurs appropriés
utilisables dans l'hydroformylation des oléfines : ces catalyseurs sont des
complexes d'une phosphine chirale avec un métal de transition tel que ie
rhodium ou le platine. Parmi les phosphines chirales développées jusqu'à
présent et jouant le rôle de ligand du rhodium ou du_ platine, on distingue
les
phosphines dans lesquelles le centre chiral est porté par le phosphore (telles
que la (2-méthoxyphényl)(méthyl)(phényl)phosphophine) dites de classe 1, les
phosphines dans lesquelles le centre chiral est porté par une chaîne carbonée
(telles que la (diphényl)(2-isopropyl-5-méthylphényl)phosphine) dites de
classe 2, et les phosphines de classe 3 portant un centre chiral sur le
1s phosphore et sur une chaine carbonée, telles que par exemple la phosphine
suivante
Phi
où Men représente
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
2
Le procédé de (invention permet notamment le dédoublement des
aldéhydes de formule A suivante, lesquels portent au moins deux centres
d'asymétrie, le premier sur le phosphore et le second sur le carbone en
position 4
dans laquelle
R~, R4, RS et R6, identiques ou différents, représentent un atome
d'hydrogène; un radical hydrocarboné aliphatique, éventuellement substitué,
10 de 1 à 40 atomes de carbone, saturé ou insaturé, dont la chaïne
hydrocarbonée est éventuellement interrompue par un hétéroatome; un radical
carbocyclique ou hétérocyclique, saturé, insaturé oû aromatique,
monocyclique ou polycyclique, éventuellement substitué; ou un radical
hydrocarboné aliphatique saturé ou insaturé dont la chaîne hydrocarbonée est
15 éventuellement interrompue par un hétéroatome et porteur d'un radical
carbocyclique ou hétérocyclique tel que défini ci-dessus, ledit radical étant
éventuellement substitué ;
ou bien R4 et Rs forment ensemble avec les atomes de carbone qui
les portent un monocycle carbocyclique saturé ou insaturé éventuellement
2 o substitué ayant de préférence de 5 à 7 atomes de carbone ;
R2 représente un atome d'hydrogène ou le radical X ;
R3 représente 1e radical X ou le radical Y ;
étant entendu qu'un et un seul des substituants RZ et R3 représente
le radical X ;
25 X étant choisi panai un radical carbocyclique ou hétérocyclique
aromatique monocyclique ou bicycüque ayant de 2 à 20 atomes de carbone ;
CA 02349918 2001-05-03
Wa 00/27778 PC'T/FR99/02700
3
un radical 1-alcényle présentant éventuellement une ou plusieurs insaturations
supplémentaires dans la chaïne hydrocarbonée et ayant de 2 à 12 atomes de
carbone ; un radical 1-alcynyle présentant éventuellement une ou plusieurs
insaturations supplémentaires dans la chaine hydrocarbonée et ayant de 2 à
12 atomes de carbone ; un radical -CN ; [(C,-C,2)alcoxy]carbonyle ; et [(Cs-
C,e)aryloxy]carbonyle ;
Y prenant l'une quelconque des significations de R, à l'exception
d'un atome d'hydrogène.
Ces phosphines appartiennent à la classe 3.
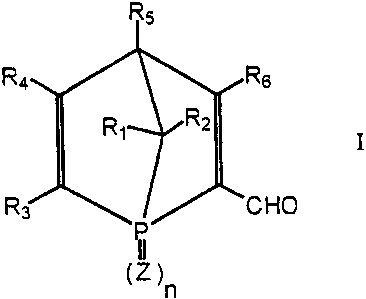
Plus généralement le procédé de l'invention permet le
dédoublement d'aldéhydes de formule I
R4
I
R~ ~O
(Z )n
dans laquelle
R~ à R6 sont tels que définis ci-dessus pour la formule A;
n représente 0 ou 1; et
Z représente un atome d'oxygène ou de soufre.
Les aldéhydes de formule A correspondent aux composés de
2 o formule I dans laquelle n représente 0.
Les aldéhydes de formule A présentent une structure 1-
phosphanorbomadiène rigide qui fixe la configuration relative des deux
centres stéréogènes : en conséquence, ces composés se présentent, sous la
forme de mélange racémique, de deux stéréoisomères seulement (malgré la
2 s présence de deux centres asymétriques).
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
4
Les aldéhydes de formule I sont plus particulièrement utiles, sous
leurs formes optiquement pures, comme ligands de métaux de transition pour
la préparation de complexes catalyseurs dans les réactions d'hydroformylation
d'oléfines, d'où fintérèt d'un procédé de dédoublement approprié.
Plusieurs essais de dédoublement par chromatographie sur colonne
chirale n'ayant pas abouti, les inventeurs ont été amenés à mettre au point le
procédé de dédoublement de l'invention.
Ce procédé comprend les étapes consistant à
a) faire réagir ledit composé de formule I avec un composé
s o optiquement actif de formule l l
A2 A3
A~ A4
II
HE GH
dans laquelle
le groupe >C(A~)(A2) est distinct du groupe >C(A3)(A4);
A,, A2, A3, A4 étant indépendamment choisis parmi un atome
d'hydrogène; un groupe (C~-C~o)alkyle; un groupe (Cs-C~o)aryle
éventuellement substitué une ou plusieurs fois par (C,-C~o)alkyle, (C~-
C,o)alcoxy, amino, (C~-C~o)alkylamino, di(C,-C~o)alkylamino ou un atome
2 o d'halogène; un groupe (C3-C8)cycloalkyle éventuellement substitué une ou
plusieurs fois par (C,-C~o)alkyle, (C,-C,o)alcoxy, amino, (C~-C~o)alkylamino,
di(C,-C,o)alkylamino ou un atome d'halogène; un hétérocycle de 5 à 7
chaînons, saturé, insaturé ou aromatique, comprenant 1 à 3 hétéroatomes
choisis parmi 0, N et S et éventuellement substitué une ou plusieurs fois par
(C~-C~o)alkyle, (C~-C~o)alcoxy, amino, (C,-C~o)alkylamino, di(C~-
C~o)alkylamino
ou un atome d'halogène; ou bien
A~ et A3 forment ensemble une chaine (C2-C6)alkylène
éventuellement substitué une ou plusieurs fois par (C~-C~o)alkyle, (C~-
C,o)alcoxy, amino, (C,-C,o)alkylamino, di(C,-C~o)alkylamino ou un atome
3 0 d'halogène; ou bien
CA 02349918 2001-05-03
WO OOI27778 PCT/FR99/02700
A~ et A3 ensemble avec les atomes de carbone qui les portent
forment un hétérocycle oxygéné de 5 à 7 chaînons saturé comprenant
éventuellement un à deux hétéroatomes supplémentaires choisis parmi 0, N et
S, ledit hétérocycle étant éventuellement substitué une ou plusieurs fbis par
5 (C~-C~o)alkyle, (C~-C,o)alcoxy, amino, (C~-C~o)alkylamino, di(C~-
C~o}alkylamino,
hydroxy ou un atome d'halogène; et
E et G représentent
- soit tous les deux un atome d'oxygène,
- soit indépendamment un radical divalent -NRo- dans lequel les
groupes Ro représentent indépendamment un atome d'hydrogène, un radical
(C,-C~o)alkyle, un radical (C6-C~o)aryie éventuellement substitué par
C1o)alkyle; ou un radical (C6-C,o)aryl-(C~-C,o)alkyle dans lequel la partie
aryle
est éventuellement substitué par un radical (C~-C~o) alkyle; de façon à former
un composé de formule III
1
dans laquelle R, à R6, A, à A4, E, G, Z et n sont tels que définis ci-dessus,
qui
est un mélange de diastéréoisomères;
b) séparer par une méthode appropriée les diastéréoisomères de
formule III; et
c) régénérer la fonction aldéhyde de chacun des diastéréoisomères
de formule III, par hydrolyse de la fonction acétal en milieu acide.
CA 02349918 2001-05-03
WO 00/27778 PCT/PR99/02700
6
Selon un premier mode de réalisation particulièrement préféré,
l'invention permet le dédoublement des composés de formule I dans laquelle
R,, R4, R5, R6 représentent indépendamment un atome d'hydrogène
ou bien un radical T choisi parmi
~ un râdical hydrocarboné aliphatique, saturé ou insaturé, ayant de
1 à .~12 atomes de carbone, dont la chaîne hydrocarbonés est
éventuellement interrompue par un hétéroatome choisis parmi 0,
N et S;
un radical carbocyclique monocyclique saturé ou comprenant 1
l o ou 2 insaturations dans le cycle; ayant de 3 à 8 atomes de
carbone; .
un radical carbocyclique bicyclique saturé ou insaturé constitué
de 2 monocycles condensés l'un à l'autre, chaque monocycle
comprenant éventuellement 1 à 2 insatùrations et présentant de
3 à 8 atomes de carbone;
un radical carbocyclique aromatique mono- ou bicycüque en C6-
un radical hétérocyclique monocyclique saturé, insaturé ou
aromatique de 5 à 6 chainons comprenant 1 à 3 hétéroatomes
2o choisis indépendamment parmi N, 0 et S;
un radical hétérocyclique bicyclique saturé, insaturé ou
aromatique constitué de deux monocycles de 5 à 6 chaînons
condensés l'un à l'autre, chaque monocycle comprenant 1 à 3
hétéroatomes choisis indépendamment parmi 0, N et S; et
~ un radical hydrocarboné aliphatique saturé ou insaturé, ayant de
1 à 12 atomes de carbone, dont la chaîne hydrocarbonée porte
un radical monocyclique carbocyclique ou hétérocyclique tel que
défini ci-dessus,
ledit radical T étant éventuellement substitué;
3 o RZ et R3 sont tels que définis ci-dessus pour la formule I étant
entendu que
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
7
Y prend l'une quelconque des significations données ci-dessus pour
R, à l'exclusion d'un atome d'hydrogène; et
X est choisi parmi un groupe alcényle en (C2-Cs), un groupe
alcynyle en (C2-Cs), phényle, naphtyle, thiényle, furyle, pyrrolyle,
imidazolyle,
pyrazolyle, thiazolyle, pyridyle, pyrazinyle, pyridazinyle, isothiazoiyle,
isoxazolyle, benzofuryle, benzothiényle, indofyle, isoindolyle, indolizinyle,
indazolyle, purinyle, quinolyle, isoquinolyle, benzothiazolyle et ptéridinyle
; et
Z et n sont tels que définis ci-dessus pour la formule 1.
La nature du substituant porté par T est très variable. Parmi les
lo substituants les plus utilisés, on peut mentionner : (C,-C6)alkyle;(C2
C6)alcényle; (C,-Cs)alcoxy; (CZ-C6)acyle; un radical choisi parmi : -Ra-OH, ~-
Ra
COORb, -Ra-N02, -Râ CN, -Ra-N{Rb)2, -Ra-SH.. -Râ hal. -RaCF3 et -0-CF3 (dans
lesquels Ra représente une liaison ou (C,-Cs)alkylène, Rb identiques ou
différents, représentent un atome d'hydrogène aù (C,-C6)alkyle; et hal
représente halogène);
ou bien encore le radical
(Rd)m
Rc
où Rd est choisi parmi (C,-C6)alkyle; {C2-C6)alcényle; (C,-C6)alcoxy; (C2-
Cs)aCyle; -Ra-OH; -Ra-COORb; -Ra-N02; -Ra-CN; -Ra-N(Rb)2 ;
-Ra SH; -Ra-hal; -Rà CF3 et -O-CF3 (dans lesquels Ra, Rb et hal sont tels que
définis ci-dessus);
m représente un entier compris entre 0 et 5;
Rç représente une liaison; (C,-C5)alkyiène;-0- ;-C00-; -NRb-; -S-;
-S02- ; Rb étant tel que défini ci-dessus.
Selon un second mode préféré de réalisation, on procède au
dédoublement des composés de formule I dans laquelle
CA 02349918 2001-05-03
wo oom~~s Pc~r~Rmoa~oo
a
R~ et R4 représentent indépendamment un atome d'hydrogène; un
groupe (C,-Cs)alkyle; un groupe phényle éventuellement substitué une ou
plusieurs fois par (C~-C6)alkyle, (C~-C6)alcoxy, amino, (C~-Cs)alkylamino,
di(C~-
C6)alkylamino ou un atome d'halogène; _ un groupe naphtyle éventuellement
substitué une ou,plusieurs fois par (C~-C6)alkyle, (C~-C6)alcoxy, amino, (C~-
C6)alkylamino, di(C~-C6)alkylamino ou un atome d'halogène;
R5 représente un atome d'hydrogène ou un groupe (C~-C6)alkyle;
R6 représente un atome d'hydrogène; un groupe (C,-C6)alkyle; (C3
C8)cycloalkyle éventuellement substitué une ou plusieurs fois par (C~
Zo C6)alkyle, (C,-C6)aicoxy, amino, (C~-C6)alkyl-amino, di(C~-C6)alkylamino ou
un
atome d'halogène; ou phényle éventuellement substitué une ou plusieurs fois
par (C1-C6)alkyle, (C~-C6)alcoxy, amino, (C~-C6)alkylamino, di(C,-
C6)alkylamino
ou un atome d'halogène;
R2 représente un atome d'hydrogène ou le radical X;
R3 représente le radical X ou le radical Y;
étant entendu qu'un et seul des substituants R2 et R3 représente le
radical X;
X représente un groupe alcényle en C2-C6; un groupe alcynyle en
CZ-C6; ou un radical phényle; et
2o Y représente l'une quelconque des significations données ci-dessus
pour R~ à l'exclusion d'un atome d'hydrogène ;
n et Z étant tels que définis ci-dessus pour la formule I.
Selon un troisième mode de réalisation préféré, on réalise le
dédoublement de composés de formule I tels que définis ci-dessus pour le
second mode de réalisation, où
- soit R, et R2 représentent un atome d'hydrogène ; R3 représente
phényle éventuellement substitué une ou plusieurs fois par (C,-Cg}alkyle ; (C,
Cs)alcoxy ; amino ; (C,-Cs)alkylamino ; di(C,-Cs)alkylamino ou un atome
3 o d'halogène ;
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
9
- soit R, et R3 représentent indépendamment phényie
éventuellement substitué une ou plusieurs fois par (C,-Cs)alkyle ; (C,-
Cs)alcoxy ; amino ; (C,-Cs)alkylamino ; di(C,-Cs)alkylamino ou un atome
d'halogène ; et RZ représente phényle.
Plus généralement, lorsque R,, R4, R5, R6 et Y comprennent un
radical hydrocarboné aliphatique interrompu par un hétéroatome,
l'hétéroatome est choisi parmi un atome d'oxygène, un atome d'azote, un
atome de soufre ou un atome de phosphore, les atomes d'oxygène et d'azote
.étant préférés. Lorsque l'atome qui interrompt la chaîne est l'azote. celui-
ci est
substitué par un atome d'hydrogène ou un radical hydrocarboné en C,-C,o
saturé ou insaturé, de préférence (C,-C,o)alkyle. Lorsque l'atome qui
interrompt la chaîne est le phosphore, celui-ci est substitué par (i)
l'hydrogène
ou un radical hydrocarboné en Cs-Cep, de préférence' (C,-C,o)alkyle ou par (ü)
un groupe oxo.
Par alkyle, on entend une chaîne hydrocarbonée aliphatique
linéaire ou ramifiée. De mème, dans les radicaux alcoxy, arylalkyle,
alkylamino
et dialkylamino, les parties alkyle représentent des chaînes k~ydrocarbonées
linéaires ou ramifiées.
2o Des exemples de radicaux (C6-C~8)aryle sont notamment phényle,
naphtyle, phénanthryle et anthryle.
Les radicaux cycloalkyle sont par exemple cyclopropyle,
cyclobutyle, cyclopentyle, cyclohexyle, cycloheptyle et cyclooctanyle.
Lorsque A~ et A3 forment ensemble avec les atomes de carbone qui
les portent un hétérocycle oxygéné de 5 à 7 chaïnons comprenant
éventuellement 1 à 2 hétéroatomes supplémentaires, celui-ci est de
préférence le reste d'un glucide tel que par exemple fa-D-glucose.
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
Lorsque l'un de R,, R4, R5, R6, X ou Y représente un radical
polycyclique (par exemple bicyclique), on préfère que ce radical comprennent
au moins deux cycles condensés l'un à l'autre, c'est-à-dire deux cycles ayant
au moins deux atomes en commun. Les composés polycycliques sont
5 généralement tels que le nombre d'atomes de carbone dans chaque cycle
varie de 3 à 7, de~préférence 5 à 6.
Comme exemple de radical carbocyclique monocyclique saturé, on
peut citer les cyclopropane, cyclobutane, cyclopentane, cyciooctane et
cycioheptane.
1o En tant que radical carbocyclique bicyclique, on préfère les dérivés
du naphtalène et de l'indène saturés ou présentant une ou plusieurs
insaturations.
En tant que radical carbocyclique aromatique, on préfère le
benzène et le naphtalène.
En tant que radical hétérocylique monocyclique, on préfère les
dérivés saturés ou insaturés des thiophène, furane, pyrane, pyrrole,
imidazole,
pyrazole, thiazole, pyridine, pyrazine, pyrrolidine, pyridazine, morpholine,
isoxazole et isothiazole.
Des exemples de radicaux bicyliques hétérocycliques sont les
2o dérivés saturés ou insaturés des benzofurane, benzothiophène, chromène,
indole, indolizine, isoindofe, indazole, purine, quinoléine, phtalazine,
naphthyridine, quinoxaline, quinazoüne, cinnoline, isoquinoléine,
benzothiazole et ptéridine.
Par dérivés insaturés, on entend les dérivés comprenant une ou
plusieurs insaturations.
Des exemples de radicaux hétérocycliques aromatiques mono- ou
bicycliques, sont notamment
le furane, le pyrrole, fimidazole, le pyrazole, le thiazole, la pyridine,
la pyrazine, la pyridazine, fisothiazole, le benzofurane, le benzothiophène,
l'indole, fisoindole, l'indolizine, findazole, la purine, la quinoléine,
l'isoquinoléine, le benzothiazole et la ptéridine.
CA 02349918 2001-05-03
WO OOI27778 PCT/FR99/02700
11
Le radical 1-alcényle ou 1-alcynyle peut présenter une ou plusieurs
insaturations supplémentaires telles que des doubles ou triples liaison
supplémentaires. II est essentiel selon l'invention que le carbone dudit
radical
1-alcényle ou 1-alcynyle qui est directement lié au noyau 1-
phosphanorbornadiène soit un carbone sp2 ou sp.
Ces radicaux ont respectivement pour formule
-C(RX)=CRyRZ (1-alcényle) et -C--__C-RX (1-alcynyle)
où RX, Ry et RZ représentent indépendamment un groupe alkyle saturé ou
présentant une ou plusieurs insaturations choisis parmi des doubles ou triples
liaisons carbone-carbone.
Lorsque R4 et RS forment ensemble avec les atomes de carbone qui
les portent, un monocycle carboxylique saturé ou insaturé, celui-ci comporte
de préférence 6 atomes de carbone.
Lorsque R,, R4, R5, Rs ou Y représentè un radical aliphatique
1 s portant un radical monocyclique carbocyclique ou hétérocyclique, on
préfère
que ce radical soit (Cs-C,o)aryl-(C~-C6)alkyle te! qu'un groupe benzyle ou (C3-
C8)cycloalkyl-(C~-C6)alkyle.
Des valeurs particulières des substituants R~, R4, R5, R6 et Y sont
les suivantes
(i) R,, R4, R5, R6 et Y identiques ou différents représentent un
radical phényle substitué de formule (a)
(Q3)p
(a)
2 5 dans laquelle p représente un entier compris entre 0 et 5;
Q3 représente(C~-Cs)alkyle; (C2-Cg)alcényle; (C~-C6)alcoxy; (C
C6)acyle; un radical choisi parmi : -R~ OH, -R7-COOR8, -R; NO2, -R~ CN, -R~-
N(Ra)2, -R~ SH, -R~ hal, -R~ CF3, -0-CF3 (où R~ représente une liaison ou (C~-
Cs)alkylène; R$ identiques ou différents, représentent un atome d'hydrogène
ou (C~-C6)alkyle; et hal représente halogène) ;
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
12
ou bien encore Q3 représente
(Rf)q (b)
-Re
où Rf est tel que défini ci-dessus pour Qs à l'exception de (b):
q représente un entier compris entre 0 et 5;
R~ représente une liaison; (C~-C6)alkylène; -O-; -COO-; -NR8-; -S-; -
SO~-; Re étant tel que défini ci-dessus;
1 o étant entendu que lorsque p est supérieur à 1, deux radicaux Q3
rattachés à deux atomes de carbone successifs du noyau phényle peuvent
être liés entre eux et former un pont de formule -O-R8-O- dans lequel Ra
représente (C,-C6)afkylène;
(ü) R~, R4, R5, R6 et Y, identiques ou différents, représentent un
radical de formule
(Q4)r
dans lequel
- r est égal à 0, 1, 2 ou 3
- 44 représente l'un des groupes ou fonctions suivantes
un atome d'hydrogène,
un radical alkyle linéaire ou ramifié, ayant de 1 à 4 atomes de
carbone,
un radical alcoxy linéaire ou ramifié ayant de 1 à 4 atomes de
2 5 carbone,
un groupe -OH,
un groupe NH2,
un groupe NO~,
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
13
un radical phényle,
un atome d'halogène,
un groupe CF3.
Plus préférablement, les radicaux Q4 identiques ou différents sont
un atome d'hydrogène ou un radical alkyle en C,-C4.
iii) R~, -ft4, R5, R6 et Y, identiques ou différents, sont choisis parmi
les radicaux phényle, tolyle ou xylyle, 1-méthoxyphényle, 2-nitrophényle et
les
radicaux biphényle, 1,1'-méthylènebiphényle, 1,1'-isopropylidènebiphényle,
1,1'-carboxybiphényle, 1,1'-oxybiphényle et 1,1'-iminobiphényle;
1 o iv) R~ et R5, identiques ou différents, représentent un atome
d'hydrogène ou un radical alkyle en C.~-C6;
v) R4 représente un atome d'hydrogène; un radical (C~-C6)alkyle;
phényle éventuellement substitué par un, deux ou trois substituants choisis
parmi (C~-C4)alkyle et (C~-C4)alcoxy ; ou naphtyle;
i s vi) R6 représente (C~-Cg)alkyle, (C3-C8)cycioalkyle ou phényle.
Des significations préférées du radical X sont un radical
carbocyclique aromatique mono- ou bicyclique en C6-C~o; un radical
hétérocyclique monocyclique aromatique de 5 à 6 chaînons comprenant 1 ou 2
hétéroatomes choisis indépendamment parmi N, 0 et S; un radical
2o hétérocyclique bicyclique aromatique constitué de deux cycles de 5 à 6
chaïnons condensés l'un à l'autre, chaque cycle comprenant 1 ou 2
hétéroatomes choisis indépendamment parmi 0, N et S; un radical 1-alcényle
de 2 à 6 atomes de carbone; un radical 1-alcényle de 2 à 6 atomes de
carbone; -CN; [(C~-Cs)alcoxy]carbonyle ou [(C~-C,8)aryloxy]carbonyle.
2 5 Les exemples préférés de radicaux carbocycliques et
hétérocycliques sont ceux mentionnés ci-dessus dans le cadre de la définition
des substituants R,, R4, R$ et R6.
Préférablement, X représente un radical 1-alcényle en C2-C6, un
radical 1-alcényle en C2-C6 ou un radical phényle.
3 o Des composés de formule I auxquels s'applique plus
particulièrement le procédé de dédoublement de l'invention sont
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
14
- le 2-formyl-3,6-diphényl-4,5-diméthyl-1-phospha- norborna-2,5-
diène;
- le 2-formyl-3,6,7,7-tétraphényl-1-phosphanorborna-2,5-diène.
La première étape du procédé de l'invention (étape a) consiste à
préparer un acétal ou un aminal de l'aldéhyde de départ de formule I par
réaction de cet albéhyde, sous la forme de mélange racémique, avec un diol
1,2 chiral ou un dérivé diamino-1,2 optiquement actif de formule Il.
On obtient à l'issue de cet étape un couple de deux
disatéréoisomères dont les propriétés physico-chimiques diffèrent.
i0 Lorsque le composé de formule II mis en jeu à l'étape a) répond à la
formule
A~ A2 A3 Aa
II
HE GH
dans laquelle E et G représentent tous les deux un atome d'oxygène, le
composé obtenu de formule III est un acétal de formule llla
R
Lorsque le composé de formule II répond à la formule
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
Ai A2 As Aa
II
HE GH
dans laquelle E et G représentent indépendamment un groupe NRo, le
composé obtenu de formule Il! est un aminal de formule Illb
nIb
5
où les groupes Ro sont indépendamment hydrogène, (C~ .C,o)alkyle, (C6-
C~o)aryle éventuellement substitué, (C6-C,Q)aryl-(C~-C,o)alkylé dans lequel la
partie aryle est éventuellement substituée.
lo
La réaction de l'aldéhyde I sur le composé de formule II est de
préférence réalisée dans un solvant, la concentration des réactifs I,
respectivement II étant de préférence comprise entre 0,05M et 2M, mieux
encore entre 0,1 M et 0, 5M.
15 La réaction de l'aldéhyde I avec le composé II peut être réalisée
dans les conditions stoechiométriques. On préfère cependant opérer en
présence d'un léger excès du composé de formule II, le rapport molaire du
composé de formule II au composé I variant généralement entre 1 et 3, par
exemple entre 1 et 1,5.
2o Le solvant mis en jeu dans cette étape est choisi de façon à
solubiliser à la fois le composé de formule I et le composé de formule II.
CA 02349918 2001-05-03
Wb OO/Z7778 PCT/FR99/02700
16
Les solvants préférés sont les solvants aprotiques, et notamment
les hydrocarbures aromatiques éventuellement halogénés (tels que benzène,
toluène et leurs dérivés chlorés), l'acétonitrile et les amides du type du
diméthylformamide et du diméthylacétamide. Dans certains cas, on peut
également opérer~dans la N-méthyl-2-pyrrolidinone comme solvant. II doit être
entendu cependant que les hydrocarbures aromatiques, comme le toluène,
éventuellement chlorés, sont préférés comme solvants.
La réactivité des composés de formule II varie suivant les
significations de E et G. Lorsque E et G représentent tous les deux un groupe
lo -NRo, les valeurs de Ra étant identiques ou différents (et de préférence
identiques), le composé de formule II est très réactif. La réaction de ce
composé sur le composé de formule I, peut donc ëtre réalisée dans des
conditions opératoires relativement douces et notamment en l'absence de
catalyseur.
Lors de la réaction de l'aldéhyde I sur le composé de formule II, la
température réactionnelle est généralement comprise entre 15 et 150°C.
Lorsque dans la formule II, E et G représeritent -NRô , une température entre
15 et 35°C est généralement suffisante.
A l'inverse, lorsque E et G représentent un atome d'oxygène dans le
2 o composé de formule II, la réaction du composé II avec le composé l peut
nécessiter des conditions réactionnelles plus sévères.
Ainsi, dans ce cas, une température réactionnelle comprise entre 40
et 120°C sera plus particulièrement souhaitable. Par ailleurs, la
présence d'un
catalyseur acide, minéral ou organique est recommandée.
2 5 Des exemples de tels catalyseurs sont notamment l'acide
paratoluènesulfonique, l'acide sulfurique, l'acide chlorhydrique ou l'acide
acétique, l'acide paratoluène- sulfonique étant nettement préféré. Toutefois,
l'homme du métier pourra utiliser l'un quelconque des catalyseurs acides
généralement utilisés dans la technique pour les réactions d'acétalisation. En
3 o règle générale, le catalyseur acide est utilisé à raison de 0,01 mole à
0,2 mole
de catalyseur pour 1 mole de l'aldéhyde de formule I, de préférence de 0,03 à
0,06 mole de catalyseur.
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
17
Lors de la mise en oeuvre de l'étape a) il peut être avantageux
d'éliminer l'eau du milieu réactionnel au fur et à mesure de sa formation.
Pour
ce faire, l'homme du métier pourra utiliser l'une quelconque des méthodes
connues de la technique. II pourra par exemple introduire dans le milieu
réactionnel un agent de séchage (tamis moléculaire ou alumine).
La deuxième étape du procédé de l'invention, consiste à séparer,
par une technique appropriée, les deux diastéréoisomères de formule III
obtenus. Pour ce faire, l'homme du métier pourra utiliser l'une quelconque des
méthodes connues dans la technique.
lo La séparation des diastéréoisomères peut être réalisée par
chromotagraphie ou bien encore par cristallisation en mettant à profit les
différences de solubilité des deux diastéréoisomères. Toutefois, toute autre
méthode de séparation basée sur une différence des propriétés physico-
chimiques (telles que points d'ébullition, points de fusion, densités ou
indices
de réfraction) des deux diastéréoisomères de formule III pourra être utilisée.
Lorsque la technique de séparation utilisée est la recristallisation, le
solvant de recristallisation choisi dépend de la nature des différents
substituants R~ à R6, Z et n d'une part, E, G et A~ à A4 d'autre part ainsi
que du
diastéréoisomère considéré. A titre d'exemple, lorsque le composé de formule
2o II est le 1,2-diphényiéthanediol et le composé de formule I est tel que
R~=R2=R3=Rs=phényle, R4=R5=H et n = 0, le solvant de recristallisation est un
mélange toluène/hexane pour un diastéréoisomère et le dichlrorométhane
dans le cas de l'autre diastéréoisomère.
Lorsque la technique de séparation est la chromatographie sur
colonne de silice, l'éluant est judicieusement choisi de façon à ce que les
temps de rétention de chacun des deux diastéréoisomères soient
suffisamment distincts l'un de l'autre. Les deux acétals diastéréoisomères
obtenus par réaction du 1,2-diphényléthanediol sur le composé de formule I
dans lequel R~=R2=H; R4=RS=CH3; R3=R6=phényle et n = O sont ainsi séparés
3o par chromatographie sur gel de silice en utilisant un mélange d'hexane et
de
dichlorométhane comme éluant.
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
18
La technique de séparation par chromatographie est notamment
décrite dans l'ouvrage de A. Bertheillier paru aux Editions Dunod et intitulé
"Chromatagraphie" (Paris, 1997).
L'étape c) du procédé revendiqué est mise en oeuvre séparément à
partir de chacun.~des deux diastéréoisomères isolés. Dans cette étape, la
fonction acétal de chaque diastéréoisomère de formule IIl est hydrolysée en
milieu acide, ce qui conduit à l'aldéhyde correspondant de formule 1.
Cette étape peut être mise en oeuvre dans les conditions classiques
d'hydrolyse des fonctions acétals. L'hydrolyse sera généralement effectuée
1o par action d'acide bromhydrique, iodhydrique, chlorhydrique, periodique ou
sulfonique dilué. On peut également envisager l'hydrolyse de la fonction
acétal
en présence d'un des acides précédents imprégnés sur silice, et notamment
en présence d'acide chlorhydrique imprégné sur silice.
Une autre méthode consiste à réaliser l'hydrolyse par acüon de
(CH3)3Sil dans le dichlorométhane ou le chloroforme, ou bien encore par
action de LiBF4 dans facétonitrile humide.
Selon un mode de réalisation préféré de l'invention, la réaction
d'hydrolyse de l'acétal III est mise en oeuvre dans l'acétone comme solvant.
En opérant dans l'acétone en effet, la réaction d'hydrolyse de l'acétal (qui
est
2o une réaction d'équilibre) est déplacée vers la formation de l'aldéhyde I du
fait
de la formation concomitante d'un acétal par action du composé de formule II
libéré
A2 A3
a
II
HE GH
sur l'acétone.
De façon avantageuse, on réalise cette réaction d'échange en
présence d'acide chlorhydrique imprégné sur silice.
En règle générale, ü suffit d'opérer en présence de 3 à 5% en mode
3o d'acide par rapport à la quantité totale d'acétal de formule III.
CA 02349918 2001-05-03
WU 00/27778 PCT/FR99/02700
19
Selon un autre de ses aspects, l'invention concerne un composé de
formule I, tel que défini ci-dessus, dans lequel n représente 0, à savoir un
composé de formule A
Ra
~R~
dans laquelle
R~, R4, RS et R6, identiques ou difFérents, représentent un atome
d'hydrogène; un radical hydrocarboné aliphatique, éventuellement substitué,
de 1 à 40 atomes de carbone, saturé ou insaturé, dont fa chaine
1 o hydrocarbonée est éventuellement interrompue par un hétéroatome; un
radical
carbocyclique ou hétérocyclique, saturé, insaturé ou aromatique,
monocyclique ou polycyclique, éventuellement substitué; .ou un radical
hydrocarboné aliphatique saturé ou insaturé dont la chaîne hydrocarbonée est
éventuellement interrompue par un hétéroatome et porteur d'un radical
carbocyclique ou hétérocyclique tel que défini ci-dessus, ledit radical étant
éventuellement substitué ;
ou bien R4 et R5 forment ensemble avec les atomes de carbone qui
les portent un monocycle carbocyclique saturé ou insaturé éventuellement
substitué ayant de préférence de 5 à 7 atomes de carbone ;
2o R2 représente un atome d'hydrogène ou le radical X ;
R3 représente le radical X ou le radical Y ;
étant entendu qu'un et un seul des substituants RZ et R3 représente
le radical X ;
X étant choisi parmi un radical carbocyclique ou hétérocyclique
aromatique monocyclique ou bicyclique ayant de 2 à 20 atomes de carbone ;
un radical 1-alcényle présentant éventuellement une ou plusieurs insaturations
CA 02349918 2001-05-03
VIrO 00/27778 PCT/FR99/02700
supplémentaires dans la chaïne hydrocarbonée et ayant de 2 à 12 atomes de
carbone ; un radical 1-alcynyie présentant éventuellement une ou plusieurs
insaturations supplémentaires dans la chaîne hydrocarbonée et ayant de 2 à
12 atomes de carbone ; un radical -CN ; [(C,-C,z)alcoxyjcarbonyle et [(Cs
5 C,e)aryloxyJcarbonyle ; et
Y preriant l'une quelconque des significations de R, à l'exception
d'un atome d'hydrogène.
Des composés préférés de formule A ci-dessus sont ceux pour
10 lesquels
R,, R4, R5, R6 représentent indépendamment un atome d'hydrogène
ou bien un radical T choisi parmi
un radical hydrocarboné aliphatique, saturé ou insaturé, ayant de
1 à 12 atomes de carbone, dont la chaîne hydrocarbonée est
15 éventuellement interrompue par un hétéroatome choisis parmi 0,
N et S;
un radical carbocyclique monocyclique saturé ou comprenant 1
ou 2 insaturations dans le cycle, ayant de 3 â 8 atomes de
carbone;
20 ~ un radical carbocyclique bicyciique saturé ou insaturé constitué
de 2 monocycles condensés l'un à l'autre, chaque monocycle
comprenant éventuellement 1 à 2 insaturations et présentant de
3 à 8 atomes de carbone;
un radical carbocyclique aromatique mono- ou bicyclique en C6-
Cep;
un radical hétérocyclique monocyclique saturé, insaturé ou
aromatique de 5 à 6 chaînons comprenant 1 à 3 hétéroatomes
choisis indépendamment parmi N, 0 et S;
un radical hétérocyclique bicycliqye saturé, insaturé ou
3 o aromatique constitué de deux monacycles de 5 à 6 chaînons
condensés l'un à l'autre, chaque monocycle comprenant 1 à 3
hétéroatomes choisis indépendamment parmi 0, N et S; et
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
21
un radical hydrocarboné aliphatique saturé ou insaturé, ayant de
1 à 12 atomes de carbone, dont la chaîne hydrocarbonée porte
un radical monocyclique carbocyclique ou hétérocyclique tel que
défini ci-dessus,
ledit radical T étant éventuellement substitué;
Y prend l'une quelconque des significations données ci-dessus pour
R~ à l'exclusion d'un atome d'hydrogène; et
X est choisi parmi un groupe alcényle en (Cz-Cs), un groupe
alcynyle en (Cz-Cs), phényle, naphtyle, thiényle, furyle, pyrrolyle,
imidazolyle,
1 o pyrazolyle, thiazolyle, pyridyle, pyrazinyle, pyridazinyle, isothiazolyle,
isoxazofyle, benzofuryle, benzothiényle, indofyle, isoindofyle; indolizinyle,
indazolyle, purinyle, quinolyle, isoquinolyle, benzothiazolyle et ptéridinyle.
Les substituants du groupe T sont tels que définis ci-dessus pour
les composés de formule I.
Un second groupe de composés préférés est constitué des
composés de formule A dans laquelle
R~ et R4 représentent indépendamment un atome d'hydrogène; un
groupe (C,-C6)alkyle; un groupe phényle éventuellement sûbstitué une ou
plusieurs fois par (C,-C6)alkyle, (C,-Cs)alcoxy, amino, (C~-Cs)alkylamino,
di(C~-
2 o C6)alkylamino ou un atome d'halogène; un groupe naphtyle éventuellement
substitué une ou plusieurs fois par (C~-C6)alkyle, (C~-C6)alcoxy, amino, (C~-
C6)alkylamino, di(C~-C6)alkylamino ou un atome d'halogène;
RS représente un atome d'hydrogène ou un groupe (C~-C6)alkyfe;
R6 représente un atome d'hydrogène; un groupe (C~-C6)alkyle; (C3
C8)cycioalkyle éventuellement substitué une ou plusieurs fois par (C~
C6)alkyle, (C~-Cg)alcoxy, amino, (C,-Cs)alkyl-amino, di(C~-C6)alkylamino ou un
atome d'halogène; ou phényle éventuellement substitué une ou plusieurs fois
par (C,-Cs)alkyle, (C~-C6)alcoxy, amino, (C,-C6)alkylamino, di(C~-
C8)alkylamino
ou un atome d'halogène;
3o Rz représente un atome d'hydrogène ou le radical X;
R3 représente le radical X ou le radical Y;
CA 02349918 2001-05-03
W~ 00/27778 PCT/FR99/02700
22
étant entendu qu'un et seul des substituants RZ et R3 représente le
radical X;
X représente un groupe alcényle en CZ-C6; un groupe afcynyle en
C2-C6; ou un radical phényle; et
Y représente l'une quelconque des significations données ci-dessus
pour R~ à l'exclusion d'un atome d'hydrogène.
Parmi ces composés ceux pour lesquels
- soit R~ et R2 représentent un atome d'hydrogène et R3 représente
phényle éventuellement substitué une ou plusieurs fois par (C,-Cs)alkyle, (C,-
1o Cs)alcoxy, amino, (C,-Cs)alkylamino, di(C,-Cs)alkylamino ou un atome
d'halogène ;
- soit R, et R3 représente indépendamment phényle éventuellement
substitué une ou plusieurs fois par (C,-Cs)alkyle, (C,-Cs)alcoxy, amino, (C,-
C6)alkylamino, di(C,-Cs)alkylamino ou un atome d'halogène ; et RZ représente
phényle,
sont particulièrement préférés.
A titre de composés préférés, on peut citer tout particulièrement
- le 2-formyl-3,6-diphényl-4,5-diméthyl-1-phosphanorborna-2,5-
2 o diène;
- le 2-formyl-3,6,7,7-tétraphényl-1-phosphanorbornadiène.
Les composés de formule A ci-dessus (formule I dans laquelle n
représente 0) peuvent être préparés simplement par mise en oeuvre d'un
procédé en deux étapes.
Lorsque fon souhaite préparer un composé de formule I dans lequel
n représente 0, R, et R3 sont distincts d'un atome d'hydrogène et RZ
représente X tel que défini pour la formule I, ce procédé, qui forme un autre
objet de l'invention, comprend les étapes consistant à
a2) faire réagir un phosphole de formule IV
CA 02349918 2001-05-03
W~ 00/27778 PCT/FR99/02700
23
R4 Rs
N
R3 ~P ~R~
I
Rz -
4
dans laquelle R~, R3, R4 et R5 sont tels que définis pour la formule I, étant
entendu qu'aucun des groupes R, et R3 ne représente un atome d'hydrogène,
et RZ représente X tel que défini pour la formule I, avec un composé de
formule V
(RO)2CH-C--__C-R6 V
dans laquelle R6 est tel que défini ci-dessus pour la formule I et R
est un groupe (C~-C6)alkyle à une température comprise entre 100 et
200°C,
1 o de préférence entre 130 et 180°C, pour !'obtention d'un composé de
formule VI
R
VI
R i(OR)2
dans laquelle R est un groupe (C~-Cs)alkyle et R~ à R6 sont tels que définis
ci-
dessus; et
15 b2) hydrolyser la fonction acétal du composé de formule VI ainsi
obtenu en milieu acide pour régénérer la fonction aldéhyde, de façon à obtenir
un composé de formule I.
La première étape (étape a2) implique tout d'abord une réaction
sigmatropique d'ordre [1,5], suivie d'une réaction d'addition de type Diels
2 o Alder.
De façon schématique, cette étape peut être schématisée comme
suit (étant entendu que R2 ~ H)
CA 02349918 2001-05-03
WO OOi17778 PCT/FR99/02700
24
i
N R~ .R;
I
R2
IV
V
i(OR)2
VI
5 La mise en oeuvre de la.première étape nécessite fe chauffage du
milieu réactionnel à une température comprise entre 160- et 190°C, de
préférence entre 130 et 180°C. II est souhaitable de ne pas chauffer au-
dessus de 200°C de façon à éviter la formation de produits secondaires.
La réaction peut être conduite sans solvant ou en présence d'un
1 o solvant. Dans ce dernier cas, celui-ci est de préférence un hydrocarbure
aliphatique, cyclique ou aromatique. A titre d'exemple d'hydrocarbure
aliphatique ou cyclique, on peut citer l'hexane, l'heptane, l'octane, le
nonane,
le décape, le undécane, le dodécane, le tétradécane ou ie cyclohexane. Des
exemples d'hydrocarbures aromatiques sont le benzène, le toluène, les
15 xylènes, le cumène, les coupes pétrolières constituées de mélange
d'alkylbenzènes, notamment les coupes de type Solvesso ~.
Les solvants préférés sont le toluène et les xylènes. - On peut
égaiement utiliser des mélanges de tels solvants.
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
Néanmoins, selon un mode de réalisation particulièrement préféré,
la réaction du phosphole IV avec l'acétylénique V a lieu en l'absence de
solvant.
La réaction de IV sur V est stoechiométrique. Toutefois, il peut être
5 avantageux d'utiliser un léger excès de, l'acétylène V. De façon générale,
le
rapport molaire du composé V au composé IV varie entre 1 et 1,5, de
préférence entre 1 et 1,2.
La deuxième étape du procédé (étape b2) consiste à hydrolyser la
fonction acétal du composé obtenu à l'étape précédente de formule VI.
10 L'hydrolyse est selon l'invention réalisée en milieu acide, par mise
en oeuvre de l'un quelconque des procédés connus de la technique.
Cette réaction pourra par exemple ëtre mise en oeuvre dans les
conditions décrites ci-dessus, pour l'étape c) du procédé de dédoublement de
l'invention.
Z 5 Selon un mode de réalisation préféré, l'hydrolyse de l'acétal VI est
réalisée dans un hydrocarbure aliphatique halogéné (tel que ceux définis ci-
dessus et notamment le dichlorométhane) en présence d'acide chlorhydrique
imprégné sur de la silice.
Lorsqu'on souhaite préparer un composé de formule I dans lequel n
2 o représente 0, R3 représente X tel que défini pour la formule I, et RZ
représente
un atome d'hydrogène, le procédé comprend les étapes consistant à
a3) faire réagir un phosphole de formule VII
vil
I
Rs
25 dans laquelle R~, R4 et R5 sont tels que définis ci-dessus pour fa
formule I, et R3 représente X tel que défini pour la formule I, avec un
composé
de formule V
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
26
(RO)ZCH-C---C-R6 V
dans laquelle R6 est tel que défini pour la formule I et R représente
(C,-Cs)alkyle à une température comprise entre 100 et 200°C, de
préférence
entre 120 et 160°C, de façon à obtenir un composé de formule VI
VI
i(OR)2
dans laquelle R, à R6 sont tels que définis ci-dessus, R représente
un groupe (C,-C6)alkyle; et
b3) hydrolyser la fonction acétal du composé de formule VI obtenu,
1o en milieu acide, pour régénérer la fonction aldéhyde, de façon à obtenir un
composé de formule I.
Les réactions mises en jeu aux étapes a3) et b3) peuvent être
schématisées comme suit
H ~, ~ R~
I
R3
VII
R
V
(~R)2
VI
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
27
Les conditions de mise en oeuvre de la réaction a3) sont identiques
à celles mises en oeuvre dans le cas de la réaction de l'acétylénique V sur ie
phosphole IV (étape a2).
De mêrxie, les conditions opératoires de la réaction d'hydrolyse de
l'acétal VI obtenu.à l'issue de l'étape a3) précédente sont semblables à
celles
décrites ci-dessus dans le cas de l'hydrolyse de l'acétal de formule VI (étape
b2}.
La préparation des composés de formule I dans laquelle n = 1 et Z
1 o représente un atome d'oxygène est possible à partir des composés
correspondants de formule I dans laquelle n = 0 et Z représente un atome
d'oxygène.
De fait, l'oxydation des composés correspondants de formule I dans
laquelle n = 0 et Z représente un atome d'oxygène conduit aux composés
attendus.
A cet effet, on utilise de préférence un peracide en tant qu'agent
oxydant, tel que l'acide méta-chloroperbenzoïque.
Cette réaction est réalisés de manière conventionnelle à une
température comprise entre -5 et 15°C, de préférence entre -5 et
10°C, par
2o exemple 0°C, dans un hydrocarbure aliphatique halogéné tel que le
dichlorométhane. Toutefois, on peut également faire appel à un co-solvant de
type hydrocarbure aromatique. Ainsi, un mélange de toluène et de
dichiorométhane est-if tout particulièrement indiqué.
Lorsqu'on souhaite préparer un composé de formule I dans lequel n
2 5 représente 0, R, représente un atome d'hydrogène, RZ est distinct d'un
atome
d'hydrogène et R3 représente X te! que défini pour la formule I, le procédé
comprend les étapes consistant à
a4) faire réagir un phosphole de formule XVI
CA 02349918 2001-05-03
WD 00/27778 PCT/FR99/02700
28
Rs
XVI
'P RZ
"3
dans laquelle Rz, ~ R4 et R5 sont tels que définis pour la formule I étant
entendu
que RZ est distinct d'un atome d'hydrogène, et R3 représente X tel que défini
pour la formule I, avec un composé de formule V
(RO)2CH-C=C-R6 V
dans laquelle R6 est tel que défini pour la formule I et R représente (C,-
C6)alkyle à une température entre 100 et 200° C, de préférence entre
130 et
180° C, de façon à obtenir un composé de formule VI
R4
Vl
R~ H(OR)2
dans laquelle R~ à Rs sont tels que définis ci-dessus, et R représente un
groupe (C~-C6)alkyle; et
b4) hydrolyser la fonction acétal du composé de formule VI obtenu,
en milieu acide, pour régénérer la fonction aldéhyde, de façon à obtenir un
composé de formule I.
Les réactions mises en jeu à l'étape a4) peuvent être schématisées
comme suit
CA 02349918 2001-05-03
Wa 00/27778 PCT/FR99/02700
29
H
~3
XVI
R
V
(~ R)z
VI
Les conditions de mise en oeuvre des réactions des étapes a4) et
5 b4) sont identiques à celles préconisées dans le cas des étapes a3) et b3).
Les composés de formule I dans laquelle n = 1 et Z représente un
atome de soufre peuvent être préparés simplement par traitement des
composés correspondants de formule I dans laquelle n = 0 par du soufre (S8) à
une température comprise entre 50 et 150°C, de préférence entre 60 et
100°C,
1 o par exemple à 80°C.
La réaction est stoéchiométrique. Toutefois, il est préférable
d'utiliser un excès de soufre. Ainsi, la quantité de soufre S8 est
généralement
comprise entre 1 et 3 équivalents, par exemple 1,8 et 2,5 équivalents
molaires.
La sulfuration a habituellement lieu dans un solvant hydrocarboné,
1 s par exemple un hydrocarbure aliphatique, aromatique ou cyclique te! que
défini ci-dessus. Des conditions particulièrement appropriées sont un
hydrocarbure aromatique tel que le toluène, une température de 80°C,
une
atmosphère inerte et l'utilisation de 2 à 2,5 équivalents molaires de S8.
La réaction est généralement conduite sous pression
2 o atmosphérique.
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
On notera que l'oxydation et la sulfuration des composés de formule
I conformément aux procédés décrits ci-dessus peut être directement
effectuée à partir des produits bruts résultant du couplage du phosphole IV,
respectivement VII, sur l'acétylénique V.
5
Selon ûn autre de ses aspects, l'invention concerne les composés
de formule III
R4
R.:
~4 H3
io dans laquelle R, à R6, X, Y, A, à A4 sont tels que définis ci-desàus.
On préfère tout particulièrement les composés de formule III dans
laquelle
R~, R4, R5, R6 représentent indépendamment un atome d'hydrogène
ou bien un radical T choisi parmi
15 ~ un radical hydrocarboné aliphatique, saturé ou insaturé, ayant de
1 à 12 atomes de carbone, dont la chaîne hydrocarbonée est
éventuellement interrompue par un hétéroatome choisis parmi O,
Nets;
un radical carbocyclique monocyclique saturé ou comprenant 1
20 ou 2 insaturations dans le cycle, ayant de 3 à 8 atomes de
carbone;
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
31
un radical carbocycüque bicycüque saturé ou insaturé constitué
de 2 monocycies condensés l'un à l'autre, chaque monocycie
comprenant éventuellement 1 à 2 insaturations et présentant de
3 à 8 atomes de carbone;
~ un radical carbocyclique aromatique mono- ou bicyclique en C6-
C~o;r
un radical hétérocyclique monocyclique saturé, insaturé ou
aromatique de 5 à 6 chaînons comprenant 1 à 3 hétéroatomes
choisis indépendamment parmi N, 0 et S;
~ un radical hétérocyclique bicyclique saturé. insaturé ou
aromatique constitué de deux monocycles de 5 à 6 chainons
condensés l'un à l'autre, chaque monocycie comprenant 1 à 3
hétéroatomes choisis indépendamment parmi O, N et S; et
un radical hydrocarboné aliphatique saturé ou insaturé, ayant de
1 à 12 atomes de carbone, dont la chaîne hydrocarbonée porte
un radical monocyclique carbocyclique ou hétérocyclique tel que
défini ci-dessus,
ledit radical T étant éventuellement substitué;
Y prend l'une quelconque des significations données ci-dessus pour
2 o R~ à l'exclusion d'un atome d'hydrogène; et
X est choisi parmi un groupe aicényle en (CZ-Cs}, un groupe
alcynyle en (C2-Cg), phényle, naphtyle, thiényle, furyle, pyrrolyle,
imidazolyle,
pyrazolyle, thiazolyle, pyridyle, pyrazinyle, pyridazinyle, isothiazolyle,
isoxazolyle, benzofuryle, benzothiényle, indolyle, isoindolyle; indolizinyle,
indazolyle, purinyle, quinolyle, isoquinolyie, benzothiazoiyle et ptéridinyle.
Un second groupe de composés préférés est constitué des
composés de formule III dans laquelle
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
32
R~ et R4 représentent indépendamment un atome d'hydrogène; un
groupe (C,-C6)alkyie; un groupe phényle éventuellement substitué une ou
plusieurs fois par (C~-Cg)alkyle, (C~-C6)alcoxy, amino, (C~-C6)alkylamino,
di(C,-
C6)alkylamino ou un atome d'halogène; un groupe naphtyle éventuellement
s substitué une ou.plusieurs fois par (C~-C6)alkyle, (C~-C6)alcoxy, amino, (C~-
C6)aikylamino, di(C~-C6)alkylamino ou un atome d'halogène;
RS représente un atome d'hydrogène ou un groupe (C,-C6)alkyle;
R6 représente un atome d'hydrogène; un groupe (C~-C6)alkyle; (C3-
C$)cycloalkyle éventuellement substitué une ou plusieurs fois par (C
1 o Cs)alkyle, (C,-C6)alcoxy, amino, (C~-C6)alkyl-amino, di(C~-Cs)alkylamino
ou un
atome d'halogène; ou phényle éventuellement substitué une ou plusieurs fois
par (C,-C6)alkyle, (C~-C6)alcoxy, amino, (C~-Cfi)alkyamino, di(C,-
C6)alkylamino
ou un atome d'halogène;
RZ représente un atome d'hydrogène ou le.radical X;
15 R3 représente le radical X ou le radical Y;
étant entendu qu'un et seul des substituants RZ et R3 représente fe
radical X;
X représente un groupe alcényle en C2-C6; un groùpe alcynyle en
CZ-C6; ou un radical phényle; et
2 o Y représente L'une quelconque des significations données ci-dessus
pour R~ à l'exclusion d'un atome d'hydrogène.
Parmi ces composés ceux pour lesquels
- soit R~ et R2 représentent un atome d'hydrogène et R3 représente
phényle éventuellement substitué une ou plusieurs fois par (C,-Cs)alkyle, (C,-
2 s Cs)alcoxy, amino, (C,-Cs)alkylamino, di(C,-Cs)alkylamino ou un atome
d'halogène ;
- soit R, et R3 représente indépendamment phényle éventuellement
substitué une ou plusieurs fois par (C,-Cs)alkyle, (C,-Cs)alcoxy, amino, (C,
Cs)aikylamino, di(C,-C6)alkylamino ou un atome d'halogène ; et RZ représente
3 o phényle,
sont particulièrement préférés.
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
33
Les composés de formule I, sous la forme de mélange racémique,
ou sous la forme de composés optiquement actifs (tels qu'obtenus par
dédoublement selon le procédé de l'invention), et les acétals de formule lll,
sous la forme de mélange racémique ou sous la forme de composés
5 optiquement actifs, sont utilisables comme ligand dans la préparation de
catalyseurs pour I:hydroformylation d'oléfines.
On préfère dans ce but utiliser les composés de formule I pour
lesquels n = 0 ou bien ceux pour lesquels n = 1 et Z représente un atome
d'oxygène.
i0 L'hydroformylation des oiéfines conduit de façon générale; par
action de monoxyde de carbone et d'hydrogène, à des aldéhydes.
A titre d'exemple, l'hydroformylation du styrène peut conduire,
suivant les conditions opératoires, aux deux composés VIII (ramifié) et IX
(linéaire) suivants dans des proportions variées
HO
HZ/CO CHO
--~ +
15 V
De façon analogue, l'hydroformylation du vinylnaphtalène conduit à
l'aldéhyde X (ramifié) ou à l'aldéhyde XI (linéaire) suivants, ou
éventuellement
à un mélange de ces deux composés
CHO
HZ/CO CHO
--~.
2 0 X XI
L'hydroformylation est réalisée à une pression relativement élevée
sous atmosphère H21C0 (généralement supérieure à BMPa) en présence d'un
catalyseur qui peut ëtre un complexe d'un métal de transition (essentiellement
25 un complexe du Rhodium, du Palladium ou du Platine).
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
34
Le complexe du métal de transition actif dans la réaction
d'hydroformylation est généralement préparé in situ, lors de la réaction
d'hydroformylation à partir d'un précataiyseur, dont la nature varie suivant
le
métal de transition sélectionnëe.
Dans le cas de l'hydroformylation par un complexe du rhodium, le
précatalyseur est. par exemple l'un des composés suivants : [Rh~(CO)2C1]2 ;
[Rh~(COD)CI]2 où COD désigne le cyctooctadiène; ou le Rhr(acac)(CO)2 où
acac désigne l'acétylacétonate.
Dans ce cas (complexe au rhodium), l'hydroformylation est
effectuée par (i) mélange du précatalyseur avec un ligand approprié, par
exemple un composé de formule I ou III, éventuellement optiquement actif,
dans un solvant; puis (ü) addition à ce mélange réactionnel de l'oléfine
substrat (le composé que l'on entend soumettre à la réaction
d'hydroformylation). L'ensemble est porté sous pression d'un mélange gazeux
d'hydrogène et de monoxyde de carbone, et éventuellement chauffé. Les
conditions générales d'hydroformylation des oléfines sont illustrées dans le
cas des complexes au rhodium dans J. Am. Chem. Sac. 1997, 119, 4413-
4423.
Dans le cas des composés de l'invention de formule I et III, on
utilise de préférence Rh~(acac)(CO)2 comme précatalyseur. Selon l'invention,
il
est souhaitable que la phosphine I ou III, éventuellement optiquement active
soit en excès par rapport au précatalyseur. Habituellement, le rapport molaire
du ligand de formule I ou III au précatalyseur Rh~(acac)(CO)2 varie entre 1 et
8,
de préférence entre 3 et 5, et par exemple, ce rapport est de 4.
A titre de solvant approprié, les hydrocarbures aromatiques tels que
le benzène et le toluène conviennent particulièrement bien; cependant de
façon à améliorer l'énantiosélectivité de la réaction d'hydroformylation, on
pourra sélectionner un éther (le tétrahydrofurane) ou un alcanol en C~-C5 (le
méthanol) comme solvant.
3 o D'autres solvants appropriés sont les amides (diméthylformamide ou
diméthylacétamide) et les ortho-éthers en C4-C5 (orthoformiate d'éthyle ou
orthoformiate de méthyle).
CA 02349918 2001-05-03
VltO 00/27778 PC'f/FR99/02700
La quantité de solvant utilisée est de préférence relativement faible,
mais dépend de la nature du substrat choisi. Lorsque le substrat est liquide à
température ambinte, le rapport volumique du substrat au solvant peut être
maintenu entre 1 et 4, de préférence entre 1 et 3. Lorsque le substrat n'est
pas
5 liquide à température ambiante, la quantité de solvant utilisée est celle
nécessaire pour solubiliser le substrat.
La réaction d'hydroformylation est effectuée sous pression d'un
mélange hydrogène/monoxyde de carbone, de préférence un mélange 1/1 de
HZICO. La pression varie généralement entre 8MPa et l6MPa, cependant une
1 o pression inférieure peut suffire. Ainsi, la pression peut varier de 1 MPa
à 20
MPa suivant les cas.
II n'est pas toujours nécessaire de chauffer le milieu réactionnel.
Toutefois, suivant la nature du substrat, la nature du solvant et celle du
catalyseur, on pourra opérer à une température réactionnelle comprise entre
15 15°C et 100°C, de préférence entre 20°C et
60°C.
Lorsque fhydroformylation est réalisée en présence d'un catalyseur
au platine ou au palladium, le précatalyseur est généralement PdClz,
respectivement PtCl2, et la réaction d'hydroformylation est mise en oeuvre par
(i) mélange dudit précatalyseur avec du chlorure d'étain (SnCl2), un ligand
(par
2o exemple un composé de formule I ou un composé de formule I11), le substrat
(à
savoir le composé que l'on entend soumettre à la réaction d'hydroformylation)
et un solvant; puis (ii) mise sous pression d'un mélange HZICO et
éventuellement chauffage du milieu réactionnel. Les conditions de ce type de
réaction d'hydroformylation sont par exemple illustrées dans J. Am. Chem.
25 Soc. Vol 119, n° 19, 1997, 4413. De manière générale, la quantité de
chlorure
d'étain varie entre 1 et 4 équivalents, de préférence entre 1 et 3 équivalents
molaires par rapport aux moles de platine, respectivement de palladium mises
en jeu. De même, pour un ligand de formule I ou III selon l'invention, le
rapport
molaire du ligand à PtCl2, respectivement PdCl2 varie entre 1 et 4, de
3 o préférence entre 1 et 3.
CA 02349918 2001-05-03
WO 00/27778 PCTlFR99/02700
36
A titre de solvant, les hydrocarbures aromatiques, les éthers, les
alcools aliphatiques, les amides et les ortho-éthers tels que définis ci-
dessus
peuvent être utilisés. On préfère, néanmoins les hydrocarbures aromatiques
du type du benzène et du toluène.
5 Concernant les conditions de~température et de pression elfes sont
sensiblement telles que préconisées ci-dessus dans le cas de
l'hydroformylation des oléfines par le rhodium.
D'autres conditions opératoires également utilisables dans le cadre
de l'invention sont telles que décrites dans J. Am. Chem. Soc. 1987, 109,
l0 7122-7127.
Les composés de l'invention de formule I et IIl sont particulièrement
intéressants en tant que ligands pour la préparation de catalyseurs
utilisables
dans l'hydroformylation des oléfines du point de vue de l'activité et de la
régiosélectivité des réactions d'hydroformylation. . En présence d'un tel
15 catalyseur, la réaction d'hydroformylation conduit à un aldéhyde
majoritaire qui
est soit le composé ramifié, soit le composé linéaire attendu.
En outre, les inventeurs se sont rendus compte de façon étonnante,
que les catalyseurs préparés à partir des composés de formule I ou Ill selon
l'invention permettant de réaliser avec succès l'hydroformylation des oléfines
2o avec acétalisation concomitante de l'aldéhyde formé.
Ainsi, les inventeurs ont pu réaliser la réaction suivante au départ
du styrène, et observer la formation de l'acétal XIII, en tant que produit
majoritaire de la réacüon
CA 02349918 2001-05-03
WO 00/Z7778 PCT/FR99/OZ700
37
CHO
CHO
HZ/CO X~ , XIv
.-~.
~\/~ CH (Ola)2
\ CH(OEt)2
X~ XV
Ce résultat est d'autant plus surprenant que Castillon et al. ont
montré dans Tetrahedron Letters, 1994, 35, 2361-2364 que cette réaction
d'hydroformylation-transacétalisation ne se produisait pas, en !'absence de
catalyse acide, malgré l'utilisation de catalyseurs, complexes du
rhodium/P(Ph)3, en présence de p-toluènesulfonate de pyridinium.
lo Les exemples suivants illustrent plus précisément l'invention.
PREPARATION 1
3,6-diphényl-4,5-diméty!-2-formyl-1-phosphanorboma-2,5-diène (1: n = 0;
Ri = RZ = H; R4 = R5 = -CH3; R3 = R$ _ -CgHs) - composé 1
~5 1 - Préparation de l'acétal diéthylique du 3,6-diphényl-4,5-diméthyl-2-
formyl-1-
phosphanorborna-2,5-diène de formule
H3C Ph
Ph ' CH(OEt) 2
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
38
Dans un ballon, on chauffe à 140°C pendant 4 heures, un mélange
de 3,4-diméthyl-1-phényl phosphole (13,3 mmol, 2,5 g) et d'acétal diéthylique
de phénylpropargyl aldéhyde (13,3 mmol, 2,7 g). Le brut de la réaction est
obtenu sous forme d'une huile très brune, pour la suite le produit est utilisé
sans purification.
2 - Préparation du 3,6-diphényl-4,5-diméthyl-2-formyl-1-phosphanorborna-2,5-
diène de formule (composé 1 )
On place dans un ballon 3 g de silice, 5 ml de CHZC12, 1 ml d'HCI
(11 N). A cette suspension on additionne, à température ambiante, sur une
période de 5 min., le produit brut obtenu à l'étape précédente dissous dans 10
ml de CHZC12. Le milieu est agité pendant 15 minutes et le mélange est ensuite
filtré sur frité, puis le solvant est évaporé. Le produit est ensuite
chromatographié sur colonne de silice (Eluant : CHZC12).
15 Le produit du titre est obtenu sous forme d'un solide jaunâtre (Point
de fusion : 112°C; 3,8 g; rendement : 88%).
' H RMN (CDC13) 8(ppm) =1,4(3H, s, CH3); 2,1 (3H, s, CH3); 2,2(2H,
m, CH2); 7,3(10H, m, CH aromatiques); 9,7(1 H, d, 3J(P-H)=9,2 Hz, CHO).
3'P RMN(CDC13) 8(ppm) =-31,2 ppm.
20 '3C RMN (CDC13) 8(ppm) =16,5(CH3, s); 20,4(CH3, s); 65,1(CH2, s);
73,6(Cq, d, 'J(P-C)=5,9 Hz); 129,0-156(carbones sp2) ; 191,0(CHO, d, 2J(P-
C)=16,7Hz).
Analyse calculée pour Cz~H~9OP:
C:79,25; H: 6,01; P:9,70.
2 5 Trouvée C:78,62; H: 6,14; P:9,62.
Spectre de masse : M+ (318,10%); M+-C9H60(188,100%).
PREPARATION 2
3,6,7,7-tétraphényl-2-formyl-1-phosphanorboma-2,5-diène (I: n = 0; R~
3o RZ=R3=Rs=-CgH~; R4=R5=H)-composé2
1 - Préparation de l'acétal diéthylique du 3,6,7,7-tétraphényl-2-formyl-1-
phosphanorborna-2,5-diène, de formule:
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
39
Ph (OEt)2
Dans un ballon, on chauffe à 170-180°C pendant 8 jours. un
mélange de 1,2,5 triphénylphosphole (4,9 g, 15,9 mmol) et d'acétal diéthylique
de phénylpropargyi adldéhyde (3,2g, 15,9 mmol). Le brut de la réaction est
obtenu sous forme d'une huile très brune. Le produit brut est utilisé dans la
suite, sans purification.
10 2 - Préparation du 3,6,7,7-tétraphényl-2-formyl-1-phosphanorborna-2,5-diène
(composé 2)
On place dans un ballon 3 g de silice, 5 ml de CH2C12, 1 ml d'HCI
(11 N). A cette suspension, on additionne, à température ambiante, sur une
période de 5 min., fe produit brut obtenu à l'étape précédente dissous dans 10
ml de CH2C12.
Le produit est obtenu sous forme d'un solide blanc (Point de fusion
234°C, rendement : 45%).
' H RMN (CDC13) 8(ppm) =5,4(1 H, m, CH); 7,26(21 H, m, CH);
9,7(1 H, d, J=9,2 Hz, CHO).
3'P RMN (CDC13) 8(ppm) _ -0,3 ppm.
'3C RMN (CDC13) S(ppm) =71,6(CH,d,J=5,6 Hz); 88,2(Cq, s); 128-
181 (carbones spz) ; 190,3(CHO, d, 2J=16,5 Hz).
Analyse calculée pour C3~ H230P:
C:84,14; H: 5,24; P:7,00.
Trouvée C:81,54; H: 5,21; P:7,31.
Spectre de masse mlz (intensité relative) : 486 (M+,40), 165(M+-
C~aHi40P,100).
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
4b
EXEMPLE 1
Dédoublement du composé 1 de la préparation 1
1 - Formation d'un acétal par action de 2-hydroxy-1,2-diphényléthanol
composé 3
H
Ph ,Ph
o HO OH
H
Dans un ballon muni d'un barreau aimanté, on place 0,7 g du
composé 1 obtenu à la préparation 1 (M=318 g/mol, 2,2 mmol), 0,5 g de (S,S)
2-hydroxy-1,2-diphényléthanol (M=214 glmol, 2,2 mmol), 0,01 g d'acide p-
1o toluènesulfonique et 7 ml de toluène. Le mélange est chauffé au reflux du
toluène pendant 3 heures. L'avancement de la réaction est suivi par RMN du
3t
P.
Le produit obtenu est un mélange de deux diastéréoisomères
(composés 3A et 38).
2 - Séparation des diastéréoisomères
Les deux diastéréoisomères sont séparés par chromatographie
flash sur gel de silice en utilisant un mélange 7I3 : hexaneICH2Cl2.
2o Diastéréoisomère A : composé 3A
[ccjo = +41,6°.
'H RMN (CDC13) 8(ppm) =1,4(3H, s, CH3); 2,0(3H, s, CH3); 2,3(4H,
m, CH2); 4,7(1 H, d, 'J(H-H)=8,0 Hz); 5,1(1 H, d. 'J(H-H)=8,0 Hz); 5,9(1 H, d,
3J(P-H)=8,7 Hz); 6,9-7,5(10H,m,CH aromatiques).
3'P RMN (CDC13)8(ppm) _ -22,9.
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
41
'3C RMN (CDC13)8(ppm) =16,4(CH3, s); 21,0(CH3, s); 66,9(Cq, s);
71,8(CHZ, d, zJ(P-C)=6,0 Hz); 87,0(CH, d, 2J{P-C)=69,8 Hz};103,0(CH, d, 4J(P-
C)=15,3Hz};129,0-169,0(carbones sp2)
'
Diastéréoisomère~B : composé 3B
[cc]v = +200°.
'H RMN (CDC13) 8(ppm) =1,5(3H, s, CH3); 2,2(3H, s, CH3); 2,3{4H,
m, CH2); 5,0(1 H, d, 'J(H-H)=8,0 Hz}; 5,2(1 H, d, 'J(H-H)=8,0 Hz); 6;0(1 H, d,
l0 3J(P-H)=9;0 Hz}; 6,9-7,5(20H,m,CH aromatiques).
3'P RMN (CDC13)â(ppm) =-22,1.
'3C RMN (CDC13) S(ppm) =16,2(CH3, s); 20.9(CH3, s); 66,4(Cq, s);
71,8(CH2, d. 2J(P-C)=8,0 Hz; 87,2(CH, d. 2J(P-C)=88.3 Hz);102,6(CH, d, 4J(P-
C)=15,4Hz);129,0-169,0(carbones sp2)
3 - Hydrolyse de l'acétal
On place dans un ballon 3 g de silice, 5 ml de dictüorométhane, 1
ml d'HCI (11 N} sous agitation. A cette suspension on additionne, à
2 o température ambiante, sur une période de 5 minutes. le composé 3A isolé à
l'étape 2 ci-dessus et dissous dans 10 ml de CHZCIZ. Le mélange est agité
pendant 15 minutes, puis filtré sur fritté et le solvant est évaporé.
Le produit est ensuite chromatographié sur colonne de silice en
utilisant CH2Clz comme éluant. L'aldéhyde attendu est obtenu sous forme d'un
solide jaunâtre.
L'aldéhyde obtenu (composé 5A) est caractérisé par un pouvoir
rotatoire [aJo = + 134,5°, tel que mesuré à 20° C dans CDC13
avec c = 0,55
En appliquant le même mode opératoire que décrit ci-dessus mais à
partir du composé 3B, on obtient l'aldéhyde correspondant 5B, lequel est
3 o caractérisé par un pouvoir rotatoire de [ajp = -133°, tel que
mesuré à 20° C
dans CDC13 avec c = 0,55.
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
42
EXEMPLE 2
Dédoublement du composé 2 de la préparation 2
1 - Formation d'un acétal par action de 2-hydroxy-1,2-diphényl éthanol
composé 4 _
Pb Ph
Ph Ph Ph ~h ph Ph
-~"
Ph CHO HO OH ph CHrO
P P
h
O
Ph
Dans un ballon, sous argon, 206 mg du composé 2 de la
préparation 2 sont chauffés à 50°C dans 10 ml de toluène, pendant 5 h,
en
1o présence de 100 mg de (S,S)-(-)-2-hydroxy-1,2-diphényléthanol et de 1 mg
d'acide p-toluènesulfonique. Le solvant est ensuite évaporé. Le produit obtenu
est un mélange de deux diastéréoisomères.
2 - Séparation des diastéréoisoméres
15 Le brut de la réaction obtenu à l'étape 1 est repris dans un mélange
80120 toluènelhexane.
Un des deux diastéréoisomère précipite. II est filtré, et lavé au
toluène, puis recristallisé dans un mélange toluène/hexane : 70130. Les eaux
mères sont concentrées et le deuxième diastéréoisomère est cristallisé dans
2 o un mélange CHzCIz.
Diastéréoisomère A : composé 4A
[a]p = -119,6°(c=2,7; CDC13).
'H RMN (CDC13) 8(ppm) - 4,6(1 H, d,J=8,1 Hz, CH); 5,0(1 H,
2s d,J=8,1Hz,CH); 5,2(1 H, m, CH); 6,0(1 H, d,J=9,7Hz,CH), 7-7,6(30H,m,CH
arom). 3' P RMN (CDC13)8(ppm) = 7,8 ppm.
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
43
'3C RMN (CDC13)8(ppm) =70,1(d, ZJ(P-C)=5,3 Hz, CH); 87,3(s,CH);
102,1 (d, °J(C-P)=15,6 Hz, CH);126-164 (carbones sp2).
Analyse calculée pour C~H3502P:
C: 84,61; H: 5,52; P: 4,85 O: 5,00.
Trouvée C : 84,41 ; H: 5, 55 ; P: 5,1.
Diastéréoisomère B : composé 4B
[a]p = -94°(c=1,0; CDC13).
' H RMN (CDC13) S(ppm) - 4,6(1 H, d,J=8,0 Hz, CH); 5,1 (1 H,
lo d.J=B;OHz, CH); 5,2(1 H, m, CH); 6;0(1 H, d, J=9,8 Hz.CH), 7-7,6(30H,m,CH
arom).
3' P RMN (CDC13)8(ppm) = 6,7 ppm.
'3C RMN (CDC13)8(ppm) =71,0(d, 2J(C-P)=5,7 Hz, CH); 86,8(s,CH);
102,7(d, 4J(C-P)=15,3 Hz, CH); 126-164(carbones sp2)
3 - Hydrolyse de l'acétal
L'acétal 4A est hydrolysé en aldéhyde 6A par mise en oeuvre d'un
mode opératoire identique à celui de l'exemple 1.3. '
Le pouvoir rotatoire de l'aldéhyde 6A tel que mesuré à 20° C dans
2 o CDC13 avec c = 0,41 est de [a]o = + g0°.
. De même, au départ de l'acétal 4B, on obtient l'aldéhyde 6B pour
lequel le pouvoir rotatoire tel que mesuré à +20° C dans CDC13 avec c =
0,41
est de [a]p = -91 °.
EXEMPLE 3
Réaction d'hydroformylation du styrène catalysée par un complexe du
rhodium
1 - Hydroformyiation du styrène
Dans cet exemple, on a étudié l'activité catalytique de différents
3 o catalyseurs au rhodium préparés à partir de ligands variés.
Daris tous les cas, l'hydroformylation du styrène est conduite de la
façon suivante
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
44
Dans une ampoule de verre de 25 mi, on place, sous argon, le
Rh(acac)(CO)2 (2,58mg; 0,01 mmol), 1 mi de solvant (toluène, THF, MeOH ou
DMF), un ligand (1 à 4 éq), puis 2 ml de styrène. On introduit ensuite un
mélange hydrogènelmonoxyde de carbone (1/1) jusqu'à la pression de travail.
On met le milieu réactionnel sous agitation et, le cas échéant, on chauffe.
Les conditions opératoires exactes (température, pression, solvant,
ligand et rapport relatif du ligand et du précatalyseur) sont telles
qu'indiquées
dans le tableau ci-dessous.
Conditions opératoires
n' de l'exempleLigand T('C)(1) P(MPa) Solvant(2)
t(h) Rh/P
3.1 Compos 1'''' S0 23 10 tolune 1/2
3.2 Compos 1 ~3~ 20 41 15 THF 1/2
3.3 Compos 5A~4~ 20 19 10 MeOH 1I4
3.4 Compos 3A~4~ 40 19 10 MeOH 1/4
3.5 Compos 4A~4~ 20 21 15 THF 1/2
3.6 Compos 4A~4~ 40 19 10 MeOH 1/4
3.7 Compos 4B~~ 40 19 10 MOH 1/4
3.8 Compos 2~3~ 20 19 10 MeOH 114
3.9 Compos 3B 40 19 10 MeOH 1/4
( 1 ) durée de la réaction
(2) rapport du nombre d'équivalents molaires de rhodium sur le nombre
d'équivalents de phosphore
(3) mélange racémique
(4) diastéréoisomère optiquement actif
En fin de réaction, le rapport du composé linéaire
(phénylpropaldéhyde), au composé ramifié (hydratropaldéhyde) de formule
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99I02700
CHO
est déterminé par RMN 'H du brut de la réaction (mélange réactionnel tel
quel). Le styrène ainsi que le solvant sont ensuite évaporés sous pression
5 réduite. L'hydratropaldéhyde est alors distillé au four à boule sous une
pression réduite à 90-100°C. 50 mg du produit distillé sont ensuite
dissous
dans 5 ml de toluène, puis le pouvoir rotatoire de la solution est mesuré.
2. Résultats
1 o Les résultats obtenus sont recueillis dans le tableau suivant.
N de l'exemple Ligand rlh'r FR'''(h-')TT%~~ a~"~
D
3.1 Compos 1 94/6 91 100
3.2 Compos 1 9515 23 47
3.3 Compos 5A 9911 10 10 +10
3.4 Compos 3A 95/5 105 100
3.5 Compos 4A 9812 41 43
3.6 Compos 4A 9713 76 73
3.7 Compos 4B 9614 52 50
3.8 Compos 2 97/3 105 100
3.9 Compos 3B 9515 52 50
Dans le cas de l'exemple 3.3, fhydroformylation était énantiosélective.
15 (1) rll : rapport molaire du produit ramifié au produit
linéaire
(2) FR désigne la fréquence de rotation qui est le rapport suivant
nombre de moles de substrat transformé
nombre de moles de catalyseur x temps (h)
(3) taux de transformation
CA 02349918 2001-05-03
WD 00/27778 PCT/FR99/02700
46
(4) pouvoir rotatoire mesuré à 20° C dans CDC13 avec c = 1.
II résulte clairement de ce tableau que l'activité des catalyseurs
selon l'invention est excellente. De méme, ces tests confirment que la
régiosélectivité obtenue en présence des catalyseurs de l'invention est
élevée.
EXEMPLE 4
Réaction d'hydroformyfation du N-vinylphtalamide catalysée par un
complexe du rhodium
Dans une ampoule de verre de 25 ml, on place sous argon le
Rh(aca)(CO)2 (2.~8 mg; 0,01 mmol), 1 ml de toluène; puis le ligand {1 à 4 éq)
et le N-vinylphtalamide dissous dans 2 à 3 ml de toluène. On introéuit ensuite
un mélange hydrogènelmonoxyde de carbone (111 ) jusqu'à la pression de
travail. On met le milieu réactionnel sous agitation, puis. le cas échéant, on
chauffe.
En fin de réaction le solvant est évaporé ~et le pouvoir rotatoire est
mesuré à partir du produit brut.
n de l'exempleLigand T(C) (1) solvant Rh/P''' P(MPa)
t(h)
4.1 Compos 4A'''~20 41 tolune 111 10
4.2 Compos 4A~3~ 20 36 tolune 1I2 2
~~ ~ auree ae la reaction
(2) rapport du nombre d'équivalents molaires de rhodium sur le nombre
d'équivalents de phosphore
(3) diastéréoisomère optiquement actif.
Les résultats obtenus sont tels qu'indiqués ci-dessous.
n de l'exempleLigand , rli TTg~o
I '~ "
4.1 Compos 4A 100 70 _
4.2 Compos 4A 100 70 + 13
CA 02349918 2001-05-03
WO 00/27778 PCT/FR99/02700
47
Dans le cas de l'exemple 4.2., l'hydroformylation était énantiosélective.
(1 ) rll : rapport molaire du produit ramifié au produit linéaire
(2) taux de transformation
(3) pouvoir rotatoire mesuré à 20° C dans CDC13 avec c = 1.
'
EXEMPLE 5
Réaction d'hydroformylation du 2-vinylnaphtalène catalysée par un
complexe du rhodium
Le mode opératoire mis en oeuvre dans cet exemple est identique à
1 o celui de l'exemple 4 sinon que le substrat utilisé est le 2-
vinylnaphtalène et
non le N-vinylphtalamide.
n de l'exempleLigand T(C) (1) P(MPa) solvant RhIP''~
t(h)
5.1 Compos 5A~3~20 67 15 tolune 1l2
(1 ) durée de la réaction _
(2) rapport du nombre d'équivalents molaires de rhodium -sur le nombre
d'équivalents de phosphore
(3) diastéréoisomère optiquement actif.
Les résultats obtenus sont les suivants.
n de l'exempleLigand rl1 TT%~
5.1 Compos SA 98/2 81 + 3,8
Dans le cas de l'exemple 5.2, fhydroformylation était énantiosélective.
(1 ) rll : rapport molaire du produit ramifié au produit linéaire
(2) taux de transformation
(3) pouvoir rotatoire mesuré à 20° C dans CDC13 avec c = 1.
CA 02349918 2001-05-03
Wa 00/2T778 PCT/FR99/02700
48
EXEMPLE 6
Réaction d'hydroformylation du styrène en présence de HC(OEt)3
catalysée par un complexe du rhodium
L'hydrofonnylation du styrène est réalisée par mise en oeuvre d'un
mode opératoire identique à celui de l'exemple 3 sinon que l'on utilise, comme
' solvant, 1 ml de HC(OEt)3.
n de l'exempleLigand T(C) P(MPa)t' (h) solvant Rh/P'
6.1 Compos 4A''~20 10 19 I HC(OEt)3 1/4
I
(1 ) durée de la réaction
(2) rapport du nombre d'équivalents molaires de rhodium sur le nombre
d'équivalents de phosphore
(3) diastéréoisomère optiquement actif.
Les résultats obtenus sont tels qu'indiqués au tableau suivant.
n de l'exempleLigand %D' %XII I %X111 %XIV % XV
6.1 Compos 0 63 I 35 0 I 2
4A
(1 ) D = styrène de départ
étant entendu que les composés de formule XII, XIII, XIV et XV sont les
2 0 suivants:
CHO CH(OEt)Z
XTI XIü
CHO CH(OEt)2
XN XV