Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
- 1 -
Procédé de production de métabolites
à partir de végétaux en culture hors sol
L'invention concerne un procédé de production de métabolites, en
continu ou en semi-continu, à partir de plantes en culture hors sol, sans
perte de
viabilité desdites plantes, ainsi qu'une installation pour la mise en oeuvre
de ce
procédé.
Les plantes produisent un grand nombre des molécules que l'homme
utilise comme médicaments, colorants, arômes, additifs alimentaires ou
pesticides.
Ces composés sont souvent typiques d'une famille d'un genre ou d'une espèce
végétale donnée. On les classe parmi les métabolites secondaires car ils ne
semblent pas toujours indispensables à la survie de la plante non stressée
(Bentley
1999, Bourgaud et al 1999, Gontier 1993). Beaucoup de ces molécules d'origine
végétale servent ou ont servi de modèle pour la synthèse chimique en vue d'une
utilisation commerciale. Parfois, les molécules sont complexes et l'extraction
à
partir de plantes sauvages, de plantes cultivées en champ ou in vitro restent
les
meilleures sources d'approvisionnement (Herman 1993).
En particulier, pour les molécules à haute valeur commerciale (prix
au kilogramme et volume du marché), les cultures de cellules ou de tissus en
bioréacteurs ont été développées (Herman 1993). Dans ce cas, les cultures
doivent
être axéniques, c'est à dire exemptes de micro-organismes (bactéries et
champignons) dont la présence pourrait être dommageable à la croissance du
matériel végétal et à la production de métabolites par ce dernier. Le maintien
de
conditions axéniques est parfois difficile dans le temps et est source de
charges
financières importantes (Gontier 1993). De plus, l'utilisation de systèmes
sophistiqués pour la culture in vitro (fermenteurs) ajoute un coût parfois
rédhibitoire, rendant le système économiquement non viable. De manière
générale, la production de biomasse in vitro est onéreuse. Pour rentabiliser
le
système, on cherchera à faire produire le maximum de molécules par cette
biomasse sans la détruire et en la réutilisant au maximum comme biocatalyseur
(Herman 1993).
La stimulation de la production peut être obtenue par ajout de
précurseurs dans le milieu de culture (Boitel et al 1997), par
perméabilisation
réversible de la biomasse ou par stress physique (élévation de température,
changement de pH, blessure...), chimique (ajout de sels CuSO4, NaCI, CaC12,
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
-2-
(NH4)2SO4...ou autres perméabilisants EDTA, DMSO, Tween20, autres
tensioactifs ou détergents...) ou biochimique (élicitation...)...(Boitel et al
1995-
1997, Weather et al 1991, Herman 1993, Mukundan et al 1998)
Le but de telles manipulations est de forcer la voie de biosynthèse en
augmentant le flux global des précurseurs vers la molécule recherchée. De
nombreuses publications font état de résultats extrêmement positifs obtenus
par
ces différentes voies (dont : Boitel et al 1995-1997, Weather et al 1991,
Herman
1993). Néanmoins, le problème du caractère axénique des cultures reste
entièrement posé.
D'autres auteurs, décrivent l'utilisation de cocktails antifongiques et
antibiotiques permettant d'assurer une survie du matériel végétal en condition
non
axénique ("Plant Preservative Mixture" dénommé couramment PPM ). Dans ce
cas, il est difficile de doser les inhibiteurs microbiens de telle sorte que
seuls les
bactéries et les champignons soient affectés et ce, sans effet négatif sur la
biomasse végétale.
Par opposition à la culture in vitro, la production de molécules à
partir de plantes récoltées dans la nature ou cultivées en champs est une
alternative intéressante. Cependant, la récolte dans la nature peut conduire à
la
disparition d'espèces en cas de surexploitation (Gontier 1993). Elle peut
aussi
entraîner d'importantes variations qualitatives et quantitatives de la
production. La
culture en champ n'est pas toujours réalisable par manque de connaissance de
la
plante ou, bien pire, pour cause d'impossible retour sur investissement à
moyen
terme. C'est souvent le cas pour les ligneux- par exemple l'if (Chen et Chen
1997,
Ketchum et al 1999)- qui poussent lentement et dont la croissance s'étale sur
des
décennies.
Depuis plusieurs années, des cultures dites hors sol (Morard 1995,
Toda et al 1999) sous serre ou en extérieur se sont développées et permettent
maintenant la culture de plantes maraîchères ou ornementales avec un niveau de
rentabilité élevé. Les progrès concernant ces techniques ont été fulgurants
depuis
environ quinze ans tant au niveau des dispositifs, des solutions nutritives
que du
contrôle et de l'automatisation de ces systèmes (Morard 1995). Jusqu'à ce
jour,
aucun essai de production de métabolite secondaire à partir de telles cultures
n'a
été tenté, ni même proposé, avec en particulier, la récupération des
métabolites
excrétés naturellement ou non à partir des racines des plantes ou même des
parties
aériennes. En particulier, l'état de l'art ne montre absolument pas, ni ne
suggère,
qu'il est possible a priori de récupérer de tels métabolites sans que ceux ci
ne
soient dégradés par la microflore rencontrée dans les cultures hors sol.
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
-3-
Actuellement, on ne sait donc pas :
- si les plantes, de manière générale, relarguent des métabolites
secondaires à partir de leurs racines ou de leurs feuilles de telle sorte que
ce
phénomène puisse être utilisé pour une application industrielle ;
- s'il est possible de forcer un relargage naturel ou non desdits
métabolites secondaires chez les plantes cultivées en particulier en culture
hors
sol ;
- si un traitement favorisant la synthèse et le relargage desdits
métabolites secondaires chez la plante va affecter la survie de ladite plante
de telle
sorte qu'aucune application industrielle ne puisse être envisagée ;
- si lesdits métabolites sont ou non dégradés de manière importante
par la microflore susceptible de se développer autour des plantes ainsi
cultivées.
Le problème posé à la présente invention consiste par conséquent à
proposer un procédé de production de molécules à partir de plantes ne
nécessitant
pas de conditions axéniques ou stériles, permettant de produire des quantités
importantes, rentable économiquement et n'entraînant pas la destruction, même
partielle, des plantes en vue de l'extraction des molécules recherchées.
A cet effet, la présente invention a pour objet un procédé de
production de molécules à partir de plantes, caractérisé en ce que lesdites
plantes
sont cultivées en conditions hors sol et sont alimentées par une solution
nutritive
et/ou aspergées par un liquide de lessivage, ladite solution et/ou ledit
liquide étant
ensuite récupéré(e)(s) et traité(e)(s) pour en extraire certaines molécules
déterminées qu'elle ou il contient et qui ont été libérées par les racines
et/ou les
parties aériennes desdites plantes.
Selon une première caractéristique de l'invention, ledit procédé peut
consister plus précisément à réaliser les étapes suivantes :
a) initiation de la culture des plantes en conditions hors sol
permettant la croissance et le développement desdites plantes et l'obtention
d'une
biomasse suffisamment importante pour rentabiliser le procédé ;
b) récupération des métabolites libérés par les racines ou les parties
aériennes des plantes au moyen d'un liquide mis en contact par percolation ou
immersion avec les racines, ou par aspersion avec les feuilles desdites
plantes ;
c) collecte de la solution usagée ou chargée sous forme de percolat
(pour les racines) ou de lessivat (pour les feuilles) et isolement des
molécules
recherchées contenues dans cette solution par extraction liquide-liquide,
liquide-
solide, par recristallisation, par sublimation ou par évaporation de l'eau.
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
-4-
Ledit procédé peut également comprendre une étape supplémentaire
de perméabilisation forcée des racines ou des parties aériennes des plantes
avec
une solution contenant notamment des sels, des tensioactifs, des détergents,
des
solvants, des éliciteurs d'origine fongique ou bactérienne, des dérivés de
l'acide
jasmonique ou d'autres produits stimulant les défenses naturelles des plantes,
de
telle sorte que les flux sortants des racines ou des feuilles vers la solution
nutritive
ou le liquide de lessivage soient augmentés de manière significative et ce,
sans
perte totale de la viabilité desdites plantes, afin que ces dernières puissent
être
réutilisées, directement ou après une phase de rinçage et de remise en
conditions
de culture permettant au moins le rétablissement d'un bon état physiologique
desdites plantes.
Dans ces conditions, le procédé comportera les étapes a à e
suivantes :
a) initiation de la culture desdites plantes en conditions hors sol
permettant la croissance et le développement desdites plantes et l'obtention
d'une
biomasse suffisamment importante pour rentabiliser le procédé. L'obtention de
cette biomasse importante, notamment au niveau racinaire, peut être favorisée
par
une transformation génétique via Agrobacterium rhizogenes (Hooykaas et
Schilperoort 1992) ;
b) perméabilisation des parties racinaires ou aériennes des plantes au
moyen de traitement chimique (sels, tensioactifs, détergents, solvants),
physique
(élévation de température...) ou biochimique (éliciteur d'origine fongique ou
non). Pour les traitements chimiques ou biochimiques, cette perméabilisation
peut
se faire à partir de la solution nutritive des plantes ou par aspersion des
parties
aériennes ;
c) récupération des métabolites libérés par les racines et/ou par les
parties aériennes des plantes par mise en contact desdites plantes avec un
liquide ;
d) récupération de la solution nutritive usagée ou du liquide aspergé
chargé (autrement appelée dans la suite : percolat pour la perméabilisation
par les
racines et lessivat pour la perméabilisation par les parties aériennes) et
isolement
des molécules recherchées contenues dans cette solution (percolat ou lessivat)
par
évaporation de l'eau ou extraction liquide-liquide (solution nutritive et
solvant
insoluble dans l'eau), liquide-solide (solution nutritive et support adsorbant
hydrophile, hydrophobe, anionique, cationique ou autre mais présentant une
forte
affinité pour les métabolites recherchés) ou par recristallisation ;
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
-5-
e) rinçage du système racinaire et/ou des parties aériennes des
plantes puis remise en conditions de croissance un temps juste suffisant pour
permettre de réaliser à nouveau le traitement.
En variante au déroulement séquentiel des étapes de
perméabilisation, de récupération et de remise en condition mentionné ci-
dessus,
dont le rebouclage sur une pluralité de cycles répétitifs autorise une
exploitation
efficiente desdites plantes, il peut également être prévu que la
perméabilisation
forcée soit réalisée de manière permanente, en additionnant une solution
perméabilisante à la solution nutritive délivrée de manière continue ou à
intervalles réguliers aux plantes.
Dans ce dernier cas, les étapes de remise en conditions des plantes
peuvent être totalement supprimées en choisissant des doses de substances
perméabilisantes peu importantes et en sélectionnant des substances peu
agressives ou stressantes pour les plantes, ou pour le moins être espacées
avec des
intervalles plus importants.
Suite à l'étape de perméabilisation ou à une phase prolongée de
perméabilisation, on réalise un rinçage du système racinaire et/ou des parties
aériennes des plantes, puis une remise en conditions de croissance desdites
plantes
pendant un temps juste suffisant pour permettre de réaliser à nouveau un
traitement de perméabilisation forcée, suivi ou accompagné d'une étape de
récupération des molécules recherchées.
Il peut être également prévu, de manière avantageuse, de renforcer
les capacités de biosynthèse de la plante et son potentiel à relarguer des
métabolites dans la solution, par l'intermédiaire d'un traitement physique
choisi
dans le groupe formé par une élévation de la température, une irradiation
lumineuse, supplémentaire ou rallongée, une élévation de la teneur en C02 dans
l'atmosphère en contact avec ladite plante et les combinaisons de plusieurs de
ces
traitements physiques.
En vue de rentabiliser davantage le procédé selon l'invention, la
production et l'excrétion des métabolites synthétisés par les plantes peuvent
être
renforcées soit par une néosynthèse de ces molécules suite à l'apport de
précurseurs de ces métabolites, ces précurseurs de la voie de biosynthèse
desdits
métabolites étant apportés à la plante par la solution nutritive au niveau des
racines ou par aspersion sur les parties aériennes en mélange avec des
tensioactifs
pour obtenir une pénétration foliaire, soit par un forçage de l'activité
photosynthétique au moyen d'un éclairement artificiel pendant une durée plus
longue que celle à laquelle la plante est habituée.
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
-6-
Selon un premier mode de réalisation de l'invention, les métabolites
recherchés sont libérés par les plantes au niveau de leurs racines et sont
récupérés
dans la solution nutritive usagée.
Selon un second mode de réalisation de l'invention, les métabolites
recherchés sont obtenus à partir des parties aériennes des plantes par
douchage ou
aspersion desdites plantes avec une solution ou un liquide adapté(e),
contenant
préférentiellement des tensioactifs, des agents de surfaces et/ou des
détergents, la
solution de douchage ou d'aspersion chargée étant récupérée séparément ou en
mélange avec la solution nutritive pour une extraction et une purification des
molécules recherchées.
De manière préférentielle, les plantes utilisées sont choisies dans le
groupe des plantes supérieures ou vascularisées, aptes à synthétiser des
métabolites d'intérêt économique en grande quantité et en ce que les molécules
recherchées correspondent à des métabolites secondaires produits naturellement
par ces plantes.
Les métabolites récupérés et isolés sont choisis dans le groupe formé
par les alcaloïdes de types tropaniques et indoliques, les anticancéreux, les
taxanes
ou dérivés du taxol, les furocoumarines, les terpènes, les glycosides, les
phénylpropanoïdes, les saponines et les stéroïdes, et, plus généralement les
substances non assimilables ou toxiques pour les micro-organismes
éventuellement présents dans l'environnement desdites plantes.
Conformément à une caractéristique supplémentaire de l'invention,
les plantes utilisées peuvent être modifiées génétiquement pour leur faire
produire
plus de métabolites ou pour modifier leur morphologie, en augmentant par
exemple leur biomasse racinaire suite à une transformation génétique par
Agrobacterium rhizogenes ou tumefaciens.
L'invention sera mieux comprise, grâce à la description ci-après, qui
se rapporte à des modes de réalisation préférés, donnés à titre d'exemples non
limitatifs, et expliqués avec référence aux dessins schématiques annexés, dans
lesquels les figures 1 à 8 représentent de manière schématique différentes
possibilités de mise en oeuvre du procédé selon l'invention, en relation avec
différents moyens et dispositifs matériels.
Ainsi, la figure 1 représente le système utilisé pour l'exemple 1
décrit dans la suite de la présente. Les plantes 1 (Daturas) sont cultivées
dans des
pots en verre 2 remplis de solution nutritive 3. La tige des plantes 1 est
fixée sur le
couvercle 2' des pots préalablement percé de trois trous. Un orifice 4 sert à
la
remise à niveau de la solution nutritive et l'autre permet le passage d'un
tuyau
CA 02390263 2002-05-07
WO 01/33942 PCT/FROO/03095
-7-
d'arrivée d'air 5 qui permet de maintenir une bonne oxygénation de la solution
nutritive des plantes par bullage (bulles 6).
La figure 2 présente le dispositif utilisé pour la culture d'Ifs telle que
décrite pour l'exemple 2 dans la suite du texte. Dans ce cas, les plantes 1
sont
posées dans le fond d'un bac en 2 PVC (polychlorure de vinyle) rempli de
solution nutritive 3, et un bullage d'air assure l'oxygénation de la solution
nutritive (bulles 6).
La figure 3 décrit le dispositif utilisé pour la réalisation des travaux
décrits dans l'exemple 4 ci-après. Les plantes 1 (Daturas) sont placées sur
des
plaques percées 7 posées sur un bac de culture 2 en PVC. La solution nutritive
est
régulièrement pulvérisée sur les racines sous forme de brouillard 8 grâce à
des
brumisateurs programmables 9.
Les figures 4 à 7 représentent différents dispositifs de culture
utilisables pour la production de métabolites à partir de plantes.
Plus particulièrement, les figures 4A et 4B représentent des
dispositifs de culture dans lesquels la solution nutritive 3 est apportée aux
plantes
1 à l'aide de capillaires. Une fois entrée en contact avec les racines
desdites
plantes, la solution nutritive usagée 3', aussi appelée percolat, est drainée
puis
recyclée. Dans ce cas, les plantes peuvent être cultivées avec ou sans
substrat 2".
Ce substrat peut être de différentes natures telles que: laine de roche,
sable,
perlite, vermiculite, sol reconstitué, ou de toute autre nature utilisée
actuellement
en culture hors sol.
Les plantes 1 peuvent aussi être cultivées selon la méthode NFT
pour : Nutrient Film Technique . Dans ce cas, la solution nutritive 3 est
amenée
aux racines des plantes 1 par ruissellement (Fig. 5) sur une gouttière ou un
plan
support 10 légèrement en pente. La récupération de la solution nutritive
usagée 3'
se fait en bout de gouttière 10 et cette solution peut être recyclée avec ou
sans
récupération des métabolites qu'elle contient.
Les figures 6A et 6B décrivent des systèmes de culture hors sol avec
immersion des systèmes racinaires des plantes 1 dans une solution nutritive.
L'apport de solution nutritive 3 et le drainage de la solution usagée 3'
peuvent être
permanents (système en continu) ou non (système discontinu). L'immersion du
svstème racinaire peut être, elle aussi, permanente (Fig. 6A) avec bullage
d'air
dans cette même solution nutritive ou temporaire (Fig. 6B). Dans le second
cas, le
drainage peut se faire vers un bac hermétique 11 en position basse. Le
transfert de
ce liquide peut alors être fait par une pompe ou par un compresseur 12 qui
pousse
CA 02390263 2002-05-07
WO 01/33942 PCT/FROO/03095
-8-
la solution contenue dans ce bac hermétique 11 vers le bac de culture 2,
éventuellement après rajout de substances additionnelles.
La figure 7 décrit un dispositif de culture de type aéroponie, dans
lequel les racines des plantes sont régulièrement arrosées par la solution
nutritive
3 sous forme de brouillard 8. Ce dernier est obtenu grâce à des brumisateurs 9
placés à l'intérieur du bac de culture 2. La solution nutritive usagée 3' peut
être
soutirée par le bas.
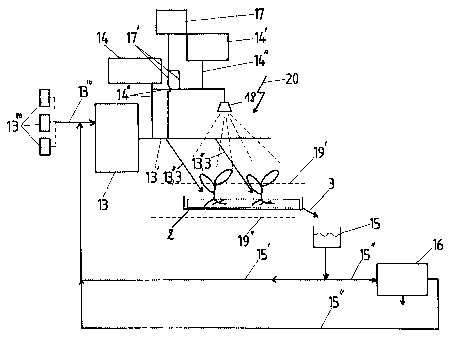
La figure 8 montre de manière schématique une installation pour la
mise en oeuvre, à grande échelle et le cas échéant de manière automatique ou
semi-automatique, le procédé de production de métabolites selon l'invention.
Comme le montre ladite figure 8, cette installation est
essentiellement constituée, d'une part, par une pluralité de contenants 2 pour
la
culture hors sol de plantes 1, renfermant ou non un support ou substrat de
culture
inerte 2", d'autre part, par un dispositif de stockage et d'apport de solution
nutritive
3 pour les plantes 1, comprenant un réservoir 13 et une ligne de distribution
13'
associée à un réseau de conduits 13" amenant ladite solution 3 de manière
contrôlée à la base desdites plantes 1, et par un dispositif de distribution
de
solution de perméabilisation et/ou de liquide de lessivage, comprenant
notamment
un réservoir de mélange et de stockage 14 pour la solution de perméabilisation
et/ou un réservoir 14' pour le liquide de lessivage, associé(s) à des lignes
de
distribution 14" par aspersion et/ou injection et, enfin, par un ensemble de
moyens
15, 15', 15", 16 de récupération, de traitement et de recyclage au moins de la
solution nutritive usagée 3'.
Les moyens de récupération, de traitement et de recyclage consistent
avantageusement en un bac de stockage intermédiaire 15 collectant la solution
nutritive usagée 3' évacuée par drainage des contenants 2 de culture hors sol
et
relié par une ligne de recyclage directe 15' et par une seconde ligne de
recyclage
15" comprenant une unité 16 de séparation ou d'extraction des métabolites
recherchés, en une boucle de réinjection sur le réservoir de stockage 13 de
solution nutritive 3, ce dernier étant également alimenté par une ligne
d'injection
13"' de substances nutritionnelles additionnelles stockées dans des réservoirs
13""
adaptés, de manière à compenser les quantités de telles substances prélevées
par
les plantes 1.
Pour augmenter la productivité de l'installation, cette dernière peut
également comprendre un dispositif de distribution de solution(s) de
précurseur(s)
des métabolites à synthétiser par les plantes et/ou de substances stimulant
ladite
synthèse de métabolites, comprenant un réservoir de stockage 17 et une ligne
de
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
-9-
distribution 17' reliée simultanément à la ligne de distribution 13' ou au
réseau de
conduits 13", délivrant la solution nutritive 3 et à des moyens 18 de
distribution
par aspersion des plantes 1 au niveau de leurs parties aériennes, tout comme
le
dispositif 14, 14', 14" de distribution de solution de perméabilisation et/ou
de
liquide de lessivage.
Conformément à une caractéristique supplémentaire de l'invention,
représentée également sur la figure 8, l'installation peut, en outre,
comporter,
d'une part, des moyens 19', 19" de chauffage des plantes 1 et/ou de leurs
contenants 2, par exemple sous la forme de réseaux de conduits parallèles et
espacés traversés par un fluide caloriporteur et s'étendant au-dessus et/ou en
dessous desdits contenants 2 et, d'autre part, des moyens 20 d'éclairage ou
d'insolation artificiels desdites plantes 1.
Le fonctionnement de l'installation représentée sur la figure 8 est
décrit plus précisément ci-après.
La solution nutritive 3 est préparée et stockée dans un premier
réservoir 13. Elle est ensuite amenée à la base des plantes 1 par un système
de
tuyauteries de plus en plus petites formant un réseau de conduits 13". Les
plantes
sont en culture hors sol, éventuellement sur un support inerte 2". La solution
nutritive usagée 3' s'écoule sur un support de préférence en pente formant
éventuellement le fond du contenant 2 correspondant, ce drainage 5 étant
permanent, cyclique ou occasionnel. Ces eaux de drainages sont récupérées dans
le bac de stockage 15. Elles sont ensuite recyclées directement ou bien les
molécules qu'elles contiennent en sont extraites et purifiées par l'unité 16
avant
recyclage. Un premier réservoir annexe facultatif 14, et le cas échéant un
second
réservoir annexe 14', contient ou contiennent des agents perméabilisants, des
précurseurs ou d'autres composés stimulant la production de métabolites chez
les
végétaux. Ces produits, mélangés à la solution nutritive ou non, sont mis en
contact avec les plantes 1 au niveau des racines par percolation (injection
dans la
solution nutritive 3) ou au niveau des feuilles par aspersion. Les plantes
sont
soumises à un éclairage naturel ou artificiel 20. Les parties aériennes et
racinaires
des plantes peuvent être réchauffées ou refroidies par des liquides
caloriporteurs
circulant dans des arrangements de tuyauteries formant des réseaux 19', 19" ou
d'autres moyens équivalents.
En relation avec les différentes variantes de réalisation de mise en
oruvre de l'invention, et en particulier avec le mode de réalisation
représenté à la
figure 8, ledit procédé sera avantageusement constitué de trois étapes
principales,
à savoir, une première étape de culture ayant pour but l'obtention d'une
biomasse
CA 02390263 2002-05-07
WO 01/33942 PCT/FROO/03095
- 10 -
importante, une seconde étape privilégiant la libération de métabolites par
les
plantes, soit au niveau de leurs parties racinaires, soit au niveau de leurs
partie
aériennes et une troisième étape visant à remettre en état lesdites plantes
avant
passage à nouveau à la première ou à la deuxième étape précitée (répétition de
cycles).
La présente invention concerne par conséquent un procédé et un
système permettant la récupération de métabolites libérés naturellement (pas
de
perméabilisation indispensable) ou non (perméabilisation indispensable) par la
plante cultivée en conditions hors sol (définition de Morard 1995), avec ou
sans
support inerte (par culture hors sol, il faut comprendre tout mode de culture
autre
que la culture en pleine terre dans les champs ou dans la nature). Cette
plante peut
être cultivée par arrosage avec une solution nutritive adaptée [culture hors
sol sur
support poreux, sur cascade (méthode dite NFT selon Morard 1995)], par
trempage permanent dans la solution nutritive avec bullage d'air (aquiculture
selon Morard 1995) ou immersion temporaire dans ladite solution nutritive
(subirrigation, hydroponie, film nutritif,...), ou par mise en contact avec
ladite
solution nutritive sous forme de brouillard (aéroponie, selon Morard 1995).
Si les métabolites sont libérés par les racines de la plante, ils seront
contenus dans la solution nutritive (percolat) et donc récupérés par piégeage
soit
dans un solvant non miscible à l'eau, soit sur un support adsorbant lesdites
molécules ou encore par évaporation ou sublimation de l'eau de la solution
nutritive. Ces différents modes opératoires peuvent être combinés si
nécessaire.
Si les métabolites sont libérés par les parties aériennes de la plante,
avec ou sans perméabilisation, ils seront récupérés par douchage desdites
plantes,
la solution de douchage (lessivat) étant récupérée et les métabolites qu'elle
contient extraits comme indiqué ci-dessus pour le percolat.
Dans tous les cas, l'eau, la solution nutritive usagée ou le liquide de
lessivage chargé peut être réutilisé pour la culture des plantes après remise
à
niveau des éléments minéraux et organiques nécessaires à la croissance et au
métabolisme secondaire de la plante. Si un traitement perméabilisant a été
effectué, il peut être nécessaire de traiter correctement la solution usagée
(percolat
ou lessivat) avant sa réutilisation pour un nouveau traitement perméabilisant
ou
pour une réutilisation comme solution nutritive normale (pour la croissance
des
plantes).
Lorsque les métabolites ont été extraits de la solution nutritive par un
solvant non miscible à l'eau, ce dernier est séparé de la phase aqueuse,
évaporé et
le résidu sec est récupéré. Les métabolites peuvent ensuite être purifiés et
séparés
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
- 11 -
d'éventuels contaminants. Si les métabolites ont été piégés sur un support
solide,
on isole ce support solide de la solution nutritive, on élue les métabolites
avec une
phase liquide aqueuse en jouant sur la force ionique, sur le pH ou en ajoutant
des
contre ions ou bien on utilise un solvant organique miscible à l'eau ou non
(alcool, hydrocarbure, organochloré, nitrile, ou autre...). Dans ce dernier
cas, on
va privilégier les solvants les plus respectueux de l'environnement, les moins
inflammables, les moins toxiques, les moins chers et les plus biodégradables.
Dans tous les cas, on mettra en oeuvre tous les moyens classiques de la
chromatographie et de la chimie pour purifier et concentrer les molécules
contenues dans l'éluat.
Lorsque les plantes ont été perméabilisées pendant le temps défini
comme optimal pour obtenir la sortie maximale de métabolites sans affection
irréversible de leur survie (perméabilisation séquentielle forcée sur des
périodes
courtes ou perméabilisation plus douce sur des périodes plus longues), le
traitement perméabilisant est stoppé. Les plantes sont remises en conditions
de
culture normale. Lorsqu'elles ont été traitées par une solution
perméabilisante,
une solution de rinçage est utilisée pour éliminer cet agent perméabilisant
(tensioactif, détergent, sel, acide, base...). Cette solution remplace
temporairement la solution nutritive. Ensuite seulement, les plantes sont
remises
en culture en conditions normales. Après une période de culture suffisante,
les
plantes peuvent à nouveau être perméabilisées. Ces cycles peuvent être
réitérés
jusqu'à diminution notable de la production, de la productivité, de l'état
sanitaire
des plantes. Dans ce cas, tout ou partie de la culture est remplacée par des
jeunes
plantes qui sont mises en croissance avant le premier traitement
perméabilisant,
préférentiellement jusqu'à obtention d'un développement optimal.
Dans certains cas, un traitement perméabilisant en continu peut être
envisagé. Dans ce cas, le traitement perméabilisant sera assez doux pour
permettre
la sortie des métabolites et surtout la survie de la plante tout au long dudit
traitement perméabilisant. Lorsque l'efficacité du traitement commence à
chuter
de manière significative, et engendre une baisse de rendement non
économiquement acceptable, on remplace les vieilles plantes par de plus
jeunes que l'on perméabilisera immédiatement ou après forçage de la
croissance.
De manière générale, lors de la perméabilisation des plantes, l'ajout
de précurseurs des métabolites recherchés peut être fait. Dans ce cas, ces
molécules peuvent être biotransformées par les cellules de ladite plante.
L'ajout
de précurseurs doit se faire avec modération pour éviter que ces derniers ne
servent de source de carbone à des micro-organismes dont le développement
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
- 12 -
pourrait à terme compromettre la survie desdites plantes. Cet ajout de
précurseurs
peut se faire directement dans la solution nutritive lorsqu'on perméabilise
les
racines. Il peut se faire par la solution nutritive via les racines si on
perméabilise
les feuilles aussi, mais il peut également être fait par voie foliaire via le
liquide de
douchage des plantes.
Afin d'illustrer davantage encore les possibles mises en oeuvre
pratiques du procédé selon l'invention, on décrit ci-après quatre exemples non
limitatifs de réalisation de ce dernier.
Exemple 1 de réalisation du procédé : Production d'alcaloïdes
tropaniques à partir de Datura innoxia Mill. cultivés en hydroponie
Les plantes utilisées proviennent de graines fournies par l'Institut für
Pflanzengenetik und Kulturpflanzenforschung (D-06466 Gatersleben,
Corrensstr.3, Allemagne). Ces graines ont été scarifiées dans l'acide
sulfurique
concentré pendant 10 minutes à température ambiante. Après rinçage abondant à
l'eau courante, elles ont été mises à germer dans des pots contenant du sol
humide
et à une température de 25 C+/-1 C avec une photopériode de 16h et une
hygrométrie de 60-70%. Au bout de deux mois, lorsque les plantes ont atteint
une
taille de 15-20cm, c'est-à-dire un stade 8-10 feuilles, elles ont été dépotées
et
transférées dans des pots de verre de type connu sous la désignation "baby
food
jar" (Sigma-Aldrich Inc., France) de 175 ml. Les plantes étaient maintenues
par le
couvercle des pots préalablement percés de trois trous (un pour la tige, un
pour le
bullage d'air et un pour la remise à niveau du liquide, Voir figure 1). Une
solution
nutritive de type MS diluée quatre fois (Murashige et Skoog, 1962) a été
ajoutée
dans le pot. Des tuyaux en silicone ont permis de faire buller de l'air dans
la
solution nutritive afin de maintenir une bonne oxygénation pour le système
racinaire des plantes et aussi, pour éviter le développement trop important de
populations de micro-organismes. Soixante plantes ont ainsi été mises en
place.
Elles ont été cultivées pendant deux semaines dans les mêmes conditions de
lumière, de température et d'hygrométrie que celles indiquées ci-dessus.
Des doses croissantes (0, 1, 2, 3 ou 5%V/V - volume pour volume)
de tensioactif (du type connu sous la désignation Tween20:
polyoxyéthylènesorbitan monolaurate) ont été ajoutées à la solution nutritive.
La
perméabilisation au Tween 20 (commercialisé par la société Prolabo) a été
réalisée en l'absence de bullage d'air (pour éviter la formation de mousse)
pendant 0, 12, 24 ou 48 heures. La solution nutritive de chaque plante a été
récoltée, filtrée et analysée par chromatographie en phase gazeuse. La
concentration totale moyenne en hyoscyamine et en scopolamine augmente
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
- 13 -
graduellement avec la concentration en tensioactif. Elle passe de 7mg/1 sans
tensioactif à 45mg/1 avec 5% de Tween20. La concentration en hyoscyamine et en
scopolamine augmente avec la durée du traitement.
L'ensemble des solutions de perméabilisation a été récupéré et les
molécules qu'elles contenaient ont été reprises dans du chloroforme après
adjonction d'ammoniaque jusqu'à pH 9. Le chloroforme a été évaporé et le
résidu
sec contenait l'ensemble des deux molécules d'hyoscyamine et de scopolamine.
Les plantes perméabilisées ont subi un rinçage du système racinaire
à l'eau courante et ont été remises en culture hydroponique comme indiqué ci
dessus. Au bout de trois semaines de culture, toutes les plantes avaient
survécu.
Elles avaient poursuivi leur croissance et certaines parmi celles qui avaient
été
perméabilisées ont même eu une croissance plus forte que les plantes témoins.
Un mois plus tard, les plantes ayant été perméabilisées une première
fois l'ont été une seconde fois selon plusieurs modalités :
a) 4 plantes témoins (non perméabilisées)
b) 4 plantes perméabilisées pendant 24heures avec 3% d'un
tensioactif connu sous la désignation de Teepol (marque déposée - société
TEMANA)
c) 4 plantes perméabilisées pendant 24heures avec 5% de Tween20
d) 4 plantes perméabilisées pendant 24heures avec 5% de Tween20
placées sous éclairement permanent à 27 C
e) 4 plantes perméabilisées pendant 24heures avec 5% de Tween20 +
1 g/1 d'ornithine et 1 g/1 de phénylalanine
les solutions nutritives ont été prélevées, filtrées et analysées comme
indiqué ci-dessus.
Les concentrations en hyoscyamine et en scopolamine étaient les
suivantes :
a) 1,5mg/1+/-1
b) 2,4mg/l+/-1,4
c) 9,lmg/1+/-4
d) 18,8mg/1+/-3,7
e) 22,7mg/1+/-2,4
Conclusion : Il est possible de faire pousser des Daturas en
aquiculture. Les Daturas libèrent spontanément des alcaloïdes (hyoscyamine et
scopolamine) dans la solution nutritive. On peut forcer cette libération
(également
appelée par la suite relargage) en perméabilisant les plantes avec des
tensioactifs.
Dans ce cas, il est possible d'avoir un effet perméabilisant tout en évitant
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
- 14 -
d'affecter la survie desdites plantes en jouant sur la nature du tensioactif,
sa
concentration et le temps de contact. Le Tween 20 est un tensioactif efficace
pour
cette application. A dose égale, le Tween 20 est plus efficace que le Teepol.
L'ajout de précurseurs de l'hyoscyamine et de la scopolamine est très
bénéfique
en terme de quantité d'alcaloïdes libérés dans la solution nutritive.. Le
passage des
plantes à un éclairement permanent pendant 24h et à une température plus
élevée
donne des résultats proches de ceux obtenus avec ajout de précurseurs. Dans ce
cas, on peut penser qu'une optimisation du système pourrait permettre
d'augmenter encore largement la productivité du procédé.
Les plantes perméabilisées ont été rincées et remises en culture.
Toutes ont survécu et ont donné lieu à des perméabilisations ultérieures.
Il résulte de ce qui précède que les plantes de type Datura peuvent
être cultivées en conditions hors sol pour leur faire produire des alcaloïdes
tropaniques que l'on récupère dans la solution nutritive usagée. La production
peut être augmentée en procédant à un traitement adapté. Ce traitement peut se
faire à l'aide de tensioactifs. Tous les tensioactifs ne sont pas aussi
efficaces les
uns que les autres. Plus la dose de tensioactif est élevée, plus le traitement
est
efficace. Plus le traitement est long plus il est efficace. Uri traitement
réalisé dans
de bonnes conditions permet la survie de la plante, voire un développement
supplémentaire de celle-ci, et il est alors possible de la perméabiliser
plusieurs
fois. L'efficacité du traitement perméabilisant peut être renforcée par ajout
de
précurseurs dans la solution perméabilisante. Cette efficacité peut aussi être
renforcée par forçage de la photosynthèse en soumettant les plantes à un
éclairement permanent, à une augmentation du taux de CO2 et/ou par élévation
de
la température environnante.
Exemple 2 de réalisation du procédé : Production de taxanes à partir
d'ifs en culture hors sol.
Quatre plantes d'ifs de 60cm de hauteur ont été achetés dans le
commerce, dépotés et placés dans des pots en PVC (polychlorure de vinyle)
d'une
contenance de 6 litres et contenant 5 litres d'une solution nutritive de type
MS
(Murashige et Skoog, 1962)diluée 12 fois. Au bout de 4 jours de culture en
serre
avec bullage d'air (0,25vvm - 0,25 volume de gaz par volume de milieu et par
minute) (Figure 2), la solution nutritive a été prélevée, filtrée sur filtres
du type
Millex 0,45 m et analysée par HPLC (chromatographie liquide haute pression)
sur colonne C18 de 30 cm avec un gradient de 0 à 100% de méthanol et une
détection UV à 254nm. Il n'a pas pu être détecté de taxol dans cette solution
nutritive. La solution a été remplacée par une solution neuve et 2% de Tween20
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
- 15 -
ont été ajoutés dans le pot de culture de deux des plantes. Après 24 heures,
une
concentration de 2,lmg/1+/-1,04 (soit 5 g/1/g de matière fraîche) a été
mesurée
dans la solution nutritive des plantes perméabilisées alors que seulement
0,2mg/l+/-0,16 (soit 0,2 g/1/g de matière fraîche) ont pu être mesurés dans le
cas
des plantes non perméabilisées. Des résultats assez similaires sont obtenus
pour le
dosage de la baccatine 3 (autre métabolite secondaire intéressant chez l'if).
Après
rinçage des racines, les plantes ont pu être perméabilisées à nouveau sans
compromettre leur viabilité pendant au moins les trois semaines de
l'expérimentation. Ces résultats montrent donc qu'il est possible d'obtenir
une
libération partielle des taxanes (paclitaxel) à partir d'ifs en culture hors
sol (dans
ce cas, culture hydroponique de type aquiculture). Dans notre exemple, ni la
solution nutritive, ni le traitement perméabilisant n'ont été optimisés. On
peut
donc s'attendre à des résultats plus intéressants encore après optimisation de
ladite
solution nutritive (voir Morard 1995), des conditions de culture (température,
lumière, C02...) et dudit traitement perméabilisant.
Exemple 3 de réalisation du procédé : Production de furocoumarines
à partir de Rues (Ruta graveolens) cultivées en hydroponie (aquiculture selon
Morard 1995).
Huit plantes âgées de 10 mois et cultivées en pot ont été placées en
culture en solution nutritive MS/4 (solution de Murashige et Scoog 1962,
diluée 4
fois) avec bullage d'air pendant deux semaines (même dispositif que sur la
figure
2). Quatre des huit plantes ont été perméabilisées pendant 24 heures avec 3%
(V/V) de Tween 20. Les solutions nutritives ont été ensuite prélevées,
filtrées et
analysées par chromatographie en phase gazeuse. Les solutions nutritives des
25. plantes perméabilisées contenaient en moyenne 8,1 +/-4,1 mg/1 de
furocoumarines
(psoralène, 8 méthoxypsoralène, 5 méthoxypsoralène et 5.8 diméthoxypsoralène)
contre 5,2+/-2,8mg/1 pour les solutions nutritives des quatre plantes témoins.
Les
racines des plantes ont été rincées à l'eau puis les plantes ont été remises
en
culture pour une semaine. Ensuite, les quatre plantes ayant déjà été
perméabilisées
la première fois ont été à nouveau perméabilisées de la même manière. Les
résultats sont les suivants : 22,5+/-6,lmg/1 pour les perméabilisées contre
19+/-
8.5mg/1 pour les non perméabilisées.
Une troisième perméabilisation a été refaite sur les mêmes plantes et
a donné des résultats similaires avec survie de la totalité des plantes.
Conclusion : Les Rues peuvent être cultivées en conditions hors sol.
Elles relarguent naturellement des furocoumarines dans la solution nutritive
mais
cette libération peut être augmentée par un traitement perméabilisant adapté
(ici,
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
- 16 -
le Tween 20 à 3%). D'autres types de traitements peuvent être envisagés de la
même manière : autres tensioactifs, élévation de la température de la solution
nutritive ou augmentation de la salinité de la solution nutritive, ajout
d'umbelliferone ou de phénylalanine par exemple. Comme dans l'exemple 2, les
conditions de culture et le traitement perméabilisant peuvent bien entendu
être
optimisés pour donner des rendements encore meilleurs.
Exemple 4 de réalisation du procédé : Culture de Datura innoxia et
Datura stramonium en aéroponie
Des graines de Datura stramonium et de Datura innoxia ont été mises
à germer dans des petits godets contenant de la vermiculite arrosée de
solution
nutritive. Ces godets ont ensuite été transférés dans des supports composés de
plaques (de PVC) percées. Ces plaques ont été placées sur un grand bac de 1,2m
X lm X lm au fond duquel six brumisateurs trempaient dans de la solution
nutritive (figure 3). Les brumisateurs se déclenchaient pendant 15 minutes
toutes
les demi-heures. L'ensemble du dispositif a été placé en phytotron avec des
conditions identiques à celles de l'exemple 1. Au bout d'un mois de culture,
de
quelques dizaines de grammes de matière fraîche, la biomasse totale a dépassé
le
kilogramme (tiges + feuilles + racines). Une analyse par HPLC a révélé la
présence de 8mg/1 d'alcaloïdes dans les 40 litres de solution nutritive, soit
un total
calculé de 320mg d'hyoscyamine et de scopolamine.
Conclusion : la croissance des Daturas en aéroponie est très rapide.
Les plantes sont saines et vigoureuses. En outre, elles relarguent
spontanément des
alcaloïdes dans la solution nutritive. Ce relargage peut être amélioré par un
traitement adapté tel que la perméabilisation, un changement de la solution
nutritive avec augmentation de la concentration en sels ou augmentation de la
température d'incubation des racines et éventuellement l'ajout de précurseurs
des
alcaloïdes tropaniques (Gontier 1993).
Il résulte de ce qui précède qu'on peut cultiver des Daturas en
aéroponie et dans ce cas, la croissance du matériel végétal est très rapide.
De
grandes quantités de biomasse peuvent être obtenues en un temps plus court
qu'en
hydroponie (aquiculture selon Morard 1995). De plus, il est possible de
récupérer
des métabolites secondaires dans la solution nutritive usagée. La teneur en
métabolites de cette solution est fonction de la quantité de biomasse et du
temps
de contact de la solution nutritive avec la partie racinaire de cette
biomasse. On
peut aussi imaginer d'augmenter la concentration en métabolites par un
traitement
adapté (perméabilisation, force ionique, température, élicitation).
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
- 17 -
Ainsi, dès lors qu'il est possible de faire pousser des plantes sur
plusieurs milliers de mètres carrés de serre (c'est le cas pour la tomate et
le
concombre) et dès lors qu'il est possible de recycler les solutions nutritives
usagées (c'est le cas en méthode de type aquiculture, aéroponique, NFT
(Nutrient
Film Technique), le procédé de l'invention peut permettre de cultiver sur
plusieurs
milliers de mètres carrés des plantes produisant des métabolites secondaires.
On
peut récupérer les métabolites relargués spontanément dans la solution
nutritive
usagée. On peut même forcer la libération de ces molécules ainsi que leur
biosynthèse avant relargage. Chez les plantes qui produisent des métabolites
secondaires qui sont ensuite "extrudés" ou "excrétés" à la surface des
feuilles
(Brown et Zobel 1990), on peut même récupérer ces composés par douchage
desdites plantes avec une solution adaptée et récupérer les lessivats
contenant les
métabolites d'intérêt. Un tel dispositif servira à produire des molécules
d'origine
végétale et ces molécules pourront avoir diverses applications telles que
thérapeutiques, cosmétiques, alimentaires ou non alimentaires. De préférence,
ces
molécules seront de masse moléculaire assez réduite et ne devront pas être
totalement insolubles dans l'eau additionnée ou non de tensioactif.
Bien entendu, l'invention n'est pas limitée au mode de réalisation
décrit et représenté aux dessins annexés. Des modifications restent possibles,
notamment du point de vue de la constitution des divers éléments ou par
substitution d'équivalents techniques, sans sortir pour autant du domaine de
protection de l'invention.
30
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
- 18 -
Bibliographie détaillée :
BENTLEY R., 1999, "Secondary metabolite biosynthesis : the first
century", Critical review in Biotechnology. 19,1,1-40.
BOITEL-CONTI M., GONTIER E., LABERCHE J.C., DUCROCQ
C. and SANGWAN-NORREEL B.S., 1995 - "Permeabilization of Datura innoxia
hairy roots for release of stored tropane alkaloids". Planta Medica, 61,287-
290.
BOITEL-CONTI M., GONTIER E., LABERCHE J.C., DUCROCQ
C., SANGWAN-NORREEL B.S., 1996 - "Inducer effect of Tween 20
permeabilization treatment used for release of stored tropane alkaloids in
Datura
innoxia Mill hairy root cultures". Plant Cell reports, 16, 241-244.
BOITEL-CONTI M., GONTIER E., ASSAF C., LABERCHE J.C..
and SANGWAN B,.Cultures de racines in vitro, Demande de brevet français
n 97 00641, 22 janvier 1997.
BOURGAUD F., BOUQUE V. and GUCKERT A., 1999,
"Production of flavonoids by Psoralea hairy root cultures". Plant Cell, Tissue
and
Organ Culture. 56, 97-104
BROWN S.A. and ZOBEL A.M., 1990, "Biosynthesis and
distribution of coumarins in the plant", Padova, 20-22 septembre 1990, Italy,
Ed :
Societa italiana di fitochimica and imprimitur editrice s.n.c, 15-37
GONTIER E., 1993, "Etude de la production d'alcaloïdes
tropaniques chez le Datura innoxia Mill. cultivé in vitro : impact
physiologique de
l'immobilisation des cellules dans une matrice d'alginate de calcium". Thèse
de
l'Université de Picardie Jules Verne, pp 200.
HERMAN E.B., 1993, "Recent advances in plant tissue culture II,
Secondary metabolite production" 1988-1993, Ed. Herman E.D., Agritech
concultants, Inc., Shrub oak, USA.
CA 02390263 2002-05-07
WO 01/33942 PCT/FR00/03095
- 19 -
HOOYKAAS P.J.J. and SCHILPERORT R.A., 1992,
"Agrobacterium and plant genetic engineering", Plant Molecular Biology, 19,
15,
15-38.
KETCHUM R.E.B , GIBSON D.M., CROTEAU R.B. and
SCHULER M. 1999, "The kinetics of taxoid accumulation in cell suspension
cultures of Taxus following elicitation with methyl jasmonate", Biotechnol.
and
Bioeng. 62, 1, 98-105
MORARD P., 1995, "Les cultures végétales hors sol", publications
agricoles Agen, ISBN : 2-9509297-0-2, pp304.
MUKUNDAN U., BHIDE V., SINGH G. and CURTIS WR, 1998,
"pH mediated release of betalains from transformed root cultures of Beta
vulgaris". Appl. Microbiol. And Biotechnol., 50, 241-245
MURASHIGE and SCOOG, 1962, "A revised medium for rapid
growth and bioassays with tobacco tissue cultures", Physiol. Plant, 15, 473-
497.
SHEN Y.C. and CHEN C.Y., 1997, "Taxanes from the roots of
Taxus marei". Phytochem., 44, 8, 1527-1533.
TODA T, KOYAMA H. and HARA T., 1999, "A simple hydroponic
method for the development of a high viable root system in Arabidopsis
thaliana.", Biosc. Biotechnol. Biochem. 63, 1, 210-212.
WEATHER P. CHEETHAM R.D. and DILORO A., 1991, "Process
for extracting enhanced amounts of plant secondary metabolites with limited
loss
of plant viability", brevet US-A 5413928.