Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
Inhibiteurs de kinases dépendantes des cyclines (CDK)
et de la ~lyco~ène synthase kinase-3 (GSK-3)
La présente invention a pour objet de nouveaux inhibiteurs de kinases
dépendantes des
cyclines, et en particulier de la cycline B 1/cdc2, et de la glycogène
synthase kinase-3
(GSK-3).
Le contrôle de la transition entre les différentes phases du cycle cellulaire
de la mitose
ou de la méiose est assurée par un ensemble de protéines dont les activités
enzymatiques sont associées à des états différents de phosphorylation. Ces
états sont
contrôlés par deux grandes classes d'enzymes : les kinases et les
phosphatases.
La synchronisation des différentes phases du cycle cellulaire permet ainsi la
réorganisation de l'architecture cellulaire à chaque cycle dans l'ensemble du
monde
1o vivant (microorganismes, levures, organismes supérieurs, plantes). Parmi
les kinases,
les kinases dépendantes des cyclines (CDKs) jouent un rôle majeur dans ce
contrôle du
cycle cellulaire. Les CDKs sont des complexes où les kinases portent l'
activité
enzymatique et les cyclines associées une activité régulatrice de cette
dernière.
L'association entre ces protéines n'est pas permanente, ces associations
varient au cours
du cycle dans des fenêtres précises de temps. Plusieurs cyclines et CDKs
coexistent
dans la cellule, mais les associations entre les cyclines et les CDKs sont
spécifiques. A
cette date, au moins dix CDKs ont été décrites (CDK1-X) (Detivaud et coll.,
Eur. J.
Biochena. (1999), 264, 55-66). L'enzyme cdc2 est appelée aussi CDKl (Meijer et
coll.,
Eur. J. Biochem. (1997), 243, 527-536). A l'exception de CDK3, chacune des
CDKs est
2o associée spécifiquement à un ou plusieurs membres de la famille des
cyclines
- cycline A : CDKl et CDK2 ;
- cyclines B1-B3 : CDK1 ;
- cycline C : CDKB ;
- cyclines D1-D3 : CDK1, CDK2, CDK4, CDKS et CDK6 ;
- cycline E : CDK2 ;
- cycline H : CDK7 ;
- cycline T : CDK9.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-2-
Les partenaires CDKs des cyclines F, G et T ne sont pas encore identifiés.
D'autres
kinases proches de cdc2 et d' autres cyclines ont été identifiées et la
caractérisation de
leurs fonctions est en cours comme par exemple dans les parasites (Le Roch et
coll.,
J. Biol. Clzem. (2000), 275, 8952-8958) ou encore dans les virus de l'herpès
(Card et
coll., EMBO (2000),19, 2877-2888).
Par ailleurs, l' activité enzymatique de ces différentes CDKs est contrôlée
par deux
autres familles d'enzymes qui travaillent en opposition (Dessus et Ozon, Prog.
Cell
Cycle Res. (1995), 1, 215-228). La première regroupe des kinases telles que
Weel et
Mikl qui désactivent les CDKs en phosphorylant certains acides aminés (Den
Haese et
l0 coll., Mol. Biol. Cell (1995), 6, 371-385). La seconde regroupe des
phosphatases telle
que la famille des Cdc25 qui active certaines CDKs en déphosphoiylant des
résidus
tyrosine et thréonine de CDKs (Gould et coll., Science (1990), 250, 1573-
1576). Il est à
noter que l'entrée dans les cellules peut se produire sans activation de la
kinase cdc2
dans des cellules traitées par l'acide okadaïque, suggérant que la phosphatase
cdc25C et
d'autres kinases pourraient jouer un rôle dans ce processus (Gowdy et coll.,
J. Cell Sci.
(1998),111, 3401-3410).
Pour compléter ce contrôle du cycle cellulaire, différents inhibiteurs
endogènes de
CDKs ont été identifiés : pl6ink4A, pl5ink4B, pl8ink4C, p27kip1, p57kip2,
p2lcipl
(Linares-Cruz et coll., Proc. Natl. Acad. Sci. U.S.A. (1998), 95, 1131-1135 ;
Goubin et
Ducommun, Oncogezze (1995), 10, 2281-2287). L'expression de ces inhibiteurs
endogènes est très souvent altérée dans les cellules tumorales.
Beaucoup de composés bloquant l'activité kinase des CDKs sont connus (Meijer
et
Kim, Methods Enzyzzzol. (1997), 283, 113-128). Ils sont étudiés dans plusieurs
domaines
thérapeutiques comme l'oncologie pour prévenir la division des cellules
tumorales
(McDonald et el-Deiry, Int. J. Oncol. (2000), 16, 871-886), la neurobiologie
pour
prévenir l' apoptose naturelle ou chimio-induite des cellules normales (par
exemple les
neurones) (Maas et coll., J. Neurochem. (1998), 70, 1401-1410 ; Park et coll.,
J. Neurosci. (1997), 17, 1256-1270), la néphrologie pour restaurer la fonction
rénale
altérée en cas de glomérulonéphrite (Pippin et coll., J. Clin. Izzvest.
(1997), 100, 2512-
2520) et la parasitologie pour bloquer le cycle de reproduction des parasites
(Knockaert
et coll., Chem. Biol. (2000), 7, 411-422 ; Le Roch et coll., J. Biol. Chefzz.
(2000), 275,
8952-8958).
Les inhibiteurs de kinases dépendant des cyclines sont donc susceptibles
d'être utilisés
comme médicaments, en particulier dans le traitement des maladies / désordres
décrits
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-3-
dans Meijer et coll., Phann.acol. Ther. (1999); 82, 279-284, et notamment
~ pour inhiber la prolifération tumorale en utilisation seule ou en
combinaison avec
d' autres traitements ;
~ pour inhiber la prolifération des cellules normales en utilisation seule ou
en
combinaison avec d'autres traitements (par exemple : athérosclérose,
angiogénèse,
psoriasis ou resténose) ;
~ dans la prévention de l' alopécie spontanée ;
~ dans la prévention de l'alopécie induite par des produits exogènes ;
~ dans la prévention de l' alopécie radio-induite ;
l0 ~ dans la prévention de l' apoptose spontanée ou induite des cellules
normales (ischémie) ;
~ dans la prévention de la méiose et la fécondation ;
~ dans la prévention de la maturation des oocytes ;
~ dans le traitement des infections virales ou rétrovirales (harpes, SmA,
cytomégalovirus) ;
dans la prévention et le traitement des maladies neurodégénératives (par
exemple les
tauopathies et notamment la maladie d'Alzheimer) ;
~ dans la prévention et le traitement des parasites (prolifération de
protozoaires, par
exemple de Trypanosomes, de Toxoplasmes ou de Plasmodium) ;
~ dans le traitement des myopathies ;
~ et plus généralement dans le traitement de toutes les maladies / tous les
désordres
correspondant à des utilisations rapportées pour les inhibiteurs de CDKs.
L'enzyme glycogène synthase kinase-3 (GSK-3) (Parker et coll., Eur. T.
Biochem.
(1983), 130, 227-234) est quant à elle une enzyme sérine/thréonine kinase. Il
existe
deux isoformes a et (3 issues de deux gènes distincts. L'isoforme a code pour
un
polypeptide de 51 kd. L'isoforme (3 code pour un polypeptide de 47 kd
présentant une
homologie de 85% en acides aminés avec GSK-3 a (Woodgett, EMBO (1990), 9,
2431-2438).
Les niveaux d'expression des messagers pour les isoformes a et (3 de GSK-3
sont
prédominants dans les testicules, le thymus, la prostate et les ovaires mais
faibles dans
le poumon et le rein. L'analyse de la détection des protéines dans les
différents tissus
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
_q_
montre un manque de corrélation entre la transcription et la traduction (Lau
et coll., J.
Pept. Res. (1999), 54, 85-91).
GSK-3 est sous une forme activée dans les cellules où elle inhibe la Glycogen
synthase
par phosphorylation directe (Eldar-Finkelman et coll., Proc. Natl. Acad. Sci.
U.S.A.
(1996), 93, 10228-10233)(3). L'insuline inhibe GSK-3 et entraîne l'activation
de la
glycogène synthase. L'inhibition de GSK-3 peut être observée avec d'autres
facteurs de
croissance comme l'Ifzsulirz-like Growth Factor-1 (IGF-I) ou l'Epidermal
Growtlz
Factor (EGF).
De plus, GSK-3 participe à d'autres processus biologiques incluant le contrôle
du cycle
cellulaire (Diehl et coll., Gefzes & Dev. (1998), 12, 3499-3511), la
distribution cellulaire
de la (3-caténine (Yost et coll., Genes & Dev. (1996), 10, 1443-1454), la
survie
cellulaire et l' activation de Nf-kappaB dans le contrôle de l' apoptose
(Hoeflich et coll.,
Nature (2000), 406, 86-90), le métabolisme du glucose (Summers et coll., J.
Biochem.
(1999), 274,17934-17940), la phosphorylation de la protéine tau (Spittaels et
coll., J.
Biol. Chem., 27 Septembre 2000), ou encore la dynamique des microtubules
(Krylova et
coll., J. Cell Biol. (2000),151(1), 83-94).
L'étude du rôle de GSK-3 est encore en cours et de nombreuses interventions
sont
probablement encore à décrire.
Parmi les molécules aujourd'hui rapportées comme inhibiteurs de GSK-3, on peut
principalement citer
~ le lithium, un agent thérapeutique utilisé dans le traitement de la
dépression depuis
de très nombreuses années, qui est un inhibiteur direct de GSK-3 ; en plus de
ces
effets sur la dépression, le lithium peut moduler la prolifération de cellules
normales
ou tumorales (Cui et coll., Braie Res. Dev. Braie Res. (1998), 111(2), 177-88)
;
~ les composés SB-216763 et SB-415286 qui inhibent spécifiquement GSK-3cc et
GSK-3(3 in vitro avec des Ki de l'ordre du nM. Ils stimulent la synthèse de
glycogène dans les cellules de foie humain en inhibant l' activité cellulaire
GSK-3
mesurée par l'activation de la glycogène synthase qui est la cible directe de
GSK-3
(Coghlan et coll., Chem. Biol. (2000), 7(10), 793-803) ;
~ la plupart des inhibiteurs de CDK, à l'exception de ceux dérivés des
purines, qui
sont rapportés comme des inhibiteurs puissants de GSK-3 (Meijer, Supplenzent
to
Caracer Clifzical Research (November 2000), 6, Proceedings of the NCI-EORTC-
ACCR Symposium, 043).
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-5-
Il existe par ailleurs des inhibiteurs de CDKs qui ne sont pas des inhibiteurs
de GSK-3,
comme les dérivés des purines (roscovitine, olomucine, purvalanol...) et la
butyrolactone. Les valeurs spécifiques d'inhibition de différents produits sur
les deux
classes d'enzymes sont reportées dans Leclerc et coll., J. Biol. Chena.,
septembre 2000.
Les applications thérapeutiques potentielles des inhibiteurs de GSK-3 sont
nombreuses
(Ferkey et coll., Dev. Biol. (2000), 225(2), 471-479)
~ la dépression ;
~ les désordres de l'humeur (Manji et coll., J. Clin. Psychiatry (2000),
61(Suppl. 9),
82-96) ;
1o ~ les désordres neurodégénératifs comme la maladie de Parkinson ;
~ les tauopathies, pathologies où la protéine tau est hyperphosphorylée comme
dans la
maladie d'Alzheimer ou certaines démences ;
~ les maladies prolifératives, et notamment le cancer ; et
~ le diabète (Nikoulina et coll., Diabetes (2000), 49(2), 263-71).
Certains dérivés de triazolopyrazines de structures plus simples étaient déjà
utilisés en
thérapie, par exemple en tant qu'inhibiteurs de phosphodiestérases (brevets
US 3,846,423 et US 3,865,824), en tant qu'antagonistes du facteur de
libération de
corticotropine (CRF) (demandes de brevet PCT WO 98/08847 et WO 99/67247) ou
encore dans le traitement de désordres respiratoires (brevet US 3,995,039), de
désordres
2o gastro-intestinaux (brevet US 4,565,815) ou de désordres cardio-vasculaires
et
circulatoires (brevet US 5,356,894).
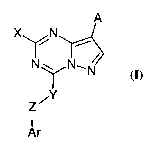
Les composés répondant à la formule générale (I)
A
X~N
~N'/w N ~ ~l
N
/Y
Z
I
Ar
(I)
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-6-
sous forme racémique, d'énantiomère ou toute combinaison de ces formes, dans
laquelle
A représente un atome d'hydrogène, un atome halogène, un radical formyle,
cyano,
nitro, guanidinoaminométhylènyle, (1,3-dihydro-2-oxoindol)-3-ylidèneméthyle,
alkylcarbonyle, aralkylcarbonyle ou hétéroaralkylcarbonyle, ou encore un
radical
-L-NR1R2 dans lequel L représente un radical alkylène et Rl et R2 sont choisis
indépendamment parmi un atome d'hydrogène et un radical alkyle ou R~ et RZ
pris
ensemble avec l'atome d'azote qui les porte forment un hétérocycle de 5 à 7
chaînons,
les chaînons complémentaires étant choisis indépendamment parmi le groupe
composé
1o de -CH2-, -NR3-, -S- et -O-, R3 représentant indépendamment à chaque fois
qu'il
intervient un atome d'hydrogène ou un radical alkyle ;
X représente un atome d'hydrogène, un radical alkylthio, aralkylthio,
alkylthioxo ou
aralkylthioxo, ou encore un radical NR4R5 dans lequel R4 représente un radical
alkyle,
un radical hydroxyalkyle, un radical cycloalkyle éventuellement substitué par
un ou des
radicaux choisis parmi les radicaux alkyle, hydroxy et amino, un radical
aralkyle dont le
radical aryle est éventuellement substitué par un ou des radicaux choisis
parmi un atome
halogène, le radical cyano, le radical nitro et les radicaux alkyle ou alkoxy,
ou encore R4
représente un radical hétéroaryle ou hétéroarylalkyle, le radical hétéroaryle
des radicaux
hétéroaryle ou hétéroarylalkyle étant éventuellement substitué par un ou des
radicaux
2o alkyle et RS représente un atome d'hydrogène, ou alors R4 et RS pris
ensemble avec
l' atome d' azote qui les porte forment un hétérocycle de 5 à 7 chaînons, les
chaînons
complémentaires étant choisis indépendamment parmi le groupe composé de -CH2-,
-NR6-, -S- et -O-, R6 représentant indépendamment à chaque fois qu'il
intervient un
atome d'hydrogène ou un radical alkyle ou hydroxyalkyle ;
~ représente NH ou un atome d' oxygène ;
Z représente une liaison ou un radical alkyle ou alkylthioalkyle ; et
Ar représente un radical aryle earbocyclique éventuellement substitué de 1 à 3
fois par
des radicaux choisis indépendamment parmi un atome halogène, le radical cyano,
le
radical nitro, un radical alkyle ou alkoxy et un radical NR7R8 dans lequel R7
et R8
représentent indépendamment un atome d'hydrogène ou un radical alkyle ou R7 et
R8
pris ensemble avec l' atome d' azote qui les porte forment un hétérocycle de 5
à 7
chaînons, les chaînons complémentaires étant choisis indépendamment parmi le
groupe
composé de -CH2-, -NR9-, -S- et -O-, R~ représentant indépendamment à chaque
fois
qu'il intervient un atome d'hydrogène ou un radical alkyle,
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
ou encore Ar représente un radical aryle hétérocyclique comptant 5 ou 6
chaînons et
dont le ou les hétéroatomes sont choisis parmi des atomes d'azote, d'oxygêne
ou de
soufre, lesdits hétéroatomes pouvant éventuellement être oxydés (Ar peut
représenter
par exemple le radical oxidopyridyle) et ledit radical aryle hétérocyclique
pouvant être
éventuellement substitué par un ou des radicaux choisis indépendamment parmi
les
radicaux alkyle, aminoalkyle, alkylaminoalkyle et dialkylaminoalkyle ;
ou les sels pharmaceutiquement acceptables des composés de formule générale
(I)
peuvent être utilisés pour préparer un médicament destiné à inhiber les
kinases
dépendant des cyclines (CDK).
Selon une variante préférée de l'invention, les composés de formule générale
(I)
peuvent être utilisés pour préparer un médicament destiné à inhiber à la fois
les kinases
dépendant des cyclines (CDK) et la glycogène synthase kinase-3 (GSK-3).
Par alkyle, lorsqu'il n'est pas donné plus de précision, on entend un radical
alkyle
linéaire ou ramifié comptant de 1 à 6 atomes de carbone. Par cycloalkyle,
lorsqu'il n'est
pas donné plus de précision, on entend un radical cycloalkyle comptant de 3 à
7 atomes
de carbone. Par aryle carbocyclique ou hétérocyclique, lorsqu'il n'est pas
donné plus de
précision, on entend un système carbocyclique ou hétérocyclique comprenant de
un à
trois cycles condensés dont l'un au moins est un cycle aromatique, un système
étant dit
hétérocyclique lorsque l'un au moins des cycles qui le composent comporte un
ou des
hétéroatomes (O, N ou S). Par aryle, lorsqu'il n'est pas donné plus de
précision, on
entend un radical aryle carbocyclique. Par hétéroaryle, on entend un radical
aryle
hétérocyclique.
Par les radicaux alkylcarbonyle, aralkylcarbonyle, hétéroaralkylcarbonyle,
alkylthio,
aralkylthio, alkylthioxo, aralkylthioxo, hydroxyalkyle, alkylthioalkyle,
aralkyle,
hétéroaralkyle, aminoalkyle, alkylaminoalkyle et dialkylaminoalkyle on entend
respectivement les radicaux alkylcarbonyle, aralkylcarbonyle,
hétéroaralkylcarbonyle,
alkylthio, aralkylthio, alkylthioxo, aralkylthioxo, hydroxyalkyle,
alkylthioalkyle,
aralkyle, hétéroaralkyle, aminoalkyle, alkylaminoalkyle et dialkylarninoalkyle
dont les
radicaux aryle, hétéroaryle et alkyle ont les significations indiquées
précédemment.
Par alkyle linéaire ou ramifié ayant de 1 à 6 atomes de carbone, on entend en
particulier
les radicaux méthyle, éthyle, propyle, isopropyle, butyle, isobutyle, sec-
butyle et
tert-butyle, pentyle, néopentyle, isopentyle, hexyle, isohexyle. Par
cycloalkyle, on
entend notamment les radicaux cyclopropyle et cyclohexyle. Par aryle
carbocyclique, on
entend notamment les radicaux phényle et naphtyle. Par aryle hétérocyclique,
on entend
notamment les radicaux pyrrolyle, furannyle, thiényle, pyridyle, imidazolyle,
oxazolyle,
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
_g_
thiazolyle, indolyle et quinolyle. Enfin, par halogène, on entend les atomes
de fluor, de
chlore, de brome ou d'iode.
Par sel pharmaceutiquement acceptable, on entend notamment des sels d'addition
d'acides inorganiques tels que chlorhydrate, bromhydrate, iodhydrate, sulfate,
phosphate, diphosphate et nitrate ou d'acides organiques tels que acétate,
maléate,
fumarate, tartrate, succinate, citrate, lactate, méthanesulfonate, p-
toluènesulfonate,
pamoate et stéarate. Entrent également dans le champ de la présente invention,
lorsqu'ils
sont utilisables, les sels formés à partir de bases telles que l'hydroxyde de
sodium ou de
potassium. Pour d'autres exemples de sels pharmaceutiquement acceptables, on
peut se
référer à "Sait selection for basic drugs", hzt. J. Pharna. (1986), 33, 201-
217.
Dans certains cas, les composés selon la présente invention peuvent comporter
des
atomes de carbone asymétriques. Par conséquent, les composés selon la présente
invention ont deux formes énantiomères possibles, c'est-à-dire les
configurations "R" et
"S". La présente invention inclut les deux formes énantiomères et toutes
combinaisons
de ces formes, y compris les mélanges racémiques "RS". Dans un souci de
simplicité,
lorsqu'aucune configuration spécifique n'est indiquée dans les formules de
structure, il
faut comprendre que les deux formes énantiomères et leurs mélanges sont
représentés.
En particulier, les composés de formule générale (I) définis précédemment, ou
leurs sels
pharmaceutiquement acceptables, pourront être utilisés pour préparer un
médicament
2o destiné à traiter les maladies / désordres / phénomènes naturels suivants :
la
prolifération tumorale, la prolifération des cellules normales, l' alopécie
spontanée,
l' alopécie induite par des produits exogènes, l' alopécie radio-induite, l'
apoptose
spontanée ou induite des cellules normales (ischémie), la méiose, la
fécondation, la
maturation des oocytes, les infections virales ou rétrovirales (herpes, SIDA,
cytomégalovirus), les maladies neurodégénératives (par exemple les tauopathies
dont
maladie d'Alzheimer), la prolifération de parasites (prolifération de
protozoaires, par
exemple de Trypanosomes, de Toxoplasmes ou de Plasmodium) et les myopathies.
Plus
particulièrement, les composés de formule générale (I) définis précédemment,
ou leurs
sels pharmaceutiquement acceptables, pourront être utilisés pour préparer un
médicament destiné à traiter les maladies / désordres / phénomènes naturels
suivants : la
prolifération tumorale, la prolifération des cellules normales, en particulier
la resténose,
et les tauopathies dont la maladie d'Alzheimer.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
_g_
De préférence, les composés selon l'invention seront tels qu'ils présentent au
moins
l'une des caractéristiques suivantes
~ A représente un atome d'hydrogène, un atome halogène, un radical formyle,
cyano,
nitro, guanidinoaminométhylènyle, (1,3-dïhydro-2-oxoindol)-3-ylidèneméthyle,
alkylcarbonyle ou aralkylcarbonyle, ou encore un radical -L-NRIRz dans lequel
L
représente un radical alkylène et Rl et R2 sont choisis indépendamment parmi
un
atome d'hydrogène et un radical alkyle ou Rl et R2 pris ensemble avec l'atome
d' azote qui les porte forment un hétérocycle de 5 à 7 chaînons, les chaînons
complémentaires étant choisis indépendamment parmi le groupe composé de -CH2-,
l0 -NR3-, -S- et -O-, R3 représentant indépendamment à chaque fois qu'il
intervient un
atome d'hydrogène ou un radical alkyle ;
~ X représente un atome d'hydrogène, un radical alkylthio ou alkylthioxo, ou
encore
un radical NR4R5 dans lequel R4 représente un radical alkyle, un radical
hydroxyalkyle, un radical cycloalkyle éventuellement substitué par un ou des
radicaux amino, un radical aralkyle dont 1e radical aryle est éventuellement
substitué
par un ou des radicaux choisis parmi un atome halogène et les radicaux alkyle
ou
alkoxy, ou encore R4 représente un radical hétéroaryle ou hétéroarylalkyle, le
radical
hétéroaryle des radicaux hétéroaryle ou hétéroarylalkyle étant éventuellement
substitué par un ou des radicaux alkyle et R5 représente un atome d'hydrogène,
ou
alors R4 et RS pris ensemble avec l' atome d' azote qui les porte forment un
hétérocycle de 5 à 7 chaînons, les chaînons complémentaires étant choisis
indépendamment parmi le groupe composé de -CHZ-, -NR6-, -S- et -O-, R6
représentant indépendamment à chaque fois qu'il intervient un atome
d'hydrogène
ou un radical alkyle ou hydroxyalkyle.
Plus préférentiellement, les composés selon l'invention seront tels qu'ils
présentent au
moins l'une des caractéristiques suivantes
~ A représente un atome halogène, un radical formyle,
guanidinoaminométhylènyle,
(1,3-dihydro-2-oxoindol)-3-ylidèneméthyle ou alkylcarbonyle, ou encore un
radical
-L-NR1R~ dans lequel L représente un radical méthylène et Rl et R2 sont
choisis
indépendamment parmi un atome d'hydrogène et un radical alkyle ou R1 et R2
pris
ensemble avec l' atome d' azote qui les porte forment un hétérocycle de 5 à 7
chaînons, les chaînons complémentaires étant choisis indépendamment parmi le
groupe composé de -CH2-, -NR3- et -O-, R3 représentant indépendamment à chaque
fois qu'il intervient un atome d'hydrogène ou un radical alkyle ;
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
- 10-
~ X représente un radical alkylthio ou alkylthioxo, ou encore un radical NR4R5
dans
lequel R4 représente un radical alkyle, un radical hydroxyalkyle, un radical
cycloalkyle éventuellement substitué par un ou des radicaux amino, ou encore
R4
représente un radical hétéroaryle ou hétéroarylalkyle, le radical hétéroaryle
des
radicaux hétéroaryle ou hétéroarylalkyle étant éventuellement substitué par un
ou
des radicaux alkyle et RS représente un atome d'hydrogène, ou alors R4 et RS
pris
ensemble avec l' atome d' azote qui les porte forment un hétérocycle de 5 à 7
chaînons, les chaînons complémentaires étant choisis indépendamment parmi le
groupe composé de -CH2-, -NR6- et -O-, R6 représentant indépendamment à chaque
fois qu'il intervient un atome d'hydrogène ou un radical alkyle ou
hydroxyalkyle ;
~ Z représente une liaison ou un radical alkyle ;
~ Ar représente un radical aryle carbocyclique éventuellement substitué de 1 à
3 fois
par des radicaux choisis indépendamment parmi un atome halogène et un radical
NR7R8 dans lequel R7 et R$ représentent indépendamment un atome d'hydrogène ou
i5 un radical alkyle ou R7 et R8 pris ensemble avec l' atome d' azote qui les
porte
forment un hétérocycle de 5 à 7 chaînons, les chaînons complémentaires étant
choisis indépendamment parmi le groupe composé de -CH2-, -NR7- et -O-, R7
représentant indépendamment à chaque fois qu'il intervient un atome
d'hydrogène
ou un radical alkyle,
ou encore Ar représente un radical aryle hétérocyclique comptant 5 ou 6
chaînons et
dont le ou les hétéroatomes sont choisis parmi des atomes d'azote et
d'oxygêne,
lesdits hétéroatomes pouvant éventuellement être oxydés et ledit radical aryle
hétérocyclique pouvant être éventuellement substitué par un ou des radicaux
choisis
indépendamment parmi les radicaux alkyle, aminoalkyle, alkylaminoalkyle et
dialkylaminoalkyle.
Encore plus préférentiellement, les composés selon l'invention seront tels
qu'ils
présentent au moins l'une des caractéristiques suivantes
~ A représente un atome halogène, un radical formyle,
guanidinoaminométhylènyle,
(1,3-dihydro-2-oxoindol)-3-ylidèneméthyle ou alkylcarbonyle, ou encore un
radical
3o -L-NR1R2 dans lequel L représente un radical méthylène et Rl et R2 sont
choisis
indépendamment parmi un atome d'hydrogène et un radical alkyle ou Rl et R2
pris
ensemble avec l' atome d' azote qui les porte forment un hétérocycle de 5 à 7
chainons, les chaînons complémentaires étant choisis indépendamment parmi le
groupe composé de -CH2-, -NR3- et -O-, R3 représentant indépendamment à chaque
fois qu'il intervient un atome d'hydrogène ou un radical alkyle ;
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-11-
~ X représente un radical alkylthio (et de préférence méthylthio) ou
alkylthioxo (et de
préférence méthylthioxo), ou encore un radical NRøRS dans lequel R4 représente
un
radical alkyle, un radical hydroxyalkyle, un radical cycloalkyle (et de
préférence
cyclohexyle) éventuellement substitué par un ou des radicaux amino, ou encore
R4
représente un radical hétéroaryle ou hétéroarylalkyle, le radical hétéroaryle
des
radicaux hétéroaryle ou hétéroarylalkyle étant éventuellement substitué par un
ou
des radicaux alkyle et RS représente un atome d'hydrogène, ou alors R4 et RS
pris
ensemble avec l' atome d' azote qui les porte forment un hétérocycle de 5 à 7
chaînons, les chaînons complémentaires étant choisis indépendamment parmi 1e
groupe composé de -CH2- et -NR6-, R6 représentant indépendamment à chaque fois
qu'il intervient un atome d'hydrogène ou un radical alkyle ou hydroxyalkyle ;
~ Y représente NH ;
Z représente une liaison ou un radical -CH2- ;
~ Ar représente un radical aryle carbocyclique (ledit radical aryle
carbocyclique étant
de préférence un radical phényle) éventuellement substitué de 1 à 3 fois par
des
radicaux choisis indépendamment parmi un atome halogène et un radical NR7Rs
dans lequel R7 et R$ représentent indépendamment un atome d'hydrogène ou un
radical alkyle ou R' et R8 pris ensemble avec l'atome d'azote qui les porte
forment
un hétérocycle de 5 à 7 chaînons, les chaînons complémentaires étant choisis
indépendamment parmi le groupe composé de -CH2- et -NR9-, R9 représentant
indépendamment à chaque fois qu'il intervient un radical alkyle,
ou encore Ar représente un radical aryle hétérocyclique comptant 5 ou 6
chaînons et
dont le ou les hétéroatomes sont choisis parmi des atomes d'azote et d'oxygène
(ledit radical aryle hétérocyclique étant de préférence un radical pyridyle),
lesdits
hétéroatomes pouvant éventuellement être oxydés et ledit radical aryle
hétérocyclique pouvant être éventuellement substitué par un ou des radicaux
choisis
indépendamment parmi les radicaux alkyle, aminoalkyle, alkylaminoalkyle et
dialkylaminoalkyle.
Seront par ailleurs particulièrement préférés les composés décrits dans les
exemples 1 à
33 ci-après. Encore plus particulièrement préférés seront les composés des
exemples 1 à
8, 11, 12, 1S, 18, 26 et 33.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
- 12-
L'invention a de plus pour objet, en tant que médicaments, les composés de
formule
générale (II)
A
X~ N
N ~ N~.NI
/Y
Z
I
Ar
(II)
sous forme racémique, d'énantiomère ou toute combinaison de ces formes, dans
laquelle
A représente un radical formyle, cyano, nitro, guanidinoaminométhylènyle,
(1,3-dihydro-2-oxoindol)-3-ylidèneméthyle, alkylcarbonyle, aralkylcarbonyle ou
hétéroaralkylcarbonyle, ou encore un radical -L-NR1R2 dans lequel L représente
un
radical alkylène et Rl et R2 sont choisis indépendamment parmi un atome
d'hydrogène
et un radical alkyle ou Rl et R2 pris ensemble avec l'atome d'azote qui les
porte forment
1o un hétérocycle de 5 à 7 chaînons, les chaînons complémentaires étant
choisis
indépendamment parmi le groupe composé de -CH2-, -NR3-, -S- et -O-, R3
représentant
indépendamment à chaque fois qu'il intervient un atome d'hydrogène ou un
radical
alkyle ;
X représente un atome d'hydrogène, un radical alkylthio, aralkylthio,
alkylthioxo ou
aralkylthioxo, ou encore un radical NR4R5 dans lequel R4 représente un radical
alkyle,
un radical hydroxyalkyle, un radical cycloalkyle éventuellement substitué par
un ou des
radicaux choïsis parmi les radicaux alkyle, hydroxy et amino, un radical
aralkyle dont le
radical aryle est éventuellement substitué par un ou des radicaux choisis
parmi un atome
halogène, le radical cyano, le radical nitro et les radicaux alkyle ou alkoxy,
ou encore R4
2o représente un radical hétéroaryle ou hétéroarylalkyle, le radical
hétéroaryle des radicaux
hétéroaryle ou hétéroarylalkyle étant éventuellement substitué par un ou des
radicaux
alkyle et RS représente un atome d'hydrogène, ou alors R4 et RS pris ensemble
avec
l' atome d' azote qui les porte forment un hétérocycle de 5 à 7 chaînons, les
chaînons
complémentaires étant choisis indépendamment parmi le groupe composé de -CH2-,
-
NR6-, -S- et -O-, R6 représentant indépendamment à chaque fois qu'il
intervient un
atome d'hydrogène ou un radical alkyle ou hydroxyalkyle ;
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-13-
Y représente NH ou un atome d' oxygène ;
Z représente une liaison ou un radical alkyle ou alkylthioalkyle ; et
Ar représente un radical aryle carbocyclique éventuellement substitué de 1 à 3
fois par
des radicaux choisis indépendamment parmi un atome halogène, le radical cyano,
le
radical nitro, un radical alkyle ou alkoxy et un radical NR7R8 dans lequel R7
et R8
représentent indépendamment un atome d'hydrogène ou un radical alkyle ou R7 et
R$
pris ensemble avec l' atome d' azote qui les porte forment un hétérocycle de 5
à 7
chaînons, les chaînons complémentaires étant choisis indépendamment parmi le
groupe
composé de -CH2-, -NR9-, -S- et -O-, R9 représentant indépendamment à chaque
fois
qu'il intervient un atome d'hydrogène ou un radical alkyle,
ou encore Ar représente un radical aryle hétérocyclique comptant 5 ou 6
chaînons et
dont le ou les hétéroatomes sont choisis parmi des atomes d'azote, d'oxygène
ou de
soufre, lesdits hétéroatomes pouvant éventuellement être oxydés (Ar peut
représenter
par exemple le radical oxidopyridyle) et ledit radical aryle hétérocyclique
pouvant être
éventuellement substitué par un ou des radicaux choisis indépendamment parmi
les
radicaux alkyle, aminoalkyle, alkylaminoalkyle et dialkylaminoalkyle ;
étant entendu toutefois que lorsque A ne représente pas un radical cyano,
nitro ou
guanidinoaminométhylènyle alors
- soit Z représente un radical alkyle ou thioalkyle ;
- soit X représente un radical NR4R5 dans lequel R4 représente un radical
aralkylthio,
aralkylthioxo ou hydroxyalkyle, l'un des radicaux alkyle, alkylthio ou
alkylthioxo
comptant de 2 à 5 atomes de carbone, un radical cycloalkyle éventuellement
substitué par un ou des radicaux choisis parmi les radicaux alkyle, hydroxy et
amino, un radical aralkyle dont le radical aryle est éventuellement substitué
par un
ou des radicaux choisis parmi un atome halogène et les radicaux alkyle ou
alkoxy,
ou encore R4 représente un radical hétéroaryle ou hétéroarylalkyle, le radical
hétéroaryle des radicaux hétéroaryle ou hétéroarylalkyle étant éventuellement
substitué par un ou des radicaux alkyle et R5 représente un atome d'hydrogène,
ou
alors R4 et RS pris ensemble avec l' atome d' azote qui les porte forment un
3o hétérocycle de 5 à 7 chaînons, les chaînons complémentaires étant choisis
indépendamment parmi le groupe composé de -CH2-, -NR6-, -S- et -O-, R6
représentant indépendamment à chaque fois qu'il intervient un atome
d'hydrogène
ou un radical alkyle ou hydroxyalkyle ;
ou les sels pharmaceutiquement acceptables des composés de formule générale
(II).
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
- 14-
En particulier, l'invention concerne en tant que médicaments les composés des
exemples 3 à 33.
Elle concerne de même les compositions pharmaceutiques comportant, à titre de
principe actif, au moins un composé de formule générale (II), l'un des
composés des
exemples 3 à 33 ou un sel pharmaceutiquement acceptable d'un de ces derniers.
Elle
concerne enfin, à titre de produits industriels nouveaux, les composés de
formule
générale (II) ou leurs sels ou l'un des composés des exemples 3 à 33 ou un sel
d'un de
ces derniers.
D'une façon générale, les mêmes préférences que celles indiquées précédemment
pour
les utilisations des composés de formule générale (I) sont applicables
f~iutatis mutandis
aux composés de formule générale (II) des médicaments, compositions
pharmaceutiques et produits selon l'invention.
Les compositions pharmaceutiques contenant un composé de l'invention peuvent
être
sous forme d'un solide, par exemple des poudres, des granules, des comprimés,
des
gélules, des liposomes ou des suppositoires. Les supports solides appropriés
peuvent
être, par exemple, le phosphate de calcium, le stéarate de magnésium, le talc,
les sucres,
le lactose, la dextrine, l'amidon, la gélatine, la cellulose, la cellulose de
méthyle, la
cellulose carboxyméthyle de sodium, la polyvinylpyrrolidine et la cire.
Les compositions pharmaceutiques contenant un composé de l'invention peuvent
aussi
se présenter sous forme liquide, par exemple, des solutions, des émulsions,
des
suspensions ou des sirops. Les supports liquides appropriés peuvent être, par
exemple,
l'eau, les solvants organiques tels que le glycérol ou les glycols, de même
que leurs
mélanges, dans des proportions variées, dans l'eau.
L'administration d'un médicament selon l'invention pourra se faire par voie
topique,
orale, parentérale, par injection intramusculaire, etc.
La dose d'administration envisagée pour médicament selon l'invention est
comprise
entre 0,1 mg à 10 g suivant le type de composé actif utilisé.
Conformément à l'invention, on peut préparer les composés de formule générale
(I) par
les procédés décrits ci-après.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-15-
Préparation des composés de formule générale (I)
Un certain nombre de triazolopyrazines de formule générale (I) peut être
facilement
préparé selon les procédures décrites dans le brevet US 4,565,815.
Les autres composés de formule générale (I) selon l'invention peuvent être
préparés en
quelques étapes, schéma 1, à partir des composés de formule générale (III)
dans
laquelle A' représente un atome d'hydrogène ou un atome halogène et X'
représente un
atome d'hydrogène ou un radical alkylthio. La préparation des composés de
formule
générale (III) est décrite dans le brevet US 4,565,815 ou dans Kobe et coll.,
J. Het.
Chezzz. (1974),11(2), 199 et s.
A' A
--
X \ /N ~ ~ X\ /N
N ~ N~N, ~ N ~ N~N
CI ,Y
Z
I
Ar
(III) (I)
Schéma 1
Différents cas doivent être considérés selon la nature des substituants A, X
et Y-Z-Ar
des composés de formule générale (I).
Préparation des comuosés de formule générale (I) dans lesguels A représente un
atome d'hydro ène ou un atome halogène
Prés?af_ation.des_çoo?zposés_defo>?nule_générale_~1)_dans lesguelsX
représeizte_un atonie
d'hydrogène ou_alky_lthio
Dans ce cas, le composé de formule générale (III) de départ est tel que X
représente H
ou alkylthio et A représente H ou un atome halogène Hal. La stratégie de
synthèse est
résumée dans le schéma 2 ci-après.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-16-
A Ar-Z-YH A
X N (IV) X N
~/ //
N~N~N N~N~N
CI /Y
Z
(III) är (I)
Schéma 2
Le composé de formule générale (III) est soumis à une réaction de substitution
nucléophile avec le composé de formule générale (IV) pour donner le composé de
formule générale (I). La réaction peut, si besoin, être effectuée dans un
solvant comme
le chloroforme.
Préparation__des__çom~?osés__de_ fonnule__~énérale__~1)_ darzs_
lesq_uels__X__représente_ ufz
radical NR4R5
Dans ce cas, le composé de formule générale (III) de départ est tel que X'
représente
alkylthio et de préférence méthylthio. La stratégie de synthèse est résumée
dans le
schéma 3 ci-après.
A Ar_Z_YH A
X~~N i (I~ X~~N
N ~ N~N, N ~ N~N%
CI /Y
Z
(III)
är (V)
1) acide m-chloroperbenzoïque
2) R4NHRs
R5
I A
R~N~N i
N ~ N~NI
Z,Y
är (I)
Schéma 3
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-17-
Le composé de formule générale (III) est d'abord soumis à une réaction de
substitution
avec l'alcool ou l'amine de formule générale (IV) pour donner le composé de
formule
générale (V). Le composé de formule générale (V) est ensuite traité avec de
l'acide
f~iéta-chloroperbenzoïque puis avec l' amine de formule générale R4NHR5 pour
donner
finalement le composé de formule générale (I). Ces réactions sont effectuées
de
préférence dans un solvant comme le chloroforme.
Pré,~aration__des_ ~om,~osés__de_ formule__pétzérale__~1)_ dans_
lesquels__X__représente_ un
radiçal alkylthioxo :_
Cette préparation est effectuée de façon analogue à celle décrite dans le
schéma 3, la
seule différence étant que le dérivé thioxo est isolé lors de la deuxième
étape au lieu
d' être substitué par l' amine de formule générale R4NHR5 (cf. schéma 3bis).
A Ar_Z_YH A
S N (IV) ~S N
Alk ~ i Alk ~ i
N ~ N~N N ~ N,.N
CI ,Y
Z
(III) är (V)
acide m-chloroperbenzoïque
O A
AIk~S~N
N ~ N, ~l
N
Z,Y
är (I)
Schéma ibis
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-18-
Préparation des composés de formule générale (I) dans lesguels A ne représente
pas un atome d'hydro~ène ou un atome halogène
Pré_paration__des__~omposés__de_ formule__~éfiérale__~1) _ dafzs_
lesq_uels__A__représente_ ufi
radiçal =~HZ-NR1R2_:
Lorsque A représente un radical -L-NR1R2 dans lequel L représente -CHZ-, on
utilise par
exemple comme composé de départ le composé de formule générale (VI)
représentée
dans le schéma 4. Ce composé est un composé de formule générale (I) dans
laquelle A
représente H et sa synthèse a donc été décrite précédemment. Le composé de
formule
générale (VI) est par exemple d' abord traité avec un excès de chlorure de
1o (chlorométhylène)-diméthylammonium dans un solvant polaire aprotique tel
qu'un
mélange acétonitrile-diméthylformamide. Ceci permet d' obtenir des composés de
formule générale (I) dans lesquels A représente le radical formyle. Ces
composés
permettent à l'homme du métier de construire par des réactions chimiques
classiques
différents composés de formule générale (I) avec des radicaux A variés.
Dans le cas particulier où A représente un radical -L-NR1R2 dans lequel L
représente
-CHZ- et Rl et R2 sont des groupes méthyle, on peut obtenir directement le
composé de
formule générale (I) à partir du composé de formule générale (VI) par réaction
avec du
chlorure de (chlorométhylène)-diméthylammonium en excès suivi par l' action de
NaBH4.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
- 19-
H -N -~- CI- CHO
X N
CI
X\ /N H ~ H
N ~ N~N~ 2) NaOAc (aq.) N ~ N~N~
Z ~Y Z ~Y
är (~) är (I)
1 ) C ~ \ + CI- 2~ N (OAc)3BH,
NaBH4 ou LiAIH4
2) NaBH4 (par exemple)
N N R1
X N ~ X N R2
i ~ i
H ~ / H
N~N~N N~N~N
Z/Y Z/Y
är (I) är (I)
Schéma 4
Préparatiof~__des__çomposés__de_ formule__,~énérale__,~I)_ dans_
lesq_uels__A__représente_ un
radical -L-NRI R2 : .
Ces composés peuvent être préparés de façon classique à partir du composé de
formule
générale (VI), par exemple selon la procédé représenté dans le schéma 5. Le
composé
de formule générale (VI) peut pax exemple être traité à basse température (par
exemple
à -78 °C) successivement par du butyllithium dans un solvant polaire
aprotique tel
l'éther éthylique ou le tétrahydrofuranne puis le composé de formule générale
(VII)
dans lequel Hal représente un atome halogène, avant d'être hydrolysé par de
l'eau
légèrement acidifiée pour donner le composé de formule générale (I) dans
lequel A
1o représente un radical -L-NR1R2.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-20-
1) BuLi
R
2) /L_.N R1
H Hal R2 L-N
X N (VII) X N ~R2
i ~ i i
H ~ / H
N~N~N 3) H20~ H30+ N~N~N
Z ~Y Z ~Y
I
Ar (VI) Ar (I)
Schéma 5
Préparation__des__çom~osés__de_ formule__,~éizérale__~I?_ dans_
lesq_uels__A__représen_te_ un
radial alky_lçarbofzyle,_ aralkxlçarbonyle~_hétéroaralkylçarbonyle__:
Lorsque l' on souhaite obtenir un composé de formule générale (I) dans
laquelle A soit
un radical -CO-~ dans lequel O représente un radical alkyle, aralkyle ou
hétéroaralkyle,
le composé de formule générale (VI) est traité, schéma 6, par le composé de
formule
générale 0-COCI en présence de AlCl3 dans un solvant adapté, par exemple dans
du
dichlorométhane.
O
H
X N ~ 0-COCI, AICI3 X N
H ~ ~ H
N~N~N N~N~N
Z /Y Z ~Y
är (VI) är (I)
Schéma 6
Préparation__des__çofnposés__de_formule_~énérale__~(1)_ dans_
lesq_uels__A__représente_ ufz
radiçal_guanidinoaminométhylènyle_ou_,(1,3=dilzxdro=2=oxoindol)=3_y_lidèrzemétl
zy_le
1o Le composé de formule générale (I) dans lequel A représente un radical
formyle est
converti en le composé de formule générale (I) dans lequel A représente un
radical
guanidinoaminométhylènyle, schéma 7, par réaction avec le bicarbonate de
l'aminoguanidine dans un solvant comme l'éthanol et en présence catalytique
d'une
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-21-
base comme la pipéridine. Le composé de formule générale (I) dans lequel A
représente
un radical formyle est converti en le composé de formule générale (I) dans
lequel A
représente un radical (1,3-dihydro-2-oxoindol)-3-ylidèneméthyle par le même
type de
réaction, l'oxoindole remplaçant le bicarbonate de l'aminoguanidine.
H2N,N NH NH
CHO HC03 ~ ~N'N~NH
X N H2N X N 2
i ~ i
e H ~ ~ H
N ~ N~N EtOH N w N~N
traces pipéridine
Z /Y Z /Y
är (I) är (I)
N
O
X\ /N
EtO ~'~H
traces pipéridine N
Z /Y
I
Ar (I)
Schéma 7
Préparation__des__çomposés__de_ for»lule__,~énérale__jl)_ dans_
les_q_uels__A__représen~e_ uf~
raeliçal ~y_ano
Le composé de formule générale (I) dans lequel A représente un radical formyle
est
converti en le composé de formule générale (I) dans lequel A représente un
radical
cyano, schéma 8, par réaction avec l'hydroxylamine dans un mélange de formate
de
1o sodium et d'acide formique. La réaction est de préférence effectuée en
chauffant.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-22-
CHO CN
X N ~ X N
H ~ ~ H
N ~ N~N NH20H N ~ N''N
HCOONa/HCOOH
Z /Y Z /Y
är (I) är (I)
Schéma 8
Préparatiofi__des__çom~osés__de_ formule__~éTZérale__~1~_ daizs_
lesq_uels__A__re~résente__un
radical Tzitro
Ces composés sont facilement préparés à partir de composés de formule générale
(I)
dans lesquels A représente un atome d'hydrogène par diverses méthodes de
nitration,
par exemple en faisant réagir ces derniers avec un mélange d'acide nitrique et
d'acide
sulfurique ou avec des sels nitrate inorganiques en présence d'un acide comme
l'acide
sulfurique (cf. Cao et coll., Synthesis (1998), 1724). L'introduction des
autres groupes
(X et Y-Z-Ar) est effectuée, de préférence après, en utilisant des procédés
analogues à
ceux décrits précédemment.
1o A moins qu'ils ne soient définis d'une autre manière, tous les termes
techniques et
scientifiques utilisés ici ont la même signification que celle couramment
comprise par
un spécialiste ordinaire du domaine auquel appartient cette invention. De
même, toutes
les publications, demandes de brevets, tous les brevets et toutes autres
références
mentionnées ici sont incorporées par référence.
Les exemples suivants sont présentés pour illustrer les procédures ci-dessus
et ne
doivent en aucun cas être considérés comme une limite à la portée de
l'invention.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-23-
EXEMPLES
Exemple 1 : 8-bromo-4-[Z-(5-méthyl-4-imidazolylméthylthio)-éthylamino]-
2-méthylthiopyrazolo[1,5-a]-1,3,5-triazine
Ce composé a été préparé selon la méthode décrite dans le brevet américain
4,565,815.
Spectrométrie de masse (Electrospray) : 416,0.
Exemple 2 : 8-bromo-4-{2-{[5-(diméthylamino)méthyl-2-furannyl]-
méthyl}thio}éthylamino-2-méthylthiopyrazolo[1,5-a]-1,3,5-triazine
Ce composé a été préparé selon la méthode décrite dans le brevet américain
4,565,815.
Spectrométrie de masse (Electrospray) : 459,1.
Exemple 3 : 8-bromo-4-(3-(1-imidazolyl-propylamino)-2-méthylthio-
pyrazolo[1,5-a]-1,3,5-triazine
A une solution de 8-bromo-4-chloro-2-méthylthiopyrazolo[1,5-a]-1,3,5-triazine
(50 mg)
dans un mélange de 2 ml de chloroforme et 2 ml de méthanol, on ajoute 60 p,1
de
1-(3-aminopropyl)imidazole et le mélange est agité une nuit à température
ambiante.
Après évaporation des solvants, le résidu est partagé entre le chloroforme et
l' eau. La
phase organique est ensuite séchée sur MgS04, puis, après évaporation des
solvants, le
résidu est soumis à une chromatographie préparatrice sur gel de silice en
utilisant un
mélange chloroforme / méthanol 4/1 comme éluant. La fraction appropriée est
isolée,
extraite avec un mélange chloroforme-méthanol et les solvants sont évaporés à
sec sous
vide. On obtient un solide blanc. Chromatographie sur Couche Mince (gel de
silice ;
chloroforme / méthanol en mélange 4/1) : Rf - 0,32. Spectrométrie de
masse (Electrospray) : 368,4 ; 370,1.
Les cof~aposés des exemples 4 à Il sont préparés selon ma mode opératoire
analogue à
celui de l'exemple 3.
Exemple 4 : 8-bromo-4-[(3-pyridyl)méthylamino]-2-méthylthio-pyrazolo
[1,5-a]-1,3,5-triazine
Spectrométrie de masse (Electrospray) : 351,0 ; 353,0.
Exemple 5 : 8-bromo-4-(3-chloroanilino)-2-méthylthio-pyrazolo
[1,5-a]-1,3,5-triazine
3o Spectrométrie de masse (Electrospray) : 369,9 ; 371,9.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-24-
Exemple 6 : 8-bromo-2-méthylthio-4-(4-pyridylméthylamino)pyrazolo[1,5-a]-
1,3,5-triazine
Spectrométrie de masse (Electrospray) : 351,0 ; 352,9.
Exemple 7 : 8-bromo-2-méthylthio-4-(2-pyridyléthylamino)pyrazolo[1,5-a]-
1,3,5-triazine
Spectrométrie de masse (Electrospray) : 365,0 ; 366,9.
Exemple 8 : 8-bromo-2-méthylthio-4-(2-pyridylméthylamino)pyrazolo[1,5-a]-
1,3,5-triazine
Solide blanc. Spectrométrie de masse (Electrospray) : 351,0 ; 352,9.
1o Exemple 9 : 8-bromo-2-méthylthio-4-(4-fluorophénylméthylamino)-
pyrazolo[1,5-a]-1,3,5-triazine
Solide blanc. Spectrométrie de masse (Electrospray) : 367,9 ; 369,9.
Exemple 10 : 8-bromo-2-méthylthio-4-(3-fluorophénylméthylamino)-
pyrazolo[1,5-a]-1,3,5-triazine
Solide blanc. Spectrométrie de masse (Electrospray) : 367,9 ; 369,8.
Exemple 11 : 8-bromo-2-méthylthio-4-[4-N-méthylpipérazinyl)anilino]-
pyrazolo[1,5-a]-1,3,5-triazine
Poudre blanche. Point de fusion : 223-224 °C.
Exemple 12 : 8-bromo-2-(1R-isopropyl-2-hydroxyéthylamino)-
4-(3-chloroanilino)-pyrazolo[1,5-a]-1,3,5-triazine
12.1) 8-bro~io-4-(3-claloroaiailino)-2-méthylthioxo pyrazolo~l,5-aj-1,3,5-
triazifae
A une solution de 8-bromo-4-(3-chloroanilino)-2-méthylthio-pyrazolo[1,5-a]-
1,3,5-triazine (200 mg ; préparée de façon analogue à celle utilisée pour les
composés
des exemples 3 à 5 à partir de la 8-bromo-4-chloro-2-méthylthiopyrazolo[1,5-a]-
1,3,5-triazine et de la 3-chloroaniline) dans 5 ml de chloroforme sont ajoutés
280 mg
d' acide m-chloroperbenzoïque. Le mélange est agité une nuit à température
ambiante.
Le milieu réactionnel est dilué avec du chloroforme (10 ml) et est lavé avec
une
solution aqueuse de NaHS03 puis une solution aqueuse de NaHC03. On sèche la
phase
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-25-
organique sur MgS04 et évapore les solvants à sec sous vide. On obtient 200 mg
d'un
solide brun. Spectrométrie de masse (Electrospray) : 402,0 ; 404,0.
12.2) 8-brorno-2-(1R-isopropyl-2-IZydroxyéthylarnino)-4-(3-chloroanilino)-
pyrazolo(1,5-a)-1,3,5-triazirze
A une suspension partielle de l'intermédiaire 12.1 (130 mg) dans 5 ml de
chloroforme,
on ajoute 2 ml de solution de R-Valinol dans du propanol (50 mg/ml). Le
mélange
résultant est agité une nuit à température ambiante. Après évaporation des
solvants, le
résidu est soumis à une chromatographie préparatrice sur gel de silice en
utilisant un
mélange chloroforme / acétone (9:1) comme éluant. La fraction appropriée est
isolée,
extraite avec un mélange chloroforme-acétone et les solvants sont évaporés à
sec sous
vide. On obtient un solide brun. CCM (gel de silice ; chloroforme/acétone en
mélange
9/1) : Rf = 0,28. Spectrométrie de masse (Electrospray) : 425,1 ; 427,0.
Les composés des exemples 13 à 17 sont préparés selon un mode opératoire
analogue à
celui de l'exemple 12.
Exemple 13 : 8-bromo-2-(2-aminocyclohexylamino)-4-(3-chloroanilino)-
pyrazolo[1,5-a]-1,3,5-triazine
Solide jaune pâle. Spectrométrie de masse (Electrospray) : 436,1 ; 438,1.
Exemple 14 : 8-bromo-2-(1R-isopropyl-2-hydroxyéthylamino)-4-(3-oxido-
pyridylméthylamino)-pyrazolo[1,5-a]-1,3,5-triazine
2o Liquide j aune-brun pâle. Spectrométrie de masse = 422,1.
Exemple 15 : 8-bromo-2-(1R-isopropyl-2-hydroxyéthylamino)-
4-(3-fluorophénylméthylamino)-pyrazolo[1,5-a]-1,3,5-triazine
Spectrométrie de masse (Electrospray) : 424,9.
Exemple 16 : 8-bromo-2-(4'-hydroxyéthylpipérazinyl)-4-(3-oxido-
pyridylméthylamino)-pyrazolo[1,5-a]-1,3,5-triazine
Spectrométrie de masse (Electrospray) : 451,0.
Exemple 17 : 8-bromo-2-(4'-hydroxyéthylpipérazinyl)-4-(3-pyridylméthylamino)-
pyrazolo [1,5-a]-1,3,5-triazine
Spectrométrie de masse (Electrospray) : 435,0.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-26-
Exemple 18 : 2,4-bis-(3-pyridylméthylamino)-8-bromo-pyrazolo[1,5-a]-
1,3,5-triazine
A une solution de 8-bromo-4-chloro-2-méthylthio-pyrazolo[1,5-a]-1,3,5-triazine
(270 mg) dans 10 ml de chloroforme sont ajoutés 430 mg d'acide
m-chloroperbenzoïque. Le mélange est agité une heure à température ambiante.
4 équivalents de 3-aminométhylpyridine sont ajoutés et le mélange est agité
une nuit à
température ambiante. Après dilution avec du chloroforme (20 ml) et lavage
avec de
l'eau, la phase organique récupérée est séchée sur MgS04. Aprês évaporation
des
solvants, le résidu est soumis à une chromatographie préparatrice sur gel de
silice en
1o utilisant un mélange chloroforme / méthanol 9515 comme éluant. La fraction
appropriée
est isolée, extraite avec un mélange chloroforme - méthanol et les solvants
sont
évaporés à sec sous vide. On obtient un solide jaune. CCM (gel de silice ;
chloroforme l méthanol en mélange 9/1) : Rf = 0,33. Spectrométrie de masse
(Electrospray) : 411,2 ; 413,2.
Exemple 19 : 2,4-bis-(2-pyridylméthylamino)-8-bromo-pyrazolo[1,5-a]-
1,3,5-triazine
Ce composé est préparé selon un mode opératoire analogue à celui décrit pour
l'exemple 17. Solide jaune. Spectrométrie de masse (Electrospray) : 383,1 ;
385,1.
Exemple 20 : 8-acétyl-4-(3-pyridylméthylamino)-2-méthylthiopyrazolo[l,5-a]-
1,3,5-triazine
A une solution de 2-méthylthio-4-(3-pyridylméthylamino)-pyrazolo-[1,5-a]-
1,3,5-triazine (110 mg) dans 15 ml de dichlorométhane, on ajoute
successivement
213 mg AlCl3 puis 90 ,u1 de chlorure d'acétyle. Le mélange est porté à reflux
durant
4 heures. Après dilution avec du chloroforme (20 ml), le mélange est acidifié
avec HCl
dilué, puis basifié avec une solution aqueuse de NaHC03 et la phase organique
récupérée est séchée sur MgSO4. Les solvants sont éliminés par évaporation à
sec sous
vide. Le résidu est soumis à une chromatographie préparatrice sur gel de
silice en
utilisant un mélange chloroforme / acétone (9:1) comme éluant. Les portions
appropriées sont isolées, extraites avec un mélange chloroforme-méthanol et
les
solvants sont éliminés par évaporation à sec sous vide. On obtient 65 mg d'un
solide
blanc. CCM (gel de silice ; chloroforme ! acétone en mélange 9!1) : Rf = 0,18.
Spectrométrie de masse (Electrospray) : 315,1.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-27-
Exemple 21 : 8-diméthylaminométhyl-4-(3-pyridylméthylamino)-
2-méthylthiopyrazolo[1,5-a]-1,3,5-triazine
Une solution de 2-méthylthio-4-(3-pyridylméthylamino)-pyrazolo[1,5-a]-1,3,5-
triazine
(50 mg) et de chlorure de (chlorométhylène)-diméthylammonium (2 équivalents)
dans
un mélange d' acétonitrile et de diméthylformamide (4:1 ; 10 ml) porté à
reflux durant
4 heures. Les solvants sont éliminés par évaporation à sec sous vide. Le
résidu est
dissous dans 20 ml d'éthanol et traité avec un excès de NaBH4. Après 2 heures
d'agitation à température ambiante, de l'acide acétique est ajouté au mélange
réactionnel pour décomposer le réactif en excès. Après élimination sous vide
des
1o solvants, le résidu est partagé entre CHC13 et de l'eau. La phase organique
récupérée est
séchée sur MgS04. Après élimination des solvants, le résidu est soumis à une
chromatographie préparatrice sur gel de silice en utilisant un mélange
chloroforme-méthanol (3:1) comme éluant. Les portions appropriées sont isolées
et
extraites avec un mélange chloroforme-méthanol et les solvants sont éliminés
par
évaporation à sec sous vide. On obtient 19 mg d' une poudre ocre. CCM (gel de
silice ;
chloroforme / méthanol en mélange 3/1) : Rf = 0,19. Spectrométrie de masse
(Electrospray) : 330,1.
Exemple 22 : 8-formyl-4-(3-pyridylméthylamino)-2-méthylthiopyrazolo[1,5-a]-
1,3,5-triazine
De la 2-méthylthio-4-(3-pyridylméthylamino)-pyrazolo[1,5-a]-1,3,5-triazine
(100 mg)
et du chlorure de (chlorométhylène)-diméthylammonium (4 équivalents) dans un
mélange acétonitrile-diméthylformamide (4:1 ; 50 ml) est porté à reflux durant
2 heures.
Après évaporation des solvants, le résidu est dissous dans du
tétrahydrofuranne (50 ml)
et 25 ml d'une solution aqueuse 0,5M d'acétate de sodium. Après 4 heures
d'agitation à
température ambiante, la plus grande partie du tétrahydrofuranne est éliminée
sous vide.
Le résidu concentré est partagé entre du chloroforme et de l'eau. La phase
organique
récupérée est ensuite séchée sur MgS04 et les solvants sont sous vide pour
donner la 8-
formyl-2-méthylthio-4-(3-pyridylméthylamino)-pyrazolo[1,5-a]-
1,3,5-triazine. CCM (gel de silice ; mélange chloroforme / méthanol = 9/1) :
R~ = 0,5.
Spectrométrie de masse (Electrospray) : 301,0.
Exemple 23 : 8-morpholinométhyl-4-(3-pyridylméthylamino)-
2-méthylthiopyrazolo[1,5-a]-1,3,5-triazine
A une solution de 8-formyl-4-(3-pyridylméthylamino)-2-méthylthiopyrazolo[1,5-
a]-
1,3,5-triazine (90 mg) et de morpholine (52 mg) dans 40 ml de dichloroéthylène
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-28-
contenant 1% d'acide acétique, on ajoute des tamis moléculaires 3Pr (0,5 g) et
Na(OAc)3BH (134 mg). Le mélange obtenu est agité pendant une nuit à
température
ambiante. Le mélange réactionnel est filtré et le filtrat dilué avec du
chloroforme
(50 ml). La solution résultante est ensuite lavée avec une solution aqueuse de
NaHC03
et une solution aqueuse de NaCI avant d'être séchée sur MgS04. Après
évaporation des
solvants, le résidu est soumis à une chromatographie préparatrice sur gel de
silice en
utilisant un mélange chloroforme / méthanol (9:1) comme éluant. Les portions
appropriées sont isolées et extraites avec un mélange chloroforme-méthanol et
les
solvants sont éliminés par évaporation à sec sous vide. On obtient 26 mg d'un
solide
blanchâtre. CCM (gel de silice ; mélange chloroforme / méthanol = 9/1) : Rf =
0,19.
Spectrométrie de masse (Electrospray) : 372,2.
Exemple 24 : 8-[(1,3-dihydro-2-oxoindol)-3-ylidèneméthyl)-2-méthylthio-
4-(3-pyridylméthylamino)pyrazolo[1,5-a]-1,3,5-triazine
Un mélange de 8-formyl-2-méthylthio-4-(3-pyridylméthylamino)-pyrazolo[1,5-a]-
1,3,5-triazine (70 mg), d'oxoindole (64 mg) et d'une goutte de pipéridine dans
50 ml
d'éthanol est porté à reflux pendant 7 heures. Après retour à température
ambiante, un
solide jaune est récupéré par filtration et séché. CCM (gel de silice ;
mélange
chloroforme / méthanol - 9/1: Rf - 0,49). Spectrométrie de masse
(Electrospray) : 416,2.
2o Exemple 25 : 8-(guanidinoaminométhylène)-2-méthylthio
4-(3-pyridylméthylamino)pyrazolo[1,5-a]-1,3,5-triazine
Ce composé est préparé selon un mode opératoire analogue à celui décrit pour
l'exemple 24, l'oxoindole étant remplacé par le bicarbonate de
l'aminoguanidine.
Solide brun. Spectrométrie de masse (Electrospray) : 359,2.
Exemple 26 : 8-bromo-2-méthylthioxo-4-(3-pyridylméthylamino)pyrazolo[1,5-a]-
1,3,5-triazine
Ce composé est préparé selon un mode opératoire analogue à celui décrit pour
l'intermédiaire 12.1. Poudre jaune foncé. Point de fusion : 70-71 °C.
Exemple 27 : 8-bromo-2-méthylthioxo-4-(3-chloroanilino)pyrazolo[1,5-a]-1,3,5-
triazine
Il s'agit de l'intermédiaire 12.1.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-29-
Exemple 28 : 8-[(1,3-dihydro-2-oxoindol)-3-ylidèneméthyl]-2-méthylthio-
4-[3-(1-imidazolyl)propylamino]pyrazolo[1,5-a]-1,3,5-triazine
Ce composé est préparé selon un mode opératoire analogue à celui décrit pour
l'exemple 24, la 8-formyl-2-méthylthio-4-(3-pyridylméthylamino)pyrazolo[1,5-a]-
1,3,5-triazine étant remplacée par r la 8-formyl-2-méthylthio-
4-(3-(1-imidazolyl)propylamino)pyrazolo[1,5-a]-1,3,5-triazine. Solide jaune.
Spectrométrie de masse (Electrospray) : 433,2.
Exemple 29 : 8-cyano-2-méthylthio-4-(3-pyridylméthylamino)pyrazolo[1,5-a]-
1,3,5-triazine
1o Ce composé est préparé en chauffant à reflux un mélange contenant le
composé de
l'exemple 22 (1 équivalent), du chlorhydrate d'hydroxylamine (2 équivalents),
du
formate de sodium (10 équivalents) et de l'acide formique (100 équivalents)
(cf. J.
CIZem. Soc. (1965), 1564). Solide jaune pâle. Spectrométrie de masse
(Electrospray)
298,2.
Exemple 30 : 8-(N-méthylpipérazinométhyl)-2-méthylthio
4-(3-pyridylméthylamino)pyrazolo[1,5-a]-1,3,5-triazine
Ce composé est préparé selon un mode opératoire analogue à celui décrit pour
l'exemple 23, la morpholine étant remplacée par la N-méthylpipérazine. Solide
brun.
Spectrométrie de masse (Electrospray) : 385,4 ; 386,4.
2o Exemple 31 : 2-méthylthio-4-(3-pyridylméthylamino)pyrazolo[1,5-a]-1,3,5-
triazine
A une solution de 4-chloro-2-méthylthiopyrazolo[1,5-a]-1,3,5-triazine (2,0 g)
dans
40 ml de chloroforme et 14 ml de méthanol, on ajoute de la 3-
aminométhylpyridine
(3,0 g). Le mélange obtenu est agité pendant une nuit à température ambiante.
Après
évaporation des solvants à sec sous vide, le résidu est partagé entre du
chloroforme et de
l'eau. La phase organique est séchée sur MgS04 et les solvants sont évaporés à
sec sous
vide. Le mélange résiduel est soumis à une chromatographie sur gel de silice
en utilisant
un mélange chloroforme / méthanol (19:1) comme éluant. Les portions
appropriées sont
isolées et les solvants sont éliminés par évaporation à sec sous vide. On
obtient 1,47 g
3o d'un solide blanc. CCM (gel de silice ; mélange chloroforme / méthanol =
19/1)
Rf = 0,58. Spectrométrie de masse (Electrospray) : 273,1.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-30-
Exemple 32 : 2-méthylthio-8-vitro-4-(3-pyridylméthylamino)pyrazolo[1,5-a]-
1,3,5-triazine
Du nitrate cuprique (70 mg) est ajouté à une suspension de 2-méthylthio-
4-(3-pyridylméthylamino)-pyrazolo[1,5-a]-1,3,5-triazine (50 mg ; composé de
l'exemple 31) dans 6 ml d'anhydride acétique. Le mélange est agité à
température
ambiante pendant une nuit avant d'être partagé entre du chloroforme et une
solution
aqueuse saturée en NaHC03. La phase organique est séchée sur MgS04 et les
solvants
sont évaporés à sec sous vide. Le résidu est soumis à une chromatographie
préparatrice
sur gel de silice en utilisant un mélange chloroforme-méthanol (15:1) comme
éluant. La
1o fraction appropriée est isolée et extraite avec le mélange chloroforme
méthanol. Une
fois les solvants évaporés à sec sous vide, on obtient le produit attendu sous
la forme
d'un solide blanchâtre. Chromatographie sur couche mince (gel de silice ;
mélange
chloroforme-méthanol 9:1) : Rf= 0,46. Spectrométrie de masse (Electrospray) :
318,1.
Exemple 33 : 8-bromo-2-(1R-isopropyl-2-hydroxyéthylamino)-
4-(3-pyridylméthylamino)pyrazolo[1,5-a]-1,3,5-triazine
33.1) 8-bronzo-2-métlzylthioxo-4-(3 pyridylméthylamino) pyrazolo~l,5-aJ-
1,3,5-triazine
A une solution de chlorhydrate de 8-bromo-2-méthylthio-4-(3-
pyridylméthylamino)-
pyrazolo[1,5-a]-1,3,5-triazine (100 mg) dans un mélange éthanol-eau (1:1 ; 50
ml), on
2o ajoute 100 mg d'oxone. Après 15 minutes, on dilue le mélange avec de l'eau
(20 ml),
on ajoute NaHC03 afin de rendre le milieu basique et on extrait avec un
mélange
chloroforme-méthanol (9:1). La phase organique est séchée (MgS04) et les
solvants
sont éliminés pour donner le produit attendu sous forme d'un solide jaune pâle
(100 mg). Spectrométrie de masse (Electrospray) : 367,2 ; 369,2.
33.2) 8-bromo-2-(IR-isopropyl-2-lzydroxyéthylarrzino)-4-(3
pyridylméthylanzizzo)-
pyrazolo~l,5-aJ-1,3,5-triazine
Un mélange de l'intermédiaire 33.1 (100 mg) et de R-valinol (2 éq. ; 60 mg)
dans 3 ml
de CI~CN est porté à reflux pendant 3 heures. Après évaporation des solvants,
le résidu
est repris dans un mélange chloroforme-méthanol (9:1 ; 30 ml), lavé avec une
solution
aqueuse saturée en NaCI puis séché sur MgSOø. Les solvants sont éliminés par
évaporation à sec sous vide et le résidu est soumis à une chromatographie
préparatrice
sur gel de silice en utilisant un mélange chloroforme-méthanol (19:1) comme
éluant. La
fraction appropriée est isolée et extraite à l'aide du mélange chloroforme-
méthanol. Les
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-31-
solvants sont éliminés par évaporation à sec sous vide. Le produit attendu est
obtenu
sous la forme d'un solide amorphe blanchâtre (50 mg). Chromatographie sur
couche
mince (gel de silice ; mélange chloroforme-méthanol 9:1) : Rf = 0,32.
Spectrométrie de
masse (Electrospray) : 406,2 ; 408,2.
Etude pharmacologique des composés de l'invention
Méthodes employées
Mesure de l'état de phosphorylation de l'histone HI par le cofyiplexe cycline
BI l cdc2
L'activité du complexe cycline B/ kinase cycline dépendante 1 (CDKl = cdc2)
est
évaluée par la phosphorylation d'une histone Hl par de l'ATP-33 et non plus
par de
1o l'ATP-32 comme précédemment (Alessi et coll., Exp.Cell Res. (1998), 245, 8-
18 ;
Baratte et coll., AnticafZCer Res. (1992), 12, 873-880 ; Glab et coll., FEBS
Lett. (1994),
353, 207-211). L'apparition d'histone H1 phosphorylée en présence
d'inhibiteurs de
l'enzyme CDK1 est déterminée par comptage de la radioactivité. Le complexe
cycline
B/CDKl, isolé à partir d'oocytes d'étoiles de mer (Marthasterias glacialis)
est purifié par
chromatographie d'affinité puis est élué avec NaCI 0,2 M. Du glycérol à la
concentration finale à 20°Io, vlv est ajouté à l'enzyme purifiée avant
le stockage à
-80 °C (Meijer et Kim, Methods Ehzymol. (1997), 283, 113-128). La
réaction est
réalisée en plaques 96 puits sous un volume final de 30 ~.1. Chaque réaction
contient 5 ~,l
d'histone H1 à 5 mg/ml en concentration finale (Sigma, H5505, Saint Quentin en
Yvelines, France), 16 p1 de tampon composé de (3-glycérophosphate 60 mM
(Sigma,
66251, Saint Quentin en Yvelines, France), p-nitrophényl phosphate 30 mM
(Sigma,
N6260, Saint Quentin en Yvelines, France), MOPS 25 mM (Sigma M5789, Saint
Quentin en Yvelines, France), dithiothréitol 1 mM (Sigma D9779, Saint Quentin
en
Yvelines, France), EGTA 5 mM (Sigma E8145, Saint Quentin en Yvelines, France),
orthovanadate de sodium O,lmM (Sigma 56508, Saint Quentin en Yvelines,
France),
MgClz 15 mM (Sigma M8286, Saint Quentin en Yvelines, France) et 1 ~,1 du
complexe
Cycline B/CDKl (activité finale : 1,5 pmol d'ATP incorporées en 1 minute par 1
p,1 de
kinase). L'inhibiteur en concentration croissante est ajouté sous un volume de
3 ~,1. La
réaction démarre par l'ajout de 5 p1 d'une solution d'ATP contenant 4 ,u1
d'ATPy33
(370 MBq/mmol, Amersham BF1000, Les Ulis, France), 90 ~,l d'ATP froid 1 mM
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-32-
(Sigma A7699, Saint Quentin en Yvelines, France) dilués dans 906 ~,l du tampon
décrit
ci-dessus.
Les plaques sont incubées pendant 10 minutes à 30 °C. Le milieu
réactionnel est
récupéré sur des plaques 96 puits de filtration en phosphocellulose P81
(Unifilter
Polyfiltronics Whatman 7700-0512, Rungis, France) et lavé avec du TCA
1°7o sur un
collecteur (Filtermate Harvester, Packard, Rungis, France). Après séchage du
filtre, le
scintillant Microscint° 0 (Packard, 6016311, Rungis, France) est
distribué dans tous les
puits. La radioactivité est lue dans un compteur à scintillation pour
microplaques
Topcount° (Packard, Rungis, France). Les résultats sont exprimés sous
la valeur de la
1o concentration d'inhibiteur inhibant 50% de la réaction enzymatique.
Mesure de l'aetivité i~alaibitrice de la glycogèf2e synthase kinase-3/3:
Ce test peut être effectué comme décrit dans Leclerc et coll., J. Biol. Chem.,
septembre
2000.
Caractérisation de l'actzvité antiproliférative
i5 A titre d'exemple, on étudiera l'effet d'un traitement sur deux lignées de
cellules
humaines Mia-Paca2 et DU145 par les composés des exemples 1 à 33 décrits
précédemment. Les lignées cellulaires DU145 (cellules humaines de cancer de la
prostate) et Mia-PaCa2 (cellules humaines de cancer du pancréas) ont été
acquises
auprès de American Tissue Culture Collection (Rockville, Maryland, USA). Les
20 cellules placées dans 95 ~,1 de milieu Eagle modifié de Dulbecco (Gibco-
Brl, Cergy-
Pontoise, France) complété avec 10°Io de sérum foetal de veau inactivé
par chauffage
(Gibco-Brl, Cergy-Pontoise, France), 100 unités/1 de pénicilline et
100~,g/ml/1
streptomycine (Gibco-Brl, 10378-057, Cergy-Pontoise, France), et 2 mM de
glutamine
(Gibco-Brl, Cergy-Pontoise, France) ont été ensemencées sur une plaque de 96
puits au
25 jour 0. Les cellules ont été traitées au jour 1 pendant 96 heures avec 5
~,l de chacun des
composés à des concentrations croissantes de 0 à 25 ,uM en concentration
finale. A la
fin de cette période, la quantification de la prolifération cellulaire est
évaluée par test
colorimétrique en se basant sur le clivage du sel de tétrazolium WST1 par les
déhydrogénases mitochondriales dans les cellules viables conduisant à la
formation de
30 formazan (Boehringer Mannheim, Meylan, France). Ces tests sont effectués en
double
avec 8 déterminations par concentration testée. Pour chaque composé à tester,
les
valeurs incluses dans la partie linéaire de la sigmoïde ont été retenues pour
une analyse
en régression linéaire et utilisées pour estimer la concentration inhibitrice
CIso. Les
produits sont solubilisés dans le diméthylsulfoxide (DMSO) à 10-z M et
utilisés en
35 culture avec 0,5% DMSO en final.
CA 02432417 2003-06-18
WO 02/50079 PCT/FRO1/04048
-33-
Résultats
Les composés de la présente invention ont été testés selon le test cycline B/
kinase
cycline-dépendante 1 décrit précédemment. Tous les composés testés ont montré
une
inhibition significative de l' activité de la cycline B/ kinase cycline-
dépendante 1
(CDK1 = cdc2).
Les composés de la présente invention ont de plus été testés selon les tests
relatifs à
l'activité antiproliférative décrits précédemment, leurs activités étant
comparées â celle
de la Roscovitine. Tous les composés testés de la présente invention ont
montré une
activité antiproliférative supérieure à celle de la Roscovitine en ce qui
concerne les
cellules Mia-PaCa2. En outre, tandis qu' aucune activité antiproliférative en
ce qui
concerne les cellules DU-145 n'était observée avec la Roscovitine, de nombreux
composés testés de la présente invention ont montré une activité
antiproliférative
vis-à-vis de ces cellules également.