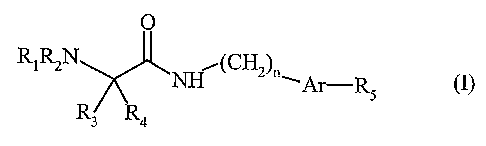Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-1-
NQUVEAUX »ERTVES ~aAGIBES AlVUNES,
LEUR P~OGEDE ~.lE ~'REPARA~'TTE)N
ET LES GOI~~'OS~T~QNS ~'I~AR1MACEU'~'~Q~UES QU7f LES C4NT~ENNENT
La présente invention concerne de nouveaux dérivés d'acides aminés, leur
procédé de
préparation, les compositions pharmaceutiques qui les contiennent ainsi que
leur utilisation
en tant qu'inhibiteurs de protéases à sérine apparentés à la trypsine.
L'une de ces protéases à sérine, la protéine C activée, est l'enzyme clé d'un
puissant
processus d'anticoagulation physiologique puisque ses substrats naturels, les
facteurs V
activé et VIII activé, sont de puissants promoteurs de la coagulation sanguine
(Dahlb~ck B,
lo Thrombosis Research 1995, 77, 1-43)
L'inhibition directe et spécifique de la protéine C activée est un moyen
efficace pour
inhiber ce processus anticoagulant naturel et promouvoir la coagulation
sanguine dans des
situations cliniques hémorragiques, et représente donc une approche
extrêmement
intéressante dans le traitement des maladies impliquant un dysfonctionnement
de
l'hémostase nécessitant un traitement procoagulant, telles que la maladie de
Willebrand ou
(hémophilie A ou B.
Des dérivés peptidomimétiques, présentant une activité iWibitrice de la
Protéine C activée
ont déjà été décrits dans le brevet W098/22125.
Il était particulièrement intéressant de synthétiser de nouveaux inhibiteurs
de protéases à
2o sérine afm d'augmenter la puissance et la sélectivité des composés déjà
décrits dans la
littérature.
De plus, en présence de traces de facteur tissulaire et de thrombomoduline,
ces nouveaux
composés augmentent la génération de la thrombine dans le plasma humain et
sont actifs
par voie orale.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-2-
Plus spécifiquement, la présente invention concerne les composés de formule
(I)
O
R1~N ~ (CH2)n'~-R (I)
s
Ra
dans laquelle
Rl représente un groupement aryle, hétéroaryle, alkyle (C1-C6) linéaire ou
ramifié
éventuellement substitué par un ou plusieurs groupements, identiques ou
différents,
choisis parmi aryle ou hétéroaryle, ou bien Rl représente un groupement de
formule
-(CO)-CR6R7NR8R9 dans lequel
- R6 représente un atome d'hydrogène ou un groupement choisi parmi aryle,
hétéroaryle, hétérocycloalkyle, cycloalkyle (C3-C$) ou alkyle (C1-C6) linéaire
ou
lo ramifié éventuellement substitué par un ou plusieurs groupements,
identiques ou
différents, choisis parmi aryle, hétéroaryle, hétérocycloalkyle, cycloalkyle
(C3-
C8) ou carboxy,
- R7 représente un atome d'hydrogène ou un groupement alkyle (C1-C6) linéaire
ou ramifié,
- ou bien R6 et R7 forment ensemble un groupement cycloalkyle (C3-C8),
- R8 représente un atome d'hydrogène ou un groupement alkyle (C1-C6) linéaire
ou ramifié,
- et R9 représente un atome d'hydrogène ou un groupement R'9 dans lequel R'9
représente un groupement choisi parmi
~ alkyle (C1-C6) linéaire ou ramifié éventuellement substitué par un
groupement aryle, carboxy, alkoxycarbonyle (Cl-C6) linéaire ou ramifié
ou carbamoyle,
~ aryle,
~ hétéroaryle,
~ ou sulfonyle substitué par un groupement choisi parmi cycloalkyle (C3-
C8), hétérocycloalkyle, aryle (éventuellement substitué par un
groupement aryloxy ou hétéroaryloxy), ou alkyle (Cl-C6) linéaire ou
ramifié éventuellement substitué par un groupement aryle, hétéroaryle,
cycloalkyle (C3-C8) ou hétérocycloalkyle,
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-3-
RZ représente un atome d'hydrogène ou un groupement alkyle (C1-C6) linéaire ou
ramifié,
y R3 représente un atome d'hydrogène ou un groupement alkyle (C1-C6) linéaire
ou
ramifié éventuellement substitué par un ou plusieurs groupements aryle,
~ R4 représente un système bicyclique, saturé ou insaturé, de 7 à 15 chaînons,
ou un
groupement alkyle (C1-C6) linéaire ou ramifié éventuellement substitué par un
ou
plusieurs groupements aryle,
ou bien R3 et R4 forment ensemble, avec l'atome de carbone qui les porte, un
système
mono-, bi- ou tricyclique, saturé ou insaturé, de 3 à 18 chaînons, comportant
1o éventuellement un ou plusieurs hétéroatomes choisis parmi O, S et N, et
éventuellement substitué par un ou plusieurs groupements, identiques ou
différents,
choisis parmi halogène, alkyle (Cl-C6) linéaire ou ramifié, alkoxy (C1-C6)
linéaire ou
ramifié, hydroxy, trihalogénoalkyle (C1-C6) linéaire ou ramifié, amino
(substitué
éventuellement par un ou plusieurs groupements alkyle (C1-C6) linéaire ou
ramifié) ou
carboxy,
n représente zéro, 1 ou 2,
Ar représente un groupement aryle ou hétéroaryle,
RS représente un groupement choisi parmi amino, guanidino, cyano et amidino
éventuellement substitué par un groupement hydroxy ou alkoxycarbonyle (C1-C6)
linéaire ou ramifié,
leurs isomères optiques ainsi que leurs sels d'addition à un acide
pharmaceutiquement
acceptable.
Parmi les acides pharmaceutiquement acceptables, on peut citer à titre non
limitatif les
acides chlorhydrique, bromhydrique, sulfurique, phosphorique, acétique,
trifluoroacétique,
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-4-
lactique, pyruvique, malonique, succinique, glutarique, fumarique, tartrique,
maléfique,
citrique, ascorbique, oxalique, méthanesulfonique, benzènesulfonique,
camphorique.
Par groupement hétérocycloalkyle, on entend un groupement monocyclique,
saturé, de 3 à
8 chaînons, contenant un, deux ou trois hétéroatomes choisis parmi oxygène,
azote ou
soufre, étant entendu que l'hétérocycle peut être éventuellement substitué par
un ou
plusieurs groupements, identiques ou différents, choisis parmi halogène,
alkyle (C1-C6)
linéaire ou ramifié, alkoxy (C1-C6) linéaire ou ramifié, oxo, hydroxy,
trihalogénoalkyle
(C1-C6) linéaire ou ramifié ou amino (substitué éventuellement par un ou
plusieurs
groupements alkyle (Cl-C6) linéaire ou ramifié). Les groupements
hétérocycloalkyle
lo préférés sont les groupements morpholinyle, pipérazinyle ou pipéridyle.
Par groupement aryle, on entend phényle, biphénylyle ou naphtyle, chacun de
ces
groupements étant éventuellement substitué par un ou plusieurs groupements,
identiques
ou différents, choisis parmi halogène, alkyle (C1-C6) linéaire ou ramifié,
alkoxy (C1-C6)
linéaire ou ramifié, hydroxy, trihalogénoalkyle (C1-C6) linéaire ou ramifié,
amino
(substitué éventuellement par un ou plusieurs groupements alkyle (Cl-C6)
linéaire ou
ramifié) ou carboxy.
Par groupement hétéroaryle, on entend un groupement aromatique monocyclique ou
un
groupement bicyclique dans lequel fun au moins des cycles est aromatique,
composé de 5
à 12 chaînons, contenant un, deux ou trois hétéroatomes identiques ou
différents choisis
2o parmi oxygène, azote ou soufre, étant entendu que fhétéroaryle peut être
éventuellement
substitué par un ou plusieurs groupements, identiques ou différents, choisis
parmi
halogène, alkyle (C1-C6) linéaire ou ramifié, hydroxy, alkoxy (C1-C6) linéaire
ou ramifié,
trihalogénométhyle, ou amino (substitué éventuellement par un ou plusieurs
groupements
alkyle (C1-C6) linéaire ou ramifié). Parmi les groupements hétéroaryle, on
peut citer à titre
non limitatif les groupements thiényle, pyridyle, furyle, pyrrolyle,
imidazolyle, oxazolyle,
isoxazolyle, thiazolyle, isothiazolyle, pyrimidinyle, pyrazinyle,
pyridazinyle, pyrazolyle,
quinolyle.
Les groupements hétéroaryle préférés sont les groupements pyridyle
éventuellement
substitué, benzisoxazolyle ou indazolyle.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-5-
Un aspect avantageux de (invention concerne les composés de formule (I) pour
lesquels R1
représente un groupement de formule -(CO)-CHR6NHR9 dans laquelle R6 représente
un
groupement cycloalkyle (C3-Cg), ou alkyle (C1-C6) linéaire ou ramifié
éventuellement
substitué par un groupement cycloalkyle (C3-C8), et R9 représente un
groupement choisi
parmi alkyle (C1-C6) linéaire ou ramifié éventuellement substitué par un
groupement
carboxy, alkoxycarbonyle (C1-Cs) linéaire ou ramifié ou carbamoyle, et
alkylsulfonyle (C1-
C6) linéaire ou ramifié substitué par un groupement cycloalkyle (C3-C8).
Un autre aspect avantageux de l'invention concerne les composés de formule (I)
pour
lesquels R3 et R4, identiques ou différents, représentent chacun un groupement
alkyle (C1-
lo C6) linéaire ou ramifié.
Un autre aspect avantageux de l'invention concerne les composés de formule (I)
pour
lesquels R3 et R4 forment ensemble un groupement indanyle éventuellement
substitué ou
un groupement cyclopentapyridyle.
Un autre aspect avantageux de (invention concerne les composés de formule (I)
pour
lesquels n représente 1.
Un autre aspect avantageux de l'invention concerne les composés de formule (I)
pour
lesquels Ar représente un groupement phényle, et RS représente un groupement
amidino
éventuellement substitué par un groupement hydroxy.
Un autre aspect avantageux de (invention concerne les composés de formule (I)
pour
lesquels Ar représente un groupement pyridyle substitué par un groupement
méthyle, et RS
représente un groupement amino.
Lorsque Rl représente un groupement de formule -(CO)-CHR6NR8R9 dans laquelle
R6, R8
et R9 sont tels que définis dans la formule (I), l'atome de carbone portant
les substituants Rs
et NR$R9 constitue un centre asymétrique dont la configuration est
préférentiellement R.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-6-
Parmi les composés préférés de l'invention, on peut citer plus
particulièrement
- l'acide {[(1R)-2-({2-[({4-amidinobenzyl}-amino)-carbonyl]-indan-2-yl}-amino)-
1-
cyclohexyl-2-oxoéthyl]-amino}acétique, ses isomères optiques ainsi que ses
sels
d'addition à un acide pharmaceutiquement acceptable,
- le {[(1R)-2-({2-[({4-[amino-(hydroxyimino)-méthyl]-benzyl}-amino)-carbonyl]-
indan-2-yl}-amino)-1-cyclohexyl-2-oxoéthyl]-amino}-acétate d'éthyle, ses
isomères
optiques ainsi que ses sels d'addition à un acide pharmaceutiquement
acceptable,
- l'acide {[(1R)-2-({2-[({4-amidinobenzyl}-amino)-carbonyl]-indan-2-yl}-amino)-
1-
cyclohexylméthyl-2-oxoéthyl]-amino}acétique, ses isomères optiques ainsi que
ses
lo sels d'addition à un acide pharmaceutiquement acceptable,
- (acide {[(1R)-2-({2-[({4-amidinobenzyl}-amino)-carbonyl]-indan-2-yl}-amino)-
1-
isopropyl-2-oxoéthyl]-amino}acétique, ses isomères optiques ainsi que ses sels
d'addition à un acide pharmaceutiquement acceptable,
- le N-(4-amidinobenzyl)-2-[((2R)-2-cyclohexyl-2-{[(cyclohexylméthyl)-
sulfonyl]-
amino}-éthanoyl)-amino]-2-indanecarboxamide, ses isomères optiques ainsi que
ses
sels d'addition à un acide pharmaceutiquement acceptable,
- le N-(4-amidinobenzyl)-2-[((2R)-2-{[(cyclohexylméthyl)-sulfonyl]-amino}-3-
méthyl
butanoyl)-amino]-2-indanecarboxamide, ses isomères optiques ainsi que ses sels
d'addition à un acide pharmaceutiquement acceptable,
- le N-(4-amidinobenzyl)-2-[((2R)-2-{[isobutylsulfonyl]-amino}-3-
méthylbutanoyl)-
amino]-2-indanecarboxamide, ses isomères optiques ainsi que ses sels
d'addition à un
acide pharmaceutiquement acceptable,
- et le N-(4-amidinobenzyl)-6-[((2R)-2-{[(cyclohexylméthyl)-sulfonyl]-amino}-3-
méthylbutanoyl)-amino]-6,7-dihydro-5H cyclopenta[b]pyridine-6-carboxamide, ses
isomères optiques ainsi que ses sels d'addition à un acide pharmaceutiquement
acceptable.
L'invention s'étend également à un procédé de préparation des composés de
formule (I),
caractérisé en ce que l'on met en réaction, dans des conditions de couplage
peptidique, un
composé de formule (II)
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
_7_
P1HN C02H (II)
R3 R4
dans laquelle R3 et R4 sont tels que définis dans la formule (I), et P1
représente un
groupement protecteur de la fonction amino,
avec un composé de formule (III)
HaN~ (CHZ)n'Ar-R's (III)
dans laquelle n et Ar sont tels que définis dans la formule (I), et R's
représente un
groupement choisi parmi amino, guanidino et amidino éventuellement substitué
par un
groupement hydroxy ou alkoxycarbonyle (C1-C6) linéaire ou ramifié, chacun de
ces
groupements étant éventuellement substitué par un groupement protecteur,
lo pour conduire après déprotection au composé de formule (IV)
O
(CHZ)n ~-R~s ~)
R3 R4
dans laquelle R3, R4, n, Ar et R's sont tels que définis précédermnent,
que l'on met en réaction
~ soit, lorsqu'on souhaite accéder aux composés de formule (I) pour lesquels
Rl
représente un groupement aryle, hétéroaryle ou alkyle (Cl-C6) linéaire ou
ramifié
éventuellement substitué, avec un çomposé de formule (V):
RmZ (V)
dans laquelle Rla représente un groupement aryle, hétéroaryle ou alkyle (C1-
C6)
linéaire ou ramifié éventuellement substitué par un ou plusieurs groupements
choisis
parmi aryle ou hétéroaryle, et Z représente un groupement partant tel que, par
exemple, un atome d'halogène ou un groupement tosylate, mésylate ou triflate,
pour conduire, après éventuelle déprotection, aux composés de formule (Ia),
cas
particulier des composés de formule (I)
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
_g_
O
RiaR2N ~ (CH2)n'~-R (Ia
s )
R3 R4
dans laquelle Rla, R2, R3, R4, n, Ar et Rs sont tels que définis précédemment,
~ soit, lorsqu'on souhaite accéder aux composés de formule (I) pour lesquels
Rl
représente un groupement alkyle (C2-C6) linéaire ou ramifié éventuellement
substitué,
avec un composé de formule (VI), dans des conditions d'amination réductrice
Rlb-CHO (VI)
dans laquelle Rlb représente un groupement alkyle (C1-Cs) linéaire ou ramifié
éventuellement substitué par un ou plusieurs groupements choisis parmi aryle
ou
hétéroaryle, pour conduire, après éventuelle déprotection, aux composés de
formule
lo (Ib), cas particulier des composés de formule (I)
O
Rlb ~ NRz NH (CH2)ny-Rs
R3 R4
dans laquelle Rlb, R2, R3, R4, n, Ar et Rs sont tels que définis précédemment,
~ soit, lorsqu'on souhaite accéder aux composés de formule (I) pour lesquels
Rl
représente un groupement de formule -(CO)-CR6R7NR8R9 dans lequel R6, R7, R8 et
R9
sont tels que définis dans la formule (I), avec un composé de formule (VII),
dans des
conditions de couplage peptidique
R6 R7
OH (VII)
PzHN
O
dans laquelle R6 et R7 sont tels que définis dans la formule (I), et PZ
représente un
groupement protecteur de la fonction amino, pour conduire après déprotection
au
2o composé de formule (VIII)
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-9-
R ~ O
6
NR2 / (CHZ n
H2N ~ ~~-R~s (V~
O R3 R4
dans laquelle R6, R7, RZ, R3, R4, n, Ar et R's sont tels que définis
précédemment,
que fon met ensuite en réaction, lorsqu'on le souhaite, avec un composé de
formule
(IX)
s R'9-Z (IX)
dans laquelle R'9 est tel que défini dans la formule (I), et Z représente un
groupement
partant tel que, par exemple, un atome d'halogène ou un groupement tosylate,
mésylate ou triflate,
pour conduire au composé de formule (X)
O
R6 R7
NRZ ~(CHZ)n
R 9HN NH ~Ar-R's (X)
io O R3 Ra
dans laquelle R'9, R6, R7, R2, R3, R4, n, Ar et R's sont tels que définis
précédemment,
composés de formule (VIII) ou (X) que l'on met en réaction, lorsqu'on le
souhaite, avec un
composé de formule (XI)
R' 8-Z (XI)
15 dans laquelle R'8 représente un groupement alkyle (C1-C6) linéaire ou
ramifié, et Z
représente un groupement partant tel que, par exemple, un atome d'halogène ou
un
groupement tosylate, mésylate ou triflate,
pour conduire au composé de formule (XII)
R ~ O
6
R' R N ~Z _ ~(CH2)n
s 9 NH ~~'-R~s (
O R3 R4
2o dans laquelle R'8, R6, R7, R2, R3, R4, n, Ar et R's sont tels que définis
précédemment, et R9
est tel que défini dans la formule (I),
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
- 10-
composés de formule (VIII), (X) ou (XII) que l'on déprotège éventuellement
pour conduire
au composé de formule (Ic), cas particulier des composés de formule (I)
R ~ O
6
NRZ ~ (CHZ)"
R8R9N ~NH ~Ar-RS (Ic)
O R3 R4
dans laquelle R8, R9, Rb, R7, R2, R3, R4, n, Ar et RS sont tels que définis
précédemment,
composés de formule (Ia), (Ib) et (Ic) qui constituent l'ensemble des composés
de formule
(I), que l'on purifie, le cas échéant, selon une technique classique de
purification, dont on
sépare, si on le souhaite, les isomères selon une technique classique de
séparation, et que
l'on transforme, si on le souhaite, en ses sels d'addition à un acide
pharmaceutiquement
acceptable.
lo Les composés de la présente invention, outre le fait qu'ils soient
nouveaux, présentent des
propriétés pharmacologiques particulièrement intéressantes.
Ce sont de puissants inhibiteurs de la protéine C activée, ce qui les rend
utiles dans le
traitement de toutes les conditions pathologiques impliquant la protéine C
activée, et
notamment dans le traitement des maladies impliquant un dysfonctionnement de
l'hémostase nécessitant un traitement procoagulant, comprenant toutes les
situations
cliniques hémorragiques telles que la maladie de Willebrand ou l'hémophilie A
ou B.
Il peuvent également être utilisés en tant que médicaments antidotes des
traitements
antithrombotiques, tels que les traitements anticoagulants, antiplaquettaires
et
fibrinolytiques.
2o L'invention s'étend aussi aux compositions pharmaceutiques renfermant comme
principe
actif un composé de formule (I) avec un ou plusieurs excipients inertes, non
toxiques et
appropriés. Parmi les compositions pharmaceutiques selon l'invention, on
pourra citer plus
particulièrement celles qui conviennent pour l'administration orale,
parentérale
(intraveineuse ou sous-cutanée), nasale, les comprimés simples ou dragéifiés,
les
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-11-
comprimés sublinguaux, les gélules, les tablettes, les suppositoires, les
crèmes, les
pommades, les gels dermiques, les préparations injectables, les suspensions
buvables, etc.
La posologie utile est adaptable selon la nature et la sévérité de
l'affection, la voie
d'administration ainsi que l'âge et le poids du patient. Cette posologie varie
de 1 à 500 mg
par jour en une ou plusieurs prises.
Les exemples suivants illustrent l'invention mais ne la limitent en aucune
façon.
Les produits de départ utilisés sont des produits de départ connus ou préparés
selon des
modes préparatoires connus.
Les préparations A à F conduisent à des intermédiaires de synthèse, utiles
pour la
lo préparation des composés de l'invention.
Les structures des composés décrits dans les exemples ont été déterminés selon
les
techniques spectrophotométriques usuelles (infrarouge, RMN, spectrométrie de
masse).
PRÉPARATION A : [4-Aminométhyl-phényl]-(imino)-méthyl-carbamate de benzyle
Le produit attendu est obtenu selon le procédé décrit par G. De Nanteuil et
colt. (Synth.
Comm. 1998, Vol. 28 N° 23, pp. 4419-4429).
PRÉPARATION B : [4-Aminométhyl-phényl]-(hydroxyimino)-méthyl-carbamate de
benzyle
Le produit attendu est obtenu selon le procédé décrit par G. De Nanteuil et
coll. (Synth.
Comm. 1998, Vol. 28 N° 23, pp. 4419-4429).
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-12-
PRÉPARATION C : 6-Amino-3-aminométhyl-2-méthylpyridine
Stade A : 6-Anaitto-3-cyatzo-2-~rtétltylpyriditze
A 10 rmnoles de 6-amino-3-bromo-2-méthylpyridine en solution dans le
diméthylformamide est ajouté du cyanure de cuivre (I) (12 mmoles). Le mélange
est porté
au reflux pendant 10 heures, puis refroidi à 80°C et coulé dans une
solution de cyanure de
sodium (40 mmoles) dans l'eau. Après 1 heure d'agitation à température
ambiante, le
mélange est extrait à l'acétate d'éthyle. La phase organique est lavée, puis
séchée et
évaporée pour conduire au produit attendu sous la forme d'un solide ocre.
Stade B : 6-Anaitzo-3-anainométlzyl-2-tnéthylpy>"iditte
lo Une solution du composé décrit dans le stade précédent (10 mmoles) dans
l'éthanol est
placée sous hydrogène pendant une nuit en présence de nickel de Raney. Après
filtration
du catalyseur, le solvant est évaporé pour conduire au produit attendu.
PRÉPARATION D : [4-Aminométhyl-phënyl]-(imino)-méthyl-carbamate de méthyle
Le produit attendu est obtenu selon le procédé décrit par G. De Nanteuil et
colt. (Synth.
Comm. 1998, Vol. 28 N° 23, pp. 4419-4429), à partir de 4-bromométhyl
benzonitrile et de
chloroformiate de méthyle.
PRÉPARATION E : [4-Aminométhyl-phënyl]-(imino)-méthyl-carbamate d'hexyle
Le produit attendu est obtenu selon le procédé décrit par G. De Nanteuil et
coll. (Synth.
Comm. 1998, Vol. 28 N° 23, pp. 4419-4429), à partir de 4-bromométhyl
benzonitrile et de
chloroformiate d'hexyle.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-13-
PREPARATION F : 4-Aminométhyl-N-hydroxybenzènecarboximidamide
Le produit attendu est obtenu selon le procédé décrit par G. De Nanteuil et
roll. (Synth.
Comm. 1998, Vol. 28 N° 23, pp. 4419-4429).
EXElYIPLE 1 : Acide ~~(1R)-2-({2-.[(~4..amidinobenzyl~-amïno)-carbonyl]-
indan..2-
s yl}-amina)-1-cyclohexyl-2-oxpéthyl]-amino~acétique, chiarhydrate
Stade A : (4-~~(~2-~(Test-butyloxycaf°bonyl)-anainoJ-indan-2 ylJ-
ca~bonyl)-aminoJ-
naéthylJ phényl)-(imino)-méthyl-carbamate de berazyle
A une solution d'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique
(10 mmoles) et du composé décrit dans la préparation A (10 mmoles) dans le
l0 diméthylfonnamide, sont ajoutés du tétrafluoroborate de O-(1H benzotriazol-
1-yl)-
N,N,N',N'-tétraméthyluronium (11 mmoles) et de la düsopropyléthylamine (11
mmoles).
Après une nuit d'agitation à température ambiante, le solvant est évaporé. Le
résidu obtenu
est repris par de l'acétate d'éthyle. La phase organique est lavée, séchée
puis évaporée. Le
produit attendu est obtenu après purification du résidu par chromatographie
sur gel de
15 silice en utilisant comme éluant un mélange dichlorométhane/acétate
d'éthyle (1/1).
Stade B : (4-~~(~2 Amino-indan-2 yl~-car~borayl)-aminoJ-métlayl) phényl)-
(imino)-
nzétlayl-carbamate de benzyle, dichlorhydf°ate
Un courant d'HCl gaz est passé sous agitation, à 0°C, dans une solution
du composé décrit
dans le stade précédent (10 mmoles) dans l'acétate d'éthyle, pendant 30
minutes. Après
2o une nuit d'agitation à température ambiante, le précipité formé est filtré,
rincé à l'acétate
d'éthyle puis séché sous vide au dessicateur.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-14-
Stade C : ~4-~(~(2-(~(2R)-2-~(Tes°t-butyloxycaf°bonyl)-aminoJ-2-
cyclolaexyléthanoylJ-
amino)-indara-~ ylJ-ca~borayl~-amino)-métlaylJ phénylJ-(imino)-
méthylcarbamate de benzyle
A une solution du composé décrit dans le stade précédent (10 mmoles) et de (R)-
N-(tert-
butyloxycarbonyl)-cyclohexylglycine (10 mmoles) dans le diméthylformamide sont
ajoutés du tétrafluoroborate de O-(1H benzotriazol-1-yl)-N,N,N',N'-
tétraméthyluronium
(11 mmoles), du 1-hydroxybenzotriazole hydrate (11 mmoles) et de la
düsopropyléthylamine (11 mmoles). Après une nuit d'agitation à température
ambiante, le
solvant est évaporé. Le résidu obtenu est repris par de l'acétate d'éthyle. La
phase
organique est lavée, séchée puis évaporée. Le produit attendu est obtenu après
purification
du résidu par chromatographie sur gel de silice en utilisant comme éluant un
mélange
dichlorométhane/acétate d'éthyle (1/1).
Stade D : ~4-~(~~2-(~(2R)-2 Anaino-2-cyclolzexyléthanoyl)-amino)-indan-2 ylJ-
carbonyl,~-amino)-méthylJ phényl~-(inaino)-méthylca~bamate de benzyle,
dichlorhydrate
Un courant d'HCl gaz est passé sous agitation, à 0°C, dans une solution
du composé décrit
dans le stade précédent (10 mmoles) dans l'acétate d'éthyle, pendant 30
minutes. Après
une nuit d'agitation à température ambiante, le précipité formé est filtré,
rincé à l'acétate
d'éthyle puis séché sous vide au dessicateur.
Stade E : ~~(IR)-~-(~2-~(~4-~~(Benzyloxycaf~bonyl)-anainoJ-(irnirt.o)-méthylJ-
benzylJ-
anaino)-carbonylJ-indan-~ ylJ-amino)-I-cyclolaexyl-2-oxoéthylJ-amino~-
acétate de benzyle
A une solution du composé décrit au stade précédent (10 mmoles) dans
l'acétonitrile est
ajouté du carbonate de potassium (30 mmoles) puis du 2-bromoacétate de benzyle
(11 mmoles). Après une nuit d'agitation, la solution est filtrée et évaporée,
le résidu est
repris par de l'acétate d'éthyle, la phase organique est lavée, séchée puis
évaporée.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-15-
Stade F : Acide ~~(IR)-2-(~2-~(~4-amidiraobenzylJ-arraino)-carbonylJ-iradan-2
ylJ-
amino)-1-cyclohexyl-2-oxoéthylJ-amirZOJacétique, chlorl2ydr°ate
Une solution du composé décrit dans le stade précédent (10 mmoles) dans
l'éthanol est
placée sous hydrogène pendant une nuit en présence de Pd/C à 10 % (0,5 g).
Après
filtration du catalyseur, le solvant est évaporé pour conduire après
salification par l'acide
chlorhydrique au produit attendu.
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 62,04 6,69 12,92 6,54
lo Trouv : 61,61 6,35 12,74 7,86
~XE1~IPLE W, Acïde ~[(1R)-2-({1-[((4-amïdinobenzyl~-amïno)-carb0nyl]-.
c~elohex~l~.-amïna)-1-c~clohexyl-~-QxOéthyl].=amïno~acêtïque,
~hlarh~drate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant
l'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par l'acide 1-
[(tert-
butyloxycarbonyl)-amino]-cyclohexanecarboxylique.
Miçroanalyse élémentaire
%C %H %N %Cl
Calculé : 59,10 7,54 13,78 6,98
Trouvé : 59,20 7,30 13,52 8,09
E~E~1"LE 3 : Acïde [((IR)-2-{[2-( f 4-Amïdïnobenzyl}-amïno)-I,I-dïméthyl-~-
oxoélhyl]-amïno~-I-c~clohexyl-2-arx0é~hyl)-amïnolacétique,
chlorhydrate
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-16-
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant
l'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par la N-(tert-
butyloxy-
carbonyl)-2-méthylalanine.
EXEl~I'"LE 4 ~ N-(4-Amîdînarben~l)-2-({(~R)-2-[(benzylsulfonyl?-amine]-Z-
~y~lohex~l~thano~~l}-amîno)-2-mëth~l~ropî~namîd~~ Ghlorh~drat~
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine et de chlorure de
phénylméthanesulfonyle.
Miçroanalyse élémentaire
%C %H %N %Cl %S
Calculé : 57,48 6,79 12,41 6,28 5,68
Trouvé : 57,75 6,97 12,35 5,94 5,59
EXEMPLE S . N-(4-Amîdînaben~yl)-1-(~(~R)-2.-[(laenzylsul~an~l)-amine]-~-
c~Glah~x~l~~hano~l~-amîno)-c~~lapen~anecarbnxamîdeT chlarh~dra.te
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide
1-[(tert-butyloxycarbonyl)-amino]-cyclopentanecarboxylique, du composé décrit
dans la
préparation A, de (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine et de
chlorure de
phénylméthanesulfonyle.
E~EI~TPLE G N-(4-Amîdînoben~l~-~-(~(21~)-~-[([I,1 ~-bî~hén~l]-4 ~l-~ulfonyl)-
2o amîno]-2-cyelohex~léthanoyl}-amino)-2-méth~lpropîonamîde,
chlarhydra~e
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine et de chlorure de [1,1'-biphényl]-4-
sulfonyle.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-17-
Microanalyse élémentaire
%C %H %N %Cl %S
Calcul : 61,38 6,44 11,18 5,66 5,12
Trouv : 60,47 6,51 11,00 6,00 4,86
EXEMPLE 7 : N-(4-Amidïnob~nz~l)-2..({(~R)-2-~(phënylsulfonyl)-amino]-2-
cyelahexylêthanc~yl~-amïno)-2..méthylpropionamïde~ chlorhxdra~e
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine et de chlorure de benzènesulfonyle.
lo Miçroanalyse élémentaire
%C %H %N %Cl %S
Calcul : 55,30 6,51 12,40 8,79 5,68
Trouv : 54,67 6,58 12,74 8,89 5,06
EXE1~LE ~ : N-(4-Amïdïnobenzyl)-~-(~(2~t.)-~-[(Z-naphiylsui~onyl)-amïno]-~_
t5 c~clohea~lé~hanoyl~-amïna?-~-mé~hylpra~pïonama'ide~ Ghlarhydra~e
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine et de chlorure de 2-
naphtalènesulfonyle.
Miçroanalyse élémentaire
20 %C %H %N %Cl %S
Calcul : 60,04 6,38 11,67 5,91 5,34
Trouv : 60,03 6,47 11,37 5,79 5,25
EXEMPLE 9 : N-(4-Amïdïnobenzyl)-2-({(~R)-.2-[[4-(4-pxrîdyloxy)-phénylsulfonyl~-
amïno]-2-cyGlohexyléthanoyl}-amino)-2-méthylpropionamide,
25 dïchlorhydrate
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-18-
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine et de chlorure de 4-(4-pyridyloxy)-
benzènesulfonyle.
Miçroanalyse élémentaire
%C %H %N %Cl %S
Calcul : 54,78 5,93 12,36 10,43 4,72
Trouv 55,16 6,02 12,24 10,37 4,41
E~E~PLE 1(1 k N-(4-.~midinaben~yl)-2-({(~1~.)-~- f (benzylsul~onyl)-amino]-2_
1o phënylé~hanoyl~-amino)-~_mé~hylpropïonamidez chlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-phénylglycine et de chlorure de
phényhnéthanesulfonyle.
Miçroanalyse élémentaire
is %C %H %N %Cl %S
Calcul : 58,11 5,78 12,55 6,35 5,75
Trouv 58,05 5,84 12,45 6,34 5,76
E~EMFLE 11 .~ N-(4-Amidinobenzyl)-2..(~(ZR~-2-~[(4-pyridyl).-mëthyl-sulfonyl]-
.
amino]-2-~yclahexyléthanoyl~-amino)-2-méthylpro~ionamide,
2o diçhlorhydra~e
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine et de chlorure de (4-pyridyl)-
méthanesulfonyle.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-19-
Miçroanalyse élémentaire
%C %H %N %Cl %S
Calculé : 51,91 6,37 13,97 11,79 5,33
Trouvé 52,53 6,22 14,21 10,93 5,07
I~XE1~PLE 1~ ; Acide ~[(lI~)-2.~(~1.~[(~4-amidïnaben~yl~-a,mino)-carbonyl]-
~yclolaent~l~-amino)wl~-(dic~clQhexylméth~l)..2-oxoëthyl]-
amino~acétïdue, chlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 1-
[(tert-butyloxycarbonyl)-amino]-cyclopentanecarboxylique, du composé décrit
dans la
l0 préparation A, de (R)-N-(tert-butyloxycarbonyl)-dicyclohexylalanine et de 2-
bromoacétate
de benzyle.
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 61,57 8,07 11,58 8,21
Trouv 61,58 8,00 11,25 7,75
E~EI~LE 1~ : N-(4-Amidinobcnzyl)-2-({(~I~.)-2-[(cyclohex~lméthylsulF~ny1)-
amin0]-
2-cycl0hexylëthano~l~-aminar)-~-mëthylpropionamide, chlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine et de chlorure de
cyclohexylméthanesulfonyle.
Miçroanalyse élémentaire
%C %H %N %Cl %S
Calcul : 56,88 7,78 12,28 6,22 5,62
Trouv : 56,95 7,74 12,16 6,49 5,35
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-20-
EXEMPLE I4 : N-(4-Amidinobenzyl)-2-(~(ZR)-2-[(4-mor~rhplinylsulfonyl)-amino]-2-
cyelohexytéthanoyl}-amino)-z-méthylpropion.amide, chlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine et de chlorure de 4-
morpholinesulfonyle.
Miçroanalyse élémentaire
%C %H %N %Cl %S
Calculé : 51,56 7,03 15,03 6,34 5,73
Trouvé : 51,67 6,69 15,10 7,12 5,37
1o E~1~'iPL~ 1S : N-(4-Amidinol~en~yl)-~-(~(21~~-2-[[3-(4-morghalinyl~-
.pro~yl~ulf4nyl]-
amin4]-~-ayclahea;yléthanoyl~-amina~-~-m~thylpropionamide,
dichlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine et de chlorure de 3-(4-morpholinyl)-
propanesulfonyle.
Miçroanalyse élémentaire
%C %H %N %Cl %S
Calcul : 50,85 7,29 13,18 11,12 4,70
2o Trouv : 50,92 7,07 13,41 11,56 4,70
~~:E1~PLE 16 : N-(4-Amidinobenzyl)-2-(~(~R)-2-[(benzylsulfonyla-a~nnino]-2_
~yclohexyléthauoyl~-ami~o)-2-in~danecarbo~amide, chlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, du composé décrit dans
la
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-21-
préparation A, de (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine et de
chlorure de
phénylméthanesulfonyle.
Microanalyse élémentaire
%C !H %N %Gl %S
Calcul : 62,10 6,32 10,97 5,55 5,02
Trouv : 62,61 6,36 10,88 5,61 4,99
~~ElIFTPLE 1~ ~ N-(4-Amldiuoben~~l)-~-(~(~R)-2-[(lacn~~lsulfun~l)-amina~]-~_
~~rclohcx~l~lhana~l]-amino)-cychh~xanecarbaxamide, cltlorh~dratc
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 1-
lo [(tert-butyloxycarbonyl)-amino]-cyclohexanecarboxylique, du composé décrit
dans la
préparation A, de (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine et de
chlorure de
phénylméthanesulfonyle.
Miçroanalyse élémentaire
~C .H SN AoCI ~S
Calcul : 59,64 7,01 11,59 5,87 5,31
Trouv : 59,38 7,11 11,40 6,16 5,07
E~l~IPL~E 18 : Ac~dc ~[(1R.)-2-( f 1-[(~4-amidinoben~yl~-amino)-carbonyl]-
cyclopent~l}-amino)-l..cyclohexyl-2..oxoë hyl]-amino~-acëtïque,
chlorhydrate
2o Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 1-
[(tert-butyloxycarbonyl)-amino]-cyclopentanecarboxylique, du composé décrit
dans la
préparation A, de (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine et de 2-
bromoacétate
de benzyle.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-22-
Microanalyse élémentaire
%C %H %N %Cl
Calcul : 57,08 7,26 13,87 9,13
Trouv : 57,03 7,17 13,40 9,31
~~El!'IPLE 1~ ~ N-(4-Amidin0benzyl)-2-(~(2R)-~-[(ben~~lsulîonyl)-amino]-~-
benz~l~thanoyl~..amïna)-2.-méthylprapionamide~ ehlnrh~drate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-phénylalanine et de chlorure de
phénylméthanesulfonyle.
l0 Miçroanalyse élémentaire
%G %H %N %Cl %S
Calcul : 58,78 5,99 12,24 6,20 5,60
Trouv : 59,28 6,10 11,99 6,21 5,57
LXL~PLE 2fl t ~~(~R)-~-(~2-[(~4-[Amkn~-(hydraxyimino)-m~th~l]-ben~yl~-amin~)_
1 s earbonyl]-indan-~-~l~-amieo)-l.-cyclohe~yl-~-o~Qëxhyl]-a~nxna~_
~,~ét~te d'éthyle
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1, à
partir d'acide 2
[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, du composé décrit dans
la
préparation B, de (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine et de 2-
bromoacétate
2o d'éthyle.
Miçroanalyse élémentaire
%C %H %N
Calcul : 65,55 7,15 12,74
Trouv : 65,47 6,91 12,59
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-23-
EXEMPLE 21 ; ~-~[(2R)-2-Amïnc~-2-ç~clohexyléthanoylj-amïno}-N-[(6-amian.n-2-
méxhyl-3-p~ridyl)-~néth~lj-~-ïndanecarboxamide, dichlorh~drate
Stade A : 2 Amifao-N ~(6-amino-2-métlayl-3 pyridyl)-tnéthylJ-2-
indanecarboxarnide,
dic7ZlonIZydnate
Le produit attendu est obtenu selon le procédé décrit dans les stades A et B
de l'exemple 1,
à partir d'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique et du
composé
décrit dans la préparation C.
Stade B : 2-~~(2R)-2 Amino-2-cyclolaexyléthanoylJ-aminoJ-N ~(6-amino-2anéthyl-
3-
pyf°idyl)-méthylJ-2-indanecarboxamide, dichlorhydrate
lo Le produit attendu est obtenu selon le procédé décrit dans les stades C et
D de l'exemple 1,
à partir du composé obtenu au stade précédent et de (R)-N-(tert-
butyloxycarbonyl)-
cyclohexylglycine.
Miçroanalyse élémentaire
%C %H %N %Cl
Calculé : 59,05 6,94 13,77 13,94
Trouvé : 59,35 6,55 13,60 14,27
EXEMPLE 22 ; Acïde f [(1R)-.2..(~~-[( j[6-amïno.-2..méthyl-.3-pyridylj-mêth~lj-
amïno)_
carbon~lj-indan-2.-ylj-amïno)-1-cyclohexyl-2-oxoéthylj-
amina]a~étïqu~~ di~hlarhydrat~
2o Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1, à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, du composé décrit dans
la
préparation C, de (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine et de 2-
bromoacétate
de benzyle.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-24-
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 57,24 6,58 12,36 12,52
Trouv : 57,53 6,58 12,31 12,08
E~lI~IPLE ~3 : N-~(6-Amina..~-m~~hyl-~..PYridyl)..méthyl~-2-({(2R~-2-
[(henzylsulfon~l~~amino~-~-cyçl~hexylé~hana~~l~-amino-~
indanecarhaxamide, ehlorhydraxe
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1, à
partir d'acide 2
[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, du composé décrit dans
la
préparation C, de (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine et de
chlorure de
lo phénylméthanesulfonyle.
Miçroanalyse élémentaire
%C %H %N %Cl %S
Calcul : 61,38 6,44 11,18 5,66 5,12
Trouv : 61,30 6,54 10,94 5,74 4,83
1s EX1~MPLh~ 2~ : Acide [((~R~-2-f [~-(~4-Amid~nobenzyl~-amina)-L,1.-dimé~hyl-
2-
oxor6~hyl]_aminc~~-I-ghényl-2-oxoé~hyl)-amina] acétique, ehl0rhydra~e
Le produit attendu est obtenu selon le procédé décrit dans l'exemple l, à
partir de N-(tert-
butyloxycarbonyl)-2-méthylalanine, du composé décrit dans la préparation A, de
(R)-N-
(tert-butyloxycarbonyl)-phénylglycine et de 2-bromoacétate de benzyle.
2o EXEIVIPLE 25 : Acide [((1.R)-~-~[~-({[(3-amino-~.&T inda~ol-6-yl)-méthyl]-
amino~-
earl~onyl)-indan-2-yl]-amino}-1.-cxclohexyl-2-axoéthyl)_
amin0]aeétiqne, ehlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1, à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, de 6-(aminométhyl)-1H
indazol-3-
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-25-
amine (dont la préparation est décrite dans la demande de brevet WO 00/26211),
de (R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine et de 2-bromoacétate de benzyle.
E~El!'IFLE 26 : Acïdc [((1R)-2-~[~_(~[(~_amino~l,2-bcnzisoxaz0l-~-yl)-mëthyl]_
amino]-carbQnyl)-ïndan-~-yl]-amino]-1-cycl0hcxyl-2-oxoëthyl)_
amind]acëtique, xrïîluoroacëxatc
StadeA : Acide ~((IR)-~-~~2-(~~(3-antino-1,2-benzisoxazol-6 yl)-rnéthylJ-
antinoJ-
caf°botayl)-indan-2 ylJ-amino)-1-cyclohexyl-2-oxoétl2yl)-aminoJacétique
Le produit attendu est obtenu selon le procédé décrit dans les stades A à C de
l'exemple l,
à partir d'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, de 6-
lo (aminométhyl)-1,2-benzisoxazol-3-amine (dont la préparation est décrite
dans la demande
de brevet WO 00/26210), de (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine et
de 2-
bromoacétate de benzyle.
Stade B : Acide ~((1R)-2-~~2-(~~(3-amino-1,2-benzisoxazol-6 yl)-rtaéthylJ-
atniftoJ-
carbortyl)-indan-2 ylJ-amino)-1-cyclohexyl-2-oxoéthyl)-aminoJacétique,
trifZuot~oacétate
Le produit attendu est obtenu selon le procédé décrit dans le stade D de
l'exemple l, en
remplaçant l'HCl gaz par l'acide trifluoroacétique.
Miçroanalyse élémentaire
%C %H %N /Cl
2o Calculé : 59,1 6,42 13,95 7,06
Trouvé 59,75 6,35 13,60 6,76
EXElI~FLE 2'Z : Acïdc {[(1R~-2-(~~-[(~4-amidïnophënyl~-amino)-carh0nyl]-indan-
2-
yl}-amina)-1-cycl0hexyl-2-oxoëthyl]-amino}acëlique, chlorhydrate
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-26-
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant le
composé de la préparation A par le (4-aminophényl)-(imino)-méthyl-carbamate de
benzyle.
EXEMPLE 2~ : Acide {~(1R)-~-(~~-[(~4-amidïna~benzyl~-amino)-carlaon~l]-indan-~-
yl]-amino)-1-phényl-2-axoéth~l]-amino]acëtïque3 dichlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant la
(R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-N-(tert-
butyloxycarbonyl)-
phénylglycine.
Microanalyse élémentaire
%C ~H %N %Cl
Calcul : 58,74 5,46 12,23 12,39
Trouv 59,06 5,49 12,14 12,13
EXEMPLE 2~ : Acide ][(1R)-2-({~-~(]4-amidin~b~n2~l]_amino~-~arb~n~l]-iadan-2,-
~l~-aminaa-1-bcn~~l-2-ox~êth~l]-amina~acétique, dichla~rhydratc
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant la
(R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-N-(tert-
butyloxycarbonyl)-
phénylalanine.
Microanalyse élémentaire
%C %H %N %Cl
2o Calculé : 59,39 5,67 11,94 12,09
Trouvé 59,70 5,65 11,84 11,68
EXEMPLE 30 : Acide ~[(1R)-2-((2-[(~4-amidinoben2yl}-amino)-carbonyl]-iadan-2-
yl}-amino~-1-cyclohexylméthyl-Z-oxoéth~l]-amino} acétique,
dichlorhydratc
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-27-
Le produit attendu est obtenu selon le procédé décrit dans l' exemple 1 en
remplaçant la
(R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-N-(tert-
butyloxycarbonyl)-
cyclohexylalanine.
Miçroanalyse élémentaire
%C %H %N %Cl
Calculé : 58,78 6,63 11,82 11,97
Trouvé 59,55 6,55 11,92 11,92
EXEMPLE ~l : N-[(â-AminQ-2-méth~l-~-~yxldyl)-méth~i]-2_~(~_~hén~th~l)-amin9]-
Z_
lndane~~~rba~amide, dichla~rhyd~rate
lo A 10 mmoles du composé décrit au stade A de l'exemple 21 en solution dans
le 1,2-
dichloroéthane sont ajoutées 10 rmnoles de phénylacétaldéhyde, puis 14 mmoles
de
triacétoxyborohydrure de sodium. Après 4 heures d'agitation, de l'eau est
ajoutée, puis le
milieu réactionnel est décanté et extrait au dichlorométhane. Les phases
organiques
rassemblées sont séchées, puis filtrées et évaporées. Le résidu ainsi obtenu
est purifié par
chromatographie sur silice (éluant : dichlorométhane/méthanol 95/5), pour
conduire, après
salification par l'acide chlorhydrique, au produit attendu.
Microanalyse élémentaire
~C ~H ~N iôCl
Calculé : 63,42 6,39 11,83 14,98
2o Trouvé 63,92 6,33 11,89 15,36
EXEMPLE 32 A~id~ ~[(~S)-2-(~2-[(~4-amidin0henzyl}-a~mino)-carbonyl]-indan-2-
yl~
-amlno)-1.-GyG~ohexyl-Z-ox0éthyl]-amlno}acëtzque~ dich~oxhydrate
Le produit attendu est obtenu selon le procédé décrit dans les stades C à F de
l'exemple 1 à
partir du composé décrit dans le stade B de l'exemple 1 et de (S)-N-(tert
butyloxycarbonyl)-cyclohexylglycine.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-28-
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 5 8,13 6,45 12,11 12,26
Trouv : 58,46 6,59 12,02 11,99
EXEMPLE 33 t N-[(6-AmïnO-~-méthyl-~-Pyrïd~l)-méthyl]-~-.[(~,~-dïphënyléthyl)-
amina]-2-indanecarboxamide, chlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 31, en
remplaçant le
phénylacétaldéhyde par le diphénylacétaldéhyde.
Microanalyse élémentaire
%C %H %N %Cl
Calcul : 67,75 6,24 10,20 12,90
Trouv : 68,15 6,18 10,19 12,96
EXEMPLE â4 t N-[(~-Ämïna-2-mëth~l-~-P~rid~l)-m~th~l]-2-[(~-Phén~lproPyl)-
amina]-~-indane~arb0~amïde, Ghlarhydrale
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 31, en
remplaçant le
phénylacétaldéhyde par le 3-phénylpropanal.
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 64,06 6,62 11,49 14,55
2o Trouv : 64,74 6,51 11,59 14,68
EXEMPLE 35 : N-(4-Amïdinoben2yl)-~-[(2,2-diphényléthyl)-amino]-2-indane
carboxamide~ chlorhydrate
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-29-
Stade A : (4-~~(~2-~(2,2-Diphényléthyl)-arraiyaoJ-ifadan-2 ylJ-carbonyl)-
aTniraoJ-
méthyl) phényl)-(imiho)-métlaylcaYbamate de benzyle, chlorhydy~ate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 31, à
partir du
composé obtenu au stade B de l'exemple 1 et de diphénylacétaldéhyde.
Stade B : N (4 Amidinobenzyl)-2-~(2,2-diphé~cylétlayl)-aminoJ-2-
ihdafzeca~boxamide, chlo~hydy~ate
Le produit attendu est obtenu selon le procédé décrit dans le stade F de
l'exemple 1 à partir
du composé obtenu au stade précédent.
Miçroanalyse élémentaire
%C %H %N %Gl
Calcul : 73,20 6,33 10,67 6,75
Trouv : 72,55 5,96 10,15 7,42
EXElI~FLE 3~ : ({~1R)-1-C~~IOh~~yt-2,-[(~-~~~4-]imi~o-~(méth~x~ca~bpn~t)-
amîna]_
métb~~t}-bo~zyt)-amïna]-~arba~n~t~-indan-2-~I)-amt~Q]-Z-a~xaë bit]_
amine)-acétate d~éthyt~
Le produit attendu est obtenu selon le procédé décrit dans les stades A à E de
l'exemple 1
en remplaçant, au stade A, la préparation A par la préparation D, et au stade
E, le 2-
bromoacétate de benzyle par le 2-bromoacétate d'éthyle.
Microanalyse élémentaire
% C %H %N
Calculé : 64,96 6,98 11,84
Trouvé : 64,29 6,91 11,45
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-30-
EXEMPLE ~7 : (~(1~)-1-Cclohcxyl-2-[(2-{[(4-~imino-C({hexyioxy}-carbonyl)-
amino]-
méthyi~-ben~yl)-amin.o]-carhunyl}-xndan-2-xi)-amina]-z-oxaéxhy~~-
amxno)_acétate d'éthyie
Le produit attendu est obtenu selon le procédé décrit dans les stades A à E de
l'exemple 1
en remplaçant, au stade A, la préparation A par la préparation E, et au stade
E, le 2-
bromoacétate de benzyle par le 2-bromoacétate d'éthyle.
Miçroanalyse élémentaire
%C %H %N
Calculé : 67,15 7,77 10,58
lo Trouvé : 67,21 7,85 10,57
EXEMPLE 38 : N-(4-Amidinabenzyl)-2-({(~R).,2-~(2_amino-2-oxaé~hyl)-amino]-~-
cyclohca~Ié~han0yl~-amine)-~-indanecarbc~xamidc, chl0rhydratc
Le produit attendu est obtenu selon le procédé de l'exemple 1, en remplaçant,
au stade E, le
2-bromoacétate de benzyle par le 2-bromoacétamide.
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 62,15 6,89 15,53 6,55
Trouv : 62,77 6,70 15,33 6,75
EXEMPLE 39 A : Acide ~[(1R)-2-({Z-[(~4-amidinobcnzyl}-amina)-carbone]-indan-
2o Z-yl]~-amino)-1-isa~ropyl-2-oxoéthyi]-amino]a.cëticiuc,
chiorhydrate
Le produit attendu est obtenu selon le procédé de l'exemple 1 en remplaçant,
au stade C, la
(R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-N-(tert-
butyloxycarbonyl)-
valine.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-31-
Miçroanalyse élémentaire
C °fO H ~ N ° ô Cl
Calculé : 59,81 6,42 13,95 7,06
Trouvé : 59,75 6,35 13,60 6,76
EXEMPLE ~~ B : Acidc {[(11~)-2-(]2-[( f 4-amidinobcnzyl]-amino)-Garbonyl]-
indan-
Z..yl]-amino)..1-iso~rogyl-~-oxaéthyl]-amino~acétique,
dichlcrrhydratc
Miçroanalyse élémentaire
%C %H %N %Cl
l0 Calculé : 55,76 6,18 13,01 13,17
Trouvé : 55,62 6,27 12,75 13,45
EXEMPLE 4Q : N-(4-Amîdinolzea~zyl)-2-[((21~)-~-cyclohcxyl-2-
{[(Gycluhcxylmë~hyl)-
sulf4nyl]-amine]-éthanoyl)-amino].-2-indanecarboxamidc,
chlc~rhydratc
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, du comp~sé décrit dans
la
préparation A, de (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine et de
chlorure de
cyclohexylméthanesulfonyle.
Miçroanalyse élémentaire
%C %H %N %Cl %S
Calcul : 61,52 7,20 10,87 5,50 4,98
Trouv : 61,22 7,22 10,67 5,49 4,91
EXEMPLE 41 : N-(4-Amidinobenzyl)-2-[((2R)-2-cyclohexyl-2-][(cyclohexylméthyl)-
sulFonyl]-amino}-e'thauoyl)-amïno]-2,3-dihydro-1H cyclapenta[b]
naphtalène-2-carboxamide, chlorhydrate
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-32-
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-2,3-dihydro-1H cyclopenta[b]naphtalène-2-
carboxylique,
du composé décrit dans la préparation A, de (R)-N-(tert-butyloxycarbonyl)-
cyclohexylglycine et de chlorure de cyclohexylméthanesulfonyle.
EXEMPLE 42 ; N-(4-Amïdïnobenzyl)-2-[((~R)-2..cyclohexyl-2-{[(ey~lohexylméihyl)-
sulfonyl].,amino{-êthanoyl)-amino]-2,3..dihydro-l~l Gyclop~nta
[a]naphtalen~-2-oarboxamïde, ~hlarhydra~~
Le produit attendu est obtenu selon le procédé décrit dans l' exemple 1 à
partir d' acide 2-
[(tert-butyloxycarbonyl)-amino]-2,3-dihydro-1H cyclopenta[a]naphtalène-2-
carboxylique,
lo du composé décrit dans la préparation A, de (R)-N-(tert-butyloxycarbonyl)-
cyclohexylglycine et de chlorure de cyclohexylméthanesulfonyle.
EXEMPLE 43 : N-(4.=Amïdïnob~nzyl)..2-[((2R)-2-{[(cyclohexylmëthyl)-salfonyl]-
amïno}-~-m~thylbu~anayl)-aminoj-~,3-dïhydra~-~.H=cyclapenïa
[a]naphïalèn~-~-eaxbAxamide~ ohlorhydra~~
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-2,3-dihydro-1H cyclopenta[a]naphtalène-2-
carboxylique,
du composé décrit dans la préparation A, de (R)-N-(tert-butyloxycarbonyl)-
valine et de
chlorure de cyclohexylméthanesulfonyle.
Microanalyse élémentaire
2o dC %H %N %Cl SS
Calculé : 62,42 6,78 10,70 4,90 5,42
Trouvé : 62,95 7,02 10,65 4,71 5,39
EXEMPLE 44 : N-(4-Amidinobenzyl)-2-[((ZR)-2-{[(Gyclohexylmèthyl)-sulfonyl]-
amino{-3-~mè~hylbutanoyl)-amino{-2,3-dihydro-1H cyclopenta
[banaphtalène-.~-carboxamide, chlorhydrate
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
- 33 -
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-2,3-dihydro-1H cyclopenta[b]naphtalène-2-
carboxylique,
du composé décrit dans la préparation A, de (R)-N-(tert-butyloxycarbonyl)-
valine et de
chlorure de cyclohexylméthanesulfonyle.
EXEMPLE 4a : Acide ~[(1R)-2-(~2-[(~4.~amidinobenzyl~-amino)-carbonyl]w.~,~-
dih~dro-1~ c~elopenta[b]naphtalén-~-.yI]-amino)..1-c~clohexyl-.~:-
oxoéthxl]-amina~acétîclue, chlarhydxate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade A, (acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par
l'acide 2-
[(tert-butyloxycarbonyl)-amino]-2,3-dihydro-1H cyclopenta[b]naphtalène-2-
carboxylique.
EXEMPLE ~f : Acîde ~[(1R)-2-(f2-[(~4-amidînohen~~l~-amino)-carbonyl]-~,~-
dihydro-1hT cyclapenta[a]naphtalén-2-~I]...amino)-1-cyclohexyl-2-
oxQ~thylj-amino]acêlique, chlarh~drale
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade A, (acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par
l'acide 2-
[(tert-butyloxycarbonyl)-amino]-2,3-dihydro-1H cyclopenta[a]naphtalène-2-
carboxylique.
EXEMPLE 47 : Acide ( f (1R).=1-[(~2-[(~4-amidinoben~yl}-amïno)-carbonyl]-.2,3-
dîhydro-111 cyclopenta[a]naphtal~n-2-yl~-.amino)-.carbonyI]-2-
méth~lprapyl~-amino)-ac~lique, chlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade A, (acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par
l'acide 2-
[(tert-butyloxycarbonyl)-amino]-2,3-dihydro-1H cyclopenta[a]naphtalène-2-
carboxylique,
et, au stade C, la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-
N-(tert-
butyloxycarbonyl)-valine.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-34-
Microanalyse élémentaire
~C ~H oN ~Cl
Calcul : 63,09 6,21 12,69 6,42
Trouv : 63,46 6,08 12,60 6,57
EXEl~IPLE 48 : AGïde ({(IR)-1-[((2-[(~4-amïdinobenzyl~-amino)-Garbonxl]-2,3-
dïhydro~-l.H cyelo~enta[b~naghtalén-2-yl~-amïno)-earbonyl]-~-
mêth~lprc~~~l}-amïno)-aeétïque? chlo~xh~drate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade A, (acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par
l'acide 2-
lo [(tert-butyloxycarbonyl)-amino]-2,3-dihydro-1H cyclopenta[b]naphtalène-2-
carboxylique,
et, au stade C, la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-
N-(tert-
butyloxycarbonyl)-valine.
Miçroanalyse élémentaire
%C %H %N ~Cl
Calculé : 63,09 6,21 12,69 6,42
Trouvé : 63,17 5,91 12,39 6,49
EXElI~IPLE 49 : N..(4-Amïdïnobenzyl)-2-[((2R)-2-~[(cyelohexylmëthyl)-sulfonyl]-
amïno~-3-mêthylbutanoyl)..amino~-2-indaneearboxamïde,
chlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, du composé décrit dans
la
préparation A, de (R)-N-(tert-butyloxycarbonyl)-valine et de chlorure de
cyclohexylméthanesulfonyle.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-35-
Microanalyse élémentaire
~C ~H AN foS ~Cl
Calcul : 59,64 7,01 11,59 5,31 5,87
Trouv : 59,75 7,07 11,43 5,22 5,92
E~EMF~LE ~Q ; N-(4-Amidinoben~yl)-~-[(~~I~)-~-~[(cy~lahexylméthyl~-snlfonyl]..
aminu~-~-.mé~hylbutanoyl)-amino]-2,3.-dihydro.-l~ phénalène-~-
Garbaxamlde, chlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-2,3-dihydro-1H phénalène-2-carboxylique, du
composé
lo décrit dans la préparation A, de (R)-N-(tert-butyloxycarbonyl)-valine et de
chlorure de
cyclohexylméthanesulfonyle.
Miçroanalyse élémentaire
doC ~H %N %S ~Cl
Calcul : 62,42 6,78 10,70 4,90 5,42
Trouv : 62,79 7,58 10,63 4,49 5,31
E~Ell~f"LE ~l : Acide ( f (1R)-I-[(i~-C(~4-amidinoben~yl].-aminQ)-carbanyl]-
~,~-
dihydro-1H ghénalén-2-yI~-mina)-carbanyl]-2-.më~hylpropyl~-
amino)-acëtidue, diehla~rhydra~e
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
2o stade A, (acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par
l'acide 2-
[(tert-butyloxycarbonyl)-amino]-2,3-dihydro-1H phénalène-2-carboxylique, et,
au stade C,
la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-N-(tert-
butyloxycarbonyl)-
valine.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-36-
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 59,18 5,99 11,90 12,05
Trouv : 59,56 5,59 11,85 11,25
E~l~'~~"I,E S~ ~ N.-('4.-Amidinabenz~l~-.~_[((2Ra'~-{[iso~u~isulfanyl]-amino}-
3..
mëth~Ibutano~l)-.amino]-2-indanecarboxamïdax chIorhydrat~
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 2
[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, du composé décrit dans
la
préparation A, de (R)-N-(tert-butyloxycarbonyl)-valine et de chlorure d'
lo isobutanesulfonyle.
Microanalyse élémentaire
SC -H ~N ~S ~Cl
Calcul : 57,48 6,79 12,41 5,68 6,28
Trouv : 57,77 6,93 12,28 5,41 6,38
1s EXEII~L~ S3 ; A,~ide (~(~.R)-~-[(~6-[(~4-amidinobenzyi]-amino)-carbcanyi]-
6~7_
dih~dro-5~=dib~n~o[a,a~]cyciaheptén-G-xi~-amino~-carbonyi]-2_
m~thylprapyl~-amino~-acétique, dichlarhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade A, l'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par
20 l'acide 6-[(tert-butyloxycarbonyl)-amino]-6,7-dihydro-5H
dibenzo[a,c]cycloheptène-6-
carboxylique, et, au stade C, la (R)-N-(tert-butyloxycarbonyl)-
cyclohexylglycine par la
(R)-N-(tert-butyloxycarbonyl)-valine.
Miçroanalyse élémentaire
~C rH ~N AoCI
25 Calcul : 60,59 6,07 11,40 11,54
Trouv : 61,11 6,11 11,34 11,68
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-37-
EXEMPLE â4 : N-(4-C~anc~ben~yi)-~-[((2R)-2-~[(e~ciohexylm~thyl)-~ui~anyi~-
amino~-3-m,é~hyibu~anoyi)-amina]-2-indaneaarlaAxamide
Le produit attendu est obtenu selon le procédé décrit dans les stades A à E de
l'exemple 1
en remplaçant, au stade A, le composé de la préparation A par le 4-
(aminométhyl)benzonitrile, et, au stade E, le 2-bromoacétate de benzyle par le
chlorure de
cyclohexylméthanesulfonyle.
Miçroanalyse élémentaire
%C ~H %N %S
Calculé : 65,43 6,95 10,17 5,82
1o Trouvé : 65,28 6,93 10,17 5,73
EXEMPLE SS : N-~4..[(Hydroxyamino)-(imino)-méthyle-benzxl~-2-~((2R).-2-
~~(cyGlo
hexylm~thyI)..SUlfonyl]-aminc~~-3-mêthylbutanoyl)-amino~-2-
indaneearbaxamide
Le produit attendu est obtenu selon le procédé décrit dans les stades A à E de
l'exemple 1
en remplaçant, au stade A, le composé de la préparation A par le composé de la
préparation
F, et, au stade E, le 2-bromoacétate de benzyle par le chlorure de
cyclohexylméthanesulfonyle.
Miçroanalyse élémentaire
~C rH %N ~S
2o Calcul : 61,73 7,08 12,00 5,49
Trouv : 61,52 7,06 11,99 5,16
EXEMPLE S6 : Acide ~[2-({2-[(~4-amidînobenzyl~-amino)-carbanyl]-indan-2-yl}-
amino)-I,l-dïméthyl-2-oxoé~hyl~-amino~aeëlique, dichlorhydra~e
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-38-
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade C, la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la N-(tert-
butyloxycarbonyl)-2-méthylalanine.
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 54,97 5,96 13,35 13,52
Trouv : 54,97 5,84 13,13 12,69
EXEM~'T.~E 5? : A~xd~ ({1-[({~-[(~4-amidinaben~~l}-amine)-~arhon~i]-indan-~-
yl~-
a,mina)-~arbo~yi]-~~cla~pen~i~-amxno)-ac6tiqu~, di~hiorhxdra~e
lo Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade C, la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par l'acide 1-
[(tert-
butyloxycarbonyl)-amino]-cyclopentanecarboxylique.
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 56,73 6,04 12,72 12,88
Trouv : 56,57 5,92 12,61 12,23
E~ElIfIFLE ~~ : Acide ({(1R)-1-~(~~-[({4-amidinabenzyl]-aminor)-earbon~l]-
indan-2-
yl]..amino)-c~rbonyl]-pro~p~I}-amino)-açë~ique, dichlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade C, la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par l'acide (2R)-2-
[(tert
butyloxycarbonyl)-amino]-butanoïque.
Miçroanalyse élémentaire
%C %H %N %CZ
Calcul : 54,97 5,96 13,35 13,52
Trouv : 54,68 5,85 13,14 12,87
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-39-
E~E~TPLL 5~ : Acide (~(1.R,2R)-L-[(~2-[(~4-amidinobenzyl~-axnino)-carbanyl]-
indan-
-yl~-amino)-carbonyl]-2-méihylbutyl~-amino)-acétiqu.c,
dichlorh~dra.~c
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade C, la (R)-N-(teut-butyloxycarbonyl)-cyclohexylglycine par la (2R,3R)-N-
(tert
butyloxycarbonyl)-isoleucine.
Miçroanalyse élémentaire
%C %H %N %Cl
Calculé : 56,52 6,39 12,68 12,83
lo Trouvé : 57,26 6,43 12,69 12,61
EXEMPLE 6Q : Acide (~(1R)-2-.[({2-[(~4-amidinobenzyl~-amino)-carbonyl]-indan-2-
yl~-amino)-carbonyl]-~,~-diméthylpropyl~-amïno)-acétique,
dichlorhydraic
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade C, la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par l'acide (2R)-2-
[(tert-
butyloxycarbonyl)-amino]-3,3-diméthylbutanoïque.
Microanalyse élémentaire
%C %H %N %Cl
Calcul : 56,52 6,39 12,68 12,83
Trouv : 56,98 6,36 12,61 12,34
EXEMPLE 61 : Diastéréoisomère 1. de hacide (~(1R)-i-[(]6-[(~4-amidinobenzyl}_
amino)-carbonyl]-6x7-dihydro-5~ cyclopenta.[b]pyridin-6-yl~-amino)
-carbonyl]-2-méihylgropyl]-amïno)-acétique, trichlorhydraie
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-40-
Stade A : Diasté~éoisomère 1 du (~(1 R)-1-~(~6-~(~4-~~~(berzzyloxy)-carbofaylJ-
amiraoJ-(ifniyao)-mét7zylJ-benzylJ-amino)-ca~bonylJ-6, 7-dilaydro-SH-
cycloperata~bJpy~idifa-6 yl~-anaino)-carborzylJ-2-méthylpy~opyl)-anaino)-
acétate de benzyle
Le produit attendu est obtenu selon le procédé décrit dans les stades A à E de
l'exemple 1
en remplaçant, au stade A, l'acide 2-[(tert-butyloxycarbonyl)-amino]-2-
indanecarboxylique
par l'acide 6-[(tert-butyloxycarbonyl)-amino]-6,7-dihydro-5H
cyclopenta[b]pyridine-6-
carboxylique, et, au stade C, la (R)-N-(tert-butyloxycarbonyl)-
cyclohexylglycine par la
(R)-N-(tert-butyloxycarbonyl)-valine, puis en séparant le mélange de
diastéréoisomères
l0 ainsi obtenu par chromatographie sur silice.
Le produit attendu est le premier des diastéréoisomères ainsi séparés.
Stade B: Diasté~éoisonaère I de l'acide (~(IR)-1-~(~6-~(~4-amidinobenzyl,~-
amifao)
ca~bofzylJ-6, 7-dihydf~o-SH çyclopenta~bJpyf~idifz-6 yl)-amino)-ca~bonylJ-2-
méthylpf°opylJ-amino)-acétique, triclalo~hydrate
Le produit attendu est obtenu selon le procédé décrit dans le stade F de
l'exemple 1 à partir
du composé obtenu au stade précédent.
Miçroanalyse élémentaire
%C %H %N %Cl
Calculé : 50,05 5,78 14,59 18,47
Trouvé : 50,39 5,71 14,54 18,37
EXEMPLE ~~ : Diastéréolsomérc 2 de lucide ({(1R)-1-[(~6-[(~~-amidxnobenz~i~-
amlno)carbony~]-6?7-dxhydro-S.F.I cyciogenta[b]pyridin-6-yl~-amino)-
carhonyl]-2-mé~hylgrogyl]-amino)-aGéüque, irichiorh~draic
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-41-
Stade A : Diastéréoisomè~e 2 du (~(1 R)-1-((~6-~(~4-~~~(benzyloxy)-carbonylJ-
anZinoJ-(intino)-méthylJ-benzylJ-anZino)-carbotaylJ-6, 7-dilaydro-SH
cyclopenta~bJpyridin-6 ylJ-amino)-ca~bonylJ-2-méthylpropylJ-amino)-
acétate de benzyle
Le produit attendu est le deuxième des diastéréoisomères séparés au stade A de
l'exemple
61.
Stade B: Diastéréoisomèf~e 2 de l'acide(~(IR)-1-~(~6-~(~4-amidinobenzylJ-
amino)
ca~bonylJ-6, 7-dilaydro-SH cyclopenta~bJpy~~idin-6 ylJ-amino)-carbonylJ-2-
méthylpropylJ-anaino)-acétique, trichlot°hyd~ate
l0 Le produit attendu est obtenu selon le procédé décrit dans le stade F de
l'exemple 1 à partir
du composé obtenu au stade précédent.
Miçroanalyse élémentaire
%C %H %N %Cl
Calculé : 50,05 5,78 14,59 18,47
Trouvé : 50,14 5,56 14,45 19,00
E~El~FLE 6~ : (4-~i[(~~-[((~R)-~-~~(Gyclahex~lmé~hyl)-sulîan~l]-amïna~-3_
méth~lbu~anc~yl)..amïno].~ïndan~-2..~1},.carbon~l)-amïno]-mêah~l~-
phényl).~(imïna)-mé~h~lcarbamate d'hexyle
Le produit attendu est obtenu selon le procédé décrit dans les stades A à E de
(exemple 1 à
partir d'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, du
composé décrit
dans la préparation E, de (R)-N-(tert-butyloxycarbonyl)-valine et de chlorure
de
cyclohexylméthanesulfonyle.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-42-
Miçroaiialyse élémentaire
%C %H %N %S
Calculé : 63,86 7,68 10,06 4,61
Trouvé : 64,10 7,93 9,89 4,30
E~ElI~IFLE 64 : N-.(4..Amîdinoben~l)-~-[((~R)-2-~[(c~clohex~lméthyl)-sulfonyl]-
amîno~-3-méth~lbutano~l)-amino]-6,7-dîhydra-~~I cycloFenta.[l~]
p~ridîne.-â-çarboxamide, dîchlorhydrate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 6-
[(tert-butyloxycarbonyl)-amino]-6,7-dihydro-5H cyclopenta[b]pyridine-6-
carboxylique, du
l0 composé décrit dans la préparation A, de (R)-N-(tert-butyloxycarbonyl)-
valine et de
chlorure de cyclohexylméthanesulfonyle.
Miçroayalyse élémentaire
%C %H %N %S %Cl
Calculé : 54,28 6,60 13,10 5,00 11,05
Trouvé : 54,57 6,57 13,05 4,99 10,85
E~El~I"LE 6~ : Acide (((1R)-1-.[((h-[(~4_amidinoben~yl}-amîna)earbonyl]-6,?-
dih~dro-~~';e~elopenta[c]p~rîdin-f-~l~-amino~-earbonyl]-2_
mëth~lpropy]-amîno)-acétîque,trichlorh~drate
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade A, l'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par
l'acide 6-
[(tert-butyloxycarbonyl)-amino]-6,7-dihydro-5H cyclopenta[c]pyridine-6-
carboxylique et,
au stade C, la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-N-
(tert-
butyloxycarbonyl)-valine.
EXEMPLE 66 : N-(4-Amidinabenzyl)-~-~[(~R)-~2-(isobutylamino)-3-mëthyl
butanoyl]-amino}-Z-indanecarboxamîde, dïchlorhydrate
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
- 43 -
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique, du composé décrit dans
la
préparation A, de N-(tert-butyloxycarbonyl)-glycine et de chlorure
d'isobutyle.
Miçroanalyse élémentaire
~C ~H %N rCl
Calcul : 58,30 6,73 14,16 14,34
Trouv : 57,97 6,86 14,19 14,92
EXEMPLE 6'1 : N-[(6-.Amïno-2-méthyl-3-pyrïdyl)-méthxl]-2-f [(2R)-2-(isobutyl
amïno)-3-mëth~lbutanoyl]-amïno]-2-ïndane~arlao~amlde~
1 o dïchlorhydrate
Le produit attendu est obtenu sous forme de base selon le procédé décrit dans
les stades C
à E de l'exemple 1 à partir du composé obtenu au stade A de l'exemple 21, de N-
(tert-
butyloxycarbonyl)-glycine et de chlorure d'isobutyle, puis il est salifié par
l'acide
chlorhydrique.
Microanalyse élémentaire
~C %H %N %Cl
Calcul : 57,26 6,89 14,52 14,70
Trouv : 57,17 7,02 14,49 14,95
EXEMPLE GS t AGïde f [2-( f 2-[(ø4-amïdïnol~enzyl]~-amino)-carbon~l]-indan-2-
yl]-
2o amïno)-2-o~oëthyl]-amïno~acét~iclue, dichlorhydra e
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade C, la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la N-(tert-
butyloxycarbonyl)-glycine.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-44-
Microanalyse élémentaire
%C %H %N %Cl
Calcul : 53,23 5,48 14,11 14,28
Trouv : 53,40 5,56 14,00 14,32
EXEMPLE 69 : Acido f [(1R).=2-(~~.~[({4-amïdinobenzyl~-amino)-carbonyl]-a,6.~
dïméthoxy-indan-2-yl}-amino)-l.~isagrogyl-.2-oxoéthyl],amino~
a,~éticïue~ ~hlorh~drate
Le produit attendu est obtenu selon le procédé de l'exemple 1 en remplaçant,
au stade A,
l'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par l'acide 2-
[(tert-
lo butyloxycarbonyl)-amino]-5,6-diméthoxy-2-indanecarboxylique, et au stade C,
la (R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-N-(tert-butyloxycarbonyl)-
valine.
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 57,70 6,46 12,46 6,31
Trouv : 58,06 6,32 12,50 6,78
EXEMPLE ZO : Acïd~ (~(LR)-1-[({2-~(~4-amïdïnoben~yl}-amino)-Garbonyl]-indan-2-
yl}-amino)-carbonylj-3-méxhylbutyl}-amino~-acëïique, chlorhydraxe
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade C, la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-N-(tert
butyloxycarbonyl)-leucine.
Miçroanalyse élémentaire
%C %H %N %Cl
Calcul : 60,52 6,64 13,57 6,87
Trouv : 60,39 6,53 13,40 7,56
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
- 45 -
EXElVIPLE 71 : AGide ~[(1R)-2-({2-[({4-amidinolaen~yl~-amiuo)-carbonyl]-iudan-
2-yl}
-amino)-~.-méthxl-2-oxoéthyl]-amino}ac~tïque, dichlorhydratc
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 en
remplaçant, au
stade C, la (R)-N-(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-N-(tert
butyloxycarbonyl)-alanine.
Miçroanalyse élémentaire
%C %H %N ~CZ
Calcul : 54,12 5,73 13,72 13,89
Trouv : 54,34 5,87 13,53 14,35
1o EXElYn"LE 72 : N-(4-Amïdïnobenzyl)-2_.[(f2R)-2_~[ïsobut~lsulFonyl],-amino~-
3_
m~thylbutanoyl)-amïnoJ-5,6-.dimélhox~-Z-indanecarboxamïde,
chlc~rh~dra~e
Le produit attendu est obtenu selon le procédé décrit dans l'exemple 1 à
partir d'acide 2-
[(tert-butyloxycarbonyl)-amino]-5,6-diméthoxy-2-indanecarboxylique, du composé
décrit
dans la préparation A, de (R)-N-(tert-butyloxycarbonyl)-valine et de chlorure
d'
isobutanesulfonyle.
Microanalyse élémentaire
~C %H ~N ~S SCl
Calculé : 55,80 6,78 11,22 5,14 5,68
2o Trouvé : 55,58 6,94 11,21 4,90 6,01
EXENI~'LE 73 : A~ïde ~C(1.1Z.)-i.-(ø[(1S)-2-(~4-amïdïnobe~~~l~-amino)-~-bcnzyl-
~-
oxoë~hyl~-amïno~-carbonyl)-2-méth~lprogyl]amino~-acétique,
dïchlorhxdratc
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-46-
Le produit attendu est obtenu selon le procédé de l'exemple 1 en remplaçant,
au stade A,
l'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par la (S)-N-
(tert-
butyloxycarbonyl)-phénylalanine, et au stade C, la (R)-N-(tert-
butyloxycarbonyl)-
cyclohexylglycine par la (R)-N-(tert-butyloxycarbonyl)-valine.
Miçroanalyse élémentaire
%C °~H %N %Cl
Calculé : 54,75 6,32 13,30 13,47
Trouvé : 54,90 6,40 13,27 13,08
E~EI~)~'~~ 74 ; .Acide ({(lit.)--[(~(15~)-2- f ~4-amidlnobenzyl~-amino)-~-
benzh~dryl-2-
o~oéthyl]-amino~-carbanyl)-~-mélhylgropyl]amino~-acétiqucz
dichlorhydratc
Le produit attendu est obtenu selon le procédé de l'exemple 1 en remplaçant,
au stade A,
l'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par l'acide
(2S)-2-[(tert-
butyloxycarbonyl)-amino]-3,3-diphénylpropanoïque, et au stade C, la (R)-N-
(tert-
butyloxycarbonyl)-cyclohexylglycine par la (R)-N-(tert-butyloxycarbonyl)-
valine.
Miçroanalyse élémentaire
môC %H °doN %CZ
Calculé : 59,80 6,19 11,62 11,77
Trouvé : 60,35 6,15 11,88 11,62
2o EXElI~FT,E 7â : Acidc (f (1.R)-1-[(~(1S)-2-[~4-amidinobcn~yl]-amina)-1-(~,~-
dihydro-
1H indén-2-yl)-2-oxoélhyl]-amïno~-carbanyl)-2-méthylprogyl]
amine]-acétique, dichlorhydrate
Le produit attendu est obtenu selon le procédé de l'exemple 1 en remplaçant,
au stade A,
l'acide 2-[(tert-butyloxycarbonyl)-amino]-2-indanecarboxylique par l'acide
(2S)-2-[(tert-
butyloxycarbonyl)-amino]-(2,3-dihydro-1H indén-2yl)éthanoïque, et au stade C,
la (R)-N-
(tert-butyloxycarbonyl)-cyclohexylglycine par la (R)-N-(tert-butyloxycarbonyl)-
valine.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
-47-
Microanalyse élémentaire
%C %H %N %Cl
Calculé : 56,52 6,39 12,68 12,83
Trouvé : 56,63 6,57 12,80 12,62
ETLII~E P~IARlI~IAGUI.OGIQUE DES GOI~IPOSES DE L'INVENTION
EXEMPLE 76 : ~n~~bit~on de 1a F~rptéin~e G a~cl~vée et de grotéas~s à s~~~ïne
de Ia
~oagu~at~o~ et de Via, ~b~~~a~ly~e
Pour évaluer in vitro l'activité inhibitrice des produits de l'invention sur
la protéine C
activée humaine purifiée (Diagnostica Stago), le substrat chromogène pyroGlu-
Pro-Arg-
lo pNA (0.39 mM, 52366, Chromogenix) a été ajouté à une quantité donnée de
protéine C
activée (2 nM) préalablement incubée avec ou sans l'inhibiteur à tester
(20°C, 30 minutes).
Pour évaluer in vitro la sélectivité vis-à-vis de la thrombine et de la
plasmine, le même
protocole a été appliqué à la thrombine humaine purifiée (0.7 nM, Sigma) et à
la plasmine
humaine purifiée (2 nM, Stago) en utilisant respectivement pour substrat le
fibrinogène
humain purifié (6 ~,M, Enzyme Research Laboratories) et le peptide
paracitroanilidé <Glu-
Phe-Lys-pNA (0.37 mM, 52403, Chromogenix).
Inhibiteurs, enzymes et substrats sont dilués dans le même tampon (tampon
phosphate
0.01 mM, pH 7.4, contenant 0.12 M de chlorure de sodium et 0.05 % de sérum
albumine
bovine dans le cas de la thrombine et tampon TRIS-HCl 50 mM, pH 7.4, contenant
0.12 M
2o de chlorure de sodium, 3 mM de chlorure de calcium et 0.05 % de sérum
albumine bovine
dans le cas de la protéine C activé et de la plasmine) puis distribués dans
une microplaque
en polystyrène sous un volume de 50 ql.
CA 02474785 2004-08-03
WO 03/070690 PCT/FR03/00506
- 48 -
Le paranitroanilide libéré ou la fibrine formée par l'action de la protéase à
sérine est
mesurée spectrophotométriquement à 405 nm après 10 à 30 minutes de réaction à
20°C.
Dans ce test, les composés de l'invention sont des inhibiteurs puissants de la
protéine C
activée (concentration des composés inhibant 50 % (ICSO) de l'activité
enzymatique de
l'ordre de 20 à 1000 nM).
De plus, les composés possèdent une sélectivité très importante vis-à-vis
d'une protéase à
sérine de la fibrinolyse, la plasmine, et de la coagulation, la thrombine.
A titre d'exemple, le composé de l'exemple 1 possède une ICSO de 820 nM vis-à-
vis de la
protéine C activée, de 1100 nM vis-à-vis de la plasmine et >33000 nM vis-à-vis
de la
lo thrombine.
~XElYIPLE ~'~ : ~omposi~ia~n pharmaceu~~que
Formule de préparation pour 1000 comprimés dosés à 10 mg
Composé de 1 exemple
1..............................................................................
....... 10 g
Hydroxypropylcellulose
...............................................................................
....... 2 g
Amidon de blé
...............................................................................
..................... 10 g
Lactose
...............................................................................
...............................100 g
Stéarate de
magnésium......................................................................
.................. 3 g
Talc...........................................................................
........................................... 3 g