Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
1
DÉRIVES DE QUINOLEINES-4-SUBSTITUÉES, LEURS PROCÉDÉ ET
INTERMÉDIAIRES DE PRÉPARATION ET LES COMPOSITIONS
PHARMACEUTIQUES QUI LES CONTIENNENT
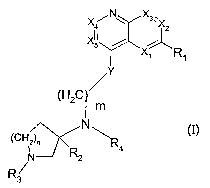
La présente invention concerne des dérivés de
quinoléines-4-substituées de formule générale
X~NW X3.
4 ~~2
R~
~Y
(H2C~
m
N \ (I)
(CH2)~ R
N R2
R3
qui sont actifs comme antimicrobiens. L'invention concerne
également leurs procédé'et intermédiaires de préparation et
- les compositions pharmaceutiques les contenant.
Dans les demandes de brevet WO 99/37635 et WO 00/43383 ont
été décrits des dérivés de quinolyl propyl pipéridine
antimicrobiens, de formule générale .
A-B-(CHZ)~ N-R4 A-B-(CHZ)~ 'N-R4
~u s z
\ \ R R3 R~~z1~ ~ i s R3
(R1)m 22
/ NJ z~~zi N~z4
3
dans laquelle le radical R1 est notamment alcoxy (C1-6), R~
est hydrogène, R3 est en position -2 ou -3 et représente
alcoyle (C1-6) pouvant être éventuellement substitué par 1 à
3 substituants choisis parmi thiol, halogène, alcoylthio,
trifluorométhyl, carboxy, alcoyloxycarbonyle,
alcoylcarbonyle, alcènyloxyçarbonyle, alcènylcarbonyle,
hydroxy éventuellement substitué par alcoyle, R4 est un groupe
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
2
-CH2-RS pour lequel RS est. sélectionné parmi alcoyle
hydroxyalcoyle, alcènyle, alcynyle, tétrahydrofuryle,
phénylalcoyle éventuellement substitué, phénylalcényle
éventuellement substitué, hétéroarylalcoyle éventuellement
substitué, hétéroaroyle éventuellement substitué ..., n est 0
à 2, m est 1 ou 2 et A et B sont notamment oxygène, soufre,
sulfinyle, sulfonyle, NR11, CR6R~ pour lequel Rg et R~
représentent H, thiol, alcoylthio, halo, trifluorométhyle,
alcènyle, alcènylcarbonyle, hydroxy, amino, et Z1 à Z5 sont N
ou CRla . - .
D'autres demandes, notamment WO 00/21952, WO 00/21948,
WO O1/0743~2, WO 01/07433, WO 03/010138, ou encore WO 02/40474
ou WO 02/072572 décrivent d'autres dérivés de 4-quinolyl
propyl) pipéridines, substituêes notamment en 3 ou
disubstituées en 4, actifs dans le même domaine. La demande
européenne EP 30044 décrit par ailleurs des dérivés
apparentés, actifs dans le domaine cardiovasculaire.-
I1 a maintenant été trouvé, et c'est ce qui fait l'objet de
la présente invention, que les composés de formule générale
(I) dans laquelle .
Xl, Xz, X3, X4 et XS représentent respectivement >C-R' 1 à
>C-R'S, ou bien l'un au plus d'entre eux représente un atome
d' azote,
R1, R' l, R' 2, R' 3, R' 4 et R' S sont identiques ou différents et
représentent un atome d'hydrogène ou d'halogène ou un radical
alcoyle, cycloalcoyle, phényle, phénylthio, hétêroaryle ou
hétéroarylthio mono ou bïcyclique, OH, SH, alcoyloxy, difluo-
rométhoxy, trifluorométhoxy, alcoylthio, trifluorométhylthio,
cycloalcoylox~, cycloalcoylthio, acyl, acyloxy, acylthio,
cyano, carboxy, alcoyloxycarbonyle, cycloalcoyloxycarbonyle,
nitro, -NRaRb ou -CONRaRb (pour lesquels Ra et Rb peuvent
représenter hydrogène, alcoyle, cycloalcoyle, phényle,
hétéroaryle mono ou bicyclique ou Ra et Rb forment ensemble
avec l'atome d'azote auquel ils sont liés un hétérocycle à 5
ou 6 chaînons pouvant éventuellement contenir un autre
hétéroatome choisi parmi O, S ou N et portant le cas échéant
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
3
un substituant alcoyle, phényle ou hétéroaryle mono ou
bicyclique sur l'atome d'azote ou, le cas échéant, dont
l'atome de soufre est oxydé à l'état sulfinyle ou sul.fonyle),
ou représentent un radical méthylène substitué par fluoro,
hydroxy, alcoyloxy, alcoylthio, cycloalcoyloxy;
cycloalcoylthio, phényle, hétéroaryle mono ou bicyclique,
carboxy, alcoyloxycarbonyle, cycloalcoyloxycarbonyle, -NRaRb
ôu -CONRaRb pour le.squel Ra et Rb sônt définis comme
précédemment,
ou représentent phénoxy, hétérocyc.lyloxy, benzyloxy,
hétérocyclylméthyloxy, ou bien R1 peut également représenter
difluorométhoxy, ou un radical de structure -CmF2m+i. -SCmFzm+i
ou -OCmF2m+i pour lesquels m est un entier de 1 à 6 ou bien R'S
peut également représenter trifluoracétyle,
m est égal à 0,1 ou 2';
n est égal à 0 ou 1 ;
Y représente un groupe CHR, C=O ou, quand m est égal à 1 ou
2, CROH, CRNHz, CRF ou CF2, R étant un atome d'hydrogène ou un
radical alcoyle (Ci-~) ;
Rz représente un radical R, -C02R, -CH2COZR, -CHI-CHzC02R,
-CONH2, -CHI-CONH2, -CHZ-CHz-CONH2, -CHzOH, -CHz-CHZOH, -CH2-NH~
-CH2-CHa-NH2 ou -CH2-CH2-CH2-NH2, R étant tel que défini plus
haut ;
R3 représente un radical phényle, hétéroaryle mono ou
bicyclique, alk-R°3 pour lequel~alk est un radical alcoylène
et R°3 représente hydrogène, halogène, hydroxy, alcoyloxy,
alcoylthio, alcoylsulfinyle, alcoylsulfonyle, alcoylamino,
dialcoylamino, cycloalcoyle, cycloalcoyloxy, cycloalcoylthio,
cycloalcoylsulfinyle, cycloalcoylsulfonyle, cycloalcoylamino,
N-cycloalcoyl N-alcoyl amino, -N-(cycloalcoyle)~, acyle,
cycloalcoylcarbonyle, phényle, phénoxy, phénylthio,
phénylsulfinyle, phénylsulfonyle, phénylamino, N-alcoyl
N-phényl amino, N-cycloalcoyl N-phényl amino, -N-(phényle)~,
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
4
phénylalcoyloxy, phénylalcoylthio, phénylalcoylsulfinyle,
phénylalcoylsulfonyle, phénylalcoylamino,. N-alcoyl N-phényl
aminoalcoyle, N-cycloalcoyl N-phénylalcoyl amino, benzoyle,
hétéroaryle mono ou bicyclique, hétéroaryloxy,
hétéroarylthio, hétéroarylsulfinyle, hétéroarylsulfonyle,
hétéroarylamino, N-alcoyl N-hétéroaryl amino, N-
cycloalcoyl N-hétéroaryl amino, hétéroarylcarbonyle,
hétéroarylalcoyloxy, hétéroarylalcoylthio,
hétéroarylalcoylsulfinyle, hétéroarylalcoylsulfonyle,
hétéroarylalcoylamino, N-alcoyl N-hétéroaryl amino-alcoyle,
N-cycloalcoyl N-hétéroaryl aminoalcoylë, (les parties
hétéroaryle citées ci-avant étant mono ou bicycliques),
carboxy, alcoyloxy-carbonyle, -NRaRb ou -CO-NRaRb pour
lesquel Ra ët Rb représentent respectivement hydrogène,
alcoyle, cycloalcoyle, phényle, hétéroaryle mono ou
bicyclique, ou l'un de Râ ou Rb représente hydroxy,
alcoyloxy, cycloalcoyloxy, ou Ra et Rb forment ensemble avec
h'atome d'azote auquel ils sont liés un hétérocycle à 5 ou 6
chaînons pouvant éventuellement contenir un autre hétéroatome
choisi parmi O, S et N et portant, le cas échéant, un
substituant alcoyle, phényle ou hétérôaryle mono ou
bicyclique sur l'atome d'azote ou, le cas échéant, dont
1~'atome de soufre est oxydé à l'état sulfinyle ou sulfonyle,
ou bien R°3 reprêsente -CR'b=CR'c-R'a pour lequel R'a
représente phényle, phénylalcoyle, hétéroàryle ou
hétéroarylalcoyle dont la partie hétéroaryle est mono ou
bicyclique, phénoxyalcoyle, phénylthioalcoyle,
phénylsulfinylalcoyle, phénylsulfonylalcoyle,
phénylaminoalcoyle, N-alcoyl N-phényl aminoalcoyle,
hétéroaryloxyalcoyle, hétéroarylthioalcoyle,
hétéroarylsulfinylalcoyle, hétéroarylsulfonylalcoyle,
hétéroarylaminoalcoyle, N-alcoyl N-hétêroaryl aminoalcoyle,
hétéroarylthio, hétéroarylsulfinyle, hétéroarylsulfonyle,
(les parties hétéroaryle citées ci-avant êtant mono ou
bicycliques), phénylthio, phénylsulfinyle, phénylsulfonyle,
et pour lequel R'b et R'c représentent hydrogène, alcoyle ou
cycloalcoyle, ou bien R°3 représente un radical -C---C-Rd pour
lequel Rd est alcoyle, phényle, phénylalcoyle,
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
phénoxyalcoyle, phénylthioalcoyle,
N-alcoyl N-phényl aminoalcoyle, hétéroaryle mono ou
bicyclique, hétéroarylalcoyle, hétérôaryloxyalcoyle,
hétéroarylthioalcoyle, hétéroarylaminoalcoyle,
5 N-alcoyl N-hétéroaryl aminoalcoyle, (les parties hétéroaryle
citées ci-avant étant- aromâtiques mono ou bïcycliques), ou
bien R°3 représente un radical -CFz-phényle ou
-CF2-hétéroaryle mono ou bïcyclique,
étant entendu que les radicaux ou portions phényle, benzyle,
benzoyle ou hétéroaryle mentionnés ci-dessus sont
éventuellement substitués sur le cycle par 1 à 4 substïtuants
choisis parmi halogène, hydroxy, alcoyle, alcoyloxy,
alcôyloxyalcoyle, halogénoalcoyle, trifluorométhyle,
trifluorométhoxy, trifluorométhylthio, carboxy, alcoyloxy-
carbonyle, cyano, alcoylamino, -NRaRb pour lequel Ra et Rb
sont définis comme ci-dessus, phényle, hydro~yalco~le,
alcoylthioalcoyle, alcoylsulfinylalcoyle, alcoylsulfonyl-
alcoyle ; '
R4 représente un radical R,-CHO, -COCH3, -CHzC02H ou
2 0 -COCHZNHZ ;
étant entendu que les radicaux et portions alcoyle ou acyle
contiennent (sauf. mention spéciale) 1 à 10 atomes de carbone,
en chaîne droite ou ramifiée, et que les radicaux
cycloalcoyle contiennent 3 à 6 atomes de carbone,
sous leurs formes énantiomères ou diastéréoisomères ou les
mélanges de ces formes, et/ou le cas échéant sous forme syn
ou anti ou leur mélange, ainsi que leurs sels, sont de très
puissants agents anti-bactériens.
Il est entendu que lorsque les radicaux représentent ou
portent un atome d'halogène, l'halogène est choisi parmi
fluor, chlore, brome ou iode, et est de préférence le fluor.
Dans la formule générale cï-dessus, lorsque les radicaux
représentent ou portent un substituant hétéroaryle mono ou
bicyclique, ce dernier contient 5 à 10 chaînons et peut être
choisi (à titre non limitatif) parmi thiényle, furyle,
pyrrolyle, imïdazolyle, thiazolyle, oxazolyle, thïadiazolyle,
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
6
oxadiazolyle, tétrazolyle, pyridyle,~ pyridazinyle,
pyrazinyle, pyrimidinyle, indolyle, benzothiényle,
benzofuranyle indazolyle, benzothiazolyle, nàphtyridinyle,
qùinolyle, isoquinolyle, cinnolyle, quinazolyle, quinoxalyle,
benzoxazolyle, benzimidazolyle pouvant être éventuellement
substitués par les substituants cités ci-dessus.
Parmi les composés de formule générale (I), on peut notamment
citer ceux dans lesquels
X1, X2, X3, X4 et XS sont tels que définis ci-dessus,
R1, R' 1, R' 2, R' 3, R' 4, et R' S, sont identiques ou différents
et représentent un atome.d'hydrogène ou d'halogène ou un
radical alcoyle ou alcoyloxy, ou représentent un radical
méthylène substitué par alcoyloxy ;
m est égal à 1 ;
n est égal à l';
Y représente un radical CHz, CHOH, CHF, CHNHz ou C=O ;
R2 est tel que défini précédemment, et
R3 représente un radical alk-R°3 pour lequel alk est un
radical alcoylène et R°3 représente alcoyloxy, alcoylthio,
alcoylamino, dialcoylamino, cycloalcoyloxy, cycloalcoylthïo,
cycloalcoylamino, N-cycloalcoyl N-alcoyl amino,
-N-(cycloalcoyle)2, phénoxy, phénylthio, phériylamino,
N-alcoyl N-phényl amino, N-cycloalcoyl N-phényl amino,
phénylalcoyloxy, phénylalcoylthio, phénylalcoylamino,
N-alcoyl N-phényl aminoalcoyle, N-cycloalcoyl N-phénylalcoyl
amino, hétéroaryl oxy, hétéroarylthio, hétéroarylamino.,
N-alcoyl N-hétéroaryl amino, N-cycloalcoyl N-hétéroaryl
amino, hétéroarylcarbonyle, hétéroarylalcoyloxy,
_ hétéroarylalcoylthio,. hétéroarylalcoylamino,
N-alcoyl N-hétéroaryl aminoalcoyle, N-cycloalcoyl
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
7
N-hétéroaryl aminoalcoyle, (les parties hétéroaryles citées
ci-avant étant mono oû bicycliques), -NRaRb ou -C0-NRaRb
.pour lesquels Ra-et Rb sont définis comme plus hauts ou bien
R°3 représente -CR'b=CR'c-R'a pour lequel R'a représente
phényle, phénylalcoyle, hétéroaryle ou hétéroarylalcoyle,
phénoxyalcoyle, phénylthioalcoyle, phénylaminoalcoyle,
N-alcoyl N-phényl amïnoalcoyle, hétéroaryloxyalcoyle,
hétéroarylthioalcoyle, hétéroarylaminoalcoyle.,
N-alcoyl N-hétéroaryl aminoalcoyle, hétéroarylthio, (les
parties hétéroaryles citées ci-avant étant mono ou
bicycliques), ou phénylthio, et pour lequel R'b et R'c
représentent hydrogène, alcoyle ou cycloalcoyle, ou bien R°3
représente un radical -C---C-Rd pour lequel Rd est alcoyle,
phényle, phénylalcoyle, phénoxyalcoyle, phénylthioalcoyle,
N-alcoyl N-phényl amino-alcoyle, hétéroaryle,
hétéroarylalcoyle, hétéroaryloxyalcoyle,
hétéroarylthioalcoyle, hétéroarylaminoalcoyle,~
N-alcoyl N-hétéroaryl aminoalcoyle, (les parties hétéroaryles
citêes ci-avant étant mono ou bicycliques), ou bien R°3
représente un radical -CF2-phényle ou =CF2-hétéroaryle mono ou
bic~rclique ;
R4 est tel que défini précédemment ;
étant entendu que les radicaux ou portions phênyle, benzyle,
benzoyle ou hétéroaryle mentionnés ci-dessus peuvent être
éventuellement substitués comme envisagé plus haut,
sous leurs formes énantiomères ou diastéréoisomères ou les
mélanges de ces formes, et/ou, le cas échéant, sous forme syn
ou anti ou leurs mélanges, ainsi que leurs sels, et plus
particulièrement ceux dans lésquels
Xl, X~, X3, X4 et Xs représentent respectivement >C-R' 1 à
>C-R's,
R1, R'1, R'2, R'3, R'4, R's sont ïdentiques ou différents et
représentent un atome d'hydrogène ou d'halogène ou un radical
alcoyle ou alcoyloxy, ou représentent un radical méthylène
substitué par alcoyloxy ;
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
8
m est égal à 1 ;
n est égal à 1 ;
Y représente un radical CH2, CHOH, CHF, CHNH~ ou C=O ;
R2 est tel que défini plus haut, et
R3 représente un radical alk-R°3 pour lequel alk est un
radical alcoylène et R°3 représente cycloalcoyloxy,
cycloalcoylthio, phénoxy, phénylthio, phénylalcoyloxy,
phénylalcoylthio, hétéroaryl oxy, hétéroarylthio,
hétéroarylalcoyloxy, hétéroarylalcoylthio, (les parties
hétéroaryles citées ci-avant étant mono ou bicycliques) ou
bien R3 représente -CR'b=CR'c-R'a pour lequel R'a représente
phényle, phénylalcoyle, hétéroaryle, hétéroarylalcoyle,
phénoxyalcoyle, phénylthioalcoyle, hétéroaryloxyalcoyle,
hétéroarylthioalcoyle.(les parties hétéroaryles citées ci-
avant étant mono ou bicycliques), ou phénylthio, et pour
lequel R'b et R'c représentent hydrogène, alcoyle ou
~cycloalcoyle, ou bien R°3 représente un radical -C---C-Rd pour
lequel Rd est alcoyle, phényle, phénylalcoyle,
phénoxyalcoyle, phénylthioalcoyle, N-alcoyl N-phényl amino-
alcoyle, hétéroaryle mono ou bicyclique, hétéroarylalcoyle,
hétéroaryloxyal.coyle, hétéroarylthioalcoyle, (les parties
hétéroaryles citées ci-avant étant mono ou bicycliques) ;
R4 représente un radical R ;
étant entendu qué les radicaux ou portions phényle, ben~yle,
benzoyle ou hétéroaryle mentionnées ci-dessus peuvent être
éventuellement substituês nomme envisagé plus haut,
sous leurs formes énantiomères ou diastéréoisomères ou les
mélanges de ces formes, et/ou le, cas échéant, sous forme syn
ou anti ou leurs mélanges, ainsi que ~.eurs sels.
Parmi les composés de formule générale (I), l'invention
a tout particulièrement pour objet l'une quelconque de ceux
dont les noms suivent .
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
9
~ l' acide 1- [ (E) -3- (2, 5-difluoro-phényl) -allyl] -3- [2- (3-
fluoro-6-méthoxy-4-quinoleïnyl)-éthylamino]-3-
pyrrolidine carboxylique ;
~ l' acide 1- [ (E) -3- (2, 5-difluoro-phényl) -allyl] -3- [2- (6-
méthoxy-4-quinoleinyl)- éthylamino]-3-pyrrolidine
carboxylique ;
~ le 1- [ (E) -3- (2, 5-difluoro-phenyl) -allyl] -3- [2- (3-
fluoro-6-méthoxy-4-quinoleinyl)-éthylamino]-3-
pyrrolidine carboxylate de~méthyle ;
~ le 1- [ (E) -3- (2, 5-difluoro-phenyl) -alkyl] -3- [2- (-6-
méthoxy-4-quinoleinyl)- éthylamino]-pyrrolidine
carboxylate de méthyle
~ l' acide 1- [ (E) -3- (2, 5-difluoro-phényl) -allyl] -3- [2- (3-
chloro-6-méthoxy-4-quinoleinyl)- éthylamino]-
pyrrolidine carboxylate de méthyle ;
~ le 1- [ (E) -3- (2, 5-difluoro-phényl) -allyl] -3- [2- (3-
chloro-6-mêthoxy-4-quinoleinyl)- éthylamino]-3-
pyrrolidine carboxylate de méthyle ;
sous leurs formes énantiomères ou diastéréoisomères ou les
mélanges de ces formes, et/ou, le cas échéant, sous forme syn
ou anti ou leur mélange, ainsi que leurs sels.
Parmi les composés de formule générale (I), on peut
encore citer ceux dont les noms suivent .
~ l' acide 1- [ (2E) -3- (2, 5-difluorophényl) -2-propényl] -3-
[[2-(3-fluoro-6-méthoxy-4-
quinoléinyl)éthyl]méthylamino]-3-pyrrolidine
carboxylique ;
~ l'acide 1- [ (2E) -3- (2, 5-difluorophényl) -2-propényl] -3-
[[2-(3-fluoro-6-méthoxy-4-
quinoléinyl)éthyl]formylamino]-3-pyrrolidine
carboxylique ;
~ l'acide 3-[(aminoacétyl)[2-(3-fluoro-6-méthoxy-4-
quinoléinyl) éthyl] amino] -1- [ (2E) -3- (2, 5-difluorophényl)
2-propényl]-3-pyrrolidinecarboxylique ;
~ l'acide 3-[(carboxymêthyl)[2-(3-fluoro-6-méthoxy-4-
quinoléinyl) éthyl] amino] -1-~[ (2E) -3- (2, 5-difluorophényl)
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
-2-propényl]-3-pyrrolidinecarboxylique ;
~ la N- [1- [ (2E) -3- (2, 5-difluorophényl) -2-propényl] -3-
pyrrolidinyl]-3-fluoro-6-méthoxy-4-quinoléine
5 éthanamine ;
~ la N- [1- [ (2E) -3- (2, 5-difluorophényl) -2-propényl] -3-
pyrrolidinyl] -N- [2- (3-fluoro-6-méthoxy-4-
quinoléinyl)éthyl]-glycine ;
~ la N- [1- [ (2E) -3- (2, 5-difluorophényl) -2-propényl] -3-
10 pyrrolidinyl]-3-fluoro-6-méthoxy-N-méthyl-4-
quinoléineéthanamine ;
~ le 1- [ (2E) -3- (2, 5-difluorophényl) -2-propényl] -3- [ [2- (3-
fluoro-6-méthoxy-4-quinoléinyl)éthyl]amino]-3-
pyrrolidineméthanol ; .
~ le 1- [ (2E) -3- (2, 5-difluorophényl) -2-propényl] -3- [ [2- (3-
fluoro-6-méthoxy-4-quinoléinyl)éthyl]amino]-3-
pyrrolidinecarboxamide ;
~ la N- [3- (aminométhyl) -1- [ (2E) -3- (2, 5-difluorophényl) -2-
propényl]-3-pyrrolidinyl]-3-fluoro-6-méthoxy-4-
quinoléineéthanamine ;
~ l'a- [ [ [1- [ (2E) -3- (2,5-difluorophényl) -2-propényl] -3-
pyrrolidinyl]amino]méthyl]-3-fluoro-6-méthoxy-4-
quinoléineméthanol.
sous leurs formes énantiomère~s ou diastéréoisomères ou les
mélanges de ces formes, et/ou, le cas échéant, sous forme sen
ou anti ou leur~mélange, ainsi que leurs sels.
Selon l'invention, les produits de formule générale (I)
peuvent être obtenus par condensation de la chaîne R3 sur le
dérivé de quinoléine-4-substituée de formulé générale .
~(CHz)m \ (CHz)~
I Rz N
X
R~ ~~ \X R4 H
3 5 ~ (II)
Xz~X~ NiXa
3
dans laquelle Xl, Xz, X3, X4, X5, Rl, Rz, Y, m et n sont définis
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
11 -
comme précédemment, Rz et R4 étant protégés lorsqu'ils portent
un radical carboxy, suivie le cas échéant de l'élimination du
groupe protecteur du radical carboxy, éventuellement de la
séparation des formes énantiomères ou diastéréoisomères et/ou
le cas échéant des formes syn ou anti et éventuellement de la
transformation clu produit obtenu en un sel.
La condensation de la chaîne R3 sur l'azote hétérocyclique
s'effectue avantageusement par action d'un dérivé de formule
générale .
R3-X (IIa)
dans laquelle R3 est défini comme précédemment et X représente
un atome d'halogène, un radical méthylsulfonyle, un radical
trifluorométhylsulfonyle ou p.toluènesulfonyle, en opérant en
milieu anhydre, de préférence inerte, dans un solvant
organique tel qu'un amide (diméthylformamide par exemple),
une cétone (acétone par exemple) ou un nitrile (acétonitrile
par exemple) en présence d'une base telle qu'une base
organique azotée (par exemple triéthylamine) ou une base
minérale (carbonate alcalin . carbonate de potassium par
exemple) à une température comprise entre 20°C et la
température de reflux du solvant. L'atome d'azote du cycle
pyrrolidine du dérivé de formule générale (II) est
éventuellement protégé selon les méthodes habituelles
compatibles avec le reste de la molécule ou la réaction ; la
protection s'effectue par exemple par un radical protecteur
choisi parmi les groupements benzyle, t.butoxycarbonyle et
benzyloxycarbonyle, et cet atome d'azote est libéré
préalablement à la condensation avec le dérivé de formule
(IIa), notamment par hydrolyse acide.
De préférence, on fait agir un dérivé de formule générale
(IIa) pour lequel X est un atome de chlore, de brome ou
d'iode.
Des conditions dans lesquelles peut être effectuée la
condensation entre les dérivés de formules générales (II) et
(IIa) sont également décrites dans la demande WO 02/40474.
Lorsque R3 est un radical -alk-R°3 dans lequel R°3 est un
groupement -C=C-Rd, dans lequel Rd est tel que défini plus
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
12
haut, on condense, intermédiairement un halogénure d'alcynyle
puis on condense le radical désiré sur L'alcyne ainsi obtenu.
Lorsque R3 représente un radical -alk-R°3 pour leqùel alk est
un radical alcoyle et R°3 représente~un radical phénoxy,
'phénylthio, phénylamino, hétéroaryloxy, hétéroarylthio ou
hétéroarylamino, on peut également construire la chaîne en
condensant d'abord une chaîne HO-alk-X pour laquelle X est un
atome d'halogène, de préférence l'iode, dans les conditions
décrites ci-dessus pour la réaction du produit de formule
générale (IIa),puis, le cas échéant, en transformant la
. chaîne~hydroxyalcoyle en une chaîne halogénoalcoyle,
méthanesulfonyla.lcoyle ou p.toluènesulfonylalcoyle et enfin
en faisant agir en milieu basique un dérivé aromatique de
structure R°3H ou R°3H2.
l5 La transformation de la chaîne hydroxylée en chaîne
halogénoalcoyle ou p.toluènesulfonyle s'effectue selon les
méthodes habituelles d'halogénation ou de sulfonylation,
notamment on fait agir un agent d'halogénation comme le
chlorure de thionyle, les dérivés halogénés du phosphore
(trichlorure ou tribromure de phosphore par exemple) ou un
agent de sulfonylation comme par exemple le chlorure de
méthanesulfonyle, le chlorure de p.toluènesulfonyle ou
l'anhydride trifluorométhanesulfonique. La réactiom
s'effectue dans un solvant organique comme un solvant chloré
(dichlorométhane ou chloroforme par exemple), à une
température comprise entre 0 et 60°C.~Dans certains cas il
peut être avantageux d'opérer en présence d'une base comme la
pyridine ou la triéthylamine.
La réaction du dérivé aromatique R3H ou R3H2 s'effectue
avantageusement comme décrit précédemment pour l'action du
dérivé de formule générale (IIa), dans un solvant organique
tel qu'un amide (diméthylformamide par exemple), une cétone
(acétone par exemple), un nitrite (acétonitrile par exemple),
en présence d'une base telle qu'une base organique azotée
(par exemple triéthylamine) ou une base minérale (carbonate
alcalin . carbonate de potassium par exemple) à une tempéra-
. . ture comprise entre 20°C et la température de reflux du
mélange réactionnel. Il peut être avantageux d'opérer en
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
13
présence_d'iodure de potassium. On peut encore opérer dans un
éther (tétrahydrofuranne par exemple) dans des conditïons de
déshydrâtation en présence, par exemple, de diisopropyl-
carbodiimide et de triphénylphosphine.
Il est entendu que, si les radicaux R3 portent des
substituants carboxy ou amino, ces derniers sont
préalablement protégés, puis libérés après la réaction. On
opère selon les méthodes bien connues de l'hommé du métier
qui n'altèrent pas le reste de la molécule, notamment selon
les méthodes décrites par T.W. Greene et P.G.M. Wuts,
Protective Groups in Organic Synthesis (2eme éd.), A. Wiley -
Interscience Publication (1991), ou par Mc Omie, Protective
Groups in Organic Chemistry, Plenum Press (1973).
Le radical carboxy protégé porté par R2 ou R4 peut être choisi
parmi les esters facilement hydrolysables. A titre d'exemple
peuvent être cités les esters méthyliques, benzyliques,
tertiobutyliques, ou bien les esters de phénylpropyle ou
d'allyle. Éventuellement la protection du radical carboxy
s'effectue simultanêment à la réaction.
Le cas échéant, la protection du radical amino s'effectue au
moyen des radicaux protecteurs habituels cités dans les
références ci-dessus.
La mise en place et l'élimination de ces radicaux protecteurs
s'effectue selon les méthodes connues de l'homme du métier.
Selon l'invention, lés dérivés de formule générale (I) pour
lesquels R~ est hydroxyméthyle ou hydroxyéthyle peuvent être
préparés par action d'un agent de réduction approprié sur un
dêrivé pour lequel RZ est carboxy ou~carboxyméthyl ou carboxy
protégé ou carboxy méthyl~protégé. Une fonction cétone
éventuellement présente doit alors être intermédiairement
protégée.
Également selon l'invention, les produits de formule génêrale
(I) pour lesquels Ra est carboxyméthyle ou carboxyéthyle
peuvent également être préparés à partir des dérivés pour
lesquels R2 est hydroxyméthyle ou hydroxyéthyle, par action
sur celui-ci d'un agent d'halogénation ou de tosylation, puis
d'un agent de cyanuration et enfin d'un agent~d'hydrolyse du
nitrile.
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
14
Egalement selon l'invent-ion, les produits de formule
générale (I) pour lesquels Rz est -CONH2, -CHz-CONHZ ou
-CH2-CH2-CONHZ peuvent être préparés à partir des acides ou
esters correspondants par amidification par l'ammoniac.
Egalement selon l'ïnvention, les produits de formule
générale (I) pour lesquels Rz est -CH2-NH2, - (CHZ)~2-NHz ou -
(CH~)3-NHz peuvent être préparés à partir des amides
correspôndants par rédLi.ction.
On peut effectuer la réduction du carboxy protégé selon
les méthodes habituelles qui n'altèrent pas le reste de la
molécule, en particulier par action d'un hydrure (hydrure
d'aluminium et de lïthium ou hydrure de diisobutyl aluminium
par exemple) dans un solvant tel qu'un éther
(tétrahydrofurane par exemple) à une température comprise
entre 20 et 60°C. On protège intermédiairement puis déprotège
une fonction cétone éventuellement présente selon les
méthodes classiques connues de l'homme du métier, notamment
via un acétal, cyclique ou non.
La réduction du carboxy libre peut être effectuée selon
des méthodes également connues de l'homme du métier, par
exemple par hydrogénation en présence d'un catalyseur.à base
de rhodium ou de ruthénium, par action de hydroborure de
sodium en présence d'acide de Lewis ou d'hydrure d'aluminium
et de lithium dans l'éther. De préférence, la fonction cétone
est dans ce cas également intermédiairement protégée.
La transformation du radical hydroxyméthyle ou
hydroxyéthyle.en un radical carboxyméthyle ou carboxyéthyle
s'effectue selon les méthodes habituelles qui n'altèrent pas
le reste de la molécule, notamment par action d'un agent
d'halogénation comme par exemple le chlorure de thionyle ou
le trichlorure de phosphore ou le tribromia.re de phosphore, ou
d'un agent de tosylation, puis d'un cyanure alcalin, par
exemple (cyanure de potassium ou cyanure de sodium, pour
préparer le dérivé cyanométhyle correspondant, suivie de
l'hydrolyse du nitrite.
L'halogénation peut être effectuée dans un solvant
chloré (dichlorométhane ou chloroforme par exemple), à une
température comprise entre 0°C et la,température dé reflux du
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
solvant..
La réaction d'amidification par l'âmmoniac est
effectuée dans les conditions habituelles, connues de l'homme
du métier. On opère de préférence au départ de l'acide, par
5 exemple en présence de dicyclohexylcarbodiimide et de
diméthylaminopyridine ou d'hydroxybenzotriazole, au sein d'un
éther, par exemple le tétrahydrofurane, d'un solvant chloré,
par exemple de dichlorométhane, ou diméthylformamide.
La réduction en amine est effectuée, de méme, dans des
10 conditions classiques, par exemple par action d'un hydrure
tel que l'hydrure de lithium et d'aluminium au sein d'un
éther.,. par exemple le tétrahydrofurane, ou par action d'un
borane en présence de diméthylsulfure.
Lorsque R4 est un atome d'hydrogène, la condensation de
15 la chaîne R3 sur l'azote de la pyrrolidine ou de l'azétidine
ne nécessite en principe pas que l'azote porteur de R4 soit
protégé compte tenu de l'encombrement stérique autour de cet
azote. Le cas échéant, dans les cas exceptionnels où cela
pourrait s'avérer nécessaire, un groupement protecteur
classique des fonctions amines tel que ceux décrits dans
l'ouvrage de T.W.Greene et P.G.M. Wuts cité plus haut peut
être utilisé.
Selon l'invention, la préparation des produits de
formule générale (II) pour lesquels Y est un groupe CHI et m
est égal à 1 ou 2, s'effectue par condensation d'un dérivé
hétéroaromatique de formule.générale .
O=C-H
3 0 (CHZ)m
X
~X
(III)
XZ\X/ N~X4
3
dans laquelle R1, Xl, X2, X3, X4 et X5 sont définis comme
précédemment et m est égal à 1 ou 2 , sur un dérivé de
formule générais .
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
16
H
H- N (OHz)~
Rz ~N
\P
(IV)
dans laquelle P est un groupement -protecteur, n et Rz sont
définis comme précédemment et Rz représente un radical protégé
si RZ représente ou porte une fonction acide carboxylique,
suivie de l'élimination des groupements protecteurs et/ou
suivie de la transformation, par opération subséquente, des
substituants du bicycle aromatique de formule, générale (II)
ainsi obtenu, pour conduire au dérivé portant le radical R1,
R'1, R'2, R'3, R'4, R'S attendu, et le cas échéant élimination
du/des radicaux protecteurs encore présents sur la molécule.
P peut être tout groupement protecteur de l'atome d'azote
compatible avec la réaction (t-butyloxycarbonyle,
benzyloxycarbo,nyle par exemple). Les groupements protecteurs
des fonctions acides sont choisis parmi les groupements
habituels dont la mise en place et l'élimination n'affectent
pas le reste de la molécule, notamment ceux mentionnés dans
les références citées précédemment.
La réaction peut être effectuée en présence d'une base aminée
telle que la,triéthyamine, au sein d'un solvant.halogène tel
que le chloroforme ou le dichloréthane puis d'un réducteur
tel que le triacétoxybrohydrure de sodium en présence d'acide
acétique, en opérant à température ambiante.
Dans le cas où m est égal à O, la préparation s'effectue dans
des conditions similaires, en utilisant au départ un dérivé
de formule générale
p\ C~H
w
3 5 ~ R~ XW ~ X
(III')
Xz.X~ NiXa
3
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
17
dans laquelle R1, X1, X2, X3, X4 et XS sont définis comme
précédemment.
Selon l'invention, les produits de formule générale (II) pour
lesquels Y est un groupe CHR, R étant un alcoyle, peuvent
être préparés au départ des composés correspondants dans
lesquels Y est CH2, par action d'un halogénure d'alkyle, de
préférence un iodure. sur l'anion en a de la quinoléine
préparé par action d'une base forte, par exemple un
tertbutylate alcalin. De telles réactions sont connues de
l'homme du métier.
Selon l'_invention, la prêparation des produits de formule
générale (II) pour lesquels Y est un groupe CHOH et m = 1
s'effectue par condensation d'un dérivé de formule générale
O
X
R~~ '~ ~X
(III")
Xa~X/ NiX4
3
dans laquelle R1, X1, X2, X3, X4 et X5 sont définis comme
précédemment, sur un dérivé de formule générale IV) telle que
définie précédemment.' On peut opérer en présence de lithium
ou sodium perchlorate dans un solvant tel que le
dïméthylfornamide, à chaud.
Les produits de formule générale (II) pour lesquels Y est un
groupe carbonyle et m = 1 ou 2 peuvënt être préparês par
oxydation du dérivé correspondant de formule générale (II)
pour lequel Y est un groupe CHOH. Cette oxydation s'effectue
par exemple au moyen de permanganate de potassium, ,
éventuellement dans une solution de soude (par exemple soude
3N), à une température comprise entre -20 et 20°C, ou bien
par action de chlorure d'oxalyle en présence de
diméthylsulfoxyde, suivie de l'addition d'une amine telle la
trïéthylamïne, dans un solvant inerte tel le dichlorométhane,
le diméthylsulfoxyde à une température comprise entre -60 et
20°C par analogie avec la méthode décrite par D. SWERN et
coll., J. Org. Chem., 44, 4148 (1979).
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
1g
Les.produits de formulè générale (II) pour lesquels Y est un
groupe carbonyle et m = O peuvent être obtenus par une
réaction de çouplage peptidique de L'amine de formule (IV)
avec un produit de formule générale -
OH
O~O
R~~X~~ ~X
5
~ (III~~~)
X2~X~ NiX4
3
dans laquelle Rl, X1, X2, X3, X4 et X5 sont définis comme
précédemment.
On opère par exemple en présence de dicyclohex~lcarbodiimide
et de 1-hydroxybenzotriazole.
Les produits de formule générale (II) dans laquelle Y est un
groupe CROH, R étant un alcoyle, peuvent être obtenus au
-départ des produits dans lesquels Y est un groupe carbonyle,
par réaction d'un halogiénure d'alkyl magnésium approprié,
dans des conditions classiques connues de l'homme du métier.
On opère par exemple par action de chlorure de méthyl
magnésium dans un éther tel que le tétrahydrofurane.
Les produits de~formule générale (II) dans laquelle Y est un
25~ groupe CHR, R étant un alcoyle, peuvent encore être obtenus
au départ des produits dans lesquels Y est un groupe C~ROH,
obtenus tel que décrit ci-dessus, par élimination de l'alcool
par l'intermédiaire d'un xanthate. On fait réagir l'alcool
avec une base forte, par exemple l'hydrure de sodium, puis on
rajoute du sulfurè de carbone et ensuite de l'iodure de
méthyle. On chauffe ensuite le xanthate ainsi obtenu en
présence d'hydrure de tributylétain.
Le dérivé de formule générale (II) pour lequel Y est un
groupe CRNH2 peut être préparé à partir du dérivê CROH
correspondant que l'on transforme en son dérivé tosylé, sur
lequel on fait agir de l'ammoniac. On opère dans un solvant
inerte tel le N,N-diméthylformamide ou le diméthylsulfoxyde
et de préférence sous pression (2 à 20 atmosphères) à une
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
19
température comprise entre 20 et 100°C.
'Le dérivé tosyloxy est obtenu à partir.du produit de formule
générale (II) pour lequel Y est CROH, par action du chlorure
de tosyle dans la pyridïne, à une température comprise entre
-10 et 20°C.
Les dêrivés de formule générale (II) pour lesquels Y est un
groupe CRF ou CF2 peuvent, être préparés par fluoration
respectivement à partir du dérivé pour lequel Y est un groupe
CROH et de celui pour lequel Y est un groupe carbonyle. La
réaction est mise en oeuvre en présence d'un fluorùre de
soufre [par exemple en présence d'un trifluorure
d'aminosoufre (trifluorure de diéthylamino soufre
(Tetrahedron, _44, 2875 (1988), trifluorure de bis(2-
méthoxyéthyl)amino soufre (Deoxofluor ~)', trifluorure de
morpholino soufre par exemple) ou alternativement en présence
de tétrafluorure de soufre (J. Org. Chem., 40, 3808 (1975)].
La réaction de fluoration peut encore êtrë effectuée au moyen
d'un agent de fluoration comme l'.hexafluoropropyl
dïéthylamine (JP 2 039 546) ou la N-(chloro-2 trifluoro-1,1,2
éthyl) diéthylâmine.
On opère dans un solvant organique tel qu'un solvant chloré
(par exemple dichlorométhane, dichloréthane, chloroforme) ou
dans un éther (tétrahydrofuranne, dioxanne par exemple) à une
température comprise entre -78 et 40°C (de préférencé entre
0 et 30°C). I1 est avantageux d'opérer sous atmosphère inerte
Les produits de formule générale (II) pour lesquels Y
représente un groupe CHOH et m = 1 ou 2, peuvent encore être
préparées par oxydation en milieu basique du dérivé
correspondant pour lequel Y est un groupe CH2. L'oxydation
s'effectue par action de l'oxygène, de préférence au sein
d'un solvant inerte tel que,le diméthylsulfoxyde en présence
de tert-butanol et d,'une base telle le tert-butylate de
potassium ou de sodium à une température comprise entre à 0
et 100°C.
Les réactions ci-dessus destinées à intervenir au niveau
de Y sur le produit de formule (II) sont conduites, le cas
échéant, après protéction des fonctions réactives de la
pyrrolidine ou de l'azétïdine et de la chaîne au niveau de R4.
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
Les groupements protecteurs utilisés sont notamment ceux
évoqués plus haut.
Les produits de formule générale ('III) dans laquelle
m = 1 préparé au départ du produit de formule .
5
z
X.
R~~ '\ ~X
(V)
Xa~ / ~Xa
dans laquelle R1, X1, X2, X3, X4 et X5 sont définis comme
précédemment, que l'on fait agir avec l'allyltributylétain en
présence de tétrakistriphénylphosphine palladium et d'iodure
de cuivre dans le diméthylfornamide à 60°, pour obtenir le
produit allylé de formule .
X
R~~ y \X
5, (VI)
X2wX/ N iXa
3
que l'on oxyde par le tétraoxyde d'osmium en présence de
N-oxyde de N-méthylmorpholine, dans un mélange eau-acétone à
température ambiante, pour obtenir le diol de formule .
H
3 0 ~H
R~ X
(VII)
X2 ~ X3
que l'on oxyde par le périodate de sodium dans un mélange
tétrahydrofunane-eau à température ambiante.
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
21
Le produit de départ de formule générale (V) peut être
obtenu~comme décrit dans la demande de brevet WO 02.40474
Le produit de formule généralë (III) dans laquelle m = 2
peut être préparé au départ d'un produit de formule (VI)
telle que défini ci-dessus, que l'on soumet à une réaction
d'hydroboration par traitement au 9-borabicyclo[3,2,1]octane,
suïvie d'une oxydation à l'eau oxygénê, pour obtenir le
produit de formule générale .
15 (VIII)
X2 \
que l'on oxyde en l'aldéhyde correspondant de formule
générale .
H
X
R~
(IX)
X2\X3 N
par exemple par la méthode dite de Swern évoquée plus haut.
On peut encore utiliser la méthode dite de Dess-Martin,
consistant à traiter l'alcool dans des conditions données par
le périodïnane (J.Org. Chem. 1983, p.48, 1.155-6).
Le produit de formule générale (III') peut être obtenu au
départ du produit de formule générale .
X
~X
s (X)
X2~X~ N /Xa
3
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
22
dans laquelle R1, Xr, Xz, X3, X4 et X5 sont définis' comme
précédemment, que l'on traite par une base forte, puis fait
agir sur l'anion ainsi obtenu le diméthylformamide. La base
forte est de préférence le butyllithium, le sec-butyllithium,
ou le lithium diisopropylamïdure, et on opère dans un solvant
tel qu'un éther, le tétrahydrofuranne par exemple, à une
température comprise entre -7B° et -40°. La condensation de
ce dérivé lithié sur le DMF se fait dans le même solvant, à
une température comprise entre -78°C et 0°C.
Le produit de formule générale (X) peut être préparé selon
une méthode décrite dans la demande de brevet WO 02.40474.
Le produit de formule (III") peut être obtenu au départ du
produit de formule générale (X) telle que définie plus haut,
dont on prépare l'.anïon en position 4 comme précédemment, que
l'on traite par l'acétaldéhyde pour obtenir l'alcool de
formule générale
HO~ ~
2 0 R X~ ~ ,
~ \ ~ 5 (XI)
Xa~X~ N /Xa
3
que l'on oxyde en la cétone correspondante de formule (XII)
2 5 . O CH3
X
\ ~ 5 (XII)
Xz~X~ NeXa
que l'on traite par le brome en présence d'acide sulfurique
concentré, pour obtenir le produit de formule générale
O Br
X
¿~1~ 1\ ~X
5 (X111)
XZ~X~ NiXa
3
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
23
que l'on soumet à l'action d'un agent-réducteur de la cétone
pour obtenir le produit de formule de formule générale
HO
Br
w
R~ . X~ ~ \ X
(XIV)
X2\X/ NsX4
s
que l'on soumet à l'action d'une base pour obtenir le produit
attendu.
L'agent réducteur de la cétone peut notamment être l'hydrure
de bore et on opère par exemple au sein du tétrahydrofurane.
La base utïlisé est notâmment un carbonate ou un hydroxyde
alcalin et on opère par exemple dans un alcanol.
Le produit de-formule générale (III"') peut être obtenu au
départ du produit de formule générale (X) telle que définie
précédemment, dont on prépare l'anion en position.4, que l'on
traite par un chloroformiate d'alcoyle, pour obtenir l'ester
de formule générale
O Oalc
X
R~~ 1~ \X _
(XV)
Xa~X/ NiX4
3
que l'on saponifie par une base dans des conditions.
classiques.
Des produits correspondant aux produits de formule
générale (IV) telle que définie plus haut, dans lesquels les
fonctions réactives sont libres ainsi que certains dans
lesquels elles sont protégées sont décrits et, pour certains
commerciaux, dans les cas où n = O ou 1 et R2 = H, CH3, C2H5,
COOH, COOCH3 , CH~C02CH3 , CONHZ , CHzOH .
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
24
Parmi.les références de la littérature, on peut citer les
'demandes WO 9414794, WO 0170734, WO 9907696, EP 536035, EP
326916, EP 242789, JP 63130594 A2 et JP 62030776 A2, ainsi
que les références Synlett (1991), 11, 783-4, Synthetic Comm.
(1995) , 25 (9) , 1295-1302.
Les -produïts ~de formia.le (IV~) non décrits peuvent en général'
être obtenus par des méthodes décrites dans ces réfêrences
ou, au départ, des produits décrits, par des méthodes connues
de l'homme du métier.
Selon l'invention des produits de formule générale (I) pour
lesquels R4 est dïfférent d'hydrogène peuvent être obtenus
soït comme décrit précédemment, au départ d'un produit de
formule génêrale (II) pour lequel R4 a la valeur
correspondante, différente d'hydrogène, soit au départ d'un
produit de formule générale (I) pour lequel R4 est hydrogène,
par l'un ou l'autre des procédés décrits ci-après.
Selon l'invention, les produits de formule générale (II) pour
lesquels R4 est différent d'hydrogène peuvent être obtenus au
départ d'un produit de formule générale (II) pour lequel R4
est hydrogène; par les mêmes procédés.
Le cas échéant, et notamment pour la préparation des produits
de formule générale (II), la mise en ouvre de ces procédés
nécessite la protection intermédiaire des fonctïons
réactives, notamment amino et/ou carboxy et/ou hydroxy.
Celle-ci, ainsi que la déprotection, peuvent être effectuées
selon les méthodes décrites précédemment.
Les produits pour lesquels R4 représente un radical alcoyle
peuvent être obtenus par action d'un aldéhyde correspondant
sur l'amine, en présence d'un agent réducteur. Celui-ci peut
être par exemple le borohydrure de sodium ou le
cyanoborohydrure de sodium ou encore le triacétoxy
borohydrure de sodium et on peut opérer dans un solvant
halogéné classique ou dans un. alcool. Il peut être avantageux
d'opérer à pH légèrement acide, par exemple en présence
d'acïde acétique.
Les produits pour lesquels R4 représente un radical CHO
peuvent être obtenus par action d'acide formique en présence
d'acide acétique, ou par action d'orthoformiate de triéthyle
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
en présence d'acide paratoluène sulfonique et de
triéthylamine, sur l'amine. On peut opérer dans un solvant
halogéné ou dans le tétrahydrofurane ou encore dans le
diméthylformamide. On peut encore effectuer la formylation
5 selon une méthode de type Vilsmeyer.
Les produits pour_lesquels R4 représente un radical COCH3
peuvent être obtenus par action d'un halogéniure d'acétyle ou
d'anhydride acétique sur l'amine. On opère en présence d'une
base telle que la triéthylamine.
10 Les produits pour lesquels R4 représente un radical CH2C02H
peuvent être obtenus par action de l'acide bromoacétique sur
l'amine, en opérant dans les même-s conditions que ci-dessus,
ou par action de glyoxaldéhyde sur l'amine puis réduction par
le cyanoborohydrure de sodium en opérant dans le même type de
15 solvants.
Les produits pour lesquels R4 représente un radical CO-CHZ-NH2
peuvent être obtenus par couplage peptidique par action de la
glycine sur l'amine, en présence par exemple de
dicyclohexylcarbodiimidë, et après avoir protégé la fonction
20 amine de la glycine, ou encore par action sù.r l'amine de la
même glycine protégée, dont on active au préalable la-
fonction acide, notamment sous forme de chlorure, par action
de chlorure d'oxalyle ou de chlorure de thionyle. On opère de
préférence dans un solvant halogéné ou dans le
25 tétrahydrofurane.
Les produits intermédiaires de formule générale (II) pour
lesquels~les fonctions réactives sont libres ou protégées
obtenus lors de la mise en oeuvre de procédé selon l'invention
sont nouveaux et, à ce titre, font partie de l'invéntion.
De même, les produits intermédiaires de formules générales
XI), (XII),.(XIII) et (XIV) sont également nouveaux et, à ce
titre, font également partie de l'invention.
I1 est entendu que les dérivés de formule générale (I) et
(II), peuvent exister sous des formes énantiomères ou
diastéréoisomères ou sous forme syn ou anti, lesquelles
entrent bien entendu dans le cadre de la présente invention.
Ces formes peuvent être' séparées selon les méthodes
habituelles, connues de l'homme du métier, notamment par
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
26
~chromatogrâphie chirale ou par Chromatographie Liquïde Haute
Performance (CLHP). Ceci est illustré ci~-après dans la partie
expérïmentale.
Les dérivés de formule générale (I) peuvent être
purifiés le cas échéant par des méthodes physiques telles que
la cristallisation ou la chromatographie.
Les dérivés de formule générale (I) peuvent être le cas
échéant transformés en sels d'additïon avec les acides ou
avec les bases, par les méthodes connues. Il est entendu que
ces sels avec.les acides ou les bases entrent aussi dans le
cadre de la présente invention.
Comme exemples de sels d'addition avec des acides
pharmaceutiquement acceptables, peuvent être cités les sels
formés avec les acides minéraux (par .exemple les
chlorhydrates, bromhydrates, sulfates, nitrates ou
' phosphates)' ou avec les acides organiques (par exemple les
succïnates, fumarates, tartrates, acétates, propionates,
maléates, citrates, méthanesulfonates, éthanesulfonates,
phénylsulfonates, p.toluènesulfonates, iséthionates,
naphtylsulfonates ou camphorsulfonates) ou avec des dérivés
de substitution de ces acides.
Les dérivés de formule générale (I) portant un radical
carboxy peuvent être transformés en sels métalliques ou en
sels d'addition avec les bases azotées selon lés méthodes
connues en soi. Les sels peuvent être obtenus par action
d'une base métallique (par exémple alcaline ou alcalino-
terreuse), de l'ammoniac ou d'une amine, sur un produit selon
l'invention, dans un solvant approprié tel qu'un alcool, un
éther ou l'eau, ou par réaction d'échange avec un sel d'un
acide organique. Le sel formé précïpite après concentration
éventuelle de la solution, il est séparé par filtration,
décantation ou lyophilisation. Comme exemples de sels
pharmaceutiquement acceptables peuvent être notamment cités
les sels avec les métaux alcalins (sodium, potassium,
lithium) ou avec les métaux alcalinoterreux (magnésium,
calcium), le sel d'ammonium, les sels de bases azotées
(éthanolamine, diéthanolamine, triméthylamine, triéthylamine,
méthylamine, propylamine, diisopropylamine,
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
27
NN-diméthyléthanolamine, benzylamine, dicyclohexylamine,
N-benzyl-(3-phénéthylamine, NN'-dibenzyléthylènediamine,
diphénylènediamine, benzydrylamine, quinine, choline,
arginine, lysine, leucine, dibenzylamine).
5~ Les dérivés de formule générale (I) selon l'invention
sont des agents antibactériens particulièrement actifs.
L'étude ci-après le démontre.
a) Activité in vitro
La méthode des dilutïons en milieu agar en accord avec
les recommandatïons NCCLS est utilisée pour la détermination
des concentrations minimales inhibitrices (C.M.I.) exprimées
en ~.g/ml.
Les activités des composés des exemples 1 à 4 sont
regroupées dans le tableau suivant .
Grain-positif CMI ~,g/ml 24
heures
S. aureus TP8203 sensible 0,06 - 4
S. aureus AS 5155 0,06 - 4
methicilline resistant
S. pneumoniae 6254-Ol 0,012 - 2
MLSB resistant
E. faecalis ATCC29212 0,5 - 4
vancomycine resistant
Grain-ngatif CMI ~,g/ml 48 heures
M. catarrhales IPA151 sensible 0,25 - 4
H. influenzae 87169 sensible 4 - 32
In vitro, les composés de l'invention se sont donc montrés
tout à fait remarquables sur à la fois germes grain positifs
que sur germes négatifs.
b)Les produits selon l'invention sont particulièrement
intéressants du fait de leur faible toxicité. Aucun des
produits n'a manïfesté de toxicité à la dose de 50 mg/kg par
voie sous-cutanée ou par voïe orale chez la souris (2
administrations/jour).
Ces propriétés rendent aptes lesdits produits, ainsi
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
28
que leurs sels d'acides et de bases pharmaceutiquement
acceptables, à être utilisés comme médicaments dans le
traitement des affections à germes sensibles provoquées par
des bactéries à gram -positif et notamment dans celles à
staphylococcus, telles que septicémies à staphylocoques,
staphylococcies malignes de la face ou cutanée, pyodermites,
plaies septiques ou suppurantes, anthrax, phlegmons,
érysipèles, staphylococcies aiguës primitives ou post
grippales, broncho-pneumonies, suppurations pulmonaires,
ainsi que dans celles à streptocoques ou enterocoques.
Ces produits peuvent également être utilisés comme
médicaments dans le traitement des infections respiratoires
hautes et basses provoquées par des bactéries à gram-négatif
telles que Haemophilus influenzae et Moraxella catarrhales.
La présente invention a donc également pour objet, à
titre de médicaments et notamment de médicaments destinés au
traitement des infections bactériennes chez l'homme ou
l'animal, les composés de formule générale (I) tels que '
définis ci-dessus ainsi que leurs sels pharmaceutiquement
acceptables, et notamment les composés préférés mentionnés
plus haut.
La présente invention concerne également les
compositions pharmaceutiques contenant au moins un dérivé de
quinoléine-4-substituée selon l'invention, le cas échéant
25. sous forme de sel, à l'état pur ou sous forme d'une
association avec un ou plusieurs diluants ou adjuvants
compatibles et pharmaceutiquement acceptables.
Les compositions selon l'invention peuvent être
utilisées par voie orale, parentérale, topique, rectale ou en
aérosols.
Comme compositions solides pour administration'orale
peuvent être utilisés des comprimés, des pilules, des
gélules, des~poudres ou des granulés. Dans ces compositions,
le produit actif selon l'invention est mélangé à un ou
plusieurs diluants ou adjuvants inertes, tels que saccharose,
lactose ou amidon. Ces compositions peuvent comprendre des
substances autres que'.les diluants, par exemple un lubrifiant
tel que le stéarate de magnésium ou un enrobage destiné à une
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
29
libération contrôlée.
Comme compositions liquides pour administration orale,
on peut utiliser des solutions pharmaceutiquement
acceptables, des suspensions, des émulsions, des sirops et
des élixirs contenant des diluants inertes tels que l'eau ou
l'huile de paraffine. Ces compositions peuvent également
comprendre des substances autres que les diluants, par
exemple des produits mouillants , édulcorants ou aromatisants.
Les compositions pour administration parentérale,
peuvent être des solutions stériles ou des émulsions. Comme
solvant ou véhicule, on peut employer l'eau, le
propylèneglycol, un polyéthylèneglycol, des huiles végétales,
en particulier l'huile d'olive, des esters organiques
injectables, par exemple l'oléate d'éthyle. Ces compositions
peuvent également contenir des adjuvants, en particulier des
agents mouillants, isotonisants, émulsifiants, dispersants et
stabilisants.
La stérilisation.peut se faire de plusieurs façons, par
exemple à l'aide d'un filtre bactériologique, par irradiation
ou par chauffage. Elles peuvent également être préparées sous
forme de compositions solides stériles qui peuvent être
dissoutes au moment de l'emploi dans de l'eau stérile ou tout
autre milieu stérïle injectable.
Les compositions pour administration topique peuvent'
être par exemple des crèmes, des pommades, des lotions ou des
aérosols.
Les compositions pour administration rectale sont les
suppositoires ou les capsules rectales, qui contiennent outre
le principe actif, des excipients tels que le beurre de
cacao, des glycérides semi-synthétiques ou des
polyéthylèneglycols.
Les compositions peuvent également être des aérosols.
Pour l'usâge sous forme d'aérosols liquides, les compositions
peuvent être des solutïons stériles stables ou des
.35 compositions solides dissoutes au moment de l'emploi dans de
l'eau stérile apyrogène, dans du sérum ou toua autre véhicule
pharmaceutiquement acceptable. Pour l'usage sous forme
d'aérosols secs destinés à être directement inhalés, le
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
principe actif est finement divisé et associé à un dïluant ou
véhicule solide hydrosoluble d'une granulométrie de 30 à 80
,um, par exemple le dextrane, lè mannitol ou le lactose.
En thérapeutique humaine, les nouveaux dérivés de
5 quinoléine-4-substituée selon l'invention sont
particulièrement utiles dans-le traitement des infections
d'origine bactérienne. Les doses dépendent de l'effet
recherché et de la durée du traitement. Le médecin
déterminera~la posologie qu'il estime la plus appropriée en
10 fonction du traitement, en fonction de l'âge, du poids, du
degré de l'infection et des autres facteurs propres au sujet
à traiter. Généralement, les doses sont comprises entre
750 mg et 3 g de produit actif en 2 ou 3 prises par jour par
voie orale ou entre 4'00 mg et 1,2 g par voie intraveineuse
15 pour un adulte.
Les éxemples suivants illustrent des compositions selon
'l'invention.
a) On prépare selon la technique habituelle une
composition liquide destinée à l'usage parentéral
20 comprenant
~ Acide -1- [ (E) -3- (2, 5-difluoro-phényl) -allyl] -3- [2- (3-fluoro-
6-méthoxy-4-quinoleinyl)éthylamino]-3-pyrrolidine
carboxylique.._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._
.. 1 g
0
~
Glucose.............................................................:..........
................................. qsp 2 , 5 0
25~ hydroxyde .de
sodium:.............................................:.........................
qsp pH=4-4, 5
~ eau
ppi............................................................................
................................ qsp 2 0 ml
b) On prépare selon la technique habituelle une
composition liquide destinée à l'usage parentéral
30 comprenant .
~ Acide -1- [ (E) -3- (2, 5-difluoro-phényl) -allyl] -3- [2- (6-
méthoxy-4-quinoleinyl)-éthylamino]-3-pyrrolidiné
carboxylique ;
~ a
glucbse.._._._._._._._._._._._._._._._._._._._._._._._...._._._._._._._._._._._
._._._.. qsp 5 0
~ hydroxyde de sodium._._._._._._._._._...._._._._._...._._._._._._._...._._..
qsp pH=4 -4 , 5
~ eau
ppi.._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._._.
_.. qsp 50 ml
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
31 _
Les exemples suivants illustrent l'invention.
Exemple 1
Enantiomères A et B de l'acide 1-[.(E)-3-(2,5-difluoro-
phényl)-a11~1]-3-[-2-(3-fluoro-6-méthoxy-4-quinoléinyl)-
éthylamino]-3-pyrrolidine carboxylique .
L'énantiomère A de l'acide 1-[(E)-3-(2,5-difluoro-phényl)-
allyl]-3-[-2-(3-fluoro-6-méthoxy-4-quinoléinyl)-éthylamino]-
3-pyrrolidine carboxylique_peut être préparé de la manière
suivante .
A une solution contenant 0.226 g (0,452 mmole) de l'ester
méthylique de l'énantiomère A de L'acide 1-[(E)-3-(2,5-
difluoro-phériyl)-allyl]-3-[-2-(3-fluoro-6-méthoxy-quinoléine-
4-yl)-éthylamino]-pyrrolidine-3-carboxylique dans 25 cm3 de
dïoxanne sont ajoutés, sous agitation, 3,80 cm3 (19,00 mmoles)
d'une solution aqueusè de soude 5N, et la solution jaune
ainsi obtenue est portée au reflux,vet agitée 18 heures à
cette température. Le milieu réactionnel est alors ramené à
une température voisine de 20° C, puis concentré à sec sous
pression réduite. Le résidu ainsi obtenu est purifïé par
chromatographie sur une colonne de 2 cm de diamètre contenant
15 cm de silice 20-45 ~,m à pression atmosphérique en
utilisant comme.éluant un mélange chloroforme/méthanol/
ammoniaque aqueux à 28 % (12/3/0,5 en volume). Les fractions
contenant l'attendu sont réunies et concentrées sous pression
réduite pour donner 0,150 g d'un produit jaune pâle qui est
repris dans 20 cm3 d'un mélange dichlorométhane/méthanol
(9/1). La solution résultante est filtrée sur papier, le
papier est lavé par deux fois 10 cm3 d'un mélange
dichlorométhane/méthanol (9/1), les filtrats sont réunis puis
concentrês à sec sous pression réduite. Le résidu est repris
par 50 cm3 d'éther isopropylique, puis la suspension
résultante est concentrêe à sec sous pression réduite pour.
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
32
donner 0,138 g de l'énantiomère A attendu, sous forme d'un
solide' amorphe jaune pâle.
[a]D = + 25,5° +/- 0,7 (c = 0,5 dans le méthanol)
Spectre MS :IC m/z = 486 MH+ pic de base
Spectre de R.M.N. 1H (3'00 MHz, ~ (CD3) zSO, 8 en .ppm) . 1, 82 (mt
. 1H) ; 2,24 (mt . 1H) ; 2,40 (mt . 1H) ; 2,73 (d, J = 11
Hz . 1H) ; de 2,75 à 3,05 (mt . 4H) ; de 3,05 à 3,40 (mt .
4H) ; 3, 96 (s . 3H) ; 6, 41 (dt, J = 16 et 6 Hz . 1H) ; 6, 58
(d large, J = 16 Hz . 1H) ; 7,13 (mt . 1H) ; 7,23 (t
.dédoublé, J = 9,5 et 5 Hz . 1H)' ; de 7,35 à 7,50 (mt . 1H) ;
7,38 (dd, J = 9 et 3 Hz . 1H) ; 7,48 (d, J = 3 Hz . 1H) ;
7,96 (d, J = 9,5 Hz . 1H) ; 8,70 (s large . 1H).
Spectre IR (pastille de KBr) . 2962; 2834; 1621; 1512; 1490;
1385; 1264; 1240; 1145; 1033; 969; 825; 799 et 727 crril
L'énantiomère B de l'acide 1-[(E)-3-(2,5-difluoro-phényl)-
allyl]-3-[-2-(3-fluoro-6-méthoxy-4-quinoléinyl)-éthylamino]-
3-pyrrolidine carboxylique peut être préparé de la manière
suivante .
A une solution contenant 0.229 g (0,458 mmole) de l'ester
méthylique de l'énantiomère B de l'acide 1-[(E)-3-(2,5-
difluoro-phényl)-allyl]-3-[-2-(3-fluoro-6-mêthoxy-4-
quinoléinyl)-éthylamino]-3-pyrrolidine carboxylique dans 25
cm3 de dioxanne sont ajoutés, sous agitation, 3,85 cm3 (19,24
mmoles) d'une solution aqueuse de soude 5N, et la solution
jaune ainsi obtenue est portée au reflux, et agitée 18 heures
à cette température. Le milieu réactionnel est alors ramené à
une température voisine de 20° C, puis concentré à sec sous
pression réduite. Le résidu ainsi obtenu est purifié par
chromatographie sur une colonne de 2~cm de diamêtre contenant
21 cm de silice 20-45 ~,m à pression atmosphérique en
utilisant comme éluant un mélange chloroforme/méthanol/
ammoniaque aqueux à 28 ~ (12/3/0.,5 en volume). Les fractions
contenant. l'attendu sont réunies et concentrées sous pression
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
33
réduite pour donner 0,150 g d'un produit jaune pâle qui est
repris dans 20 cm3 d'un mélange dichlorométhane/méthanol
(9/1). La solution résultante est filtrée sur papier, le
papier est lavé par deux fois 10 cm3 d'un mélange
dichlorométhane/méthanol (9/1), les filtrats sont réunis puis
concentrés à sec sous pression réduite. Le résidu est repris
par 50 cm3 d'éther isopropylique, puis la suspension
résultante est concentrée à sec sous pression réduite pour
donner 0,143 g de l'énantiomère B attendu sous forme d'un
solide amorphe jaune pâle.
[a]D = -21, 6 +/- 0,7(c = 0,5 dans le mthanol)
Spectre MS :IC m/z = 486 MH+ pic de base
- Spectre de R.M.N. 1H (300 MHz, (CD3)~SO avecajout de quelques
gouttes de CD3COOD d4, b en ppm) . 2,02(mt 1H) 2,33 (mt .
. ;
1H) ; 2,65 (mt . 1H) ; 2,94 (d, J = 11 Hz 1H) de 3,00
. ;
3,20 (mt . 3H) ; 3,22 (d, J = 11 Hz . 1H) de 0~ 3,50
; 3,3
(mt . 4H) ; 3,93 (s . 3H), ; 6,41 (dt, J = et Hz . 1H)
16 6
6, 67 (d large, 1H) 7, 23 (t
J = 16 Hz . 1H) ;
; ~ 7, 14 (mt .
ddoubl, J = 9,5 et 5 Hz . 1H) ; de 7,35 7,45(mt
.
1H)
;
7,38 (dd, J = 9 et 3 Hz . 1H) ; 7,44 (d, J 3 Hz . 1H) ;
=
7,96 (d, J = 9,5 Hz . 1H) ; 8,70 (s large 1H).
.
Spectre IR (pastille de KBr) . 2928; 2835; 1621; 1510; 1490;
1384; 1264; 1239; 1146; 1032; 969; 825; 799 et cnil
727
Les énantiomères A et B de l'ester méthylique de 1-'-acide
1- [ (E) -3- (2, 5-difluoro-phényl) -allyl] -3- [-2- (3-fluoro-6-
méthoxy-4-quinoléinyl)-éthylamino]-3-pyrrolidine carboxylique
peuvent être préparés de la manière suivante .
A une solution contenant 1,15 g (3,3 mmoles) d'ester
méthylique de l'acide 3-(RS)-3-[-2-(3-flûoro-6-méthoxy-4-
quinoléinyl)-éthylamino]-3-pyrrolidine carboxylique dans 90
cm3 d'acétonitrile anhydre sont ajoutés, sous agitation et
sous atmosphère inerte . 2,3 g (16,5 mmoles) de carbonate de
potassium, 0,603 g (3,63 mmoles) d'iodure de potassium et, en
5 minutes, 30 cm3 d'une solution contenant 1 g (3,8 mmoles) de
chlorure de (2,5-difluoro-phényl)-allyle (préparé selon la
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
34
méthôde décrite.dans la demande de brevet WO 9307109) dans
l'acétonitrile anhydre. La suspension jaune ainsi obtenue est
portée au reflux pendant 5 heures, puis ramenée à une
température voisine de 20° C et agité'18 heures. Le milieu
réactionnel est alors filtré, le résidu est rincé par 3 fois
30 cm3 d'acétonitrile et le filtrat est concentré sous
pression réduite. Le résidu ainsi obtenu est ~repris.dans 250
cm3 d'acétate d'éthyle, la phase organique est lavée à l'eau,
séchée sur sulfate de magnésium anhydre, filtrée sur papier
et concentrée sous pression réduite. L'huile orange ainsi
obtenue est purifié par chromatographie sur une colonne de
3,5 cm de diamètre contenant 26 cm de silice 20-45 ~,m à
pression atmosphérique en utilisant comme éluant un mélange
acétate d'éthyle/méthanol (90/10), puis un mélange
.dichlorométhane/méthanol (95/5). Les fractions contenant
l'attendu sont réunies et concentrées sous pression réduïte
pour donner 0,427 g de l'ester méthylique de l'acide 3-(RS)-
1- [ (E) -3- (2, 5-difluoro-phényl) -allyl] -3- [-2- (3-fluoro-6-
méthoxy-quinoléine-4-yl)-éthylamino]-pyrrolidine-3~-
carboxylique sous forme d'une huile visqueuse jaune.
Spectre MS . IE m/z = 499 M+' ; m/z = 440 (M - C02CH3) +; m/z =
346 (M - C9H~F~)+ ; m/z = 279 (M - C12Hi30N2F)+' : m/z = 153
C9H~F~+ ; m/z = 42 C2H4N+ pic de base
Spectre de R.M.N. 1H (300 MHz, (CD3) 250, b en ppm) . 1, 70 (mt
. 1H) ; 2,20 (mt .. 1H) ; 2,.40 (mf . 1H) ; de 2,55 à 2,80
(mt . 4H) ; 3, 03 (d large, J - 10 Hz . 1H) ; de 3, 10 à 3, 20
(mt . 4H) ; 3, 58 (s . 3H) ; 3, 95 (s . 3H) ; 6, 45 (dt, J = 16
et 6 Hz . 1H) ; 6,58 (d large, J - 16 Hz . 1H) ; 7,13 (mt .
1H) ; 7,25 (t dédoublé, J = 9,5 et 5 Hz . 1H) ; 7,39 (dd, J =
9 et 3 Hz . 1H) ; 7,43 (d, J - 3 Hz . 1H) ; 7,50 (ddd, J -
9,5 - 6 et 3 Hz . 1H) ; 7,96 (d, J - 9 Hz . 1H) ; 8,69
(s large . 1H).
Spectre IR (solution dans le CH2C12) . 2985; 2805; 1730; 1621;
1508; 1490; 1469; 1277; 1232; 1145; 1088; 1030; 972 et
834 cm 1
Sont également récupérés 0,294 g de chlorhydrate de~ l'ester
méthylique de l' acide 3- (RS) -1- [ (E) -3- (2, 5-difluoro-phényl) -
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
allyl] -3- [-2- (3-fluoro.-6-méthoxy-4-quinoléinyl) -éthylamino] - .
3-pyrrolidine carboxyliqué sous forme d'une huile jaune.
Spectre MS . IE m/z - 499 M+' ; m/z=440 (M - C02CH3) +; m/z=346
5 (M - C9H~F2) + ; m/z = 279 (M - C1zH130NzF) +' ; m/z = 153 C9H~F2+ ;
m/z = 42 C2H4N+ pic de base
Ce.dernier produit est repassé sous sa forme base libre par
traitement d'une solution dans l'acétate d'éthyle le
10 contenant par une solution aqueuse de bicarbonate de sodïum,
décantation de la phase organique, séchage sur sulfate de
magnésium anhydre et concentration sous pression réduite. Le
produit ainsi obtenu est mélangé à la fraction précêdente,
puis les deux énantiomères sont séparés par chromatographie
15 chirale sur phase Chiracel OD 20 ~m en éluant par un mélange
Heptane 95 % iPrOH 5 % TEA 0.5 %. La détection est réalisée à
265 nm. Sont ainsi obtenus .
* 0,226 g de l'énantiomère A de l'ester méthylique de
20 l' acide 1- [ (E) -3- ('2, 5-difluoro-phényl) -allyl] -3- [-2- (3-
fluoro-6-méthoxy-4-quinoléinyl)-éthylamino]-3-pyrrolidine
carboxylique sous forme d'une gomme ambrée
[a]D = + 12,9 +/- 0,7 (c = 0,5 dans le mthanol)
25 Spectre MS . IE m/z = 499
M+' ; m/z = 440 (M - C02CH3)
+ ; m/z =
346 (M - C9H~Fz) + ; m/z = 279 (M C1zH130NaF) +' ; m/z = 153
-
CgH~F2+ ; m/z = 42 CZH4N+ pic de
base
Spectre de R.M.N. 1H (300 MHz, (CD3) ~SO, 8 en ppm) . 1, 70
(mt
1H) ; 2,20 (mt . 1H) ; 2,39(d, J = 10 Hz . 1H) ; 2,48
30 (mt . 1H) ; de 2, 55 2, (mt . 4H) ; 3, 03 (d, J = 10 Hz
80
1H) ; 3, 14 (d large, J = 6 Hz 2H) ; 3, 18 (t large , J =
. 7, 5
Hz . 2H) ; 3,59 (s . 3H) ; 3,97(s . 3H) ; 6,45 (dt, J = 16
et 6 Hz . 1H) ; 6,59 (d large, J - 16 Hz . 1H) ; 7,13 (mt
.
1H) ; 7,25 (t ddoubl, J = 9,5 et 5 Hz . 1H) ; 7,39 (dd, J
=
35 9 et 3 Hz . 1H) ; 7,43 (d, J 3 Hz . 1H) ; 7,50 (ddd, J -
-
9, 5 - 6 et 3 Hz . 1H) ; 7, (d, J - 9 Hz . 1H) ; 8, 69
96
(s large . 1H).
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
36
Spectre IR (solution dans le CC14) . 3077;. 3033; 2935; 2928;
2832; 2801; 1732; 1622; 1507; 1490; 1469; 1431; 1263; 1232;
1217; 1140; 1034; 971; 909; 872 et 833 crnl
5' * et 0,229 g de l'énantiomère B de l'ester méthylique de
l' acide -1- [ (E) -3- (2, 5-difluoro-phényl) -allyl] -3- [-2- (3,-
fluoro-6-méthoxy-4-quinoléinyl)-éthylamino]-3-pyrrolidine
carboxylique sous forme d'une gomme ambrée
[a,] D = - 5, 2 ° +/- 0, 7 (c = 0, 5 dans le méthanol)
Spectre MS . IE m/z = 499 M+' ; m/z = 440 (M - C02CH3) + ; m/z
-
346 (M - C9H~Fz)'i' ; m/z - 279 (M .- /C1zH13ONzF)+' ; m/z
- 153
C9H~Fz+ ; m/z = 42 CZH4N+ pic de base
Spectre de R.M.N. 1H (300 MHz,. (CD3)
zSO, 8 en ppm) . 1, 70 (mt
. 1H) ; 2, 20 (mt . 1H) ; 2, 39 J = 10 Hz . 1H) ; 2,48 (t,
(d,
J = 7,5 Hz . 1H) ; de 2,55 2,80 (mt . 4H) ; 3,03 (d, J =
10
Hz . 1H) ; 3, 14 (d large, J = 6 Hz
. 2H) ; 3, 18 (t large , J
- 7,5 Hz . 2H) ; 3,59 (s . 3H) ; 3,97 (s . 3H) ; 6,45 (dt,
J = 16 et 6 Hz . 1H) ; 6, 59 (d large,
J = 16 Hz . 1H) ; 7, 13
(mt . 1H) ; 7,25, (t ddoubl, J - 9,5 et 5 Hz . 1H) ; 7,39
(dd, J - 9 et 3 Hz . 1H) ; 7,43 (d, J - 3 Hz . 1H) ; 7,50
(ddd, J = 9, 5 - 6 et 3 Hz . 1H) ; 7, 96 (d, J = 9 Hz . 1H)
;
8,69 (s large . 1H).
Spectre IR (solution dans le CC14)~ . 3077; 3033; 2935; 2928;
2831; 2800; 1733; 1622; 1507; 1490;1469; 1431; 1263; 1232;,
1217; 1140; 1034; 971; 909; 873 et 833 cm-1
L'ester méthylique de l'acide 3-(RS)-3-[-2-(3-fluoro-6-
méthôxy-4-quinoléinyl)-éthylamino]-3-pyrrolidine carboxylique
peut être préparé de la manière suivante .
A une solution contenant 1,8 g (4,114 mmoles) d'ester
méthylique de l'acide 3-(RS)-1-benzyl-3-[-2-(3-fluoro-6-
méthoxy-4-quinoléinyl)-éthylamino]-3-pyrrolidine carboxylique
dans 160 cm3 de méthanol sont ajoutés, sous agitation, 25 cm3
de cyclohexêne, puis 1,8 g de palladium sur charbon à 10 %.
La suspension noire ainsi obtenue est portée au reflux et
agitée une heure à cette température, avant d'être ramenée à
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
37
une température voisine de 20° C. Le milieu réactionnel- est .
filtré sia.r papier et le résidu est lavé par 5 fois 30~cm3 de
méthanol. Le filtrat.est concentré sous pression réduite pour
donner 1,15 g d'ester attendu sous forme d'une huile jaune.
Spectre MS . IE m/z = 347 M+' ; m/z = 305 (M - CzH4N) +' ; m/z =
288 (M - C02CH3) + ; m/z = 192 C11H11~NF+ pic de base ; m/z = 157
C~Hi30zNz+ ; m/ z = 4 2 C2H4N+
L'ester méthylique de l'acide 3-(RS)-1-benzyl-3-[-2-(3-
fluoro-6-méthox~r-4-quinoléinyl)-éthylamino]-3-pyrrolidine
carboxylique peut être préparé de la manière suivante .
A une suspension contenant 1,5 g X6,766 mmoles) de (3-fluoro-
6-méthoxy-4-quinoléinyl) acetaldehyde dans 70 cm3 de
chloroforme anhydre sont ajoutés, sous agitation et sous
atmosphère inerte (Argon) 2,08 g (6,766 mmoles) de
dichlorhydrate de l'ester méthylique de l'acide 3-(RS)-3-
amino-3-pyrrolidine carboxylique (acide préparé selon la
méthode décrite par Mamoun et roll. Synth Commun., 1995,
25(9), 1295-1302) et, en 5 minutes, une solution contenant
1.9 cm3 (13,53 mmoles) de triéthylamine en solution dans 30
cm3 de chloroforme anhydre. La suspension est agitée vivement
sous atmosphère inerte à une température voisine de 20° C
pendant 18 heures. La solution limpide orange ainsi obtenue
est concentrée sous pression réduite pour donner un résidu
jaune qui est repris dans 100 cm3 de dichloro-1,2-éthane ét
agité à une température voisine. de 20° C. A la suspension
jaune ainsi obtenue sont ajoutés 2,12 g (9,472 mmoles) de
triacétoxyborohydrure de sodium, suivi par 0,547 cïn3 (9,472
mmoles) d'acide acétique. La suspension ainsi obtenue est
agitée à une température voisine de 20° C pendant 18 heures.
Le milieu réactionnel est alors dilué par 300 cm3 de
dichlorométhane, la phase organique est lavée par 5 fois 150
cm3 d'eau, séchée sur sulfate de magnésium anhydre, filtrêe
sur papier puis concentrée à sec sous pression réduite. Le
résidu ainsi obtenu est purifié par chromatographïe sur
silice 70-200 ~,m à pression atmosphérique en utilisant comme
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
38
éluant un mélange acétate d'éthyle/méthanol (95/5): Les
fractions contenant le produit sont réunies et concentrées
sous pression~réduite pour donner 1,8 g de l'estes attendu
sous forme d'une huile jaune.
Spectre MS . IE m/z = 437 M+' ; m/z = 378 (M - C02CH3)+ ; m/z =
346 (M - C~H~) + ; m/z = 219 C13H1~02N+~ ; m/z = 133 C9H11N+' ; m/z
- 91 C~H~* ; m/z = 42 C2H4N+ pic de base
Le (3-fluoro-6-méthoxy-4-quinoléinyl) acétaldéhyde peut être
préparé de la manière suivante .
A une suspension contenant 1,7 g (6,766 mmoles) de 3-(3-
fluroro-6-méthoxy-4-quinoléinyl)-propane-1,2-diol dans 90 cm3
de tetrahydrofuranne sont ajoutés, sous agitation, 90 cm3
d'eau distillée puis 7,3 g (33,83 mmoles) de periodate de
sodium. La suspension jaune ainsi obtenue est agité 90
minutes à une température voisine de 20° C,. puis diluée par
300 cm3 d' eau. La phase aqueuse est extraite par 3 fois 200
cm3 d'acétate d'éthyle, les phases organiques sont réunies,
lavées par 3 fois 100 cm3 d'eau. L'émulsion ainsi créée est
reprise par 100 cm3 de saumure, décantée, et les phases
organiques sont séchées sur sulfate de magnésium anhydre,
filtrées sur papier puis concentrées à sec sous pression
réduite pour donner 1,5 g de produit attendu, sous forme d'un
solide jaune_pâle utilisé tel quel dans l'êtape suivante.
Spectre MS . IE m/z = 219 M+' ; m/z=191 (M - CO)+'pic de base
Le 3-(3-fluroro-6-méthoxy-4-quinoléinyl)-propane-1,2-diol
peut être préparé de la manière suivante .
A une solution contenant 1,9 g (8,746 mmoles) de 4-allyl-3-
fluoro-6-méthoxy quinoléine dans 75 cm3 d'acétone et 15 cm3
d'eau sont ajoutés, sous agitation, 5,2 g (43,73 mmoles) de
N-oxyde de N-méthylmorpholine puis 2 cm3 d'une solution à 2%
de tetraoxyde d'osmium dans l'alcool, aert-butylique. La~
solution noire est agitée une nuit à une température voisine
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
39
de .20° C. Le milieu réactionnel est alors refroidi à une
température voisine de 0° C, puis traité par 30 cm3 d'une
solution aqueuse. saturée en Na2S03.5H20. La solution ainsi
obtenue est agitée 15 minutes à une température voisine de 0°
C, puis diluée par 150 cm3 d'acétate d'éthyle. La phase
organique est décantée et la phase aqueuse est extraite par 3
fois 100 cm3 d'acétate d'éthyle. Les phases organiques sont
réunies, lavées par 3 fois 50 cm3 d'eau, puis séchées sur
sulfate de magnésium anhydre, filtrées sur papier et
concentrées à sec sous pression réduite. Le résidu solide
ainsi obtenu est repris~dans 50 cm3 d'acétate d'éthyle et
agité 30 minutes à une température voisine de 20° C. La-
suspension ainsi obtenue est filtrêe, le solide est lavé par
l'acétate d'éthyle, puis par l'éther isopropylique. Le solide
ainsi obtenu est séché au dessicateur sous vide pendant 2
heures pour donner 1,6 g de produit attendu sous forme de
cristaux de couleur crème fondant à 162° C.
Spectre MS . IE m/z = 251 M+' ; m/z = 191 (M - C2H4O2) +' pic de
2 0 base ; m/ z = 61 C~H502+
La 4-allyl-3-fluoro-6-méthoxy quinoléine peut être préparêe
de la manière suivante .
A une suspension contenant 4,55 g (15 mmoles) de 4-iodo-3-
fluoro-6-méthoxy quinoléine (préparée selon la méthode
décrite dans la demande de brevet WO 0240474) dans 150 cm3 de
DMF sont ajoutés 7,2 cm3 (22,5 mmoles) d'allyl-tributylétain,
0,88 g (0,75 mmole) de tétrakis(triphénylphosphine)palladium
et 0, 575 g (3 mmoles) d' iodLi.re de cuivre (I) . La suspension
est agitée sous atmosphère inerte (Argon) et à une
température voisine de 60° C pendant 24 heures. Le milieu
réactionnel est alors ramené à une température voisine de 20°
C, dilué par 500 cm3 d'acétate d'éthyle et lavé par 3 fois 300
cm3 d'eau. L'émulsion qui s'est formée est filtrée sur verre
fritté n° 4, et le résidu est lavé par 3 fois 100 cm3 d'eau,
puis par 3 fois 100 cm3 d'acétate d'éthyle. Les phases
organiques sont réunies et séchées sur sulfate de magnésium
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
anhydre. La suspension est filtrée sur papier, et lâ solution
est concentrée à sec sous pression réduite. Le résidu ainsi
obtenu est purifié par chromatographie sur une colonne silice
20-45 ~,m à pression atmosphérique en utilisant comme éluant
5 un mélange dichlorométhane/acétate d'éthyle (95/5 en volume).
Les fractions contenant le produit sont réunies et-
concentrées sous pression réduite. On obtient 1,9 g de
produit attendu sous forme d'une huile jaune.
10 Spectre MS . IC m/z = 218 MH+ pic de base
Exemple 2
Sel de sodium de l' acide 3- (RS) -1- [ (E) -3- (2, 5-difluoro-
15 phênyl)-allyl]-3-[-2-(3-chloro-6-méthoxy-4-quinoléinyl)-
éthylamino]-3-pyrrolidine carboxylique
A une solution contenant 0.125 g (0,242 mmole) de l'ester
méthylique de l'acide 3-(RS)-1-[(E)-3-(2,5-difluoro-phényl)-
20 allyl]-3-[-2-(3-chloro-6-méthoxy-4-quinoléinyl)-éthylamino]-
pyrrolidine carboxylique dans 20 cm3 de dioxanne sont ajoutés,
sous agitation, 2, 1 cm3 (10, 18 mmoles) d'une solution aqueuse
de soude 5N, et la solution orange ainsi obtenue est portée
au reflux, et agitée 18 heures à cette température. Le milieu
25 réactionnel est alors ramené â une température voisine de 20°
C, puis concentré à sec sous pression réduite. Le résidu
ainsi obtenu est purifié par chromatographie sur une colonne
de 2,5 cm de diamètre contenant 15 cm de silice 20-45 Om à
pression atmosphérique en utilisant comme éluant un mélange
30 chloroforme/méthanol/ammoniaque aqueux à 28 ~ (12/3/0,5). Les
fractions contenant l'attendu sont réunies et concentrées
sous pression réduite. On obtient 0,038 g du sel de sodium
attendu sous forme d'une meringue jaune pâle
35 Spectre de masse (IE) . m/z=501 M+' ; m/z=265 C14H130~NF2+.
m/z=207 CllHioONCl+' ; m/z=153 C9H~F2+ (pic de base) ; m/z=42
C2H4N+
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
41
Spectre de R.M.N. 1H (300 .MHz, (CD3).2SO avec ajout -de quelques
gouttes de CD3COOD d4, ~ eri ppm) . 2,05 (mt . 1H) ; 2,35
(mt . 1H) ; 2,72 (mt . 1H) ; 3,00 (d large, J = 10,5 Hz
1H) ; 3,00 à 3,20 et 3,30 à 3,65 (mts . 7H) ; 3,25 (d large,
J = 10,5~Hz . 1H) ; 3,97 (s . 3H) ; 6,42 (dt, J = l6 et 7
Hz .. 1H) ; 6,69 (d large, J = 16 Hz . 1H) ; de 7,05 à 7,30
(mt . 2H) ; de 7,35 à 7,45 (mt . 1H) ; 7,44 (dd large, J = 9
et 3 Hz . 1H) ; 7,50 (d large, J = 3 Hz . 1H) ; 7,97 (d, J =
9 Hz . 1H) ; 8, 68 (s . 1H) .
Spectre IR (pastille de KBr) . 3064; 2920; 2850; 2379; 1621;
1506; 1490; 1387; 1261; 1233; 1178; 1122; 1026; 971; 872; 825
et 72'~crri i .
L.' ester méthylique de l' acide 3- (RS) -1- [ (E) -3- (2, 5-difluoro-
phényl)-allyl]-3-[-2-(3-chloro-6-méthoxy-4-quinoléinyl)-
éthylamino]-3-pyrrolidine carboxylique peut être préparé de
la manière suivante .
A une solution contenant 0,240 g (0,66 mmole) d'ester
méthylique de l'acide 3-(RS)-3-[-2-(3-chloro-6-méthoxy-4-
quinoléinyl)-éthylamino]-3-pyrrolidine carboxylique dans
cm3 d'acétonitrile anhydre sont ajoutés, sous agitation et
sous atmosphère inerte (Argon) . 0,456 g (3,3 mmoles) de
carbonate de potassium, 0,121 g (0,726 mmole) d'iodure de
25 potassium et, en 5 minutes, 10 cm3 d'une solution contenant
0,15 g (0,760 mmole) de chlorure de (2,5-difluoro-phényl)-
allyle (préparé selon la méthode décrite dans la demande de
brevet WO 9307109) dans l'acétonitrile anhydre. La suspension
jaune ainsi obtenue est portée au reflux pendant 8 heures,
30 puis ramenée à une température voisine de 20° C et agité 18
heures. Le milieu réactionnel est alors filtré, le résidu est
rincé par 3 fois 15 cm3 d'acétonitrile et le fïltrat est
concentré sous pression réduite. Le résidu ainsi obtenu est
repris dans 50 cm3 d'acétate d'éthyle, la phase organique est
lavée par 3 fois 15 cm3 d'eau, séchée sur sulfate de magnésium
anhydre, filtrée sur papier et concentrée sous pression
réduite. L'l2uile orange ainsi obtenue est_purifiée par
chromatographie sur une colonne de 2 cm de diamètre. contenant
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
42
15 .cm de silice.20-45 ~.m à pression atmosphérique en
utilisant comme éluant un mélange acétate d'éthyle/méthanol
(95/5), puis un mélange acétate d'éthyle/méthanol (95/5). Les ,
fractïons contenant le produit sont réunies et concentrées
sous pression réduite. On obtient 0,147 g de produit attendu
sous formé d'une meringue jaune.
Spectre IR (pastille de KBr) . 2953; 2651; 1731; 1621; 1504;
1491; 1432; 1423; 1272; 1261; 1231; 1195; 1117; 1040; 1024;
973; 832 et 727 cm-1
-- L'ester méthylique de l'acide 3-(RS)-3-[-2-(3-chloro-6-
méthoxy-quinoléine-4-yl)-éthylamino]-pyrolidine-3-
carboxylique peut être préparê de la manière suivante
A une solution contenant 1,03 g (2,044 mmoles) de l'ester
méthylique de l'acide 1-vinyloxycarbonyl-3-~[2-(3-chloro-6- .
methoxy-4-quinoléinyl)-ethyl]-vinylôxycarbonyl-aminô~-3-
pyrolidine carboxylique dans 10 cm3 d'acide acétique sous
atmosphère inerte et sous agitation sont ajoutés goutte à
goutte l,l cm3 (6,132 mmoles, 3 équivalents) d'une solution à
33 ~ d'acide bromhydrique dans l'acide acétique en environ 15
minutes et à une température voisine de 15° C. La solution
orange ainsi obtenue est agité 3 heures à une température
voisine de 20° C. Le milieu réactionnel est alors concentré
sous pression réduite, et 1e résidu obtenu est.repris dans 50
cm3 d'eau, le pH de la solution est amené à une valeur voisine
de 9 par une solution aqueuse de NaHC03, et la phase aqueuse
ainsi obtenue est extraite par 3 fois 100 cm3 d'acétate
d'éthyle. Les phases organiques sont réunies, lavées par 3
fois 30 cm3 d'eau, séchées sur MgS04 anhydre, filtrées et
concentrées sous pression réduite. Le résidu ainsi obtenu est
purifié par chromatographie sur silice 20-45 ~,m à pression
atmosphérique en. utilisant comme éluant mélange
dichlorométhane/mêthanol (50/50). Les fractions contenant le
produit sont réunies et concentrées sous pression réduite. On
obtient 0,240 g d'ester attendu sous forme d'une huile
orange.
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
43
Spectre de masse (IC) . m/z=364 MH+ (pic de base) .
L'ester méthylique de l'acide 3-(RS)-1-vinyloxycarbonyl-3-
f[2-(3-chloro-6-methoxy-4-quinoléinyl)-ethyl]-
vinyloxycarbonyl-amino~-3-pyrolidine carbôxylique peut être
préparé de la manière suivante .
A une solution contenant 1,2 g (2,643 mmoles) d'ester
méthylique de l'acide 3-(RS)-Z-benzyl-3-[-2-(3-chloro-6-
méthoxy-4-quinoléinyl)-éthylamino]-3-pyrrolidine carboxylique
(préparé comme. ci-dessous) dans 100 cm3 de dichloro-1,2-éthane
sous atmosphère inerte et sous agitation, sont ajoutés 0,55
cm3,(6,343 mmoles, 2,2 équivalents) de chlorure de .
vinyloxycarbonyle. La solution orange obtenue est agitée 1
heure à une température voisine de 20° C, puis 3 heures à une
température voisine de 100° C. Le milieu réactionnel est
alors concentré sous pression réduite, et le résidu ainsi
obtenu est purifié par chromatographie sur silice 20-45 ~.m à
pression atmosphérique en utilisant comme éluant du
dichlorométhane, puis un mélange dichlorométhane/acétate
d'éthyle (95/5). Les fraçtions contenant le produit sont
réunies et concentrées sous pression réduite. On obtient
0,550 g de l'ester attendu, sous forme d'une huile orange.
Spectre de masse (IC) . m/z=504 MH+,(pic de base).
Exemple 3
Acide 3- (RS) -1- [ (E) -3- (2, 5-difluoro-phényl) -allyl] -3- [-2- (6-
méthoxy-4-quinoléinyl)-éthylamino]-3-pyrrolidine carboxylique
A une solution contenant 0.44 g (0,914 mmole) de l'ester
méthylique de l'acide 3-(RS)-1-[(E)-3-(2,5-difluoro-phényl)-
allyl]-3-[-2-(6-méthoxy-4-quinoléinyl)-éthylamino]-3-
pyrrolidine carboxylique dans 50 cm3 de dioxanne sont ajoutés,
sous agitation, 7,7 cm3 (38,39 mmoles) d'une solution aqueuse
de soude 5N, et la solution orange ainsi obtenue est portée
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
44
au reflux, et agitée 18 heures à cette température.. Le milieu
réactionnel est alors.ramené à une température voisine de 20°
. C, puis concentré à sec sous pression réduite. Le résidu
ainsi obtenu est purifié par chromatographie sur une colonne
de 2 cm de diamètre contenant 2l,cm de silice 20-45 Om à
pressïon atmosphérique en utilisant comme éluant un mélange
dichloromêthane/méthanol/ammoniaque aqueux à 28 % (40/5/0,5).
Les fractions contenant l'attendu sont réunies et concentrées
sous pression réduite pour donner 0,360 g d'une meringue
jaune pâle qui est reprise dans 25 cm3 d'un mélange
dichlorométhane/méthanol (9/1). La solution résultante est
filtrée, le filtre est lavé par un mélange
dichlorométhane/méthanol (9/1), les filtrats sont réunis puis
concentrés à sec sous pression réduite. Le résidu est repris
par 50 cm3 d'éther isopropylique, agité l0 minute, puis la
suspension résultante est concentrée à sec sous pression
réduite pour donner 0,330 g de l' acidé attendu sous forme
d'un solide jaune pâle..
Spectre MS . IE m/z = 467 M+' ; m/z = 282 - Ci2H110N) + ;
(M m/z
- 185 C1~H110N+'
pic de base
; m/z = 42
C H N+
2 4
Spectre de R.M.N. (300 MHz, (CD3)2S0 avec ajout de quelques
1H
gouttes de CD3COOD, 8 en ppm) . 2,05 (mt 1H) ; 2,34 (mt
. .
1H) ; 2 , 65 (mt . ; 2 , 95 (d, J = 11 Hz . 1H) ; de 3 ,
1H) 05
3,20 (mt 3H) ; ; de 3,30 3,50
. 3,25
(d, J
- 11
Hz .
1H)
(mt . 4H) ; 3, 92 . 3H) ; 6, 42 (dt, J
(s = 16 et 6 Hz . 1H) ;
,6,67 (d large, 16 Hz . 1H) ; 7,13 (mt . 1H) ; 7,23 (t
J -
ddoubl, J = 9, 5 5 Hz . 1H) ; de 7, 35 7, 50 (mt . 4H)
et ;
7,95 (d, J = 9,5 1H) ; 8,66 (d, J = 4,5 Hz . 1H).
Hz .
Spectre IR (pastillede KBr) . 2961; 2832;
1621; 1592; 1510;
1490; 1476; 1431; 5; 10.82; 1030;
1367;
1263;
1242;
1228;
114
969; 847; 821 cm-i
et 727
L'ester méthylique de l'acide 3-(RS)-1-[(E)-3-(2,5-difluoro-
phényl)-allyl]-3-[-2-(6-méthoxy-4-quinoléinyl)-éthylamino]-3-
pyrrolidine carboxylique peut êtré préparé de la manière
suivante .
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
A une solution contenant 0,8 g (2,187 mmoles) du
dichlorhydrate de l'ester méthylique de l'acide 3-(RS)-3-[-2-
(6-méthoxy-4-quinoléinyl)-éthylamino]-3-pyrrolidine
carboxylique dans 60 cm3 d'acétonitrile anhydre sont ajoutés,
5 sous agitation et sous atmosphère inerte (Argon) . 1,82 g
(10,94 mmoles) de carbonate de potassium, 0,400 g (2,406
mmoles) d'iodure de potassium et, en 5 minutes, 10 cm3 d'une
solution contenant 0,600 g (2,517 mmoles) de chlorure de
(2,5-difluoro-phényl)-allyle (préparé selon la méthode
10 décrite dans la demande de brevet WO 9307109) dans
l'acétonitrile anhydre. La suspension jaune ainsi obtenue est
portée au reflux pendant 5 heures, puis ramenée à une
température voisine de 20° C et agité 18 heures. Le milieu
réactionnel est alors filtré sur verre fritté. n° 4, le résidu
15 est rincé par 3 fois 30 cm3 d'acétonitrile et le filtrat est
concentré sous pression réduite. Le résidu ainsi obtenu est
repris dans 250 cm3 d'acétate d'éthyle; la phase organique
est lavée par 3 fois 100 cm3 d'eau, séchée sur sulfate de
magnésium anhydre, filtrée et concentrée sous pression
20 réduite. L'huile orange ainsi obtenué est purifiée par
chromatographie sur silice 70-200 ~,m à pression atmosphérique
en utilisant comme éluant un mélange acétate
d'éthyle/méthanol (90/10), puis un mélange
dichlorométhane/méthanol (90/10). Les fractions contenant le
25 produit attendu sont réunies et concentrées sous pression
réduite. On obtient 0,460 g de l'ester attendu sous forme
d'une huile jaune.
Spectre MS . ES m/z = 431 MH+ pic de base
30 Spectre R.M.N. 1H (300 MHz, (CD3)250, 8
de en ppm) . 1,27 (mt
. 1H) ; 2,23 . ; de 2,50
(mt . 1H) 1H)
; 2,46 (d,
J = 10 Hz
2, 85 (mt . 5H) ; 3, 05 (d, J - 10 Hz . 1H) ; 3, 10 3,
de 25
(mt . 4H) ; 3, 60 (s . 3H) ; 3, 95 (s . 3H) 6, (dt, J =
; 47 16
et 6 Hz . 1H) ; 6,62 (d large, J - 16 Hz . 1H) ; 7,14 (mt
.
35 1H) ; 7,26 (t ddoubl, J = 9,5 et 5 Hz . 1H) 7,35 (d,
; J =
4,5 Hz . 1H) J 9,5 - 6 et
; 7,40 (mt -
. 2H) ; 7,51
(ddd,
3 Hz . 1H) ; 7, 94 (d, J = 9 Hz . 1H) ; 8, (d, J = 4, 5
64 Hz
1H) .
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
46
Spec_tre IR (solution dans le ÇC14) . 3076; 3031; 2952; 2907;
2833; 2800; 1733; 1621;1593; 1508; 1490; 1474; 1431; 1262;
1241; 1229; 1196; 1036; 971; 872 et 850 cm 1
Le dichlorhydrate de l'ester méthylique de l'acide 3-(RS)-3-
[-2-(6-méthoxy-4-quinoléinyl)-éthylâmino]-3-pyrrolidine
carboxylique peut être préparé de la manière suivante .
A une solution contenant 1,2 g (2,643 mmoles) d'ester
méthylique de l'acide 3-(RS)-1-benzyl-3-[-2-(3-chloro-6-
méthoxy-4-quinoléinyl)-éthylamino]-3-pyrrolidine carboxylique
dans 100 cm3 de méthanol sont ajoutés, sous agitation, 15 cm3
de cyclohexène, puis 1,2 g de palladium sur charbon à 10 %.
La suspension noire ainsi obtenue est portée au reflux et
agitée une heure à cette température, avant d'être ramenée à
une température voisine de 20° C. Le milieu réactionnel est
filtré et le résidu est lavé par 5 fois 20 cm3 de méthanol. Le
filtrat est concentré sous pression réduite pour donner 0,8 g
de dichlorhydrate de l'ester attendu sous forme d'une huile
2 0 j aune .
Spectre MS . IE m/z = 329 M+' ; m/z = 287 (M - C2H4N)+'; m/z =
270 (M - CO~CH3)+ ; m/z = 173 C11H11ON+' pic de base ; m/z =.42
C2H4N+ ; m/ z = 3 6 HCl+'
L' ester méthylique . de l' acide 3- (RS) -1-benzyl-3- [-2- (3-
chloro-6-méthoxy-4-quinoléinyl)-éthyTamino]-3-pyrrolidine
carboxylique peut être préparé de la manière suivante .
A une suspension contenant 1,06 g (4,5 mmoles) de (3-chloro-
6-méthoxy-4-quinoléinyl) acetaldehyde dans 45 cm3 de
chloroforme anhydre sont ajoutés, sous agitation et sous
atmosphère inerte (Argon) 1, 38 g (4, 5 mmoles) de
dichlorhydrate de l'ester méthylique de l'acide 3-(RS)-3-
amino-3-pyrrolidine carboxylique et, en 5 minutes, une
solution contenant 1.27 cm3 (9 mmoles) de triéthylamine en
solution dans 15 cm3 de chloroforme anhydre. La suspension est
agitée vivement sous atmosphêre inerte~à une température
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
47
voisine de 20° C pendant 18 heures. La solution ainsi obtenue
est concentrée sous pression réduite pour donner un résidu
qui est repris dans 60 cm3 de dichloro-1,2-éthane et agité à
une température voisine de 20° C. A la suspension ainsi
obtenue sont ajoutés 1;4 g (6,3 mmoles) de
triacétoxyborohydrure de sodium, suivi par 0,364 cm3 (6,3
mmoles) d'acide, acétique. La suspension ainsi obtenue est
agitée à une température voisïne de 20° C pendant 18 heures.
Le milieu réactionnel est alors dilué par 250 cm3 de
dichlorométhane, la phase organique est lavée par 5 fois 100
cm3 d'eau, séchée sur sulfate de magnésium anhydre, filtrée
puis concentrée à sec sous pression réduite. Le résidu ainsi
obtenu est purifié par chromatographie sur de silice
70-200 ~,m à pression atmosphérique en utilïsant comme éluant
un mélange acétate d'éthylé/méthanol (95/5). Lés fractions
contenant le produit sont réunies et concentrées sous
pression réduite. On obtient 1,2 g de l'ester méthylique
attendu sous forme d'une huile jaune.
Spectre MS . IE m/z = 453 M+' ; m/z = 394 (M - COZCH3) + ; m/z =
3 62 (M - C7H~ ) + ; m/ z = 219 C13H1~02N+' ; m/ z=13 3 C9H11N+' ; m/ z
91 C~H~+ ; m/z = 42 C2H4N+ pic de base
Le (3-chloro-6-méthoxy-4-quinoléinyl) acétaldéhyde peut être
préparé de la manière suivante .
A une suspension contenant 1, 2 g (4, 55 mmoles) de 3°- (3-
chloro-6-méthoxy-4-quinoléinyl)-propane-1,2-diol dans 60 cm3
de tetrahydrofuranne sont ajoutés, sous agitation, 60 cm3
d'eau distillée puis 4,8 g (22,5 mmoles) de periodate de
sodium. La suspension jaune ainsi obtenue ést agité 90
minutes à une température voisine de 20° C, puis diluée par
280 cm3 d'eau. La phase aqueuse est extraite par 3 fois 150
cm3 d'acétate d'éthyle, les phases organiques sont réunies,
lavées par 3 fois 100 cm3 d'eau. L'émulsion ainsi créée est
reprise par 1.00 cm3 de saumure, décantée, et les phases
organiques sont séchées._sur sulfate de magnésium anhydre,
filtrées sur papier puis concentrées à sec sous pression
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
48
réduite pour donner 1,1 g de. produit attendu sous forme d'un
solide jaune pâle utilisé~tel quel dans l'étape suivante.
Spectre MS . IE m/z = 235 M+' ; m/z = 207 (M - CO)+' pic de
base
Le 3-(3-chloro-6-méthoxy-4-quinoléine-4-yl)-propane-1,2-diol
peut être préparé de la manière suivante .
A une solution. contenant 1,85 g (7,916 mmoles) de 4-allyl-3-
chloro-6-méthoxy quinolêine dans 75 cm3 d'acétone et 15 cm3
d'eau sont ajoutés, sous agitation, 4,7 g (39;58 mmoles) de
N-oxyde de N-méthylmorpholine puis 1,8 cm3 d'une solution à 2%
de tetraoxyde d'osmium dans l'alcool tert-butylique. La
solution noire est agitée une nuit à une température voisine
de 20° C. Le milieu réactionnel est alors refroidi à une
température voisine de 0° C, puis traité par 30 cm3 d'une
solution aqueuse saturée en Na2S03.5H20. La solution ainsi
obtenue est agitée 15 minutes à une température voisine de 0°
C, puis diluée par 150 cm3 d'acétate d'éthyle. La phase
organique est décantée et la phase aqueuse est extraite par 3
fois 100 cm3 d'acétate d'êthyle. Les phases orgâniques sont
réunies, lavées par 3 fois 50. cm3 d'eau, puis séchées sur
sulfate de magnésium anhydre, filtrées et concentrées à sec
sous pression,réduite. Le résidu solide ainsi. obtenu est
repris dans 50 cm3 d'acétate d'éthyle et agité 30 minutes à
une température voisine de 20° C. La suspension ainsi obtenue
est filtrée, le solide est lavé par 3 fois 10 cm3-d'acétate
d'éthyle, puis par 3 fois 10 cm3 d'éther isopropylique. Le
solide ainsi obtenu est séchê sous pression réduite pendant 2
heures. On obtient 1,2 g de produit attendu sous forme de
cristaux fondant à 138° C.
Spectre MS . IE m/z = 267 M+' ; m/z = 207 (M - C2H40~) +'
pic de base ; m/z = 61 CaH502+
La 4-allyl-3-chloro-6-méthoxy quinoléine peut être préparée
de la manière suivante .
CA 02535020 2006-02-03
WO 2005/016916 PCT/FR2004/002090
49
A une suspension. contenant 8,2 g (30 mmoles) de 4-bromo-3-
chloro-6-méthoxy quinoléine (préparê selon la méthode décrite
dans la demande de brevet VJO 0240474) dans 250 cm3 de DMF sont
ajoutés 14,4 cm3 (45 mmoles) d'allyl-tributylétain, 1,75 g
(1,5 mmoles) de tétrakis(triphénylphosphine)palladium et 1,2
g (6 mmoles) d'iodure de cuivre (I). La suspension est agitée
sous atmosphère inerte (Argon) et à une tempêrature voisine
de 60° C pendant 48 heures. Le milieu réactionnel est alors
ramené à une tempêrature voisine de 20° C, dilué par 500 cm3
d'acétate d'éthyle et lavê par 3 fois 300 cm3 d'eau.
L'émulsion qui s'est formée est filtrée, et le résidu est
lavé par ~3 fois 100 cm3 d' eau, puis par 3 fois 100_ cm3
d'acétate d'éthyle. Les phases organiques sont réunies et
séchées sur sulfate de magnésium anhydre. On filtre et
concentre à sec sous pression réduite. Le résidu ainsi obtenu
est purifïê par chromatographie sur une colonne de 6 cm de
diamëtre contenant 30 cm de silice 40-63 ~m à pression
atmosphérique en utilisant comme éluant le dichlorométhane.
Les fractions contenant le produit sont réunies. et on obtient
Z,85 g de produit attendu sous forme d'une huile.
Spectre MS . IC m/~ = 234 MH+ pic de base
30
40