Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
DERIVES DE GENKWANINE ET SAKUR,4NETINE, UTILISATION
COSMÉTIQUE ET THÉRAPEUTIQUE, ET PROCEDE DE
PREPARA TION
Domaine de l'invention
La présente invention a trait à des dérivés osylés de genkwanine et
sakuranétine. Plus précisément, elle concerne (i) l'utilisation en cosmétique
ou dermatologie, d'une part, et en thérapeutique, d'autre part, des dérivés
osylés de genkwanine et sakuranétine de formule I ci-après, (ii) des
nouveaux dérivés de formule I en tant que produits industriels, et (iii) leur
procédé de fabrication.
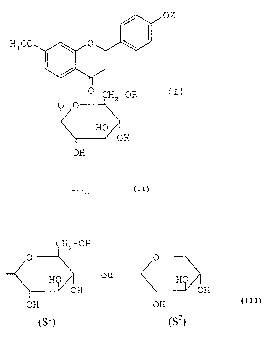
Les composés selon l'invention répondent à la formule I :
oz
H3 CO 0
-OR I
0 CHOHO"
H
OH
dans laquelle,
le symbole représente une simple ou une double liaison,
R représente H ou un reste osyle, notamment de structure S1 ou S2 :
CH2 - OH
0
HO ou HO
OH OH
OH OH
(S1) (S2)
Z représente H, un groupe alkyle en C1-C4, acyle en C1-C5, ose ou
sulfate.
CA 02559377 2012-01-05
2
Art antérieur
On sait que quelques produits de formule I ont déjà été décrits et
étudiés dans le passé. En particulier la 5-0-(i-D-primevérosyl-genkwanine
(qui est un composé de formule I où le symboles représente une double
liaison, R est un reste osyle de structure S2, et Z est H) est obtenue par
extraction de Gnidia kraussiana (une plante de la savane africaine de la
famille des thyméléacées) et possède des propriétés immunitaires
(notamment immunostimulantes), anticancéreuses et antileucémiques. Plus
précisément, lors de désordres immunitaires graves, les lymphoblastes
io physiologiques sont en hyperplasie, et l'intérêt de la 5-O-(3-D-
primevérosyl-
genkwanine réside dans le fait qu'elle détruit les lymphoblastes formés.
Voir à cet effet FR 2510580 A, FR 2597751 A et l'article de Jer-Huei LIN
et al., Yaowu Shipin Fenxi, 2001;9(l),6-1 1.
Le pinostrobine-5-glucoside (qui est un composé de formule I où le
symbole- représente une double liaison, R est H, et Z est H) a été isolé
de l'écorce de Prunus cerasus et est considéré comme étant caractéristique
de l'espèce Prunus cerasus. Voir à cet effet l'article de Martin GEIBEL et
al., Phythochemistiy, 1991;30(5),1519-1521.
La sakuranine, autre nomenclature : sakuranétine-5-glucoside, (qui
est un composé de formule I où le symbole -~-- représente une simple
liaison, R est H, et Z est H), a été isolée de Prunus yedoensis sans que ses
éventuelles propriétés cosmétiques ou pharmacologiques (notamment les
propriétés antiradicalaires) aient été étudiées. Voir à cet effet l'ouvrage
Merck Index, 12th Edition, 1996, Monograph No. 8470, pages 1431-1432.
L'art antérieur précité ne décrit ni ne suggère que les composés de
formule I selon l'invention présentent des propriétés bénéfiques :
- en cosmétique ou dermatopharmacie, en tant que substances
améliorant la texture de la peau, et
- en thérapeutique humaine ou vétérinaire (notamment les animaux à
sang chaud), en tant que substances antiradicalaires.
Résumé de l'invention
Selon un premier aspect de l'invention, on préconise une nouvelle
utilisation de dérivés osylés de genkwanine et sakuranétine, en tant que
substances (a) cosmétiques ou dermatologiques, ou (b) antiradicalaires,
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
3
pour (a) améliorer la texture de la peau ou, respectivement, (b) traiter ou
prévenir les désordres provoqués par les radicaux libres.
Dans cette optique, on fournit une nouvelle utilisation (a) en
cosmétique ou dermatologie, d'une part, ou (b) en thérapeutique humaine
ou vétérinaire, d'autre part, ladite utilisation étant caractérisée en ce que
l'on fait appel à une substance choisie parmi l'ensemble constitué par
(i) les dérivés osylés de genkwanine ou sakuranétine de formule I :
oz
H 1
0 \
0 Ç C H I )
O 0
HO
OH
OH
dans laquelle,
le symbole- représente une simple ou une double liaison,
R représente H ou un reste osyle, notamment de structure S 1 ou S2 :
CH2 - OH
O 0
HO ou HO
OH OH
OH OH
(S1) (S2)
Z représente H, un groupe alkyle en C,-C4, acyle en C1-C5, ose ou
sulfate, et
(ii) leurs mélanges,
en tant qu'ingrédient actif (a) cosmétique ou dermatologique, ou,
respectivement, (b) antiradicalaire, pour l'obtention (a) d'une préparation
cosmétique ou dermatologique pour améliorer la texture de la peau ou,
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
4
respectivement (b) d'un médicament destiné à un usage en thérapeutique
vis-à-vis des désordres provoqués par les radicaux libres.
Selon un second aspect de l'invention, on préconise, en tant que
produits industriels nouveaux, des composés de formule I où R est
notamment un reste ose de structure S 1 et leurs mélanges.
Selon un troisième aspect de l'invention, on préconise un procédé
pour la préparation des composés de formule I et en particulier pour celle
desdits nouveaux composés.
Brève description des dessins
Les figures annexées concernent une partie des résultats des essais
qui ont été entrepris avec des produits de formule I :
= la figure 1 montre que les produits de formule I testés ont des
propriétés antiradicalaires, et
= les figures 2 et 3 montrent que les produits de formule I testés
présentent un intérêt en tant qu'agents agents immunosuppresseurs.
Description détaillée de l'invention
La présente invention englobe des dérivés osylés de genkwanine
quand le symbole_ représente une double liaison, d'une part, et des
dérivés osylés de sakuranétine quand ledit symbole_ représente une
simple liaison, d'autre part.
Dans la définition de Z, les groupe alkyle en C1-C4 comprennent des
groupes à chaîne hydrocarbonée linéaire ou ramifiée, à savoir les groupes
méthyle, éthyle, n-propyle, i-propyle, n-butyle, sec.-butyle et tert.-butyle ;
les groupes acyle en C1-C5 comprennent les groupes aliphatiques à chaîne
hydrocarbonée linéaire ou ramifiée ayant de 1 à 5 atomes de carbone, à
savoir les groupes CH3CO, CH3CH2CO, CH3CH2CH2CO, (CH3)2CHCO,
CH3CH2CH2CH2CO, (CH3)2CHCH2CO, CH3CH2CH(CH3)CO et
(CH3)3CCO ; le groupe sulfate comprend le reste S03" que l'on rencontre
principalement sous la forme acide SO3H et, le cas échéant, sous une forme
salifiée telle que SO3NH4 ou SO3Na. Enfin le groupe Z peut représenter un
reste osyle, notamment un reste glucosyle, xylosyle, thioxylosyle,
fructosyle, mannosyle, etc.
Le groupe osyle, qui intervient dans la définition de R, peut être un
reste ose quelconque, notamment un des restes énumérés plus haut pour le
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
groupe pour Z. Avantageusement, les groupes R selon l'invention seront de
structure S1 ou S2, la structure S1 étant la préférée.
Parmi les composés de formule I conformes à l'invention, l'on peut
avantageusement citer :
s = la 5-[O-6-(D-glucopyranosyl)-[i-D-glucopyranosyl]oxy-2-(4-éthoxyphé-
nyl)-7-méthoxy-4H-1-benzopyran-4-one [autre nomenclature : 4'-éthoxy-
genkwanine-5-(D-glucosido)-3-D-glucoside] de formule la :
OCH2CH3
H3CO 0 \
CH2 - OH
0 (Ia)
O CH2 _0 HO
O 0 OH
OH
HO
OH
OH
lo qui est le produit le plus intéressant de l'invention ;
= la 5-0-[3-D-primevérosyl-genkwanine précitée de formule IIa :
OH
H3 CO 0 \
O (IIa)
CH2 -O HO
O 0 OH
HO OH
OH
OH
= le pinostrobine-5-glucoside précité de formule IIIa :
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
6
OH
H3 Co 0
-OH (IIIa)
0 CHQOIIO
HOH
= la 2,3-dihydro-5-[0-6-(D-glucopyranosyl)-~ -D-glucopyranosyl]oxy-2-
(4-éthoxyphényl)-7-méthoxy-4H-1-benzopyran-4-one [autre nomenclature :
4'-éthoxysakuranétine-5-(D-glucosido)-3-D-glucoside de formule Ib :
OCH2CH3
H3 CO 0 \
C:I2-OH
0 (Ib)
0 CH2 -0 HO
0 0 OH
HO OH
2OH
OH
qui est l'homologue du produit de formule la eu égard au remplacement de
la genkwanine par la sakuranétine,
= la 5-0-p-D-primevérosyl-sakuranétine de formule IIb :
OH
1 1
H3 CO eCH
p (IIb)
HO
O
0 OH
HO OH
OH
OH
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
7
et leurs dérivés où Z est un groupe sulfate (de préférence SO3H, ou le cas
échéant SO3Na voire SO3NH4).
Parmi les composés nouveaux selon l'invention, l'on peut citer plus
particulièrement les produits de formule IV :
Oz1
OH
H3 CO O PCH CH2IV)
O O HO
OH
OH
H
OH
dans laquelle symbole représente une simple ou une double liaison et Zr
a la même définition que Z ci-dessus et représente avantageusement un
groupe alkyle en Cl-C4 (de préférence le groupe éthyle) ou sulfate (de
1o préférence le groupe SO3H).
Les composés de formule I peuvent être préparés selon une méthode
connue en soi par application de mécanismes réactionnels et/ou processus
d'extraction classiques. A titre d'exemple : (i) on extrait la genkwanine, la
sakuranétine ou un de leurs osides à partir d'une plante appropriée
appartenant à l'ensemble des Prunus, Gnidia et Daphne ; (ii) on osyle en
position 5 l'aglycone avec un ose approprié (si nécessaire après blocage de
la fonction OH en position 4' si celle-ci n'est pas protégée), et/ou (iii) on
éthérifie (notamment au moyen d'un iodure d'alkyle pour ne pas affecter les
groupes OH de la portion sucre), estérifie ou sulfate le groupe 4'-OH de
l'oside extrait ou préparé comme indiqué ci-dessus (si nécessaire après
déprotection du groupe 4'-OH).
Le procédé, que l'on recommande selon l'invention pour préparer le
composé de formule la, est caractérisé en ce qu'il comprend les étapes
consistant à :
(1 ) extraire les racines broyées de Daphne gnidium avec CH2C12,
(2 ) filtrer pour écarter la solution de chlorure de méthylène, ainsi
obtenue, et recueillir le résidu solide que l'on sèche ;
(3 ) extraire ledit résidu solide sec, ainsi obtenu, avec CH3OH ;
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
8
(4 ) filtrer pour recueillir la solution méthanolique, ainsi obtenue, et
écarter le résidu solide résultant ;
(5 ) évaporer à sec la solution méthanolique, ainsi recueillie, sous
vide, à une température inférieure ou égale à 60 C, pour
obtenir un résidu solide ;
(6 ) laver le résidu solide, ainsi obtenu à l'étape (5 ), avec de l'eau à
une température inférieure ou égale à 60 C sous agitation, et
laisser refroidir ;
(7 ) éliminer l'eau de lavage puis reprendre le résidu solide avec
CH30H ;
(8 ) reproduire 3 à 7 fois le cycle des opérations des étapes (5 ) à
(7 ) jusqu'à ce que la dernière eau de lavage soit jaune pâle et
limpide ;
(9 ) reprendre le résidu sec résultant avec un mélange méthanol-eau
25/2 p/p selon une quantité appropriée pour obtenir un liquide
ayant une densité de 0,885 g/mL ;
(10 ) laisser reposer ledit liquide à 2-4 C, de préférence à 3 C,
pendant au moins 2 jours, de préférence pendant 3 jours, et
recueillir le précipité formé ;
(11 ) laver ledit précipité avec successivement du méthanol puis des
mélanges méthanol-éther ayant des teneurs croissantes en éther,
jusqu'à ce que le surnageant soit incolore ;
(12 ) filtrer le précipité, ainsi obtenu, et le laver plusieurs fois à
l'éther, jusqu'à ce que l'éther de lavage soit incolore ;
(13 ) filtrer et sécher le produit solide résultant qui est constitué d'un
mélange des produits de formules la, lia et IIIa ; et,
(14 ) si nécessaire, séparer ledit mélange pour recueillir le produit de
formule la.
De façon pratique, l'extraction de l'étape (1 ) est menée à chaud (i. e.
à une température de 30-35 C sous pression atmosphérique (~ 105 Pa) ou,
le cas échéant, à une température plus élevée sous pression réduite) pendant
3-6 jours (de préférence pendant 5 jours) dans un appareil de type
Kumagawa ; l'extraction de l'étape (3 ) est effectuée à chaud (notamment à
une température de 45-55 +C sous pression normale (;z~ 105 Pa) ou, le cas
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
9
échéant, à une température plus élevée sous pression réduite) dans le même
appareil pendant 3-6 jours (de préférence pendant 5 jours).
Eu égard aux modalités préférentielles sus-visées, on obtient à l'issue
de l'étape (13 ) un mélange Ia/IIa/IIIa selon un rapport pondéral d'environ
10/85/5 p/p.
En fonction des purifications entreprises par chromatographie, on
obtient à l'issue de l'étape (14 ) :
= un mélange la/IIa enrichi en la, notamment le mélange Ia/IIa 80/20
p/p, ou
= le composé de formule la essentiellement pur (i. e. ayant une pureté
supérieure ou égale à 98 %) ou plus purifié (i. e. ayant une pureté
supérieure ou égale à 99,5 %).
Les composés de formule I, et en particulier les composés nouveaux
de formule IV, sont utiles en cosmétique ou dermatopharmacie en tant
qu'agents améliorant la texture de la peau.
Administrés par voie topique, sous forme d'une solution, d'une
lotion, d'un gel ou d'une émulsion le cas échéant multiple (par exemple une
émulsion H/L/H ou L/H/L), les composés de formule I ou IV ont :
= une action favorable sur les effets du vieillissement de la peau,
notamment pour réduire les rides et assurer la fermeté et la souplesse
souhaitées pour la peau ;
= un effet anti-age permettant d'éviter l'injection de collagène ; et,
= un pouvoir de contrôle de l'hydratation de la peau.
En particulier, comme les composés de formule I ou, respectivement,
IV s'hydratent aisément en I.xH2O ou, respectivement, IV.xH2O (où x est
un nombre entier ou fractionnaire compris notamment entre 0,3 et 5), ils
servent, selon l'invention, dans l'épaisseur de la peau en tant que
régulateurs d'hydratation, soit en captant l'eau en excès, soit surtout en
apportant de l'eau quand la teneur en eau dans la peau est insuffisante.
Outre l'aspect cosmétique ou dermatologique précité, les composés
de formule I ou IV sont utiles en thérapeutique humaine et vétérinaire en
raison de leurs propriétés antiradicalaires pour traiter et surtout prévenir
les
désordres induits par les radicaux libres.
Lesdits désordres comprennent en particulier les pathologies induites
par une hyperproduction ou une production non contrôlée de radicaux libres
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
dans l'organisme, telles que les maladies myélodégénératives, le syndrome
maniaco-dépressif, et la démence sénile. Les composés de formules I ou IV
sont surtout intéressants en thérapeutique humaine avant que ces
pathologies ne deviennent irréversibles
5 Par ailleurs, tous les composés de formule IV, qui ont été testés en
vue de leurs propriétés immunomodulatrices, antiathéromateuses et anti-
cancéreuses, se sont révélés efficaces. La substance préférée selon
l'invention, qui est constituée par le produit de formule la ou les mélanges
Ia1IIa/IIIa (i. e. extrait de Daphne gnidium) et Ia/IIa précités, est
1o particulièrement active vis-à-vis de certains cancers et leucémies aiguës
(effet antiblastique, i. e. destruction des leucoblastes), et de la leucémie
myéloïde chronique.
Selon l'invention, l'on préconise une composition cosmétique (a),
dermatopharmaceutique (b) ou thérapeutique (c), qui est caractérisée en ce
que :
(a) la composition cosmétique renferme, en association avec un
excipient physiologiquement acceptable par voie topique, au moins
un composé de formule I ;
(b) la composition dermatopharmaceutique renferme, en association
avec un excipient physiologiquement acceptable notamment par
voie topique, au moins un composé de formule I ; ou,
(c) la composition thérapeutique renferme, en association avec un
excipient physiologiquement acceptable notamment par voie orale
ou injectable, au moins un composé de formule IV en tant
qu'ingrédient actif immunomodulateur, notamment vis-à-vis de
poussées récentes de sclérose en plaque, ou anticancéreux,
notamment vis-à-vis de la leucémie myéloïde chronique.
D'autres avantages et caractéristiques de l'invention seront mieux
compris à la lecture qui va suivre d'exemples de préparation et de résultats
3o d'essais cosmétologiques et pharmacologiques. Bien entendu, l'ensemble de
ces éléments n'est nullement limitatif mais est fourni à titre d'illustration.
Exemples
Quelques composés typiques de formule I ont été consignés dans le
tableau I ci-après avec des produits de comparaison (CP. 1 et CP.2).
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
11
Tableau I
Composés typiques selon l'invention
Exemple Structure
Ex. 1 mélange Iallla/IIIa 10/85/5 p/p
Ex. 2 produit de formule lia
Ex. 3 produit de formule Ma
Ex. 4 mélange IaIIIa 80/20 p/p
Ex. 5 produit de formule Ib
Ex. 6 produit de formule Ilb
Ex. 7 4'-sulfate du produit de formule Ib
Ex. 8 Produit de formule la
Ex. 9 4'-sulfate du produit de formule la
Ex. 10 mélange Ib/IIa/IIIa 10/85/5 p/p
CP.1 genkwanine
CP.2 sakuranétine
Préparation A
- Obtention du mélange IallIaIIlla 10/85/5 p/p (Ex. 1) -
11 kg de racines de Daphne gnidium (plante du bassin méditer-
ranéen de la famille des thyméléacées) sont broyés puis traités en continu
avec du chlorure de méthylène, à 30-35 C, pendant 5 jours dans un
1o appareil de type Kumagawa. La solution liquide ainsi obtenue est écartée et
on recueille le résidu solide que l'on sèche. On extrait ledit résidu, ainsi
séché, avec du méthanol à chaud ( 45-55 C) pendant 5 jours dans ledit
appareil de type Kumagawa. L'extrait méthanolique, obtenu après avoir
écarté le résidu solide, est traité de la façon suivante : évaporation à sec
sous pression réduite à une température inférieure à 60 C dans un ballon ;
lavage du résidu solide, ainsi obtenu, à l'eau chaude en agitant de façon à
décoller ledit résidu du fond du ballon ; refroidissement à la température
ambiante et élimination de l'eau de lavage ; et reprise du résidu dans du
méthanol. Cette succession de traitements est reproduite de 5 à 7 fois, selon
l'origine des racines, jusqu'à ce que la dernière eau de lavage soit limpide
et de couleur jaune pâle. Le résidu résultant est repris à chaud (45-55 C)
avec du méthanol contenant 8 % en poids d'eau, en quantité suffisante pour
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
12
obtenir un liquide ayant une densité de 0,885 g/mL. On laisse reposer
pendant 3 jours à 3 C puis récupère le précipité formé par centrifugation.
On lave ce précipité par fractions successives de méthanol puis de mélanges
méthanol/diméthyl éther (ou méthanol/diéthyl éther) de plus en plus riches
en éther. Quand le surnageant est enfin presque incolore, on filtre le
précipité et le lave plusieurs fois à l'éther jusqu'à ce que l'éther de lavage
soit incolore. On obtient un solide beige très clair que l'on sèche sous
pression réduite puis qui est broyé.
Ce solide est un mélange Ia/IIa/IIIa dans un rapport pondéral de
1o 10/85/5. Le rendement est de l'ordre de 2 à 3 % selon l'origine de la
plante
et la saison de la récolte des racines.
Analyse
Les composés de formules la, Ha et Ma étant de structures proches
(partie favonoide et partie saccharidique) ont de fortes similarités spectros-
copiques, en particulier en ultra-violet et en infra-rouge.
Spectre UV (dans mélange acétonirile-eau 80/20 v/v)
On observe deux bandes d'absorption à 331,7 et 261,7 nanomètres
(la bande à 261,7 nm ayant une intensité qui est d'environ la moitié
de celle de la bande à 331,7 nm).
Spectres IR (en pastille de KBr)
On observe les bandes suivantes :
- bande intense à 3374 cm-' (O-H de la partie sucre) ;
- bande intense à 1635 cm-' (bande de vibration du carbonyle de la
flavone) ;
- bande d'intensité moyenne à 1609 cm 1 (bande de vibration de la
double liaison éthylénique de la flavone) ; et
- bandes d'intensité moyenne à 1450 et 1360 cm-' (bandes de vibration
des parties aromatiques).
Préparation B
- Obtention du mélange Ia/Ila 80/20 p/p (Ex. 4) -
En soumettant le produit de l'exemple 1 à une chromatographie
séparative (HPLC), on obtient le mélange la/IIa 80/20 p/p.
Préparation C
- Obtention du produit de formule la (Ex. 8) -
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
13
En soumettant le produit de l'exemple 1 ou de l'exemple 4 à une
chromatographie séparative plus poussée, on obtient le composé de formule
la avec une pureté supérieure ou égale à 98 %, voire même avec une pureté
supérieure ou égale à 99,5 %.
Analyse
On a déterminé les spectre de RMN (à 250 Mhz en solution dans du
méthanol deutéré) et spectre de masse (par technique FAB). Les résultats
obtenus sont les suivants, où la lère unité sucre est celle qui est liée au
squelette flavone et la 2ème unité sucre est celle de structure Si ou S2.
Spectre RMN
- triplet centré à 1,31 ppm (groupe méthyle CH3 de la chaîne
phénolique alkylée) ,
- quadruplet centré à 3,20 ppm (groupe méthylène CH2 de ladite
chaîne alkylée) ;
- massif de 3,27 à 4,39 ppln (protons des deux unités sucre)
[attributions détaillées sur la base d'expériences COSY, HMQC et
HMBC à 600 Mhz, dont les deux protons anomères des deux unités
sucre, respectivement à 4,75 ppm (doublet) pour la 1ère unité liée en
position 5 à la flavone, et à 4, 27 ppm (doublet) pour la 2ème unité ;
pont -CH2-O- entre les deux unités sucre à 3,60 (d) et 3,93 (d) ppm ;
et -CH2- en 5 sur 2ème unité sucre à 3,32 (d) et 3,60 (d) ppm ; la
stéréochimie dans les deux unités sucre ayant été établie sur la base
des couplages proton-proton vicinaux en partant des protons
anomères] ;
- 3,87 ppm (CH3 du groupement CH3-O-) ;
- 6,60 ppm (proton éthylénique de la partie flavone) ;
- massif 6,91-6,94 ppm (4 protons aromatiques) ; et
- massif 7,82-7,86 ppm (2 protons aromatiques).
Spectre de masse
Masse moléculaire : 636,598 (C30H36015)
Pic de masse : 636 ; adduits de Na et K conformes.
La méthode de spectrométrie de masse a été également utilisée pour
confirmer les structures de formules la, lia et IIIa après acétylation de tous
les groupements O-H (par le mélange anhydride acétique/pyridine) ; il a été
procédé à l'analyse par spectrométrie de masse des produits d'acétylation
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
14
après purification chromatographique sur silice (éluant : eau/acétonitrile
50/50 v/v).
Préparation C bis
- Obtention des produits de formule IIa (Ex. 2) et de formule IIIa (Ex. 3) -
En soumettant le produit de l'exemple 1 à des chromatographies
séparatives plus poussées, on a isolé les produits de formule Ha (Ex. 2) et
de formule IIIa (Ex. 3) avec une pureté supérieure ou égale à 98 %.
Analyse (entreprise comme indiqué à la préparation C ci-dessus)
Spectre RMN de Ex. 2
Le spectre de RMN du produit de formule lia (Ex. 2) est identique à
celui du produit de formule la (Ex. 8) aux différences près suivantes :
- absence des signaux CH3 à 1,31 ppm et CH2 à 3,20 ppm de la chaîne
éthyle ;
- disparition des signaux à 3,32 et 3,60 ppm du CH2 en position 5 sur le
second sucre.
Spectre de masse de Ex. 2
Masse moléculaire : 578,519 (C27H30014)
Pic de masse : 578 ; adduits de Na et K conformes.
Spectre RMN de Ex. 3
Le spectre de RMN du produit de formule Illa (Ex. 3) est identique à
celui du produit de formule la (Ex. 8) à la différence près suivantes :
- simplification du massif correspondant aux protons de la partie sucre
avec un seul proton anomère à 4,76 ppm (d).
Spectre de masse de Ex. 3
Masse moléculaire : 446,404 (C22H22010)
Pic de masse : 446 ; adduits de Na et K conformes.
Préparation D
- Obtention du produit de formule lb (Ex. 5)
En reproduisant le procédé des Préparations A et C ci-dessus, à partir
de l'écorce ou des racines de Prunus yedoensis, on obtient le composé de
formule lb.
Préparation E
- Obtention du 4'-sulfate du produit de formule Ib (Ex.7) -
Le produit attendu est obtenu par sulfatation du groupe 4'-OH selon
une méthode connue en soi.
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
Essais F
La propriété d'améliorer la texture de la peau a été appréciée par le
biais de la régénération du tissu cutané après brûlure.
On rase une portion du dos de rats mâles adultes et applique sur cette
5 portion une platine métallique de 0,5 cm2 chauffée à une température de
130 C pour créer une zone de brûlure calibrée. On applique un gel
contenant 0 (lot témoin) ou 1,5 % en poids de produit de formule I (lots
traités) une fois par jour pendant 21 jours sur la brûlure des rats (8 animaux
par produit à tester, 10 animaux pour le lot témoin). On constate que, chez
10 les lots traités (Ex 1 à Ex 10), la régénération du tissu cutané est
obtenue en
1 mois ; en revanche chez le lot témoin, ladite régénération intervient en 6 à
8 semaines
Essais G
L'étude des propriétés antiradicalaires des produits selon l'invention
15 (Ex. 1 à Ex. 10) a été entreprise selon le procédé de "détermination du
potentiel de défense antiradicalaire", objet de la demande de brevet
français No. 03 12 351 déposée le 22 octobre 2003, en suivant la cinétique
de la lyse d'hématies (notamment des hématies de mouton ; il est également
possible d'opérer sur sang total ou plasma sanguin) induite par des radicaux
libres générés in situ, en présence d'un produit selon l'invention à des doses
croissantes de 0 mg/L (lot témoin) 'à 100 mg/L (lots traités), et avec
hydrolyse du milieu réactionnel au moyen d'un mélange d'enzymes (R-
glucosidase, sulfatase et P- glucuronidase). Selon ce procédé, on mesure en
particulier le temps (T1/2) qui correspond à la lyse de la moitié des cellules
concernées, ici les hématies, en fonction de la concentration (en mg/L) du
produit de formule I à tester.
Une partie des résultats obtenus est consignée dans la figure 1 ci-
après, dans laquelle la courbe 1 est celle du produit Ex. 1 ; la courbe 2,
celle
de Ex. 2 ; la courbe 3, celle de Ex. 3 ; et la courbe 4, celle de Ex. 4.
La figure 1 montre que Ex. 4 (i. e. le mélange Ia/IIa 80/20 p/p), qui
contient le composé la (i. e. Ex. 8) "contaminé" par le composé Ha (i. e.
Ex. 2), est plus actif en tant que substance antiradicalaire que Ex. 1, Ex. 2
et
Ex. 3.
Essais H
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
16
Des essais complémentaires ont été réalisés avec Ex. 10 et ses
constituants (Ex. 5, Ex. 2 et Ex. 3) sur des cellules sanguines humaines
[fournies pas EFS (Etablissements Français du Sang)].
Il s'agit de cellules sanguines isolées sur coussin de Ficoll et
s conservées sous vapeur d'azote liquide. Après décongélation, lesdites
cellules sont incubées pendant 24 h à 37 C avant l'addition des produits de
formule I à tester. Après nouvelle incubation à 37 C pendant 24 h ou 48 h,
les cellules sont analysées pour apprécier l'éventuelle expression de
marqueurs membranaires significatifs, selon le tableau II qui suit.
Tableau II
Analyses du matériel cellulaire Expression du marqueur
membranaire
Lymphocytes T CD3
Lymphocytes T cytotoxiques CD8
Lymphocytes T "helper" CD4
Lymphocytes B CD 19
Monocytes/macrophages CD 11 c
Activations cellulaires CD69
Surnageants cellulaires IL-2
Comme indiqué dans le tableau II, les surnageants cellulaires ont été
analysés pour leur contenu en interleukine 2 (IL-2), produit induisant la
prolifération des lymphocytes T, avec ou sans ajout d'un activateur
notamment (i) la phyto-hématoglutinine (PHA), qui est un activateur
classique, et (ii) un super antigène (SEB), qui induit une interaction entre
les molécules de classe II des lymphocytes B avec les récepteurs des
lymphocytes T ou TRC mimant de ce fait une présentation d'antigène
On observe deux points majeurs, à savoir :
(1) Ex. 10 et ses constituants, Ex. 5, Ex. 2 et Ex. 3, n'induisent pas la
prolifération des cellules sanguines de la réponse immunitaire ; et
(2) Ex. 10, Ex. 5, Ex. 2 et Ex. 3 sont actifs sur ces cellules et vont
interférer avec les cascades de signaux entraînant une réponse
immunitaire ; l'effet observé semble être immunosuppresseur avec
CA 02559377 2006-09-11
WO 2005/087786 PCT/FR2005/000596
17
une diminution de production d'anticorps pour les lymphocytes B,
une diminution des MHC de classe II pour les cellules
dendritiques et une inhibition de la production d'IL-2 (facteur
induisant la prolifération lymphocytaire) suite à la stimulation par
PHA ou SEB.
Les figures 2 et 3 montrent l'effet des produits Ex. 10, Ex. 5, Ex. 2 et
Ex. 3 sur la sécrétion de IL-2 induite par PHA (figure 2) et, respectivement,
par SEB (figure 3). En particulier la figure 3, d'une part, présente la
production (exprimée en pg/mL) de IL-2 par rapport à la concentration
(exprimée en pmol/mL) en SEB (courbe 11), SEB + Ex. 10 (courbe 12),
SEB + Ex. 5 (courbe 13), SEB + Ex. 2' (courbe 14) et SEB + Ex. 3 (courbe
15) et, d'autre part, montre l'effet des produits Ex. 10, Ex. 5, Ex. 2 et Ex.
3
sur la stimulation des cellules immunitaires.
En conclusion, les composés de formule IV, et notamment les produits des
exemples 1, 4, 8, 9 et 10 sont particulièrement intéressants eu égard à :
= leurs effets immunomodulateurs, notamment vis-à-vis de poussées
récentes de sclérose en plaque ;
= leurs effets immunosuppresseurs, notamment illustrés par inhibition
de l'activité des stimulants PHA et SEB sur la production de IL-2 ;
= leurs effets anti-blastiques (i.e. par destruction des leucoblastes) et qui
sont utiles dans le traitement de la leucémie myéloïde chronique et des
leucémies aiguës ;
= leurs effets contre certains cancers; et
= la quasi-absence d'effets secondaires néfastes quand ils sont
administrés par voie topique, orale ou injectable.
Chez l'homme adulte, la posologie recommandée pour les produits
de formule I. et de préférence les produits de formule IV, est de l'ordre de
50 mg/kg per os. Ces produits peuvent également être administrés par voie
locale sous forme de gels, pommades; onguents ou lotions ; dans cette
éventualité, la forme locale peut contenir de 1 à 5 % en poids de produit de
formule I, de formule IV ou d'un de leurs mélanges par rapport au poids de
ladite forme locale.