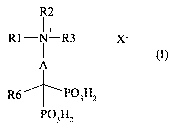Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
Composés bisphosphoniques pour empêcher ou limiter la fixation de
macromolécules, de microorganismes et d'un biofilm sur des surfaces solides,
notamment métalliques ou minérales .
L'invention concerne le domaine de la protection de surfaces solides, telles
que des
surfaces métalliques ou minérales, contre la contamination macromoléculaire et
microbiologique, en particulier la contamination bactérienne.
On entend par contamination microbiologique, la contamination par des
microorganismes.
L'invention concerne en particulier des nouveaux composés bisphosphoniques,
les
compositions anti-contamination les contenant, ainsi que leur utilisation pour
limiter la fixation de macromolécules et de microorganismes, en particulier de
bactéries, sur des surfaces, telles que des surfaces métalliques ou minérales.
Dans l'industrie alimentaire ou médicale, les surfaces représentent une source
importante de contamination bactériologique.
Par exemple, dans les industries utilisant des fermentations ou des réacteurs
comme
en biotechnologie, l'adsorption de macromolécules sur les parois des
conteneurs
peut conduire à la dénaturation de ces composés, ce qui a un effet délétère
dans le
cas de productions de protéines de haute valeur (comme des cytokines par
exemple)
au moyen de fermenteurs.
Dans d'autres situations, la couche polymérique formée peut être elle-même
potentiellement pathogène, comme dans le cas de prions adsorbés et
partiellement
dénaturés dont l'enlèvement complet de la surface est difficile à obtenir.
Les microorganismes, et en particulier les bactéries, sont susceptibles de
coloniser
des surfaces variées et de former de véritables communautés. Ces phénomènes de
colonisation de surface sont à l'origine de la formation du biofilm qui
constitue une
source importante de contamination microbiologique.
La formation des biofilms sur une surface implique différents phénomènes
successifs.
Le phénomène précurseur est la fixation ou encore l'adsorption de
macromolécules
par leur dénaturation et leur étalement au contact de la surface. Ces
macromolécules
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
polymériques sont de type protéique ou polyosidique, voire polyphénolique. De
manière générale, elles sont d'origine biologique, en particulier d'origine
bactérienne. En se fixant sur la surface, les macromolécules forment une
couche
polymérique potentiellement pathogène, comme dans le cas de prions adsorbés.
De nombreux micro-organismes tels que les protozoaires, les bactéries, les
champignons ou encore les algues, vont alors pouvoir se développer dans cette
couche polymérique par la présence de zones hydrophobes, de groupements amines
ou sulfures ou de sites mono ou polyosidiques. Une fois fixés, en conditions
favorables, ces micro-organismes vont non seulement se multiplier mais
également
sécréter d'autres polymères, construisant ainsi une matrice de type film, que
l'on
appelle biofilm. Ce film est connu par exemple pour être un facteur essentiel
de la
contamination des installations de climatisation par des légionelles,
permettant une
dissémination de ces germes en haute concentration.
En conditions particulières, comme en milieux marin ou fluvial, ce film
microbiologique va servir de support à des organismes pluricellulaires
végétaux ou
animaux conduisant à des films épais. Un exemple est celui de la contamination
des
coques de bateaux, conduisant à une augmentation importante de leur résistance
à
l'avancement.
De manière générale, l'ensemble de ces phénomènes est souvent connu sous le
terme fouling ou biofouling , ce qui peut se définir ainsi : ensemble
des
processus successifs conduisant à la colonisation de surfaces par des micro-
organismes voire des organismes pluricellulaires.
Un phénomène proche est celui des prothèses implantées, qui se recouvrent
rapidement des macromolécules présentes dans les milieux en contact, en
servant
ultérieurement de support à l'envahissement des cellules migrantes.
La structure du biofilm est en général poreuse et permet la circulation de
l'eau et de
nutriments qui permettent le renouvellement et le développement des colonies
de
microorganismes. Cette couche macromoléculaire permet également de protéger
les
microorganismes contres les agressions extérieures (biocides, antibiotiques,
antiseptiques) en ralentissant l'accès de produits biologiquement actifs vis à
vis des
cellules. Lors de l'étape d'adsorption macromoléculaire, différentes forces
2
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
d'attraction entrent en jeu selon le type de surface. Celles qui interviennent
généralement dans ce processus sont de type électrostatiques, ioniques, Van
Der
Waals, liaisons hydrogènes ou interactions hydrophobes. L'adsorption dépend
ainsi
des forces d'attraction ou de répulsion existant entre les macromolécules et
la
surface. En outre, il faut tenir compte de nombreux facteurs comme la tension
de
surface du support (modulée par la présence ou l'absence de tensio-actifs), ou
encore la répartition non uniforme des charges électriques sur la surface.
Après cette phase d'adsorption, la fixation proprement dite du microorganisme
dépend de son type, de l'importance de sa population dans le milieu, de la
durée de
sa phase de croissance, et de la déformation cellulaire. Cette dernière dépend
également du milieu de dispersion : température de la solution, pH,
concentration
en électrolyte et disponibilité des nutriments. Enfin, la force d'attachement
dépend
aussi de la charge de la surface et de la durée du contact.
Après fixation, les microcolonies se forment sur la surface. Leur croissance
puis
leur confluence aboutissent rapidement à la formation d'un enduit mince et
superficiel au départ, qui s'épaissit au fur et à mesure de la croissance
microbiologique jusqu'à atteindre quelques millimètres d'épaisseur : c'est le
biofilm. L'adhésion macromoléculaire est donc une étape primordiale dans le
processus de formation du biofilm.
Le biofilm le plus connu est probablement le biofilm dentaire, communément
appelé plaque dentaire, écosystème complexe de la cavité buccale de l'homme,
qui
est à l'origine des caries dentaires, des récidives de caries, des maladies
parodontales et des péri-implantites qui mettent en péril la longévité du
biomatériau.
Les agents chimiques biocides, tels que le chlore ou les anti-biotiques,
s'avèrent
souvent inefficaces ou insuffisants contre la formation du biofilm sur les
surfaces.
En effet, la chloration d'un biofilm n'atteint que la partie externe du
biofilm et
laisse intact une couche de bactéries capables de se développer rapidement à
nouveau. L'utilisation de chlore pour éliminer le biofilm n'est efficace que
si celui-
ci est éliminé manuellement de la surface.
3
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
Les antibiotiques ne sont pas non plus satisfaisants car ils sont susceptibles
d'entraîner la dissémination de gênes de résistance chez les microorganismes,
notamment les bactéries, les rendant ainsi peu à peu inactifs. Il est fréquent
de voir
des produits biocides actifs in vitro contre des bactéries isolées devenir
complètements inactifs contre des bactéries sessiles.
Par ailleurs, l'utilisation de molécules répulsives ne s'avère efficace que
pour les
organismes pluricellulaires évolués.
A l'heure actuelle, la recherche est donc orientée vers le développement de
produits
actifs contre les biofilms et non plus uniquement contre le développement des
microorganismes ou des bactéries eux-mêmes. Deux possibilités existent pour
lutter
contre la contamination des surfaces :
- Une action enzymatique directe permettant une dégradation de la structure
du biofilm facilitant ainsi son décrochage.
- Une limitation de l'adhésion des macromolécules sur les surfaces pour
empêcher le développement de colonies de microorganismes et faciliter le
nettoyage de ces surfaces.
Dans la présente invention, l'approche choisie consiste à rendre les
propriétés
physico-chimiques des surfaces solides, notamment les forces d'attraction de
ces
surfaces, défavorables à l'adhésion ou l'adsorption macromoléculaire, et donc
à
limiter voire empêcher la fixation de microorganismes, en particulier de
bactéries,
sur ces surfaces.
La difficulté de cette approche réside dans l'identification d'un composé qui
est
capable à la fois de se fixer ou de s'adsorber rapidement, efficacement et
durablement sur la surface à protéger, et qui empêche ou limite la fixation de
microorganismes sur cette surface, grâce à la création d'une interface entre
la
surface et le milieu extérieur, défavorable à l'adhésion et au développement
des
microorganismes.
Pour limiter l'adsorption des macromolécules, une voie connue est le
recouvrement,
par adsorption et/ou greffage, de polymères hydrophiles. L'agitation
brownienne de
leurs chaînes repousse les molécules susceptibles de s'adsorber. Dans cette
gamme
de molécules, se trouvent des polymères naturels comme certains polyosides
4
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
(dextrane par exemple) et des protéines (dont l'exemple le plus courant est
l'albumine) mais également des polymères synthétiques comme les
polyéthylèneglycols (PEG). Malgré ses avantages indéniables et son efficacité
prouvée, cet effet de brosse polymérique présente certaines limitations : la
densité
de surface ne doit être ni trop faible (dans ce cas, il existe des trous dans
la couche
et donc des possibilités d'adsorption) ni trop forte (les chaînes ne
présentent plus la
liberté suffisante pour avoir une agitation brownienne permettant de repousser
les
autres molécules). De plus, les interactions entre les macromolécules
immobilisées
et les molécules en solution, qu'elles soient de nature spécifique ou non,
doivent
être faibles. Ce point exclut de fait tous les polymères fortement chargés
électrostatiquement qui peuvent contracter des interactions fortes avec des
macromolécules de forte charge opposée. D'un point de vue pratique, la
réalisation
d'un revêtement aux propriétés convenables et durables dans le temps est en
général
difficile à mettre en oeuvre, en particulier pour des surfaces étendues. Des
moyens
pour arriver à obtenir des couches de propriétés convenables sont proposés
dans ce
brevet.
Depuis quelques années, il a été montré que des surfaces exprimant des
groupements phosphorylcholine en densité suffisante pouvaient limiter
considérablement l'adsorption de protéines (Biomaterials, 2002, 23, 3699-
3710).
Ceci a notamment été montré pour des liposomes à base de phosphatidylcholine
et
dans la protection de prothèses vasculaires recouvertes de polymères porteurs
de
groupements phosphorylcholine. De même, il est possible de réduire
considérablement l'adsorption de protéines sur des supports métalliques de
type
or en utilisant des molécules, comportant des groupements phosphorylcholine,
fixées sur le support par des groupements thiols. Le mécanisme en cause dans
ces
effets semble être lié à la forte hydrophilie intrinsèque de la
phosphorylcholine
greffée et à la présence d'un dipôle électrique, en absence de groupements
acide-
base de Lewis susceptibles de contracter des liaisons hydrogène. Cette
hypothèse
expliquerait que des molécules zwitterioniques comme des sulfobétaïnes soient
également susceptibles d'avoir un effet anti-adsorption.
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
Le brevet US 5,888,405 propose l'utilisation d'aminophosphonates pour modifier
les
propriétés superficielles et par là altérer le phénomène de biofouling.
Cependant, les
forces d'adsorption de phosphonates sur des supports métalliques types oxydes
de
fer sont relativement discrètes (J. Coll. Interface Sci., 238(1):37-42) et
laissent
entrevoir une action limitée.
Dans la littérature, il n'existe pas de molécule disponible limitant
l'adsorption
protéique et capable de se fixer fortement sur des supports comme l'acier,
l'aluminium, les calcaires ou le verre modifié.
L'invention vise à palier les inconvénients de l'art antérieur en proposant
des
composés et des compositions particulièrement efficaces et adaptées à la
réduction
du biofouling (au sens large du terme), selon différentes applications
possibles,
notamment pâtes et gels, solutions aqueuses, alcooliques ou organiques,
suspensions, mousses, poudres, aérosols ....
L'invention vise à définir le protocole de fabrication le plus adapté pour des
molécules efficaces dans ces applications.
L'invention vise également à fournir des compositions utilisant une quantité
efficace de composé actif, apte à lutter contre les contaminations
microbiologiques
de surfaces métalliques ou minérales.
L'invention vise en particulier à obtenir une composition comprenant un
composé
capable à la fois d'être un bon inhibiteur compétitif de la fixation des
protéines et de
se fixer efficacement et durablement sur les surfaces métalliques ou minérales
à
protéger.
L'invention propose ainsi de nouveaux composés capables de se fixer sur des
surfaces métalliques ou minérales et de limiter la fixation de
microorganismes, en
particulier de bactéries, et le développement de ceux-ci sur ces surfaces.
L'invention vise en particulier les compositions contenant ces nouveaux
composés
et leur utilisation contre la contamination microbiologique de surfaces
métalliques
ou minérales, dans le domaine odontologique (limitation de la formation de la
plaque dentaire, lutte contre la formation de caries et les maladies
parodontales) et
les domaines de l'hygiène hospitalière et de l'agro-alimentaire.
6
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
L'invention a pour premier objet les composés de formule (I) :
R2
1 +
R1-N-R3 X-
A
R6 P03H2
P03H2
(I)
dans laquelle :
- R6 représente un atome d'hydrogène, un atome d'halogène, un groupe alkyle en
Cl-C12, linéaire ou ramifié, un groupe -OH, une amine éventuellement
substituée
par un ou deux groupes alkyle en Cl-C4, linéaires ou ramifiés, ou un groupe -
A'-
N+RI'R2'R3', Xl-,
- Rl, Rl', R2, R2', R3 et R3' représentent indépendamment l'un de l'autre :
* un groupe alkyle en Cl-C12, linéaire ou ramifié, ou
* un groupe alkylammonium -(CH2)ri N+RR'R", X2 dans lequel n est un
entier compris entre 1 et 12 et R, R', et R" représentent indépendamment l'un
de
l'autre un alkyle en Cl à C4, linéaire ou ramifié,
- A et A' représentent indépendamment l'un de l'autre un groupe -(CH2)m Z-
(CH2)p dans lequel :
* m est un entier compris entre 0 et 12,
* p est un entier compris entre 0 et 12,
* m + p est un entier compris entre 0 et 12, et
*-Z- représente un atome d'oxygène, un atome de soufre, un groupe -
CR7R8R9-, un groupe -COO-, un groupe -CONR7- ou un groupe -NR7R8- dans
lesquels R7, R8 et R9 ont les mêmes significations que Rb, ou bien un groupe -
N+R4R5-, X3- dans lequel R4 et R5 représentent indépendamment l'un de l'autre
un
groupe alkyle en Cl-C12, linéaire ou ramifié,
- avec la condition que la molécule de formule (I) contient au moins deux
fonctions
ammonium quaternaires,
7
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
- et X, Xl, X2 et X3 sont des contre-ions pharmaceutiquement acceptables.
Le terme pharmaceutiquement acceptable signifie acceptable d'un point de vue
de la
toxicité.
Le terme atome d'halogène signifie un atome de fluor, de chlore, de brome
ou d'iode.
Les termes alkyle en Cl à C4 et alkyle en Cl à C12 signifient
respectivement
un alkyle comprenant 1 à 4 atomes de carbone et un alkyle comprenant 1 à 12
atomes de carbone. Un groupe alkyle en Cl à C4, linéaire ou ramifié, comprend
notamment les groupes méthyle, éthyle, n-propyle, isopropyle, n-butyle, sec-
butyle,
tert-butyle.
L'expression R7, R8 et R9 ont les mêmes significations que R6 signifie que
Rb,
R7, R8 et R9 représentent indépendamment l'un de l'autre un atome d'hydrogène,
un
atome d'halogène, un groupe alkyle en Cl-C12, linéaire ou ramifié, un groupe -
OH,
une amine éventuellement substituée par un ou deux groupes alkyle en Cl-C4,
linéaires ou ramifiés, ou un groupe -A'-1V}Rl'R2'R3', Xl- tel que défini
précédemment.
Ces composés sont particulièrement appropriés contre la contamination
microbiologique de surfaces métalliques ou minérales, pour les raisons
suivantes :
- ils sont non toxiques et biodégradables,
- ils ne sont pas nécessairement biocides,
- ils ne sont pas nécessairement bactériostatiques,
- ils présentent une haute affinité pour les surfaces métalliques (tels que
l'acier
inoxydable ou l'aluminium) ou minérales (tels que la surface dentaire),
- ils sont capables de se fixer rapidement, efficacement et durablement sur
les
surfaces à protéger,
- ils forment un film monomoléculaire auto-assemblé au contact de surfaces
métalliques ou minérales et créent ainsi une interface entre la surface
protégée et le
milieu extérieur, qui limite efficacement et durablement le développement de
biofilms sur ces surfaces,
- cette interface limite voire évite la dénaturation des macromolécules
habituellement à l'origine de la formation de biofilms au contact de la
surface.
8
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
Les composés de formule (I) comprennent deux groupements phosphoniques liés au
même atome de carbone (groupements bisphosphoniques ou gem-diphosphoniques)
qui permettent la fixation sur les surfaces solides à protéger, et une ou deux
chaînes
éventuellement ramifiées, liées également à ce même atome de carbone et
comprenant au moins deux fonctions ammonium quaternaire, situées l'une à la
suite
de l'autre sur la chaîne ou bien sur des chaînes ramifiées.
Les fonctions ammonium quaternaire ont deux rôles importants pour lutter
contre le
phénomène de contamination microbiologique :
- elles permettent de réduire la charge de surface qui est souvent très
négative
dans le cas de la dent ou de surfaces métalliques. Une faible charge
électrique est un facteur important de biocompatibilité,
- elles permettent une hydratation de la surface par une structuration de
l'eau
à l'interface avec le milieu extérieur. Cette hydratation permet de limiter
voire d'éviter la dénaturation des composés macromoléculaires.
Dans la formule (I), si R6 représente le groupe -A'-1V}Rl'R2'R3', Xl-, alors,
de
préférence, A'=A, Rl' = Rl, R2' = R2 et R3' = R3 et Xl- = K.
De manière préférée, R6 représente un atome d'hydrogène, un atome d'halogène,
un
groupe -OH ou une amine NH2.
De préférence, Z représente un atome d'oxygène, un atome de soufre, un groupe -
CR7R8R9-, un groupe -COO-, un groupe -CONR7- ou un groupe NR7R8- où R7,
R8 et R9 sont tels que définis précédemment. De manière encore plus préférée,
Z
représente un groupe 1V}R4R5-, X3- dans lequel R4 et R5 représentent
indépendamment l'un de l'autre un groupe alkyle en Cl-C12, linéaire ou
ramifié.
Avantageusement, Rl, R2, R3, R4 et R5 représentent indépendamment l'un de
l'autre
un groupe alkyle en Cl à C4, de préférence linéaire, tel que le groupe éthyle
ou
méthyle.
Encore plus avantageusement, Rl, R2, et R3 sont identiques et représentent
chacun
un groupe méthyle ou éthyle et R4 et R5 sont identiques et représentent chacun
un
groupe méthyle ou éthyle.
9
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
Avantageusement, X, Xl, X2 et X3 sont choisis parmi les ions iodure, chlorure,
bromure, fluorure, sulfonate, phosphate, phosphonate, ou tout ion
pharmacologiquement actif.
De préférence, les composés selon la présente invention sont choisis parmi
ceux
répondant à la formule (la) suivante :
R2
1+
R1-N-R3
~CH2)p
+
R4-N-R5 2 X-
I
CH2)m
R6 P03H2
P03H2
(la)
dans laquelle :
R6 représente -OH ou NH2,
m est un entier compris entre 1 et 12,
p est un entier compris entre 1 et 12,
- m + p est un entier compris entre 2 et 12,
Rl, R2, R3, R4 et R5 représentent indépendamment l'un de l'autre un groupe
alkyle en Cl-C4, linéaire ou ramifié, et
- X- représente un contre-ion pharmaceutiquement acceptable.
Chez les composés de formule (la), m est de préférence compris entre 3 et 7 et
p est
de préférence compris entre 1 et 4.
Avantageusement, Rl, R2, R3, R4 et R5 représentent indépendamment l'un de
l'autre
un groupe alkyle en Cl à C4, de préférence linéaire, tel que le groupe éthyle
ou
méthyle.
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
Rl, R2, et R3 sont de préférence identiques et représentent chacun un groupe
méthyle ou éthyle R4 et R5 sont de préférence identiques et représentent
chacun un
groupe méthyle ou éthyle.
Avantageusement, X est choisi parmi les ions iodure, chlorure, bromure,
fluorure,
sulfonate, phosphate, phosphonate, ou tout ion pharmacologiquement actif.
Selon un second aspect, l'invention a pour objet une composition pour hygiène
buccale par voie topique, comprenant au moins un composé de formule (I) tel
que
décrit ci-dessus, de préférence un composé de formule (la), de préférence en
association avec un ou plusieurs excipients pharmaceutiquement acceptables.
La composition comprend avantageusement entre 0,001 % et 10 % en poids du
composé de formule (I), de préférence entre 0,005 et 5 % en poids, encore plus
préférentiellement entre 0,01 % et 1 % en poids. La composition se présente
typiquement sous la forme d'un bain de bouche, d'un liquide à pulvériser,
d'une
pâte à dentifrice, d'un gel dentifrice, d'une pâte à appliquer, d'une poudre,
d'une
gomme à mâcher ou à appliquer ou d'une mousse.
La composition peut être appliquée sur les dents par diverses techniques
appropriées
notamment le brossage, la teinture, la pulvérisation, le bain de bouche, la
gomme à
mâcher, ou au moyen d'un accessoire dentaire comme un fil dentaire imprégné de
ladite
composition, une lingette éventuellement jetable imprégnée de ladite
composition ou
une éponge imprégnée de ladite composition. D'autres moyens d'application
possibles
sont connus de lhomme du métier.
Divers autres ingrédients peuvent être incorporés dans la composition, tels
que des
agents prophylactiques, des agents de polissage, d'autres surfactants, des
arômes,
des agents d'épaississement ou d'humectation appropriés. Il faut cependant
s'assurer
que ces agents n'empêchent pas la fixation souhaitée des polyphosphonates sur
les
surfaces dentaires.
Parmi les agents prophylactiques, on peut citer des composés limitant les
caries tels
que du fluorure de sodium, du fluorure de potassium, de l'hydrofluorure
d'hexylamine, mais également tous les antiseptiques et antibiotiques connus
pour
leur activité au niveau buccal. Typiquement, ces agents prophylactiques sont
11
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
présents en quantités suffisantes, par exemple pour fournir une concentration
en ion
fluorure de l'ordre de 0,5 à 2 % en poids de la composition.
Parmi les agents de polissage on peut citer des résines (produit de
condensation de
l'urée et du formaldéhyde), des particules de résines polymérisées par
chauffage
(voir US 3 070 510), des xérogels de silice (US 3 538 230), des particules de
silice
précipitées, le pyrophosphate de calcium, le métaphosphate insoluble de
sodium,
l'alumine hydratée, l'orthophosphate dicalcium, ces agents étant suffisamment
peu
abrasifs pour ne pas altérer de manière non souhaitée la surface de la dent ou
de la
dentine. Ces agents peuvent représenter par exemple 5 à 95 % en poids de la
composition.
Parmi les agents de gélification ou d'épaississement, on peut citer des gommes
naturelles, telle que la gomme arabique, le carboxyle cellulose de sodium,
l'hydroxyéthyl cellulose, représentant généralement 0,5 à 10 % de la
composition en
poids.
Lorsque la composition est sous forme d'un liquide buccal, elle contient
typiquement un alcool, un solubilisant, un agent de nettoyage non abrasif, et
lorsqu'elle est sous forme d'un gel elle comprend typiquement un agent
épaississant.
Parmi les humectants, on peut citer la glycérine, le sorbitol, le polyéthylène
glycol
et d'autres alcools polyhydriques, ces humectants pouvant représenter jusqu'à
environ 35 % du poids de la composition. Typiquement la composition peut
comprendre une phase liquide représentant 10 à 99% en poids et comprenant de
l'eau et un humectant en proportion variable.
Parmi les arômes, on peut utiliser éventuellement associés les huiles de
menthe, le
menthol, l'eugénol, l'orange, le citron, l'anis, la vanilline, le thymol, ces
agents
représentant généralement moins de 5 % en poids de la composition.
La composition peut comprendre en outre par exemple des agents sucrants
(saccharinate de sodium), des agents de blanchiment (dioxyde de titane ou
oxyde de
zinc), des vitamines, d'autres agents anti-plaque ( sels de zinc, dont citrate
de zinc, sels
de cuivre, sels d'étain, sels de strontium, allantoïne, chlorhexidine), des
agents
antibactériens (triclosan : 2',4,4'-10 / trichloro-2-hydroxy-diphényl éther),
des
agents anti-calculs (pyrophosphates de métal di et/ou tétra alcalins), des
agents
12
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
ajusteurs de pH, des agents colorants, des agents anti-caries (caséine, urée,
glycérophosphates de calcium, fluorure de sodium, fluorophosphate de
monosodium), des composés antitaches (polymères de silicone), des agents anti-
inflammatoires (salicylanilides substitués), des agents désensibilisants
(nitrate de
potassium, citrate de potassium). D'autres agents sont cités dans le brevet US
5
258 173.
Le pH de la composition est typiquement compris entre 5 et 10. Le pH sera
préférentiellement compris entre 5 et 7.
Exemple de composition pour une pâte ou un gel dentifrice (% en poids) :
- composé bisphosphonique de formule (I): 0,005 à 5 %
- agent abrasif : 10% à 50%
- agent épaississant : 0,1% à 5%
- agent humectant : 10% à 55%
- agent arôme : 0,04% à 2%
- agent sucrant : 0,1 % à 3%
- agent colorant : 0,01% à 0,5%
- eau : 2 à 45%.
Exemple de composition de gel non abrasif tel qu'un gel subgingival (% en
poids) :
- composé bisphosphonique de formule (I): 0,005 à 5 %
- agent épaississant : 0,1% à 20%
- agent humectant : 10% à 55%
- agent arôme : 0,04% à 2%
- agent sucrant : 0,1 % à 3%
- agent colorant : 0,01% à 0,5%
- eau : 2 à 45%.
Exemple de composition de bain de bouche (% en poids) :
- composé bisphosphonique de formule (I): 0,005 à 5 %
- agent humectant : 0 à 50%
13
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
- agent arôme : 0,04% à 2%
- agent sucrant : 0,1 % à 3%
- agent colorant : 0,01 % à 0,5%
- eau:45à95%
- ethanol : 0 à 25%
Une solution dentaire comprendra typiquement 90 à 99% d'eau. Une composition
de type chewing-gum comprendra typiquement une gomme de base (environ 80% à
99%), un agent arôme (environ 0,4% à 2%), un agent sucrant (environ 0,01 % à
20%).
L'homme du métier incorporera de manière appropriée et sans effort excessif
différents agents tels que cela est décrit dans le brevet US 6 132 702.
Pour préparer une composition dentifrice, on procède par exemple comme suit :
les
humectants tels que la glycérine, le propylène glycol, sont dispersés avec
l'agent
sucrant et l'eau dans un mélangeur, jusqu'à ce que le mélange devienne un gel
homogène. On ajoute alors un pigment, un ajusteur de pH le cas échéant, un
agent
anti-caries. Ces ingrédients sont mélangés jusqu'à obtenir une phase homogène,
à
laquelle on mélange alors un agent de polissage. Le mélange est alors
transféré dans
un mélangeur à haute vitesse, dans lequel un agent épaississant, un arôme, et
le
composé de formule (I) sont mélangés, sous pression réduite de 20 à 100 mm de
Hg. Le produit obtenu est une pâte semi-solide et extrudable.
La composition dentifrice est typiquement appliquée régulièrement, chaque jour
ou
tous les deux ou trois jours, d'une à trois fois par jour, à un pH d'environ 5
à 9 ou
10, en général entre 5,5 et 8.
La présente invention a également pour objet un procédé cosmétique pour
prévenir
l'apparition de la plaque dentaire ou limiter le développement de la plaque
dentaire
sur les dents, comprenant l'application d'une quantité efficace de la
composition
pour hygiène buccale telle que précédemment décrite, sur les dents. Une
quantité
efficace signifie une quantité permettant de limiter ou d'empêcher
l'apparition ou
le développement de la plaque dentaire.
14
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
La présente invention a également pour objet un médicament comprenant au moins
un composé de formule (I), de préférence (la), ou bien la composition buccale
précédemment décrite, notamment pour prévenir la formation des caries ou pour
prévenir les maladies parondotales.
Selon un troisième aspect, la présente invention a pour objet une composition
anti-
contamination destinée à empêcher ou limiter la fixation de macromolécules sur
les
surfaces solides, telles que les surfaces métalliques ou minérales, comprenant
au
moins un composé de formule (I) tel que décrit ci-dessus, de préférence au
moins
un composé de formule (la).
Dans le cadre de la présente invention, on entend par macromolécule, une
molécule
organique ayant une masse moléculaire relativement élevée (poids moléculaire
supérieur à 1000 Da) et pouvant servir de substrat pour la fixation et le
développement de microorganismes sur des surfaces solides. Ces macromolécules
sont notamment de type peptidique, protéique, polyosidique, polyphénolique,
lipidique ou acide nucléique.
En outre, la composition anti-contamination selon l'invention limite ou
empêche la
fixation des microorganismes, en particulier des bactéries, et ainsi, limite
ou
empêche la formation et le développement d'un biofilm sur les surfaces
solides,
notamment métalliques ou minérales.
Dans le cadre de la présente invention, le terme microorganisme désigne
notamment les bactéries, les virus et les prions.
Parmi les bactéries ciblées par ce type de composition, on peut citer
notamment,
Streptococcus (mutans, sanguis, pyogenes...), Salmonella, Listeria
monocytogenes,
Legionella, Vibrio cholerae, Lactobacillus, Porphyromonas, Staphylococcus
(aureus, epidermidis), Pseudomonas, Escherichia coli, Candida.
La composition anti-contamination comprend avantageusement entre 0,001 % et 10
% en poids du composé de formule (I), de préférence le composé de formule
(la),
de préférence entre 0,005 % et 5 % en poids, encore plus préférentiellement
entre
0,01 % et 1 % en poids.
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
Le pH de la composition est typiquement compris entre 5 et 10. Le pH sera
préférentiellement compris entre 5 et 7. Ce produit pourra être utilisé en
mélange en
tant qu'additif dans des formulations détergentes ou désinfectantes utilisées
dans
l'industrie.
Les agents chimiques les plus communément utilisés pour la fabrication de
détergents sont les agents tensio-actifs (ioniques, non ioniques ou
amphotères), les
agents chélatants, les alcalins et les solvants. Ces formulations peuvent
également
contenir des principes actifs de type antiseptiques, biocides, antibiotiques.
A titre d'exemple, le composé de formule (I) peut être incorporé dans une
formulation de composition suivante :
~ désinfectants (tels que le glutaraldéhyde, l'acide peracétique,
l'hypochlorite
de sodium...) représentant par exemple 0,01 % à 30 % en poids de la
composition,
~ agents tensio-actifs (tels que alcools gras étholés, propoxylés, des oxydes
d'amines, des condensats d'oxyde d'éthylène et de propylène, des sels
d'ammoniums quaternaires, des sulfates, des sulfonates et sulfosuccinates)
en représentant par exemple 0,01 % à 30 % en poids de la composition,
~ agents chélatants (par exemple 1'EDTA, iminodisuccianate de sodium, les
carbonates de soude, les ortho phosphates et les silicates, les phosphates
condensés) représentant par exemple 0,1 % à 5 % en poids de la
composition,
~ alcalins (carbonates, phosphates et silicates) représentant par exemple 0,1
%
à 40 % en poids de la composition,
~ solvants, miscibles à l'eau (alcools, glycol) ou non miscibles à l'eau
(dérivés
de térébentine, dérivés du pétrole), éventuellement ioniques, représentant
par exemple 0,1 % à 80 % en poids de la composition.
Les surfaces pouvant être protégées par la composition anti-contamination
selon
l'invention sont par exemple des surfaces métalliques telles que le fer,
l'acier
inoxydable, le chrome, l'aluminium, le zinc, le titane, le tungstène, le plomb
ou le
cuivre, ainsi que les alliages ou composites contenant au moins l'un de ces
métaux,
16
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
ou bien des surfaces minérales, telles que le silicium et ses dérivés, les
matériaux
silicieux, les surfaces calciques, céramiques ou dentaires.
L'application de la composition anti-contamination sur les surfaces à traiter
peut se
faire par trempage ou immersion de cette surface dans la composition, ou par
pulvérisation de la composition sur la surface à traiter. Elle peut se faire
aussi au
moyen d'accessoires, comme par l'emploi de lingettes éventuellement jetables
imprégnées de la composition.
La présente invention a ainsi pour objet l'utilisation des composés de formule
(I)
tels que précédemment décrits ou des compositions anti-contamination
microbiologique telles que précédemment décrites, pour limiter ou empêcher la
fixation de macromolécules, de microorganismes et de biofilm sur des surfaces
solides, notamment métalliques ou minérales.
Ces surfaces sont par exemple la surface de matériel industriel,
agroalimentaire ou
hospitalier, de bâtiments, de constructions ou de véhicules terrestres,
aériens ou
maritimes, de matériel de climatisation ou de réfrigération, ou bien sur la
surface
d'instruments chirurgicaux, de prothèses, d'instruments de dentisterie ou de
capteurs biologiques et médicaux.
Exemple de composition liquide anti-contamination microbiologique appliquée
par
trempage, rinçage, dépôt par chiffon humide ou par aspersion (% en poids):
- composé de formule (I) : 0,02 à 5 %
- eau:15à99%
- éthanol:0à85%
Dans la composition précédente, la présence d'alcool facilite le mouillage de
la
surface et l'homogénéité du revêtement. De plus, l'évaporation de l'alcool
permet
d'obtenir à la surface de très hautes concentrations facilitant une adsorption
rapide.
L'éthanol peut être avantageusement remplacée par des composés volatils
miscibles
à l'eau (alcools de C1 à C6 en particulier alcool isopropylique, aldéhydes,
cétones
dont acétone, éthers, ...) ou peu miscibles à l'eau (alcanes de C4 à C8 en
particulier).
17
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
Une telle composition ne laisse que peu de résidus solides après évaporation
des
liquides et est donc particulièrement indiquée lorsque la surface doit être
directement utilisée après application, en particulier pour les appareils et
instruments devant être au contact de la nourriture ou de l'organisme humain.
Exemple de composition de liquide de rinçage de surface (% en poids):
- composé bisphosphonique de formule (I) : 0,02 à 5 %
- agent humectant : 0 à 50 %
- agent odoriférant : 0,04 % à 2 %
- agent colorant : 0 à 0,5 %
- eau:15à99%
- éthanol:0à85%
Dans cette composition destinée à faciliter l'entretien de surfaces
esthétiques,
comme les feuilles inox dans les bâtiments publics, la présence d'agents
humectants, odoriférants voire colorants est prévue pour rendre l'application
plus
aisée mais également pour améliorer l'agrément esthétique (par exemple,
colorant
azurant).
Exemple de composition pour une pâte ou un gel (% en poids) :
- composé bisphosphonique de formule (I) : 0,02 à 5 %
- agent abrasif: 10%à50%
- agent épaississant : 0,1 % à 5 %
- agent humectant : 10 % à 55 %
- agent colorant : 0 à 0,5 %
- agent de contrôle du pH : 0 à 3%
- eau:2à60%.
Cette composition est spécialement destinée au récurage de surfaces fortement
encrassées, en particulier sur des surfaces verticales voire inversées.
Exemple de composition de type mousse (% en poids):
- composé bisphosphonique de formule (I) : 0,02 à 5 %
18
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
- agent tensioactif : 0 à 20 %
- agent épaississant : 0 à 20 %
- eau:25à50%
- éthanol : 0 à 25 %
- agent propulseur : 5 à 70 %
Dans cette composition, l'agent propulseur peut être un gaz liquéfié comme des
alcanes (propane ou butane), des fluorocarbonés (F14, F26, ...), des gaz sous
pression (C02, N2, ...) voire des liquides volatils. Cette formulation est
particulièrement avantageuse lorsque les pièces sont difficiles à atteindre
(intérieur
de tuyaux fins, échangeurs de chaleur, climatiseurs, ...). Elle est également
intéressante pour les usages avec de larges surfaces (fermenteurs en
biotechnologie,
salles de préparation ou de découpe en agro-alimentaire, ...).
Exemple de composition de type poudre (% en poids):
- composé bisphosphonique de formule (I) : 0,02 à 5 %
- agent tensio-actif : 5 % à 95 %
- agent complexant : 1 à 10 %
- agent diluant : 10 à 90 %
- agent humectant : 1 % à 5 %
- agent colorant : 0 à 0,5 %
- agent de contrôle du pH : 0 à 3%
Dans cette composition, la composition globale peut être celle d'une poudre de
lavage déjà connue de l'homme de l'art, à laquelle est rajouté le composé
bisphosphonique de formule (I). Cette formulation est particulièrement
avantageuse
comme agent de lavage pour les machines à laver la vaisselle, les machines à
laver
le linge.
Dans toutes les compositions précédentes, les composés bisphosphoniques de
formule (I) peuvent être utilisés soit seuls soit en association.
Exemple de composition pour recouvrement de prothèses (% en poids):
19
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
- composé bisphosphonique de formule (I) : 0,02 à 5 %
- agent complexant : 0 à 10 %
- agent de contrôle du pH : 0 à 3%
Dans cette composition, l'ajout d'agents complexant et de contrôle de pH est
destiné à assurer une fixation optimale du composé bisphosphonique de formule
(I). De plus, l'utilisation de composé bisphosphonique de formule (I) lié à
une ou
des molécules biologiquement actives, de type peptide, protéine, lipides,
glucides
ou acides nucléiques peut permettre une meilleure biocompatibilité, ou une
orientation de la réaction de l'organisme. Les prothèses concernées sont en
particulier les systèmes métalliques (acier inoxydable, nitinol, titane,
nickel-
chrome...) soit pour être au contact des tissus tout en restant extérieurs à
l'organisme (comme les prothèses dentaires ou auditives) soit implantables,
aux
niveaux vasculaire, osseux, implants dentaires...
Exemple de composition pour recouvrement de capteurs (% en poids):
- composé bisphosphonique de formule (I) : 0,02 à 5 %
- agent complexant : 0 à 10 %
- agent de contrôle du pH : 0 à 3%
Dans cette application également, l'utilisation de composé bisphosphonique de
formule (I) lié à une ou des molécules biologiquement actives, de type
peptide,
protéine, lipides, glucides, acides nucléiques ou autres permet de détecter un
objet
moléculaire, particulaire, cellulaire, viral... dont la concentration peut
être dosée.
Suivant les usages retenus, les compositions anti-contamination
microbiologique
selon l'invention sont typiquement appliquées après chaque utilisation (comme
par
exemple avec le matériel de chirurgie), après chaque cycle d'utilisation
(comme par
exemple avec le matériel de découpe industrielle de viande), régulièrement
lors de
l'entretien général (surfaces esthétiques) voire de manière unique.
La figure 1 représente l'activité (en Becquerel) des molécules
bisphosphoniques
modèles fixées sur le support en fonction du temps de contact.
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
~ pH=5
= pH=7
Aà, pH=9
x pH=11
La présente invention est illustrée par les exemples suivants.
A) Synthèse de composés selon la formule (I)
A-1) Etape 1
OH
Hg \
OH / \\
/N-H ~ H3 \ /--(CH2)b O
/-(CH2)a + N
/-(CH2)b O ~(CH2)a
H-N\
CH3 Br H-N
CH3
1 2 3
Cinq équivalents de la diamine 1 sont dissous dans un minimum d'acétonitrile.
On
ajoute ensuite goutte à goutte le bromoacide 2. Le mélange est agité de 3 à 24
h.
Séparation de l'excès de diamine par recristallisation ou par lavage à chaud.
Séchage.
Molécule 3 étape 1
b 3
a 1
rendement 98 %
ml (g) 9,Og
m2 (g) 4,Og
m3 (g) 3,2g
Dans l'étape 1, on peut aussi utiliser une diaminetétraméthylée de formule
(CH3)2
N-CH2-(CH2)â N(CH3)2 à la place de la diaminediméthylée 2. Dans ce cas, on
utilisera moins d'équivalents d'halogénure d'alkyle à l'exemple 3.
21
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
A-2) Etape 2
OH
HO
\ POgH2
(CH 2)b r_>~pO 3H2
(CH 2)b
HC-N 3 = H20 = PCI3 - H3C-N
(CH 2)a
(CH 2)a
N H
H3C~ /-NH
3C
3 4
Le produit de départ 3 est dispersé dans du chlorobenzène.
A ce mélange, 2.5 équivalents d'H20 sont ajoutés. Le mélange est chauffé à 40
C.
Par une ampoule à addition on ajoute ensuite le trichlorure de phosphore
goutte à
goutte.
Le mélange est porté à reflux pendant deux heures.
La réaction est stoppée par ajout d'un excès d'eau. Le produit 4 ainsi formé
est
porté à reflux (100 C) pendant deux heures.
La molécule 4 est purifiée par cristallisation dans l'éthanol.
Molécule 4 étape 2
b 3
a 1
rendement 50 %
m3 1,OOg
mPC13 1,26g
m4 0,85g
22
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
A-3) Etape 3
HO HO
PO3H2 PO3H2
r~~-
PO3H2
P03H2
(CH2)b r(CH2)b
H3C-N + NaOH = CH31 H3C-N CH3
(CH2)a (CH2)a
N
H3C~ H3C-N-CH3 , 2 I_
CH3
4 5
La molécule 4 est reprise dans un excès de CH3I auquel on ajoute trois
équivalents
d'hydroxyde de sodium anhydre. Le mélange est agité à l'abri de l'air et de la
lumière à reflux pendant 24 à 72 heures.
Le produit formé est condensé sous vide.
Molécule 5 étape 3
b 3
a 1
rendement 30%
ma 0,27g
mCIH3I 0,09g
m5 0,10g
L'étape 3 peut être aussi réalisée en faisant réagir un autre halogénure
d'alkyle à la
place du iodure de méthyle, comme par exemple du bromure de méthyle.
A-4) Autres synthèses
Par ailleurs, les molécules dont le nombre de fonctions ammonium quaternaires
est
supérieur à deux peuvent aisément être obtenues en additionnant des quantités
stoechiométriques de bromure de bromoalkyl-trialkylammonium sur un
23
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
aminoalkyldiphosphonate. Cette étape est suivie ou non d'une méthylation au
iodométhane suivant le degré de saturation de l'amine substituée.
Par exemple, des molécules comportant trois ou bien quatre fonctions ammonium
peuvent être synthétisées de la façon suivante :
CH
Br_ ÇH3 1+s
rH3C-N-CH.
NH CH3 H3C-N-CH3 1
Z 1 + (CHL2: 2 (CHZ)a
H3C-N-CH3
CHZ)b + 2 (
HO CHZ)a
H3CN+
P03HZ P03HZ
Br HO CHZ)b
HZ)b
PO3HZ PO3HZ HO
PO3H PO3HZ
CH s Br
Br- 1 +
H3C-N-CH3
NH2 CH (CHZ)a
H3C-N-CH3 ~
+
HO CHZ)b + 3 X(CH2)a _
N Br-
P03HZ P03HZ
Br HO CHZ)b b=[0 ; 11]
a = [0 ; 10]
PO3HZ PO3HZ
D'une façon générale, l'homme du métier saura préparer sans difficulté les
composés de formule (I) en faisant à appel à des synthèses classiques et bien
connues de celui-ci.
B) Fixation de molécules bisuhosuhonigues sur support d'hydroxyauatite
Des tests ont été réalisés sur des molécules modèles radiomarquées afin de
mettre en
évidence la capacité des molécules bisphosphoniques à se fixer rapidement et
de façon
24
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
homogène sur des surfaces minérales. Ces tests réalisés dans des conditions de
pH
différents ont permis de mettre en évidence une cinétique de fixation rapide
des acides
bisphosphoniques sur des surfaces minérales (hydroxyapatite).
B-1) Matériel et méthodes
B-1-1) Solutions
Des solutions aqueuses d'acides bisphosphoniques radiomarqués à l'iode 125 ont
été
préparées à des concentrations de 0,1 mo1.L-1 et 0,01 mo1.L-1. Le pH de ces
solutions a été
ajusté à 5, 7, 9 et 11 grâce à des solutions molaires en HC1 et NaOH. Chaque
solution a
reçu une quantité de molécules radiomarquées correspondant à 5. 108 Bq/mL.
B-1-2) Surface
Les surfaces servant de support aux composés bisphosphoniques consistent en de
la
poudre d'hydroxyapatite (CIHT Ceramic hydroxyapatite, phosphate de calcium
(Ca5(P04)301-1)2, Biorad, France). Cette surface est conditionnée en tubes à
hémolyse à raison de 14 mg par tube.
B-1-3) Recouvrement des surfaces
Les molécules servant au recouvrement des surfaces sont des composés
bisphosphoniques de synthèse dont la structure est la suivante :
/ OH
OH
POgH2
NH
r--_ ~ 125
POgH2
O
Ces molécules ont été choisies comme modèle de fixation des acides
bisphosphoniques
sur des surfaces métalliques et minérales à cause de leur similarité de
structure
(présence d'un groupe bisphosphonique et d'un atome d'azote), mais aussi pour
leur propriété physicochimiques (solubilité dans l'eau importante, adsorption
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
rapide sur les surfaces considérées) similaires à celles des molécules
correspondant
à la formule générale (I).
Un volume de 200 L de solution de recouvrement est ajouté à chaque tube
contenant les surfaces. Un témoin est réalisé en utilisant 200 L d'eau
distillée
stérile (pH 6,8 0,2). Les temps d'incubation utilisés pour la fixation des
molécules
de composés bisphosphoniques sont de 30 secondes, 5 minutes ou 1 heure. Le
surnageant est ensuite éliminé en prenant soin de ne pas aspirer les
particules de
surface, puis deux cycles rinçage/décantation/élimination du surnageant sont
effectués à l'aide de 3 mL d'eau distillée.
B-1-4) Dénombrement des molécules fixées
Après élimination des eaux de rinçage, la radioactivité gamma émise lors de la
désintégration de l'125I présent sur les composés bisphosphoniques fixés à la
surfaces des billes d'hydroxyapatite est comptée grâce à un appareil Cobra 2
autogamma counting system (Packard Bioscience Company, France).
B-2) Résultats
Les résultats sont exprimés en fonction du pH. L'activité en Becquerel est
mesurée
en fonction du temps de mise en contact, et ce pour une concentration en
composé
bisphosphonique de 0,1 mol/L. Les résultats sont représentés sur la figure 1.
On note une forte influence du pH, à la fois sur la cinétique de fixation et
sur la
quantité de produit fixé par unité de surface. On note que la cinétique de
fixation
atteint rapidement une phase de plateau puisque dès les cinq premières minutes
de
mise en contact on note que la surface disponible est presque intégralement
recouverte. Par ailleurs, le pH a une influence importante sur la charge de la
molécule et entraîne une répulsion électrostatique importante aux pH élevés,
ce qui
explique les plus faibles taux de recouvrement observés à pH 9 et 11.
Le pH préférentiel d'utilisation des composés bisphosphoniques pour recouvrir
une
surface est donc compris entre 5 et 7.
26
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
C) Prévention de la contamination de surface
C-1) Matériel et méthodes
C-1-1) Surfaces
Les surfaces servant de support au biofilm consistent en de la poudre
d'hydroxyapatite (CHT Ceramic hydroxyapatite, phosphate de calcium
(Ca5(P04)30H)2, Biorad, France). La granulométrie de la poudre
d'hydroxyapatite
(HAP) est de 80 8 m et la surface développée de 72 cm2.g 1.
Cette surface est conditionnée en tubes à hémolyse à raison de 14 mg par tube.
La
quantité correspondante de particules de surface par tube est de 5000. Avant
utilisation, elles sont stérilisées par chaleur sèche (four Tau, Italie) à 180
C pendant
2 heures.
C-1-2) Molécules de recouvrement
Les molécules servant au recouvrement des surfaces sont des acides
bisphosphoniques de synthèse. La molécule utilisée est la molécule A,
synthétisée à
l'exemple A et de formule suivante :
HO
P03H2
PO3H2
r~3
+
HgC-N-CHg
H3C-N CH3 , 2 I
I
CH3
(A)
Des solutions sont préparées à 0,1 mo1.L-1 (pH 4,8) et stérilisées par
filtration sur
filtre 0,2 m (Minisart, Sartorius, France).
27
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
C-1-3) Salive arNficielle
Afm de reproduire l'environnement buccal, le modèle de salive suivant a été
formulé (d'après Hutteau & Mathlouti, 1998) :
Salive artificielle : NaHC03 5,208 g.L-1; KIH2P04, 3H20 1,369 g.L-1; NaC1
0,877
g.L-1; NaN3 0,500 g.L-1; KC10,477 g.L-1; CaC12, 21-120 0,441 g.L-1, mucine à
2,16
g.L-1 et alpha amylase à 200 000 UI.L-1.
La salive artificielle est ajustée à pH isotonique (pH 7) et stérilisée par
filtration sur
filtre 0,2 m (Minisart, Sartorius, France).
C-1-4) Souche bactérienne
L'étude est menée sur un modèle de bactéries cariogènes : Streptococcus mutans
ATCC 25175D (LGC Promochem, Molscheim, France). Streptococcus mutans est
un constituant de la plaque dentaire et un agent étiologique majeur de la
carie
dentaire.
La souche est conservée en aliquots à-80 C. Elle est remise en culture par
transfert
d'une pointe de pipette de 2 mL vers un tube de 10 mL de bouillon Schaedler
(Bio
Mérieux, France) et incubation à 37 C pendant 24 heures. L'absorbance d'une
dilution au 1/20ème de la solution mère obtenue est mesurée à 600 nm puis elle
est
diluée en salive artificielle (préparée comme indiqué en C-1-3.) de façon à
obtenir 3
mL de suspension ajustée (SA) à environ 5.106 unités formant colonies (ufc)
dans
100 L.
C-1-5) Recouvrement des surfaces
Un volume de 200 L de solution de recouvrement (C-1-2) est ajouté à chaque
tube
contenant les surfaces (C-1-1). Un témoin est réalisé en utilisant 200 L
d'eau
distillée stérile (pH 6,8 0,2). Le temps d'incubation utilisé pour la
fixation des
molécules bisphosphoniques est de 3 minutes à 37 C. Le surnageant est ensuite
éliminé en prenant soin de ne pas aspirer les particules de surface, puis deux
cycles
rinçage/décantation/élimination du surnageant sont effectués à l'aide de 3 mL
d'eau
distillée stérile.
28
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
C-1-6) Formation du biofilm
Un volume de 3 mL de salive artificielle (C-1-3) est ajouté aux tubes
contenant les
surfaces recouvertes (témoins et essais). Immédiatement après, un volume de
100 l
de la suspension bactérienne ajustée (C-1-4) est inoculé dans les tubes. Les
tubes
sont incubés pendant 4 à 24 heures à 37 C.
C-1-7) Dénombrement des bactéries du biofilm
Les particules colonisées sont lavées afin d'éliminer les bactéries non
adhérentes en
réalisant trois cycles rinçage/décantation/élimination du surnageant (en
prenant soin
de ne pas aspirer les particules de surface) à l'aide de 3 mL d'eau
physiologique.
Les particules de surface sont remises en suspension dans 1 mL d'eau
physiologique et traitées par ultra-sons afin de détacher les bactéries
adhérentes
(Branson 1200, 47 KHz, 95 W, 5 minutes, Bransonic, USA). La suspension
bactérienne obtenue est dénombrée par dilutions décimales en eau physiologique
et
étalement de 100 l des dilutions -1 et -2 sur gélose au sang. La numération
est
réalisée après 48 à 72 heures d'incubation à 37 C. Le nombre de bactéries est
exprimé en ufc pour 14 mg d'hydroxyapatite.
C-2) Résultats
C-2-1) Prévention de la contamination bactérienne
Le recouvrement des surfaces HAP est réalisé pendant 3 minutes avec la
solution à
tester. Les surfaces HAP sont ensuite incubées de 4 à 24 heures avec une
solution
bactérienne.
Le tableau 1 rassemble les résultats obtenus montrant la colonisation
bactérienne en
fonction du temps pour des surfaces d'hydroxyapatite recouvertes ou non par
les
composés bisphosphoniques (respectivement essai et témoin). Pour l'analyse
statistique les nombres d'ufc ont été transformés en 10Log pour obtenir une
distribution normale des résultats. Le test de Student a été utilisé pour
évaluer la
signification des valeurs dans les deux expérimentations (tableau I).
29
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
Tableau I. Valeurs moyennes des dénombrements de Streptococcus mutans
adhérant à l'hydroxyapatite
Temps (heures) 4 8 15 24
Témoin (T) 5,19 f 0,25 5,73 f 0,18 7,18 f 0,40 7,04 f 0,25
Essai (E) 4,72 0,19 4,98 0,32 5,02 0,24 5,07 0,30
Diminution 10 0,47 0,75 2,16 1,97
Probabilité P 0,060 0,024 0,001 0,001
Essai : hydroxyapatite (IIf1P) recouverte par les composés bisphosphoniques.
Témoin :
IIf1P non recouverte. Données exprimées en log du nombre d'ufc pour 14 mg de
IIf1P (n =
6).
Dans les deux cas, une croissance du biofilm est observée, mais le profil des
courbes de colonisation n'est pas similaire. Le nombre de bactéries colonisant
les
surfaces d'hydroxyapatite est plus élevé pour le témoin. La différence de
colonisation est significative dès 6 heures et après 8, 15 et 24 heures
d'incubation (P
< 0,05). Ainsi, après 15 heures, le nombre de bactéries recouvrant les
surfaces HAP
recouvertes par les composés bisphosphoniques diminue d'un facteur 100.
D) Evaluation de l'activité bactéricide de la molécule A
D-1) Principe
L'activité bactéricide de la molécule A est évaluée selon le protocole de la
norme
NF EN 1040 modifié de façon à prendre en compte les conditions pratiques
d'emploi. Les conditions retenues sont les suivantes : souche cible
Streptococcus
mutans, milieu eau physiologique, température 37 C, temps de contact 5
minutes.
D-2) Matériel et méthodes
D-2-1) Solutions de la molécule A
Une solution mère à 2.10-1 mo1.L-1 (pH ajusté à 6,0 0,1) est préparée et
stérilisée
par filtration sur filtre 0,2 m (Minisart, Sartorius, France). Puis une gamme
de
solutions est réalisée par dilutions en eau distillée stérile, soit, 10-1,
2.10-2 et 10-2
mo1.L-1.
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
D-2-2) Souche bactérienne
Les essais sont réalisés avec le modèle de bactéries cariogènes choisi pour
l'étude
sur biofilm : Streptococcus mutans ATCC 25175D (LGC Promochem, Molscheim,
France).
La souche est conservée en aliquots à-80 C. Elle est remise en culture par
transfert
d'une pointe de pipette de 2 mL vers un tube de 13 mL de bouillon Schaedler
(Bio
Mérieux, France) et incubation à 37 C pendant 24 heures.
L'absorbance d'une dilution au 1/20ème de la solution mère obtenue est mesurée
à
600 nm puis elle est diluée en eau physiologique ou en salive artificielle de
façon à
obtenir 3 mL de suspension ajustée (SA) à environ 10' unités formant colonies
(ufc)
dans 100 L.
D-2-3) Mesure de l'activité bactéricide
Pour chacune des concentrations de molécules testées, 2 tubes sont remplis
avec
900 L d'eau physiologique. Puis 100 L de SA préparée dans le milieu sont
ajoutés immédiatement avant essais. Enfin au temps To, 1 mL de la
concentration de
molécules ou d'eau distillée stérile (témoin) est ajouté dans les tubes. Ceux-
ci sont
incubés à 37 C pendant 5 minutes 15 secondes. La gamme de concentration de
molécules au contact avec les bactéries est donc la suivante : 10-1, 5.10-2,
10-2 et
5.10-3 mo1.L-1. Après incubation le nombre de bactéries présentes dans les
tubes est
déterminé par dilutions décimales en eau physiologique (Bio Mérieux, France)
et
étalement de 100 l des dilutions -2, -3 et -4 sur gélose au sang (Columbia +
5% de
sang de mouton, Bio Mérieux, France). La numération est réalisée après 48
heures
d'incubation à 37 C. Le nombre de bactéries est exprimé en ufc par mL.
D-3) Résultats
Le tableau II rassemble les résultats obtenus pour le milieu eau
physiologique.
31
CA 02588832 2007-05-22
WO 2006/053910 PCT/EP2005/056120
Tableau II. Résultats des essais de mesure de mesure de l'activité bactéricide
de la
molécule A sur S. mutans ATCC 25175D en eau physiologique
Concentratio Concentration ufc par log10 ufc par
n en mo1.L-1 en mg.L-1 mL mL
(ppm)
0,1 51900 2,76.10 6,44
0,05 25950 1,93.10 6,29
0,01 5190 2,56.10 6,41
0,005 2595 2,57.10 6,41
0 (témoin) 0 2,91.10 6,46
Aucune diminution significative de la population bactérienne n'est observée
dans
les tubes contenant la molécule comparativement au tube témoin. La molécule ne
présente donc pas d'activité bactéricide à la concentration maximale testée
soit 10-1
mo1.L-1'
32