Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02689116 2009-11-30
WO 2009/004171 1 PCT/FR2008/000739
DERIVES DE 1-BENZYLPYRAZOLE, LEUR PREPARATION ET LEUR
APPLICATION EN THERAPEUTIQUE
La présente invention se rapporte à des dérivés de 1-benzylpyrazole, à leur
préparation et à leur application en thérapeutique.
Des dérivés de 1-benzylpyrazole sont connus dans la littérature, notamment le
brevet européen EP-B-868 420 et son équivalent américain US 5 925 768
décrivent
des composés de formule :
R3 COX1
6
gs / ~N
N W2
r I
\ 4~ ~ W3 (A)
g4 g2 I
g3 r5
W5 W4
W5
Ces composés présentent une affinité pour les récepteurs CB2 humains.
La demande de brevet FR 2 887 550 décrit des composés de formule
rl
I CH2-CO-Nr6r7
I N
N r4
r2 I rs
r3 CH2
qui sont des ligands des récepteurs aux cannabinoides CB2.
On a maintenant trouvé des composés antagonistes des récepteurs aux
cannabinoïdes CB2 qui présentent un bon passage de la barrière intestinale.
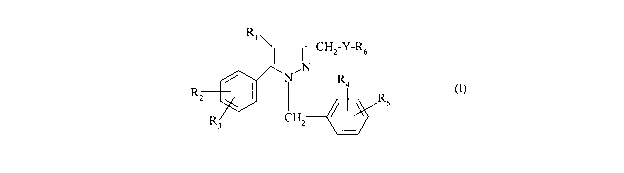
La présente invention a pour objet des composés répondant à la formule (I)
CA 02689116 2009-11-30
WO 2009/004171 2 PCT/FR2008/000739
R1
I I CH2-Y-R6
N
/ N~ R4
RZ I I R (1)
s
R CHZ
3
3
dans laquelle :
- Y représente un groupement choisi parmi :
i) -N(R7)CO-,
ii) -N(R7)CO-N(R7)-,
iii) -OCO-,
iv) -N(R7)S(O)n
- R1 représente un atome d'hydrogène ou un groupe (C1-C4)alkyle ;
- R2 et R4 représentent chacun indépendamment l'un de l'autre un atome
d'hydrogène
ou d'halogène, un groupe (C 1 -C4)alkyle, (C 1 -C4)alcoxy ou trifluorométhyle
;
- R3 et R5 représentent chacun indépendamment l'un de l'autre un atome
d'halogène
ou un groupe (C 1 -C4)alkyle, (C 1 -C4)alcoxy, trifluorométhyle,
trifluorométhoxy,
cyano ou S(O)mAlk;
- R6 représente un groupe choisi parmi :
. un groupe (C 1-C6)alkyle non substitué ou substitué une ou plusieurs fois
par un
ou plusieurs substituants choisis indépendamment parmi un atome d'halogène ou
un groupe hydroxy, (C 1-C4)alcoxy ou trifluorométhoxy ;
un phényle non substitué ou substitué une ou plusieurs fois par Rg ;
un benzyle ou benzhydryle ;
un radical hétérocyclique choisi parmi : thiényle, furyle ou pyrrolyle,
lesdits
radicaux étant non substitués ou substitués par un atome d'halogène, un groupe
(C 1 -C4)alkyle ou trifluorométhyle ;
. un radical carbocyclique non aromatique en C3-C 12, non substitué ou
substitué
une ou plusieurs fois par un atome d'halogène ou un groupe (C 1-C4)alkyle, (C
1-
C4)alcoxy, hydroxy ou cyano ;
. un groupe (C3-C7)cycloalkylméthyle, non substitué ou substitué sur le
cycloalkyle par un ou plusieurs groupes (C 1-C4)alkyle ;
. un groupe aryloxyméthyle non substitué ou substitué sur le méthyle par un ou
deux groupes alkyles, dans lequel le terme aryloxy représente un groupe
phénoxy
non substitué ou substitué une ou plusieurs fois par Rg ;
- R7 représente un atome d'hydrogène ou un groupe (C1-C4)alkyle ;
CA 02689116 2009-11-30
WO 2009/004171 3 PCT/FR2008/000739
- R8 représente un atome d'halogène ; un groupe (C I-C4)alkyle ;
trifluorométhyle ;
cyano ; (C 1 -C4)alcoxy ; trifluorométhoxy ; phényle ; (C3-C7)cycloalkyle ou
NHS(O)nAlk;
- n représente 1 ou 2;
- m représente 0, 1 ou 2;
- Alk représente un (C 1-C4)alkyle.
Les composés de formule (I) peuvent exister à l'état de bases ou de sels
d'addition à des acides. De tels sels d'addition font partie de l'invention.
Ces sels sont avantageusement préparés avec des acides pharmaceutiquement
acceptables, mais les sels d'autres acides utiles, par exemple, pour la
purification ou
l'isolement des composés de formule (I) font également partie de l'invention.
Les composés de formule (I) peuvent également exister sous forme d'hydrates ou
de solvats, à savoir sous forme d'associations ou de combinaisons avec une ou
plusieurs molécules d'eau ou avec du solvant. De tels hydrates et solvats font
également partie de l'invention.
De plus, les composés de formules (I) selon l'invention, tels quels ou sous
forme
radiomarquée peuvent être utilisés comme outils pharmacologiques chez l'homme
ou
l'animal pour la détection et le marquage de récepteurs aux cannabinoides CB2.
On
peut citer en particulier les composés (I) comportant un ou plusieurs atomes
marqués
choisi parmi 3H, iiC, 14C, 18F~ 35S, 76Br, 1231, 125I, et 131I.
Les composés de formule (I) peuvent comporter un ou plusieurs atomes de
carbone asymétriques. Ils peuvent donc exister sous forme d'énantiomères ou de
diastéréoisomères. Ces énantiomères, diastéréoisomères, ainsi que leurs
mélanges y
compris les mélanges racémiques font partie de l'invention.
Dans le cadre de la présente invention, on entend par :
- un atome d'halogène : un fluor, un chlore, un brome ou un iode, le chlore et
le fluor
étant préférés ;
- un groupe (C 1-C4)alkyle ou (C 1-C6)alkyle : un groupe aliphatique saturé
linéaire ou
ramifié respectivement en C1-C4 ou en C1-C6. A titre d'exemples, on peut citer
les
groupes méthyle, éthyle, propyle, isopropyle, butyle, isobutyle, sec-butyle,
tert-
butyle, ainsi que les groupes pentyle, isopentyle, hexyle, isohexyle, pour les
groupes alkyles en (C I -C6) ;
- un groupe (C 1-C4)alcoxy : un radical O-alkyle où le groupe alkyle est tel
que
précédemment décrit ;
- un radical carbocyclique non aromatique en C3-C 12 : un radical monocyclique
ou un
radical di- ou tricyclique condensé ou ponté ; par radical monocyclique on
entend
CA 02689116 2009-11-30
WO 2009/004171 4 PCT/FR2008/000739
un cycloalkyle, c'est-à-dire un groupe alkyle cyclique par exemple
cyclopropyle,
cyclobutyle, cyclopentyle, cyclohexyle, cycloheptyle, les radicaux
cyclopentyle,
cyclohexyle et cycloheptyle étant préférés ; par radical di- ou tricyclique
condensé
ou ponté, on entend par exemple le bicyclo[2.2. 1 ]heptyle, le
bicyclo[2.2.2]octanyle,
le bicyclo[3.2. 1 ]octanyle, l'adamantyle.
Au sein des composés de formule (I) selon l'invention, on distingue :
- les composés de formule (IA) dans laquelle Y représente un groupe -N(R7)CO-;
- les composés de formule (IB) dans laquelle Y représente un groupe
- N(R7)CON(R7)-;
- les composés de formule (IC) dans laquelle Y représente un groupe -OCO- ;
- les composés de formule (ID) dans laquelle Y représente un groupe -
N(R7)S(O)n-.
Parmi les composés de formule (I), objet de l'invention, on peut citer les
composés préférés qui se définissent comme suit :
- RI représente l'hydrogène ;
- R2 et R3 représentent un atome de chlore en 3 ou en 4, un groupe
trifluorométhyle
en 4, ou deux atomes de chlore en 3 et 4;
- R4 et R5 représentent un atome de chlore en 2, 3 ou 4, un groupe
trifluorométhyle en
4, ou un atome de chlore en 3 et un groupe méthyle en 4.
Parmi les 4 familles de composés, celles de formule (IA) et de formule (ID)
sont
préférés.
Au sein des composés de formules (IA) et (ID), on préfère les composés dont
les
substituants ont les définitions suivantes :
- RI représente l'hydrogène ;
- R2 et R3 représentent un atome de chlore en 3 ou en 4, un groupe
trifluorométhyle
en 4, ou deux atomes de chlore en 3 et 4;
- R4 et R5 représentent un atome de chlore en 2, 3 ou 4, un groupe
trifluorométhyle en
4, ou un atome de chlore en 3 et un groupe méthyle en 4.
- R6 représente un groupe choisi parmi :
. un groupe (CI-C6)alkyle non substitué ou substitué une ou plusieurs fois par
un
ou plusieurs substituants choisis indépendamment parmi un atome d'halogène ou
un groupe hydroxy, (C I-C4)alcoxy ou trifluorométhoxy ;
. un radical carbocyclique non aromatique en C3-C12, non substitué ou
substitué
une ou plusieurs fois par un atome d'halogène ou un groupe (C1-C4)alkyle, (C1-
C4)alcoxy, hydroxy ou cyano.
Tout particulièrement, les composés suivants sont préférés
CA 02689116 2009-11-30
WO 2009/004171 5 PCT/FR2008/000739
- N-((1-(3,4-dichlorobenzyl)-5-(3,4-dichlorophényl)-1 H-pyrazol-3-yl)méthyl)-
2,2-diméthylpropanamide.
- et N-((1-(3,4-dichlorobenzyl)-5-(3,4-dichlorophényl)-1 H-pyrazol-3-
yl)méthyl)-
2-méthylpropane-2-sulfonamide.
Conformément à l'invention, on peut préparer les composés de formule (I) selon
le procédé qui suit. Ce procédé est caractérisé en ce que
on traite un composé de formule :
R1
I CH2-XH
N
/ N
RZ I R4 R (II)
s
R CHZ
3
dans laquelle X représente un atome d'oxygène, un groupe NH ou N(R7) et RI,
R2, R3, R4, R5 sont tels que définis ci-dessus pour les composés de formule
(I) :
a) soit avec un dérivé fonctionnel d'un acide de formule R6COOH (III) dans
laquelle
R6 est tel que défini ci-dessus pour (I) pour obtenir un composé de formule
(IA) ou
(IC) dans laquelle Y représente la valeur i) ou ii) ;
b) soit par un isocyanate de formule R6N=C=O (IV) dans laquelle R6 est tel que
défini ci-dessus pour (I), pour obtenir un composé de formule (IB) dans
laquelle Y
représente la valeur ii).
c) soit par un dérivé halogéné de formule R6S(O)nHal dans laquelle Hal
représente un
atome d'halogène, préférentiellement le chlore, et R6 est tel que défini ci-
dessus
pour (I), pour obtenir un composé de formule (ID) dans laquelle Y a la valeur
iv).
A partir d'un composé de formule (ID) dans laquelle Y = -N(R7)SO-, on peut
préparer un composé de formule (ID) dans laquelle Y=-N(R7)S02-, par oxydation,
par exemple par action de l'acide métachloroperbenzoïque.
Par dérivé fonctionnel d'un acide de formule R6COOH, on entend un chlorure
d'acide, un anhydride ou encore l'acide libre opportunément activé par exemple
avec
l' hexafluorophosphate de benzotriazol- 1 -yloxytris(diméthylamino)phosphonium
(BOP) ou la dicyclohexylcarbodiimide (DCC).
Les composés de formule (I) dans laquelle Y représente un groupe -N(R7)CO- ou
-N(R7)CON(R7)- peuvent être préparés à partir des composés correspondant de
formule (I) dans laquelle Y représente un groupe -NHCO- ou -NHCONH- par une
méthode choisie parmi les méthodes connues de l'homme de l'art. Parmi celles-
ci, on
CA 02689116 2009-11-30
WO 2009/004171 6 PCT/FR2008/000739
peut citer l'alkylation par un halogénure de méthyle ou encore la formation
d'un
carbamate par action du chloroformiate d'éthyle suivi d'une réduction par
LiA1H4.
Selon une variante du procédé de l'invention, les composés de formule (IB)
peuvent être obtenus par un procédé caractérisé en ce que :
cl) on traite un composé de formule (II) par un ester de formule Ha1COOAr (V)
dans laquelle Hal représente un atome d'halogène et Ar représente un groupe
aryle tel
que par exemple phényle ou 4-nitrophényle ;
c2) on traite le carbamate ainsi obtenu de formule :
O
R, 11
I CHZ-NHZ-C-O-Ar
N'IN
R
R2 I I 4 R (VI)
s
R CHZ
3
par une amine de formule : R6R7NH (VII) dans laquelle R6 et R7 sont tels que
définis pour un composé de formule (IB).
L'étape a) est réalisée dans un solvant aprotique tel que le dichlorométhane,
le
THF ou le DMF à une température comprise entre 0 C et la température
d'ébullition
du solvant.
L'étape b) est réalisée dans un solvant tel que le dichlorométhane à la
température
ambiante.
L'étape cl) est réalisée dans un solvant aprotique tel que le dichlorométhane
à la
température ambiante.
L'étape c2) est réalisée dans un solvant aprotique tel que le dichlorométhane,
à
une température comprise entre la température ambiante et la température
d'ébullition
du solvant.
Les composés de formule (II) sont préparés selon le schéma réactionnel suivant
:
CA 02689116 2009-11-30
WO 2009/004171 7 PCT/FR2008/000739
SCHEMA 1
Ri Ri
I I COZMe LiAlH4 I I CHz-OH
P N R4 (a,R N R4
RZ R5 Z I I R5
R 3 CHz / R 3 CHz
(VIII) (IX)
Ri CH Hal Ri
/N
IN 2- 1) N N CHZ NHz
R N N/N / Ra
R I I
(~ z R RS (a Rz RS
s CHz R CHz
2) HCl
(X) (XI)
Hal : atome d'halogène, préférentiellement Cl ou Br.
Lorsque X représente un groupe NH, le composé de formule (II) est représenté
par le composé de formule (XI).
Lorsque X représente un atome d'oxygène, le composé de formule (11) est
représenté par le composé de formule (IX).
A la première étape (al), l'ester de formule (VIII) est réduit par action d'un
agent
réducteur tel que LiA1H4.
A l'étape suivante (a2), le dérivé hydroxyméthylé (IX) obtenu est traité par
un
agent tel que PC15, PBr3, HBr ou BBr3 pour former le dérivé halogénométhylé de
formule (X).
Enfin, le composé de formule (XI) est obtenu au cours de l'étape (a3) en
traitant le
composé de formule (X) successivement par le 1,3,5,7-tétraazatricyclo[3.3.13'7
]decane
(ou hexaméthylène tétramine) puis par un acide fort tel que l'acide
chlorhydrique.
Les composés de formule (VIII) sont obtenus selon le mode de préparation
décrit
dans le brevet EP-B-868 420.
Les composés de formule (XI) sont nouveaux.
CA 02689116 2009-11-30
WO 2009/004171 8 PCT/FR2008/000739
Ainsi l'invention, selon un autre de ses aspects, a également pour objet les
composés de formule (XII) :
Ri
I CH2 W
N (XII)
/ ( N R4
R2 Rs
R3 CHZ
dans laquelle :
- W représente un groupe hydroxyle ou amino ;
- R1 représente un atome d'hydrogène ou un groupe (C 1-C4)alkyle ;
- R2 et R4 représentent chacun indépendamment l'un de l'autre un atome
d'hydrogène
ou d'halogène, ou un groupe (C 1 -C4)alkyle, (C 1 -C4)alcoxy ou
trifluorométhyle ;
- R3 et R5 représentent chacun indépendamment l'un de l'autre un atome
d'halogène
ou un groupe (C 1 -C4)alkyle, (C 1 -C4)alcoxy ou trifluorométhyle ;
Les composés de formule (XII) peuvent exister à l'état de bases ou de sels
d'addition à des acides. De tels sels d'addition font partie de l'invention.
Les composés de formule (XII) peuvent également exister sous forme d'hydrates
ou de solvats, à savoir sous forme d'associations ou de combinaisons avec une
ou
plusieurs molécules d'eau ou avec du solvant. De tels hydrates et solvats font
également partie de l'invention. Ces composés sont utiles comme intermédiaires
de
synthèse des composés de formule (I) selon l'invention.
Préférentiellement, les composés de formule (XII) correspondent à ceux dont
les
substituants ont les définitions suivantes :
- R1 représente un atome d'hydrogène ;
- R2 et R3 représentent un atome de chlore en 3 ou en 4, un groupe
trifluorométhyle
en 4, ou deux atomes de chlore en 3 et 4;
- R4 et R5 représentent un atome de chlore en 2, 3 ou 4, un groupe
trifluorométhyle
en 4, ou un atome de chlore en 3 et un groupe méthyle en 4.
- R6 représente un groupe choisi parmi :
. un groupe (C 1-C6)alkyle non substitué ou substitué une ou plusieurs fois
par un
ou plusieurs substituants choisis indépendamment parmi un atome d'halogène ou
un groupe hydroxy, (C 1-C4)alcoxy ou trifluorométhoxy ;
CA 02689116 2009-11-30
WO 2009/004171 9 PCT/FR2008/000739
. un radical carbocyclique non aromatique en C3-C 12, non substitué ou
substitué
une ou plusieurs fois par un atome d'halogène ou un groupe (C 1-C4)alkyle, (C
1-
C4)alcoxy, hydroxy ou cyano.
Les exemples suivants décrivent la préparation de certains composés conformes
à
l'invention. Ces exemples ne sont pas limitatifs et ne font qu'illustrer la
présente
invention. Les numéros des composés exemplifiés renvoient à ceux donnés dans
le
tableau ci-après, qui illustre les structures chimiques et les propriétés
physiques de
quelques composés selon l'invention.
Dans les exemples, on utilise les abréviations suivantes :
TA : température ambiante
(déc.) : décomposition
TEA : triéthylamine
THF : tétrahydrofurane
DMF : diméthylformamide
DCM : dichlorométhane
DMSO : diméthylsulfoxyde
BOP : benzotriazol-1-yloxytris(diméthylamino)phosphonium
/ hexafluorophosphate
K2SO4/KHSO4 : tampon pH 2(KHSO4 0,12 M et K2SO4 0,185 M)
AcOEt : acétate d'éthyle
PyBOP : hexafluorophosphate de benzotriazol-1-yloxytris(pyrrolidino)
phosphonium
LiHMDS : sel de lithium de l'hexaméthyldisilazane
MeOH : methanol
EtOH : ethanol
Et20 : ether éthylique
AcOH : acide acétique
F : température de fusion.
Pour les spectres de résonnance magnétique nucléaire (RMN) enregistrés à 200
MHz dans le DMSO-d6, les signaux observés sont exprimés ainsi : d: doublet ;
de :
doublet élargi ; d. de d. : doublet de doublet ; s : singulet ; se : singulet
élargi ; t
triplet.
Les composés selon l'invention sont analysés par couplage LC/UV/MS
(chromatographie liquide/détection UV/spectrométrie de masse). On mesure le
pic
moléculaire (MH) et le temps de rétention (t) en minutes.
CA 02689116 2009-11-30
WO 2009/004171 10 PCT/FR2008/000739
Conditions (A) :
On utilise une colonne Xterra Waters MS C 18, commercialisée par Waters, de
2,1 x 30 mm, 3,5 m, à température ambiante, débit 1 mL/minute.
L'éluant est composé comme suit :
- solvant A: 0,025 % d'acide trifluoroacétique (TFA) dans l'eau;
- solvant B : 0,025 % de TFA dans l'acétonitrile.
Gradient : Le pourcentage de solvant B varie de 0 à 100 % en 2 minutes avec un
plateau à 100 % de B pendant 1 minute.
La détection UV est effectuée entre 210 nm et 400 nm et la détection de masse
en
mode ionisation chimique à pression atmosphérique.
Conditions (B) :
On utilise une colonne Symmetry C18 de 2,1 x 50 mm, 3,5 m, à 30 C, débit 0,4
mL/minute.
L'éluant est composé comme suit :
- solvant A: 0,005 % d'acide trifluoroacétique (TFA) dans l'eau à pH 3,15 ;
- solvant B 0,005 % de TFA dans l'acétonitrile.
Gradient :
Temps (mn) % A % B
0 100 0
10 10 90
15 10 90
16 100 0
100 0
Température de la colonne : 30 C, débit 0,4 ml/minutes.
La détection UV est effectuée à;~ = 210 nM et la détection de masse en mode
20 ionisation chimique (ESI de l'anglais Electro Spray Ionisation) positif.
Conditions (C) :
On utilise une colonne Symmetry C18 de 2,1 x 50 mm, 3,5 m, à 30 C, débit 0,4
mL/minute.
L'éluant est composé comme suit :
- solvant A 0,005 % d'acide trifluoroacétique (TFA) dans l'eau à pH 3,1
- solvant B 0,005 % de TFA dans l'acétonitrile.
CA 02689116 2009-11-30
WO 2009/004171 11 PCT/FR2008/000739
Gradient :
Temps (mn) % A % B
0 100 0
10 90
10 90
16 100 0
100 0
Température de la colonne : 30 C, débit 0,4 ml/minutes.
La détection UV est effectuée à1 = 210 - 220 nM et la détection de masse en
mode ionisation chimique (ESI de l'anglais Electro Spray Ionisation) positif.
5 Conditions (D) :
On utilise une colonne XTerra MS C 18 de 2,1 x 50 mm, 3,5 m, à 30 C, débit
0,4
mL/minute.
L'éluant est composé comme suit :
- solvant A: 10 mM d'acetate d'ammonium dans l'eau à pH 7;
10 - solvant B : acétonitrile.
Gradient :
Temps (mn) . % A % B
0 100 0
10 10 90
15 10 90
16 100 0
20 100 0
Température de la colonne : 30 C, débit 0,4 ml/minutes.
La détection UV est effectuée à a, = 210 nM et la détection de masse en mode
ionisation chimique (ESI de l'anglais Electro Spray Ionisation) positif.
15 EXEMPLE 1: composé 19.
N-((1-(3-Chloro-4-méthylbenzyl)-5-(3,4-dichlorophényl)-1 H-pyrazol-3-yl)
méthyl)- 1 -méthylcyclohexanecarboxamide.
A) (1-(3-chloro-4-méthylbenzyl)-5-(3,4-dichlorophényl)-1 H-pyrazol-3-
yl)méthanol.
On dissout 4 g de 1-(3-chloro-4-méthylbenzyl)5-(3,4-dichlorophényl)-1H-
20 pyrazole-3-carboxylate de méthyle dans 100 ml de THF et on refroidit entre
0 C et
-5 C puis on ajoute par petites portions 0,6 g de LiA1H4 en maintenant à la
même
basse température. On laisse revenir à TA et on agite 30 minutes. On hydrolyse
à O C
par NaOH N (100 ml). On filtre puis on lave le filtrat par THF et on évapore.
L'huile
CA 02689116 2009-11-30
WO 2009/004171 12 PCT/FR2008/000739
obtenue est reprise par de l'éther, on lave à l'eau, par une solution de NaCI,
puis on
sèche sur Na2SO4 et on évapore à sec pour obtenir 3,5 g du composé attendu.
RMN (200 MHz) dans DMSO-d6 : 7,7 ppm : d: 1H ; 7,6 ppm : d: 1H ; 7,4 ppm :
dded: 1H;7,3ppm:d: 1H;7ppm:d: 1H; 6,8 ppm: d de d: 1H;6,4ppm:s:
1H;5,3ppm:s:2H;5,lppm:t: 1H;4,4ppm:d:2H;2,2ppm:s:3H.
B) 3-(chlorométhyl)-1-(3-chloro-4-méthylbenzyl)-5-(3,4-dichlorophényl)-1 H-
pyrazole.
On dissout 3,45 g de composé du composé de l'étape précédente dans 100 ml de
DCM. On refroidit par un bain de glace et on ajoute par fraction, à une
température
inférieure à 10 C, 1,96 g de PC15. On laisse 3 heures sous agitation à TA puis
on verse
sur un mélange d'eau et de glace et on maintient l'agitation pendant 3 heures.
On
laisse décanter puis on lave la phase organique par une solution de NaHCO3
puis de
l'eau. On sèche sur Na2SO4 puis on évapore à sec. L'huile obtenue est purifiée
par
chromatographie sur silice en éluant par le mélange AcOEt/cyclohexane (25/75
;v/v).
On obtient 2,35 g du composé attendu sous forme d'huile qui cristallise. F =
88 C.
C) Chlorhydrate de (1-(3-chloro-4-méthylbenzyl)-5-(3,4-dichlorophényl)-1H-
pyrazol-3-yl)méthanamine.
On dissout 2,3 g du composé de l'étape précédente dans 200 ml de CHC13 et on
ajoute 0,8 g de 1,3,5,7-tétraazatricyclo[3.3.13'7 ]decane. Après 5 jours sous
agitation à
TA, on ajoute 150m1 d'éther, le précipité formé est essoré puis on le dissout
dans
50 ml d'éthanol. On ajoute 2 ml d'HCl concentré puis on chauffe à 50 C pendant
3
heures. On concentre le milieu à mi-volume, puis on ajoute 50 ml d'éther. On
essore,
lave à l'éther et sèche pour obtenir 1,78 g du composé attendu sous forme de
base.
Pour préparer le chlorydrate, on dissout dans 50 ml d'éthanol, on ajoute 2 ml
d'HCl concentré puis on chauffe à 50 C pendant 3 heures. Le milieu est
concentré
sous vide, essoré puis lavé à l'éther et séché, on obtient 1,88 g du
chlorydrate attendu.
RMN (200 MHz) dans DMSO-d6 : 8,6 ppm : se : 1H ; 7,7 ppm : d: 1H ; 7,6
ppm : d:1 H; 7,4 ppm : d de d:1 H; 7,3 ppm : d: 1 H; 7,1 ppm : d:1 H; 6,9 ppm
: d
ded: 1H;6,7ppm:s: 1H;6ppm:se:2H;5,4 ppm:s:2H;4ppm:2d:2H;2,3
ppm : s : 3H.
D) N-((1-(3-chloro-4-méthylbenzyl)-5-(3,4-dichlorophényl)-1H-pyrazol-3-
yl)méthyl)-1-méthylcyclohexanecarboxamide.
On mélange 417 mg du composé de l'étape précédente, 142 mg d'acide 1-
méthylcyclohexanecarboxylique et 580 mg de BOP dans 50 ml de DMF puis on
ajoute de la triéthylamine pour atteindre pH 10.
On laisse sous agitation pendant 20 heures à température ambiante.
CA 02689116 2009-11-30
WO 2009/004171 13 PCT/FR2008/000739
Le produit obtenu est purifié par chromatographie sur silice en éluant par un
mélange DC1V1/MeOH (97,5/2,5 ; v/v). On obtient 250 mg du composé attendu,
F = 63 C.
EXEMPLE 2 : composé 60
N-(tert-Butyl)-N'-((1-(3-chloro-4-méthylbenzyl)-5-(3,4-dichlorophényl)-1 H-
pyrazol-3-yl)méthyl)urée.
On dissout 0,5 g du composé obtenu à l'étape C de l'Exemple 1 dans 30 ml de
DCM et on ajoute 0,137 ml de 2-isocyanato-2-méthylpropane puis une quantité
suffisante de triéthylamine pour atteindre pH9. On laisse sous agitation à TA
pendant
une nuit. Après avoir ajouté 10 ml d'eau, on décante. La phase organique est
lavée
successivement par des solutions aqueuses de NaHCO3, K2SO4/KHSO4, puis de
l'eau. On sèche sur Na2SO4 puis on évapore à sec. Le résidu est repris par un
mélange
AcOEt/cyclohexane (50/50 ; v/v). Le composé attendu précipite sous forme d'un
solide blanc : m= 360 mg, F = 181 C.
EXEMPLE 3: composé 46
N-((1-(3-chlorobenzyl)-5-(3,4-dichlorophényl)-1 H-pyrazol-3-yl)méthyl)-2,2-
diméthylpropanamide.
A) 1-(3,4-Dichlorophényl)-4-méthoxy-3,4-dioxobut-1-en-1-olate de sodium.
On prépare une solution de méthylate de sodium en introduisant lentement 23 g
de sodium dans 1 litre de méthanol, on refroidit par un bain de glace et on
ajoute
188,97 g de 1-(3,4-dichlorophényl)éthanone puis 149,14 g d'oxalate d'éthyle
dans 250
ml de méthanol. Il se forme un précipité. On ajoute 500 ml de méthanol puis on
laisse
sous agitation pendant 2 heures. On ajoute 500 ml d'Et20 et on maintient
l'agitation
minutes. On filtre le précipité formé puis on le sèche pour obtenir 297 g du
25 composé attendu.
B) 5-(3,4-Dichlorophényl)-1H-pyrazole-3-carboxylate de méthyle.
On place 123,43 g du composé obtenu à l'étape précédente dans 800 ml d'AcOH,
on ajoute goutte à goutte 25,60 ml d'hydrate d'hydrazine et on chauffe une
nuit à
reflux. On verse le milieu réactionnel dans de l'eau glacée. Le précipité
formé est
30 essoré puis lavé à l'eau. On le reprend dans Et2O, la phase organique est
lavée par une
solution de NaC1 saturée puis séchée sur Na2SO4, évaporée et filtrée. On
obtient
91,85 g du composé attendu.
C) 1-(3-Chlorophényl)-5-(3,4-dichlorophényl)-1H-pyrazole-3-carboxylate de
méthyle.
On place 14,50g du composé obtenu à l'étape précédente dans 250 ml de toluène
et on ajoute 2,35 g de NaH par pincées puis on chauffe à 65 C pendant 1 heure.
On
CA 02689116 2009-11-30
WO 2009/004171 14 PCT/FR2008/000739
refroidit à TA et on ajoute lentement 7,72 ml de bromure de 3-chlorobenzyle.
On
chauffe le milieu réactionnel à reflux pendant 20 heures puis on le neutralise
par une
solution saturée de NH4C1. On laisse décanter la phase organique puis on la
lave par
une solution de NaCI saturée. On sèche sur Na2SO4 puis on évapore. Le produit
obtenu est dissout dans AcOEt puis lavé par une solution de NaHCO3 saturée,
une
solution K2SO4/KHSO4, de l'eau. On sèche sur Na2SO4 et évapore pour obtenir
64,37 g du composé attendu.
D) 1-(1-(3-Chlorobenzyl)-5-(3,4-dichlorophényl)-1 H-pyrazol-3-yl)méthanol.
On dissout 24,26 g du composé obtenu à l'étape précédente dans 500 ml de THF
sous atmosphère d'azote et on refroidit à-5 C. On ajoute 1,47 g du LiA1H4 par
petites
fractions à une température inférieure à 0 C. On laisse revenir à TA puis on
agite
pendant 1 heure. On hydrolyse le milieu réactionnel à 0 C par NaOH 1N. On
filtre
puis on lave l'insoluble par du THF. On réunit les filtrats que l'on évapore à
sec puis
on reprend par de l'éther. On lave cette phase organique par une solution
saturée de
NaCI puis on sèche sur Na2SO4 et évapore à sec. Le produit obtenu est purifié
par
chromatographie sur silice en éluant par un mélange AcOEt/cyclohexane (50/50 ;
v/v).
On obtient 6,82 g du composé attendu, F = 95 C.
E) 1-(3-Chlorobenzyl)-3-(chlorométhyl)-5-(3,4-dichlorophényl)-1 H-pyrazole.
On dissout 6,7 g du composé obtenu à l'étape précédente dans 200 ml de DCM et
on refroidit entre 0 C et -10 C. On ajoute par pincées à-10 C 3,98 g de PC15
puis on
laisse sous agitation 4 heures à TA. On verse le milieu réactionnel sur de la
glace et on
laisse une nuit au repos. La phase organique est décantée puis extraite à
nouveau par
50 ml de DCM. On rassemble les extraits, sèche sur Na2SO4 et évapore à sec. On
obtient 7,41 g du composé attendu.
F) Chlorhydrate de 1-(1-(3-chlorophényl)-5-(3,4-dichlorophényl)-1 H-pyrazol-3-
yl)méthanamine.
On dissout 7,3 g du composé obtenu à l'étape précédente dans 500 ml de
chloroforme et on ajoute 2,65 g de 1,3,5,7-tétraazatricyclo[3.3.13'7 ]décane.
Après 5
jours sous agitation, on ajoute 500 ml d'éther. Après 2 heures, on essore le
précipité
formé. Le produit obtenu est dissous dans 50 ml d'EtOH puis on ajoute 2 ml
d'HCl
concentré et on chauffe à 60 C pendant 3 heures. On évapore à sec puis on
reprend
par de l'éther chlorhydrique. Le précipité formé est essoré puis séché pour
donner 4,67
g du composé attendu. F= 150 C.
G) N-((1-(3-chlorobenzyl)-5-(3,4-dichlorophényl)-1 H-pyrazol-3-yl)méthyl)-2,2-
diméthylpropanamide.
CA 02689116 2009-11-30
WO 2009/004171 15 PCT/FR2008/000739
On dissout 0,6 g du composé obtenu à l'étape précédente et 0,18 g d'acide
pivalique dans 50 ml de DMF puis on ajoute 0,92 g de PyBOP et 0,45 ml de
triéthylamine et on laisse sous agitation une nuit à TA. On évapore le DMF
puis on
reprend par AcOEt. On lave par une solution saturée de NaHCO3, une solution de
K2SO4/KHSO4 puis de l'eau ; on sèche sur Na2SO4 puis on évapore à sec. Le
produit
obtenu est purifié par chromatographie sur silice en éluant par un mélange
DCM/MeOH (95/5 ; v/v). On obtient 0,31 g du composé attendu.
RMN: 1,12ppm:s:9H;4,25ppm:d:2H;5,34ppm:s:2H;6,33ppm:s:
1H;6,85-7,45ppm:m:5H;7,61ppm:d: 1H;7,71ppm:d: 1H;7,98ppm:t:
1H.
EXEMPLE 4: composé N 55
Pivalate de (1-(3,4-dichlorobenzyl)-5-(4-trifluorométhylphényl)-1 H-pyrazôl-3-
yl)
méthyle.
A) 1-(4-(Trifluorométhylphényl)-4-éthoxy-3,4-dioxobut- 1 -en- 1 -olate de
lithium.
Sous atmosphère d'azote, on dissout 24,45 g de LiHMDS dans 100 ml de THF
anhydre et on refroidit à-60 C. Par ailleurs, on dissout 25 g de 1-(4-
trifluorométhylphényl)éthanone dans 50 ml d'Et20. On introduit goutte à goutte
la
solution de cétone sur la solution de LiHMDS à-60 C puis on laisse remonter la
température à-30 C et on ajoute rapidement 19,85 ml d'oxalate de diéthyle.
Après une
nuit à TA, on évapore à sec le milieu réactionnel puis on reprend par de
l'éther. Le
précipité formé est essoré, lavé à l'éther puis séché. On obtient 33,28 g du
composé
attendu.
B) 5-(4-Trifluorométhylphényl)-1 H-pyrazol-3-carboxylate d'éthyle.
On dissout 33,2 g du composé obtenu à l'étape précédente dans 400 ml d'AcOH et
on ajoute goutte à goutte 6,33 ml d'hydrate d'hydrazine puis on chauffe à
reflux
pendant 5 heures sous agitation. Après 1 nuit à TA, on verse le milieu sur de
l'eau
glacée et on essore le précipité formé après 1 heure. On lave à l'eau et
sèche, puis on
reprend par DCM. On sèche sur Na2SO4 et évapore à sec. On obtient 30,37 g du
composé attendu.
C) 1-(3,4-Dichlorobenzyl)-5-(4-trifluorométhylphényl)-1 H-pyrazole-3-
carboxylate
d'éthyle.
A partir de 30,3 g du composé obtenu à l'étape précédente, on prépare ce
composé
selon la méthode décrite à l'Exemple 3, étape C. On obtient 36,24 g du composé
attendu.
D) 1-(1-(3,4-Dichlorobenzyl)-5-(4-trifluorométhylphényl)-1 H-pyrazol-3-yl
méthanol.
CA 02689116 2009-11-30
WO 2009/004171 16 PCT/FR2008/000739
Ce composé est préparé en suivant la méthode décrite à l'Exemple 3, étape D. A
partir de 33 g du composé de l'étape précédente, on obtient 23,10 g du composé
attendu, F = 96 C
E) Pivalate de (1-(3,4-dichlorobenzyl)-5-(4-trifluorométhylphényl)-1H-pyrazol-
3-yl)
méthyl.
On dissout 1 g du composé obtenu à l'étape précédente dans 50 ml de DMF. On
ajoute 0,37 ml de chlorure de pivaloyle puis 0,52 ml de triéthylamine et on
laisse sous
agitation à TA pendant 20 heures. On évapore le solvant sous vide puis on
reprend par
50 ml d'AcOEt. On lave par une solution de NaHCO3 saturée puis par
K2SO4/KHSO4 puis par une solution saturée de NaCI. On sèche sur Na2SO4 puis on
évapore à sec. Le produit obtenu est purifié par chromatographie sur silice en
éluant
par un mélange AcOEt/cyclohexane (25/75 ; v/v). On obtient 0,89 g du composé
attendu sous forme d'huile qui cristallise, F= 92 C.
En procédant comme à l'étape C) de l'Exemple 1, on prépare les composés
intermédiaires décrits dans le Tableau 1 ci-après. Lorsque le composé est
caractérisé
par LC/UV/MS, les conditions opérationnelles (A), (B), (C) ou (D) sont
spécifiées.
TABLEAU 1
CHZ-NHZ
N
ReC5~~N~ I
R
4 R s
HZ
3
3
Caractérisation
R1 R2, R3 R4, R5 F C ou LC/MS Sel
H 4-C1 2,4-diCl 176 C HCl
H 3,4-diCl 4-C1 237 C HCI
H 4-Cl 3,4-diCl 214 C HCl
Me 4-Cl 2,4-diCl 172 C HCl
H 3-Cl 3,4-diCl 63 C HCl
H 3,4-diCl 4-CF3 382 C HCl
H 3-C1 3-C1 165 C HC1
H 4-C1 4-C1 229 C HC1
H 3,4-diCl 3,4-diCl 205 C HCl
CA 02689116 2009-11-30
WO 2009/004171 17 PCT/FR2008/000739
Caractérisation
R1 R2, R3 R4, R5 F C ou LC/MS Sel
H 3,4-diCl 3-Cl, 4-OMe MH+ = 396 HC1
t=7,25mn
(C)
H 3,4-diCl 3-Cl, 4-OCF3 MH = 450 HC1
t = 7,25 mn
(C)
H 3,4-diCl 3-Cl, 4-CF3 MH = 434 HC1
t = 7,47 mn
(C)
H 3,4-diCl 3-CF3, 4-Cl MH = 434 HCl
t = 7,46 mn
(C)
H 4-OMe 3,4-diCl MH = 362 HC1
t = 6,62 mn
(C)
EXEMPLE 5: composé N 60
N-((1-(3,4-dichlorobenzyl)-5-(3,4-dichlorophényl)-1 H-pyrazol-3-yl)méthyl)-2,2-
diméthylpropanamide.
On place 0,50 g de 1-(1-(3,4-dichlorobenzyl)-5-(3,4-dichlorophényl)-1 H-
pyrazol-
3-yl)méthanamine, décrit dans le tableau I, et 0,15 g d'acide pivaloïque dans
50 ml de
DMF en présence de 0,68 g de PyBOP et on ajoute 0,28 ml de TEA. Après une nuit
sous agitation à température ambiante, on évapore le solvant puis on reprend
par
AcOEt, lave par une solution saturée de NaHCO3, puis par K2SO4/KHSO4. On sèche
sur Na2SO4 puis on évapore à sec. On purifie par chromatographie sur silice en
éluant
par un mélange AcOEt/cyclohexane (50/50; v/v). On obtient 0,36 g du composé
attendu. F = 56,5 C.
RMN : 1,09 ppm : s: 9H; 4,23 ppm : d: 2H ; 5,32 ppm : se : 2H; 6,31 ppm : s:
1 H; 6,96 ppm : d. de d. : 1 H; 7,27 ppm : d: 1 H; 7,61 ppm : d: 1 H; 7,69 ppm
: d:
1H;7,95ppm:t:1H.
EXEMPLE 6: composé N 89
N-((1-(3,4-dichlorobenzyl)-5-(3,4-dichlorophényl)-1 H-pyrazol-3-yl)méthyl)-2-
méthylpropane-2-sulfinamide.
On place 1,2 g de 1-(1-(3,4-dichlorobenzyl)-5-(3,4-dichlorophényl)-1H-pyrazol-
3-yl)méthanamine décrit dans le tableau I, et 0,44 ml de chlorure de 2-
méthylpropane-
CA 02689116 2009-11-30
WO 2009/004171 18 PCT/FR2008/000739
2-sulfinyle dans 50 ml de DMF et on ajoute 1,24 ml de TEA. On laisse sous
agitation
pendant 16 heures. On évapore le solvant puis on purifie par chromatographie
sur
silice en éluant par du cyclohexane puis par un gradient cyclohexane/AcOEt de
99/1 à
70/30. On obtient 0,85 g du composé attendu.
RMN: 1,12 ppm: s: 9H; 4,15 ppm: m: 2H; 5,37 ppm: s: 2H; 5,71 ppm: t:,
1H;6,52ppm:s: 1H;6,99ppm:dded: 1H;7,27ppm:d: 1H; 7,36 ppm: d de
d: 1H;7,57ppm:d: 1H;7,63ppm:d: 1H;7,72ppm:d: 1H.
EXEMPLE 7: composé N 90 N-((1-(3,4-dichlorobenzyl)-5-(3,4-dichlorophényl)-1 H-
pyrazol-3-yl)méthyl)-2-méthylpropane-2-sulfonamide.
On dissout 0,68 g d'acide métachloroperbenzoïque dans 55 ml de DCM et on
refroidit entre 0 C et -5 C puis on ajoute 0,55 g du composé obtenu à
l'exemple
précédente dans 5 ml de DCM. On laisse revenir à température ambiante puis on
agite
pendant une nuit. On verse le milieu réactionnel dans 50 ml de NaOH, 1N puis
on
décante. La phase organique est lavée à l'eau puis séchée et évaporée à sec.
On purifie
par chromatographie sur silice en éluant par du cyclohexane puis par un
gradient
cyclohexane/AcOEt de 99/1 à 50/50 en 1 heure. On obtient 0,39 g du composé
attendu. F = 127,4 C.
RMN : 1,27 ppm : s: 9H ; 4,22 ppm : d: 2H ; 5,37 ppm : se : 2H; 6,50 ppm : s:
1H ; 6,97 ppm : d de d: 1H ; 7,28 ppm : d: 1H ; 7,36 ppm : d de de: 1H ; 7,46
ppm :
t: 1 H; 7,56 ppm : d: 1 H; 7,63 ppm : d: 1 H; 7,72 ppm : d: 1 H.
Les tableaux qui suivent, illustrent les structures chimiques et les
propriétés
physiques de quelques composés selon l'invention. Dans les tableaux, Me, Et,
iPr et
tBu représentent respectivement les groupes méthyle, éthyle, isopropyle et
tert-butyle.
Lorsque le composé est caractérisé par LC/UV/MS, les conditions
opérationnelles (A),
(B), (C) ou (D) sont spécifiées.
TABLEAU 2
R~
"N'
~ R
RZ I I 4 R (IA)
5
CHz
R
3
CA 02689116 2009-11-30
WO 2009/004171 19 PCT/FR2008/000739
Caractérisation
Composés R1 R2, R3 R4, R5 R6
F C ou LC/MS
1 H 3,4-diCl 3-Cl, 4-Me 4- tBu)- hényl F 59 C
2 H 3,4-diCl 3-C1, 4-Me 4-F- hén 1 F 118 C
3 H 3,4-diCl 3-C1, 4-Me bicyclo[2.2.1 ]heptan-2- F 107 C
Y
4 H 3,4-diCl 3-Cl, 4-Me 4-Cl-phényl F 149 C
F = 55 C
H 3,4-diCl 3-Cl, 4-Me 4-Me-phényl
(déc.)
6 H 3,4-diCl 3-Cl, 4-Me 3,5-diF-phényl F = 130 C
7 H 3,4-diCl 3-Cl, 4-Me 2,3-diF-phényl F = 122 C
8 H 3,4-diCl 3-Cl, 4-Me 2,5-diF-phényl F = 140 C
9 H 3,4-diCl 3-Cl, 4-Me 2,4-diF-phényl F = 109 C
H 3,4-diCl 3-Cl, 4-Me 4-MeO-phényl F 50 C
11 H 3,4-diCl 3-C1, 4-Me 4-CF - hényl F 170 C
12 H 4-Cl 2,4-diCl exobicyclo[2.2.1]- F 56 C
heptan-2-yl
13 H 3,4-diCl 3-Cl, 4-Me 3,4-diF- hényl F 103 C
14 H 3,4-diCl 3-Cl, 4-Me 2,6-diF-phényl F = 140 C
H 3,4-diCl 3-Cl, 4-Me (1,1'-biphényl)-2-yl F = 182 C
16 H 3,4-diCl 3-CI, 4-Me (1,1'-biphényl)-4-yl F = 148 C
17 H 3,4-diCl 3-Cl, 4-Me 3,5-diMe-phényl F 95 C
18 H 3,4-diCl 3-Cl, 4-Me 4-c clohéx 1- hényl F 155 C
19 H 3,4-diCl 3-C1, 4-Me (1-méthyl)cyclohéxyl F 63 C
H 3,4-diCl 3-Cl, 4-Me 2,6-diMe-phényl F 137 C
21 H 3,4-diCl 3-Cl, 4-Me cycloheptyl F 75 C
22 H 3,4-diCl 3-Cl, 4-Me cyclohexylméthyl F 98 C
23 H 3,4-diCl 3-Cl, 4-Me adamant-1-yl F 60 C
24 H 3,4-diCl 3-Cl, 4-Me cyclopentylméthyl F 88 C
H 3,4-diCl 3-Cl, 4-Me tBu F 56 C
26 H 3,4-diCl 3-Cl, 4-Me cyclohexyl F 131 C
27 H 3,4-diCl 3-Cl, 4-Me benzhydryl F 130 C
28 H 3,4-diCl 3-Cl, 4-Me bicyclo[2.212]octan-2- F F 116513 C
C
Y
=
29 H 4-Cl 3,4-diCl 2,6-diF-phényl
CA 02689116 2009-11-30
WO 2009/004171 20 PCT/FR2008/000739
Caractérisation
Composés R1 R2, R3 R4, R5 R6
F C ou LC/MS
30 H 4-Cl 3,4-diCl tBu RMN
31 H 4-Cl 3,4-diCl (1-méthyl)cyclohex 1 F 62 C
32 H 3,4-diCl 4-Cl 2,6-diF-phényl F 139 C
33 H 3,4-diCl 4-Cl tBu RMN
34 H 3,4-diCl 4-Cl (1-méthyl)cyclohexyl RMN
+
MH =
35 H 3,4-diCl 3-Cl, 4-Me 490,40
t = 2,30 mn
(A) .
+
MH =
36 H 3,4-diCl 3-Cl, 4-Me cyclopropyle 448,34
t = 2,20 mn
(A)
MH+ _
37 H 3,4-diCl 3-Cl, 4-Me cyclobutyle 462,41
t = 2,60 mn
(A)
+
MH =
38 H 3,4-diCl 3-Cl, 4-Me 474,08
~ t=2,16mn
(A)
H 3,4-diCl 4-Cl _M
39 o~~ NSO2Me F = 80 C
Me
40 H 3,4-diCl 4-Cl iPr F = 129 C
41 H 3,4-diCl 4-Cl -CH2-iPr F = 119 C
42 H 3,4-diCl 4-Cl cyclopropyle F = 140 C
' Me
43 H 3,4-diCl 4-C1 -CHEt F = 120 C
(racémi ue
44 H 3,4-diCl 3-Cl -0 F = 143 C
CA 02689116 2009-11-30
WO 2009/004171 21 PCT/FR2008/000739
Caractérisation
Composés R1 R2, R3 R4, R5 R6
F C ou LC/MS
MH = 489
45 H 3,4-diCl 3-Cl 7O t = 11,66 mn
Me (B)
MH = 449
46 H 3,4-diCl 3-Cl tBu t = 10,66 mn
(B)
47 H 3,4-diCl 3-C1 cyclo ent lméthyl F 120 C
48 H 3-Cl 3,4-diCl 7O F 93 C
Me
49 H 3-Cl 3,4-diCl -0 F 125 C
+
MH = 449
50 H 3-Cl 3,4-diCl tBu t = 10,63 mn
(B)
MH = 483
51 H 3,4-diCl 4-CF3 tBu t = 10,87 mn
(B)
MH = 523
52 H 3,4-diCl 4-CF3 70 t = 11,67 mn
Me (B)
MH = 469
53 H 3,4-diCl 4-CF3 -iPr t = 10,41 mn
(B)
-CF3
54 H 3,4-diCl 4-Cl F = 115 C
55 H 4-CF3 3,4-diCl tBu F = 130 C
+
MH =415
56 H 3-Cl 3-Cl tBu t= 10,16 mn
(B)
MH = 455
57 H 3-Cl 3-Cl 70 t= 11,05 mn
Me (B)
CA 02689116 2009-11-30
WO 2009/004171 22 PCT/FR2008/000739
Caractérisation
Composés R1 R2, R3 R4, R5 R6
F C ou LC/MS
58 H 4-Cl 4-C1 tBu F 97 C
MH = 455
59 H 4-Cl 4-Cl 7O t= 11,16 mn
Me (B)
60 H 3,4-diCl 3,4-diCl tBu F = 56,5 C
MH = 482
61 H 3,4-diCl 3,4-diCl t= 11,05 mn
(C)
62 H 3,4-diCl 3,4-diCl iPr F = 113 C
MH = 521
63 H 3,4-diCl 3,4-diCl t = 11,61 mn
CN (C)
64 H 3,4-diCl 3,4-diCl --~< F = 125 C
CN
F
65 H 3,4-diCl 3,4-diCl F F = 140 C
66 H 3,4-diCl 3-Cl, 4-OMe tBu F = 118 C
67 H 3,4-diCl 3-Cl, 4-OMe F = 143 C
CN
MH+ = 534
68 H 3,4-diCl 3-Cl, 4-OCF3 tBu t = 11,70 mn
(C)
Me MH+ = 488
69 H 3,4-diCl 3,4-diCl t = 10,87 mn
Me F (C)
MH = 524
70 H 3,4-diCl 3,4-diCl 7O t = 12,06 mn
Me (C)
CF3 MH+ = 550
71 H 3,4-diCl 3,4-diCl t= 11,96 mn
(C)
CA 02689116 2009-11-30
WO 2009/004171 23 PCT/FR2008/000739
Caractérisation
Composés R1 R2, R3 R4, R5 R6
F C ou LC/MS
Me
72 H 3,4-diCl 3,4-diCl F 89 C
Me CN
F
73 H 3,4-diCl 3,4-diCl F 143 C
MH = 536
74 H 3,4-diCl 3,4-diCl ~ t = 11,72 mn
CF3 (C)
OH
75 H 3,4-diCl 3,4-diCl Et F 82 C
Et
76 H 3,4-diCl 3,4-diCl -CF3 F 100 C
77 H 3,4-diCl 3-Cl, 4-CF3 F 89 C
MH =517
78 H 3,4-diCl 3-CF3, 4-Cl tBu t= 11,28 mn
(C)
79 H 3,4-diCl 3-CF3, 4-Cl F 92 C
MH = 446
80 H 4-OMe 3,4-diCl tBu t 10,07 mn
(C)
RMN : Composé 30 : 1,0 ppm : s: 9H ; 4,1 ppm : d: 2H ; 5,2 ppm : s: 2H ; 6,2
ppm : s: 1H ; 6,9 ppm : d. de d. : 1H ; 7,1 ppm : d: 1H ; 7,2-7,6 ppm : m: 5H
; 7,9
ppm:t:1H.
RMN : Composé 33 : 1,0 ppm : s: 9H ; 4,2 ppm : d: 2H ; 5,2 ppm : s: 2H ; 6,2
ppm: s: 1H;6,9ppm:d:2H;7,2ppm:m:3H;7,5ppm d: 1H;7,6ppm:d:
1 H; 7,9 ppm : t: 1 H.
RMN : Composé 34: 1,0-1,6 ppm : m: 11H ; 1,8-2,1 ppm : d : 2H ; 4,2 ppm : d:
2H; 5,3 ppm : s : 2H ; 6,2 ppm: s : 1H;7,0ppm:d:2H;7,4ppm:m:3H;7,6
ppm:d: 1H;7,7ppm:d: 1H;8,0ppm:t: 1H.
CA 02689116 2009-11-30
WO 2009/004171 24 PCT/FR2008/000739
TABLEAU 3
FN CHZ-NH-I -NH-R6
O
/ R
RZ 4 R (IB)
s
R3 CHZ
Caractérisation
Composés R2, R3 R4, R5 R6
F C ou LC/MS
81 3,4-diCl 3-Cl, 4-Me tBu F= 181 C
82 3,4-diCl 3-Cl, 4-Me cyclohexyl F = 182 C
F =128 C
83 3,4-diCl 3-Cl, 4-Me 2,6-diF-phényl
(déc.)
84 3,4-diCl 3,4-diCl tBu F 150 C
TABLEAU 4
I I CH2-O-CO-R6
N/N R4
~ I I (IC)
Rs
R3 CH2
Caractérisation
Composés R2, R3 R4, R5 R6
F C ou LC/MS
MH = 483
85 3,4-diCl 3,4-diCl t= 12,75mn
(C)
MH = 497
86 3,4-diCl 3,4-diCl t= 13,16 mn
(C)
CA 02689116 2009-11-30
WO 2009/004171 25 PCT/FR2008/000739
TABLEAU 5
1I I CH2-NH-S(O)n-R6
N
R I N/ Ra (ID)
2 L2__
Caractérisation
Composés R2, R3 R4, R5 -S(O)n-R6 F C ou LC/MS
87 3,4-diCl 3-Cl -SOCF F= 84 C
88 3,4-diCl 3-Cl -SO tBu F=112 C
MH = 504
89 3,4-diCl 3,4-diCl -SOtBu t = 10,71 mn
(D)
90 3,4-diCl 3,4-diCl -SO tBu F=127 C
91 3,4-diCl 3-Cl, 4-OCF3 -SO (CH ) Me F=101 C
MH = 554
92 3,4-diCl 3-Cl, 4-OCF3 -SOtBu t = 11,32 mn
(C)
MH = 570
93 3,4-diCl 3-Cl, 4-OCF3 -SO2tBu t = 11,69 mn
(C)
94 3,4-diCl 3-Cl, 4-OMe -SO tBu F = 59 C
Les composés de formule (I) possèdent une très bonne affinité in vitro pour
les
récepteurs aux cannabinoïdes CB2, qu'il s'agisse de récepteurs humains ou de
récepteurs de rongeur. Les essais de liaison par affinité (binding) ont été
réalisés avec
des membranes issues de tissus de rongeur et de lignées cellulaires dans
lesquelles les
récepteurs CB2 (Munro et al., Nature 1993, 365, 61-65) ont été exprimés, selon
les
conditions expérimentales décrites par M. Rinaldi-Carmona dans J. Pharmacol.
Exp.
Therap. 1998, 287, 644-650.
Plus particulièrement, les composés de la présente invention ou leurs sels
éventuels sont des ligands puissants et sélectifs des récepteurs aux
cannabinoïdes
CB2, ayant une IC50 (concentration causant une inhibition de 50% de la liaison
spécifique du contrôle) généralement compris entre 0,1 et 500nM. Ils sont
CA 02689116 2009-11-30
WO 2009/004171 26 PCT/FR2008/000739
généralement entre 10 et 1000 fois plus actifs sur les récepteurs CB2 que sur
les
récepteurs CB I. De plus, la nature antagoniste des composés de formule (I) a
été
démontrée par les résultats obtenus dans les modèles de l'inhibition de
l'adénylate-
cyclase comme décrit dans M. Rinaldi-Carmona et al., J. Pharmacol. Exp. Ther.
1996,
278, 871-878 et 1998, 284, 644-650 et M Bouaboula et al., J. Biol Chem., 1997,
272,
22330-22339.
Les composés selon l'invention ont été étudiés sur un modèle du passage de la
barrière intestinale constitué par les cellules Caco-2. (M.C.Grès, Pharm.
Res., 1998,
15(5), 726-733). Ce modèle permet de définir le coefficient Ptot de
perméabilité
apparente du produit pour la monocouche de cellules épithéliales intestinales
plus
filtre. A titre d'exemples, les composés n 60 (ex.5) et n 90 (ex.7)
présentent
respectivement dans ce modèle un Ptot de 111,97 et 64,5 (lO 7 cm.sec-1 ;
concentration = 20 M ; pH apical = 6,5 et pH basal = 7,4). Ces valeurs sont
prédictives d'une absorption totale chez l'homme, après administration par
voie orale.
Ainsi, selon un autre de ces aspects, l'invention a pour objet des médicaments
pour la médecine humaine ou vétérinaire qui comprennent un composé de formule
(I)
ou un sel d'addition de ce dernier à un acide pharmaceutiquement acceptable ou
encore un hydrate ou un solvat. Les composés selon l'invention peuvent être
utilisés
chez l'homme ou chez l'animal (notamment chez les mammifères incluant de façon
non limitative les chiens, les chats, les chevaux, les bovins, les moutons)
dans le
traitement ou la prévention de maladies impliquant les récepteurs aux
cannabinoïdes
CB2.
Ces médicaments trouvent leur emploi en thérapeutique dans le traitement ou la
prévention des pathologies impliquant les cellules du système immunitaire ou
les
désordres immunitaires par exemple les maladies auto-immunes, les maladies
associées aux transplantations d'organes, les maladies infectieuses, les
maladies
allergiques, les maladies du système gastrointestinal, les maladies d'origine
inflammatoire. Plus particulièrement on peut citer, les maladies auto-immunes
suivantes : lupus érythémateux disséminé, les maladies du tissu conjonctif ou
connectivites, le syndrome de Sjôgren's, la spondylarthrite ankylosante,
l'arthrite
réactive, la polyarthrite rhumatoïde, la spondylarthrite indifférenciée, la
maladie de
Behcet, les anémies auto-immunes hémolytiques, la sclérose en plaque, la
sclérose
latérale amyotrophique (la maladie de Charcot), le psoriasis. Les maladies
allergiques
à traiter peuvent être du type hypersensibilité immédiate ou asthme, la
rhinite
allergique, les conjonctivites allergiques ou la dermatite de contact. De même
les
composés et leurs sels éventuels pharmaceutiquement acceptables peuvent être
utilisés
CA 02689116 2009-11-30
WO 2009/004171 27 PCT/FR2008/000739
pour traiter les vascularités, les infections parasitaires, les infections
virales (Sida), les
infections bactériennes (méningites), l'amylose, les maladies affectant les
lignées du
système lymphohématopoïetique.
Les composés de formule (I) selon l'invention peuvent être utilisés comme
médicament dans le traitement ou la prévention de la douleur : les douleurs
neuropathiques, les douleurs aiguës périphériques, les douleurs chroniques
d'origine
inflammatoire. On peut citer les maladies inflammatoires suivantes :
l'arthrite,
l'arthrite rhumatoïde, l'ostéoathrite, la spondylite, la goutte, la maladie de
Crohn's, la
colite ulcérative, les maladies de l'intestin irritable (IBS) ou enflammé
(IBD), la
pancréatite aiguë. Les composés de formule (I) peuvent également être utilisés
dans le
traitement des maladies osseuses et de l'ostéoporose.
De plus, les composés de formule (I) selon l'invention peuvent être utilisés
en tant
que médicament dans le traitement ou la prévention des troubles gastro-
intestinaux,
des troubles diarrhéiques, des ulcères, des vomissements, des troubles
vésicaux et
urinaires, des troubles rénaux, de l'ischémie rénale, des néphrites, des
troubles
d'origine endocrinienne, des troubles cardio-vasculaires, du choc
hémorragique, du
choc septique, de la cirrhose chronique du foie, de l'asthme, de la maladie de
Raynaud, du glaucome, des troubles de la fertilité, ainsi qu'en tant que
médicament
pour la chimiothérapie anticancéreuse (cancer de la peau, de la prostate ou
d'origine
cérébrale). Les composés de formule (I) selon l'invention peuvent être
utilisés comme
médicament dans le traitement des troubles de l'appétit et/ou des conduites
alimentaires, notamment pour le traitement de la cachexie. Les composés de
formule
(I) selon l'invention peuvent être utilisés comme médicament dans la
prévention et/ou
le traitement de l'obésité et des maladies cardio-métaboliques associées
(hypertension,
dyslipédimie, arthérosclérose) le syndrome métabolique, la résistance à
l'insuline
(diabète de type 2) et la stéatohépatopathie métabolique.
De plus, les composés de formule (I) peuvent être utiles comme
neuroprotecteur,
dans le traitement de l'ischémie, des traumatismes crâniens et le traitement
des
maladies neurodégénératives : incluant la maladie de chorée, la maladie de
chorée de
Huntington, le syndrome de Tourrette.
Le composés de formule (I) selon l'invention peuvent être utilisés comme
médicament pour le traitement ou la prévention de la migraine, du stress, des
maladies
d'origine psychosomatique, des crises d'attaques de panique, de l'épilepsie,
des
troubles du mouvement.
Les composés de formule (I) selon l'invention peuvent être utilisés comme
médicament dans le traitement ou la prévention des maladies du système
respiratoire
CA 02689116 2009-11-30
WO 2009/004171 28 PCT/FR2008/000739
tel que la bronchite chronique, la bronchite chronique obstructive (COPD) ou
l'emphysème.
Ainsi les composés de formule (I) selon la présente invention sont utiles en
particulier pour la préparation de médicaments destinés au traitement et à la
prévention des désordres immunitaires, de la douleur, des troubles gastro-
intestinaux,
des troubles cardiovasculaires ou rénaux, et/ou utile dans la chimiothérapie
anticancéreuse.
Selon un autre de ses aspects, la présente invention concerne des compositions
pharmaceutiques comprenant, en tant que principe actif, au moins un composé de
formule (I) selon l'invention. Ces compositions pharmaceutiques contiennent
une dose
efficace d'un composé selon l'invention, ou un sel pharmaceutiquement
acceptable,
un hydrate ou solvat dudit composé, ainsi qu'un ou plusieurs excipients
pharmaceutiquement acceptables.
Lesdits excipients sont choisis selon la forme pharmaceutique et le mode
d'administration souhaité, parmi les excipients habituels qui sont connus de
l'homme
du métier.
Outre un composé de formule (I) ou de ses sels pharmaceutiquement acceptables
ou d'hydrates ou de solvats, les compositions pharmaceutiques selon la
présente
invention peuvent comprendre un ou plusieurs autres principes actifs utiles
dans le
traitement ou la prévention des pathologies indiquées ci-avant.
Ainsi, la présente invention a également pour objet des compositions
pharmaceutiques comprenant un composé de formule (I) selon la présente
invention
associé à un (ou plusieurs) principe actif choisi parmi l'une des classes
thérapeutiques
suivantes :
- un antagoniste et/ou modulateur et/ou agoniste inverse des récepteurs CB 1
aux
cannabinoïdes;
- un autre antagoniste et/ou modulateur et/ou agoniste inverse des récepteurs
CB2 aux
cannabinoïdes;
- un antagoniste des récepteurs AT1 de l'angiotensine II ;
- un inhibiteur de l'enzyme de conversion ;
- un antagoniste calcique ;
- un diurétique ;
- un béta-bloquant ;
- un antidépresseur, un antispychotique, un anxiolytique ;
- un anticancéreux ou un agent antiprolifératif ;
- un antagoniste des opioïdes ;
CA 02689116 2009-11-30
WO 2009/004171 29 PCT/FR2008/000739
ainsi que
- un agent améliorant la mémoire ;
- un agent utile dans le traitement de l'alcoolisme ou des symptômes de
sevrage ;
- un agent utile pour traiter l'ostéoporose ;
- un agent utile pour traiter les maladies auto-immunes ;
- un agent utile pour traiter les rejets de greffe d'organe ;
- un anti-inflammatoire non stéroïdien ou stéroïdien ;
- un anti-infectieux ;
- un anti-parasitaire;
- un anti-viral;
- un analgésique ;
- un anti-diarrhéique;
- un antiasthmatique.
Selon un autre aspect de l'invention, le composé de formule (I), ou un de ses
solvats
ou hydrates et l'autre principe actif associé peuvent être administrés de
manière
simultanée, séparée ou étalée dans le temps.
Par utilisation simultanée , on entend l'administration des composés de la
composition selon l'invention compris dans une seule et même forme
pharmaceutique.
Par utilisation séparée , on entend l'administration, en même temps, des
deux
composés de la composition selon l'invention chacun compris dans une forme
pharmaceutique distincte.
Par utilisation étalée dans le temps , on entend l'administration
successive, du
premier composé de la composition de l'invention, compris dans une forme
pharmaceutique, puis du deuxième composé de la composition selon l'invention,
compris dans une forme pharmaceutique distincte. Dans ce cas, le laps de temps
écoulé entre l'administration du premier composé de la composition selon
l'invention
et l'administration du deuxième composé de la même composition selon
l'invention
n'excède généralement pas 24 heures.
Dans les compositions pharmaceutiques de la présente invention pour
l'administration orale, sublinguale, sous-cutanée, intramusculaire,
intraveineuse,
topique, locale, intratrachéale, intranasale, transdermique ou rectale, le
principe actif
de formule (I) ci-dessus, ou son sel, solvat ou hydrate éventuel peut être
administré
sous forme unitaire d'administration, en mélange avec des excipients
pharmaceutiques
classiques, aux animaux et aux êtres humains pour la prophylaxie ou le
traitement des
troubles ou des maladies ci-dessus.
CA 02689116 2009-11-30
WO 2009/004171 30 PCT/FR2008/000739
Les formes unitaires d'administration appropriées comprennent les formes par
voie orale telles que les comprimés, les gélules molles ou dures, les poudres,
les
granules et les solutions ou suspensions orales, les formes d'administration
sublinguale, buccale, intratrachéale, intraoculaire, intranasale, par
inhalation, les
formes d'administration topique, transdermique, sous-cutanée, intramusculaire
ou
intraveineuse, les formes d'administration rectale et les implants. Pour
l'application
topique, on peut utiliser les composés selon l'invention dans des crèmes, gels
pommades ou lotions.
A titre d'exemple, une forme unitaire d'administration d'un composé selon
l'invention sous forme de comprimé peut comprendre les composants suivants :
Composé selon l'invention : 50,0 mg
Mannitol : 223,75 mg
Croscarmellose sodique : 6,0 mg
Amidon de maïs : 15,0 mg
Hydroxypropyl-méthylcellulose : 2,25 mg
Stéarate de magnésium : 3,0 mg
Par voie orale, la dose de principe actif administrée par jour peut atteindre
0,01 à
100 mg/kg, en une ou plusieurs prises, de préférence de 0,1 à 50 mg/kg.
Il peut y avoir des cas particuliers où des dosages plus élevés ou plus
faibles sont
appropriés ; de tels dosages ne sortent pas du cadre de l'invention. Selon la
pratique
habituelle, le dosage approprié à chaque patient est déterminé par le médecin
selon le
mode d'administration, le poids et la réponse dudit patient.
La présente invention, selon un autre de ses aspects, concerne également une
méthode de traitement des pathologies ci-dessus indiquées qui comprend
l'administration, à un patient, d'une dose efficace d'un composé selon
l'invention, ou
d'un de ses sels pharmaceutiquement acceptables ou hydrates ou solvats.