Note : Les descriptions sont présentées dans la langue officielle dans laquelle elles ont été soumises.
CA 02691535 2009-12-18
WO 2009/004257 1 PCT/FR2008/051106
Procédé de traitement mixte chimique
électrochimique d'un milieu liquide chargé en nitrates,
dispositif pour traiter un tel milieu liquide et
applications .
La présente invention concerne un procédé de
traitement mixte chimique électrochimique d'un milieu
liquide chargé en nitrates.
L'invention concerne également un dispositif pour
traiter un tel milieu liquide et les applications de ce
procédé.
Les effluents liquides résultant du drainage des
sols de cultures sont soumis à une réglementation visant
à réduire la quantité de polluants contenus dans ces
effluents.
Parmi ces polluants, les nitrates sont plus
particulièrement visés.
Dans le cadre des cultures de tomates hors sol sous
serre par exemple, les effluents liquides provenant des
eaux de drainage peuvent contenir une concentration en
nitrate allant jusqu'à 3 g/L pour un débit maximum de 31
m3/jour/hectare.
Or, le rejet de ces eaux est nuisible pour
l'environnement, la concentration en nitrates maximum
acceptable pour l'environnement pouvant être estimée à 50
mg/L.
Un traitement biologique de ces effluents est
possible mais présente deux inconvénients majeurs, à
savoir la présence de composés organiques non facilement
biodégradables dans les effluents, la nécessité d'un
ajout significatif de méthanol ainsi que la présence de
micro-organismes ce qui est peu souhaitable à proximité
du lieu de culture.
Dans ce contexte, l'invention vise un procédé de
traitement d'un milieu liquide chargé en nitrates
permettant de réduire la concentration en nitrates et ne
nécessitant pas l'utilisation d'espèces organiques
CA 02691535 2009-12-18
WO 2009/004257 2 PCT/FR2008/051106
polluantes pouvant nuire à l'environnement. L'invention
réside également dans un dispositif permettant de traiter
un milieu liquide chargé en nitrates et dans les
applications possibles du procédé de l'invention.
A cet effet, l'invention concerne un procédé de
traitement mixte chimique électrochimique d'un milieu
liquide chargé en nitrates.
Selon l'invention, ce procédé comprend une étape
d'électrolyse du milieu liquide en présence d'un sel
métallique, l'électrolyse étant conduite à un pH
inférieur à 5.
Avantageusement, le procédé comprend au moins une
étape de formation d'une solution électrolytique par
ajout d'un sel métallique audit milieu liquide.
De préférence, le sel métallique est un sel
métallique de zinc.
Dans ce cas, le pH de la solution électrolytique
est maintenu entre 2 et 5.
Plus précisément, l'étape d'électrolyse est
conduite avec une anode et une cathode de graphite ou en
carbone vitreux.
Selon une variante, l'étape d'électrolyse est
conduite avec une anode en graphite et une cathode en
zinc massif.
En complément, le procédé comprend une étape
d'électrodialyse de la solution en sortie d'électrolyse,
l'électrodialyse étant employée en déminéralisation de
cette solution, afin de former un effluent déminéralisé
en sel métallique de zinc apte à être évacué.
Dans ce cas, l'électrodialyse est également
employée en concentration ionique de la solution en
sortie d'électrolyse, afin de former un effluent
concentré en sel métallique apte à servir de source de
sel métallique pour l'étape d'électrolyse en présence de
sel métallique.
De préférence, l'étape d'électrodialyse est
conduite à la température ambiante.
CA 02691535 2009-12-18
WO 2009/004257 3 PCT/FR2008/051106
Il est possible que le procédé comprenne une étape
de recirculation de l'effluent concentré en sel
métallique jusqu'à une enceinte dans laquelle le milieu
liquide subit l'étape d'électrolyse en présence de sel
métallique.
De façon complémentaire, le procédé comprend une
étape d'oxydation des ions ammoniums du liquide en sortie
d'électrolyse par laquelle est obtenu un effluent riche
en nitrates destiné à être traité par électrolyse en
présence de sel métallique.
Dans ce cas, l'étape d'oxydation des ions ammoniums
est conduite avec le dioxyde de chlore C102 comme agent
oxydant.
Plus précisément, le pH du liquide subissant
l'étape d'oxydation des ions ammoniums est acide.
Selon une autre caractéristique, le procédé
comprend une étape de recirculation de l'effluent riche
en nitrates jusqu'à une enceinte dans laquelle ce liquide
subit l'étape d'électrolyse en présence de sel
métallique.
Selon un deuxième mode de réalisation, le procédé
comprend une série d'étapes d'électrolyse du milieu
liquide en présence d'un sel métallique d'un métal de
transition, et d'étapes d'oxydation du milieu en présence
d'un agent oxydant, en alternance les unes des autres, la
première étape imposée au milieu étant une étape
d'électrolyse.
Dans ce cas, chaque étape d'électrolyse et chaque
étape d'oxydation sont conduites respectivement au sein
d'un compartiment d'électrolyse et d'un compartiment
d'oxydation, et un compartiment d'électrolyse est situé
en dessous d'un compartiment d'oxydation, les espèces
gazeuses produites au sein d'un compartiment
d'électrolyse étant absorbées par le liquide contenu dans
le compartiment d'oxydation surjacent, le passage du
milieu à traiter étant effectué depuis le compartiment
CA 02691535 2009-12-18
WO 2009/004257 4 PCT/FR2008/051106
d'électrolyse le plus bas jusqu'au compartiment
d'oxydation le plus haut.
Selon une autre caractéristique, le procédé
comprend une étape d'électrodialyse du milieu sortant de
la série de compartiments par laquelle est formée une
solution enrichie en sel métallique, et une solution
appauvrie en sel métallique.
Avantageusement, le procédé comprend une étape de
recirculation de la solution enrichie en sel métallique à
l'entrée du premier compartiment d'électrolyse.
De préférence, le procédé comprend une étape de
détermination du nombre de couples compartiment
d'électrolyse / compartiment d'oxydation en fonction de
la concentration en ions nitrates du milieu à traiter.
L'invention concerne également un dispositif de
traitement par voie chimique d'un milieu liquide chargé
en nitrates.
Ce dispositif comprend une solution électrolytique
contenant le milieu à traiter en mélange avec un sel
métallique d'un métal de transition, une enceinte
d'électrolyse accueillant la solution électrolytique, une
source d'apport d'un milieu chargé en nitrates, et des
moyens de régulation du pH de la solution électrolytique
en dessous de 5. Cette enceinte comprend une entrée de
liquide à traiter, une sortie de liquide traité, une
source d'apport d'un sel métallique, et un moyen de
mélange du milieu liquide à traiter avec le sel
métallique de la source.
Le sel métallique est plus particulièrement un sel
métallique de zinc.
Avantageusement, le dispositif comprend des moyens
de régulation de la concentration en sel métallique du
liquide traversant l'enceinte.
En outre, il comprend au moins un régulateur de pH
permettant de maintenir le liquide traversant l'enceinte
d'électrolyse à un pH inférieur à 5.
CA 02691535 2009-12-18
WO 2009/004257 5 PCT/FR2008/051106
Selon une variante de réalisation, ce dispositif
comprend un électrodialyseur monté à la sortie de
l'enceinte d'électrolyse et pourvu d'une colonne
d'enrichissement en sel métallique et d'une colonne
d'appauvrissement en sel métallique reliée à une conduite
d'évacuation du milieu liquide traité.
La colonne d'enrichissement en sel métallique est
alors reliée à l'entrée de l'enceinte d'électrolyse et
sert de source d'apport en sel métallique.
Une amélioration consiste à munir le dispositif
d'une unité d'oxydation d'un effluent chargé en ions
ammoniums montée à la sortie de l'enceinte d'électrolyse
afin d'oxyder les ions ammoniums de l'effluent en ions
nitrates, ces derniers étant destinés à être traités au
sein de l'enceinte d'électrolyse.
Cette unité d'oxydation comprend une entrée de
liquide communiquant avec la sortie de l'enceinte
d'électrolyse, une sortie de liquide chargé en nitrate,
une entrée d'un agent oxydant nommé dioxyde de chlore
(C102), et un moyen de mélange du liquide traversant
l'unité d'oxydation avec l'agent oxydant, le pH du
liquide traversant l'unité d'oxydation étant proche
acide.
La sortie de liquide de l'unité d'oxydation est
alors reliée à l'entrée de l'enceinte d'électrolyse, en
vue du traitement mixte chimique électrochimique de ce
liquide.
L'invention concerne également l'utilisation du
procédé et du dispositif ci-dessus décrits pour traiter
tout milieu liquide chargé en nitrates.
Dans cette utilisation, le milieu liquide est
constitué par des eaux de drainage de cultures.
L'invention concerne en outre un procédé de
traitement par voie chimique d'un milieu liquide chargé
en ions ammoniums, comprenant au moins une étape
d'oxydation des ions ammoniums.
CA 02691535 2009-12-18
WO 2009/004257 6 PCT/FR2008/051106
Cette étape d'oxydation est conduite au moyen d'un
agent oxydant nommé dioxyde de chlore (C102).
Le pH de la solution subissant l'étape d'oxydation
des ions ammoniums est acide.
L'invention concerne aussi un dispositif de
traitement par voie chimique d'un milieu liquide chargé
en ammoniums, comprenant une unité d'oxydation des ions
ammoniums.
L'unité d'oxydation comprend une entrée de liquide
chargé en ions ammoniums, une sortie de liquide chargé en
ions nitrate, une entrée d'un agent oxydant nommé dioxyde
de chlore (C102), et un moyen de mélange du liquide à
traiter avec l'agent oxydant, le pH du liquide traversant
l'unité d'oxydation étant acide.
Selon un deuxième mode de réalisation du
dispositif, l'enceinte d'électrolyse comprend plusieurs
compartiments d'électrolyse, l'unité d'oxydation comprend
plusieurs compartiments d'oxydation, les compartiments
d'électrolyse et d'oxydation étant montés en série et en
alternance les uns des autres, le premier compartiment
traversé par le milieu à traiter étant un compartiment
d'électrolyse.
Avantageusement, les compartiments d'électrolyse et
d'oxydation sont superposés les uns aux autres de façon à
former une colonne de traitement des nitrates, l'entrée
du milieu à traiter s'effectuant en bas de colonne et la
sortie en haut de colonne, le dernier compartiment
traversé par le milieu à traiter étant un compartiment
d'oxydation.
Selon une première variante de réalisation, un
compartiment d'électrolyse comprend deux électrodes se
présentant sous la forme de plaques, disposées en regard
l'une de l'autre et situées de part et d'autre de l'axe
de la colonne.
Dans ce cas, un compartiment d'oxydation est
délimité par deux plaques perméables au milieu, disposées
perpendiculairement à l'axe de la colonne.
CA 02691535 2009-12-18
WO 2009/004257 7 PCT/FR2008/051106
Selon une deuxième variante de réalisation, un
compartiment d'électrolyse comprend deux électrodes se
présentant sous la forme de plaques, disposées en regard
l'une de l'autre et sécantes à l'axe de la colonne.
Dans ce cas, un compartiment d'oxydation est
délimité par les électrodes des compartiments
d'électrolyse situés au dessus et en dessous de ce
compartiment d'oxydation.
Selon une autre caractéristique, le dispositif
comprend une source d'apport d'un agent oxydant reliée à
chaque compartiment d'oxydation par un tube débouchant
entre les éléments délimitant le compartiment d'oxydation
concerné.
Avantageusement, chaque compartiment d'électrolyse
comprend un agitateur.
Selon encore une autre caractéristique, le
dispositif comprend un électrodialyseur, monté en sortie
de colonne, et fabriquant une solution enrichie en sel
métallique et une solution appauvrie en sel métallique.
De préférence, le dispositif comprend une conduite
de recirculation de la solution enrichie en sel
métallique vers l'entrée de la colonne.
L'invention concerne enfin l'utilisation du procédé
et du dispositif ci-dessus pour traiter tout milieu
liquide chargé en ions ammoniums.
L'invention sera mieux comprise et d'autres buts,
avantages et caractéristiques de celle-ci apparaîtront
plus clairement à la lecture de la description qui suit
et qui est faite au regard des dessins annexés sur
lesquels :
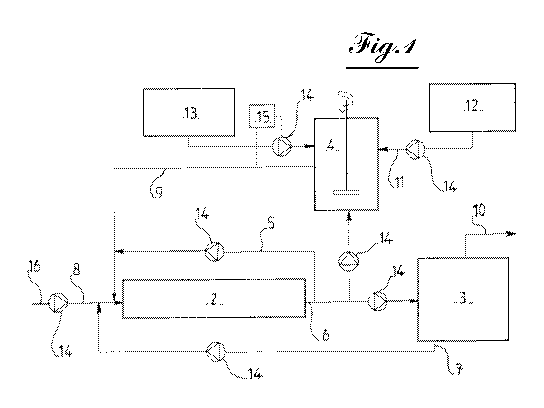
- la figure 1 est un schéma de principe d'un
premier mode de réalisation d'un dispositif de traitement
par voie mixte chimique électrochimique d'un milieu
liquide chargé en nitrates selon l'invention ;
- la figure 2 illustre les évolutions des
concentrations en ions nitrates au cours de trois
expériences menées sur une solution mère contenant une
CA 02691535 2009-12-18
WO 2009/004257 8 PCT/FR2008/051106
concentration initiale connue de nitrates en présence
d'une électrode de zinc, sans courant appliqué sur
l'électrode et sans ions zinc au départ (courbe à
losanges), avec courant et sans ions zinc au départ
(courbe à carrés), avec courant et avec ions zinc au
départ (courbe à triangles) ;
- la figure 3 est une figure analogue à celle de la
figure 2, mais qui illustre les évolutions des
concentrations en ions nitrites ;
- la figure 4 est une figure similaire à celle de
la figure 2 mais qui définit les évolutions des
concentrations en ions zinc ;
- la figure 5 représente les évolutions des
concentrations en ions zinc des deux colonnes
d'appauvrissement de l'électrodialyseur du dispositif de
la figure 1 ; et
- la figure 6 représente les évolutions des
concentrations en ions zinc de la colonne
d'enrichissement de l'électrodialyseur de la figure 1,
- la figure 7 représente un schéma de principe d'un
second mode de réalisation du dispositif de traitement
par voie mixte chimique électrochimique d'un milieu
liquide chargé en nitrates selon l'invention, pourvu de
plusieurs compartiments d'électrolyse et de compartiments
d'oxydation,
- la figure 8 représente une variante de
réalisation des compartiments d'électrolyse du dispositif
de la figure 7.
1. Premier mode de réalisation du dispositif de
traitement
Sur la figure 1 est représenté un premier mode de
réalisation d'un dispositif de traitement par voie mixte
chimique électrochimique d'un milieu liquide chargé en
nitrates selon l'invention.
CA 02691535 2009-12-18
WO 2009/004257 9 PCT/FR2008/051106
Ce dispositif 1 comprend principalement une
enceinte d'électrolyse 2 utilisant un métal sous forme
ionique pour diminuer la concentration en nitrate du
milieu à traiter à pH bas.
Le métal est choisi par rapport à son aptitude à
céder des électrons et à catalyser la réduction des ions
nitrates.
Les métaux de transition sont particulièrement
adaptés à ces applications, et notamment ceux des
colonnes les plus à droites du tableau de Mendeleïev.
Des études expérimentales ont montré que le zinc
présentait un pouvoir catalytique important dans la
réduction des nitrates. C'est donc ce métal qui sera
utilisé au sein du dispositif selon l'invention.
Il est introduit sous forme ionique avant même le
commencement de l'électrolyse, comme amorceur de
réaction.
Pour ce faire, une solution de travail est
constituée en mélangeant milieu à traiter avec une
solution enrichie en ions zinc.
Cette solution est introduite à l'entrée de
l'électrolyseur 2 pour que les ions nitrates qu'elle
contient soient réduits.
Une partie du liquide déjà traité par
l'électrolyseur 2 est amenée depuis la sortie de ce
dernier jusqu'à l'entrée 8 de l'électrolyseur 2 au moyen
d'une conduite de recirculation 5 afin de faire subir une
nouvelle fois au milieu déjà traité, une électrolyse en
présence de zinc ionique pour diminuer encore la
concentration en nitrate de ce milieu.
Pour fixer le pH à une valeur basse, le dispositif
selon l'invention comprend un régulateur de pH relié à
l'enceinte dans laquelle est conduite l'électrolyse.
En complément, le dispositif comprend un
électrodialyseur 3 et une unité d'oxydation des ions
ammoniums 4, montés tous deux en sortie de
l'électrolyseur 2 afin de traiter respectivement le zinc
CA 02691535 2009-12-18
WO 2009/004257 10 PCT/FR2008/051106
sous forme ionique qui a été utilisé durant l'électrolyse
et les ions ammoniums générés durant cette même
électrolyse.
L'électrodialyseur 3 permet d'une part
l'appauvrissement en ions zinc d'une partie du liquide
sortant de l'électrolyseur 2, qui sera apte à être
évacuée, et l'enrichissement en ions zinc de l'autre
partie du liquide qui sera quant à elle réutilisée comme
source d'apport en ions zinc au sein de l'électrolyseur
2.
A cet effet, le dispositif comprend une conduite de
recirculation 7 reliant la sortie de la colonne
d'enrichissement de l'électrodialyseur 3 à l'entrée de
l'électrolyseur 2, ainsi qu'une conduite d'évacuation de
l'effluent traité.
Afin de réguler la concentration en ions zinc de la
solution électrolytique traversant l'électrolyseur, le
dispositif selon l'invention comprend un régulateur qui
contrôle l'ouverture de la vanne d'admission de la
solution concentrée en zinc ionique provenant de
l'électrodialyseur 3.
L'unité d'oxydation 4, utilisée pour traiter le
liquide sortant de l'électrolyseur 2, contenant des ions
ammoniums, l'un des produits de la transformation des
ions nitrates, comprend une source d'apport d'un agent
oxydant et un moyen de régulation du pH.
L'agent oxydant choisi est le dioxyde de chlore C102
qui réagit, sous pH contrôlé, avec les ions ammonium à
éliminer pour reformer des ions nitrates qui seront
retraités dans l'électrolyseur 2.
Pour ce faire, la sortie de l'unité d'oxydation des
ions ammoniums est reliée par une conduite 9 à l'entrée
de l'électrolyseur 2.
Ainsi, le dispositif selon l'invention fonctionne
en boucle fermée et permet le rejet d'un effluent
respectant non seulement les normes de rejet en nitrate
CA 02691535 2009-12-18
WO 2009/004257 11 PCT/FR2008/051106
et ammonium mais également les normes de rejet en ions
zinc.
On donne dans ce qui suit de plus amples détails
sur le fonctionnement de chacune des unités importantes
2, 3, 4 du dispositif et sur les résultats expérimentaux
obtenus au sein de ces unités et illustrant leur
efficacité.
Electrolyseur 2
Une étude comparative a été menée pour observer
l'influence des ions zinc durant une électrolyse,
notamment sur les ions nitrates à éliminer.
La technique retenue pour le dosage des ions
nitrates, nitrites et zinc sont les techniques
normalisées suivantes .
- pour N03- : NF EN ISO 10304-1 (chromatographie)
- pour N02 : NF EN 26777
- pour Zn2+ : NF EN ISO 11885
A cet effet, trois expériences ont été conduites
- sans courant et sans ions zinc (losanges sur les
figures 2 à 4)
- avec courant et sans ions zinc (carrés sur les
figures 2 à 4)
- avec courant et avec ions zinc (triangles sur les
figures 2 à 4).
Les expériences ont été conduites sur une solution
d'un volume de 1 litre, contenant à l'origine 953 mg.L-1
d'ions nitrates avec une agitation de 400 tour.min-1 et un
pH maintenu autour de 3.
Les électrodes utilisées sont une électrode de
carbone vitrifié et une électrode de zinc (surface de 20
cm3 ).
Les solutions électrolytiques de chacune de ces
expériences ont été analysées toutes les heures pendant 7
heures pour observer les évolutions des teneurs en ions
nitrates, en ions nitrites et en ions zinc.
CA 02691535 2009-12-18
WO 2009/004257 12 PCT/FR2008/051106
Ces trois évolutions sont regroupées dans le
tableau 1 ci-dessous pour les trois expériences ci-dessus
et illustrées respectivement sur les figures 2 à 4
précitées.
Tableau 1
Sans courant Avec courant Avec courant et ZnZ+
Temps
(hj N03_ NOZ_ ZnZ+ N03_ NOZ_ ZnZ+ N03_ NOZ_ Znz+
mg.L-' mg.L-' mg.L-' mg.L-' mg.L-' mg.L-' mg.L-' mg.L-' mg.L-11
0 979 1,63 27,8 875 <0,20 0,48 953 3,34 70,8
1 936 2,89 2i2 844 4,79 404 545 11,7 1391
2 900 3,26 374 68o 5,9i 890ii6 3,23 2436
3 817 8,63 644 513 3,36 1330 <i0 <0,20 299i
4 673 22,4 i024 3i5 i,8 i80i <i0 <0,20 3133
548 5,34 1458 i67 i,26 2i27 <i0 <0,20 3230
6 403 i2,9 1768 93 0,43 2262 <20 <0,20 3434
7 274 29,4 2045 33 0,06 246i <20 <0,20 3525
NH4+ 66 138 116
5
On constate à la lecture de la figure 2, que la
réduction des ions nitrates est plus rapide lorsque des
ions zinc sont présents à l'origine dans la solution
électrolytique et que le courant d'électrolyse est non
nul (courbe à triangles).
Dans ce cas, la concentration en ions nitrates
devient nulle au bout de trois heures d'électrolyse,
alors que avec courant d'électrolyse et sans ions zinc
(courbes à carrés), seule une concentration faible d'ions
nitrates et non pas nulle, pouvait être atteinte (33 mg.L-
1) et uniquement au bout de 7 heures d'électrolyse. Dans
le cas de l'expérience sans courant et sans ions zinc,
même au bout de 7 heures d'électrolyse, il reste 274 mg.L-
1 d'ions nitrates (courbe à losanges).
Par conséquent, la présence initiale d'ions zinc
dans la solution électrolytique permet de diminuer le
temps nécessaire à la réduction des ions nitrates de plus
de deux fois par rapport aux expériences sans ions zinc
au démarrage de l'électrolyse.
Des expériences complémentaires ont montré qu'une
concentration en Zn2+ supérieure à 0,5 g.L-1 était encore
plus bénéfique pour la réduction des nitrates.
CA 02691535 2009-12-18
WO 2009/004257 13 PCT/FR2008/051106
De même, ces expériences ont permis de montrer que
de meilleurs résultats sont atteints avec un pH
relativement bas, c'est-à-dire inférieur à 5. Selon le
mode de réalisation préféré, le pH est maintenu entre 2
et 5. Plus particulièrement, le pH est maintenu autour de
3.
D'autres expériences ont également permis d'étudier
les influences sur les rendements chimiques et
électriques des diverses électrolyses réalisées, de la
nature du sel métallique présent en début d'électrolyse
en utilisant du Fe2+ ou Zn2+, de la nature du sel de fond,
en utilisant le NaCl ou le Na2SO4 ainsi que des natures
des anodes et cathodes par l'emploi du graphite, du zinc
ou du fer.
Il est à noter que le rendement chimique (E)
résulte de la diminution de la concentration des ions
nitrate (Coõt), calculée en pourcentage de la
concentration initiale (Cin) qui est calculé comme suit
cin - cout
E(%) = x 100
cin
Le rendement électrique représente le rapport en
pourcentage de la quantité de courant théorique,
nécessaire à la réduction des ions nitrate en ammoniac
sur la quantité de courant consommé.
La technique retenue pour le dosage des ions
nitrates durant l'électrolyse, est la spectrophotométrie.
Cette technique détecte certes des concentrations en
nitrates beaucoup trop élevés par rapport à des résultats
escomptés sur des échantillons de concentration connue,
mais les ions nitrites n'interfèrent aucunement dans les
mesures, contrairement à la polarographie par exemple. En
outre, cette technique est plus facile à mettre en ceuvre
que la polarographie.
CA 02691535 2009-12-18
WO 2009/004257 14 PCT/FR2008/051106
Ces résultats sont illustrés sur le tableau 2 ci-
dessous.
Tableau 2: Résultats des analyses spectrophotométriques des diverses
électrolyses.
Electrodes Milieu Conditions Rendement Rendement
d'électrolyses chimique (%) électrique (%)
+ graphite KNO3 10-2M ; NaCI 10-2M I= 0,6 A; t=6h 3 37
-: graphite pH=7 U = 28 V
+ graphite KNO3 10-2M ;NazSO410-zM I= 0,6 A; t=6h 0 28
-: graphite pH=7 U = 28 V
+ graphite NH4NO3 10 M;NaCI 10 M I= 0,9 A; t=2h 29 74
-: graphite pH=7 ; Zn2+ 10-2M U = 26 V
+ graphite NH4NO3 10-2M ; Na2SO4 10-2M I= 0,9 A; t=2h 20 74
-: graphite pH=7 ; Zn2+ 10-2M U = 27,75 V
+ graphite NH4NO3 10-2M ;NaCI 10-2M I= 0,9 A; t=2h 29 74
-: graphite pH=4 ; Fe2+ 5.10-3M U = 26 V
+ graphite NH4NO3 10-2M ;NaCI 10-2M I= 0,9 A; t=2h 3 74
-: graphite pH=7 ; Fe2+ 5.10-3M U = 27,75 V
+ fer NH4NO3 10-2M ;NaCI 10-2M I= 4 A; t=2h 24 17
-: graphite pH=7 U = 27,5 V
+ fer NH4NO3 10-2M ;NaCI 10-2M I= 1 A; t=2h 93 30
-: graphite pH=4 ; Fe2+ 5.10-3M U = 17 V
+ fer KNO3 10-2M ; NaCI 10-2M I= 1,3 A; t=4h30 97 23
-: graphite pH=4 ; Fe2+ 5.10-3M U = 26,5 V
+ fer KNO3 10-2M ;NazSO4 10-2M I= 1,4 A; t=4h30 95 21
-: graphite pH=4 ; Fe2+ 5.10-3M U = 25,5 V
+ :graphite (2) KNO3 10-2M ; NaCI 10-2M I= 0,8 A; t=2h45 22 61
- : graphite (2) pH=4 ; Fe2+ 5.10-3M U = 24 V
+ :graphite (2) KN03 10"2M ; NaCI 10"2M I= 0,4 A; t=4h 85 84
-: graphite (2) pH=4 ; Zn2+ 10"2M U = 29 V
+ :graphite (2) KN03 10"2M ; Na2SO410"2M I= 0,4 A; t=4h 93 84
-: graphite (2) pH=4 ; Zn2+ 10"2M U = 28,75 V
+ :graphite (3) KN03 10"2M ; Na2SO410"2M I= 0,6 A; t=3h30 96 64
- : zinc (3) pH=4 U = 29 V
+:graphite KNO3 10-2M ; NaCI 10-2M I= 1 A; t=6h 79 22
-: zinc pH=4 U = 28 V
+ :graphite KNO3 10-2M ;Na2SO4 10-2M I= 0,8 A; t=2h 11 67
-: zinc pH=4 U= 21 V
+ :graphite KNO3 10-2M ;Na2SO4 10-2M I= 0,8 A; t=6h 79 28
-: zinc pH=4 U = 28 V
+ :graphite NH4NO310-2M ;NaCI 10-2M I= 1 A; t=6h 93 22
-: zinc pH=4 U= 21 V
+ :graphite KNO3 10-2M ; NaCI 10-2M I= 0,6 A; t=5h30 60 41
- : graphite pH=7 ; poudre de zinc U = 26 V
CA 02691535 2009-12-18
WO 2009/004257 15 PCT/FR2008/051106
Conformément au tableau 2, ces expériences ont
permis de montrer que :
- les moyennes des rendements chimiques des
électrolyses réalisées en ne faisant varier que le sel de
fond sont quasiment similaires. La nature du sel de fond
ne semble donc pas influer sur la réaction,
- la réduction des ions nitrates sur une cathode de
fer ne peut s'effectuer qu'à pH acide et si des ions Fe2+
ont été introduits préalablement en solution afin
d'initier la réaction (lignes 8 à 10),
- l'utilisation d'une cathode de zinc sans ions
zinc en solution ajoutés en début d'électrolyse (ligne
14) permet d'obtenir un rendement chimique très bon et un
rendement électrique moyen,
- par contre, l'utilisation d'un sel métallique de
zinc en début d'électrolyse permet la réduction des ions
nitrates, avec à la fois un très bon rendement chimique
et un très bon rendement électrique (lignes 12 et 13).
Par conséquent, les expériences réalisées permettent
de montrer que la réduction des ions nitrates en solution
aqueuse est réalisable. Une dénitratation électrolytique
sélective est donc possible.
Pour ce faire, un milieu acide est requis dans tous
les cas.
Les meilleurs rendements chimiques et électriques
ont été obtenus grâce à une réduction indirecte par
l'intermédiaire des ions Zn2+ initialement présents dans
la solution électrolytique et un pH acide.
Ainsi, un électrolyseur coopérant avec une source
de sel métallique est adapté pour constituer la base du
dispositif de traitement selon l'invention.
Mais parallèlement à la réduction des quantités
d'ions nitrates, rendue rapide du fait de l'emploi d'ions
zinc au départ de l'électrolyse, la quantité des ions
zinc en solution augmente et atteint les 3525 mg.L-1 au
bout de sept heures d'électrolyse avec courant et avec
CA 02691535 2009-12-18
WO 2009/004257 16 PCT/FR2008/051106
ions zinc en début d'électrolyse (figure 4, courbe à
carrés).
Afin de diminuer cette concentration en ion zinc en
sortie du dispositif selon l'invention, celui-ci est
pourvu de l'électrodialyseur précité pour former une
solution pauvre en ion zinc qui sera évacuée par une
conduite d'évacuation 10 représenté sur la figure 1 et
une solution riche en ions zinc qui sera recyclée au sein
du dispositif et en amont de l'électrolyseur 2.
Electrodialyseur 3
Pour étudier la faisabilité de la réduction de la
quantité d'ions zinc au sein d'un effluent en contenant,
un électrodialyseur de trois réservoirs a été rempli
d'une solution de concentration en zinc ionique connue,
indépendamment de l'électrolyseur 2.
Cet électrodialyseur est de type batch, et pourvu
d'une colonne d'enrichissement en sel métallique, de deux
colonnes d'appauvrissement en sel métallique reliée à une
conduite d'évacuation du milieu liquide traité et d'une
électrode de zinc.
La solution de concentration connue en zinc ionique
est préparée avec du chlorure de zinc et sa température
est maintenue à la température ambiante.
On applique un champ électrique et on prélève des
échantillons de solution de 4 mL par incréments de temps
réguliers.
Le pH et la conductivité du milieu ont été suivis
en continu.
L'agitation s'est faite par le biais de pompes de
circulation raccordées à chaque compartiment.
Les résultats obtenus lors de l'électrodialyse au
sein des colonnes d'appauvrissement sont représentés sur
la figure 5 et les résultats obtenus dans la colonne
d'enrichissement sont visibles sur la figure 6.
CA 02691535 2009-12-18
WO 2009/004257 17 PCT/FR2008/051106
Ces résultats montrent clairement la possibilité
d'atteindre dans les colonnes d'appauvrissement les
normes de rejet pour les Zn2+ puisque au plus tard au bout
de 60 min une concentration inférieure à la norme de
rejet (5 mg. L-1) est atteinte (figure 5).
De plus, ils mettent en évidence la possibilité de
concentrer dans la colonne d'enrichissement les Zn2+
puisque leur concentration est multipliée par presque 1,8
au bout de 20 min.
Par conséquent, l'utilisation d'un électrodialyseur
en sortie de l'enceinte d'électrolyse permettra
l'évacuation d'un effluent respectant en plus des normes
de rejet d'ions nitrates, les normes de rejet d'ions zinc
de 5 mg. L-1.
La recirculation d'un effluent plus concentré en
Zn2+ que la solution entrant dans cet électrodialyseur
sera réacheminée à l'entrée de l'électrolyseur.
La boucle de circulation des ions zinc ainsi formée
est quasiment autonome, de façon à limiter les quantités
d'ions zinc nécessaires au traitement des nitrates.
Unité d'oxydation 4
La réduction des ions nitrates et nitrites dans
l'électrolyseur engendre la formation d'ions ammoniums
qui ne sont pas toxiques en tant que tels mais qui
peuvent se transformer en ammoniac qui lui est toxique.
Pour pallier ce problème, le dispositif selon
l'invention est muni d'une unité d'oxydation montée à la
sortie de l'enceinte d'électrolyse afin d'oxyder les ions
ammoniums de l'effluent.
Lorsque du C102, par exemple produit par mélange de
HCl issu de l'unité de stockage 13 et de NaClO issu de
l'unité de stockage 12, est ajouté à une solution
comprenant des ions ammoniums à un temps donné pour
atteindre une concentration proche de 5% en volume, on
observe au bout de 30 secondes un abattement de 95% de la
CA 02691535 2009-12-18
WO 2009/004257 18 PCT/FR2008/051106
quantité d'ions ammoniums, et au bout de 5 minutes un
abattement de 98%.
Il est à noter que la concentration en oxydant joue
un rôle important au niveau de l'abattement mais peu
important au niveau de la cinétique.
De plus, il a été observé que le pH optimal
d'oxydation des ions ammoniums est proche de 2.
Par conséquent, une solution contenant des ions
ammoniums pourra être traitée avec du C102 à pH bas afin
d'éliminer presque 100% de ces ions ammoniums.
L'un des produits de l'oxydation de ces ions
ammoniums sont les ions nitrates.
Au sein du dispositif selon l'invention, ces ions
nitrates pourront idéalement être redirigés à l'entrée de
l'enceinte d'électrolyse 2 afin d'y être éliminés.
L'unité d'oxydation intégrée au dispositif selon
l'invention comprendra ainsi une entrée de liquide
communiquant avec la sortie de l'enceinte d'électrolyse,
une sortie de liquide chargé en nitrate, une entrée d'un
agent oxydant nommé dioxyde de chlore (C102), et un moyen
de mélange du liquide traversant l'unité d'oxydation avec
l'agent oxydant.
En outre, le pH du liquide traversant l'unité
d'oxydation est maintenu proche de 2 par l'intermédiaire
du pH repéré par 15 sur la figure 1, et de l'unité de
stockage de HCl 13.
La sortie de liquide de l'unité d'oxydation est
reliée à l'entrée de l'enceinte d'électrolyse, en vue du
traitement par électrolyse de ce liquide.
L'unité d'oxydation ci-dessus décrite est
idéalement intégrée au sein du dispositif selon
l'invention car elle permet de traiter les effluents en
sortie d'électrolyseur pour les appauvrir en ions
ammoniums et est reliée à l'entrée de l'électrolyseur 2
pour que ce dernier élimine les nitrates reformés.
Cependant, cette unité d'oxydation peut être
utilisée indépendamment de l'électrolyseur du dispositif
CA 02691535 2009-12-18
WO 2009/004257 19 PCT/FR2008/051106
selon l'invention, pour traiter n'importe quel effluent
chargé en ions ammoniums.
Le choix du C102 comme agent oxydant est
particulièrement approprié à l'oxydation des ions
ammoniums puisque d'une part, cet agent présente un fort
pouvoir oxydant vis-à-vis des ions ammoniums et réagit
ainsi rapidement et naturellement avec ces derniers, et
que d' autre part, il ne réagit pas avec les ions zinc et
reste donc en solution pour le traitement des ions
ammoniums.
Le dispositif selon l'invention, muni de
l'électrolyseur, l'électrodialyseur et l'unité
d'oxydation tels que décrits ci-dessus, pourra
avantageusement être piloté par un système de commande
autonome, apte à gérer les ouvertures des vannes de
régulation 14 des conduites de liaison entre ces trois
éléments et de la conduite d'approvisionnement en milieu
à traiter 16, en fonction des concentrations en ions
nitrates, ions zinc et ions ammonium relevées en sortie
de l'électrolyseur, l'électrodialyseur et de l'unité
d'oxydation, afin d'optimiser le traitement du milieu
liquide et de purifier l'effluent traité.
2. Deuxième mode de réalisation du dispositif de
traitement
Le deuxième mode de réalisation du dispositif de
traitement par voie mixte chimique électrochimique d'un
milieu liquide chargé en nitrates selon l'invention est
illustré sur la figure 6.
Il diffère essentiellement du premier mode de
réalisation de la figure 1 par le fait que la solution de
travail, issue du mélange de l'effluent à traiter avec
une solution enrichie en ions zinc, circule de bas en
haut au sein d'un récipient disposé verticalement et
CA 02691535 2009-12-18
WO 2009/004257 20 PCT/FR2008/051106
comprenant une alternance de compartiments d'électrolyse
et de compartiments d'oxydation en présence de C102.
Le premier compartiment que traverse la solution de
travail durant son cheminement au sein de la colonne de
traitement des nitrates est un compartiment d'électrolyse
2A, afin de réduire une partie des ions nitrates qu'elle
contient, qui sont transformés en ions ammoniums, en
azote, et oxydes d'azote NOx.
Le deuxième compartiment que traverse cette
solution est un compartiment d'oxydation 4A en présence
de C102 afin que les ions ammoniums formés au sein du
compartiment d'électrolyse sous-jacent 2A soient oxydés
et transformés en ions nitrates. Comme l'agent oxydant
utilisé (C102) présente un fort pouvoir d'oxydation,
l'ensemble des ions ammoniums parvenant à ce compartiment
d'oxydation est transformé en ions nitrates.
Le troisième compartiment que traverse alors la
solution est de nouveau un compartiment d'électrolyse 2B,
afin de réduire d'une part les ions nitrates qui
n'avaient pas été réduits durant l'électrolyse conduite
au premier compartiment d'électrolyse 2A, et d'autre part
de réduire les ions nitrates produits au sein du
compartiment d'oxydation sous-jacent 4A.
Les compartiments 4B, 2C, 4C que traverse ensuite
la solution, respectent l'alternance compartiment
d'oxydation / compartiment d'électrolyse et permettent
toujours la réduction des nitrates qui n'ont pas été
réduits dans les compartiments d'électrolyse sous-
jacents, et celle des nitrates produits au sein des
compartiments d'oxydation sous-jacents.
Le dernier compartiment traversé par la solution
est un compartiment d'oxydation 4C.
L'intérêt de faire subir à la solution de travail
une alternance d'électrolyses et d'oxydation en présence
de C102r dans une colonne verticale est le suivant :
CA 02691535 2009-12-18
WO 2009/004257 21 PCT/FR2008/051106
Des expériences conduites pour les besoins de
l'invention ont montré que lorsque la solution de travail
traverse un premier compartiment d'électrolyse en
présence d'ions zinc puis le compartiment surjacent
d'oxydation en présence d'ions ammoniums, la solution
sortant du compartiment d'oxydation comprenait moitié
moins d'ions nitrates.
Par conséquent, un étage de compartiment
d'électrolyse et d'oxydation, tel que repéré par 20 sur
la figure 7, permet un abattement de 50 % des ions
nitrates entrant.
La multiplication de ces étages 20 permet
d'éliminer d'autant plus d'ions nitrates.
En outre, grâce à cette disposition verticale
alternée particulière, les espèces gazeuses (notamment
des oxydes d'azote NOX) produites durant l'électrolyse à
un étage N sont dissoutes dans le liquide surplombant cet
étage (loi de Henry).
Surtout, cette disposition verticale permet de
dissoudre une espèce gazeuse particulièrement
indésirable, constituée par le dichlore formé au sein des
compartiments d'électrolyse 2A, 2B, 2C du fait de la
présence de C102 dans la solution traversant la colonne de
traitement des nitrates 21.
En effet, bien que le C102 soit injecté au niveau
des compartiments d'oxydation 4A, 4B, 4C, ce C102 se
retrouve au niveau des compartiments d'électrolyse 2A,
2B, 2C puisque la solution circule d'un compartiment à un
autre. Au niveau de ces compartiments d'électrolyse, le
C102 subit également une réduction qui produit du dichlore
C12. Mais grâce à la disposition en alternance des
compartiments d'électrolyse et d'oxydation, les bulles de
dichlore 31 formées au sein d'un compartiment
d'électrolyse 2A, 2B, 2C remontent par la poussée
d'Archimède au niveau du compartiment d'oxydation
surjacent correspondant 4A, 4B, 4C où elles sont
dissoutes dans le liquide contenu dans ce compartiment.
CA 02691535 2009-12-18
WO 2009/004257 22 PCT/FR2008/051106
On donne maintenant le détail des éléments
constitutifs du dispositif selon le second mode de
réalisation de l'invention.
Sur l'exemple représenté, la colonne de traitement
des nitrates 21 est constituée par un tube cylindrique 22
alimenté en solution de travail par une conduite 23,
débouchant dans sa partie basse et délivrant depuis sa
partie supérieure la solution traitée par une conduite
24, la circulation de solution s'effectuant de bas en
haut.
Ce tube est séparé en trois étages 20A, 20B, 20C
scindés chacun en un compartiment d'électrolyse et un
compartiment d'oxydation des ions ammoniums tels que
décrits ci-dessous.
Compartiments d'électrolyse 2A, 2B, 2C de la figure 7
Chaque compartiment d'électrolyse 2A, 2B, 2C est
délimité par deux plaques horizontales circulaires
formant électrode 25, 26, 27, 28, 29, 30, disposées
concentriquement le long de l'axe de la colonne, entre
lesquelles est imposée une différence de potentiel au
moyen d'une source d'alimentation 43.
Dans l'exemple illustré sur la figure 7, les
plaques inférieures 25, 27 et 29 des compartiments
d'électrolyse 2 sont portées à un potentiel inférieur à
celui de la plaque surjacente 26, 28, 30.
Entre deux plaques d'un compartiment d'électrolyse
25, 26 est disposé un agitateur rotatif 34 actionné au
moyen d'un axe 35 entraîné par un moteur 36. Cet axe 35
est confondu avec celui de la colonne 21 et traverse les
plaques 25, 26 dans leur épaisseur au travers d'une
ouverture 32.
Le passage de la solution d'un compartiment
d'électrolyse au compartiment d'oxydation surjacent
s'effectue au travers de cette ouverture 32.
CA 02691535 2009-12-18
WO 2009/004257 23 PCT/FR2008/051106
Du fait de la différence de potentiel existant
entre les deux plaques 25, 26 d'un même compartiment
d'électrolyse, la solution qui passe entre celle-ci subit
une électrolyse au cours de laquelle les ions nitrates
sont réduits en majeure partie.
Parmi les produits de cette électrolyse, on compte
l'azote N2, des ions ammoniums, des oxydes d'azote.
Et du fait de la présence de C102 dans la colonne
21, on compte également du dichlore C12.
Compartiments d'oxydation 4A, 4B, 4C de la figure 7
Les premier 4A et deuxième 4B compartiments
d'oxydation sont délimités chacun par la plaque
supérieure 26, 28 du compartiment d'électrolyse sous-
jacent et par la plaque inférieure 27, 29 du compartiment
d'électrolyse surjacent.
Entre ces deux plaques, est introduit du C102 au
moyen d'un tube 37 relié à une source 4 de C102.
Les plaques 26 et 27 d'une part et 28 et 29 d'autre
part, qui délimitent les compartiments d'oxydation 4A, 4B
sont soumises à une différence de potentiel puisque les
plaques de la colonne sont alimentées alternativement
négativement et positivement. Cette différence de
potentiel est d'ailleurs égale à celle imposée au sein de
chaque compartiment d'électrolyse.
Ces plaques 26, 27 et 28, 29 imposent ainsi à la
solution les traversant, une électrolyse.
Les compartiments 4A, 4B sont donc des
compartiments d'oxydation-électrolyse.
Au contraire, selon un mode de réalisation de
l'alimentation des plaques de la colonne, non illustré,
les deux plaques délimitant un compartiment d'oxydation
présentent des potentiels identiques, de sorte que ces
compartiments ne sont pas le siège d'une électrolyse,
mais uniquement d'une oxydation.
CA 02691535 2009-12-18
WO 2009/004257 24 PCT/FR2008/051106
Le troisième compartiment d'oxydation 4C est
délimité par la plaque supérieure 30 du compartiment
d'électrolyse sous-jacent 2C et par la partie supérieure
de la colonne.
Compartiments d'électrolyse 2A, 2B, 2C de la figure 8
Selon une variante de disposition des électrodes
des compartiments d'électrolyse, représentée sur la
figure 8, celles-ci ne sont pas circulaires et
horizontales mais rectangulaires et verticales.
Deux électrodes de ce type 25, 26 ; 27, 28 ; 29, 30
sont disposées en regard l'une de l'autre et longent
chacune la paroi de la colonne 21. On impose une
différence de potentiel entre les deux électrodes d'un
même compartiment.
Un agitateur 34 est encore interposé entre les deux
électrodes.
CA 02691535 2009-12-18
WO 2009/004257 25 PCT/FR2008/051106
Compartiments d'oxydation 4A, 4B, 4C de la figure 8
Les premier 4A et deuxième 4B compartiments
d'oxydation de la variante de réalisation de la figure 8,
sont délimités par deux plaques 51, 52 entre lesquelles
est injecté l' oxydant fort C102. Ces plaques 51, 52 sont
pourvues d'une ouverture de passage de l'axe de rotation
des agitateurs 34 des compartiments d'électrolyse, qui
assure également le passage de la solution depuis ou vers
un compartiment d'électrolyse.
Le dernier compartiment d'oxydation 4C est délimité
dans sa partie inférieure par une plaque 51 et dans sa
partie supérieure par le haut de la colonne 21.
La solution sortant de la colonne de traitement des
nitrates 21, selon la variante de réalisation de la
figure 7 ou 8, qui comprend trois étages, contient
environ 88 % d'ions nitrates en moins que la solution
entrant dans cette colonne.
Cependant cette solution contient une concentration
importante d'ions zinc, supérieure aux normes de rejet.
On la redirige vers un électrodialyseur 3 tel que décrit
précédemment, afin de préparer à partir de cette solution
un liquide enrichi en ions zinc qui sera recyclé, et un
liquide appauvri en ions zinc et respectant les normes de
rejet, qui sera évacué sans traitement supplémentaire.
Le liquide enrichi en ions zinc est redirigé à
l'entrée de la colonne de traitement des nitrates 21 au
moyen de la conduite 7 et la vanne de régulation associée
14.
Si nécessaire, un ajustement en ions zinc pourra
être effectué au moyen d'un réservoir prévu à cet effet
44, monté sur la conduite de recirculation 7.
On donne dans ce qui suit un exemple de réalisation
avec une colonne comprenant deux étages de traitement :
CA 02691535 2009-12-18
WO 2009/004257 26 PCT/FR2008/051106
Solution initiale
Solution réelle de drainage de serre, Concentration
en ions nitrate : 150 mg.L-1
Solution de travail
Concentration en ions zinc : 500 mg.L-1
Compartiments d'électrolyse
Différence de potentiel imposée entre deux
électrodes définissant un compartiment d'électrolyse : 2V
Vitesse d'agitation : 300 tr.min-1
pH : 3.80
Compartiments d'oxydation
C102 : 200-205 grammes par gramme d'ions nitrates à
traiter
Solution sortant de la colonne de traitement des
nitrates
Concentration en ions nitrates : 7.6 mg.L-1
Concentration en ions ammoniums : 11.5 mg.L-1 (7
mg.L-1 lorsque 230-240 grammes de C102 par gramme d'ions
nitrates à traiter sont utilisés)
Abattement des ions nitrates et ammoniums par
rapport à la solution initiale : 87 ~
Température : ambiante
Puissance électrique requise par gramme d'ions
nitrates traités :
21,5 Watts par grammes de nitrates traités
Le dispositif selon l'invention, muni du réservoir
42 de solution à traiter, de la colonne de traitement des
nitrates 21, du récipient de stockage de C102 et de
l'électrodialyseur 3 tels que décrits ci-dessus, pourra
avantageusement être piloté par un système de commande
CA 02691535 2009-12-18
WO 2009/004257 27 PCT/FR2008/051106
autonome, apte à gérer les ouvertures des vannes de
régulation 14 des conduites de liaison entre ces quatre
éléments, en fonction des concentrations en ions
nitrates, ions zinc, C102 et ions ammonium relevées au
sein du circuit, afin d'optimiser le traitement du milieu
liquide et d'atteindre les normes de rejet en vigueur.
En outre, il présente différents avantages :
- le nombre d'étages de la colonne de traitement
des nitrates 21 pourra être adapté en fonction de la
concentration en ions nitrates de la solution à traiter
afin d'atteindre une concentration en nitrates souhaitée
en sortie de colonne, puisqu'il est possible de
déterminer un pourcentage d'abattement d'ions nitrate
opéré par un étage,
- De même, le débit de la solution traversant la
colonne pourra être adapté en fonction de la
concentration en nitrates souhaitée en sortie de colonne
21, pour par exemple augmenter le temps de séjour de la
solution au sein de la colonne,
- Une autre façon de procéder pour atteindre une
concentration en nitrates souhaitée en sortie de colonne
est de diluer la solution à traiter au sein du réservoir
42,
- l'injection de C102 pourra être adaptée en
fonction du débit de la solution et/ou en fonction des
composés autres que les ions nitrates présents dans la
solution initiale. Typiquement, pour une solution de
synthèse, ne comptant que des ions nitrates, environ 200
mg de C102 par gramme d'ions nitrates sont suffisants pour
l'oxydation des ions ammoniums issus de l'électrolyse des
ions nitrates. Mais pour une solution réelle de drainage,
contenant notamment des ions fers et d'autres anions que
les ions nitrates, 230 à 240 mg par grammes de nitrates
de C102 seront alors nécessaires,
- la quantité d'ions zinc nécessaire pour accélérer
la réduction des ions nitrates est peu impactée par la
CA 02691535 2009-12-18
WO 2009/004257 28 PCT/FR2008/051106
concentration de ces ions dans la solution à traiter. En
effet, des expériences ont démontré que la même
concentration d'ions zinc (500 mg.L-1) était aussi
efficace pour accélérer la réduction des ions nitrates
contenus dans une solution de 150 mg.L-1 que pour des
solutions de 600 mg.L-1 à 1 g.L-1, ce qui permet de limiter
la consommation de ces ions même pour des solutions plus
concentrées en ions nitrates,
- La hauteur de liquide surplombant chaque
compartiment d'électrolyse pourra également être adaptée
en fonction du dégagement gazeux observé au sein de ces
compartiments d'électrolyse pour atteindre une
dissolution complète de ces gaz,
- la température de la solution parcourant la
colonne relativement faible (température ambiante)
ralentit la précipitation des ions fer sous forme de
complexes, et également le dégagement de chlore.